Фосфор получение — Справочник химика 21
Самую многочисленную группу составляют химические процессы, из которых наиболее важными в технологии являются следующие процессы горение (сжигание жидкого, твердого и газообразного топлива с целью получения энергии, серы — для получения серной кислоты) пирогенные (коксование углей, пиролиз и крекинг нефтепродуктов) окислительно-восстановительные процессы (газификация твердых и жидких топлив, конверсия углеводородов) электрохимические (электролиз воды, растворов и расплавов солей, электрометаллургия, химические источники тока) электротермические (электровозгонка фосфора, получение карбида и цианамида кальция) плазмохимические (реакции в низкотемпературной плазме, включая окисление азота и пиролиз метана, получение ультрадисперсных порошкообразных продуктов) термическая диссоциация (получение извести, кальцинированной соды, глинозема и пигментов) обжиг и спекание (высокотемпературный синтез силикатов, получение цементного клинкера и керамических кислородсодержащих и бескислородных материалов со специальными функциями) гидрирование (синтез аммиака, метанола, гидрокрекинг и гидрогенизация жиров) комплексообразова-ние (разделение и рафинирование платиновых и драгоценных металлов, химическое обогащение руд, например путем хлорирующего или сульфатизирующего обжига для перевода металлов в летучие или способные к выщелачиванию водой соединения) химическое разложение сложных органических веществ (варка древесных отходов с растворами щелочей или бисульфита кальция с целью делигнизацми древесины в производстве целлюлозы) гидролиз (разложение целлюлозы из отходов сельскохозяйственного производства или деревообрабатывающей промышленности с по- 211]
211]
Элементарный фосфор получен Шееле [258] в 1771 г. из костяной золы в ретортах при 1000° С по реакциям [c.7] Бесцветная жидкость низкокипящая, легколетучая, тяжелая. Полностью гидролизуется а воде. Окисляется концентрированной азотной кислотой, реагирует со щелочами, хлором. Проявляет свойства донора и акцептора фторид-иона. Полярный апротонный растворитель хорошо растворяет серу и фосфор. Получение см. 36 И. [c.190]
Аналогично может быть проведен опыт сжигания фосфора, получения пятиокиси фосфора и фосфорной (метафосфорной) кислоты. Используя склянки на 100 лл с хорошо подобранными резиновыми пробками и сжигая небольшое количество красного фосфора в стандартной стальной ложечке, можно не опасаться загрязнения воздуха. [c.89]
Количество фосфора, полученного по реакции (1) л(Р) = 2л[Сад(Р04)2] = 2 0,1 = 0,2 моль [c.180]
Трехфтористый фосфор, полученный, как описано выше. [c.227]
[c.227]
В условиях морского климата и атмосферы промышленного района были проведены сравнительные испытания № — Р покрытий с 10 и 7 % ным содержанием фосфора полученных из растворов
Получение 2-фенил-5-(4-хлорфенил)-1,3,4-оксадиазола. Д колбу емкостью 250 мл, снабженную обратным холодильником, помещают 22 г 1-бензоил-2-(4-хлорбензоил)-гидразина и 70 мл хлорокиси фосфора. Полученную смесь кипятят на воздушной бане 90 минут, причем все вещество переходит в раствор. Затем из реакционной массы отгоняют 30 мл хлор-окиси фосфора, а остаток осторожно при перемешивании выливают в 200—300 л. холодной воды. После того как масса полностью закристаллизуется, ее отфильтровывают, хорошо промывают на фильтре водой (5—6 раз по 25 мл) и сушат, выход 19,5 г, т. пл. 147—148°. Полученный продукт перекристаллизовывают из этанола (200—300 мл), выход 17 г, т. пл. 155 . Для дальнейшей очистки оксадиазол пропускают через хроматографическую колонку, наполненную окисью алюминия, с применением толуола в качестве растворителя.
Известно, что никелевые покрытия технического назначения наносятся в основном электролитическим и химическим способами и используются для улучщения свойств стали в условиях агрессивных сред, в том числе под нагрузкой и при эрозионном воздействии, а также для защиты от фреттинг-коррозии. Покрытия типа никель—бор, никель-фосфор, полученные химическим осаждением в восстановительных средах, обладают поляризащюнными характеристиками, несколько отличными от гальванически осажденных покрытий. Коррозионная стойкость покрытия, полученного химическим никелированием, с увеличением содержания фосфора и бора возрастает. [c.95]
Сернистый газ. Бесцветный, термически устойчивый. Хорошо растворяется в воде медленно создает слабокислотную среду, но не образует определенного соединения. Химически активный в растворе медленно окисляется.

Структура и свойства химически осажденного никеля [15, 51]. Сплавы никель—фосфор, полученные химическим путем, всегда содержат фосфор (от нескольких процентов до 15 %). [c.53]
Важное значение имеют многие производные щавелевой кислоты. Дихлорангидрид, называемый оксалилхлоридом, получают действием на безводную щавелевую кислоту пентахлорида фосфора (получение хлорангидридов — см. разд. 6.1.3.1 и 6.1.3.2) [c.389]
В стеклянный или эмалированный сосуд заливалось 100 мл воды и вносилось оиределенное количество щелочи и фосфора. Полученная смесь выдерживалась при температуре 100°. Продукты реакции исследовались. Предварительными ТАБЛИЦА 1 опытами была определена [c.40]
Производство фосфорной кислоты осуществляется двумя методами взаимодействием фосфатного сырья с минеральными кислотами (экстракционный способ) и гидратацией фосфора, полученного термическим способом из того же сырья. [c.173]
[c.173]
Результаты исследования инфракрасного спектра пятиокиси фосфора, полученные Сидоровым и Соболевым, находятся в удовлетворительном согласии с результатами исследования спектра комбинационного рассеяния [1683], а также с данными, приведенными в работе [1238], для инфракрасного спектра. [c.413]
Термическая фосфорная кислота дороже экстракционной (в пересчете на Р2О5), причем около 92% себестоимости фосфорной кислоты составляет стоимость фосфора, получение которого связано со значительным расходом электроэнергии (на долю,
Этот продукт под действием безводного Sn la восстанавливается до R H = NH, который выпадает в осадок в виде комплекса с Sn U, который затем гидролизуют (реакция 16-2) до альдегида. Восстановление по Стефану дает наилучшие результаты для ароматических групп R, но реакция проходит и в случае алифатических групп, содержащих до 6 атомов углерода [280]. Соединение 23 можно приготовить также обработкой Ar ONHPh пентахлоридом фосфора. Полученный таким образом продукт 23 можно затем превратить в альдегид. Эта реакция известна под названием метода Зонна — Мюллера. [c.363]
Полученный таким образом продукт 23 можно затем превратить в альдегид. Эта реакция известна под названием метода Зонна — Мюллера. [c.363]
Получение 2-фенил-5-фениламино-1,3,4-оксадиазола. В колбу емкостью 100 мл, снабженную обратным холодильником, помещают 4,6 г 1-бензоил-4-фенилсемикарбазида и 42 мл хлорокиси фосфора. Полученную смесь кипятят до образования гомогенного раствора. Затем реакционную массу охлаждают и осторожно, при энергичном перемешивании, приливают к 300 мл холодной воды. Выпавший бесцветный кристаллический осадок отфильтровывают, промывают на фильтре водой до нейтральной реакции и сушат при температуре 100°. После двукратной перекристаллизации из этанола и ледяной уксусной кислоты выход продукта равен 1,8 г, что составляет 41% от теоретического, т. пл. 212—213°. [c.93]
Получение фосфата азотола А. В двугорлую колбу емкостью 250 мл, снабженную капельной воронкой и обратным холодильником с хлоркальциевой трубкой, помещают 13,2 г (0,05 М) азотола А, 50 мл диоксана и 26,2 г (0,125 Ai) йяти-хлористого фосфора. Полученную смесь нагревают на теплой водяной бане (около 50°) и прикапывают, в течение 1 часа, [c.66]
Полученную смесь нагревают на теплой водяной бане (около 50°) и прикапывают, в течение 1 часа, [c.66]
Получение п-хлоранилидофосфорилдихлорида. В круглодонную колбу емкостью 500 мл, снабженную обратным холодильником с хлоркальциевой трубкой, помещают 74 г (0,45 М) хлоргидрата -хлоранилина и 82 мл (0,9 М) хлор-окиси фосфора. Полученную смесь нагревают на масляной бане при температуре около 130° в течение 4 часов. В результате реакции образуется прозрачная светло-коричневая жидкость, которую выливают при размешивании в колбу, содержащую 400 мл петролейного эфира. Выпавший белый осадок -хлоранилидофосфорилдихлорида отфильтровывают на воронке Бюхнера, промывают 100 мл петролейного эфира ч помещают в вакуум-эксикатор над смесью едкого кали с парафином (см. примечание 2).
Получеиие 2-фенил-5-(4-метоксифенил)-1,3,4-оксадиазола. В колбу емкостью 250 мл, снабженную обратным долодильни-ком, помещают 50 г 1-бензоил-2-(4-метоксибензоил)-гидразина и 150 мл хлорокиси фосфора. Полученную смесь нагревают на воздушной бане до полного растворения осадка, на что требуется 45—60 минут, после чего ее прогревают еще один час. Затем реакционную массу охлаждают и осторожно при перемешивании в течение 30—60 минут выливают в с.месь 1600 г льда и воды (см. примечание 4). После того как масса полностью закристаллизуется, ее отфильтровывают, хорошо промывают на фильтре водой (5—6 раз по 50 мл) и сушат. Полученный продукт растворяют при кипячении в 500 мл этанола, к раствору добавляют 2—3 г активированного угля и фильтруют. При охлаждении из раствора выкристаллизовывается вещество с т. пл. 143—144°, выход 39 г. Полученный оксадиазол йерекристаллизовывают из 180—200 мл толуола, выход 28 (см. примечание 5). После повторной перекристаллизации из 150 мл толуола получается 23 г (49% теории) оксадиазола для цинтилляциoнt ыx целей с т. пл. 144,5—146° (см. примечание 6).
[c.61]
Полученную смесь нагревают на воздушной бане до полного растворения осадка, на что требуется 45—60 минут, после чего ее прогревают еще один час. Затем реакционную массу охлаждают и осторожно при перемешивании в течение 30—60 минут выливают в с.месь 1600 г льда и воды (см. примечание 4). После того как масса полностью закристаллизуется, ее отфильтровывают, хорошо промывают на фильтре водой (5—6 раз по 50 мл) и сушат. Полученный продукт растворяют при кипячении в 500 мл этанола, к раствору добавляют 2—3 г активированного угля и фильтруют. При охлаждении из раствора выкристаллизовывается вещество с т. пл. 143—144°, выход 39 г. Полученный оксадиазол йерекристаллизовывают из 180—200 мл толуола, выход 28 (см. примечание 5). После повторной перекристаллизации из 150 мл толуола получается 23 г (49% теории) оксадиазола для цинтилляциoнt ыx целей с т. пл. 144,5—146° (см. примечание 6).
[c.61]
Получение 2.5-ди-(4-метоксифенил)-1,3,4-оксадиазола.

Получение 2,5-ди-(4-дифенилил)-1,3,4-оксадиазола. В круглодонную колбу емкостью 0,5 л, снабженную обратным холодильником, помещают 60 г 1,2-ди-(4-дифенилоил)-гидразина и 150 мл хлорокиси фосфора. Полученную смесь кипятят в течение 8 часов, причем осадок не растворяется, а приобретает лишь вид блестящих зеленовато-желтых лепестков. После прекращения нагревания содержимое колбы охлаждают до комнатной температуры, а затем осторожно при перемешивании выливают в 2 л холодной воды. Образовавшийся бесцветный кристаллический 2,5-д и-(4-дифени111Ил)-1,3,4-оксадиазол фильтруют, хорошо промывают на фильтре водвй я сушат, выход 55 г, т. пл. 228—23Г, После перекристаллизации из [c.66]
После прекращения нагревания содержимое колбы охлаждают до комнатной температуры, а затем осторожно при перемешивании выливают в 2 л холодной воды. Образовавшийся бесцветный кристаллический 2,5-д и-(4-дифени111Ил)-1,3,4-оксадиазол фильтруют, хорошо промывают на фильтре водвй я сушат, выход 55 г, т. пл. 228—23Г, После перекристаллизации из [c.66]
Желто-орлнжевый. при слабом нагревании плавится и разлагается. Известей красный изомер с ионным строением(РВ 4)Вг. Растворяется в теграхлориое углерода, сероуглероде. Гидролизуется водой, реагирует со щелочами. Восстанавливается фосфором. Получение см. ЗIS ЗЗИ. [c.183]
Бесцветная легколетучая тяжелвя жидкость. Легко гидролизуется во влажном воздухе ( дымит ). При смешивании с малым количеством воды (до 18 моль Н]0 на 1 моль А СЬ) образуется прозрачный раствор, при разбавлении гидролизуется с образованием осадка. Окисляется концентрированной азотной кислотой. Разлагается щелочами. Проявляет свойства донора и акцептора хлорид-ноиа. Апротонный автоионизирующийся растворитель растворяет иодиды щелочных металлов, серу, фосфор. Получение см. 359 . 361 , 364. [c.191]
Апротонный автоионизирующийся растворитель растворяет иодиды щелочных металлов, серу, фосфор. Получение см. 359 . 361 , 364. [c.191]
Если в лаборатории нет вакуум-насоса, то обезвоживают тригидрат перхлората магния при 170°С в струе воздуха при помощи водоструйного насоса, присоединенного через хлоркальциевую трубку к колбе, в которой осущается перхлорат магния. Воздух для осушки предварительно пропускают через колонку с безводной серной кислотой и пяти-оксидом фосфора. Полученный препарат хранят в банке с притертой пробкой, залитой парафином, или в запаянных ампулах. [c.54]
Желто-оранжевый, при слабом нафевании плавится и разлагается. Известен красный изомер с ионным строением (РВг4)Вг. Растворяется в тетрахлориде углерода, сероуглероде. Гидролизуется водой, реагирует со щелочами. Восстанавливается фосфором. Получение см. 315 , 35И. [c.183]
Безводную роданистоводородную кислоту получают по Розеи-гейму и Леви , действием концентрированной серной кислоты на смесь тщательно высушенного роданистого калия и пятиокиси фосфора. Полученную роданистоводородную кислоту при давлении 60—70 мм током водорода вытесняют из реакционного сосуда в сильно охлажденный приемник. [c.79]
Полученную роданистоводородную кислоту при давлении 60—70 мм током водорода вытесняют из реакционного сосуда в сильно охлажденный приемник. [c.79]
Красный фосфор получение чистой Н3РО4 (термическая фосфорная кислота), полупроводниковых матсриа.чов (ОаР, 1пР и др.) в производстве безопасных спичек. [c.82]
Учебник общей химии (1981) — [ c.273 ]
Химический тренажер. Ч.1 (1986) — [ c.24 , c.31 , c.42 ]
Пособие по химии для поступающих в вузы 1972 (1972) — [ c.247 ]
Курс неорганической химии (1963) — [ c.673 ]
Минеральные кислоты и основания часть 1 (1932) — [ c.169 ]
Неорганическая химия (1950) — [
c. 178
]
178
]
Общая и неорганическая химия (1981) — [ c.412 ]
Руководство к практическим занятиям по радиохимии (1968) — [ c.231 ]
Неорганические хлориды (1980) — [ c.299 , c.301 ]
Общая химическая технология (1977) — [ c.210 , c.211 ]
Технология минеральных солей (1949) — [ c.475 ]
Химия органических соединений фосфора (1972) — [ c.267 ]
Неорганическая химия (1994) — [ c.284 ]
Химия изотопов Издание 2 (1957) — [ c.19 , c.202 ]
Курс неорганической химии (1972) — [
c. 603
]
603
]
Неорганические полимеры (1965) — [ c.72 ]
Основы общей химии том №1 (1965) — [ c.428 , c.432 ]
Использование и применение фосфора
Одним из наиболее важных биогенных элементов признан именно фосфор. Его отсутствие делает невозможным жизнедеятельность многих живых организмов, в том числе и человеческого, поскольку он содержится в белках, фосфолипидах, и многих других органических соединениях, среди которых АТФ и ДНК. Одновременно с этим неорганика фосфора является богатой разнообразными молекулами. Участвует в образовании свыше 200 минералов, из которых наиболее приоритетными являются фосфорит и апатит.
Фосфором называется химический элемент, название которого с древнегреческого означает «светоносный». В периодической системе Менделеева фосфор занял место в 15-й группе третьего периода. Он относится к группе химических элементов под названием пниктогены.
Он относится к группе химических элементов под названием пниктогены.
Существует несколько версий открытия данного элемента. Наиболее раннее упоминание о существовании фосфора можно найти в алхимических записях, которые датируются 12 веком. Само название элемента в подобных работах отсутствует, однако, можно встретить сведения о получении неизвестного «светящегося» вещества.
По официально версии фосфор был открыт в 1669 году обанкротившимся торговым купцом, пытающимся найти философский камень. Произошло это случайно во время многократного прокаливания мочи человека, в результате чего было образовано вещество, от которого исходил яркий свет.
Получение фосфора
Современные ученые владеют многими методами, посредством которых можно синтезировать фосфор. Наиболее популярным считается его восстановление из минералов, в составе которых он содержится. Как правило, таковыми являются апатиты или фосфориты, взаимодействующие с коксом и кремнеземом в достаточно высоких температурных условиях (порядка 1600 0 С). Производство фосфора, в данном случае, осуществляется в специальных печах.
Производство фосфора, в данном случае, осуществляется в специальных печах.
В природе данный химический элемент широко распространен. Фосфор обладает очень сильной химической активностью, в связи с чем не встречается в свободном состоянии. Он содержится в земной коре и воде, однако к наиболее крупным его запасам во всем мире относятся морские фосфориты наряду с продуктами их выветривания. Ученые считают, что последние имеют океаническое происхождение.
Так, фосфаты формировались путем разных органических и неорганических процессов на протяжении очень продолжительного времени в прибрежных регионах пояса пассатов. Фосфаты аккумулировались из внешней среды, что привело к многократному увеличению концентрации фосфоритов в месторождении.
Сегодня наиболее крупные такие месторождения находятся на территории Марокко, а также Западной Сахары, Америки, Китая, Туниса, Казахстана. Пальма первенства в этом принадлежит именно Марокко – на долю этой страны приходится 70% от всех запасов фосфатов в мире. Но, не смотря на это, среди стран-производителей фосфора Марокко расположилась на втором месте, пропустив вперед США. По данным на 2002 г. в мире из года в год добывается порядка 135 млн. тонн данного вещества.
Но, не смотря на это, среди стран-производителей фосфора Марокко расположилась на втором месте, пропустив вперед США. По данным на 2002 г. в мире из года в год добывается порядка 135 млн. тонн данного вещества.
Стоит отметить, что не все месторождения данного вещества могут называться промышленными. Таковыми принято считать только те, из 1 га которых можно получить фосфатную породу в количестве минимум 6000 тонн и более. Добыча фосфата осуществляется в открытых карьерах с применением скребковых экскаваторов. Первым делом происходит очистка от песчаных наносов и пустых пород, после чего и начинается извлечение фосфатной руды, путь которой к обогатительным фабрикам пролегает по стальным трубам. Стоит сказать, что таким образом руда может преодолевать расстояния в несколько километров.
В морской воде вид данного вещества несколько отличается от других мест его нахождения. Так в водной среде фосфор представлен ортофосфат-анионом, концентрация которого, в среднем, насчитывает около 0,07 мг3/л. Общий океанический объем фосфора составляет 9,8*1010 тонн.
Общий океанический объем фосфора составляет 9,8*1010 тонн.
Применение фосфора
| Вещества | Область применения |
|---|---|
| Белый фосфор | Получение красного фосфора, зажигательных и дымообразующих веществ, в металлургии. |
| Красный фосфор | В производстве спичек: P+KCLO3+S+MnO2+Fe2O3 |
| P2O5 | Получение фосфорной кислоты |
| H3PO4 | Получение фосфорных солей и удобрений |
|
Ca3(PO4)2,Ca(H2PO4)2; Ca(H2PO4)2+2CaSO4H2O, CaHPO4,(NH4)2HPO4,NH4H2PO4 |
Используются в качестве фосфорных удобрений в сельском хозяйстве |
Сфер человеческой деятельности, в которых применяется фосфор и его соединения, колоссальное множество. Это связано, прежде всего, с тем, что как само вещество, так и его соединения, принимают очень важное, неотъемлемое, участие в биологических процессах живых организмов.
Это связано, прежде всего, с тем, что как само вещество, так и его соединения, принимают очень важное, неотъемлемое, участие в биологических процессах живых организмов.
Кроме этого, с участием данного химического элемента осуществляется производство такого очень известного предмета, которым пользуется каждый человек, как спички. С его участием изготавливаются взрывчатые соединения, зажигательные бомбы, некоторые виды топлива, смазочные материалы. Использование фосфора уместно для производства антикоррозионных материалов, при производстве ламп накаливания, в качестве средства для снижения жесткости воды, а также для поглощения газов. Кроме этого, фосфор является распространенным веществом, применяемым в сельском хозяйстве в качестве материала для удобрения почвы. Также он является активным участником химических синтезов во время производства различных веществ.
Ну и ко всему стоит добавить, что фосфор – это жизненно необходимый элемент, на котором основывается синтез ДНК, РНК и фосфолипидов
Фосфор, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
просто и понятно о физических и химических свойствах, применении, влиянии на организм
История открытияКаждый человек знаком с 15 элементом таблицы Менделеева – фосфором, ведь каждый в своей жизни хотя бы раз пользовался спичками, имеющими фосфор в своем составе. Более того, все люди содержат фосфор в своем организме, не в чистом виде, разумеется, а в виде химических соединений, но тем не менее. Особенно много фосфора находится в наших костях и зубах, чей химический состав почти полностью совпадает с формулой минерала фосфорита Ca3(PO4)2. Также фосфорсодержащие белки находятся в наших мышцах, нервах и мозговой ткани, именно поэтому фосфор особенно полезен для мозга. О физических и химических свойствах этого важного химического элемента, о его применении и влиянии на человека читайте далее.
Также фосфорсодержащие белки находятся в наших мышцах, нервах и мозговой ткани, именно поэтому фосфор особенно полезен для мозга. О физических и химических свойствах этого важного химического элемента, о его применении и влиянии на человека читайте далее.
История открытия
В 1669 гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз пытался осуществить мечту всех средневековых алхимиков – найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие. Увы, философский камень и в этот раз найти не удалось, но, тем не менее, Хеннигу посчастливилось сделать другое не менее важное открытие в химии. На этот раз в качестве эксперимента немецкий алхимик решил выпаривать воду из… человеческой мочи. В результате череды сложных химических манипуляций над собственной мочой в реторте у алхимика образовалось неведомое до того светящееся вещество – фосфор.
К слову, само слово «фосфор» с древнегреческого переводится как «несущий свет». Именно такое название он получил за свою удивительную способность светиться в темноте. Первооткрыватель фосфора алхимик Хенниг Брандт быстро понял свою выгоду от этого открытия и за большие деньги показывал светящийся фосфор разным знатным и богатым господам, нажив при этом большое состояние (развлечений в то время в Европе было не так уж и много, так что научно-популярные представления предприимчивого алхимика пользовались большим спросом).
Именно такое название он получил за свою удивительную способность светиться в темноте. Первооткрыватель фосфора алхимик Хенниг Брандт быстро понял свою выгоду от этого открытия и за большие деньги показывал светящийся фосфор разным знатным и богатым господам, нажив при этом большое состояние (развлечений в то время в Европе было не так уж и много, так что научно-популярные представления предприимчивого алхимика пользовались большим спросом).
Впрочем, Хенинг Брандт был не первым, кто добыл фосфор опытным путем. Еще до него, в XII веке это удалось сделать арабскому алхимику Алхиду Бехилу, все также благодаря химическим манипуляциям с мочой и глиной, но его открытие затерялось, и именно повторное открытие фосфора немецким алхимиком принесло широкую популярность этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим свечением и только в конце XIX века ученые поняли, что фосфор также является чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Физические свойства
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
Так схематически выглядит строение молекулы белого фосфора, состоящей из четырех атомов.
Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.
Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства.
Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.
Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.
Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.
Так выглядят разные виды фосфора.
Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Химические свойства
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.
Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P +3O2 > 2P2O3
4P + 5O2 > 2P2O5
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 > 2PCl3
2P + 5Cl2 > 2PCl5
При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S > P2S3
2P + 5S > P2S5
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca > Ca3P2
2P + 3Mg > Mg3P2
Применение
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.
Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.
Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Получения
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).
Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какая роль фосфора в организме человека. А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
Помимо костей и зубов фосфор имеет влияние и на самое главное – мыслительное деятельность человека, ведь он содержится в нашей мозговой ткани и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется метаболизм липидов и протеинов, биосинтез всех необходимых органических веществ. Наконец фосфор входит в состав ДНК и РНК, участвует в ферментивных процессах, поддерживающих кислотно-щелочной баланс в организме.
Фосфор для ребенка
Особенно необходим фосфор для растущего детского организма, ведь у ребенка идет активное формирование костей скелета, развиваются клетки головного мозга. Поэтому очень важно чтобы малыш получал фосфор в необходимых количествах и при этом регулярно, ведь значительная его часть вымывается из организма с мочой.
Поэтому важно знать, какие продукты содержат фосфор.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.
Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Суточная норма
Суточная норма фосфора для взрослого человека составляет 1200-1600 мг. Также стоит учесть, что для людей занимающихся интенсивными физическими нагрузками, а также для беременных и кормящих матерей суточная норма фосфора выше и составляет приблизительно 3000-3800 мг.
Детям требуется от 300 до 1800 мг фосфора каждый день, в зависимости от их возраста.
Недостаток (дефицит) фосфора в организме
Недостаток или дефицит фосфора в человеческом организме может быть обусловлен разными причинами:
- приемом некоторых лекарств, которые понижают кислотность,
- диетами с пониженным содержанием белков,
- алкогольными или наркотическими зависимостями,
- эндокринными заболеваниями,
- заболеваниями почек.
Симптомами недостатка фосфора является общее недомогание, слабость, апатичность, депрессия, физическое и умственное истощение. Если у вас проявляются эти симптомы, то лучше чем скорее обратится к врачу, чтобы он прописал вам правильное лечение.
Избыток фосфора в организме и симптомы отравления им
Избыток фосфора в человеческом организме может быть столь же вредным, как и его недостаток. Обычно причиной избытка фосфора является злоупотребление человеком мясной пищей. Когда фосфора становится слишком много, нарушается его пропорция содержания с кальцием. Кальция становится меньше чем нужно, его вытесняет фосфор, от чего кости человека становятся более хрупкими, может возникнуть остеопороз (снижение плотности костей, повышение их хрупкости).
Также переизбыток фосфора может привести к возникновению проблем с зубами, нарушению работы нервной системы, почек и щитовидных желез. Чтобы предотвратить все это важно вести здоровый образ жизни, правильно питаться (не одним лишь хлебом и мясом, а обязательно фруктами, овощами), избегать вредных привычек.
Видео
И в завершение, образовательное видео по теме нашей статьи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
| ArticleName | Изменение постоянной составляющей фазного напряжения в рудно-термических печах для получения фосфора и карбида кальция | ArticleAuthorData | ООО «ЛЕННИИГИПРОХИМ» А.
Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург А. П. Суслов, проректор |
Abstract | На примере фосфорных и карбидных печей рассматривается характер изменения и природа существования постоянной составляющей (Uп.с) в фазном напряжении рудно-термической печи с закрытым колошником. Постоянная составляющая, обусловленная контактом электрода с расплавом, вызвана химическим взаимодействием последнего с углеродистым электродом и уменьшением падения напряжения на ванне печи на величину изобарно-изотермического потенциала в полупериод, когда на электроде «+», и возрастанием на ту же величину, когда на электроде «–». Значение данной Uп.с зависит от состава расплава, температуры на поверхности электрода, контактирующей с этим расплавом, и доли тока электрода, проходящей через этот контакт. |
References | 1. Сергеев П. В. Энергетические закономерности руднотермических печей, электролиза и электрической дуги. — Алма-Ата : Изд-во АН КазССР, 1963. — 248 с. |
Природные соединения и получение фосфора
План:
|
Введение……………………………………………………………………………. |
3 |
|
История развития фосфора………………………………………………………… |
3 |
|
Природные соединения и получение фосфора…………………………………… |
4 |
|
Химические свойства……………………………………………………………… |
4 |
|
Аллотропные изменения…………………………………………………………… |
5 |
|
а) белый…………………………………………………………………………….. |
6 |
|
б) красный………………………………………………………………………….. |
7 |
|
в)
черный……………………………………………………………………………. |
7 |
|
Оксиды фосфора…………………………………………………………………… |
7 |
|
Ортофосфорная кислота…………………………………………………………… |
9 |
|
Ортофосфаты………………………………………………………………………. |
11 |
|
Фосфор в организме человека…………………………………………………….. |
11 |
|
Спички………………………………………………………………………………. |
12 |
|
Фосфорные удобрения…………………………………………………………….. |
12 |
|
Заключение…………………………………………………………………………. |
14 |
|
1. Значение фосфора……………………………………………………………….. |
14 |
|
2. Применение фосфора…………………………………………………………… |
15 |
|
Список используемой литературы………………………………………………… |
17 |
Введение
Пятая группа Периодической системы включает два типических элемента азот и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими элементами наблюдается значительное различие в свойствах.
В состоянии простых
веществ азот – газ, а фосфор – твердое
вещество. Эти два вещества получили
большую область применения, хотя
когда азот впервые был выделен из
воздуха его посчитали вредным газом,
а на продаже фосфора удавалось заработать
большое количество денег (в фосфоре
ценили его способность светится в
темноте).
История открытия фосфора
По иронии судьбы фосфор открывался несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль (XII век) открыл фосфор при перегонке мочи в смеси с глиной, известью и углем. Однако датой открытия фосфора считается 1669 год. Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, мечтавший с помощью алхимии поправить свои дела, подвергал обработке самые разнообразные продукты. Предполагая, что физиологические продукты могут содержать «первичную материю», считавшейся основой философского камня, Бранд заинтересовался человеческой мочей.
Он собрал около
тонны мочи из солдатских казарм и
выпаривал ее до образования сиропообразной
жидкости. Эту жидкость он вновь
дистиллировал и получил тяжелое красное
«уринное масло», которое перегонялось
с образованием твердого остатка. Нагревая
последний, без доступа воздуха, он
заметил образование белого дыма,
оседавшего на стенках сосуда и ярко
светившего в темноте. Бранд назвал
полученное им вещество фосфором, что в
переводе с греческого означает
«светоносец».
Бранд назвал
полученное им вещество фосфором, что в
переводе с греческого означает
«светоносец».
Несколько лет «рецепт приготовления» фосфора хранился в строжайшем секрете и был известен лишь нескольким алхимикам. В третий раз фосфор открыл Р.Бойль в 1680 году.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца (PbO), поваренной солью (NaCl), поташом (K2CO3) и углем (C). Лишь 1777 году К.В.Шееле заработал способ получения фосфора из рога и костей животных.
Природные соединения и получение фосфора
По
распространенности в земной коре фосфор
опережает азот, серу и хлор. В отличие
от азота фосфор, из-за большой химической
активности встречается в природе только
в виде соединений. Наиболее важные
минералы фосфора — апатит Са5Х(РО4)3
(Х — фтор, реже хлор и гидрооксильная
группа) и фосфорит основой которого
является Са3(РО4)2. Крупнейшее месторождение апатитов
находится на Кольском полуострове, в
районе Хибинских гор. Залежи фосфоритов
находятся в районе гор Каратау, в
Московской, Калужской, Брянской областях
и в других местах. Фосфор входит в состав
некоторых белковых веществ, содержащихся
в генеративных органах растений, в
нервных и костных тканях организмов
животных и человека. Особенно богаты
фосфором мозговые клетки.
Крупнейшее месторождение апатитов
находится на Кольском полуострове, в
районе Хибинских гор. Залежи фосфоритов
находятся в районе гор Каратау, в
Московской, Калужской, Брянской областях
и в других местах. Фосфор входит в состав
некоторых белковых веществ, содержащихся
в генеративных органах растений, в
нервных и костных тканях организмов
животных и человека. Особенно богаты
фосфором мозговые клетки.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема:
Ca3(PO4)2+3SiO2+5C3CaSiO3+5CO+P2.
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
Химические свойства
Электронная конфигурация атома фосфора
1S22S22P63S23P33d0
Наружный электронный
слой содержит 5 электронов. Наличием
трех неспаренных электронов на внешнем
энергетическом уровне объясняет то,
что в нормальном, невозбужденном
состоянии валентность фосфора равна
3.
Наличием
трех неспаренных электронов на внешнем
энергетическом уровне объясняет то,
что в нормальном, невозбужденном
состоянии валентность фосфора равна
3.
Но на третьем энергетическом уровне имеются вакантные ячейки d-орбиталей, поэтому при переходе в возбужденное состояние 3S-электроны будут разъединяться, переходить на d подуровень, что приводит к образованию 5-ти неспаренных элементов.
Таким образом, валентность фосфора в возбужденном состоянии равна 5.
В соединениях фосфор обычно проявляет степень окисления +5, реже +3, -3.
1. Реакции с кислородом:
4P0 + 5O2 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 2P2+3O3)
2. С галогенами и
серой:
С галогенами и
серой:
2P0 + 3Cl2 2P+3Cl3
P0 + 5S P2+5S5
(галогениды фосфора легко разлагаются водой, например:
PCl3
+ 3H2O
H3PO3
+ 3HCl
PCl5
+ 4H2O
H3PO4
+ 5HCl)
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O 3H3P+5O4 + 5N+2O
4. С металлами
образует фосфиды, в которых фосфор
проявляет степень окисления — 3:
С металлами
образует фосфиды, в которых фосфор
проявляет степень окисления — 3:
2P0 + 3Mg Mg3P2-3
(фосфид магния легко разлагается водой Mg3P2 + 6H2O 3Mg(OH)2 + 2PH3(фосфин))
3Li + P Li3P-3
5. Со щелочью:
4P + 3NaOH + 3H2O PH3 + 3NaH2PO2
В реакциях (1,2,3) — фосфор выступает как восстановитель, в реакции (4) — как окислитель; реакция (5) — пример реакции диспропорционирования.
Фосфор может быть
как восстановителем, так и окислителем.
Аллотропные изменения
В свободном состоянии фосфор образует несколько аллотропных видоизменений. Это объясняется тем, что атомы фосфора способны, взаимно соединяясь, образовывать кристаллические решетки различного типа.
Таблица 1
Физические свойства фосфора
|
Аллотропная модификация |
Плотность, г/см3 |
tпл, 0C |
Tкип, 0C |
Внешний вид и характерные признаки |
|
Белый |
1,73 |
44,1 |
280,5 |
Белый кристаллический
порошок, ядовит, самовозгорается
на воздухе. |
|
Красный |
2,3 |
590 |
Возгоняется около 400°С |
Красный кристаллический или аморфный порошок, неядовит. При 220°С и 12 108 Па переходит в черный фосфор. Загорается на воздухе только при поджигании |
|
Черный |
2,7 |
При нагревании переходит в красный фосфор |
Графитоподобная структура. При нормальных условиях — полупроводник, под давлением проводит электрический ток как металл |
|
Белая
модификация фосфора,
получающаяся при конденсации паров,
имеет молекулярную кристаллическую
решетку, в узлах которой дислоцированы
молекулы Р4
(рис. 1). Из-за слабости межмолекулярных
сил белый фосфор летуч, легкоплавок,
режется ножом и растворяется в
неполярных растворителях, например в
сероуглероде. Белый фосфор весьма
реакционноспособное вещество. Он
энергично взаимодействует с кислородом,
галогенами, серой и металлами. Окисление
фосфора на воздухе сопровождается
разогреванием и свечением. Поэтому
белый фосфор хранят под водой, с которой
он не реагирует. Белый фосфор очень
токсичен.
1). Из-за слабости межмолекулярных
сил белый фосфор летуч, легкоплавок,
режется ножом и растворяется в
неполярных растворителях, например в
сероуглероде. Белый фосфор весьма
реакционноспособное вещество. Он
энергично взаимодействует с кислородом,
галогенами, серой и металлами. Окисление
фосфора на воздухе сопровождается
разогреванием и свечением. Поэтому
белый фосфор хранят под водой, с которой
он не реагирует. Белый фосфор очень
токсичен.
Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жесткости питьевой воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для создания дымообразующих веществ и зажигательных смесей.
Техника
безопасности.
В производстве фосфора и его соединений
требуется соблюдение особых мер
предосторожности, т.к. белый фосфор –
сильный яд. Продолжительная работа в
атмосфере белого фосфора может привести
к заболеванию костных тканей, выпадению
зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает
болезненные, долго не заживающие ожоги.
Хранить белый фосфор следует под водой,
в герметичных сосудах. Горящий фосфор
тушат двуокисью углерода, раствором
CuSO4
или песком. Обоженную кожу следует
промыть раствором KmnO4
или CuSO4.
Противоядием при отравлении фосфором
является 2%-ый раствор CuSO4.
Воспламеняясь, белый фосфор вызывает
болезненные, долго не заживающие ожоги.
Хранить белый фосфор следует под водой,
в герметичных сосудах. Горящий фосфор
тушат двуокисью углерода, раствором
CuSO4
или песком. Обоженную кожу следует
промыть раствором KmnO4
или CuSO4.
Противоядием при отравлении фосфором
является 2%-ый раствор CuSO4.
При длительном хранении, а также при нагревании белый фосфор переходит в красную модификацию (впервые его получили лишь 1847 году). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до темно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, и по сравнению с белым фосфором они менее реакционноспособны и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
Красный фосфор
находит применение в металлургии,
производстве полупроводниковых
материалов и ламп накаливания, используется
в спичечном производстве.
Наиболее стабильной модификацией фосфора является черный фосфор. Его получают аллотропным превращением белого фосфора при t=2200C и повышенным давлением. По внешнему виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется в белый фосфор.
Оксид фосфора (V)
|
Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора. |
|
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые
кристаллы, t0пл. =
5700С,
t0кип.=
6000C,
= 2,7 г/см3.
Имеет несколько модификаций. В парах
состоит из молекул P4H10,
очень гигроскопичен (используется как
осушитель газов и жидкостей).
=
5700С,
t0кип.=
6000C,
= 2,7 г/см3.
Имеет несколько модификаций. В парах
состоит из молекул P4H10,
очень гигроскопичен (используется как
осушитель газов и жидкостей).
Получение
4P + 5O2 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
Благодаря
исключительной гигроскопичности оксид
фосфора (V) используется в лабораторной
и промышленной технике в качестве
осушающего и дегидратирующего средства. По своему осушающему действию он
превосходит все остальные вещества. От
безводной хлорной кислоты отнимает
химически связанную воду с образованием
ее ангидрида:
По своему осушающему действию он
превосходит все остальные вещества. От
безводной хлорной кислоты отнимает
химически связанную воду с образованием
ее ангидрида:
Ортофосфорная кислота. Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорная кислота Н3РО4 (Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,350С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:
НО ОН
Р
О ОН
В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
В
промышленности ортофосфорную кислоту
получают двумя способами: экстракционным
и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
Ортофосфорная кислота затем отфильтровывается и концентрируется упариванием.
2. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу ортофосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Физические свойства. Ортофосфорная кислота — твердое, бесцветное, кристаллическое вещество, хорошо растворимое в воде.
Химические свойства ортофосфорной кислоты представлены в табл.2:
Таблица 2
Химические свойства ортофосфорной кислоты
|
Общие с другими кислотами |
Специфические |
|
1.
Легче всего идет диссоциация по первой ступени и труднее всего – по третьей 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода:
3. Реагирует с основными оксидами:
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
5. Реагирует с солями слабых кислот:
|
двуфосфорная кислота
2. желтый осадок
3. Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ. При разложении АТФ выделяется большое количество энергии. |
Ортофосфаты. Ортофосфорная кислота образует три ряда солей. Если обозначить атомы металлов буквами Me, то можно изобразить в общем виде состав ее солей (табл.3).
Таблица 3
Химические формулы ортофосфатов, содержащих металлы
|
одновалентные |
двухвалентные |
трехвалентные |
|
Ме3РО4 |
Ортофосфаты Ме3(РО4)2 |
Ме3РО4 |
|
Ме2НРО4 |
Гидроортофосфаты МеНРО4 |
Ме2(НРО4)3 |
|
МеН2РО4 |
Дигидроортофосфаты Ме(Н2РО4)2 |
Ме(Н2РО4)3 |
Вместо одновалентного металла в состав молекул ортофосфатов может входить группа аммония: (NH4)3PO4 — ортофосфат аммония;
(NH4)2HPO4—гидроортофосфат
аммония; NH4H2PO4
– дигидро-ортофосфат аммония.
Ортофосфаты и гидроортофосфаты кальция и аммония широко используют в качестве удобрений, ортофосфат и гидроортофосфат натрия — для осаждения из воды солей кальция.
Фосфор в организме человека
В теле человека массой 70 кг. Содержится около 780 г. фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденизинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно,
что для правильного питания необходимо
соблюдать баланс между количеством
потребляемого фосфора и кальцием:
оптимальное соотношение в этих элементах
пищи составляет 1,51.
Избыток богатой фосфором пищи приводит
к вымыванию кальция из костей, а при
избытке кальция развивается мочекаменная
болезнь.
Спички
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав спичечной головки входят окислители (PbO2, KСlO3, BaCrO4) и восстановители (S, Sb2S3). При трении от зажигательной поверхности смесь, нанесенная на спичку, воспламеняется:
Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь 1827 г. Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам. Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену фосфорным спичкам пришли безопасные, которые верно служат нам и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Фосфорные удобрения
Минеральные удобрения
– источник различных питательных
элементов для растений и свойств почвы,
в первую очередь азота, фосфора и калия,
а затем кальция, магния, серы, железа.
Фосфор входит в состав многих органических соединений в растениях. Фосфорное питание регулирует рост и развитие растений.
Сырьем для производства фосфорных удобрений, фосфора и всех фосфорных соединений служат апатитовые и фосфоритовые руды. Состав апатитов чаще всего выражается формулой Са5(РО4)3F (фторапатит). Фосфориты отличаются от фторапатитов тем, что в них вместо ионов F— содержатся ионы ОН— или . Фосфориты обычно содержат больше примесей, чем фторапатит.
В дореволюционной
России были известны и разрабатывались
лишь маломощные месторождения фосфоритов
низкого качества. Поэтому событием
огромного народнохозяйственного
значения было открытие в 20-х годах
месторождения апатита на Кольском
полуострове в Хибинах. Здесь построена
крупная обогатительная фабрика, которая
разделяет добываемую горную породу на
концентрат с высоким содержанием фосфора
и примеси – «нефелиновые хвосты»,
используемые для производства алюминия,
соды, поташа и цемента.
Мощные месторождения фосфоритов открыты в Южном Казахстане, в горах Каратау.
Самое дешевое фосфорное удобрение – это тонко измельченный фосфорит – фосфоритная мука. Фосфор содержится в ней в виде нерастворимого в воде фосфата кальция Са3(РО4)2. Поэтому фосфориты усваиваются не всеми растениями и не на всех почвах. Основную массу добываемых фосфорных руд перерабатывают химическими методами в вещества, доступные всем растениям на любой почве. Это водорастворимые фосфаты кальция:
Двойной суперфосфат (цвет и внешний вид сходен с простым суперфосфатом – серый мелкозернистый порошок).
Получается при действии на природный фосфат фосфорной кислоты:
По сравнению
с простым суперфосфатом он не содержит
СаSО4
и является значительно концентрированным
удобрением (содержит до 50% Р2О5).
Преципитат – содержит 35-40% Р2О5.
Получается при нейтрализации фосфорной кислоты раствором гидроксида кальция:
Применяется на кислых почвах.
Аммофос – сложное удобрение, содержащее азот (до 15% N) и фосфор (до 58% Р2О5) в виде NH4H2PO4 и (NH4)2HPO4. Получается при нейтрализации фосфорной кислоты аммиаком.
Раньше в течение более 100 лет в качестве фосфорного удобрения широко использовали так называемый простой суперфосфат, который образуется при действии серной кислоты на природный фосфат кальция:
В этом случае
в реакцию с фосфатом кальция вступает
относительно меньше серной кислоты,
чем при получении из него фосфорной
кислоты. Получается смесь дигидрофосфата
кальция и сульфата кальция. Это удобрение
с массовой долей Р2О5
не выше 20%. Сейчас простой суперфосфат
производится в сравнительно небольших
масштабах на ранее построенных заводах.
Это удобрение
с массовой долей Р2О5
не выше 20%. Сейчас простой суперфосфат
производится в сравнительно небольших
масштабах на ранее построенных заводах.
Примеры фосфорных удобрений даны в табл.4.
Таблица 4
Удобрения, содержащие фосфор
|
Название удобрения |
Химический состав |
|
Простые |
|
|
Суперфосфат двойной |
|
|
Суперфосфат простой |
|
|
Фосфоритная мука |
|
|
Костяная мука |
|
|
Преципитат |
|
|
Шлак мартеновский печей |
Сложный
состав. |
|
Комплексные |
|
|
Аммофос |
|
|
Аммофоска |
|
|
Нитроаммофос |
|
Заключение
Значение фосфора
Фосфорная кислота имеет большое значение как один из важнейших компонентов питания растений. Фосфор используется растениями для построения своих самых жизненно важных частей — семян и плодов.
Производные
ортофосфорной кислоты очень нужны не
только растениям, но и животным. Кости,
зубы, панцири, когти, иглы, шипы у
большинства живых организмов состоят,
в основном, из ортофосфата кальция. Кроме того, ортофосфорная кислота,
образуя различные соединения с
органическими веществами, активно
участвуют в процессах обмена веществ
живого организма с окружающей средой.
В результате этого производные фосфора
содержатся в костях, мозге, крови, в
мышечных и соединительных тканях
организмов человека и животных. Особенно
много ортофосфорной кислоты в составе
нервных (мозговых) клеток, что позволило
А.Е. Ферсману1,
известному геохимику, назвать фосфор
«элементом мысли». Весьма отрицательно
(заболевание животных рахитом, малокровие,
и др.) сказывается на состоянии организма
понижение содержания в рационе питания
соединений фосфора или введение их в
неусвояемой форме.
Кроме того, ортофосфорная кислота,
образуя различные соединения с
органическими веществами, активно
участвуют в процессах обмена веществ
живого организма с окружающей средой.
В результате этого производные фосфора
содержатся в костях, мозге, крови, в
мышечных и соединительных тканях
организмов человека и животных. Особенно
много ортофосфорной кислоты в составе
нервных (мозговых) клеток, что позволило
А.Е. Ферсману1,
известному геохимику, назвать фосфор
«элементом мысли». Весьма отрицательно
(заболевание животных рахитом, малокровие,
и др.) сказывается на состоянии организма
понижение содержания в рационе питания
соединений фосфора или введение их в
неусвояемой форме.
Применение фосфора
Применяют ортофосфорную
кислоту в настоящее время довольно
широко. Основным ее потребителем служит
производство фосфорных и комбинированных
удобрений. Для этих целей ежегодно
добывается во всем мире фосфоросодержащей
руды около 100 млн. т. Фосфорные удобрения
не только способствуют повышению
урожайности различных сельскохозяйственных
культур, но и придают растениям
зимостойкость и устойчивость к другим
неблагоприятным климатическим условиям,
создают условия для более быстрого
созревания урожая в районах с коротким
вегетативным периодом. Они также
благоприятно действуют на почву,
способствуя ее структурированию,
развитию почвенных бактерий, изменению
растворимости других содержащихся в
почве веществ и подавлению некоторых
образующихся вредных органических
веществ.
т. Фосфорные удобрения
не только способствуют повышению
урожайности различных сельскохозяйственных
культур, но и придают растениям
зимостойкость и устойчивость к другим
неблагоприятным климатическим условиям,
создают условия для более быстрого
созревания урожая в районах с коротким
вегетативным периодом. Они также
благоприятно действуют на почву,
способствуя ее структурированию,
развитию почвенных бактерий, изменению
растворимости других содержащихся в
почве веществ и подавлению некоторых
образующихся вредных органических
веществ.
Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны
и другие применения ортофосфорной
кислоты в промышленности. Например,
было замечено, что пропитка древесины
самой кислотой и ее солями делают дерево
негорючим. На этой основе сейчас
производят огнезащитные краски, негорючие
фосфодревесные плиты, негорючий фосфатный
пенопласт и другие строительные
материалы.
Например,
было замечено, что пропитка древесины
самой кислотой и ее солями делают дерево
негорючим. На этой основе сейчас
производят огнезащитные краски, негорючие
фосфодревесные плиты, негорючий фосфатный
пенопласт и другие строительные
материалы.
Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
Особое место
занимают фосфорорганические соединения
как экстрагенты, пластификаторы,
смазочные вещества, присадки к пороху
и абсорбенты в холодильных установках.
Соли кислых алкилфосфатов используют
как поверхностно-активные вещества,
антифризы, специальные удобрения,
антикоагулянты латекса и др. Кислые
алкилфосфаты применяют для экстракционной
переработки урановорудных щелоков.
Кислые
алкилфосфаты применяют для экстракционной
переработки урановорудных щелоков.
Список использованной литературы:
Ф.Г.Фельдман, Г.Е.Рудзитис. ХИМИЯ. Учебник для 9 класса общеобразовательных учреждений. – М., 5-е издание, ПРОСВЕЩЕНИЕ, 1997.
ХИМИЯ. Справочные материалы. Под ред.Ю.Д.Третьякова, — М., ПРОСВЕЩЕНИЕ, 1984.
ХИМИЯ. Справочник школьника, — М., 1995.
ХИМИЯ. Энциклопедия для детей. Том 17, АВАНТА, 2000.
Везер В.-Дж., Фосфор и его соединения, пер. с англ., — М., 1963.
Интернет: /nsm/chemistry/
1 Ферсман Александр Евгеньевич [27.10 (8.11).1883, Петербург, — 20.5.1945, Сочи], советский геохимик и минералог, академик АН СССР (1919). Ученик В. И. Вернадского.
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня.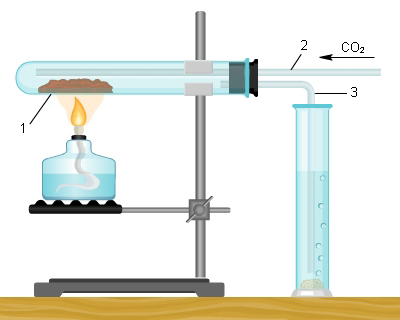 Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Фосфор
Фосфор необходим каждой живой клетке. Органическое фосфатное соединение дезоксирибонуклеиновая кислота (ДНК) обеспечивает генетический код жизни, а аденозинтрифосфат (АТФ) необходим для преобразования клеточной энергии. В сельском хозяйстве фосфор, наряду с азотом и калием, является одним из трех основных питательных веществ для растений.
В сельском хозяйстве фосфор, наряду с азотом и калием, является одним из трех основных питательных веществ для растений.
Элементный фосфор (часто называемый белым (или желтым) фосфором, P 4 ) требуется только для производства ограниченного числа химикатов, и большая часть фосфора, потребляемого во всем мире, потребляется в форме фосфатов.
Использование фосфора
Существуют различные аллотропные формы фосфора, но только две формы имеют коммерческое значение — белый и красный фосфор — и белый фосфор является наиболее коммерчески важным, на него приходится 99% мирового спроса.
Большая часть фосфора используется для производства фосфорной кислоты высокой чистоты, необходимой для обработки пищевых продуктов и травления полупроводников. Она известна как термическая фосфорная кислота и производится путем сжигания фосфора во влажном воздухе.
Однако большая часть фосфорной кислоты, необходимой для производства удобрений, не обязательно должна быть очень чистой, и ее дешевле производить непосредственно из каменно-фосфатных руд, а не через элемент.
Элементный фосфор также используется для производства других химических промежуточных продуктов (продуктов, используемых в процессах производства других химических продуктов).
Рисунок 1 Использование фосфора.
Использование некоторых ключевых соединений фосфора, таких как трихлорид фосфора, фосфористая кислота, сульфиды фосфора, гипофосфит натрия, фосфин и фосфиды, обсуждаются в этом разделе.
Фосфорная кислота и фосфаты используются очень широко.
Красный фосфор используется в пиротехнике и спичек. Он также используется в качестве антипирена в пластмассах (особенно полиамидах), где его быстрое окисление потребляет весь присутствующий кислород, тем самым останавливая возгорание.
Годовое производство элементарного фосфора
Данные по производству фосфора в тоннах отсутствуют. Считается, что на долю Китая приходится около 84% мировых мощностей, за ним следуют Казахстан, США и Западная Европа с 6%, 5% и 5% соответственно 1 .
1. IHS Markit, 2013 г.
Производство белого фосфора
Элементарный фосфор производится электротермическим способом, поэтому потребность в энергии очень высока. На каждую произведенную тонну фосфора требуется около 14 МВтч. Его производство осуществляется только там, где доступна сравнительно дешевая энергия, например, гидроэлектроэнергия. Основные производители находятся в Казахстане, Китае и США.
Наиболее важным источником является фторапатит, 3Ca 3 (PO 4 ) 2 .CaF 2 , широко известный как «фосфоритная порода». Присутствующие примеси включают карбонаты кальция и магния, оксид железа (III), оксид алюминия и кремнезем. Встречается широко, но важные источники находятся в США (Флорида, Северная Каролина), Марокко, Тунисе, России и Китае.
Для повышения эффективности производства подача фосфоритной руды в печь должна быть как можно более равномерной. Для этого фосфатную породу сильно нагревают в печи (обычно во вращающейся обжиговой печи), что приводит к плавлению мелких частиц с образованием твердых конкреций, необходимых для удовлетворительной работы печи.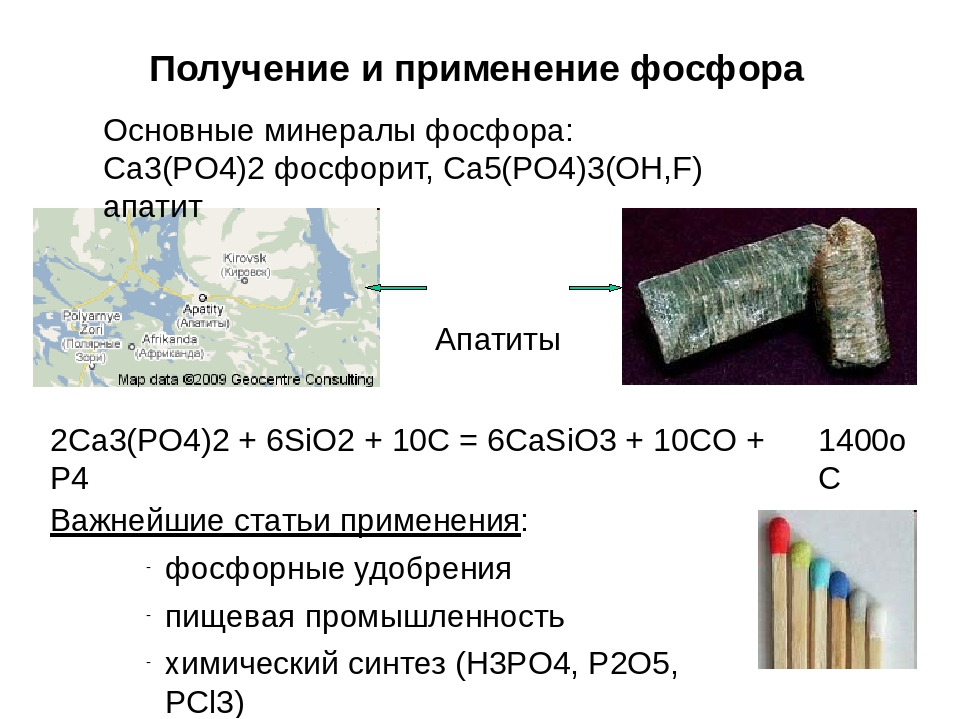 В печь, содержащую три вертикальных углеродных электрода, подают смесь кокса, песка и фосфорита в массовом соотношении, как правило, 16: 30: 100.
В печь, содержащую три вертикальных углеродных электрода, подают смесь кокса, песка и фосфорита в массовом соотношении, как правило, 16: 30: 100.
Современная печь имеет диаметр примерно 12 м и высоту 8 м и может производить 30 000 тонн фосфора в год.
Реакцию можно представить как:
Газообразные фосфор и окись углерода из верхней части печи попадают в струю воды при 343 К. Большая часть фосфора (т.пл. 317 К) конденсируется.Конденсация осуществляется с помощью холодной воды.
Окись углерода сжигается или используется в качестве источника топлива. Его можно использовать в производственном процессе для подготовки конкреций из фосфоритов или, в некоторых случаях, продавать местным производителям электроэнергии.
Расплав силикатно-кальциевого шлака и сплав железа и фосфора, известный как феррофосфор, удаляются отдельно от основания печи. Ферро-фосфор можно добавлять в листовую сталь для предотвращения прилипания листов или добавлять в железо для улучшения жесткости. Это улучшает обрабатываемость некоторых сталей. Некоторый силикат кальция используется как низкосортный хардкор.
Это улучшает обрабатываемость некоторых сталей. Некоторый силикат кальция используется как низкосортный хардкор.
Белый фосфор самовоспламеняется на воздухе и поэтому хранится в теплой воде в виде нижнего жидкого слоя. Во время хранения смесь фосфор / вода / твердые частицы накапливается на поверхности воды, и этот «фосфорный шлам» либо перекачивается обратно в печь для извлечения фосфора, либо перегоняется в отдельных установках для перегонки «шлама». «Фоснистая вода», возникающая из конденсаторов, может содержать растворенный и взвешенный элементарный фосфор, а также оксикислоты фосфора, гексафторкремниевую кислоту, аммиак и кремнезем.Фоснистая вода нейтрализуется известью (иногда аммиаком), отстаивается, а затем обрабатывается хлором для удаления последних следов фосфора.
Фосфор транспортируется в цистернах под водой или под азотом, причем цистерны обогреваются трубами горячей воды. Поставки из Великобритании импортируются в специально сконструированных железнодорожных вагонах, в которых перевозится около 50 тонн твердого элемента, который перед выгрузкой необходимо расплавить. Его растапливают в горячей воде (косвенный нагрев), затем поддерживают при 330 K в железнодорожном вагоне и выгружают прямо из железнодорожного вагона в резервуар для хранения, где он хранится под водой.
Его растапливают в горячей воде (косвенный нагрев), затем поддерживают при 330 K в железнодорожном вагоне и выгружают прямо из железнодорожного вагона в резервуар для хранения, где он хранится под водой.
Производство красного фосфора
Красный фосфор, в отличие от белого фосфора, не самовоспламеняется, но легко воспламеняется.
Изготовлен из белого фосфора. Белый фосфор переливается из резервуара для хранения в стальную емкость, где он хранится под слоем воды. Крышка, снабженная предохранительной трубкой, надежно закрывается, и горшок нагревается до 550 К в течение 3-4 дней. Вода выходит в виде пара через предохранительную трубу, а потеря паров фосфора предотвращается системой конденсации орошения.
Через 48 часов температура повышается до 673 К, когда отгоняется большая часть неизмененного белого фосфора (т. Кип. 553 К).
Содержимое горшка держат во влажном состоянии и измельчают до образования кашицы красного фосфора. После декантации большей части воды добавляют карбонат натрия. При кипячении оставшийся белый фосфор разрушается.
При кипячении оставшийся белый фосфор разрушается.
Наконец, красный фосфор удаляют и сушат в вакууме.
Соединения фосфора
(а) Треххлористый фосфор
Общий объем трихлорида фосфора, производимого каждый год, составляет около 700 000 тонн путем прямой реакции между фосфором и хлором:
Он очень реактивен к атмосферной влаге и транспортируется в сосудах, футерованных свинцом, стеклянных или никелевых.
Трихлорид фосфора имеет ряд важных применений, включая производство:
- оксихлорид фосфора (POCl 3 )
Это делается путем прямой реакции с кислородом:
POC л 3 используется как хлорирующий агент.
В последние годы наиболее важным применением PCl 3 было производство гербицида глифосата, для которого необходимо сначала превратить его в фосфористую кислоту (см. Ниже).
- Присадки для пластмасс, смазочных масел, красок и других отраслей промышленности
- пентахлорид фосфора (PCl 5 )
- триалкилфосфиты Триметилфосфит является важным примером, который используется для производства фосфорорганических гербицидов, пестицидов и антипиренов.

Используются в фармацевтическом синтезе
(b) Фосфорная кислота
Его получают путем гидролиза трихлорида фосфора в разбавленной фосфористой кислоте.Кислота концентрируется в испарителях, а расплавленный продукт охлаждается. Он застывает в хлопья.
Фосфорная кислота используется в производстве гербицидных глифосатов.
Глифосат является наиболее широко используемым и коммерчески ценным химическим веществом для сельскохозяйственных культур. Его получают путем нагревания смеси фосфористой кислоты с глицином (2-аминоэтановой кислотой) с последующим добавлением метаналя.
(в) Сульфиды фосфора
Белый фосфор реагирует с серой с образованием различных сульфидов, P 4 S 10 , P 4 S 7 , P 4 S 5 , P 4 S 3 .Безусловно, наиболее важным из них является P 4 S 10 , который обычно называют пентасульфидом фосфора, P 2 S 5 . Он используется для изготовления присадок к смазочным маслам, которые действуют как антиоксиданты, ингибиторы коррозии и противоизносные присадки, а также в качестве промежуточного продукта при производстве инсектицидов, таких как фосфорорганические пестициды на основе серы.
Он используется для изготовления присадок к смазочным маслам, которые действуют как антиоксиданты, ингибиторы коррозии и противоизносные присадки, а также в качестве промежуточного продукта при производстве инсектицидов, таких как фосфорорганические пестициды на основе серы.
Существует более 52 зарегистрированных пестицидов, для которых P 2 S 5 является промежуточным.Он реагирует с метанолом, этанолом или пропан-2-олом (изопропанолом) с образованием соответственно диметилфосфородитиевой кислоты (DMPA), диэтилфосфородитиевой кислоты (DEPA) или диизопропилфосфородитиевой кислоты (DIPA). Это ключевые промежуточные продукты для производства фосфорорганических пестицидов.
Небольшие количества сесквисульфида фосфора, P 4 S 3 , используются в спичечной промышленности. Однако этот продукт используется только для спичек «где угодно» (т. Е. Небезопасных), а объем мирового рынка для P 4 S 3 составляет около 100 тонн в год. Есть только один производитель продукта.
Есть только один производитель продукта.
(d) Гипофосфит натрия
Моногидрат гипофосфита натрия (SHPM) представляет собой натриевую соль гипофосфористой кислоты HOP (O) H 2 . Сначала кальциевая соль производится путем взаимодействия белого фосфора с известковой суспензией при кипении. Впоследствии соль кальция реагирует с сульфатом натрия с образованием SHPM. Он имеет ряд коммерческих применений, но наиболее важным является нанесение химического никелирования (ENP), в котором он действует как восстановитель.На ЕПС приходится около 90% спроса. Основным направлением роста ENP было производство жестких дисков для компьютеров.
e) фосфин
Белый фосфор нагревают под давлением в воде, подкисленной фосфорной кислотой, примерно до 550 К с получением фосфина:
Белый фосфор перед дальнейшей реакцией образует красный аллотроп. Реакция проводится в графитовых реакторах периодического действия.
Около 1500 тонн фосфина, который является ядом, производится каждый год и используется для производства огнезащитных производных и для борьбы с вредителями.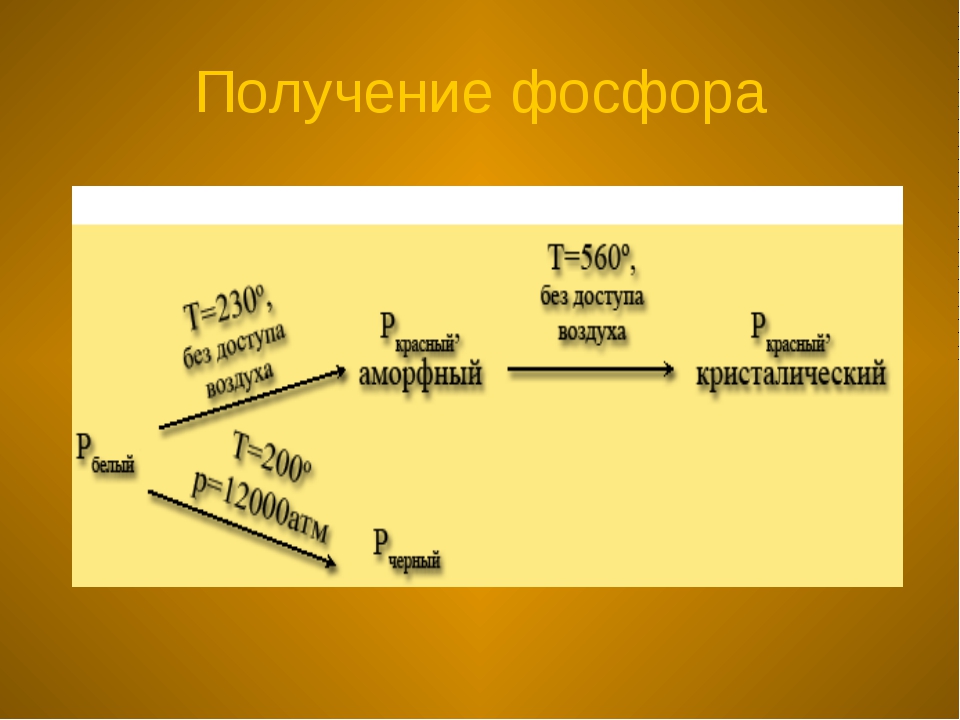 Например, газ используется в больших зерновых силосах для защиты зерна.
Например, газ используется в больших зерновых силосах для защиты зерна.
(е) Фосфиды
Красный фосфор нагревают вместе с металлическими порошками с образованием фосфидов, таких как фосфид алюминия, AlP, фосфид цинка, Zn 3 P 2 и фосфид кальция, Ca 3 P 2 .
Их основное назначение — убивать грызунов, таких как крысы, и как фумигант для хранимого зерна злаковых.
Фосфиды реагируют с влагой, гидролизуются с образованием фосфина, поэтому с ними нужно обращаться очень осторожно.
Дата последнего изменения: 6 января 2017 г.
фермеров столкнулись с фосфорным кризисом. Решение начинается с почвы.
В пасмурный день Роджер Сильвестр-Брэдли идет по изгороди из боярышника, собирая толстую корку грязи на своих кожаных ботинках, прежде чем ступить на пологое поле ячменя.
Он наклоняется, чтобы вырвать с земли саженец высотой по щиколотку, и осматривает его здоровую копну тонких белых корней. Поворачивая их в руках, он говорит: «Когда вы видите растение с дефицитом фосфора, оно выглядит не так.
Поворачивая их в руках, он говорит: «Когда вы видите растение с дефицитом фосфора, оно выглядит не так.
Это стало неожиданностью для Сильвестра-Брэдли, ученого-растениеводства из ADAS, сельскохозяйственной консалтинговой компании в Кембридже, Англия. Фосфор естественным образом содержится в почве и является важным питательным веществом для роста растений. На протяжении веков фермеры добавляли дополнительные площади на свои поля, чтобы увеличить урожай, но Сильвестр-Брэдли и его коллеги изучают способы производства продуктов питания, используя меньшее количество урожая.
Причин двоякое: во-первых, сток фосфора с ферм способствует широкомасштабному загрязнению воды.Во-вторых, у нас нет фосфора, который можно выбрасывать.
Почти весь фосфор, который фермеры используют сегодня и который мы потребляем с пищей, которую мы едим, добывается из нескольких источников фосфорита, в основном в США, Китае и Марокко. По некоторым оценкам, они могут закончиться всего за 50–100 лет. Геологам известны и другие месторождения, но они труднодоступны и содержат меньше фосфора. Таким образом, цена, вероятно, вырастет, из-за чего производителям будет сложнее покупать удобрения, а людям — продукты питания.
Геологам известны и другие месторождения, но они труднодоступны и содержат меньше фосфора. Таким образом, цена, вероятно, вырастет, из-за чего производителям будет сложнее покупать удобрения, а людям — продукты питания.
Здесь и на других экспериментальных площадках в Англии Сильвестр-Брэдли и его коллеги сделали первый здравый шаг к решению проблемы: они перестали добавлять фосфорные удобрения на половину ячменного поля, чтобы посмотреть, как будут расти растения. Восемь лет спустя они только начали наблюдать первые эффекты в размере урожая и урожайности. Растения выжили за счет избытка питательных веществ в почве — так называемого унаследованного фосфора — который, по мнению некоторых, представляет собой ключевой элемент фосфорной головоломки.
Исследователи подсчитали, что в таких странах, как Великобритания и США, в земле уже есть удобрения на миллиарды долларов, которые могут помочь компенсировать спрос на добытый фосфор. Его использование также ограничило бы сток фосфора.
Роджер Сильвестр-Брэдли проверяет корни здорового растения ячменя на наличие признаков дефицита фосфора. В поле не вносили удобрений почти десять лет, и растения только сейчас начинают показывать небольшой недостаток.
Фотография Джулии РозенПожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Для Пола Уизерса, почвоведа из Ланкастерского университета и одного из сотрудников Сильвестра-Брэдли, использование унаследованного фосфора не составляет труда, а сохранение статус-кво — это рецепт как экологической, так и гуманитарной катастрофы. «Мы не можем допустить, чтобы сельское хозяйство загрязняло окружающую среду и использовало ресурсы так, как мы», — говорит Уизерс. «В конце концов, это просто вызовет крах.”
Коварное питательное вещество
Фосфор — непреложное требование для жизни. Это основа ДНК и Р в АТФ — молекула, которая переносит энергию по клеткам. Для роста растениям необходим фосфор, поэтому фермеры тысячелетиями скармливают им свои посевы.
Сначала, не понимая химии, люди использовали навоз и человеческие отходы в качестве удобрений. Затем, в 1800-х годах, фермеры поняли, что богатые фосфором кости и камни тоже работают.
В 1842 году бросивший Оксфордский университет по имени Джон Беннет Лоуз запатентовал процесс обработки этих новых минеральных форм фосфора кислотой, сделав это питательное вещество более доступным для растений, и вскоре начал продавать первое в мире удобрение, созданное руками человека.
Лоус вложил свою значительную прибыль в исследования в загородном имении своей семьи, которое позже стало исследовательским центром Ротамстеда. И там ученые обнаружили, что фосфор — это довольно коварное питательное вещество.
Удобрение, произведенное Лавсом, содержало растворимую неорганическую форму фосфора, которую растения могут легко использовать. Но как только фосфор попадает в почву, большая его часть вступает в реакцию с минералами почвы, образуя соединения, недоступные для сельскохозяйственных культур. Некоторые также были заперты в столь же недоступных органических формах.
Некоторые также были заперты в столь же недоступных органических формах.
На основании этих наблюдений ученые пришли к выводу, что фермерам не следует экономить на фосфоре. Им следует наброситься на это, особенно когда они мчались, чтобы прокормить растущее население мира в 20 — веках.
Фактически, когда-то Уитерс был обязанностью распространять информацию. В 1980-е годы, будучи советником правительства по фермам, он ездил на красном универсале Volvo по извилистым дорогам сельской Англии, говоря фермерам, чтобы они удостоверились, что их урожай содержит много основных питательных веществ.
Этот метод, который Уизерс называет «фермерством на основе страхования», все еще преобладает во многих частях мира.В Европе фермеры применяют примерно 4 килограмма фосфора на каждый килограмм, который мы потребляем с пищей. Для рациона США это соотношение составляет примерно 9: 1, а в Китае оно может достигать 13: 1 (есть важные исключения в местах, где у фермеров никогда не было достаточного доступа к фосфорным удобрениям, например, во многих частях Африки и США). Южная Америка.)
Южная Америка.)
Фосфор теряется на многих этапах производства и обработки пищевых продуктов. Но эта неэффективность создает проблему, поскольку надвигающиеся изменения в доступности фосфора и ценах угрожают дестабилизировать мировую продовольственную систему, говорит Уизерс.«Мы вроде как переборщили и снова вернулись к уязвимости».
Что еще хуже, некоторое количество неиспользованных удобрений накапливается в почве, что вызывает экологические проблемы еще долгое время после их внесения, — говорит Хелен Джарви, гидрохимик из Центра экологии и гидрологии в Уоллингфорде, Великобритания. Ее исследования показывают, что удобрения медленно просачиваются в почву. окружающей среде в течение десятилетий, препятствуя благим намерениям землевладельцев уменьшить загрязнение питательными веществами.
Даже небольшого количества фосфорных стоков с ферм и сточных вод достаточно для разжигания цветения водорослей, которые наполняют водотоки гнойной зеленой пеной.Иногда, как в озере Эри, они производят токсины, которые могут загрязнять питьевую воду и использовать растворенный кислород, убивая рыбу и других водных организмов.
Согласно одному исследованию, загрязнение фосфором затрагивает почти 40 процентов площади суши Земли. И ущерб складывается. По одной из оценок, только в США воздействие избытка фосфора и азота — еще одного ключевого питательного вещества — на качество воды и экосистемы обходится в 2,2 миллиарда долларов в год.
Данк для растений?
Если унаследованный фосфор является негативным фактором для окружающей среды, это также огромная возможность, по мнению Уизерса и других ученых.В исследовании за 2015 год он и его коллеги подсчитали, что поля в Соединенном Королевстве содержат фосфора на сумму более 10 миллиардов долларов, чего достаточно для удовлетворения потребности страны в удобрениях на срок до 54 лет.
Фронтальный погрузчик перемещает гранулы моноаммонийфосфата на склад на заводе удобрений «ФосАгро-Череповец» в Череповце, Россия, 9 августа 2017 г.
Фотография Андрея Рудакова, Bloomberg / Getty Images Пожалуйста, соблюдайте авторские права . Несанкционированное использование запрещено.
Несанкционированное использование запрещено.
Многие другие страны обладают аналогичными запасами. Анализ 2012 года показал, что глобальные почвы содержат достаточно унаследованного фосфора, чтобы сократить прогнозируемый спрос на новые удобрения вдвое к 2050 году.
«Растения могут использовать наши ошибки прошлого», — говорит Шейда Саттари, ведущий автор исследования.
Если судить по цифрам, устаревший фосфор выглядит как беспроигрышный вариант. Но могут ли растения жить на нем? Исследования показывают, что в местах с долгой историей чрезмерного использования фосфора, таких как Великобритания., урожай может расти в течение 10 или более лет за счет накопленных в земле запасов. Самый яркий пример — из Саскачевана, где исследователи не добавляли фосфор на участки под пшеницу с 1995 года. Двадцать пять лет спустя они все еще не видели проблем.
Традиционные измерения химического состава почвы предполагают, что следует вносить больше удобрений, — говорит Барбара Кейд-Менун, которая наблюдает за экспериментами в Центре исследований и разработок Swift Current в Канаде. «Но наши урожаи не меняются.”
«Но наши урожаи не меняются.”
Ученые считают, что по мере того, как растения используют легко доступный фосфор на полях, минеральные вещества почвы и органические вещества выделяют больше питательных веществ. Кейд-Менун еще не знает, могут ли изменения химического состава почвы, почвенных микробов или самих растений объяснить происходящее на ее участках. Тем не менее, результаты показывают, что те недоступные формы фосфора, о которых беспокоились исследователи из Ротамстеда, не так уж и запрещены, как когда-то думали ученые.
А это означает, что простое сокращение удобрений может иметь большое значение для удовлетворения спроса на фосфор и уменьшения стока без ущерба для урожая.
Более разумные посевы
Однако в какой-то момент уровень фосфора в почве упадет настолько, что посевы станут подвержены стрессу. Это отчасти потому, что некоторые из них действительно недоступны для растений, но также потому, что многие современные культуры не могут удержать то, что там есть.
Дефицит фосфора в природе вынудил дикие растения разрабатывать стратегии для обеспечения его достаточного запаса. Многие развили обширные корневые системы, которые ищут фосфор. Некоторые также могут выделять химические вещества, чтобы высвободить питательные вещества из почвы.
Но большинство товарных культур не обладают такими способностями. Ученые выращивали их на хорошо удобренных почвах, которые не требовали от растений затрат энергии на использование таких инструментов. И в мире обильных ресурсов селекционеры не отбирали сорта с сильными фосфорными свойствами. В результате, как говорит Фил Хейгарт, почвовед из Ланкастерского университета, получилась «масса быстрорастущих немых растений», которые с трудом извлекают фосфор из почвы.
Теперь исследователи хотят создавать более разумные культуры.В 2012 году ученые идентифицировали ген в древнем сорте японского риса, который увеличивал способность растения обнаруживать фосфор за счет выращивания тонких корней. Затем исследователи внедрили этот признак в современные растения риса, и в 2019 году фермеры на Мадагаскаре, который имеет бедные питательными веществами почвы, начали тестирование некоторых из наиболее многообещающих сортов.
Сигрид Хойер, исследователь из Ротамстеда, которая участвовала в исследовании риса, ищет аналогичный ген в пшенице в рамках Международного партнерства по урожайности пшеницы.Другие ученые разрабатывают сорта сельскохозяйственных культур, которым вообще не нужно столько фосфора.
Помимо селекции, беспахотное земледелие может помочь, предотвращая уплотнение почвы и способствуя хорошему развитию корней, чтобы помочь растениям получить доступ к большему количеству унаследованного фосфора. Добавление симбиотических грибов, которые распространяются через почву, может расширить возможности растения под землей, а выращивание сельскохозяйственных культур вместе с бобовыми и другими растениями, выделяющими фосфорные соединения, может высвободить больше питательных веществ.
Уизерс и Сильвестр-Брэдли пытались снизить уровень фосфора на своих испытательных полях именно с целью изучения таких подходов.
Исследователям пришлось покинуть поле ячменя в Кембридже из-за смены владельца фермы. Но на оставшихся участках уровни фосфора наконец упали до достаточно низкого уровня, чтобы они начали проводить эксперименты о том, как помочь растениям получить доступ к как можно большему количеству унаследованного фосфора. В первом будет сравниваться эффективность существующих товарных сортов пшеницы.
Но на оставшихся участках уровни фосфора наконец упали до достаточно низкого уровня, чтобы они начали проводить эксперименты о том, как помочь растениям получить доступ к как можно большему количеству унаследованного фосфора. В первом будет сравниваться эффективность существующих товарных сортов пшеницы.
Исследователям пришлось ждать дольше, чем ожидалось — почти десять лет, — пока уровень фосфора не упадет до естественного уровня.Но сам по себе этот факт должен убедить производителей, что они могут безопасно сократить потребление питательных веществ, говорит Сильвестр-Брэдли.
«Насколько я понимаю, фермеры могут расслабиться».
Эта история была поддержана стипендией научной журналистики Европейского союза геонаук.
Глобальная нехватка фосфора будет усугубляться эрозией почв
Глобальные потери P из почв и почвенных балансов P
Все континенты приводят к отрицательному балансу фосфора (например.g., чистые потери фосфора в сельскохозяйственных системах, таблица 1; Рис. 2), за исключением Азии, Океании и Австралии, причем Азия имеет слегка положительный, но близкий к нулю баланс P. И это несмотря на внесение химических удобрений от высокого до очень высокого (диапазон от 1,7 до 13 кг га -1 год -1 между разными континентами, с национальными значениями, достигающими 14 и 19 кг га -1 года −1 для 15 старых государств-членов Европейского Союза (ЕС15, страны-члены, присоединившиеся до 2004 г., в основном в Западной и Северной Европе) и Китай, соответственно).Наиболее отрицательные балансы P показаны для Африки из-за очень низкого внесения химических удобрений 1,7 кг га -1 год -1 в сочетании с высокими потерями из-за эрозии почвы 9,6 кг га -1 год -1 . Южная Америка, а также Центральная и Восточная Европа (NEU11; новые государства-члены, присоединившиеся к ЕС после 2004 г., за исключением Кипра и Мальты) также демонстрируют высокие потери P, но по другим причинам.
2), за исключением Азии, Океании и Австралии, причем Азия имеет слегка положительный, но близкий к нулю баланс P. И это несмотря на внесение химических удобрений от высокого до очень высокого (диапазон от 1,7 до 13 кг га -1 год -1 между разными континентами, с национальными значениями, достигающими 14 и 19 кг га -1 года −1 для 15 старых государств-членов Европейского Союза (ЕС15, страны-члены, присоединившиеся до 2004 г., в основном в Западной и Северной Европе) и Китай, соответственно).Наиболее отрицательные балансы P показаны для Африки из-за очень низкого внесения химических удобрений 1,7 кг га -1 год -1 в сочетании с высокими потерями из-за эрозии почвы 9,6 кг га -1 год -1 . Южная Америка, а также Центральная и Восточная Европа (NEU11; новые государства-члены, присоединившиеся к ЕС после 2004 г., за исключением Кипра и Мальты) также демонстрируют высокие потери P, но по другим причинам. В Южной Америке очень много химических удобрений, но также и высокие потери из-за эрозии почвы в сочетании с высоким экспортом фосфора из-за управления органическим фосфатом (рассчитывается как сумма внесения навоза и остатков за вычетом поглощения растениями).Напротив, новые государства-члены восточноевропейского союза (NEU11) имеют довольно низкие потери от эрозии, но также очень низкие объемы внесения химических удобрений. При гипотетическом предположении об отсутствии восполнения запасов из-за химических удобрений (например, из-за экономических или технических ограничений) расчет баланса P в почве приводит к отрицательному балансу во всем мире, а также для всех рассматриваемых континентов и регионов (истощение от 4 до 20 кг. P га −1 год −1 ; рис.3 и 4; таблица 1). Последнее демонстрирует уязвимость современной глобальной системы управления земельными ресурсами и ее сильную зависимость от химических фосфорных удобрений из невозобновляемых полезных ископаемых.
В Южной Америке очень много химических удобрений, но также и высокие потери из-за эрозии почвы в сочетании с высоким экспортом фосфора из-за управления органическим фосфатом (рассчитывается как сумма внесения навоза и остатков за вычетом поглощения растениями).Напротив, новые государства-члены восточноевропейского союза (NEU11) имеют довольно низкие потери от эрозии, но также очень низкие объемы внесения химических удобрений. При гипотетическом предположении об отсутствии восполнения запасов из-за химических удобрений (например, из-за экономических или технических ограничений) расчет баланса P в почве приводит к отрицательному балансу во всем мире, а также для всех рассматриваемых континентов и регионов (истощение от 4 до 20 кг. P га −1 год −1 ; рис.3 и 4; таблица 1). Последнее демонстрирует уязвимость современной глобальной системы управления земельными ресурсами и ее сильную зависимость от химических фосфорных удобрений из невозобновляемых полезных ископаемых.
Хроматическая шкала представляет оценки потерь P, в то время как серый цвет указывает площади пахотных земель, которые были исключены из моделирования из-за недоступности данных. Обратите внимание, что классы не ранжируются по регулярной шкале, а делятся на шесть классов с использованием метода квантильной классификации.Учитывались только фракции, доступные для растений. Для получения большего количества остаточных фракций P см. Таблицу 1 или Рис. 3 и 4).
Рис. 3: Глобальные резервуары почвы P и истощение из-за эрозии. Стрелки указывают потоки (положительный: чистый вклад в почвы, отрицательный: истощение почв). * Управление органическим фосфатом = сумма внесенного навоза и остатков минус поглощение растениями. Нерастительный P = нерастительный доступный P. Неорганический и органический P дают растительные фракции. Общий P почвы: сумма фракций P, потерянных из почвы в результате эрозии с относительными ошибками.Нет / с хим. = P баланс с химическими удобрениями и без них.
* Управление органическим фосфатом = сумма внесенного навоза и остатков минус поглощение растениями. Нерастительный P = нерастительный доступный P. Неорганический и органический P дают растительные фракции. Общий P почвы: сумма фракций P, потерянных из почвы в результате эрозии с относительными ошибками.Нет / с хим. = P баланс с химическими удобрениями и без них.
AD = атмосферное осаждение. CF = химическое удобрение. OM = Управление органическим P = сумма внесенного навоза и остатков минус поглощение растениями. Стрелки указывают потоки (положительные: чистый вклад в почвы, отрицательные: истощение почв). Нерастительный P = нерастительный доступный P. Неорганический и органический P дают растительные фракции. Почва P потеряла : сумма фракций P, потерянных из почвы в результате эрозии с относительными ошибками.{+ 1.17 \%} \) кг га −1 год −1 в мире (рис. 3, таблица 1). Это примерно 60% от показателей, данных Smil 16 , который оценил 10 кг P га -1 год -1 с пахотных полей из-за эрозии почвы водой. Наши общие потери фосфора из-за эрозии почвы водой из пахотных почв во всем мире составляют 6,3 Тг в год -1 с 1,5 Тг в год -1 для органических и 4,8 Тг в год -1 для неорганического Р. С этими значениями результаты находятся в нижней части диапазона, обсуждаемого в литературе (1–19 Тг / год –1 , таблица 2).
3, таблица 1). Это примерно 60% от показателей, данных Smil 16 , который оценил 10 кг P га -1 год -1 с пахотных полей из-за эрозии почвы водой. Наши общие потери фосфора из-за эрозии почвы водой из пахотных почв во всем мире составляют 6,3 Тг в год -1 с 1,5 Тг в год -1 для органических и 4,8 Тг в год -1 для неорганического Р. С этими значениями результаты находятся в нижней части диапазона, обсуждаемого в литературе (1–19 Тг / год –1 , таблица 2).
Liu 34 при оценке чистых поступлений в системы пахотных земель и выхода из них показал чистую потерю фосфора с пахотных земель мира в размере около 12,8 тг / год −1 (при расчете поступления из атмосферы, выветривания и химических удобрений по сравнению с производительностью от регулирование органического фосфора, эрозия почвы и сток), что, согласно их расчетам, будет того же порядка величины, что и внесение синтетических удобрений (13.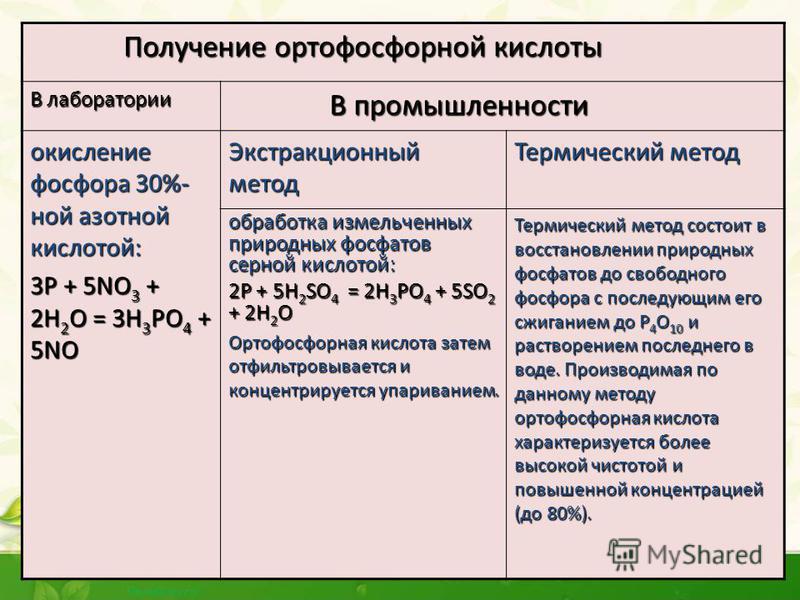 8 Тг / год −1 за 2003/2004 статистический год). Наши расчеты приводят к приблизительной чистой потере почвы из-за эрозии в размере 6,3 тг / год -1 при среднемировом внесении химических удобрений 9,2 тг / год -1 . Потоки ясно показывают критическую зависимость от химических удобрений во всем мире с гипотетическим истощением, связанным с чистой средней площадью 10,7 кг га -1 год -1 во всем мире без компенсации за счет химических удобрений, из которых потеря 5 .2 кг га -1 год -1 связано с управлением органическим фосфатом (сумма внесенного навоза и пожнивных остатков за вычетом поглощения растениями) и 5,9 кг га -1 года -1 в результате эрозии почвы (Таблица 1). Континентальные и национальные потери фосфора в результате эрозии составляют от 40 до 85% от общих потерь фосфора в сельскохозяйственных системах, за исключением Европы и Австралии (16 и 19%, соответственно). В глобальном масштабе, а также в Африке, Южной Америке и Азии потери фосфора в почве из-за эрозии выше, чем потери из-за управления органическим фосфатом.
8 Тг / год −1 за 2003/2004 статистический год). Наши расчеты приводят к приблизительной чистой потере почвы из-за эрозии в размере 6,3 тг / год -1 при среднемировом внесении химических удобрений 9,2 тг / год -1 . Потоки ясно показывают критическую зависимость от химических удобрений во всем мире с гипотетическим истощением, связанным с чистой средней площадью 10,7 кг га -1 год -1 во всем мире без компенсации за счет химических удобрений, из которых потеря 5 .2 кг га -1 год -1 связано с управлением органическим фосфатом (сумма внесенного навоза и пожнивных остатков за вычетом поглощения растениями) и 5,9 кг га -1 года -1 в результате эрозии почвы (Таблица 1). Континентальные и национальные потери фосфора в результате эрозии составляют от 40 до 85% от общих потерь фосфора в сельскохозяйственных системах, за исключением Европы и Австралии (16 и 19%, соответственно). В глобальном масштабе, а также в Африке, Южной Америке и Азии потери фосфора в почве из-за эрозии выше, чем потери из-за управления органическим фосфатом.
Недавняя количественная оценка поступления атмосферной пыли P, основанная на измерениях пыли в Сьерра-Неваде, пришла к выводу, что измеренные потоки пыли больше или равны современным эрозионным выходам и большой долевой вклад относительно коренных пород 35 . Однако, даже несмотря на то, что их измеренные и смоделированные максимальные атмосферные потоки P были того же порядка величины, что и данные об атмосферных потоках Ванга и др. 36 , использованные в этом исследовании (0,1 кг га −1 год −1 для Северной Америки), темпы эрозии по измерениям отстойников в исследованных лесных экосистемах были значительно ниже (максимум 0.06 кг га −1 год −1 35 ), чем можно было бы ожидать на пахотных землях во всем мире. Таким образом, мы явно не можем согласиться с приведенным выше выводом.
Смягчение P-статуса почв в долгосрочной перспективе путем уменьшения дефицита текущего управления органическим P кажется трудным и довольно маловероятным во многих регионах мира (см. Обсуждение континентального баланса ниже). Таким образом, и учитывая ожидаемую в будущем нехватку фосфора из промышленных удобрений, оценка потоков фосфора ясно показывает, что эрозия почвы должна быть ограничена возможным абсолютным минимумом в будущем.
Обсуждение континентального баланса ниже). Таким образом, и учитывая ожидаемую в будущем нехватку фосфора из промышленных удобрений, оценка потоков фосфора ясно показывает, что эрозия почвы должна быть ограничена возможным абсолютным минимумом в будущем.
Только малая часть общего фосфора почвы доступна для растений, потому что большая часть либо связана, адсорбируется, либо становится недоступной из-за окклюзии минералами (апатитом и поглощенным фосфатом) 37 . Наш подход к моделированию следует подходу Янга и др. 37 , который основан на существующих знаниях о процессах почвенного фосфора и базах данных для предоставления пространственно точных оценок различных форм естественного почвенного фосфора в глобальном масштабе. Ян и др. 37 использует данные, полученные с помощью метода фракционирования Хедли 38 , который разделяет почвенный P на различные фракции, которые извлекаются последовательно с более сильными реагентами и которые объединяются в различные неорганические и органические пулы. Существует большая неопределенность в отношении связи этих фракций с функциональным потреблением растений 39,40 , но некоторые недавние работы направлены на количественное определение времени пребывания различных фракций 17,41 . Мы представляем общую потерю фосфора, а также доступный для растений пул (рис. 3 и 4, таблица 1) как наиболее лабильный фосфат, который может участвовать в питании растений во временном масштабе до месяцев 17 (т. Е. Так — лабильный неорганический P, неорганический P, связанный с вторичными минералами, лабильный и стабильный органический P ( 33,37 ).Мы сравниваем эти более лабильные, короткоживущие фракции с фракциями, считающимися очень стабильными, которые не были бы доступны растениям в короткие сроки (т.е. неорганический P, связанный с такими минералами, как апатит или поглощенный P 17 , что соответствует 52% от общего количества фосфора в почве. по нашим оценкам в мировом масштабе).
Существует большая неопределенность в отношении связи этих фракций с функциональным потреблением растений 39,40 , но некоторые недавние работы направлены на количественное определение времени пребывания различных фракций 17,41 . Мы представляем общую потерю фосфора, а также доступный для растений пул (рис. 3 и 4, таблица 1) как наиболее лабильный фосфат, который может участвовать в питании растений во временном масштабе до месяцев 17 (т. Е. Так — лабильный неорганический P, неорганический P, связанный с вторичными минералами, лабильный и стабильный органический P ( 33,37 ).Мы сравниваем эти более лабильные, короткоживущие фракции с фракциями, считающимися очень стабильными, которые не были бы доступны растениям в короткие сроки (т.е. неорганический P, связанный с такими минералами, как апатит или поглощенный P 17 , что соответствует 52% от общего количества фосфора в почве. по нашим оценкам в мировом масштабе).
Проверка потерь фосфора в почве по сравнению с речным экспортом фосфора.
 Тем не менее, для проверки нашего подхода к потере почвы фосфора на месте с данными об экспорте фосфора за пределы участка требуются два предварительных условия: общая сумма сельскохозяйственных, городских и промышленных стоков) и (ii) допущение в отношении скорости поступления наносов (например, процент отложений, попадающих в реки из общего количества эродированных наносов) для оценки нагрузки P на реки в результате потери фосфора в почве на месте. Что касается первого предварительного условия, мы провели поиск опубликованных данных по экспорту фосфора из реки с отделением сельскохозяйственной эрозии и вклада стока от общих нагрузок фосфора в реках.Что касается второй предпосылки, то отсутствуют модели, описывающие комплексную доставку наносов в реки в континентальном или глобальном масштабе, но обсуждалось, что коэффициенты поступления наносов обычно снижаются по мере увеличения площади водосбора, в пределах примерно от 30 до 100% в небольших пределах. водосборов (≤0,1 км 2 ) до 2–20% в больших пространственных масштабах (например, ≥1000 км 2 ) 42 .
Тем не менее, для проверки нашего подхода к потере почвы фосфора на месте с данными об экспорте фосфора за пределы участка требуются два предварительных условия: общая сумма сельскохозяйственных, городских и промышленных стоков) и (ii) допущение в отношении скорости поступления наносов (например, процент отложений, попадающих в реки из общего количества эродированных наносов) для оценки нагрузки P на реки в результате потери фосфора в почве на месте. Что касается первого предварительного условия, мы провели поиск опубликованных данных по экспорту фосфора из реки с отделением сельскохозяйственной эрозии и вклада стока от общих нагрузок фосфора в реках.Что касается второй предпосылки, то отсутствуют модели, описывающие комплексную доставку наносов в реки в континентальном или глобальном масштабе, но обсуждалось, что коэффициенты поступления наносов обычно снижаются по мере увеличения площади водосбора, в пределах примерно от 30 до 100% в небольших пределах. водосборов (≤0,1 км 2 ) до 2–20% в больших пространственных масштабах (например, ≥1000 км 2 ) 42 .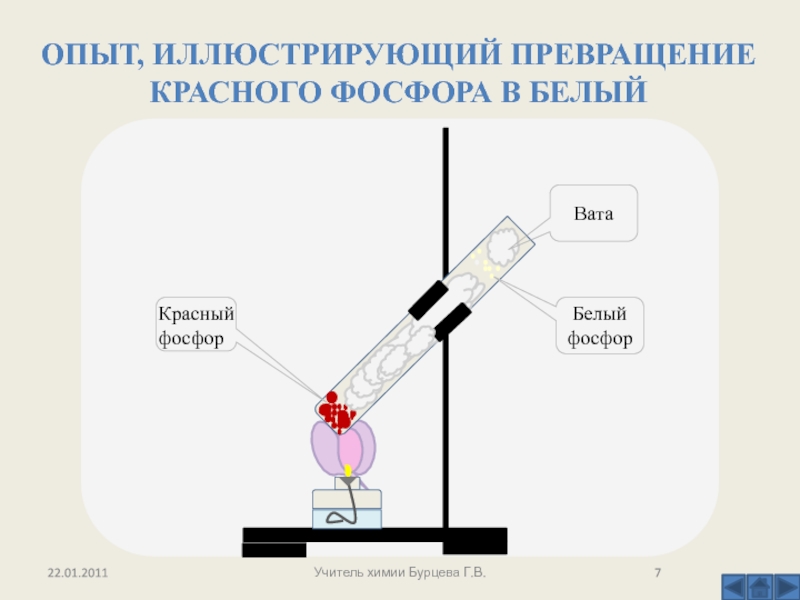 Для нашего сравнения мы использовали диапазон средних скоростей доставки наносов от 11 до 30%, который использовался в недавних крупномасштабных исследованиях от континентального до глобального масштаба 43,44 .При этом мы хотели бы отметить, что даже если 70–89% фосфора, потерянного из сельскохозяйственных почв, могут быть повторно отложены в пределах водосборов, потенциальные угрозы потери фосфора из почв не уменьшатся. Эрозия (и, следовательно, потеря фосфора) происходит преимущественно на сельскохозяйственных почвах, в то время как повторное отложение будет происходить в основном в ложбинах отложения, заболоченных территориях, прибрежных зонах или буферных полосах. Таким образом, P теряется в качестве питательного вещества на участках производства продуктов питания и кормов, но повторно откладывается как потенциальная экологическая угроза для биоразнообразия и здоровья экосистемы из-за его эффекта эвтрофикации в менее интенсивных или неуправляемых экосистемах.И последнее, но не менее важное: мы хотели бы отметить, что RUSLE учитывает смещение почвы только в результате эрозии и межколейной эрозии, не принимая во внимание обработку почвы и эрозию оврагов, а также оползание почвы.
Для нашего сравнения мы использовали диапазон средних скоростей доставки наносов от 11 до 30%, который использовался в недавних крупномасштабных исследованиях от континентального до глобального масштаба 43,44 .При этом мы хотели бы отметить, что даже если 70–89% фосфора, потерянного из сельскохозяйственных почв, могут быть повторно отложены в пределах водосборов, потенциальные угрозы потери фосфора из почв не уменьшатся. Эрозия (и, следовательно, потеря фосфора) происходит преимущественно на сельскохозяйственных почвах, в то время как повторное отложение будет происходить в основном в ложбинах отложения, заболоченных территориях, прибрежных зонах или буферных полосах. Таким образом, P теряется в качестве питательного вещества на участках производства продуктов питания и кормов, но повторно откладывается как потенциальная экологическая угроза для биоразнообразия и здоровья экосистемы из-за его эффекта эвтрофикации в менее интенсивных или неуправляемых экосистемах.И последнее, но не менее важное: мы хотели бы отметить, что RUSLE учитывает смещение почвы только в результате эрозии и межколейной эрозии, не принимая во внимание обработку почвы и эрозию оврагов, а также оползание почвы.
Сравнение рассчитанного потенциального экспорта фосфора в реки из наших местных потерь фосфора в почве находится в пределах диапазона опубликованных речных экспортов фосфора (Таблица 3). Beusen et al. Номер 45 использовал измерения общего количества взвешенных наносов из базы данных GEMS-GLORI для экстраполяции пространственно распределенных уровней наносов для крупнейших рек мира с учетом землепользования, топографии, литологии и осадков в качестве факторов в подходе множественной линейной регрессии, учитывающем эрозию почвы, а также наносные отложения. ловушка.Соответствующий экспорт питательных веществ для всех континентов, а также глобальная оценка были выполнены путем калибровки экспорта питательных веществ по скорости отложений с помощью модели Global News 45 с использованием установленных корреляций между концентрацией отложений и питательных веществ. Сравнивая их экспорт P с взвешенными отложениями в реках 45 с нашими оценками, мы недооценили экспорт P в глобальном масштабе, а также на всех континентах, за исключением Африки (Таблица 3), что, однако, (i) сильно связано с предполагаемые скорости поступления наносов и (ii) наше приложение RUSLE учитывает только процессы эрозии между ручьями и ручьями с неизвестным вкладом оврагов, оползней и эрозии почвы.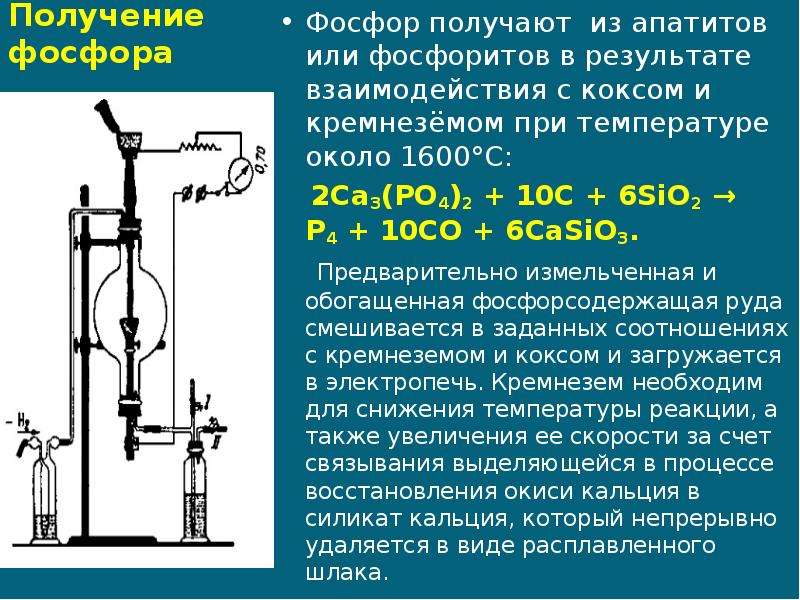
Анализ 17 крупных европейских водосборов (250–11 000 км 2 ) с количественной оценкой потерь P в поверхностные воды с точки зрения за пределами площадки (измерение потока P в водах) привел к 0.05–1,5 кг га –1 год –1 потери фосфора из-за эрозии почвы и стока сельскохозяйственных угодий в ручьи и реки (за исключением водосбора Греции с очень высоким экспортом фосфора в 6 кг га –1 год -1 ) 46 . Пересчет наших потерь фосфора в почве на месте с коэффициентами поступления наносов между 11–30% дает показатели для географической Европы между 0,1–0,4 кг га –1 года –1 , которые находятся в нижней части диапазона Кронванг, и другие. 46 (таблица 3).Потенциальные потери P в виде речного вывоза из-за сельскохозяйственного стока и эрозии 143 водосборов на территории США 47 находятся в том же диапазоне, что и расчетная оценка потерь P в нашем исследовании, в то время как нагрузки P на озеро Эри, оцененные в региональном исследовании 48 кажутся немного выше (Таблица 3). Однако в последнем исследовании невозможно разделить потоки на сельскохозяйственные, городские или промышленные. Оценка бассейна реки Янцзы (1,8 млн. Км 2 около 20% всей территории Китая) дает смоделированные потери фосфора в почве (перспектива на месте) между 0–196 кг га –1 года –1 демонстрируя огромную пространственную неоднородность темпов эрозии почвы на местах 49 .Выходные данные модели были откалиброваны с учетом общей измеренной нагрузки биогенных веществ в реках, в то время как распределение различается между растворенными точечными и неточечными загрязнениями, а также адсорбированными неточечными загрязнениями, которые в основном могут быть отнесены на счет эрозии почвы сельскохозяйственных полей.
46 (таблица 3).Потенциальные потери P в виде речного вывоза из-за сельскохозяйственного стока и эрозии 143 водосборов на территории США 47 находятся в том же диапазоне, что и расчетная оценка потерь P в нашем исследовании, в то время как нагрузки P на озеро Эри, оцененные в региональном исследовании 48 кажутся немного выше (Таблица 3). Однако в последнем исследовании невозможно разделить потоки на сельскохозяйственные, городские или промышленные. Оценка бассейна реки Янцзы (1,8 млн. Км 2 около 20% всей территории Китая) дает смоделированные потери фосфора в почве (перспектива на месте) между 0–196 кг га –1 года –1 демонстрируя огромную пространственную неоднородность темпов эрозии почвы на местах 49 .Выходные данные модели были откалиброваны с учетом общей измеренной нагрузки биогенных веществ в реках, в то время как распределение различается между растворенными точечными и неточечными загрязнениями, а также адсорбированными неточечными загрязнениями, которые в основном могут быть отнесены на счет эрозии почвы сельскохозяйственных полей. Средние нагрузки фосфора из-за эрозии почвы на сельскохозяйственных полях в бассейне реки Янцзы хорошо сопоставимы с диапазоном, оцененным в нашем исследовании для Китая (2,7 по сравнению с диапазоном 1,4–3,7 кг га −1 год −1 , соответственно) .То же самое верно и для сравнений оценок Африки 50 и Южной Америки 51 (Таблица 3), хотя следует учитывать, что особенно для этих последних исследований шкала значительно отличается от нашего подхода.
Средние нагрузки фосфора из-за эрозии почвы на сельскохозяйственных полях в бассейне реки Янцзы хорошо сопоставимы с диапазоном, оцененным в нашем исследовании для Китая (2,7 по сравнению с диапазоном 1,4–3,7 кг га −1 год −1 , соответственно) .То же самое верно и для сравнений оценок Африки 50 и Южной Америки 51 (Таблица 3), хотя следует учитывать, что особенно для этих последних исследований шкала значительно отличается от нашего подхода.
Региональные потери и остатки фосфора
Параллельно модели распределения и динамики глобальной эрозии почв водой 32 , потери фосфора из почв из-за водной эрозии наиболее значительны в странах и регионах с интенсивным сельским хозяйством и / или экстремальным климатом ( е.g., засухи, за которыми следуют значительные дожди или частые сильные ливни) из-за эффектов высокой эрозии 52 . Таким образом, наши расчеты приводят к чрезвычайно высоким потерям фосфора из-за эрозии (> 20 кг га -1 год -1 ) в таких регионах, как восточный Китай, многие регионы Индонезии, части восточной и юго-восточной Африки ( Эфиопия, Эритрея, Мозамбик), Центральная Америка и некоторые части Южной Америки (Юго-Восточная Бразилия; Южный Чили, Перу (рис. 2)). Очень высокие потери фосфора (от 10 до 20 кг га -1 год -1 ) оцениваются в некоторых частях южной части Африки (Южная Африка, Мадагаскар, Танзания) и Южной Америки (Боливия), а также высокие потери (5-10 кг га −1 год −1 ) для большей части Индии, а также регионов Южной Африки (Ангола, Замбия) и Южной Америки (Уругвай) (рис.2). Несмотря на то, что основной алгоритм модели эрозии рассчитывает не чистый выход водосбора, а, скорее, смещение почвенных отложений на месте, которые затем могут быть перемещены в другие части полей или даже захоронены в местах отложения, рассматриваемое местное поле очевидно, что менеджмент столкнется со значительными потерями фосфора из-за водной эрозии почвы. Только с учетом агрономических входов и выходов фосфора без учета потерь фосфора из-за эрозии Макдональда и др. 22 привела к совершенно иной глобальной модели P: наиболее распространенный крупный дефицит был в Южной Америке (северо-восточные страны, например.
2)). Очень высокие потери фосфора (от 10 до 20 кг га -1 год -1 ) оцениваются в некоторых частях южной части Африки (Южная Африка, Мадагаскар, Танзания) и Южной Америки (Боливия), а также высокие потери (5-10 кг га −1 год −1 ) для большей части Индии, а также регионов Южной Африки (Ангола, Замбия) и Южной Америки (Уругвай) (рис.2). Несмотря на то, что основной алгоритм модели эрозии рассчитывает не чистый выход водосбора, а, скорее, смещение почвенных отложений на месте, которые затем могут быть перемещены в другие части полей или даже захоронены в местах отложения, рассматриваемое местное поле очевидно, что менеджмент столкнется со значительными потерями фосфора из-за водной эрозии почвы. Только с учетом агрономических входов и выходов фосфора без учета потерь фосфора из-за эрозии Макдональда и др. 22 привела к совершенно иной глобальной модели P: наиболее распространенный крупный дефицит был в Южной Америке (северо-восточные страны, например. g., Аргентина и Парагвай), север Соединенных Штатов и Восточной Европы, в то время как самые большие излишки приходятся на большую часть Восточной Азии, Западной и Южной Европы, прибрежные районы США, Юго-Восточную Бразилию и Уругвай.
g., Аргентина и Парагвай), север Соединенных Штатов и Восточной Европы, в то время как самые большие излишки приходятся на большую часть Восточной Азии, Западной и Южной Европы, прибрежные районы США, Юго-Восточную Бразилию и Уругвай.
При среднем истощении почвы из-за эрозии 9,6 кг га −1 год −1 в Африке, общий баланс P уже отрицательный на 9,7 кг га −1 год −1 сегодня (Таблица 1, Рис.4). Поскольку среднее истощение фосфора в Африке из-за отрицательных потоков при регулировании органического фосфора равно входным потокам из атмосферы плюс химические удобрения, африканские фермеры могут снизить потери фосфора почти до нуля с помощью эффективного смягчения последствий эрозии почвы.Несмотря на то, что истощение запасов фосфора в системе из-за управления органическим фосфатом в Африке относительно низкое (-2,2 кг га -1 год -1 ) по сравнению со средним глобальным показателем (-5,2 кг га -1 год -1 ), высокие общие потери фосфора вряд ли могут быть покрыты ни за счет смягчения последствий и более устойчивого управления органическим фосфатом, ни за счет увеличения внесения химических удобрений. Потоки P из-за управления органическим P рассчитываются здесь как сумма внесенного навоза и остатков за вычетом поглощения растениями (что приводит к экспорту биомассы в пахотные системы, за исключением остатков, оставшихся на поле).Общая сумма потребления растениями, вероятно, увеличится с увеличением потребности в пище и кормах параллельно с прогнозируемым ростом популяции и скота в Африке в будущем. Многие почвы в Африке к югу от Сахары уже характеризовались как дефицитные по уровню доступного для растений фосфора в течение последних десятилетий 53 . В настоящее время в Африке одновременно востребованы внесение навоза и его остатков (нехватка биомассы в целом, низкая продуктивность животноводства и даже при наличии навоза, нет возможности транспортировать его туда, где он необходим), что приводит к рекомендациям интегрированное управление хозяйством с комбинациями органических и неорганических удобрений 54,55,56 .Поскольку неорганические удобрения P становятся все более дефицитными, можно ожидать, что в будущем истощение запасов из-за управления органическим P в Африке возрастет.
Потоки P из-за управления органическим P рассчитываются здесь как сумма внесенного навоза и остатков за вычетом поглощения растениями (что приводит к экспорту биомассы в пахотные системы, за исключением остатков, оставшихся на поле).Общая сумма потребления растениями, вероятно, увеличится с увеличением потребности в пище и кормах параллельно с прогнозируемым ростом популяции и скота в Африке в будущем. Многие почвы в Африке к югу от Сахары уже характеризовались как дефицитные по уровню доступного для растений фосфора в течение последних десятилетий 53 . В настоящее время в Африке одновременно востребованы внесение навоза и его остатков (нехватка биомассы в целом, низкая продуктивность животноводства и даже при наличии навоза, нет возможности транспортировать его туда, где он необходим), что приводит к рекомендациям интегрированное управление хозяйством с комбинациями органических и неорганических удобрений 54,55,56 .Поскольку неорганические удобрения P становятся все более дефицитными, можно ожидать, что в будущем истощение запасов из-за управления органическим P в Африке возрастет. В то же время сегодняшние цены на химические удобрения могут быть уже в 2–6 раз дороже для фермера в Африке, чем в Европе, из-за более высоких затрат на транспортировку и хранение 3 , хотя в самой Африке самые высокие геологические месторождения фосфора в мире (по данным по сегодняшним оценкам 80% мировых геологических месторождений P расположены в Марокко и Западной Саре ( 8 ).Таким образом, и если политическая ситуация не изменится кардинально (например, поставки фосфора продаются в Африке, а не экспортируются в США, Европу и Китай), единственное реальное средство сокращения истощения фосфора в африканских почвах сегодня и в других странах. в будущем — резко снизить эрозию почвы.
В то же время сегодняшние цены на химические удобрения могут быть уже в 2–6 раз дороже для фермера в Африке, чем в Европе, из-за более высоких затрат на транспортировку и хранение 3 , хотя в самой Африке самые высокие геологические месторождения фосфора в мире (по данным по сегодняшним оценкам 80% мировых геологических месторождений P расположены в Марокко и Западной Саре ( 8 ).Таким образом, и если политическая ситуация не изменится кардинально (например, поставки фосфора продаются в Африке, а не экспортируются в США, Европу и Китай), единственное реальное средство сокращения истощения фосфора в африканских почвах сегодня и в других странах. в будущем — резко снизить эрозию почвы.
Мы понимаем, что значения, рассчитанные в Таблице 1 и на Рисунке 4, являются грубыми оценками в больших масштабах, и что пространственный контекст и масштаб, особенно на африканском континенте, важны.Дефицит фосфора — это проблема страны, района, хозяйства и почвы в Африке, например, в некоторых частях Восточной Африки и Сахеля наблюдается значительный дефицит 57 . В Африке к югу от Сахары ~ 40% почв считаются имеющими низкие запасы питательных веществ (<10% атмосферных минералов), и деградация почвы увеличивает дефицит. 58 . Борьба с эрозией важна, но это только часть решения, которое должно быть многогранным. Омуто и Варгас 59 оценили общую эрозию почвы на основе полевых измерений в Малави и увеличились на ~ 10% в период с 2010 г. (26 т га −1 год −1 ) по 2017 г. (30 т га −1 год год). −1 , обратите внимание, что скорость эрозии от ручейной и межлевой эрозии только в наших смоделированных оценках для Малави, основанных на Borrelli et al. 32 — 19 т га -1 год -1 ). Опросы фермеров показали, что 45% не вкладывали средства в борьбу с эрозией почвы, и многие из них находились в районах, где была высокая потребность. Более того, фермеры признали, что отсутствие внедрения устойчивых методов управления земельными ресурсами было основной причиной высоких темпов эрозии, помимо того факта, что почвы часто бывают уязвимыми и хрупкими.
В Африке к югу от Сахары ~ 40% почв считаются имеющими низкие запасы питательных веществ (<10% атмосферных минералов), и деградация почвы увеличивает дефицит. 58 . Борьба с эрозией важна, но это только часть решения, которое должно быть многогранным. Омуто и Варгас 59 оценили общую эрозию почвы на основе полевых измерений в Малави и увеличились на ~ 10% в период с 2010 г. (26 т га −1 год −1 ) по 2017 г. (30 т га −1 год год). −1 , обратите внимание, что скорость эрозии от ручейной и межлевой эрозии только в наших смоделированных оценках для Малави, основанных на Borrelli et al. 32 — 19 т га -1 год -1 ). Опросы фермеров показали, что 45% не вкладывали средства в борьбу с эрозией почвы, и многие из них находились в районах, где была высокая потребность. Более того, фермеры признали, что отсутствие внедрения устойчивых методов управления земельными ресурсами было основной причиной высоких темпов эрозии, помимо того факта, что почвы часто бывают уязвимыми и хрупкими. Следовательно, борьба с эрозией является частью решения.
Следовательно, борьба с эрозией является частью решения.
Попытки повысить уровень питательных веществ в Малави с 2010 года с помощью общих рекомендаций по минеральным удобрениям не только привели к значительному увеличению производства, превратив страну в страну-экспортера продуктов питания, но также привели к подкислению почвы во многих районах 59 .Таким образом, в дополнение к борьбе с эрозией почвы требуется интегрированное управление плодородием почвы (ISFM), которое сочетает в себе использование минеральных удобрений и органических веществ, а также выращивание бобовых (бобовых деревьев и / или покровных культур) 57 . Несмотря на то, что бобовые деревья потенциально могут получить доступ к питательным веществам глубоко в недрах почвы и отложить их на поверхность через опадание подстилки, временная задержка, необходимая для внедрения такой системы, стала препятствием для ее внедрения, поскольку фермерам приходилось отказываться от одного урожая 57 . Кроме того, низкий P-статус почв во многих африканских регионах 57 означает, что рециркуляция органических материалов недостаточна для повышения урожайности, отсюда и потребность в минеральных удобрениях. Несмотря на то, что бобовые растения в первую очередь улучшают статус почв по азоту, а не по фосфору, недавний обзор зернобобовых культур показал, что зерновые бобовые могут получить доступ к менее доступным формам фосфора в условиях дефицита фосфора (через выделение корневых экссудатов; доступ к большему количеству фосфора). лабильный P благодаря более тонкой корневой архитектуре и усиленным ассоциациям с микоризой) 60 .Следовательно, требуются интегрированные варианты управления, учитывающие специфику региона и почвы, и эти сложности необходимо учитывать при интерпретации наших показателей в континентальном масштабе, которые могут помочь обеспечить глобальный контекст для действий. Несмотря на то, что сложности управления P хорошо задокументированы и обсуждаются 57,58,59,60 , мы хотели бы обратить внимание на смягчение последствий эрозии почвы как на одну из важных составляющих сокращения недоедания в Африке.
Кроме того, низкий P-статус почв во многих африканских регионах 57 означает, что рециркуляция органических материалов недостаточна для повышения урожайности, отсюда и потребность в минеральных удобрениях. Несмотря на то, что бобовые растения в первую очередь улучшают статус почв по азоту, а не по фосфору, недавний обзор зернобобовых культур показал, что зерновые бобовые могут получить доступ к менее доступным формам фосфора в условиях дефицита фосфора (через выделение корневых экссудатов; доступ к большему количеству фосфора). лабильный P благодаря более тонкой корневой архитектуре и усиленным ассоциациям с микоризой) 60 .Следовательно, требуются интегрированные варианты управления, учитывающие специфику региона и почвы, и эти сложности необходимо учитывать при интерпретации наших показателей в континентальном масштабе, которые могут помочь обеспечить глобальный контекст для действий. Несмотря на то, что сложности управления P хорошо задокументированы и обсуждаются 57,58,59,60 , мы хотели бы обратить внимание на смягчение последствий эрозии почвы как на одну из важных составляющих сокращения недоедания в Африке.
С высокой степенью истощения почвы из-за эрозии 8.9 кг га −1 год −1 в Южной Америке и потери из-за использования органического фосфора в размере 8,7 кг га −1 год −1 баланс фосфора земли в пахотном использовании приводит к отрицательному сальдо в размере — 6,1 кг га −1 год −1 , несмотря на текущее высокое внесение химических удобрений 11,4 кг га −1 год −1 (Таблица 1). Поскольку в Южной Америке нет заметных геологических отложений фосфора, дальнейшее внесение большого количества удобрений или даже увеличение количества удобрений для компенсации высоких потерь фосфора в почве в будущем кажется нереальным (а также неприемлемо с экологической точки зрения, если скорость эрозии почвы и, следовательно, выход фосфора на свежие и океанских вод существенно не снижается).Однако, имея гораздо более высокую производственную мощность континентальной биомассы по сравнению с Африкой, многие регионы Южной Америки могли бы снизить потери P за счет улучшения управления органическим P (например, за счет общего применения ресурсосберегающего земледелия, органического и / или других устойчивых методов ведения сельского хозяйства 61 ) и / или увеличение использования отходов животноводства или человеческих экскрементов 1 , или применение систем управления с более широким использованием исходных остатков. Тем не менее, в долгосрочной перспективе сокращение потерь фосфора за счет уменьшения эрозии почвы (например,g., ресурсосберегающее земледелие, мульчирование, увеличение растительного покрова, совмещение культур, управление земельными ресурсами с учетом топографии) будет наиболее эффективным способом и одновременно улучшит здоровье почвы, общий питательный статус почвы и способность удерживать воду, а также снизит экологически негативное воздействие. в пресных и океанских водах из-за высокого поступления фосфора и сопровождающегося эвтрофикацией и гипоксией.
Тем не менее, в долгосрочной перспективе сокращение потерь фосфора за счет уменьшения эрозии почвы (например,g., ресурсосберегающее земледелие, мульчирование, увеличение растительного покрова, совмещение культур, управление земельными ресурсами с учетом топографии) будет наиболее эффективным способом и одновременно улучшит здоровье почвы, общий питательный статус почвы и способность удерживать воду, а также снизит экологически негативное воздействие. в пресных и океанских водах из-за высокого поступления фосфора и сопровождающегося эвтрофикацией и гипоксией.
Средняя потеря фосфора из-за эрозии почвы с пахотных земель в Европе, вместе с Австралией, является самой маленькой из всех континентов (1.2 и 0,9 кг га -1 год -1 для Европы и Австралии соответственно; Таблица 1). Тем не менее, общие потери фосфора в сельскохозяйственных системах Европы равны потерям из-за эрозии почвы (таблица 1), и особенно страны Центральной и Восточной Европы (NEU11) явно имеют отрицательный баланс фосфора.
Чато и Радимски 62 при обсуждении землепользования и управления в ЕС утверждают, что отрицательный баланс P и ухудшение P-статуса в странах Центральной и Восточной Европы резко контрастируют с прошлой практикой в странах бывшего ЕС-15, где были сильные положительные Баланс фосфора и избыток фосфора привели к экологическим угрозам.Хотя есть свидетельства того, что уровень избыточного предложения в предыдущих странах ЕС-15 снижался в начале 1990-х годов из-за тенденций к снижению использования минеральных удобрений 63 , ухудшения уровней дефицита фосфора (отчасти из-за быстрого сокращения применения удобрений после 1990-х годов). ) может привести к снижению урожайности и возникновению экономических и агрономических проблем в странах Центральной и Восточной Европы. 62 . Несмотря на то, что страны Центральной и Восточной Европы (NEU11) имеют более низкие потери P из-за эрозии почвы по сравнению с бывшими странами ЕС-15 (1.2 кг га −1 год −1 по сравнению с 2,1 кг га −1 год −1 для NEU11 по сравнению с EU15, соответственно), общий баланс P почти сбалансирован в бывших EU15 (0,4 кг га -1 год -1 ) из-за значительно более высокого внесения химических удобрений в западных странах по сравнению с восточным NEU11 (отрицательное сальдо, таким образом, общее истощение почвы составляет -4,3 кг га -1 год -1 ). Таким образом, в будущем может возникнуть проблема дефицита фосфора и истощения питательных веществ в NEU11, несмотря на сравнительно меньшие эрозионные потери фосфора из почв в воды.При отсутствии крупных геологических залежей фосфора в Европе 8 страны Восточной и Западной Европы столкнутся в будущем с жесткой политической и экономической борьбой за фосфорные удобрения, при этом оба региона будут иметь верхний предел отрицательного баланса фосфора без добавления фосфора. химических удобрений (−14 и −9,5 кг га −1 год −1 для EU15 и NEU11, соответственно; Таблица 1).
Таким образом, в будущем может возникнуть проблема дефицита фосфора и истощения питательных веществ в NEU11, несмотря на сравнительно меньшие эрозионные потери фосфора из почв в воды.При отсутствии крупных геологических залежей фосфора в Европе 8 страны Восточной и Западной Европы столкнутся в будущем с жесткой политической и экономической борьбой за фосфорные удобрения, при этом оба региона будут иметь верхний предел отрицательного баланса фосфора без добавления фосфора. химических удобрений (−14 и −9,5 кг га −1 год −1 для EU15 и NEU11, соответственно; Таблица 1).
Что касается Азии, Китай, безусловно, выделяется обширными программами по сохранению и переработке P (e.g., отделение человеческих экскрементов и мочи, извлечение из осадка сточных вод, золы ила и производство удобрений ( 64 ). В то же время в почвах Китая наблюдается самый высокий уровень потребления химических удобрений, что приводит к почти сбалансированному балансу фосфора (-0,4 кг га -1 год -1 ). При самых высоких потерях фосфора из-за водной эрозии почвы (12,3 кг га −1 год −1 с учетом только эрозии ручьев и межбуровой эрозии, таблица 1), значительное снижение скорости эрозии почвы внесло бы огромный вклад в снижение уровня эрозии почвы. национальная борьба за спасение П.
При самых высоких потерях фосфора из-за водной эрозии почвы (12,3 кг га −1 год −1 с учетом только эрозии ручьев и межбуровой эрозии, таблица 1), значительное снижение скорости эрозии почвы внесло бы огромный вклад в снижение уровня эрозии почвы. национальная борьба за спасение П.
Несмотря на то, что в некоторых регионах (в основном, в Европе, Северной Америке и Австралии) спрос на P остается неизменным, сегодня общий спрос, тем не менее, растет во всем мире из-за роста населения, интенсификации сельского хозяйства и перехода от вегетарианской диеты к диете на основе мяса 3,12 . Было высказано предположение, что сокращение пищевых и кормовых отходов на 50% в сочетании с 50% сокращением производства и потребления продуктов животного происхождения позволит на 100% перейти на органическое сельское хозяйство, тем самым способствуя устойчивому сельскому хозяйству и сводя к минимуму проблемы, связанные с сельскохозяйственным производством, такие как производство парниковых газов, потеря биоразнообразия, эвтрофикация вод и вопросы, связанные с экотоксикологией 65 . Однако переход на 100% органическое производство во всем мире был бы возможен только в том случае, если бы каменный фосфат использовался в качестве минерального фосфорного удобрения в органическом сельском хозяйстве в той же степени, что и сегодня в традиционном сельском хозяйстве. 65 .
Однако переход на 100% органическое производство во всем мире был бы возможен только в том случае, если бы каменный фосфат использовался в качестве минерального фосфорного удобрения в органическом сельском хозяйстве в той же степени, что и сегодня в традиционном сельском хозяйстве. 65 .
В заключение, поскольку поставки фосфора из геологических отложений не могут быть увеличены, но ресурсы фосфора будут все больше ограничиваться в будущем во всем мире, снижение эрозии почвы может быть решающим, если не самым важным вариантом управления, чтобы (i) позволить уменьшить внесение удобрений и, таким образом, сохранить сегодня часть ценных ресурсов фосфора, (ii) остановить непрерывное истощение запасов фосфора в почве в Восточной Европе и Африке и (iii) снизить воздействие на пресные и океанские воды, чтобы противодействовать эвтрофикации и гипоксии.Мы хотели бы отметить, что скорость эрозии, основанная на RUSLE, в качестве основы для расчета потерь P из-за эрозии учитывает только процессы эрозии, вызванной водой, и не учитываются процессы эрозии из-за обработки почвы, оврагов или оползней. Таким образом, можно ожидать, что наша оценка убытков P будет консервативной. Меры по снижению эрозии почвы будут зависеть от конкретных характеристик климата, топографии, почв и целей сбора урожая, а также от экономической и топографической осуществимости вариантов управления.Адекватная и адаптированная борьба с эрозией может быть одной или комбинацией таких мер, как (i) отсутствие обработки или низкая обработка почвы, (ii) поддержание постоянного почвенного покрова за счет увеличения растительности, особенно покровных культур, диверсификации видов растений, мульчирования и / или совмещение культур, а также (iii) управление земельными ресурсами с учетом топографии (например, террасирование, ленточное земледелие и контурное земледелие) 66,67 . В частности, сочетание устойчивых методов может оказать серьезное влияние на сокращение эрозии и связанных с этим потерь фосфора в наиболее уязвимых странах, что приведет к положительным сельскохозяйственным и экологическим результатам.
Таким образом, можно ожидать, что наша оценка убытков P будет консервативной. Меры по снижению эрозии почвы будут зависеть от конкретных характеристик климата, топографии, почв и целей сбора урожая, а также от экономической и топографической осуществимости вариантов управления.Адекватная и адаптированная борьба с эрозией может быть одной или комбинацией таких мер, как (i) отсутствие обработки или низкая обработка почвы, (ii) поддержание постоянного почвенного покрова за счет увеличения растительности, особенно покровных культур, диверсификации видов растений, мульчирования и / или совмещение культур, а также (iii) управление земельными ресурсами с учетом топографии (например, террасирование, ленточное земледелие и контурное земледелие) 66,67 . В частности, сочетание устойчивых методов может оказать серьезное влияние на сокращение эрозии и связанных с этим потерь фосфора в наиболее уязвимых странах, что приведет к положительным сельскохозяйственным и экологическим результатам.
Улучшение фосфорного процесса — Химический факультет Массачусетского технологического института
Лаборатория недели
Группа Cummins
Комната 6-435
Курс 5: Химия
Фосфор, обозначенный символом P и атомным номером 15, является одним из шести биогенных элементов, необходимых для живых организмов. Фосфор находится в наших костях и зубах в виде гидроксилапатита. Он составляет основу ДНК, а в аденозинтрифосфате (АТФ) он служит основным носителем энергии в живых клетках.
Профессор Кристофер «Кит» Камминс, профессор химии Генри Дрейфуса, много лет интересовался фосфором и его переработкой для промышленного использования. Когда я встретился с ним и его аспирантом Майклом Б. Гисоном, он вытащил широкую многослойную блок-схему, объясняющую пути переработки фосфора.
«Это рисунок, который я получил от компании под названием ThermPhos», — начал он.
Чистый фосфор P4 не встречается в природе из-за его высокой реакционной способности. По словам Камминса, фосфор добывается из фосфатной руды, также называемой «минеральным апатитом». «В основном это кости и зубы животных, это осадочные породы, которые могут иметь разную степень чистоты и различное качество руды».
По словам Камминса, фосфор добывается из фосфатной руды, также называемой «минеральным апатитом». «В основном это кости и зубы животных, это осадочные породы, которые могут иметь разную степень чистоты и различное качество руды».
Как фосфоритная руда обрабатывается и становится доступной для коммерческого использования?
Фосфор из фосфоритной руды перерабатывается двумя основными способами: для производства фосфорсодержащих удобрений для глобального сельского хозяйства большая часть фосфатов (~ 95%) перерабатывается «мокрым способом», когда фосфат обрабатывается серной кислотой. для производства фосфорной кислоты.
С другой стороны, производство фосфорсодержащих химикатов требует «термического процесса», энергоемкого процесса, который восстанавливает фосфат до чистого белого фосфора. Затем белый фосфор обрабатывают опасным для окружающей среды хлором для получения трихлорида фосфора PCl3. «Хлориды могут быть заменены образованием таких вещей, как углеродно-фосфорные связи или другие», — пояснил Камминс, в то время как многие химические продукты, содержащие фосфор, в конечном итоге не содержат хлор.
«Белый фосфор становится отправной точкой, первым чистым веществом», — сказал Камминс. Он воскообразный, «как кусочки масла», и раньше его перевозили в пластиковых контейнерах под водой, с которой он не вступает в реакцию. Конечные продукты важны для нашей экономики: они используются в антипиренах, литиевых батареях, которыми питаются наши ноутбуки, смартфоны и автомобили, а также в фармацевтических препаратах, бытовых чистящих средствах и даже кока-коле, которую мы пьем. «Кока-кола — это один из примеров пищевой фосфорной кислоты, получаемой из белого фосфора.”
«Я думаю, что мы традиционно считали само собой разумеющимся, что отправной точкой является белый фосфор», — сказал Камминс. Согласно Cummins, термический процесс является «унаследованным». Хотя многие люди задавались вопросом, можно ли сшить «мокрый процесс» для получения химических соединений и избежать образования отходов белого фосфора и хлора, этого никогда не делали раньше. «Между химическими веществами удобрений, с одной стороны, и всеми другими фосфорсодержащими химикатами, с другой стороны, была такая стена. ”
”
Пара опубликовала статью в Science 9 февраля, в которой они описали новый метод получения химических соединений, которые обычно производятся термическим способом из фосфорной кислоты, продукта мокрого процесса.
Cummins и Geeson обнаружили ранее неизвестный промежуточный продукт, бис (трихлорсилил) фосфид, «выделяемый, сыпучий белый порошок», который можно хранить и транспортировать в контролируемых условиях. Geeson удалось создать несколько различных фосфорных химикатов, включая гексафторфосфат (содержащийся в литиевых батареях) и (4-фенилбутил) фосфин (используемый в фармацевтике) из промежуточного продукта.
[[[{«fid»: «17290 ″,« view_mode »:« default »,« fields »: {« format »:« default »,» field_file_image_alt_text [und] [0] [value] »: false,» field_file_image_title_text [und] [0] [значение] »: false,« field_captions [und] [0] [value] »:« Ранее неизвестный промежуточный бис (трихлорсилил) фосфид в виде изолированного белого порошка. »},« link_text »: null, «type»: «media», «field_deltas»: {«1»: {«format»: «default», «field_file_image_alt_text [und] [0] [value]»: false, »field_file_image_title_text [und] [0 ] [значение] »: false,« field_captions [und] [0] [значение] »:» Ранее неизвестный промежуточный бис (трихлорсилил) фосфид в виде изолированного белого порошка. ”}},” Attributes ”: {“ height ”: 426,“ width ”: 800,” class ”:” media-element-file-default ”,“ data-delta ”:” 1 ″}}]]
”}},” Attributes ”: {“ height ”: 426,“ width ”: 800,” class ”:” media-element-file-default ”,“ data-delta ”:” 1 ″}}]]
Фосфорная кислота, полученная мокрым способом, может быть обезвожена хлоридом натрия с образованием триметафосфата. Триметафосфат может иметь разные формы, по словам Камминз, циклический тример — самый простой в изготовлении.
«Чтобы получить бис (трихлорсилил) фосфид, триметафосфат должен быть восстановлен с помощью трихлорсилана», — сказал Камминс, указывая на стрелку между молекулами в реакции.Трихлорсилан производится в промышленных масштабах для производства силикона в полупроводниковой промышленности. Очищено от песка. «Трихлорсилан довольно летуч, его температура кипения составляет 35 ° C, — сказал Камминс, приподняв брови. «На самом деле мы проводим эту реакцию при 110 ° C в стальном реакторе под давлением», — добавил Гисон. Реактор изготовлен музеем Массачусетского технологического института и умещается в ладони.
Если этот метод станет широко доступным, ученые потенциально смогут избежать проблем с получением белого фосфора для производства фосфорных химикатов и вместо этого сами производить его из коммерчески доступных продуктов.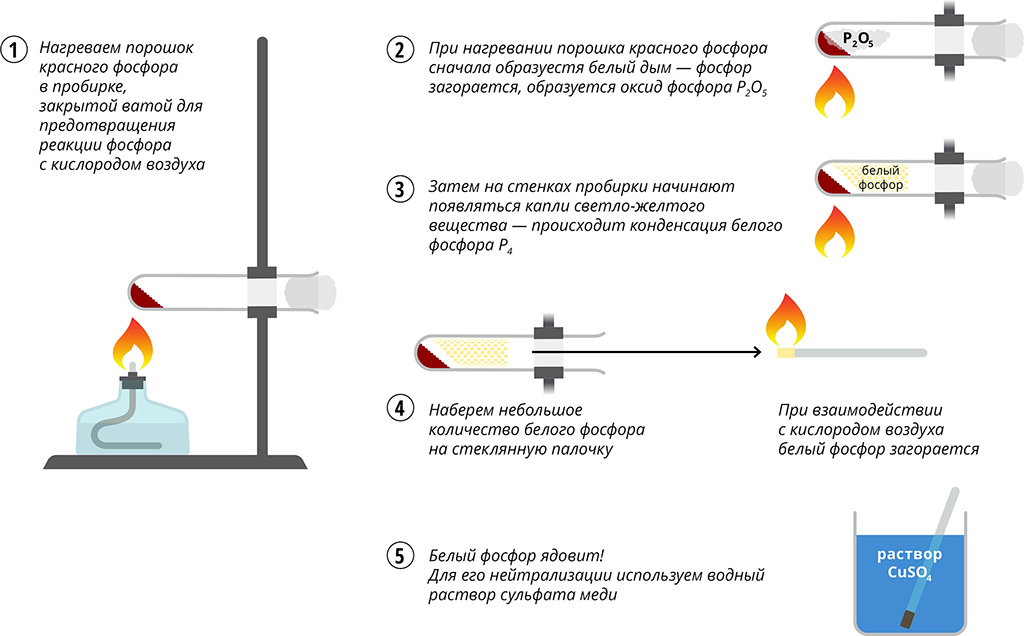
Является ли метод более энергоэффективным и экологически безопасным, чем традиционный процесс? «Подробный анализ того, как это по сравнению с производством белого фосфора, будет иметь ценность. Мы пока точно не знаем. Это может быть лучше из-за экономии на масштабе », — сказал Камминс.
Может ли новый метод заменить традиционные процессы химического производства фосфора? Cummins дает двоякий ответ на этот вопрос: цель — изменить способ производства фосфорсодержащих химикатов людьми.Мы хотели бы иметь новый способ, который лучше… Есть много решений проблемы, которые мы сформулировали. И в этой статье мы предложили одно решение ».
Лаборатория Cummins изучает альтернативные пути и варианты оптимизации переработки фосфатов и приглашает UROPs присоединиться к его проектам. В 2010 году Камминс и его аспирант Дэниел Тофан опубликовали в Angewandte Chemie статью, описывающую метод устранения экологически опасного хлора при производстве фосфорных химикатов из белого фосфора с помощью ультрафиолетового излучения.
Ресурсы фосфатов на Земле истощаются; основные запасы фосфоритов сегодня находятся в Марокко и Западной Сахаре. Фосфор не является возобновляемым ресурсом. Кроме того, фосфор, используемый в сельском хозяйстве, обеспечивая питательными веществами почву для выращивания растений, стекает в грунтовые воды, реки и, в конечном итоге, в океаны, вызывая эвтрофикацию и разрушение морских экосистем. «Это превращает питательное вещество в загрязнитель», — сказал Камминс и предложил найти решения этих проблем с помощью химии.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Мировое производство продуктов питания зависит от фосфора. Мы скоро закончим?
Растения и методы выращивания, используемые в современном сельском хозяйстве, полностью зависят от удобрений, двумя наиболее важными компонентами которых являются азот и фосфор. Азотные удобрения могут производиться на заводах и на практике являются возобновляемым ресурсом.
Азотные удобрения могут производиться на заводах и на практике являются возобновляемым ресурсом.
Но то же самое нельзя сказать о фосфоре в удобрениях.
В настоящее время фосфор добывают из горных пород, содержащих это вещество, называемое каменным фосфатом, которое добывают в нескольких местах по всему миру, особенно в Китае и на оккупированной Марокко территории Западной Сахары.
И эти ресурсы не могут длиться вечно.
Некоторые предсказывают, что осталось всего несколько десятилетий
В 2008 году некоторые расчеты предсказывали, что мир начнет испытывать нехватку каменного фосфора уже в 2030 году. Следствием этого будет, во-первых, резкое повышение цен на удобрения и постепенное снижение урожая.
В последние годы ученые регулярно звучали предупреждения о надвигающемся кризисе. Например, в 2019 году британская газета The Guardian писала, что нам осталось потреблять всего несколько десятилетий.
Но информация по теме может сбивать с толку.
Другие говорят 2000 лет
Сами представители производителей удобрений никакого кризиса не предвидят.
«У нас достаточно фосфора, по крайней мере, на 2000 лет при сегодняшнем уровне потребления», — написал Андерс Роньлиен из Yara, производителя удобрений, в статье, опубликованной в норвежской национальной газете Aftenposten в 2010 году.
Некоторые исследователи согласны с этим.
Например, Педро Санчес, исследователь из Колумбийского университета в Нью-Йорке, был процитирован в блоге 2013 года: «За мою долгую 50-летнюю карьеру раз в десять лет люди говорят, что у нас скоро закончится фосфор.Каждый раз это опровергается. Все самые надежные оценки показывают, что у нас достаточно ресурсов фосфоритов, чтобы их хватило на 300–400 лет ».
Так есть кризис или нет?
Ева Брод, научный сотрудник Норвежского института биоэкономических исследований (NIBIO) изучает фосфор в сельском хозяйстве. То же самое делает профессор Петтер Йенссен из Норвежского университета естественных наук (NMBU).
Они оба пришли к выводу, что у нас не скоро закончится фосфор.
Тем не менее, они согласны, что нам нужно что-то с этим делать.
Современное сельское хозяйство зависит от удобрений (Фото: Criniger kolio / Shutterstock / NTB scanpix)
Более 250 лет
«Последний обзор мировых запасов фосфатов был проведен Хоканом Йёнссоном из Шведского университета сельскохозяйственных наук», — говорит Йенссен из NMBU.
«Его оценка показывает, что у нас есть более 250 лет при нынешнем уровне потребления».
Но такие оценки часто неточны.Они дают представление о размерах месторождений, где в настоящее время добывается каменный фосфат, и прогнозы основаны на том, сколько фосфора можно извлечь с использованием современных технологий и по разумной цене.
Однако это не означает, что это единственные источники фосфатов. В других частях земного шара может быть много запасов, которые не разрабатываются, потому что они более недоступны, менее концентрированы или имеют более низкое качество.
Токсичен и радиоактивен
«Например, много фосфоритов загрязнено кадмием или ураном», — говорит Брод из NIBIO.
Если фосфор из этих источников предполагается использовать в удобрениях, его сначала необходимо обработать, чтобы почва не была загрязнена тяжелыми металлами или радиоактивными веществами. Сейчас это слишком дорого, чтобы такая дезинфекция была оправданной.
Но если лучший каменный фосфат начинает заканчиваться — а технологии развиваются, — тем не менее, источники более низкого качества могут внезапно стать интересными.
Это означает, что сельское хозяйство по-прежнему будет иметь доступ к удобрениям, но фермерам придется платить за это больше.И эта дополнительная стоимость будет переложена на потребителей, поэтому нам придется платить больше за еду.
Сейчас добывают всего в нескольких местах
«У такой богатой страны, как Норвегия, не будет проблем с получением достаточного количества фосфора», по крайней мере, не так, как сейчас, — говорит Брод.
Однако стоит отметить, что мировые запасы каменного фосфора очень неравномерно распределены с географической точки зрения. Безусловно, самые большие запасы находятся в Марокко и оккупированной части Западной Сахары.
«На сегодняшний день в Европе и Индии нет реальных запасов фосфора», — говорит Йенссен.
«Следовательно, мы зависим от импорта, и только Китай и Западная Сахара имеют большие объемы для экспорта. Китай ввел экспортные пошлины, чтобы их хватило для внутреннего потребления », — сказал он.
Таким образом, если крупные события, такие как война или конфликт, затронут эти области, мир все еще может иметь проблемы с получением достаточного количества фосфора.
Ряд причин для изменения
Это одна из причин, по которой миру, возможно, придется искать другие способы удовлетворить потребность в фосфоре, даже если нет немедленного кризиса.
И это не единственная причина.
Сегодняшнее использование, например, не является устойчивым навсегда, даже несмотря на то, что запасы фосфатов могут достигать 2000 лет.
Окружающая среда также является проблемой. Выбросы азота и фосфора в результате сельского хозяйства приводят к значительному загрязнению водных путей по всему миру.
Итак, что должно делать общество? Где найти достаточно большие залежи фосфора?
Ответ на удивление тривиален.
Питательные вещества из сельскохозяйственных удобрений часто попадают в реки и ручьи.Это может вызвать серьезные проблемы для экосистем (Фото: BMJ / Shutterstock / NTB scanpix)
Как природа
Природа обрабатывает фосфор, перерабатывая его. Исследователи говорят, что мы тоже должны это делать.
«Важно помнить, что фосфор — это элемент. Его много на Земле, и оно никогда не исчезнет по-настоящему », — говорит Брод.
Этот элемент, наряду с другими, является необходимыми строительными блоками в клетках всех живых существ.
Растения поглощают питательные вещества из воды из почвы и встраивают их в свои клетки.Затем животные получают вещества, поедая растения или других животных.
Но фосфор не израсходован. И животные, и растения постоянно возвращают фосфор и другие питательные вещества обратно в почву через экскременты и мертвые ткани.
Таким образом, лес или естественное поле удобряются все время, так что в них никогда не заканчивается фосфор.
Навоз, мусор и сточные воды
Но сельское хозяйство — другое дело. Здесь мы ежегодно удаляем с полей растения и их фосфор.Почва теряет немного фосфора с каждой собранной культурой. Вместо того чтобы возвращать питательные вещества обратно в почву, мы откладываем их где-нибудь в другом месте — в навозных ямах, в пищевых отходах, в сточных водах или в иле от рыбоводных хозяйств.
Брод и Йенссен считают, что эти ресурсы содержат более чем достаточно фосфора для удовлетворения потребностей норвежского сельского хозяйства — если бы мы только могли найти хорошие способы вернуть эти питательные вещества на поля фермеров.
Навоз может быть отличным источником питательных веществ. Но это не всегда практично. Например, навоз содержит много воды, он тяжелый и может быть дорогостоящим для перевозки на большие расстояния (Фото: Бернхард Рихтер / Shutterstock / NTB scanpix)
Но это не всегда практично. Например, навоз содержит много воды, он тяжелый и может быть дорогостоящим для перевозки на большие расстояния (Фото: Бернхард Рихтер / Shutterstock / NTB scanpix)
Длинный и тяжелый путь от навозной ямы до поля
«В настоящее время переработка и повторное использование этих ресурсов практически невозможны», — говорит Брод.
«Например, одна из проблем заключается в том, что животноводство происходит в основном в западной Норвегии и на побережье, в то время как потребность в фосфоре наиболее велика внутри страны», — говорит она.
Навоз домашнего скота содержит много воды, поэтому перевозить его на большие расстояния дорого и непрактично. И у фермеров необязательно есть оборудование для использования навоза вместо удобрений.
Нелегко также использовать сточные воды в качестве удобрения. Современные процессы очистки отстоя сточных вод затрудняют использование содержащегося в нем фосфора для растений.
Для получения решений, которые работают на практике, необходимо переработать навоз, отстой от рыбоводства и сточные воды от людей.
Но дело не только в сушке отходов и их использовании в качестве удобрения, — говорит Брод.
«Различные виды обработки изменяют качество фосфора, а термическая обработка не так хороша», — сказала она.
Эти процессы также могут быть дорогими и требуют большого количества оборудования и энергии. Но это может измениться в будущем, считают исследователи.
Бактерии могут улавливать фосфор
«Мы только находимся на начальной стадии изучения рециркуляции фосфора», — говорит Йенссен.
Но кое-что начинает происходить.
«NMBU реализует несколько проектов, включая переработку пищевых отходов и туалетов», — сказал он.
«И очистная установка HIAS в Хамаре была пионером в переработке фосфора из сточных вод».
Очистные сооружения Hamar улавливают фосфор из сточных вод с помощью бактерий. Бактерии поглощают и концентрируют фосфор, так что фосфорные удобрения можно производить в твердой форме. Эти удобрения можно вносить на поля с помощью того же оборудования, которое используется для внесения современных удобрений.
«Я думаю, что эта модель будет использоваться во многих странах и отраслях, в Норвегии и во всем мире», — говорит Йенссен.
Он говорит, что предпринимаются попытки использовать водоросли таким же образом: водоросли могут расти на наших отходах, а затем мы можем использовать водоросли, например, в качестве удобрений или корма для рыб.
Большой интерес к переработке отходов
Йенсен также считает, что когда-нибудь у нас появятся туалеты и канализационные системы, которые упростят извлечение питательных веществ из наших отходов.
«Вакуумные туалеты используются в новых многоквартирных домах в рамках проекта ЕС, который NMBU и NIBIO осуществляют во Фредрикстаде», — говорит Йенссен.
Аналогичная работа ведется в Гамбурге, Германия.
«Это упрощает извлечение ресурсов из фекалий и органических бытовых отходов. Эти продукты могут быть превращены как в биогаз, так и в удобрения, над чем мы работаем в рамках проекта ЕС », — сказал он.
Йенсен говорит, что существует большой интерес к переработке и повторному использованию питательных веществ из сточных вод, но исследователи все еще находятся на начальной стадии изучения того, как это лучше всего делать. В настоящее время только несколько решений являются достаточно прибыльными, чтобы конкурировать с удобрениями.
В настоящее время только несколько решений являются достаточно прибыльными, чтобы конкурировать с удобрениями.
Но это может быстро измениться по мере исчезновения лучших запасов фосфоритов. Или источники других питательных веществ, если на то пошло.
Полям необходимы другие питательные вещества, в том числе калий и сера.
«Мы редко говорим о том, что может быть нехватка этих веществ», — сказал Йенссен.
Тем не менее, «хотя не похоже, что мы сразу же сталкиваемся с ужасающим сценарием нехватки фосфора, нет причин не сосредоточиться на переработке», — сказал он.
«Нам нужны политические подходы, чтобы обеспечить более эффективное использование имеющегося у нас фосфора. Тогда кризиса не будет », — сказал Брод.
Перевод Нэнси Базильчук
———
Прочтите норвежскую версию этой статьи на сайте forskning.no
Возможно, вас заинтересует эта статья, подготовленная и профинансированная SINTEF:
Фосфор — ресурс ограниченный, поэтому исследователи извлекают его из сточных вод.

Фосфор и фосфорные химические вещества — Справочник по химической экономике (CEH)
Содержание
Номер страницы раздела
Краткое содержание11
Резюме12
Введение 17
Производственные процессы 23
Фосфор (P 4
) Сырье 23Эффективность процесса 23
Побочные продукты 23
Основные фосфорные химические вещества 24
Трихлорид фосфора (PCl 3 ) 24
Пентасульфид фосфора (P 2 S 5 ) 24 S 5 (P 2 O 5 ) 24
Гипофосфит натрия (NaH 2 PO 2 · H 2 O) 24
Гипофосфористая кислота (фосфиновая кислота) 25
Неорганические трихлоридные производные фосфора
Оксихлорид фосфора 25
Сульфохлорид фосфора 25
Пентахлорид фосфора 25
9000 2 Фосфорная кислота (фосфоновая кислота) 26Экологические проблемы 27
Спрос и предложение по регионам 29
США 29
Элементарный фосфор 30
Производственные компании 30
Основные статистические данные 30
Потребление 31
Прочие химические вещества и сплавы 33
Прямое использование 33
Цена 33
Торговля 34
Хлорид фосфора и оксихлорид фосфора 35
Компании-производители 35
Статистика основных характеристик 36
Потребление 37
Пестициды 40
Пестициды и секвестранты и эластомерные добавки 42
Функциональные жидкости 45
Присадки к смазочным маслам 46
Прочие 46
Цена 48
Торговля 48
Пентасульфид фосфора 50
Производственные компании 50
Статистика смазочных материалов 50
il добавки 52
Пестициды 53
Реагенты для флотации 54
Прочие 54
Цена 55
Торговля 55
Пятиокись фосфора 55
Производственные компании 55
Статистика по основным показателям 56
000000
Потребление пластмасс 56 9000 и эластомерные добавки / катализаторы 58
Присадки к смазочным маслам 58
Прочие 58
Цена 58
Торговля 58
Гипофосфит натрия 59
Производственные компании 59
Статистика основных характеристик 59
000 Торговля Цена 59
9000 61Канада 61
Производственные компании 61
Потребление 61
Торговля 62
Мексика 62
Производящие компании 62
Потребление 62
Торговля 63
Западная Европа 64
Резюме 64
Элементарный фосфор 66
Компании-производители 66
Важная статистика 66
Производство 67
Потребление 67
Цена 69
Торговля 69
Импорт 69
Экспорт 70
Красный фосфор 70
Производственные компании 70
Производство 71
71
Потребление Антипирены 72
Спички безопасности 73
Гражданская и военная пиротехника 73
Металлургия 73
Цена 73
Трихлорид и оксихлорид фосфора 73
Производственные компании 73
Статистика по фосфору 74
Тр.
Оксихлорид фосфора 77
Сульфохлорид фосфора 78
Цена 78
Торговля 78
Треххлористый фосфор 78
Оксихлорид фосфора 79
Пентасульфид фосфора 79
Пентасульфид фосфора 80
Статистика компаний-производителей 80
Производственные компании 1
Инсектициды 81
Присадки к смазочным маслам 81
Прочие 82
Цена 82
Торговля 82
Пятиокись фосфора 83
Производственные компании 83
Статистика основных характеристик 83
000 Торговля Цена 84
Импорт 85
Экспорт 86
Гипофосфит натрия 86
Производственные компании 86
Производство 87
Потребление 87
Цена 87
Торговля 87
Центральная Европа 88
Компании по производству элементарных фосфоров
9Важная статистика 88
Потребление 88
Цена 89
Торговля 89
Импорт 89
Хлориды фосфора 90
Производственные компании 90
Польша 91
Румыния 91
Потребление 91
Пентосфор 91
Торговля 92
Pro производящие компании 92
Потребление92
Польша 92
Румыния 92
Содружество Независимых Государств (СНГ) 92
Элементарный (желтый) фосфор 92
Производственные компании 92
Статистика основных направлений 93
Производство 94
ПотреблениеРоссия94
Прочие94
Торговля 94
Трихлорид фосфора 95
Производственные компании 95
Trade96
Пентасульфид фосфора96
Индийский субконтинент96
Статистика Elemental Потребление 98
Торговля 98
Красный фосфор 99
Производственные компании 99
Торговля 99
Треххлористый фосфор 100
Производственные компании 100
Trade100
Оксихлорид фосфора 101
Производственные компании Trade101
Пентахлорид фосфора 102
Компании-производители 102
Trade102
Пентасульфид фосфора102
Пентоксид фосфора 103
Компании-производители 103
Trade103
9102 Фосформатерик Фосфор желтый Производственные компании 104
Основная статистика 107
Потребление 108
Термическая кислота108
Трихлорид фосфора108
Прочие109
Цена 109
Торговля110
Красный фосфор111
Производственные компании Антипирены112
Пестициды 112
Металлургия 112
Спички безопасности113
Прочие 113
Цена 113
Торговля113
Трихлорид фосфора114
Производящие компании 11 4
Основная статистика 115
Потребление 116
Пестициды 117
Оксихлорид фосфора119
Прочие120
Цена 120
Торговля120
Оксихлорид фосфора 120
Статистика потребления
Производственные компании
Производственные компании замедлители123
Фармацевтические препараты 123
Пестициды124
Прочие 124
Цена 124
Торговля124
Пентасульфид фосфора 125
Производящие компании 125
Статистические данные о примесных веществах 125
Статистические данные о примеси 125
Потребление 126
Цена 127
Торговля 127
Пятиокись фосфора 128
Производящие компании 128
Важная статистика 128
Потребление 129
Высокочистые фосфаты 130
Осушители 130
9 0002 ПАВ 130Прочие 130
Цена 130
Trade130
Гипофосфит натрия 131
Производственные компании 131
Основные статистические данные 131
Потребление 132
Электролитическое никелирование 133
133
Прочие 133
Цена 133
Торговля 133
Япония 134
Элементарный (желтый) фосфор 134
Производящие компании 134
Основная статистика 134
Потребление 135
Цена 136
Торговля 136
9000 9000 Красный фосфор предприятия136Потребление 137
Цена 138
Торговля 138
Треххлористый фосфор 138
Производственные предприятия 138
Производство139
Потребление 139
Цена 140
Торговля 140
Компонент anies141
Производство142
Потребление 142
Цена 143
Торговля 143
Пентахлорид фосфора144
Пентасульфид фосфора145
Производственные предприятия145
Производственные предприятия145
Производственные компании145
Производственные компании145
Производственные предприятия145
9000 9000
9000
Производство145
Производство145 9000
9000 9000 9000
Производство145 9000 компании146
Производство147
Потребление 147
Цена 148
Торговля 149
Гипофосфит натрия149
Производственные компании 149
Производство149
Потребление 150
Потребление 150
Азия 150
Nortal
Азия фосфор 151
Основная статистика 151
Потребление 152
Торговля 153
Красный фосфор 154
Треххлористый фосфор154
Оксихлорид фосфора154
Пентахлорид фосфора155 90 003
Пятиокись фосфора155
Юго-Восточная Азия 156
Элементарный (желтый) фосфор 156
Производящие компании156
Статистика солей 157
Потребление 157
Торговля 158
Торговля 158
Фосфор
Фосфор
Фосфор
Фосфор
Хлор ФосфорРедакции 163
.

 А. Педро, проф., зав. лаб. высокотемпературных процессов и аппаратов, тел. 8 (812) 592-64-45
А. Педро, проф., зав. лаб. высокотемпературных процессов и аппаратов, тел. 8 (812) 592-64-45 Направление Uп.с в измерительной цепи — от расплава или кокса, плавающего на его поверхности, к электроду, т. е. на расплаве «+». Постоянная составляющая, определяемая вентильным эффектом электрической дуги переменного тока, зависит от материала электродов, между которыми горит дуга (т. е. от работы выхода электронов из катодных пятен в полупериоды, когда они находятся на электродах), температуры катодных пятен и газовой среды, в которой горит дуга. Поскольку одним из электродов является расплав или плавающий на его поверхности кокс, пропитанный этим расплавом, то Uп.с зависит от состава расплава. Кроме того, Uп.с зависит от доли тока электрода, проходящей через дугу, т. е. от тока дуги. Направление Uп.с, определяемой дугой, зависит от величины электронной эмиссии из электродов. Тот электрод (расплав или непосредственно электрод), из которого эмиссия выше, в измерительной цепи является «+». Величина и направление суммарной Uп.с, обусловленной одновременным наличием вентильных эффектов электрода с расплавом и электрической дуги переменного тока, зависят от соотношения процессов химического взаимодействия электрода с компонентами реакционной зоны, а также от степени развития и условий горения электрической дуги.
Направление Uп.с в измерительной цепи — от расплава или кокса, плавающего на его поверхности, к электроду, т. е. на расплаве «+». Постоянная составляющая, определяемая вентильным эффектом электрической дуги переменного тока, зависит от материала электродов, между которыми горит дуга (т. е. от работы выхода электронов из катодных пятен в полупериоды, когда они находятся на электродах), температуры катодных пятен и газовой среды, в которой горит дуга. Поскольку одним из электродов является расплав или плавающий на его поверхности кокс, пропитанный этим расплавом, то Uп.с зависит от состава расплава. Кроме того, Uп.с зависит от доли тока электрода, проходящей через дугу, т. е. от тока дуги. Направление Uп.с, определяемой дугой, зависит от величины электронной эмиссии из электродов. Тот электрод (расплав или непосредственно электрод), из которого эмиссия выше, в измерительной цепи является «+». Величина и направление суммарной Uп.с, обусловленной одновременным наличием вентильных эффектов электрода с расплавом и электрической дуги переменного тока, зависят от соотношения процессов химического взаимодействия электрода с компонентами реакционной зоны, а также от степени развития и условий горения электрической дуги.
 1993. № 5. С. 28–31.
1993. № 5. С. 28–31.


 При 280—300°С переходит в
красный
При 280—300°С переходит в
красный Водный раствор кислоты изменяет
окраску индикаторов. Диссоциация
происходит ступенчато:
Водный раствор кислоты изменяет
окраску индикаторов. Диссоциация
происходит ступенчато: При действии раствора нитрата серебра
(I) появляется
желтый осадок:
При действии раствора нитрата серебра
(I) появляется
желтый осадок: Содержит P,Ca,
Si,
C,
Fe
и др. элементы
Содержит P,Ca,
Si,
C,
Fe
и др. элементы