положительный катализ — это… Что такое положительный катализ?
- положительный катализ
- positive catalysis
Большой англо-русский и русско-английский словарь. 2001.
- положительный итог
- положительный катализатор
Смотреть что такое «положительный катализ» в других словарях:
Катализ — (греч. κατάλυσις восходит к καταλύειν разрушение) избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное… … Википедия
Катализ — (от греч. katálysis разрушение) изменение скорости химических реакций в присутствии веществ (катализаторов (См. Катализаторы)), вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после… … Большая советская энциклопедия
КАТАЛИЗ — (от греч.
 katalysis разрушение), изменение скорости хим. р ции при воздействии в в ( катализаторов), к рые участвуют в р ции, но не входят в состав продуктов. Катализатор не находится в стехиометрич. отношениях с продуктами и регенерируется после … Химическая энциклопедия
katalysis разрушение), изменение скорости хим. р ции при воздействии в в ( катализаторов), к рые участвуют в р ции, но не входят в состав продуктов. Катализатор не находится в стехиометрич. отношениях с продуктами и регенерируется после … Химическая энциклопедияКинетика химическая — Химическая кинетика или кинетика химических реакций раздел химии, изучающий механизмы протекания химических реакций, порядок химической реакции, а также закономерности протекания химических реакций во времени. Содержание 1 Скорость химической… … Википедия
Катализаторы биологические — биокатализаторы, вещества, образующиеся в живых клетках и ускоряющие (положительный Катализ) или замедляющие (отрицательный катализ) химические процессы, протекающие в организмах. К числу К. о. относятся в первую очередь Катализаторы… … Большая советская энциклопедия
биокатализаторы — (см. био… + катализаторы) вещества, присутствие которых обусловливает ускорение (положительный катализ) или торможение (отрицательный катализ) свойственных живой материи хим.
 процессов; к биокатализаторам относят гл. обр. ферменты, но иногда… … Словарь иностранных слов русского языка
процессов; к биокатализаторам относят гл. обр. ферменты, но иногда… … Словарь иностранных слов русского языкабиокатализатор — Вещество, обусловливающее ускорение (положительный катализ) или торможение (отрицательный катализ) биохимических процессов. [ГОСТ Р 52808 2007] Тематики энергетика биоотходов EN biocatalysts … Справочник технического переводчика
биокатализатор — 6 биокатализатор: Вещество, обусловливающее ускорение (положительный катализ) или торможение (отрицательный катализ) биохимических процессов. Источник: ГОСТ Р 52808 2007: Нетрадиционные технологии. Энергетика биоотходов. Термины и определения … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р 52808-2007: Нетрадиционные технологии. Энергетика биоотходов. Термины и определения — Терминология ГОСТ Р 52808 2007: Нетрадиционные технологии. Энергетика биоотходов. Термины и определения оригинал документа: 40 бензанол; газохол: Автомобильное моторное топливо, представляющее собой смесь нефтяных бензинов и этанола.
 Определения… … Словарь-справочник терминов нормативно-технической документации
Определения… … Словарь-справочник терминов нормативно-технической документацииБиокатализатор — * біякаталізатар * biocatalyst соединение, которое катализирует биохимические процессы в живых объектах, ускоряют (положительный катализ) или тормозят их (отрицательный катализ). Наиболее известными биокатализаторами являются ферменты … Генетика. Энциклопедический словарь
Мюон — Символ μ (μ−) Масса 105,6583715(35) МэВ[1] Античастица … Википедия
Положительный катализ — Большая Энциклопедия Нефти и Газа, статья, страница 1
Положительный катализ
Cтраница 1
Положительный катализ происходит тогда, когда скорость образования промежуточных соединений катализатора с реагентами и дальнейшего превращения их в продукт больше, чем скорость получения продукта некаталитическим путем. Практически катализаторы производят только для положительного катализа, который мы и рассматриваем в этой — монографии, называя просто катализом. Свободная энергия катализатора до — акта катализа и после него неизменна.
[1]
Свободная энергия катализатора до — акта катализа и после него неизменна.
[1]
Положительный катализ происходит тогда, когда скорость образования промежуточных соединений катализатора с реагентами и дальнейшего превращения их в продукт больше, чем скорость получения продукта некаталитическим путем. Практически катализаторы производят только для положительного катализа, который мы и рассматриваем в этой монографии, называя просто катализом. Энергия Гиббса катализатора до акта катализа и после него неизменна. Поэтому в обратимых реакциях катализатор ускоряет достижение равновесия, но не смещает его. [2]
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора, и отрицательный катализ, приводящий к уменьшению скорости химического превращения. При отрицательном катализе, наоборот, подавляется ( ингибируется) быстрая и энергетически более легкая стадия химического взаимодействия. Следует отметить, что под термином катализ подразумевают преимущественно только положительный катализ.
[3]
Следует отметить, что под термином катализ подразумевают преимущественно только положительный катализ.
[3]
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора — и отрицательный катализ, приводящий к уменьшению скорости химического превращения. При отрицательном катализе, наоборот, подавляется ( ингибируется) быстрая и энергетически более легкая стадия химического взаимодействия. Следует отметить, что под термином катализ подразумевают преимущественно только положительный катализ. [4]
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора — и отрицательный катализ, приводящий к уменьшению скорости химического превращения. При отрицательном катализе, наоборот, подавляется ( ингибируется) быстрая и энергетически более легкая стадия химического взаимо — действия. Следует отметить, что под термином катализ подразумевают преимущественно только положительный катализ.
Различают положительный катализ — увеличение скорости реакции под влиянием катализатора, и отрицательный катализ, при-водящий к уменьшению скорости химического превращения. При отрицательном катализе, наоборот, подавляется ( ингибируется) быстрая и энергетически более легкая стадия химического взаимодействия. Следует отметить, что под термином катализ подразумевают преимущественно только положительный катализ. [6]
Сущность положительного катализа одинакова для всех его видов: гомогенного, гетерогенного, ферментативного. Каждый из этих видов имеет свои отличительные особенности. Повышение температуры, например, ускоряет реакцию путем увеличения энергетического уровня реагирующих молекул, активации их за счет вводимого извне тепла. Поскольку при этом изменяется запас внутренней энергии системы, то повышение температуры смещает положение равновесия, что для экзотермических реакций понижает равновесный выход продукта и ограничивает применение температуры выше оптимальной.
Примером положительного катализа может служить получение серной кислоты контактным способом, разложение перокси-да водорода в присутствии диоксида марганца МпО2 или бурное взаимодействие порошков магния с иодом в присутствии воды. [9]
Сущность положительного катализа одинакова для всех его видов: гомогенного, гетерогенного, ферментативного. Каждый из этих видов имеет свои отличительные особенности. Повышение температуры, например, ускоряет реакцию увеличением энергетического уровня реагирующих молекул, активацией их за счет вводимой извне теплоты. [10]
Примером положительного катализа, кроме приводимого уже ускорения разложения перекиси водорода двуокисью марганца, может служить еще ускорение окисления иодистоводородной кислоты HI над сернокислым аммонием ( Nh5) 2S2O8 и окисью меди или железа, ускорение разложения муравьиной кислоты в присутствии металлического родия, возникновение бурной реакции между порошком алюминия и иода в присутствии капли воды, возникновение мгновенной реакции, сопровождающейся ослепительной вспышкой между перекисью натрия и порошком алюминия в присутствии капли воды. [11]
[11]
При гетерогенном положительном катализе, как и при гомогенном, ускоряющее действие катализатора обусловлено тем, что реагирующие вещества образуют промежуточные поверхностные ( адсорбционные) соединения, что снижает общую энергию активации. Образуются адсорбционные соединения на активных центрах катализатора. Силовые поля этих центров ослабляют связь между атомами адсорбированных молекул, что и вызывает возрастание их реакционной способности. [12]
Катализ ( положительный катализ) — селективное ускорение химической реакции веществом — катализатором, который многократно вступает в промежуточные химические реакции, но регенерируется к моменту образования конечных продуктов. К этому определению необходимо сделать несколько пояснений. Во-первых, далеко не всегда ускорение реакции добавкой вещества есть катализ. Например, ионную реакцию можно ускорить, изменив ионную силу раствора, однако такое ускорение не результат катализа: химически нейтральные ионы влияют на частоту встреч реагентов в растворе, но они не участвуют в реакции, не образуют с ними промежуточных соединений.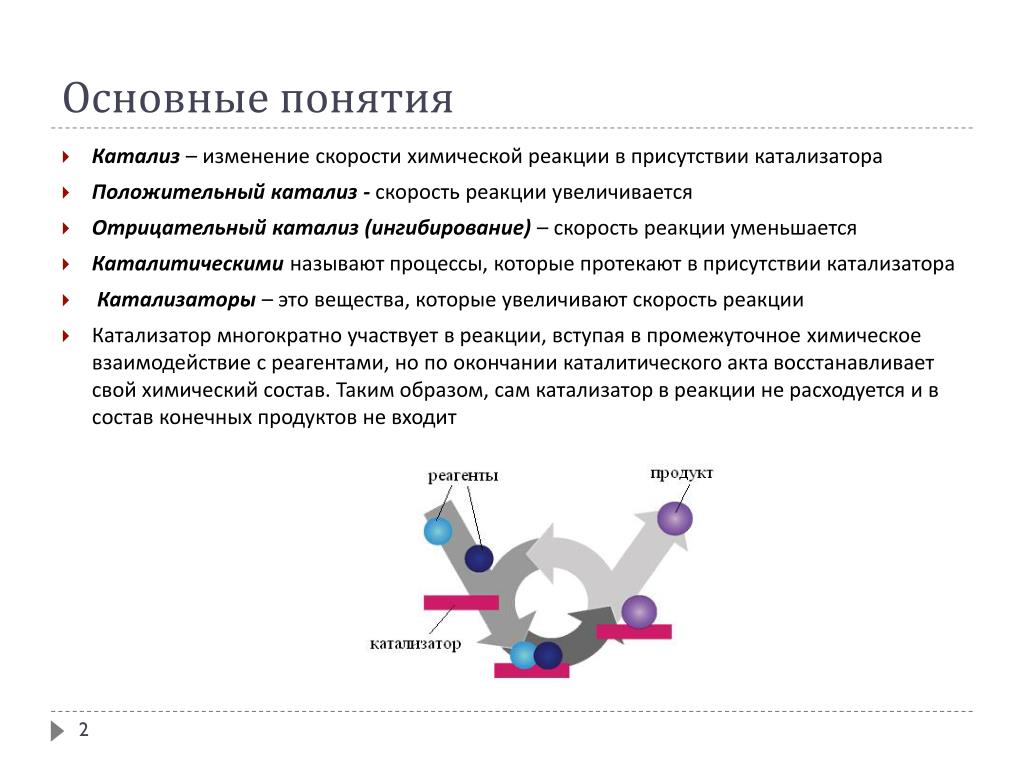
В случае положительного катализа скорость химической реакции при введении катализатора возрастает, а при отрицательном катализе — течение химического процесса замедляется. [14]
Типичным примером гомогенного положительного катализа является влияние водяного пара на реакцию горения окиси углерода с кислородом. Если окись углерода совершенно сухая, то зажженное пламя сейчас же гаснет. В сыром воздухе, напротив, окись углерода горит очень хорошо. Водяной пар здесь является катализатором горения. Так как водяной пар значительно легче распадается на радикалы ( энергия расщепления водяного пара 118 ккал-моль-1, а окиси углерода 160 — 200 ккал-моль -), то реакция может идти при более низких температурах. [15]
Страницы: 1 2 3 4
Катализ отрицательный — Справочник химика 21
Общие понятия и определения. Явление катализа можно определить как зависимость скорости реакций от присутствия веществ — катализаторов, которые на отдельных стадиях химического процесса вступают во взаимодействие с реагирующими молекулами и резко изменяют скорость реакции, оставаясь в химически неизмененном виде. Катализатором реакции является вещество — атомы, молекулы, ионы или поверхности раздела фаз, которое взаимодействует с молекулами реагирующих веществ, изменяет скорость химической реакции и выделяется на последующих стадиях в химически неизмененном виде. Большое практическое и теоретическое значение имеют катализаторы, повышающие скорости химических реакций. Иногда нх назьшают положительными катализаторами. Катализаторы, понижающие скорость химической реакции, называют отрицательными катализаторами. Все каталитические процессы с учетом их специфичности можно разбить на три группы. [c.616]
Явление катализа можно определить как зависимость скорости реакций от присутствия веществ — катализаторов, которые на отдельных стадиях химического процесса вступают во взаимодействие с реагирующими молекулами и резко изменяют скорость реакции, оставаясь в химически неизмененном виде. Катализатором реакции является вещество — атомы, молекулы, ионы или поверхности раздела фаз, которое взаимодействует с молекулами реагирующих веществ, изменяет скорость химической реакции и выделяется на последующих стадиях в химически неизмененном виде. Большое практическое и теоретическое значение имеют катализаторы, повышающие скорости химических реакций. Иногда нх назьшают положительными катализаторами. Катализаторы, понижающие скорость химической реакции, называют отрицательными катализаторами. Все каталитические процессы с учетом их специфичности можно разбить на три группы. [c.616]
Катализ. Катализом называется изменение скорости химической реакции в присутствии веществ — катализаторов.
 Если скорость реакции в присутствии катализатора возрастает, то катализ называют положительным или просто катализом, а катализаторы — положительными. Известны также вещества, которые замедляют (тормозят) скорость химических реакций. Эти вещества называют отрицательными катализаторами или ингибиторами, а катализ отрицательным. [c.83]
Если скорость реакции в присутствии катализатора возрастает, то катализ называют положительным или просто катализом, а катализаторы — положительными. Известны также вещества, которые замедляют (тормозят) скорость химических реакций. Эти вещества называют отрицательными катализаторами или ингибиторами, а катализ отрицательным. [c.83]Различают положительный и отрицательный катализ. Если катализатор ускоряет реакцию, такое химическое явление называется положительным катализом или просто катализом. Отрицательным катализом называется явление уменьшения скорости протека-. ния химических процессов под действием специальных веществ — ингибиторов. Основное значение в химической технологии имеет положительный катализ. [c.218]
Химическое явление, при котором катализатор ускоряет реакцию, носит название положительного катализа или просто катализа). Отрицательным катализом называют химические процессы, скорость протекания которых замедляется (тормозится) под действием специальных веществ — ингибиторов. В химической технологии основное значение имеет положительный катализ. [c.463]
В химической технологии основное значение имеет положительный катализ. [c.463]
Катализатором называется вещество, в присутствии которого течение химической реакции значительно ускоряется, а в некоторых случаях замедляется (отрицательный катализ). [c.44]
Катализ делится на положительный и отрицательный. Отрицательный катализ — это уменьшение скорости химических реакций под действием некоторых веществ — отрицательных катализаторов. Если нет специальной оговорки, то положительный катализ называют просто катализом. Отрицательные катализаторы следует отличать от ядов. [c.327]
На рис. 1У.6. изображены кривые, иллюстрирующие зависимость константы скорости реакции от pH и температуры. Из этих кривых видно, что константа скорости реакции элиминирования особенно быстро растет в области pH, близкой к названным выше значениям перехода общего катализа в специфический. С повышением температуры эти точки по оси абсцисс сближаются. Расчет эффективных энергий и энтропии активации показал, что они сильно зависят от pH, причем при pH специфического кислотного катализа, отрицательная энтропия активации скачкообразно увеличивается, принимая положительное значение. [c.152]
Расчет эффективных энергий и энтропии активации показал, что они сильно зависят от pH, причем при pH специфического кислотного катализа, отрицательная энтропия активации скачкообразно увеличивается, принимая положительное значение. [c.152]
Совершенно естественно, что аналогичный эффект должен наблюдаться и при реакциях водородного обмена, причем заранее можно предвидеть, что в случае щелочного катализа отрицательный заряд субстрата будет [c.227]
Катализ называют положительным, если скорость реакции увеличивается. Отрицательный катализ означает уменьшение скорости химического превращения вследствие действия катализатора он связан, как правило, с замедленным превращением в продукт промежуточного химического соединения. [c.19]
Скорость каталитической реакции может быть болыие или меньше скорости некаталитической, т. е. катализатор, входящий в состав активного комплекса, может или ускорять реакцию положительным катализ, или замедлять ее — отрицательный [c. 273]
273]
Некоторые добавки вызывают отрицательный катализ в области автоокисления масел. Наиболее эффективными антиокислителями являются фенольные и аминные группы, а также некоторые сернистые соединения. Роль ингибиторов играют асфальтово-смолистые вещества ароматического происхождения. Асфальтово-смолистые вещества из нафтеновых или парафиновых углеводородов стабилизирующей способностью не обладают или обладают в очень малой степени. Сильные ингибиторы — асфальтово-смолистые вещества ароматического происхождения, содержащие фенолы [124]. [c.68]
В цепных реакциях очень распространено явление отрицательного катализа веществами, соединяющимися с активными переносчиками реакции и вызывающими обрыв цепей. Например, при распаде углеводородов активными частицами являются радикалы вроде метила СН3-, которые могут реагировать с окисью азота по уравнению [c.204]
Действие катализатора на химическую реакцию. Положительным катализом называют ускорение реакции, отрицательным катализом — замедление реакции. [c.75]
[c.75]
Отрицательный катализ называют также ингибированием, а отрицательные катализаторы — ингибиторами. — Прим. ред. [c.75]
Отрицательный катализ встречается, например, в цепных реакциях, когда катализатор вступает в промежуточное взаимодействие с активными частицами, что приводит к обрыву цепей. Замедление реакций Б присутствии некоторых веществ часто не связано с катализом. Например, при замедлении химического растворения металлов в присутствии поверхностно-активных веществ проявляется защитное действие адсорбционной пленки этого вещества. [c.405]
Каталитическая активность может быть положительной и отрицательной в соответствии с положительным и отрицательным катализом. Часто второй член Шв(1—ф) в уравнении формулы (IX, 1) настолько мал по сравнению с первым, что им можно пренебречь. Поэтому [c.407]
Если добавка катализатора действует на процесс ускоряюще, то явление называют положительным катализом, при замедлении (торможении) реакции—отрицательным катализом. Большинство каталитических реакций протекает с ускорением, и лишь в последние годы повысилось значение реакций торможения. К реакциям торможения относятся, например, стабилизация раствора формальдегида добавками метанола, стабилизация хлороформа добавками [c.21]
Большинство каталитических реакций протекает с ускорением, и лишь в последние годы повысилось значение реакций торможения. К реакциям торможения относятся, например, стабилизация раствора формальдегида добавками метанола, стабилизация хлороформа добавками [c.21]
Для катализа не требуется присутствия на поверхности из-мери.мого количества хемосорбированных атомов, однако существенно, чтобы теплота хемосорбции реагирующих вешеств была достаточно мала или даже отрицательна. [c.168]
Что такое положительный и отрицательный катализ [c.57]
Соответственно этой двойной функции автор предлагает ввести двойное обозначение дефектный катализ — для заторможенного, антикатализ — для тормозящего положительного катализа. Отрицательные катализаторы дефектного катализа называются стабилизаторами, антикатализа — ингибиторами. [c.376]
Различают положительный катализ — увеличение скорости резь ции под влиянием катализатора — и отрицательный катализ, при]юдящий к уменьшению скорости химического превращения. При положительном катализе промежуточное взаимодействие реагирующих веществ с катализатором открывает новый, энергети — чес(высотой энергетического бар ,сра), по сравнению стермолизом, реакционный путь (маршрут). При отрицательном катализе, наоборот, подавляется (ингибируется) быс трая и энергетически более ле1кая стадия химического взаимо — действия. Следует отметить, что под термином «катализ» подразумевают преимущественно только положительный катализ. [c.79]
При положительном катализе промежуточное взаимодействие реагирующих веществ с катализатором открывает новый, энергети — чес(высотой энергетического бар ,сра), по сравнению стермолизом, реакционный путь (маршрут). При отрицательном катализе, наоборот, подавляется (ингибируется) быс трая и энергетически более ле1кая стадия химического взаимо — действия. Следует отметить, что под термином «катализ» подразумевают преимущественно только положительный катализ. [c.79]
Катализаторы бывают положительные и отрицательные первые увеличивают скорость реакции, вторые уменьшают ее. Катализаторы для той или иной реакции подбирают главным образом экспериментальным путем. Иа скорость реакции сильное влияние оказывает природа самого катализатора, его структура, всевозможные добавки к нему (активаторы) и т. д., т. е. сам катализатор обусловливает очень многие факторы, ускоряющие или замедляющие данную реакцию. Кроме того, состав реагирурощих веществ, посторонние примеси в них и т. п. также сильно влияют на каталитическую способность данного катализатора. Несмотря на то, что за последние годы в области катализа достигнуты значительные успехи, современные теоретические представления о катализе в настоящее время еще не являются основой для создания общей методики техно-химических расчетов каталитических процессов промышленных установок. [c.230]
п. также сильно влияют на каталитическую способность данного катализатора. Несмотря на то, что за последние годы в области катализа достигнуты значительные успехи, современные теоретические представления о катализе в настоящее время еще не являются основой для создания общей методики техно-химических расчетов каталитических процессов промышленных установок. [c.230]
Изменения катализатора при воздействии реакционной смеси и каталитической реакции приводят к дополнительному уменьшению свободной энергии и увеличению энтропии системы в целом, В то же время энтропия собственно катализатора (подсистемы) уменьшается, а свободная энергия возрастает. Это положение становится очевидным уже из того, что, в рассмотренной системе при исключении катализа должен пойти самопроизвольный процесс К Кт. Другими словами, катализатор в таких системах играет роль своеобразной энергетической ловушки, в которой накапливается также отрицательная энтропия . Здесь просматривается интересная аналогия с биологическими системами, неотъемлемая функция которых — порождение отрицательной энтропии и свободной энергии за счет протекающих в организме процессов переработки питательных веществ [79].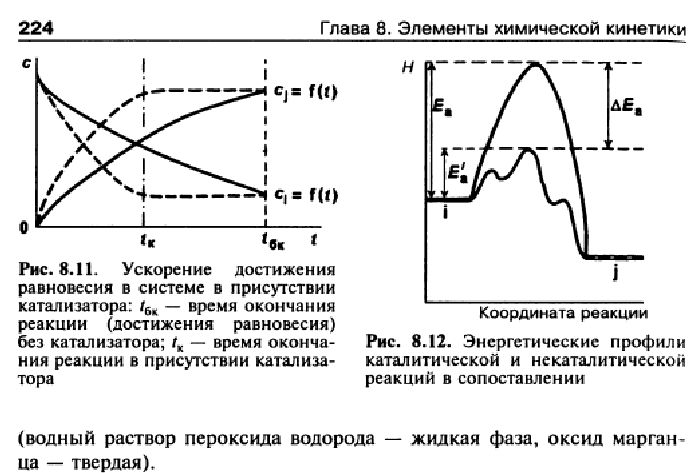 Можно сказать, что в каталитических системах существует механизм молекулярной селекции, обусловленной устойчивостью различных активных состояний. Цапомним, что устойчивость активного состояния (соединения) в каталитической реакции тем выше, чем больше оно удалено от равновесного и чем больше, следовательно, его запас свободной энергии и отрицательной энтропии [80]. [c.303]
Можно сказать, что в каталитических системах существует механизм молекулярной селекции, обусловленной устойчивостью различных активных состояний. Цапомним, что устойчивость активного состояния (соединения) в каталитической реакции тем выше, чем больше оно удалено от равновесного и чем больше, следовательно, его запас свободной энергии и отрицательной энтропии [80]. [c.303]
Наиболее отрицательное влияние на точность анализа может оказать реакция гидрогенолиза циклопентановых угловодородов в процессе дегидрогенизационного катализа циклопеитановые углеводороды, подвергаясь гидрогенолизу, превращаются в алкил-замещенные бензолы. Напри.мер, 7 -бутилциклопентан об азует смесь пропилбензола и метилэтилбензола [1] [c.241]
Катализатор —это вещество, которое или резко меняет скорость реакции, или вызывает ее, если она не идет, но принципиально осуществима, т. е. ДбсО. Так, смесь алюминия и иода при комнатной температуре не обнаруживает заметных признаков взаимодействия, но достаточно капли воды, чтобы вызвать бурную реакцию [(ДС298)а11, = =—75 ктл1моль. Таково действие положительного катализатора. Реже приходится иметь дело с отрицательным катализатором, т. е. с замедлением процесса, и с явлением автокатализа, когда катализатором служит один из продуктов реакции. Мы будем рассматривать положительный катализ. Огромное практическое значение катализаторов обусловлено возможностью быстро, без затраты энергии получать в больших количествах самые разнообразные вещества. [c.118]
Таково действие положительного катализатора. Реже приходится иметь дело с отрицательным катализатором, т. е. с замедлением процесса, и с явлением автокатализа, когда катализатором служит один из продуктов реакции. Мы будем рассматривать положительный катализ. Огромное практическое значение катализаторов обусловлено возможностью быстро, без затраты энергии получать в больших количествах самые разнообразные вещества. [c.118]
Наряду с гомогенно-каталитическими реакциями, в которых катализатор служит ускоряющим агентом (положительный катализ), известно большое число реакций, замедляемых примесями. Такие примеси называются отрицательными катализаторами или ингибиторами. Примером отрицательного катализатора может служить кислород, замедляющий реакцию Иг + С1г = = 2НС1 (см. [11]). В этих и подобных случаях причиг[а замедляющего действия ингибитора заключается в его взаимодействии с активными промежуточными веществами. [c.18]
Большое значение для окисления имеет также соотношение углеводородов разных классов, входящих в состав масел. Например, замечено, что присутствие определенного количества ароматических углеводородов в смеси парафинов и нафтенов приводит к автозамедлению процесса окисления за счет образования фенольных соединений из ароматических углеводородов. Вероятно, при этом конкурируют в основном два явления. Нафтеновые и парафиновые углеводороды превращаются в вещества, катализирующие окисление в результате происходят автокаталитические процессы. Ароматические углеводороды, наоборот, при окислении образуют вещества, стремящиеся задержать окисление нафтенов и парафинов, т. е. ароматические углеводороды приводят к замедлению окисления. Таким образом, автозамедление есть отрицательный катализ при помощи продуктов окисления, изменяющих ход реакции и уменьшающих скорость окисления. [c.15]
Например, замечено, что присутствие определенного количества ароматических углеводородов в смеси парафинов и нафтенов приводит к автозамедлению процесса окисления за счет образования фенольных соединений из ароматических углеводородов. Вероятно, при этом конкурируют в основном два явления. Нафтеновые и парафиновые углеводороды превращаются в вещества, катализирующие окисление в результате происходят автокаталитические процессы. Ароматические углеводороды, наоборот, при окислении образуют вещества, стремящиеся задержать окисление нафтенов и парафинов, т. е. ароматические углеводороды приводят к замедлению окисления. Таким образом, автозамедление есть отрицательный катализ при помощи продуктов окисления, изменяющих ход реакции и уменьшающих скорость окисления. [c.15]
Соотношение, связываюшее минимальное давление с температурой самовоспламенения, было подтверждено многочис-лениыми экспериментами и оказалось ненным при изучении кинетики процессов горения, а также в пожарной профплак-т 1ке. Вместе с тем тепловая теория самовоспламенения не в состоянии объяснить ряда особенностей, наблюдаемых нри горении положительный или отрицательный катализ при введении в реагирующую систему малых примесей отдельных ве-и еств, пределы воспламенения в зависимости от давления и др. Эти особе1П10сти объясняет теория ценных реакций. [c.126]
Вместе с тем тепловая теория самовоспламенения не в состоянии объяснить ряда особенностей, наблюдаемых нри горении положительный или отрицательный катализ при введении в реагирующую систему малых примесей отдельных ве-и еств, пределы воспламенения в зависимости от давления и др. Эти особе1П10сти объясняет теория ценных реакций. [c.126]
Катализом называется изменение скорости химических реакций при воздействии веществ-катализаторов, которые участвуя в процессе, остаются после его окончания химически неизменными. Катализ называется положительным, если- катализатор ускоряет реакцию и отрицательным при снижении скорбсти ее. В данной книге рассматривается, в основном, положительный гетерогенный катализ в газовой среде на твердых катализаторах. [c.61]
Цепная теория является логическим развитием рассмотренных выше классических теорий окисления. Ни одна из этих теорий не в состоянии объяснить некоторые характерные особенности автоокисления углеводородов, например существование индукционного периода, предшествующего видимой реакции, резкое действие иногда ничтожных количеств тех пли иных примесей на скорость процесса, аналогичное влияние стенок сосуда, явлэния отрицательного катализа ири окислении и т.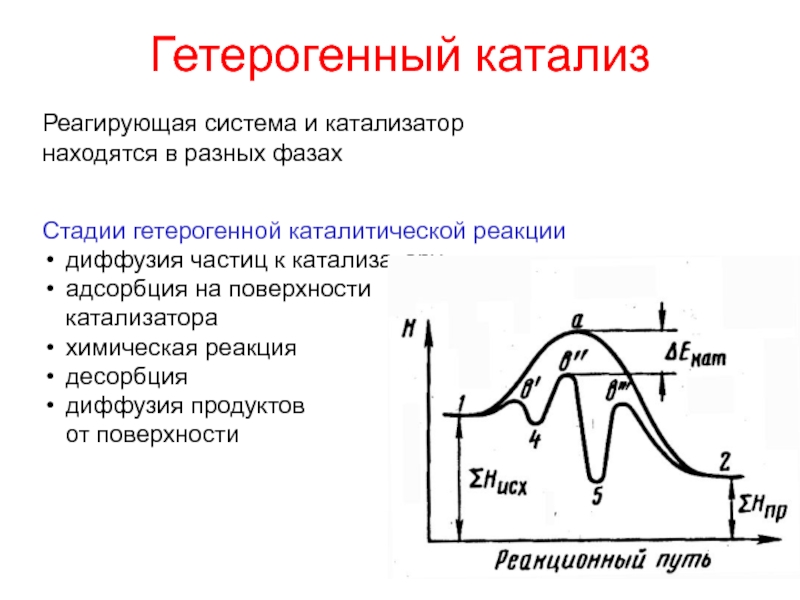 д. Истолкование этих фактов может быть проведено [c.349]
д. Истолкование этих фактов может быть проведено [c.349]
У ионов М+ и Р (например, N3+ и С1 ) имеются замкнутые восьмиэлектронные оболочки и отсутствуют свободные неспаренные (валентные) электроны. У электроне аожительного атома имеется валентный электрон — свободная положительная валентность (п-связь). У электроотрицательного атома отсутствует один электрон в восьмиэлектронной оболочке, что равнозначно появлению эфг )ективного положительного заряда (дырке) или отрицательной свободной валентности (р-связь). Для катализа имеет значение появление таких свободных валентностей на поверхности твердого тела [c.453]
Опыты проводились с одним и тем же катализатором. Как видно из кривых рис. 4 и 5, достаточно трехсекундного контакта газа с катализатором, чтобы при 600 добиться максималыю] о выхода олефинов. Побочные реакции проявляются незначительно. Если сравнить выходы олефинов, которых можно практически достигнуть, с выходами, которых можно было бы ожидать, основываясь па расчете равновесных концентраций, то окажется, что первые всегда значительно ниже вторых. Увеличение времени контакта газа с катализатором не только не приводит к увеличению выхода, но даже оказывает отрицательное влияние. Это объясняется тем, что с увеличением времени пребывания газа в зоне катализа начинают преобладать побочные реакции, которые идут медленнее дегидрирования. Полное исключение по бочных реакций, особенно в производственных условиях, невозможно. Эти реакции вызываются процессами, протекающими но на поверхности контакта, а в промежутках между шариками или таблетками катализатора при этом образуются низкомолекулярные осколки в результате чисто термических преобразований (крекинг, деструктивное дегидриропание и т. д.). [c.57]
Увеличение времени контакта газа с катализатором не только не приводит к увеличению выхода, но даже оказывает отрицательное влияние. Это объясняется тем, что с увеличением времени пребывания газа в зоне катализа начинают преобладать побочные реакции, которые идут медленнее дегидрирования. Полное исключение по бочных реакций, особенно в производственных условиях, невозможно. Эти реакции вызываются процессами, протекающими но на поверхности контакта, а в промежутках между шариками или таблетками катализатора при этом образуются низкомолекулярные осколки в результате чисто термических преобразований (крекинг, деструктивное дегидриропание и т. д.). [c.57]
Если ири нуклеофильном катализе происходит подача электронов от катализатора к субстрату, то при электрофильном катализе происходит оттягивание электронов, или перенос электронной плотности, от субстрата к катализатору. Ионы металлов — отличные электрофильные катализаторы. Электрофильный катализ особенно существен для химии фосфатов, поскольку отрицательные заряды атомов фосфора стремятся оттолкнуть нуклеофилы. Например, синтез 3, 5 -гуанозинциклофосфата (сОМР, разд. 3.4.2) из гуанозинтрифосфата заметно ускоряется в присутствии двухзарядиых катионов металлов (например, Mg2+, Мп2+, Ва2+, 2п=+, Са2+). [c.195]
Например, синтез 3, 5 -гуанозинциклофосфата (сОМР, разд. 3.4.2) из гуанозинтрифосфата заметно ускоряется в присутствии двухзарядиых катионов металлов (например, Mg2+, Мп2+, Ва2+, 2п=+, Са2+). [c.195]
Хотя эти отрицательные результаты несколько разочаровывают (что часто бывает при нсиользовании модельных соединений), они тем не мепее позволяют предположить, что реакционная способность отдельного субстрата, видимо, определяется в основном конфигурацией расщепляемой связи относительно общей формы молекулы субстрата и решающий фактор для катализа — ориентация расщепляемой связи. [c.238]
Для того чтобы мог иметь. место катализ, теплота хе.мосорб-цни должна иметь малую величину. В некоторых случаях она бывает даже отрицательной. Мы уже отмечали, что эндотер.мн-ческая Хемосорбция может играть важную роль (разделы V, 9, VI, 3, 4, 5 и X, 4). Рис. 40 показывает, что эндотермическая хемо-сс рбция нромотируется поверхностными примесями. Растворение атомов водорода в никеле, так же как и в железе, происходит с поглощением тепла. Весьма воз.можно, что растворенные атомы водорода из металлической фазы реагируют с хемосорбированными углеводородами. [c.168]
Весьма воз.можно, что растворенные атомы водорода из металлической фазы реагируют с хемосорбированными углеводородами. [c.168]
Из уравнения (2.21) видно, что термодинамически эффективность ферментативного катализа определяется разницей свободных энергий межмолекулярного (при образовании комплекса Михаэлиса) и внутримолекулярного (в переходном состоянии реакции) образования связи Е-Я. Следовательно, в количественном отношении кинетическая роль комплексообразования Е Н в ускорении ферментативной реакции представляется несколько иной, чем в кинетическом режиме второго порядка (уравнение 2.19). Однако и здесь движущей силой катализа остается свободная энергия взаимодействия Е-Н именно в переходном состоянии реакции (а не в промежуточном комплексе). Действительно, чем более термодинамически выгодным будет внутримолекулярное взаимодействие Е-К в активированном состоянии (чем более отрицательные значения примет величина АОз внутр). тем более благоприятным должно быть отношение VI/ии для ферментативной реакции [см. (2.21)]. Это связано с тем (см. рис. 12), что барьер свободной энергии активации ферментативной реакции (ДО/. внутр) в этом случае уменьшается (по сравнению с ДОи) и, следовательно, скорость процесса [уравнение (2.20)] возрастает. Наоборот, при заданном значении ДО .ппутр термодинамически более благоприятное взаимодействиеЕ -Н в исходном состоянии реакции (фермент-субстратный комплекс ХЕ-КУ) будет тормозить ее протекание. Так, более отрицательные значения Д(3 приводят к неблагоприятным значениям VI /иц в отношении ферментативного процесса [уравнение (2.21)]. Это связано с тем, что активационный барьер Д01% утр (см. рис. 12), определяющий скорость превращения фермент-субстратного комплекса [уравнение (2.20)], при этом возрастает. [c.41]
(2.21)]. Это связано с тем (см. рис. 12), что барьер свободной энергии активации ферментативной реакции (ДО/. внутр) в этом случае уменьшается (по сравнению с ДОи) и, следовательно, скорость процесса [уравнение (2.20)] возрастает. Наоборот, при заданном значении ДО .ппутр термодинамически более благоприятное взаимодействиеЕ -Н в исходном состоянии реакции (фермент-субстратный комплекс ХЕ-КУ) будет тормозить ее протекание. Так, более отрицательные значения Д(3 приводят к неблагоприятным значениям VI /иц в отношении ферментативного процесса [уравнение (2.21)]. Это связано с тем, что активационный барьер Д01% утр (см. рис. 12), определяющий скорость превращения фермент-субстратного комплекса [уравнение (2.20)], при этом возрастает. [c.41]
Физическая химия (1987) — [ c.520 ]
Физическая и коллоидная химия (1988) — [ c.103 ]
Краткий курс физической химии Изд5 (1978) — [
c. 485
]
485
]
Учебник физической химии (1952) — [ c.335 , c.344 ]
Курс химии Часть 1 (1972) — [ c.163 ]
Аккумулятор знаний по химии (1977) — [ c.75 ]
Основы физической и коллоидной химии Издание 3 (1964) — [ c.298 ]
Основы химической термодинамики и кинетики химических реакций (1981) — [ c.201 ]
Химическая кинетика и катализ 1974 (1974) — [ c.345 ]
Химическая кинетика и катализ 1985 (1985) — [ c.372 ]
Лабораторные работы по неорганической химии (1948) — [ c.129 ]
Курс физической химии Том 2 Издание 2 (1973) — [
c. 192
,
c.257
]
192
,
c.257
]
Физическая и коллоидная химия (1954) — [ c.61 ]
Физическая и коллоидная химия (1964) — [ c.126 ]
Учебник физической химии (0) — [ c.374 , c.383 ]
Общая химическая технология Том 1 (1953) — [ c.72 , c.74 ]
Краткий курс физической химии Издание 3 (1963) — [ c.4 ]
Курс физической химии Издание 3 (1975) — [ c.667 ]
Основы общей химии Т 1 (1965) — [ c.345 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.333 ]
Современные теоретические основы органической химии (1978) — [ c.188 ]
Современные теоретические основы органической химии (1978) — [ c.188 ]
Основы общей химии том №1 (1965) — [ c.345 ]
Что такое «катализ»? Интересно о катализе
Что такое «катализ»?
Термин «катализ» предложил в 1835 г. Йёнс Якоб Берцелиус, шведский академик и почетный иностранный член Санкт-Петербургской академии наук. Он образовал его из двух греческих слов: «káto» (вниз) и «λύειν» (отпускать), которые образуют греческое же слово «καταλύειν» – разрушение. Берцелиус писал, что «… катализатор производит на другие тела действие, весьма отличающегося от химического сродства. Катализатор производит разрушение в веществах и создает новые, в состав которых он сам не входит».
4 интересных факта о катализе
- Одним из первых неорганических катализаторов была серная кислота, которую использовал в 1552 г. Валериус Кордус (1514-1554 гг.) для конвертации спирта в эфир. Серная кислота и сегодня широко используется в качестве катализатора в нефтепереработке.
- Нобелевскую премию по химии в 2010 г. получили Ричард Хек, Эйичи Негиси и Акира Судзуки за разработку реакции палладиевого катализа. В отличие от традиционных реакций, она не разрушает молекулу, но способствует образованию одинарных связей между атомами углерода в молекулах. Именно эти трое ученых сыграли важнейшую роль в массовом распространении светодиодов, которые освещают сегодня наши дома и украшают вечером город. Также они сыграли роль в удешевлении противораковых средств, цена которых обычно заоблачна. Реакция Судзуки легла в основу производства фунгицидов – консервантов для продуктов и новых антибиотиков. Методы, примененные этими учеными, позволяют получить органическую молекулу любой сложности, подобную натуральной.
- Катализ меняет скорость реакции не только в сторону увеличения (положительный катализ). Отрицательный катализ (ингибирование) замедляет скорость течения химической реакции.
- Процесс исследования источников энергии на основе водорода получил новый толчок при открытии учеными из группы Даниеля Носера (Daniel Nocera) в 2010 г. дешевых катализаторов расщепления воды, на основе распространенных в природе и дешевых (относительно драгметаллов) соединений никеля и бора. Водород является наиболее чистым в природоохранном отношении источником получения энергии.
Платина и катализ: история и современные тенденции в промышленном применении
Использование платины в качестве катализатора берет свое начало от 1820 г., когда Иоганн Дёберайнер продемонстрировал окисление водорода в присутствии катализатора. В 1831 г. Перегрин Филипс изобрел «процесс свинцовой камеры» для получения концентрированной серной кислоты каталитическим окислением оксида серы с помощью платинового катализатора. Это дало толчок развитию химической промышленности.
Платина – настоящий «мастер на все руки» в мире каталитиза. Она используется и для расщепления нефти на качественные топливные фракции (каталитический риформинг), и для удаления продуктов горения из воздуха доокислением. В автомобильной промышленности тройной катализатор из родия, платины и палладия используется для практически полного удаления продуктов сжигания углеводородов. Сначала на восстановительном катализаторе на платиновой основе осуществляется расщепление оксидов азота на кислород и азот, затем высвободившимся кислородом угарный газ (CO) доокисляется до относительно безвредного углекислого газа (СО2). Впервые каталитический конвертер был применен в автомобильной промышленности в 1975 г., что позволило убрать кислородные аппараты с улиц Токио, задыхавшегося от смога.
Известна проблема металлической ртути в дымовых газах, которая не может быть уловлена в мокром скруббере – основном оборудовании очистки дымовых газов. Каталитическое окисление на углеродном катализаторе в присутствии галогенов переводит ртуть в форму растворимого оксида, который удаляется вместе со стоками. Степень очистки от ртути данной технологией достигает 100 %. Проблемы: в до сих пор недостаточном понимании механизма окисления ртути и, как следствие, – нестабильности и относительно невысокой эффективности каталитического процесса.
Эмиссии ЛОС (летучих органических соединений) являются основным путем загрязнения атмосферы. Главные источники ЛОС – нефтехимические производства, автомобильный транспорт, разложение биокомпонентов, фармацевтика, производство тканей и пр. Наиболее распространенные ЛОС – это галогенные соединения, альдегиды, спирты, кетоны, ароматические углеводороды. Высокие концентрации ЛОС приводят к раздражениям слизистых, тошноте, головокружению и головным болям. Многие ЛОС канцерогенны для человека и животных. Некоторые ядовиты и даже смертельно опасны.
Наиболее распространенной технологией борьбы с выбросами ЛОС является каталитическое окисление, отличающееся широким спектром эффективности и относительно мягкими рабочими условиями. Недостатки каталитического окисления – дорогие и высокотехнологичные компоненты, использование драгоценных или дорогостоящих металлов: платины, золота, серебра, рутения, палладия, иридия и пр., и падение эффективности процесса в случае изменения условий его протекания – легко окупаются высокой степенью очистки и общей экономической эффективностью.
Недавняя совместная работа исследовательских групп Йонг Вана из Вашингтонского Университета, Школы химической инженерии и биоинженерии им. Джина и Линды Войланд и группы катализа Абхай К. Датье из Университета Нью-Мексико позволила получить катализатор, работающий в супершироком диапазоне температур от 150 до 750 °С, путем интеграции отдельных атомов платины в материал из оксида церия. Это позволит как справиться с пиковыми нагрузками, так и решить известную проблему «холодного старта», то есть большого количества загрязнителей, выбрасываемого при низкой температуре не разогретого процесса. Атомы платины при высокой температуре имеют тенденцию «сбиваться» в кластеры, тем самым уменьшая эффективность катализатора. Именно поэтому платиновые катализаторы следует периодически тестировать на эффективность удаления загрязнителей. Удержание атомов платины в оксиде церия противодействует процессу слипания атомов платины.
Ознакомиться с модельным рядом и заказать газоочистное оборудование можно в Каталоге каталитических установок SC. Специалисты компании ЗАО «БТ» ответят на все вопросы, касающиеся утилизации газовых выбросов, и помогут подобрать оптимальное технологическое решение, адаптированное под нужды конкретного объекта.
При использовании материала/любой его части (медиаконтента) ссылка на авторство и сайт (https://safecat.ru) обязательна.
Вернуться к спискуКаталитические процессы. Положительный и отрицательный катализ. Энергия активации каталитических реакций. Гомогенный, ферментативный и гетерогенный катализ.
Катализ – процесс, происходящий в присутствии катализатора.
Катализаторы — вещества, изменяющие скорость хим. реакции, вступающие в химическое взаимодействие с реагирующими веществами, а сами к концу реакции остающиеся химически неизменными и практически в неизменном количестве.
Катализаторы бывают:
1. положительные – повышают скорость химической реакции.
2. отрицательные – уменьшают скорость химической реакции (используют, что бы замедлить нежелательные реакции, например, коррозию металлов)
- Ингибиторы – вещества, ингибирующие (замедляющие) процесс. Например, в анатации лекарственных средств есть ингибирующие вещества.
- Антиокислители. Например, что бы масла не окислялись, то к ним добавляют антиокислители
- Антистарители – предотвращают старение многих полимеров (каучук)
В качестве катализаторов используют различные по агрегатному состоянию вещества, чаще твердые — металлы ( никель, железо, хром, платина), оксиды металлов ( оксид железа (3), оксид ванадия), некоторые соли (хлорид железа 3). Так же в качестве катализаторов используют жидкости – кислоты, и газы (оксид азота 2)
Автокаталитические реакции – реакции, в которых катализатором является один из продуктов (например, в окисление сульфата железа перманганатом калия в кислой среде, получаемая соль сульфата марганца является катализатором).
Катализаторы характеризуются избирательностью, специфичностью для данной реакции. Есть вещества, которые не являются катализаторами, но помогают активации катализаторов (промоутеры). Например, соли щелочных металлов активируют некоторые катализаторы. Есть вещества, которые замедляют действие катализатора — каталитические яды, например, оксид углерода 2.
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные корректировки и доработки. Узнайте стоимость своей работы.
Виды катализа:
1. гомогенный – катализатор и реагирующие вещества образуют гомогенную систему (либо все в растворе, либо все газы)
2. гетерогенный — катализатор и реагирующие вещества находятся в различных фазах
Например,
3Н2 + N2 Pt 2Nh4
3. ферментативный – в качестве катализатора выступает фермент:
2h3 O2 каталаза 2h3 O + O2
Теория гомогенного катализа:
Катализатор вступает в химическое взаимодействие с одним из реагирующих веществ, образуя непрочное промежуточное соединение, которое обладает высокой активностью. Это промежуточное соединение вступает во взаимодействие с другим веществом, а катализатор остается химически неизменным.
Без катализатора: А + В= АВ (большая Е0)
С участием катализатора:
1. К + А = АК (меньше Е0)
2. АК + В = АВ + К
Катализатор направляет реакцию по пути, которому соответствует меньшая энергия активации. В результате скорость реакции будет больше.
Теория гетерогенного катализа:
Общее, что происходит адсорбция реагирующих веществ на поверхности твердого катализатора. В результате адсорбции вещество концентрируется на небольшой поверхности, а его концентрация увеличивается. Следовательно, по закону действующих масс скорость реакции увеличивается. Не вся поверхность катализатора обладает активностью, а только активные центры катализатора. Роль активных центров могут выполнять атомы в узлах кристаллической решетки катализатора, или инородные включения. У разных авторов разные взгляды на природу активных центров.
Теория ферментативного катализа:
Без катализатора: в начале концентрация субстрата не меняется, потом плавно уменьшается и практически перестает уменьшаться.
Изменение скорости ферментативной реакции со временем: в начале скорость увеличивается, затем становится постоянной, и затем уменьшается.
Механизм:
S + E = SE, S – субстрат, Е – фермент, SE – промежуточное соединение,
SE = P+ E, Р – продукт
Энергия активации E каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора. Например, для некаталитического разложения Nh4 на N2 + Н2 E ~ 320 кДж/моль, для того же разложения в присутствии Pt Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими.
Поможем написать любую работу на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимостьУрок 42. движение как качественное изменение. химические реакции — Естествознание — 10 класс
Естествознание, 10 класс
Урок 42. Движение как качественное изменение. Химические реакции
Перечень вопросов, рассматриваемых в теме: Как во времени протекает химическая реакция? Что такое механизм химической реакции и как реакции можно классифицировать по механизму их протекания? Как определяется скорость химической реакции для различных процессов? Что такое кинетическое уравнение реакции и в чём его смысл? Как различные факторы влияют на скорость реакции? Каков механизм действия катализатора?
Глоссарий по теме:
Химическая кинетика – это раздел химической науки, изучающий механизм и скорость химической реакции.
Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем).
Закон действующих масс – при постоянной температуре скорость данной реакции пропорциональна произведению концентраций реагирующих веществ.
Механизм химической реакции – это последовательность элементарных стадий процесса, в результате которого исходные вещества превращаются в продукты реакции.
Энергия активации – это средняя избыточная энергия (по сравнению со средней энергией движения), которой должны обладать реагирующие частицы (атомы, молекулы), чтобы преодолеть энергетический барьер, разделяющий в химической реакции реагенты (исходные вещества) и продукты (конечное состояние).
Правило Вант-Гоффа – при повышении температуры на каждые 100 С скорость реакции увеличивается в среднем в 2 – 4 раза.
Катализ – это изменение скорости реакции под действием катализаторов.
Катализатор (от греч. katalysis – разрушение) – это вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
Ферменты (от лат. fermentum – закваска) – это вещества, катализирующие биохимические реакции в организмах.
Основная и дополнительная литература по теме урока:
1. Естествознание. 10 класс: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд. – М.: Просвещение, 2017. – С. 184-189.
2. Энциклопедия для детей. Том 17. Химия. / Глав. ред. В.А. Володин. – М.: Аванта+, 2000. – С. 116-126; 568-576.
3. Савинкина Е.В. История химии. Элективный курс: Учебное пособие / Е.В. Савинкина, Г.П. Логинов, С.С. Плоткин. – М.: БИНОМ. Лаборатория знаний, 2007. – С. 139-144.
Открытые электронные ресурсы по теме урока:
Левченков С.И. Химическая кинетика // Краткий очерк истории химии: Учебное пособие для студентов химфака РГУ. URL:
http://www.physchem.chimfak.rsu.ru/Source/History/Sketch_7.html#Кинетика
Теоретический материал для самостоятельного изучения
Многообразие объектов Вселенной отражается в многообразии видов и форм движения. Качественные изменения, которые происходят в ходе химических превращений, можно интерпретировать как особый вид движения, а саму химическую реакцию рассматривать как определенную химическую форму движения. Изучением того, как во времени протекают химические процессы, занимается химическая кинетика – область химической науки, становление которой началось со второй половины XIX века.
Химические процессы протекают с различной скоростью: бронзовый памятник во влажном воздухе медленно покрывается голубоватым налетом, значительно быстрее покрывается ржавчиной железный предмет, лежащий в воде, долька яблока через несколько часов покрывается бурой пленкой, а образование осадка при сливании растворов, например, сульфата натрия и хлорида бария, происходит очень быстро. Для количественной характеристики скорости химической реакции используют не время её протекания, а скорость изменения количества вещества (в моль), вступающего в реакцию или образующегося в ходе реакции. Таким образом, скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем). Напомним, что гомогенная система состоит из одной фазы, а гетерогенная система – из нескольких фаз, разграниченных между собой поверхностями раздела. Наиболее часто в химии рассматривается зависимость концентрации веществ от времени, поэтому скорость реакции можно определять как изменение концентрации одного из реагирующих веществ или одного из образующихся в ходе реакции веществ в единицу времени.
𝑣 = ± ∆с/∆t, где 𝑣 – скорость реакции, ∆с – изменение концентрации вещества, ∆t – промежуток времени, в котором определяют скорость реакции. Если скорость определяют по изменению концентрации реагирующего вещества, которая в ходе реакции уменьшается, то перед формулой ставят знак «–», если скорость определяется по изменению концентрации продукта реакции, которая в ходе реакции увеличивается, то перед формулой ставят знак «+». Скорость химической реакции изменяется во времени, поэтому по приведенной формуле можно вычислить только среднюю скорость реакции в определенном интервале времени. Графическое изображение зависимости концентрации реагентов от времени называется кинетической кривой. С помощью кинетической кривой можно графически определить истинную скорость реакции в каждый момент времени.
Чтобы управлять химической реакцией – замедлять или ускорять химические процессы, необходимо знать, от чего зависит скорость реакции. Особенно важно знать зависимость скорости реакции от концентрации реагирующих веществ. Впервые скорость химической реакции и её зависимость от концентрации исходных веществ исследовал немецкий химик Людвиг Фердинанд Вильгельми (1812 – 1864), изучая гидролиз сахарозы. В своей работе, опубликованной в 1850 году, он привел формулу, отражающую зависимость скорости реакции от концентрации реагирующих веществ – первое кинетическое уравнение химической реакции. В 1864 – 1867 гг. норвежские учёные Като Максимилиан Гульдберг (1836 – 1902) и Петер Вааге (1833 – 1900) опубликовали работы, в которых на основе сотен экспериментов доказали, что скорость реакции пропорциональна произведению «действующих масс» реагентов, т.е. (концентрациям). Таким образом, количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для некоторой реакции xA + yB → zD эта зависимость будет иметь вид: 𝑣 = k∙CAx∙CBy, где СА и СВ – молярные концентрации веществ А и В, k – коэффициент пропорциональности, называемый константой скорости химической реакции, численно равный скорости реакции при концентрации всех реагирующих веществ, равных 1 моль/л и определяемый экспериментально. Зависимость скорости реакции от концентрации реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Скорость гетерогенных реакций, протекающих на границе раздела фаз не зависит от концентрации. Как правило, при низких температурах скорость гетерогенных реакций зависит от площади поверхности раздела фаз и температуры.
Превращение одних веществ в другие не является одномоментным событием, – это сложный процесс, который развертывается во времени и пространстве. Еще в XIX веке учёные определили, что химические реакции в подавляющем большинстве являются многостадийными процессами. Последовательность элементарных стадий процесса, в результате которого исходные вещества превращаются в продукты реакции, называется механизмом реакции. По числу стадий реакции подразделяются на простые (элементарные) и сложные. Простые реакции осуществляются в одну стадию, химическое уравнение таких реакций полностью отражает какие и сколько частиц участвуют непосредственно в элементарном акте химического взаимодействия. В реакциях изомеризации или диссоциации, например, происходит химическое превращение одной молекулы. Есть простые реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или разных) или даже трёх частиц. Сложные реакции осуществляются в несколько стадий, каждая из которых является простой реакцией. Каждая из стадий протекает со своей скоростью. Скорости отдельных стадий могут существенно отличаться друг от друга. Скорость сложной реакции в целом будет определяться скоростью самой медленной стадии, которая называется лимитирующей. Механизмы химических реакций определяются экспериментально.
Скорость химической реакции зависит от температуры. Впервые влияние температуры на скорость реакции было учтено Якобом Генриком Вант-Гоффом (1852 – 1911), им было сформулировано эмпирическое правило (правило Вант-Гоффа): при повышении температуры на каждые 10°С скорость реакции увеличивается в 2 – 4 раза. Однако это правило носит приближенный характер и применимо лишь в узком интервале температур. Более точно зависимость скорости химической реакции от температуры была определена шведским химиком Сванте Августом Аррениусом (1859 – 1927), он ввёл понятие энергии активации и сформулировал закон температурной зависимости для константы скорости простых реакций.
Многие химические процессы в растворе или газовой фазе происходят при столкновении частиц реагирующих веществ. Число таких соударений огромно. Если бы все соударения частиц приводили к химическому взаимодействию, то реакции протекали бы мгновенно, однако этого не происходит. Это объясняется тем, что не все соударения приводят к химическому взаимодействию. Чтобы соударение было эффективным (привело к химическому взаимодействию) столкнувшиеся частицы должны обладать достаточной энергией для разрыва или ослабления химических связей в молекулах реагирующих веществ. В результате происходит образование некоторого промежуточного неустойчивого комплекса (активированного комплекса) с последующим перераспределением электронной плотности и образованием продуктов реакции. Средняя избыточная энергия (по сравнению со средней энергией движения), которой должны обладать реагирующие частицы (атомы, молекулы), чтобы преодолеть энергетический барьер, разделяющий в химической реакции реагенты (исходные вещества) и продукты (конечное состояние) называется энергией активации. Так как при повышении температуры доля частиц, обладающих избыточной энергией увеличивается, то увеличивается и число эффективных соударений и, следовательно, константа скорости реакции.
На скорость реакции могут оказывать влияние вещества, которые получили название катализаторов. Еще с начала XIX века химики обратили внимание на необычные химические реакции, для протекания которых требовалось добавление некоторых веществ. Эти вещества в реакциях не расходовались, но без их добавления реакции не протекали. В 1835 году все известные на тот момент каталитические исследования обобщил шведский химик Йёнс Якоб Берцелиус (1779 – 1848), он же первым использовал термин «катализ» (от греч. katalysis – разрушение). Однако, механизм влияния этих добавок был непонятен химикам XIX века. Только в самом конце XIX века немецкий химик Вильгельм Фридрих Оствальд (1853 – 1932) сумел дать современные определения катализа и катализатора. Появление современных теорий катализа относится к 20-м годам XX века. Первой из них была мультиплетная теория, которую разработал российский химик Алексей Александрович Баландин (1898 – 1967).
Катализаторы – это вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся. Изменение скорости реакции под действием катализаторов называют катализом. Известны различные виды катализа. Катализ может быть положительным – увеличивать скорость реакции, или отрицательным – уменьшать скорость реакции. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, замедляющие течение реакции – ингибиторами. Катализ, при котором катализатор образует одну фазу с реагирующими веществами, называют гомогенным катализом. Если катализатор образует самостоятельную фазу и реакция происходит на поверхности катализатора, то катализ называется гетерогенным катализом. Хорошо известный Вам из школьного курса процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 (2SO2 + O2 = 2SO3 + Q) можно проводить с использованием разных катализаторов.
В начале XX века этот процесс осуществляли в газовой фазе с использованием оксида азота (II) NO в качестве катализатора – это пример гомогенного катализа. Если в качестве катализатора использовать оксид ванадия (V) V2O5, который является твердым веществом, то реакция протекает на его поверхности – это пример гетерогенного катализа. Гетерогенный катализ может быть усилен добавлением промоторов – веществ, которые сами не являются катализаторами, но повышают активность катализатора данной реакции. Так, для синтеза аммиака, идущего с использование железного катализатора, используется добавление оксидов алюминия и калия. Однако, есть вещества, которые наоборот снижают активность катализатора. Такие вещества называются каталитическими ядами. Так, например, платиновый катализатор очень чувствителен по отношению к соединениям серы и селена.
Важными свойствами катализаторов является их специфичность и селективность. Под специфичностью катализатора понимается его способность ускорять только какую-то одну группу реакций и никак не влиять на скорость других реакций. Хорошо известный Вам пример: платина Pt и никель Ni являются катализаторами процессов гидрирования. Другое свойство катализаторов – селективность (избирательность) заключается в способности катализаторов ускорять только одну из возможных при данных условиях параллельных реакций. На этом свойстве катализаторов основаны способы получения разных продуктов из одних и тех же исходных веществ. Например, из этилового спирта C2H5OH в присутствии оксида алюминия Al2O3 получают этилен CH2=CH2, а в присутствии меди Cu – уксусный альдегид CH3COH. Наибольшей селективностью отличаются биологические катализаторы белковой природы – ферменты. Кроме того, ферменты обладают высокой активностью, что объясняется значительным снижением энергии активации биохимического процесса ферментами.
В чем же заключается действие катализатора? Оказывается, катализаторы снижают энергию активации реакции, в результате чего увеличивается число частиц, обладающих энергией, достаточной для химического взаимодействия. Катализаторы участвуют в образовании активированного комплекса, требующего меньшей энергия активации.
Таким образом, превращение одних веществ в другие – это процесс, развертывающийся во времени, т. е. имеющий свою временную структуру, которая выражена механизмом реакции. Вместе с тем механизм реакции учитывает не только изменения в составе веществ-участников реакции, но и изменение положений атомов в пространстве по мере протекания реакции. Поэтому можно говорить о пространственно-временной структуре реакции. Любое превращение одних веществ в другие, т.е. химическую реакцию, можно рассматривать как качественное изменение и особую форму движения.
Выводы:
1. Скорость химической реакции определяется изменением количества реагирующих веществ или продуктов реакции за единицу времени в единице объёма (для гомогенных систем) или на единице поверхности (для гетерогенных систем).
2. На скорость реакции оказывают влияние: природа реагирующих веществ, их концентрация (для гомогенных систем), площадь поверхности (для гетерогенных систем), температура и наличие катализатора.
3. Количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
4. Большинство химических реакций являются многостадийными процессам, механизм которых определяется экспериментально. Под механизмом химической реакции понимают последовательность элементарных стадий процесса, в результате которых исходные вещества превращаются в продукты реакции.
5. Многие химические реакции являются каталитическими, т.е. для их осуществления необходимы катализаторы – вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся.
6. Химическая реакция – имеет сложную пространственно-временную структуру, что позволяет её рассматривать не только как качественное изменение веществ, но и особую форму движения.
Примеры и разбор решения заданий тренировочного модуля:
1. Укажите верные утверждения:
Утверждение | Правильный ответ и пояснение |
А. Химическое уравнение не отражает механизм протекания реакции. | Правильное утверждение. Химическое уравнение не отражает механизм протекания реакции, механизм реакции определяется экспериментально. |
Б. Катализатор ускоряет реакцию, но сам в реакции не участвует. | Неправильное утверждение. Катализаторы – вещества, изменяющие скорость реакции, участвующие в промежуточных стадиях реакции, но при этом не расходующиеся. |
В. Закон действующих масс выражает количественную зависимость скорости реакции от концентрации реагирующих веществ. | Правильное утверждение. Количественно зависимость между скоростью реакции и концентрацией определяется основным законом химической кинетики – законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях. |
2. Установление соответствие между элементами двух множеств. К каждой позиции первого столбца подберите соответствующую позицию второго.
Утверждение | Теория |
1. Процесс гидрирования этилена СН2=СН2 c использованием никеля Ni в качестве катализатора. | А. Гомогенный катализ Б. Гетерогенный катализ |
2. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида азота (II) NO в качестве катализатора. | |
3. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида ванадия (V) V2O5 в качестве катализатора. |
Правильный ответ:1 – Б; 2 – А; 3 – Б.
Утверждение | Теория |
1. Процесс гидрирования этилена СН2=СН2 c использованием никеля Ni в качестве катализатора. | Б. Гетерогенный катализ |
2. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида азота (II) NO в качестве катализатора. | А. Гомогенный катализ |
3. Процесс получения оксида серы (VI) SO3 из оксида серы (IV) SO2 с использованием оксида ванадия (V) V2O5 в качестве катализатора. | Б. Гетерогенный катализ |
Катализ — HimHelp.ru
Увеличить скорость реакции можно с помощью катализаторов. Применять катализаторы выгоднее, чем повышать температуру, тем более, что ее повышение далеко не всегда возможно.
Катализаторами называются вещества, изменяющие скорость химических реакций.
Одни катализаторы сильно ускоряют реакцию – положительный катализ, или просто катализ, другие – замедляют – отрицательный катализ. Примерами положительного катализа могут служить получение серной кислоты, окисление аммиака в азотную кислоту с помощью платинового катализатора и др. Примерами отрицательного катализа являются замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта или уменьшение скорости разложения пероксида водорода в присутствии небольших количеств серной кислоты (0,0001 мас. частей) и др. Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, – ингибиторами (механизм действия последних отличен от действия катализаторов).
Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Каталитическое воздействие может быть оказано на большинство химических реакций. Число катализаторов очень велико, а их каталитическая активность весьма различна. Она определяется изменением скорости реакции, вызываемым катализатором.
Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему – газовую или жидкую, между катализатором и реагирующими веществами отсутствует поверхность раздела. Например, каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – газы или жидкости. Примерами могут служить окисление аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или оксида марганца (IV) (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава, строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, – к снижению высоты энергетического барьера.
При этом образуется активированный комплекс с более низким уровнем энергии и скорость реакции сильно возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А + В = АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
А + К = АК
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор высвобождается:
АК + В = АВ + К
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение быстро протекающей реакции:
А + В = АВ
Приведем конкретный пример – окисление SО2 в SО3 с участием катализатора NO:
SO2 + ½O2 = SO3
A + B = AB
Эта реакция протекает медленно. Но при введении катализатора образуется промежуточное соединение:
NO + ½ O2 = NO2
K + B = KB
и далее
SO2+ NO2 = SO3 + NO
А + КВ = АВ + К
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. А это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. И в этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы. В производственных условиях реагирующие вещества подвергают очистке от каталитических ядов, а уже отравленные катализаторы регенерируют.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому, применяя разные катализаторы, можно получить из одного и того же вещества разные продукты. Так, например, в присутствии катализатора оксида алюминия Аl2О3 при 300° С из этилового спирта получают воду и этилен:
С2Н5ОН → Н2О + С2Н4
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
«Отрицательный» и «положительный катализ»: дополнительные принципы, которые формируют каталитический ландшафт ферментов
Обзор
DOI: 10.1016 / j.cbpa.2018.09.013. Epub 2018 27 сентября.Принадлежности Расширять
Принадлежности
- 1 Институт земной микробиологии им. Макса Планка, отдел биохимии и синтетического метаболизма, Karl-von-Frisch-Str.10, D-35043 Марбург, Германия.
- 2 Институт земной микробиологии им. Макса Планка, отдел биохимии и синтетического метаболизма, Karl-von-Frisch-Str. 10, D-35043 Марбург, Германия; Центр синтетической микробиологии LOEWE (SYNMIKRO), Марбург, Германия. Электронный адрес: [email protected].
Элемент в буфере обмена
Обзор
Bastian Vögeli et al.Curr Opin Chem Biol. Декабрь 2018 г.
Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
DOI: 10.1016 / j.cbpa.2018.09.013. Epub 2018 27 сентября.Принадлежности
- 1 Институт земной микробиологии им. Макса Планка, отдел биохимии и синтетического метаболизма, Karl-von-Frisch-Str. 10, D-35043 Марбург, Германия.
- 2 Институт земной микробиологии им. Макса Планка, отдел биохимии и синтетического метаболизма, Karl-von-Frisch-Str. 10, D-35043 Марбург, Германия; Центр синтетической микробиологии LOEWE (SYNMIKRO), Марбург, Германия. Электронный адрес: [email protected].
Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
В нашем понимании ферментного катализа доминирует теория переходного состояния.Согласно этой концепции, ферментативная реакция направляется по желаемой координате реакции через стабилизацию благоприятного переходного состояния. Но насколько результат ферментативной реакции контролируется дестабилизацией нежелательных переходных состояний? Здесь мы возродим и критически рассмотрим гипотезу о том, что активный центр ферментов также содержит элементы «отрицательного катализа». Мы приводим примеры, которые показывают, что ферментативный катализ может быть достигнут за счет комбинированного действия положительных и отрицательных ограничений на активный центр фермента.Этот комплексный взгляд на ферментный катализ имеет прямые последствия для наших исследований каталитического ландшафта ферментов, а также для текущих усилий в области ферментной инженерии и дизайна ферментов de novo.
Авторские права © 2018. Издано Elsevier Ltd.
Похожие статьи
-
Ферментный катализ: не иначе, просто лучше.
Ноулз-младший. Ноулз-младший. Природа. 1991 14 марта; 350 (6314): 121-4. DOI: 10.1038 / 350121a0. Природа. 1991 г. PMID: 2005961 Рассмотрение.
-
Специфика привязки переходного состояния: новый взгляд на модель Полинга.
Эмис Т.Л., Ричард Дж.П. Эмис Т.Л. и др. Биохимия. 2013 26 марта; 52 (12): 2021-35. DOI: 10.1021 / bi301491r. Epub 2013 4 февраля.Биохимия. 2013. PMID: 23327224 Бесплатная статья PMC. Рассмотрение.
-
Дизайн ферментов de novo с использованием Rosetta3.
Рихтер Ф., Ливер-Фэй А., Кхаре С.Д., Бьелич С., Бейкер Д. Richter F, et al. PLoS One. 2011; 6 (5): e19230. DOI: 10.1371 / journal.pone.0019230. Epub 2011 16 мая. PLoS One. 2011 г. PMID: 21603656 Бесплатная статья PMC.
-
Прецизионность важна для эффективного катализа в усовершенствованной элиминазе Кемп.
Бломберг Р., Крис Х., Пинкас Д.М., Миттл ПР, Грюттер М.Г., Приветт Х.К., Майо С.Л., Хилверт Д. Бломберг Р. и др. Природа. 2013 21 ноября; 503 (7476): 418-21. DOI: 10,1038 / природа12623. Epub 2013 16 октября. Природа. 2013. PMID: 24132235
-
Дизайн биомиметических катализаторов методом молекулярного импринтинга в синтетических полимерах: роль стабилизации переходного состояния.
Вульф Дж., Лю Дж.Wulff G, et al. Acc Chem Res. 2012 21 февраля; 45 (2): 239-47. DOI: 10.1021 / ar200146m. Epub 2011 3 октября. Acc Chem Res. 2012 г. PMID: 21967389
Процитировано
3 статей-
Количество каталитических циклов в жизни фермента и почему это важно для метаболической инженерии.
Хансон А.Д., Маккарти Д.Р., Генри К.С., Ксиан Х, Джоши Дж., Паттерсон Дж. А., Гарсия-Гарсия Дж. Д., Флейшманн С. Д., Тивендейл Н. Д., Миллар А. Х. Hanson AD, et al. Proc Natl Acad Sci U S A. 2021 30 марта; 118 (13): e2023348118. DOI: 10.1073 / pnas.2023348118. Proc Natl Acad Sci U S A. 2021. PMID: 33753504 Бесплатная статья PMC.
-
Пробуждение ферментов спящей карбоксилазной функции: разработка природного CO 2 -связывающего потенциала редуктаз.
Bernhardsgrütter I, Schell K, Peter DM, Borjian F, Saez DA, Vöhringer-Martinez E, Erb TJ. Bernhardsgrütter I, et al. J Am Chem Soc. 26 июня 2019 г .; 141 (25): 9778-9782. DOI: 10.1021 / jacs.9b03431. Epub 2019 14 июня. J Am Chem Soc. 2019. PMID: 31188584 Бесплатная статья PMC.
-
Назад в будущее: зачем нам энзимология, чтобы построить синтетический метаболизм будущего.
Erb TJ. Erb TJ. Beilstein J Org Chem. 2019 26 февраля; 15: 551-557. DOI: 10.3762 / bjoc.15.49. Электронная коллекция 2019. Beilstein J Org Chem. 2019. PMID: 30873239 Бесплатная статья PMC. Рассмотрение.
Типы публикаций
- Поддержка исследований, за пределами США. Правительство
Условия MeSH
- Оксидоредуктазы, действующие на доноров группы CH-CH / химия
- Оксидоредуктазы, действующие на доноров группы CH-CH / метаболизм
- Триозофосфат-изомераза / химия
- Триозо-фосфат-изомераза / метаболизм
Вещества
- Оксидоредуктазы, действующие на доноров группы CH-CH
- транс-2-еноил-КоА редуктаза (НАДФН)
- таксоны-4 (5), 11 (12) -диен-синтаза
- Триозофосфат изомераза
цитировать
КопироватьФормат: AMA APA ГНД NLM
Что такое положительные катализаторы и отрицательные катализаторы 11 класса химии CBSE
Подсказка: Положительные катализаторы увеличивают скорость реакции и уменьшают энергию активации, тогда как отрицательные катализаторы замедляют реакцию до завершения. Полный ответ:
Чтобы ответить на наш вопрос, нам необходимо знать о катализаторах. Каждая химическая реакция имеет определенную скорость, некоторые реакции происходят быстро, например, реакция натрия с водой, тогда как некоторые реакции происходят очень медленно, например, ржавление железа. Катализаторы — это вещества, которые при добавлении в реакцию изменяют скорость реакции, она может либо ускорять, либо замедлять. Однако сам катализатор не расходуется в ходе реакции. Катализаторы существуют в твердой, жидкой и газообразной формах.{0}} C $.
\ [KCl {{O} _ {3}} \ xrightarrow {MnO} KCl + {{O} _ {2}} \]
Отрицательные катализаторы противоположны положительным катализаторам. Они снижают общую скорость химической реакции. Примером отрицательного катализатора является фосфорная кислота, которую можно использовать для уменьшения скорости разложения перекиси водорода.
\ [{{H} _ {2}} {{O} _ {2}} \ xrightarrow {{{H} _ {3}} P {{O} _ {4}}} {{H} _ { 2}} O + {{O} _ {2}} \]
Катализаторы создают альтернативный путь протекания реакции, следовательно, они несут ответственность за изменение скорости реакции.
Примечание:
Катализ происходит как в природе, так и в организме человека. У нас есть катализаторы в виде ферментов, которые помогают нам переваривать пищу.
Вы в одном шаге от ответа!
Подпишитесь бесплатно!
Регистрируясь, вы также получаете БЕСПЛАТНЫЙ доступ к тысячам решенных вопросов, викторин
и загружаемым PDF-файлам!
О катализе —- Институт химической физики Ланьчжоу Китайской академии наук
1.Определение катализа
Катализ — это процесс, при котором скорость химической реакции увеличивается или уменьшается с помощью химического вещества, известного как катализатор. В отличие от других реагентов, которые участвуют в химической реакции, катализатор не расходуется в самой реакции. Катализатор может участвовать во множестве химических превращений. Катализаторы, ускоряющие реакцию, называются положительными катализаторами. Катализаторы, замедляющие реакцию, называются отрицательными катализаторами или ингибиторами.Вещества, повышающие активность катализаторов, называются промоторами, а вещества, дезактивирующие катализаторы, называются каталитическими ядами. Например, при восстановлении этина до этена катализатором является палладий (Pd), частично «отравленный» ацетатом свинца (II) (Pb (Ch4COO) 2). Без дезактивации катализатора производимый этен будет далее восстанавливаться до этана. [1] [2]
| Твердые гетерогенные катализаторы, такие как автомобильные каталитические нейтрализаторы, наносятся на структуры, спроектированные таким образом, чтобы максимально увеличить площадь их поверхности. |
Общая особенность катализа заключается в том, что каталитическая реакция имеет более низкое ограничение скорости изменения свободной энергии в переходное состояние, чем соответствующая некаталитическая реакция, что приводит к большей скорости реакции при той же температуре. Однако механистическое происхождение катализа сложно. Катализаторы могут благоприятно влиять на реакционную среду, например кислотные катализаторы для реакций карбонильных соединений, образуют определенные промежуточные продукты, которые не образуются естественным образом, такие как сложные эфиры осмата при дигидроксилировании алкенов, катализируемом тетроксидом осмия, или вызывают лизис реагентов до реакционноспособных форм, таких как атомарный водород, при каталитическом гидрировании.
Кинетически каталитические реакции ведут себя как типичные химические реакции, т.е. скорость реакции зависит от частоты контакта реагентов на стадии, определяющей скорость. Обычно катализатор участвует в этой медленной стадии, и скорость ограничена количеством катализатора. В гетерогенном катализе диффузия реагентов к поверхности и диффузия продуктов с поверхности могут быть определяющими. Аналогичные события, связанные со связыванием субстрата и диссоциацией продукта, применимы к гомогенным катализаторам.
Хотя катализаторы не расходуются в ходе самой реакции, они могут быть ингибированы, дезактивированы или разрушены вторичными процессами. При гетерогенном катализе типичные вторичные процессы включают коксование, при котором катализатор покрывается побочными полимерными продуктами. Кроме того, гетерогенные катализаторы могут растворяться в растворе в системе твердое тело-жидкость или испаряться в системе твердое тело-газ.
2. Общие принципы катализа
Типовой механизм
Катализ и энергия реакции
Типичные каталитические материалы
3.Типы катализа
Гетерогенные катализаторы
Гомогенные катализаторы
Электрокатализаторы
Органокатализ
4. Значение катализа
Переработка энергии
Массовые химикаты
Тонкие химикаты
Пищевая промышленность
Биология
В окружающей среде
Артикул:
[1] W.P. Дженкс, «Катализ в химии и энзимологии», Макгроу-Хилл, Нью-Йорк, 1969. ISBN 0070323054
[2] Майрон Л. Бендер, Макото Комияма, Раймонд Дж. Бержерон «Биоорганическая химия ферментативного катализа» Wiley-Interscience, Хобокен, штат Вашингтон.С., 1984 ISBN 0471059919
(Источник: http://en.wikipedia.org)
17.6: Катализаторы и катализатор — Chemistry LibreTexts
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи, представленные выше. Особенно важно, чтобы вы знали точное значение всех выделенных зеленым цветом терминов в контексте этой темы.
- Что такое катализаторы и как они действуют, изменяя параметры реакции?
- Опишите сходства и различия между тремя основными классами катализаторов.
- Определите физическую сорбцию , и хемосорбцию , и объясните роль последней в инициировании каталитического события.
- В чем смысл и значение Принцип Сабатье ?
- Каковы принципиальные различия между механизмами гетерогенного катализа Ленгмюра-Хиншелвуда и Элея-Ридела ?
- Опишите роль фермент-субстратного комплекса .
- Каким образом особые свойства аминокислот , окружающих активный центр фермента, могут способствовать его каталитическому эффекту?
- Опишите модели действия ферментов с замком и ключом, и , вызванные соответствием .
- Объясните функцию и значение аллостерических сайтов на ферменте.
Это почти похоже на волшебство! Смесь газообразных H 2 и O 2 может сосуществовать неопределенно долго без какой-либо обнаруживаемой реакции, но если платиновая проволока нагревается, а затем погружается в газовую смесь, реакция протекает мягко, так как выделяющееся при реакции тепло заставляет проволоку светиться докрасна.Катализаторы играют важную роль в нашей современной индустриальной экономике, в заботе об окружающей среде и во всех биологических процессах. Этот урок познакомит вас с удивительным миром катализаторов и поможет понять, что они из себя представляют и как работают.
Что такое катализаторы?
Катализаторы не влияют на константу равновесия и, следовательно, на равновесный состав. Катализаторы — это вещества, которые ускоряют реакцию, но не потребляются ею и не фигурируют в итоговом уравнении реакции.Также — и это очень важно — катализаторы одинаково влияют на прямую и обратную скорости ; это означает, что катализаторы не влияют на константу равновесия и, следовательно, на состав состояния равновесия. Таким образом, катализатор (в данном случае серная кислота) может быть использован для ускорения обратимой реакции, такой как образование сложного эфира или его обратный гидролиз сложного эфира:
Рисунок \ (\ PageIndex {1} \): Реакции, катализируемые кислотойКатализатор не влияет на константу равновесия или направление реакции.Направление можно контролировать, добавляя или удаляя воду (принцип Ле Шателье).
Катализаторы функционируют, позволяя реакции протекать через альтернативный механизм, требующий меньшей энергии активации. Это изменение вызвано особым взаимодействием между катализатором и компонентами реакции. Вы помните, что константа скорости реакции является экспоненциальной функцией энергии активации, поэтому даже небольшое уменьшение \ (E_a \) может дать впечатляющее увеличение скорости.
Катализаторы обеспечивают альтернативные пути реакции
Катализаторы условно делятся на две категории: гомогенные и гетерогенные . Ферменты , природные биологические катализаторы, часто включаются в первую группу, но поскольку они обладают некоторыми свойствами обоих, но обладают некоторыми очень особыми свойствами, мы будем рассматривать их здесь как третью категорию.
Некоторые общие примеры катализа
Как сжечь сахарный кубик
При нагревании кусочек сахара (сахароза) плавится при 185 ° C, но не горит.Но если натереть кубик сигаретным пеплом, он сгорит перед расплавлением из-за каталитического действия следов соединений металлов в золе.
Платина как катализатор окисления
Поверхность металлической платины является эффективным катализатором окисления многих паров топлива. Это свойство используется в беспламенных походных печах (слева). Изображение справа показывает светящуюся платиновую проволоку, нагретую за счет медленного горения аммиака на ее поверхности. Однако, если окунуть нагретую Pt проволоку в жидкий аммиак , произойдет миниатюрный взрыв: см. Видео ниже.{–1} \]
В отсутствие примесей эта реакция протекает очень медленно, но различные вещества, начиная от йода, оксидов металлов и следовых количеств металлов, значительно ускоряют реакцию, в некоторых случаях почти взрывоопасно из-за быстрого выделения тепла. Наиболее эффективным катализатором из всех является фермент каталаза , присутствующий в крови и внутриклеточных жидкостях; добавление капли крови к раствору 30% перекиси водорода вызывает бурную реакцию.
Быстрое высвобождение O 2 может привести к эффектной пены для ванны, если добавить немного мыла.[Эта же реакция использовалась для запуска гоночного автомобиля!
Иодид калия эффективно катализирует осаждение H 2 O 2 . В этом коротком видео показано, что происходит при объединении цветного мыла, H 2 O 2 и KI. Но «не пробуйте это у себя дома»!
Каждый тип катализатора способствует разному пути со своей собственной энергией активации. Поскольку скорость является экспоненциальной функцией от E a (уравнение Аррениуса), даже относительно небольшие различия в E a могут иметь драматическое влияние на скорость реакции.Обратите особое внимание на значения для каталазы; химик по-прежнему остается непрофессионалом по сравнению с тем, что природа может сделать с помощью естественного отбора!
| катализатор |
Ea |
относительный коэффициент |
|---|---|---|
| без катализатора | 75 | 1 |
| иодид-ион | 56 | 2140 |
| платина коллоидная | 50 | 24 000 |
| каталаза (фермент) | 21 | 2 900 000 000 |
Как выражается каталитическая активность
Изменения константы скорости или энергии активации — очевидные способы измерения эффективности катализатора.Но вошли в употребление два других термина, которые имеют особое значение в промышленных приложениях.
Оборотный номер
Число оборотов (TON) — это среднее количество циклов, которое катализатор может пройти до того, как его характеристики ухудшатся (см.). Зарегистрированные значения TON для обычных промышленных катализаторов охватывают очень широкий диапазон от 10 до 10 5 , что приближается к пределам диффузионного переноса.
Частота оборота
Этот термин, который первоначально применялся к реакциям, катализируемым ферментами, вошел в более широкое употребление.Это просто количество раз, когда общая каталитическая реакция происходит на катализатор (или на активный центр на ферменте или гетерогенном катализаторе) в единицу времени: определяется как
Число активных центров S на гетерогенном катализаторе часто трудно оценить, поэтому его часто заменяют общей площадью открытого катализатора, которую обычно можно измерить экспериментально. TOF для гетерогенных реакций обычно находится в диапазоне от 10 –2 до 10 2 с –1 .
Гомогенный катализ
Как следует из названия, гомогенные катализаторы присутствуют в той же фазе (газ или жидкий раствор), что и реагенты. Гомогенные катализаторы обычно вступают непосредственно в химическую реакцию (путем образования нового соединения или комплекса с реагентом), но высвобождаются в исходной форме после завершения реакции, так что они не появляются в итоговом уравнении реакции.
Катализируемая йодом
Цис-транс ИзомеризацияЕсли вы не изучаете курс органической химии, на котором ваш инструктор указывает иное, не пытайтесь запоминать эти механизмы .Они представлены здесь с целью убедить вас, что катализ — это не черная магия, и познакомить вас с некоторыми особенностями каталитических механизмов. Вам должно быть достаточно просто убедить себя, что отдельные шаги имеют химический смысл.
Как вы помните, цис-транс-изомерия возможна, когда атомы, связанные с каждым из двух атомов углерода с двойной связью, могут находиться на одной ( цис, ) или противоположных ( транс, ) сторонах связи.Это отражает тот факт, что вращение вокруг двойной связи невозможно.
Превращение алкена между его формами цис — и транс может происходить только в том случае, если двойная связь временно разорвана, что позволяет двум концам вращаться. Процессы, расщепляющие ковалентные связи, имеют высокую энергию активации, поэтому реакции цис-транс-изомеризации имеют тенденцию быть медленными даже при высоких температурах. Йод является одним из нескольких катализаторов, которые значительно ускоряют этот процесс, поэтому изомеризация бутена служит хорошим вводным примером гомогенного катализа.
Считается, что механизм реакции, катализируемой йодом, включает атаку атомов йода (образованных равновесием диссоциации на одном из атомов углерода на этапе:
За время своего недолгого существования активированный в свободном состоянии комплекс может вращаться вокруг связи С — С, так что, когда он разлагается с высвобождением йода (), часть восстановленного бутена будет в его форме транс . Наконец, атом йода рекомбинирует в дийод.Поскольку процессы и нейтрализуются, йод не появляется в общем уравнении реакции — требование для настоящего катализатора.
Кислотно-щелочной катализ
Многие реакции катализируются присутствием кислоты или основания; во многих случаях и кислоты, и основания катализируют одну и ту же реакцию. Как и следовало ожидать, механизм включает добавление или удаление протона, превращая реагент в более кинетически лабильную форму. Простым примером является добавление йода к пропанону
.I 2 + (CH 3 ) 2 –C = O → (CH 2 I) (CH 3 ) –C = O
Механизм кислотно-катализируемого процесса включает несколько этапов.Роль кислоты заключается в обеспечении протона, который присоединяется к карбонильному кислороду, образуя нестабильный ион оксония. Последний быстро перестраивается в енол (т.е. углерод, связанный как с двойной связью ( ен ), так и с гидроксильной ( ol ) группой). Это завершает каталитическую часть процесса, которая в основном представляет собой кислотно-основную группу. (перенос протона) реакция, в которой роль протона состоит в том, чтобы отнимать электрон от кислорода кетона.
На второй стадии енол реагирует с йодом.Изогнутые стрелки указывают на сдвиги в расположении электронов. Ниже электрон отводится с π-орбитали двойной связи одним из атомов молекулы I 2 . Это вызывает сдвиг электронов в последнем, в результате чего половина этой молекулы выбрасывается в виде иодид-иона. Другая половина йода теперь представляет собой ион йодония I + , который вытесняет протон одной из метильных групп. Образовавшийся ион карбония затем вытесняет протон -ОН с получением конечного нейтрального продукта.
Возможно, наиболее известной реакцией, катализируемой кислотой, является гидролиз (или образование) сложного эфира — реакция, с которой большинство студентов сталкивается в лабораторных курсах органической химии. Это более сложный процесс, состоящий из пяти шагов; его механизм обсуждается здесь. См. Также этот сайт У. Калгари, который описывает реакцию, катализируемую как кислотой, так и основанием.
Окислительно-восстановительный катализ
Многие реакции окисления-восстановления (переноса электрона), включая прямое окисление молекулярным кислородом, протекают довольно медленно.{2 +}} \]
Эта реакция катализируется либо Cu + , либо Cu 3+ , и скорость пропорциональна концентрации V 3+ и иона меди, но не зависит от концентрации Fe 3+ . Считается, что этот механизм состоит из двух этапов:
| 1 V 3+ + Cu 2+ V 4+ + Cu + | (нормоопределение) |
| 2 Fe 3+ + Cu + Fe 2+ + Cu 2+ | (очень быстро) |
(Если в качестве катализатора используется Cu + , он сначала окисляется до Cu 2+ на стадии 2.+ \]
Катализаторы гетерогенные
Как следует из названия, гетерогенный катализатор существует как отдельная фаза (почти всегда твердая) от фазы (чаще всего газа), в которой происходит реакция. Каталитический эффект возникает из-за разрушения (часто приводящего к диссоциации) молекул реагента, вызванного их взаимодействием с поверхностью катализатора.
← Модель катализатора, состоящего из кластеров из 8-10 атомов платины (синий цвет), нанесенных на поверхность оксида алюминия.Этот катализатор эффективно удаляет атомы водорода из пропана, превращая его в промышленно важный пропилен. [источник]
Неуравновешенные силы на поверхностях
Как вы помните, одно универсальное свойство материи — это слабые силы притяжения, которые возникают, когда две частицы близко подходят друг к другу. (См. Здесь для быстрого обзора.) Когда частицы имеют противоположные электрические заряды или вступают в ковалентную связь, это гораздо более сильное притяжение доминирует и определяет «химию» взаимодействующих частиц.
Молекулярные единицы в объеме твердого тела связаны со своими соседями посредством этих сил, которые действуют в противоположных направлениях, чтобы удерживать каждую под своего рода «натяжением», которое ограничивает ее движение и способствует связности и жесткости твердого тела.
На поверхности любого конденсированного вещества все обстоит иначе. Атомы или молекулы, которые находятся на поверхности, испытывают несбалансированные силы, которые не позволяют им принимать такие же низкие потенциальные энергии, которые характерны для внутренних единиц.(То же самое происходит с жидкостями и вызывает множество межфазных эффектов, таких как поверхностное натяжение.)
Но в случае твердого тела, в котором силы притяжения имеют тенденцию быть сильнее, происходит нечто гораздо более значительное. Молекулярные единицы, которые находятся на поверхности, можно рассматривать как частично погруженные в нее, а их выступающие части (и возникающие из них межмолекулярные притяжения) открыты для внешнего мира. Сила притягивающего силового поля, исходящего от твердой поверхности, варьируется в зависимости от природы атомов или молекул, составляющих твердое тело.
Не путайте сорбцию d с сорбцией b ; последнее относится к массовому поглощению вещества внутри пористого материала. На микроскопическом уровне, конечно, поглощение также связано с адсорбцией. Процесс, при котором молекулы газа или жидкости вступают в контакт и прикрепляются к твердой поверхности, известен как адсорбция , . Адсорбция почти всегда является экзотермическим процессом, и ее сила обычно выражается энтальпией или «теплотой» адсорбции Δ H адс .
Хемосорбция и физическая сорбция
Обычно различают две общие категории адсорбции, в зависимости от степени воздействия на электронную или связывающую структуру присоединенной молекулы. Когда силы притяжения возникают из-за относительно слабых ван-дер-ваальсовых взаимодействий, такой эффект невелик, и Δ H ad имеет тенденцию быть малым. Это состояние описывается как физическая адсорбция , (физическая адсорбция , ). Физическая адсорбция газа на поверхности энергетически похожа на конденсацию газа в жидкость, она обычно создает несколько слоев адсорбированных молекул и протекает с нулевой энергией активации.
Более важную роль в каталитических явлениях имеет хемосорбция , при которой адсорбат связан с поверхностью химической связью. Возникающее в результате нарушение электронной структуры адсорбированных частиц «активирует» их и делает их подверженными химической реакции (часто диссоциации), которая не может быть легко достигнута посредством термической активации в газовой или жидкой фазе. В отличие от физадсорбции, хемосорбция обычно включает энергию активации (обеспечиваемую Δ H адс ), и адсорбированные частицы всегда являются монослоем.
Механизмы реакций на поверхностях
Диссоциативная адсорбция
Простейшим гетерогенным процессом является хемосорбция с последующим разрывом связи, как описано выше. Наиболее распространенным и тщательно изученным из них является диссоциация водорода, которая происходит на поверхности большинства переходных металлов. Одиночный 1 s электрон каждого атома водорода координируется с d орбиталями металла, образуя пару хемосорбционных связей (обозначенных красными пунктирными линиями).Хотя эти новые связи более стабильны, чем простая ковалентная связь, которую они заменяют, образующиеся в результате атомы водорода могут перемещаться по поверхности благодаря непрерывной протяженности орбитальной зоны проводимости d .
Механизм Eley-Rideal
Альтернативный механизм исключает вторую стадию хемосорбции; адатомы кислорода взаимодействуют непосредственно с газообразными молекулами CO , заменяя хемосорбционную связь новой связью C – O, когда они проносятся по поверхности:
Примеры обоих механизмов известны, но механизм Ленгмюра-Хиншелвуда более важен, поскольку он использует активацию адсорбированного реагента.В случае окисления окиси углерода исследования, включающие эксперименты с молекулярными пучками, подтверждают эту схему. Ключевым свидетельством является наблюдение короткого промежутка времени между контактом молекулы CO с поверхностью и высвобождением CO 2 , что позволяет предположить, что CO остается хемосорбированным в течение этого интервала.
Принцип Сабатье
Чтобы быть эффективными, эти процессы адсорбции, реакции и десорбции должны быть организованы таким образом, чтобы в значительной степени зависеть от свойств катализатора по отношению к хемосорбционным свойствам (Δ H адс ) реагентов и продуктов.
- Адсорбция реагента на каталитической поверхности ( 2 ) должна быть достаточно сильной, чтобы нарушить связывание внутри частиц, диссоциировать или активировать его;
- Если полученные фрагменты должны мигрировать в другие места на поверхности ( 3-4 ), их хемосорбция должна быть достаточно слабой, чтобы допустить это движение, но не настолько малой, чтобы они улетали, прежде чем у них будет возможность вступить в реакцию;
- Продукт должен иметь достаточно малые значения Δ H ad , чтобы обеспечить их быструю десорбцию с катализатора ( 5 ), чтобы поверхность была освобождена для повторения цикла
Важность выбора катализатора, который обеспечивает надлежащий баланс теплоты адсорбции различных компонентов реакции, известна как принцип Сабатье , но иногда его называют «правильным» или «принципом Златовласки».Помните историю Златовласки и трех медведей? … или посмотрите это видео на UTube.
В применении к катализу этот принцип часто иллюстрируется «вулканической диаграммой», на которой скорость катализированной реакции представлена как функция Δ H адс субстрата, такого как H 2 , на поверхность переходного металла.
График слева показывает относительную эффективность различных металлов в катализе разложения муравьиной кислоты HCOOH.Вертикальная ось отложена как температура. Идея состоит в том, что чем лучше катализатор, тем ниже температура, необходимая для поддержания заданной скорости.
Каталитический цикл
Этот термин относится к идеализированной последовательности этапов между адсорбцией реагента на катализаторе и десорбцией продукта, завершающейся восстановлением катализатора до его исходного состояния. Типичный каталитический цикл гидрирования пропена проиллюстрирован ниже.
Эта конкретная реакция
H 3 C – CH = CH 2 + H 2 → H 3 C – CH 2 –CH 3
происходит спонтанно только в обратном направлении, но он представляет процесс, используемый для гидрогенизации двойных углерод-углеродных связей в растительных маслах с получением твердых насыщенных жиров, таких как маргарин.
Катализатор отравления и поломки
Отравление катализатором, вызванное необратимым связыванием вещества с его поверхностью, может быть постоянным или временным. В последнем случае катализатор можно регенерировать, обычно путем нагревания до высокой температуры. В организмах многие вещества, известные нам как «яды», действуют как каталитические яды на ферменты. Если катализаторы действительно остаются неизменными, они должны работать вечно, но на практике могут происходить различные события, ограничивающие срок службы многих катализаторов.
- Примеси в исходном сырье или продуктах побочных реакций могут постоянно связываться с достаточным количеством активных центров, что со временем снижает каталитическую эффективность, «отравляя» катализатор.
- Физический износ катализатора или его носителя, часто вызываемый высокими температурами, иногда используемыми в промышленных процессах, может уменьшить эффективную площадь поверхности или доступность реагентов к активным центрам.
Катализаторы, как правило, довольно дороги, поэтому желательно, чтобы их можно было повторно обрабатывать или регенерировать для восстановления их активности.Обычной промышленной практикой является периодическая остановка технологических установок для замены отработанных катализаторов.
Как работают гетерогенные катализаторы
Фактические механизмы, с помощью которых адсорбция молекулы на каталитической поверхности способствует разрыву связи, сильно варьируются от случая к случаю.
Мы приводим здесь только один пример — диссоциацию диксо гена O 2 на поверхности катализатора, способного временно отдавать электрон, который попадает на молекулярную орбиталь, разрывающую кислород, которая явно дестабилизирует связь O – O.(После разрыва связи электрон возвращается катализатору.)
Типы каталитически активных поверхностей
Гетерогенные катализаторы в основном зависят от одного или нескольких из следующих типов поверхностей:
Некоторые факторы, влияющие на эффективность катализатора
Поскольку для гетерогенного катализа требуется прямой контакт между реагентами и каталитической поверхностью, площадь активной поверхности находится в верхней части списка. В случае металлической пленки это не то же самое, что номинальная площадь пленки, измеренная линейкой; на микроскопическом уровне даже кажущиеся гладкими поверхности имеют очень неправильную форму, а некоторые полости могут быть слишком маленькими для размещения молекул реагентов.
Рассмотрим, например, что куб платины размером 1 см (стоимостью примерно 1000 долларов) имеет номинальную площадь поверхности всего 6 см. 2 . Если его разбить на 10 12 меньших кубов со сторонами 10 –6 м, общая площадь поверхности составит 60 000 см 2 , что в принципе способно увеличить скорость реакции, катализируемой Pt, в раз. из 10 4 . Эти очень мелкоизмельченные (и часто очень дорогие) металлы обычно прикрепляются к инертной опорной поверхности для максимального воздействия на них реагентов.
Топография поверхности. На микроскопическом уровне даже кажущаяся гладкой поверхность ямчатая и неровная, и некоторые участки будут более активными, чем другие. Проникновение молекул в некоторые из более мелких каналов пористой поверхности и из них может стать ограничивающим скорость.
В остальном гладкая поверхность всегда будет иметь множество дефектов, таких как ступеньки и углы, которые обеспечивают большую открытость и могут быть либо единственными активными центрами на поверхности, либо чрезмерно активными, чтобы постоянно связываться с реагентом, уменьшая активную площадь поверхность.В одном исследовании было определено, что дефекты перегиба, составляющие всего 5 процентов поверхности платины, ответственны за более 90% каталитической активности в определенной реакции.
Стерические факторы
Когда хемосорбция происходит в двух или более местах на реагенте, для эффективного катализа необходимо, чтобы расстояние между активными центрами на каталитической поверхности было таким, чтобы поверхностные связи могли образовываться без значительного углового искажения.
Таким образом, активация двойной связи этилена на поверхности никеля происходит эффективно, поскольку угол между связями C-Ni и C-C близок к тетраэдрическому значению 109.5 ° требуется для углерода sp 3 гибридная орбитальная формация. Точно так же можно ожидать, что гидрирование бензола должно эффективно протекать на поверхности, на которой активные центры расположены в диапазоне от 150 до 250 пм.
Это одна из причин, по которой многие металлические катализаторы проявляют разную каталитическую активность на разных гранях кристаллов.
Некоторые специальные типы гетерогенных катализаторов
Металлокластерные катализаторы
По мере того, как размер частиц катализатора уменьшается, доля более сильно экспонированных ступенчатых, краевых и угловых атомов увеличивается.Крайний случай имеет место с наноразмерными (1-2 нм) металлическими кластерными структурами, обычно состоящими из 10-50 атомов.
[ссылка] →
Металлическое золото, хорошо известное своей химической инертностью, проявляет очень высокую каталитическую активность, когда оно осаждается в виде металлических кластеров на оксидном носителе. Например, O 2 легко диссоциирует на кластеры Au 55 , которые, как было обнаружено, эффективно катализируют окисление углеводородов [статья].
Цеолитные катализаторы
Цеолиты представляют собой глинистые алюмосиликатные твердые вещества, которые образуют микропористые структуры с открытым каркасом, которые могут содержать связанные клетки, полости или каналы, размеры которых могут быть адаптированы к размерам реагентов и продуктов.Для тех молекул, которые способны диффундировать через эти пространства, цеолиты фактически являются «всей поверхностью», что делает их высокоэффективными. Такая избирательность по размеру делает их важными для адсорбции, разделения, ионного обмена и каталитических применений. Многие цеолиты встречаются в виде минералов, но другие производятся синтетическим путем, чтобы оптимизировать их свойства.
В качестве катализаторов цеолиты обладают рядом преимуществ, которые сделали их особенно важными в операциях «зеленой химии», в которых количество стадий обработки, количество нежелательных побочных продуктов и объемы потоков отходов сведены к минимуму.
Ферменты и биокатализ
«Кувшин вина, буханка хлеба и…» Ферменты!
Это искажение уже искаженного перевода Роберта Фитцджеральда знаменитого катрена из чудесного Rubaiyat Омара Хайяма подчеркивает центральную роль, которую ферменты и их технологии играли в цивилизации с древних времен.
← Иллюстрация Эдмунда Дюлака (1882-1953)
Ферментация и виноделие были частью истории и культуры человечества не менее 8000 лет, но признание роли катализа в этих процессах пришлось отложить до конца девятнадцатого века.К 1830-м годам были обнаружены многочисленные подобные агенты, например, те, которые способствуют перевариванию белков в желудке. Термин «фермент», означающий «из дрожжей», был придуман немецким физиологом Вильгельмом Кюне в 1876 году. В 1900 году Эдуард Бухнер (1860-1917, Нобелевская премия по химии 1907 года) показал, что брожение, которое, как считалось ранее, зависит от загадочного «Жизненная сила», содержащаяся в живых организмах, таких как дрожжи, может быть достигнута бесклеточным «прессованным соком», который он выжал из дрожжей.
К этому времени было признано, что ферменты являются формой катализаторов (термин, введенный Берцелиусом в 1835 году), но их точная химическая природа оставалась под вопросом. Оказалось, что они связаны с белками, но общее осознание того, что ферменты — это белки, началось только в 1930-х годах, когда был кристаллизован первый чистый фермент, и не стало общепринятым до 1950-х годов. Теперь ясно, что почти все ферменты являются белками, за исключением небольшого, но важного класса ферментов на основе РНК, известных как рибозимы.
Белки состоят из длинных последовательностей аминокислот, связанных амидными связями; эта последовательность определяет первичную структуру белка. Их огромный размер (обычно 200-2000 аминокислотных единиц с общей молекулярной массой 20 000 — 200 000) позволяет им складываться сложными способами (известными как вторичные и третичные структуры), конфигурации которых необходимы для их каталитической функции.
Поскольку ферменты, как правило, намного больше, чем молекулы реагентов, на которые они действуют (известные в биохимии как субстратов ), ферментативный катализ в некотором смысле похож на гетерогенный катализ.Основное отличие состоит в том, что связывание субстрата с ферментом намного более избирательно.
Прекурсоры и кофакторы
Большинство ферментов возникают в виде неактивных предшественников ( зимогенов ), которые превращаются в свои активные формы в то время и в том месте, где они необходимы.
- Например, ферменты, которые приводят к свертыванию крови, должны оставаться неактивными до фактического начала кровотечения; основным активирующим фактором является воздействие на кровь белков поврежденной стенки сосуда.
- Фермент, который катализирует образование лактозы (молочного сахара) в молочной железе, образуется во время беременности, но остается неактивным до момента рождения, когда гормональные изменения заставляют элемент-модификатор связываться с ферментом и активировать его.
Превращение в активную форму может включать простое разрушение белка путем гидролиза соответствующей пептидной связи или присоединения фосфатной или аналогичной группы к одному из аминокислотных остатков.
Многие ферментные белки также нуждаются в «вспомогательных» молекулах, известных как кофакторы , чтобы сделать их каталитически активными.Это могут быть простые ионы металлов (многие из микропитательных ионов Cu, Mn, Mo, V и т. Д.) Или более сложные органические молекулы, которые называются коферментами . Многие из последних — это то, что мы обычно называем витаминов . Другие молекулы, известные как ингибиторы , снижают активность фермента; Так действуют многие лекарства и яды.
Ферментно-субстратный комплекс
Стандартная модель кинетики фермента состоит из двухэтапного процесса, в котором фермент обратимо связывается со своим субстратом S (реагентом) с образованием комплекса фермент-субстрат ES:
Комплекс фермент-субстрат играет роль, аналогичную роли активированного комплекса в традиционной кинетике, но основная функция фермента — стабилизировать переходное состояние.
На второй, по существу необратимой стадии, продукт и фермент высвобождаются:
Общая кинетика процесса была разработана в 1913 году немецким биохимиком Леонором Михаэлисом и его канадской ученицей Мод Ментен.
Основная кинетическая трактовка этого процесса включает предположение, что концентрации [E] и [ES] достигают стационарных значений, которые не меняются со временем. (Подробное лечение, выходящее за рамки этого курса, можно найти здесь.)
Общий процесс описывается уравнением Михаэлиса-Ментен , которое изображено здесь. Константа Михаэлиса k M определяется, как показано, но может быть упрощена до константы диссоциации ES k –1 / k 1 в случаях, когда диссоциация комплекса является скоростной. предельный шаг. Величина v max не наблюдается напрямую, но может быть определена из k M , как показано здесь.
Ферменты белки
Чтобы понять ферменты и то, как они катализируют реакции, сначала необходимо рассмотреть несколько основных понятий, касающихся белков и аминокислот, из которых они состоят.
Аминокислоты: полярные, неполярные, положительные, отрицательные.
21 аминокислота, из которой состоят белки, обладают основной структурой, показанной здесь, где R представляет собой водород или боковую цепь, которая сама может содержать дополнительные группы –NH 2 или –COOH.Оба типа групп могут образовывать водородные связи с водой и с полярными частями субстратов и, следовательно, вносят свой вклад в полярность и гидофильную природу аминокислоты. Боковые цепи, которые содержат более длинные углеродные цепи и особенно бензольные кольца, имеют противоположный эффект и имеют тенденцию делать аминокислоту неполярной и гидрофобной.
pK a ионизируемой группы — это pH, при котором половина этих групп будет ионизирована. Например, если группа –COOH имеет pK , то равно 2.5, он будет существовать почти полностью в этой форме при pH около 1,5 или меньше, и в виде отрицательного иона –COO — при pH выше около 3,5.
Обе группы –NH 2 и –COOH ионизируются (т.е. они могут действовать как доноры или акцепторы протонов), и когда они находятся в ионной форме, они будут иметь электрический заряд. Группы –COOH имеют pKa в диапазоне 1,8–2,8 и, следовательно, будут находиться в их ионизированных формах –COO – при обычных значениях клеточного pH около 7.4. РКа аминогруппы составляет около 8,8-10,6, поэтому они также обычно находятся в ионизированных формах NH 3 + .
Это означает, что при обычном клеточном pH как карбоксильная, так и аминогруппа будут ионизированы. Но поскольку заряды имеют противоположные знаки, аминокислота, не имеющая дополнительных ионизируемых групп в боковой цепи, будет иметь нулевой заряд. Но если боковая цепь содержит дополнительную амино- или карбоксильную группу, аминокислота может нести чистый электрический заряд.На следующей диаграмме показаны типичные аминокислоты, которые попадают в каждую из описанных выше групп.
Для ясности здесь показаны только заряды в боковых цепях, но, конечно, карбоксильные и аминогруппы в головном конце каждой аминокислоты также будут ионизированы. Маленькие зеленые числа — это значения pK и . См. Здесь полный список аминокислот, которые встречаются в белках.
Белки
Белки состоят из одной или нескольких цепочек аминокислот, связанных друг с другом пептидными связями путем удаления молекулы воды.
Продукт, показанный выше, называется пептидом , в частности, это дипептид , потому что он содержит две аминокислоты остатков (то, что осталось после удаления воды). Белки — это просто очень длинные полипептидные цепи, или их комбинации. (Различие между длинным полипептидом и маленьким белком довольно нечеткое!)
Глобулярные белки
Большинство ферментов попадают в категорию глобулярных белков .В отличие от волокнистых белков , которые образуют структурные компоненты тканей, глобулярные белки растворимы в воде и редко имеют какие-либо систематические третичные структуры. Они состоят из одной или нескольких аминокислотных цепей (« пептид »), которые складываются в различные формы, которые можно грубо описать как сферические — отсюда термин «глобулярный» и суффикс «глобин», который часто добавляется к их названия, например, «гемоглобин».
Сворачивание белка — это спонтанный процесс, на который влияет ряд факторов.Одна из них, очевидно, является их первичной аминокислотной последовательностью, которая способствует образованию внутримолекулярных связей между аминокислотами в различных частях цепи. Они состоят в основном из водородных связей, хотя нередки дисульфидные связи S-S между серосодержащими аминокислотами.
Помимо этих внутримолекулярных сил, важную роль играют взаимодействия с окружающей средой. Наиболее важным из них является гидрофобный эффект , который способствует конформациям складчатости, в которых полярные аминокислоты (которые образуют водородные связи с водой) находятся снаружи, в то время как так называемые гидрофобные аминокислоты остаются в защищенных местах в пределах складки.
Как работают ферменты: активный центр
Каталитический процесс, опосредованный ферментом, происходит в углублении или щели, в результате чего субстрат подвергается воздействию лишь нескольких из сотен и тысяч аминокислотных остатков в белковой цепи. Высокая специфичность и активность ферментативного катализа чувствительно зависят от формы этой полости и от свойств окружающих аминокислот
В 1894 году, задолго до того, как стало ясно, что ферменты — это белки, немецкий химик Эмиль Фишер предложил так называемую модель блокировки и ключа как способ понять, как данный фермент может специфически действовать только на один вид молекул субстрата.Эта модель, по сути, является развитием той, которую мы все еще используем для объяснения гетерогенного катализа.
Хотя базовая модель с замком и ключом продолжает оставаться полезной, она была изменена в то, что теперь называется моделью с принудительной подгонкой. Это предполагает, что, когда субстрат входит в активный сайт и взаимодействует с окружающими частями аминокислотной цепи, он изменяет форму активного сайта (и, возможно, других частей фермента), чтобы он мог более полно взаимодействовать с субстратом.
Одним из важных шагов в этом процессе является выдавливание любых молекул воды, которые связаны с субстратом и могут помешать его оптимальному расположению.
В активном центре специфические взаимодействия между субстратом и соответствующим образом заряженными, гидрофильными и гидрофобными аминокислотами активного центра затем стабилизируют переходное состояние, искажая молекулу субстрата таким образом, чтобы привести к переходному состоянию, имеющему существенно более низкую активацию. энергии, чем может быть получен обычным неферментативным катализом.Помимо этого, основные каталитические стадии являются довольно обычными, причем наиболее распространенными являются кислотно-щелочной и нуклеофильный катализ.
Для очень ясной и поучительной иллюстрации типичной многоступенчатой последовательности типичной реакции, катализируемой ферментами, см. Эту страницу онлайн-учебника Марка Бишопа, из которого взята эта иллюстрация.
Регулирование и ингибирование ферментов
Если бы все ферменты в организме были активны все время, результатом был бы хаос.Большинство клеточных процессов, таких как производство и использование энергии, деление клеток и расщепление продуктов метаболизма, должны протекать в изящно отлаженной и точно настроенной манере, как в большом симфоническом оркестре; Здесь нет места джазовой импровизации!
Природа придумала различные способы достижения этого; мы описали действие предшественников и коферментов. Здесь мы сосредоточимся на одном из наиболее важных (и химически интересных) регуляторных механизмов.
Аллостерическая регуляция: настройка активного сайта
Существует важный класс ферментов, которые обладают особыми сайтами (отличными от каталитически активных сайтов), с которыми определенные внешние молекулы могут обратимо связываться.Хотя эти аллостерических сайтов , как их называют, могут быть довольно далеко от каталитических сайтов, эффект связывания или высвобождения этих молекул должен запускать быстрое изменение паттерна сворачивания фермента, который изменяет форму активный сайт. Эффект заключается в том, чтобы позволить сигнальной или регуляторной молекуле (часто очень маленькой, такой как NO) модулировать каталитическую активность активного центра, эффективно включая или выключая фермент.
В некоторых случаях продукт катализируемой ферментом реакции может сам связываться с аллостерическим сайтом, снижая активность фермента и, таким образом, обеспечивая отрицательную обратную связь, которая помогает поддерживать продукт в желаемой концентрации.Считается, что таким образом регулируются концентрации ионов в плазме, таких как кальций, и энергоснабжающего АТФ.
Аллостерические ферменты — это больше, чем просто катализаторы: они действуют как контрольные точки в метаболических и клеточных сигнальных сетях. Аллостерические ферменты часто стоят в начале последовательности ферментов в метаболической цепи или в точках разветвления, где две такие цепи расходятся, действуя очень сильно. как светофоры на перегруженных перекрестках.
Ингибирование ферментов
Как и в случае с гетерогенными катализаторами, некоторые молекулы, отличные от нормального субстрата, могут быть способны проникать и удерживаться в активном центре, чтобы конкурентно ингибировать активность фермента.Так работают пенициллин и родственные ему антибиотики; эти молекулы ковалентно связываются с аминокислотными остатками в активном центре фермента, который катализирует образование важного компонента стенок бактериальных клеток. Когда клетка делится, новообразованное потомство по существу распадается.
Ферменты вне клетки
Концепция художника Майка Перкинса об иммобилизованном ферменте внутри функционализированной нанопористой поры кремнезема. Фермент показан зеленым цветом, а положительно заряженные области показаны красным.Синие структуры внутри пор представляют собой отрицательно заряженные функциональные группы, добавленные к мезопористому диоксиду кремния, чтобы создать благоприятную химическую среду для фермента. Благоприятная среда в каждой поре привлекает молекулу фермента в незанятую пору. Эта среда стабилизирует и увеличивает химическую активность фермента, позволяя ему преобразовывать вредные материалы субстрата (фиолетовые частицы) в полезные или безвредные продукты (желтые и красные частицы). [ссылка на сайт]Ферменты уже очень давно широко используются в пищевой, целлюлозно-бумажной промышленности и производстве моющих средств, но в основном это неочищенные экстракты целых клеток.
В последние годы развитие биотехнологии и постепенный переход промышленности от нефтяного сырья и растворителей к так называемой «зеленой» химии сделали ферменты более привлекательными в качестве промышленных катализаторов. По сравнению с последними очищенные ферменты, как правило, дороги, их трудно перерабатывать и они нестабильны за пределами довольно узких диапазонов температуры, pH и состава растворителя.
Иммобилизованные ферменты
Многие проблемы, связанные с использованием свободных ферментов, можно преодолеть путем иммобилизации фермента.Это можно сделать несколькими способами:
- Связывание фермента с инертным твердым поддерживающим материалом
- Впервые это было сделано в 1916 году с использованием древесного угля или гидроксида алюминия. С 1960-х годов, когда этот метод стал более популярным, широкое распространение получили синтетические полимеры, часто предназначенные для конкретного применения. Также были использованы некоторые природные биополимеры, такие как целлюлоза или крахмал, и неорганические твердые вещества, такие как диоксид кремния и оксид алюминия.
- Улавливание фермента в пористом материале
- Полимеризация акриламида в присутствии фермента дает пористый гель, который обеспечивает свободную диффузию субстрата и продуктов. Другие материалы, используемые для этой цели, включают натуральные гели, такие как альгинат (полученный из морских водорослей), пористый кремнезем или твердые частицы керамики и цеолиты.
- Сшитые ферменты
- Если фермент химически связан с другим веществом (обычно очень маленькой молекулой), образующееся твердое вещество, известное как сшитый агрегат фермента, может сохранять высокую каталитическую эффективность в очень широком диапазоне условий. Более недавняя связанная разработка включает осаждение менее очищенной формы фермента (например, путем добавления этиленгликоля или сульфата аммония) с последующим сшиванием полученных агрегатов.
Ссылки: больше для изучения
Катализ
- Гади Ротенберг — Катализ: концепции и экологические приложения (Wiley-VCH, 2008)
- R.A. ван Сантан, М. Нейрок — Молекулярный гетерогенный катализ: концептуальный и вычислительный подход (Wiley-VCH, 2006)
- История катализа: список веб-страниц, включая пятьдесят лет катализа — список основных достижений в области 1949–1999. Более подробные страницы истории из Великобритании
- Катализ и его приложения — очень удобочитаемый и интересный отчет о приложениях катализа в различных промышленно важных областях.
Авторы и авторство
катализ | Химия, классификация и химические реакции
Катализ , в химии, изменение скорости химической реакции, обычно ускорение, путем добавления вещества, не израсходованного во время реакции. Скорости химических реакций, то есть скорости, с которыми они происходят, зависят от ряда факторов, включая химическую природу реагирующих частиц и внешние условия, которым они подвергаются.Особый феномен, связанный со скоростью химических реакций, который представляет большой теоретический и практический интерес, — это катализ, то есть ускорение химических реакций веществами, не участвующими в самих реакциях, — веществами, известными как катализаторы. Изучение катализа представляет теоретический интерес из-за того, что оно раскрывает фундаментальную природу химических реакций; На практике изучение катализа важно, потому что успех многих промышленных процессов зависит от катализаторов.По сути, это своеобразное явление жизни вряд ли было бы возможным без биологических катализаторов, называемых ферментами.
наночастицы: пероксид водородаНаночастицы сплава золото-палладий (желто-синий), нанесенные на обработанный кислотой углерод (серый), непосредственно катализирующие образование пероксида водорода из водорода (белый) и кислорода (красный), при этом предотвращая нежелательное разложение пероксида водорода .
Фотография любезно предоставлена доктором Дэвидом Дж. Уиллоком, Кардиффский университетПри каталитической реакции катализатор обычно вступает в химическую комбинацию с реагентами, но в конечном итоге регенерируется, поэтому количество катализатора остается неизменным.Поскольку катализатор не расходуется, каждая молекула катализатора может вызывать превращение многих молекул реагентов. Для активного катализатора количество молекул, трансформируемых за минуту одной молекулой катализатора, может достигать нескольких миллионов.
Если данное вещество или комбинация веществ претерпевает две или несколько одновременных реакций, дающих разные продукты, на распределение продуктов может влиять использование катализатора, который избирательно ускоряет одну реакцию относительно другой (й).Путем выбора подходящего катализатора может происходить конкретная реакция, практически исключающая другую. Многие важные применения катализа основаны на такой селективности.
Поскольку обратная химическая реакция может протекать путем обращения стадий, составляющих механизм прямой реакции, катализатор данной реакции ускоряет реакцию в обоих направлениях одинаково. Следовательно, катализатор не влияет на положение равновесия химической реакции; он влияет только на скорость достижения равновесия.Очевидным исключением из этого обобщения являются те реакции, в которых один из продуктов также является катализатором реакции. Такие реакции называют автокаталитическими.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасТакже известны случаи, когда добавление постороннего вещества, называемого ингибитором, снижает скорость химической реакции. Это явление, правильно называемое торможением или замедлением, иногда называют отрицательным катализом.В некоторых случаях концентрации ингибитора могут быть намного ниже, чем у реагентов. Ингибирование может быть результатом (1) снижения концентрации одного из реагентов из-за образования комплекса между реагентом и ингибитором, (2) снижения концентрации активного катализатора («отравления» катализатора) из-за образование комплекса между катализатором и ингибитором или (3) прекращение цепной реакции из-за разрушения носителей цепи ингибитором.
История
Термин катализ (от греческого kata- , «вниз» и lyein , «ослаблять») был впервые использован великим шведским химиком Йенсом Якобом Берцелиусом в 1835 году для сопоставления группы наблюдения, сделанные другими химиками в конце 18 — начале 19 вв. К ним относятся усиленное преобразование крахмала в сахар под действием кислот, впервые обнаруженное Готлибом Сигизмундом Константином Кирхгофом; Наблюдения сэра Хэмфри Дэви о том, что платина ускоряет горение множества газов; открытие стабильности перекиси водорода в кислотном растворе, но ее разложения в присутствии щелочей и таких металлов, как марганец, серебро, платина и золото; и наблюдение, что окисление спирта до уксусной кислоты осуществляется в присутствии мелкодисперсной платины.Агенты, способствующие этим различным реакциям, были названы катализаторами, и Берцелиус предположил, что в таких процессах действует особая неизвестная каталитическая сила.
В 1834 году английский ученый Майкл Фарадей исследовал способность платиновой пластины осуществлять рекомбинацию газообразного водорода и кислорода (продуктов электролиза воды) и замедлять эту рекомбинацию присутствием других газов, таких как этилен. и окись углерода. Фарадей утверждал, что для активности необходима идеально чистая металлическая поверхность (на которой замедляющие газы могут конкурировать с реагирующими газами и, таким образом, подавлять активность), концепция, которая, как позже будет показано, имеет важное значение для катализа.
Многие из примитивных технических искусств включали бессознательное применение катализа. Ферментация вина до уксусной кислоты и производство мыла из жиров и щелочей были хорошо известны в ранней истории человечества. Серная кислота, полученная путем сжигания смесей серы и селитры (нитрат натрия), была ранним предшественником ведущего камерного процесса производства серной кислоты, в котором окисление диоксида серы ускорялось добавлением оксидов азота. (Механизм последнего процесса был предложен сэром Хэмфри Дэви в 1812 году на основе экспериментов, проведенных другими.)
В 1850 году концепция скорости реакции была разработана во время исследований гидролиза или инверсии тростникового сахара. Термин инверсия относится к изменению вращения, которому подвергается монохроматический свет, когда он проходит через реакционную систему, параметр, который легко измерить, тем самым облегчая изучение реакции. Было обнаружено, что в любой момент скорость инверсии пропорциональна количеству тростникового сахара, подвергающегося трансформации, и что скорость ускоряется присутствием кислот.(Позже было показано, что скорость инверсии прямо пропорциональна силе кислоты.) Эта работа была отчасти предвестником более поздних исследований скорости реакции и ускоряющего влияния более высокой температуры на эту скорость, проведенных Дж. Ван’т Хофф, Сванте Аррениус и Вильгельм Оствальд, которые играли ведущие роли в развитии науки физической химии. Работа Оствальда по скоростям реакции привела его в 1890-х годах к определению катализаторов как веществ, которые изменяют скорость данной химической реакции без изменения энергетических факторов реакции.
Это заявление Оствальда было запоминающимся достижением, поскольку оно подразумевало, что катализаторы не изменяют положение равновесия в реакции. В 1877 году Жорж Лемуан показал, что разложение иодоводородной кислоты до водорода и йода достигло той же точки равновесия при 350 ° C (660 ° F), 19 процентов, независимо от того, протекала ли реакция быстро в присутствии платиновой губки или медленно в присутствии платиновой губки. газовая фаза. Это наблюдение имеет важное следствие: катализатор прямого процесса в реакции также является катализатором обратной реакции.P.E.M. Бертло, выдающийся французский химик, подтвердил это наблюдение в 1879 году на жидких системах, когда он обнаружил, что реакция органических кислот и спиртов, называемая этерификацией, катализируется присутствием небольших количеств сильной неорганической кислоты, как и наоборот. процесс, гидролиз сложных эфиров (реакция между сложным эфиром и водой).
Целенаправленное применение катализаторов в промышленных процессах было предпринято в 19 веке. Английский химик П. Филлипс запатентовал использование платины для окисления диоксида серы до триоксида серы воздухом.Его способ применяли какое-то время, но от него отказались из-за потери активности платинового катализатора. Впоследствии было установлено, что причиной этого являются яды в реагентах, и этот процесс стал техническим успехом на рубеже 20-го века. В 1871 году был разработан промышленный процесс окисления соляной кислоты до хлора в присутствии солей меди, пропитанных глиняным кирпичом. Полученный хлор использовали в производстве отбеливающего порошка (сухого вещества, выделяющего хлор при обработке кислотой) путем реакции с известью.Опять же, в этой реакции было замечено, что одно и то же равновесие было достигнуто в обоих направлениях. Кроме того, было обнаружено, что чем ниже температура, тем больше равновесное содержание хлора; рабочая температура 450 ° C (840 ° F) дает максимальное количество хлора в удобное время.
Ближе к концу XIX века классические исследования выдающегося французского химика Поля Сабатье по взаимодействию водорода с широким спектром органических соединений проводились с использованием различных металлических катализаторов; Это исследование привело к разработке немецкого патента на гидрирование жидких ненасыщенных жиров до твердых насыщенных жиров с использованием никелевых катализаторов.Разработка трех важных немецких каталитических процессов оказала большое влияние на промышленность в конце 19 века и в первые десятилетия 20 века. Одним из них был так называемый контактный процесс каталитического производства серной кислоты из диоксида серы, полученного при плавке. Другим был каталитический метод синтетического производства ценного красителя индиго. Третий — каталитическая комбинация азота и водорода для производства аммиака — процесс Габера-Боша для фиксации азота, разработанный химиками Фрицем Габером и Карлом Бошем.
12.7 Катализ — химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните функцию катализатора с точки зрения механизмов реакции и диаграмм потенциальной энергии
- Перечислить примеры катализа в природных и промышленных процессах
Мы видели, что скорость многих реакций может быть увеличена с помощью катализаторов. Катализатор ускоряет скорость реакции за счет снижения энергии активации; кроме того, катализатор регенерируется в процессе.Несколько реакций, которые являются термодинамически благоприятными в отсутствие катализатора, протекают с разумной скоростью только при наличии катализатора. Одной из таких реакций является каталитическое гидрирование, процесс, при котором водород добавляют через связь C = C алкена с получением насыщенного алканового продукта. Сравнение диаграмм координат реакции (также известных как энергетические диаграммы) для каталитического и некаталитического гидрирования алкена показано на рисунке 1.
Рис. 1. На этом графике сравниваются координаты реакции каталитического и некаталитического гидрирования алкена.Катализаторы функционируют, обеспечивая альтернативный механизм реакции, который имеет более низкую энергию активации, чем было бы в отсутствие катализатора. В некоторых случаях каталитический механизм может включать дополнительные этапы, как показано на диаграммах реакций, показанных на рисунке 2. Эта более низкая энергия активации приводит к увеличению скорости, как описано уравнением Аррениуса. Обратите внимание, что катализатор снижает энергию активации как для прямой, так и для обратной реакции, и, следовательно, ускоряет как прямую, так и обратную реакции .Следовательно, присутствие катализатора позволит системе быстрее достичь равновесия, но не влияет на положение равновесия, что отражается в значении его константы равновесия (см. Следующую главу о химическом равновесии).
Рис. 2. Эта диаграмма потенциальной энергии показывает влияние катализатора на энергию активации. Катализатор обеспечивает другой путь реакции с более низкой энергией активации. Как показано, каталитический путь включает двухступенчатый механизм (обратите внимание на наличие двух переходных состояний) и промежуточный вид (представленный долиной между двумя переходными состояниями).Пример 1
Использование диаграмм реакций для сравнения каталитических реакций
Две диаграммы здесь представляют одну и ту же реакцию: одна без катализатора, а другая с катализатором. Определите, какая диаграмма предполагает присутствие катализатора, и определите энергию активации катализированной реакции:
Раствор
Катализатор не влияет на энергию реагента или продукта, поэтому этими аспектами диаграмм можно пренебречь; они, как и следовало ожидать, идентичны в этом отношении.Однако есть заметная разница в переходном состоянии, которое на диаграмме (b) заметно ниже, чем на (a). Это указывает на использование катализатора на диаграмме (b). Энергия активации — это разница между энергией исходных реагентов и переходного состояния — максимум на координатной диаграмме реакции. Реагенты имеют концентрацию 6 кДж, а переходное состояние — 20 кДж, поэтому энергию активации можно рассчитать следующим образом:
[латекс] E _ {\ text {a}} = 20 \; \ text {kJ} \; — \; 6 \; \ text {kJ} = 14 \; \ text {kJ} [/ latex]
Проверьте свои знания
Определите, какая из двух диаграмм здесь (обе для одной и той же реакции) включает катализатор, и определите энергию активации катализированной реакции:
Ответ:
Диаграмма (b) представляет собой каталитическую реакцию с энергией активации около 70 кДж.
Гомогенный катализатор присутствует в той же фазе, что и реагенты. Он взаимодействует с реагентом с образованием промежуточного вещества, которое затем разлагается или вступает в реакцию с другим реагентом на одной или нескольких стадиях для регенерации исходного катализатора и образования продукта.
В качестве важной иллюстрации гомогенного катализа рассмотрим озоновый слой Земли. Озон в верхних слоях атмосферы, защищающий Землю от ультрафиолетового излучения, образуется, когда молекулы кислорода поглощают ультрафиолетовый свет и вступают в реакцию:
[латекс] 3 \ text {O} _2 (g) \; {\ xrightarrow {hv}} \; 2 \ text {O} _3 (g) [/ latex]
Озон — относительно нестабильная молекула, которая разлагается с образованием двухатомного кислорода по обратному уравнению.Эта реакция разложения соответствует следующему механизму:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {O} _3 & \ text {O} _2 \; + \; \ text {O} \\ [0.5em ] \ text {O} \; + \; \ text {O} _3 & 2 \ text {O} _2 \ end {array} [/ latex]
Присутствие оксида азота NO влияет на скорость разложения озона. Оксид азота действует как катализатор по следующему механизму:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {NO} (g) \; + \; \ text {O} _3 (g) & \ text {NO} _2 (g) \; + \; \ text {O} _2 (g) \\ [0.5em] \ text {O} _3 (g) & \ text {O} _2 (g) \; + \; \ text {O} (g) \\ [0.5em] \ text {NO} _2 (g) \ ; + \; \ text {O} (g) & \ text {NO} (g) \; + \; \ text {O} _2 (g) \ end {array} [/ latex]
Общее химическое изменение для каталитического механизма такое же, как:
[латекс] 2 \ text {O} _3 (g) \; {\ longrightarrow} \; 3 \ text {O} _2 (g) [/ latex]
Оксид азота реагирует и регенерируется в этих реакциях. Он не расходуется постоянно; таким образом, он действует как катализатор. Скорость разложения озона выше в присутствии оксида азота из-за каталитической активности NO.Некоторые соединения, содержащие хлор, также катализируют разложение озона.
Марио Дж. Молина
Нобелевскую премию по химии 1995 года разделили Пол Дж. Крутцен, Марио Дж. , Молина (рис. 3) и Ф. Шервуд Роуленд «за их работы в области химии атмосферы, особенно в отношении образования и разложения озона». Молина, гражданин Мексики, выполнял большую часть своей работы в Массачусетском технологическом институте (MIT).
Рисунок 3. (a) Мексиканский химик Марио Молина (1943 -) разделил Нобелевскую премию по химии в 1995 году за исследование (b) озоновой дыры в Антарктике. (Фото а: любезно предоставлено Марио Молиной; кредит б: модификация работы НАСА)В 1974 году Молина и Роуленд опубликовали статью в журнале Nature (одна из основных рецензируемых публикаций в области науки) с подробным описанием угроза хлорфторуглеродных газов стабильности озонового слоя в верхних слоях атмосферы Земли. Озоновый слой защищает Землю от солнечного излучения, поглощая ультрафиолетовый свет.Поскольку химические реакции истощают количество озона в верхних слоях атмосферы, над Антарктидой образуется измеримая «дыра», и увеличение количества солнечного ультрафиолетового излучения, во многом связанное с распространением рака кожи, достигает поверхности Земли. Работа Молины и Роуленда сыграла важную роль в принятии Монреальского протокола, международного договора, подписанного в 1987 году, который успешно начал поэтапное прекращение производства химикатов, связанных с разрушением озона.
Молина и Роуленд продемонстрировали, что атомы хлора из химических веществ, созданных человеком, могут катализировать разрушение озона в процессе, аналогичном процессу, с помощью которого NO ускоряет разрушение озона.Атомы хлора образуются, когда хлороуглероды или хлорфторуглероды, которые когда-то широко использовались в качестве хладагентов и пропеллентов, фотохимически разлагаются ультрафиолетом или реагируют с гидроксильными радикалами. Здесь показан пример механизма с использованием хлористого метила:
[латекс] \ text {CH} _3 \ text {Cl} \; + \; \ text {OH} \; {\ longrightarrow} \; \ text {Cl} \; + \; \ text {other \; продукты } [/ латекс]
Хлорные радикалы разрушают озон и регенерируются в следующем каталитическом цикле:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {Cl} \; + \; \ text {O} _3 & \ text {ClO} \; + \; \ текст {O} _2 \\ [0.5em] \ text {ClO} \; + \; \ text {O} & \ text {Cl} \; + \; \ text {O} _2 \\ [0.5em] \ text {total \; Реакция: \; O} _3 \; + \; \ text {O} & 2 \ text {O} _2 \ end {array} [/ latex]
Один одноатомный хлор может расщепить тысячи молекул озона. К счастью, большая часть атмосферного хлора существует в виде каталитически неактивных форм Cl 2 и ClONO 2 .
После получения своей части Нобелевской премии Молина продолжил свою работу в области химии атмосферы в Массачусетском технологическом институте.
Дефицит глюкозо-6-фосфатдегидрогеназы
Ферменты в организме человека действуют как катализаторы важных химических реакций клеточного метаболизма.Таким образом, дефицит определенного фермента может привести к опасному для жизни заболеванию. Дефицит G6PD (глюкозо-6-фосфатдегидрогеназы), генетическое заболевание, которое приводит к нехватке фермента глюкозо-6-фосфатдегидрогеназы, является наиболее распространенной недостаточностью ферментов у людей. Этот фермент, показанный на Рисунке 4, является ферментом, ограничивающим скорость метаболического пути, который поставляет НАДФН в клетки (Рисунок 5).
Рисунок 4. Глюкозо-6-фосфатдегидрогеназа — это фермент, ограничивающий скорость метаболического пути, который поставляет НАДФН в клетки.Нарушение этого пути может привести к снижению содержания глутатиона в эритроцитах; как только весь глутатион израсходован, ферменты и другие белки, такие как гемоглобин, становятся уязвимыми. Например, гемоглобин может метаболизироваться до билирубина, что приводит к желтухе — состоянию, которое может стать серьезным. Люди, страдающие дефицитом G6PD, должны избегать определенных продуктов и лекарств, содержащих химические вещества, которые могут вызвать повреждение их эритроцитов с дефицитом глутатиона.
Рисунок 5. В механизме пентозофосфатного пути G6PD катализирует реакцию, регулирующую NAPDH, кофермент, регулирующий глутатион, антиоксидант, защищающий эритроциты и другие клетки от окислительного повреждения.Гетерогенный катализатор представляет собой катализатор, который находится в другой фазе (обычно в твердой фазе), чем реагенты. Такие катализаторы обычно функционируют, создавая активную поверхность, на которой может происходить реакция. Газовые и жидкофазные реакции, катализируемые гетерогенными катализаторами, происходят на поверхности катализатора, а не внутри газовой или жидкой фазы.
Гетерогенный катализ имеет не менее четырех этапов:
- Адсорбция реагента на поверхности катализатора
- Активация адсорбированного реагента
- Реакция адсорбированного реагента
- Диффузия продукта с поверхности в газовую или жидкую фазу (десорбция).
Любой из этих шагов может быть медленным и, таким образом, может служить шагом определения скорости. В целом, однако, в присутствии катализатора общая скорость реакции выше, чем если бы реагенты находились в газовой или жидкой фазе.
На рис. 6 показаны этапы, которые, по мнению химиков, происходят в реакции соединений, содержащих двойную углерод-углеродную связь, с водородом на никелевом катализаторе. Никель — это катализатор, используемый при гидрировании полиненасыщенных жиров и масел (которые содержат несколько двойных углерод-углеродных связей) для получения насыщенных жиров и масел (которые содержат только одинарные углерод-углеродные связи).
Рис. 6. Есть четыре стадии катализа реакции C 2 H 4 + H 2 ⟶C 2 H 6 никелем.(а) Водород адсорбируется на поверхности, разрывая связи H – H и образуя связи Ni – H. (б) Этилен адсорбируется на поверхности, разрывая π-связь и образуя связи Ni – C. (c) Атомы диффундируют по поверхности и при столкновении образуют новые связи C – H. (d) C 2 H 6 молекул ускользают с поверхности никеля, так как они не сильно притягиваются к никелю.Другие важные промышленные процессы, в которых используются гетерогенные катализаторы, включают получение серной кислоты, получение аммиака, окисление аммиака до азотной кислоты и синтез метанола, CH 3 OH.Гетерогенные катализаторы также используются в каталитических нейтрализаторах большинства автомобилей с бензиновым двигателем (рис. 7).
Автомобильные каталитические преобразователи
Ученые разработали каталитические нейтрализаторы для уменьшения количества токсичных выбросов, производимых при сжигании бензина в двигателях внутреннего сгорания. Каталитические нейтрализаторы используют все пять факторов, влияющих на скорость химических реакций, чтобы обеспечить максимальную безопасность выбросов выхлопных газов.
Используя тщательно подобранную смесь каталитически активных металлов, можно добиться полного сгорания всех углеродсодержащих соединений до диоксида углерода, а также снизить выход оксидов азота.Это особенно впечатляет, если учесть, что один этап включает добавление кислорода к молекуле, а другой — удаление кислорода (рис. 7).
Рис. 7. Каталитический нейтрализатор позволяет сжигать все углеродсодержащие соединения до диоксида углерода, одновременно снижая выход оксида азота и других загрязняющих веществ в выбросы от двигателей, работающих на бензине.Большинство современных трехкомпонентных каталитических нейтрализаторов имеют поверхность, пропитанную платино-родиевым катализатором, который катализирует превращение оксида азота в диазот и кислород, а также превращение оксида углерода и углеводородов, таких как октан, в диоксид углерода и водяной пар:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} 2 \ text {NO} _2 (g) & \ text {N} _2 (g) \; + \; 2 \ text {O} _2 (g) \\ [0.5em] 2 \ text {CO} (g) \; + \; \ text {O} _2 (g) & 2 \ text {CO} _2 (g) \\ [0.5em] 2 \ text {C} _8 \ текст {H} _ {18} (g) \; + \; 25 \ text {O} _2 (g) & 16 \ text {CO} _2 (g) \; + \; 18 \ text {H} _2 \ текст {O} (g) \ end {array} [/ latex]
Для обеспечения максимальной эффективности большинство каталитических нейтрализаторов предварительно нагревается электронагревателем. Это гарантирует, что металлы в катализаторе будут полностью активны даже до того, как выхлопные газы автомобиля станут достаточно горячими для поддержания соответствующих температур реакции.
«ChemWiki» Калифорнийского университета в Дэвисе дает подробное объяснение того, как работают каталитические нейтрализаторы.
Структура и функции фермента
Изучение ферментов — важная взаимосвязь между биологией и химией. Ферменты обычно представляют собой белки (полипептиды), которые помогают контролировать скорость химических реакций между биологически важными соединениями, особенно теми, которые участвуют в клеточном метаболизме. Различные классы ферментов выполняют множество функций, как показано в Таблице 36.
| Класс | Функция |
|---|---|
| оксидоредуктазы | окислительно-восстановительные реакции |
| трансфераз | перенос функциональных групп |
| гидролазы | реакции гидролиза |
| лиаз | отщепление группы с образованием двойных связей |
| изомеразы | изомеризация |
| лигаз | образование связи при гидролизе АТФ |
| Таблица 36. Классы ферментов и их функции | |
Молекулы фермента обладают активным центром, частью молекулы, форма которой позволяет ей связываться с определенным субстратом (молекулой реагента), образуя комплекс фермент-субстрат в качестве промежуточного продукта реакции. Есть две модели, которые пытаются объяснить, как работает этот активный сайт. Самая упрощенная модель называется гипотезой замка и ключа, которая предполагает, что молекулярные формы активного центра и субстрата дополняют друг друга и подходят друг к другу, как ключ в замке.Гипотеза индуцированной подгонки, с другой стороны, предполагает, что молекула фермента является гибкой и меняет форму, чтобы приспособиться к связи с субстратом. Однако это не означает, что активный центр фермента полностью податлив. И модель «замок-и-ключ», и модель индуцированного соответствия учитывают тот факт, что ферменты могут связываться только с определенными субстратами, поскольку в целом конкретный фермент катализирует только конкретную реакцию (рис. 8).
Рис. 8. (a) Согласно модели с замком и ключом, форма активного центра фермента идеально подходит для субстрата.(б) Согласно модели индуцированной подгонки, активный центр в некоторой степени гибок и может изменять форму, чтобы соединиться с подложкой.Королевское химическое общество представляет собой прекрасное введение в ферменты для студентов и преподавателей.
Катализаторы влияют на скорость химической реакции, изменяя ее механизм, чтобы обеспечить более низкую энергию активации. Катализаторы могут быть гомогенными (в той же фазе, что и реагенты) или гетерогенными (отличная от реагентов фаза).
Химия: упражнения в конце главы
- Учитывать увеличение скорости реакции, вызванное катализатором.
- Сравните функции гомогенных и гетерогенных катализаторов.
- Рассмотрите этот сценарий и ответьте на следующие вопросы: Атомы хлора, образующиеся в результате разложения хлорфторметанов, например CCl 2 F 2 , катализируют разложение озона в атмосфере. Один из упрощенных механизмов разложения:
[латекс] \ text {O} _3 \; {\ xrightarrow {\ text {солнечный свет}}} \; \ text {O} _2 \; + \; \ text {O} \ \ [0.5em] \ text {O} _3 \; + \; \ text {Cl} \; {\ longrightarrow} \; \ text {O} _2 \; + \; \ text {ClO} \\ [0.5em] \ text {ClO} \; + \; \ text {O} \; {\ longrightarrow} \; \ text {Cl} \; + \; \ text {O} _2 [/ latex](а) Объясните, почему атомы хлора являются катализаторами газофазного превращения:
[латекс] 2 \ text {O} _3 \; {\ longrightarrow} \; 3 \ text {O} _2 [/ latex]
(b) Оксид азота также участвует в разложении озона по механизму:
[латекс] \ text {O} _3 \; {\ xrightarrow {\ text {солнечный свет}}} \; \ text {O} _2 \; + \; \ text {O} \\ [0.5em] \ text {O} _3 \; + \; \ text {NO} \; {\ longrightarrow} \; \ text {NO} _2 \; + \; \ text {O} _2 \\ [0.5em] \ текст {NO} _2 \; + \; \ text {O} \; {\ longrightarrow} \; \ text {NO} \; + \; \ text {O} _2 [/ latex]
Является ли NO катализатором разложения? Поясните свой ответ.
- Для каждой из следующих пар диаграмм реакций укажите, какая из пары катализируется:
(а)
(б)
- Для каждой из следующих пар диаграмм реакций укажите, какая из пар катализируется:
(а)
(б)
- Для каждой из следующих диаграмм реакций оцените энергию активации ( E a ) реакции:
(а)
(б)
- Для каждой из следующих диаграмм реакций оцените энергию активации ( E a ) реакции:
(а)
(б)
- На основании диаграмм в упражнении 6 «Химия» в конце главы, какая из реакций протекает быстрее всего? У кого самая низкая скорость?
- На основании диаграмм в упражнении 7 в конце главы «Химия», какая из реакций протекает быстрее всего? У кого самая низкая скорость?
Глоссарий
- катализатор гетерогенный
- катализатор присутствует в фазе, отличной от фазы реагентов, обеспечивая поверхность, на которой может происходить реакция
- гомогенный катализатор
- катализатор присутствует в той же фазе, что и реагенты
Решения
Ответы на упражнения в конце главы по химии
1.Общий способ действия катализатора заключается в обеспечении механизма, с помощью которого реагенты могут легче объединяться, выбирая путь с более низкой энергией реакции. Скорость как прямой, так и обратной реакции увеличивается, что приводит к более быстрому достижению равновесия.
3. (a) Атомы хлора являются катализатором, потому что они реагируют на второй стадии, но регенерируются на третьей стадии. Таким образом, они не расходуются, что характерно для катализаторов. (б) NO является катализатором по той же причине, что и в части (а).
5. Понижение энергии переходного состояния указывает на действие катализатора. а) А; (б) B
7. Энергия, необходимая для перехода из начального состояния в переходное, составляет: а) 10 кДж; (б) 10 кДж
9. У обоих одинаковая энергия активации, поэтому у них одинаковая скорость.
.