Число частиц, количество вещества, объём, плотность — урок. Химия, 8–9 класс.
Число частиц (атомов, молекул, протонов, электронов и т. д.) обозначается буквой N.
Пример:
N(O)= \(10000\) — число атомов кислорода равно \(10000\).
N(CO2)= 1025 — число молекул углекислого газа равно 1025.
N(n)= 2 ·1022 — число нейтронов равно 2 ·1022.
Химическое количество вещества — физическая величина, пропорциональная числу частиц, содержащихся в данной порции вещества. Обозначается буквой n. Единица измерения — моль.
\(1\) моль — количество вещества, в котором содержится 6,02⋅1023 частиц.
Величина, равная 6,02⋅1023 моль-1 или 6,02⋅1023 1/моль, называется постоянной Авогадро. Единица в числителе дроби (1/моль) заменяет название частицы вещества.
Пример:
Na(O)= 6,02⋅1023 моль-1 обозначает, что один моль содержит 6,02⋅1023 атомов кислорода.
Na(CO2)= 6,02⋅1023 моль-1 обозначает, что один моль углекислого газа содержит 6,02⋅1023 молекул.
Na(n)= 6,02⋅1023 моль-1 обозначает, что один моль нейтронов содержит 6,02⋅1023 этих частиц.
Объём V измеряется в кубических дециметрах (дм³), кубических метрах (м³), кубических сантиметрах (см³). Применяются также единицы измерения литр (л) и миллилитр (мл).
Обрати внимание!
\(1\) дм³ \(=1\) л, \(1\) см³ \(=1\) мл, \(1\) м³ \(=1000\) дм³ \(=1000\) л, \( 1\) дм³ \(=1000\) см³ \(=1000\) мл.
Молярный объём Vm — это отношение объёма вещества к его химическому количеству. Численно равен объёму одного моля вещества. Единица измерения — дм³/моль.
Для всех газов при нормальных условиях молярный объём равен \(22,4\) дм³/моль.
Плотность обозначается буквой ρ. Измеряется в г/см³, г/мл (для твёрдых веществ и жидкостей), г/дм³ или г/л (для газов).
Часто в химических расчётах применяется плотность жидкой воды. При \(4\) °С она равна \(1\) г/см³ или \(1000\) г/дм³.
Готовимся к углубленному изучению химии : 2.6 Моль. Молярная масса
2.6. Моль. Молярная масса В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль. Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро. Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 1 моль серной кислоты
содержит 6,02 • 1023 молекул H2SO4.
1 моль железа содержит 6,02 •
1023 атомов Fe.
1 моль серы содержит 6,02
• 1023 атомов S.
2 моль серы содержит
12,04 • 1023 атомов S.
0,5 моль серы содержит
3,01 • 1023 атомов S.
Исходя из этого, любое количество
вещества можно выразить определенным числом молейν (ню).
Например, в образце вещества содержится 12,04 • 1023 молекул.
Следовательно, количество вещества в этом образце составляет:
где N –
число частиц данного вещества;
1 моль серной кислоты
содержит 6,02 • 1023 молекул H2SO4.
1 моль железа содержит 6,02 •
1023 атомов Fe.
1 моль серы содержит 6,02
• 1023 атомов S.
2 моль серы содержит
12,04 • 1023 атомов S.
0,5 моль серы содержит
3,01 • 1023 атомов S.
Исходя из этого, любое количество
вещества можно выразить определенным числом молейν (ню).
Например, в образце вещества содержится 12,04 • 1023 молекул.
Следовательно, количество вещества в этом образце составляет:
где N –
число частиц данного вещества;Nа – число частиц, которое содержит 1 моль вещества (постоянная Авогадро). Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).

Например, молярная масса метана CH4 определяется следующим образом: Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16 M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул. Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле: Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей: или найти массу вещества по числу молей и молярной массе: Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от M
1.
2.
3.
4. Вычислите массу (г) железа, взятого количеством вещества M(Fe) = Ar(Fe) = 56 г/моль (Из периодической системы) m (Fe) = 56 г/моль · 0,5 моль = 28 г Ответ: m (Fe) =28 г 5.
 Вычислите массу (г) 12,04 · 1023 молекул оксида кальция CaО.
m = M · ν, ν= N/Na,
следовательно, формула
для расчёта
M(CaO) = Ar(Ca) + Ar(O) = 40 +
16 = 56 г/моль
m= 56 г/моль · (12,04 * 1023
/6.02 · 1023 1/моль) = 112 г
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Рассчитайте массу одной молекулы
азота.
2.
Сколько молекул содержится в : а)
0,5 моль вещества; б) 3 моль вещества.
3.
Сколько молей составляют и сколько
молекул содержат: а) 128 г SO2;
б) 8 г NaOH; в) 280 г N2.
4.
Сколько молей составляют и сколько
атомов содержат: а) 8 г серы; б) 280 г
железа.
5.
Определите массу: а) 0,1 моль Н2; б) 5 моль СО2.
6.
В какой молекуле воды содержится
приблизительно 30,1 * 1024 молекул Н2О.
Вычислите массу (г) 12,04 · 1023 молекул оксида кальция CaО.
m = M · ν, ν= N/Na,
следовательно, формула
для расчёта
M(CaO) = Ar(Ca) + Ar(O) = 40 +
16 = 56 г/моль
m= 56 г/моль · (12,04 * 1023
/6.02 · 1023 1/моль) = 112 г
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Рассчитайте массу одной молекулы
азота.
2.
Сколько молекул содержится в : а)
0,5 моль вещества; б) 3 моль вещества.
3.
Сколько молей составляют и сколько
молекул содержат: а) 128 г SO2;
б) 8 г NaOH; в) 280 г N2.
4.
Сколько молей составляют и сколько
атомов содержат: а) 8 г серы; б) 280 г
железа.
5.
Определите массу: а) 0,1 моль Н2; б) 5 моль СО2.
6.
В какой молекуле воды содержится
приблизительно 30,1 * 1024 молекул Н2О. 7.
Масса 3 моль вещества равна 51 г.
Чему равны молярная масса и относительная молекулярная масса этого вещества.
8.
Сколько молей атомов углерода,
водорода и кислорода содержится в 1 моле глюкозы С
7.
Масса 3 моль вещества равна 51 г.
Чему равны молярная масса и относительная молекулярная масса этого вещества.
8.
Сколько молей атомов углерода,
водорода и кислорода содержится в 1 моле глюкозы С10. Даны 10 г NaOH и 10 г Fe2(SO4)3. Во сколько раз число молекул NaOH в данной массе больше числа молекул Fe2(SO4)3 в такой же массе.
| 1. Молярная масса численно не равна массе: | |
| а) одной молекулы вещества | б) 6,02 * 1023 структурных единиц вещества |
в) 22,4 л газа (н. у.) у.)
|
г) 1 моль вещества |
| 2. Укажите единицу молярной массы: | |
| 3. Количество вещества измеряется в: | |
| 4. 1 моль – это: | |
| а) все ответы верны | б) масса 22,4 л газа при н.у. |
| в) количества вещества, содержащее 6,02 * 1023 структурных единиц | г) отношение массы вещества к его количеству |
5. |
|
| 6. Как обозначается молярная масса: | |
| 7. Единицы измерения молярной массы: | |
| 8. Какую массу имеет N2 количеством 0,5 моль: | |
9. Определите
количество вещества Н2, в котором содержится 18,06 · 1023 молекул:
Определите
количество вещества Н2, в котором содержится 18,06 · 1023 молекул:
|
|
| 10. Определите число молекул кислорода, содержащихся в 2 моль О2: | |
Что такое молярный объём | Решаем химию: вопросы и ответы
Молекулы вступают в реакцию в определённых соотношениях, и это описывают химические реакции. Например, из этого уравнения
Например, из этого уравнения
2Н2 + О2 = 2Н2О
видно, что в реакции приняли участие 2 молекулы водорода и 1 молекула кислорода, образовав при этом 2 молекулы воды. Но молекула так малы, что увидеть их невозможно, и уж тем более нельзя взять их в руки. Поэтому в учебнике химии и появляется понятие моль – количество вещества, в котором содержится число Авогадро частиц (6,02*10 в двадцать третьей степени). Рядом с этим понятием стоит другое – молярная масса, то есть масса 1 моля частиц. Молярная масса совпадает с атомной или молекулярной, рассчитывается по таблице Менделеева и выражается в граммах на моль (г/моль).
Фото: pixabay.comФото: pixabay.com
Но мы прекрасно знаем, что не все вещества в обычных условиях находятся в твёрдом или жидком состоянии. Например, кислород, азот, хлор, неон – это газы. Резонно спросить: а как же их взвешивать? На этот случай химии для 8 класса припасено ещё одно понятие – молярный объём.
Что такое молярный объём
Тут следует запомнить, что в обычных условиях 1 моль любого газа занимает одинаковый объём. То есть молярный объём – это объём 1 моля любого газа. Сейчас советую на всякий случай вспомнить, что в 1 моле любого вещества (в том числе газа) содержится число Авогадро частиц. Старайтесь не забывать об этом факте.
Теперь надо обязательно упомянуть следующее. Все знают, что при изменении температуры и давления объём газов меняется. Так вот чтобы все расчёты вести правильно, то есть в одинаковых условиях, говорят о нормальных условиях: температуре 0 градусов Цельсия и давлении в 1 атмосферу (или 101,3 кПа). Это нужно просто запомнить:
нормальные условия в химии: температура – 0 градусов Цельсия, давление – 1 атм.
Экспериментально было доказано, что в нормальные условиях 1 моль любого газа занимает объем 22,4 литра.
То есть молярный объём любого газа в н.у. составляет 22,4 л/моль.
И это число тоже нужно запомнить! Оно даже важнее, чем сами нормальные условия, потому используется это число в решениях по химии намного чаще, чем н.у. (нормальные условия).
Как найти молярный объём
Очень просто. Если молярную массу для каждого вещества нужно рассчитывать по таблице Менделеева, то
молярный объём для всех газов одинаков.
Пример 1.
Молярная масса воды Н2О 18 г/моль (2*1+16, всё берем из периодической таблицы), молярная масса оксида кальция СаО 56 г/моль (40+16), молярная масса серной кислоты Н2SO4 98 г/моль (2*1+32+4*16).
Зато в нормальных условиях молярный объём кислорода О2 22,4 л/моль, молярный объём фтора P2 22,4 л/моль, молярный объём ксенона 22,4 г/моль. Приятно, не правда ли?
Другое дело, если речь идёт о химических реакциях. Но для начала просто потренируемся с цифрами.
Пример 2.
Определите объём, который занимают 10 моль кислорода в н.у.
Решение:
Молярный объём кислорода 22,4 л/моль, то есть 1 моль занимает 22,4 л. Следовательно, 10 моль будут занимать в 10 раз больше 22,4*10=224 литра. Это и есть ответ: 10 моль кислорода займут объём 224 литра.
Пример 3.
Известно, что неон в н.у. занял объём 5,6 литра. В каком количестве взят неон (в молях)?
Решение:
1 моль занимает объём 22,4 литра, а вот неизвестное число моль заняло объём 5,6 литра. Можно составить пропорцию:
1 моль — 22,4 литра
Х моль — 5,6 литра
Отсюда Х=1*5,6/22,4=0,25. Значит ответ такой: неон взяли в количестве 0,25 моль.
Пример 4.
Это уже расчёт по химической реакции, поэтому будьте внимательны. Итак, хлор прореагировал с водородом с образованием хлорида водорода:
Н2 + Cl2 = 2HCl
Для реакции взяли 11,2 литра водорода. Сколько понадобилось хлора (н.у.)?
Сколько понадобилось хлора (н.у.)?
Решение:
Посмотрим, сколько нам дано водорода по условию задачи. 1 моль водорода занимает объём 22,4 литра. Но у нас всего 11,2 литра водорода, то есть Х моль. Составим пропорцию:
1 моль – 22,4 литра
Х моль – 11,2 литра
Отсюда Х=1*11,2/22,4=0,5 моль водорода. Значит, по условию задачи у нас водорода 0,5 моль.
Из уравнения химической реакции Н2 + Cl2 = 2HCl видно, что нам нужно по 1 молю водорода и хлора (об этом говорят коэффициенты в уравнении). То есть, 1 моль водорода реагирует с 1 молем хлора. Но нам дали всего 0,5 моль водорода, сколько нам нужно хлора? Составим ещё одну пропорцию:
1 моль водорода реагирует с 1 молем хлора
0,5 моль водорода реагирует с Х молями хлора.
Отсюда получаем: Х=0,5*1/1=0,5 моль. Таким образом, нам нужно 0,5 моль хлора. А это количество занимает объём 22,4*0,5=11,2 литра.
Ответ: понадобилось 11,2 литра хлора.
В следующий раз мы научимся делать расчёты по реакциям, в которых участвуют и твёрдые вещества, и газы, то есть одновременно будем использовать молярную массу и молярный объём.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Количество вещества. Моль — единица количества вещества. Число Авогадро — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
В этом разделе вы узнаете…
• в каких единицах измеряют вещества;
• что это за зверь — моль;
• можно ли пересчитать молекулы;
• как можно измерять массу и объем моля;
• почему условия бывают ненормальными;
• может ли плотность быть относительной.
Вспомните:
• все вещества состоят из очень маленьких частиц; наименьшие из них — атомы, для удобства мы представляем их в виде шариков;
• атомы могут объединяться друг с другом и образовывать молекулы;
• каждое вещество характеризуется только ему присущими молекулами.
Количество вещества — физическая величина
Все, что человек видит вокруг себя, он старается описать в количественных характеристиках. Так, когда мы расходуем воду, мы определяем ее объем: сколько литров (или кубометров) ее вытекло из крана. Покупая конфеты, мы сообщаем продавцу их массу: сколько граммов необходимо взвесить. Но в некоторых случаях знания массы или объема будет недостаточно. Например, нужно купить столько яблок, чтобы хватило на всех учеников в школе. Довольно сложно пересчитывать тысячу или две тысячи яблок. Значительно проще будет сосчитать число ящиков с яблоками (при условии, что мы знаем, сколько яблок содержится в одном ящике). То есть в этом случае мы считаем не отдельные частицы, а число групп (порций) частиц (рис. 24.1).
То есть в этом случае мы считаем не отдельные частицы, а число групп (порций) частиц (рис. 24.1).
Рис. 24.1. Количественные характеристики
Для химических явлений и процессов не всегда нужно знать массу или объем вещества. Часто для определения количества вещества намного важнее знать число атомов или молекул, например при составлении уравнений химических реакций.
Для определения числа частиц используют специальную физическую величину — количество вещества. Ее обозначают латинской буквой n.
Она показывает, сколько частиц (структурных единиц) данного вещества содержится в том или другом образце.
Для веществ молекулярного строения такими частицами являются молекулы, а для веществ немолекулярного строения это могут быть атомы или ионы.
Количество вещества — физическая величина, которая показывает число структурных единиц вещества (атомов, молекул, ионов).
Моль — единица измерения количества вещества
Атомы и молекулы очень малы, поэтому неудивительно, что их число в природе огромно.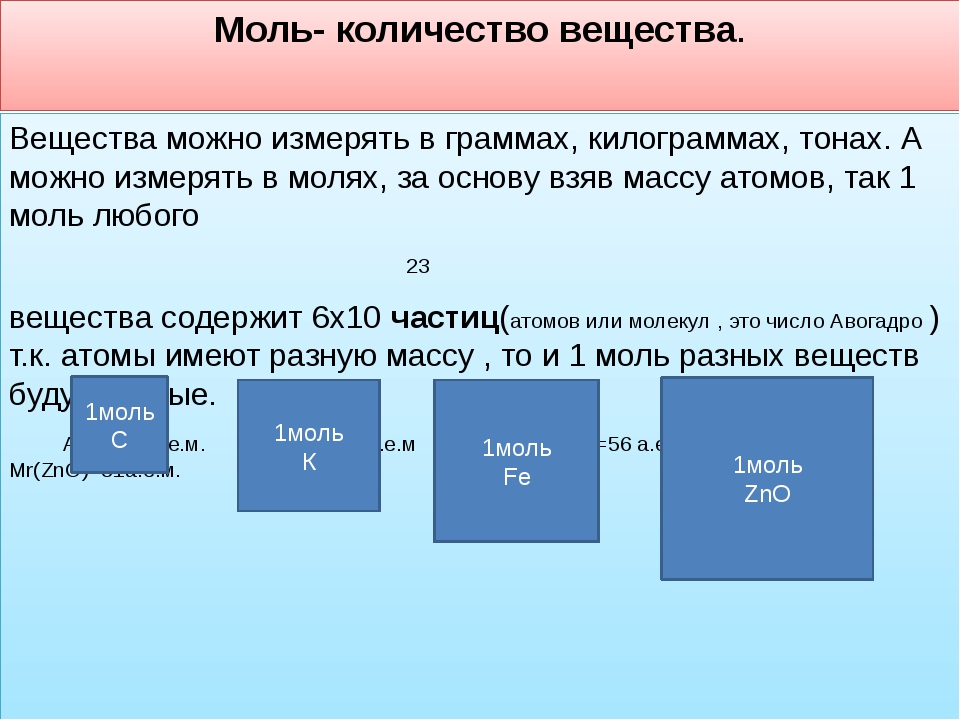 Даже в самом маленьком кристалле сахара число молекул превышает миллиард миллиардов. Поэтому практически невозможно пересчитывать отдельные молекулы. Для измерения количества вещества используют специальную единицу — моль.
Даже в самом маленьком кристалле сахара число молекул превышает миллиард миллиардов. Поэтому практически невозможно пересчитывать отдельные молекулы. Для измерения количества вещества используют специальную единицу — моль.
1 моль — это такое количество вещества, которое содержит 6,02 • 1023 структурных единиц этого вещества (атомов, молекул, ионов).
К количеству вещества следует относиться как к обычному числу, которое позволяет выразить число атомов или молекул в определенной порции вещества (рис. 24.2). В том, что один моль вещества содержит такое «экзотическое» число частиц, нет ничего удивительного. Подобные числа (или порции) нам встречаются довольно часто, и используем мы их для измерения массы, объема, времени и даже денег. Большинство из них довольно простые числа. Например, одна тонна — это одна тысяча килограммов, один кубический метр — это одна тысяча литров, один час — это 60 минут, одна гривня — это сто копеек. Существуют также величины измерения, не кратные десяти: одни сутки — это 24 часа, одна дюжина — это 12 штук, один карат — это 0,2 грамма, а один световой год — это почти 9,5 • 1012километров.
Рис. 24.2. Для измерения количества можно пользоваться различными единицами: карандаши считают штуками, бумагу — листами, атомы — молями
У каждого вещества есть свои собственные структурные единицы. Например, уголь состоит из атомов Карбона, а сера — из молекул S8. Поэтому у образцов различных веществ количеством вещества 1 моль разные массы и объемы (рис. 24.3).
Рис. 24.3. Образцы веществ количеством 1 моль
Число Авогадро
Число 6,02 • 1023 называют числом Авогадро в честь итальянского ученого Амедео Авогадро. Почему именно такое число было выбрано для определения моля вещества? Дело в том, что столько атомов содержится в образце углерода массой 12 г, что в современной науке используют в качестве стандарта для определения атомной единицы массы. Учитывая это, можно дать еще одно определение моля:
1 моль — это такое количество вещества, в котором число частиц (атомов или молекул) равно числу атомов Карбона 12С, содержащихся в образце углерода массой 12 г.
Лоренцо Романо Амедео Карло Авогадро ди Кваренья ди Черето (1776-1856)
Итальянский физик и химик. Получил юридическое образование, после чего стал доктором церковного законоведения. В 24 года начал изучать естественные науки. С 1809 г. был профессором высшей физики в Туринском университете. С 1850 г. директор отделения физики и математики Туринской академии наук. Ввел в науку понятия «молекула» и «молекулярный вес». На основании открытого им закона разработал метод определения молекулярных и атомных масс. Первым установил, что формула воды — Н2O, а не НО, как считали раньше. Установил состав многих веществ — водорода, кислорода, азота, аммиака, оксидов Нитрогена, Хлора, Фосфора и др. Впервые правильно определил атомную массу многих элементов. Заложил основы атомно-молекулярной теории. Однако его труды было признаны лишь после его смерти на Международном конгрессе химиков в Карлсруэ в 1860 г.
Числу Авогадро численно равна постоянная Авогадро NA. Эта постоянная, в отличие от числа Авогадро, выражается в единицах на моль (1/моль или моль-1):
Эта постоянная, в отличие от числа Авогадро, выражается в единицах на моль (1/моль или моль-1):
NA = 6,02 • 1023 моль-1
Для большинства расчетов число Авогадро округляют до 6 • 1023.
Известно, что один атом Карбона нуклида 12С имеет массу 1,9993 • 10-23 г. Следовательно, в 12 граммах такого углерода число атомов Карбона равно:
Из курса химии 7 класса вам известно, что одна атомная единица массы равна 1,66 • 10-24 г. Произведение атомной единицы массы и числа Авогадро равно 1 г:
Таким образом, определение моля непосредственно связано с определением единицы массы атомов и молекул, а число Авогадро является коэффициентом пропорциональности между массой атомов и их относительной атомной массой.
Решение задач с использованием количества вещества
Зная постоянную Авогадро, можно любое количество вещества выразить в молях. Если вещество содержит N молекул (или структурных единиц), то количество вещества равно:
Если вещество содержит N молекул (или структурных единиц), то количество вещества равно:
Наоборот, зная количество вещества в молях, можно вычислить число частиц:
Задача 1. В комнате содержится 2,77 • 1026 молекул кислорода. Вычислите количество вещества кислорода.
Задача 2. Вычислите число атомов Оксигена и Гидрогена, которые содержатся в 5 моль воды.
Задача 3. В стакане содержится около 11 моль молекул воды. Определите число молекул в стакане.
Лингвистическая задача
У слов «моль» и «молекула» общий корень, они пришли к нам из латинского языка. На латыни moles — «тяжесть, глыба». А слово «молекула» (с уменьшительным латинским суффиксом — cula) означает маленькую массу. Как вы объясните толкование терминов «моль» и «молекула»?
• Сделать вывод о том, насколько огромно численное значении постоянной Авогадро, можно с помощью следующего сравнения: площадь поверхности нашей планеты равна 510 млн км2. Если равномерно рассыпать по всей поверхности 6,02 • 1023 песчинок диаметром всего лишь 1 мм, то они образуют слой песка толщиной более одного метра.
Если равномерно рассыпать по всей поверхности 6,02 • 1023 песчинок диаметром всего лишь 1 мм, то они образуют слой песка толщиной более одного метра.
• В наше время получен силиций чистотой 99,9999999 %. Это означает, что среди одного миллиарда атомов Силиция находится лишь один атом другого элемента.
• В Америке ученые празднуют День числа Авогадро. Празднование проходит с 6 часов 02 минут утра 23 октября до 6 часов 02 минут следующего дня.
Выводы
1. Количество вещества — физическая величина, позволяющая измерять количественные характеристики вещества. Она показывает число структурных единиц вещества в определенном образце.
2. Количество вещества обозначают буквой n; единица измерения — моль. В веществе количеством 1 моль содержится 6,02 • 1023 структурных единиц этого вещества (атомов, молекул, ионов).
3. Число 6,02 • 1023 называют числом Авогадро. Оно равно числу атомов Карбона, которое содержится в образце углерода массой 12 г. Постоянная Авогадро обозначается символом NA и равна 6,02 • 1023 моль-1.
Постоянная Авогадро обозначается символом NA и равна 6,02 • 1023 моль-1.
Контрольные вопросы
1. Дайте определение понятий «количество вещества» и «моль».
2. Какую размерность имеет постоянная Авогадро? Чему равно ее значение?
3. Предложите способы, какими можно наглядно продемонстрировать, насколько велико число Авогадро.
4. Приведите формулу для вычисления количества вещества по известному числу частиц.
Задания для усвоения материала
1. В ложке воды содержится около 0,5 моль вещества. Вычислите число молекул воды в ложке.
2. В стакан помещается около 1,5 моль сахара. Вычислите число молекул сахара в стакане.
3. В воздушном шаре содержится около 0,9 • 1023 молекул азота. Вычислите количество вещества азота (в молях).
4. Вычислите количество вещества атомов Оксигена, которое содержится в углекислом газе СO2 количеством: а) 0,5 моль; б) 2 моль?
5. Вычислите количество вещества озона O3, если известно, что число атомов Оксигена в нем составляет: а) 3 • 1023; б) 0,6 • 1019; в) 3 моль; г) 0,18 моль.
Вычислите количество вещества озона O3, если известно, что число атомов Оксигена в нем составляет: а) 3 • 1023; б) 0,6 • 1019; в) 3 моль; г) 0,18 моль.
6. Вычислите количество вещества атомов каждого химического элемента, которое содержится в 1 моль следующих соединений: а) Сl2; б) H2SO4; в) Н3РO4; г) Fe2O3; д) Са(ОН)2.
Глава 12. Основные понятия и принципы молекулярно-кинетической теории
В задания ЕГЭ по физике всегда включаются задачи, касающиеся основных принципов молекулярно-кинетической теории. Это задачи, связанные с молекулярной структурой газов, жидкостей и твердых тел, с определением температуры, с методами подсчета числа составляющих тело молекул. В этой главе собраны задачи, связанные с понятиями моля и температуры.
Молем вещества называется такое количество этого вещества, которое содержит приблизительно молекул, причем независимо от того, какое это вещество (точнее ). Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
| (12.1) |
Обратим внимание читателя на то, что моль — макроскопическое количество вещества (в переводе с латинского языка — языка средневековой науки — слово moles означает толпа).
Масса одного моля вещества называется молярной массой этого вещества. И поскольку массы молекул разных веществ — разные, а число молекул в моле разных веществ одинаковое, то молярные массы веществ различны. При этом отношение молярных масс двух веществ равно отношению масс их молекул. Поэтому массы молей пропорциональны массам молекул. Число Авогадро (12.1) было подобрано так, чтобы масса моля, выраженная в граммах, численно совпадала с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Поэтому массы молей различных веществ легко найти из периодической системы химических элементов. Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Необходимо также знать определение температуры. Температура тела — величина, пропорциональная средней кинетической энергии молекулы
| (12.2) |
где — средняя кинетическая энергия молекулы, — абсолютная температура (ее называют также температурой в шкале Кельвина), — постоянная, которая называется постоянной Больцмана. Из формулы (12.2) следует, что температура по шкале Кельвина не может быть отрицательна, ее минимальное значение (абсолютный нуль температуры) достигается, когда все молекулы имеют нулевые кинетические энергии. 1 градус шкалы Кельвина (или просто один Кельвин) совпадает с градусом более привычной в быту шкалы Цельсия, нуль которой определяется как температура плавления льда, а температура 100 отвечает температуре кипения воды при атмосферном давлении. Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
В задаче 12.1.1 правильным ответом правильным ответом является ответ 3, поскольку число молекул в моле не зависит от того, какое это вещество, и равно числу Авогадро.
Поскольку массы молекул разных веществ — разные, одинаковые массы разных веществ содержат различные количества молекул. Найти эти количества можно, зная молярные массы и число Авогадро. Например, в задаче 12.1.2 можно провести такие рассуждения. Водород массой 1 г составляет половину моля, и, следовательно, содержит молекул. Кислород массой 1 г составляет 1/32 часть моля, и, следовательно, содержит молекул. Отсюда находим отношение числа молекул в 1 г водорода к числу молекул в 1 г кислорода: (ответ 1).
Согласно определению число молекул в моле одинаково для любого вещества, причем независимо от того, сколько атомов входят в состав одной молекулы этого вещества. Другими словами, это число не зависит от того, являются ли молекулы одно-, двух-, и т.д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
Поскольку число молекул в моле любого вещества равно числу Авогадро, то для молярной массы любого вещества справедливо соотношение: , где — масса одной молекулы. Отсюда находим в задаче 12.1.4, что (ответ 1).
Чтобы понять, сколько молей содержит та или иная масса вещества, нужно разделить эту массу на молярную массу данного вещества (или число содержащихся в ней молекул на число Авогадро). Поскольку молярная масса гелия равна 4 г/моль, то 10 г гелия в задаче 12.1.5 составляют 4/10 = 2,5 моль (ответ 1).
Для характеристики числа молекул в некоторой массе вещества принято использовать величину, которая называется количество вещества. Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества). Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества). Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Как указывалась во введении к настоящей главе, молярные массы веществ можно найти по периодической таблице элементов. Масса моля, выраженная в граммах, численно совпадает с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Из приведенной в условии задачи 12.1.7 клетки таблицы, отвечающей рутению, находим массу молекулы рутения = 101,07 а.е.м. (второе число в клетке, которое для всех элементов является обязательно целым, представляет собой порядковый номер элемента). Поэтому для рутения находим: = 101,07 ≈ 101 г/моль (ответ 2).
Связь температуры и средней кинетической энергии молекул определяется формулой (12. 2) (задача 12.1.8 – ответ 2).
2) (задача 12.1.8 – ответ 2).
Температурой плавления льда (и замерзания воды) является температура 0 . Поскольку нуль шкалы Кельвина (абсолютный нуль температуры) в шкале Цельсия составляет –273 (см. введение к настоящей главе), то температура плавления льда по абсолютной шкале равна 273 (задача 12.1.9 — ответ 3).
Изменением температуры тела в некотором процессе называется разность его конечной и начальной температур тела . Так как температуры в шкале Цельсия и Кельвина связаны «сдвигом»: , то разность температур в градусах Кельвина и в градусах Цельсия совпадает:
Другими словами, изменение температуры тела одинаково при задании температуры как в шкале Кельвина, так и в шкале Цельсия. Поэтому правильный ответ в задаче 12.1.10 — 2.
В задаче 12.2.1 нужно снова использовать определение количества вещества. Напоминаем, что количеством вещества называется число молей, составляющих данную порцию вещества. Отсюда находим количество вещества водорода моль и количество кислорода моль в сосудах. Поэтому (ответ 1).
Отсюда находим количество вещества водорода моль и количество кислорода моль в сосудах. Поэтому (ответ 1).
Из периодической таблицы элементов имеем для масс атомов: = 1 а.е.м., = 14 а.е.м., = 16 а.е.м. (задача 12.2.2). Отсюда находим массу молекулы азотной кислоты
Поэтому = 63 г/моль (ответ 4).
Масса одной молекулы углерода = 12 а.е.м. А поскольку моль углерода содержит , то масса моля углерода равна а.е.м. (задача 12.2.3 – ответ 1).
Поскольку молярная масса — это характеристика вещества, то, находя эту величину, можно определить вещество. Например, в задаче 12.2.4 плотность газа (масса единицы объема) и концентрация молекул (число молекул в единице объема), очевидно, связаны друг с другом через массу одной молекулы . Умножая правую и левую часть этой формулы на число Авогадро и учитывая, что , получим = 4 г/моль. Поэтому неизвестный газ — гелий (ответ 2).
Используя определение температуры (12.2), получим для средней скорости молекул водорода в задаче 12.2.5
(ответ 3).
Из определения температуры (12.2) следует, что при повышении температуры в 2 раза средняя скорость молекул увеличивается в раз (задача 12.2.6 – ответ 3).
При приведении газов в тепловой контакт их температуры выровняются (задача 12.2.7). Отсюда согласно определению температуры следует, что средние кинетические энергии молекул газов станут равными:
или (ответ 3).
Задача 12.2.8 аналогична предыдущей. Используя определение температуры (12.2) для каждого газа и учитывая, что независимо от того, сколько атомов входит в состав молекулы, в правую часть определения температуры (12.2) входит коэффициент 3/2, получим
где — средняя скорость молекул водорода, — средняя скорость молекул гелия. Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
(ответ 2).
Поскольку моль любого вещества содержит одинаковое количество молекул, то для сравнения числа молекул воды и ртути в стакане (задача 12.2.9) можно сравнить число молей. Число молей воды и ртути в стакане найдем из следующих цепочек формул. Воды:
| (1) |
Ртути:
| (2) |
где и — массы и плотности веществ, — молярные массы, — объем стакана. Сравнивая величины (1) и (2), заключаем
(здесь использованы плотности и молярные массы воды и ртути). Поэтому в стакане ртути больше молекул, чем в стакане воды (ответ 2), причем в 67/55 =1,2 раза.
Сначала обратим внимание читателя, что предложенные в задаче 12. 2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
(ответ 4).
Молярный объем
Молярный объём – это объём 1 моль вещества. Понятие молярного объема применимо для газов. Например, если взять 1 моль воды, то мы не взвешиваем на весах 18 г воды, т.к. это совершенно неудобно, а зная, что плотность воды 1 г/мл, мы измеряем её объем цилиндром или мензуркой.
Молярный
объем воды в таком случае будет равен 18 мл/моль. Молярный
объём твёрдых веществ и жидкостей зависит от их плотности. Молярный
объём воды, кислоты, сахара и соли отличается между собой, потому что и
плотности их тоже отличаются.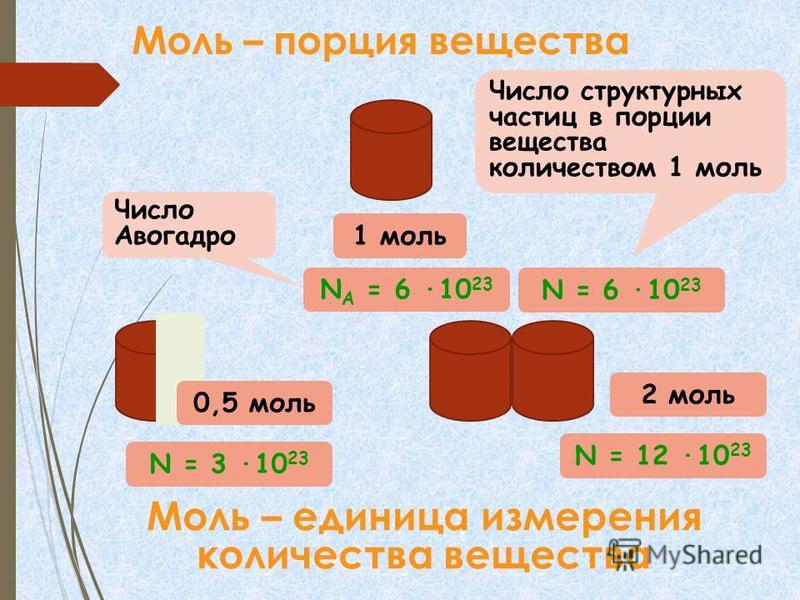
Если взять 1 моль кислорода, 1 моль углекислого газа, 1 моль водорода, то при одинаковых нормальных условиях они будут занимать одинаковый объем, равный 22,4 л. Эти газы также будут содержать и одинаковое число частиц, т.е. 6,02 · 1023. Нормальными условиями или н.у. принято считать температуру 0 0С (градусов по Цельсию) и давление 760 мм. рт. ст. (миллиметров ртутного столба) или 101,3 кПа (килопаскаля).
Следовательно, молярный объём – это объём газа количеством 1 моль. Обозначается молярный объём, как и любой другой объем, но с символом Vm.
Кроме того, молярный объём – это физическая величина, равная отношению объёма вещества к количеству вещества. Это можно записать в виде формулы:
Vm=
V
–
это объём газа, n
–
это количество вещества.
Из этого выражения можно найти и V.
V= n · Vm
Единицей измерения молярного объёма является л/моль, и т.к. это величина постоянная при нормальных условиях, то молярный объём равен 22,4 л/моль.
Объём 1 кмоля называют киломолярным объёмом и измеряют в м3/кмоль, т.е. он равен 22,4 м3/кмоль, а объём 1 ммоля называют миллимолярным объёмом, измеряют его в мл/ммоль, т.е. миллимолярный объём равен 22, 4 мл/ммоль.
Используя новые формулы, решим задачи.
1. Найдите объём азота (N2) количеством 2 моль.
Найдем объем азота (N2)
количеством 2 моль. По условию нам дано количество вещества азота – 2 моль.
Найти необходимо его объем. Для решения задачи используем формулу нахождения
объема газа через количество вещества, т. е. нужно молярный объем умножить на
количество вещества. Подставляем значения в формулу, т.е. 22,4 литра на моль
умножаем на 2 моль, в результате получаем 44,8 литра. Следовательно, 2 моль
азота занимает объем 44,8 л.
е. нужно молярный объем умножить на
количество вещества. Подставляем значения в формулу, т.е. 22,4 литра на моль
умножаем на 2 моль, в результате получаем 44,8 литра. Следовательно, 2 моль
азота занимает объем 44,8 л.
2. Найдите количество вещества озона (O3) объёмом 67,2 л.
По условию задачи нам дан объем озона – 67,2 литра, найти нужно количество вещества озона. Для решения задачи используем формулу: объем, разделенный на молярный объем, подставим значения в формулу, т.е. 67,2 литра делим на 22,4 литра на моль, получаем результат – 3 моль. Поэтому 3 моль озона занимают объем 67,2 л.
Крот
Следующее содержание является содержанием лекции 8. В этой лекции мы рассмотрим моль и число Авагадро, а также расчет молярной массы и преобразования с использованием молей.
МОЛЬ (моль) — это единица измерения, представляющая собой количество чистого вещества, содержащего такое же количество химических единиц (атомов, молекул и т. д.), сколько атомов содержится ровно в 12 граммах углерода-12 (т. е. 6,022 X 10 23 ).
д.), сколько атомов содержится ровно в 12 граммах углерода-12 (т. е. 6,022 X 10 23 ).
Итак, моль — это название, используемое для количества 6.022 x 10 23 во многом так же, как слово «дюжина» используется для обозначения суммы 12.
Итак, если бы у вас была моль пончиков, у вас было бы 6,022 x 10 23 пончиков и сильная боль в животе.
Мы используем моль (моль) для представления количества веществ в химии, потому что количество атомов и молекул в каждом веществе очень велико. Значение 6,022 x 10 23 называется числом Авагадро в честь ученого, который нашел количество атомов в 12 граммах углерода 12.Зачем использовать 12 грамм? Это теоретическая атомная масса изотопа углерода-12 (6 протонов и 6 нейтронов). Это означает, что атомная масса или атомный вес (12 граммов) углерода точно равна 1 молю углерода.
Используя углерод в качестве эталона, атомные веса, которые вы видите в периодической таблице, также равны одному молю этих веществ:
Литий
, например, имеет атомную массу 6,941 грамма, что равно одному молю лития. Вот почему мы указываем атомную и молекулярную массу в граммах на моль или г/моль.
Вот почему мы указываем атомную и молекулярную массу в граммах на моль или г/моль.
Что мы можем сделать с родинками? Мы используем устройство для проведения расчетов на основе сбалансированных химических уравнений. Мы используем стехиометрию (причудливый способ выражения молярных соотношений в уравнении), чтобы делать прогнозы о том, сколько продукта или реагента потребуется, если мы знаем количество одного моля в реакции.
Моль вещества и молекулярная масса
Молярная масса или молекулярная масса (взаимозаменяемые термины, пока мы находимся на Земле) вещества представляет собой сумму всех индивидуальных масс содержащихся в нем элементов.Чтобы использовать нашу старую знакомую воду в качестве примера:
Один моль воды состоит из 1 моля кислорода и двух молей водорода. Масса кислорода, равная одному молю кислорода, равна 15,998 г, а масса одного моля водорода равна 1,008 г. Если суммировать количества каждого элемента в молекуле воды в граммах = 15,998 г/моль + 2 (1,008 г/моль), мы получим молярную массу воды = 18,014 г/моль.
Итак, если бы у нас было ровно 18,014 г воды, у нас был бы 1 моль воды.
Практика: моль и молярная масса
Родственные связи
Причина, по которой моль так важна, заключается в том, что мы используем моль в качестве единицы для большинства взаимосвязей в химии.Реакции уравновешиваются на основе количества молей каждого элемента в реакции, концентрации растворов очень часто описываются в молях на литр или молях на кг растворителя, и мы уже видели, что молекулы или атомы элемента указываются как молей вещества, а не индивидуальное количество их частиц.
Давайте начнем обсуждение отношений с отношениями между кротом и AMU.
AMU составляет 1/12 массы атома углерода-12, который согласно периодической таблице весит около 12 г.Это означает, что 1 AMU ≈ 1 г, верно? и, таким образом, углерод имеет массу 12 а. е.м., верно? Но подождите, это не может быть масса одного атома углерода, верно? Они действительно очень маленькие. И это правильно, масса, указанная в периодической таблице, на самом деле является массой 6,022 x 10 23 атомов углерода или моля атомов углерода. Таким образом, в действительности 1 АМЕ = 1,66 x 10 -24 г, и хотя атом углерода весит 12 АМЕ, масса, указанная в периодической таблице, равна
е.м., верно? Но подождите, это не может быть масса одного атома углерода, верно? Они действительно очень маленькие. И это правильно, масса, указанная в периодической таблице, на самом деле является массой 6,022 x 10 23 атомов углерода или моля атомов углерода. Таким образом, в действительности 1 АМЕ = 1,66 x 10 -24 г, и хотя атом углерода весит 12 АМЕ, масса, указанная в периодической таблице, равна
12 атомов x 1,66 x 10
-24 г x 6.022 x 10 23 атомов/моль= 12 г/мольТаким образом, один атом углерода весит 12 а.е.м., а моль атомов углерода весит 12,01 г/моль.
Расчеты молей
Существует множество вычислений, которые можно провести, используя единицу измерения молей в качестве промежуточного значения. Сейчас я рассмотрю некоторые из них, и по мере того, как мы будем продвигаться по более поздним темам, вы увидите, что родинки также важны для этих вычислений.
Типичные расчеты молей:
1) Расчет молекулярной массы или молярной массы соединения
Молярная масса соединения, которую на Земле также часто называют молекулярной массой, представляет собой просто сумму масс всех отдельных элементов в соединении.Вы используете периодическую таблицу в качестве эталона для этих масс и суммируете их:
Например, если мы хотим суммировать молярную массу сульфата алюминия Al 2 (SO 4 ) 3 , нам нужно определить количество и массу каждого элемента в соединении. Для сульфата алюминия общее количество составляет 2 Al, 3 S и 12 O. Итак, вот математика с использованием атомных масс, указанных в периодической таблице:
.2(26,98 г/моль) + 3(32,07 г/моль) + 12(16.00 г/моль) = 342,17 г/моль
2) Преобразование граммов в моли или молей в граммы
Как только вы узнаете молярную массу соединения, вы можете использовать эту массу для определения количества молей в грамме вещества или, наоборот, вы можете рассчитать количество граммов в мольном количестве вещества.
Вот несколько примеров:
Сколько молей содержится в 55,4 г сульфата алюминия?
Расчет настраивается как преобразование с молярной массой сульфата алюминия в качестве коэффициента преобразования:
55.4G AL
2 (SO 4 ) 3 ) 3 x 1 Mol al 2 (SO 4 ) 3 /342.17 G AL 2 (SO 4 ) 3 = 0.162 Mol al 2 (СО 4 ) 3Или сколько граммов Al 2 (SO 4 ) 3 содержится в 6,34 молях Al 2 (SO 4 ) 3 ?
6.34 Mol al
2 (SO 4 ) 3 ) 3 x 342.17G AL 2 (SO 4 ) 3 /1 Mol AL 2 (SO 4 ) 3 = 2 .17 x 10 3 Алюминий 2 (SO 4 ) 33) Преобразование в молекулы или атомы
Помимо того, что моль является единицей молекулярной массы, моль также является связующим звеном между массой вещества и его атомами или молекулами.
Например, если спросить, сколько молекул Al 2 (SO 4 ) 3 содержится в 55,4 г Al 2 (SO 4 ) 3 , нам просто нужно сначала вычислить приведенное выше количество молей, как и раньше, а затем используйте число Авагадро, чтобы преобразовать моли в молекулы:
55.4G AL
2 (SO 4 ) 3 ) 3 x 1 Mol al 2 (SO 4 ) 3 /342.17 G AL 2 (SO 4 ) 3 = 0.162 Mol al 2 (СО 4 ) 30.162 Mol al
2 (SO 4 ) 4 ) 3 x 6.022 x 10 23 молекул Al 2 (SO 4 ) 3 /1 Mol AL 2 (SO 4 ) 3 =9,76 x 10
22 Молекулы Al 2 (SO 4 ) 3 Кроме того, если мы продолжим задачу и спросим, сколько атомов алюминия содержится в 55. 4 г Al 2 (SO 4 ) 3 ?
4 г Al 2 (SO 4 ) 3 ?
Ну, это простое продолжение. Нам просто нужно умножить на количество атомов алюминия в соединении:
9.76 x 10
22 Молекулы AL 2 (так 4 ) 3 ) 3 x 2 Atoms Al / 1 Molecule AL 2 (SO 4 ) 3 = 1,95 х 10 23 Атомы AlДавайте еще потренируемся:
Насколько велика родинка? |
Существует около 20 видов пушистых кротов (тех, что ползают по земле) и один вид кротов, который может появиться на вашем лице, но сегодня день празднования другого вида кротов.Сегодняшний крот — это единица, изобретенная человеком по имени Авогадро.
Действительно, крот — это просто группа объектов. Вы можете думать о «кроте» так же, как о «дюжине». Вы, вероятно, знакомы с дюжиной яиц, цыплят или планет. Родинки ничем не отличаются. У вас может быть моль молекул, или людей, или чизбургеров. Но в кроте гораздо больше двенадцати вещей — их 6,02 х 10 23 . Это 602 000 000 000 000 000 000 000 вещей. Поскольку моль содержит так много единиц, они чаще всего используются в химии как способ измерения действительно очень маленьких вещей, таких как атомы или молекулы.
Родинки ничем не отличаются. У вас может быть моль молекул, или людей, или чизбургеров. Но в кроте гораздо больше двенадцати вещей — их 6,02 х 10 23 . Это 602 000 000 000 000 000 000 000 вещей. Поскольку моль содержит так много единиц, они чаще всего используются в химии как способ измерения действительно очень маленьких вещей, таких как атомы или молекулы.
Итак, моль воды равен 6,02 x 10 23 молекул воды, что составляет около 18 граммов или 18 мл. Моль алюминия составляет около 26 граммов. Но чтобы по-настоящему оценить, сколько молекул содержится в моле, полезно подумать о вещах, которые мы можем видеть. Для этого давайте попробуем провести сравнение из урока Даниэля Дулека о том, насколько велика родинка.
Способ представить относительный размер родинки?
Если бы у вас был моль пончиков, они покрыли бы всю Землю слоем пончиков толщиной в пять миль.
Если бы у вас был крот из баскетбольных мячей, вы могли бы создать новую планету размером с Землю!
Если бы вы получили моль пенни в день своего рождения и тратили по миллиону долларов в секунду, пока не умерли в возрасте 100 лет, у вас все еще было бы более 99,99% ваших денег в банке.
Один моль эритроцитов — это больше эритроцитов, чем у каждого человека на Земле прямо сейчас. Крот коробок с хлопьями, сложенных встык, достанет от Солнца до Плутона 7.5 миллионов раз. Крот индейки может образовать шестнадцать земель.
Итак, теперь, когда мы знаем, почему в кроте содержится 6,02 x 10 23 вещей, что мы можем сделать с этой информацией? Родинки в химии гораздо полезнее, чем родинки на земле или на лице. Они учитываются во всех видах уравнений и важных понятиях химии. Химики думают о молях или атомах, как вы, а я думаю о дюжине яиц — мы добавляем их в рецепты, заказываем в магазине и рассчитываем, что нам нужно, исходя из того, сколько у нас есть.
Как бы выглядела родинка пушистых кротов? Ну, куча животных весила бы чуть больше половины массы нашей Луны. К счастью, в мире нет химического уравнения, которое требует такого количества млекопитающих. Но если бы это было так, вы бы теперь знали, сколько это было бы млекопитающих.
Насколько велика родинка?
Я люблю заполнять пустые дни. Однако есть проблема с днем крота. День крота, конечно же, 23.10. Знаешь, крот? Один моль равен 6,02 x 10 23 Число Авогадро.Возьми? 10 на 23? Хорошо, прежде чем я перейду к проблемам с родинками, позвольте мне взглянуть на два других дня.
День Пи — 14 марта
Очевидно, это праздник числа Пи. Действительно, один из самых крутых номеров. В качестве бонуса день Пи также является днем рождения Альберта Эйнштейна. Итак, что вы могли бы сделать в день числа Пи? Вы можете посмотреть на соотношение между диаметром и окружностью круглых объектов. Очень просто. Или вы можете вычислить Пи, используя случайные числа (я так и сделал). Ключевым моментом является то, что вы можете численно связать длину окружности и диаметр.
Ключевым моментом является то, что вы можете численно связать длину окружности и диаметр.
g-day — 9/8
Я не знаю, прижился ли еще этот гиковский праздник, но я продвигаю его. Это торжество местного гравитационного поля (9,8 Н/кг). Что ты делаешь в день рождения? (что не является сокращением от «добрый день», просто чтобы вы знали) Вы стреляете в вещи, вы бросаете вещи. На самом деле возможности безграничны. В следующем году я думаю о том, чтобы сбрасывать арбузы со здания и предлагать зрителям определить местное гравитационное поле. Ключевой момент — 9,8 — это доступное число.
Проблема с днем крота — 23.10
Чем можно заняться в день крота? Лучше всего было бы показать родинку чего-нибудь.Моль алюминия легко показать. Это всего 26 или около того граммов. Но большой крик. Откуда кто знает, что это крот? Вы видите каждый атом алюминия? Нет. Берите пример. А как насчет 1/2 — дюжинного дня? Кто-нибудь когда-нибудь видел дюжину яиц?
Итак, вопрос: могу ли я показать одну родинку чего-то, чтобы вы также могли видеть отдельные части? Честно говоря, я не знаю. Но черт возьми, я попробую.
Но черт возьми, я попробую.
Как насчет моля крупинки соли? Я вижу отдельное зерно соли. Насколько большой будет родинка? Проблема в том, что даже в 1/4 -й чайной ложки соли больше крупинок, чем мне хотелось бы сосчитать.У меня нет под рукой грейдера 8 th , чтобы пересчитать 1000 зерен. Следующим лучшим способом является обман. Я умею обманывать.
Вот изображение 41 крупинки соли. О, я знаю, что не могу получить объем (плотно упакованный объем). Но я могу получить массу. Вы не можете получить массу 41 крупинка соли. Это невозможно даже для компьютера. Это возможно. Мы привыкли к бычьему глазу соли еще в Каньоне Беггера, и они не намного больше, чем 2 метра.
Вот обманная часть.Я использовал аналитические весы нашего факультета (Юго-восточный университет Луизианы). При этом я получаю массу 0,0077 грамма. Теперь, для следующей части. Вот градуированный цилиндр, наполненный солью. Около 23 мл (извините за картинку).
Крот кротов
Что произойдет, если собрать моль (единицу измерения) кротов (маленьких мохнатых тварей) в одном месте?
— Шон Райс
Вещи становятся немного ужасными.
Сначала несколько определений. Моль — это единица.{23}\)). Это такой большой число, потому что оно используется для подсчета количества молекул, которые много.
«Один моль» близко к числу атомов в грамме водорода. Его также, случайно, приличное приблизительное предположение о количестве зерен песок на Земле.
Крот также относится к роющим млекопитающим. Есть несколько типов родинок, и некоторые из них действительно ужасающий.
Так что бы моль кротов — 602 214 129 000 000 000 000 000 животные-похожи?
Во-первых, давайте начнем с приблизительных приближений.это пример того, что может прийти мне в голову еще до того, как я возьму в руки калькулятор, когда я просто пытаюсь понять количество — вид расчет, где 10, 1 и 0,1 достаточно близки, чтобы мы могли считать их равными:
Я могу подобрать крота (животное) и бросить. [необходима цитата] Все, что я могу бросить, весит один фунт. Один фунт – это один килограмм. То
число 602 214 129 000 000 000 000 000 выглядит вдвое длиннее, чем
триллион, что означает, что это около триллиона триллионов. я случайно
помните, что триллион триллионов килограммов — это то, сколько весит планета.
я случайно
помните, что триллион триллионов килограммов — это то, сколько весит планета.
… если кто-то спросит, я сказал , а не , что можно было так считать.
Этого достаточно, чтобы понять, что речь идет о куче кротов на масштаб планет. Однако это довольно грубая оценка, поскольку она может отклоняться в тысячи раз в любом направлении.
Давайте лучше цифры.
Восточный крот ( Scalopus aquaticus ) весит около 75 граммов, что значит моль молей весит
\[ (6.{22} \) литров 3562 км, что означает, что мы говорим о сфере с радиусом 2210 километров, или куб 2213 миль на каждом ребре. (Это аккуратно совпадение, которого я никогда раньше не замечал — кубическая миля оказывается почти ровно \( \frac{4}{3}\pi \) кубических километров, поэтому сфера с радиусом X километров имеет тот же объем, что и куб со стороной X миль. с каждой стороны.)
Если бы этих кротов выпустили на поверхность Земли, они бы ее заполнили до 80 километров в глубину — почти до (бывшего) края космоса:
Этот удушающий океан мяса под высоким давлением уничтожит большую часть жизни на
планеты, что могло — к ужасу Reddit — угрожать целостности
DNS-система. Так что делать это на Земле определенно не вариант.
Так что делать это на Земле определенно не вариант.
Вместо этого соберем кротов в межпланетном пространстве. гравитационный притяжение втянуло бы их в сферу. Мясо плохо сжимается ну, так что он подвергся бы только небольшому гравитационному сжатие, и мы получим кротовую планету немного больше, чем Луна.
Кроты будут иметь поверхностную гравитацию примерно в одну шестнадцатую меньше, чем Земной — такой же, как у Плутона. Планета стартовала бы равномерно чуть теплым — вероятно, немного выше комнатной температуры — и гравитационное сокращение нагрело бы глубокую внутреннюю часть на несколько градусов.
Но вот тут все становится странно.
Кротовая планета теперь представляет собой гигантскую сферу из мяса. В нем много скрытого
энергии (на кротовой планете достаточно калорий, чтобы поддерживать
нынешнее население Земли за 30 миллиардов лет). Обычно при органическом
материя разлагается, она выделяет большую часть этой энергии в виде тепла. Но
на большей части недр планеты давление превышает
сто мегапаскалей, что достаточно для уничтожения всех бактерий и стерилизации
родинка остается, не оставляя микроорганизмов, способных разрушить родинку
ткани.
Ближе к поверхности, где давление ниже, есть еще один препятствие для разложения — внутри кротовой планеты мало кислород. Без кислорода обычное разложение не происходит, и единственные бактерии, которые могут разрушить родинки, это те, которые не требуют кислорода. Несмотря на свою неэффективность, это анаэробное разложение может разблокировать довольно много тепла. Если продолжать бесконтрольно, это приведет к нагреву планета до кипения.
Но разложение является самоограничивающимся. Немногие бактерии могут выжить при температуры выше примерно 60 °C, поэтому при повышении температуры бактерии отмирают, а разложение замедляется.По всей планете, тельца кротов постепенно распадаются на кероген, кашицу органических материя, которая, если бы планета была горячее, в конце концов образовала бы нефть.
Внешняя поверхность планеты излучает тепло в космос и замерзает.
Поскольку кроты образуют настоящую шубу, при замерзании она изолирует кожу.
внутрь планеты и замедляет отдачу тепла в космос. Тем не менее
в потоке тепла внутри жидкости преобладает конвекция. Перья
горячего мяса и пузырьков захваченных газов, таких как метан, — вместе с воздухом
из легких умерших кротов – периодически поднимаются через кротовину
корки и вулканически извергается с поверхности, гейзер смерти
выбрасывая тела кротов с планеты.
Тем не менее
в потоке тепла внутри жидкости преобладает конвекция. Перья
горячего мяса и пузырьков захваченных газов, таких как метан, — вместе с воздухом
из легких умерших кротов – периодически поднимаются через кротовину
корки и вулканически извергается с поверхности, гейзер смерти
выбрасывая тела кротов с планеты.
В конце концов, после столетий или тысячелетий беспорядков, планета успокаивается. и охлаждает настолько, что начинает замерзать насквозь. Глубоко внутри находится под таким высоким давлением, что при охлаждении вода кристаллизуется в экзотические формы лед, такой как лед III и лед V, и, наконец, лед II и лед IX (нет связь).
В общем, это довольно мрачная картина. Давайте попробуем альтернативу подход.
У меня нет надежных данных о глобальной популяции кротов (или небольших
биомассы млекопитающих в целом), но мы сделаем снимок в темноте и
подсчитали, что есть по крайней мере несколько десятков мышей, крыс, полевок и
других мелких млекопитающих на каждого человека.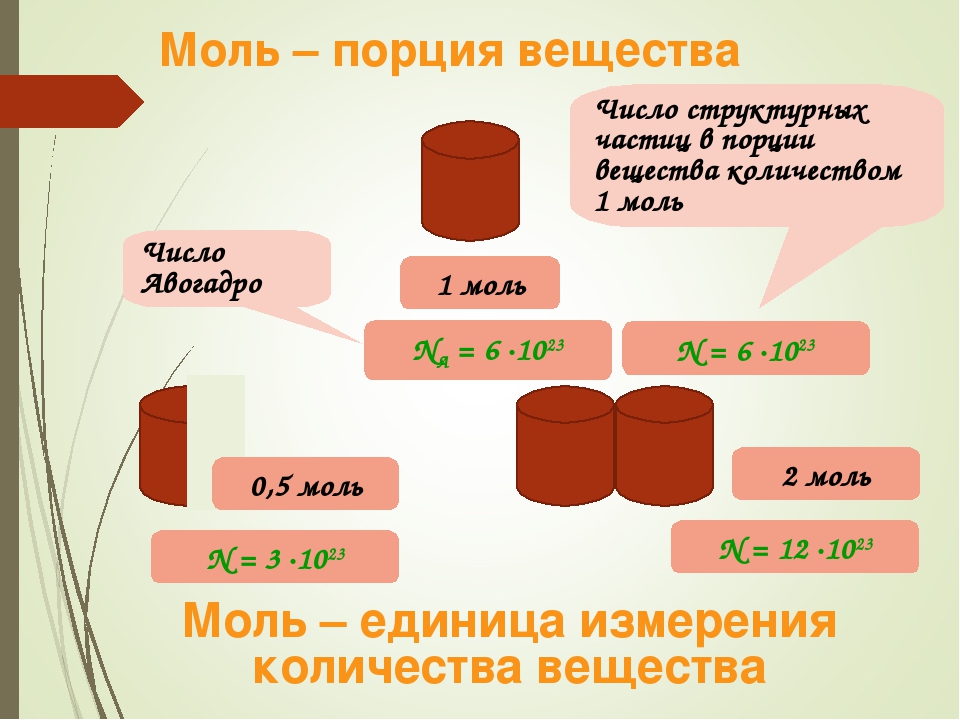
Может быть миллиард обитаемых планеты в нашей галактике. Если бы мы их колонизировали, мы бы точно привезли с собой мышей и крыс. с нами. Если бы хотя бы один из ста был населен мелкими млекопитающими в числа, подобные земным, через несколько миллионов лет — ненадолго, в эволюционного времени — общее число когда-либо живших превзошло бы Число Авогадро.
Хочешь крот из кротов — построй космический корабль.
моль
мольМолекулы и атомы настолько малы, что нам нужно их сосчитать в большем количестве, чем по одному.23 зажима = 150 молей
Расчет массы вещей:
Мы не можем увидеть ни одной молекулы воды, не говоря уже о том, чтобы определить ее массу.
Вместо этого нам нужно использовать массу моля молекул воды.
Тождество, которое мы использовали в предыдущих примерах, заключалось в том, сколько
вещи были в моль той вещи. Теперь мы будем использовать тождество
сколько массы имеет моль вещей. Например, моль
вода имеет массу 18,0 г. Моль углекислого газа имеет массу
44,0 г.
Моль углекислого газа имеет массу
44,0 г.
Пример: Какова масса 2.36 атомов?
Сколько лет вам понадобится, чтобы сосчитать 3 моля пенни со скоростью 2 копейки в секунду? Каждая молекула воды содержит 2 атома водорода. Как много атомов водорода в 5 молях воды? Какова масса 7,5 молей углекислого газа (44,0 г/л крот)? Сколько молекул углекислого газа имеют массу 72,0 г? Вычисления в молях аналогичны преобразованию дюймов в футы. или подсчет стопок по десять, а затем умножение на десять.Если это все еще кажется вам чуждым, перечитайте примеры выше. Если у вас все еще есть проблемы, не стесняйтесь обращаться ко мне по телефону 651-486-9697 или по адресу [email protected]
Кроме того, для получения дополнительной информации посетите страницу мистера Логана о кроте. расчеты.
Вернуться на страницу введения здесь.
Автор: Дженнифер Каски, Средняя школа Махтомеди, Миннесота Создано: 12 июня 1999 г.
Обновлено: 28 июня 1999 г. URL-адрес: /lincon/w99/projects/apchem/apchem/mole.html
Моль (единица измерения) — New World Encyclopedia
моль (аббревиатура «моль») — основная единица СИ, которая измеряет количество вещества. Один моль вещества — это количество вещества, содержащее число сущностей Авогадро, которое составляет примерно 6,022×10 23 сущностей. Моль очень похож на «дюжину» в том смысле, что обе единицы могут использоваться для количественной оценки любого набора объектов, но моль обычно используется для измерения количества атомов, молекул и субатомных частиц в заданном количестве вещества.Определение
Один моль определяется как количество вещества в системе, которая содержит столько же элементарных частиц, сколько атомов содержится в 0,012 кг углерода-12, где атомы углерода-12 не связаны, находятся в состоянии покоя и в своей основной скорости. [1] Количество атомов в 0,012 кг углерода-12 известно как число Авогадро и определяется эмпирическим путем.
В настоящее время принятое значение составляет 6,0221415(10)×10 23 моль -1 (публикация Комитета по данным для науки и техники, 2002 г.).
Согласно SI [2] моль не безразмерна, а имеет свои собственные размеры, а именно «количество вещества», сравнимое с другими размерами, такими как масса и сила света. SI дополнительно определяет число Авогадро как имеющее единицу обратного моля, поскольку это отношение безразмерной величины и количества с единицей моля. [3] [4]
Отношение атомной единицы массы к числу Авогадро означает, что моль также может быть определен как: Количество вещества, масса которого в граммах равна его формульному весу. Например, атомный вес железа 55,845, поэтому моль железа весит 55,845 грамма. Это обозначение обычно используется химиками и физиками.
Масса (в граммах) одного моля химического элемента или соединения называется его молярной массой . [5] Используется в качестве коэффициента преобразования между количеством граммов чистого вещества (которое можно измерить напрямую) и количеством молей этого вещества.

Большинство инженеров-химиков, а также многие другие инженеры и ученые различают грамм-моль и килограмм-моль (кгмоль или кмоль): 55.845 граммов в грамм-моле железа и 55,845 килограмма в килограмм-моле железа. Точно так же инженеры и ученые в Соединенных Штатах используют фунт-моль (lbmol). Например, в фунт-моле железа содержится 55,845 фунтов. В дополнение к кгмоль, кмоль или фунт-моль также используются тонно-моли. Например, монооксид углерода (CO) имеет молекулярную массу 28, поэтому один моль CO содержит 28 г, один фунт-моль CO содержит 28 фунтов, а одна тонно-моль CO содержит 28 тонн. Следует отметить, однако, что только «грамм-моль» одобрен SI — ни одно из этих производных не является официальными единицами.Правильно, грамм-моль называется просто моль, и число Авогадро напрямую связано с этим молем — его отношение к фунт-молям или другим вариантам требует коэффициента пересчета.
Элементарные объекты
Когда моль используется для указания количества вещества, необходимо идентифицировать вид элементарных объектов (частиц) в веществе.
Частицами могут быть атомы, молекулы, ионы, формульные единицы, электроны или другие частицы. Например, один моль воды эквивалентен примерно 18 граммам воды и содержит один моль молекул H 2 O, но три моля атомов (два моля H и один моль O).
Когда исследуемым веществом является газ, частицы обычно представляют собой молекулы. Однако все благородные газы (He, Ar, Ne, Kr, Xe, Rn) являются моноатомными, что означает, что каждая частица газа представляет собой отдельный атом. Все газы имеют одинаковый молярный объем 22,4 литра на моль при стандартной температуре и давлении (СТД).
Моль атомов или молекул также называют «граммовым атомом» или «граммовой молекулой».
История
Название моль (нем. Mol ) приписывается Вильгельму Оствальду, который ввел это понятие в 1902 году.Это аббревиатура от молекулы (нем. Molekül ), которая, в свою очередь, происходит от латинского моль , что означает «масса, массивная структура».
Он использовал его для выражения молекулярной массы вещества в граммах. Так, например, один моль соляной кислоты (HCl) имеет массу 36,5 грамма (атомные массы Cl: 35,5 ед, H: 1,0 ед).
До 1959 года и IUPAP, и IUPAC использовали кислород для определения моля: химики определяли моль как количество атомов кислорода, которые имели массу 16 г, физики использовали аналогичное определение, но только с изотопом кислорода-16. .В 1959/1960 годах две организации договорились дать определение кроту как таковому:
- Моль – это количество вещества в системе, которая содержит столько элементарных частиц, сколько атомов содержится в 0,012 кг углерода-12; его символ — «моль».
Это было принято МКМВ (Международным комитетом мер и весов) в 1967 году, а в 1971 году оно было принято 14-й ГКМВ (Генеральной конференцией по мерам и весам).
В 1980 году МКМВ разъяснил приведенное выше определение, определив, что атомы углерода-12 не связаны и находятся в основном состоянии.

Предлагаемое будущее определение
Как и в случае с другими базовыми единицами СИ, были предложения изменить определение килограмма таким образом, чтобы определить некоторые измеряемые в настоящее время физические константы в фиксированных значениях. Одно из предложенных определений [2] килограмма:
- Килограмм — это масса ровно (6,0221415×10 23 /0,012) несвязанных атомов углерода-12 в состоянии покоя и в основном состоянии.
Таким образом, число Авогадро точно будет равно N A = 6.0221415×10 23 элементарных единиц на моль, и, следовательно, моль стал бы просто единицей счета, как и дюжина.
Полезность кротов
Моль полезна в химии, потому что она позволяет сравнивать разные вещества. Используя одинаковое количество молей двух веществ, оба количества имеют одинаковое количество молекул или атомов. Моль облегчает практическую интерпретацию химических уравнений.
Таким образом, уравнение:
- 2H 2 + O 2 → 2H 2 O
можно понимать как «два моля водорода плюс один моль кислорода дают два моля воды.»
Моли полезны в химических расчетах, поскольку они позволяют вычислять выходы и другие значения при работе с частицами различной массы.
Количество частиц является более полезной единицей в химии, чем масса или вес, потому что реакции происходят между атомами (например, два атома водорода и один атом кислорода составляют одну молекулу воды), которые имеют очень разные веса (один атом кислорода весит почти в 16 раз больше, чем у атома водорода). Однако необработанное количество атомов в реакции неудобно, потому что оно очень велико; например, всего в одном миллилитре воды содержится более 3×10 22 (или 30 000 000 000 000 000 000 000) молекул.
Пример расчета
В этом примере моли используются для расчета массы углекислого газа (CO 2 ), выделяющегося при сгорании одного г этана.
Уравнение этой химической реакции:
- 7 O 2 + 2 C 2 H 6 → 4 CO 2 + 6 H 2 O
т.е.
- Семь молекул кислорода реагируют с двумя молекулами этана с образованием четырех молекул углекислого газа и шести молекул воды.
Первым делом необходимо выяснить, сколько молекул этана было сожжено. Мы знаем, что этого было достаточно, чтобы получить один г, поэтому теперь нам нужна молекулярная масса этана. Это можно рассчитать: масса в граммах одного моля вещества по определению является его атомной или молекулярной массой; Атомная масса водорода равна единице, а атомная масса углерода равна 12, поэтому молекулярная масса C 2 H 6 равна (2 × 12) + (6 × 1) = 30. Один моль этана равен 30 г. Таким образом, один г этана составляет 1/30 моля; сожженное количество составляло 1/30 моля (помните, что это число, совсем как «полдюжины»).
Теперь мы можем подсчитать количество выделившихся молекул CO 2 .
Так как на две молекулы этана мы получаем четыре молекулы СО 2 , то на каждую молекулу этана приходится две молекулы СО 2 . Так, на 1/30 моля этана было произведено 2 × 1/30 = 1/15 моля СО 2 .
Далее нам нужна молекулярная масса CO 2 . Атомная масса углерода равна 12, а масса кислорода равна 16, поэтому один моль углекислого газа равен 12 + (2 × 16) = 44 г/моль.
Наконец, масса CO 2 равна 1/15 моль × 44 г/моль = 2,93 г углекислого газа.
Обратите внимание, что количество молей не обязательно балансируется в любой части уравнения. Это связано с тем, что моль учитывает не массу или количество вовлеченных атомов , а количество вовлеченных частиц (каждая из которых состоит из переменного числа атомов). Однако мы могли бы аналогичным образом рассчитать массу потребленного кислорода и массу образовавшейся воды и заметить, что масса продуктов (углекислого газа и воды) равна массе дикислорода плюс этана:
- (7/2)(1/30 моль кислорода) (2 × 16 г/моль) = 7 × 16/30 г = 3.
73 г
- (6/2)(1/30 моль воды)(2×1 + 16 г/моль) = 1,8 г
- 3,73 г + 1 г = 2,93 + 1,8 г. с другой стороны — масса молекул, состоящих из них, — здесь это не учитывалось.)
Родинки повседневных объектов
Примечание: все нижеприведенные значения имеют точность примерно до одной значащей цифры.
- Учитывая, что объем песчинки составляет примерно 10 -12 м 3 [6] , и учитывая, что площадь Соединенных Штатов составляет около 10 13 м 2 [7 ] , отсюда следует, что моль песчинок покрыла бы Соединенные Штаты приблизительно одним сантиметром песка.
- Человеческое тело содержит примерно сто триллионов клеток [8] , и на Земле проживает примерно семь миллиардов человек, поэтому общее количество человеческих клеток на планете составляет примерно 100×10 12 *7×10 9 =7×10 23 , что составляет примерно один моль.
- Так как Земля имеет радиус около 6400 км [9] , ее объем составляет примерно 10 21 м 3 .
Поскольку в одном кубическом метре [10] уместится около пятисот крупных грейпфрутов, отсюда следует, что моль грейпфрута будет иметь примерно такой же объем, как Земля.
См. также
Примечания
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Браун, Теодор Э., Х. Юджин ЛеМэй и Брюс Э. Берстен. 2005. Химия: Центральная наука . 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Прентис-холл. ISBN 0131096869 и ISBN 978-0131096868.
- Чанг, Раймонд. 2006. Химия . 9-е изд. Нью-Йорк: McGraw-Hill Science/Engineering/Math. ISBN 0073221031.
- Хаускрофт, Кэтрин Э. и Алан Г. Шарп. 2001. Неорганическая химия . 4-е изд. Харлоу, Великобритания: Прентис Холл. ISBN 0582310806 и ISBN 978-0582310803.
- Макмерри, Джон и Роберт С.Фэй. 2004. Химия . 4-е изд. Река Аппер-Сэдл, Нью-Джерси: Прентис-холл. ISBN 0131402080.
- Мур, Джон В., Конрад Л. Станицкий и Питер К.
Юрс. 2002. Химия: молекулярная наука . Нью-Йорк: Колледж Харкорт. ISBN 0030320119.
- Смит, Роланд. 1994. Покоряя химию . Сидней: Макгроу-Хилл. ISBN 0074701460 и ISBN 9780074701461.
Кредиты
New World Encyclopedia авторы и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание.
На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Что такое Крот? — Кристин Мун Наука
В химии одним из самых сложных понятий для учащихся является моль.
Не тот крот, который зарывается под землю, и не тот крот, который может быть у вас на коже. Я говорю о химическом кроте.
Что такое химический крот?
Крот — это слово, обозначающее число, как и слова «пара», «дюжина» и «брутто».
Когда у кого-то есть пара туфель, мы знаем, что у него две туфельки.Пара означает два.
Когда у кого-то дюжина яиц, мы знаем, что у него 12 яиц. Дюжина значит двенадцать.
Хотя это и не так широко известно, гросс – это дюжина дюжин. Если у кого-то много карандашей, то у него есть дюжина дюжин, или 144 карандаша.
Если у кого-то есть моль атомов, то у него 602 000 000 000 000 000 000 000 атомов.
Хотите знать, как произносится это число? Это 602 тысячи миллиардов миллиардов или 602 секстиллиона.
Пара ботинок, дюжина яиц, пачка карандашей и моль атомов.Поскольку никто не хочет выписывать столько нулей, мы можем записать число в экспоненциальном представлении следующим образом: 6.02 х 10 23 .
Кстати, число, которое мы используем для описания количества в моле — 602 000 000 000 000 000 000 000 или 6,02 x 10 23 — известно как число Авогадро. Он так часто используется в химии, что большинство людей запоминают его. Это одно из тех чисел, которое, как и число Пи, кажется, засело в глубинах мозга и может быть вызвано годами (даже десятилетиями) после его изучения.
Чем полезен крот?
Но давайте вернемся назад и ответим на вопрос, который, я уверен, вас интересует: зачем вообще кому-то нужно знать, как считать 6,02 x 10 23 вещей?
Помните, с чем мы имеем дело. В химии мы рассматриваем реакции, происходящие с атомами и молекулами.
Атомы и молекулы невероятно малы. Поскольку они такие маленькие, неразумно проводить химическую реакцию между отдельными атомами или молекулами.
Водород является первым элементом в периодической таблице. Он имеет атомный номер 1 и атомную массу 1,01.Вместо этого мы имеем дело с количествами атомов и молекул, которые можем измерить. Но количество атомов и молекул в количествах, которые мы можем измерить, очень велико.
Рассмотрим водород, первый элемент периодической таблицы.
Масса одного атома водорода составляет приблизительно 1,67 x 10 -24 грамм (0,0000000000000000000000000167 грамм).Это будет действительно трудно измерить.
Но если бы вы взвесили всего один грамм* водорода, как вы думаете, сколько атомов водорода у вас было бы?
Получается, что у вас будет приблизительно 602 000 000 000 000 000 000 000 или один моль атомов водорода. Поэтому, хотя взвесить один атом водорода почти невозможно, довольно легко измерить моль атомов водорода.
Использование периодической таблицы для расчета молей
Круто то, что вы можете использовать периодическую таблицу, чтобы определить, сколько массы каждого элемента вам нужно, чтобы иметь моль этого элемента.
Атомную массу элемента можно использовать для определения того, сколько граммов требуется, чтобы получить моль атомов этого элемента.(Я уже говорил это раньше и скажу еще раз: таблица Менделеева содержит так много информации!)
В периодической таблице каждый элемент часто указывается двумя числами. Атомный номер (меньшее из двух чисел) соответствует порядку элемента в периодической таблице и говорит, сколько протонов имеет атом этого элемента.
Атомная масса говорит нам, сколько граммов этого элемента будет содержать моль атомов.
Таким образом, просто взглянув на периодическую таблицу, мы можем узнать, сколько каждого элемента необходимо, чтобы иметь 602 000 000 000 000 000 000 000 атомов этого элемента.
Атомная масса говорит нам, сколько граммов нужно, чтобы получить моль этого элемента.Важно отметить, что количество элемента (в граммах), необходимое для образования моля атомов, сильно различается.
Требуется всего 1,01 грамма водорода, чтобы иметь моль атомов водорода, но требуется 12 граммов углерода, чтобы иметь такое же количество атомов углерода.
Несмотря на то, что количество атомов в моле разных элементов одинаково, они имеют разную массу.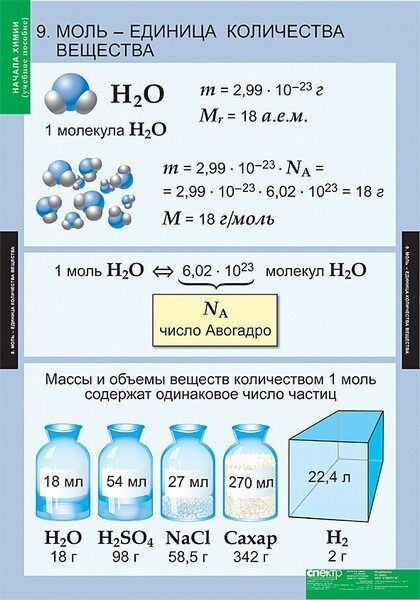
Но это не так уж и удивительно, если вспомнить, что родинка — это еще одно слово, обозначающее число (например, пара, дюжина или брутто). У нас может быть пара ботинок, а может быть пара слонов: у нас есть по два каждого (вот что значит пара), но эти две пары определенно не весят одинаково.
Рассмотрим пару ботинок и пару слонов: у нас есть по два каждого, но они не весят одинаково. Точно так же моль атомов водорода весит всего 1.01 грамм, а моль свинца весит 207,2 грамма. Но 1,01 грамма водорода и 207,2 грамма свинца содержат 6,02 x 10 23 атомов.
Один моль атомов водорода весит всего 1,01 грамма, а один моль свинца весит 207,2 грамма. Обе величины содержат одинаковое количество атомовКак моль используется в химии
В химических реакциях атомы или молекулы, которые реагируют друг с другом, реагируют определенным образом. Рассмотрим реакцию между натрием (Na) и хлором (Cl) с образованием поваренной соли (NaCl):
Это сбалансированное химическое уравнение образования поваренной соли.
Если вам интересно, что означают цифры, я бы с удовольствием объяснил это (но не хочу заблудиться в кроличьей норе). Просто поверьте мне на слово, что реакция выглядит именно так.
В этой реакции два атома натрия (Na) соединяются с двумя атомами хлора (обозначены как Cl 2 ) с образованием двух молекул хлорида натрия (NaCl, поваренной соли). Это атомарный «рецепт» приготовления поваренной соли из натрия и хлора. Мы также можем представить это так:
Как и рецепт еды, этот атомарный рецепт можно масштабировать.Два моля атомов натрия могут соединиться с двумя молями атомов хлора, чтобы получить два моля хлорида натрия.
И хотя мы не можем измерить отдельные атомы натрия или хлора, мы МОЖЕМ измерить моль каждого из них. Глядя на периодическую таблицу, мы видим, что для одного моля атомов натрия требуется 23 грамма натрия, поэтому в 46 граммах у нас будет два моля. Для одного моля атомов хлора требуется 35,5 грамма хлора, поэтому в 71 грамме у нас будет два моля.
Таким образом, в нашей увеличенной версии атомарного рецепта два моля натрия могут вступить в реакцию с двумя молями хлора, чтобы получить два моля хлорида натрия.(**Не пытайтесь дома.**)
Как видите, возможность определить, сколько атомов содержится в измеренном количестве элемента, невероятно полезна в химии. Знание атомных рецептов химических реакций и того, сколько граммов каждого элемента необходимо, может сэкономить время и деньги, особенно для элементов, которые дороги или ограничены.
способов изучить концепцию кротов дома
Если ваши ученики изучают химию, им нужно будет понять химическую моль.Мой совет — дать им как можно больше способов помочь им смоделировать эту абстрактную концепцию.
— Предложите им использовать периодическую таблицу, чтобы выяснить, сколько граммов каждого элемента требуется, чтобы получить моль этого элемента.
-Эксперимент! Вы знаете, что формула воды H 2 O. Это означает, что одна молекула воды состоит из двух атомов водорода (H) и одного атома кислорода.
В масштабе это означает, что один моль воды содержит два моля атомов водорода и один моль атомов кислорода.Сколько будет весить один моль воды? Используйте периодическую таблицу, чтобы выяснить, сколько граммов содержится в двух молях водорода, и прибавьте к этому количество граммов в одном моле кислорода. Вы должны были только что подсчитать, что один моль воды будет весить примерно 18,02 грамма. Если у вас есть цифровые весы***, вы можете отмерить 18 граммов воды и знать, что у вас есть 602 000 000 000 000 000 000 000 молекул воды. Разве это не круто?!
Вы можете провести аналогичный эксперимент, отмерив моль поваренной соли (NaCl, состоящей из одного моля Na и одного моля Cl).
Если вы действительно настроены амбициозно, вы можете прикинуть, сколько граммов потребуется, чтобы получить моль столового сахара. Формула столового сахара (сахарозы) C 12 H 22 O 11 . Это означает, что один моль столового сахара содержит 12 молей углерода, 22 моля водорода и 11 молей кислорода.
Используйте периодическую таблицу, чтобы выяснить остальное.
*Если вы не знаете, сколько весит грамм, это примерно эквивалентно весу одной стандартной скрепки.
*** Если у вас нет весов, но есть способ измерения в миллилитрах, 18 миллилитров воды эквивалентны 18 граммам воды. 18 миллилитров – это примерно 1 столовая ложка с четвертью.
Похожие сообщения
