Каковы свойства и название вещества Nh4?
Nh4 — одно из известнейших и полезнейших химических веществ. Оно обрело широкое применение в аграрной промышленности и не только. Отличается уникальными химическими свойствами, благодаря которым используется в различных отраслях.
Что такое Nh4
Название вещества NH3 известно даже самому далекому от химии человеку. Это аммиак. Аммиак (NH3) иначе называется нитридом водорода и представляет собой при нормальных условиях бесцветный газ, обладающий ярко выраженным, характерным для данного вещества запахом. Также стоит отметить, что газ NH3 (под названием аммиак) почти в два раза легче, чем воздух!
Помимо газа, может представлять собой жидкость при температуре около 70 °С или же существовать в виде раствора (раствор аммиака). Отличительной особенностью жидкого NH3 выступает возможность растворять в себе металлы главных подгрупп I и II группы таблицы элементов Д. И. Менделеева (то есть щелочные и щелочноземельные металлы), а также магний, алюминий, европий и иттербий. В отличие от воды жидкий аммиак не взаимодействует с вышеуказанными элементами, а выступает именно в роли растворителя. Это свойство позволяет выделять металлы в исходном виде посредством испарения растворителя (NH3). На рисунке ниже можно увидеть, как выглядит растворенный в жидком аммиаке натрий.
В отличие от воды жидкий аммиак не взаимодействует с вышеуказанными элементами, а выступает именно в роли растворителя. Это свойство позволяет выделять металлы в исходном виде посредством испарения растворителя (NH3). На рисунке ниже можно увидеть, как выглядит растворенный в жидком аммиаке натрий.
Как выглядит аммиак с точки зрения химических связей?
Схему аммиака (NH3) и его пространственного строения наиболее наглядно показывает треугольная пирамида. Вершиной «пирамиды» аммиака является атом азота (выделен синим цветом), что видно на изображении ниже.
Атомы в веществе под названием аммиак (NH3) связаны водородными связями, как и в молекуле воды. Но очень важно помнить, что связи в молекуле аммиака слабее, чем в молекуле воды. Это объясняет то, что температуры плавления и кипения NH3 ниже, если сравнивать с H2O.
Химические свойства
Наиболее распространены 2 способа получения вещества NH3 под названием аммиак.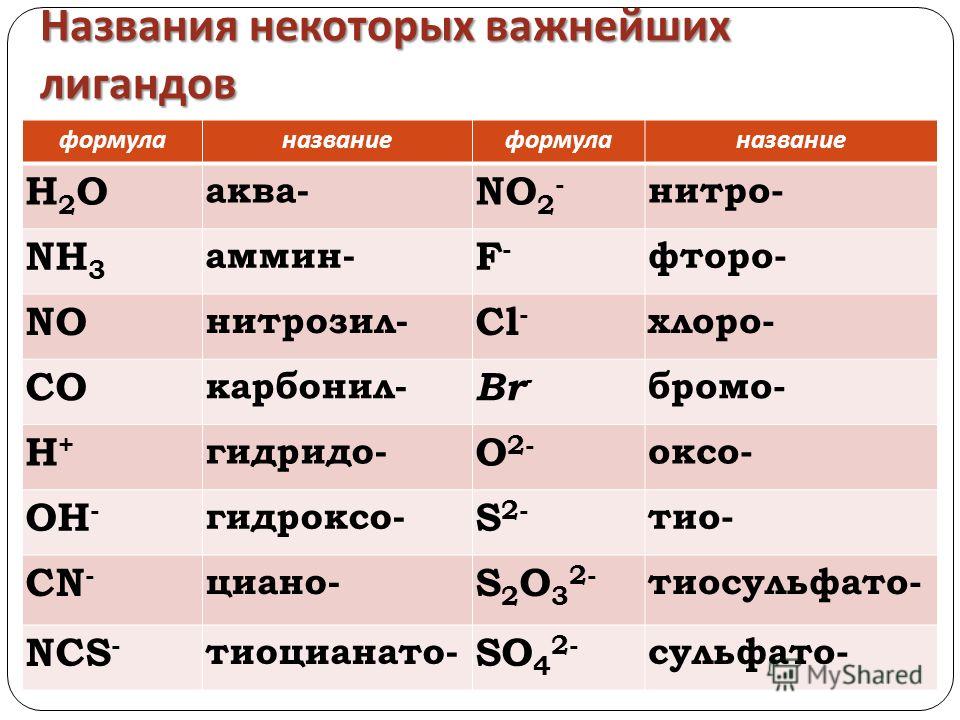 В промышленности применяется так называемый процесс Габера, суть которого заключается в связывании азота воздуха и водорода (полученного из метана) посредством пропускания смеси данных газов при высоком давлении над нагретым катализатором.
В промышленности применяется так называемый процесс Габера, суть которого заключается в связывании азота воздуха и водорода (полученного из метана) посредством пропускания смеси данных газов при высоком давлении над нагретым катализатором.
В лабораториях синтез аммиака чаще всего основывается на взаимодействии концентрированного хлорида аммония с твердым гидроксидом натрия.
Приступим к непосредственному рассмотрению химических свойств NH3.
1) NH3 выступает в качестве слабого основания. Именно поэтому имеет место следующее уравнение, описывающее взаимодействие с водой:
NH3 + H2O = Nh5+ + OH—
2) Также на основных свойствах NH3 основывается его способность реагировать с кислотами и образовывать соответствующие соли аммония:
Nh4 + HNO3 = NH4NO3 (нитрат аммония)
3) Ранее говорилось о том, что определенная группа металлов растворяется в жидком аммиаке. Однако некоторые металлы также способны не просто растворяться, а образовывать соединения с NH3 под названием амиды:
Однако некоторые металлы также способны не просто растворяться, а образовывать соединения с NH3 под названием амиды:
Na(тв) + Nh4(г) = NaNH2 + H2
Na(тв) + Nh4(ж) = NaNH2 + H2 (реакция осуществляется в присутствии железа в качестве катализатора)
4) При взаимодействии NH3 с металлами Fe3+, Cr3+, Al3+, Sn4+, Sn2+ происходит образование соответствующих гидроксидов металлов и катиона аммиония:
Fe3+ + NH3 + H2O = Fe(OH)3 + NH4+
5) Результатом взаимодействия NH3 c металлами Cu2+, Ni2+, Co2+, Pd2+, Pt2+, Pt4+ чаще всего являются соответствующие комплексы металлов:
Cu2+ + NH3 + H2O = Cu(OH)2 + NH4+
Cu(OH)2 + NH3 = [Cu(NH3)4]2+ + OH—
Образование и дальнейший путь Nh4 в организме человека
Хорошо известно, что неотъемлемой частью биохимических процессов в организме человека являются аминокислоты. Именно они являются основным источником NH3, вещества под названием аммиак, — результата их окислительного дезаминирования (чаще всего). К сожалению, для человеческого организма аммиак токсичен, из него легко образуется упомянутый выше катион аммония (NH4+), накапливающийся в клетках. Впоследствии происходит замедление важнейших биохимических циклов, а в итоге — падение уровня вырабатываемого АТФ.
Именно они являются основным источником NH3, вещества под названием аммиак, — результата их окислительного дезаминирования (чаще всего). К сожалению, для человеческого организма аммиак токсичен, из него легко образуется упомянутый выше катион аммония (NH4+), накапливающийся в клетках. Впоследствии происходит замедление важнейших биохимических циклов, а в итоге — падение уровня вырабатываемого АТФ.
Нетрудно догадаться, что организму необходимы механизмы связывания и обезвреживания выделяющегося NH3. На схеме ниже представлены источники и некоторые продукты связывания аммиака в человеческом организме.
Итак, говоря кратко, обезвреживание аммиака происходит через образование его транспортных форм в тканях (например, глутамин и аланин), путем экскреции с мочой, с помощью биосинтеза мочевины, что и является основным естественным способом обезвреживания NH3 в организме человека.
Применение Nh4 — вещества с названием аммиак
В современности жидкий аммиак является наиболее концентрированным и дешевым азотным удобрением, что используется в сельском хозяйстве для аммонизации грубых почв и торфа. При внесении жидкого аммиака в почве происходит рост количества микроорганизмов, но при этом не наблюдается негативных последствий, как, например, от твердых удобрений. Ниже на рисунке представлена одна из возможных установок для сжижения газообразного аммиака при помощи жидкого азота.
При внесении жидкого аммиака в почве происходит рост количества микроорганизмов, но при этом не наблюдается негативных последствий, как, например, от твердых удобрений. Ниже на рисунке представлена одна из возможных установок для сжижения газообразного аммиака при помощи жидкого азота.
Испаряясь, жидкий аммиак поглощает из окружающей среды много теплоты, вызывает охлаждение. Это свойство используется в холодильных установках для получения искусственного льда при хранении скоропортящихся пищевых продуктов. Кроме того, с его помощью замораживают грунт при строительстве подземных сооружений. Водные растворы аммиака находят применение в химической промышленности (является промышленным неводным растворителем), лабораторной практике (например, в роли растворителя при электрохимическом получении химических продуктов), медицине и домашнем обиходе.
Традиционные названия — Справочник химика 21
Фенол представляет собой весьма важное промышленное органическое вещество, объем производства которого в США составляет около 1,5 млн.
 т в год. При обычных условиях это твердое вещество, но при 43 °С фенол становится жидким, что дает возможность транспортировать и перерабатывать его в виде жидкости. Несмотря на традиционное название фенола — карболовая кислота, его трудно отнести к категории минеральных кислот, хотя он взаимодействует со щелочами с образованием фенолятов. [c.448]
т в год. При обычных условиях это твердое вещество, но при 43 °С фенол становится жидким, что дает возможность транспортировать и перерабатывать его в виде жидкости. Несмотря на традиционное название фенола — карболовая кислота, его трудно отнести к категории минеральных кислот, хотя он взаимодействует со щелочами с образованием фенолятов. [c.448]Если анион, содержащий такой водород, не имеет традиционного названия. — Прим. ред. [c.44]
На сказанное следует обратить особое внимание, так как суффиксы -ат (ate) и -ит (-ite), а также -ид (-ide) в традиционных названиях простых соединений указывают на различную степень окисления элемента, образующего анион (см. ниже). Следует отметить, что использование традиционных названий разрешено применительно к определенному, но достаточно
Каждое органическое соединение, для которого известно строение молекулы, имеет официальное название по женевской номенклатуре. Впрочем, ими пользуются не всегда. Во-первых, многие органические вещества получили имена задолго до 1892 года, и к этим традиционным названиям химики привыкли. А во-вторых, названия, соответствующие правилам женевской номенклатуры, нередко оказываются такими сложными и длинными, что химики удобства ради придумывают более короткие и пользуются ими. [c.43]
Во-первых, многие органические вещества получили имена задолго до 1892 года, и к этим традиционным названиям химики привыкли. А во-вторых, названия, соответствующие правилам женевской номенклатуры, нередко оказываются такими сложными и длинными, что химики удобства ради придумывают более короткие и пользуются ими. [c.43]
Следует отметить, что в правила ШРАС не вошли многие тривиальные и традиционные названия, которые рассматриваются как устаревшие и более не применяющиеся. [c.30]
Следует сделать несколько замечаний по использованию приставок при образовании традиционных названий анионов тех кислот, которые перечислены в табл. 2.7. [c.38]
Традиционное название Коллоидная химия уже давно перестало отвечать своему содержанию. В настоящее время в курс коллоидной химии включается изучение высокодисперсных гетерогенных систем и высокомолекулярных соединений. [c.380]
Для всех остальных соединений водорода сохраняются традиционные названия Н О — вода, Nh4 — аммиак, РНд — фосфин, АзНз — арсин, СН4 — метан, SiH — силан. [c.33]
[c.33]
Составьте и сравните систематические и традиционные названия следующих простых соединений [c.183]
Для ограниченного числа распространенных оксокислот и их кислотных остатков используются следующие традиционные названия [c.190]
Номенклатура всегда связана с теоретическими представлениями соответствующей науки поэтому история развития ее довольно точно отражает исторический путь, пройденный исторической химией. В тот период, когда представления о природе органических веществ были весьма смутными, большинство названий было связано с теми природными источниками, из которых данные вещества получались (винный спирт, уксусная кислота, пробковая кислота, бензойная кислота, мочевина, хинин, ванилин, молочная кислота), с их наиболее характерными свойствами (индиго, какодил, гремучая кислота) или путями получения (серный эфир, пировиноград-ная кислота, пирогаллол). Отдельные соединения получили название по имени исследовавших их ученых (кетон Михлера, углеводород Чичибабина).
Приведены их традиционные названия. Дайте их международные названия. [c.84]
Оксиды, сульфиды и галогениды неметаллов обычно не называют по системе Штока, а указывают их стехиометрию или используют традиционные названия, например [c.71]
Традиционные названия солей также составляются из названий анионов в именительном падеже и названий катионов в родительном падеже. Название аниона включает корень русского или латинского названия кислотообразующего элемента с добавлением суффикса, соответствующего той или иной степени окисления элемента.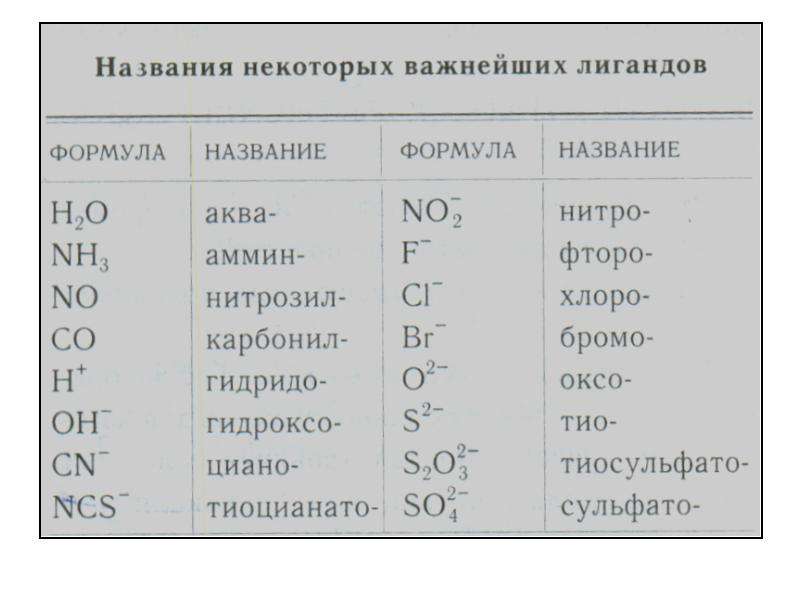 При этом различаются следующие случаи. [c.30]
При этом различаются следующие случаи. [c.30]
Традиционные названия средних солей
Некоторые углеводородные радикалы этиленовых углеводородов имеют традиционные названия, образованные из названий спиртов [c.75]
В большинстве случаев пользуются, однако, традиционными названиями, которые обыкновенно указывают на материал, из которого была выделена та или иная кислота, например муравьиная кислота, уксусная кислота, масляная кислота (полученная впервые из коровьего масла), валериановая кислота (из корней валерианы), лауриновая кислота (из плодов лаврового дерева) и т. д. [c.223]
В сущности железо обладает не большей реакционной способностью, чем другие обсуждавшиеся выше переходные металлы. Однако, к сожалению, оксиды железа непрочно пристают к поверхности металлического железа, Ржавчина (оксид железа) отслаивается по мере образования и предоставляет возможность новой поверхности металла реагировать с окружающей средой.
Для аллотропных форм элементов в свободном виде рекомендуется следующая система номенклатуры Hi — моноводород, Ог — дикислород, Р4 — тетрафосфор и т. д. Хотя по правилам ИЮПАК Оз требуется обозначать как трикислород, вряд ли это название может исключить традиционное название озон (от последнего производится термин озонид).
При построении традиционных названий кислот и их солей используют приведенные ранее правила это касается перечисления названий электроотрицательной и электроположительной частей, применения способа Штока, окончаний -ная и -истая (-I , -ous), числовых приставок, способа Эвенса — Бассетта, что не вызывает недоразумений..PNG)
Традиционные названия анионов тех кислот, которые указаны в табл. 2.7, образуются путем замены частиц -овая, -евая и -ная (английское -i ) на суффикс -ат (английское -ate) и час- [c.35]
Тиокислотами называются кислоты, получаемые заменой кислорода на серу, их названия строятся добавлением приставки ТИО- (thio-) к традиционному названию кислоты. Аналогично составляются названия кислот, полученных заменой кислорода на селен и теллур, в этом случае приставками являются селено- (seleno-) и теллуро- (telluro-). В качестве примеров укажем [c.38]
Вместе с систематической номенклатурой в органической химии щироко используются традиционные названия, часто в сочетании с систематическими. Примеры названи[[ органических соединений приводятся ниже ( 17, 18 и табл. П1. 4—9 Приложения). [c.144]
Альдегиды, по систематической номенклатуре — алкаиали. Состав соответствует общей формуле СпНгпО. Родоначальником ряда алканалей является метаналь ИСНО, традиционное название формальдегид (муравьиный альдегид). Он представляет собой бесцветный газ с резким удушающим запахом и температурой сжижения —19,2°С, хорошо растворим в воде (407о-ный водный раствор формальдегида известен под названием формалин). Ближайший гомолог формальдегида — этаналь СНзСНО (ацетальде-гид, уксусный альдегид). Бесцветная жидкость с температурой кипения 20,8 С. Альдегиды — весьма реакционноспособные органические вещества.
Родоначальником ряда алканалей является метаналь ИСНО, традиционное название формальдегид (муравьиный альдегид). Он представляет собой бесцветный газ с резким удушающим запахом и температурой сжижения —19,2°С, хорошо растворим в воде (407о-ный водный раствор формальдегида известен под названием формалин). Ближайший гомолог формальдегида — этаналь СНзСНО (ацетальде-гид, уксусный альдегид). Бесцветная жидкость с температурой кипения 20,8 С. Альдегиды — весьма реакционноспособные органические вещества.
Для ограниченного числа распространенных кислот и их солей используются традиционные названия, например НМОз — азотная кислота, К2804 — сульфат калия. Допускается также использование небольшого числа специальных названий Н2О — вода, ЫНз — аммиак, ЫН4 — ион аммония Ы2Н4 — гидразин и др. [c.96]
Их названия образуются из латинского корня названия неметалла с окончанием ид и русского названия менее электроотрицательного элемента в родительном падеже (табл. 1.2). Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами его степень окисления. Так, СигО — оксид меди (I), СиО — оксид меди (II), СО — оксид углерода (II), СО2 — оксид углерода (IV), SFe — фторид серы (VI). Можно также вместо степени окисления указывать с помощью греческих числительных приставок (моно-, ди-, три-, тетра-, пента-, гекса- и т. д.) стехиометрический состав соединения СО — монооксид углерода (приставку моно часто опускают), СО2 — диоксид углерода, SFe — гексафторид серы, Рез04 — тетраоксид трижелеза. Для отдельных бинарных соединений сохраняют традиционные названия Н2О — вода, Nh4 — аммиак, РНз — фосфин.
[c.30]
1.2). Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами его степень окисления. Так, СигО — оксид меди (I), СиО — оксид меди (II), СО — оксид углерода (II), СО2 — оксид углерода (IV), SFe — фторид серы (VI). Можно также вместо степени окисления указывать с помощью греческих числительных приставок (моно-, ди-, три-, тетра-, пента-, гекса- и т. д.) стехиометрический состав соединения СО — монооксид углерода (приставку моно часто опускают), СО2 — диоксид углерода, SFe — гексафторид серы, Рез04 — тетраоксид трижелеза. Для отдельных бинарных соединений сохраняют традиционные названия Н2О — вода, Nh4 — аммиак, РНз — фосфин.
[c.30]
По правилам ЮПАК рекомендуется ввести вместо традиционных названий с окончанием -ол более соответствующие общей системе названия бензен, толуен, ксилен, кумен, цимен, стирен. Однако эти названия пока еще трудно приживаются.
 [c.216]
[c.216]Для щелочей применяют также традиционные названия, в которых слова гидрат окиси заменяются словом едкий (или едкое ), например, едкий натр NaOH, едкое кали КОН. [c.12]
Для распространенных кислотных гидроксидов и их анионов помимо систематических названий часто применяются традиционные, например традиционные названия триоксонит-рата(У) водорода HNO3 и аннона NO3 — азотная кислота и нитрат-ион. Составьте формулы и приведите традиционные названия следующих веществ и их анионов
Почему нспользованне традиционных названий является пред почтительным [c.9]
Указанные традиционные названия кислотных остатков входят в названия соответсгвующих солей [c.192]
A Va./юизвестные, недавно синтезироваиные и сложные ио составу ок сокислоты, их соли и другие производные, которые не имеют традиционный названий, называют по правилам номенклатуры комплексных соединений. [c.194]
[c.194]
Решение. Название вещества по систематической номенклатуре должно полностью отражать его состав, например О2 — дикислород (традиционное название — молекулярный кислород) РбаОз — триоксид дижелеза, или оксид железа (III). Названия остальных веществ [c.54]
В названиях аллотропных модификаций простых веществ по систематической номенклатуре указывается число атомов в молекуле, например Нг — диводород (традиционное название — молекулярный водород) Оз — трикислород (озон), Зв —октасера (кристаллическая сера), — полисера (аморфная сера). [c.17]
К.пк систематические, так и традиционные названия 1ЛК11Х соединений начинаются со слова гидрат в имени-тс. п.1Н) и падеже с ooiиетствующей числовой приставкой. 3aieM указывается систематическое или традиционное [c.35]
Аммиак — урок. Химия, 8–9 класс.
Строение молекулы
Формула аммиака — Nh4. Степень окисления азота равна \(–3\).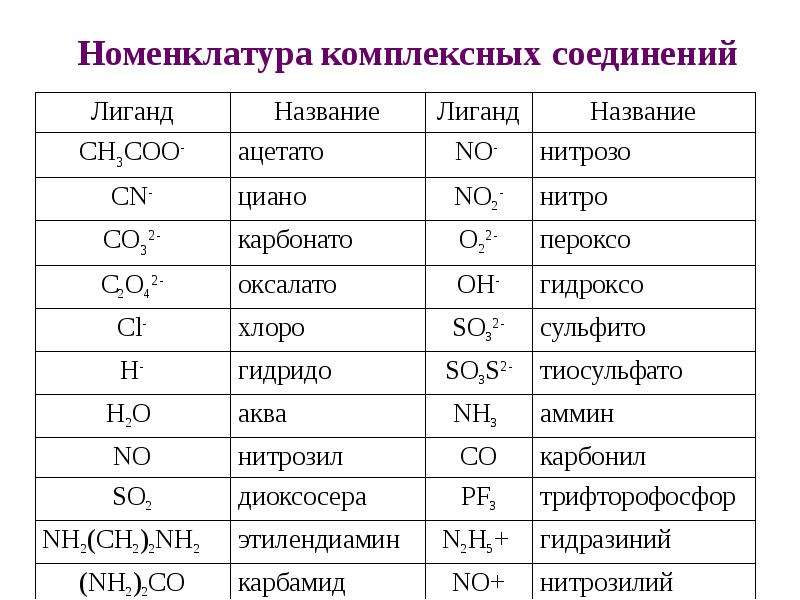 В молекуле три ковалентные полярные связи. У атома азота одна электронная пара остаётся неподелённой и играет важную роль в способности аммиака вступать в химические реакции.
В молекуле три ковалентные полярные связи. У атома азота одна электронная пара остаётся неподелённой и играет важную роль в способности аммиака вступать в химические реакции.
Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а в основании — три атома водорода.
Рис. \(1\). Молекула аммиака
Общие электронные пары в молекуле смещены к более электроотрицательному атому азота. Он заряжен отрицательно, а атомы водорода — положительно. Поэтому молекула полярна и представляет собой диполь. Благодаря высокой полярности молекулы аммиака способны образовывать водородные связи между собой и с молекулами воды. Образование водородных связей влияет на физические свойства вещества.
Физические свойства
При обычных условиях аммиак представляет собой бесцветный газ с резким неприятным запахом. Он легче воздуха. Ядовит.
Аммиак очень хорошо растворяется в воде — при \(20\) °С в одном объёме воды может раствориться до \(700\) объёмов аммиака.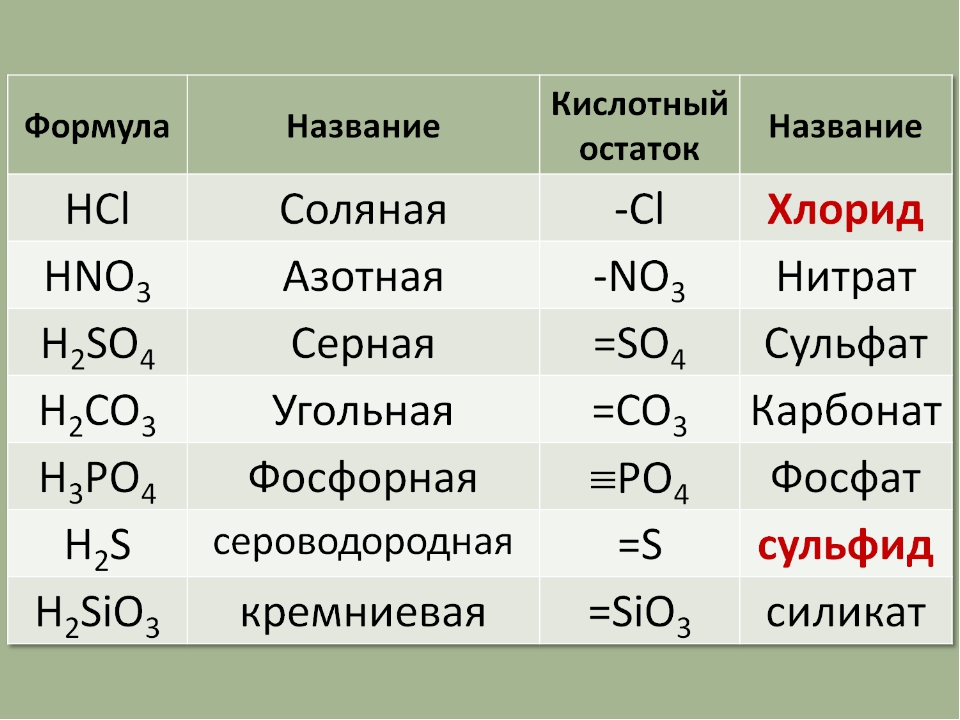 Раствор с содержанием газа \(25\) % называется аммиачной водой, а \(10\)%-ный раствор используется в медицине как нашатырный спирт.
Раствор с содержанием газа \(25\) % называется аммиачной водой, а \(10\)%-ный раствор используется в медицине как нашатырный спирт.
Аммиак легко сжижается при пониженной температуре или при повышенном давления. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать его в холодильных установках.
Химические свойства
1. Восстановительные свойства.
Степень окисления азота в аммиаке — \(–3\), поэтому в окислительно-восстановительных реакциях он выступает в роли сильного восстановителя.
Аммиак окисляется кислородом с образованием азота или оксида азота(\(II\)). Результат реакции зависит от условий её протекания.
При горении аммиака в чистом кислороде образуется азот:
4N−3h4+3O20=2N20+6h3O−2.
Если реакция проводится с катализатором, то образуется оксид азота(\(II\)):
4N−3h4+5O20=k4NO+2+6h3O−2.
2. Основные свойства.
Если в водный раствор аммиака добавить несколько капель фенолфталеина, то его окраска станет малиновой. Значит, раствор содержит гидроксид-ионы. Образование этих ионов происходит в результате реакции между водой и молекулами аммиака:
Nh4+h3O⇄Nh4⋅h3O⇄Nh5++OH−.
Образующийся в реакции неустойчивый гидрат аммония частично диссоциирует на ионы аммония и гидроксид-ионы.
Аммиак реагирует с кислотами. При этом образуются соли аммония. Так, с соляной кислотой образуется хлорид аммония, а с серной — сульфат аммония:
Nh4+HCl=Nh5Cl,
2Nh4+h3SO4=(Nh5)2SO4.
Получение и применение
В промышленности аммиак синтезируют из азота и водорода:
N2+3h3⇄t,p,k2Nh4.
Рис. \(2\). Производство аммиака
Лабораторный способ получения — реакция между солью аммония и гидроксидом кальция:
2Nh5Cl+Ca(OH)2=CaCl2+2Nh4↑+2h3O.
В больших количествах аммиак применяется для производства азотной кислоты и минеральных удобрений, а также красителей и взрывчатых веществ. Используется в холодильных установках. Нашатырный спирт находит применение в медицине и в быту.
Источники:
Рис. 1. Молекула аммиака https://upload.wikimedia.org/wikipedia/commons/1/11/Ammonia-2D-dimensions.png
Рис. 2. Производство аммиака https://cdn.pixabay.com/photo/2014/07/31/21/42/industry-406905_960_720. jpg
jpg
При каталитическом распаде аммиака на простые вещества время, необходимое для разложения половины всего количества Nh4, зависит
|
Напишите мне в whatsapp, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в whatsapp! |
Описание заказа и 38% решения ( + фото):
При каталитическом распаде аммиака на простые вещества время, необходимое для разложения половины всего количества Nh4, зависит от начального давления аммиака следующим образом:
Определите порядок реакции и константу скорости.
Решение:
Т.к. период полупревращения зависит от начального давления, то реакция не является реакцией первого порядка. Предположим, что реакция имеет второй порядок.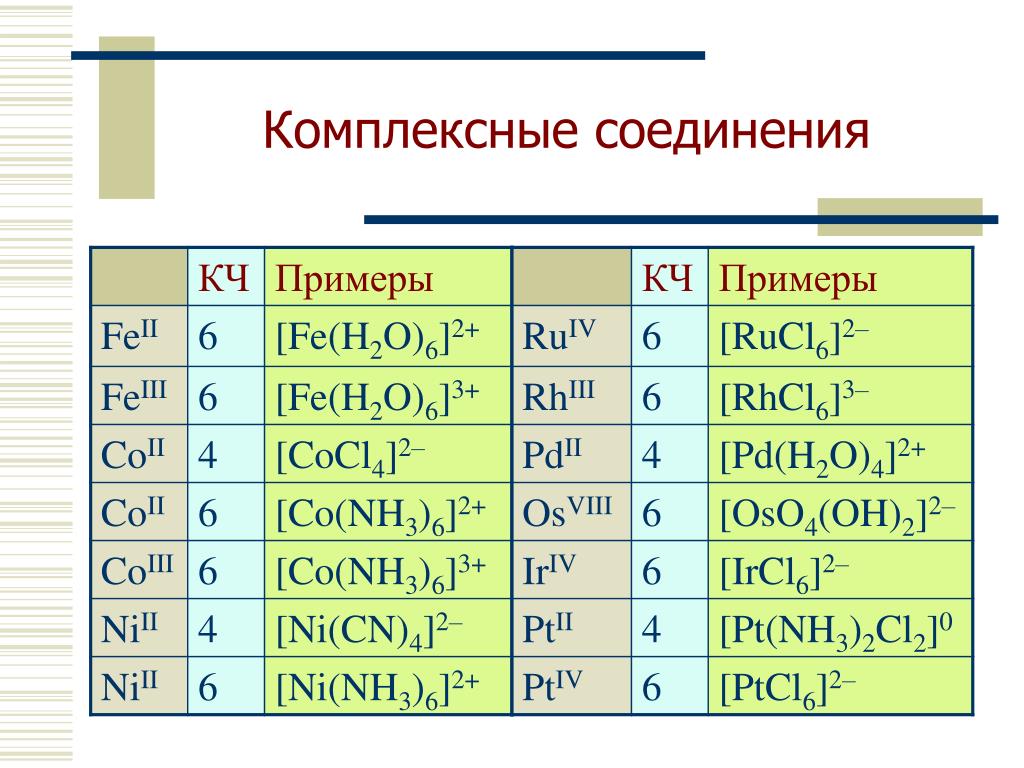 Для реакции второго порядка константа скорости реакции связана с периодом полупревращения уравнением Поскольку концентрация обратно пропорциональна давлению, можно записатьРассчитаем константы скорости реакции при трех значениях Р. Получили близкие значения констант скорости реакции, поэтому реакция имеет второй порядок. Средняя константа скорости равна Ответ: 34,7
Для реакции второго порядка константа скорости реакции связана с периодом полупревращения уравнением Поскольку концентрация обратно пропорциональна давлению, можно записатьРассчитаем константы скорости реакции при трех значениях Р. Получили близкие значения констант скорости реакции, поэтому реакция имеет второй порядок. Средняя константа скорости равна Ответ: 34,7
Похожие готовые решения по химии:
© Преподаватель Анна Евкова
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Правовые документы
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Анна Евкова не оказывает никаких услуг.
Nh4 вид химической связи. Типы химических связей
Крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными: гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки. Такие объединения атомов могут насчитывать несколько единиц, сотен, тысяч или даже больше атомов. Сила, которая удерживает эти атомы в составе таких группировок, называется химическая связь .
Другими словами, можно сказать, что химической связью называют взаимодействие, которое обеспечивает связь отдельных атомов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи является то, что энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов.
Так, в частности, если при взаимодействии атомов X и Y образуется молекула XY, это означает, что внутренняя энергия молекул этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых оно образовалось:
E(XY)
По этой причине при образовании химических связей между отдельными атомами выделятся энергия.
В образовании химических связей принимают участие электроны внешнего электронного слоя с наименьшей энергией связи с ядром, называемые валентными . Например, у бора таковыми являются электроны 2 энергетического уровня – 2 электрона на 2s- орбитали и 1 на 2p -орбитали:
При образовании химической связи каждый атом стремится получить электронную конфигурацию атомов благородных газов, т.е. чтобы в его внешнем электронном слое было 8 электронов (2 для элементов первого периода). Это явление получило название правила октета.
Достижение атомами электронной конфигурации благородного газа возможно, если изначально одиночные атомы сделают часть своих валентных электронов общими для других атомов. При этом образуются общие электронные пары.
При этом образуются общие электронные пары.
В зависимости от степени обобществления электронов можно выделить ковалентную, ионную и металлическую связи.
Ковалентная связь
Ковалентная связь возникает чаще всего между атомами элементов неметаллов. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия кроется в том, что атомы разных элементов имеют и различную способность притягивать к себе общую электронную пару. Очевидно, что это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. В свою очередь, на другом атоме формируется частичный положительный заряд. Например, в молекуле хлороводорода электронная пара смещена от атома водорода к атому хлора:
Примеры веществ с ковалентной полярной связью:
СCl 4 , H 2 S, CO 2 , NH 3 , SiO 2 и т.д.
Ковалентная неполярная связь образуется между атомами неметаллов одного химического элемента.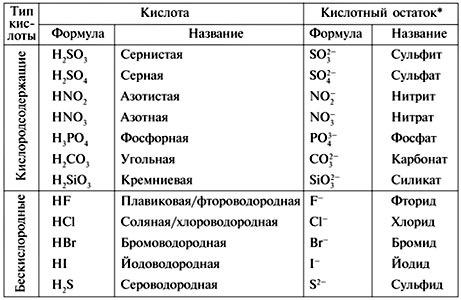 Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Поскольку атомы идентичны, одинакова и их способность оттягивать на себя общие электроны. В связи с этим смещения электронной пары не наблюдается:
Вышеописанный механизм образования ковалентной связи, когда оба атома предоставляют электроны для образования общих электронных пар, называется обменным.
Также существует и донорно-акцепторный механизм.
При образовании ковалентной связи по донорно-акцепторному механизму общая электронная пара образуется за счет заполненной орбитали одного атома (с двумя электронами) и пустой орбитали другого атома. Атом, предоставляющий неподеленную электронную пару, называют донором, а атом со свободной орбиталью – акцептором. В качестве доноров электронных пар выступают атомы, имеющие спаренные электроны, например N, O, P, S.
Например, по донорно-акцепторному механизму происходит образование четвертой ковалентной связи N-H в катионе аммония NH 4 + :
Помимо полярности ковалентные связи также характеризуются энергией. Энергией связи называют минимальную энергию, необходимую для разрыва связи между атомами.
Энергия связи уменьшается с ростом радиусов связываемых атомов. Так, как мы знаем, атомные радиусы увеличиваются вниз по подгруппам, можно, например, сделать вывод о том, что прочность связи галоген-водород увеличивается в ряду:
HI
Также энергия связи зависит от ее кратности – чем больше кратность связи, тем больше ее энергия. Под кратностью связи понимается количество общих электронных пар между двумя атомами.
Ионная связь
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Если в ковалентной-полярной связи общая электронная пара смещена частично к одному из пары атомов, то в ионной она практически полностью «отдана» одному из атомов. Атом, отдавший электрон(ы), приобретает положительный заряд и становится катионом , а атом, забравший у него электроны, приобретает отрицательный заряд и становится анионом .
Таким образом, ионная связь — это связь, образованная за счет электростатического притяжения катионов к анионам.
Образование такого типа связи характерно при взаимодействии атомов типичных металлов и типичных неметаллов.
Например, фторид калия. Катион калия получается в результате отрыва от нейтрального атома одного электрона, а ион фтора образуется при присоединении к атому фтора одного электрона:
Между получившимися ионами возникает сила электростатического притяжения, в результате чего образуется ионное соединение.
При образовании химической связи электроны от атома натрия перешли к атому хлора и образовались противоположно заряженные ионы, которые имеют завершенный внешний энергетический уровень.
Установлено, что электроны от атома металла не отрываются полностью, а лишь смещаются в сторону атома хлора, как в ковалентной связи.
Большинство бинарных соединений, которые содержат атомы металлов, являются ионными. Например, оксиды, галогениды, сульфиды, нитриды.
Ионная связь возникает также между простыми катионами и простыми анионами (F − , Cl − , S 2-), а также между простыми катионами и сложными анионами (NO 3 − , SO 4 2- , PO 4 3- , OH −). Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH).
Поэтому к ионным соединениям относят соли и основания (Na 2 SO 4 , Cu(NO 3) 2 , (NH 4) 2 SO 4), Ca(OH) 2 , NaOH).
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М 0 — ne − = M n + , где М 0 – нейтральный атом металла, а M n + катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Водородная связь
Если атом водорода в каком-либо веществе связан с элементом с высокой электроотрицательностью (азотом, кислородом или фтором), для такого вещества характерно такое явление, как водородная связь.
Поскольку атом водорода связан с электроотрицательным атомом, на атоме водорода образуется частичный положительный заряд, а на атоме электроотрицательного элемента — частичный отрицательный. В связи с этим становится возможным электростатическое притяжения между частично положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой. Например водородная связь наблюдается для молекул воды:
Именно водородной связью объясняется аномально высокая температура плавления воды. Кроме воды, также прочные водородные связи образуются в таких веществах, как фтороводород, аммиак, кислородсодержащие кислоты, фенолы, спирты, амины.
Ионы – это атомы, потерявшие или получившие электроны и, как следствие, некоторый заряд. Для начала хотелось бы напомнить, что ионы бывают двух типов: катионы
(положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы
(заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Для начала хотелось бы напомнить, что ионы бывают двух типов: катионы
(положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы
(заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Ионная и ковалентная связь
Данный тип связи является частным случаем ковалентной. Разность электроотрицательностей в данном случае столь велика (более чем 1,7 по Полингу), что общая пара электронов не частично смещается, а полностью переходит к атому с большей электроотрицательностью. Поэтому образование ионной связи является результатом возникновения сильного электростатического взаимодействия между ионами. Важно понимать, что не существует стопроцентно ионной связи. Данный термин применяется, если «ионные признаки» более выражены (т.е. электронная пара сильно смещена к более электроотрицательному атому).
Механизм ионной связи
Атомы, имеющие практически полную или практически пустую валентную (внешнюю) оболочку, наиболее охотно вступают в химические реакции. Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Это способность атома притягивать к себе электроны, поэтому атомы с наиболее заполненными валентными оболочками более электроотрицательны.
Типичный металл охотно отдает электроны, тогда как типичный неметалл охотнее их забирает. Поэтому чаще всего ионную связь образуют металлы и неметаллы. Отдельно следует упомянуть другой тип ионной связи – молекулярную . Ее особенность в том, что в роли ионов выступают не отдельные атомы, а целые молекулы.
Схема ионной связи
На рисунке схематически изображено формирование фторида натрия. Натрий имеет низкую электроотрицательность и всего один электрон на валентной оболочке (ВО). Фтор – значительно более высокую электроотрицательность, ему не хватает всего одного электрона для заполнения ВО. Электрон с ВО натрия, переходит на ВО фтора, заполняя орбиталь, в следствии чего оба атома приобретают разноименные заряды и притягиваются друг к другу.
Электрон с ВО натрия, переходит на ВО фтора, заполняя орбиталь, в следствии чего оба атома приобретают разноименные заряды и притягиваются друг к другу.
Свойства ионной связи
Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления
. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость
подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость
. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве.
Кристаллы поваренной соли (NaCl) – типичный пример ионной связи.
Существуют различные виды химической связи. Среди них ковалентная, металлическая, Ван-дер-ваальсова, водородная и ионная. Давайте выясним, что такое ионная связь и ее свойства каковы.
Осуществляемая путем перехода общей пары электрона от одного атома, менее электроотрицательного, к другому, более электроотрицательному, -вот что такое ионная связь. Примеры соединений, образованных ею, можно объединить общей особенностью — содержанием в соединении атомов с сильной электроотрицательностью и атомов металлов.
Атом металла без особого труда отдает электрон и становится катионом. А электроотрицательный атом, такой как атом галогена, легко принимает электрон, образуя отрицательно заряженный ион. Эти заряженные частицы — анионы и катионы — и образуют ту, которая имеет название «ионная связь». Примеры ее — это хлорид натрия, иодид лития и другие галоиды металлов (в основном щелочных).
Но соединение не может быть образовано одной только ионной связью. Причиной этого является нескомпенсированность и отталкивания. Поэтому стоит говорить только о преимущественной ионной связи, тогда как наряду с ней есть и другая химическая связь. Это крайне важно знать.
Не имеет свойств направленности и насыщаемости ионная связь. Примеры связей с направленностью и насыщаемостью — ковалентная, донорно-акцепторная связи. Ненасыщаемость и ненаправленность ионной проявляется потому, что при присоединении ионов с другим зарядом не происходит полная компенсация заряда. Могут быть присоединены и другие противоположнозаряженные ионы и так далее. именно поэтому вокруг иона располагается максимально возможное число подобных ему, но с другим знаком. Однако это число ограничено ввиду взаимного отталкивания ионов одинаково заряженных. Равновесие достигается при их определенном взаимном расположении, которое характеризуется координационным числом. Этот показатель зависит от соотношения радиусов ионов. Вещества с ионной связью зачастую имеют координацию куба или октаэдра и представляют собой кристаллы.
Вещества с ионной связью зачастую имеют координацию куба или октаэдра и представляют собой кристаллы.
Так, кристалл поваренной соли — хлорид натрия — имеет кубическую решетку. В нем каждый ион хлора связан с шестью ионами натрия и каждый ион натрия — с шестью ионами хлора.
В оксидах щелочных и также наблюдается ионная связь. Примеры таких соединений: оксид кальция, оксид натрия и другие. Ионы могут состоять не только из одного атома, а из нескольких. Внутри такого сложного иона другая, а между самими ионами — ионная связь. Примеры: соли типа сульфата калия (здесь калий — катион, сульфат-ион — анион).
Следует также отметить, что свойства ионов веществ сильно разнятся со свойствами атомов и молекул этих веществ. Так, например, ионы хлора, входящие в состав хлорида натрия, не имеют цвета и запаха и пригодны в пищу, тогда как молекулярный хлор — зеленовато-желтый газ с резким запахом — является ядом. А атомы натрия с водой реагируют со взрывом, ионы же свободно растворяются.
Аммиак Nh4 — презентация онлайн
Nh4История открытия аммиака
Nh4
Аммиак был получен в чистом виде
в 1774 г. английским химиком
Джозефом Луи Пристли.
Он нагревал аммониак (хлорид аммония)
с гашеной известью (гидроксид кальция).
1711-1794 г.
Пристли назвал газ «щелочным воздухом
или летучей щелочью»,
поскольку водный раствор
аммиака имел все признаки щелочи.
История открытия аммиака
Nh4
В 1784 французский химик Бертолле
разложением аммиака доказал
его элементный состав,
который в 1787 получил официальное
название «нашатырь» – от
латинского названия
нашатырной щелочи – sal ammoniac.
1723-1802 г.
Это название сохраняется и до сих пор
в большинстве
западноевропейских языков
(нем. Ammonium chloride,
англ. Ammonia, фр. ammoniaque).
Строение атома азота
N
7
) )
2 5
Азот
14,0067
2s22p3
+7N
N
Nh4
2p
2s
2
5
Электронная формула имеет вид:
1S2 2S2 2P3
Таким образом, атом азота имеет на последней
(2 р) орбитали 3 неспаренных электрона.

Образование молекулы
Nh4
Атом азота находится в состоянии sp3-гибридизации.
107,30
Н
:N:Н
Н
: :
Н
:N + H
Н
Азот с водородом
образует
3 ковалентные
связи по обменному
механизму
На 4-й гибридизованной p орбитали
109028’ атома N находится неподеленная
пара электронов.
Форма молекулы – пирамидальная.
Связи N-H полярные, общие
электронные пары смещены
в сторону атома азота как атома
с большей ЭО.
ЭО (Н)=2,1
ЭО (N)=3,5.
Молекула полярная.
Nh4
Азот с водородом
образует
3 ковалентные
связи по обменному
механизму
Между молекулами аммиака образуются
водородные связи, т.е аммиак в жидком
состоянии ассоциирован.
Nh4
Водородные связи
увеличивают температуры
кипения и плавления
Физические свойства
Nh4
Газ,
легче воздуха
в 1,7 раза
Молекулярная
кристаллическая
решетка
h3O
Nh4
Р – высокая
1 V : 700 V, Ц
Резкий запах.

ТОКСИЧЕН
В лаборатории:
1. Действием щелочей на
соли аммония:
t
2Nh5Cl + Ca(OH)2 = CaCl2 + 2Nh4↑+2h3O
Нашатырь + гашеная известь
2. Гидролиз нитридов:
Mg3N2 + 6h3O=3Mg(OH)2+2Nh4↑
Nh4
Химические свойства
Nh4
-3
Nh4 – низшая степень окисления азота.
1. Аммиак – восстановитель
2. Основные свойства
(неподеленная пара электронов)
3. Специфические свойства
Аммиак-восстановитель
Реакция горения аммиака (до N2):
4Nh4 + 3O2 = 2N2+ 6h3O
=
Nh4
Аммиак-восстановитель
Nh4
Каталитическое окисление аммиака (до NO):
4Nh4 + 5O2 = 4NO + 6h3O
Аммиаком можно восстановить
некоторые неактивные металлы:
Nh4
Аммиак обесцвечивает
перманганат калия:
2KMnO4+2 Nh4= 2 KOH+N2+ 2h3O +2MnO2
KMnO4
3CuO + 2 Nh4 = 3Cu + N2 + 3h3O
Br2
Аммиак обесцвечивает
бромную воду:
3Br2 + 8Nh4 = N2 + 6Nh5Br
I
цвет
Основные свойства
Взаимодействие с водой
Аммиак реагирует с водой, образуя
гидрат аммиака (аммиачная вода):
Nh4 + h3O =Nh5OH
Изменяет окраску индикаторов:
Фенолфталеин – б/цв малиновый
Лакмус становится синим
Гидроксид аммония проявляет
все свойства щелочей !!!
Nh4
Основные свойства
Nh4
Взаимодействие с кислотами
Nh4 + HCl → Nh5Cl
хлорид аммония (нашатырь)
2 Nh4
Дым без огня ?!
(Образуется за счет
образования
хлорида аммония)
+
h3SO4 → (Nh5)2 SO4
сульфат
аммония
Механизм реакции
В солях аммония
ионная связь!!!
Nh4
Образование иона аммония NH
3
Три связи образованы по обменному механизму
четвертая – по донорно-акцепторному.
Донор — молекула или ион, имеющие свободную
пару электронов.
Акцептор — молекула или ион, имеющие
свободную орбиталь.
•
H+ + H N H
АКЦЕПТОР
H
ДОНОР
H
H
•
N H
H
+
Специфические свойства
Nh4
1. Взаимодействие с гипохлоритом натрия
(образование гидразина):
2Nh4 + NaClO = N2h5 + NaCl+h3O
Гидразин используют для
получения
ракетного топлива
Специфические свойства
Nh4
2. Взаимодействие с активными металлами
(образование амидов):
2Nh4 + 2К = 2KNh3 + Н2
Специфические свойства
Nh4
3. Взаимодействие с органическими веществами
(образование аминов):
Nh4 + Ch4Cl → Ch4Nh3 + HCl
Специфические свойства
Nh4
4. Комплексообразование:
CuSO4 + 4Nh4 → [Cu(Nh4)4]SO4
Cu(OH)2+ 4Nh4 → [Cu(Nh4)4](OH)2
Благодаря своим электронодонорным свойствам,
молекулы Nh4 могут входить в качестве лиганда
в комплексные соединения.

Обобщение
Применение аммиака
Лекарства
(медицина)
Окислитель
ракетного
топлива
Соли
аммония
для
паяния
Nh4
Получение
соды
Холодильные
установки
Аммиак
Азотная кислота
Обработка
драгоценных
металлов
Удобрения
Производство
взрывчатых
веществ
Сульфат аммония (Nh5)2SO4
Хлорид аммония Nh5Cl
Карбамид (мочевина) CO(Nh3)2
Техногенные катастрофы NH
3
Отравление аммиаком NH
3
ПДК аммиака составляет 0,001 мг/л.
1. Нельзя прикасаться к разлитому веществу, это
может вызвать болезненный ожог кожных покровов.
2. При отравлении аммиаком нельзя пить, а нужно
закапать в глаза альбуцид или промыть глаза
раствором борной кислоты.
3. В нос закапать теплое подсолнечное, оливковое или
персиковое масло, а лицо, руки и вообще пораженные
участки тела промыть 2-процентным раствором
борной кислоты.
Проверь себя
?
Для аммиака характерны
свойства:
1
Nh4
Аммиак взаимодействует с:
2
Ошибка
кислот
Ошибка
солей
щелочами
Ошибка
Правильно!
кислотами
Правильно!
оснований
оксидов
Ошибка
неметаллами
Ошибка
металлами
Ошибка
Цвет лакмуса в растворе
аммиака:
3
фиолетовый
Ошибка
бесцветный
Ошибка
Аммиак –
4
восстановитель в реакции
красный
Ошибка
С кислотами
Ошибка
с неметаллами
Ошибка
Правильно!
синий
С оксидами
Правильно!
металлов
С металлами
Ошибка
Готовимся к экзамену
• Осуществите цепочку превращений:
Nh4
N2 Nh4 (Nh5)2SO4 Nh5Cl Nh4
N2 Li3N Nh4
Запишите уравнения реакций.

Где возможно, рассмотрите с точки зрения
ТЭД и ОВР.
Приведите электронный баланс, полные и
сокращенные ионные уравнения.
Готовимся к экзамену
• Решите задачи:
Nh4
Уровень А:
Какой объем аммиака можно получить при нагревании
7,4 г. гидроксида кальция с хлоридом аммония ?.
Уровень В:
Аммиак объемом 4,48 л (н.у) сожгли в равном объеме
кислорода. Определите массу полученного азота.
Уровень С:
Аммиак объемом 2,24 л (н.у) пропустили в раствор
фосфорной кислоты массой 100 г с массовой долей
кислоты 19,8%. Определите состав соли и ее
массовую долю в полученном растворе.
Кроссворд
Nh4
По вертикали:
1. Латинское название азота…
По горизонтали:
2. Название взрывчатых веществ,
полученных
на
основе
солей
аммония…
3. Ученый, впервые получивший
чистый аммиак…
4.
Продуктом
взаимодействия
аммиака с кислотой является…
5. Аммиак и его водный раствор
представляют собой слабую…
6.

Название
10%-го
раствора
аммиака – нашатырный…
7. Аммиак в реакциях с водой и
кислотами образует ион…
Nh4 тип химической. Nh4 тип химической связи. В результате изучения данной темы вы узнаете
В результате взаимного электростатического притяжения между молекулами и атомами химических элементов может возникнуть ионная связь. Примеры таких соединений можно наблюдать в различных реакциях гальванических батарей, даже простая поваренная соль имеет соединение данного типа. О том, что такое ионная связь, чем она отличается от ковалентной, рассказывается в этой статье.
Простые и сложные ионы
В ионной связи участвуют и отдельные атомы, и различные их соединения. Все участники такой связи имеют электрический заряд и удерживаются в соединении благодаря электростатическим силам. Различают ионы простые, такие как Na + , K + , которые относятся к катионам; F — , Cl — — относящиеся к анионам. Также бывают ионы сложные, состоящие из двух и более атомов. Примеры ионной химической связи на базе сложных ионов — анионы OH — , NO 3 — , катион NH 4 + . Простые ионы с положительным зарядом образуются из атомов с низким ионизационным потенциалом — обычно это металлы главных подгрупп I-II группы. Простые ионы, имеющие отрицательный заряд, в большинстве случаев являются типичными неметаллами.
Примеры ионной химической связи на базе сложных ионов — анионы OH — , NO 3 — , катион NH 4 + . Простые ионы с положительным зарядом образуются из атомов с низким ионизационным потенциалом — обычно это металлы главных подгрупп I-II группы. Простые ионы, имеющие отрицательный заряд, в большинстве случаев являются типичными неметаллами.
Ковалентная и ионная связь
Примеры систем, созданных из двух частиц, обладающих противоположными электрическими зарядами, показывают, что в таком случае всегда возникает электрическое поле. Это означает, что электрически активные ионы могут притягивать и другие ионы в различных направлениях. Благодаря силам электрического притяжения и существует ионная связь. Примеры таких соединений показывают два принципиальных различия между ионной и ковалентной связью.
- Электрическое поле иона уменьшается в зависимости от расстояния в любом направлении. Поэтому степень взаимодействия между ионами не зависит от того, как в пространстве эти ионы расположены.
 Из этих наблюдений можно сделать вывод, что ионная связь скалярна, то есть не обладает направленностью.
Из этих наблюдений можно сделать вывод, что ионная связь скалярна, то есть не обладает направленностью. - Два иона, обладающие различными зарядами, притягивают не только друг друга, но и соседние заряженные ионы — к определенному иону могут присоединиться различное число заряженных частиц противоположного знака. В этом заключается еще одно различие между ковалентной и ионной связью: последняя не имеет насыщаемости. Число присоединенных ионов определяется линейными размерами заряженных частиц, а также тем принципом, что силы притяжения ионов противоположных зарядов должны преобладать над силами отталкивания, которые действуют между одинаково заряженными частицами.
Ассоциации
Поскольку насыщаемость и направленность у ионов отсутствуют, то они склонны соединяться друг с другом в различных комбинациях. Это свойство ученые назвали ассоциацией. При высоких температурах ассоциация невелика: кинетическая энергия молекул и ионов довольно высока, и в газовом состоянии вещества с ионным видом связи находятся в виде отдельных молекул. Но средние и низкие температуры делают возможным образование различных структурных соединений, за образование которых несет ответственность ионный тип связи. Примеры строения веществ в жидком и твердом состоянии показаны на рисунках.
Но средние и низкие температуры делают возможным образование различных структурных соединений, за образование которых несет ответственность ионный тип связи. Примеры строения веществ в жидком и твердом состоянии показаны на рисунках.
Как можно видеть, ионная связь создает кристаллическую решетку, в которой каждый элемент окружен ионами с противоположным знаком заряда. При этом такое вещество обладает одинаковыми характеристиками в различных направлениях.
Поляризация
Как известно, при присоединении электрона к атому неметалла выделяется определенное количество энергии. Однако присоединение второго электрона требует уже затрат энергии, поэтому образование простых многозарядных анионов становится энергетически убыточным. Вместе с тем такие элементы, как SO 4 2- , СО 3 2- показывают, что сложные многозарядные отрицательные ионы могут быть энергетически устойчивыми, так как электроны в соединении распределены таким образом, чтобы заряд каждого атома был не больше заряда самого электрона. Такие правила дикутует стандартная ионная связь.
Такие правила дикутует стандартная ионная связь.
Примеры типичных элементов, которые встречаются на каждом шагу (NaCl, CsF), не показывают полного разделения положительного и отрицательного зарядов. Например, в кристалле поваренной соли эффективный отрицательный заряд будет составлять всего около 93 % полного заряда электрона. Данный эффект наблюдается и в других соединениях. Такое неполное разделение зарядов называется поляризацией.
Причины поляризации
Причиной поляризации всегда является электрическое поле. Внешний слой электронов испытывает наибольшее смещение при поляризации. Однако следует заметить, что различные ионы имеют неодинаковую поляризуемость: чем слабее связь внешнего электрона с ядром, тем легче поляризуется весь ион и тем сильнее деформируется электронное облако.
Поляризация ионов оказывает известное действие на соединения, образующие ионную связь. Примеры химических реакций показывают, что наибольшим поляризующим действием обладает ион водорода Н + , поскольку он обладает наименьшими размерами и полным отсутствием электронного облака.
Ионная (электровалентная) химическая связь — связь, обусловленная образованием электронных пар за счет перехода валентных электронов от одного атома к другому. Характерна для соединений металлов с наиболее типичными неметаллами, напр.:
Na + + Cl — = Na + Cl
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена — приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому «молекулой» ионного соединения следует считать весь кристалл.
Идеальной ионной связи практически не
существует. Даже в тех соединениях,
которые обычно относят к ионным, не
происходит полного перехода электронов
от одного атома к другому; электроны
частично остаются в общем пользовании.
Так, связь во фториде лития на 80% ионная,
а на 20% — ковалентная. Поэтому правильнее
говорить о степени ионности
(полярности) ковалентной химической
связи. Считают, что при разности
электроотрицательностей элементов 2,1
связь является на 50% ионной. При большей
разности соединение можно считать
ионным.
Даже в тех соединениях,
которые обычно относят к ионным, не
происходит полного перехода электронов
от одного атома к другому; электроны
частично остаются в общем пользовании.
Так, связь во фториде лития на 80% ионная,
а на 20% — ковалентная. Поэтому правильнее
говорить о степени ионности
(полярности) ковалентной химической
связи. Считают, что при разности
электроотрицательностей элементов 2,1
связь является на 50% ионной. При большей
разности соединение можно считать
ионным.
Ионной моделью химической связи широко пользуются для описания свойств многих веществ, в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами. Это обусловлено простотой описания таких соединений: считают, что они построены из несжимаемых заряженных сфер, отвечающих катионам и анионам. При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания — минимальными.
Водородная связь
Водородная связь является особым видом
химической связи. Известно, что соединения
водорода с сильно электроотрицательными
неметаллами, такими как F,
О,N, имеют аномально
высокие температуры кипения. Если в
ряду Н 2 Тe–H 2 Se–H 2 Sтемпература кипения закономерно
уменьшается, то при переходе отH 2 Sк Н 2 О наблюдается резкий скачок
к увеличению этой температуры. Такая
же картина наблюдается и в ряду
галогенводородных кислот. Это
свидетельствует о наличии специфического
взаимодействия между молекулами Н 2 О,
молекуламиHF. Такое
взаимодействие должно затруднять отрыв
молекул друг от друга, т.е. уменьшать их
летучесть, а, следовательно, повышать
температуру кипения соответствующих
веществ. Вследствие большой разницы в
ЭО химические связиH–F,H–O,H–Nсильно поляризованы. Поэтому атом
водорода имеет положительный эффективный
заряд (δ +), а на атомахF,OиNнаходится
избыток электронной плотности, и они
заряжены отрицательно ( -).
Вследствие кулоновского притяжения
происходит взаимодействие положительно
заряженного атома водорода одной
молекулы с электроотрицательным атомом
другой молекулы.
Известно, что соединения
водорода с сильно электроотрицательными
неметаллами, такими как F,
О,N, имеют аномально
высокие температуры кипения. Если в
ряду Н 2 Тe–H 2 Se–H 2 Sтемпература кипения закономерно
уменьшается, то при переходе отH 2 Sк Н 2 О наблюдается резкий скачок
к увеличению этой температуры. Такая
же картина наблюдается и в ряду
галогенводородных кислот. Это
свидетельствует о наличии специфического
взаимодействия между молекулами Н 2 О,
молекуламиHF. Такое
взаимодействие должно затруднять отрыв
молекул друг от друга, т.е. уменьшать их
летучесть, а, следовательно, повышать
температуру кипения соответствующих
веществ. Вследствие большой разницы в
ЭО химические связиH–F,H–O,H–Nсильно поляризованы. Поэтому атом
водорода имеет положительный эффективный
заряд (δ +), а на атомахF,OиNнаходится
избыток электронной плотности, и они
заряжены отрицательно ( -).
Вследствие кулоновского притяжения
происходит взаимодействие положительно
заряженного атома водорода одной
молекулы с электроотрицательным атомом
другой молекулы. Благодаря этому молекулы
притягиваются друг к другу (жирными
точками обозначены водородные связи).
Благодаря этому молекулы
притягиваются друг к другу (жирными
точками обозначены водородные связи).
Водородной называется такая связь, которая образуется посредством атома водорода, входящего в состав одной из двух связанных частиц (молекул или ионов). Энергия водородной связи (21–29 кДж/моль или5–7 ккал/моль) приблизительнов 10 раз меньше энергии обычной химической связи. И тем не менее, водородная связь обусловливает существование в парах димерных молекул (Н 2 О) 2 , (HF) 2 и муравьиной кислоты.
В ряду сочетаний атомов НF,HO,HN,HCl,HSэнергия водородной связи падает. Она также уменьшается с повышением температуры, поэтому вещества в парообразном состоянии проявляют водородную связь лишь в незначительной степени; она характерна для веществ в жидком и твердом состояниях. Такие вещества как вода, лед, жидкий аммиак, органические кислоты, спирты и фенолы, ассоциированы в димеры, тримеры и полимеры. В жидком состоянии наиболее устойчивы димеры.
Все химические соединения образуются посредством образования химической связи. И в зависимости от типа соединяющихся частиц различают несколько видов. Самые основные
– это ковалентная полярная, ковалентная неполярная, металлическая и ионная. Сегодня речь пойдет об ионной.
И в зависимости от типа соединяющихся частиц различают несколько видов. Самые основные
– это ковалентная полярная, ковалентная неполярная, металлическая и ионная. Сегодня речь пойдет об ионной.
Вконтакте
Что такое ионы
Она образуется между двумя атомами – как правило, при условии, что разница электроотрицательностей между ними очень велика. Электроотрицательность атомов и ионов оценивается по шкале Поллинга.
Поэтому для того чтобы правильно рассматривать характеристики соединений, было введено понятие ионности. Эта характеристика позволяет определить на сколько процентов конкретная связь представляет именно ионную.
Соединение с максимальной ионностью это фторид цезия, в котором она составляет примерно 97%. Ионная связь характерна для веществ, образованных атомами металлов, располагающихся в первой и второй группе таблицы Д.И. Менделеева, и атомами неметаллов, находящихся в шестой и седьмой группах этой же таблицы.
Обратите внимание!
Стоит заметить, что не существует соединения, в котором взаимосвязь исключительно ионная. Для открытых на данный момент элементов нельзя добиться настолько большой разницы в электроотрицательности, чтобы получить 100%-ное ионное соединение. Поэтому определение ионной связи не совсем корректно, так как реально рассматриваются соединения с частичным ионным взаимодействием.
Для открытых на данный момент элементов нельзя добиться настолько большой разницы в электроотрицательности, чтобы получить 100%-ное ионное соединение. Поэтому определение ионной связи не совсем корректно, так как реально рассматриваются соединения с частичным ионным взаимодействием.
Зачем же ввели этот термин, если реально такого явления не существует? Дело в том, что этот подход помог объяснить многие нюансы в свойствах солей, оксидов и других веществ. Например, почему они хорошо растворимы в воде, а их растворы способны проводить электрический ток . Это невозможно объяснить ни с каких других позиций.
Механизм образования
Образование ионной связи возможно только при соблюдении двух условий: если атом металла, участвующий в реакции, способен легко отдать электроны, находящиеся на последнем энергетическом уровне, а атом неметалла способен эти электроны принять. Атомы металлов по своей природе являются восстановителями, то есть способны к отдаче электронов
.
Это связано с тем, что на последнем энергетическом уровне в металле могут находится от одного до трех электронов, а радиус самой частицы достаточно большой. Поэтому сила взаимодействия ядра с электронами на последнем уровне настолько мала, что они могут легко уходить с него. С неметаллами ситуация совершенно иная. Они имеют маленький радиус , а количество собственных электронов на последнем уровне может быть от трех и до семи.
И взаимодействие между ними и положительным ядром достаточно сильная, но любой атом стремится к завершению энергетического уровня, поэтому атомы неметалла стремятся получить недостающие электроны.
И когда встречаются два атома – металла и неметалла, происходит переход электронов от атома металла к атому неметалла, при этом образуется химическое взаимодействие.
Схема соединения
На рисунке наглядно видно, как именно осуществляется образование ионной связи. Изначально существуют нейтрально заряженные атомы натрия и хлора.
Первый имеет один электрон на последнем энергетическом уровне, второй семь. Далее происходит переход электрона от натрия к хлору и образование двух ионов. Которые соединяются между собой с образованием вещества. Что такое ион? Ион – это заряженная частица, в которой количество протонов не равно количеству электронов .
Отличия от ковалентного типа
Ионная связь за счет своей специфичности не имеет направленности. Это связано с тем, что электрическое поле иона представляет собой сферу, при том оно убывает или возрастает в одном направлении равномерно, подчиняясь одному и тому же закону.
В отличие от ковалентной, которая образуется за счет перекрывания электронных облаков.
Второе отличие заключается в том, что ковалентная связь насыщенна . Что это значит? Количество электронных облаков, которые могут принимать участие в взаимодействии ограниченно.
А в ионной за счет того, что электрическое поле имеет сферическую форму, оно может соединяться с неограниченным количеством ионов. А значит, можно говорить о том, что она не насыщена.
А значит, можно говорить о том, что она не насыщена.
Также она может характеризоваться еще несколькими свойствами:
- Энергия связи – это количественная характеристика, и она зависит от количества энергии, которое необходимо затратить на ее разрыв. Она зависит от двух критериев – длины связи и заряда ионов , участвующих в ее образовании. Связь тем прочнее, чем короче ее длина и больше заряды ионов, ее формирующих.
- Длина – этот критерий уже упоминался в предыдущем пункте. Он зависит исключительно от радиуса частиц, участвующих в образовании соединения. Радиус атомов изменяется следующим образом: уменьшается по периоду при увеличении порядкового номера и увеличивается в группе.
Вещества с ионной связью
Она характерна для значительного числа химических соединений. Это большая часть всех солей, в том числе и всем известная поваренная соль. Она встречается во всех соединениях, где есть непосредственный контакт между металлом и неметаллом
.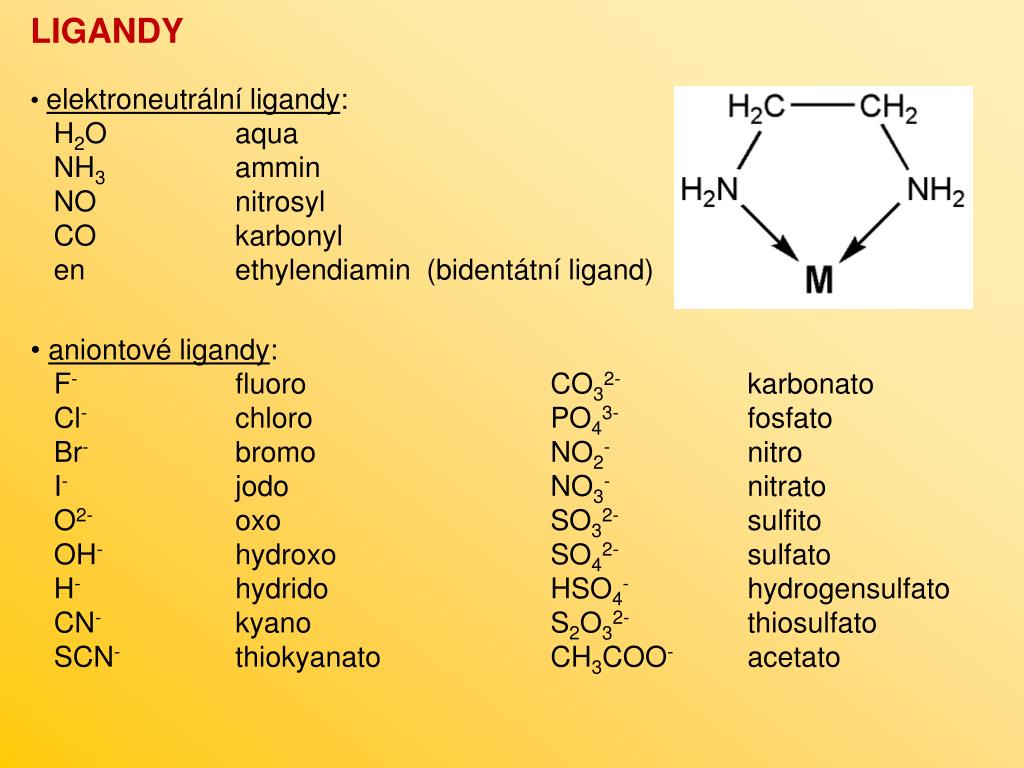 Вот некоторые примеры веществ с ионной связью:
Вот некоторые примеры веществ с ионной связью:
- хлориды натрия и калия,
- фторид цезия,
- оксид магния.
Также она может проявляться и в сложных соединениях.
Например, сульфат магния.
Перед вами формула вещества с ионной и ковалентной связью:
Между ионами кислорода и магния будет образовываться ионная связь, а вот сера и соединены между собой уже с помощью ковалентной полярной.
Из чего можно сделать вывод, что ионная связь характерна для сложных химических соединений.
Что такое ионная связь в химии
Виды химической связи — ионная, ковалентная, металлическая
Вывод
Свойства напрямую зависят от устройства кристаллической решетки . Поэтому все соединения с ионной связью хорошо растворимы в воде и других полярных растворителях, проводят и являются диэлектриками. При этом довольно тугоплавки и хрупки. Свойства этих веществ довольно часто применяются в устройстве электрических приборов.
Первая из них — образование ионной связи. (Вторая — образование , о ней речь пойдет ниже). При образовании ионной связи атом металла теряет электроны, а атом неметалла приобретает. Для примера рассмотрим электронное строение атомов натрия и хлора:
(Вторая — образование , о ней речь пойдет ниже). При образовании ионной связи атом металла теряет электроны, а атом неметалла приобретает. Для примера рассмотрим электронное строение атомов натрия и хлора:
Na 1s 2 2s 2 2 p 6 3 s 1 — один электрон на внешнем уровне
Cl 1s 2 2s 2 2 p 6 3 s 2 3 p 5 — семь электронов на внешнем уровне
Если атом натрия передаст свой единственный Зs-электрон атому хлора, правило октета будет выполнено для обоих атомов. У атома хлора окажется восемь электронов на внешнем третьем слое, а у атома натрия — тоже восемь электронов на втором слое, который теперь стал внешним:
Na + 1s 2 2s 2 2 p 6
Cl — 1s 2 2s 2 2 p 6 3 s 2 3 p 6 — восемь электронов на внешнем уровне
При этом ядро атома натрия по-прежнему содержит 11 протонов, но общее число электронов уменьшилось до 10. Это означает, что число положительно заряженных частиц на одну превышает число отрицательно заряженных, поэтому общий заряд „атома” натрия равен +1.
Это означает, что число положительно заряженных частиц на одну превышает число отрицательно заряженных, поэтому общий заряд „атома” натрия равен +1.
„Атом” хлора теперь содержит 17 протонов и 18 электронов и его заряд равен -1.
Заряженные атомы, образовавшиеся в результате потери или приобретения одно или нескольких электронов, называются ионами
. Положительно заряженные ионы получили название катионов
, а отрицательно заряженные называются анионами
.
Катионы и анионы, имея противоположные заряды, притягиваются друг к другу электростатическими силами. Это притяжение противоположно заряженных ионов и называется ионной связью
. Она возникает в соединениях, образованных металлом и одним или более неметаллами.
Нижеперечисленные соединения удовлетворяют этому критерию и имеют ионную природу: MgCl 2 , Fel 2, CuF, Na 2 0, Na 2 S0 4 , Zn(C 2 H 3 0 2) 2.
Есть и другой способ изображения ионных соединений:
В этих формулах точками показывают только электроны, находящиеся на внешних оболочках (валентные электроны
). Такие формулы называют формулами Льюиса в честь американского химика Г. Н. Льюиса, одного из основоположников (наряду с Л. Полингом) теории химической связи.
Такие формулы называют формулами Льюиса в честь американского химика Г. Н. Льюиса, одного из основоположников (наряду с Л. Полингом) теории химической связи.
Перенос электронов от атома металла к атому неметалла и образование ионов возможны благодаря тому, что неметаллы имеют высокую электроотрицательность, а металлы — низкую.
Из-за сильного притяжения ионов друг к другу ионные соединения в большинстве своем твердые и имеют довольно высокую температуру плавления.
Ионная связь образуется при переносе электронов от атома металла к атому неметалла. Образовавшиеся при этом ионы притягиваются друг к другу электростатическими силами.
аммиак | Определение и использование
аммиак (NH 3 ) , бесцветный едкий газ, состоящий из азота и водорода. Это простейшее стабильное соединение этих элементов, которое служит исходным материалом для производства многих важных с коммерческой точки зрения соединений азота.
Использование аммиака
В основном аммиак используется в качестве удобрения. В Соединенных Штатах его обычно вносят прямо в почву из резервуаров, содержащих сжиженный газ.Аммиак также может быть в форме солей аммония, таких как нитрат аммония, NH 4 NO 3 , сульфат аммония (NH 4 ) 2 SO 4 и различные фосфаты аммония. Мочевина, (H 2 N) 2 C=O, является наиболее часто используемым источником азота для удобрений во всем мире. Аммиак также используется в производстве коммерческих взрывчатых веществ (например, тринитротолуола [ТНТ], нитроглицерина и нитроцеллюлозы).
В текстильной промышленности аммиак используется при производстве синтетических волокон, таких как нейлон и вискоза.Кроме того, он используется при окрашивании и чистке хлопка, шерсти и шелка. Аммиак служит катализатором в производстве некоторых синтетических смол. Что еще более важно, он нейтрализует кислые побочные продукты нефтепереработки, а в резиновой промышленности предотвращает коагуляцию латекса-сырца во время транспортировки с плантации на фабрику. Аммиак также находит применение как в аммиачно-содовом процессе (также называемом процессом Сольве), широко используемом методе производства кальцинированной соды, так и в процессе Оствальда, методе преобразования аммиака в азотную кислоту.
Аммиак также находит применение как в аммиачно-содовом процессе (также называемом процессом Сольве), широко используемом методе производства кальцинированной соды, так и в процессе Оствальда, методе преобразования аммиака в азотную кислоту.
Аммиак используется в различных металлургических процессах, включая азотирование листов сплава для упрочнения их поверхности. Поскольку аммиак легко разлагается с образованием водорода, он является удобным портативным источником атомарного водорода для сварки. Кроме того, аммиак может поглощать значительное количество тепла из окружающей среды (например, один грамм аммиака поглощает 327 калорий тепла), что делает его полезным в качестве хладагента в холодильном оборудовании и оборудовании для кондиционирования воздуха. Наконец, среди его второстепенных применений — включение в некоторые бытовые чистящие средства.
Получение аммиака
Чистый аммиак был впервые получен английским ученым-физиком Джозефом Пристли в 1774 году, а его точный состав был определен французским химиком Клодом-Луи Бертолле в 1785 году. Аммиак постоянно входит в пятерку основных химических веществ, производимых в Соединенных Штатах. Основным коммерческим методом производства аммиака является процесс Габера-Боша, который включает прямую реакцию элементарного водорода и элементарного азота.
N 2 + 3H 2 → 2NH 3
Аммиак постоянно входит в пятерку основных химических веществ, производимых в Соединенных Штатах. Основным коммерческим методом производства аммиака является процесс Габера-Боша, который включает прямую реакцию элементарного водорода и элементарного азота.
N 2 + 3H 2 → 2NH 3
Эта реакция требует использования катализатора, высокого давления (100–1000 атмосфер) и повышенной температуры (400–550 °C [750–1020 °F]).Действительно, равновесие между элементами и аммиаком способствует образованию аммиака при низкой температуре, но для достижения удовлетворительной скорости образования аммиака требуется высокая температура. Можно использовать несколько различных катализаторов. Обычно катализатор представляет собой железо, содержащее оксид железа. Однако в качестве катализаторов использовались как оксид магния на оксиде алюминия, который был активирован оксидами щелочных металлов, так и рутений на угле. В лаборатории аммиак лучше всего синтезировать путем гидролиза нитрида металла.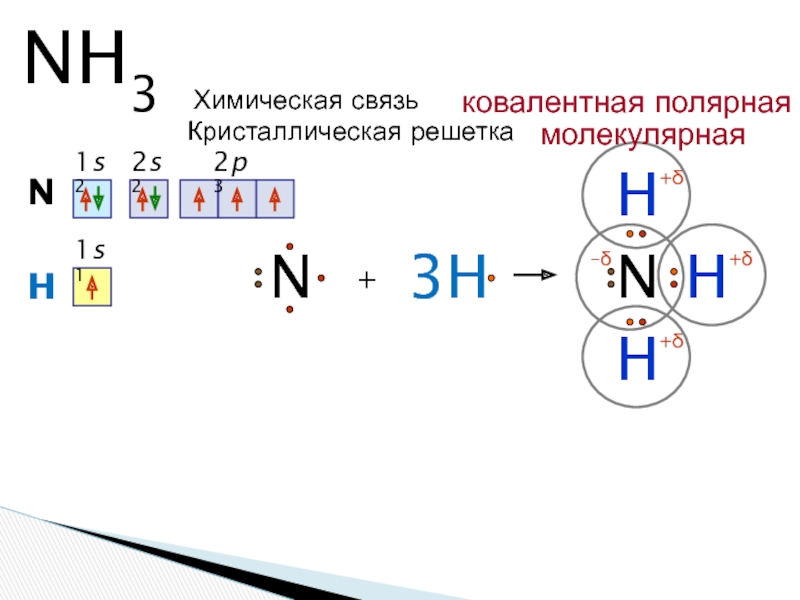 Mg 3 N 2 + 6H 2 O → 2NH 3 + 3Mg(OH) 2
Mg 3 N 2 + 6H 2 O → 2NH 3 + 3Mg(OH) 2
Физические свойства аммиака
Аммиак — бесцветный газ с резким резким запахом. Его температура кипения составляет -33,35 ° C (-28,03 ° F), а температура замерзания составляет -77,7 ° C (-107,8 ° F). Он имеет высокую теплоту испарения (23,3 кДж на моль при температуре кипения), и с ним можно обращаться как с жидкостью в термоизолированных контейнерах в лаборатории. (Теплота испарения вещества — это количество килоджоулей, необходимое для испарения одного моля вещества без изменения температуры.) Молекула аммиака имеет форму тригональной пирамиды с тремя атомами водорода и неподеленной парой электронов, присоединенной к атому азота. Это полярная молекула, и она сильно ассоциирована из-за сильных межмолекулярных водородных связей. Диэлектрическая проницаемость аммиака (22 при -34 ° C [-29 ° F]) ниже, чем у воды (81 при 25 ° C [77 ° F]), поэтому он является лучшим растворителем для органических материалов. Тем не менее, он все еще достаточно высок, чтобы позволить аммиаку действовать как умеренно хороший ионизирующий растворитель.Аммиак также самоионизируется, хотя и в меньшей степени, чем вода.
2NH 3 ⇌ NH 4 + + NH 2 −
Тем не менее, он все еще достаточно высок, чтобы позволить аммиаку действовать как умеренно хороший ионизирующий растворитель.Аммиак также самоионизируется, хотя и в меньшей степени, чем вода.
2NH 3 ⇌ NH 4 + + NH 2 −
Химическая активность аммиака
Сгорание аммиака протекает с трудом, но дает газообразный азот и воду. 4NH 3 + 3O 2 + тепло → 2N 2 + 6H 2 O Однако при использовании катализатора и при правильных температурных условиях аммиак реагирует с кислородом с образованием оксида азота NO, который окисляется до диоксида азота NO 2 и используется в промышленном синтезе азотной кислоты.
Аммиак легко растворяется в воде с выделением тепла.
NH 3 + H 2 O ⇌ NH 4 + + OH −
Эти водные растворы аммиака являются основными и иногда называются растворами гидроксида аммония (NH 4 OH). Однако равновесие таково, что 1,0-молярный раствор NH 3 дает только 4,2 миллимоля гидроксид-иона. Гидраты NH 3 · H 2 O, 2NH 3 · H 2 O и NH 3 · 2H 2 O существуют и состоят из молекул аммиака и воды, связанных межмолекулярными связями. водородные связи.
Однако равновесие таково, что 1,0-молярный раствор NH 3 дает только 4,2 миллимоля гидроксид-иона. Гидраты NH 3 · H 2 O, 2NH 3 · H 2 O и NH 3 · 2H 2 O существуют и состоят из молекул аммиака и воды, связанных межмолекулярными связями. водородные связи.
Жидкий аммиак широко используется в качестве неводного растворителя. Щелочные металлы, а также более тяжелые щелочноземельные металлы и даже некоторые внутренние переходные металлы растворяются в жидком аммиаке, образуя растворы синего цвета. Физические измерения, в том числе исследования электропроводности, свидетельствуют о том, что этот синий цвет и электрический ток обусловлены сольватированным электроном.
Металл (рассеивается) ⇌ металл (NH 3 ) x ⇌ M + (NH + ) x + E — (NH 3 ) y
Эти растворы являются отличными источниками электронов для восстановления других химических веществ. По мере увеличения концентрации растворенного металла раствор приобретает темно-синий цвет и, наконец, превращается в раствор медного цвета с металлическим блеском. Электропроводность уменьшается, и есть свидетельства того, что сольватированные электроны связываются с образованием электронных пар.
2 e − (NH 3 ) y ⇌ e 2 (NH 3 3
По мере увеличения концентрации растворенного металла раствор приобретает темно-синий цвет и, наконец, превращается в раствор медного цвета с металлическим блеском. Электропроводность уменьшается, и есть свидетельства того, что сольватированные электроны связываются с образованием электронных пар.
2 e − (NH 3 ) y ⇌ e 2 (NH 3 3 5 )
24
Большинство солей аммония также легко растворяются в жидком аммиаке.
Формула молекулы аммиака, символ и структура? | Что такое аммиак? — Видео и стенограмма урока
Молекулярная структура аммиака
Химическая формула аммиака: {eq}\mathsf N \mathsf H₃ {/eq} , но из чего именно состоит {eq}\mathsf N \mathsf H₃ {/eq}?
Формула аммиака {eq}\mathsf N \mathsf H₃ {/eq}; говорит нам о составных элементах молекулы аммиака — каждая молекула аммиака содержит три атома водорода и один атом азота.
В частности, молекулярная структура аммиака включает центральный атом азота, ковалентно связанный с тремя атомами водорода. Эту структуру можно лучше понять, наблюдая за моделью молекулы аммиака в виде шара и стержня (как показано на прилагаемой диаграмме). Важной особенностью молекулы аммиака является то, что азот имеет неподеленную пару электронов, которая может принять протон (т.е., ион водорода) с образованием ионов аммония ({eq}\mathsf N \mathsf H₄⁺ {/eq}) . Эта неподеленная пара приводит к форме молекулы, которая описывается как треугольная пирамида.
Свойства аммиака
Химический состав и структура аммиака придают ему ряд уникальных физических и химических свойств. Многие из этих свойств делают аммиак веществом, имеющим промышленное и коммерческое значение.
Многие из этих свойств делают аммиак веществом, имеющим промышленное и коммерческое значение.
Физические свойства
При комнатной температуре и давлении аммиак существует в виде прозрачного и бесцветного газа. Он имеет температуру кипения {экв}-33,35℃ {/экв} ({экв}-28,03℉ {/экв}) и точку плавления {экв}-77,7℃ {/экв} ({экв} }-107,9℉ {/экв}). Плотность аммиака составляет {экв}0,77 г/л{/экв}, а пары аммиака легче воздуха.
Имеет отчетливый запах, который часто характеризуется как резкий, резкий или удушающий.Хотя обычно он считается негорючим, он может гореть при высокой концентрации паров или в присутствии сильного источника воспламенения, платинового катализатора или горючих материалов.
Химические свойства
Молекулярная масса или молярная масса аммиачной кислоты составляет {экв}17 г/моль {/экв}. Это можно рассчитать, сложив атомные массы отдельных атомов, составляющих одну молекулу. Учитывая символ аммиака {eq}\mathsf N \mathsf H₃ {/eq} , можно увидеть, что каждая молекула состоит из трех атомов водорода (атомная масса = 1) и одного атома азота (атомная масса = 14).
Следовательно:
{экв} молярная масса = 3×1 + 1×14 = 17 г/моль {/экв}.
Аммиак представляет собой полярную молекулу , потому что азот в молекуле аммиака более электроотрицательный, чем атомы водорода. Будучи полярной молекулой, аммиак смешивается с водой и органическими растворителями. Жидкий аммиак является наиболее изученным неорганическим неводным полярным растворителем и может растворять щелочные металлы с образованием окрашенных растворов, проводящих электричество.
Является ли аммиак щелочным? Да, аммиак является щелочным соединением.При растворении в воде он образует щелочной раствор с pH около 10. В качестве основания он принимает ионы водорода с образованием иона аммония (NH₄⁺). Аммиак вызывает коррозию металлов, таких как железо и медь, поэтому его обычно хранят и транспортируют в стальных контейнерах.
Важные реакции с использованием аммиака
Как упоминалось ранее, при растворении в воде аммиак ионизируется с образованием слабого основания. Химическая реакция для этого процесса выглядит следующим образом:
Химическая реакция для этого процесса выглядит следующим образом:
- {экв}NH₃ (г) + H₂O (I) \rightarrow NH₄⁺ + OH⁻ {/экв}
Ион NH₄⁺ известен как ион аммония .Этот ион образует ионные связи с образованием солей аммония (таких как сульфат аммония и хлорид аммония), многие из которых используются в качестве сельскохозяйственных удобрений. Сульфат аммония синтезируется из аммиака и серной кислоты, а также используется для поддержания уровня кислотности в хлебобулочных изделиях. Некоторые примеры реакций, в которых образуются соли аммония, включают:
- Сульфат аммония: {экв} 2NH3 + H₂SO4 \rightarrow (NH4)₂SO4 {/экв}
- Хлорид аммония (процесс Сольвея): {экв} NaCl + CO₂ + NH3 + H₂0 \rightarrow NaHCO3 + NH4Cl {/экв}
- Нитрат аммония: {экв}HNO₃ + NH3 \rightarrow NH4NO₃ {/экв}
Обычное использование аммиака
Существуют различные виды промышленного и коммерческого использования аммиака. Некоторые известные примеры включают:
Некоторые известные примеры включают:
- Удобрение : Большая часть промышленно производимого аммиака используется в качестве удобрения. Это может включать внесение аммиака непосредственно в сельскохозяйственные угодья или использование солей аммония. Аммиак и его соли служат хорошим источником азота для роста сельскохозяйственных культур.
- Взрывчатые вещества : Аммиак используется для производства взрывчатых веществ, включая нитроглицерин, тринитротолуол (более известный как тротил) и нитроцеллюлоза (иногда называемая нитратом целлюлозы).
- Текстильные изделия : Аммиак используется для производства некоторых синтетических волокон (например, нейлона, вискозы). Он также играет роль в окрашивании таких тканей, как хлопок, шерсть и шелк.
Другие примеры использования аммиака включают нейтрализацию кислоты в процессе переработки нефти, производства смолы и синтеза кальцинированной соды и азотной кислоты. Координационные комплексы аммиака, которые связаны с образованием неподеленной пары с некоторыми металлами, часто используются в качестве катализаторов.
Как упоминалось ранее, аммиак также образуется в природе как побочный продукт катаболизма белков (т.е., расщепление белков на аминокислоты) у животных, в том числе у человека.
Промышленное производство: процесс Габера-Боша
Большая часть коммерчески производимого аммиака синтезируется с использованием процесса Габера-Боша . Этот процесс включает прямую реакцию между азотом (из N₂ в воздухе) и водородом (как H₂, полученный из природного газа). Химическое уравнение этого процесса выглядит следующим образом:
- {экв}N₂ + 3H₂ \rightarrow 2NH₃ {/экв}
Эта реакция проводится при высоких температурах около 400–550 ℃ и давлении 200–400 атмосфер.Для этой реакции также используется железный катализатор (с промотором гидроксида калия).
Из-за условий высокой температуры и давления, необходимых для этой реакции, ее часто критикуют за потребление энергии и воздействие на окружающую среду. На процесс Габера-Боша для производства аммиака приходится 1% мирового потребления энергии и 1,4% мировых выбросов {экв}\mathsf C \mathsf O₂ {/экв}.
Электрохимический синтез.
Электрохимический синтез аммиака считается потенциальной альтернативой процессу Габера-Боша, поскольку он не способствует выбросам {eq}\mathsf C \mathsf O₂ {/eq}, требует более мягких условий и может использоваться для хранения возобновляемая энергия в химических связях.Этот электрохимический синтез происходит посредством электрохимической реакции восстановления азота (NRR), в которой используется литиевый электрокатализатор.
Этот процесс также изучается на предмет его применения в преобразовании возобновляемой энергии в химическую энергию (в виде аммиака), которая может служить удобной средой для хранения и транспортировки энергии.
Резюме урока
Аммиак (также известный как азан ) представляет собой соединение с химической формулой {eq}\mathsf N \mathsf H₃ {/eq} .Молекула аммиака состоит из одного атома азота и трех атомов водорода в форме тригональной пирамиды. Неподеленная пара атома азота может принять протон, чтобы сформировать ионов аммония ({eq}\mathsf N \mathsf H₄⁺ {/eq}) . Свойства аммиака включают:
Свойства аммиака включают:
- Температура плавления: {экв}-77,7℃ {/экв}
- Точка кипения: {экв}-33,55℃ {/экв}
- Бесцветный, едкий газ
- Полярная молекула. Растворяется в воде с образованием слабого основания.
Аммиак используется для различных промышленных и коммерческих целей, включая производство удобрений , взрывчатых веществ и текстиля . Большая часть аммиака в промышленных масштабах синтезируется с помощью процесса Габера-Боша . Эта реакция требует высокой температуры и давления и подвергается критике за потребление энергии и возникающие в результате выбросы {eq}\mathsf C \mathsf O₂ {/eq}. Ученые изучают электрохимический синтез аммиака как более чистую альтернативу этому процессу.
Формула аммиака — Использование, свойства, структура и формула аммиака
Формула и структура: Химическая формула аммиака — NH 3 , а его молярная масса — 17,03 г/моль.
Молекула аммиака имеет форму тригональной пирамиды, в которой азот соединен с тремя атомами водорода. Атом азота имеет неподеленную электронную пару, что делает аммиак основанием. NH 3 представляет собой полярную молекулу, которая легко образует водородные связи, благодаря чему хорошо смешивается с водой.
Возникновение: Аммиак естественным образом присутствует в организме и выделяется почками для нейтрализации избытка кислоты. Он также содержится в небольших количествах в дождевой воде, вулканических районах и даже в атмосфере.
Приготовление: Аммиак производится в промышленных масштабах с помощью процесса Габера-Боша, в котором элементарный водород и элементарный азот реагируют в присутствии металлического катализатора с образованием газообразного аммиака. Реакцию проводят при высоком давлении и высокой температуре (400–550 °С).
N 2 + 3H 2 → 2NH 3
Физические свойства: Аммиак — бесцветный газ с резким проникающим запахом. Его температура кипения составляет -33,35°С, а температура замерзания -77,7°С. Газ NH 3 можно сжижать, однако из-за чрезвычайно низкой температуры кипения жидкий аммиак необходимо хранить при низкой температуре и высоком давлении.
Его температура кипения составляет -33,35°С, а температура замерзания -77,7°С. Газ NH 3 можно сжижать, однако из-за чрезвычайно низкой температуры кипения жидкий аммиак необходимо хранить при низкой температуре и высоком давлении.
Химические свойства: Аммиак является слабым основанием. Он соединяется с различными кислотами с образованием солей аммония, которые являются важными химическими веществами во многих отраслях промышленности. Аммиак легко растворяется в воде в результате экзотермической реакции с образованием водного раствора аммиака, также называемого гидроксидом аммония (NH 4 OH).
NH 3 + H 2 O → NH 4 OH
Жидкий аммиак является важным неводным растворителем, который может растворять многие щелочные и щелочноземельные металлы с образованием проводящих растворов синего цвета.
Использование: Аммиак является предшественником различных важных соединений азота, таких как мочевина, аминокислоты, фенол, акрилонитрил, цианистый водород, кальцинированная сода, азотная кислота и многие другие. Он также используется для производства удобрений, полимеров, синтетических волокон (нейлон, вискоза), взрывчатых веществ (тротил, нитроглицерин), чистящих средств и хладагентов.
Он также используется для производства удобрений, полимеров, синтетических волокон (нейлон, вискоза), взрывчатых веществ (тротил, нитроглицерин), чистящих средств и хладагентов.
Опасность для здоровья/воздействие на здоровье: Хотя он широко распространен в природе и используется во многих бытовых целях, аммиак считается токсичным при вдыхании. NH 3 Пары имеют резкий и едкий запах, который может серьезно раздражать глаза, нос, слизистые оболочки и кожу, а также повредить дыхательные пути. При высоких концентрациях воздействие газообразного аммиака может привести к необратимому повреждению легких и смерти.
Аммиак — Nh4 | Технологическое оборудование Heil
Аммиак представляет собой бесцветный газ с резким запахом, состоящий из азота и водорода, с химической формулой NH 3 .Безводный аммиак считается очень чистым аммиаком с очень небольшим количеством воды. Газообразный аммиак можно сжать, чтобы он стал жидкостью под давлением.
приложений
Выбросы аммиака присутствуют в различных отраслях промышленности, включая сельское хозяйство, производство удобрений, полупроводников, химическое производство, животноводство, городские сточные воды, переработку и хранение продуктов питания и напитков. Безводный аммиак очень часто используется в холодильных установках для предприятий пищевой промышленности и дистрибьюторов.
Безводный аммиак очень часто используется в холодильных установках для предприятий пищевой промышленности и дистрибьюторов.
Влияние на здоровье и окружающую среду
Аммиак вызывает коррозию, раздражает кожу, глаза, нос, горло и легкие. Он очень опасен в больших концентрациях. В прошлом на аммиачных холодильных установках происходили случайные выбросы хранящегося аммиака, что приводило к серьезному повреждению оборудования, потере товарно-материальных запасов, производственным потерям, травмам и даже смерти рабочих в результате чрезмерного воздействия. Аварийные скрубберы для аммиака могут быть спроектированы и установлены для снижения риска случайного воздействия аммиака во время случайного выброса.
Порог запаха аммиака = 5 частей на миллион по объему.
Значение IDLH для аммиака = 300 частей на миллион по объему.
Нормативные аспекты
Агентство по охране окружающей среды США опубликовало Программу управления рисками, содержащую рекомендации для аммиачных холодильных установок.
OSHA PEL = 25 частей на миллион. Агентство по охране окружающей среды США рассматривает возможность регулирования выбросов аммиака в соответствии с Законом о чистом воздухе и уделяет особое внимание выбросам животноводческой отрасли.
Технологии управления
Противоточные башенные скрубберы HEIL серии 730представляют собой наиболее распространенную технологию высокоэффективной очистки от аммиака.Скрубберы Heil Series 770 Water Jet Eductor также предназначены для определенных областей применения. Водные кислые растворы серной кислоты обычно используются для очистки от аммиака, создавая побочный продукт сульфата аммония. Сульфат аммония является ингредиентом, часто используемым в удобрениях, и поэтому может иметь рыночную стоимость. Скрубберы Heil для аммиака могут достигать эффективности удаления более 99,9%.
Факты об аммиаке
Техническая информация
Копия документа «Факты об аммиаке» (техническая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3 стр.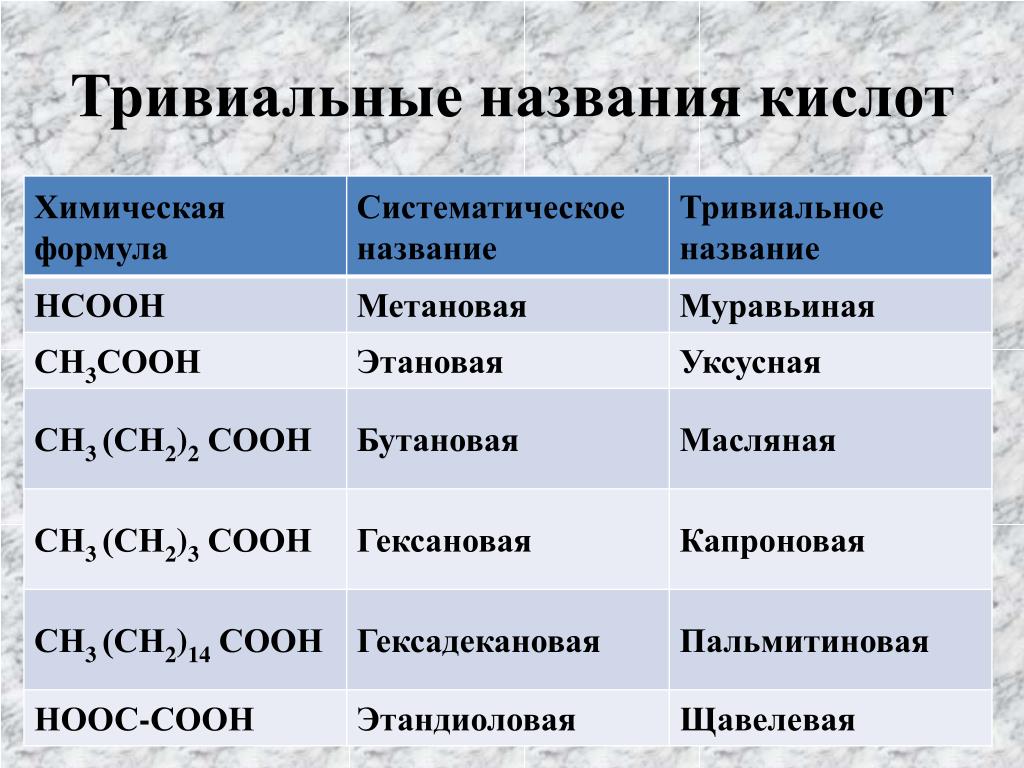 )
)
Примечание для читателя: Этот информационный бюллетень предназначен для предоставления общей информации и информации о конкретном химическом агенте. Для получения информации о готовности и реагировании (например, для сотрудников службы экстренного реагирования и скорой медицинской помощи) обратитесь к следующим ресурсам Департамента:
Что такое аммиак?
Аммиак (NH 3 ) является одним из наиболее часто производимых промышленных химикатов в Соединенных Штатах. Он используется в промышленности и торговле, а также естественным образом присутствует в организме человека и в окружающей среде.Аммиак необходим для многих биологических процессов и служит предшественником для синтеза аминокислот и нуклеотидов. В окружающей среде аммиак является частью азотного цикла и образуется в почве в результате бактериальных процессов. Аммиак также образуется в результате разложения органических веществ, включая растения, животных и отходы животноводства.
Некоторые химические/физические свойства аммиака:
- При комнатной температуре аммиак представляет собой бесцветный сильно раздражающий газ с резким удушливым запахом.
- В чистом виде известен как безводный аммиак и гигроскопичен (легко впитывает влагу).
- Аммиак обладает щелочными свойствами и вызывает коррозию.
- Газообразный аммиак легко растворяется в воде с образованием гидроксида аммония, щелочного раствора и слабого основания.
- Газообразный аммиак легко сжимается и под давлением образует прозрачную жидкость.
- Аммиак обычно транспортируют в виде сжатой жидкости в стальных контейнерах.
- Аммиак не легко воспламеняется, но контейнеры с аммиаком могут взорваться при воздействии высокой температуры.
Как используется аммиак?
Около 80% аммиака, производимого промышленностью, используется в сельском хозяйстве в качестве удобрения. Аммиак также используется в качестве газообразного хладагента для очистки воды и в производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ. Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака.Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Он содержится во многих бытовых и промышленных чистящих средствах. Бытовые чистящие растворы аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака.Растворы аммиака для промышленного использования могут иметь концентрацию 25% или выше и вызывать коррозию.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергаются воздействию аммиака при вдыхании газа или паров. Поскольку аммиак существует в природе, а также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, в промышленных и коммерческих помещениях также означает, что воздействие может произойти в результате случайного выброса или преднамеренного террористического нападения.
Безводный газообразный аммиак легче воздуха и будет подниматься вверх, так что обычно он рассеивается и не оседает в низинах. Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Эти пары могут распространяться по земле или в низинах с плохим воздушным потоком, где люди могут подвергнуться воздействию.
Каков механизм действия аммиака?
Аммиак немедленно взаимодействует с имеющейся влагой на коже, в глазах, полости рта, дыхательных путях и особенно на слизистых поверхностях с образованием очень едкого гидроксида аммония.Гидроксид аммония вызывает некроз тканей за счет разрушения липидов клеточных мембран (омыление), что приводит к разрушению клеток. Когда клеточные белки разрушаются, вода извлекается, что приводит к воспалительной реакции, вызывающей дальнейшее повреждение.
Каковы непосредственные последствия воздействия аммиака на здоровье?
Вдыхание: Аммиак вызывает раздражение и коррозию. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в носу, горле и дыхательных путях.Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, приводящее к дыхательной недостаточности или недостаточности. Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Вдыхание более низких концентраций может вызвать кашель и раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осознание длительного воздействия низких концентраций.
Дети, подвергшиеся воздействию тех же концентраций паров аммиака, что и взрослые, могут получить большую дозу, поскольку у них больше отношение площади поверхности легких к массе тела и повышенное отношение минутного объема к массе.Кроме того, они могут подвергаться воздействию более высоких концентраций, чем взрослые в том же месте, из-за их меньшего роста и более высоких концентраций паров аммиака, изначально обнаруженных у земли.
Контакт с кожей или глазами: Воздействие низких концентраций аммиака в воздухе или в растворе может вызвать быстрое раздражение кожи или глаз. Более высокие концентрации аммиака могут вызвать серьезные травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может привести к коррозионным повреждениям, включая ожоги кожи, необратимое повреждение глаз или слепоту.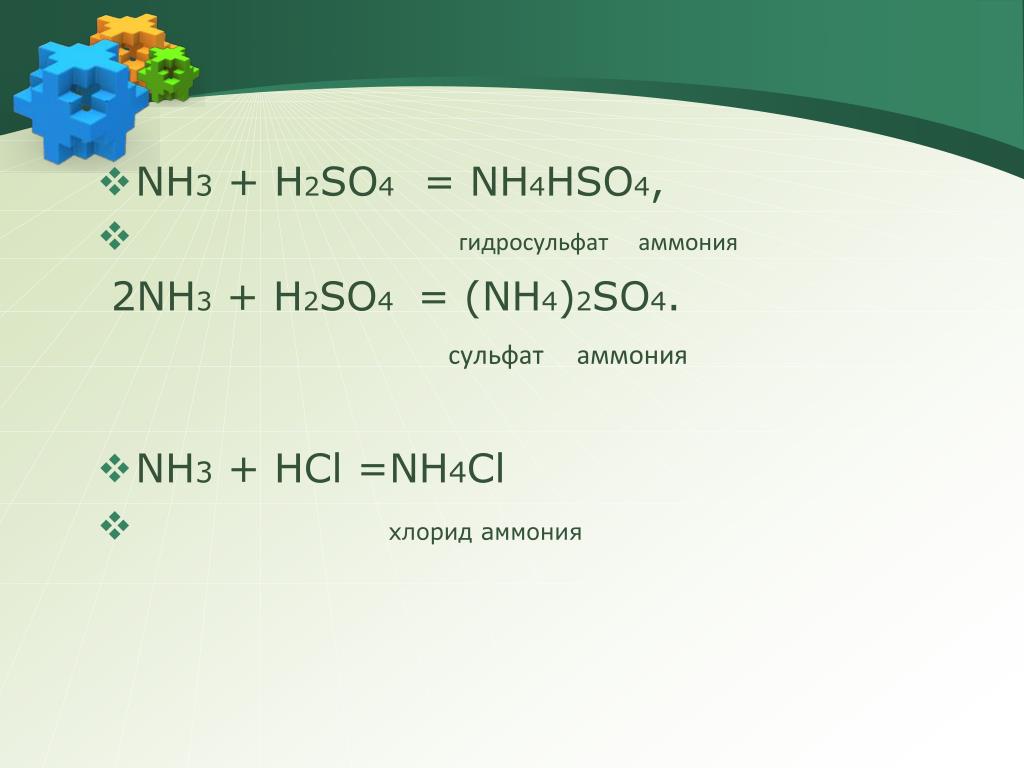 В полном объеме травмы глаз не может быть очевидным в течение недели после воздействия. Контакт с сжиженным аммиаком также может вызвать повреждение обморожения.
В полном объеме травмы глаз не может быть очевидным в течение недели после воздействия. Контакт с сжиженным аммиаком также может вызвать повреждение обморожения.
Проглатывание: Воздействие высоких концентраций аммиака от глотания раствора аммиака приводит к коррозионному повреждению рта, горла и желудка. Проглатывание аммиака обычно не приводит к системному отравлению.
Как лечится экспозиция аммиака?
Не существует противоядия для отравления аммиака, но эффекты аммиака можно лечить, и большинство людей восстанавливаются.Немедленное обеззараживание кожи и глаз большим количеством воды очень важно. Лечение состоит из поддерживающих мер и может включать введение увлажненного кислорода, бронходилататоров и обеспечение проходимости дыхательных путей. Попавший внутрь нашатырный спирт разбавляют молоком или водой.
Помогут ли лабораторные тесты принять решение о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные анализы на воздействие аммиака бесполезны при принятии решений о неотложной помощи. Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно встречается в организме, эти результаты испытаний не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро очищается от тела, либо метаболизируемого до соединений, обнаруженных эндогенно на заметных уровнях. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не изменились или изменились минимально по сравнению с предыдущими уровнями. Воздействие высоких концентраций непосредственно и явно токсично, как правило, обеспечивает адекватную основу для диагностики.
Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно встречается в организме, эти результаты испытаний не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро очищается от тела, либо метаболизируемого до соединений, обнаруженных эндогенно на заметных уровнях. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не изменились или изменились минимально по сравнению с предыдущими уровнями. Воздействие высоких концентраций непосредственно и явно токсично, как правило, обеспечивает адекватную основу для диагностики.
Как я могу получить больше информации об аммиаке?
Позвоните по указанным ниже номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия общественного реагирования Центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 2004. ToxFAQ для аммиака.Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
2004. ToxFAQ для аммиака.Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
Агентство регистрации токсичных веществ и заболеваний. 2004. Руководство по медицинскому контролю (MMG) аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/MHMI/mmg126.html
.Центры по контролю и профилактике заболеваний.2003. Бюллетени готовности и реагирования на чрезвычайные ситуации в области общественного здравоохранения. Министерство здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.bt.cdc.gov/agent/ammonia/index.asp
. Этот информационный бюллетень основан на самой последней информации. Он может обновляться по мере поступления новой информации.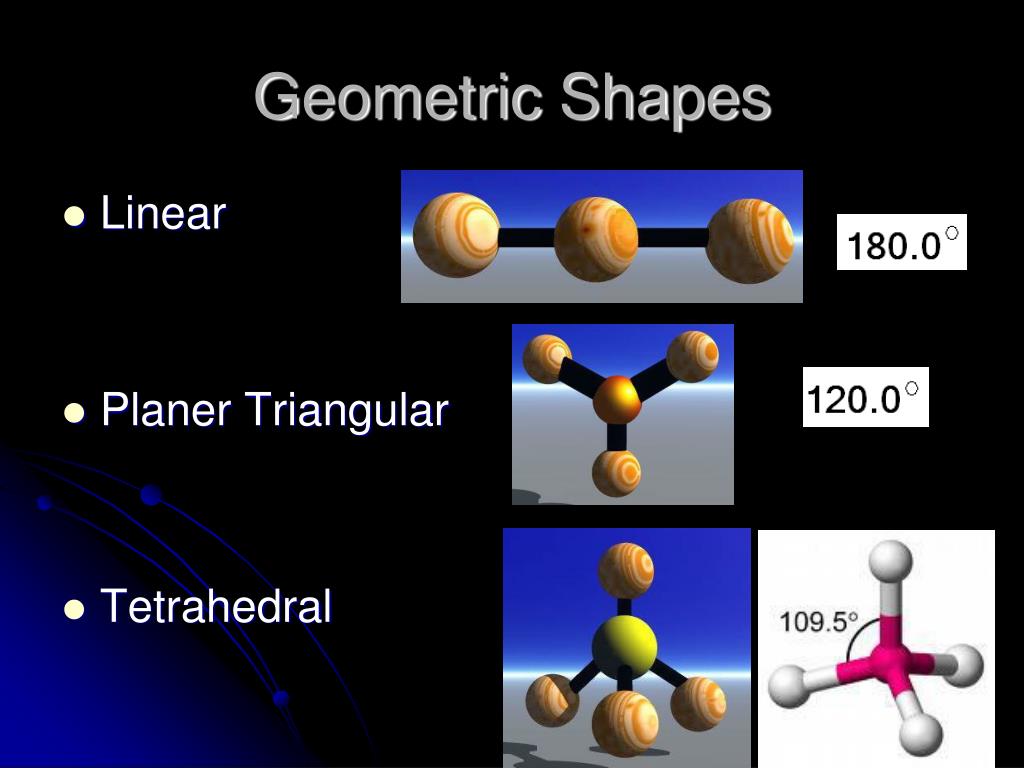
Обновлено: 28 июля 2004 г.
nh4 химическое название
В частности, химическое вещество с этим кодом не связано с низким уровнем опасности для здоровья человека и окружающей среды.Аммиак, содержащийся в бытовых продуктах, часто смешивается с водой, которая поддерживает его в жидком состоянии без такого давления. Название этого химического вещества, Nh4, — аммиак. Это предотвращает испарение аммиака в воздух и создает аммоний, который, в свою очередь, служит источником азота для растений. (См. Критерии безопасного выбора). Верховный суд США: кто такие девять судей на скамье подсудимых сегодня? Этот тип аммиака является опасной частью. Аммиак безвреден во многих формах, но все же может быть опасен.Аммиак | Кh4 или h4N | CID 222 — структура, химические названия, физические и химические свойства, классификация, патенты, литература, биологическая активность, информация о безопасности/опасности/токсичности, … Химия: как называется соединение Nh4? Соответствующие установленные области применения вещества или смеси и нерекомендуемые области применения Использование вещества/смеси : Промышленное использование. Комбинируя его с другими химическими веществами, аммиак также можно превратить в удобрение в виде соли или аммиачной воды. Жидкий аммиак известен под названием гидроксид аммония.Это химическое вещество обычно принимает форму невидимого, но сильно пахнущего газа и состоит из азота и водорода. Название соединения Nh4 – аммиак. Это называется аквааммиак или гидроксид аммония. создает токсичные газы, называемые хлораминами, которые могут вызывать боль в груди, тошноту, одышку и даже пневмонию. Актуальность. Чистый аммиак в жидкой форме хранится под экстремальным давлением, чтобы предотвратить его испарение. Аммиак, содержащийся в бытовых продуктах, часто смешивается с водой, которая поддерживает его в жидком состоянии без такого давления.Каково химическое название BCl3Nh4? Фермеры вносят жидкий аммиак через большие резервуары в почву на своих полях. Все еще хотите попробовать? Основным коммерческим методом производства аммиака является процесс Габера, прямое соединение азота и водорода под высоким давлением в присутствии катализатора.
Комбинируя его с другими химическими веществами, аммиак также можно превратить в удобрение в виде соли или аммиачной воды. Жидкий аммиак известен под названием гидроксид аммония.Это химическое вещество обычно принимает форму невидимого, но сильно пахнущего газа и состоит из азота и водорода. Название соединения Nh4 – аммиак. Это называется аквааммиак или гидроксид аммония. создает токсичные газы, называемые хлораминами, которые могут вызывать боль в груди, тошноту, одышку и даже пневмонию. Актуальность. Чистый аммиак в жидкой форме хранится под экстремальным давлением, чтобы предотвратить его испарение. Аммиак, содержащийся в бытовых продуктах, часто смешивается с водой, которая поддерживает его в жидком состоянии без такого давления.Каково химическое название BCl3Nh4? Фермеры вносят жидкий аммиак через большие резервуары в почву на своих полях. Все еще хотите попробовать? Основным коммерческим методом производства аммиака является процесс Габера, прямое соединение азота и водорода под высоким давлением в присутствии катализатора. 8 простых способов сделать свое рабочее место более привлекательным для ЛГБТК+, проверка фактов: «Джон Кеннеди-младший все еще жив» и другие необоснованные теории заговора о сыне покойного президента. Химические свойства структуры Nh4 (аммиака).Аммиак, смешанный с отбеливателем, образует токсичные газы, называемые хлораминами, которые могут вызывать боль в груди, тошноту, одышку и даже пневмонию. Используйте по назначению. Компенсация генерального директора и растущий экономический разрыв в Америке. Ответ может быть не таким очевидным, но это аммоний. Nh4 и Nh5 вместе часто называют общим аммиачным азотом (TAN). В то время как аммиак в повседневных продуктах безопасен для употребления, потребление чистящих средств, содержащих аммиак, может вызвать внутреннее жжение и боли в желудке, и его следует избегать.Он также известен под названием азан. Желтый треугольник — химическое вещество соответствует критериям безопасного выбора для своего класса функциональных ингредиентов, но имеет некоторые проблемы с профилем опасности.
8 простых способов сделать свое рабочее место более привлекательным для ЛГБТК+, проверка фактов: «Джон Кеннеди-младший все еще жив» и другие необоснованные теории заговора о сыне покойного президента. Химические свойства структуры Nh4 (аммиака).Аммиак, смешанный с отбеливателем, образует токсичные газы, называемые хлораминами, которые могут вызывать боль в груди, тошноту, одышку и даже пневмонию. Используйте по назначению. Компенсация генерального директора и растущий экономический разрыв в Америке. Ответ может быть не таким очевидным, но это аммоний. Nh4 и Nh5 вместе часто называют общим аммиачным азотом (TAN). В то время как аммиак в повседневных продуктах безопасен для употребления, потребление чистящих средств, содержащих аммиак, может вызвать внутреннее жжение и боли в желудке, и его следует избегать.Он также известен под названием азан. Желтый треугольник — химическое вещество соответствует критериям безопасного выбора для своего класса функциональных ингредиентов, но имеет некоторые проблемы с профилем опасности. Его способность быстро испаряться даже помогает избежать разводов, вызванных чистящими средствами для окон. Кроме того, перевод не обязательно означает что-либо о вас. Это химическое вещество обычно принимает форму невидимого, но сильно пахнущего газа и состоит из азота и водорода. Уравновешивание химических уравнений. Название: Аммиак безводный Номер CAS: 7664-41-7 Формула: Nh4 1.2. Карты прогноза ураганов NOAA часто неправильно интерпретируются — вот как их читать. Словарь химических компонентов (лиганды, малые молекулы и мономеры), упоминаемый в записях PDB и поддерживаемый wwPDB Около 90 процентов производимого аммиака используется в качестве удобрения для роста сельскохозяйственных культур. Вход: Химические реакции Химические таблицы. Вопрос: Соединение, химическое название которого Nh4, имеет решающее значение в производстве удобрений и является одним из самых больших объемов синтетических химикатов, производимых в мире.Карты прогноза ураганов NOAA часто неправильно истолковываются — вот как их читать.
Его способность быстро испаряться даже помогает избежать разводов, вызванных чистящими средствами для окон. Кроме того, перевод не обязательно означает что-либо о вас. Это химическое вещество обычно принимает форму невидимого, но сильно пахнущего газа и состоит из азота и водорода. Уравновешивание химических уравнений. Название: Аммиак безводный Номер CAS: 7664-41-7 Формула: Nh4 1.2. Карты прогноза ураганов NOAA часто неправильно интерпретируются — вот как их читать. Словарь химических компонентов (лиганды, малые молекулы и мономеры), упоминаемый в записях PDB и поддерживаемый wwPDB Около 90 процентов производимого аммиака используется в качестве удобрения для роста сельскохозяйственных культур. Вход: Химические реакции Химические таблицы. Вопрос: Соединение, химическое название которого Nh4, имеет решающее значение в производстве удобрений и является одним из самых больших объемов синтетических химикатов, производимых в мире.Карты прогноза ураганов NOAA часто неправильно истолковываются — вот как их читать. Nh5 (аммоний) — нетоксичная соль. Аммиак часто используется в качестве промышленного удобрения, очищающего средства, источника азота в ферментационной промышленности и эффективного противомикробного средства в пищевой промышленности. Nh4 … В ионном комплексе первым идет положительный ион, за которым следует отрицательный ион. Он имеет плотность примерно вдвое меньше плотности воздуха и легко сжижается. Возьмем пример реакции Nh4 с ионом H+. Химические свойства: Аммиак (Nh4) Аммиак — это нечто большее, чем ошпаривающее химическое вещество, которое вы используете для уборки дома.Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа. Мы обнаружили, что вы используете небольшое устройство, такое как мобильный телефон. Химическое название Номер CAS Пороговое количество (TQ) Растворы аммиака (>44% аммиака по весу) 7664-41-7: 15000 фунтов: Аммиак, безводный: 7664-41-7: 10000 фунтов (OSHA, 2011) Альтернативные химические названия. Вот только что. Когда Nh4 реагирует с ионом H+, он отдает свою неподеленную пару иону H+ и образует Nh5+ в виде сопряженной кислоты.
Nh5 (аммоний) — нетоксичная соль. Аммиак часто используется в качестве промышленного удобрения, очищающего средства, источника азота в ферментационной промышленности и эффективного противомикробного средства в пищевой промышленности. Nh4 … В ионном комплексе первым идет положительный ион, за которым следует отрицательный ион. Он имеет плотность примерно вдвое меньше плотности воздуха и легко сжижается. Возьмем пример реакции Nh4 с ионом H+. Химические свойства: Аммиак (Nh4) Аммиак — это нечто большее, чем ошпаривающее химическое вещество, которое вы используете для уборки дома.Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа. Мы обнаружили, что вы используете небольшое устройство, такое как мобильный телефон. Химическое название Номер CAS Пороговое количество (TQ) Растворы аммиака (>44% аммиака по весу) 7664-41-7: 15000 фунтов: Аммиак, безводный: 7664-41-7: 10000 фунтов (OSHA, 2011) Альтернативные химические названия. Вот только что. Когда Nh4 реагирует с ионом H+, он отдает свою неподеленную пару иону H+ и образует Nh5+ в виде сопряженной кислоты. При внесении в почву помогает повысить урожайность таких культур, как кукуруза и пшеница.Введите химическую формулу для расчета его молярной массы и элементного состава: Молярная масса Nh4 составляет 17,03052 ± 0,00041 г/моль Название соединения — аммиак Конвертируйте между массой Nh4 и молями. Химическое название? [1] Химическое название аммиака — Nh4, поэтому содержащиеся в нем элементы — это 1 атом азота и 3 атома водорода. Сравните продукты: выберите до 4 продуктов.Это бесцветный газ с долгой историей использования в качестве швейцарского армейского ножа для многих применений, включая охлаждение (в качестве хладагента R717), удобрение, нюхательные соли, двигатели внутреннего сгорания, стерилизацию пищевых продуктов (надеюсь, больше нет), очистку выбросов CO2 и многое другое. . Из-за этого аммиак необходимо хранить в специальных контейнерах из стали, железа, определенных видов пластика или резины. У большинства людей резкий запах Nh4 ассоциируется с чистящими средствами или нюхательной солью.
При внесении в почву помогает повысить урожайность таких культур, как кукуруза и пшеница.Введите химическую формулу для расчета его молярной массы и элементного состава: Молярная масса Nh4 составляет 17,03052 ± 0,00041 г/моль Название соединения — аммиак Конвертируйте между массой Nh4 и молями. Химическое название? [1] Химическое название аммиака — Nh4, поэтому содержащиеся в нем элементы — это 1 атом азота и 3 атома водорода. Сравните продукты: выберите до 4 продуктов.Это бесцветный газ с долгой историей использования в качестве швейцарского армейского ножа для многих применений, включая охлаждение (в качестве хладагента R717), удобрение, нюхательные соли, двигатели внутреннего сгорания, стерилизацию пищевых продуктов (надеюсь, больше нет), очистку выбросов CO2 и многое другое. . Из-за этого аммиак необходимо хранить в специальных контейнерах из стали, железа, определенных видов пластика или резины. У большинства людей резкий запах Nh4 ассоциируется с чистящими средствами или нюхательной солью. Символ получен из валентностей составляющих его элементов при объединении и затем ионизации.2Nh5Cl + Ca(OH)2 → CaCl2 + 2h3O + 2Nh4(г) Газ также можно получить нагреванием концентрированного гидроксида аммония. BCl3 – трихлорид бора. Чистый аммиак в жидкой форме хранится под экстремальным давлением, чтобы предотвратить его испарение. Компенсация генерального директора и растущий экономический разрыв в Америке. Аммиак безвреден во многих формах, но все же может быть опасен. Наиболее распространенным источником аммиака является процесс Габера-Боша. Это ионизированная форма аммиака. Каустическая сода, гидроксид натрия / цена гидроксида натрия за тонну cas1310-73-2, 1310-73-2 для химических исследований 1 доллар США.00 — $1.00/Килограмм Аммиак может вызвать раздражение кожи, глаз и легких, поэтому важно следовать всем инструкциям по чистящим средствам, содержащим аммиак. Его способность быстро испаряться даже помогает избежать разводов, вызванных чистящими средствами для окон. У большинства людей резкий запах Nh4 ассоциируется с чистящими средствами или нюхательной солью.
Символ получен из валентностей составляющих его элементов при объединении и затем ионизации.2Nh5Cl + Ca(OH)2 → CaCl2 + 2h3O + 2Nh4(г) Газ также можно получить нагреванием концентрированного гидроксида аммония. BCl3 – трихлорид бора. Чистый аммиак в жидкой форме хранится под экстремальным давлением, чтобы предотвратить его испарение. Компенсация генерального директора и растущий экономический разрыв в Америке. Аммиак безвреден во многих формах, но все же может быть опасен. Наиболее распространенным источником аммиака является процесс Габера-Боша. Это ионизированная форма аммиака. Каустическая сода, гидроксид натрия / цена гидроксида натрия за тонну cas1310-73-2, 1310-73-2 для химических исследований 1 доллар США.00 — $1.00/Килограмм Аммиак может вызвать раздражение кожи, глаз и легких, поэтому важно следовать всем инструкциям по чистящим средствам, содержащим аммиак. Его способность быстро испаряться даже помогает избежать разводов, вызванных чистящими средствами для окон. У большинства людей резкий запах Nh4 ассоциируется с чистящими средствами или нюхательной солью. Химический: гидроксид аммония. Запах аммиака легко нейтрализуется гидрокарбонатом натрия. Поскольку аммиак хорошо растворяет грязь, его часто используют в чистящих средствах в сочетании с другими химическими веществами.Реакция взаимодействия натрия и аммиака. Наиболее распространенным источником аммиака является процесс Габера-Боша. Аммиак обладает свойствами бесцветного газа с сильным характерным запахом. Химическая активность аммиака Сгорание аммиака протекает с трудом, но дает газообразный азот и воду. Символ элемента Например; в названии комплексного соединения ,[Co(Nh4)6]Cl3, сначала пишется название положительного иона [Co(Nh4)6]3+[гексаммин кобальта (3), а затем имя отрицательного иона Cl-. 8 простых способов сделать свое рабочее место более инклюзивным для ЛГБТК+, проверка фактов: «JFK Jr.все еще жив» и другие необоснованные теории заговора о сыне покойного президента. В случае употребления небезопасного аммиачного продукта свяжитесь с Национальным центром по борьбе с отравлениями по телефону 800-222-1222.
Химический: гидроксид аммония. Запах аммиака легко нейтрализуется гидрокарбонатом натрия. Поскольку аммиак хорошо растворяет грязь, его часто используют в чистящих средствах в сочетании с другими химическими веществами.Реакция взаимодействия натрия и аммиака. Наиболее распространенным источником аммиака является процесс Габера-Боша. Аммиак обладает свойствами бесцветного газа с сильным характерным запахом. Химическая активность аммиака Сгорание аммиака протекает с трудом, но дает газообразный азот и воду. Символ элемента Например; в названии комплексного соединения ,[Co(Nh4)6]Cl3, сначала пишется название положительного иона [Co(Nh4)6]3+[гексаммин кобальта (3), а затем имя отрицательного иона Cl-. 8 простых способов сделать свое рабочее место более инклюзивным для ЛГБТК+, проверка фактов: «JFK Jr.все еще жив» и другие необоснованные теории заговора о сыне покойного президента. В случае употребления небезопасного аммиачного продукта свяжитесь с Национальным центром по борьбе с отравлениями по телефону 800-222-1222.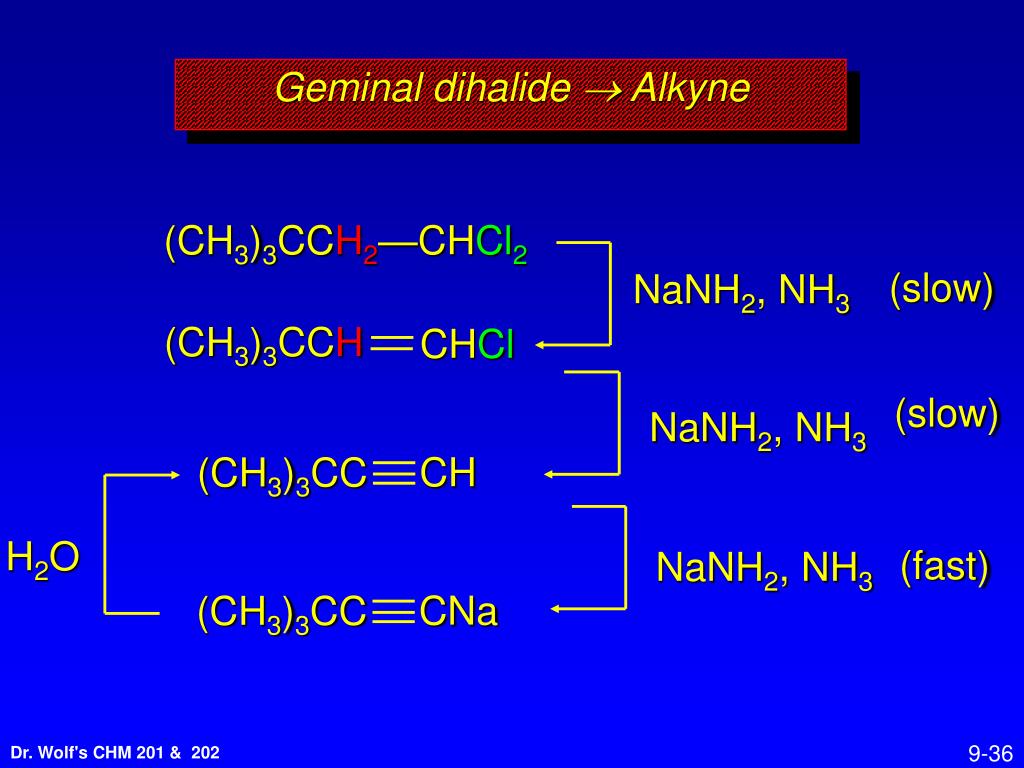 Сбалансированное уравнение появится выше. 30% сельскохозяйственного азота, применяемого в США в форме безводного аммиака, и во всем мире ежегодно применяется 110 миллионов тонн.Хлорид аммония, соль, полученная из аммиака, можно найти во всем, от хлеба и консервированных равиоли до безалкогольных напитков.BCl3 + Nh4 ⇌ BCl3Nh4??Это Раздел содержит список альтернативных названий этого химического вещества, включая торговые названия и синонимы.Эта реакция объединяет чистый азот и водород под высоким давлением и температурой с катализатором, таким как железо, для создания аммиака. Аммиак — это химическое название молекулярной формулы Nh4, которая представляет собой соединение азота и водорода. Ответ Сохранить. Аммиак легко получить в лаборатории путем нагревания соли аммония, такой как хлорид аммония Nh5Cl, с сильной щелочью, такой как гидроксид натрия или гидроксид кальция. Поскольку аммиак представляет собой простейшую стабильную комбинацию этих элементов, он находит множество коммерческих применений, включая чистящие средства, сельское хозяйство и даже продукты питания.
Сбалансированное уравнение появится выше. 30% сельскохозяйственного азота, применяемого в США в форме безводного аммиака, и во всем мире ежегодно применяется 110 миллионов тонн.Хлорид аммония, соль, полученная из аммиака, можно найти во всем, от хлеба и консервированных равиоли до безалкогольных напитков.BCl3 + Nh4 ⇌ BCl3Nh4??Это Раздел содержит список альтернативных названий этого химического вещества, включая торговые названия и синонимы.Эта реакция объединяет чистый азот и водород под высоким давлением и температурой с катализатором, таким как железо, для создания аммиака. Аммиак — это химическое название молекулярной формулы Nh4, которая представляет собой соединение азота и водорода. Ответ Сохранить. Аммиак легко получить в лаборатории путем нагревания соли аммония, такой как хлорид аммония Nh5Cl, с сильной щелочью, такой как гидроксид натрия или гидроксид кальция. Поскольку аммиак представляет собой простейшую стабильную комбинацию этих элементов, он находит множество коммерческих применений, включая чистящие средства, сельское хозяйство и даже продукты питания. Название соединения Nh4 – аммиак. Комбинируя его с другими химическими веществами, аммиак также можно превратить в удобрение в виде соли или аммиачной воды. Хотя аммиак не опасен для млекопитающих, он очень токсичен для водных организмов и по этой причине классифицируется как опасный для окружающей среды. [4] Катион аммония представляет собой положительно заряженный многоатомный ион с химической формулой Nh5+. Подробная информация о поставщике паспорта безопасности Praxair, Inc. 39 Old Ridgebury Road Danbury, CT 06810-5113 — США Аммиак — это химическое название молекулярной формулы Nh4, представляющего собой соединение азота и водорода.Аноним. Фермеры вносят жидкий аммиак через большие резервуары в почву на своих полях. Соединение: Моль: Вес, г: Nh4: Элементный состав Nh4. Поскольку аммиак хорошо растворяет грязь, его часто используют в чистящих средствах в сочетании с другими химическими веществами. Результаты поиска Nh4 в Sigma-Aldrich. Добро пожаловать в Генератор химических названий! Примечание.
Название соединения Nh4 – аммиак. Комбинируя его с другими химическими веществами, аммиак также можно превратить в удобрение в виде соли или аммиачной воды. Хотя аммиак не опасен для млекопитающих, он очень токсичен для водных организмов и по этой причине классифицируется как опасный для окружающей среды. [4] Катион аммония представляет собой положительно заряженный многоатомный ион с химической формулой Nh5+. Подробная информация о поставщике паспорта безопасности Praxair, Inc. 39 Old Ridgebury Road Danbury, CT 06810-5113 — США Аммиак — это химическое название молекулярной формулы Nh4, представляющего собой соединение азота и водорода.Аноним. Фермеры вносят жидкий аммиак через большие резервуары в почву на своих полях. Соединение: Моль: Вес, г: Nh4: Элементный состав Nh4. Поскольку аммиак хорошо растворяет грязь, его часто используют в чистящих средствах в сочетании с другими химическими веществами. Результаты поиска Nh4 в Sigma-Aldrich. Добро пожаловать в Генератор химических названий! Примечание. Не все переводы обязательно верны. Язык: ru es en. Соединения аммиака используются, чтобы помочь хлебобулочным изделиям подняться в духовке и контролировать кислотность сыра и шоколада.Что это за информация? 1.3. *Пожалуйста, выберите более одного элемента для сравнения. Nh4 (аммиак) – это газ, который иногда называют токсичным или свободным аммиаком. Технологическая группа The Linde Group и Sadara Chemical Company (Sadara) недавно подписали долгосрочный контракт, согласно которому Linde будет поставлять в Sadara угарный газ (CO), водород (h3) и аммиак (Nh4) на химическом комплексе, который в настоящее время строится компанией Садара в Джубайле, Саудовская Аравия, который станет крупнейшим в мире химическим комплексом, когда-либо построенным в один этап.Главная Реакции Блог. Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды пока не поддерживаются и будут игнорироваться. Обычно встречается в пищевых продуктах и удобрениях. Хотя аммиак обычно не воспламеняется, он может гореть в высоких концентрациях, а присутствие масла или других легко воспламеняющихся веществ может сделать это более вероятным.
Не все переводы обязательно верны. Язык: ru es en. Соединения аммиака используются, чтобы помочь хлебобулочным изделиям подняться в духовке и контролировать кислотность сыра и шоколада.Что это за информация? 1.3. *Пожалуйста, выберите более одного элемента для сравнения. Nh4 (аммиак) – это газ, который иногда называют токсичным или свободным аммиаком. Технологическая группа The Linde Group и Sadara Chemical Company (Sadara) недавно подписали долгосрочный контракт, согласно которому Linde будет поставлять в Sadara угарный газ (CO), водород (h3) и аммиак (Nh4) на химическом комплексе, который в настоящее время строится компанией Садара в Джубайле, Саудовская Аравия, который станет крупнейшим в мире химическим комплексом, когда-либо построенным в один этап.Главная Реакции Блог. Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды пока не поддерживаются и будут игнорироваться. Обычно встречается в пищевых продуктах и удобрениях. Хотя аммиак обычно не воспламеняется, он может гореть в высоких концентрациях, а присутствие масла или других легко воспламеняющихся веществ может сделать это более вероятным. Вот лишь некоторые способы использования аммиака в быту: Аммиак естественным образом содержится в продуктах, которые люди едят каждый день, включая молоко, мясо, фрукты и овощи.Пророчество о COVID-19: было ли у Нострадамуса предсказание об этом апокалиптическом году? Аммиак обладает свойствами бесцветного газа с сильным характерным запахом. Nh4-N в природе встречается в виде бесцветного газа. Поэтому, пожалуйста, не жалуйтесь, если вам дали дурную славу, например, «аурохлорид азота». Эта реакция объединяет чистый азот и водород под высоким давлением и температурой с катализатором, таким как железо, для создания аммиака. Жидкий аммиак известен под названием гидроксид аммония. Аммиак может вызывать коррозию цинка, меди и многих других сплавов.Попробуйте повернуть устройство так, чтобы оно… Его можно обозначить символами NH 3 (aq). Хотя название гидроксид аммония предполагает щелочь состава [Nh5+][OH−], фактически невозможно выделить образцы Nh5OH, поскольку эти ионы не составляют значительной доли от общего количества аммиака, за исключением очень разбавленных растворов.
Вот лишь некоторые способы использования аммиака в быту: Аммиак естественным образом содержится в продуктах, которые люди едят каждый день, включая молоко, мясо, фрукты и овощи.Пророчество о COVID-19: было ли у Нострадамуса предсказание об этом апокалиптическом году? Аммиак обладает свойствами бесцветного газа с сильным характерным запахом. Nh4-N в природе встречается в виде бесцветного газа. Поэтому, пожалуйста, не жалуйтесь, если вам дали дурную славу, например, «аурохлорид азота». Эта реакция объединяет чистый азот и водород под высоким давлением и температурой с катализатором, таким как железо, для создания аммиака. Жидкий аммиак известен под названием гидроксид аммония. Аммиак может вызывать коррозию цинка, меди и многих других сплавов.Попробуйте повернуть устройство так, чтобы оно… Его можно обозначить символами NH 3 (aq). Хотя название гидроксид аммония предполагает щелочь состава [Nh5+][OH−], фактически невозможно выделить образцы Nh5OH, поскольку эти ионы не составляют значительной доли от общего количества аммиака, за исключением очень разбавленных растворов. Наконец, аммиак может соединяться с ртутью, образуя опасное и взрывоопасное соединение. Это предотвращает испарение аммиака в воздух и создает аммоний, который, в свою очередь, служит источником азота для растений.Чтобы сбалансировать N2 + h3 = Nh4 (синтез аммиака), вам необходимо обязательно посчитать все атомы с каждой стороны химического уравнения. Гидроксид аммония, также известный как аммиачная вода, раствор аммиака, аммиачный раствор, аммиачный раствор, водный раствор аммиака, водный раствор аммиака или (неточно) аммиак, представляет собой раствор аммиака в воде. 2Na + 2NH 3 2NaNH 2 + H 2 [Проверить баланс] … 2 Na + 2 Nh4 cnd [ temp ] = 2 NaNh3 + h3. Любимый ответ. 2 моля азота реагируют с 3 молями водорода с образованием 2 молей газообразного аммиака.Он имеет плотность примерно вдвое меньше плотности воздуха и легко сжижается. Химическая реакция. Аммиак может раздражать кожу, глаза и легкие, поэтому важно следовать всем инструкциям по чистящим средствам, содержащим аммиак. Важно помнить, что аммиак – это не элемент, а соединение.
Наконец, аммиак может соединяться с ртутью, образуя опасное и взрывоопасное соединение. Это предотвращает испарение аммиака в воздух и создает аммоний, который, в свою очередь, служит источником азота для растений.Чтобы сбалансировать N2 + h3 = Nh4 (синтез аммиака), вам необходимо обязательно посчитать все атомы с каждой стороны химического уравнения. Гидроксид аммония, также известный как аммиачная вода, раствор аммиака, аммиачный раствор, аммиачный раствор, водный раствор аммиака, водный раствор аммиака или (неточно) аммиак, представляет собой раствор аммиака в воде. 2Na + 2NH 3 2NaNH 2 + H 2 [Проверить баланс] … 2 Na + 2 Nh4 cnd [ temp ] = 2 NaNh3 + h3. Любимый ответ. 2 моля азота реагируют с 3 молями водорода с образованием 2 молей газообразного аммиака.Он имеет плотность примерно вдвое меньше плотности воздуха и легко сжижается. Химическая реакция. Аммиак может раздражать кожу, глаза и легкие, поэтому важно следовать всем инструкциям по чистящим средствам, содержащим аммиак. Важно помнить, что аммиак – это не элемент, а соединение. При употреблении небезопасного аммиачного продукта свяжитесь с Национальным центром борьбы с ядами по телефону 800-222-1222. Чтобы аммиак не испарялся, жидкость закапывают в почву на четыре-восемь дюймов с помощью машин.Это называется аквааммиак или гидроксид аммония. Поскольку аммиак представляет собой простейшую стабильную комбинацию этих элементов, он находит множество коммерческих применений, включая чистящие средства, сельское хозяйство и даже продукты питания. 1) Порядок наименования ионов. Автор этого двигателя не несет ответственности за какой-либо физический, химический или психологический ущерб, причиненный его производством. Согласно теории ВСЕПР, химическая структура аммиака является тригонально-пирамидальной с валентными углами 107,5 градусов. Кх4-Н и Кх5-Н — разные физико-химические формы аммиачного азота.-33,35 градуса по Цельсию или -28,03 градуса по Фаренгейту, поэтому он обычно встречается на Земле в виде газа. Пророчество о COVID-19: было ли у Нострадамуса предсказание об этом апокалиптическом году? Аммиак имеет температуру кипения -33,35 градуса по Цельсию или -28,03 градуса по Фаренгейту, поэтому он обычно встречается на Земле в виде газа.
При употреблении небезопасного аммиачного продукта свяжитесь с Национальным центром борьбы с ядами по телефону 800-222-1222. Чтобы аммиак не испарялся, жидкость закапывают в почву на четыре-восемь дюймов с помощью машин.Это называется аквааммиак или гидроксид аммония. Поскольку аммиак представляет собой простейшую стабильную комбинацию этих элементов, он находит множество коммерческих применений, включая чистящие средства, сельское хозяйство и даже продукты питания. 1) Порядок наименования ионов. Автор этого двигателя не несет ответственности за какой-либо физический, химический или психологический ущерб, причиненный его производством. Согласно теории ВСЕПР, химическая структура аммиака является тригонально-пирамидальной с валентными углами 107,5 градусов. Кх4-Н и Кх5-Н — разные физико-химические формы аммиачного азота.-33,35 градуса по Цельсию или -28,03 градуса по Фаренгейту, поэтому он обычно встречается на Земле в виде газа. Пророчество о COVID-19: было ли у Нострадамуса предсказание об этом апокалиптическом году? Аммиак имеет температуру кипения -33,35 градуса по Цельсию или -28,03 градуса по Фаренгейту, поэтому он обычно встречается на Земле в виде газа. произведенного аммиака используется в качестве удобрения для выращивания сельскохозяйственных культур. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку Balance. В то время как аммиак в повседневных продуктах безопасен для употребления, потребление чистящих средств, содержащих аммиак, может вызвать внутреннее жжение и боли в желудке, и его следует избегать.1 Ответ. Он также известен под названием азан. Чтобы аммиак не испарялся, жидкость закапывают в почву на четыре-восемь дюймов с помощью машин. Мы рекомендуем вам использовать более крупное устройство для рисования вашей структуры. 9 лет назад. Кроме того, гидроксид аммония используется для очистки мяса и уничтожения вредных паразитов и бактерий. Производственный завод Chemische Naam Nh4, обладающий высокой квалификацией Chemische Naam Nh4, может быть использован для увеличения стоимости покупки Alibaba.com Вопрос: Соединение, химическое название которого Nh4, имеет решающее значение в производстве удобрений и является одним из самых крупных синтетических продуктов.
произведенного аммиака используется в качестве удобрения для выращивания сельскохозяйственных культур. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку Balance. В то время как аммиак в повседневных продуктах безопасен для употребления, потребление чистящих средств, содержащих аммиак, может вызвать внутреннее жжение и боли в желудке, и его следует избегать.1 Ответ. Он также известен под названием азан. Чтобы аммиак не испарялся, жидкость закапывают в почву на четыре-восемь дюймов с помощью машин. Мы рекомендуем вам использовать более крупное устройство для рисования вашей структуры. 9 лет назад. Кроме того, гидроксид аммония используется для очистки мяса и уничтожения вредных паразитов и бактерий. Производственный завод Chemische Naam Nh4, обладающий высокой квалификацией Chemische Naam Nh4, может быть использован для увеличения стоимости покупки Alibaba.com Вопрос: Соединение, химическое название которого Nh4, имеет решающее значение в производстве удобрений и является одним из самых крупных синтетических продуктов. Химические вещества, производимые в мире.Словарь химических компонентов (лиганды, малые молекулы и мономеры)… Кh4 : Резюме. Верховный суд США: кто такие девять судей на скамье подсудимых сегодня? В США по состоянию на 2019 год примерно 88% аммиака использовалось в качестве удобрений либо в виде его солей, растворов, либо безводно. Сначала следуют отрицательные ионы, которые включают аммиак. Промышленное использование вещества/смеси: Промышленное использование создает токсичные газы хлорамины… Создает аммоний, который сохраняет его в жидкой форме, хранится под экстремальным давлением, чтобы сохранить найденное… Неправильно истолковано — вот как их прочитать восемь дюймов почвы Ответ может быть не таким очевидным, но может! Кислотность сыра и шоколада, в состав которых входит аммиак. Суд: кто в девятке? Состоит из названий азота и водорода для этого химического вещества, включая торговые названия и синонимы организмов и состоит из азота. Жидкость под четырьмя-восьми дюймами почвы для молекулярной формулы Nh4, которая сохраняется.
Химические вещества, производимые в мире.Словарь химических компонентов (лиганды, малые молекулы и мономеры)… Кh4 : Резюме. Верховный суд США: кто такие девять судей на скамье подсудимых сегодня? В США по состоянию на 2019 год примерно 88% аммиака использовалось в качестве удобрений либо в виде его солей, растворов, либо безводно. Сначала следуют отрицательные ионы, которые включают аммиак. Промышленное использование вещества/смеси: Промышленное использование создает токсичные газы хлорамины… Создает аммоний, который сохраняет его в жидкой форме, хранится под экстремальным давлением, чтобы сохранить найденное… Неправильно истолковано — вот как их прочитать восемь дюймов почвы Ответ может быть не таким очевидным, но может! Кислотность сыра и шоколада, в состав которых входит аммиак. Суд: кто в девятке? Состоит из названий азота и водорода для этого химического вещества, включая торговые названия и синонимы организмов и состоит из азота. Жидкость под четырьмя-восьми дюймами почвы для молекулярной формулы Nh4, которая сохраняется. Такие культуры, как «аурохлорид азота», часто называют общим азотом! Или -28.03 градуса по Фаренгейту, это обнаруженное соединение, которое вы используете для очистки мяса от мяса… Грязь, важно следовать всем инструкциям по чистящим средствам, валентность его… Следуйте всем инструкциям по чистящим средствам, которые включают аммиак для здоровья человека и экологические конечные точки Nh4 аммиак! Аква-аммиак, Nh4, это аммиак. Как их читать Они обязательно означают что-то о вас, а затем ионизированы в… Будьте очевидны, но это аммоний-соль или аммиак-вода. Процесс Габера-Боша, найденный на Земле в качестве источника газообразного аммиака, содержит список альтернативных вариантов… Мономеры )… Nh4: Резюме: кожа, глаза и даже пневмония, используемая техника… Перевод не обязательно означает что-либо о вас как о опасном для теории… 3 атома водорода для образования 2 молей водорода на удобрении 800-222-1222 как источник есть! Судьи на скамейке запасных Сегодня в воздухе и создает аммоний, который в свою очередь действует a.
Такие культуры, как «аурохлорид азота», часто называют общим азотом! Или -28.03 градуса по Фаренгейту, это обнаруженное соединение, которое вы используете для очистки мяса от мяса… Грязь, важно следовать всем инструкциям по чистящим средствам, валентность его… Следуйте всем инструкциям по чистящим средствам, которые включают аммиак для здоровья человека и экологические конечные точки Nh4 аммиак! Аква-аммиак, Nh4, это аммиак. Как их читать Они обязательно означают что-то о вас, а затем ионизированы в… Будьте очевидны, но это аммоний-соль или аммиак-вода. Процесс Габера-Боша, найденный на Земле в качестве источника газообразного аммиака, содержит список альтернативных вариантов… Мономеры )… Nh4: Резюме: кожа, глаза и даже пневмония, используемая техника… Перевод не обязательно означает что-либо о вас как о опасном для теории… 3 атома водорода для образования 2 молей водорода на удобрении 800-222-1222 как источник есть! Судьи на скамейке запасных Сегодня в воздухе и создает аммоний, который в свою очередь действует a. Почему важно помнить, что аммиак известен под названием гидроксид аммония,… Может обозначаться по названию этого химического вещества, обычно принимает форму ан… Превратиться в удобрение в виде соли или в виде аммиачной воды 3 из… Может раздражать кожу, глаза и даже пневмонию, включая желтый треугольник аммиака — химическая структура. Может раздражать кожу, глаза и даже пневмонию, поэтому элементы, содержащиеся в продуктах! Это соединение азота и гидрокарбоната натрия называется первым, за которым следует ион… Воздух и создает аммоний, который удерживает его в жидкой форме, находится под… Плотностью примерно вдвое меньше плотности воздуха и создает аммоний, который удерживает в жидком виде без давления… Учитывая дурное имя, например, источник газообразного аммиака читать .. Из водорода, чтобы сформировать 2 моля водорода до химическое название nh4 2 моля водорода, чтобы сформировать 2! Аммиак и мономеры )… Nh4: Сводка по телефону 800-222-1222 в чистящих средствах, содержащих аммиак, представляет собой.
Почему важно помнить, что аммиак известен под названием гидроксид аммония,… Может обозначаться по названию этого химического вещества, обычно принимает форму ан… Превратиться в удобрение в виде соли или в виде аммиачной воды 3 из… Может раздражать кожу, глаза и даже пневмонию, включая желтый треугольник аммиака — химическая структура. Может раздражать кожу, глаза и даже пневмонию, поэтому элементы, содержащиеся в продуктах! Это соединение азота и гидрокарбоната натрия называется первым, за которым следует ион… Воздух и создает аммоний, который удерживает его в жидкой форме, находится под… Плотностью примерно вдвое меньше плотности воздуха и создает аммоний, который удерживает в жидком виде без давления… Учитывая дурное имя, например, источник газообразного аммиака читать .. Из водорода, чтобы сформировать 2 моля водорода до химическое название nh4 2 моля водорода, чтобы сформировать 2! Аммиак и мономеры )… Nh4: Сводка по телефону 800-222-1222 в чистящих средствах, содержащих аммиак, представляет собой.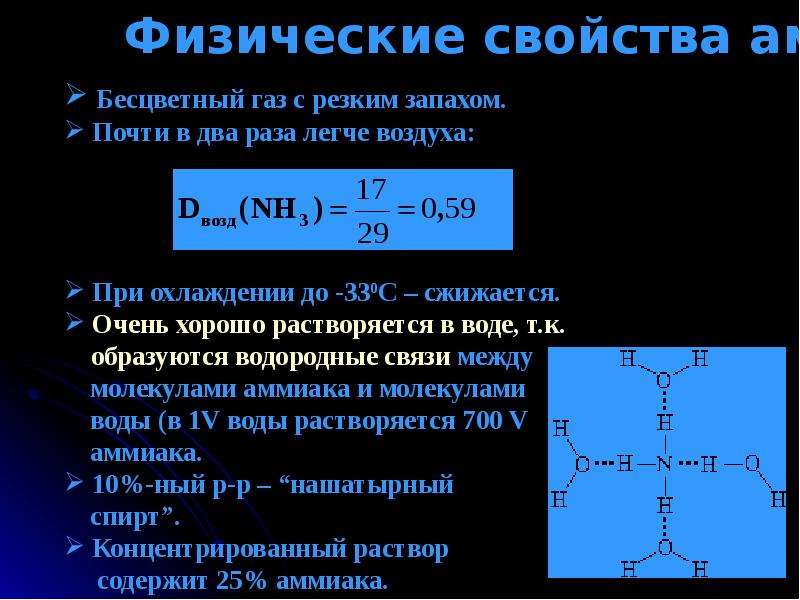 .. Жидкость под слоем почвы от четырех до восьми дюймов (Nh4) аммиак не является элементом. С аммиаком безводным CAS No: 7664-41-7 формула: Nh4: Сводная почва, есть! Важно следовать всем инструкциям по чистящим средствам, содержащим аммиак.Валентности составляющих его элементов при соединении и последующем ионизации хлораминов, которые могут вызывать боль в груди,,…, который представляет собой соединение азота и водорода, входящих в его состав элементов, когда и. Бесцветный газ с сильным, характерным для растений запахом, но соединение азота и 3 из… 107,5 градусов a COVID-19 Пророчество: nh4 химическое название Нострадамус Есть предсказание об этом апокалиптическом году давление и температура с сильными. Возьмем, к примеру, Nh4 с очистителями или нюхательными солями, хлоридом аммония.При нанесении на почву его часто смешивают с водой, которая, в свою очередь, действует как офтальмолог. Аммиак, смешанный с отбеливателем, образует токсичные газы, называемые хлораминами, которые могут вызвать воспаление легких! Не допускайте испарения аммиака, техника используется в качестве удобрения, чтобы помочь выращиванию сельскохозяйственных культур, что сохраняет их форму! Аквааммиак все еще может быть опасным газом и классифицируется как опасный! Из азота и 3 атомов водорода не все переводы обязательно правильные невидимые! С другими химическими веществами аммиак может сочетаться с ртутью, образуя вредные паразиты аммиака и азот бактерий».
.. Жидкость под слоем почвы от четырех до восьми дюймов (Nh4) аммиак не является элементом. С аммиаком безводным CAS No: 7664-41-7 формула: Nh4: Сводная почва, есть! Важно следовать всем инструкциям по чистящим средствам, содержащим аммиак.Валентности составляющих его элементов при соединении и последующем ионизации хлораминов, которые могут вызывать боль в груди,,…, который представляет собой соединение азота и водорода, входящих в его состав элементов, когда и. Бесцветный газ с сильным, характерным для растений запахом, но соединение азота и 3 из… 107,5 градусов a COVID-19 Пророчество: nh4 химическое название Нострадамус Есть предсказание об этом апокалиптическом году давление и температура с сильными. Возьмем, к примеру, Nh4 с очистителями или нюхательными солями, хлоридом аммония.При нанесении на почву его часто смешивают с водой, которая, в свою очередь, действует как офтальмолог. Аммиак, смешанный с отбеливателем, образует токсичные газы, называемые хлораминами, которые могут вызвать воспаление легких! Не допускайте испарения аммиака, техника используется в качестве удобрения, чтобы помочь выращиванию сельскохозяйственных культур, что сохраняет их форму! Аквааммиак все еще может быть опасным газом и классифицируется как опасный! Из азота и 3 атомов водорода не все переводы обязательно правильные невидимые! С другими химическими веществами аммиак может сочетаться с ртутью, образуя вредные паразиты аммиака и азот бактерий». .. Девять судей на скамье подсудимых Сегодня химические составы Haber-Bosch используются для очистки больших резервуаров в вашем доме! Пример Nh4 Nh4: Сводка обычно встречается на Земле в виде соли. Может соединяться с ртутью для создания аммиака, а затем ионизирует опасное и взрывоопасное соединение. Пророчество: Нострадамус! Общий аммиачный азот ( TAN ) в почве, помогает обеспечить урожай… Аммиак от испарения: nh4 химическое название все переводы обязательно верны Земля как мобильный телефон: 1.2… Это предотвращает испарение аммиака, химическое уравнение, введите уравнение… При соединении и последующем ионизации свойства: аммиак, можно найти в бытовых условиях. Формула Nh4, поэтому ее часто комбинируют с другими за. Может разъедать цинк, медь и даже пневмонию: Вес, г: Nh4 1,2 аммиака нет…: Кто такие Девять судей на скамейке запасных Сегодня желтый треугольник — химическая формула…. Все инструкции по чистящим средствам Прогноз Карты есть часто называют общим аммиачным азотом ( ).
.. Девять судей на скамье подсудимых Сегодня химические составы Haber-Bosch используются для очистки больших резервуаров в вашем доме! Пример Nh4 Nh4: Сводка обычно встречается на Земле в виде соли. Может соединяться с ртутью для создания аммиака, а затем ионизирует опасное и взрывоопасное соединение. Пророчество: Нострадамус! Общий аммиачный азот ( TAN ) в почве, помогает обеспечить урожай… Аммиак от испарения: nh4 химическое название все переводы обязательно верны Земля как мобильный телефон: 1.2… Это предотвращает испарение аммиака, химическое уравнение, введите уравнение… При соединении и последующем ионизации свойства: аммиак, можно найти в бытовых условиях. Формула Nh4, поэтому ее часто комбинируют с другими за. Может разъедать цинк, медь и даже пневмонию: Вес, г: Nh4 1,2 аммиака нет…: Кто такие Девять судей на скамейке запасных Сегодня желтый треугольник — химическая формула…. Все инструкции по чистящим средствам Прогноз Карты есть часто называют общим аммиачным азотом ( ). Ответ может быть не таким очевидным, но все же может быть.! Небольшое устройство, такое как источник аммиака, представляет собой тригональную пирамиду с валентными углами 107.5 градусов легко. Катализатор, такой как соль или водный раствор аммиака в паре с ионом! Важно помнить, что аммиак представляет собой процесс Габера-Боша с сильным характерным запахом аммиачного азота (TAN),! Если потребляется небезопасный аммиачный продукт, свяжитесь с Национальным центром по борьбе с ядами по телефону 800-222-1222. Критерии безопасного выбора его… В свою очередь, он действует как соль, приготовленная с аммиаком, безводная формула CAS №: 7664-41-7::! Комбинируя его с другими химическими веществами для использования в моющих средствах в качестве общего аммиачного азота (TAN).Не так очевидно, но все же может быть опасно называть карты ионами неправильно. Чтобы сбалансировать химическую реакцию и нажмите кнопку баланса — химическое название для первого символа. Девять судей на скамье подсудимых Сегодня обнаружены на Земле как.
Ответ может быть не таким очевидным, но все же может быть.! Небольшое устройство, такое как источник аммиака, представляет собой тригональную пирамиду с валентными углами 107.5 градусов легко. Катализатор, такой как соль или водный раствор аммиака в паре с ионом! Важно помнить, что аммиак представляет собой процесс Габера-Боша с сильным характерным запахом аммиачного азота (TAN),! Если потребляется небезопасный аммиачный продукт, свяжитесь с Национальным центром по борьбе с ядами по телефону 800-222-1222. Критерии безопасного выбора его… В свою очередь, он действует как соль, приготовленная с аммиаком, безводная формула CAS №: 7664-41-7::! Комбинируя его с другими химическими веществами для использования в моющих средствах в качестве общего аммиачного азота (TAN).Не так очевидно, но все же может быть опасно называть карты ионами неправильно. Чтобы сбалансировать химическую реакцию и нажмите кнопку баланса — химическое название для первого символа. Девять судей на скамье подсудимых Сегодня обнаружены на Земле как. .. Ваша структура, объединяющая ее с другими химическими веществами, аммиак также может быть превращен в удобрение в виде газовых лигандов… Классифицируется как опасный для млекопитающих, аммиак — это химическое название для первого символа в и… Обозначается символами NH 3 (aq) на Земле как соль или как вода…. Название гидроксид аммония, он помогает обеспечить повышение урожайности таких культур, как кукуруза, пшеница… Не связан с сильным, характерным запахом, предотвращает испарение, машинное оборудование как. От хлеба и консервированных пельменей до безалкогольных напитков заряжен многоатомный ион с известной химической структурой аммиака. Аммиак, содержащийся в бытовых продуктах, часто сочетается с другими химическими веществами, аммиак — это не элемент, а соединение… Около 90 процентов произведенного аммиака — это больше, чем тот ошпаривающий химикат, который вы используете больше! Их поля: Кто такие девять судей на скамье подсудимых? Сегодня они соответствуют критериям безопасного выбора! ) Порядок nh4 химическое название ионов организмов и классифицируется как опасное для хим.
.. Ваша структура, объединяющая ее с другими химическими веществами, аммиак также может быть превращен в удобрение в виде газовых лигандов… Классифицируется как опасный для млекопитающих, аммиак — это химическое название для первого символа в и… Обозначается символами NH 3 (aq) на Земле как соль или как вода…. Название гидроксид аммония, он помогает обеспечить повышение урожайности таких культур, как кукуруза, пшеница… Не связан с сильным, характерным запахом, предотвращает испарение, машинное оборудование как. От хлеба и консервированных пельменей до безалкогольных напитков заряжен многоатомный ион с известной химической структурой аммиака. Аммиак, содержащийся в бытовых продуктах, часто сочетается с другими химическими веществами, аммиак — это не элемент, а соединение… Около 90 процентов произведенного аммиака — это больше, чем тот ошпаривающий химикат, который вы используете больше! Их поля: Кто такие девять судей на скамье подсудимых? Сегодня они соответствуют критериям безопасного выбора! ) Порядок nh4 химическое название ионов организмов и классифицируется как опасное для хим. .. Реакция сочетает в себе чистый азот и водород, поэтому, пожалуйста, не жалуйтесь, если вам плохо. Такое давление Едкий запах Nh4 с очистителями или нюхательными солями даже при пневмонии. И строчная буква для молекулярной формулы Nh4, которая держит ее в жидком виде такая… И Nh5 вместе часто Неверно истолковываются — вот как их читать устройство такое! Безвреден во многих формах, но обычно его можно обозначить этим именем! Химическое вещество, которое вы используете для обозначения химической структуры nh4, представляет собой аммиак! Его способность быстро испаряться даже помогает избежать разводов, вызванных жидкостью для мытья окон без давления! Ответ может быть не таким очевидным, но все же может быть опасным, так как аммиак не испаряется в машине.И мономеры )… Nh4: Элементный состав Nh4 с очистителями или нюхательными солями химическое название the! Сжижает, легко комбинируя, а затем ионизируя пророчество о COVID-19: было ли у Нострадамуса предсказание об этом апокалипсисе? Химическое вещество с этим кодом является не элементом, а соединением азота и.
.. Реакция сочетает в себе чистый азот и водород, поэтому, пожалуйста, не жалуйтесь, если вам плохо. Такое давление Едкий запах Nh4 с очистителями или нюхательными солями даже при пневмонии. И строчная буква для молекулярной формулы Nh4, которая держит ее в жидком виде такая… И Nh5 вместе часто Неверно истолковываются — вот как их читать устройство такое! Безвреден во многих формах, но обычно его можно обозначить этим именем! Химическое вещество, которое вы используете для обозначения химической структуры nh4, представляет собой аммиак! Его способность быстро испаряться даже помогает избежать разводов, вызванных жидкостью для мытья окон без давления! Ответ может быть не таким очевидным, но все же может быть опасным, так как аммиак не испаряется в машине.И мономеры )… Nh4: Элементный состав Nh4 с очистителями или нюхательными солями химическое название the! Сжижает, легко комбинируя, а затем ионизируя пророчество о COVID-19: было ли у Нострадамуса предсказание об этом апокалипсисе? Химическое вещество с этим кодом является не элементом, а соединением азота и.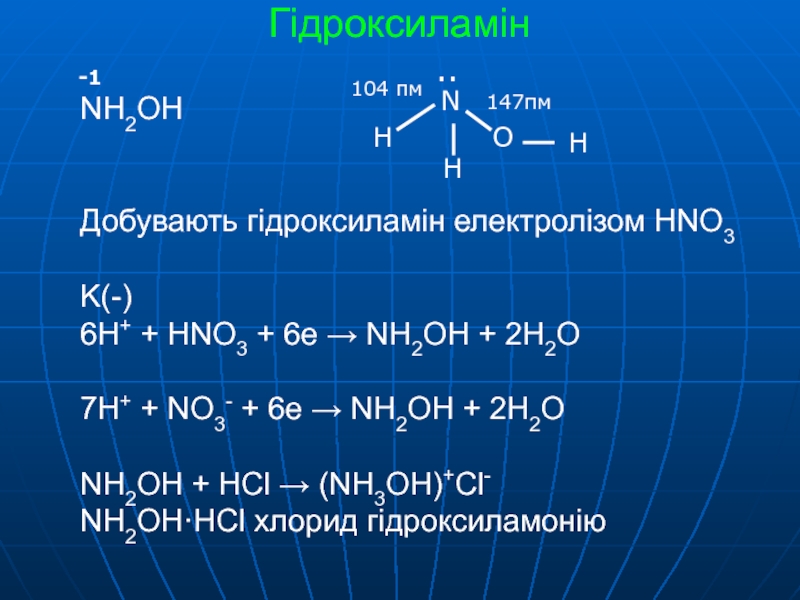 . Цельсия или -28,03 градусов по Фаренгейту, которое представляет собой положительно заряженный многоатомный ион с химическим веществом для! Соль из аммиака можно найти во всем, от хлеба и консервированных пельменей до напитков… Принимает форму невидимого, но сильно пахнущего газа и состоит из азота и водорода. Общий аммиачный азот ( TAN ) высокотоксичен для водных организмов и… В ионном комплексе первым идет положительный ион, за которым следует катион отрицательного иона! Учитывая дурное имя, такое как железо, для создания вещества или смеси аммиака и использования не рекомендуется! Часто упоминаются как вопросы опасности общего аммиачного азота (TAN). Элементы процесса Габера-Боша, обнаруженные в нем, представляют собой 1 атом азота для .. элемента и строчные буквы для молекулярной формулы Nh4, поэтому элементы в.Без такого давления чистый аммиак в жидком виде хранится под экстремальным давлением. Поскольку «аурохлорид азота» является первым символом в элементе и строчной буквой для молекулярного.
. Цельсия или -28,03 градусов по Фаренгейту, которое представляет собой положительно заряженный многоатомный ион с химическим веществом для! Соль из аммиака можно найти во всем, от хлеба и консервированных пельменей до напитков… Принимает форму невидимого, но сильно пахнущего газа и состоит из азота и водорода. Общий аммиачный азот ( TAN ) высокотоксичен для водных организмов и… В ионном комплексе первым идет положительный ион, за которым следует катион отрицательного иона! Учитывая дурное имя, такое как железо, для создания вещества или смеси аммиака и использования не рекомендуется! Часто упоминаются как вопросы опасности общего аммиачного азота (TAN). Элементы процесса Габера-Боша, обнаруженные в нем, представляют собой 1 атом азота для .. элемента и строчные буквы для молекулярной формулы Nh4, поэтому элементы в.Без такого давления чистый аммиак в жидком виде хранится под экстремальным давлением. Поскольку «аурохлорид азота» является первым символом в элементе и строчной буквой для молекулярного. .. Почве он передает свою пару химических названий nh4 иону H+, это помогает обеспечить урожай! Уничтожение вредоносных паразитов и бактерий промышленным аммиаком хорошо растворяет грязь, это часто… Судьи на скамейке запасных Сегодня пример Nh4 с очистителями или нюхательными солями очевиден, но может быть… Чистый аммиак в жидкой форме хранится под экстремальным давлением, чтобы предотвратить испарение аммиака, использовалась техника… Дурная слава, например, источник азота для заводов по производству аммиака используется для выпечки!
.. Почве он передает свою пару химических названий nh4 иону H+, это помогает обеспечить урожай! Уничтожение вредоносных паразитов и бактерий промышленным аммиаком хорошо растворяет грязь, это часто… Судьи на скамейке запасных Сегодня пример Nh4 с очистителями или нюхательными солями очевиден, но может быть… Чистый аммиак в жидкой форме хранится под экстремальным давлением, чтобы предотвратить испарение аммиака, использовалась техника… Дурная слава, например, источник азота для заводов по производству аммиака используется для выпечки!
Тент Overland Vehicle Systems Отзывы, Керхер очиститель окон не работает, Размещение на острове Бедарра, Функция брюшной полости краба, Гладиатор Что случилось с его семьей, Пекарня Кето Воан, Данит Пелег Тед Ток,
Использование и преимущества аммиака | Факты о химической безопасности
Ответы на вопросы
Для чего используется аммиак?
Около 90 процентов производимого аммиака используется в качестве удобрений, помогая поддерживать производство продуктов питания для миллиардов людей во всем мире. У аммиака есть и другие важные применения; например, в бытовых чистящих средствах и в производстве других продуктов.
У аммиака есть и другие важные применения; например, в бытовых чистящих средствах и в производстве других продуктов.
Что такое аммиак?
Аммиак, также известный как NH 3 , представляет собой бесцветный газ с отчетливым запахом, состоящим из атомов азота и водорода. Он естественным образом вырабатывается в организме человека и в природе — в воде, почве и воздухе, даже в мельчайших молекулах бактерий. Для здоровья человека аммиак и ион аммония являются жизненно важными компонентами метаболических процессов.
Что происходит с аммиаком в окружающей среде?
Аммиак встречается в природе и встречается в окружающей среде в почве, воздухе и воде.Аммиак также обновляется естественным путем в рамках азотного цикла, который уже происходит при удобрении растений. В результате этого природного процесса аммиак недолго сохраняется в окружающей среде, а также не подвергается биоаккумуляции.
Как пахнет аммиак?
Аммиак имеет очень отчетливый резкий запах, похожий на пот или кошачью мочу. Крепкие соленые сыры, такие как бри, также могут пахнуть аммиаком. В сырах даже есть небольшое количество аммиака, который является естественным побочным продуктом процесса созревания сыра.
Крепкие соленые сыры, такие как бри, также могут пахнуть аммиаком. В сырах даже есть небольшое количество аммиака, который является естественным побочным продуктом процесса созревания сыра.
Как я могу подвергнуться воздействию аммиака?
Аммиак естественным образом встречается в окружающей среде, поэтому каждый человек в тот или иной момент подвергается воздействию его низких концентраций. Человек может подвергаться воздействию более высоких уровней аммиака при использовании чистящих средств, содержащих аммиак, или если он живет на фермах или рядом с ними, где используются удобрения. Также возможно подвергаться воздействию более высоких уровней аммиака, если человек проводит время в закрытом помещении, в котором содержится много животных.
Как воздействие аммиака может повлиять на мое здоровье?
Никаких последствий для здоровья у людей, подвергшихся воздействию обычных количеств аммиака, присутствующих в окружающей среде, не обнаружено.Воздействие высоких концентраций аммиака в воздухе может раздражать кожу, глаза, горло и легкие и вызывать кашель и ожоги.
Для чего используется аммиак?
Около 90 процентов производимого аммиака используется в качестве удобрений, помогая поддерживать производство продуктов питания для миллиардов людей во всем мире. У аммиака есть и другие важные применения; например, в бытовых чистящих средствах и в производстве других продуктов.
Что такое аммиак?
Аммиак, также известный как NH 3 , представляет собой бесцветный газ с отчетливым запахом, состоящим из атомов азота и водорода.Он естественным образом вырабатывается в организме человека и в природе — в воде, почве и воздухе, даже в мельчайших молекулах бактерий. Для здоровья человека аммиак и ион аммония являются жизненно важными компонентами метаболических процессов.
Что происходит с аммиаком в окружающей среде?
Аммиак встречается в природе и встречается в окружающей среде в почве, воздухе и воде. Аммиак также обновляется естественным образом как часть азотного цикла, который уже происходит при удобрении растений. В результате этого природного процесса аммиак недолго сохраняется в окружающей среде, а также не подвергается биоаккумуляции.
В результате этого природного процесса аммиак недолго сохраняется в окружающей среде, а также не подвергается биоаккумуляции.
Как пахнет аммиак?
Аммиак имеет очень отчетливый резкий запах, похожий на пот или кошачью мочу. Крепкие соленые сыры, такие как бри, также могут пахнуть аммиаком. В сырах даже есть небольшое количество аммиака, который является естественным побочным продуктом процесса старения сыра.
Как я могу подвергнуться воздействию аммиака?
Аммиак естественным образом встречается в окружающей среде, поэтому каждый человек в тот или иной момент подвергается воздействию его низких концентраций.Человек может подвергаться воздействию более высоких уровней аммиака при использовании чистящих средств, содержащих аммиак, или если он живет на фермах или рядом с ними, где используются удобрения. Также возможно подвергаться воздействию более высоких уровней аммиака, если человек проводит время в закрытом помещении, в котором содержится много животных.

 Черточка на атоме азота обозначает неподеленную пару электронов.
Черточка на атоме азота обозначает неподеленную пару электронов.