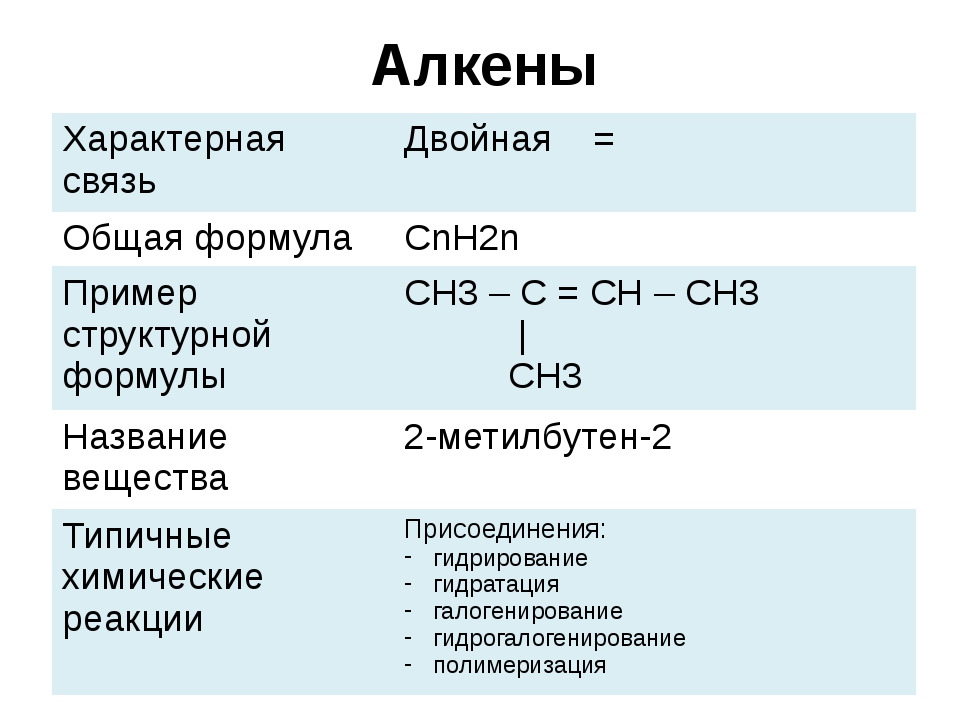
Контрастирующие вещества в магнитно-резонансной томографии
В основе любого метода визуализации лежит способность глаза отличать участки изображения по их яркости. Контрастность патологического очага по отношению к окружающим тканям зависит от собственных свойств ткани и способа получения изображения на томограммах. В магнитно-резонансной томографии (МРТ) изображение, получаемое на томограммах строится на основе магнитных характеристик тканей, главные из которых — протонная плотность (р) и релаксационные времена T1 и Т2.
На магнитные характеристики объекта при проведении МРТ с контрастом влияют содержание воды, крупных молекул (это в основном белки), ионов и свободных радикалов. Эти соотношения почти всегда нарушаются при патологических состояниях. Так, воспаление сопровождается увеличением количества внутриклеточной и внеклеточной воды, а опухоли — внутриклеточной воды.
По-особому ведет себя кровоизлияние на томограммах. Дезоксигемоглобин — диамагнетик. Метгемоглобин действует как парамагнетик, в неразрушенных эритроцитах крови он сокращает релаксационные времена. После разрушения эритроцитов проявляется суперпарамагнитный эффект, и кровь становится яркой на Т1-взвешенных томограммах. Гемосидерин обладает высокой магнитной чувствительностью, приводя к быстрой дефазировке окружающие протоны, кровь выглядит на томограмма темной.
Протонная плотность— число резонирующих протонов в единице объема — мало отличается у тканей в норме и при патологических состояниях. Исключение составляетжировая ткань, имеющая самую высокую протонную плотность и потому высокую интенсивность сигнала, особенно на Т1-взвешенных томограммах. Низкая протонная плотность компактной
костной ткани делает ее темной на изображениях любого типа взвешенности.
В большинстве случаев естественной контрастности МР — томограмм достаточно для выявления и характеристики патологического очага. Вместе с тем встречаются ситуации, когда патологический очаг не визуализируется на томограмме вследствие изоинтенсивности или малых размеров. Бывает трудно определить границы патологических изменений при МРТ и оценить внутреннюю структуру. В таких ситуациях помогает диагностика с введением контрастных веществ, т.н. МРТ с контрастным усилением. Кроме того, есть и другие специальные применения контрастных веществ. Точкой приложения магнито-фармацевтики являются релаксационные времена. Контрастные вещества для МР исследований меняют их неспецифически и напрямую. В этом плане они 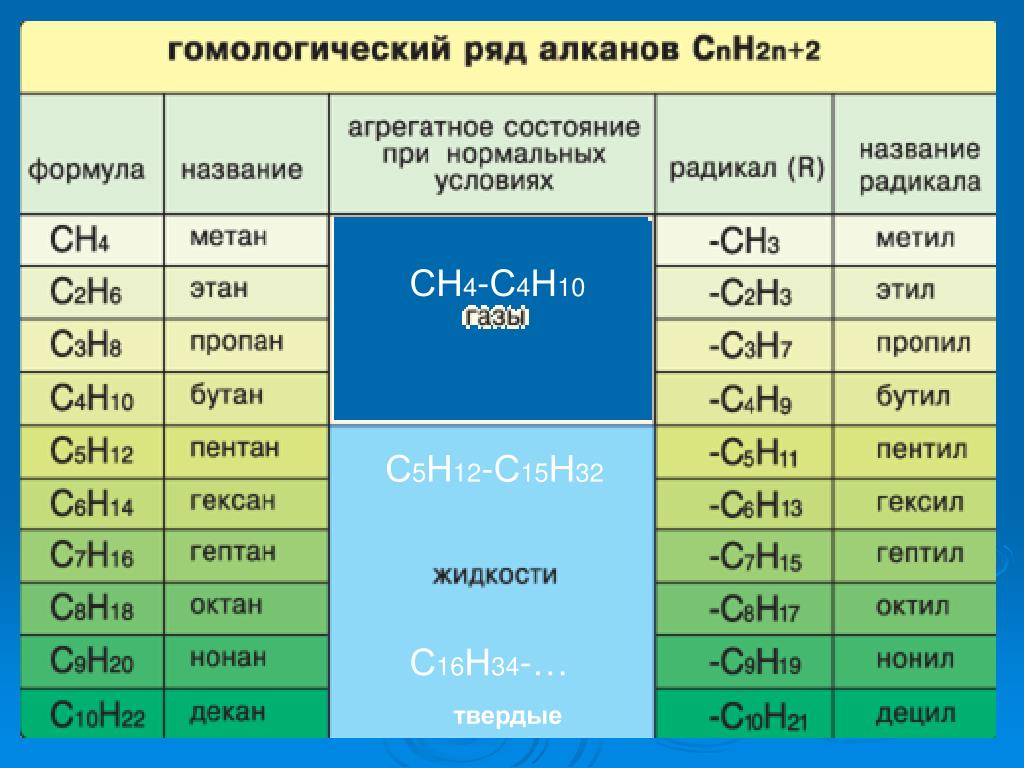
Позитивные контрастные веществаотносятся к группе парамагнетиков. Парамагнетики содержат в качестве активной части ионы с непарными электронами на внешней орбите — Gd3+, Mn2+, Fe3+, Cr3+ и т.д. Практическое значение при проведении МРТ с контрастом на сегодняшний день имеют соли гадолиния (Gd3+), так как остальныеионы более токсичны и малорастворимы.
Гадолинийотносится к редкоземельным элементам из группы лантаноидов. Гадолиний содержит семь непарных электронов, которые преимущественно сокращают время спин-решетчатой релаксации (Т1). В результате патологический очаг становится ярким при рассмотрении томограммы. Гадолиний в виде простых солей очень токсичен, поэтому он включается в состав хелатов. В таблице приведены основные соединения гадолиния, выпускаемые в качестве контрастных препаратов для МРТ диагностики.
| Контрастные вещества, содержащие гадолиний(Gd3+) | |||||
| Название МРКС | Химическое соединение | Сокращенное обозначение | Химическая структура | Заряд | |
| Омнискан | Гадодиамид | Gd-DTPA-BMA | Линейная | Неионный | Nycomed Австрия |
| Магневист | Гадопентетата димеглумин | Gd-DTPA | Линейная | Ионный | Schering Германия |
| Мультиханс | Гадобената димеглумин | Gd-BOPTA | Линейная | Ионный | Braeco Италия |
| Примовист | Гадоксетовой кислоты динатриевая соль | Gd-EOB-DPTA | Линейная | Ионный | Байер Шеринг АГ(Германия) |
| Вазовист | Гадофосвесета тринатриевая соль | Gd-DTPA | Линейная | Ионный | Меллинкродт Медикал Ink США |
| Проханс | Гадотеридол | Gd-HP -DO3A | Цикличная | Неионный | Италия |
| Гадовист | Гадобутрол | Gd-BTDO3A | Цикличная | Неионный | Шеринг АГ(Германия) |
| Дотарем | Гадотерата меглумин | GdDOTA | Цикличная | Ионный | Guerbet Франция |
Принцип действияконтрастных веществ в МРТ диагностике одинаковый, хотя и с некоторыми фармакологическими и фармакокинетическими различиями.
При внутривенном введении контрастные вещества попадают в межклеточное пространство тканей, не задерживаясь в сосудистом русле. Накопление в патологических тканях (кроме ЦНС) зависит от васкуляризации этих образований. Препараты гадолиния в соединении со средними полимерными цепями относительно длительно удерживаются в сосудистом русле и могут применяться для контрастной МР — ангиографии, томографии головного мозгас контрастным усилением.
Контрастирующие вещества на основе гадолиния должны с осторожностью применяться при заболеваниях почек.
В виде жировых эмульсий гадолиний потенциально применим как вещество, контрастирующее желудочно-кишечный тракт.
Негативные контрастные веществасодержат в качестве активной части Fe2+ или Fe3+. По своему действию железо выступает в качестве суперпарамагнетика. Препарат Endorem применяется для  Для контрастирования желудочно-кишечного тракта служат Lumirem, Gastromark, Abdoscan. В нашем отделении используются только контрастирующие вещества содержащие гадолиний.
Для контрастирования желудочно-кишечного тракта служат Lumirem, Gastromark, Abdoscan. В нашем отделении используются только контрастирующие вещества содержащие гадолиний.
Проведение МР исследования с контрастирующим веществом состоит из двух этапов. Вначале проводится МР сканирование соответствующего отдела со стандартными требованиями. Необходимость контрастного усиления определяется по данным именно этого исследования. При согласии пациента и отсутствии противопоказаний врач определяет дозировку контрастирующего вещества и способ его введения. Перед повторным исследованием пациент вывозится из туннеля томографа. В вену локтевого сгиба устанавливается катетер, через который вводится контрастирующее вещество. Внутривенное введение может осуществляться вручную, и с помощью электронного инжектора.
Для автоматического введения контрастирующего веществамы используемдвухголовочный инжектор Optistar LE. Онспециально создан для магнитно-резонансной томографии, и работает в условиях магнитного поля до 3. 0 Тесла.
0 Тесла.
Рабочая головка и вертикальная стойка с основанием, размещенные рядом с магнитно-резонансным томографом, изготовлены из немагнитных материалов.
Инжектор позволяет осуществлять различные схемы введения контрастирующего вещества. Применяется фронтальная загрузка двух одноразовых шприцов, заполненных контрастирующим препаратом и физиологическим раствором соответственно.
ИнжекторOptiStar LE обеспечивает выполнение инъекции с изменением программируемых параметров: скорость введения, давление, объем контрастирующего препарата, задержка инъекции, режим капельного введения физиологического раствора.
Пациенту запрещается менять положение тела и двигаться во время всего исследования.
Если исследование с введением контрастирующего вещества запланировано, необходимо убедиться в доступности и проходимости поверхностных вен. Если пункция вены вызывает затруднение (был проведён курс химиотерапии, анатомические особенности и т. п.), до МР исследования необходимо позаботиться об установке венозного катетера до исследования. Данную манипуляцию можно осуществить в нашем стационаре.
Данную манипуляцию можно осуществить в нашем стационаре.
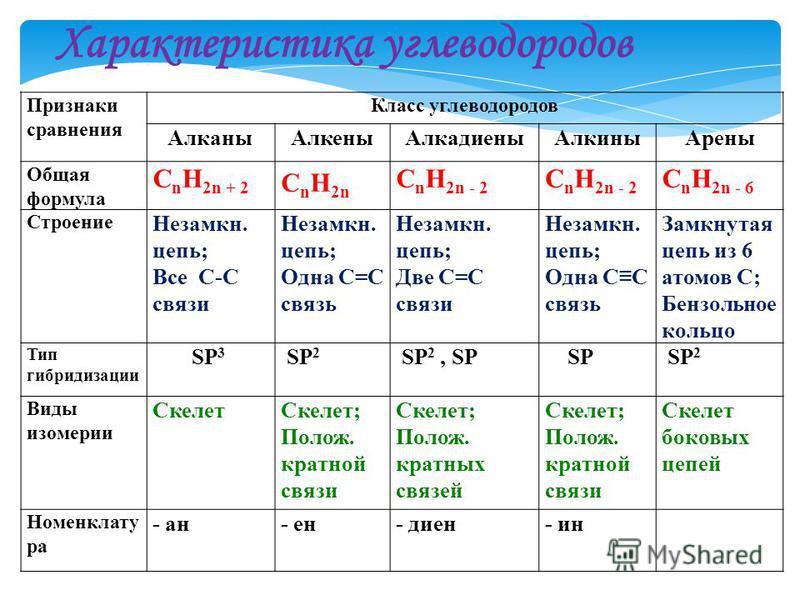
Урок 4. арены (ароматические углеводороды) — Химия — 10 класс
Химия, 10 класс
Урок № 4. Арены (ароматические углеводороды)
Перечень вопросов, рассматриваемых в теме: урок посвящён ароматическим углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека.
Глоссарий
Ароматический углеводород – соединение, содержащее в молекуле специфическую систему чередующихся одинарных и двойных связей (сопряженных π-связей).
Акцептор – атом или группа атомов, принимающих электроны и образующих химическую связь за счёт своей пустой орбитали и неподелённой пары электронов донора.
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Группа функциональная – группа атомов, определяющая наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Донорное (электронодонорное) свойство – способность атомов элемента отдавать свои электроны другим атомам. Количественной мерой донорных свойств атомов, образующих химическую связь, является их электроотрицательность.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.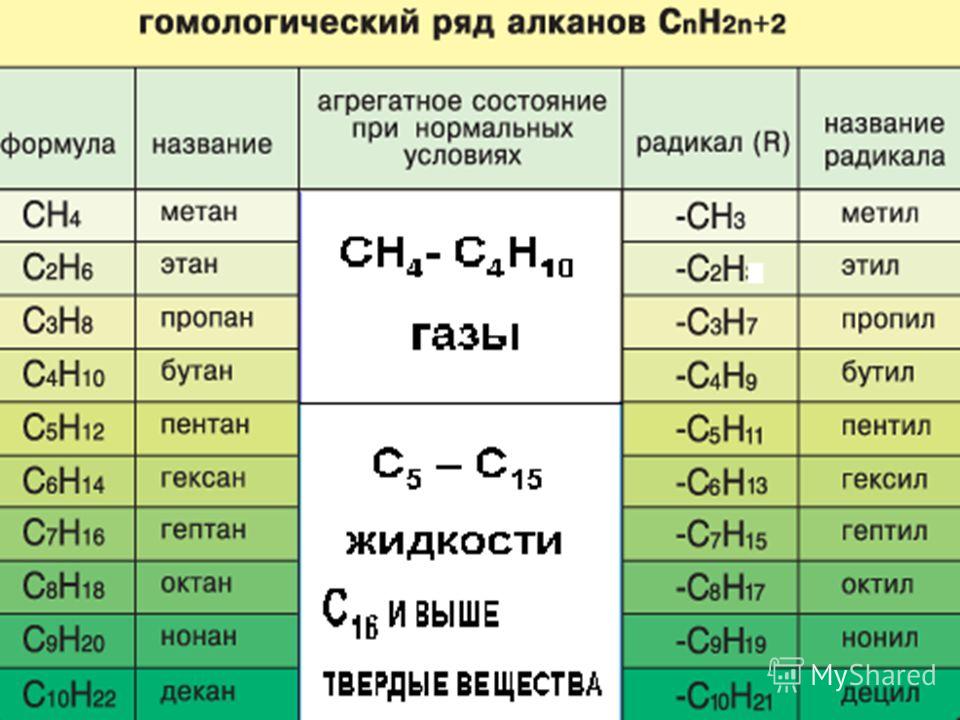
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
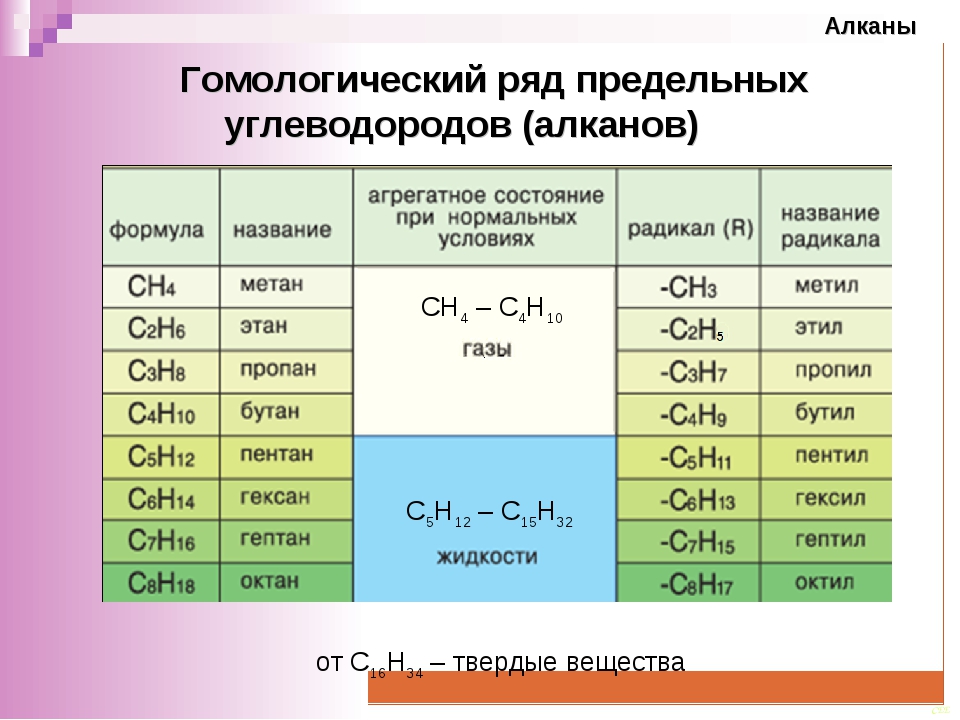
Арены (ароматические углеводороды) – органические соединения, имеющие общую формулу СnH2n –6, а в составе молекулы бензольное кольцо (ядро).
Бензольное кольцо – это цикличная группа шести атомов углерода; структуру в виде кольца предложил Ф. А. Кекуле в 1865 г.
Простейшим представителем аренов является бензол С6Н6. Среди других представителей можно отметить, например, кумол (изопропилбензол) C6H5CH(CH3)2.
Формулы бензола
Полная структурная (формула, предложенная Ф.А. Кекуле) | |
Сокращенная структурная (формула, предложенная Ф.А. Кекуле) | |
Сокращенная структурная с сопряженными связями |
Бензол – первый представитель класса аренов (ароматических углеводородов). Каждый атом углерода в молекуле бензола С6Н6 имеет 4 валентных электрона: s1p3. Тип гибридизации атомов углерода в бензольном кольце молекулы аренов, как и у алкенов, – sp2.
sp2 гибридизация – это смешивание одного s и двух p электронных облаков и образование трёх одинаковых (гибридных). Гибридные облака участвуют в образовании 3 δ-связей, лежащих на плоскости. Оставшееся у каждого из шести атомов углерода негибридизованное третье p-облако имеет форму гантели. Шесть p-облаков, перекрываясь с соседними над и под плоскостью δ-связей, участвует в образовании общего 6-электронного облака, которое является общим для всех атомов углерода.
Свойства бензола и других ароматических соединений и их обусловленность электронным строением молекулы бензола.
Физические и химические свойства бензола и его гомологов
Физические свойства бензола
Бензол – бесцветная жидкость с характерным запахом, которая кипит при 80,1 °С, ρ = 0,876 г/cм3. Бензол очень огнеопасен!
Бензол является хорошим растворителем. В пробирку нальем 1 мл дистиллированной воды и добавим несколько капель масла. Масло не растворяется в воде даже после перемешивания содержимого. Во вторую пробирку нальем 1 мл бензола. Перемешаем содержимое. Масло растворяется в бензоле. Однако ввиду высокой токсичности, использование бензола в качестве растворителя нежелательно.
Масло не растворяется в воде даже после перемешивания содержимого. Во вторую пробирку нальем 1 мл бензола. Перемешаем содержимое. Масло растворяется в бензоле. Однако ввиду высокой токсичности, использование бензола в качестве растворителя нежелательно.
Сопряжение π-связей в молекуле бензола
Образование пи-связей в молекуле бензола обусловлено тем, что негрибридизованные облака образуют общие электронные плотности в виде колец над и под плоскостью молекулы бензола. Обратите внимание, что в результате образуется общее пи-электронное облако, а все связи между атомами углерода в молекуле бензола оказываются одинаковыми (их еще называют полуторными). Именно пи-электронные облака являются объяснением того факта, что – в отличие от первоначального варианта представления молекулярной формулы бензола с чередованием одинарных и двойных связей – бензол не проявляет выраженных свойств алкенов.
Химические свойства бензола
Реакции замещения (как алканы) | Галогенирование | Реакция происходит в присутствии катализатора (соли FeBr3, AlCl3, AlBr3): |
Нитрование | ||
Алкилирование | ||
Реакции присоединения (как алкены) | Каталитическое гидрирование | |
Радикальное хлорирование | ||
Окисление | Горение | 2С6Н6 + 15О2→12СО2 + 6Н2О |
Взаимодействие с перманганатом калия | Не обесцвечивает раствор перманганата калия (реакция не идёт) |
Горение бензола
Бензол горит жёлтым коптящим пламенем, если внести в пламя стекло, на нем быстро оседает слой копоти.
Электрофилы – это положительно заряженные частицы, имеющие свободную орбиталь на внешнем электронном уровне и способные образовывать новые ковалентные связи за счёт пары электронов другой молекулы. К электрофилам относятся молекулы галогенов, SO3 и молекулы с сильнополяризованной связью (HCOO—Br+).
Электрофильное замещение в ароматических соединениях можно представить реакцией присоединения-отщепления. Эта реакция проходит в несколько стадий.
При инициации реакции молекула хлора распадается на два иона. Катализатор, например, AlCl3, присоединяя ион хлора Cl−, приобретает отрицательный заряд. Оставшийся ион хлора Cl+, который является электрофилом, присоединяется к образовавшемуся на катализаторе отрицательному иону AlCl4−.Образованное соединение называется π-комплексом. Этот комплекс вступает в реакцию с молекулой бензола, обеспечивая присоединение ионов хлора Cl+ к атомам углерода.
Сравнение свойств бензола и толуола
Бензол
Отношение к раствору KMnO4 | Не окисляется |
Горение на воздухе | 2С6Н6 + 15О2 → 12СО2 + 6Н2О |
Реакция гидрирования | |
Присоединение хлора (галогена) | |
Замещение водорода хлором (галогеном) | |
Нитрование |
Толуол
Отношение к раствору KMnO4 | Окисление боковых цепей (в присутствии h3SO4 или KMnO4) |
Горение на воздухе | C6H5–CH3 + 9O2 → 7CO2 + 4H2O |
Реакция гидрирования | |
Присоединение хлора (галогена) | |
Замещение водорода хлором (галогеном) | |
Нитрование |
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Определение формулы бензола. Пошаговый тренажер решения задач
Определение формулы бензола. Пошаговый тренажер решения задач
Шаг 1.
Найдите молекулярную формулу бензола, если известно, что его пары в 2,78 раз тяжелее азота.
1. Вывод формулы для нахождения относительной массы бензола из формулы относительной плотности.
D (по N2) = Mr (бензола) / Mr (N2), выведем формулу для расчета относительной массы бензола:
Mr (бензола) = D (по N2) [×] Mr (N2).
Ответ: Mr (бензола) = D (по N2) × Mr (N2)
2. Рассчитаем относительную молекулярную массу азота, используя периодическую систему химических элементов Д.И. Менделеева.
Mr (N2) = 2 · 14 = 28.
Ответ: Mr (N2) = 28.
3. Рассчитаем относительную молекулярную массу бензола (с точностью до целых):
Mr (бензола) = 2,78 · 28 = 77,84 ≈ 78.
Ответ: Mr (бензола) = 78
4. Бензол является углеводородом. Все углеводороды состоят из углерода и водорода.
Бензол является углеводородом. Все углеводороды состоят из углерода и водорода.
5. Нахождение количества атомов углерода в молекуле бензола. Количество атомов углерода в молекуле бензола равно […].
Ответ: 6.
Пусть количество атомов углерода равно x, а количество атомов водорода – y. Поскольку вещество имеет равное количество атомов углерода и водорода, то x = y.
Составим уравнение с учетом значений относительной атомной массы углерода и водорода, а также вычисленной относительной молекулярной массы бензола.
12 ⋅ x + 1 ⋅ y = 78.
x = y = 78 / 13 = 6.
Следовательно, в молекуле содержатся шесть атомов углерода и шесть атомов водорода.
6. Составление молекулярной формулы бензола С6Н6
2. Решение задачи о свойствах толуола
В результате взаимодействия 2,5 моль толуола с бромом образовалось 700 г трибромтолуола. Найдите практический выход реакции (%) от теоретически возможного. Ответ округлите до целого числа.
Ответ: 86 %.
Решение.
1. Запишем уравнение реакции.
С6Н5СН3 + 3Br2 → | С6Н2СН3Br3 + | 3НBr |
Толуол | Трибромтолуол |
2. Рассчитаем молярную массу трибромтолуола.
М (С6Н2СН3Br3) = 329 г/моль
3. Рассчитаем теоретический выход (г) трибромтолуола.
2,5 моль | х г | |
С6Н5СН3 + 3Br2 → | С6Н2СН3Br3 + | 3НBr |
1 моль | 1 моль · 329 г/моль |
2,5 моль / 1 моль = х г / 1 моль · М (С6Н2СН3Br3)
х = 2,5 · 329 / 1 = 815 (г).
4. Рассчитаем теоретический выход (%) трибромтолуола.
Составляем пропорцию:
815 г составляет 100 %
700 г – х %.
Отсюда:
х = 700 · 100 / 815 = 85,88 ≈ 86 (%).
Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония.
Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л h3O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства азота: Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Характерная валентность – 3 и 4.
Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. В обычных условиях азот подобен инертному газу.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li3N. При нагревании (то есть активации молекул N2) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
N2 + 3H2 ↔ 2NH3
N2 + 2B → 2BN
3Si + 2N2 → Si3N4
3Ca + N2 → Ca3N2
N2 + O2 → 2NO.
Получение азота. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). Полученный азот содержит примеси благородных газов (аргона).
Полученный азот содержит примеси благородных газов (аргона).
В лабораториях обычно используется азот, доставляемый с производства в стальных баллонах под повышенным давлением или жидкий азот в сосудах Дьюара. Можно получать азот разложением некоторых его соединений:
NH4NO2 → N2 + 2H2O (при to)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O (при to)
2N2O → 2N2 + O2 (при to)
Особо чистый азот получают термическим разложением азида натрия:
2NaN3 → 2Na + 3N2 (при to)
Нахождение в природе: в природе азот встречается в основном в свободном состоянии. Содержание азота в воздухе — его объемная доля 78,09 %. В небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – ДНК и РНК – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цитизила и уридила. Общее содержание азота в земной коре – 0,01 %. Из минералов промышленное значение имеют чилийская селитра NaNO3 и индийская селитра KNO3.
Общее содержание азота в земной коре – 0,01 %. Из минералов промышленное значение имеют чилийская селитра NaNO3 и индийская селитра KNO3.
оксидов азота | Национальный кадастр загрязнителей
Описание
Оксиды азота — это смесь газов, состоящая из азота и кислорода. Двумя наиболее токсикологически значимыми соединениями являются оксид азота (NO) и диоксид азота (NO 2 ). К другим газам, относящимся к этой группе, относятся окись азота (или закись азота, N 2 O) и пятиокись азота (NO 5 ).
Двуокись азота производится для производства азотной кислоты.Большая часть азотной кислоты используется в производстве удобрений, а часть используется в производстве взрывчатых веществ как для военных, так и для горнодобывающих целей.
Сведения о веществе
Название вещества: Оксиды азота
Номер CASR: N / A
Химическая формула: NO, NO 2 , N 2 O и N 2 O 5
Синонимы: NO: оксид азота, оксид азота, оксид азота, монооксид азота
NO 2 : диоксид азота
Физические свойства
НЕТ: резкий, душистый, бесцветный газ
Температура плавления: -163. 6 ° С
6 ° С
Температура кипения: -151,8 ° C
Относительная плотность: 1,04 (воздух = 1)
NO2: красновато-коричневый газ с раздражающим запахом.
Температура плавления: -9,3 ° C
Температура кипения: 21,15 ° C
Плотность пара: 1,58
Химические свойства
NO горит только при нагревании водородом и образует азотную кислоту (сильную кислоту) при растворении в воде.
NO 2 плохо растворяется в воде с образованием азотистой кислоты (слабой кислоты).
Дополнительная информация
Национальный реестр загрязнителей ( NPI ) содержит данные для всех источников выбросов оксидов азота в Австралии.
Описание
Низкий уровень оксидов азота может раздражать глаза, нос, горло и легкие, что может приводить к кашлю, одышке, усталости и тошноте. Воздействие также может привести к скоплению жидкости в легких в течение 1-2 дней после воздействия. Вдыхание высоких уровней оксидов азота может вызвать быстрое жжение, спазмы и отек тканей в горле и верхних дыхательных путях, снижение оксигенации тканей, скопление жидкости в легких и, возможно, даже смерть.
Вдыхание высоких уровней оксидов азота может вызвать быстрое жжение, спазмы и отек тканей в горле и верхних дыхательных путях, снижение оксигенации тканей, скопление жидкости в легких и, возможно, даже смерть.
Контакт с кожей или глазами с высокой концентрацией оксидов азота или жидкого диоксида азота может привести к серьезным ожогам.
Вход в тело
Оксиды азота могут вдыхаться или абсорбироваться через кожу.
Воздействие
Большинство людей подвергаются воздействию оксидов азота при вдыхании загрязненного воздуха. Люди, живущие рядом с источниками горения, такими как угольные электростанции или в районах интенсивного использования автотранспорта, или в домохозяйствах, которые сжигают много древесины или используют керосиновые обогреватели или газовые плиты, могут подвергаться воздействию более высоких уровней оксидов азота.Рабочие, занятые на объектах, где используются сварочные материалы, производят азотную кислоту или определенные взрывчатые вещества, могут вдыхать оксиды азота во время своей работы.
Двуокись азота и окись азота содержатся в табачном дыме.
Стандарты воздействия на рабочем месте
Safe Work Australia устанавливает стандарты воздействия на рабочем месте свинца и соединений посредством стандартов воздействия на рабочем месте загрязняющих веществ, переносимых по воздуху. Эти стандарты подходят только для использования на рабочих местах и не ограничиваются какой-либо конкретной отраслью или операцией.Убедитесь, что вы понимаете, как интерпретировать стандарты, прежде чем использовать их.
Диоксид азота
- Максимальное восьмичасовое средневзвешенное значение (TWA): 3 части на миллион (5,6 мг / м 3 )
- Максимальный предел кратковременного воздействия (STEL): 5 частей на миллион (9,4 мг / м 3 )
Оксид азота
- Максимальное восьмичасовое средневзвешенное значение (TWA): 25 частей на миллион (31 мг / м 3 )
Закись азота
- Максимальное восьмичасовое средневзвешенное значение (TWA): 25 частей на миллион (45 мг / м 3 )
Рекомендации по питьевой воде
Австралийские директивы по питьевой воде включают следующие рекомендации по приемлемому качеству воды:
Нитриты
- Максимум 3 миллиграмма на литр воды для здоровья
Нитраты
- Максимум 50 миллиграммов на литр воды в медицинских целях для младенцев в возрасте до трех месяцев, в противном случае — 100 миллиграммов на литр воды.

Описание
Избыточный уровень оксидов азота, особенно диоксида азота (NO 2 ), может вызвать гибель растений и корней и повредить листья многих сельскохозяйственных культур. NO 2 — повреждающий компонент фотохимического смога. Чрезмерные уровни повышают кислотность дождя (снижают pH) и, таким образом, понижают pH поверхностных и грунтовых вод и почвы. Пониженный pH может иметь пагубные последствия, возможно, даже смерть, для множества биологических систем.
Вход в окружающую среду
Оксиды азота являются частью биогеохимического круговорота азота и обнаруживаются в воздухе, почве и воде.
В атмосфере оксиды азота быстро уравновешиваются диоксидом азота (NO 2 ), который в конечном итоге образует кислотный дождь. В стратосфере оксиды азота играют решающую роль в поддержании уровня озона. Озон образуется в результате фотохимической реакции между диоксидом азота и кислородом.
Где это заканчивается
Оксиды азота быстро разлагаются при взаимодействии с другими веществами, содержащимися в воздухе. Двуокись азота может образовывать азотную кислоту на солнечном свете и является основным компонентом кислотных дождей, тропосферного озона и смога. Оксиды азота реагируют в почве и воде с образованием азотной кислоты.
Двуокись азота может образовывать азотную кислоту на солнечном свете и является основным компонентом кислотных дождей, тропосферного озона и смога. Оксиды азота реагируют в почве и воде с образованием азотной кислоты.
Экологические директивы
В 1999 г. были установлены следующие стандарты качества атмосферного воздуха для диоксида азота:
Период усреднения 1 час, максимум 0.12 частей на миллион, с максимально допустимым превышением 1 день в год.
Период усреднения 1 год, максимум 0,03 частей на миллион.
Отраслевые источники
Промышленными источниками оксидов азота являются электроснабжение, горнодобывающая промышленность, добыча нефти и газа, обрабатывающая промышленность и производство нефти.
Диффузные источники и промышленные источники, включенные в данные о диффузных выбросах
Различные виды сельскохозяйственной деятельности (выращивание и кормление животных) и лесоводство (как «выжигание», так и вырубка) увеличивают скорость естественных процессов, приводящих к образованию оксидов азота. Сжигание топлива, например, нагревание и курение сигарет, также являются диффузными источниками оксидов азота.
Сжигание топлива, например, нагревание и курение сигарет, также являются диффузными источниками оксидов азота.
Природные источники
Биологический круговорот азота включает процессы, которые производят оксид азота и закись азота в качестве промежуточных продуктов.
Термические процессы в атмосфере (во время молний или лесных пожаров) приводят к образованию оксидов азота.
Источники транспорта
Окиси азота присутствуют в выхлопных газах всех транспортных средств, в том числе автомобилей, газонокосилок, судов и лодок, самолетов и железных дорог.
Потребительские товары
Нитратосодержащие удобрения содержат оксиды азота.
Источники, использованные при подготовке данной информации
- Агентство по регистрации токсичных веществ и заболеваний (ASTDR), ToxFAQs: Nitrogen Oxides, по состоянию на май 2007 г.
- Межправительственная группа экспертов по изменению климата (2001 г.), Изменение климата: Рабочая группа 1: Научная основа (Глава 4), по состоянию на май 2007 г.

- Merck and Co. 2006, Merck Index, 14-е издание, США.
- Национальный реестр загрязнителей (1999 г.), контекстная информация.
- Офис Австралийского совета по безопасности и компенсации, Стандарты воздействия: оксид азота, по состоянию на май 2007 г.
- Офис Австралийского совета по безопасности и компенсации, Стандарты воздействия: диоксид азота, по состоянию на май 2007 г.
- Офис Австралийского совета по безопасности и компенсации, Стандарты воздействия: закись азота, по состоянию на май 2007 г.
- Техническая консультативная группа 1999 г., Заключительный отчет Национальному совету по охране окружающей среды.
- Организация Объединенных Наций, Международные карты химической безопасности: оксид азота, по состоянию на май 2007 г.
- Организация Объединенных Наций, Международные карты химической безопасности: диоксид азота, по состоянию на май 2007 г.
- Организация Объединенных Наций, Международные карты химической безопасности: закись азота, по состоянию на февраль 2007 г.

- Агентство по охране окружающей среды США. Интегрированная система информации о рисках (IRIS): диоксид азота, по состоянию на май 2007 г.
- Safe Work Australia, Стандарты воздействия переносимых по воздуху загрязнителей на рабочем месте, по состоянию на январь 2019 г.
- Национальный совет здравоохранения и медицинских исследований (NHMRC), Австралийские рекомендации по питьевой воде (2011 г.) — обновлено в октябре 2017 г., по состоянию на май 2018 г.
Основная информация о NO2 | Агентство по охране окружающей среды США
На этой странице:
Что такое NO
2 и как он попадает в воздух?Двуокись азота (NO 2 ) — это один из группы высокореактивных газов, известных как оксиды азота или оксиды азота (NO x ).Другие оксиды азота включают азотистую кислоту и азотную кислоту. NO 2 используется как индикатор для большей группы оксидов азота.
NO 2 в первую очередь попадает в воздух в результате сгорания топлива. NO 2 образуется в результате выбросов легковых, грузовых автомобилей и автобусов, электростанций и внедорожного оборудования.
NO 2 образуется в результате выбросов легковых, грузовых автомобилей и автобусов, электростанций и внедорожного оборудования.
Воздействие NO
2Воздействие на здоровье
Воздух для дыхания с высокой концентрацией NO 2 может вызывать раздражение дыхательных путей в дыхательной системе человека.Такое воздействие в течение коротких периодов времени может усугубить респираторные заболевания, особенно астму, приводя к респираторным симптомам (таким как кашель, хрипы или затрудненное дыхание), госпитализации и обращению в отделения неотложной помощи. Более длительное воздействие повышенных концентраций NO 2 может способствовать развитию астмы и потенциально повышать восприимчивость к респираторным инфекциям. Люди, страдающие астмой, а также дети и пожилые люди, как правило, подвергаются большему риску воздействия на здоровье NO 2 .
NO 2 вместе с другими NO x вступает в реакцию с другими химическими веществами в воздухе с образованием твердых частиц и озона.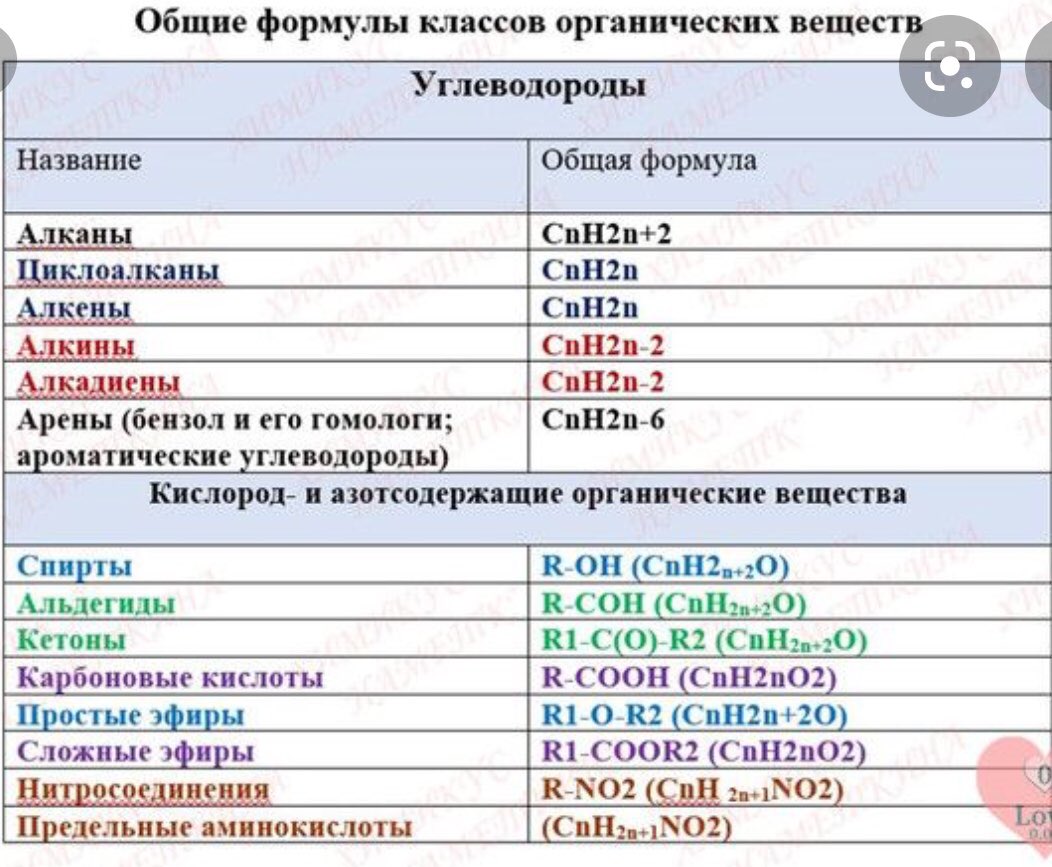 Оба они также вредны при вдыхании из-за воздействия на дыхательную систему.
Оба они также вредны при вдыхании из-за воздействия на дыхательную систему.
Воздействие на окружающую среду
NO 2 и другие NO x взаимодействуют с водой, кислородом и другими химическими веществами в атмосфере с образованием кислотных дождей. Кислотные дожди наносят вред уязвимым экосистемам, таким как озера и леса.
Нитратные частицы, образующиеся в результате NO x , делают воздух мутным и трудно различимым.Это влияет на многие национальные парки, которые мы посещаем ради просмотра.
NO x в атмосфере способствует загрязнению прибрежных вод питательными веществами.
Что делается для уменьшения загрязнения NO
2 ?Национальные и региональные правила EPA по сокращению выбросов NO 2 и NO x помогут правительствам штатов и местным властям соответствовать Национальному стандарту качества окружающего воздуха (NAAQS).
EPA определяет районы, где качество воздуха не соответствует национальным стандартам NO 2 . Для этих территорий правительства штатов, местных властей и племен разрабатывают планы по сокращению количества NO 2 в воздухе.
Для этих территорий правительства штатов, местных властей и племен разрабатывают планы по сокращению количества NO 2 в воздухе.
Молекулы и химическая номенклатура — Вводная химия — 1-е канадское издание
- Определите молекулу .
- Назовите простые молекулы на основе их формул.
- Определите формулу молекулы, основываясь на ее названии.
Есть много веществ, которые существуют в виде двух или более атомов, связанных вместе настолько прочно, что они ведут себя как единая частица.Эти многоатомные комбинации называются молекулами. Молекула — это наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества. В некоторых отношениях молекула похожа на атом. Однако молекула состоит из более чем одного атома.
Некоторые элементы существуют в природе в виде молекул. Например, водород и кислород существуют в виде двухатомных молекул. Другие элементы также существуют в природе в виде двухатомных молекул (см. Список «Элементы, которые существуют в виде двухатомных молекул»).Как и в случае с любой молекулой, эти элементы помечены молекулярной формулой, формальным списком того, что и сколько атомов находится в молекуле. (Иногда используется только слово , формула , и его значение определяется из контекста.) Например, молекулярная формула для элементарного водорода — H 2 , где H является символом водорода, а нижний индекс 2 означает, что существует два атома этого элемента в молекуле. Другие двухатомные элементы имеют аналогичные формулы: O 2 , N 2 и т. Д.Другие элементы существуют в виде молекул — например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. Рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем предполагать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле есть только один атом, если справа от символа элемента нет числового индекса.
Список «Элементы, которые существуют в виде двухатомных молекул»).Как и в случае с любой молекулой, эти элементы помечены молекулярной формулой, формальным списком того, что и сколько атомов находится в молекуле. (Иногда используется только слово , формула , и его значение определяется из контекста.) Например, молекулярная формула для элементарного водорода — H 2 , где H является символом водорода, а нижний индекс 2 означает, что существует два атома этого элемента в молекуле. Другие двухатомные элементы имеют аналогичные формулы: O 2 , N 2 и т. Д.Другие элементы существуют в виде молекул — например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. Рис. 3.3 «Молекулярное искусство S»). В противном случае мы будем предполагать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле есть только один атом, если справа от символа элемента нет числового индекса.
Ниже приводится список элементов, которые существуют в виде двухатомных молекул:
- водород
- кислород
- азот
- фтор
- хлор
- бром
- йод
Рисунок 3.3 «Молекулярное искусство молекул S 8 и P 4 ». Если каждый зеленый шар представляет собой атом серы, то диаграмма слева представляет молекулу S 8 . Молекула справа показывает, что существует одна форма элементарного фосфора в виде четырехатомной молекулы.
Рисунок 3.3 «Молекулярное искусство S» показывает два примера того, как мы будем представлять молекулы в этом тексте. Атом представлен маленьким шаром или сферой, что обычно указывает, где находится ядро в молекуле.Цилиндрическая линия, соединяющая шары, представляет собой связь между атомами, которые превращают этот набор атомов в молекулу. Эта связь называется химической связью. В главе 9 «Химические связи» мы исследуем происхождение химических связей. В этой книге вы увидите другие примеры этого представления молекул «шар и цилиндр».
В этой книге вы увидите другие примеры этого представления молекул «шар и цилиндр».
Многие соединения существуют в виде молекул. В частности, когда неметаллы соединяются с другими неметаллами, соединение обычно существует в виде молекул.(Соединения между металлом и неметаллом различаются и рассматриваются в разделе «Ионы и ионные соединения».) Кроме того, в некоторых случаях существует много разных типов молекул, которые могут образовываться между любыми заданными элементами, причем все разные молекулы имеют разные химические и физические свойства. Как их отличить?
Ответ — очень специфическая система именования соединений, называемая химической номенклатурой. Следуя правилам номенклатуры, каждое соединение имеет свое собственное уникальное имя, и каждое имя относится к одному и только одному соединению.Здесь мы начнем с относительно простых молекул, содержащих только два элемента, так называемых бинарных соединений :
- Определите элементы в молекуле по ее формуле.
 Вот почему вам необходимо знать имена и символы элементов в Таблице 3.8 «Имена и символы общих элементов».
Вот почему вам необходимо знать имена и символы элементов в Таблице 3.8 «Имена и символы общих элементов». - Начните имя с имени элемента первого элемента. Если в молекулярной формуле содержится более одного атома этого элемента, используйте числовой префикс, чтобы указать количество атомов, как указано в таблице 3.6 «Числовые префиксы, используемые для наименования молекулярных соединений». Не используйте префикс mono- , если есть только один атом первого элемента.
Таблица 3.6. Числовые префиксы, используемые при наименовании молекулярных соединений Число атомов элемента Префикс 1 моно- 2 di- 3 три- 4 тетра- 5 пента- 6 гекса- 7 гепта- 8 окта- 9 нона- 10 дека- -
Назовите второй элемент, используя три части:
- числовой префикс, указывающий количество атомов второго элемента, плюс
- основа имени элемента (e.
 г., окс для кислорода, хлор для хлора и т. д.), плюс
г., окс для кислорода, хлор для хлора и т. д.), плюс - суффикс — ide .
- Объедините два слова, оставив между ними пробел.
Давайте посмотрим, как эти шаги работают для молекулы с молекулярной формулой SO 2 , которая имеет один атом серы и два атома кислорода — это завершает шаг 1. Согласно шагу 2 мы начинаем с имени первого элемента. — сера. Помните, что мы не используем префикс mono- для первого элемента.Теперь для шага 3 мы объединяем числовой префикс di- (см. Таблицу 3.6 «Числовые префиксы, используемые при именовании молекулярных соединений») с основанием ox- и суффиксом -ide , чтобы получить диоксид . Объединив эти два слова, мы получим уникальное название этого соединения — диоксид серы.
К чему все эти неприятности? Существует еще одно распространенное соединение, состоящее из серы и кислорода, молекулярная формула которого SO 3 , поэтому необходимо различать эти соединения.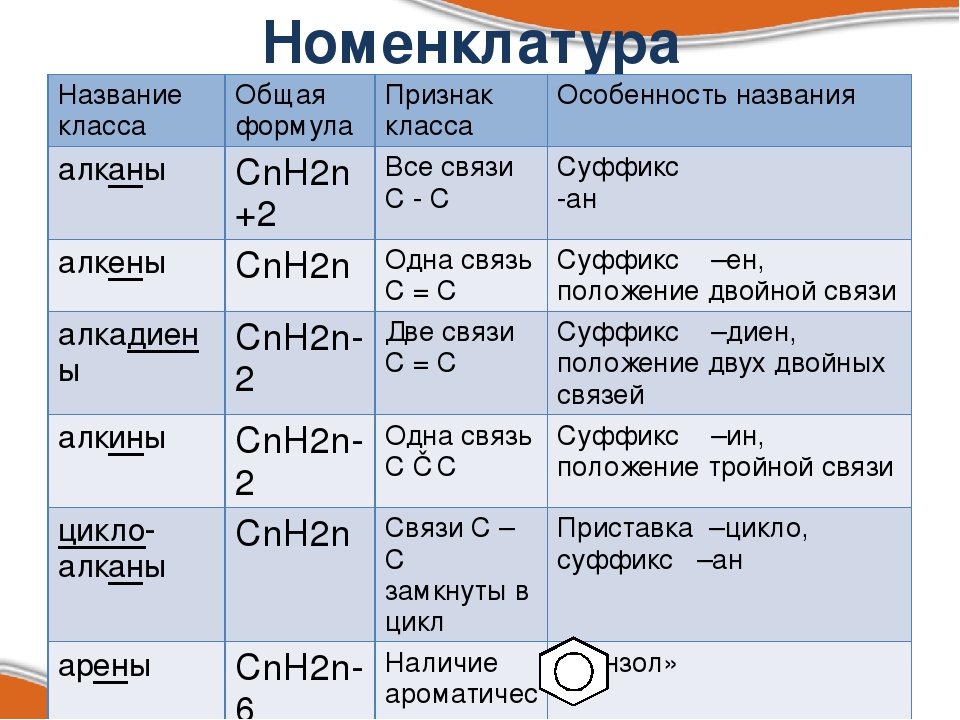 SO 3 содержит три атома кислорода, поэтому это другое соединение с разными химическими и физическими свойствами. Система химической номенклатуры предназначена для присвоения этому соединению собственного уникального названия . Его имя, если пройти все этапы, — триоксид серы. Разные соединения имеют разные названия.
SO 3 содержит три атома кислорода, поэтому это другое соединение с разными химическими и физическими свойствами. Система химической номенклатуры предназначена для присвоения этому соединению собственного уникального названия . Его имя, если пройти все этапы, — триоксид серы. Разные соединения имеют разные названия.
В некоторых случаях, когда префикс заканчивается на a или o , а имя элемента начинается с o , мы добавляем в префикс a или o .Таким образом, мы видим монооксид или пентоксид , а не монооксид или пентаоксид в названиях молекул.
В этой системе замечательно то, что она работает в обоих направлениях. По названию соединения вы сможете определить его молекулярную формулу. Просто перечислите символы элементов с числовым нижним индексом, если существует более одного атома этого элемента, в порядке имени (мы не используем нижний индекс 1, если присутствует только один атом элемента; подразумевается 1) . Из названия трихлорид азота , вы должны получить NCl 3 в качестве формулы для этой молекулы. Из названия пятиокись дифосфора вы должны получить формулу P 2 O 5 (обратите внимание на числовой префикс на первом элементе, указывающий, что в формуле содержится более одного атома фосфора).
Из названия трихлорид азота , вы должны получить NCl 3 в качестве формулы для этой молекулы. Из названия пятиокись дифосфора вы должны получить формулу P 2 O 5 (обратите внимание на числовой префикс на первом элементе, указывающий, что в формуле содержится более одного атома фосфора).
Назовите каждую молекулу.
- ПФ 3
- CO
- SE 2 Br 2
Решения
- Молекула с одним атомом фосфора и тремя атомами фтора называется трифторидом фосфора.
- Соединение с одним атомом углерода и одним атомом кислорода правильно называется монооксидом углерода, а не монооксидом углерода.
- Есть два атома каждого элемента, селена и брома. Согласно правилам, собственное имя здесь — дибромид диселена.
Назовите каждую молекулу.
- SF 4
- P 2 S 5
Ответы
- тетрафторид серы
- пентасульфид дифосфора
Приведите формулу каждой молекулы.
- четыреххлористый углерод
- диоксид кремния
- тетранитрид трисиликония
Решения
- Название четыреххлористый углерод подразумевает один атом углерода и четыре атома хлора, поэтому формула — CCl 4 .
- Название диоксид кремния подразумевает один атом кремния и два атома кислорода, поэтому формула SiO 2 .
- У нас есть имя с числовыми префиксами на обоих элементах. Три- означает три, а тетра- означает четыре, поэтому формула этого соединения: Si 3 N 4 .
Приведите формулу каждой молекулы.
- дифторид дисеры
- пентабромид йода
Ответы
- S 2 F 2
- IBr 5
У некоторых простых молекул есть общие названия, которые мы используем как часть формальной системы химической номенклатуры. Например, H 2 O дается название вода , а не монооксид дигидрогена . NH 3 называется аммиак , а CH 4 называется метан .Время от времени мы будем видеть другие молекулы с общими названиями; мы укажем на них по мере их появления.
NH 3 называется аммиак , а CH 4 называется метан .Время от времени мы будем видеть другие молекулы с общими названиями; мы укажем на них по мере их появления.
- Молекулы — это группы атомов, которые ведут себя как единое целое.
- Некоторые элементы существуют в виде молекул: водород, кислород, сера и так далее.
- Существуют правила, которые могут выражать уникальное имя для любой данной молекулы и уникальную формулу для любого данного имени.
- Какие из этих формул представляют молекулы? Укажите, сколько атомов в каждой молекуле.
- Fe
- PCl 3
- П 4
- Ar
- Какие из этих формул представляют молекулы? Укажите, сколько атомов в каждой молекуле.
- I 2
- He
- H 2 O
- Al
- В чем разница между CO и Co?
- В чем разница между H 2 O и H 2 O 2 (перекись водорода)?
- Приведите правильную формулу для каждого двухатомного элемента.
- В 1986 году, когда комета Галлея в последний раз пролетела над Землей, астрономы обнаружили присутствие S 2 в свои телескопы. Почему сера не считается двухатомным элементом?
- Какая основа фтора используется в названиях молекул? CF 4 является одним из примеров.
- Какая основа селена используется в названиях молекул? SiSe 2 является примером.
- Дайте название каждой молекуле.
- ПФ 3
- TeCl 2
- N 2 O 3
- Дайте название каждой молекуле.
- НЕТ
- КС 2
- As 2 O 3
- Дайте название каждой молекуле.
- XeF 2
- O 2 F 2
- SF 6
- Дайте название каждой молекуле.
- П 4 О 10
- В 2 О 3
- P 2 S 3
- Дайте название каждой молекуле.

- N 2 O
- N 2 O 4
- N 2 O 5
- Дайте название каждой молекуле.
- SEO 2
- Класс 2 O
- XeF 6
- Приведите правильную формулу для каждого имени.
- пятиокись азота
- трикарбид тетрабора
- пентахлорид фосфора
- Приведите правильную формулу для каждого имени.
- трииодид азота
- трисульфид ди мышьяка
- трихлорид йода
- Приведите правильную формулу для каждого имени.
- дихлорид кислорода
- трисульфид диазота
- тетрафторид ксенона
- Приведите правильную формулу для каждого имени.
- диоксид хлора
- дибромид селена
- диоксид азота
- Приведите правильную формулу для каждого имени.
- трифторид йода
- триоксид ксенона
- декафторид дисеры
- Приведите правильную формулу для каждого имени.
- диоксид германия
- сероуглерод
- дибромид диселена
-
- не молекула
- молекула; всего четыре атома
- молекула; всего четыре атома
- не молекула
- СО представляет собой соединение углерода и кислорода; Со — элемент кобальт.
- H 2 , O 2 , N 2 , F 2 , Cl 2 , Br 2 , I 2
- фтор-
-
- трифторид фосфора
- дихлорид теллура
- диоксид азота
-
- дифторид ксенона
- дифторид кислорода
- гексафторид серы
-
- диоксид азота
- тетроксид диазота
- пятиокись азота
-
- N 2 O 5
- В 4 В 3
- PCl 5
-
- O 2 Класс 2
- N 2 S 3
- XeF 4
-
- IF 3
- XeO 3
- S 2 F 10
Атрибуция в СМИ
Рисунок 3. 3
3
Как растения получают азот из воздуха?
Категория: Химия Опубликовано: 21 февраля 2014 г.
Растения получают азот из почвы, а не напрямую из воздуха. Public Domain Image, источник: Кристофер С. Бэрд.
Растения не получают азот непосредственно из воздуха. Хотя азот является наиболее распространенным элементом в воздухе, каждый атом азота в воздухе имеет тройную связь с другим атомом азота с образованием молекулярного азота, N 2 .Эта тройная связь очень прочная, и ее очень трудно разорвать (для разрыва химических связей требуется энергия, тогда как энергия высвобождается только при их образовании). В результате, хотя азот в воздухе очень распространен, для растения энергетически невыгодно расщеплять молекулу азота, чтобы получить необработанные атомы, которые оно может использовать. Сильная тройная связь N 2 также затрудняет реакцию молекулярного азота с большинством других химических веществ. Фактически, это отчасти причина того, что в воздухе так много азота. Кроме того, стабильность и симметрия молекулы азота затрудняют связывание различных молекул азота друг с другом. Это свойство означает, что молекулярный азот можно охладить до очень низких температур, прежде чем он станет жидким, что делает жидкий азот очень эффективной криогенной жидкостью.
Кроме того, стабильность и симметрия молекулы азота затрудняют связывание различных молекул азота друг с другом. Это свойство означает, что молекулярный азот можно охладить до очень низких температур, прежде чем он станет жидким, что делает жидкий азот очень эффективной криогенной жидкостью.
Акт разрушения двух атомов в молекуле азота называется «фиксацией азота». Растения получают необходимый им азот из почвы, где он уже закреплен бактериями и археями.Бактерии и археи в почве и корнях некоторых растений обладают способностью преобразовывать молекулярный азот воздуха (N 2 ) в аммиак (NH 3 ), тем самым разрывая прочную тройную связь молекулярного азота. Такие организмы называют «диазотрофами». Отсюда различные микроорганизмы превращают аммиак в другие соединения азота, которые легче использовать растениям. Таким образом, растения получают азот косвенно из воздуха через микроорганизмы в почве и в некоторых корнях растений.Обратите внимание, что молния и солнечное излучение высокой энергии также могут расщеплять молекулу азота и, следовательно, также фиксировать азот в воздухе. Однако количество азота, фиксируемого молнией и солнечной радиацией, незначительно по сравнению с количеством, фиксируемым диазотрофами в почве и корнях. В своей книге «Азотная фиксация» Джон Постгейт утверждает: «
Однако количество азота, фиксируемого молнией и солнечной радиацией, незначительно по сравнению с количеством, фиксируемым диазотрофами в почве и корнях. В своей книге «Азотная фиксация» Джон Постгейт утверждает: «
Фиксация азота — преобразование атмосферного азота в форму, которую могут использовать растения — является фундаментальным процессом в мировом сельском хозяйстве.Это происходит в результате спонтанной, антропогенной и биологической деятельности. Существование и важность биологического компонента были признаны более века, но научные достижения за последние несколько десятилетий радикально изменили наше понимание его природы и механизмов.
Биологический цикл азота в решающей степени зависит от обитающих в почве и корнях бактерий и архей, которые расщепляют молекулы азота из воздуха.Public Domain Image, источник: EPA.
Темы: воздух, аммиак, атмосфера, диазотроф, азот, азотфиксация, растения
Universal Industrial Gases, Inc .
 .. Свойства азота N2, использование, применение
Многоотраслевое использование азота:
.. Свойства азота N2, использование, применение
Многоотраслевое использование азота: Инертные свойства азота делают его хорошим защитный газ для многих применений. Азот Покрытие используется для защиты легковоспламеняющихся или взрывоопасных твердых веществ и жидкости от контакта с воздухом.Некоторые химические вещества, поверхности твердые вещества и хранящиеся пищевые продукты обладают свойствами, которые необходимо защищать от разложение под воздействием атмосферного кислорода и влаги. Защита достигается за счет содержания этих предметов в (под) азотной атмосфере. «Инертинг» или «набивка» — это другие термины, используемые для описания вытеснения воздуха и азотная подушка.
«Промывание»
с азотом — это барботирование газообразного азота через жидкость для удаления
нежелательные летучие компоненты, включая летучие органические соединения (ЛОС)
что может быть необходимо для соблюдения правил сокращения загрязнения.
Некоторые вещества трудно измельчить или измельчить, потому что они жесткие, иначе они будут деградированы тепло, выделяемое механическими процессами, такими как шлифование. Жидкий азот можно использовать для замораживания мягких или вязких веществ перед их ввод в процесс уменьшения размера. Баллон с холодным испарением азота использоваться для охлаждения материалов (и в инертной атмосфере) во время измельчения. Криогенное измельчение используется в различных областях, в том числе при производстве измельченные фармацевтические препараты, пластмассы и пигменты; и для измельчения шин в заводы по переработке отходов.
Металлы Использование азота в производстве:
Азот используется для обработки расплава при производстве стали и других металлов, а также в качестве защитного газа при термообработке чугуна, стали и других металлов. Он также используется в качестве технологического газа вместе с другими газами для снижения карбонизации и азотирования.
Вспышка или ребра на литом металле удаляются охлаждением жидким азотом, что делает их хрупкими, и позволяет они должны быть разрушены механическим воздействием.
Использование в производстве и строительстве:
Термоусадочный фитинг — интересная альтернатива традиционному расширительному фитингу. Вместо того, чтобы нагревать внешнюю металлическую часть, внутренняя часть охлаждается жидким азотом, так что металл сжимается и может быть вставлен. Когда металл возвращается к своей нормальной температуре, он расширяется до исходного размера, обеспечивая очень плотную посадку.
Жидкий азот используется для охлаждения бетона во время его заливки и укладки. Более медленное отверждение приводит к лучшему отверждению характеристики.
Когда
строительные работы должны выполняться на мягком, пропитанном водой грунте, например, при строительстве туннелей под водотоками, грунт может быть эффективно заморожен жидким азотом. Трубы вбиваются в землю, жидкий азот по трубам прокачивается под землей. Когда азот попадает в почву, он испаряется, отводя тепло от почвы и замораживая ее.
Трубы вбиваются в землю, жидкий азот по трубам прокачивается под землей. Когда азот попадает в почву, он испаряется, отводя тепло от почвы и замораживая ее.
Химическая, фармацевтическая и нефтяная промышленность:
Нефтеперерабатывающие заводы, нефтехимические заводы и морские танкеры используют азот для очистки оборудования, резервуаров и трубопроводов от опасных паров и газов (например, после завершение операции транспортировки по трубопроводу или завершение производственного цикла) и для поддержания инертной и защитной атмосферы в резервуарах для хранения легковоспламеняющихся жидкостей.
Холодный газообразный азот используется для охлаждения реакторов, заполненных катализатором, при проведении ремонтных работ. Время охлаждения можно существенно сократить.
Охлаждение
реакторы (и материалы внутри) работают до низкой температуры, что позволяет лучше контролировать побочные реакции в сложных реакциях
в фармацевтической промышленности. Жидкий азот часто используется для обеспечения
необходимое охлаждение, так как оно может привести к быстрому снижению температуры
и затем может легко поддерживать желаемые температуры холодной реакции.Охлаждение реактора и
в системах контроля температуры обычно используется
циркулирующий низкотемпературный теплоноситель для передачи холода
производится путем испарения жидкого азота в
оболочка
корпус реактора. Жидкий азот испаряется в специально разработанных
теплообменники, передающие охлаждение циркулирующему теплу
переносящая жидкость.
Жидкий азот часто используется для обеспечения
необходимое охлаждение, так как оно может привести к быстрому снижению температуры
и затем может легко поддерживать желаемые температуры холодной реакции.Охлаждение реактора и
в системах контроля температуры обычно используется
циркулирующий низкотемпературный теплоноситель для передачи холода
производится путем испарения жидкого азота в
оболочка
корпус реактора. Жидкий азот испаряется в специально разработанных
теплообменники, передающие охлаждение циркулирующему теплу
переносящая жидкость.
Жидкий азот используется при заканчивании газовой скважины для «гидроразрыва».
природные газоносные горные образования, в частности, плотные газовые образования,
в том числе сланцевый газ и природный газ из угля (метан угольных пластов)
где следует избегать гидроразрыва пласта.Азот также используется для поддержания давления в нефти и природном газе.
добывающие формации. В отличие от углекислого газа, который также используется для
наддув, азот мало
сродство к жидким углеводородам, поэтому оно накапливается и остается
в бензобаке.
В отличие от углекислого газа, который также используется для
наддув, азот мало
сродство к жидким углеводородам, поэтому оно накапливается и остается
в бензобаке.
Азот используется в качестве инертного газа для проталкивания жидкостей через линии, чтобы очистить линии. и прогонять «скребков» по трубопроводам, чтобы выметать один материал перед использование линии для транспортировки другого материала.
Резина и Использование в пластмассовой промышленности:
Материалы становятся твердыми и хрупкими при охлаждении до очень низких температур. Это свойство позволяет удалять вспышки или плавники при гипсе. пластмассы и резина. Отливки охлаждаются жидким азотом, а вспышка прерывается механическим воздействием.
Еда и напитки:
Сильный холод
в
жидкий азот позволяет очень быстро замораживать продукты, в результате
повреждение клеток кристаллами льда и улучшение внешнего вида, вкуса и текстуры. Хорошо спроектированные криогенные туннели и спиральные морозильные камеры эффективно улавливают
охлаждение из-за испарения жидкости и из-за потока холодного газообразного азота
через морозильную камеру.
Хорошо спроектированные криогенные туннели и спиральные морозильные камеры эффективно улавливают
охлаждение из-за испарения жидкости и из-за потока холодного газообразного азота
через морозильную камеру.
При хранении таких веществ, как растительное масло и вино, инертные свойства азота могут использоваться для защищать от потери качества из-за окисления, удаляя воздух, захваченный жидкостью (барботирование) и защита жидкостей в резервуарах для хранения путем заполнения парового пространства (покрытия).
Азот (и азот смешанный с CO2 и кислородом) используется в транспортных средствах и в упаковке в модифицированной атмосфере (MAP) для продлить срок хранения упакованных пищевых продуктов, предотвращая окисление, плесень, насекомых заражение и миграция влаги.
Здоровье Использование для ухода:
Азот
используется в качестве защитного газа при упаковке некоторых лекарств для предотвращения
разложение путем окисления или адсорбции влаги.
Азот используется для заморозить кровь, а также вирусы для вакцинации. Он также используется для замораживания семени домашнего скота, которое затем может храниться годами. Быстрое замораживание в результате сильного холода сводит к минимуму повреждение клеточной стенки. Жидкий азот также используется в некоторых МРТ (магнитных Resonance Imaging) для предварительного охлаждения низкотемпературных магнитов перед к использованию гораздо более дорогого жидкого гелия для окончательного охлаждения.
Жидкий азот используется в криохирургии для разрушения пораженных тканей.
Разное использование азота:
Азот используется непосредственно в качестве охлаждающей жидкости для тяжелых экологических испытаний многих изделий, или в качестве источника холода для охлаждения циркулирующего сухого воздуха.
Молекулы и химическая номенклатура
3.
 2 Молекулы и химическая номенклатура
2 Молекулы и химическая номенклатура
Цели обучения
- Определите молекулу .
- Назовите простые молекулы на основе их формул.
- Определите формулу молекулы, основываясь на ее названии.
Есть много веществ, которые существуют в виде двух или более атомов, связанных вместе настолько прочно, что они ведут себя как единая частица. Эти многоатомные комбинации называются молекулами. Наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества. Молекула — это наименьшая часть вещества, обладающая физическими и химическими свойствами этого вещества.В некоторых отношениях молекула похожа на атом. Однако молекула состоит из более чем одного атома.
Некоторые элементы существуют в природе в виде молекул. Например, водород и кислород существуют в виде двухатомных молекул. Другие элементы также существуют в природе в виде двухатомных молекул — молекулы всего с двумя атомами. (см. Таблицу 3.3 «Элементы, которые существуют в виде двухатомных молекул»). Как и в случае с любой молекулой, эти элементы помечены молекулярной формулой — формальным списком того, что и сколько атомов находится в молекуле., формальный список того, что и сколько атомов находится в молекуле. (Иногда используется только слово , формула , и его значение определяется из контекста.) Например, молекулярная формула для элементарного водорода — H 2 , где H является символом водорода, а нижний индекс 2 означает, что существует два атома этого элемента в молекуле. Другие двухатомные элементы имеют аналогичные формулы: O 2 , N 2 и т. Д. Другие элементы существуют в виде молекул — например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. Рисунок 3.3 «Молекулярное искусство S»). В противном случае мы будем предполагать, что элементы существуют в виде отдельных атомов, а не молекул.
(см. Таблицу 3.3 «Элементы, которые существуют в виде двухатомных молекул»). Как и в случае с любой молекулой, эти элементы помечены молекулярной формулой — формальным списком того, что и сколько атомов находится в молекуле., формальный список того, что и сколько атомов находится в молекуле. (Иногда используется только слово , формула , и его значение определяется из контекста.) Например, молекулярная формула для элементарного водорода — H 2 , где H является символом водорода, а нижний индекс 2 означает, что существует два атома этого элемента в молекуле. Другие двухатомные элементы имеют аналогичные формулы: O 2 , N 2 и т. Д. Другие элементы существуют в виде молекул — например, сера обычно существует в виде восьмиатомной молекулы, S 8 , а фосфор существует в виде четырехатомной молекулы, P 4 (см. Рисунок 3.3 «Молекулярное искусство S»). В противном случае мы будем предполагать, что элементы существуют в виде отдельных атомов, а не молекул. Предполагается, что в формуле есть только один атом, если справа от символа элемента нет числового индекса.
Предполагается, что в формуле есть только один атом, если справа от символа элемента нет числового индекса.
Таблица 3.3 Элементы, которые существуют в виде двухатомных молекул
| Водород |
| Кислород |
| Азот |
| Фтор |
| Хлор |
| Бром |
| Йод |
Рисунок 3.3 Молекулярное искусство S 8 и P 4 Молекулы
Если каждый зеленый шар представляет собой атом серы, то диаграмма слева представляет молекулу S 8 . Молекула справа показывает, что существует одна форма элементарного фосфора в виде четырехатомной молекулы.
Рисунок 3.3 «Молекулярное искусство S» показывает два примера того, как мы будем представлять молекулы в этом тексте. Атом представлен маленьким шаром или сферой, что обычно указывает, где находится ядро в молекуле.Цилиндрическая линия, соединяющая шары, представляет собой связь между атомами, которые превращают этот набор атомов в молекулу. Эта связь называется химической связью. Связь между двумя атомами в молекуле. В главе 9 «Химические связи» мы исследуем происхождение химических связей. В этой книге вы увидите другие примеры этого представления молекул «шар и цилиндр».
Атом представлен маленьким шаром или сферой, что обычно указывает, где находится ядро в молекуле.Цилиндрическая линия, соединяющая шары, представляет собой связь между атомами, которые превращают этот набор атомов в молекулу. Эта связь называется химической связью. Связь между двумя атомами в молекуле. В главе 9 «Химические связи» мы исследуем происхождение химических связей. В этой книге вы увидите другие примеры этого представления молекул «шар и цилиндр».
Многие соединения существуют в виде молекул. В частности, когда неметаллы соединяются с другими неметаллами, соединение обычно существует в виде молекул.(Соединения между металлом и неметаллом различаются и будут рассмотрены в разделе 3.4 «Ионы и ионные соединения».) Кроме того, в некоторых случаях существует много разных типов молекул, которые могут образовываться между любыми заданными элементами, со всеми различными молекулы, обладающие разными химическими и физическими свойствами. Как их отличить?
Ответ — очень специфическая система наименования соединений, называемая химической номенклатурой. Очень специфическая система наименования соединений, в которой уникальные вещества получают уникальные названия.. Следуя правилам номенклатуры, каждое соединение имеет свое собственное уникальное имя, и каждое имя относится к одному и только одному соединению. Здесь мы начнем с относительно простых молекул, содержащих только два элемента, так называемых бинарных соединений :
Очень специфическая система наименования соединений, в которой уникальные вещества получают уникальные названия.. Следуя правилам номенклатуры, каждое соединение имеет свое собственное уникальное имя, и каждое имя относится к одному и только одному соединению. Здесь мы начнем с относительно простых молекул, содержащих только два элемента, так называемых бинарных соединений :
- Определите элементы в молекуле по ее формуле. Вот почему вам необходимо знать названия и символы элементов в Таблице 3.2 «Названия и символы общих элементов».
-
Начните имя с имени элемента первого элемента.Если в молекулярной формуле содержится более одного атома этого элемента, используйте числовой префикс для обозначения количества атомов, как указано в Таблице 3.4 «Числовые префиксы, используемые при наименовании молекулярных соединений». Не используйте префикс mono- , если есть только один атом первого элемента.
Таблица 3.
 4 Числовые префиксы, используемые в именах молекулярных соединений
4 Числовые префиксы, используемые в именах молекулярных соединений Число атомов элемента Префикс 1 моно- 2 di- 3 три- 4 тетра- 5 пента- 6 гекса- 7 гепта- 8 окта- 9 нона- 10 дека- -
Назовите второй элемент, используя три части:
- числовой префикс, указывающий количество атомов второго элемента, плюс
- основа имени элемента (e.
 г., окс для кислорода, хлор для хлора и т. д.), плюс
г., окс для кислорода, хлор для хлора и т. д.), плюс - суффикс -ide .
- Объедините два слова, оставив между ними пробел.
Давайте посмотрим, как эти шаги работают для молекулы с молекулярной формулой SO 2 , которая имеет один атом серы и два атома кислорода — это завершает шаг 1. Согласно шагу 2 мы начинаем с имени первого элемента. — сера.Помните, что мы не используем префикс mono- для первого элемента. Теперь для шага 3 мы объединяем числовой префикс di- (см. Таблицу 3.4 «Числовые префиксы, используемые для наименования молекулярных соединений») со стержнем ox- и суффиксом -ide , чтобы получить диоксид . Объединив эти два слова, мы получим уникальное название этого соединения — диоксид серы.
К чему все эти неприятности? Существует еще одно распространенное соединение, состоящее из серы и кислорода, молекулярная формула которого SO 3 , поэтому необходимо различать эти соединения. SO 3 содержит три атома кислорода, поэтому это другое соединение с разными химическими и физическими свойствами. Система химической номенклатуры предназначена для присвоения этому соединению собственного уникального названия . Его имя, если пройти все этапы, — триоксид серы. Разные соединения имеют разные названия.
SO 3 содержит три атома кислорода, поэтому это другое соединение с разными химическими и физическими свойствами. Система химической номенклатуры предназначена для присвоения этому соединению собственного уникального названия . Его имя, если пройти все этапы, — триоксид серы. Разные соединения имеют разные названия.
В некоторых случаях, когда префикс заканчивается на a или o , а имя элемента начинается с o , мы добавляем в префикс a или o .Таким образом, мы видим монооксид или пентоксид , а не монооксид или пентаоксид в названиях молекул.
В этой системе замечательно то, что она работает в обоих направлениях. По названию соединения вы сможете определить его молекулярную формулу. Просто перечислите символы элементов с числовым нижним индексом, если существует более одного атома этого элемента, в порядке имени (мы не используем нижний индекс 1, если присутствует только один атом элемента; подразумевается 1) . Из названия трихлорид азота , вы должны получить NCl 3 в качестве формулы для этой молекулы. Из названия пятиокись дифосфора вы должны получить формулу P 2 O 5 (обратите внимание на числовой префикс на первом элементе, указывающий, что в формуле содержится более одного атома фосфора).
Из названия трихлорид азота , вы должны получить NCl 3 в качестве формулы для этой молекулы. Из названия пятиокись дифосфора вы должны получить формулу P 2 O 5 (обратите внимание на числовой префикс на первом элементе, указывающий, что в формуле содержится более одного атома фосфора).
Пример 3
Назовите каждую молекулу.
- ПФ 3
- CO
- SE 2 Br 2
Решение
- Молекула с одним атомом фосфора и тремя атомами фтора называется трифторидом фосфора.
- Соединение с одним атомом углерода и одним атомом кислорода правильно называется монооксидом углерода, а не монооксидом углерода.
- Есть два атома каждого элемента, селена и брома. По правилам здесь собственное наименование дибромид диселена .
Проверьте себя
Назовите каждую молекулу.
- SF 4
- P 2 S 5
Ответы
- тетрафторид серы
- пентасульфид дифосфора
Пример 4
Приведите формулу каждой молекулы.
- четыреххлористый углерод
- диоксид кремния
- тетранитрид трисиликония
Решение
- Название четыреххлористый углерод подразумевает один атом углерода и четыре атома хлора, поэтому формула — CCl 4 .
- Название диоксид кремния подразумевает один атом кремния и два атома кислорода, поэтому формула — SiO 2 .
- У нас есть имя с числовыми префиксами на обоих элементах. Tri- означает три, а тетра- означает четыре, поэтому формула этого соединения — Si 3 N 4 .
Проверьте себя
Приведите формулу каждой молекулы.
- дифторид дисеры
- пентабромид йода
Ответы
- S 2 F 2
- IBr 5
У некоторых простых молекул есть общие названия, которые мы используем как часть формальной системы химической номенклатуры.Например, H 2 O дается название вода , а не монооксид дигидрогена . NH 3 называется аммиак , а CH 4 называется метан . Время от времени мы будем видеть другие молекулы с общими названиями; мы укажем на них по мере их появления.
Основные выводы
- Молекулы — это группы атомов, которые ведут себя как единое целое.
- Некоторые элементы существуют в виде молекул: водород, кислород, сера и так далее.

- Существуют правила, которые могут выражать уникальное имя для любой данной молекулы и уникальную формулу для любого данного имени.
Упражнения
-
Какие из этих формул представляют молекулы? Укажите, сколько атомов в каждой молекуле.
- Fe
- PCl 3
- П 4
- Ar
-
Какие из этих формул представляют молекулы? Укажите, сколько атомов в каждой молекуле.
- I 2
- He
- H 2 O
- Al
-
В чем разница между CO и Co?
-
В чем разница между H 2 O и H 2 O 2 (перекись водорода)?
-
Приведите правильную формулу для каждого двухатомного элемента.

-
В 1986 году, когда комета Галлея в последний раз проходила мимо Земли, астрономы обнаружили присутствие S 2 в свои телескопы. Почему сера не считается двухатомным элементом?
-
Какая основа фтора используется в названиях молекул? CF 4 является одним из примеров.
-
Какая основа селена используется в названиях молекул? SiSe 2 является примером.
-
Дайте каждой молекуле собственное имя.
- ПФ 3
- TeCl 2
- N 2 O 3
-
Дайте каждой молекуле собственное имя.

- НЕТ
- КС 2
- As 2 O 3
-
Дайте каждой молекуле собственное имя.
- XeF 2
- O 2 F 2
- SF 6
-
Дайте каждой молекуле собственное имя.
- P 4 O 10
- В 2 О 3
- P 2 S 3
-
Дайте каждой молекуле собственное имя.

- N 2 O
- N 2 O 4
- N 2 O 5
-
Дайте каждой молекуле собственное имя.
- SEO 2
- Класс 2 O
- XeF 6
-
Приведите правильную формулу для каждого имени.
- пятиокись азота
- трикарбид тетрабора
- пентахлорид фосфора
-
Приведите правильную формулу для каждого имени.
- трииодид азота
- трисульфид ди мышьяка
- трихлорид йода
-
Приведите правильную формулу для каждого имени.
- дихлорид кислорода
- трисульфид диазота
- тетрафторид ксенона
-
Приведите правильную формулу для каждого имени.
- диоксид хлора
- дибромид селена
- диоксид азота
-
Приведите правильную формулу для каждого имени.

- трифторид йода
- триоксид ксенона
- декафторид дисеры
-
Приведите правильную формулу для каждого имени.
- диоксид германия
- сероуглерод
- дибромид диселена
ответы
-
- не молекула
- молекула; всего четыре атома
- молекула; всего четыре атома
- не молекула
-
CO представляет собой соединение углерода и кислорода; Со — элемент кобальт.

-
H 2 , O 2 , N 2 , F 2 , Cl 2 , Br 2 , I 2
-
- трифторид фосфора
- дихлорид теллура
- диоксид азота
-
- дифторид ксенона
- дифторид кислорода
- гексафторид серы
-
- оксид азота
- тетроксид диазота
- пятиокись азота
вопросов и ответов — В чем разница между соединением и молекулой?
Предыдущий вопрос
(Что такое смесь?)
Вопросы и ответы Главный указатель
Следующий вопрос
(Что такое молекула?)
В чем разница между соединением и молекулой?
Соединение — это вещество, состоящее из двух или более различных элементов. Вода (H 2 O), поваренная соль (NaCl), диоксид углерода (CO 2 ), метан (CH 4 ) и хлорофилл (C 55 H 72 O 5 N 4 Mg) представляют собой несколько примеров соединений. Они являются составными, потому что каждый из них содержит более одного вида элементов. Такие вещества, как газообразный азот (N 2 ) и бакминстерфуллерен (C 60 ), являются соединениями , а не , поскольку они содержат только один вид элементов (газообразный азот содержит только азот, а бакминстерфуллерен содержит только углерод).
Вода (H 2 O), поваренная соль (NaCl), диоксид углерода (CO 2 ), метан (CH 4 ) и хлорофилл (C 55 H 72 O 5 N 4 Mg) представляют собой несколько примеров соединений. Они являются составными, потому что каждый из них содержит более одного вида элементов. Такие вещества, как газообразный азот (N 2 ) и бакминстерфуллерен (C 60 ), являются соединениями , а не , поскольку они содержат только один вид элементов (газообразный азот содержит только азот, а бакминстерфуллерен содержит только углерод).
Является ли что-то молекулой или нет, зависит от типа связи, которая образуется, когда его атомы соединяются вместе. В общем, электроны могут быть разделены между атомами (молекулярная связь) или электроны могут быть полностью удалены от одного атома и переданы другому (ионная связь). Молекулы имеют молекулярные связи.
Газообразный азот (N 2 ) представляет собой молекулу, потому что связь между атомами азота является молекулярной связью.