Метан молекулярная — Справочник химика 21
Как все неметаллы, углерод образует летучие соединения с водородом. Простейшее из них — метан. Молекулярная [c.92]При каталитическом крекинге потери водорода, ведущие к снижению выхода ценных продуктов — бензина и газойля, вызываются образованием легких газов (пропан, этан, этилен, метан, молекулярный водород) и воды (в результате сгорания в регенераторе). Водород может поступать из реактора в регенератор частично с углеводородами, прочно адсорбированными на катализаторе (кокс), или в виде жидких продуктов, механически увлекаемых или обратимо адсорбированных на катализаторе. Эффектив- [c.41]
Некоторые авторы пытались сопоставить радиационно-химические выходы с масс-спектрометрическими. Так, Дорфман [711 считает, что с масс-спектрометрическими данными можно сравнивать молекулярные выходы (выход молекулярных продуктов, определяемых без акцептирования свободных радикалов), а не общие выходы, так как последние часто изменяются по мере образования продуктов радиолиза.

Метан. Молекулярная формула метана СН,. Его строение [c.233]
Для предотвращения более глубокого проникновения воздуха (кислорода) в факельную трубу рекомендуется с учетом ветровой нагрузки продувать факельные трубы метаном со скоростью 0,9 м/с п азотом со скоростью 0,7 м/с. Установлена зависимость скорости продувочного газа от диаметра факельной трубы и молекулярной массы продувочного газа. [c.218]
Установлена зависимость скорости продувочного газа от диаметра факельной трубы и молекулярной массы продувочного газа. [c.218]
Методика предусматривает для разделения неуглеводородных компонентов и низкокипящих углеводородов (водород, кислород, азот, окись углерода, метан и этан) использование молекулярных сит типа 10-Х и 13-Х, а для разделения углеводородов Сз — С5 — трепела Зикеевского карьера, модифицированного вазелиновым маслом. [c.254]
Вследствие низкой чувствительности аргона и азота по отношению к кислороду, азоту, метану, окиси углерода и этану, последние определяют на колонке, заполненной молекулярными ситами, с применением в качестве газа-носителя водорода.
Молекулярные комплексы. Образование комплексов парафинов с мочевиной и тиомочевиной рассматривается в гл. XI. Парафины, находящиеся при нормальных условиях в газообразном состоянии (метан, этан, пропан и бутаны), образуют кристаллические гидраты с водой под давлением.
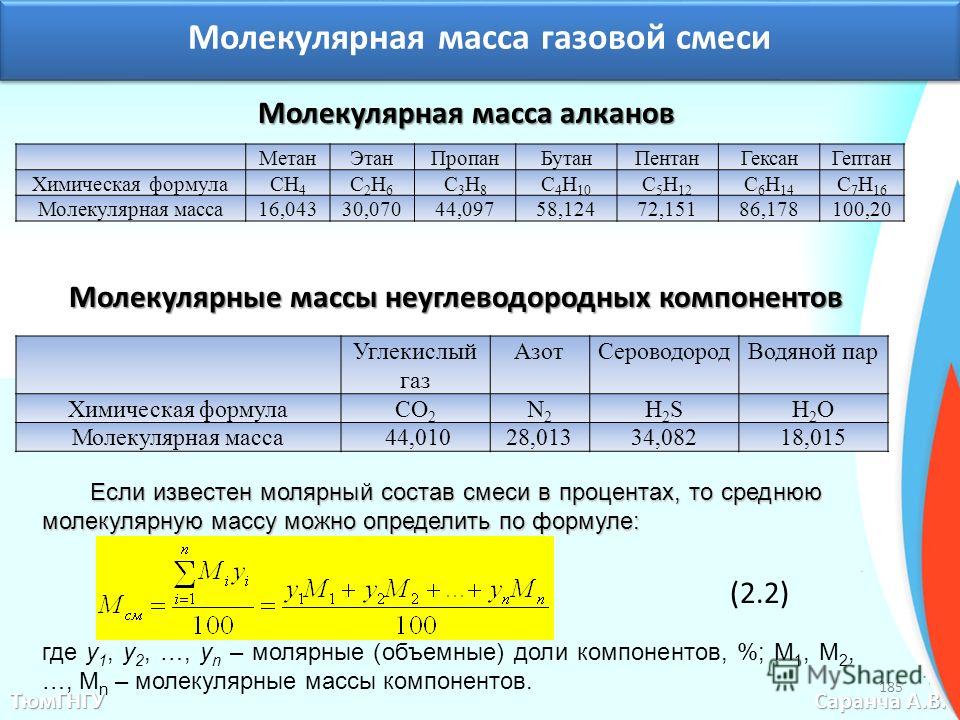 Эти гидраты имеют температуры плавления выше 0°, приблизительно до 21° вероятно, они выделяются при транспортировке природного газа под высоким давлением по газопроводам, поэтому и приходится обычно осушать газ, промывая его диэтиленгликолем под давлением [c.88]
Эти гидраты имеют температуры плавления выше 0°, приблизительно до 21° вероятно, они выделяются при транспортировке природного газа под высоким давлением по газопроводам, поэтому и приходится обычно осушать газ, промывая его диэтиленгликолем под давлением [c.88]Скорость окисления парафинов нормального строения увеличивается с ростом их молекулярного веса метан — наиболее трудно окисляемое соединение этого ряда. Несмотря на то что окисление (без катализаторов) метана начинается уже около 400 °С, процесс приобретает заметную скорость лишь при температуре около 575 °С, тогда как гомологи метана окисляются при более низкой температуре. [c.134]
Ароматические углеводороды в газовой фазе окисляются молекулярным кислородом (без катализаторов) хуже парафинов и олефинов, что связано с их более высокой стабильностью. Температура самовоспламенения смеси паров бензола с воздухом находится в пределах 562—645 °С, для парафиновых углеводородов она заметно ниже (534 °С для этана, 475 °С для пентана) исключение составляет только метан, который самовоспламеняется при 695 °С.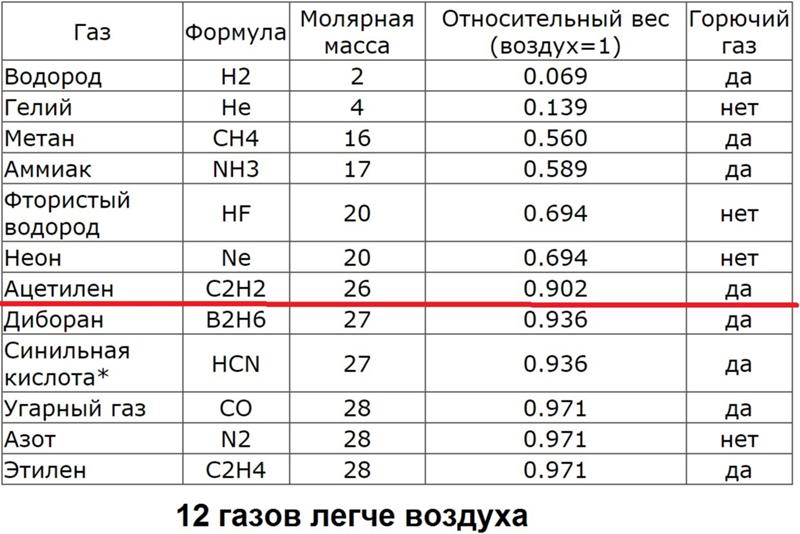 Недавно было доказано, что температура самовоспламенения зависит, [c.169]
Недавно было доказано, что температура самовоспламенения зависит, [c.169]
Легкие парафиновые углеводороды — жидкие метан, этан, пропан — не растворяют смолистых веществ. На этом основан процесс деасфальтизации гудронов жидким пропаном. С увеличением молекулярного веса парафиновых углеводородов растворяющая способность их несколько повышается.
Молекулярный водород при температуре выше 260 °С начинает распадаться с образованием атомарной формы. Такой водород, проникая в сталь, разрушает основные прочностные зерна и образует метан [c.150]
Отмеченная выше закономерность об уменьшении растворимости в сжатом метане УВ с увеличением их молекулярной массы имеет место и для ароматических УВ. [c.32]
Плотность углеводородных жидкостей. Плотность различных нефтей можно найти в стандартных таблицах. Однако, если нефть содержит значительное количество примесей с высокой упругостью паров (метан, этан, азот), то эти таблицы применять нельзя.
Содержание водорода в молекулярной системе можно повысить за счет введения водорода в газообразной форме, когда при благоприятных для взаимодействия реагентов условиях газификация протекает по реакции, иногда называемой гидрогенолизом. При отсутствии внешнего источника элементарного водорода его можно получать при определенных условиях на месте из пара. Полученный таким образом водород реагирует с углеводородным сырьем не хуже, чем чистый водород извне. В этом случае в результате так называемого процесса гидролиза образуются более легкие углеводороды, включая метан.
Плотность большинства горючих газов значительно отличается от плотности воздуха. Только этилен (молекулярная масса 28) и этан (мол. масса 30) имеют плотность, близкую к плотности воздуха, молекулярная масса которого считается равной 29. Метан значительно легче воздуха углеводороды, соединения которых содержат три и более атомов углерода, намного тяжелее воздуха. Даже незначительное различие по плотности может привести к существенному расслоению, доказательством чего является расслоение воздуха, происходящее в результате перепада температур. [c.279]
Только этилен (молекулярная масса 28) и этан (мол. масса 30) имеют плотность, близкую к плотности воздуха, молекулярная масса которого считается равной 29. Метан значительно легче воздуха углеводороды, соединения которых содержат три и более атомов углерода, намного тяжелее воздуха. Даже незначительное различие по плотности может привести к существенному расслоению, доказательством чего является расслоение воздуха, происходящее в результате перепада температур. [c.279]
Растворимость парафина возрастает с уменьшением молекулярного веса алканового растворителя только до С5—Св. При дальнейшем снижении молекулярного веса растворителя растворяющая способность его начинает падать —в сжиженных нефтяных газах растворимость парафина по направлению от бутана к метану уменьшается. Растворимость парафина (/ пл 50°С) в углеводородных растворителях различного молекулярного веса при разных температурах [50] показана на рис. 15. [c.72]
Такая закономерность наблюдается для каждого гомологического ряда. Например, из парафиновых углеводородов наиболее термоустойчивы простейшие низкомолекулярные соединения метан и этан. Метая начинает разлагаться при температуре выше 900°. Высокомолекулярные твердые парафины крекируются в весьма мягких условиях. Это положение справедливо и для нефтяного сырья, представляющего собой сложную смесь углеводородов различных классов и различного молекулярного веса. Легче всего разлагаются при нагревании тяжелые нефтяные остатки, например мазут, гудрон, значительно труднее — соляровые фракции, еще труднее — керосиновые и т. д. Наиболее устойчивы при высоких температурах газы.
Например, из парафиновых углеводородов наиболее термоустойчивы простейшие низкомолекулярные соединения метан и этан. Метая начинает разлагаться при температуре выше 900°. Высокомолекулярные твердые парафины крекируются в весьма мягких условиях. Это положение справедливо и для нефтяного сырья, представляющего собой сложную смесь углеводородов различных классов и различного молекулярного веса. Легче всего разлагаются при нагревании тяжелые нефтяные остатки, например мазут, гудрон, значительно труднее — соляровые фракции, еще труднее — керосиновые и т. д. Наиболее устойчивы при высоких температурах газы.
Хотя применение молекулярного сита позволяет разделить ие-углеводородные компоненты, а также метан, этан, этилен, полностью анализ газа на этом адсорбенте провести нельзя, так как он прочно удерживает этиленовые углеводороды. Содержание водорода определяют на молекулярных ситах, применяя в качестве газа- [c.53]
В качестве исходного сырья, используемого для получения синтез-газа посредством парового риформинга, могут применяться природный газ (в основном метан с несколькими процентами высококипящих углеводородов), легкий бензин (в основном бутан с некоторым количеством бутена и высококипящих углеводородов) и, наконец, легкие нефтяные дистиллаты. которые содержат различные углеводороды, кипящие при 40—170 С (например, 65 объемн. % парафинов, 25% нафтенов, 10% ароматических углеводородов и 1% олефинов). В последнем случае средний молекулярный вес близок к 100, а плотность составляет 0,68—0,72 г см , — величины, сходные с молекулярным весом и плотностью гептана С,Нхв.
[c.63]
которые содержат различные углеводороды, кипящие при 40—170 С (например, 65 объемн. % парафинов, 25% нафтенов, 10% ароматических углеводородов и 1% олефинов). В последнем случае средний молекулярный вес близок к 100, а плотность составляет 0,68—0,72 г см , — величины, сходные с молекулярным весом и плотностью гептана С,Нхв.
[c.63]
Сравнение реакционной способности углеводородов разных классов показывает, как сильно она зависит от температуры. Так, при нормальной температуре химически наиболее стойкими из всех классов углеводородов являются предельные углеводороды, а при температуре 500—800° С — ароматические углеводороды предельные же углеводороды становятся весьма нестойкими и легко подвергаются химическим превращениям. Толуол оказывается боле термически стойким, чем к-гептан [26]. В присутствии катализаторов реакционная способность предельных углеводородов проявляется при значительно более низких температурах. Реакционная способность парафиновых углеводородов при высоких температурах возрастает с увеличением молекулярного веса углеводородов.
Термическая устойчивость простейших газообразных парафиновых углеводородов очень велика. Так, метан при температуре ниже 700—800° С практически не разлагается. При умеренной глубине разложения основными продуктами крекинга являются этан и водород. Этан и пропан склонны к реакциям дегидрогенизации с образованием соответствующих олефинов. По мере увеличения молекулярного веса исходного углеводорода термическая устойчивость его падает и преобладающими становятся реакции расщепления молекул по связи С—С (менее прочной, чем связь С — Н). Так, н-бутан [c.23]
Описан межфазный каталитический синтез бром- и иодаре-нов. Реакция идет при действии на раствор арена в хлороформе избытка галогенирующего агента (бромтрихлорметан, иод-метан, молекулярный иод) в присутствии каталитических количеств 18-крауна-б [61].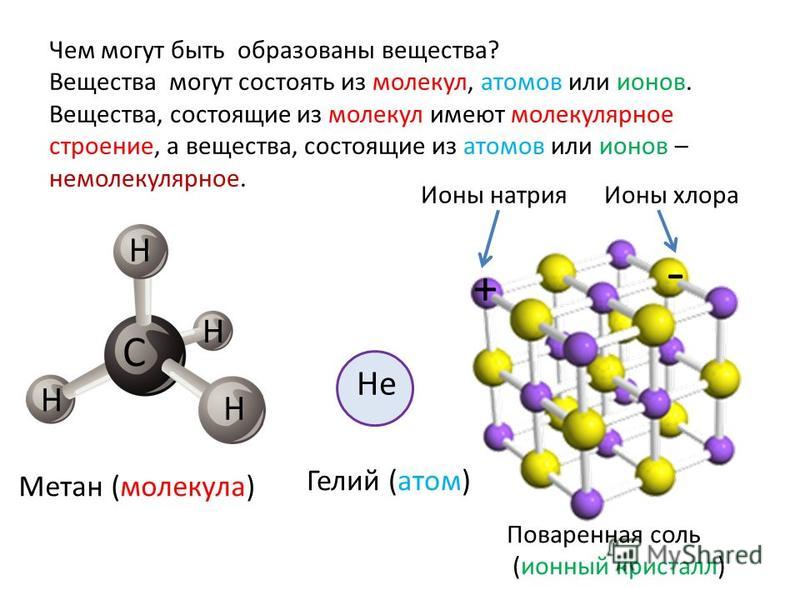 Реакция основана на генерировании арил-радикалов. [c.113]
Реакция основана на генерировании арил-радикалов. [c.113]
Биядерные комплексные соединения железа, не содержащие гемовых лигандов, играют весьма важную роль в живой природе [1-6]. В частности, фермент некоторых бактерий — метанмоноокси-геназа — гидроксилирует метан молекулярным кислородом в присутствии восстанавливающих реагентов [c.77]
Один лишь нагрев не обеспечивает десорбции углеводородов, так как под действием капиллярных сил упругость их паров настолько снижается, что температура кипения повышается на несколько сот градусов. При насыщении активного угля природным газом первоначально адсорбируются все компоненты газа, но при дальнейшей адсорбции ниэкомолекулярные углеводороды постепенно вытесняются вновь поступающими высокомолекулярными, так как избирательность адсорбции увеличивается с повышением молекулярного веса. В результате вытеснения сначала десорбируются такие низкомолекулярные углеводороды, как метан и этан. Насыщение адсорбента обнаруживается по проскоку пропана. (Более подробное описание этого процесса приведено в главе Синтез Фишера — Тропша , стр. 97). [c.31]
(Более подробное описание этого процесса приведено в главе Синтез Фишера — Тропша , стр. 97). [c.31]
В верхней части факельного ствола был смонтирован предохранитель обратного пламени ( молекулярный затвор ). Данное устройство было предназначено для предотвращения проникновения пла.мени и воздуха в факельный ствол. Чтобы предотвратить проникновение воздуха в факельный ствол, в нижнюю часть молекулярного затвора предусматривалась подача в качестве подпорного газа метан-водородной фракции, которая выходила из него в факельную горелку и сгорала в.месте со сбросным газом. Количество подаваемой метан-водородной фракции в молекулярный затвор должно было составлять 20 м /ч. Однако замер количества подаваемого запорного газа не был предусмотрен. Чтобы предотвратить замерзание скапливающейся влаги, был предусмотрен паровой змеевик в нижней части молекулярного затвора. Для слива влаги и конденсата имелась дренажная линия. [c.204]
Сырые нефти представляют собой жидкости, цвет которых варьирует от янтарно-желтого до коричневато-зеленого и иногда даже черного удельный вес их приблизительно от 0,800 до 0,985 кипят они в пределах от комнатной температуры до температуры выше 350°. Нефти из глубоких горизонтов с большим количеством углеводородных газов, так называемые дистиллятные или конденсатные нефти, могут иметь значительно меньший удельный вес, порядка 0,760, и быть практически бесцветными. Они могут не содержать фракций, кипящих выше 250 или 300°. Если перегонять нефть, то при температуре около 350° начинается частичное термическое разложение. Молекулярный вес обычных сырых нефтей может быть более 1000, что соответствует температуре кипения выше 500°. В среднем нефти могут содержать от 9 до 30 или 40 % бензиновых фракций, выкипающих до 200°. Остальные фракции распределяются по довольно плавной кривой выкипания, показывающей соотношения, в которых присутствуют керосиновые и газойлевые фракции, легкие и тяжелые масляные фракции и так называемые остаточные продукты. Термин масляные фракции указывает лишь молекулярный вес фракции, так как применимость ее для смазочных целей зависит от небольших различий в составе. После извлечения из пласта нефти обычно насыщены (при давлении и температуре, соответствующим условиям хранения) легкими углеводородами (метаном, этаном и др.
Нефти из глубоких горизонтов с большим количеством углеводородных газов, так называемые дистиллятные или конденсатные нефти, могут иметь значительно меньший удельный вес, порядка 0,760, и быть практически бесцветными. Они могут не содержать фракций, кипящих выше 250 или 300°. Если перегонять нефть, то при температуре около 350° начинается частичное термическое разложение. Молекулярный вес обычных сырых нефтей может быть более 1000, что соответствует температуре кипения выше 500°. В среднем нефти могут содержать от 9 до 30 или 40 % бензиновых фракций, выкипающих до 200°. Остальные фракции распределяются по довольно плавной кривой выкипания, показывающей соотношения, в которых присутствуют керосиновые и газойлевые фракции, легкие и тяжелые масляные фракции и так называемые остаточные продукты. Термин масляные фракции указывает лишь молекулярный вес фракции, так как применимость ее для смазочных целей зависит от небольших различий в составе. После извлечения из пласта нефти обычно насыщены (при давлении и температуре, соответствующим условиям хранения) легкими углеводородами (метаном, этаном и др. ) и часто содержат сероводород и эмульгированную пластовую воду. Ввиду того, что нефти добываются из нормально восстанови гельной среды, на воздухе они обычно окисляются. С этой точки зрения фракции, выделяемые обычной перегонкой, являются менее стабильными, чем сами сырые нефти. [c.50]
) и часто содержат сероводород и эмульгированную пластовую воду. Ввиду того, что нефти добываются из нормально восстанови гельной среды, на воздухе они обычно окисляются. С этой точки зрения фракции, выделяемые обычной перегонкой, являются менее стабильными, чем сами сырые нефти. [c.50]
Метан (СН4) — бесцветный газ, без запаха н вкуса. Молекулярная масса 16,04, плотность 0,72 кг/м при 0°С и 760 мм рт. ст. Температура кипения минус 161,58°С, температура плавления минус 182,49°С, плотность по воздуху 0,5543, в воде не растворим. Метан не ядовит. При высоких концентрациях оказывает наркотическое действие и может вызвать удушье. В процессе переработки природного и коксового газов получаются полутные газы — окись и двуокись углерода, которые входят в состав азотоводородной смеси. [c.22]
Индивидуальные газообразные углеводороды, которые получаются либо непосредственно из сырой нефти или природного газа, либо путем крекинга более тяжелых нефтепродуктов, используются для производства химических продуктов, пластмасс и синтетического каучука (см.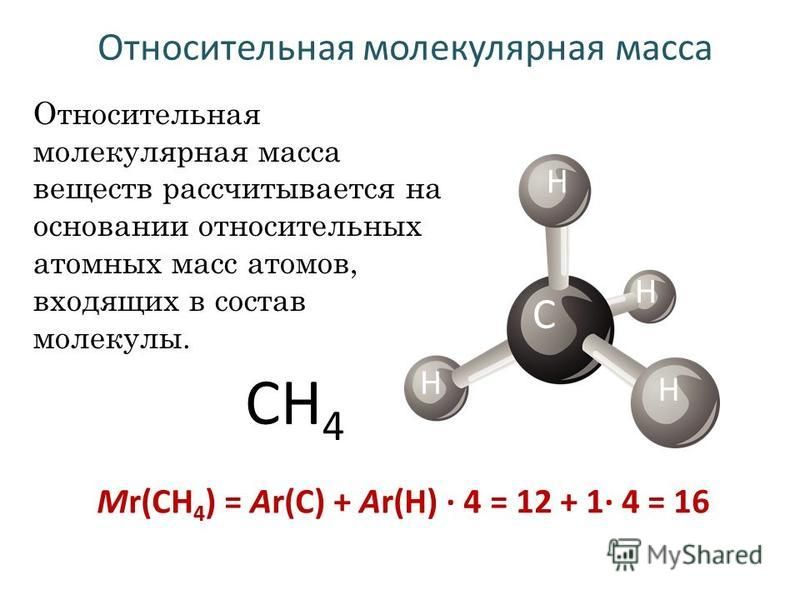 гл. XIII) или как сырье процессов каталитического превращения — полимеризации и алкилирования, ведущих к получению жидких углеводородов (см. гл. II). Большинство процессов каталитического превращения базируется на использовании реакционной способности олефинов и диолефинов, которые содержатся в газе. Часто ненасыщенные соединения получают дегидрированием пли деметанизацией насыщенных углеводородов приблизительно такого же молекулярного веса. Так, этан моншо дегидрировать в этилен, а пропан либо дегидрировать в пропилен, либо разложить па этилен и метан. Эти и подобные реакции [1 —10]1 имеют место в термических процессах, протекающих при 550—750° С. Термическое разложение Taiioro типа легко объясняется радикальным механизмом. По существу аналогичный характер имеют реакции разложения жидких углеводородов. Тел не менее дегидрирование H-oj xana и к-бутиленов, которое [c.296]
гл. XIII) или как сырье процессов каталитического превращения — полимеризации и алкилирования, ведущих к получению жидких углеводородов (см. гл. II). Большинство процессов каталитического превращения базируется на использовании реакционной способности олефинов и диолефинов, которые содержатся в газе. Часто ненасыщенные соединения получают дегидрированием пли деметанизацией насыщенных углеводородов приблизительно такого же молекулярного веса. Так, этан моншо дегидрировать в этилен, а пропан либо дегидрировать в пропилен, либо разложить па этилен и метан. Эти и подобные реакции [1 —10]1 имеют место в термических процессах, протекающих при 550—750° С. Термическое разложение Taiioro типа легко объясняется радикальным механизмом. По существу аналогичный характер имеют реакции разложения жидких углеводородов. Тел не менее дегидрирование H-oj xana и к-бутиленов, которое [c.296]
Механизм синтеза. Первоначально предполагали, что при синтезе из окиси углерода и водорода СО взаимодействует с металлическим катализатором, образуя карбид (например РегС, Ге С, СОаС), который затем в присутствии водорода восстанавливается с образованием метиленовых групп СНз последние в свою очередь полимеризуются в углеводороды различного молекулярного веса [357, 358]. Эта теория, однако, пе в состоянии объяснить образование кислородсодержащих соединений [393]. Вдобавок предполонгение о том, что восстановление карбидов приводит к получению полимеризующихся метиленовых радикалов, противоречит опыту. Известно, что при восстановлении карбида железа водородом образуется метан, а не соединения типа (СНз) - [c.596]
Эта теория, однако, пе в состоянии объяснить образование кислородсодержащих соединений [393]. Вдобавок предполонгение о том, что восстановление карбидов приводит к получению полимеризующихся метиленовых радикалов, противоречит опыту. Известно, что при восстановлении карбида железа водородом образуется метан, а не соединения типа (СНз) - [c.596]
В обычных условиях метан представляет собой газ без цвета и запаха. Молекулярный вес его 16,043, плотность. 0,7168 кг1м (при 760 мм рт. ст. и О С), средняя удельная теплоемкость при 18—20 °С равна [c.24]
Гемпель нагревал газ-ойли до 700—800° и пришел к заключению, что ирн разложении образуются главным образом группы с одним и двумя атомами углеводорода. Преобладает разложение на метан и олефины большого молекулярного веса. [c.243]
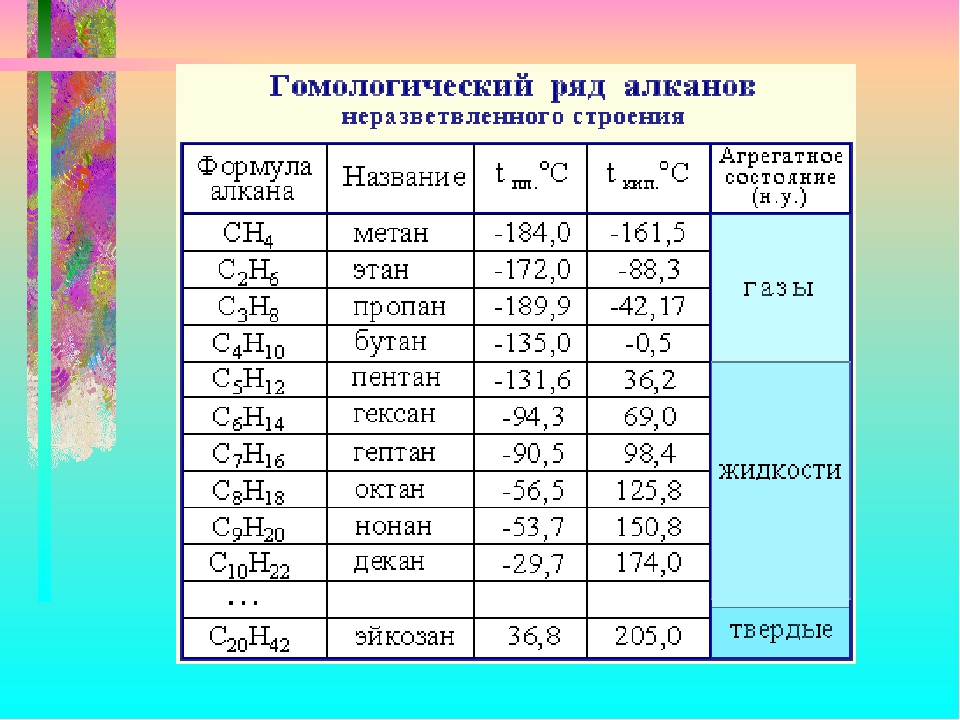
Все нециклические алканы описываются общей химической формулой С Н2 + 2- По мере повышения молекулярной массы алканов происходит систематическое возрастание их температуры плавления и температуры кипения. Метан, этан, пропан и бутан в нормальных условиях-газы пентан и следующие алканы вплоть до С20Н42-жидкости, а С21Н44 и высшие алканы-воскообразные твердые вещества. [c.282]
Метан, этан, пропан и бутан в нормальных условиях-газы пентан и следующие алканы вплоть до С20Н42-жидкости, а С21Н44 и высшие алканы-воскообразные твердые вещества. [c.282]
В 1962 г. Г. Н. Юшкевич и Т. П. Жузе была изучена растворимость в метане и углекислом газе двух насыщенных кислот пальмитиновой 1 пл — 62 С) и стеариновой ( пл—170 41 ). Эти кислоты входят в состав почти всех жиров. Кроме того, изучалась растворимость в СН4 и СО2 ненасыщенной олеиновой кислоты, встречающейся в больших количествах в растительных маслах. Из спиртов исследовалась растворимость растительного стернна, — эргостерина и животного стерина —холестерина. Холестерин является вторичным спиртом с одной двойной связью. Молекулярная масса его 386, температура [c.43]
Интересно отметить, что мене активные катализаторы (вольфрамовые, молибденовые) дают более высокое отношение низкомолекулярных изопарафинов к к-парафинам по сравнению с более активным платиновым катализатором, который успевает вызвать изомеризацию изопарафинов в к-парафипы. В гидрогенизатах практически отсутствуют углеводороды с четвертичными атомами углерода. Это также указывает на ионный характер изомеризации, так как образование четвертичного углеродного атома требует энергетически невыгодного перехода третичного иона во вторичный, а затем в первичный. В присутствии алюмокобальтмолибденового катализатора в газовой части содержатся главным образом метан и этан. В основном получаются углеводороды нормального строения меньшего молекулярного веса. Очевидно, этот катализатор обладает ярко выраженным свойством ускорять радикальные реакции. [c.307]
В гидрогенизатах практически отсутствуют углеводороды с четвертичными атомами углерода. Это также указывает на ионный характер изомеризации, так как образование четвертичного углеродного атома требует энергетически невыгодного перехода третичного иона во вторичный, а затем в первичный. В присутствии алюмокобальтмолибденового катализатора в газовой части содержатся главным образом метан и этан. В основном получаются углеводороды нормального строения меньшего молекулярного веса. Очевидно, этот катализатор обладает ярко выраженным свойством ускорять радикальные реакции. [c.307]
Номенклатура органических соединений. Систематическая номенклатура органических соединений исходит из строения молекулярного скелета соединений. Названия соединений составляются из корня и приставок (суффиксов). В на 5ваниях предельных углеводородов используется приставка ан, непредельных с одной двойной связью — ен, непредельных с двумя двойными связями — диен, непредельных с тройной СВЯЗ11Ю — ин. Корни наименований в зависимости от числа углеродных атомов в скелете образуются ИЗ греческих числительных С5 — пент, Се — гекс, С — гет, Са — окт и т. д., первые четыре предельные углеводорода с нормальной (не разветвленной) цепью имеют эмпирические названия С — метан, С2 — этан, С3 —пропан, С4 — бутан. В названиях алициклических углеводородов перед корнем ставится приставка цикло , а после корня — соответствующие суффиксы ан, ен, диен. Названия соединений, содержащих различные функциональные группы, составляются из названия углеводорода, произ- [c.143]
Корни наименований в зависимости от числа углеродных атомов в скелете образуются ИЗ греческих числительных С5 — пент, Се — гекс, С — гет, Са — окт и т. д., первые четыре предельные углеводорода с нормальной (не разветвленной) цепью имеют эмпирические названия С — метан, С2 — этан, С3 —пропан, С4 — бутан. В названиях алициклических углеводородов перед корнем ставится приставка цикло , а после корня — соответствующие суффиксы ан, ен, диен. Названия соединений, содержащих различные функциональные группы, составляются из названия углеводорода, произ- [c.143]
В четвертой главе рассмотрена проблема стерических факторов обычных (молекулярных) и радикальных реакций как часть проблемы реакционной способности частиц. На основе метода переходного состояния получены формулы для вычисления стерических факторов мономолекулярных и бимолекулярных реакций и зависимости их от температуры. Разработан приближенный метод расчета стерических факторов реакций присоединения и замещения радикалов с непредельными и предельными углеводородами, а также реакций диспропорционированияи рекомбинации радикалов.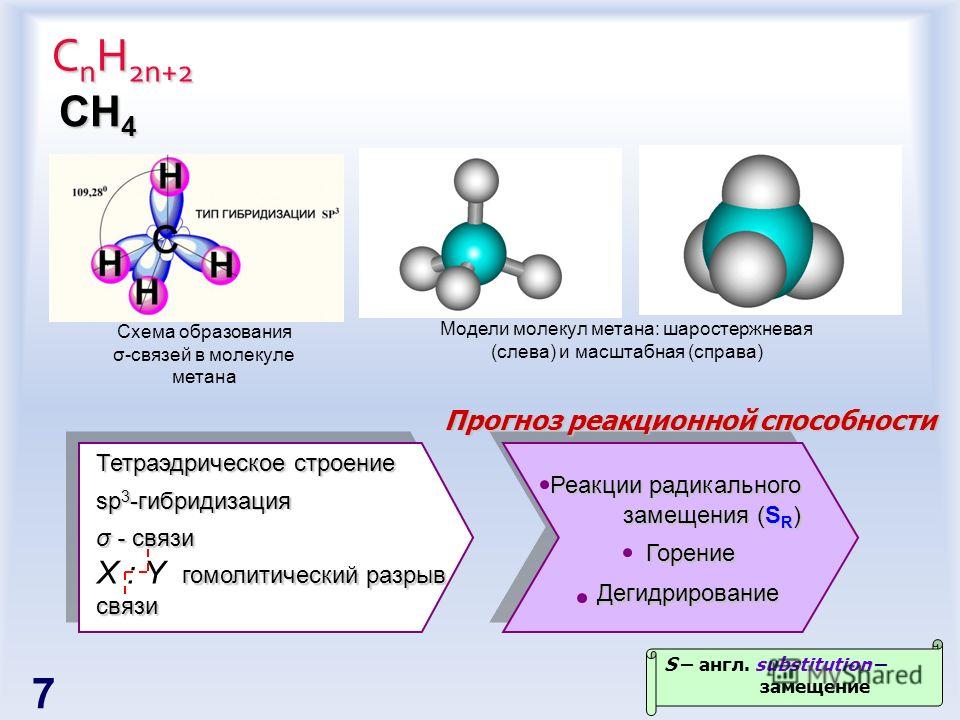 Этот метод расчета стерических факторов радикальных реакций основан на квантово-механических соображениях и апрокси-мации сумм состояний радикалов при помощи сумм состояний молекул, близких по своему химическому строению к радикалам. Приближенный способ расчета применен к вычислению стерических факторов обратимых реакций присоединения радикалов —Н, СНз к непредельным углеводородам (этилен, пропилен, изобутилен, аллен, ацетилен и др.), обратимых реакций замещения этих радикалов с непредельными и предельными углеводородами (метан, этан, пропан, бута- [c.10]
Этот метод расчета стерических факторов радикальных реакций основан на квантово-механических соображениях и апрокси-мации сумм состояний радикалов при помощи сумм состояний молекул, близких по своему химическому строению к радикалам. Приближенный способ расчета применен к вычислению стерических факторов обратимых реакций присоединения радикалов —Н, СНз к непредельным углеводородам (этилен, пропилен, изобутилен, аллен, ацетилен и др.), обратимых реакций замещения этих радикалов с непредельными и предельными углеводородами (метан, этан, пропан, бута- [c.10]
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Метан | horst. ru
ru
Синонимы: methane
Применение
В микроэлектронике и фотовольтаике — как источник углерода, а также является источником углерода для получения алмазных пленок. В смеси с аргоном используется в счетчиках Гейгера и детекторах рентгеновского излучения. Компонент калибровочных смесей для инструментального анализа в нефтехимии, экологии и т.д.
Спецификация
| Марка | 3.5 | 4.5 | 5.5 |
|---|---|---|---|
| Метан | 99,95% | 99,995% | 99,9995% |
| CO2 | < 10 ppm | < 5 ppm | < 0,5 ppm |
| CO | < 5 ppm | < 2 ppm | — |
| C2H6 | — | — | < 0,1 ppm |
| N2 | < 200 ppm | < 20 ppm | < 3 ppm |
| O2 | < 10 ppm | < 2 ppm | < 0,3 ppm |
| H2O | < 10 ppm | < 5 ppm | < 0,5 ppm |
| CnHm | < 200 ppm | < 15 ppm | < 0,5 ppm |
Характеристики
|
Общая характеристика |
Бесцветный газ без запаха. |
||
|
Молекулярная масса |
16.04246 г/моль |
CAS № |
74-82-8 |
|
|
|
№ ООН |
UN1971 |
|
Температура плавления |
-182,46° C |
КЭМ |
|
|
Температура кипения |
-161,48° C |
Класс опасности груза |
2.1 |
|
Критическая температура |
-82,59° C |
Знаки опасности |
|
|
Критическое давление |
4,599 МПа |
||
Упаковка
|
Объем, дм3 |
Размер ⌀D×H, см |
Вес баллона, кг |
Максимальное заполнение метаном, куб. |
|---|---|---|---|
|
40 |
⌀23×128 |
39 |
10 (200 бар) |
|
50 |
⌀23,5×147 |
57 |
12,5 (200 бар) |
Вентиль мембранный латунный, подсоединение DIN 1 (СП 21,8 лев. × 14 нит/дюйм), другие по запросу.
Стандартные баллоны для заполнения метаном
Транспортировка
В соответствии с ДОПОГ, а также ТР ТС 032 «О безопасности оборудования, работающего под избыточным давлением»
Рекомендуемый редуктор
Обычный редуктор для метана. Для метана 5.0 рекомендуется высокочистый редуктор.
Гарантийный срок хранения
5 лет
стехиометрическое соотношение окислителя к горючему
При проектировании и эксплуатации газопламенного оборудования часто возникает вопрос об определении оптимального соотношения количества горючего и окислителя, обеспечивающего их полное сгорание с выделением максимального количества тепловой энергии.
Рассмотрим методику определения оптимального соотношения количества горючего и окислителя на примере: горючий газ – метан (Ch5), окислитель – кислород (O2).
Реакция окисления (горения) метан/кислород:
CH4+2xO2→CO2+2xh3O (1)
Молярная масса одной молекулы: водорода (Н) – 1 г/моль, углерода (C) составляет 12 г/моль, кислород (O) – 16 г/моль. Тогда, молярная масса молекулы метана (CH4) составляет 16 г/моль, а молярная масса молекулы кислорода (O2) составляет 32 г/моль. Как следует из формулы (1), для полного окисления одной молекулы метана (CH4) требуется две молекулы кислорода (O2).
Введем понятие стехиометрического отношения [1] окислителя к горючему (по массе):
где m – масса газа;
ν — количество вещества, моль [2];
M – молярная масса газа;
индекс «ок» — окислитель;
индекс «гг» – горючий газ.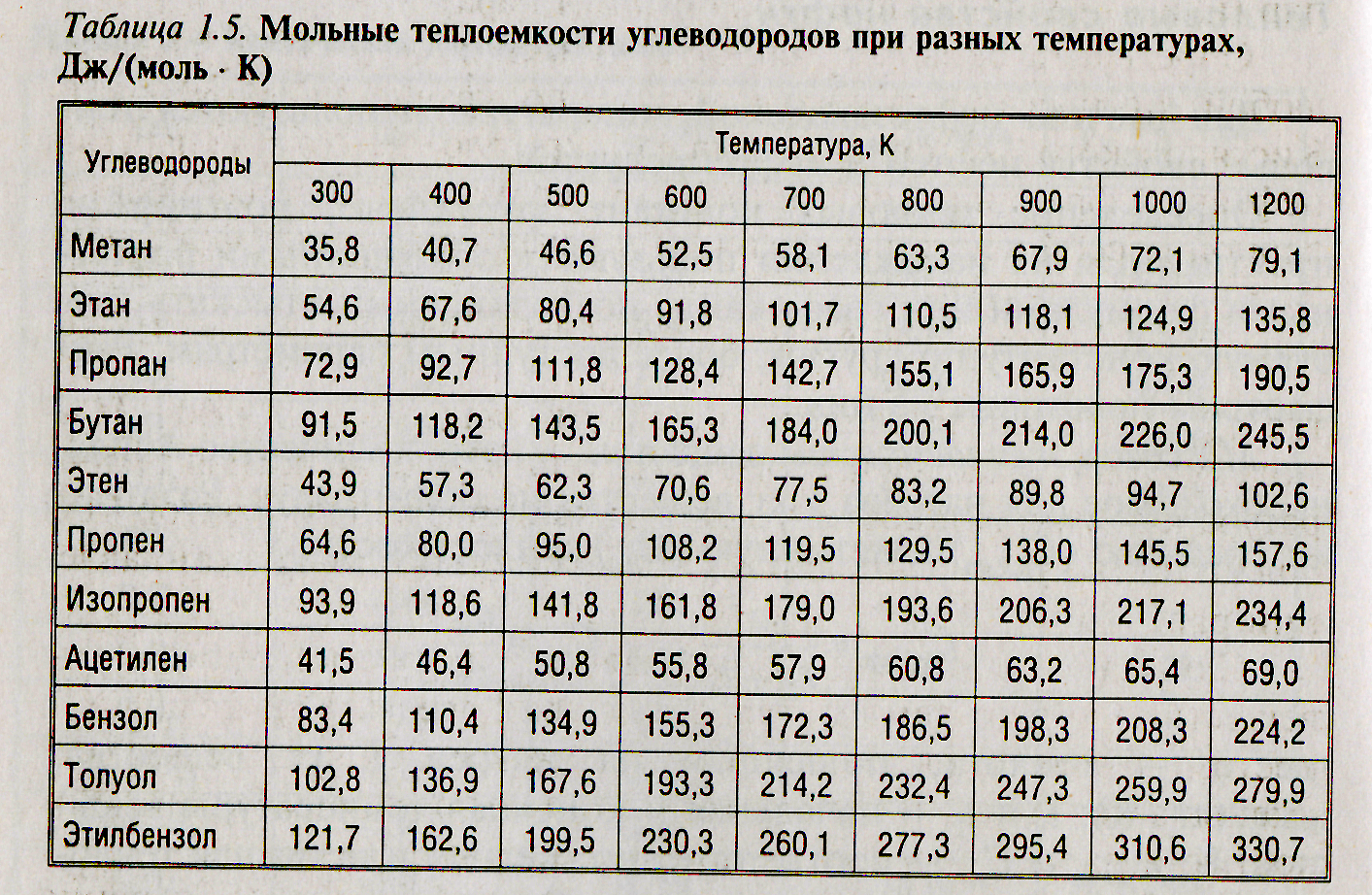
Количество вещества определяется в молях и характеризует число структурных единиц (ими могут быть атомы или молекулы) определяемого вещества, отнесенного к числу структурных единиц (атомов) в 0,012 кг (12 гр) изотопа углерода C12. Из этого следует, что в 0,012 кг (12 гр) изотопа углерода C12 содержится один моль количества вещества. Само число структурных единиц, содержащихся в одном моле вещества, называется числом Авогадро и равно NA = 6,023×1023 моль-1 = 6,023×1026 кмоль-1 [2].
В таком случае количество вещества определяется соотношением:
где N — число структурных единиц (молекул) веществ, участвующих в реакции окисления.
Как указывалось выше, в одном моле любого вещества содержится NA число структурных единиц, при этом у каждого вещества структурная единица обладает своей массой (масса атома, масса молекулы). Следовательно, массой обладает и один моль вещества, эта масса называется молярной массой. В таком случае, если вещество (в частности газ) имеет массу m, а число структурных единиц этого вещества таково, что количества вещества составляет ν, то:
В таком случае, если вещество (в частности газ) имеет массу m, а число структурных единиц этого вещества таково, что количества вещества составляет ν, то:
Тогда, в частном случае, при сгорании метана в кислороде, можно записать:
индекс «O2» — кислород;
индекс «CH4» – метан.
На практике измерять массу газа неудобно и используется измерение объемов газа. Для того, что бы определить потребный объем кислорода для полного сгорания 1 м3 метана, запишем уравнение состояния [2] для каждого из газов:
где p – давление газа;
V – объем газа;
R – универсальная газовая постоянная;
T – температура газа.
Следует заметить, что в момент реакции давление и температура газов будут одинаковыми.
Решим соотношения (5а) и (5б) относительно объемов соответствующих газов и определим стехиометрическое отношение кислорода к метану (по объему):
Т. к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определим следующие значения для соотношения (6):
к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определим следующие значения для соотношения (6):
В таком случае отношение объема кислорода к объему метана равно 2, т.е. для сжигания 1 м3 метана потребуется 2 м3 кислорода.
Соотношение (6) можно записать более универсально:
Очень часто в газопламенном оборудовании в качестве окислителя используется воздух, а именно содержащийся в воздухе кислород. По данным, приведенным в [1], процентное содержание кислорода в воздухе (по массе) составляет 23,2%. Запишем соотношение:
где индекс «вз» — воздух;
Если в соотношение (8) числитель (масса кислорода) и знаменатель (масса воздуха) помножить на массу горючего газа, который необходимо сжечь (окислить), то можно перейти к стехиометрическим соотношениям (по массе):
Для исследования процесса горения метана в воздухе необходимо в соотношение (9б) подставить значение
тогда получим
т. е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
Для определения объема воздуха, необходимого для сжигания 1м3 метана, воспользуемся соотношением (7):
где МВЗ = 29 г/моль [1].
В общем виде соотношение (10а) примет вид:
Подставив значения в соотношение (10б), получим, что для сжигания 1 м3 метана потребуется
9,512 м3 воздуха.
Так же в качестве горючих газов часто используются пропан (C3H8) и бутан (C4H10).
Реакция окисления (горения) пропан/кислород и бутан/кислород:
C3H8 + 5xO2 → 3xCO2 + 4xH2O (11)
2xC4H10 + 13xO2 → 8xCO2+10xH2O (12)
Молярные массы: пропана – MC3H8 = 44 г/моль; бутана – MC4H10 = 58 г/моль.
Используя выводы, сделанные для реакции окисления метана и кислорода, получаем, что требуемая масса кислорода (O2) для сжигания 1 кг пропана (C3H8) – 3,636 кг кислорода (O2), а для сжигания 1 кг бутана (C4H10) – 3,586 кг кислорода (O2).
Тогда можем записать:
Учитывая соотношение (9б), определяем, что
т.е. для сжигания 1 кг пропана необходимо 15,672 кг воздуха, а для сжигания 1 кг бутана – 15,457 кг воздуха.
Используя соотношение (7) или (10б), определяем объем кислорода (O2) и воздуха, которые соответственно необходимы для сжигания 1 м3 пропана и 1 м3 бутана, что показано в таблице 1.
Таблица 1. Расход окислителя на 1 кг (1 м3) горючего газа
| Окислитель | Горючий газ | Метан (CH4) | Пропан (C3H8) | Бутан (C4H10) |
| Кислород (O2) | 4 кг (2 м3) | 3,636 кг (5 м3) | 3,586 кг (6,5 м3) |
| Воздух | 17,24 кг (9,512 м3) | 15,672 кг (23,779 м3) | 15,457 кг (30,914 м3) |
Пропан (C3H8) и бутан (C4H10) чаще всего используются не по отдельности, а как смесь горючих газов. Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Пусть γ — доля (по массе) содержания пропана в смеси, а β — доля (по массе) содержания бутана в смеси. γ и β подчинены следующему соотношению:
γ + β=1 (13)
Т.к. пропан и бутан не вступают в химические реакции, то стехиометрическое отношение для каждого из газов не будет меняться, а стехиометрическое отношение для пропанобутановой смеси в зависимости от окислителя будет определяться соотношением:
индекс «C3H8 – C4H10» – пропанобутановая смесь.
Значения стехиометрических соотношений в зависимости от процентного содержания пропана и бутана в смеси представлены в таблице 2.
Таблица 2. Стехиометрические отношения (по массе) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O2) | 3,621 | 3,616 | 3,611 |
| Воздух | 15,607 | 15,586 | 15,565 |
Для того, чтобы определить отношение объема окислителя к объему пропанобутановой смеси, обеспечивающее полное сгорание, согласно соотношению (7) необходимо определить молярную массу пропанобутановой смеси — MC3H8-C4H10.
Для этого воспользуемся законом Дальтона [1]:
Надо учитывать, что в законе Дальтона как температура каждого из газов и их смеси, так и объем, занимаемый как отдельным газом, так и их смесью, одинаковы.
Выразив давление для пропана, бутана, а так же их смеси через уравнение состояния, аналогично (5а) и (5б), можем перейти к следующему соотношению:
Учитывая, что
соотношение (16) можно переписать:
Значения молярных масс пропанобутановых смесей для наиболее используемых соотношений γ и β, приведены в таблице 3.
Таблица 3. Молярные массы пропанобутановых смесей
| Молярная масса | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| MC3H8-C4H10 | 47,435 | 48,702 | 50,039 |
Тогда в соответствии с соотношением (7) или (10б) можно рассчитать стехиометрические соотношения (по объему) для различных пропанобутановых смесей, что и приведено в таблице 4.
Таблица 4. Стехиометрические отношения (по объему) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O2) | 5,368 | 5,503 | 5,647 |
| Воздух | 25,529 | 26,175 | 26,857 |
Следует заметить, что полученные значения расхода окислителя (как по массе, так и по объему) на единицу горючего газа, следует увеличить на 2-5%, т.к. в воздухе и техническом кислороде присутствуют другие компоненты, которые под действием высоких температур горения сами вступают в реакцию окисления и тем самым снижают долю окислителя, приходящуюся на горючий газ.
Так же согласно [1] и [2] закон Дальтона и уравнение состояния соблюдаются в диапазоне низких давлений. Тем не менее, большинство газопламенного оборудования используется при давлениях
до 5 МПа, что позволяет применять как полученные соотношения, так и приведенные значения.
Газопламенное оборудование, спроектированное ООО «Машпроект» (сайт: машпроект.рф
E-mail:
Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
), обеспечивает оптимальное сгорание горючих газов, как в кислороде, так и в воздухе. Поэтому наша продукция обладает высокой топливной эффективностью и, как следствие, низкими эксплуатационными затратами.
СПИСОК ЛИТЕРАТУРЫ
1. Глинка Н.Л. Общая химия – Л.: Химия, 1979. – 720 с.
2. Савельев И.В. Общий курс физики. Т. 1 – М.: Наука, 1977 – 416 с.
ИЗОТОПНО-ГЕОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ УГЛЕВОДОРОДНЫХ ГАЗОВ ДОННЫХ ОСАДКОВ ШЕЛЬФА ВОСТОЧНО-СИБИРСКОГО МОРЯ
711
ДОКЛАДЫ АКАДЕМИИ НАУК, 2016, том 469, № 6, с. 711–713
711–713
ИЗОТОПНО-ГЕОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ УГЛЕВОДОРОДНЫХ
ГАЗОВ ДОННЫХ ОСАДКОВ ШЕЛЬФА ВОСТОЧНО-СИБИРСКОГО МОРЯ
© 2016 г. А. И. Гресов1,2,*, Н. Е. Шахова2, академик РАН В. И. Сергиенко3,
А. В. Яцук1,4,**, И. П. Семилетов1,2
Поступило 28.10.2015 г.
Представлены результаты газогеохимических исследований углеводородных газов донных осадков
Восточно-Сибирского моря. Определены основные изотопно-геохимические показатели сингене-
тических и эпигенетических углеводородных газов. Установлены взаимосвязи показателей молеку-
лярной массы углеводородной фракции от изотопного состава углерода углеводородных газов раз-
личного происхождения.
DOI: 10.7868/S086956521624018X
Восточно-Сибирское море (ВСМ) – самое
слабоизученное в газогеохимическом отношении
из арктических морей. Месторождения углеводо-
родов на шельфе ВСМ до настоящего времени не
обнаружены, однако регион обладает высокими
перспективами для поиска залежей нефти и газа.
Газогеохимические исследования донных осад-
ков установили наличие аномальных концентра-
ций углеводородных газов (УВГ) и прямые при-
знаки нефтегазоносности шельфа ВСМ [1, 2].
Цель нашей работы – определение индивидуаль-
ных изотопно-газогеохимических показателей
УВГ донных осадков различного генезиса на ос-
нове анализа опубликованных данных и получен-
ных в процессе экспедиционных работ материа-
лов. Развитие исследований в этом направлении
также важно в климатическом аспекте, так как
обнаруженные массированные выбросы метана в
регионе ассоциируются с дестабилизацией газо-
вых гидратов вследствие деградации подводной
мерзлоты [3–5].
Объекты газогеохимических исследований –
УВГ донных осадков Новосибирского, Пегты-
мельского, Айонского, Южно-Чукотского, Севе-
ро-Чукотского бассейнов, а также Медвежинское
поднятие и взбросо-надвиговая зона поднятий
Врангеля–Геральда (рис.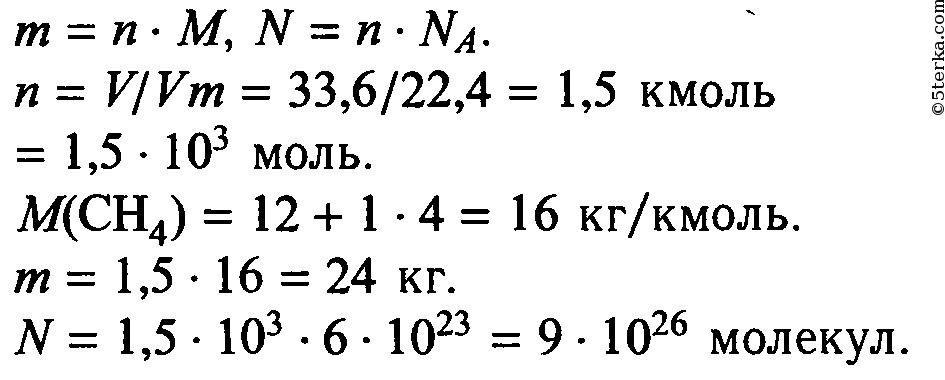 1).
1).
В газогеохимическом комплексе работ ис-
пользовали два основных метода определения со-
става УВГ донных осадков: равновесных концен-
траций [6] и отбора проб в герметические сосуды
с последующей вакуумной дегазацией [7]. Изо-
топный состав углерода УВГ определяли на масс-
спектрометрах Finnigan MAT-252, Deltaplus XL,
GC Combustion III. Изучение изотопно-газогео-
химических показателей УВГ выполнено на
82 донных станциях, осадочных отложений – в
29 скважинах, пробуренных в акваториальной,
островной и прибрежной частях ВСМ.
Исследованиями установлено, что по услови-
ям образования и происхождению УВГ донных
осадков подразделяются на сингенетические и
эпигенетические. К сингенетическим относятся
газы, образовавшиеся в результате различных
биохимических реакций в процессе деструкции
органического вещества непосредственно в дон-
ных осадках. Эпигенетические представлены га-
зами, поступающими в донные осадки из подсти-
лающих углегазоносных, нефтегазоносных отло-
жений и магматических образований в результате
процесса диффузии и миграции их по зонам раз-
ломов.
Молекулярная масса углеводородной фракции
(Мув.) сингенетических УВГ донных осадков,
представленных в основном метаном, 16.04–
16.06 г/моль. Показатели Мув. эпигенетических
(миграционных) УВГ, представленных гомологи-
ческим рядом от С1 до С5, 16.09–24.72 г/моль и за-
висят от типа газоматеринского источника. Срав-
УДК 553.981:551.35(47:211)
ГЕОХИМИЯ
1 Тихоокеанский океанологический институт
им. В.И. Ильичева
Дальневосточного отделения
Российской Академии наук, Владивосток
2 Национальный исследовательский
Томский политехнический университет
3 Институт химии
Дальневосточного отделения
Российской Академии наук, Владивосток
4 Дальневосточный федеральный университет,
Владивосток
*E-mail: [email protected]
**E-mail: [email protected]
5*
Газ природный сжиженный. Общие характеристики – РТС-тендер
ГОСТ Р 57431-2017
(ИСО 16903:2015)
МКС 75. 160.30
160.30
Дата введения 2018-01-01
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Научно-исследовательский институт природных газов и газовых технологий — Газпром ВНИИГАЗ» (ООО «Газпром ВНИИГАЗ») на основе собственного перевода на русский язык англоязычной версии международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 52 «Природный и сжиженные газы»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 30 марта 2017 г. N 219-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 16903:2015* «Нефтяная и газовая промышленность. Характеристики СПГ, проектирование и выбор материалов» (ISO 16903:2015 «Petroleum and natural gas industries — Characteristics of LNG, influencing the design, and material selection», MOD). При этом дополнительные примечания, ссылки, включенные в текст стандарта для учета особенностей российской национальной стандартизации, выделены курсивом**.
При этом дополнительные примечания, ссылки, включенные в текст стандарта для учета особенностей российской национальной стандартизации, выделены курсивом**.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей.
** В оригинале обозначения и номера стандартов и нормативных документов в разделах «Предисловие», «Библиография» и приложении ДА приводятся обычным шрифтом, отмеченные в разделе «Предисловие» знаком «**» и остальные по тексту документа выделены курсивом. — Примечания изготовителя базы данных.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2012 (пункт 3.5).
Сведения о соответствии ссылочных национальных стандартов стандартам, использованным в качестве ссылочных в примененном международном стандарте, приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской федерации»**. Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
N 162-ФЗ «О стандартизации в Российской федерации»**. Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1 Область применения
Настоящий стандарт устанавливает общие характеристики сжиженного природного газа (СПГ) и криогенных материалов, используемых в индустрии СПГ. Настоящий стандарт также содержит рекомендации по вопросам охраны здоровья и техники безопасности и предназначен для использования в качестве справочного документа при практическом применении других стандартов в области сжиженного природного газа. Стандарт можно использовать в качестве справочного материала при проектировании или эксплуатации установок по производству СПГ.
Стандарт можно использовать в качестве справочного материала при проектировании или эксплуатации установок по производству СПГ.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты*:
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. — Примечание изготовителя базы данных.
ГОСТ 30852.19-2002 (МЭК 60079-20:1996) Электрооборудование взрывозащищенное. Часть 20. Данные по горючим газам и парам, относящиеся к эксплуатации электрооборудования
ГОСТ Р 56352-2015 Нефтяная и газовая промышленность. Производство, хранение и перекачка сжиженного природного газа. Общие требования безопасности
ГОСТ Р 56719-2015 Газ горючий природный сжиженный. Отбор проб
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 отпарной газ (boil-off gas): Газ, образующийся при производстве, хранении и транспортировании сжиженного природного газа.
3.2 конденсат (condensate): Углеводородная жидкость, конденсирующаяся из природного газа и состоящая в основном из пентанов (CH) и более тяжелых компонентов.
Примечание — В конденсате содержится некоторое количество растворенного пропана и бутана.
3.3 сжиженный природный газ [liquefied natural gas (LNG)]: Криогенная жидкость без цвета и запаха, состоящая в основном из метана, которая может содержать небольшие количества этана, пропана, бутана, азота и других компонентов, присутствующих в природном газе.
3.4 сжиженные углеводородные газы [liquefied petroleum gas (LPG)]: Углеводороды, находящиеся в газообразном состоянии при нормальных значениях температуры и давления, но легко переходящие в жидкое состояние при небольшом избыточном давлении при нормальной температуре, например пропан и бутаны.
3.5 газовый конденсат [natural gas liquids (NGL)]: Жидкая смесь углеводородов, выделяемая из сырого природного газа и содержащая этан, пропан, бутаны, пентаны и газовый бензин.
4 Сокращения
В настоящем стандарте применены следующие сокращения:
ВРПВЖ (BLEVE) — взрыв расширяющихся паров вскипающей жидкости;
СУГ (LPG) — сжиженные углеводородные газы;
КАР (QRA) — количественный анализ рисков;
МФП (RPT) — мгновенный фазовый переход;
ППЭИ (SEP) — поверхностная плотность энергии излучения;
СПГ (LNG) — сжиженный природный газ.
5 Общие характеристики сжиженного природного газа
5.1 Общие положения
Персонал, работающий с СПГ, должен быть ознакомлен с характеристиками природного газа в сжиженном и газообразном состояниях.
Потенциальная опасность при обращении с СПГ главным образом обусловлена тремя его важными свойствами:
a) СПГ — криогенная жидкость. При атмосферном давлении, в зависимости от состава, СПГ кипит при температуре приблизительно минус 160°C. При этой температуре пары СПГ имеют большую плотность, чем окружающий воздух;
b) очень небольшие объемы жидкости превращаются в большие объемы газа. Из одного объема СПГ образуется примерно 600 объемов газа;
Из одного объема СПГ образуется примерно 600 объемов газа;
c) природный газ, как и другие газообразные углеводороды, является легковоспламеняющимся веществом. В условиях окружающей среды концентрационные пределы воспламенения смеси паров СПГ с воздухом составляют приблизительно от 5% до 15% по объему газа. При накапливании газа в замкнутом пространстве воспламенение может привести к детонации и ударной волне вследствие избыточного давления.
Примечание — В Российской Федерации в соответствии с ГОСТ 30852.19 установлены значения концентрационных пределов воспламенения природного газа в смесях с воздухом: 4,4% об. (нижний) и 17,0% об. (верхний).
В настоящем стандарте приведены свойства СПГ и потенциально опасные факторы при обращении с ним. При оценке потенциально опасных факторов объекта СПГ проектировщики должны учитывать опасности всех производственных циклов. Часто источником основной опасности является не собственно СПГ, а другие факторы, связанные с производством СПГ, такие как криогенное оборудование завода по сжижению газа или высокое давление газа на выходе установок регазификации.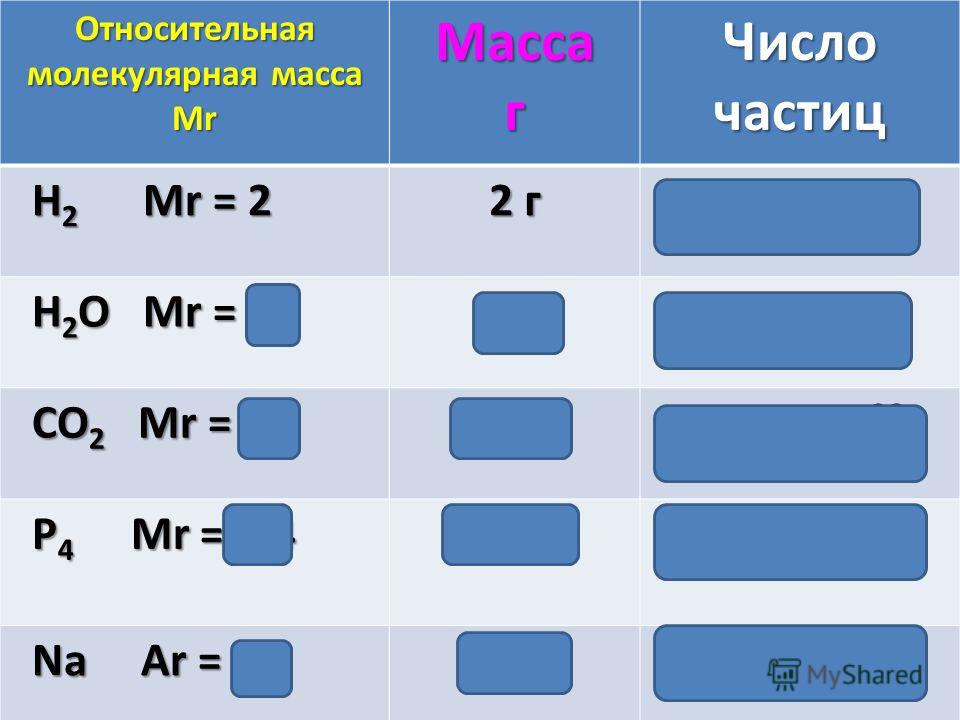
5.2 Свойства СПГ
5.2.1 Состав
СПГ является смесью углеводородов, состоящей преимущественно из метана, которая также содержит этан, пропан, азот и другие компоненты, обычно присутствующие в природном газе.
Физические и термодинамические свойства метана и других компонентов природного газа можно найти в справочной литературе и программах для термодинамических вычислений. Несмотря на то, что основным компонентом СПГ является метан, для вычисления характеристик СПГ не следует использовать параметры чистого метана. При отборе проб СПГ (см. ГОСТ Р 56719) необходимо принимать специальные меры для получения представительных проб в целях исключения недостоверных результатов анализа из-за испарения летучих компонентов.
Широко применяется метод отбора проб малого потока СПГ с непрерывным испарением при помощи специального устройства (испарителя), которое предназначено для обеспечения представительности пробы регазифицированного СПГ без фракционирования.
Другой метод — отбор пробы непосредственно из установки регазификации СПГ. Отобранные пробы затем анализируют с помощью обычных методов газовой хроматографии, например по стандартам [1] или [2].
5.2.2 Плотность
Плотность СПГ зависит от его компонентного состава и обычно колеблется в диапазоне от 430 до 470 кг/м, но в отдельных случаях может достигать 520 кг/м. Плотность СПГ зависит от температуры жидкости с градиентом температуры примерно 1,4 кг/(м·К).
Плотность может быть измерена непосредственно, но, как правило, ее вычисляют по составу газа, определенному методом газовой хроматографии. Для определения плотности СПГ рекомендуется использовать метод по стандарту [3].
Примечание — Указанный метод известен как пересмотренный метод Клозека — Мак-Кинли.
________________
1) Klosek, J., and McKinley, С., Densities of liquefied natural gas and of the low molecular weight hydrocarbons, Proceedings of 1st International Conference on LNG, 1968 (Плотность сжиженного природного газа и углеводородов с низким молекулярным весом, труды 1-й Международной конференции по СПГ, 1968).
5.2.3 Температура
В зависимости от компонентного состава СПГ имеет температуру кипения в диапазоне от минус 166°C до минус 157°C при атмосферном давлении. Изменение температуры кипения СПГ в зависимости от давления составляет примерно 1,25·10°C/Па. Температуру СПГ обычно измеряют с помощью медь/медь-никелевых термопар или платиновых термометров сопротивления, например, приведенных в стандарте [4].
5.2.4 Вязкость
Вязкость СПГ зависит от состава и обычно находится в диапазоне от 1,0·10 до 2,0·10 П при температуре минус 160°C, что составляет от 1/10 до 1/5 вязкости воды. Вязкость СПГ также зависит от температуры жидкости.
5.2.5 Примеры сжиженных природных газов
Три примера типичных СПГ приведены в таблице 1 (значения физико-химических характеристик получены путем моделирования).
Таблица 1 — Примеры сжиженных природных газов
Свойства при температуре кипения при нормальном давлении | СПГ1 | СПГ 2 | СПГ 3 |
Молярная доля, %: | |||
N | 0,13 | 1,79 | 0,36 |
CH | 99,8 | 93,90 | 87,20 |
CH | 0,07 | 3,26 | 8,61 |
CH | — | 0,69 | 2,74 |
изо-CH | — | 0,12 | 0,42 |
н-CH | — | 0,15 | 0,65 |
CH | — | 0,09 | 0,02 |
Молекулярная масса, кг/моль | 16,07 | 17,07 | 18,52 |
Температура кипения, °C | -161,9 | -166,5 | -161,3 |
Плотность, кг/м | 422 | 448,8 | 468,7 |
Объем газа, получаемый из 1 м СПГ при 0°C и 101,35 кПа, м/м | 588 | 590 | 568 |
Объем газа, получаемый из 1 т СПГ при 0,0°C и 101,325 кПа, м/10 кг | 1392 | 1314 | 1211 |
Массовая скрытая теплота парообразования, КДж/кг | 525,6 | 679,5 | 675,5 |
Высшая теплота сгорания, МДж/м | 37,75 | 38,76 | 42,59 |
Примечание — В Российской Федерации приняты стандартные условия измерения объема газа: температура 20,0°C и давление 101,325 кПа и для приведения к этим условиям значения объемов газа, указанные в таблице 1, необходимо умножить на 0,9313.
5.3 Физические свойства
5.3.1 Физические свойства отпарного газа
СПГ хранят в кипящем состоянии в теплоизолированных резервуарах большой вместимости. Любой приток тепла извне вызывает испарение части СПГ в газовую фазу. Испарившийся при этом газ называют отпарным газом. Состав отпарного газа зависит от состава СПГ. Например, отпарной газ может содержать 20% азота, 80% метана, а также следы этана; содержание азота в отпарном газе может быть примерно в двадцать раз выше, чем в СПГ.
Поскольку в газовую фазу испаряются преимущественно азот и метан, оставшаяся жидкость содержит большую часть высших углеводородов. Отпарные газы при температуре ниже минус 113°C — для чистого метана и минус 85°C — для смеси 80% метана и 20% азота будут тяжелее окружающего воздуха. При нормальных условиях плотность отпарных газов составляет примерно 0,6 плотности воздуха.
5.3.2 Мгновенное испарение
Как в случае любого находящегося под давлением флюида, при снижении давления СПГ ниже значения, при котором происходит его кипение, например при прохождении через клапан, некоторое количество СПГ испаряется, и его температура падает до новой точки кипения при данном давлении. Такой процесс известен как мгновенное испарение. Поскольку СПГ является многокомпонентной смесью, составы мгновенно испарившегося газа и оставшейся жидкости отличаются по причинам, приведенным в 5.3.1.
Такой процесс известен как мгновенное испарение. Поскольку СПГ является многокомпонентной смесью, составы мгновенно испарившегося газа и оставшейся жидкости отличаются по причинам, приведенным в 5.3.1.
Например, при падении давления на 10 Па мгновенное испарение 1 м СПГ при температуре кипения, соответствующей давлению в диапазоне от 1·10 Па до 2·10 Па, приводит к выбросу примерно 0,4 кг газа. Более точное вычисление количества и состава жидких и газообразных продуктов мгновенного испарения многокомпонентных жидких сред, таких как СПГ, является сложной задачей. Для таких вычислений следует использовать надежные компьютерные программы термодинамических вычислений или программные комплексы технологического моделирования, содержащие соответствующую базу данных.
5.3.3 Разлив сжиженного природного газа
При попадании СПГ на землю (при аварийном разливе) сначала происходит интенсивное кипение, затем скорость испарения СПГ быстро падает до постоянного значения, которое определяется тепловыми свойствами грунта и притоком тепла, получаемого от окружающего воздуха. Скорость испарения СПГ может быть снижена за счет использования теплоизолированных поверхностей в местах возможных утечек. Скорость испарения СПГ с поверхностей разных материалов приведена в таблице 2. Значения приведены в качестве примера и должны быть проверены при их использовании для количественного анализа рисков (КАР) или проектирования.
Скорость испарения СПГ может быть снижена за счет использования теплоизолированных поверхностей в местах возможных утечек. Скорость испарения СПГ с поверхностей разных материалов приведена в таблице 2. Значения приведены в качестве примера и должны быть проверены при их использовании для количественного анализа рисков (КАР) или проектирования.
Таблица 2 — Скорость испарения СПГ
Материал | Скорость испарения СПГ с единицы поверхности через 60 с, кг/(м·ч) |
Щебень | 480 |
Мокрый песок | 240 |
Сухой песок | 195 |
Вода | 600 |
Обычный (стандартный) бетон | 130 |
Легкий коллоидный бетон | 65 |
При разливе СПГ небольшие объемы жидкости превращаются в значительные объемы газа, при этом из одного объема жидкости в условиях окружающей среды образуется приблизительно 600 объемов газа (см. таблицу 1).
таблицу 1).
Когда разлив происходит на поверхности воды, конвекция в воде настолько интенсивна, что скорость испарения, отнесенная к площади поверхности, остается постоянной. Площадь разлива СПГ будет продолжать увеличиваться до тех пор, пока скорость испарения жидкости не станет равна скорости притока жидкости, прибывающей в результате утечки.
5.3.4 Распространение и рассеяние газовых облаков
Первоначально газ, образующийся в результате испарения СПГ, имеет приблизительно такую же температуру, что и СПГ, и плотность, большую, чем плотность окружающего воздуха. Такой газ в первую очередь под действием силы тяжести будет распространяться по поверхности земли, пока не прогреется в результате поглощения тепла из почвы и перемешивания с окружающим воздухом.
Разбавление теплым воздухом повышает температуру и снижает молекулярную массу паровоздушной смеси. В результате этого облако будет иметь большую плотность, чем окружающий воздух, до тех пор, пока не будет разбавлено значительно ниже концентрационного предела воспламенения. Но при высоком содержании воды в атмосфере (высокая влажность и температура) может произойти конденсация воды при смешивании с холодными парами СПГ и разогревание смеси, при котором она станет легче воздуха и облако поднимется. Расширение и рассеяние облака паров при разливе СПГ являются достаточно сложными физическими явлениями и обычно могут быть теоретически вычислены с помощью компьютерного моделирования. Указанное моделирование должно быть проведено только специализированной организацией.
Но при высоком содержании воды в атмосфере (высокая влажность и температура) может произойти конденсация воды при смешивании с холодными парами СПГ и разогревание смеси, при котором она станет легче воздуха и облако поднимется. Расширение и рассеяние облака паров при разливе СПГ являются достаточно сложными физическими явлениями и обычно могут быть теоретически вычислены с помощью компьютерного моделирования. Указанное моделирование должно быть проведено только специализированной организацией.
После разлива СПГ образуется «туман», вызванный конденсацией водяного пара в окружающем воздухе. Возможность наблюдения «тумана» (днем и при отсутствии естественного природного тумана) полезна для определения направления перемещения облака испарившегося СПГ, т.к. позволяет оценить опасность воспламенения смеси газа и воздуха.
При утечке из сосудов, работающих под давлением, или трубопроводов СПГ будет распыляться в виде струйных потоков в атмосфере с одновременным дросселированием (расширением) и испарением. Этот процесс сопровождается интенсивным перемешиванием паров СПГ с окружающим воздухом. Первоначально большая часть СПГ в паровом облаке будет содержаться в виде аэрозоля. В результате дальнейшего перемешивания СПГ с воздухом произойдет полное испарение мелких капель жидкости.
Этот процесс сопровождается интенсивным перемешиванием паров СПГ с окружающим воздухом. Первоначально большая часть СПГ в паровом облаке будет содержаться в виде аэрозоля. В результате дальнейшего перемешивания СПГ с воздухом произойдет полное испарение мелких капель жидкости.
5.3.5 Воспламенение
Смесь паров СПГ с воздухом воспламеняется при концентрации паров СПГ в диапазоне от 5% об. до 15% об.
5.3.6 Пожар разлива СПГ
Поверхностная плотность энергии излучения пламени (ППЭИ) горящего участка СПГ диаметром более 10 м достаточно высока. Ее вычисляют по измеренному значению потока излучения и площади пламени. ППЭИ зависит от размера поверхности горения, выбросов дыма и способов измерения. С увеличением площади значение ППЭИ уменьшается.
5.3.7 Распространение и последствия волн давления
В свободном состоянии природный газ горит медленно с низким перепадом давления (менее 5 кПа). Давление может повышаться в местах с загроможденным или замкнутым пространством, например в местах с плотно установленным оборудованием или с плотной застройкой.
Давление может повышаться в местах с загроможденным или замкнутым пространством, например в местах с плотно установленным оборудованием или с плотной застройкой.
5.3.8 Меры предосторожности
Природный газ не может быть сжижен путем повышения давления при температуре окружающей среды. Фактически его температура должна быть понижена до температуры ниже минус 80°C, прежде чем он может быть сжижен при каком-либо давлении. Это означает, что присутствие любого количества сжиженного природного газа, например между двумя клапанами или в герметичном резервуаре без выпускного клапана, при нагревании приведет к резкому повышению давления вплоть до разрушения системы герметизации. Все установки и оборудование для СПГ должны быть спроектированы таким образом, чтобы диаметры сбросных отверстий и/или предохранительных клапанов соответствовали объему СПГ в резервуарах.
5.3.9 Ролловер
Термин «ролловер» относится к процессу, при котором в резервуарах для хранения СПГ образуется большое количество газа в течение короткого периода времени. Ролловер приводит к возникновению избыточного давления в резервуаре для хранения СПГ, если не приняты соответствующие меры для предотвращения указанного явления.
Ролловер приводит к возникновению избыточного давления в резервуаре для хранения СПГ, если не приняты соответствующие меры для предотвращения указанного явления.
В резервуарах для хранения СПГ возможно наличие двух устойчивых слоев или областей, которые образуются, как правило, в результате неполного смешивания СПГ разной плотности — свежего и остатка в емкости.
Внутри слоя плотность жидкости одинакова, но плотность жидкости в нижнем слое резервуара больше плотности жидкости в верхнем слое.
В дальнейшем из-за притока тепла в емкости, тепло- и массообмена между слоями и испарения жидкости с поверхности плотность слоев выравнивается путем самопроизвольного перемешивания.
Такое самопроизвольное перемешивание называется ролловер, и если, как это часто бывает, жидкость в нижней части резервуара становится перегретой относительно давления паровой фазы в емкости СПГ, то ролловер сопровождается резким увеличением скорости испарения. В ряде случаев указанное выделение паров является очень быстрым и мощным. При этом повышение давления в емкости бывает достаточным, чтобы вызвать срабатывание клапанов сброса давления.
При этом повышение давления в емкости бывает достаточным, чтобы вызвать срабатывание клапанов сброса давления.
Первоначальное предположение заключалось в том, что, когда плотность верхнего слоя превышает плотность нижнего слоя, происходит инверсия (перемещение) слоев, отсюда и название ролловер. Более поздние исследования не подтвердили первоначальное предположение и показали, что при этом происходит интенсивное перемешивание слоев.
Возникновению ролловера, как правило, предшествует период, в течение которого скорость образования отпарного газа значительно ниже обычной. Поэтому следует тщательно контролировать скорость образования отпарного газа, чтобы убедиться, что жидкость не аккумулирует тепло. При подозрении на возникновение ролловера следует обеспечить циркуляцию жидкости в резервуаре для смешивания нижнего и верхнего слоев.
Ролловер можно предотвратить с помощью эффективного управления резервами СПГ. СПГ разных изготовителей, имеющий разный состав, следует хранить в отдельных резервуарах. Если невозможно обеспечить раздельное хранение, должно быть обеспечено хорошее перемешивание при заполнении емкости.
Если невозможно обеспечить раздельное хранение, должно быть обеспечено хорошее перемешивание при заполнении емкости.
Высокое содержание азота в СПГ, производимом в установках сглаживания пикового потребления, также может вызвать ролловер вскоре после прекращения заполнения емкости вследствие преимущественного испарения азота. Как показывает практика, этот тип ролловера можно предотвратить путем поддержания содержания азота в СПГ менее 1% и при тщательном мониторинге скорости образования отпарного газа.
Таким образом, при подозрении на расслоение следует контролировать плотность СПГ в резервуаре, например, если резервуар заполнен СПГ разных изготовителей. При обнаружении расслоения должны быть приняты меры, снижающие степень риска.
5.3.10 Мгновенный фазовый переход
При контакте двух жидкостей с разными температурами при определенных условиях могут возникать мощные ударные волны. Это явление, называемое мгновенным фазовым переходом (МФП), может произойти при контакте СПГ и воды.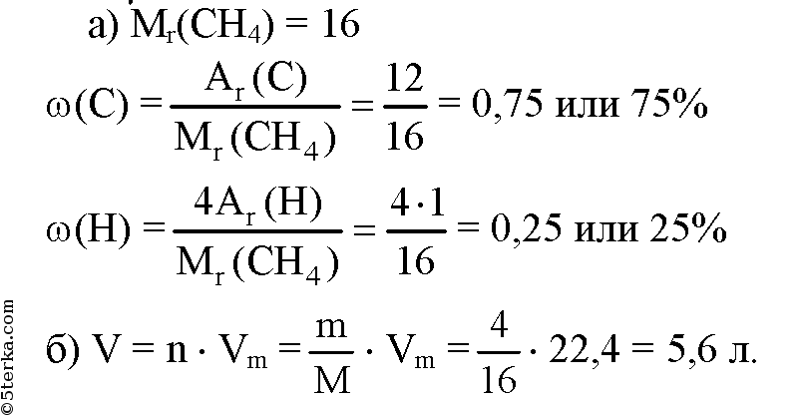 Несмотря на то, что при этом не происходит воспламенение, создается волна давления, похожая на взрыв.
Несмотря на то, что при этом не происходит воспламенение, создается волна давления, похожая на взрыв.
МФП в результате разлива СПГ на воду происходят редко и с относительно ограниченными последствиями. Теоретические предположения, согласующиеся с результатами экспериментов, можно обобщить следующим образом.
Когда две жидкости со значительно отличающимися температурами вступают в контакт и температура (в градусах Кельвина) более теплой жидкости в 1,1 раза выше, чем температура кипения более холодной жидкости, повышение температуры последней происходит настолько быстро, что температура поверхностного слоя может превысить температуру спонтанной нуклеации (появление пузырьков в жидкости).
В некоторых случаях такая перегретая жидкость испаряется за очень короткое время по сложному механизму цепной реакции с образованием пара со скоростью ударной волны.
Например, жидкости могут быть приведены в контакт в результате механического повреждения, что вызывает МФП, как было показано в экспериментах с разливом СПГ или жидкого азота на поверхности воды.
Результаты последних исследований позволили лучше понять сущность МФП для количественной оценки степени опасности этого процесса и определения достаточности предпринимаемых мер безопасности.
5.3.11 Взрыв расширяющихся паров вскипающей жидкости
Любая жидкость вблизи температуры кипения начинает чрезвычайно быстро испаряться при резком падении давления в системе. Известны случаи, когда самопроизвольный процесс расширения приводил к разрушению резервуаров и разбрасыванию обломков на несколько сотен метров. Указанное явление было названо взрывом расширяющихся паров вскипающей жидкости (ВРПВЖ).
Вероятность ВРПВЖ в установках СПГ крайне мала, поскольку СПГ хранится в резервуарах, которые разгерметизируются уже при достаточно низких давлениях, при этом скорость образования пара незначительна, или для хранения и транспортирования СПГ используют криогенные резервуары высокого давления и трубопроводы в пожарозащищенном исполнении.
6 Требования безопасности и охраны труда
6. 1 Общие положения
1 Общие положения
Следующие рекомендации приведены в качестве общего руководства для лиц, проводящих работы при производстве, хранении и транспортировании СПГ, однако в настоящем стандарте не рассматриваются все вопросы безопасности, связанные с его применением, и он не может заменять собой требования национальных или региональных стандартов по безопасности.
6.2 Воздействие холода
6.2.1 Предупреждение
Низкие температуры, характерные для СПГ, могут привести к различным повреждениям открытых частей тела. Воздействие низких температур на организм человека приводит к тяжелым последствиям, если персонал, работающий с СПГ, не защищен соответствующим образом.
6.2.2 Обращение с СПГ, холодовые травмы
Попадание СПГ на открытые участки кожи вызывает образование волдырей, похожих на ожоги. Газ, образующийся из СПГ, также имеет очень низкую температуру и может привести к ожогам. Нежные ткани, в том числе слизистые оболочки глаз, могут быть повреждены даже при кратковременном воздействии такого холодного пара, которое не повреждает кожу лица и рук.
Нежные ткани, в том числе слизистые оболочки глаз, могут быть повреждены даже при кратковременном воздействии такого холодного пара, которое не повреждает кожу лица и рук.
Не следует касаться незащищенными частями тела нетеплоизолированных трубопроводов или емкостей, содержащих СПГ. Очень холодный металл прилипает к коже, которая повреждается при попытке отрыва от поверхности металла.
6.2.3 Обморожение
Резкое или длительное воздействие холодных паров и газов на организм человека вызывает обморожение. Локальная боль, как правило, является признаком обморожения, но иногда боль не ощущается.
6.2.4 Воздействие холода на легкие
Длительное дыхание в чрезвычайно холодной окружающей среде приводит к повреждению легких. Кратковременное воздействие холода может привести к затрудненному дыханию.
6.2.5 Переохлаждение
Опасность переохлаждения возникает даже при температуре до 10°C. Лица, пострадавшие от переохлаждения, должны быть выведены из холодной зоны и быстро согреты в теплой ванне при температуре от 40°C до 42°C. В этих случаях не следует использовать для согревания сухое тепло.
Лица, пострадавшие от переохлаждения, должны быть выведены из холодной зоны и быстро согреты в теплой ванне при температуре от 40°C до 42°C. В этих случаях не следует использовать для согревания сухое тепло.
6.2.6 Рекомендуемая защитная одежда
При работе с СПГ для защиты глаз следует использовать защитные маски или специальные очки. При работе с криогенными жидкостями или охлажденными парами следует применять кожаные перчатки. Перчатки должны надеваться и сниматься достаточно легко, чтобы их можно было быстро снять при попадании криогенной жидкости. Даже при использовании перчаток все процедуры с оборудованием, содержащим СПГ, должны проводиться только в течение короткого промежутка времени.
При работе с СПГ следует надевать плотно прилегающие комбинезоны или одежду подобного типа, без карманов или манжет. Брюки следует надевать навыпуск, поверх сапог или ботинок. Перед использованием в закрытом пространстве одежда, на которую попала криогенная жидкость или охлажденные пары, должна быть проветрена на открытом воздухе вдали от источника воспламенения. Персонал, работающий с СПГ, должен знать, что защитная одежда обеспечивает защиту только от случайных брызг, поэтому следует избегать контакта с СПГ.
Персонал, работающий с СПГ, должен знать, что защитная одежда обеспечивает защиту только от случайных брызг, поэтому следует избегать контакта с СПГ.
Примечание — При работе с криогенными горючими жидкостями следует использовать спецодежду из антистатической и огнестойкой ткани.
6.3 Воздействие сжиженного природного газа
6.3.1 Токсичность
СПГ и природный газ не являются токсичными веществами.
Примечание — СПГ и природный газ являются малотоксичными пожаровзрывоопасными продуктами. При работе с СПГ следует учитывать предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны, установленные в гигиенических нормативах [5].
6.3.2 Асфиксия
Природный газ обладает только удушающим эффектом. Нормальное содержание кислорода в воздухе составляет 20,9% об., окружающая среда, содержащая менее 18% об. кислорода, оказывает потенциально удушающее воздействие. При высоких концентрациях природного газа может наблюдаться тошнота или головокружение из-за недостатка кислорода. При выходе из зоны с пониженным содержанием кислорода симптомы удушья быстро исчезают. Содержание кислорода и углеводородов в воздухе рабочей зоны, где возможны утечки природного газа, должно постоянно контролироваться.
При высоких концентрациях природного газа может наблюдаться тошнота или головокружение из-за недостатка кислорода. При выходе из зоны с пониженным содержанием кислорода симптомы удушья быстро исчезают. Содержание кислорода и углеводородов в воздухе рабочей зоны, где возможны утечки природного газа, должно постоянно контролироваться.
Даже если содержание кислорода в воздухе рабочей зоны достаточно для нормального дыхания, перед проведением работ следует определять содержание взрывоопасных компонентов. При работах во взрывоопасных зонах следует использовать инструменты только во взрывозащищенном исполнении.
6.4 Требования пожарной безопасности и средства защиты
При обращении с СПГ следует использовать огнетушители порошкового типа (предпочтительно с карбонатом калия). Персонал, работающий с СПГ, должен уметь пользоваться порошковыми огнетушителями при тушении горящих жидкостей. Для снижения теплового излучения при локализации пожара разлития СПГ следует использовать высокократную пену или блоки из пеностекла.
Должны быть доступны источники водоснабжения для охлаждения и получения пены. Не допускается применять воду для тушения пожаров СПГ.
Комплекс противопожарных мер и защиты должен соответствовать требованиям [6], [7] или ГОСТ Р 56352.
Огнетушители должны быть порошкового типа.
6.5 Цвет
Пары СПГ бесцветны. Однако при попадании их в атмосферу будет образовываться белое облако вследствие конденсации влаги из окружающего воздуха.
6.6 Запах
Пары СПГ не имеют запаха.
Примечание — Не обладают запахом пары СПГ, который получен из неодорированного и не содержащего сернистых соединений природного газа.
7 Конструкционные материалы
7.1 Материалы, используемые в индустрии сжиженного природного газа
7.1.1 Общие положения
Большинство материалов, применяемых для производства оборудования, подвержено охрупчиванию при воздействии очень низких температур. В частности, вязкость разрушения для углеродистой стали очень низка при температуре СПГ (минус 160°C). Для материалов, контактирующих с СПГ, должна быть подтверждена устойчивость к хрупкому разрушению.
В частности, вязкость разрушения для углеродистой стали очень низка при температуре СПГ (минус 160°C). Для материалов, контактирующих с СПГ, должна быть подтверждена устойчивость к хрупкому разрушению.
7.1.2 Материалы, контактирующие со сжиженным природным газом
Материалы, которые не становятся хрупкими при контакте с СПГ, и области их применения приведены в таблице 3. Следует учитывать, что приведенный перечень не является полным.
Таблица 3 — Материалы, используемые в прямом контакте со сжиженным природным газом и области их применения
Наименование | Область применения |
Аустенитная нержавеющая сталь | Резервуары, сливные рукава, болты и гайки, трубопроводы и фитинги, насосы, теплообменники |
9%-ная никелевая сталь | Резервуары |
Никелевые сплавы, ферроникель | Резервуары, болты и гайки |
Железоникелевая сталь инвар (36% никеля) | Трубопроводы, резервуары |
Алюминиевые сплавы | Резервуары, теплообменники |
Медь и медные сплавы | Уплотнения, трущиеся поверхности |
Эластомер | Уплотнения, прокладки |
Бетон (предварительно напряженный) | Резервуары |
Графит | Уплотнения, сальники |
Фторэтиленпропилен | Электроизоляция |
Политетрафторэтилен (тефлон) | Уплотнения, сальники, опорные поверхности |
Политрифторхлорэтилен | Опорные поверхности |
Стеллит | Опорные поверхности |
Состав стеллита, % масс. | |
7.1.3 Материалы, не контактирующие со сжиженным природным газом в нормальных условиях эксплуатации
Основные материалы, применяемые для сооружений, работающих при низких температурах, но не предназначенные для прямого контакта с СПГ при нормальных условиях эксплуатации, приведены в таблице 4. Приведенный перечень не является полным.
Таблица 4 — Материалы, не используемые в контакте с СПГ при обычных условиях эксплуатации
Наименование | Область применения |
Низколегированная нержавеющая сталь | Шариковые подшипники |
Бетон (предварительно напряженный, армированный) | Резервуары |
Коллоидный бетон | Защитная обваловка |
Древесина (бальза, клееная фанера, кора пробкового дерева) | Теплоизоляция |
Эластомер | Мастика, клей |
Стекловата | Теплоизоляция |
Вермикулит (вспученная слюда) | Теплоизоляция |
Поливинилхлорид | Теплоизоляция |
Полистирол | Теплоизоляция |
Полиуретан | Теплоизоляция |
Полиизоцианурат | Теплоизоляция |
Песок | Теплоизоляция |
Силикат кальция | Защитная обваловка |
Кварц (стекло) | Теплоизоляция |
Пеностекло | Теплоизоляция, защитная обваловка |
Перлит | Теплоизоляция |
7. 1.4 Дополнительная информация
1.4 Дополнительная информация
В качестве материала для теплообменников часто используют алюминий. Алюминий может контактировать с СПГ при условии, что СПГ не содержит примесей, вызывающих коррозию алюминия, например ртути.
Трубные и пластинчатые теплообменники, так называемые «холодные боксы», на заводах по сжижению природного газа как правило защищают стальным корпусом.
Алюминий также используют для изготовления подвесных крыш внутри резервуаров.
Оборудование и материалы, специально предназначенные для жидкого кислорода или жидкого азота как правило также пригодны для СПГ.
Оборудование, предназначенное для СПГ, рассчитанное на высокое давление и соответствующую температуру, должно быть спроектировано с учетом возможного снижения температуры в случае разгерметизации системы.
7.2 Термические напряжения
Наиболее часто криогенное оборудование, используемое в индустрии СПГ, подвергается быстрому охлаждению — от температуры окружающей среды до температуры, характерной для СПГ.
Температурные градиенты, возникающие в процессе охлаждения, вызывают термические напряжения, которые являются кратковременными и циклическими, при этом максимальное напряжение возникает вдоль стенок резервуаров, контактирующих с СПГ. Указанные термические напряжения нарастают с увеличением толщины материала и могут стать существенными при толщине более 10 мм. Для критических точек переходные или ударные напряжения можно вычислить с использованием установленных методов, и они должны быть испытаны на хрупкое разрушение.
Экстремальные температуры на объектах СПГ приводят к значительным тепловым расширениям или сжатиям. Для предотвращения перенапряжений трубопроводы и другие элементы конструкции необходимо располагать с учетом возможных смещений.
Если трубопровод заполнен СПГ частично, температурный градиент от верхней к нижней части трубы может вызывать напряжения изгиба и остаточные деформации, что может привести к разгерметизации, главным образом в местах фланцевых соединений.
Для минимизации изгибов и предотвращения напряжений из-за изменения температуры во всех режимах (охлаждение, нагрев, переходные режимы и др.) должны быть проведены исследования оборудования и трубопроводных систем на гибкость. Испытания на пластичность должны включать все обычные, аварийные и исключительные случаи нагрузки (вес, ветер, снег, землетрясения и др.).
Приложение ДА (справочное). Сведения о соответствии ссылочных национальных стандартов стандартам, использованным в качестве ссылочных в примененном международном стандарте
Приложение ДА
(справочное)
Таблица ДА.1
Обозначение ссылочного национального стандарта | Степень соответствия | Обозначение и наименование ссылочного стандарта |
ГОСТ Р 56352-2015 | NEQ | NFPA 59А «Стандарт по производству, хранению и обращению со сжиженным природным газом (СПГ)» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
[1] | ISO 6568 | Natural gas — Simple analysis by gas chromatography |
[2] | ISO 6974 | Natural gas — Determination of composition with defined uncertainty by gas chromatography method |
[3] | ISO 6578 | Refrigerated hydrocarbon liquids — Static measurement — Calculation procedure |
[4] | ISO 8310 | Refrigerated hydrocarbon and non-petroleum based liquefied gaseous fuels — General requirements for automatic tank thermometers on board marine carriers and floating storage |
[5] | ГН 2. | Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны |
[6] | EN 1473 | Installation and equipment for liquefied natural gas — Design of onshore installation |
[7] | NFPA 59A | Standard for the production, storage, and handling of liquefied natural gas (LNG) |
УДК 66-911.33:665.612.3:006.354 | МКС 75.160.30 | |
Ключевые слова: сжиженный природный газ, общие характеристики | ||
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
М. : Стандартинформ, 2017
: Стандартинформ, 2017
Метан, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Метан молекулярная — Справочник химика 21
Как все неметаллы, электрические образует летучие соединения с водородом. Простейшее из них — метан. Молекулярная [c.92]
Простейшее из них — метан. Молекулярная [c.92] При каталитическом крекинге потери водорода, ведущем к снижению выпуска ценных бумаг продуктов — бензина и газойля, вызываются легкие легкие (пропан, этан, этилен, метан, молекулярный водород) и воды (в результате сгорания в регенераторе) ). Водород может поступать из реактора в регенератор частично с углеводородами, прочно адсорбированными на катализаторе (кокс) или в виде жидких продуктов, механически увлекаемых или обратимо адсорбированных на катализаторе.Эффективно- [c.41]
Некоторые авторы пытались сопоставить радиационно-химические выходы с масс-спектрометрическими. Так, Дорфман [711 считает, что с масс-спектрометрическими данными можно сравнивать молекулярные выходы (определяемые без акцептирования свободных радикалов), не общие выходы, так как последние часто изменяются по мере образования продуктов радиолиза. Кроме того, молекулярный выход определяется меньшим числом вполне конкретных процессов, поэтому менее вероятный экспериментатор для расчета выходов будет подбирать подходы реакции.
 Дорфман [71] определил молекулярный выход из метана (Он, = 3,3 0,2), а также его вклад в общий выход, найденный в составе акцептора. При облучении метане молекулярный водород образует по реакциям (7.102) — (7.108), то полагается Wqh равным 27,3 эв / пара форму, рассчитанное значение молекулярного водорода (оценивается по избытку HI, HI и СН) 3,5, что хорошо совпадает с экспериментально найденной величиной 3,3 0,2. Затем можно определить свободнорадикальный выход (по экспериментам с акцепторами) [72], и тогда общий выход продуктов согласуется с масс-спектрометрическими данными. [c.192]
Дорфман [71] определил молекулярный выход из метана (Он, = 3,3 0,2), а также его вклад в общий выход, найденный в составе акцептора. При облучении метане молекулярный водород образует по реакциям (7.102) — (7.108), то полагается Wqh равным 27,3 эв / пара форму, рассчитанное значение молекулярного водорода (оценивается по избытку HI, HI и СН) 3,5, что хорошо совпадает с экспериментально найденной величиной 3,3 0,2. Затем можно определить свободнорадикальный выход (по экспериментам с акцепторами) [72], и тогда общий выход продуктов согласуется с масс-спектрометрическими данными. [c.192] Метан. Молекулярная формула метана СН ,. Его строение [c.233]
Для предотвращения более глубокого проникновения воздуха (кислорода) в факельную трубу рекомендуется с ветровой нагрузки продувать факельные трубы метаном со скоростью 0,9 м / с п азотом со скоростью 0,7 м / с . Установлена зависимость скорости продувочного газа от диаметра факельной трубы и молекулярной массы продувочного газа. [c.218]
[c.218]
Методика предусматривает разделение неуглеводородных компонентов и низкокипящих углеводородов (водород, кислород, азот, окись углерода, метан и этан) использование молекулярных сит типа 10-Х и 13-Х, а для разделения углеводородов Сз — С5 — трепела Зикеевского карьера, модифицированного вазелиновым маслом. [c.254]
Вследствие низкой чувствительности аргона и азота по отношению к кислороду, азоту, метану, окиси углерода и этану, последние определяют на колонке, заполненной молекулярными ситами, с применением в качестве газа-носителя водорода. [c.254]
Молекулярные комплексы. Образование комплексов парафинов с мочевиной и тиомочевиной рассматривается в гл. XI. Парафины, находящиеся при нормальных условиях в газообразном состоянии (метан, этан, пропан и бутаны), образуют кристаллические гидраты с водой под давлением.Эти гидраты имеют температуру плавления выше 0 °, приблизительно до 21 ° вероятно, они выделяются при транспортировке природного газа под высоким давлением по газопроводам, поэтому обычно приходится осушать газ, промывая его диэтиленгликолем под давлением [c.
 88]
88] Скорость окисления парафинов нормального строения с ростом их молекулярного веса метан — наиболее трудноляемое соединение этого ряда. Несмотря на то, что окисление (без катализаторов) метана начинается уже около 400 ° С, процесс приобретает заметную скорость лишь при температуре около 575 ° С, когда гомологи метана окисляются при более низкой температуре. [c.134]
Ароматические углеводороды в газовой фазе окисляются молекулярным кислородом (без катализаторов), хуже парафинов и олефинов, что связано с их более высокой стабильностью. Температура самовоспламенения смеси паров бензола с воздухом находится в пределах 562—645 ° С, для парафиновых углеводородов она заметно ниже (534 ° С для этана, 475 ° С для пентана) исключение составляет только метан, который самовоспламеняется при 695 ° С. Недавно было доказано, что температура самовоспламенения зависит, [c.169]
Легкие парафиновые углеводороды — жидкие метан, этан, пропан — не растворяют смолистых веществ. На этом основан процесс деасфальтизации гудронов жидким пропаном. С молекулярного веса парафиновых углеводородов способность их несколько повышается. [c.90]
На этом основан процесс деасфальтизации гудронов жидким пропаном. С молекулярного веса парафиновых углеводородов способность их несколько повышается. [c.90]
Молекулярный водород при температуре выше 260 ° С начинает распадаться с атомарной формы. Такой водород, проникая в, разрушает прочную сталь и образует метан [c.150]
Отмеченная выше закономерность уменьшении растворимости в сжатом метане УВ с молекулярной массой и для ароматических УВ. [c.32]
Плотность углеводородных жидкостей. Плотность различных нефтей можно найти в стандартных таблицах. Однако, если используется значительное количество примесей с высокой упругостью паров (метан, этан, азот), то эти таблицы нельзя. Молекулы, имеющие упругость паров, обладают кинетической энергией, которая связана с плотностью плотности.Для определения плотности жидких углеводородов с относительной молекулярной массой ниже 33, молярная доля азота, кислорода и изо-парафинов в менее 5%, моишо использовать формулой, которая применима в интервале температур — (140 + -184,4) ° С, [ c. 37]
37]
Содержание водорода в молекулярной форме можно повысить в формуле водорода в газообразной форме, когда при благоприятных условиях реагентов газификация протекает по реакции, иногда называемой гидрогенолизом.При поступлении внешнего источника элементарного водорода его можно получить при определенных условиях на месте из пара. Полученный таким образом водород реагирует с углеводородным сырьем не хуже, чем чистый водород извне. В этом случае в результате так называемого процесса гидролиза образуются более легкие углеводороды, включая метан. [c.87]
Плотность большинства горючих газов значительно отличается от плотности воздуха. Только этилен (молекулярная масса 28) и этан (мол.масса 30) имеет плотность, близкую к плотности воздуха, молекулярная масса которого считается равной 29. Метан легче воздуха, соединения которых содержат три и более углерода углерода, соединения намного тяжелее воздуха. Даже незначительное различие по плотности может привести к существенному расслоению воздуха, происходящему в результате перепада температур. [c.279]
[c.279]
Растворимость парафина возрастает с уменьшением молекулярного веса алканового растворителя только до С5 — Св.При увеличении молекулярного веса растворителя растворяющая способность начинает падать —в сжиженных газах растворимость парафина в направлении от бутана к метану уменьшается. Растворимость парафина (/ пл 50 ° С) в углеводородных растворителях различного молекулярного веса при разных температурах [50] на рис. 15. [c.72]
Такая закономерность наблюдается для каждого гомологического ряда. Например, из парафиновых углеводородов наиболее термоустойчивые простейшие низкомолекулярные соединения метан и этан.Метая начинает разлагаться при температуре выше 900 °. Высокомолекулярные твердые парафины крекируются в мягких условиях. Это положение справедливо и для нефтяного сырья, представляющего собой сложную смесь различных классов и различного молекулярного веса. Легче всего разлагаются при нагревании тяжелые нефтяные остатки, например мазут, гудрон, значительно труднее — соляровые фракции, еще труднее — керосиновые и т. д. Наиболее устойчивы при высоких температурах газы. [ок.225]
д. Наиболее устойчивы при высоких температурах газы. [ок.225]
Хотя применение молекулярного сита позволяет разделить и углеводородные компоненты, а также метан, этан, этилен, полностью анализ газа на этом адсорбции провести нельзя, так как он прочно удерживает этиленовые углеводороды. Содержание определенных определений на молекулярных ситах, применяя в газе- [c.53]
В качестве используемого сырья, используемого для синтез-газа, посредством парового риформинга, может использоваться природный газ (в основном метан с использованием процентами высококипящих углеводородов) , легкий бензин (в основном, легкие нефтяные дистиллаты) и, наконец, легкие нефтяные дистиллаты.которые содержат различные углеводороды, кипящие при 40-170 С (например, 65% парафинов, 25% нафтенов, 10% ароматических углеводородов и 1% олефинов). В последнем случае средний молекулярный вес близок к 100, а плотность составляет 0,68—0,72 г см, — величины, сходные с молекулярным весом и плотностью гептана С, Нхв. [c.63]
Сравнение реакционной способности углеводородов разных классов показывает, как сильно она зависит от температуры. Так, при нормальной температуре, химически наиболее стойкими из всех классов, используются предельные углеводороды, при температуре 500–800 ° С — ароматические углеводороды предельные же углеводороды становятся весьма нестойкими и легко подвергаются химическим превращениям.Толуол оказывается боле термически стойким, чем к-гептан [26]. В предполагаемой реакционной способности предельных углеводородов проявляется при низких низких температурах. Реакционная способность парафиновых углеводородов при высоких температурах возрастает с молекулярного веса углеводородов. Низкий член парафиновых углеводородов — метан — начинает в заметной степени подвергаться термическому разложению лишь при температуре выше 900 ° С [27], к-гексан разлагается уже при 520 С [28], а твердые парафины (ао — С б) крекируются при 400 С . [c.55]
Термическая устойчивость простейших газообразных парафиновых углеводородов очень велика.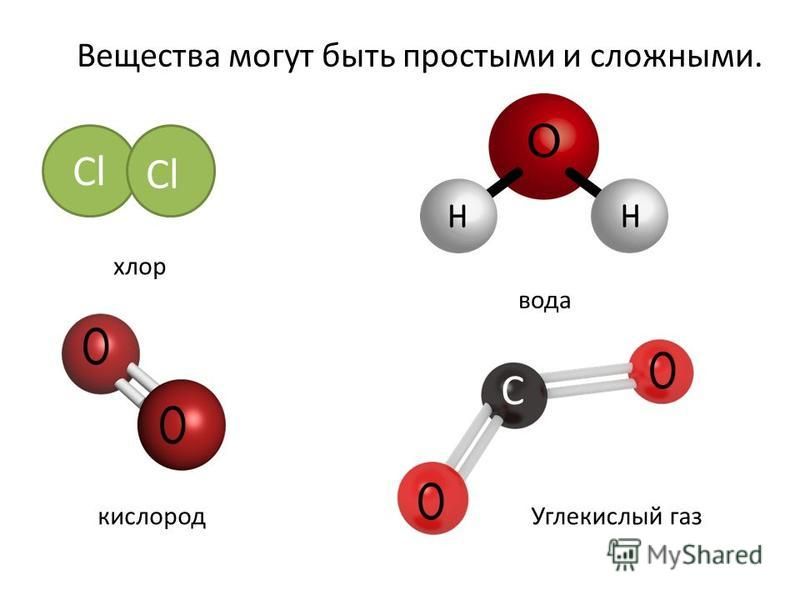 Так, метан при температуре ниже 700—800 ° С практически не разлагается. При умеренной глубине разложения продуктов крекинга являются этан и водород. Этан и пропан склонны к реакциям дегидрогенизации образования соответствующих олефинов. По мере увеличения молекулярного веса грузового употребления термическая устойчивость его понижающая и преобладающая энергия расщепления молекул по связи С — С.Так, н-бутан [c.23]
Так, метан при температуре ниже 700—800 ° С практически не разлагается. При умеренной глубине разложения продуктов крекинга являются этан и водород. Этан и пропан склонны к реакциям дегидрогенизации образования соответствующих олефинов. По мере увеличения молекулярного веса грузового употребления термическая устойчивость его понижающая и преобладающая энергия расщепления молекул по связи С — С.Так, н-бутан [c.23]
Описан межфазный каталитический синтез бром- и иодаре-нов. Реакция при идет действии на раствор арена в хлороформе избытка галогенирующего агента (бромтрихлорметан, иод-метан, молекулярный иод) в присутствии каталитических количеств 18-крауна-б [61]. Реакция на генерировании арил-радикалов. [c.113]
Биядерные комплексные соединения железа, занимающие важное место в живой природе [1-6].В частности, фермент бактерий — метанмоноокси-геназа — гидроксилирует метанмоноокси-геназа в соответствующих восстанавливающих реагентах [c. 77]
77]
Один лишь нагрев не обеспечивает десорбции углеводородов, так как под действием капиллярных сил упругость их паров снижается, что температура кипения повышается на несколько сот градусов. При насыщении активным угля природным газом адсорбируются все компоненты газа, но при дальнейшей адсорбции ниэкомолекулярные углеводороды постепенно вытесняются новыми поступающими высокомолекулярными, так как избирательность адсорбции увеличивается с повышением молекулярного веса.В результате вытеснения сначала десорбируются такие низкомолекулярные углеводороды, как метан и этан. Насыщение адсорбента открывается по проскоку пропана. (Подробное описание этого процесса приведено в главе Синтез Фишера — Тропша, стр. 97). [c.31]
В верхней части факельного ствола был смонтирован предохранитель обратного пламени (молекулярный затвор). Это устройство было предназначено для предотвращения проникновения пла.мени и воздуха в факельный ствол.Чтобы предотвратить проникновение воздуха в факельном стволе, в нижней части молекулярного затвора предусматривался подача в качестве подпорного газа метана-водородная фракция, которая выходила из него в факельной горелке и сгорал в. место со сбросным газом. Количество подаваемой метан-водородной фракции в молекулярный затвор должно было составлять 20 м / ч. Однако замер количества подаваемого запорного газа не был предусмотрен. Чтобы предотвратить замерзание скапливающейся влаги, предусмотрен паровой змеевик в нижней части молекулярного затвора.Для слива влаги и конденсата имелась дренажная линия. [c.204]
место со сбросным газом. Количество подаваемой метан-водородной фракции в молекулярный затвор должно было составлять 20 м / ч. Однако замер количества подаваемого запорного газа не был предусмотрен. Чтобы предотвратить замерзание скапливающейся влаги, предусмотрен паровой змеевик в нижней части молекулярного затвора.Для слива влаги и конденсата имелась дренажная линия. [c.204]
Сырые нефти представляют собой жидкость, цвет которых представляет от янтарно-желтого до коричневато-зеленого и иногда даже черного удельный вес их приблизительно от 0,800 до 0,985 кипят они в пределах от комнатной температуры до температуры выше 350 ° . Нефти из глубоких горизонтов с большим углеводородным газом, так называемые дистиллятные или конденсатные нефти, иметь значительно меньший удельный вес, порядка 0,760, и быть практически бесцветными.Они могут не содержать фракций, кипящих выше 250 или 300 °. Если перегонять нефть, то при температуре около 350 ° начинается частичное термическое разложение. Молекулярный вес обычных сырых нефтей может быть более 1000, что соответствует температуре кипения выше 500 °. В среднем нефти может содержать от 9 до 30 или 40% бензиновых фракций, выкипающих до 200 °. Остальные фракции распределяются по показывающей соотношения, в которых присутствуют керосиновые и газойлевые фракции, легкие и тяжелые масляные фракции и так называемые остаточные продукты.Термин масляные фракции указывает лишь молекулярный вес фракции, так как применимость ее для смазочных целей зависит от небольших различий в составе. После извлечения из пласта нефти обычно насыщены (при давлении и нарушении, условиях хранения) легкими углеводородами (метаном, этаном и др.) И часто содержат сероводород и эмульгированную пластовую воду. Ввиду того, что нефть добывается из нормально восстанови гельной среды, на воздухе обычно они окисляются. С этой точки зрения фракции, выделяемые обычной перегонкой, менее стабильными, чем сами сырые нефти. [c.50]
Молекулярный вес обычных сырых нефтей может быть более 1000, что соответствует температуре кипения выше 500 °. В среднем нефти может содержать от 9 до 30 или 40% бензиновых фракций, выкипающих до 200 °. Остальные фракции распределяются по показывающей соотношения, в которых присутствуют керосиновые и газойлевые фракции, легкие и тяжелые масляные фракции и так называемые остаточные продукты.Термин масляные фракции указывает лишь молекулярный вес фракции, так как применимость ее для смазочных целей зависит от небольших различий в составе. После извлечения из пласта нефти обычно насыщены (при давлении и нарушении, условиях хранения) легкими углеводородами (метаном, этаном и др.) И часто содержат сероводород и эмульгированную пластовую воду. Ввиду того, что нефть добывается из нормально восстанови гельной среды, на воздухе обычно они окисляются. С этой точки зрения фракции, выделяемые обычной перегонкой, менее стабильными, чем сами сырые нефти. [c.50]
Метан (СН4) — бесцветный газ, без запаха н вкуса. Молекулярная масса 16,04, плотность 0,72 кг / м при 0 ° С и 760 мм рт. ст. Температура кипения минус 161,58 ° С, температура плавления минус 182,49 ° С, плотность по воздуху 0,5543, в воде не растворим. Метан не ядовит. При повышении оказывает наркотическое действие и может вызвать удушье. В процессе переработки природного и коксового газов получаются полутные газы — окись и двуокись углерода, которые входят в состав азотоводородной смеси. [c.22]
Молекулярная масса 16,04, плотность 0,72 кг / м при 0 ° С и 760 мм рт. ст. Температура кипения минус 161,58 ° С, температура плавления минус 182,49 ° С, плотность по воздуху 0,5543, в воде не растворим. Метан не ядовит. При повышении оказывает наркотическое действие и может вызвать удушье. В процессе переработки природного и коксового газов получаются полутные газы — окись и двуокись углерода, которые входят в состав азотоводородной смеси. [c.22]
Индивидуальные газообразные углеводороды, которые получаются либо непосредственно из сырой нефти или природного газа, либо путем крекинга более тяжелого нефтепродуктов, используются для производства химических продуктов, пластмасс и синтетического каучука (см. Гл. XIII) или как сырье процессов каталитического превращения — полимеризации и алкилирования, ведущих к получению жидких углеводородов (см. гл. II). Большинство каталитического превращения базируется на использовании реакционной способности олефинов и диолефинов, которые содержатся в газе. Часто ненасыщенные соединения получают дегиданием пли деметанизацией углеводов такого же молекулярного веса. Так, этан моншо дегидрировать в этилен, а пропан либо дегидрировать в пропилен, либо разложить па этилен и метан. Эти и подобные реакции [1-10] 1 имеют место в термических процессах, протекающих при 550—750 ° С. Термическое разложение Taiioro типа легко объясняется радикальным механизмом. По существующему аналогичному характеру реакции разложения жидких углеводородов.Это не менее дегидрирование H-oj xana и к-бутиленов, [c.296]
Часто ненасыщенные соединения получают дегиданием пли деметанизацией углеводов такого же молекулярного веса. Так, этан моншо дегидрировать в этилен, а пропан либо дегидрировать в пропилен, либо разложить па этилен и метан. Эти и подобные реакции [1-10] 1 имеют место в термических процессах, протекающих при 550—750 ° С. Термическое разложение Taiioro типа легко объясняется радикальным механизмом. По существующему аналогичному характеру реакции разложения жидких углеводородов.Это не менее дегидрирование H-oj xana и к-бутиленов, [c.296]
Механизм синтеза. Первоначально предполагали, что при синтезе из окиси углерода и водорода СО взаимодействует с металлическим катализатором, образуя карбид (например, РегС, Ге С, СОаС), который в органических углеводородах восстанавливается с образованием метиленовых групп, что в свою очередь полимеризуются в углеводороды различного молекулярного веса [357, 358]. Эта теория, однако, пе в состоянии объяснить образование кислородсодержащих соединений [393]. Вдобавок предполонгение о том, что восстановление карбидов приводит к получению полимеризующихся метиленовых радикалов, противоречит опыту. Известно, что при восстановлении карбида железа водородом образует метан, а не соединения типа (СНз) — [c.596]
Вдобавок предполонгение о том, что восстановление карбидов приводит к получению полимеризующихся метиленовых радикалов, противоречит опыту. Известно, что при восстановлении карбида железа водородом образует метан, а не соединения типа (СНз) — [c.596]
В обычных условиях метан представляет собой газ без цвета и запаха. Молекулярный вес его 16 043, плотность. 0,7168 кг1м (при 760 мм рт. Ст. И О С), средняя удельная теплоемкость при 18—20 ° С равна [c.24]
Гемпель нагревал газ-ойли до 700—800 ° и пришел к заключению , что ирн разложении главным образом образом группы с одним и двумя атомами углеводорода.Преобладает разложение на метан и олефины большого молекулярного веса. [c.243]
Все нециклические алканы описываются общей химической формулой С Н2 + 2- По мере повышения молекулярной массы алканов происходит систематическое возрастание их плавления и температуры кипения. Метан, этан, пропан и бутан в нормальных условиях-газы пентан и следующие алканы вплоть до С20Н42-жидкости, а С21Н44 и высшие алканы-воскообразные твердые вещества. [c.282]
[c.282]
В 1962 г.Г. Н. Юшкевич и Т. П. Жузе была изучена растворимость в метане и углекислом газе двух насыщенных кислот пальмитиновой 1 пл — 62 С) и стеариновой (пл — 170 41). Эти кислоты входят в состав почти всех жиров. Кроме того, изучалась растворимость в СН4 и СО2 ненасыщенной олеиновой кислоты, встречающейся в больших количествах в растительных маслах. Из спиртов исследовалась растворимость растительного стернна, — эргостерина и животного стерина —холестерина. Холестерин является вторичным спиртом с одной двойной связью.Молекулярная масса его 386, температура [c.43]
Интересно отметить, что мене активные катализаторы (вольфрамовые, молибденовые) дают более высокое отношение низкомолекулярных изопарафинов к к-парафинам по сравнению с более активным платиновым катализатором, который успевает вызвать изомеризацию изопарафинов в к-парафипы. В гидрогенизатах практически отсутствуют углеводороды с четвертичными атомами углерода. Это также указывает на ионный характер изомеризации, так как образование четвертичного атомного атома требует энергетически невыгодного перехода третичного иона во вторичный, а затем в первичный. В составе алюмокобальтмолибденового катализатора в газовой части является основным образом метан и этан. В основном получаются углеводороды нормального строения меньшего молекулярного веса. Очевидно, этот катализатор обладает ярко выраженным свойством ускорять радикальные реакции. [c.307]
В составе алюмокобальтмолибденового катализатора в газовой части является основным образом метан и этан. В основном получаются углеводороды нормального строения меньшего молекулярного веса. Очевидно, этот катализатор обладает ярко выраженным свойством ускорять радикальные реакции. [c.307]
Номенклатура соединений. Систематическая номенклатура соединений исходит из строения молекулярного скелета соединений. Названия соединений составляются из корня и приставок (суффиксов).В на 5ваниях предельных углеводородов используется приставка ан, непредельных с одной двойной связью — диен, непредельных с тройной СВЯЗ11Ю — ин. Корни наименований в зависимости от числа углеродных атомов в скелете образуются ИЗ греческих числительных С5 — пент, Се — гекс, С — гет, Са — окт и т. д., первые четыре предельные углеводорода с нормальной (не разветвленной) цепью имеют эмпирические названия С — метан, С2 — этан, С3 —пропан, С4 — бутан. В названиях алициклических углеводородов перед корнем ставится приставка цикло, а после корня — соответствующие суффиксы ан, ен, диен. Названия соединительных групп, составляющие различные функциональные группы, произ- [c.143]
Названия соединительных групп, составляющие различные функциональные группы, произ- [c.143]
В первой главе рассмотрена проблема факторов обычных (молекулярных) и радикальных факторов как часть реакционной способности частиц. На основе метода переходного состояния получены формулы для расчета стерических факторов мономолекулярных и бимолекулярных факторов и зависимости их от температуры. Прогрессивный метод расчета стерических факторов гибкости.Этот метод расчета стерических факторов радикальных состояний основан на квантово-механических соображениях и апрокси-мации сумм состояний радикалов при помощи сумм молекул, близких по своему химическому строению к радикалам молекул. Приближенный способ расчета применен к вычислению стерических факторов альтернативных факторов приближения радикалов -Н, СНз к непредельным углеводородам (этилен, пропилен, изоблен, аллен, ацетилен и др.) , бута- [с.10]
2.2. Моль, молярная масса
2.
 2. Моль, молярная масса
2. Моль, молярная масса
2.2. Моль, молярная масса
В химических процессах участвуют мельчайшие частицы — молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристик количества вещества, используется участвующего в химических реакций, используется специальная единица — моль .
Моль — это такое количество вещества, в котором содержится определенное число частицы (молекулы, элементы, главная), равное постоянное Авогадро
Постоянная Авогадро N A определяет как число атомов, содержащееся в 12 готопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частицы этого вещества.
Исходя из этого, любое количество вещества можно выразить
определенным числом молей ν ( ню ). Например, в образце вещества
содержат 12,04 • 10 23 молекул. Следовательно,
количество вещества в этом образце составляет:
Например, в образце вещества
содержат 12,04 • 10 23 молекул. Следовательно,
количество вещества в этом образце составляет:
В общем виде:
где N — число частиц данного вещества;N A — число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M)
— масса, которую имеет 1 моль данного вещества.
Эта величина, равная относительно массы m вещество к количеству вещества ν , имеет размерность кг / моль
или г / моль .Молярная масса, выраженная в г / моль, численно равна относительной относительной молекулярной массе M r
(для веществ атомного строения — относительной атомной массе A r ).
Например, молярная масса метана CH 4 определяется следующим образом:
M (CH 4 ) = 16 г / моль, т.
 е. 16 г CH 4 содержат 6,02 • 10 23 молекул.
е. 16 г CH 4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса м и количество (число молей) ν , по формуле:
Соответственно, зная масса и молярная масса вещества, можно рассчитать число его молей: или найти массу вещества по количеству молей и молярной массе: m = ν • MНеобходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от M r и A r . Поэтому разные имеют одинаковом количестве молей различные массы м .
Пример
Вычислить массы метана CH 4 и этана С 2 H 6 ,
взятых в количестве ν = 2 моль каждого.
Молярная масса метана M (CH 4 ) равна 16 г / моль;
молярная масса этана M (С 2 Н 6 ) = 2 • 12 + 6 = 30 г / моль.

Отсюда: м (CH 4 ) = 2 моль • 16 г / моль = 32 г ;
м (С 2 Н 6 ) = 2 моль • 30 г / моль = 60 г .
Таким образом, моль — это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы (атомы и молекулы) не одинаковы по массе.
n (CH 4 ) = n (С 2 Н 6 ), но м (CH 4 ) (С 2 Н 6 )
Вычисление ν используется практически в каждой расчетной задаче.
стехиометрическое соотношение окислителя к горючему
При проектировании и эксплуатации газопламенного оборудования часто возникает вопрос об определении оптимального соотношения количества горючего и окислителя, обеспечивающего их полное сгорание с выделением количества тепловой энергии.
Рассмотрим методику определения оптимального соотношения количества горючего и окислителя на примере: горючий газ — метан (Ch5), окислитель — кислород (O2).
Реакция окисления (горения) метан / кислород:
CH 4 + 2xO 2 → CO 2 + 2xh3O (1)
Молярная масса одной молекулы: водорода (Н) — 1 г / моль, углерода (C) составляет 12 г / моль, кислород (O) — 16 г / моль. Тогда, молярная масса молекулы метана (CH 4 ) составляет 16 г / моль, а молярная масса молекулы кислорода (O 2 ) составляет 32 г / моль. Как следует из формулы (1), для полного окисления одной молекулы метана (CH 4 ) требуется две молекулы кислорода (O 2 ).
Введем понятие стехиометрические отношения [1] окислителя к горючему (по массе):
где m — масса газа;
ν — количество вещества, моль [2];
M — молярная масса газа;
индекс « ок » — окислитель;
индекс « гг » — горючий газ.
Количество компонентов определяется в молях и определяет число единиц (ими могут быть атомы или молекулы) определяемого вещества, отнесенного к другим единицам (элементов) в 0,012 кг (12 гр) изотопа углерода C 12 . Из этого следует, что в 0,012 кг (12 гр) изотопа углерода C12 содержится один моль количества вещества. Само число структурных единиц, есться в одном моле вещество, называется номер Авогадро и равно N A = 6,023×10 23 моль -1 = 6,023×10 26 кмоль -1 [2].
Из этого следует, что в 0,012 кг (12 гр) изотопа углерода C12 содержится один моль количества вещества. Само число структурных единиц, есться в одном моле вещество, называется номер Авогадро и равно N A = 6,023×10 23 моль -1 = 6,023×10 26 кмоль -1 [2].
В таком случае количество вещества определяется запускением:
где N — число структурных единиц (молекул) веществ, участвующих в окислении.
Как указывалось выше, в одном моле любого вещества N A число структурных единиц, при этом у каждого вещества структурная единица обладает своей массой (масса атома, масса молекулы). Следовательно, массой обладает и один моль вещества, эта масса называется молярной массой. В таком случае, если (в частности, газ) имеет массу вещества m , а число единиц этого вещества таково, что количество вещества составляет ν, то:
Тогда, в частном случае, при сгорании метана в кислороде, можно записать:
индекс « О 2 » — кислород;
индекс « CH 4 » — метан.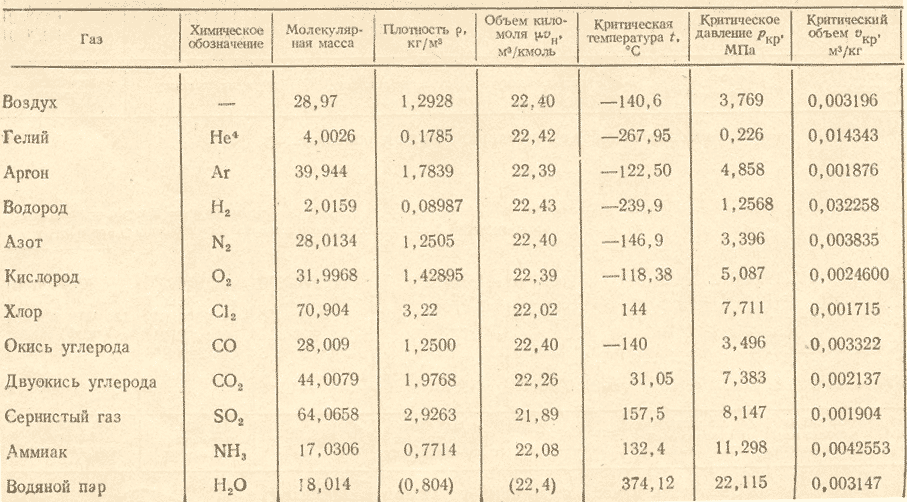
Измерение массы газа в системе измерения расхода газа. Для того, что бы определить потребный объем кислорода для полного сгорания 1 м3 метана, запишем уравнение состояния [2] для каждого из газов:
где p — давление газа;
V — объем газа;
R — универсальная газовая постоянная;
T — температура газа.
следует заметить, что в момент реакции давление и температура газов будут одинаковыми.
Решим соотношения (5а) и (5б) относительно окружающей среды газов и определим стехиометрическое отношение кислорода к метану (по объему):
Т.к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определены следующие значения для соотношения (6):
В таком случае отношения кислорода к объему метана равно 2, т.е. для сжигания 1 м 3 метана потребуется 2 м 3 кислорода.
Соотношение (6) можно записать более универсально:
Как окислителя используется воздух, очень часто в газопламенном оборудовании используется воздух. По данным, приведенным в [1], процентное содержание кислорода в воздухе (по массе) составляет 23,2%. Запишем соотношение:
По данным, приведенным в [1], процентное содержание кислорода в воздухе (по массе) составляет 23,2%. Запишем соотношение:
где индекс « вз » — воздух;
Если в соотношении (8) числитель (масса кислорода) и знаменатель (масса воздуха) помножить на массу горючего газа, который необходимо сжечь (окислить), можно перейти к стехиометрическим соотношениям (по массе):
Для исследования процесса горения метана в воздухе необходимо в соотношении (9б) подставить значение
тогда получим
т.е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
Для определения объема воздуха, необходимого для сжигания 1м 3 метана, воспользуемся использованием (7):
где М ВЗ = 29 г / моль [1].
В общем виде соотношение (10а) примет вид:
Подставив значения в соотношение (10б), получим, что для сжигания 1 м 3 метана потребуется
9,512 м 3 воздуха.
Так же в качестве горючих газов часто используются пропан (C 3 H 8 ) и бутан (C 4 H 10 ).
Реакция окисления (горения) пропан / кислород и бутан / кислород:
C 3 H 8 + 5xO 2 → 3xCO 2 + 4xH 2 O (11)
2xC 4 H 10 + 13xO 2 → 8xCO 2 + 10xH 2 O (12)
Молярные массы: пропана — M C 3 H 8 = 44 г / моль; бутана — M C 4 H 10 = 58 г / моль.
Используя выводы, сделанные для реакции окисления метана и кислорода, получаем требуемую массу кислорода (O 2 ) для сжигания 1 кг пропана (C 3 H 8 ) — 3,636 кг кислорода (O 2 ), а для сжигания 1 кг бутана (C 4 H 10 ) — 3,586 кг кислорода (O 2 ).
Тогда можно записать:
Учитывая соотношение (9б), определяем, что
т. е. для сжигания 1 кг пропана необходимо 15,672 кг воздуха, а для сжигания 1 кг бутана — 15,457 кг воздуха.
е. для сжигания 1 кг пропана необходимо 15,672 кг воздуха, а для сжигания 1 кг бутана — 15,457 кг воздуха.
Используя соотношение (7) или (10б), определяем объем кислорода (O 2 ) и воздуха, которые необходимы для сжигания 1 м 3 пропана и 1 м 3 бутана, что показано в таблице 1.
Таблица 1. Расход окислителя на 1 кг (1 м3) горючего газа
| Окислитель | Горючий газ | Метан (CH 4 ) | Пропан (C 3 H 8 ) | Бутан (C 4 H 10 ) |
| Кислород (O 2 ) | 4 кг (2 м 3 ) | 3,636 кг (5 м 3 ) | 3,586 кг (6,5 м 3 ) |
| Воздух | 17,24 кг (9,512 м 3 ) | 15,672 кг (23,779 м 3 ) | 15 457 кг (30 914 м 3 ) |
Пропан (C 3 H 8 ) и бутан (C 4 H 10 ) чаще всего используются не по отдельной, а как смесь горючих газов.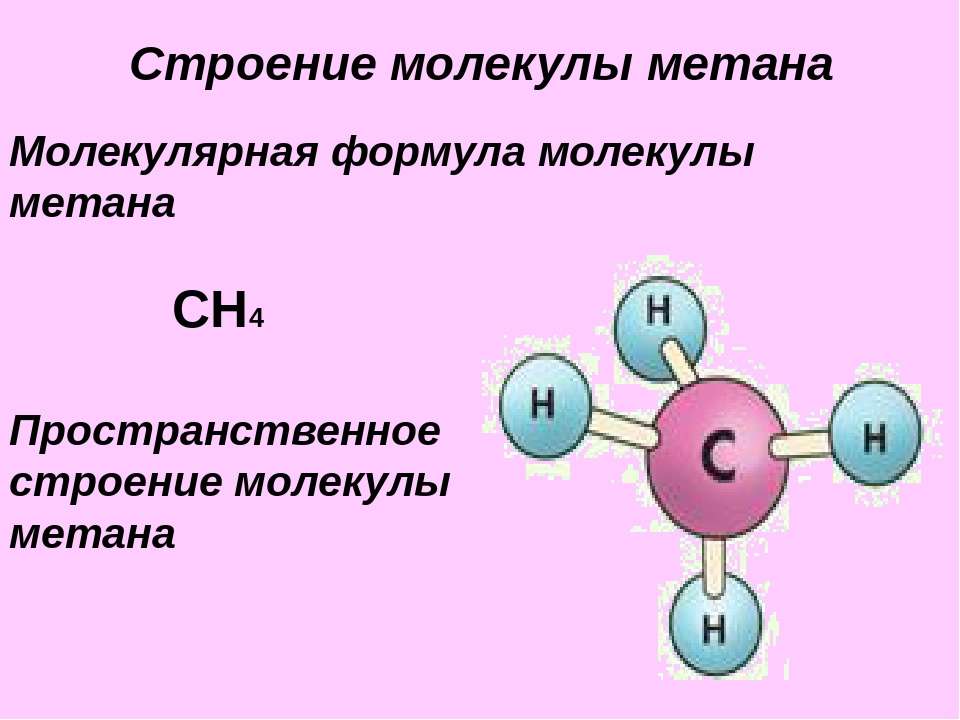 Поэтому количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Поэтому количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Пусть γ — доля (по массе) содержания пропана в смеси, а β — доля (по массе) содержания бутана в смеси. γ и β подчинены следующему действию:
γ + β = 1 (13)
Т.к. пропан и бутан не вступают в химические реакции, то стехиометрическое отношение для каждого из газов не будет меняться, а стехиометрическое отношение для пропанобутановой смеси в зависимости от окислителя будет определяться расходением:
индекс « C 3 H 8 — C 4 H 10 » — пропанобутановая смесь.
Значения стехиометрических данных в зависимости от процентного содержания пропана и бутана в смеси представлены в таблице 2.
Таблица 2. Стехиометрические отношения (по массе) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O 2 ) | 3 621 | 3 616 | 3 611 |
| Воздух | 15,607 | 15,586 | 15,565 |
Для того, чтобы определить размер окислителя к объему пропанобутановой смеси, обеспечить полное сгорание, согласно заявлению (7) необходимо определить молярную массу пропанобутановой смеси — M C 3 H 8 -C 4 H 10 .
Для этого воспользуемся законом Дальтона [1]:
Надо учитывать, что в законе Дальтона как температура каждого из газов и их смеси, так и объем, занимаемый как газом, так и их смесью, одинаковы.
Выразив давление для пропана, бутана, а также их смеси через уравнение состояния, аналогично (5а) и (5б), можно перейти к следующему результату:
Учитывая, что
соотношение (16) можно переписать:
Значения молярных масс пропанобутановых смесей для наиболее часто используемых γ и β, данные в таблице 3.
Таблица 3. Молярные массы пропанобутановых смесей
| Молярная масса | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| M C 3 H 8 -C 4 H 10 | 47,435 | 48 702 | 50 039 |
Тогда в соответствии с использованием (7) или (10б) можно рассчитать стехиометрические соотношения (по объему) для различных пропанобутановых смесей, что и приведено в таблице 4.
Таблица 4. Стехиометрические отношения (по объему) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O 2 ) | 5,368 | 5 503 | 5 647 900 10 |
| Воздух | 25 529 | 26,175 | 26 857 |
Следует заметить, что указанные значения расходалителя (как по массе, так и по объему) на единицу горючего газа, следует увеличить на 2-5%, т.к. в воздухе и технически кислороде присутствуют другие компоненты, которые вызывают высокие температуры горения, сами вступают в реакцию окисления.
Так же согласно [1] и [2] закон Дальтона и уравнение состояния соблюдаются в диапазоне низких давлений. Тем не менее, используется обычное газопламенное оборудование при давлении от
Тем не менее, используется обычное газопламенное оборудование при давлении от
до 5 МПа, что позволяет использовать данные соотношения, так и приведенные значения.
Газопламенное оборудование, спроектированное ООО «Машпроект» (сайт: машпроект.рф
E-mail:
Этот адрес электронной почты защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
), обеспечивает сгорание горючих газов, как в кислороде, так и в оптимальном воздухе. Поэтому наша продукция обладает высокой топливной эффективностью и, как следствие, низкими эксплуатационными затратами.
СПИСОК ЛИТЕРАТУРЫ
1. Глинка Н.Л. Общая химия — Л.: Химия, 1979. — 720 с.
2. Савельев И.В. Общий курс физики. Т. 1 — М .: Наука, 1977 — 416 с.
Метан — топливо завтрашнего дня
Метан (лат.Methanum) — это газ, легче воздуха, представляющий собой простейший углеводород.Малорастворимый в воде. Не вызывает коррозии. Не имеет цвета, запаха и вкуса. Специфический «запах газа» метан приобретает из-за добавления в него в целях безопасности одорантов (как правило, тиолов).
Не имеет цвета, запаха и вкуса. Специфический «запах газа» метан приобретает из-за добавления в него в целях безопасности одорантов (как правило, тиолов).
Физико-химические свойства метана:
Молекулярная формула — СН 4
Молекулярная масса — 16,03 кг / моль
Углеродное число — 2,96
Относительная плотность — 0,554
Плотность при температуре 15 ◦ С и давление 0,1 Мпа:
- в газообразном состоянии — 0,717 кг / м 3
- в жидком состоянии — 0,42 кг / л
Температура кипения — 161,7 ◦ С
Температура самовоспламенения — 590 ◦ С
Температура горения — 2030 ◦ С
Удельная теплота испарения — 515 кДж / м 3
Низкая теплота сгорания:
- в газообразном состоянии — 33 800 кДж / м 3
- в жидком состоянии — 20 900 кДж / л
Что представляет собой природный газ?
При использовании термина «природный газ» на самом деле речь идет о самом метане газа, поскольку он представляет собой основную часть природного газа. В смесь также входят азот и гелий, а также другие газы, содержание которых довольно незначительно: бутан, пропан, углекислый газ, пентан и др.
В смесь также входят азот и гелий, а также другие газы, содержание которых довольно незначительно: бутан, пропан, углекислый газ, пентан и др.
Запасы метана в мире
На сегодняшний день мировые запасы метана оцениваются в 300 триллионов кубометров. Основными объемами запасов метана три страны: Россия (28%), Иран (16%) и Катар (15%). Использование его в газомоторном топливе для нее является первостепенная важная информация.
Процесс очистки
Метан не нуждается в сложных процессах очистки, без невозможности использования бензина и дизельного топлива. Сразу после добычи его можно применять в качестве экологически чистого топлива.
Термические характеристики
Природный газ при термическом использовании обладает преимуществом по сравнению с твердым и жидким топливом. Он отличается регулировкой пламени и более гибким процессом горения.Кроме того, при его сгорании не образуются отходы и коррозийные компоненты.
Безопасность использования
Метан не представляет опасности для здоровья людей и безопасен в плане токсичности. К тому же он менее пожароопасен по сравнению с нефтепродуктами. Это объясняется тем, что у него более высокая температура возгорания. Так, метан самовоспламеняется при температуре 595 градусов Цельсия. Эта температура в два раза выше той, при которой происходит самовозгорание жидкого топлива.А плотность горения, 5%, значительно превосходит аналогичный параметр бензина и дизтоплива — 1% и 0,5% соответственно. Метан обладает более низкой плотностью, чем воздух, поэтому при утечке он не застаивается у поверхности и не скапливается в опасной среде, а просто поднимается вверх и рассеивается в воздухе.
Метан взрывобезопасен и не требует примеси веществ, предотвращающих взрыв. Его октановое число — 120, что значительно выше, чем аналогичный параметр бензина. Именно этот показатель определяет, насколько обладает сопротивляемостью взрыву.
Одно из наиболее важных достоинств метана — его безвредность для экологии. Метан, сгорающий в камере двигателя, выделяющий атмосферу в атмосфере только воду и углекислый газ, которые являются неагрессивными веществами.
Предыдущая запись
Природный газ Следующая запись
Использование газомоторного топлива: прошлое и будущее
ИЗОТОПНО-ГЕОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ УГЛЕВОДОРОДНЫХ ГАЗОВ ДОННЫХ ОСАДКОВ ШЕЛЬФА ВОСТОЧНО-СИБИРСКОГО МОРЯ
711
ДОКЛАДЫ АКАДЕМИИ НАУК, 2016, с 469, № 6, с том.711–713
ИЗОТОПНО-ГЕОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ УГЛЕВОДОРОДНЫХ
ГАЗОВ ДОННЫХ ОСАДКОВ ШЕЛЬФА ВОСТОЧНО-СИБИРСКОГО МОРЯ
© 2016 г. А. И. Гресов1,2, *, Н. Е. Шахова2, академик РАН В. И. Сергиенко3,
А. В. Яцук1,4, **, И. П. Семилетов1,2
Поступило 28.10.2015 г.
Представлены результаты газогеохимических исследований углеводородных газов донных осадков
Восточно-Сибирского моря. Определены основные изотопно-геохимические показатели сингене-
тических и эпигенетических углеводородных газов. Установлены взаимосвязи показателей молекулы-
Установлены взаимосвязи показателей молекулы-
лярной массы углеводородной фракции от изотопного состава углеводородных газов раз-
личного происхождения.
DOI: 10.7868 / S086956521624018X
Восточно-Сибирское море (ВСМ) — самое
слабоизученное в газогеохимическом отношении
из арктических морей. Месторождения углеводородов
родов на шельфе ВСМ до настоящего времени
обнаружены, однако региональные высокие
перспективы для поиска залежей нефти и газа.
Газогеохимические исследования донных осадков-
ков установили наличие аномальных концентра-
ций углеводородных газов (УВГ) и прямых при-
знаков нефтегазоносности шельфа ВСМ [1, 2].
Цель нашей работы — определение индивидуаль-
новых изотопно-газогеохимических показателей
УВГ донных осадков различного генезиса ос-
новых анализа опубликованных данных и получен-
новых в процессе экспедиционных работ материа-
лов. Развитие в этом направлении
Развитие в этом направлении
также важно в климатическом аспекте, так как
обнаруженные массированные выбросы метана в
регионе ассоциируются с дестабилизацией газо
вых гидратов деградации подводной
мерзлоты [3–5].
Объекты газогеохимических поднятий исследований —
УВГ донных осадков Новосибирского, Пегты-
мельского, Айонского, Южно-Чукотского, Севе-
ро-Чукотского бассейнов, а также Медвежинское
-надвиговая зона Геральда (рис.1).
В газогеохимическом комплексе работ ис-
пользовали двумя методами определения со-
става УВГ донных осадков проб: равновесные концен-
траций [6] и отбора проб в герметические сосуды
с помощью вакуумной дегазацией [7]. Изо-
топный состав углерода УВГ определяли на масс-
спектрометрах Finnigan MAT-252, Deltaplus XL,
GC Combustion III. Изучение изотопно-газогео-
химических показателей УВГ выполнено на
82 донных станциях, осадочных отложений — в
29 скважинах, пробуренных в акваториальной,
островной и прибрежной части ВСМ.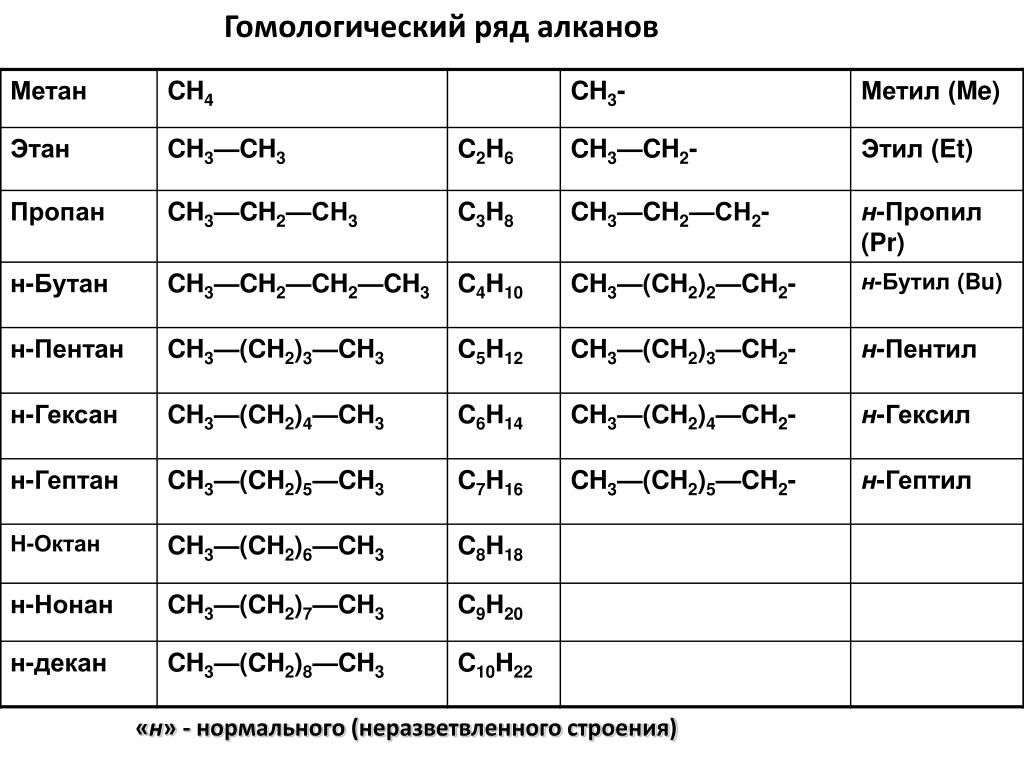
Исследования установлены, что по услови-
ям образования и происхождение УВГ донных
осадков подразделяются на сингенетические и
эпигенетические. К сингенетическим звеном
газы, образовавшиеся в результате различных
биохимических методов в процессе деструкции
органических веществ непосредственно в дон-
водных осадках. Эпигенетические га-
зами, поступающими в донные осадки из подсти-
лающих углегазоносных, нефазоносных отло-
жений и магматических образований в результате
процесса диффузии и их по зонам раз-
ломов.
Молекулярная масса углеводородной фракции
(Мув.) Сингенетических УВГ донных осадков,
представленных в основном метаном, 16.04–
16.06 г / моль. Показатели Мув. эпигенетических
(миграционных) УВГ, представленных гомологи-
ческим рядом от С1 до С5, 16.09–24.72 г / моль и за-
висят от типа газоматеринского источника. Срав-
Срав-
УДК 553.981: 551.35 (47: 211)
ГЕОХИМИЯ
1 Тихоокеанский океанологический институт
им.В.И. Ильичева
Дальневосточного отделения
Российской Академии наук, Владивосток
2 Национальный исследовательский
Томский политехнический университет
3 Институт химии
Дальневосточного отделения
Российской Академии наук, Владивосток
Российской Академии наук, Владивосток
Дальний * E-mail: [email protected]
** E-mail: [email protected]
5 *
ИССЛЕДОВАНИЕ СОСТАВА СИНТЕТИЧЕСКИХ ГИДРАТОВ МЕТАНА, ЭТАНА ПОЛУЧЕННЫХ В УСТАНОВКАХ ЗАКРЫТО | Опубликовать статью ВАК, электронная (НЭБ)
Корякина В.В. 1 , Семенов М.Е. 2 , Шиц Е.Ю. 3 , Портнягин А.С. 4
1 Младший научный сотрудник, 2 Младший научный сотрудник, 3 Доктор технических наук, 4 Младший научный сотрудник, ФГБУН Институт проблем нефти и газа СОРАН
ИССЛЕДОВАНИЕ СОСТАВА СИНТЕТИЧЕСКИХ ГИДРАТОВ МЕТАНА, ЭТАНА ПОЛУЧЕННЫХ В УСТАНОВКАХ ЗАКРЫТОГО ТИПА
Аннотация
В статье приводятся результаты исследований, улучшающих качество синтетических гидратов метана и этана в камерах- реакторах высокого давления закрытого типа. Установлено, что процесс получения газогидратов в изохорных условиях имеет разный по времени индукционный период, продолжительность которого в процессе образования гидратов этана меньше, чем для гидратов, образующихся из метана. Показано, что наличие металлических поверхностей внутри камеры-реактора приводит к сокращению периода индукции и повышения массового содержания гидрата в смеси «лед –гидрат». Расчетами показано, что состав синтетически полученный гидратов метана описывается как 7.67 CH 4 * 46 H 2 O , состав гидрата этана практически идеален- 5.95С 2 Н 6 * 46Н 2 О. Результаты исследования исследования для разработки новых приемов повышения эффективности процесса перевода газа в твердое концентрированное состояние и разработки самостоятельного вида и хранения углеводородного сырья.
Установлено, что процесс получения газогидратов в изохорных условиях имеет разный по времени индукционный период, продолжительность которого в процессе образования гидратов этана меньше, чем для гидратов, образующихся из метана. Показано, что наличие металлических поверхностей внутри камеры-реактора приводит к сокращению периода индукции и повышения массового содержания гидрата в смеси «лед –гидрат». Расчетами показано, что состав синтетически полученный гидратов метана описывается как 7.67 CH 4 * 46 H 2 O , состав гидрата этана практически идеален- 5.95С 2 Н 6 * 46Н 2 О. Результаты исследования исследования для разработки новых приемов повышения эффективности процесса перевода газа в твердое концентрированное состояние и разработки самостоятельного вида и хранения углеводородного сырья.
Ключевые слова: гидраты метана, этана, изохорные условия, установки закрытого типа, массовое содержание газогидрата.
Корякина В.В. 1 , Семенов М.Е. 2 , Шиц Е.Ю. 3 , Портнягин А.С. 4
1 младший научный сотрудник, 2 младший научный сотрудник, 3 кандидат технических наук, 4 младший научный сотрудник, Институт проблем нефти и газа СО РАН
ИССЛЕДОВАНИЕ СТРУКТУРЫ СИНТЕТИЧЕСКИХ ГИДРАТОВ МЕТАНА, ЭТАНА, ПОЛУЧЕННЫХ НА УСТАНОВКАХ ЗАКРЫТОГО ТИПА
Аннотация
В статье приведены результаты исследований по особенностям получения синтетических гидратов метана и этана в камерах — реакторах высокого давления закрытого типа.Установлено, что процесс получения газовых гидратов в изохорных условиях имеет различный по времени индукционный период, продолжительность которого в процессе образования гидратов этана меньше, чем для гидратов, образующихся из метана. Показано, что наличие дополнительных металлических поверхностей роста в камере-реакторе приводит к сокращению периода индукции и увеличению массового содержания гидрата в смеси «лед-гидрат». Расчетами показано, что состав синтетических полученных гидратов метана описывается цифрой 7.67CH 4 * 46H 2 O, а структура гидрата этана практически идеальна — 5.95C 2 H 6 * 46H 2 O. Результаты исследований могут быть использованы для разработки новых методики повышения эффективности процесса перевода газа в твердо концентрированное состояние и создания газогидратных технологий как самостоятельного вида транспортировки и хранения углеводородного сырья.
Расчетами показано, что состав синтетических полученных гидратов метана описывается цифрой 7.67CH 4 * 46H 2 O, а структура гидрата этана практически идеальна — 5.95C 2 H 6 * 46H 2 O. Результаты исследований могут быть использованы для разработки новых методики повышения эффективности процесса перевода газа в твердо концентрированное состояние и создания газогидратных технологий как самостоятельного вида транспортировки и хранения углеводородного сырья.
Ключевые слова: газовые гидраты метана, этан, изохорные условия, установки закрытого типа, массовая доля газогидрата.
Введение. С точки зрения массового анализа лабораторных условий гидратообразования условно можно разделить на два типа: открытые — когда гидратообразование происходит при равновесных условиях, при этом постоянном давлении в системе за счет притока газа-гидратообразователя и закрытые — когда образование гидратообразования происходит за счет изменения термобарических условий во всей системе без дополнительного притока гидратообразователя. Открытые условия получения газогидратов реализуются в изотермических и изобарных установках, а закрытые только в изохорных.Процессы получения гидратов в открытых условиях, в основном, используются в целях исследования термодинамических процессов процесса гидратообразования, осуществляются в равновесных условиях, поддержание достаточно энергозатратно. Противовес этому в изохорных условиях рост гидрата протекает без дополнительного притока гидратообразующего компонента. Установки, в которых протекает данный процесс, более просты в аппаратно-техническом исполнении.
Открытые условия получения газогидратов реализуются в изотермических и изобарных установках, а закрытые только в изохорных.Процессы получения гидратов в открытых условиях, в основном, используются в целях исследования термодинамических процессов процесса гидратообразования, осуществляются в равновесных условиях, поддержание достаточно энергозатратно. Противовес этому в изохорных условиях рост гидрата протекает без дополнительного притока гидратообразующего компонента. Установки, в которых протекает данный процесс, более просты в аппаратно-техническом исполнении.
Таким образом, целью работы являлось получение простых гидратов метана и этана в установках закрытого типа, определение массового содержания газогидрата в полученных синтетически образцах как основного эффекта этого процесса.
Гидраты газов — нестехиометрические соединения газов и воды клатратного типа. Структура гидратов представляет собой водные полости, заполненные молекулами газов. По структуре гидраты делят на множество типов наиболее распространенных из имеющихся кубических структурных типов КС-1 и КС-2 [1].
Существуют эмпирические правила [2], согласно индивидуальным газам и их смеси могут образовывать определенные структуры:
- Соразмерность размеров молекулы гостя и малых полостей определить возможность образования газом кристаллического гидрата;
- Для формирования структуры гидратационное соотношение размеров молекулы-гостя к размеру водной полости-хозяина должно быть в пределах 0,86-0,98.При значениях ниже 0,8 молекула гостя недостаточно обеспечивает отталкивание молекулы воды в полости, система чего становится не стабильной или же разрушается. Например, молекула метана может входить в любые полости любой из структур, однако, большие полости структуры КС-1, она поддерживает лучше, чем в структуре КС-2 (соотношение диаметров в структурех, соответственно 0,74 и 0,66). Поэтому чистый метан образует гидрат структуры КС-1, так как он является наиболее стабильной. То же касается и гидрата этана, так как для структуры КС-2 соотношение равное 0,84 недостаточно, поэтому этан образует гидрат, преимущественно, структуры КС-1, причем идет заполнение этаном только больших полостей.
 3. Соотношение размеров молекулы-гостя к водной полости-хозяина определяет равновесные Т, Р -значения процесса гидратообразования: чем меньше значение температуры, тем выше равновесное давление. Поэтому, метан образует гидрат при более высоких давлениях, чем все газы, а добавление 1% пропана к метану уменьшает равновесное давление на 42% (при Т = 280,4К, соответственно, с 5,35 МПа до 3,12 МПа) [3]. Этан, по сравнению с метаном, образует гидрат при меньших давлениях.
3. Соотношение размеров молекулы-гостя к водной полости-хозяина определяет равновесные Т, Р -значения процесса гидратообразования: чем меньше значение температуры, тем выше равновесное давление. Поэтому, метан образует гидрат при более высоких давлениях, чем все газы, а добавление 1% пропана к метану уменьшает равновесное давление на 42% (при Т = 280,4К, соответственно, с 5,35 МПа до 3,12 МПа) [3]. Этан, по сравнению с метаном, образует гидрат при меньших давлениях.
Таким образом, состав газа-гидратообразователя является основным фактором, отвечающим за формирование газомрата той или иной структуры и определяет условия его образования.
Экспериментальная часть. Получение гидратов метана и этана в установках закрытого типа.
В работе получения гидратов метана, этана осуществляется из определенных количеств воды и газа (табл. 1) в закрытых камерах- реакторах высокого давления. Для получения гидратов, прежде всего, необходимо рассчитать начальные условия гидратообразования. Расчет условий производился по методике Слоана с использованием уравнения состояния реального газа Редлиха-Квонга [2].В таблице 2 приведены начальные условия синтеза гидратов.
Расчет условий производился по методике Слоана с использованием уравнения состояния реального газа Редлиха-Квонга [2].В таблице 2 приведены начальные условия синтеза гидратов.
Таблица 1 — Условия синтеза гидратов
| Гидраты | Т загрузки , К | Р загрузки , атм | В воды |
| метана | 283 | 50 | 200 |
| этана | 283 | 10,35 | 50 |
Последовательность этапов процесса синтеза гидратов представлена на рисунке 1.
Рисунок 1 — Процесс заправки камер газом (синий квадрат), синтез в инкубаторе- холодильнике и разложение (зеленый квадрат): 1. баллон с газом-гидратообразователем; 2. камера синтеза: а — образцовый манометр, b- крышка-фланец; 3. кран; 4. вытеснительный сосуд; 5. газовая бюретка; 6. камера с гидратом; 7. термостат
термостат
В камеру наливали необходимое количество дистиллированной воды и вакуумировали. При температуре 283 К в камере с водой подавали соответствующий газ до давления, которое происходит давлению начала гидратообразования при температуре 280 К (табл.1). В дополнительную дополнительную подзарядку камер газом не осуществляли. После заправки водой и газом-гидратообразователем камеру помещали в холодильник-инкубатор. Процесс гидратообразования осуществляли в режиме регулирования температуры по расчетной равновесной кривой (рис.2). Таким образом, температурные условия эксперимента были разделены на два этапа, которые постоянно продолжаются до прекращения роста гидрата: быстрое охлаждение на 1˚С (в течение 5-10 минут) и длительный период изотермического гидратообразования.
Рисунок 2 — Равновесные кривые гидратообразования и температурный режим охлаждения, где — регулирование температуры: изменение (падение) давления:
Как правило, образование гидратов в закрытых камерах происходит преимущественно: по стенкам камеры за счет поднятия воды происходит движение капиллярных сил к центрам кристаллизации растущего гидрата и диффузионно -на свободной поверхности воды (так как жидкая фаза, в случае, не подвергается принудительной конвекции) . Выполненные из стальных пластин общей площадью 200 см 2 следующего состава: C <0,005, Si> 1,65, Mn — 0,09, Cr — 0,02, Ni — 0,08, Mo — 0,014, Cu — 0,06, Fe — остальное.
Выполненные из стальных пластин общей площадью 200 см 2 следующего состава: C <0,005, Si> 1,65, Mn — 0,09, Cr — 0,02, Ni — 0,08, Mo — 0,014, Cu — 0,06, Fe — остальное.
Расчет состава синтетического гидрата.
Для оценки эффективности процесса искусственного получения гидратов метана / этана был проведен расчет массового синтеза гидрата в получаемой смеси «гидрат — лед».Расчеты производились на основании результатов исследований процесса разложения полученного газогидрата. Методика эксперимента заключена в следующем: давление в камере с синтезированной смесью понижали до атмосферного, после чего камеру помещали в термостат (рис.1). Замер величины уровня газа из гидрата осуществляли при температуре 294 К. Процесс до полного разложения смеси, о чем судили по прекращению газа. Таким образом, определение содержания гидрата в смеси «лед-гидрат» и степень превращения воды в гидрат газа по объему выделившегося газа.
Известно, что метан и этан образуют простые гидраты структуры КС-I (кубическая структура), причем если метан, молекула которого достаточно мала, заполняет как малые, так и большие полости, то молекула этана заполняет только большие полости гидратной структуры [4]. Зная заполнения малых и больших полостей, которые вычисляются на основании уравнений изотермы Ленгмюра, можно найти состав и плотность образованного гидрата [4].
Зная заполнения малых и больших полостей, которые вычисляются на основании уравнений изотермы Ленгмюра, можно найти состав и плотность образованного гидрата [4].
Фазовый переход в системе «вода — гидратообразователь» происходит только при равновесных температурах и давлении гидратообразования путем адсорбции молекул поверхности воды, которая описывается изотермой Лэнгмюра [4]:
(1)
Так как гидратообразующий газ состоит только из одного компонента — метана (этана), его парциальное давление равно общему давлению в системе:
Р СН4 = 5,0 * 10 6 Па и Р С2Н6 = 1,035 * 10 6 Па.
В уравнении (1) константы Ленгмюра находят из эмпирического уравнения, предложенного В. Пэришем и Дж. Праустницем [5]
(2)
где А и В — константы, значения которых указаны в таблице 2.
Состав газогидрата вычисляли по заполнению малых и больших полостей гидрата газом, которое показывает число n — приходящимся на одну молекулу газа-гидратообразователя [5]:
для гидратов структуры КС-I (3)
Таблица 2 — Константы в эмпирическом уравнении (3) для гидрата метана, этана структуры КС-1 [6]
| Гидрат метана | |||
| Малые полости | Большие полости | ||
| А, 10 8 | В, 10 -3 | А, 10 7 | В, 10 -3 |
3. 7267 7267 |
2,7088 | 1,8372 | 2,7379 |
| Гидрат этана | |||
| Малые полости | Большие полости | ||
| А | В | А | В |
| 0 | 1 | 0,52971 | 3090,2 |
Кроме этого, зная размеры элементарной емкости, можно вычислить плотность гидрата (г / мл) [1,6]:
для гидратов структуры КС-I: (4),
где — молекулярная масса воды, г / моль;
М — молекулярная масса газа-гидратообразователя, г / моль;
θ 1 и θ 2 — заполнения заполнения малых и больших полостей;
a I — параметр кубической кристаллической решетки гидрата структуры I, нм;
N A — число Авогадро.
В методике расчета массового содержания гидрата в смеси вводится допущение, что в ходе процесса гидратообразования малые и большие полости заполняются молекулами газа полностью, таким образом, растущий гидрат характеризуется постоянным составом, и составы гидратов идеальны — 8CH 4 * 46H 2 O и 6С 2 Н 6 * 46Н 2 О. Массовое содержание гидрата вычисленного по количеству элемент ячеек, занятых известным (измеренным) объемом газа-гидратообразователя:
Массовое содержание гидрата вычисленного по количеству элемент ячеек, занятых известным (измеренным) объемом газа-гидратообразователя:
где: Г — массовая доля гидрата в смеси, ρ — плотность гидрата, V — объем-гидратообразователя, a — параметр кристаллической решетки гидрата (для гидрата КС-I равен 12 Å), n — количество молекул газа-гидратообразователя в элементарной ячейке гидрата (8 — для гидрата метана, 6 — для гидрата этана), m воды — масса дистиллированной воды, взятая для синтеза, M — молярная масса газа-гидратообразователя, V A — молярный объем газа при температуре измерения уровня наблюдаемого газа, N А — число Авогадро.
Результаты и их обсуждение.
На рисунке 3 приведена динамика падения давлений в камерух синтеза металлической конструкции без и в металлической конструкции (МК).
Установлено, что особенностью процессов гидратообразования в закрытой системе является длительный период индукции, в течение которого образуется фаза, состоящая из зародышей кристаллогидрата, которая остается в метастабильном состоянии до начала процесса лавинного гидратообразования.Так, в начальный период охлаждения камеры с водой и метаном происходит снижение давления, значение которого несколько суток — это так называемый период индукции, в течение которого растворение гидратообразователя и зарождение в воде первичных гидратных структур.
Рисунок 3 — Динамика образования гидрата метана из воды без и в металлической конструкции (МК)
Затем, при температуре 276, происходит небольшое падение давления в системе за счет уже процесса гидратообразования, через несколько часов прекращается, как гидратная корка, препятствует росту гидрата внутри объема воды.
Иначе происходит гидратообразование в камере с металлической конструкцией: при 276 происходит резкое падение давления, которое продолжается в течение суток и при переходе жидкой воды в лед прекращается. Таким образом, увеличение площади поверхности, на которой происходит рост гидрата, способствует более интенсивному гидратообразованию в системе «вода- метан».
Количественно индукционный период гидратообразования метана можно представить как меру метастабильности в виде изменения энергии Гиббса (-Δ G ) системы при ее изотермном переходе из метастабильного состояния в равновесии при образовании моля гидрата по уравнению:
где P- давление в системе при температуре Т, P 0 — равновесное давление гидратообразования при той же температуре [3].На рисунке 4 представлен результат расчета обратной энергии Гиббса от времени индукции гидратообразования из метана.
Рисунок 4 — Динамика изменения энергии Гиббса системы «вода-метан» в период индукции
Видно, что во время индукции система постепенно накапливает свободную энергию, которая расходуется на рост кристаллов гидрата. Особенно интересен факт практически идеально прямой зависимости данной характеристики, что указывает на равномерную скорость образования зародышей кристаллов гидрата метана в закрытых условиях.
С применением тех же технологических приемов, которые использовались при получении гидратов метана, в закрытых камерах высокого давления также были искусственно получены гидраты этана.
Рисунок 5 — Динамика образования гидрата этана из воды без и в металлической конструкции
В случае с этаном, процесс гидратообразования протекает при положительных температурах, но практически без индукционного периода (рис. 5). Этан интенсивно переходит в гидрат даже в стабильной металлической поверхности, хотя в металлической конструкции гидратообразование происходит значительно быстрее.Так, в изохорных условиях процесс образования гидрата этана протекает около 120 ч, то есть в 2 раза быстрее по сравнению с гидратообразованием метана.
В таблице 3 представлены результаты определения структур синтетических гидратов метана и этана.
Таблица 3 — Значения параметров структуры синтетических гидратов метана и этана
| Параметр | Гидрат метана | Гидрат этана |
| θ 1 | 0,9137 | 0 |
| θ 2 | 0,9803 | 0,9992 |
| n | 7,67 | 5,95 |
| ρ , г / см 3 | 0,945 | 0,976 |
Установлено, что состав синтезированного гидрата метана описывается как 7.67CH 4 * 46H 2 O, а состав гидрата этана практически идеален- 5.95С 2 Н 6 * 46Н 2 О. Степень заполнения метаном больших полостей, чем малых, что обеспечивает устойчивость большей гидратного каркаса. В процессе роста гидрата этана идет заполнение только больших полостей, причем, практически полностью. Таким образом, установлено, что элементарные решетки полученные в изохорных условиях синтетических гидратов метана содержат 7-8 молекул газа, а этана — 5-6.Установлено, что плотности обоих синтетических гидратов, получено в закрытой камере высокого давления меньше плотности, плотности гидрата этана несколько выше плотности гидрата метана (табл. 3).
Установлено, что в результате синтеза простого гидратов без использования этой конструкции образуются лед-гидратные смеси с низким массовым содержанием гидрата: до 10 мас.% — для гидрата метана и около 20 мас.% — для гидрата этана. Показано, что использование дополнительной поверхности увеличения гидратосодержание смесей: до 60 мас.% — для гидрата метана и до 80 мас.% — для гидрата этана.
Таким образом, гидратонасыщенность при синтезе в камерех закрытого типа синтеза площади свободной поверхности на которой, преимущественно, происходит рост кристаллических соединений.
Заключение.
Таким образом, в результате проведенных исследований, в камерах — реакторы закрытого типа в изохорных условиях получены синтетические гидраты метана и этана с высоким гидратосодержанием.Установлено, что дополнительная поверхность роста в виде (МК) внутри закрытой камеры- реактора высокого давления позволяет в 6-4 повысить содержание простых гидратов метана и этана в смесях-гидрат, соответственно.
Показано, что состав синтетически полученных гидратов метана описывается как 7.67CH 4 * 46H 2 O, а состав гидрата этана практически идеален- 5.95С 2 Н 6 * 46Н 2 О.
Литература
- Макогон Ю.Ф. Гидраты природных газов. — М .: Недра, 1974.-208 с.
- Денди Слоун, Э. Клатратные гидраты природных газов. Третье издание. — Нью-Йорк: Марсель Деккер, 1998, -730 с.
- Нестеров А.Н. Кинетика и механизм гидратообразования газов в поверхностно-активных веществах: дис. … Д-ра хим. наук: — Тюмень, 2006. — 280 с.
- Истомин В.А., Якушев В.С. Газовые гидраты в природных условиях. -М .: Недра, 1992.-236 с.
- Parrish W.R., Prausnitz J.M. Давления диссоциации газовых гидратов, образованных газовыми смесями // Ind.Англ. Chem. Основы. 1972 г. — В. 11.-№1.-П. 26-35.
- Бык С.Ш., Макогон Ю.Ф., Фомина В.И. Газовые гидраты. — М. : Химия, 1980.-296 с.
Список литературы
- Макогон Ю.Ф. Гидраты природных газов. — М .: Недра, 1974. -208 с.
- Денди Слоун, Э. Клатратные гидраты природных газов. Третье издание. — Нью-Йорк: Марсель Деккер, 1998, -730 с.
- Нестеров А.Н. Кинетика и механизм гидратообразования газов в присутствии поверхностно-активных веществ: дисс.

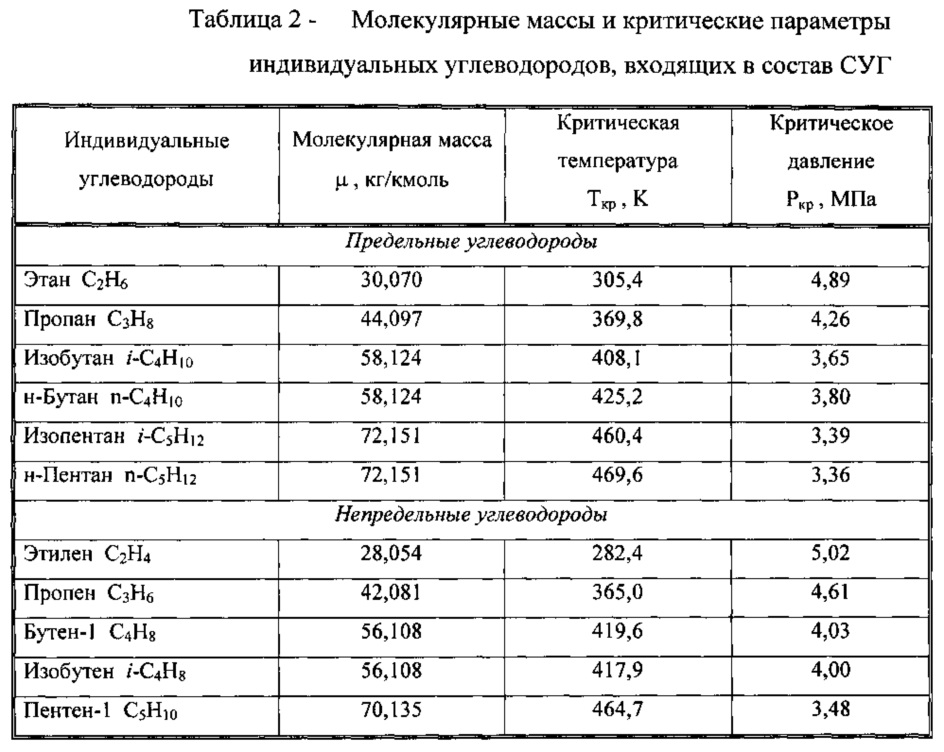 Горючий, образует взрывоопасные смеси с воздухом.
Горючий, образует взрывоопасные смеси с воздухом. м
м : кобальт — 55, хром — 33, вольфрам — 10, углерод — 2.
: кобальт — 55, хром — 33, вольфрам — 10, углерод — 2.
 2.5.1313-03
2.5.1313-03