Диссоциация электролитическая, механизм — Справочник химика 21
Причины и механизм электролитической диссоциации. Как [c.218]Механизм электролитической диссоциации — распада молекул или кристаллов растворяемого вещества на ионы под влиянием молекул растворителя — был понят несколько позднее, благодаря исследованиям различных ученых, в том числе русских В. А. К и с т я-ковского и И. А. Каблукова. Согласно современным воззрениям, такой распад является результатом взаимодействия полярных молекул растворителя, например воды, с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя атакуют кристаллическую решетку, разрушая ее и переводя составные части решетки (ионы) в раствор в форме сольватированных [c.68]
Сильные электролиты. Уже в работах Д. И. Менделеева, содержащих критику гипотезы электролитической диссоциации, было установлено, что во многих случаях выводы этой гипотезы неприменимы к экспериментальным данным.

Огромное количество химических реакций происходит в растворах. Свойства вещества в растворе отличаются от свойств индивидуального вещества и подчиняются особым законам. В этой главе произойдет наше знакомство с законами, которые действуют в водных растворах.
Теория кислот и оснований. Кислотно-основные взаимодействия широко распространены в природе и технике, поэтому давно привлекали внимание ученых, предложивших несколько теорий этих процессов. В последние годы было показано, что большинство теорий не противоречат друг другу, но имеют различные области применения. Наиболее известны теория, основанная на механизме электролитической диссоциации, протонная и электронная теории кислот и оснований.
Центральным в рассматриваемой системе. является понятие об электролитической диссоциации. При его формировании вводятся понятия об условиях диссоциации, ее механизме и результатах. На основе общих понятий о механизме диссоциации рассматривается диссоциация кислот, щелочей, солей, а это [c. 119]
119]
Поведение растворенных веществ и ионов (кислот, оснований и солей) определяется механизмом собственной ионизации. Согласно определению Бренстеда [3] и Лоури [4] кислотная функция характеризуется отдачей протона, основная — принятием, протона. Таким образом, собственная диссоциация, электролитическая диссоциация кислот и оснований, нейтрализация и сольволиз описываются некоторыми типами реакций [c.217]
Механизм электролитической диссоциации ионных соединений упрощенно можно представить следующим образом. Каждый из ионов, находящихся на поверхности кристалла электролита, создает вокруг себя электростатическое поле. Полярные молекулы растворителя, попадая в сферу действия этого поля, ориентируются, образуя вокруг иона сольватную оболочку. В результате межионная связь в кристалле ослабляется (в г раз по сравнению с взаимодействием зарядов в пустоте) тепловое движение молекул растворителя способствует отрыву сольватированных ионов друг от друга, т.
 е. происходит растворение с диссоциацией. [c.219]
е. происходит растворение с диссоциацией. [c.219]Механизм электролитической диссоциации [c.6]
Электролитическая диссоциация может протекать по двум основным механизмам. Возможно образование (например, водных) растворов электролитов при разрушении ионных кристаллов, например, КС1 при взаимодействии с растворителем. Уже
Возникновение электрохимии как науки относится к рубежу XVni и XIX вв. и связано с работами Л. Гальвани, А. Вольта, В. В. Петрова, Г. Дэви. В 1833 г. М. Фарадеем были открыты законы электролиза — основные законы электрохимии. Теория электролитической диссоциации С. Аррениуса (1887) оказалась весьма плодотворной для развития учения о механизме электродных. процессов и прохождения тока через электролиты. В 1890 г. Нернстом предложена первая теория возникновения электродного потенциала, которая позднее была усовершенствована Л. В. Писаржевским,, Н. А. Изгарышевым, Герни. В XX столетии развивались теория растворов электролитов (работы П. Дебая, Э. Хюккеля, Л. Онза- [c.454]
Дебая, Э. Хюккеля, Л. Онза- [c.454]
Чем отличается механизм электролитической диссоциации в растворе и в расплаве [c.263]
Механизм электролитической диссоциации позднее получил объяснение в связи с разработкой теории химической связи и химического равновесия. Распад электролита на ионы в растворе происходит в результате сложного физико-хими-ческого взаимодействия молекул с полярными молекулами воды. Если поместить кристаллы хлорида иатрия в воду, то полярные молекулы воды принимают упорядоченное направленное положение по отношению к ионам в кристаллической решетке соли. Под влиянием этого взаимодействия и теплового движения молекул воды хлорид натрия распадается на ионы [c.104]
Рассмотрение механизма электролитической диссоциации приводит к ряду важных выводов. [c.117]
Химически чистая вода обладает хотя и ничтожной, но измеримой электрической проводимостью, которая по сравнению с электрической проводимостью ГМ НС1 меньше в Ю раз. Из этого следует, что вода в незначительной степени диссоциирует на ионы. Процесс электролитической диссоциации воды возможен благодаря достаточно высокой полярности связей О—Н и наличию между молекула-ми воды системы Н-связей (см. гл. IV, 5). Механизм процесса объясняется следующей схемой
Из этого следует, что вода в незначительной степени диссоциирует на ионы. Процесс электролитической диссоциации воды возможен благодаря достаточно высокой полярности связей О—Н и наличию между молекула-ми воды системы Н-связей (см. гл. IV, 5). Механизм процесса объясняется следующей схемой
Существует и другой механизм, характерный для коллоидных частиц, образованных веществами — слабыми электролитами, которыми могут быть нерастворимые неорганические и органические кислоты и основания. Заряд гранул таких золей обусловлен электролитической диссоциацией ионогенных групп соответствующих веществ. Поэтому, например, золь кремневой кис- [c.261]
Какими условиями определяется возможность электролитической диссоциации вещества Какая величина характеризует ионизирующую способность растворителя Покажите механизм распада частиц растворенного вещества на ионы. [c.205]
При изучении теории электролитической диссоциации нам встретились химические реакции, ионный механизм которых оказался одним и тем же он заключается в перемещении ионов водорода Н+, или протонов, из одних частиц (молекул или ионов) в другие (молекулы или ионы).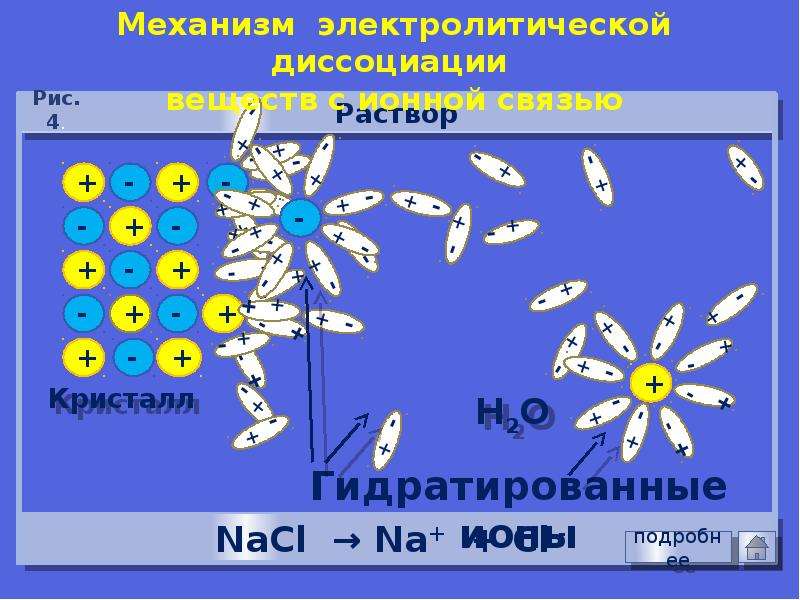
Оказывается, механизм электролитической диссоциации аммиака и кислот один и тот же. Он заключается в перемещении протонов от молекул, слабее удерживающих их, к молекулам, сильнее притягивающим. Но результат получается разный в одном случае раствор приобретает щелочную, а в других — кислую реакцию. [c.118]
Каков же механизм электролитической диссоциации В самом деле, почему электролиты диссоциируют на ионы Учение о химической связи атомов в молекулах помогает ответить на этот вопрос. Легче всего диссоциируют вещества с ионной связью. Молекулы таких веществ, или ионные пары (см. с. 167), уже состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения (ион-дипольное
Существенным является вопрос о механизме электролитической диссоциации.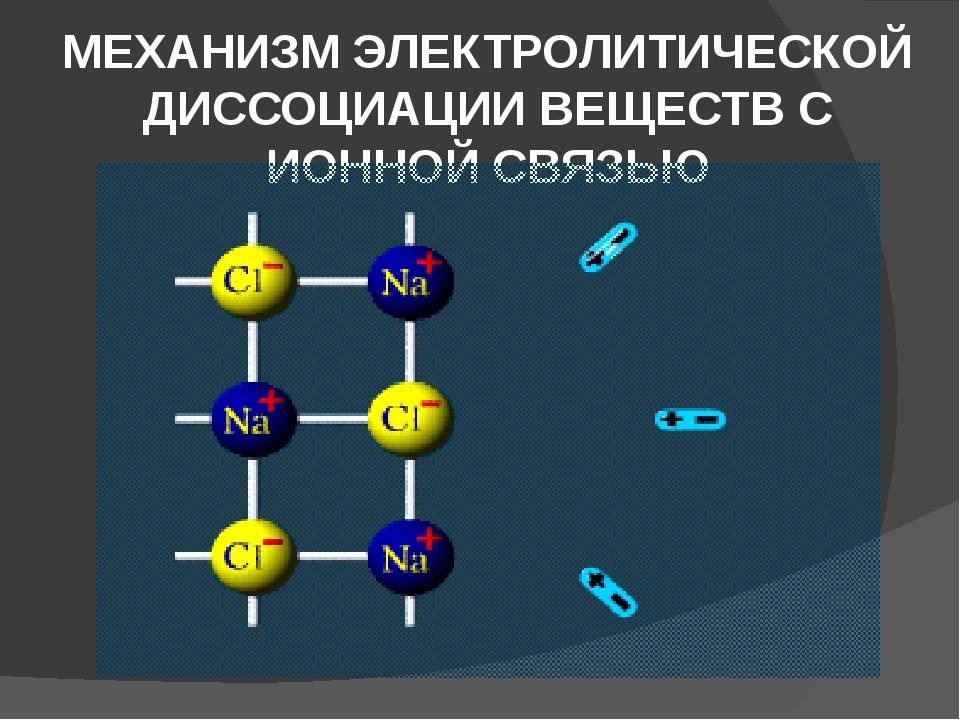 В самом деле, почему электролиты диссоциируют на ионы Учение о химической связи атомов помогает ответить на этот вопрос. [c.107]
В самом деле, почему электролиты диссоциируют на ионы Учение о химической связи атомов помогает ответить на этот вопрос. [c.107]
Механизм процесса электролитической диссоциации. Первоиа чально сформулированная Сванте Аррениусом теория электролитической диссоциации не учитывала всей сложности взаимодействия электролитов с молекулами растворителя. Ясное представление о механизме процесса электролитической диссоциации сложилось ыа основе использования наряду с теорией Аррениуса сольватной теории растворов Д. И. Менделеева и работ И. А. Каблукова, посвященных сольватации ионов. [c.171]
Исключительное значение для обоснования электрохимического механизма коррозии имели работы выдающихся ученых Г.Дэви и М. Фарадея, установивших закон электролиза. Так, М. Фарадей предложил ва кнейшее для дальнейшего развития электрохимической теории коррозии соотношение между массой аноднорастворяющегося металла и количеством протекающего электричества, а также высказал (проверено Г.
 Дэви) предположение о пленочном механизме пассивности железа и электрохимической сущности процессов растворения металлов. В 1830 г. швейцарский физикохимик О. Де да Рив ч ко сформулировал представления об электрохимическом характере коррозии (он объяснил растворение цинка в кислоте действием микрогальванических элементов). Русский ученый H.H. Бекетов (1865 г.) исследовал явление вытеснения из раствора одних металлов другими, а Д.И. Менделеев (1869 г.) предложил периодический закон элементов, который имеет очень важное значение для оценки и классификации коррозионных свойств различных металлов. Важен вклад шведского физикохимика С. Аррениуса, сформулировавшего в 1887 г. теорию электролитической диссоциации и немецкого физикохимика В. Нернста, опубликовавшего в 1888 г. теорию электродных и диффузионных потенциалов.
Дэви) предположение о пленочном механизме пассивности железа и электрохимической сущности процессов растворения металлов. В 1830 г. швейцарский физикохимик О. Де да Рив ч ко сформулировал представления об электрохимическом характере коррозии (он объяснил растворение цинка в кислоте действием микрогальванических элементов). Русский ученый H.H. Бекетов (1865 г.) исследовал явление вытеснения из раствора одних металлов другими, а Д.И. Менделеев (1869 г.) предложил периодический закон элементов, который имеет очень важное значение для оценки и классификации коррозионных свойств различных металлов. Важен вклад шведского физикохимика С. Аррениуса, сформулировавшего в 1887 г. теорию электролитической диссоциации и немецкого физикохимика В. Нернста, опубликовавшего в 1888 г. теорию электродных и диффузионных потенциалов. Образование ионов в неводных растворителях в зависимости от свойств растворителей может протекать по механизму про-толитической диссоциации или в результате других химических реакций. Электролитическая диссоциация возникает в полярных протонных и апротонных растворителях, молекулы которых содержат неподеленные электронные пары. Протонные растворители, благодаря наличию гидроксильных и аминных групп, обладают также протондонорными свойствами и образуют водородные связи как между молекулами растворителя, так и с растворенным веществом. Все это способствует растворению и диссоциации электролита и сольватации ионов. Действие полярных апротонных растворителей, например, диметилсульфоксида, [c.413]
Электролитическая диссоциация возникает в полярных протонных и апротонных растворителях, молекулы которых содержат неподеленные электронные пары. Протонные растворители, благодаря наличию гидроксильных и аминных групп, обладают также протондонорными свойствами и образуют водородные связи как между молекулами растворителя, так и с растворенным веществом. Все это способствует растворению и диссоциации электролита и сольватации ионов. Действие полярных апротонных растворителей, например, диметилсульфоксида, [c.413]
Учение о химической связи помогает объяснить механизм электролитической диссоциации. Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов (см. 1.13). При их растворении диполи воды ориентируются вокруг положительных и отрицательных ионов кристалла соли. Между ионами и диполямц воды возникают силы взаимного притяжения. [c.72]
Закон разбавления В. Оствальда подтверждал теорию электролитической диссоциации и позволял определить зависимость степени диссоциации молекул электролита от концентрации раствора. В дальнейшем этот закон подвергался неоднократной проверке. Было найдено, что для сильных электролитов и концентрированных растворов он неприменим. Потребовались многочисленные исследования ученых конца XIX и начала XX в., чтобы объясгшть причину отступления сильных электролитов от закона разбавленпя. Плодотворность теории электролитической диссоциации особенно ярко проявилась в том, что она с успехом была использована для объяснения механизма многих химических реакций и природы различных соединений, нанример комплексных. [c.317]
В дальнейшем этот закон подвергался неоднократной проверке. Было найдено, что для сильных электролитов и концентрированных растворов он неприменим. Потребовались многочисленные исследования ученых конца XIX и начала XX в., чтобы объясгшть причину отступления сильных электролитов от закона разбавленпя. Плодотворность теории электролитической диссоциации особенно ярко проявилась в том, что она с успехом была использована для объяснения механизма многих химических реакций и природы различных соединений, нанример комплексных. [c.317]
Следует различать термическую диссоциацию, протекающую ио гомолити-ческому механизму (например, ЫН4С1 КНз-1-НС1), и электролитическую диссоциацию (ионизацию), сопровождающуюся гетеролитическим распадом на ионы (ЫН4С1 ЫН4+- -С1-). [c.257]
Свойства этих растворов объясняет теория электролитической диссоциации. Знание теории электролитической диссоциации является основой для изучения свойств неорганических и органических соединений, для глубомеханизмов химических реакций в растворах электролитов.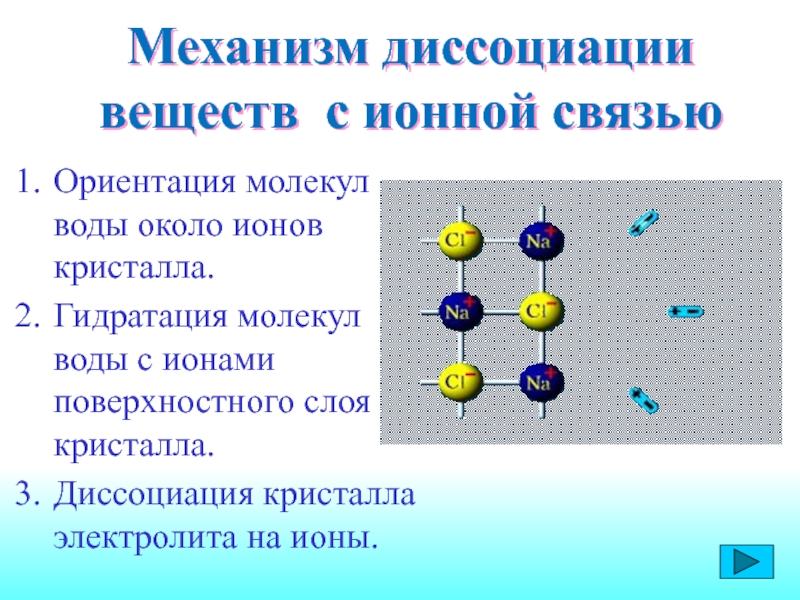 [c.160]
[c.160]
Следует различать термическую диссоциацию, протекающую по гомолитическому механизму (например, Nh5 I Nh4 + НС1), и электролитическую диссоциацию (иони- [c.153]
Ионный механизм обычно наблюдается в реакциях, протекающих с разрывом сильнополярных ковалентных связей, например углерод—кислород, углерод — галоген. Примером гетеролитическо10 разрыва связи является электролитическая диссоциация — образование катионов в водном растворе происходит под действием нуклеофильных частиц (молекул воды). [c.302]
Сорбция ИОНОЙ ш водных, растворов была первоначально изучена на минеральных сорбентах. Механизм этого процесса сводится к следующему. На поверхности раздела сорбент—раствор возникает двойной электрический слой. Поверхность сорбента несет заряды какого-то одного знака, возникаюшие либо в результате адсорбции ионов из растпора, либо в результате электролитической диссоциации молек) л поверхности самого сорбента. В растворе вблизи поверхности сорбента находятся ионы противоиолоЖ ного знака, концентрация которых убывает по мере увеличения расстояния От поверхности в глубь раствора диффузный слой), [c.506]
В растворе вблизи поверхности сорбента находятся ионы противоиолоЖ ного знака, концентрация которых убывает по мере увеличения расстояния От поверхности в глубь раствора диффузный слой), [c.506]
Кафедра физической и коллоидной химии, зав. кафедрой докт. хим. наук, проф. О. К. Кудра научное направление — физикохимическое исследование растворов и электродных процессов. Проф. О. К. Кудрой с сотрудниками разрабатываются теория и методы электролитического получения металлических порошков и методы электроосаждения различных металлов и сплавов из комплексных электролитов. При кафедре работает исследовательская лаборатория радиохимии под руководством проф. Ю. Я. Фиалкова, успешно решающая серьезные проблемы физико-химического анализа изучение механизмов электролитической диссоциации и переноса тока в растворах, разработка методов количественного физико-химического анализа жидких систем и др. Часть этих исследований обобщена в монографии Ю. Я- Фиалкова Двойные жидкие системы . [c.121]
[c.121]
Развитием идей школы В. А. Плотникова являются исследования механизмов электролитической диссоциации и переноса тока в неводных растворах. Разработанные радиометрические методики, основанные на применении радиоактивных изотопов, позволили решить ряд прин-ципиальных вопросов в изучении природы неводных электролитных Г растворов [c.176]
Э. возникла на рубеже 18 и 19 вв. благодаря работам Л. Гальвани и А. Вольта, в результате к-рых был создан первый химический источник тока — вольтов столб . Используя хим. источники тока, Г. Дэви в нач. 19 в. осуществил электролиз многих в-в. Законы электролиза были установлены М. Фарадеем в ЗО-х гг. 19 в. (см. Фарадея законы). В 1887 С. Аррениус сформулировал основы теории электролитической диссоциации. В 20-х гг. 20 в. зта теория была дополнена П. Дебаем и Э. Хюккелем, к-рые учли электростатич. взаимод. между ионами. В дальнейшем на основе Дебая — Хюккеля теории были развиты представления о механизме электропроводности электролитов (Л.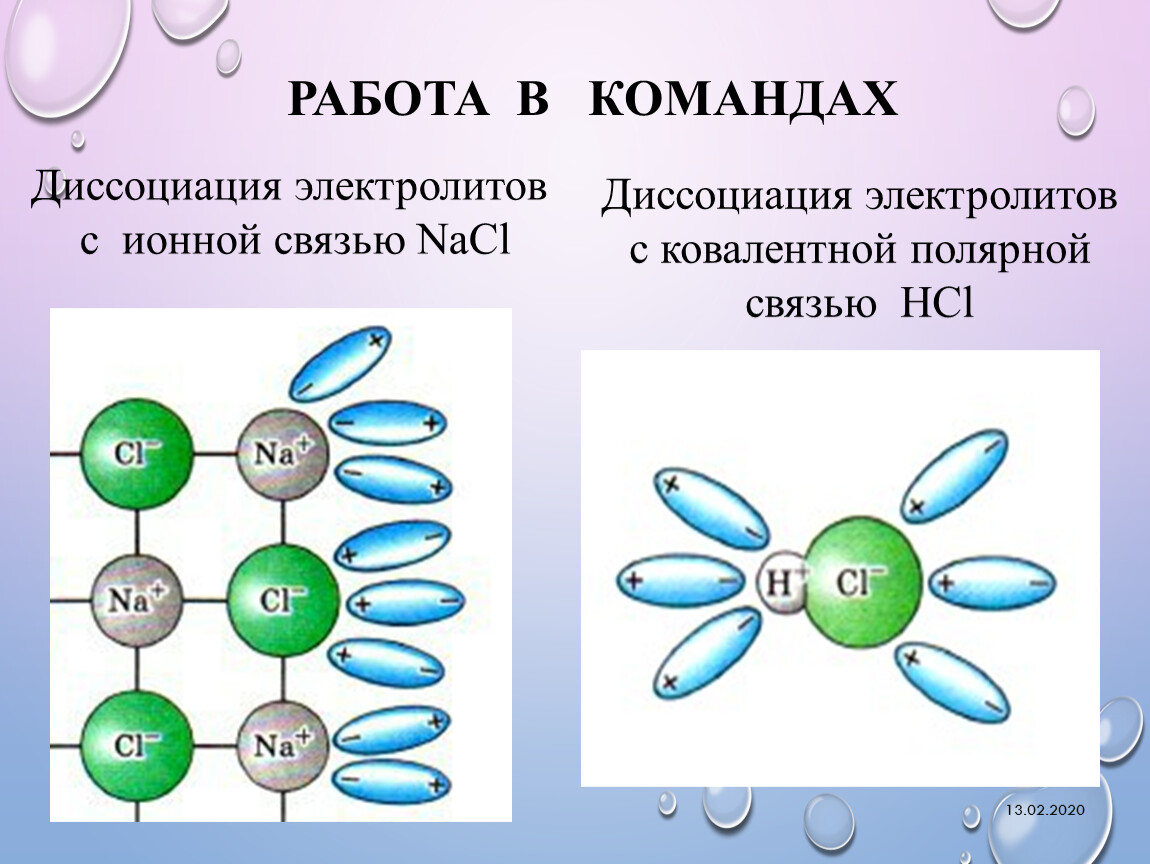 Онсагер, 1926). Во 2-й пол. 19 в. благодаря работам В. Нернста, Дж. Гиббса и Г. Гельмгольца были установлены осн. термодинамич. соотношения Э., к-рые позволили связать здс злектрохим. цепи с тепловым эффектом протекающей на электродах р-ции. Модельные представления о строении границы между электродом и р-ром, [c.705]
Онсагер, 1926). Во 2-й пол. 19 в. благодаря работам В. Нернста, Дж. Гиббса и Г. Гельмгольца были установлены осн. термодинамич. соотношения Э., к-рые позволили связать здс злектрохим. цепи с тепловым эффектом протекающей на электродах р-ции. Модельные представления о строении границы между электродом и р-ром, [c.705]
Психологическое консультирование и психотерапия — «Перцепция»
В данной статье я хочу порассуждать о диссоциации, ее частоте и интенсивности использования как защитного механизма в жизни человека, о гранях здорового и патологического, и о том, как речь может рассказать об этом.
Термин «диссоциация» был предложен в конце XIX века французским психологом и врачом П. Жане, который заметил, что комплекс идей может отщепляться от основной личности и существовать независимо и вне сознания, но может быть возвращен в сознание с помощью гипноза.
Предисловие
В психиатрии есть группа заболеваний, которая называется «диссоциативные расстройства». По сравнению с паранойей или шизофренией звучит, наверное, не очень страшно, однако это достаточно серьезный диагноз. Что же это такое? Диссоциация в переводе с латинского языка означает «распад». При данном заболевании происходит нарушение психических функций, таких как память, сознание, чувство личностной идентичности. Эти психические функции отделяются от целостного потока сознания и становятся независимыми. Таким образом, нарушается целостность личности.
По сравнению с паранойей или шизофренией звучит, наверное, не очень страшно, однако это достаточно серьезный диагноз. Что же это такое? Диссоциация в переводе с латинского языка означает «распад». При данном заболевании происходит нарушение психических функций, таких как память, сознание, чувство личностной идентичности. Эти психические функции отделяются от целостного потока сознания и становятся независимыми. Таким образом, нарушается целостность личности.
Диссоциация в жизни
После того как я вас сознательно напугал, хочу поговорить о диссоциациях, присутствующих в жизни психически здоровых людей, или — говоря языком психологии — невротиков, коими является большинство людей на планете. Надо сказать, что диссоциация — это защитный механизм психики, который включается, когда человек не может справиться с ситуацией, в которой находится. Это может быть длительная травматическая ситуация или шоковая травма, которую человек не может принять и интегрировать в собственную психику. Наиболее травмирующие и оказывающие сильное влияние на развитие человека ситуации, конечно, возникают в раннем детстве, когда при сильном стрессе ребенок не может справиться сам и у него отсутствует должная поддержка родителей, но также такие ситуации могут возникать и во взрослом периоде жизни. Это локальные стрессовые ситуации или длительные травмирующие ситуации, из которых человек чаще не хочет, чем не может выйти из-за вторичных выгод.
Наиболее травмирующие и оказывающие сильное влияние на развитие человека ситуации, конечно, возникают в раннем детстве, когда при сильном стрессе ребенок не может справиться сам и у него отсутствует должная поддержка родителей, но также такие ситуации могут возникать и во взрослом периоде жизни. Это локальные стрессовые ситуации или длительные травмирующие ситуации, из которых человек чаще не хочет, чем не может выйти из-за вторичных выгод.
Если психика человека не справляется, то включается механизм диссоциации. Человек может выпасть в трансовое состояние, может создать в своей голове иную альтернативную ситуацию, более приемлемую для него, поселить туда свои идеи, мысли, эмоции, и переживать их вместо реальности. Естественно, этот процесс происходит бессознательно. При очень сильных стрессовых ситуациях (таких как различные катастрофы, смерть близких и т.п.) может возникать психогенная амнезия — говоря простым языком, человек не хочет осознавать или признавать произошедшее и может не помнить событие или целую часть жизни.
Есть очень много вариантов проявления диссоциации, и даже в самых сложных случаях ее проявление не всегда можно однозначно назвать психическим заболеванием. Большинство людей являются здоровыми с точки зрения психиатрии. Но меня интересует процесс с точки зрения психологии. Что же происходит с психикой и личностью в реальности с точки зрения психологии?
Вопреки некоторым бытовым мнениям («а может ему так легче», «лучше не переживать», «пусть так и будет») ничего хорошего в диссоциации нет, поскольку данный процесс не стоит на месте и может усугублять психическое состояние человека, всё больше отдаляя его от реальности. При этом человек неосознанно мучается. В сознательной жизни это может проявляться в кошмарных снах, соматических заболеваниях, асоциальном поведении, употреблении различных психоактивных веществ. Часто это оправдывается и самим человеком и социумом: «у него было трудное детство», «с ним такое случилось» и т.д. Самое худшее в этой ситуации, что человек в это время не живет, а существует, так как он не может полно переживать свою нынешнюю, реальную жизнь из-за не пережитых травм прошлого.
Диссоциация — это естественный процесс психики, который помогает выжить в стрессовой ситуации, когда у человека недостаточно ресурсов для эмоционального вовлечения, и я хочу, чтобы у вас осталось понимание этого. Диссоциация превращается в патологию, если данный процесс защиты используется постоянно, как поведенческий паттерн.
Кроме того, диссоциация нам иногда необходима, и в некоторой степени мы с ней сталкиваемся в повседневной жизни. Диссоциация может происходить в трансовом состоянии, когда человек что-то делает машинально — например, идет полусонный на работу, засыпает или, наоборот, пытается не дать себе заснуть, чтобы досмотреть интересный фильм, думает или медитирует.
Речь как индикатор
Далее я хочу поговорить о нашей повседневной жизни: насколько мы втянуты в процесс диссоциации, насколько часто мы отделяем себя от текущей ситуации, помещаем себя в другую или ассоциируем себя с кем-то еще, отделяя себя от своей жизни, зачем мы это делаем, и к чему это может привести.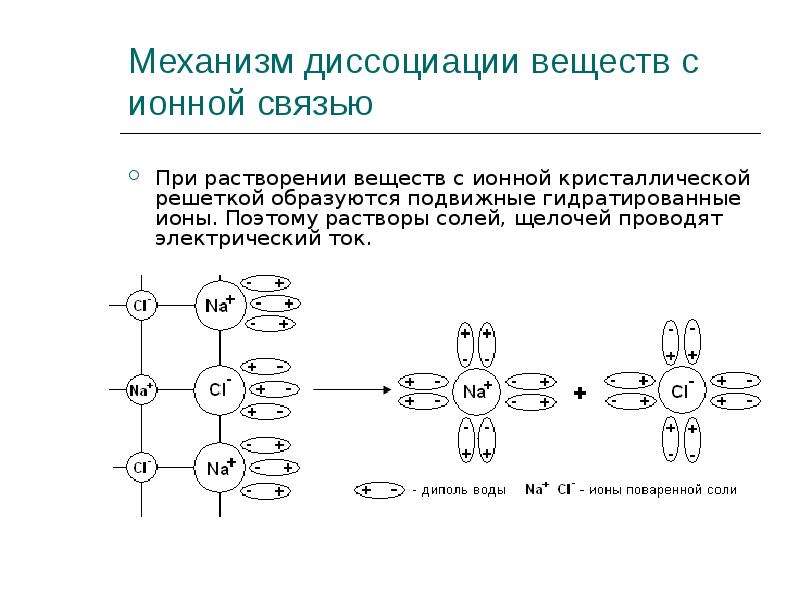 А проанализирую я это через речь.
А проанализирую я это через речь.
Прислушайтесь к речи вашего собеседника или к своей собственной речи. Какое местоимение вы или ваш собеседник используете, говоря о себе? Во многих случаях люди, говоря о себе, произносят «ты», «тебя», то есть, говоря про себя, человек не ассоциирует с собой то, о чем он рассказывает. Причины этого в каждом случае индивидуальны, но, так или иначе, по каким-то причинам бессознательно человек не хочет ассоциировать себя с тем, что он делал, делает или рассказывает. То есть бессознательно не хочет, а сознательно находится или находился в ситуации и, возможно, даже не почувствовал, что она ему вредна или неприятна. Это уже говорит о потере связи между чувствами и сознанием, между телом и сознанием, то есть диссоциация уже есть. Иногда чувствование таких ситуаций можно назвать интуицией, а интуиция — это доверие к себе, своим чувствам, но далеко не мыслям. Ведь мысли — это часто идеи, которые могут принадлежать кому-то другому, но, долго размышляя над ними, человек постепенно начинает принимать их за свои. А вот чувства у нас точно собственные, их нельзя внедрить или позаимствовать, они всегда настоящие. Можно сказать, что человек с хорошо развитой интуицией, а вернее — слышащий себя, свои чувства, в большей степени здоров, так как менее диссоциирован. Обычно и в речи такого человека реже звучат местоимения «ты», «тебя», когда он рассказывает о себе.
А вот чувства у нас точно собственные, их нельзя внедрить или позаимствовать, они всегда настоящие. Можно сказать, что человек с хорошо развитой интуицией, а вернее — слышащий себя, свои чувства, в большей степени здоров, так как менее диссоциирован. Обычно и в речи такого человека реже звучат местоимения «ты», «тебя», когда он рассказывает о себе.
Иногда, чтобы бессознательно избавиться от ответственности или добавить своему решению веса, а также в состоянии неуверенности, люди говорят «мы», хотя в 90% случаях речь идет об индивидуальном действии или решении. Если действие было совместным, то здоровее будет сказать «я и еще кто-то». Менее диссоциированные люди реже употребляют местоимение «мы», потому что они чувствуют себя более индивидуальными и более целостными.
Следующий пример речевых оборотов, употребляемых в обществе, свидетельствующий о диссоциации — это высказывания о себе (ведь диссоциировать мы можем только себя). Такие выражения, как «мое тело», «мой организм», с их различным продолжением («толстое», «худое», «чего-то хочет», «болит» и т. д.) — очень привычны и естественны в нашей речи, но что они делают? Они отделяют нас от тела. То есть существует некое «я», сидящее в теле. Возникает вопрос, а кто это — «я»? Наверняка не мозг, ведь вряд ли мы думаем о мозге, говоря о себе. К тому же, мозг — это часть тела. Итак, «я» — это, скорее всего, мысли, сознание. Вот так потихоньку мы незаметно отделяем наше сознание от тела. К слову сказать, во многих духовных практиках это даже поощряется. Но «я» есть целое: и тело, и дух вместе взятые, и здоровы мы телом и духом только тогда, когда между ними есть связь, а мы эту связь не нарушаем. Я ни в коем случае не хочу сказать, что духовные практики вредны, но к ним нужно подходить в более осознанном состоянии — иначе они не пойдут на пользу, а, наоборот, начнется более глубокий процесс диссоциации.
д.) — очень привычны и естественны в нашей речи, но что они делают? Они отделяют нас от тела. То есть существует некое «я», сидящее в теле. Возникает вопрос, а кто это — «я»? Наверняка не мозг, ведь вряд ли мы думаем о мозге, говоря о себе. К тому же, мозг — это часть тела. Итак, «я» — это, скорее всего, мысли, сознание. Вот так потихоньку мы незаметно отделяем наше сознание от тела. К слову сказать, во многих духовных практиках это даже поощряется. Но «я» есть целое: и тело, и дух вместе взятые, и здоровы мы телом и духом только тогда, когда между ними есть связь, а мы эту связь не нарушаем. Я ни в коем случае не хочу сказать, что духовные практики вредны, но к ним нужно подходить в более осознанном состоянии — иначе они не пойдут на пользу, а, наоборот, начнется более глубокий процесс диссоциации.
Хочу напомнить: я анализирую речь и использую ее как индикатор психического состояния. Во всех приведенных мной примерах у человека уже есть диссоциация. Человек диссоциирует себя своими мыслями, действиями, поведением, образом жизни, отношением к себе и окружающим.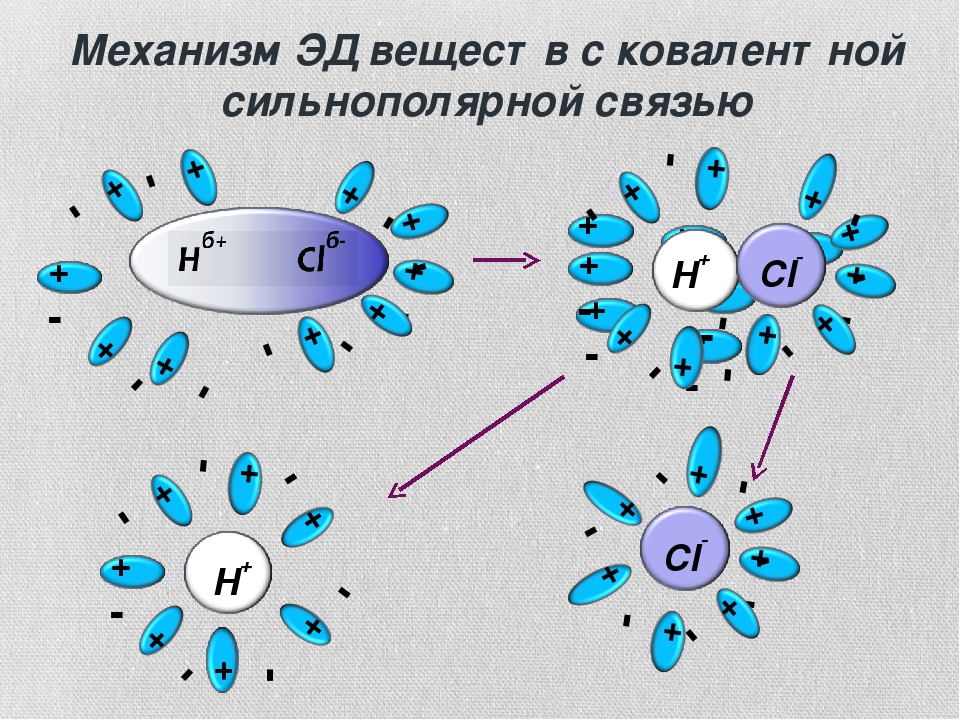
Но я думаю, если начать осознавать свою речь, это будет серьезным шагом к изменению себя.
Не могу не упомянуть о чувствах. Если понаблюдать, людям довольно сложно говорить «мое тело чувствует», все же чаще люди говорят «я чувствую». Это связано с тем, что чувства находятся в теле, и их довольно сложно отделить от него. Однако мне довелось встречаться и с такими случаями. Что очень интересно, эти люди занимались духовными практиками. Работа с такими людьми очень трудна, так как уровень их диссоциации очень высок. Схожий пример — фразы типа «моя психика не выдерживает», «…не приемлет» и т.д. То есть опять не «я». Со мной-то все хорошо — с психикой что-то не так, а она — это не совсем я. Психика не я, но она точно моя, значит, я ею управляю и контролирую (как бы не так). Как признать, что психика неконтролируемым образом управляет тем, кто сам не знает, где находится? Вспоминаем один из предыдущих примеров про то, где мы «сидим», и получаем, что и не в психике, и не в голове. Куда же мы тогда вообще делись? (Вопрос для размышления читателям). Все эти выкрутасы происходят потому, что сказать «я» гораздо сложнее — могут включиться разные стереотипы, вызывая неприятные вопросы. Например: «Как это я не выдерживаю, я что — слабый?», «Как это я не управляю собой и своей психикой?».
Куда же мы тогда вообще делись? (Вопрос для размышления читателям). Все эти выкрутасы происходят потому, что сказать «я» гораздо сложнее — могут включиться разные стереотипы, вызывая неприятные вопросы. Например: «Как это я не выдерживаю, я что — слабый?», «Как это я не управляю собой и своей психикой?».
Следующие примеры диссоциации — это, как ни странно, ассоциация себя со своей профессией, с местом проживания, с вещами. Приведу несколько очевидных примеров: «я — военный» (значит, я не могу чувствовать), «я — юрист/руководитель/чиновник» (значит, я не могу позволить себе дурачиться, искренне веселиться), и т.п. Когда человек начинает себя ассоциировать со своей профессией, он как бы растворяется в ней и теряет себя. Когда внутри нет доверия к себе, нет себя, нужно уцепиться за что-то, например, за профессию — тем более, некоторые из них имеют очень высокий статус в обществе. Профессия «прилипает», и человек остается врачом, военным или юристом всегда, даже в кругу друзей или в семье.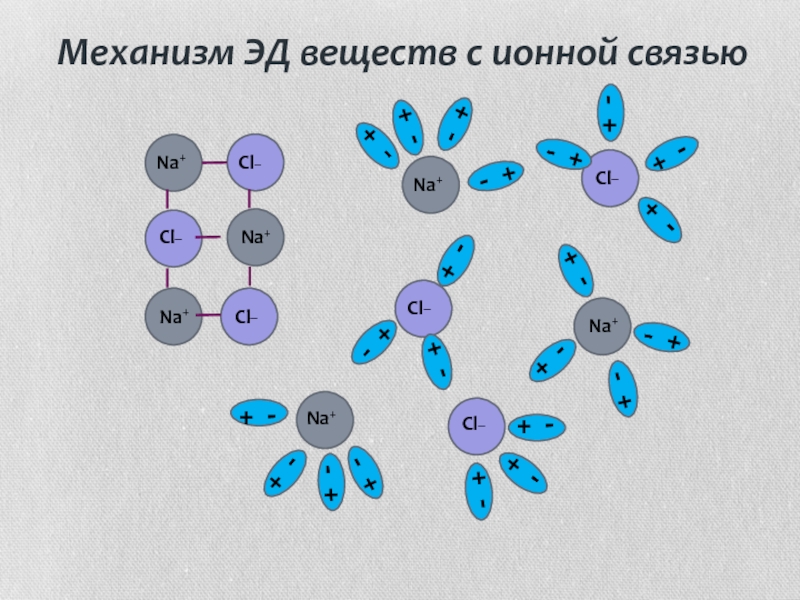 Профессия — это очень важная сфера жизни, это самореализация, но есть и другие сферы и о них не нужно забывать.
Профессия — это очень важная сфера жизни, это самореализация, но есть и другие сферы и о них не нужно забывать.
Когда у человека нет «Я», либо оно очень маленькое, он часто ассоциирует себя с тем, во что он одевается, на чем ездит и где живет — это добавляет вес, повышая статус. Но что происходит с психикой? А в психике происходит диссоциация, потому что человек — это и тело, и сознание, но не надетый бренд и не «надетая» профессия. Есть люди, настолько сильно ассоциирующие себя со своей одеждой, что они не могут надеть другую, то есть они — это не их тело и сознание, а их одежда. А ведь одежда, автомобили и прочие атрибуты — это всего лишь вспомогательные средства для жизни и саморазвития. Конечно, при таком отношении к вещам речь о развитии личности не идет. Личность в данном случае скачет по кругу, как белка в колесе, зависимая от внешних факторов. К сожалению, в наш век потребления сопутствующие средства для жизни ставятся выше того, для кого они делаются, и в рекламе мы слышим: «ты будешь лучше/ успешнее/красивее, если приобретешь. ..» (дальше следует название соответствующего продукта того или иного бренда).
..» (дальше следует название соответствующего продукта того или иного бренда).
Я привел лишь несколько примеров диссоциации, которые постоянно присутствуют в обществе и «помогают» расщеплять и без того слабо сформированные личности. Слабо, потому что индустриальное общество не способствует индивидуализации.
С чего все начинается?
Когда ребёнок рождается, у него нет самоидентификации, и он не отделяет себя от матери. Постепенно он начинает смотреть вокруг, видеть себя, поднимать голову и видеть окружающую среду, хватать предметы и ходить. Изучая таким образом мир и сопоставляя себя с ним, ребенок со временем осознает себя как нечто отдельное от всего мира. Именно в это время у него начинают возникать первые мысли о смерти, потому что разрушаются прежние связки «я = мать» и «я = мир вокруг», и он становится обособленным существом. В этом возрасте мать, говоря о ребенке, часто еще использует местоимение «мы» («мы погуляли», «мы поели», «мы покакали») и это нормально. Но примерно к 5-ти годам приходит момент, когда мать должна начать стимулировать и поддерживать процесс сепарации, и это первым делом осуществляется с помощью речи. Говоря о ребенке, следует теперь говорить «он» или «она» (естественно, в присутствии ребенка или обращаясь к нему, называть его по имени), тем самым приучая маленького человека к пониманию того, что он отдельная личность. Затем нужно постепенно делегировать ему ответственность за собственные действия и принятие решений. Можно начать с освоения ребенком элементарных навыков самообслуживания (одевания и т.д.). Важно поощрять его самостоятельность — это значит, хвалить, даже если у него не получилось.
Говоря о ребенке, следует теперь говорить «он» или «она» (естественно, в присутствии ребенка или обращаясь к нему, называть его по имени), тем самым приучая маленького человека к пониманию того, что он отдельная личность. Затем нужно постепенно делегировать ему ответственность за собственные действия и принятие решений. Можно начать с освоения ребенком элементарных навыков самообслуживания (одевания и т.д.). Важно поощрять его самостоятельность — это значит, хвалить, даже если у него не получилось.
Очень важен и собственный пример. Иногда кажется, что родители считают детей идиотами, глухими или слепыми, тогда как они гораздо умнее, чем это может показаться. Детская психика очень гибкая, она мгновенно впитывает и интегрирует все происходящее вокруг, и происходит это в несколько раз быстрее, чем у взрослого человека. Ребенок более непосредственен, открыт миру и доверчив. Поэтому, если вы что-то пообещали, сделайте это. Если не вышло, объясните ребенку, почему. Несите ответственность за свои действия и решения.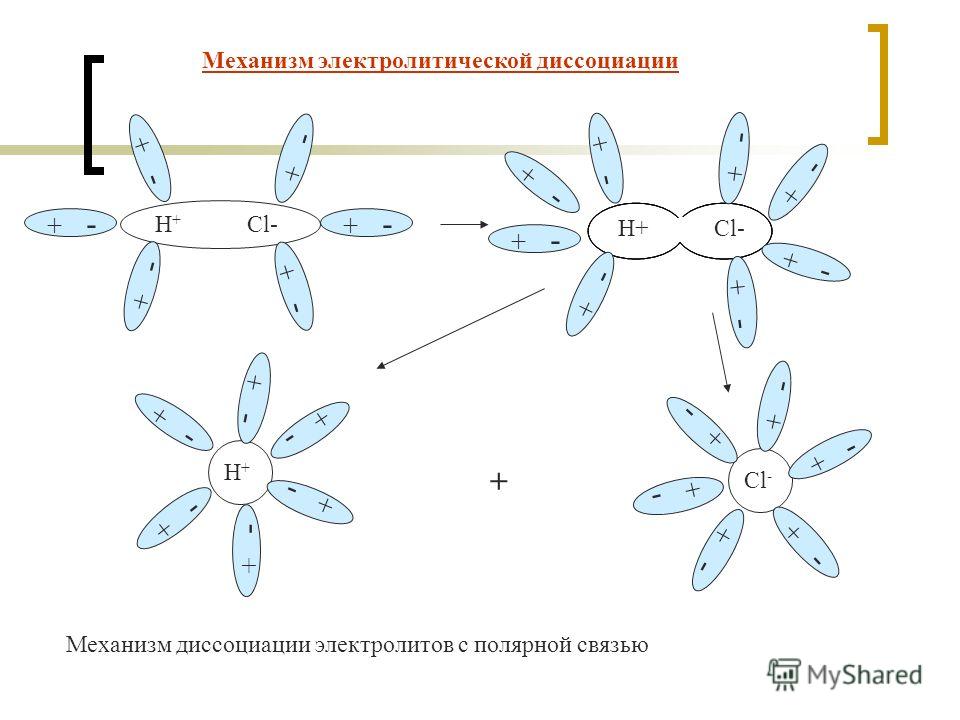 Не обманывайте и не манипулируйте: дети прекрасно понимают, если им объяснить, и чувствуют, когда ими манипулируют. Будьте сами честными, и вам не придется пожинать плоды своего обмана и манипуляций, когда ребенок «непонятно в кого так себя ведет» или в подростковом возрасте теряет доверие к родителям (в современной советской психологии последнее считается естественным, но, тем не менее, ничего не бывает «вдруг»). Больше общайтесь со своим ребёнком, воспринимайте его как личность. Так будет строиться здоровое воспитание.
Не обманывайте и не манипулируйте: дети прекрасно понимают, если им объяснить, и чувствуют, когда ими манипулируют. Будьте сами честными, и вам не придется пожинать плоды своего обмана и манипуляций, когда ребенок «непонятно в кого так себя ведет» или в подростковом возрасте теряет доверие к родителям (в современной советской психологии последнее считается естественным, но, тем не менее, ничего не бывает «вдруг»). Больше общайтесь со своим ребёнком, воспринимайте его как личность. Так будет строиться здоровое воспитание.
Я думаю, вы не раз слышали, как мама ребенка уже школьного возраста говорит своей знакомой: «А мы поступили в школу». Пока еще забавно, но крайне вредно для ребенка. Однако нередки случаи, когда мама говорит: «Мы поступили в институт» — вот это уже не забавно и не смешно. К сожалению, это может продолжаться и дальше — не мне вам рассказывать, какие конфликты возникают, когда уже взрослый человек принимает решение создать свою семью, а сепарация от родителей так и не произошла.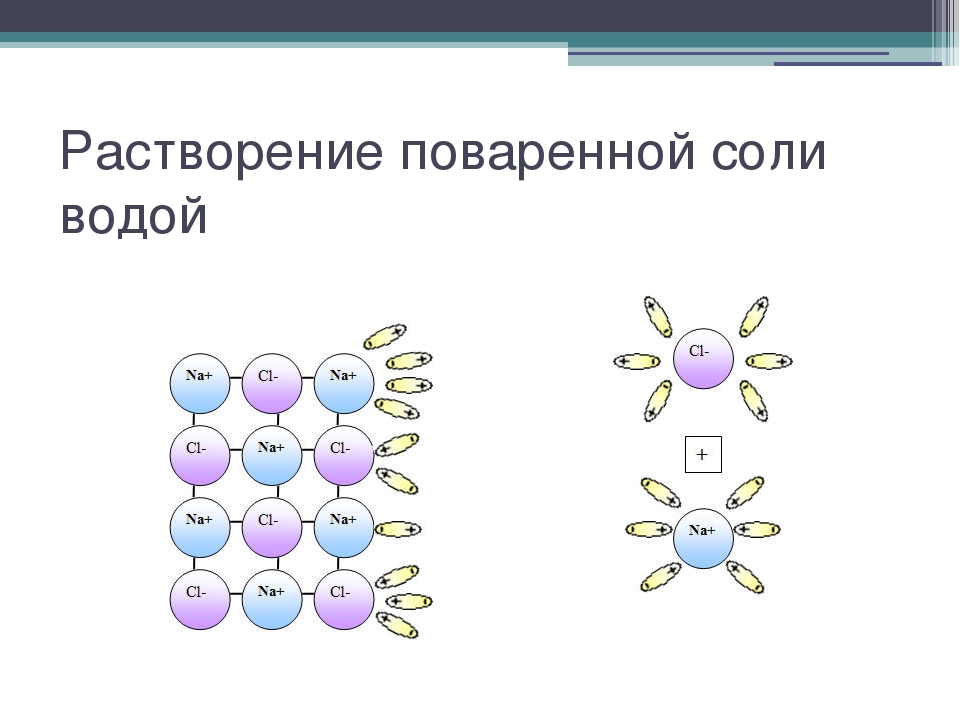 Приведенные примеры служат лишь вербальным индикатором отсутствия сепарации и самоидентификации. Конечно, и самих ситуаций гораздо больше, и они более разнообразны, да и вербальных примеров можно привести множество. Я здесь привел лишь наиболее частые из них и бросающиеся в глаза. Если сепарация не произошла, то получается, что человек физически вроде бы взрослый, а психически все еще инфантилен. Это следствие того, что в детстве родители, в силу особенностей своего развития, не смогли правильно сепарировать ребенка, а он в свою очередь не научился ассоциировать свои решения и действия с самим собой, что отражается в его речи употреблением местоимений «мы» и «ты» вместо «я».
Приведенные примеры служат лишь вербальным индикатором отсутствия сепарации и самоидентификации. Конечно, и самих ситуаций гораздо больше, и они более разнообразны, да и вербальных примеров можно привести множество. Я здесь привел лишь наиболее частые из них и бросающиеся в глаза. Если сепарация не произошла, то получается, что человек физически вроде бы взрослый, а психически все еще инфантилен. Это следствие того, что в детстве родители, в силу особенностей своего развития, не смогли правильно сепарировать ребенка, а он в свою очередь не научился ассоциировать свои решения и действия с самим собой, что отражается в его речи употреблением местоимений «мы» и «ты» вместо «я».
И чем заканчивается?
Я специально начал статью с описания психического заболевания, чтобы показать крайние варианты развития процесса диссоциации. На одном конце — диссоциативные расстройства личности, а на другом — обычные люди вокруг, или так называемые невротики, в той или иной степени диссоциированные.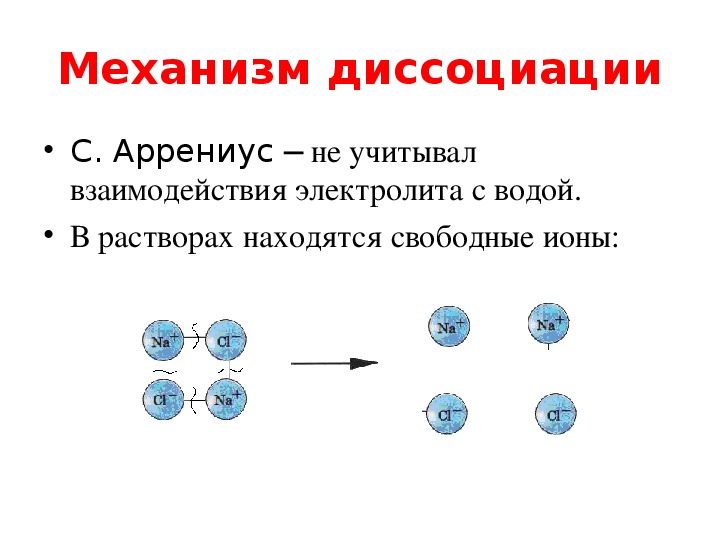 К сожалению, с возрастом диссоциация часто усугубляется, потому что данный процесс поддерживается социумом и его системой, которой не нужны целостные личности. Кроме того, процесс интеграции требует от взрослого человека больших усилий. Но я надеюсь, что эта статья даст тему для размышления нынешним или будущим родителям, всем взрослым людям, нашедшим в себе черты, описанные мной выше. В этом мире нет ничего, что нельзя было бы изменить, кроме смерти — поэтому, пока вы живы, дерзайте! Но прямо сейчас, не завтра. Только начините с местоимения «Я».
К сожалению, с возрастом диссоциация часто усугубляется, потому что данный процесс поддерживается социумом и его системой, которой не нужны целостные личности. Кроме того, процесс интеграции требует от взрослого человека больших усилий. Но я надеюсь, что эта статья даст тему для размышления нынешним или будущим родителям, всем взрослым людям, нашедшим в себе черты, описанные мной выше. В этом мире нет ничего, что нельзя было бы изменить, кроме смерти — поэтому, пока вы живы, дерзайте! Но прямо сейчас, не завтра. Только начините с местоимения «Я».
Дополнительные примеры
Я вспомнил еще несколько примеров, которые, как я считаю, могут говорить о невротизации личности.
«У меня в подъезде» — точно не ясно, где. «У меня муж/жена» — ну если не шелковый/ая, тогда не ясно, у кого именно — у вас или…. «У меня у матери» — аналогично предыдущему примеру, но здесь еще возможна проблема сепарации. Еще я заметил, что люди при встрече стали часто говорить «Приветствую». Это похоже на констатацию факта своих действий из серии «я какаю», «я иду в магазин», «я печатаю статью». По моему опыту, люди, выражающиеся таким образом, имеют нарциссические проблемы на грани психопатии (по Лоуэну). Или всем знакомое «извиняюсь» — человек говорит о себе в третьем лице либо потому, что не вырос, либо потому, что «Наполеон». В моей практике такие люди имели сильное расщепление. А само выражение еще и невежливо: «извините» или «простите» — это просьба, а в «извиняюсь» просьбы нет. Вероятно, таким людям и просить сложно, что тоже говорит о нарциссических проблемах.
По моему опыту, люди, выражающиеся таким образом, имеют нарциссические проблемы на грани психопатии (по Лоуэну). Или всем знакомое «извиняюсь» — человек говорит о себе в третьем лице либо потому, что не вырос, либо потому, что «Наполеон». В моей практике такие люди имели сильное расщепление. А само выражение еще и невежливо: «извините» или «простите» — это просьба, а в «извиняюсь» просьбы нет. Вероятно, таким людям и просить сложно, что тоже говорит о нарциссических проблемах.
Я думаю, можно продолжить список подобных выражений и составить корреляции, но у говорящих так людей, скорее всего, будет расщепление в психике.
Использованные иллюстрации принадлежат их авторам.
Теория электролитической диссоциации.Электролитическая диссоциация…
Теория электролитической диссоциации.
Электролитическая диссоциация кислот, оснований, солей.
ПЛАН ОТВЕТА:
- Электролиты.
- Положения теории электролитической диссоциации.
- Степень электролитической диссоциации.
- Классификация электролитов.
- Механизм электролитической диссоциации веществ с ионным типом связи.
- Механизм электролитической диссоциации веществ с ковалентной сильнополярной связью.
- Диссоциация кислот.
- Диссоциация оснований.
- Диссоциация солей.
Электролиты – вещества, водные растворы и расплавы которых проводят электрический ток. Эти вещества имеют ионную и ковалентную сильнополярную связи. Электролитами являются кислоты, основания, соли. Поведение электролитов в растворе объясняет теория электролитической диссоциации, сформулированная Сванте Аррениусом в 1887 году. Теория состоит из следующих положений:
- При растворении в воде электролиты распадаются на положительно и отрицательно заряженные ионы. Процесс распада электролита на ионы называется электролитической диссоциацией.
 Электролитическая диссоциация – процесс обратимый. Обратная реакция называется моляризацией.
Электролитическая диссоциация – процесс обратимый. Обратная реакция называется моляризацией. - Под действием электрического напряжения катионы двигаются к катоду, а анионы – к аноду.
- Степень электролитической диссоциации зависит от природы электролита, температуры, концентрации.
Степень электролитической диссоциации – это величина, которая показывает отношение числа распавшихся на ионы молекул к общему числу молекул в растворе. Обозначается a. Измеряется в % (долях). N – общее число молекул в растворе, n – число диссоциированных молекул.
В зависимости от величины степени электролитической диссоциации электролиты разделяют на сильные и слабые:
1.
Сильные
> 0,3
KOH, NaOH, HCl, H2SO4, Na2SO4, Al2(SO4)3.
2.
Слабые
H2S, H2CO3, Cu(OH)2, Fe(OH)3, NH4OH
Сильные электролиты имеют значение степени диссоциации более 0,3.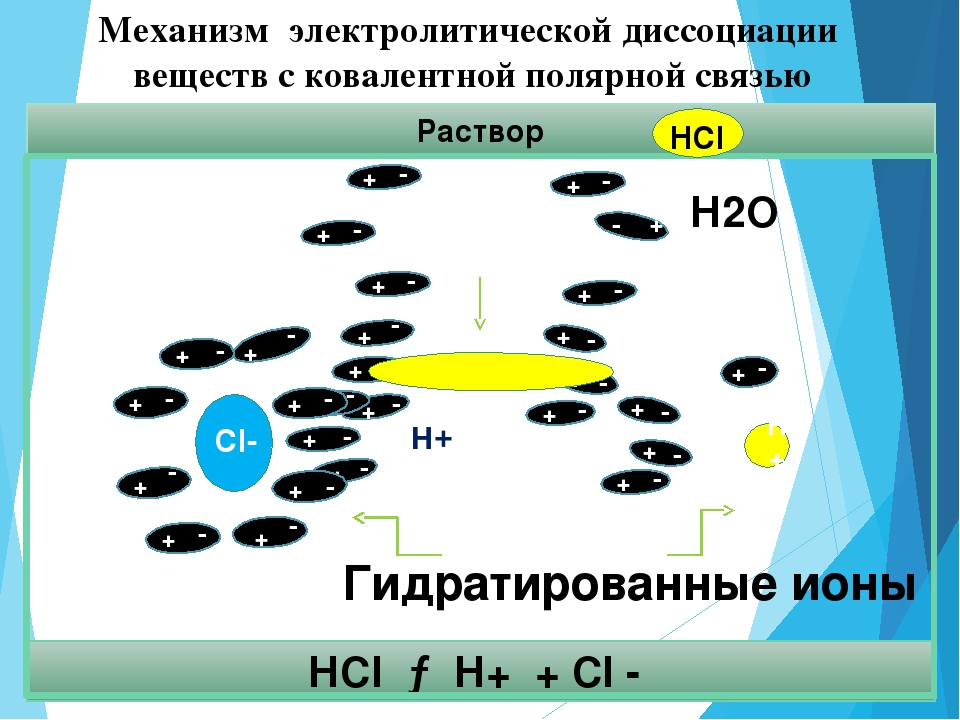 В их растворах практически нет молекул, есть только ионы. Сильными электролитами являются все соли, щёлочи, азотная, соляная и серная кислоты. К слабым электролитам относятся электролиты со степенью диссоциации меньше 0,3. В их растворах есть и ионы, и молекулы, причём молекул больше. К ним относятся нерастворимые основания гидроксид аммония, угольная, фосфорная, сернистая и кремниевая кислоты.,
В их растворах практически нет молекул, есть только ионы. Сильными электролитами являются все соли, щёлочи, азотная, соляная и серная кислоты. К слабым электролитам относятся электролиты со степенью диссоциации меньше 0,3. В их растворах есть и ионы, и молекулы, причём молекул больше. К ним относятся нерастворимые основания гидроксид аммония, угольная, фосфорная, сернистая и кремниевая кислоты.,
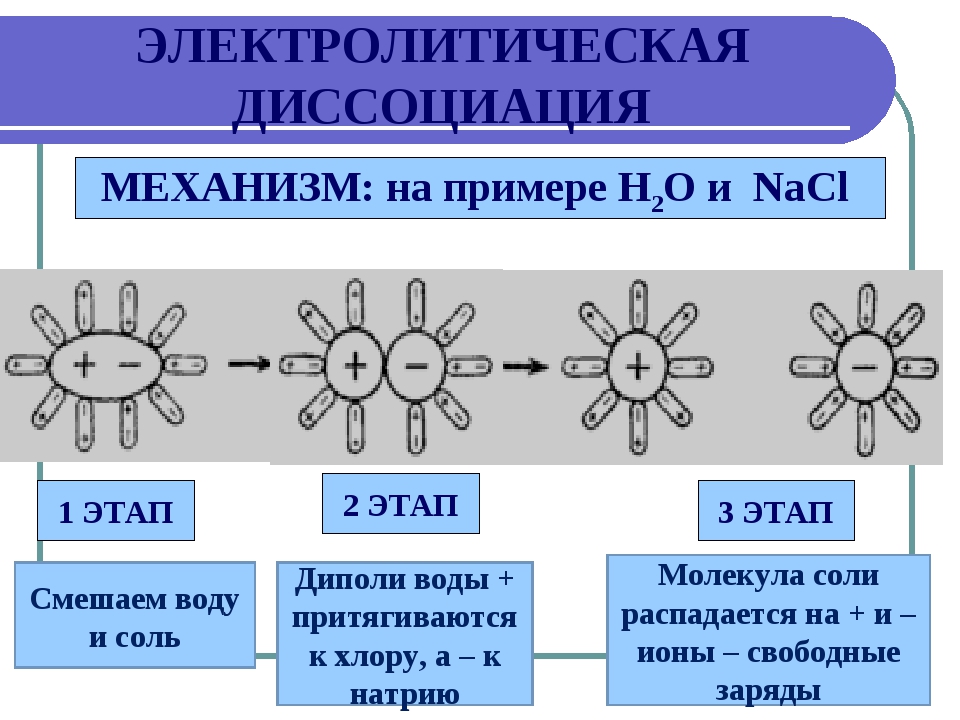
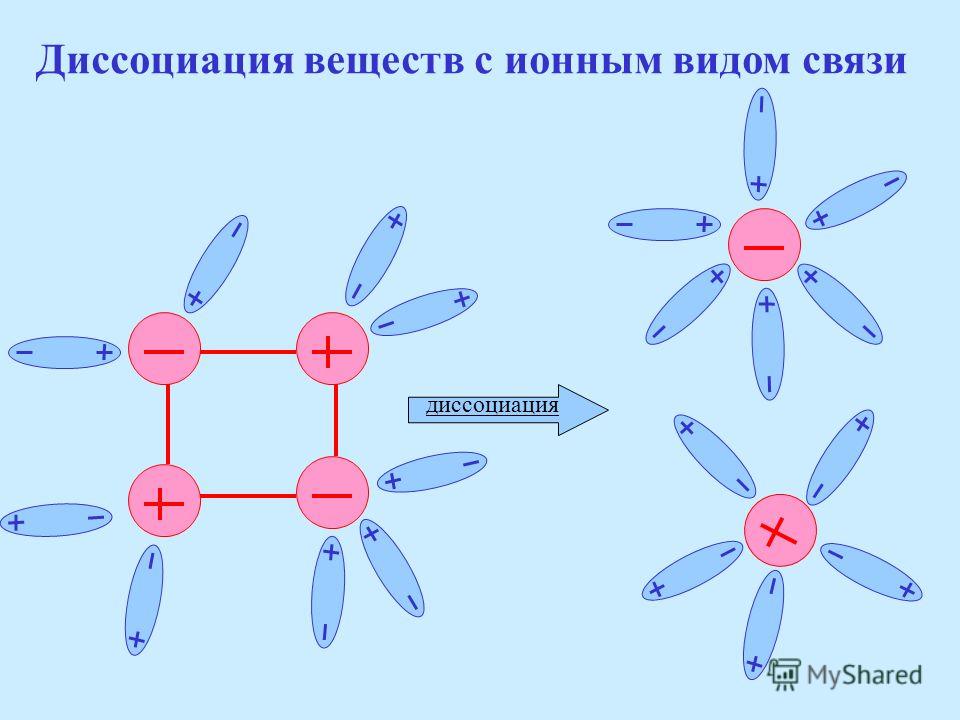
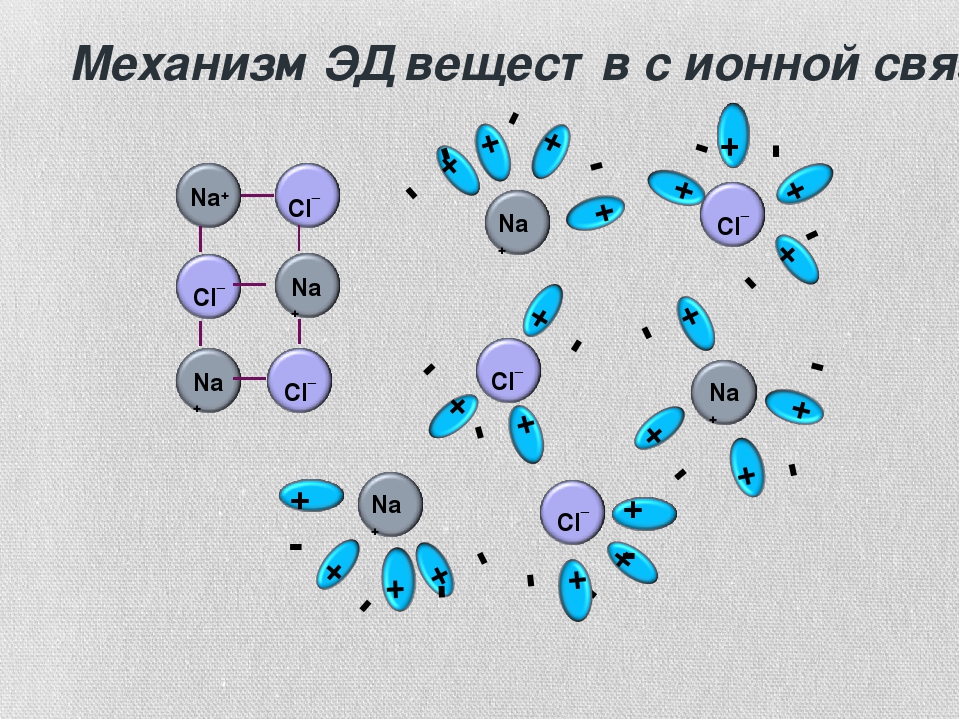
Рассмотрим механизм диссоциации веществ с ионным видом связи на примере хлорида натрия (см. таблицу). Он состоит из трёх этапов:
- ориентация полярных молекул воды (диполей) вокруг кристалла и расшатывание кристаллической решётки под действием хаотичного движения молекул воды;
- разрушение кристаллической решётки – диссоциация хлорида натрия;
- гидратация – окружение молекулами воды ионов натрия и хлора (образование гидратированных ионов).
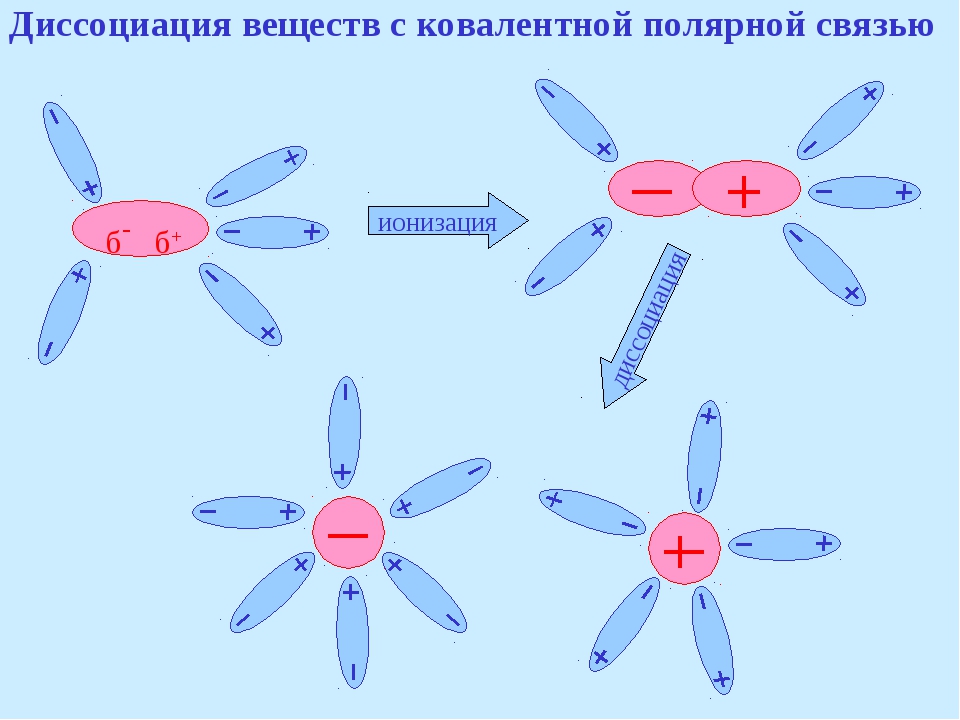
Механизм диссоциации веществ с ковалентной полярной связью включает в себя дополнительный этап:
- ориентация полярных молекул воды вокруг полярной молекулы электролита;
- изменение вида связи с ковалентной полярной на ионную;
- диссоциация электролита;
- гидратация ионов.

Все кислоты в водных растворах диссоциируют на ионы водорода и ионы кислотного остатка.
Полная диссоциация: H2SO4 ® 2H+ + SO42-
Ступенчатая диссоциация: H2SO4 ® H+ + HSO41-
HSO41- ® H+ + SO42-
Основания в водных растворах диссоциируют на гидроксид-ионы и ионы металла.
Полная диссоциация: Ba(OH)2 ® Ba2+ + 2OH1-
Ступенчатая диссоциация: Ba(OH)2 ® BaOH+ + OH1-
BaOH+ ® Ba2+ + OH1-
Средние соли диссоциируют в водных растворах на ионы металла и ионы кислотного остатка:
CaCl2 ® Ca2+ + 2Cl1-
Al2(SO4)3 ® 2Al3+ + 3SO42-
Кислые соли диссоциируют на ионы металла, ионы водорода и ионы кислотного остатка:
NaHSO4 ® Na+ + H+ + SO42-
Теория электролитической диссоциации.
 Электролитическая диссоциация… на Сёзнайке.ру
Электролитическая диссоциация… на Сёзнайке.ру
Теория электролитической диссоциации.
Электролитическая диссоциация кислот, оснований, солей.
ПЛАН ОТВЕТА:
- Электролиты.
- Положения теории электролитической диссоциации.
- Степень электролитической диссоциации.
- Классификация электролитов.
- Механизм электролитической диссоциации веществ с ионным типом связи.
- Механизм электролитической диссоциации веществ с ковалентной сильнополярной связью.
- Диссоциация кислот.
- Диссоциация оснований.
- Диссоциация солей.
Электролиты – вещества, водные растворы и расплавы которых проводят электрический ток. Эти вещества имеют ионную и ковалентную сильнополярную связи. Электролитами являются кислоты, основания, соли. Поведение электролитов в растворе объясняет теория электролитической диссоциации, сформулированная Сванте Аррениусом в 1887 году. Теория состоит из следующих положений:
Теория состоит из следующих положений:
- При растворении в воде электролиты распадаются на положительно и отрицательно заряженные ионы. Процесс распада электролита на ионы называется электролитической диссоциацией. Электролитическая диссоциация – процесс обратимый. Обратная реакция называется моляризацией.
- Под действием электрического напряжения катионы двигаются к катоду, а анионы – к аноду.
- Степень электролитической диссоциации зависит от природы электролита, температуры, концентрации.
Степень электролитической диссоциации – это величина, которая показывает отношение числа распавшихся на ионы молекул к общему числу молекул в растворе. Обозначается a. Измеряется в % (долях). N – общее число молекул в растворе, n – число диссоциированных молекул.
В зависимости от величины степени электролитической диссоциации электролиты разделяют на сильные и слабые:
1.
Сильные
> 0,3
KOH, NaOH, HCl, H2SO4, Na2SO4, Al2(SO4)3.
2.
Слабые
H2S, H2CO3, Cu(OH)2, Fe(OH)3, NH4OH
Сильные электролиты имеют значение степени диссоциации более 0,3. В их растворах практически нет молекул, есть только ионы. Сильными электролитами являются все соли, щёлочи, азотная, соляная и серная кислоты. К слабым электролитам относятся электролиты со степенью диссоциации меньше 0,3. В их растворах есть и ионы, и молекулы, причём молекул больше. К ним относятся нерастворимые основания гидроксид аммония, угольная, фосфорная, сернистая и кремниевая кислоты.,
Рассмотрим механизм диссоциации веществ с ионным видом связи на примере хлорида натрия (см. таблицу). Он состоит из трёх этапов:
- ориентация полярных молекул воды (диполей) вокруг кристалла и расшатывание кристаллической решётки под действием хаотичного движения молекул воды;
- разрушение кристаллической решётки – диссоциация хлорида натрия;
- гидратация – окружение молекулами воды ионов натрия и хлора (образование гидратированных ионов).
Механизм диссоциации веществ с ковалентной полярной связью включает в себя дополнительный этап:
- ориентация полярных молекул воды вокруг полярной молекулы электролита;
- изменение вида связи с ковалентной полярной на ионную;
- диссоциация электролита;
- гидратация ионов.
Все кислоты в водных растворах диссоциируют на ионы водорода и ионы кислотного остатка.
Полная диссоциация: H2SO4 ® 2H+ + SO42-
Ступенчатая диссоциация: H2SO4 ® H+ + HSO41-
HSO41- ® H+ + SO42-
Основания в водных растворах диссоциируют на гидроксид-ионы и ионы металла.
Полная диссоциация: Ba(OH)2 ® Ba2+ + 2OH1-
Ступенчатая диссоциация: Ba(OH)2 ® BaOH+ + OH1-
BaOH+ ® Ba2+ + OH1-
Средние соли диссоциируют в водных растворах на ионы металла и ионы кислотного остатка:
CaCl2 ® Ca2+ + 2Cl1-
Al2(SO4)3 ® 2Al3+ + 3SO42-
Кислые соли диссоциируют на ионы металла, ионы водорода и ионы кислотного остатка:
NaHSO4 ® Na+ + H+ + SO42-
|
Цели. План изложения темы
ХОД УРОКА Учитель. Известно ли вам, что
вещества растворяются не только в воде, но и в
других растворителях? Если да, то приведите
примеры. (Учащиеся приводят примеры
растворения веществ.) Учитель. 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4. Из результатов опытов сделаем вывод, что вода
в химических реакциях вовсе не пассивная среда.
Под ее влиянием вещества испытывают изменения.
Вода заставляет электролиты распадаться на ионы.
Механизм электролитической
диссоциации NaCl при растворении поваренной
соли в воде состоит в последовательном
отщеплении ионов натрия и хлора полярными
молекулами воды. Вслед за переходом ионов Na+
и Сl– из кристалла в раствор происходит
образование гидратов этих ионов.
При растворении в воде соляной
кислоты (в молекулах HCl cвязь между атомами
ковалентная сильнополярная) происходит
изменение характера химической связи. Под
влиянием полярных молекул воды ковалентная
полярная связь превращается в ионную.
Образовавшиеся ионы остаются связанными с
молекулами воды – гидратированными.
Наличие ионов в растворах кислот, щелочей и солей можно доказать реакциями обмена. Проведем следующие опыты: взаимодействие сульфата меди(II) c: взаимодействие нитрата серебра с: Запишем уравнения химических реакций: а) СuSO4 + Ba(NO3)2 = Cu(NO3)2 + BaSO4; б) СuSO4 + BaСl2 = CuCl2 + BaSO4; в) СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2; г) СuSO4 + Сa(OH)2 = CaSO4 + Cu(OH)2; д) AgNO3 + HCl = HNO3 + AgCl; е) AgNO3 + NaCl = NaNO3 + AgCl. На основании этих реакций можно сделать
следующие выводы: HCl = H+ + Cl–, NaOH = Na+ + OH–, NaCl = Na+ + Cl–. Многоосновные кислоты и кислые соли
диссоциируют ступенчато. H2SO4 = H+ + , H+ + ; NaHSO4 = Na+ + , H+ + . Cледует не допускать ошибок при написании уравнений диссоциации нерастворимых и малорастворимых веществ, которые практически не диссоциируют на ионы или диссоциируют в малой степени: CaCO3 нет диссоциации, СaSO4 Ca2+ + . Основные термины, рассматриваемые в теории
электролитической диссоциации, – это
«электролиты» и «ионы».
Общий и характерный признак ионов –
наличие электрических зарядов. Ток проводят
только те растворы, в которых содержатся ионы. СН3СООН СН3СОО– + Н+. Вещества с ионной кристаллической решеткой
полностью диссоциируют на ионы в водных
растворах. Отношение числа диссоциированных
молекул (n) к общему числу молекул (N), находящихся
в растворе, называют степенью диссоциации (). Величина может принимать
значения от 0 (диссоциации нет) до 1 (диссоциация
полная). Демонстрационный опыт. Е.Н.ДЕГТЯРЕВА,учитель химии Зареченской средней школы (п. Заречье, Нижнеудинский р-н, Иркутская обл.) |
Диссоциация
Диссоциация — Механизм психологической защиты, относящийся к так называемым первичным механизмам и состоящий в том, что человек обретает способность воспринимать происходящее с ним так, будто оно происходит не с ним, а с кем-то посторонним. Таким образом диссоциируется (отделяется) личность и неприятные ощущения, которые переживает человек.
Диссоциироваться могут не только неприятные эмоции, но и наоборот — очень сильные положительные эмоции (которые вызывают эмоциональный дистресс).
Термин «диссоциация» был предложен в конце девятнадцатого века П. Жане. Он в ходе наблюдений выяснил, что комплекс идей может отщепляться от основной личности и существовать независимо и как бы вне сознания. Интересно, что с помощью гипноза Жане удавалось на время «соединить» личность и переживания.
Диссоциация считается довольно распространенным механизмом психологической защиты, хотя она и не применяется большинством людей в обычных условиях. Признаки диссоциации:
— «Это происходит будто не со мной»,
— «Мне кажется, что эти чувства — не мои»,
— «Мои чувства как бы отделились от меня, живут самостоятельно и где-то в отдалении».
В крайних случаях диссоциация может привести к тому, что индивид начинает как бы видеть себя со стороны, вплоть до ощущения выхода из тела.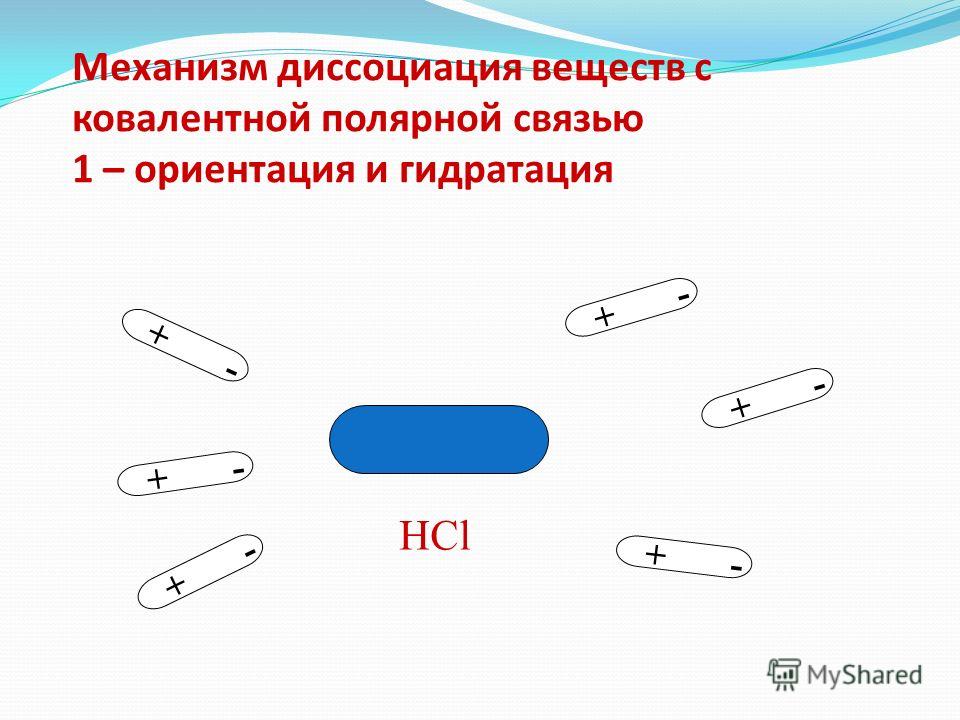
Различают диссоциацию в норме и патологии.
Диссоциация в норме — это как правило реакция на стресс, сильные неприятные переживания. Ситуация требует эмоциональной собранности и контроля над собственными действиями, но в силу неготовности к такого рода переживаниям человек прибегает к диссоциации себя и чувств. Значительный плюс такой диссоциации — временное обретение возможности трезво оценивать ситуацию и расчетливо реагировать.
При нарушениях психологического здоровья диссоциация может применяться некоторыми людьми для защиты не только от действительно сложных и опасных ситуаций, требующих немедленной трезвой оценки, но и от просто эмоционально неприятных событий. Люди с повышенной чувствительностью к негативным эмоциям могут диссоциировать в самых обычных для других людей ситуациях, требующих от них эмоционального вовлечения. Такие люди с трудом налаживают эмоциональный контакт, кажутся исключительно холодными и хладнокровными.
Постоянное использование диссоциации может привести, например, к социальной изоляции индивида: постоянный «трезвый» настрой блокирует возможность адекватно оценить эмоциональную ее составляющую, резко снижает эмпатию.
Как и другие механизмы психологической защиты эта «способность» начинает формироваться еще в далеком детстве. Чаще склонны к диссоциации люди, перенесшие в детстве тяжелую психологическую травму: подвергавшиеся насилию, пережившие катастрофу, наблюдавшие жестокое обращение с другим человеком или животным. Также развитию этой «способности» способствует наблюдение ее у других, окружающих людей.
Крайние случаи диссоциации имеют место при нарушениях психического здоровья, например при психозах. Нэнси Мак-Вильямс описывает диссоциацию как центральную защиту людей с расстройством по типу множественной личности. В целом этот механизм психологической защиты лежит в основе всех диссоциативных расстройств.
Электролитическая диссоциация в растворе
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.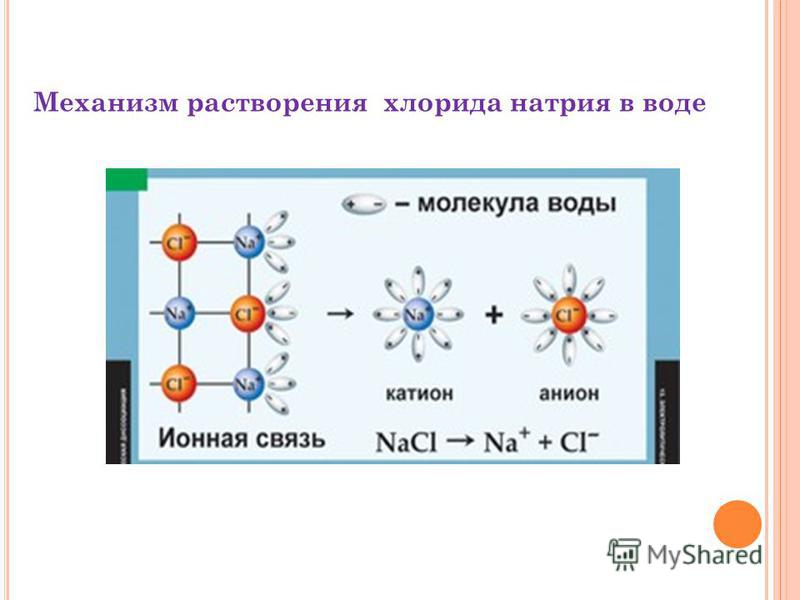
Чтобы получить подробное описание элемента, кликните по его названию.
диссоциативный механизм | химия | Британика
В координационном соединении: Замена…посредством которой может происходить замена, а именно диссоциативный и ассоциативный механизмы. В диссоциативном механизме лиганд теряется из комплекса с образованием промежуточного соединения с более низким координационным числом. Этот тип пути реакции типичен для октаэдрических комплексов, многих аквакомплексов и карбонилов металлов, таких как тетракарбонилникель. Пример…
Подробнее»,»url»:»Введение»,»wordCount»:0,»последовательность»:1},»imarsData»:{«HAS_REVERTED_TIMELINE»:»false»,»INFINITE_SCROLL»:»»}, «npsAdditionalContents»:{},»templateHandler»:{«metered»:false,»name»:»INDEX»},»paginationInfo»:{«previousPage»:null,»nextPage»:null,»totalPages»:1} ,»seoTemplateName»:»ИНДЕКС РАЗДЕЛА»,»infiniteScrollList»:[{«p»:1,»t»:1483051}],»familyPanel»:{«topicLink»:{«title»:»диссоциативный механизм»,» url»:»/science/dissociative-mechanism»},»tocPanel»:{«title»:»Directory»,»itemTitle»:»References»,»toc»:null},»groups»:[],»showCommentButton «:false,»fastFactsItems»:null},»byline»:{«contributor»:null,»allContributorsUrl»:null,»lastModificationDate»:null,»contentHistoryUrl»:null,»warningMessage»:null,»warningDescription»: null},»citationInfo»:{«участники»:null,»title»:»диссоциативный механизм»,»lastModification»:null,»url»:»https://www. britannica.com/science/dissociative-mechanism»},»веб-сайты»:null,»lastArticle»:false}
britannica.com/science/dissociative-mechanism»},»веб-сайты»:null,»lastArticle»:false}
Узнайте об этой теме в этих статьях:
реакции замещения
- В координационном соединении: Замещение
…через которое может происходить замещение, а именно диссоциативный и ассоциативный механизмы.В диссоциативном механизме лиганд теряется из комплекса с образованием промежуточного соединения с более низким координационным числом. Этот тип пути реакции типичен для октаэдрических комплексов, многих аквакомплексов и карбонилов металлов, таких как тетракарбонилникель. Пример…
Подробнее
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.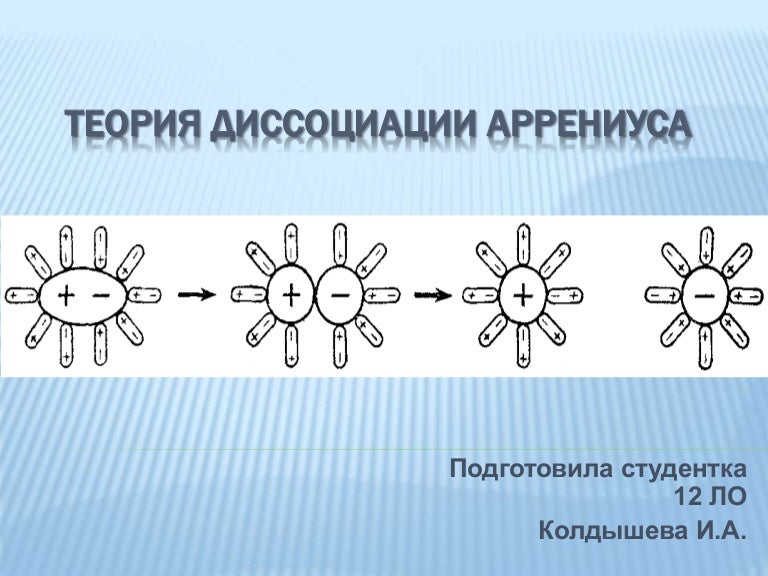 Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Сверхбыстрый механизм диссоциации экситонов в двумерных перовскитах
Равновесие диссоциации полярных экситонов в двумерных перовскитах.Авторы и права: Сунь Ци, Чжао Чуньи и Тянь Вэньминь. Исследовательская группа под руководством профессора Цзинь Шэнье из Даляньского института химической физики (DICP) Китайской академии наук обнаружила сверхбыстрый и высокоэффективный механизм диссоциации поляронного экситона в двумерных (2D) перовскитах.
Это исследование было опубликовано в журнале Journal of the American Chemical Society от ноября 2008 г.3.
Двумерные перовскиты представляют собой класс материалов с квантовыми ямами (КЯ) природного происхождения. Энергия связи экситона в двумерном перовските намного больше (до сотен мэВ), чем в их трехмерном аналоге из-за сильного квантового и диэлектрического ограничения.
Поэтому принято считать, что фотогенерированные носители заряда в двумерных перовскитах в основном существуют в виде экситонов, которые трудно диссоциировать на свободные носители при комнатной температуре.
В этом исследовании, используя ап-конверсию фемтосекундной фотолюминесценции и спектроскопию нестационарного поглощения, ученые впервые прямо и динамически наблюдали сверхбыструю и высокоэффективную диссоциацию экситонов в двумерных перовскитах.Это подтвердило, что свободные носители были доминирующими видами переносчиков в двумерных перовскитах при комнатной температуре, что противоречит предыдущей мысли.
Более того, они предложили индуцированный поляронами механизм диссоциации экситонов, в котором экситон-поляроны легко образуются за счет сильной экситон-фононной связи, как в трехмерных перовскитах, а эффект поляронного экранирования приводит к значительному снижению энергии связи для эффективной диссоциации экситона.
Исследователи продемонстрировали, что диссоциация экситона на свободные носители была основным фактором, ограничивающим квантовый выход фотолюминесценции двумерных перовскитов за счет дополнительных безызлучательных потерь носителей.
«Эта работа раскрывает общее свойство диссоциации экситонов в этом классе 2D-материалов и дает рекомендации по разработке и рациональному использованию 2D-перовскитов в оптических и оптоэлектронных приложениях», — сказал профессор Джин.
Исследование раскрывает механизм переноса электронов с помощью шнека между соседними квантовыми ямами в двумерных слоистых перовскитах
Больше информации: Ци Сан и др.
 , Сверхбыстрая и высокоэффективная диссоциация полярных экситонов в двумерных перовскитах, , Журнал Американского химического общества, (2021).DOI: 10.1021/jacs.1c08900
Предоставлено
Китайская академия наук
, Сверхбыстрая и высокоэффективная диссоциация полярных экситонов в двумерных перовскитах, , Журнал Американского химического общества, (2021).DOI: 10.1021/jacs.1c08900
Предоставлено
Китайская академия наук
Цитата : Механизм сверхбыстрой диссоциации экситонов в двумерных перовскитах (18 ноября 2021 г.) получено 16 февраля 2022 г. с https://физ.org/news/2021-11-ultrafast-exciton-dissociation-mechanism-2d.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Причины, диагностика, симптомы и лечение
ИСТОЧНИКИ:
Richard J.Левенштейн, старший психиатр; медицинский директор Программы травматологических расстройств системы здравоохранения Шеппарда Пратта; клинический профессор психиатрии Медицинской школы Университета Мэриленда.
Американская психиатрическая ассоциация: «Что такое диссоциативные расстройства?»
Диалоги в клинической неврологии : «Диссоциативные дебаты: все, что вы знаете, неверно».
Клиническая психофармакология и неврология : «Многоликая диссоциация: возможности для инновационных исследований в психиатрии».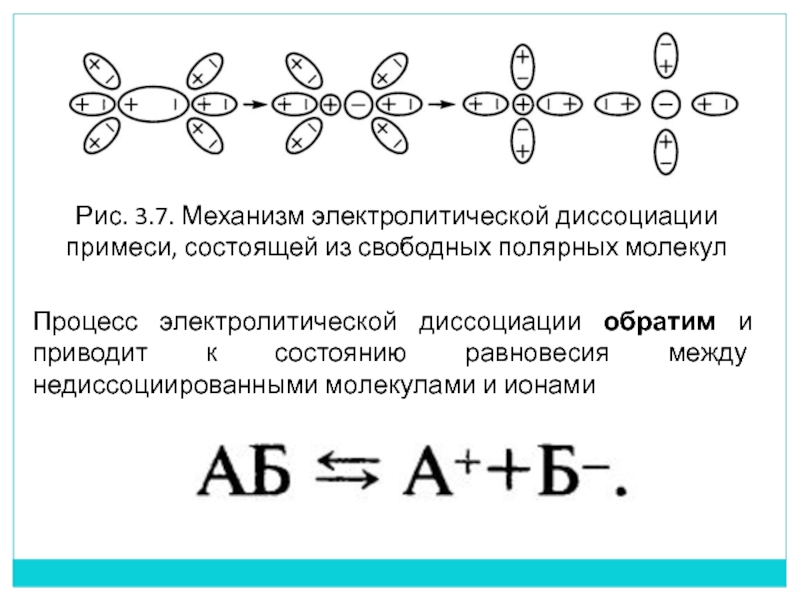
Американский журнал психиатрии: «Диссоциация при психических расстройствах: метаанализ исследований с использованием шкалы диссоциативных переживаний».
Национальная служба здравоохранения (Великобритания): «Диссоциативные расстройства».
Sheppard Pratt Health System : «Диссоциативное расстройство личности (ДРИ)».
Журнал травматического стресса : Связь между перитравматической диссоциацией и симптомами посттравматического стрессового расстройства: посредническая роль негативных убеждений о себе.
Acta Obstetricia et Gynecologica Scandinavica : «Тоническая неподвижность во время сексуального насилия — обычная реакция, предсказывающая посттравматическое стрессовое расстройство и тяжелую депрессию».
Культура, медицина и психиатрия : Диссоциативный опыт и культурная неврология: повествование, метафора и механизм».
Архив нейропсихиатрии : «Взаимосвязь между диссоциацией, вниманием и дисфункцией памяти».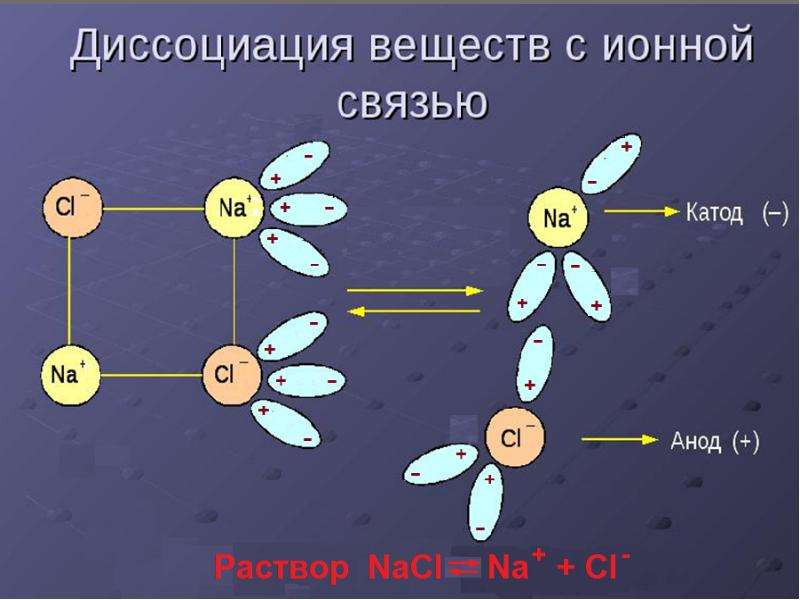
Европейский журнал психотравматологии : «Диссоциация, связанная с травмой, и измененные состояния сознания: призыв к клиническим, лечебным и неврологическим исследованиям».
Национальный альянс по психическим заболеваниям: «Диссоциативные расстройства».
Клиника Мэйо: «Гипноз».
Неврология сознания : «Измерения сознания и психоделическое состояние».
Границы психологии : «Психоделики, медитация и самосознание.
Journal of Family Violence : «Роль диссоциации в цикле насилия».
American Journal of Psychiatry : «Симптомы диссоциации у людей, испытывающих острый неконтролируемый стресс: проспективное исследование».
Нейропсихиатрические заболевания и лечение : «Диссоциация при шизофрении и пограничном расстройстве личности». Управление и лечение.
МНОЖЕСТВЕННАЯ ЛИЧНОСТЬ. МЕХАНИЗМ ДИССОЦИАЦИИ, ПРОТИВОПОЛОЖНЫЙ ШИЗОФРЕНИИ
Блисс, Э.Л. и Джеппсен, Э.А. (1985).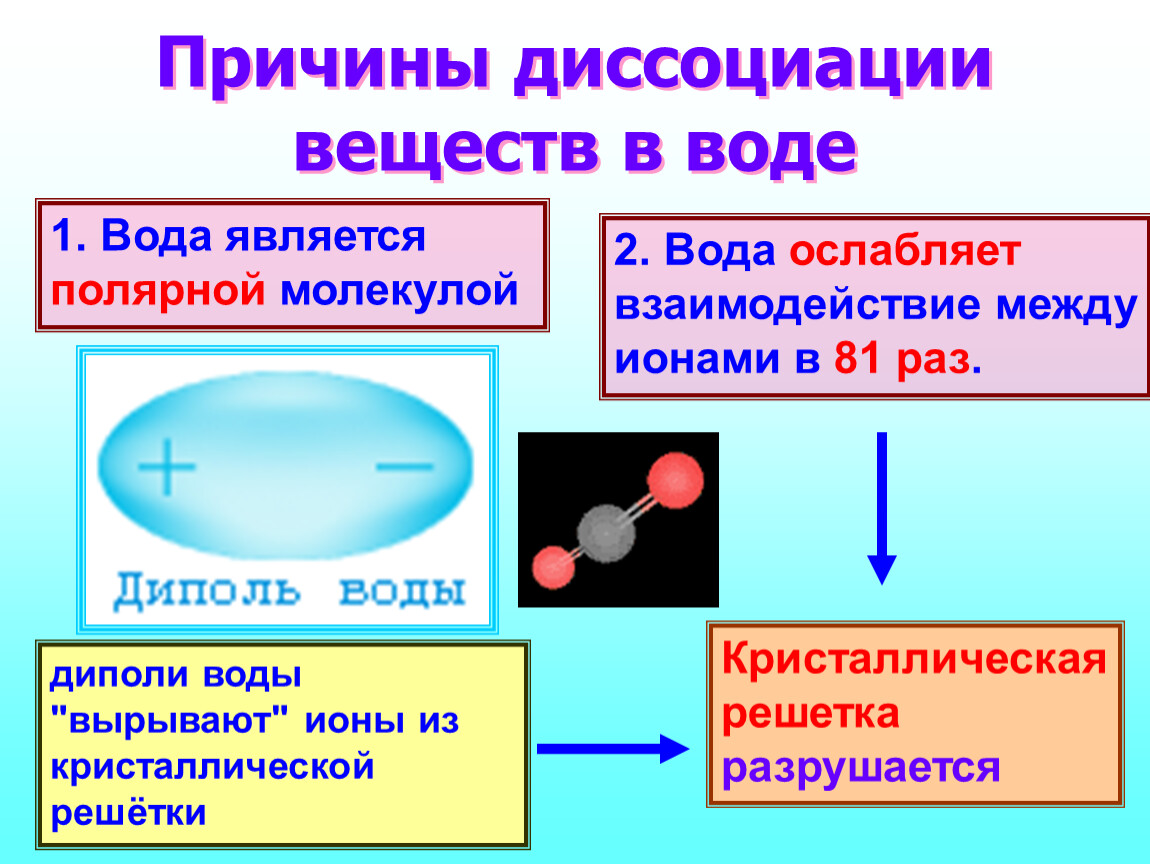 Распространенность множественной личности среди стационарных и амбулаторных больных. Американский журнал психиатрии 142 (2), 250–251.
DOI: https://doi.org/10.1176/ajp.142.2.250
Распространенность множественной личности среди стационарных и амбулаторных больных. Американский журнал психиатрии 142 (2), 250–251.
DOI: https://doi.org/10.1176/ajp.142.2.250
Браун, Б.Г. (2018). Психотерапия пережившего инцест с диссоциативным расстройством. Психиатрические клиники Северной Америки 12 (2), 307–324. Получено с https://dx.doi.org/10.1016/s0193-953x(18)30433-7 10.1016/s0193-953x(18)30433-7 DOI: https://doi.org/10.1016/S0193-953X(18)30433-7
Бренде, Дж. О. и Ринсли, Д. Б. (1981). Случай множественной личности с психологическими автоматизмами. Журнал Американской академии психоанализа 9 (1), 129–151. Получено с https://dx.doi.org/10.1521/jaap.1.1981.9.1.129 10.1521/jaap.1.1981.9.1.129 DOI: https://doi.org/10.1521/jaap.1.1981.9.1.129
КОРИЛЛ, В.(1983). Множественная личность и первичное аффективное расстройство. Журнал нервных и психических заболеваний 171 (6), 388–390. Получено с https://dx.doi.org/10.1097/00005053-198306000-00011 10.1097/00005053-198306000-00011
DOI: https://doi.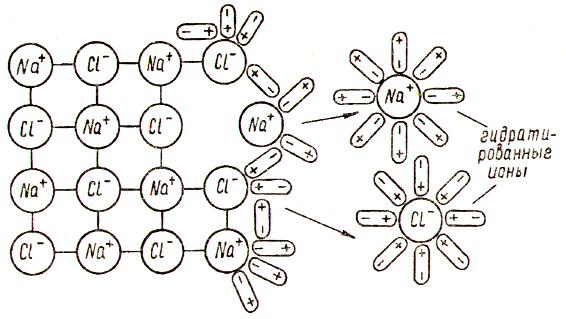 org/10.1097/00005053-198306000-00011
org/10.1097/00005053-198306000-00011
Kluft, RP (1985). Предшественники детства множественной личности. В детстве предшественники множественной личности. Вашингтон, округ Колумбия: American Psychiatric Press
.Людвиг, А.М., Брандсма, Дж. М., Уилбур, С. Б. и Бендфельдт, Ф. (1972). Объективное исследование множественной личности. Или четыре головы лучше, чем одна? Архив общей психиатрии 26 (4), 298–310. DOI: https://doi.org/10.1001/archpsyc.1972.01750220008002
Маквильямс, Н. (1994). Психоаналитический диагноз. В психоаналитической диагностике. Нью-Йорк: Гилфорд Пресс
Патнэм, Ф.В., Гуров, Дж.Дж., Зильберман, Э.К. и Барбан, Л. (1986). Клиническая феноменология множественного расстройства личности: обзор 100 недавних случаев.Журнал клинической психиатрии 47 (6), 285–93.
Росс, Калифорния (1997). Диссоциативное расстройство личности: диагностика, клинические особенности и лечение множественной личности (2-е изд.) При диссоциативном расстройстве личности: диагностика, клинические особенности и лечение множественной личности. Нью-Йорк: John Wiley & Sons, Inc.,
Нью-Йорк: John Wiley & Sons, Inc.,
Шпигель, Д. (1984). Множественная личность как посттравматическое стрессовое расстройство. Психиатрические клиники Северной Америки 7 (1), 101–110.DOI: https://doi.org/10.1016/S0193-953X(18)30783-4
Трифу С., Марика С., Браиляну Д., Карп Э. Г. и Гутт А. М. (2015). Преподавание психиатрических концепций невроза, психоза и пограничной патологии. Концептуальные границы. Procedia — Социальные и поведенческие науки 203, 125–129. Получено с https://dx.doi.org/10.1016/j.sbspro.2015.08.269 10.1016/j.sbspro.2015.08.269 DOI: https://doi.org/10.1016/j.sbspro.2015.08.269
Трифу, С., Тудор, А. и Радулеску, И. (2020). Агрессивное поведение у психически больных в связи с гормональным дисбалансом (обзор) Экспериментальная и терапевтическая медицина 20, 3483–3487. Получено с https://dx.doi.org/10.3892/etm.2020.8974 10.3892/etm.2020.8974 DOI: https://doi.org/10.3892/etm.2020.8974
Трифу, С. и Трифу, А. Д. (2020). Рецепторные профили атипичных антипсихотических молекул. Серия научных бюллетеней Политехнического университета Бухареста B-Химия и материаловедение 82 (1), 113–128.
Серия научных бюллетеней Политехнического университета Бухареста B-Химия и материаловедение 82 (1), 113–128.
Трифу С., Владути А. и Трифу А. И. (2020). Генетические аспекты шизофрении. Рецепторные теории. Метаболические теории. Румынский журнал морфологии и эмбриологии 61 (1), 25–32. DOI: https://doi.org/10.47162/RJME.61.1.03
Типы, причины, симптомы и лечение
Обзор
Что такое диссоциативные расстройства?
Слово «диссоциация» означает отключение от других, от окружающего мира или от самого себя.
Термин «диссоциативные расстройства» описывает стойкое психическое состояние, которое характеризуется чувством оторванности от реальности, нахождением вне собственного тела или потерей памяти (амнезией).
Около 2% населения США испытывают настоящие диссоциативные расстройства (а не только кратковременные чувства диссоциации). Затрагиваются все возрастные группы, расовые, этнические и социально-экономические группы. Женщины чаще, чем мужчины, диагностируются.
Типы диссоциативных расстройств
Существует три основных типа диссоциативных расстройств:
- Диссоциативное расстройство личности
- Расстройство деперсонализации/дереализации
- Диссоциативная амнезия
Острое стрессовое расстройство и посттравматическое стрессовое расстройство (ПТСР) тесно связаны с диссоциативными расстройствами и имеют общие симптомы, такие как потеря памяти, деперсонализация или дереализация.
Симптомы и причины
Что вызывает диссоциативные расстройства?
Диссоциативные расстройства часто сначала развиваются как способ справиться с катастрофическим событием или длительным стрессом, жестоким обращением или травмой. Это особенно верно, если такие события происходят в раннем детстве. В этот период жизни существуют ограничения в способности полностью понимать происходящее, механизмы преодоления не до конца развиты, а получение поддержки и ресурсов зависит от присутствия заботливых и знающих взрослых.
Мысленное отстранение себя от травмирующей ситуации, такой как авария, стихийное бедствие, военные действия, жертва преступления или повторяющееся физическое, психологическое или сексуальное насилие, может быть механизмом преодоления, помогающим избежать боли в краткосрочной перспективе. Это становится проблемой, если в течение длительного времени оно продолжает отделять человека от реальности и стирает воспоминания о целых периодах времени.
Каковы симптомы диссоциативных расстройств?
Когда-то известное как множественное расстройство личности, диссоциативное расстройство личности обычно связано с катастрофическими переживаниями, жестоким обращением или травмой, которые произошли, когда человек был ребенком.Среди людей с этим расстройством около 90% были жертвами жестокого обращения (физического или сексуального) или пренебрежения в детстве.
Симптомы диссоциативного расстройства личности включают:
Существование двух или более различных личностей или «состояний личности». Каждая идентичность имеет определенный набор моделей поведения, отношений, предпочтений, воспоминаний и способов мышления, которые могут наблюдаться другими и могут даже сообщаться пострадавшим человеком. Переход от одной идентичности к другой происходит непроизвольно, внезапно и может измениться в любой момент.
Каждая идентичность имеет определенный набор моделей поведения, отношений, предпочтений, воспоминаний и способов мышления, которые могут наблюдаться другими и могут даже сообщаться пострадавшим человеком. Переход от одной идентичности к другой происходит непроизвольно, внезапно и может измениться в любой момент.
- Долговременные провалы в памяти, касающиеся повседневных событий, личной информации или травмирующих событий прошлого.
- Проблемы в социальной среде, на рабочем месте или в других сферах повседневной жизни. Серьезность таких проблем может варьироваться от минимальной до значительной.
Суицидальные попытки, членовредительство и другие формы самоповреждающего поведения распространены среди людей с диссоциативным расстройством личности. Более 70% амбулаторных пациентов с этим заболеванием пытались покончить жизнь самоубийством.
Симптомы расстройства деперсонализации/дереализации
Одно или оба из следующих состояний повторяются у одного и того же человека в течение длительного периода времени:
- Деперсонализация – Ощущение нереальности или оторванности от собственного разума, тела или себя.
 Это как если бы человек был наблюдателем, а не участником событий собственной жизни.
Это как если бы человек был наблюдателем, а не участником событий собственной жизни. - Дереализация — ощущение нереальности или оторванности от своего окружения. Люди и вещи могут казаться нереальными.
Во время этих эпизодов человек осознает свое окружение и знает, что то, что он переживает, не является нормальным. Даже если человек проявляет мало эмоций во время этих эпизодов, они обычно интерпретируются как весьма расстраивающие.
Симптомы могут проявиться еще в детстве, средний возраст первого опыта — 16 лет. Менее 20% впервые столкнутся с расстройством после 20 лет.
Симптомы диссоциативной амнезии
Диссоциативная амнезия означает неспособность вспомнить информацию о своем прошлом.Это не то же самое, что просто быть забывчивым, поскольку обычно это связано с травмирующим или особенно стрессовым событием или периодом времени. Эпизод амнезии возникает внезапно и может длиться от нескольких минут до месяцев или лет. Нет определенного возраста начала, и эпизоды могут возникать периодически на протяжении всей жизни.
Существует три вида амнезии:
- Локализованный — не может вспомнить событие или период времени (наиболее распространенная форма амнезии)
- Selective — Невозможно вспомнить определенные детали событий за данный период времени.
- Генерализованная — Полная потеря идентичности истории жизни (наиболее редкая форма).
Человек может не осознавать потерю памяти или плохо осознавать ее. Даже когда они осознают потерю памяти, человек часто преуменьшает важность того, чтобы не вспомнить конкретное событие или период времени.
Диагностика и тесты
Как диагностируются диссовиативные расстройства?
Диагностика диссоциативных расстройств включает обзор симптомов и истории жизни человека.Физические тесты могут быть выполнены, чтобы исключить физические или медицинские условия, которые могут вызвать такие симптомы, как потеря памяти или чувство нереальности. Такие состояния могут включать травму головы, опухоль головного мозга, проблемы со сном или употребление наркотиков или алкоголя. Как только физические причины будут исключены, специалист по психическому здоровью вмешается, чтобы проанализировать детали случая человека.
Как только физические причины будут исключены, специалист по психическому здоровью вмешается, чтобы проанализировать детали случая человека.
Управление и лечение
Как лечат диссоциативные расстройства?
Лечение диссоциативных расстройств обычно состоит из психотерапии с целью помочь человеку интегрировать различные личности и получить контроль над диссоциативным процессом и симптомами.Терапия может быть долгой и трудной, так как она включает в себя вспоминание и умение справляться с прошлой травмой.
Когнитивная (то есть работающая с сознательной интеллектуальной деятельностью пациента) поведенческая терапия оказалась эффективной. Гипноз может быть еще одним полезным лечением. Более новая терапия под названием «Десенсибилизация и переработка движениями глаз» (EMDR) специально фокусируется на роли, которую тревожные воспоминания играют в развитии психических расстройств.
Никаких конкретных лекарств для лечения диссоциативных расстройств не существует, хотя для лечения симптомов депрессии могут потребоваться антидепрессанты.

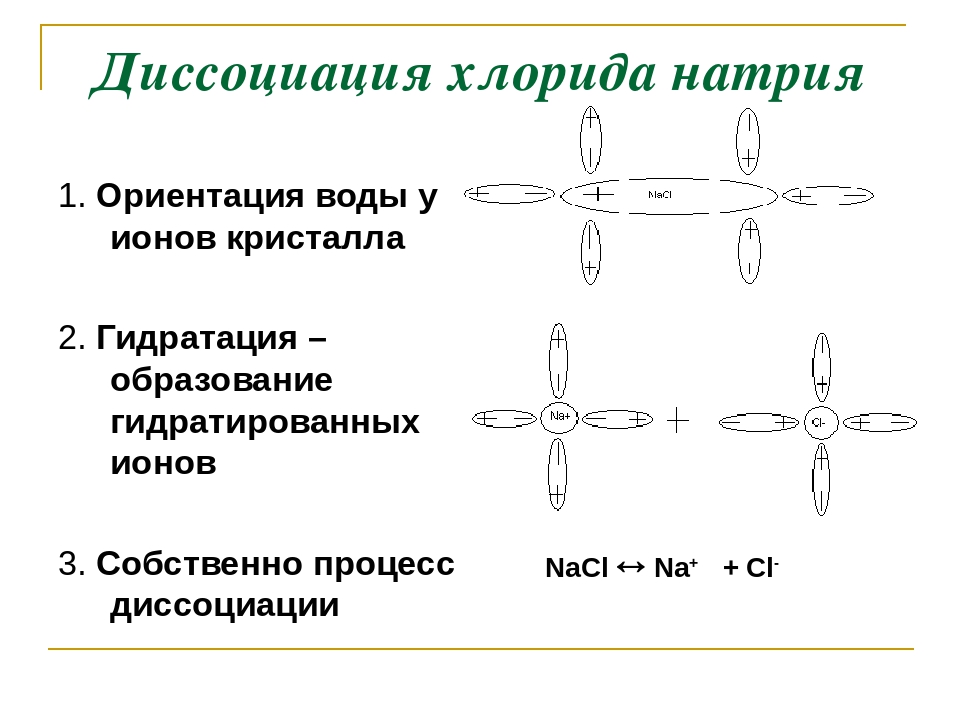 Сформировать у учащихся понятие
«электролитическая диссоциация» на основе
атомно-молекулярного учения, теории
электролитической диссоциации С.Аррениуса и
гидратной теории растворов Д.И.Менделеева.
Вскрыть причину электропроводности растворов,
обсудить значение и применение теории.
Сформировать у учащихся понятие
«электролитическая диссоциация» на основе
атомно-молекулярного учения, теории
электролитической диссоциации С.Аррениуса и
гидратной теории растворов Д.И.Менделеева.
Вскрыть причину электропроводности растворов,
обсудить значение и применение теории.
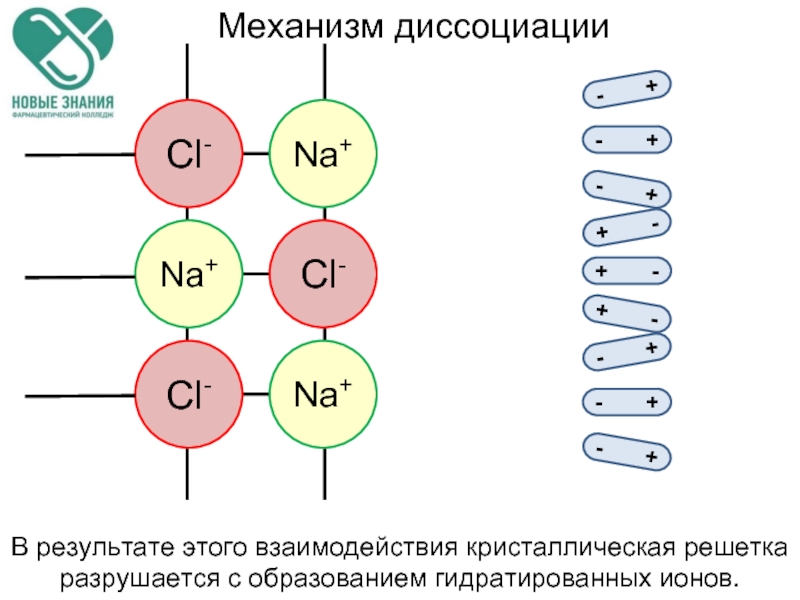 Выделяется ли водород? А
теперь перельем содержимое пробирки (из опыта) в
пробирку с водой, очень осторожно. Реакция пошла,
выделяется много тепла. Обратите внимание, без
воды реакция почти не шла, хотя вода при обычных
условиях не взаимодействует с цинком.
Выделяется ли водород? А
теперь перельем содержимое пробирки (из опыта) в
пробирку с водой, очень осторожно. Реакция пошла,
выделяется много тепла. Обратите внимание, без
воды реакция почти не шла, хотя вода при обычных
условиях не взаимодействует с цинком.
 (Далее веду
объяснение по рисунку (рис. 2, см. с. 36) учебника:
Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1999, с. 4.) А как реагируют с
молекулами воды полярные молекулы электролита?
Рассмотрим это на примере соляной кислоты (рис. 3,
(Далее веду
объяснение по рисунку (рис. 2, см. с. 36) учебника:
Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1999, с. 4.) А как реагируют с
молекулами воды полярные молекулы электролита?
Рассмотрим это на примере соляной кислоты (рис. 3, Если
растворитель неводный, то ионы называют
сольватированными.
Если
растворитель неводный, то ионы называют
сольватированными.
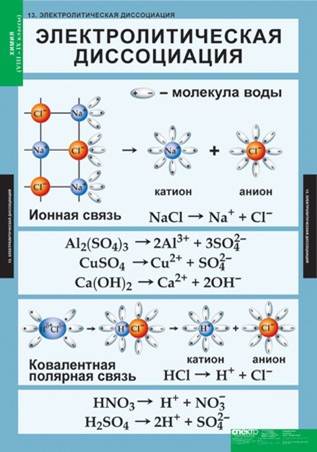 Чтобы показать
неполную диссоциацию молекул и ионов, не
относящихся к сильным электролитам, используют
знак обратимости «». Например,
для H2SO4и ее кислой соли NaHSO4:
Чтобы показать
неполную диссоциацию молекул и ионов, не
относящихся к сильным электролитам, используют
знак обратимости «». Например,
для H2SO4и ее кислой соли NaHSO4: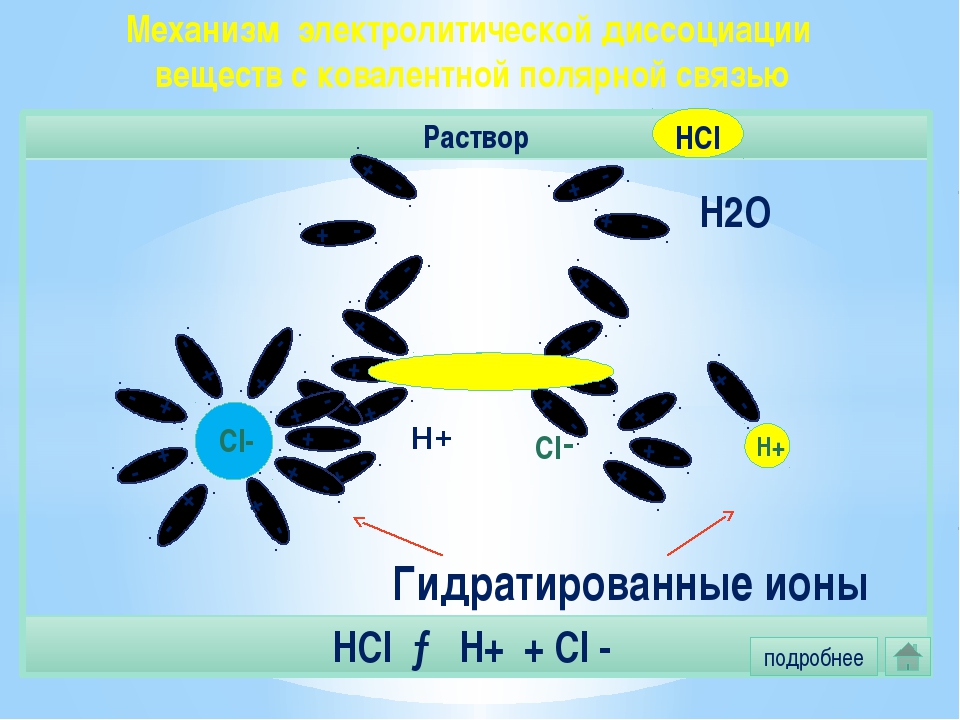
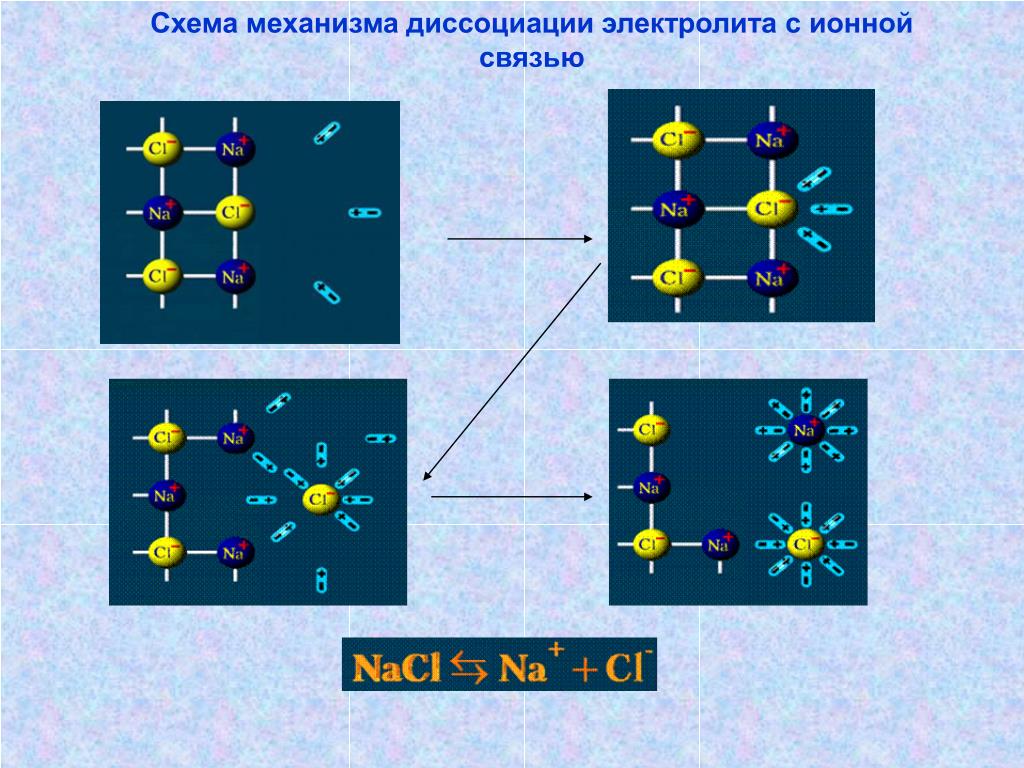 Сравним электропроводность растворов кислот,
щелочей, солей, сахара, спирта при помощи прибора
для изучения электропроводности растворов (рис.
4). Мы видим, что диссоциация происходит не во
всяком растворе. На основании ионной теории
сформулируем новые определения кислот,
оснований и солей как сложных веществ,
образующих при диссоциации в воде особые ионы.
При диссоциации кислот в качестве катионов
отщепляются только ионы H+. При
диссоциации оснований в качестве анионов
отщепляется только ионы ОН–. Средние
соли диссоциируют на катионы металлов и анионы
кислотных остатков.
Сравним электропроводность растворов кислот,
щелочей, солей, сахара, спирта при помощи прибора
для изучения электропроводности растворов (рис.
4). Мы видим, что диссоциация происходит не во
всяком растворе. На основании ионной теории
сформулируем новые определения кислот,
оснований и солей как сложных веществ,
образующих при диссоциации в воде особые ионы.
При диссоциации кислот в качестве катионов
отщепляются только ионы H+. При
диссоциации оснований в качестве анионов
отщепляется только ионы ОН–. Средние
соли диссоциируют на катионы металлов и анионы
кислотных остатков.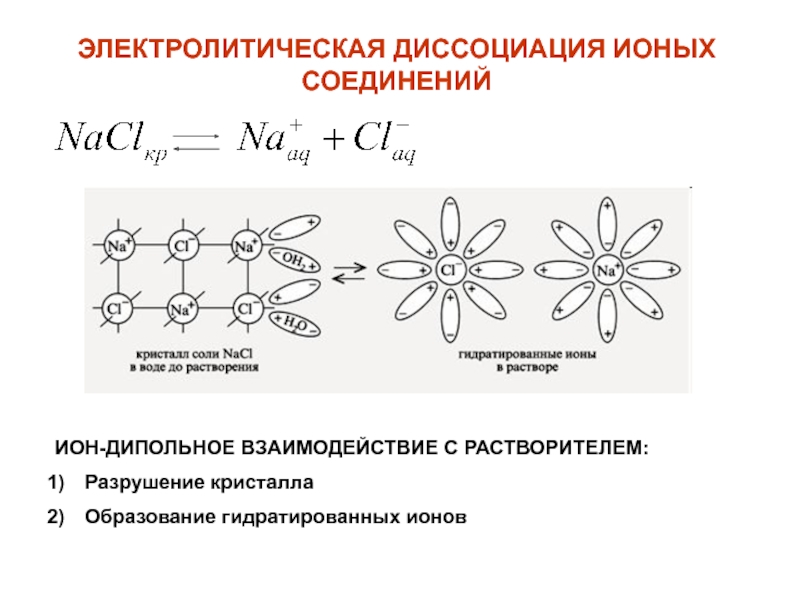 Хлорид натрия даже в
концентрированных растворах диссоциируют
полностью. Молекулы же уксусной кислоты в
концентрированных растворах почти не
диссоциируют. При разбавлении уксусной кислоты
число диссоциированных молекул увеличивается,
равновесие диссоциации смещается вправо:
Хлорид натрия даже в
концентрированных растворах диссоциируют
полностью. Молекулы же уксусной кислоты в
концентрированных растворах почти не
диссоциируют. При разбавлении уксусной кислоты
число диссоциированных молекул увеличивается,
равновесие диссоциации смещается вправо: В два
стакана нальем по 50 мл раствора метилоранжа в
ацетоне. В первый стакан добавим 1–2 капли
концентрированной серной кислоты, появляется
малиновое окрашивание. Чтобы во втором стакане
появилась такая же окраска, придется добавить в 10
раз больше (10–20 капель) уксусной кислоты, т.к.
степень диссоциации кислоты CH3COOH
незначительная и концентрация ионов водорода в
ней невелика.
В два
стакана нальем по 50 мл раствора метилоранжа в
ацетоне. В первый стакан добавим 1–2 капли
концентрированной серной кислоты, появляется
малиновое окрашивание. Чтобы во втором стакане
появилась такая же окраска, придется добавить в 10
раз больше (10–20 капель) уксусной кислоты, т.к.
степень диссоциации кислоты CH3COOH
незначительная и концентрация ионов водорода в
ней невелика.