Катализаторы — Что такое Катализаторы?
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы — вещества, изменяющие скорость химической реакции и не входящие в состав конечных продуктов.См. Спецпроект Neftegaz.RU «Национальный продукт: Отечественные катализаторы».
Катализаторы обеспечивают энергетически менее затрудненные пути реакции, что позволяет эффективно использовать сырье.
Катализ — это ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются.
Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс).
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы позволяют превратить низкосортное сырье в высокоценные продукты.
Без катализаторов невозможно обеспечить производство моторных топлив для двигателей экологического стандарта «Евро-5» и выше.
Например, в каталитическом крекинге — одном из ключевых процессов, обеспечивающих увеличение выхода светлых нефтепродуктов (особенно бензина), самое главное действие катализатора — расщепление больших углеводородных молекул на более мелкие с высоким октановым числом.
Гидрокрекинг в свою очередь — процесс получения высококачественных керосиновых и дизельных дистиллятов из тяжелого газойля вакуумной перегонки и вторичных процессов.
Он также позволяет получить высококачественную основу базовых масел, близкую по эксплуатационным характеристикам к синтетическим.
Иначе говоря, это каталитический крекинг в присутствии водорода — где сочетание водорода, катализатора и соответствующего режима процесса позволяют провести крекинг низкокачественного легкого газойля и добиться получения высококачественных основ для широкого ассортимента товарных смазочных масел.
 Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке. В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
- постоянная высокая каталитическая активность,
- селективность,
- механическая прочность,
- термостойкость,
- устойчивостью к действию каталитических ядов,
- большая длительность работы,
- легкая регенерируемость,
- необходимые гидродинамические характеристики,
- невысокая стоимость.
Формирование свойств катализатора происходит во время его приготовления и во время эксплуатации, поэтому метод приготовления катализатора должен учитывать возможность образования активных центров в условиях катализа.
 Во многих случаях активность промышленных катализаторов увеличивают добавлением промоторов (сокатализаторов).
Во многих случаях активность промышленных катализаторов увеличивают добавлением промоторов (сокатализаторов).Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Катализатор — все статьи и новости
Катализатор — вещество, которое способствует ускорению химической реакции, однако не входит в состав продуктов этих реакций. С помощью катализатора можно осуществлять быстрые реакции при небольших температурах. Процесс, при котором осуществляется ускорение химических реакций благодаря катализаторам, называется катализ. Этот термин ввел шведский химик Йёнс Якоб Берцелиус в 1835 году. Процесс, при котором катализатором выступает один из продуктов реакции или ее исходных веществ, называют автокатализом.
Процесс, при котором осуществляется ускорение химических реакций благодаря катализаторам, называется катализ. Этот термин ввел шведский химик Йёнс Якоб Берцелиус в 1835 году. Процесс, при котором катализатором выступает один из продуктов реакции или ее исходных веществ, называют автокатализом.
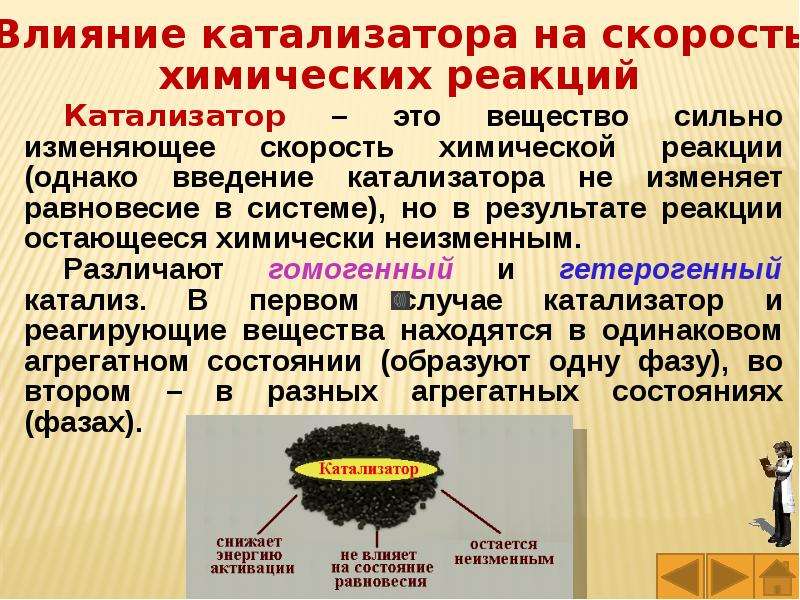
Катализаторы можно разделить на два типа: гетерогенные и гомогенные. Гомогенные катализаторы находятся в одной фазе с реагирующими веществами. В качестве гомогенных катализаторов используют кислоты и основания. Гетерогенные катализаторы образуют самостоятельную фазу, которая отделена границей раздела от фазы, в которой находятся реагирующие вещества. К гетерогенным катализаторам можно отнести металлы, а также их оксиды и сульфиды.
У всех живых существ метаболизм зависит от биологических катализаторов, которые называются энзимами. Это молекулы РНК или белковые молекулы, а также их комплексы, которые ускоряют процесс обмена веществ, что является жизненно необходимым для живых организмов.
На действии катализаторов основываются и многие промышленные процессы. Так, при производстве аммиака в качестве катализатора выступает железо. Катализаторы также широко используются при переработке нефти и создании новых материалов, например пластмассы.
Также катализатором называют деталь выхлопной системы в автомобилях, которая снижает содержание вредных веществ в выхлопных газах. Благодаря такому катализатору происходит химическая реакция, в которой участвуют такие вредные вещества, как окись углерода (CO), углеводород и оксиды азота. В результате реакции образуются оксид углерода (CO₂) и азот (N₂), которые являются менее вредными.
Вещество, которое, наоборот, замедляет реакцию, называют ингибитором.
Фото: Bdyczewski/Pixabay
Типы катализаторов Гомогенный катализ Гомогенный катализ в газовой фазе.
Катализаторы можно подразделить на три типа: гомогенные, гетерогенные и биологические (биокатализаторы, или ферменты). Все эти катализаторы в целом могут рассматриваться как положительные катализаторы, поскольку они увеличивают скорость реакций. Однако существуют и такие вещества, которые уменьшают скорость химических реакций; они называются ингибиторами. Ингибиторы иногда рассматривают как отрицательные катализаторы. Механизм их действия вовсе не противоположен механизму действия катализаторов, так как они не повышают энергию активации. Ингибиторы просто препятствуют обычному пути протекания химической реакции, вступая в реакцию с какими-либо промежуточными веществами и удаляя их из реакционной смеси, что затрудняет протекание всей последовательности стадий в многостадийной реакции. Примером ингибитора является глицерин (пропан-1,2,3-триол), который замедляет разложение пероксида водорода. Эта реакция ингибируется также разбавленными кислотами.
Все эти катализаторы в целом могут рассматриваться как положительные катализаторы, поскольку они увеличивают скорость реакций. Однако существуют и такие вещества, которые уменьшают скорость химических реакций; они называются ингибиторами. Ингибиторы иногда рассматривают как отрицательные катализаторы. Механизм их действия вовсе не противоположен механизму действия катализаторов, так как они не повышают энергию активации. Ингибиторы просто препятствуют обычному пути протекания химической реакции, вступая в реакцию с какими-либо промежуточными веществами и удаляя их из реакционной смеси, что затрудняет протекание всей последовательности стадий в многостадийной реакции. Примером ингибитора является глицерин (пропан-1,2,3-триол), который замедляет разложение пероксида водорода. Эта реакция ингибируется также разбавленными кислотами.
гомогенный катализ
Гомогенный катализ осуществляется, когда катализатор и реагирующая система находятся в одинаковом фазовом состоянии.
Гомогенный катализ в газовой фазе
Примером катализа этого типа может служить каталитическое разложение оксида диазота N2O в газовой фазе. Оксид диазота-распространенное анестезирующее средство, известное под названием «веселящий газ». При комнатной температуре он сравнительно инертен, разлагается только при температурах выше 1000 К:
Однако его разложение катализируется следами газообразного хлора, особенно в присутствии света. По-видимому, роль катализатора выполняют радикалы хлора, которые образуются в результате фотолиза газообразного хлора (см. выше). Предположительно, радикал хлора реагирует с N2O, образуя промежуточный радикал QO»:
Оглавление:
Создан новый тип катализаторов для управления продуктами химических реакций

«Конкретно исследование последнего катализатора заняло чуть больше года. Это была долгая непрерывная работа. Палладий – это хорошо известный катализатор. В различных формах он используется во многих реакциях, в промышленном масштабе – в нефтихимии, фармацевтической промышленности. В целом катализаторы различаются на два типа: гомогенные и гетерогенные. В случае гомогенных катализаторы-продукты находятся в одной фазе, например, жидкие продукты и катализатор тоже жидкий. Недостатком тут является то, что сложно отделить потом катализатор, который можно дальше использовать, от продуктов. Особенно важно это для фармацевтической промышленности, когда заявлены высокие требования к чистоте продукта. А гетерогенный катализатор – чаще всего это твердое вещество (порошок или таблетка), а продукты – газообразные или жидкие. Соответственно их легко отделить и катализатор можно использовать несколько раз», – говорит Арам Бугаев.
Заведующий Международной лабораторией нанодиагностики ЮФУ добавил, что новый материал по-настоящему уникальный, ведь он может трансформироваться под любые химические реакции.
«Первое преимущество, которым обладает новый материал, что по своим свойствам и эффективности он напоминает гомогенный катализатор, но при этом в плане практического применения обладает всеми преимуществами гетерогенного катализатора. Это порошок, который можно использовать много раз. Чем он похож на гомогенный? Тем, что все атомы палладия находятся абсолютно в одинаковом состоянии, т.е. какой бы мы не взяли атом палладия, он имеет вокруг себя абсолютно одинаковую атомную структуру», – утверждает Арам Бугаев.
Говоря о преимуществах нового материала, учёный рассказал и о тонкостях всего исследования. Он пояснил, как можно использовать различные продукты для получения интересных экспериментов, и что это главная находка для всех учёных-химиков.
«Новизна этого исследования в том, что в любой реакции мы можем иметь какой-то набор продуктов, он не всегда бывает один.
В том классе реакций, что мы исследуем, обычно все продукты образуются с равной долей вероятности, что не совсем хорошо для практического применения, когда нужно получить только один из них. В этом материале атомы палладия, которые и производят продукты, заключены внутри наноразмерных пор, и получается так, что каким-то продуктам легко образовываться внутри этой поры, а каким-то сложно. Т.е. подавляющее большинство продуктов те, молекулы которых подходят по форме пор. Это первый пример в данной области, когда удалось совместить и каталитическую активность палладия, и механические ограничения подложки, где форма пор определяет продукты реакции. Уверен, что в дальнейшем есть большие возможности по поиску более сложных каталитических реакций, где будет большой экономический выигрыш от того, что мы отсекаем все неподходящие по форме продукты. Форму пор также можно варьировать, «играться» с материалами: для экспериментальной работы тут открываются большие перспективы», – добавил Арам Бугаев.

Отметим, что исследование проходило в составе Международной группы учёных из Южного федерального университета и Католического университета Левена (Бельгия) совместно с коллегами из Гентского университета (Бельгия) и Национального института химии Словении. Исследование выполнено в рамках совместного Российско-бельгийского проекта и было опубликовано в журнале Nature Catalysis.
Катализаторы, ингибиторы, катализ
При попытке поджечь сахар он будет плавиться и обугливатьсяПоложите на сахар горку пепла, который будет служить катализаторомС пеплом сахар загорится! Сахар горит, если на него посыпать пеплом! При отсутствии пепла (катализатора) — сахар только обугливаетсяОкисление спирта в присутствии медного катализатора
Вы когда-нибудь пробовали поджечь сахар? Казалось бы, сильно экзотермическая реакция С12Н22О11+12О2 →12СО2+11Н2О должна идти легко. Не тут-то было — при сильном нагреве сахар плавится, приобретает коричневую окраску и запах карамели, но не загорается. И всё же сжечь сахар можно. Для этого надо посыпать его табачным пеплом и внести в пламя — тогда сахар загорится. Такое же воздействие на эту реакцию оказывают и некоторые другие вещества, например соли лития или оксид хрома (III).
Не тут-то было — при сильном нагреве сахар плавится, приобретает коричневую окраску и запах карамели, но не загорается. И всё же сжечь сахар можно. Для этого надо посыпать его табачным пеплом и внести в пламя — тогда сахар загорится. Такое же воздействие на эту реакцию оказывают и некоторые другие вещества, например соли лития или оксид хрома (III).
Химические реакции, которые «не желают» протекать сами по себе или идут с очень малой скоростью и требуют дополнительного «стимула» — присутствия веществ, которые в результате реакции остаются неизменными, — происходят повсеместно. Это, во-первых, абсолютно все химические процессы, лежащие в основе жизнедеятельности клеток. Они протекают только в присутствии ферментов, а отсутствие в организме хотя бы одного из них нарушает обмен веществ и чревато тяжёлой болезнью или же просто несовместимо с жизнью.
Кроме того, к таким реакциям относится большинство крупнотоннажных процессов, используемых в химической промышленности. Получение серной кислоты, переработка нефти, синтез аммиака немыслимы без участия «посторонних веществ», называемых катализаторами.
Как выглядел бы наш мир без катализаторов? Он был бы гораздо статичнее, ведь многие химические реакции просто не происходили бы. Впрочем, изучать химию всё равно было бы некому: жизнь в таком мире появиться не может.
Получение серной кислоты, переработка нефти, синтез аммиака немыслимы без участия «посторонних веществ», называемых катализаторами.
Как выглядел бы наш мир без катализаторов? Он был бы гораздо статичнее, ведь многие химические реакции просто не происходили бы. Впрочем, изучать химию всё равно было бы некому: жизнь в таком мире появиться не может.
Катализаторы позволяют проводить химические процессы при гораздо более мягких условиях. А кроме того, в присутствии катализаторов идут реакции, которые вообще невозможны без их участия ни в каких условиях.
При этом количество катализатора, необходимое для превращения огромной массы реагентов в продукты реакции, несоизмеримо мало. Одна молекула фермента катализирует разложение 5 млн. молекул сахара за 1 с!
Катализ и его секреты
Но в чём скрыта тайна веществ — катализаторов? Давайте разберёмся, почему сахар и другие органические вещества самопроизвольно не превращаются в углекислый газ и воду — гораздо более энергетически выгодные (говорят ещё «термодинамически устойчивые») соединения.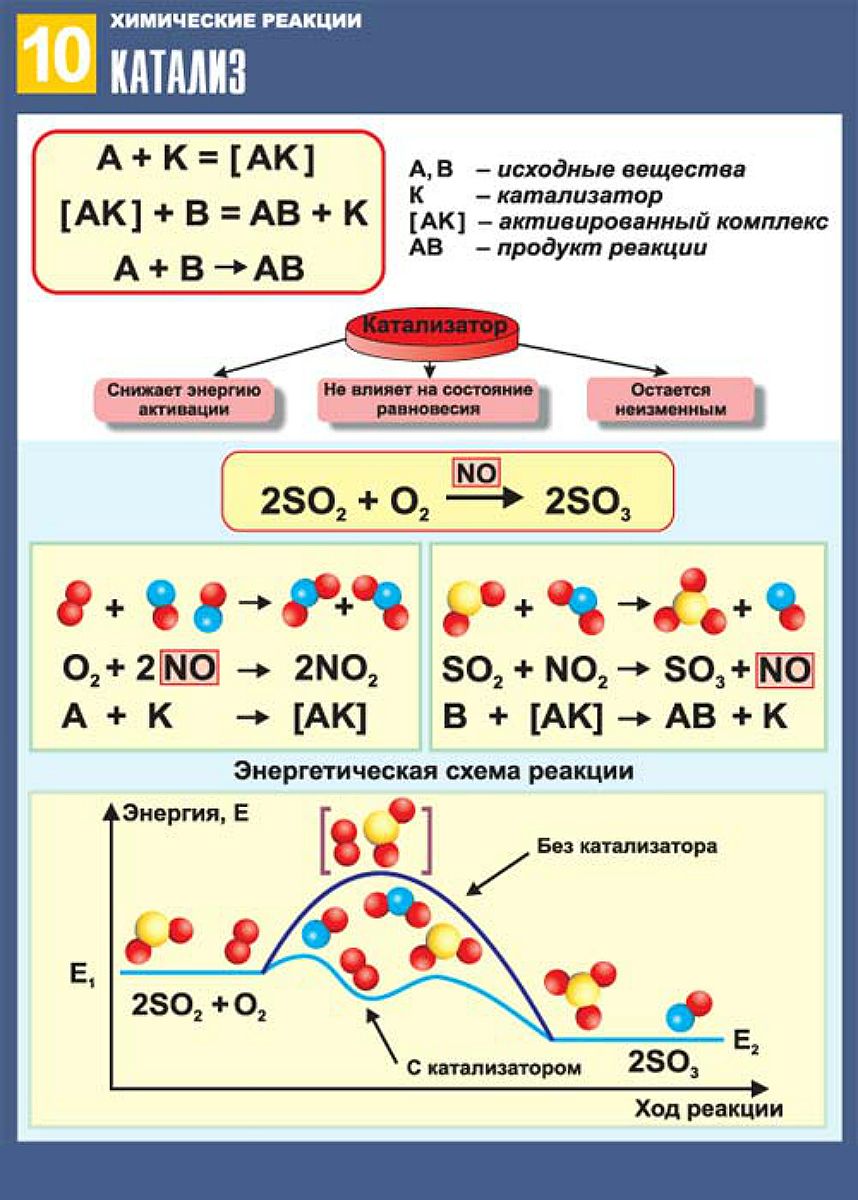 Разве это не удивительно? Ведь если положить, скажем, шарик на вершину горки, он тут же займёт более энергетически выгодное положение — скатится вниз. Если же его оградить барьером, он скатиться не сможет. Чтобы оказаться внизу и тем самым уменьшить свою потенциальную энергию, шарику нужно преодолеть барьер, а для этого ему нужно подвести дополнительную энергию.
Разве это не удивительно? Ведь если положить, скажем, шарик на вершину горки, он тут же займёт более энергетически выгодное положение — скатится вниз. Если же его оградить барьером, он скатиться не сможет. Чтобы оказаться внизу и тем самым уменьшить свою потенциальную энергию, шарику нужно преодолеть барьер, а для этого ему нужно подвести дополнительную энергию.
Все существующие химические вещества, даже весьма термодинамически неустойчивые, окружены на своих энергетических «вершинах» подобными барьерами. Порой энергия, необходимая для их преодоления, сравнима с кинетической энергией теплового движения молекул. Тогда достаточно простого смешения реагентов — и реакция происходит при комнатной температуре. Нагревая реакционную смесь, можно преодолеть барьер чуть повыше. Но иногда он слишком высок, и в этом случае придётся или искать способы доставки необходимой энергии молекулам реагентов, или попытаться обойти энергетический барьер.
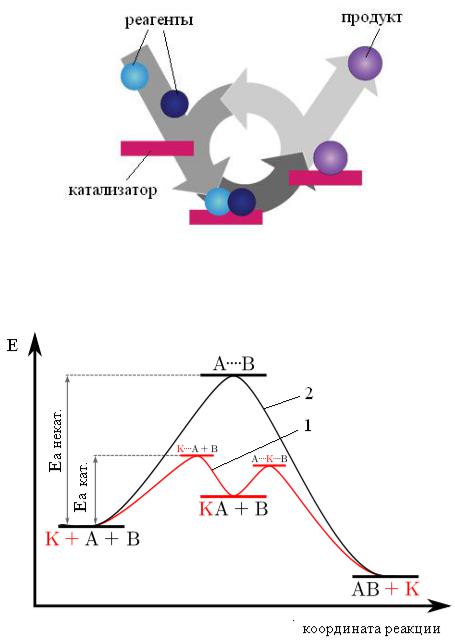
Как это сделать? Оказывается, катализатор может, подобно опытному проводнику, хорошо знающему местность, повести реакцию по совершенно иному пути. При этом её механизм претерпевает сильные изменения. Существует масса способов обойти энергетическую «гору». Каждый катализатор, работающий в конкретной реакции, выбирает для процесса свой путь. При этом новый маршрут может быть гораздо длиннее изначального: число промежуточных стадий и продуктов реакции иногда возрастает в несколько раз. Но зато количество энергии, требуемое на каждой стадии, оказывается существенно меньше, чем в отсутствие «проводника». В итоге, пройдя более длинный путь при помощи катализатора, реакция даёт желаемый результат значительно быстрее.
При этом её механизм претерпевает сильные изменения. Существует масса способов обойти энергетическую «гору». Каждый катализатор, работающий в конкретной реакции, выбирает для процесса свой путь. При этом новый маршрут может быть гораздо длиннее изначального: число промежуточных стадий и продуктов реакции иногда возрастает в несколько раз. Но зато количество энергии, требуемое на каждой стадии, оказывается существенно меньше, чем в отсутствие «проводника». В итоге, пройдя более длинный путь при помощи катализатора, реакция даёт желаемый результат значительно быстрее.
Однако «постороннее вещество» может воздействовать на ход реакции и противоположным образом: привести её к труднопреодолимому энергетическому барьеру. Тогда процесс замедляется. Такой «отрицательный» катализ называется ингибированием (от лат. inhibeo — «останавливаю», «сдерживаю»), а «катализаторы, действующие наоборот» — ингибиторами.
Зачем нужно замедлять скорость реакции? Существуют процессы, которые необходимы человеку, а также существуют такие процессы, проведение которых может пагубно сказаться как на человека, так и на предметах его обихода и окружающей среде. например появление ржавчины — коррозия металлов, гниение продуктов питания. Такими реакциями могут быть взрывы различных химических веществ, которые чувствительны к движению или сотрясению. Нужно учитывать, что химические реакции, в результате которых образуется лишь одно вещество — достаточно редкие. В основном при реакциях образуется более одного вещества. Особенно ярко такое явление наблюдается в органической химии.
например появление ржавчины — коррозия металлов, гниение продуктов питания. Такими реакциями могут быть взрывы различных химических веществ, которые чувствительны к движению или сотрясению. Нужно учитывать, что химические реакции, в результате которых образуется лишь одно вещество — достаточно редкие. В основном при реакциях образуется более одного вещества. Особенно ярко такое явление наблюдается в органической химии.
В организмах живых существ и множестве других процессах, протекающих в нашей среде обитания часто необходимо, чтобы в процессе реакции получалось только одно нужное нам вещество или продукт реакции. Именно в этом случае применяется катализ. Грамотный подбор катализатора позволяет проводить химические процессы только в нужном для нас направлении и с получением требуемого нам вещества, при этом исключая выход других побочных эффектов реакции.
В нашем организме имеются ферменты — катализаторы, которые работают точно таким же образом. Именно по аналогии с ферментами наука приобрела возможность получения каталитических реакции.
Именно по аналогии с ферментами наука приобрела возможность получения каталитических реакции.
Несмотря на аналогию и полученные знания, тайны катализа остаются полностью не раскрытыми.
Виды катализаторов
Что использовать в качестве катализатора!?
Какие виды катализаторов бывают?! В их качестве могут выступать самые разнообразные вещества: газы, ионы и различные комплексы; металлы и оксиды; простые органические соединения и сложнейшие природные и синтетические полимеры; даже… обычные вода, песок, глина!
Но самым важным фактором является агрегатное состояние катализатора и вступающих во взаимодействие веществ.
Когда катализатор, реагенты и продукты реакции находятся в одной фазе (например, жидкость, газ), где нет границ раздела, реагентам гораздо проще вступить в контакт с катализатором. При этом катализатор находится в виде молекул или ионов.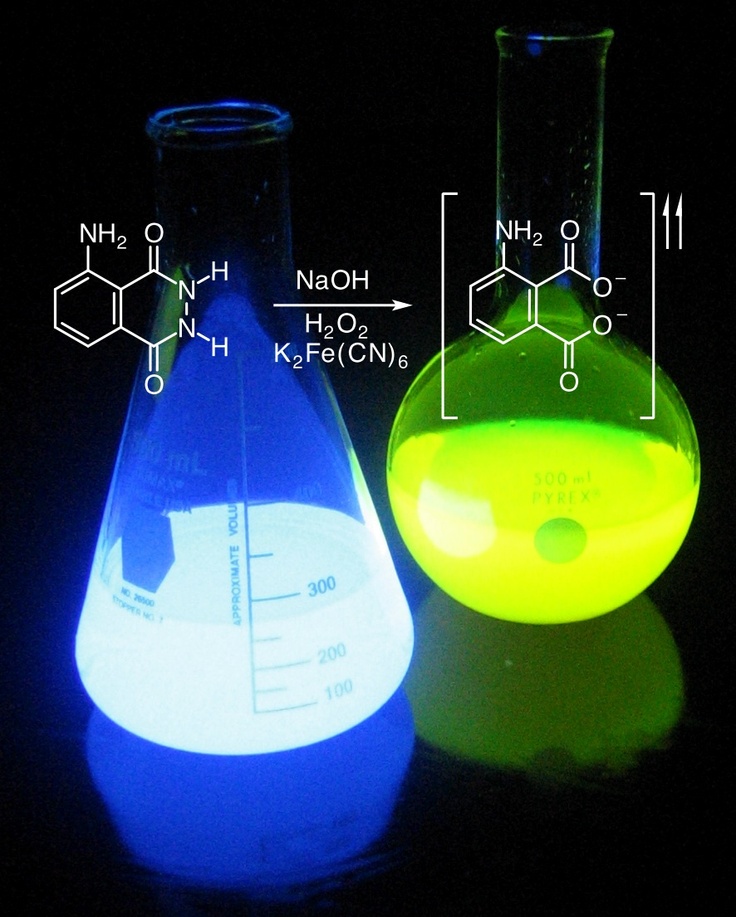 Такой катализ называют гомогенным (от греч. «гомогенес» — «однородный»). В случае гетерогенного катализа (от греч. «гетерогенес» — «разнородный»), особенно если катализатор — твёрдое тело, на ход реакции воздействует не отдельная его молекула, а целый участок поверхности и подповерхностных слоёв. Это взаимодействие реагентов сразу со многими атомами или молекулами катализатора, к тому же выстроенными определённым образом, усиливает каталитическое влияние. Реакции между твёрдыми веществами всегда гетерогенны.
Такой катализ называют гомогенным (от греч. «гомогенес» — «однородный»). В случае гетерогенного катализа (от греч. «гетерогенес» — «разнородный»), особенно если катализатор — твёрдое тело, на ход реакции воздействует не отдельная его молекула, а целый участок поверхности и подповерхностных слоёв. Это взаимодействие реагентов сразу со многими атомами или молекулами катализатора, к тому же выстроенными определённым образом, усиливает каталитическое влияние. Реакции между твёрдыми веществами всегда гетерогенны.
Гомогенный катализ и гетерогенный катализ существенно различаются по своему механизму. Вероятно, с этим связана тенденция теорий катализа к «однобокости» — преимущественному объяснению либо гомогенного, либо гетерогенного катализа.
С помощью катализаторов в мире ежегодно производятся миллиарды тонн химической продукции. Около 90 % промышленных химических процессов — каталитические процессы.
Раньше всего, в начале XIX в. , обнаружили каталитические свойства благородных металлов: платины, палладия и др. До сих пор эти металлы применяются, например, в катализаторах дожигания выхлопных газов автомобилей (они переводят ядовитый угарный газ СO, образующийся при неполном окислении топлива, в углекислый газ СО2.,), при окислении аммиака NH3, в других процессах. Конечно, учёные работают над заменой дорогих металлов более дешёвыми.
, обнаружили каталитические свойства благородных металлов: платины, палладия и др. До сих пор эти металлы применяются, например, в катализаторах дожигания выхлопных газов автомобилей (они переводят ядовитый угарный газ СO, образующийся при неполном окислении топлива, в углекислый газ СО2.,), при окислении аммиака NH3, в других процессах. Конечно, учёные работают над заменой дорогих металлов более дешёвыми.
Из гомогенных каталитических реакций наиболее известны катализ кислотами и основаниями, а также солями и комплексами металлов. Самый простой кислотный катализатор — ион водорода. Он одновременно и самый маленький. В числе первых изученных каталитических реакций был гидролиз крахмала («разваливание» его на молекулы сахаров) в кислой среде. Сейчас кислотный катализ очень распространён в органической химии: ионы водорода хорошо ускоряют различные реакции спиртов, альдегидов, жирных кислот и других веществ.
Однако технологи на химических производствах больше любят гетерогенный катализ. Скажем, реакция идёт в газовой фазе, а катализатор твёрдый (пористое железо в синтезе аммиака). Так как катализатор находится в другой фазе, продукты реакции легко от него отделить. Примечательно, что тот же кислотно-основной катализ можно сделать гетерогенным: различные алюмосиликаты и оксиды металлов в зависимости от вида их обработки и состава проявляют свойства кислоты или основания
Скажем, реакция идёт в газовой фазе, а катализатор твёрдый (пористое железо в синтезе аммиака). Так как катализатор находится в другой фазе, продукты реакции легко от него отделить. Примечательно, что тот же кислотно-основной катализ можно сделать гетерогенным: различные алюмосиликаты и оксиды металлов в зависимости от вида их обработки и состава проявляют свойства кислоты или основания
катализатор | Примеры, определение и факты
Катализатор , в химии , любое вещество, которое увеличивает скорость реакции, но само не потребляется. Ферменты — это природные катализаторы, ответственные за многие важные биохимические реакции.
Полимеризация этилена по Циглеру-НаттаПолимеризация этилена по Циглеру-Натта Газообразный этилен перекачивается под давлением в реакционный сосуд, где он полимеризуется под действием катализатора Циглера-Натта в присутствии растворителя. Суспензия полиэтилена, непрореагировавшего мономера этилена, катализатора и растворителя выходит из реактора. Непрореагировавший этилен отделяют и возвращают в реактор, а катализатор нейтрализуют промывкой спиртом и отфильтровывают. Избыток растворителя извлекается из бани с горячей водой и рециркулируется, а сушилка обезвоживает влажный полиэтилен до конечной порошкообразной формы.
Непрореагировавший этилен отделяют и возвращают в реактор, а катализатор нейтрализуют промывкой спиртом и отфильтровывают. Избыток растворителя извлекается из бани с горячей водой и рециркулируется, а сушилка обезвоживает влажный полиэтилен до конечной порошкообразной формы.
Британская викторина
Типы химических реакций
Можете ли вы определить, какой тип химической реакции показан? Проверьте свои знания с помощью этой викторины!
Большинство твердых катализаторов представляют собой металлы или оксиды, сульфиды и галогениды металлических элементов и полуметаллических элементов — бора , алюминия и кремния . Газообразные и жидкие катализаторы обычно используются в чистом виде или в сочетании с подходящими носителями или растворителями; твердые катализаторы обычно диспергированы в других веществах, известных как носители катализаторов .
В общем, каталитическое действие — это химическая реакция между катализатором и реагентом, с образованием химических промежуточных продуктов, которые могут более легко реагировать друг с другом или с другим реагентом с образованием желаемого конечного продукта. Во время реакции между химическими промежуточными продуктами и реагентами катализатор регенерируется. Способы реакций между катализаторами и реагентами широко варьируются, и в твердых катализаторах часто бывают сложными. Типичными из этих реакций являются кислотно-основные реакции, реакции окисления-восстановления, образование координационных комплексов и образование свободных радикалов . С твердыми катализаторами механизм реакциисильно зависит от свойств поверхности и электронных или кристаллических структур. Некоторые твердые катализаторы, называемые полифункциональными катализаторами, способны взаимодействовать с реагентами более чем в одном режиме; бифункциональные катализаторы широко используются для реакций риформинга в нефтяной промышленности.
Катализированные реакции составляют основу многих промышленных химических процессов. Производство катализаторов само по себе является быстро развивающимся промышленным процессом.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас| процесс | катализатор |
|---|---|
| синтез аммиака | утюг |
| производство серной кислоты | оксид азота (II), платина |
| крекинг нефти | цеолиты |
| гидрирование непредельных углеводородов | никель, платина или палладий |
| окисление углеводородов в автомобильных выхлопах | оксид меди (II), оксид ванадия (V), платина, палладий |
| изомеризация н-бутана в изобутан | хлорид алюминия, хлористый водород |
Химические реакции, катализаторы — Справочник химика 21
Получение стирола дегидратацией метилфенилкарбинола. Дегидратация спиртов относится к числу наиболее хорошо изученных химических реакций, катализаторами которой являются протонные или апротонные кислоты. Дегидратацию спиртов осуществляют как в жидкой, так и в паровой фазах. [c.228]
Дегидратация спиртов относится к числу наиболее хорошо изученных химических реакций, катализаторами которой являются протонные или апротонные кислоты. Дегидратацию спиртов осуществляют как в жидкой, так и в паровой фазах. [c.228]Поясним это примером [31]. Пусть нужно разработать некий технологический процесс. Для этого необходимо выбрать химическую реакцию, катализатор, газ-носитель, условия проведения процесса (давление, температуру), а также решить задачи разделения продуктов реакции и очистки полезного продукта после разделения. Таким образом, исследование включает в себя шесть стадий. Если на каждой из них имеется всего три варианта, то существует 729 возможностей решения, которые необходимо опробовать. Естественно, что без отсеивающих испытаний и статистического планирования эксперимента квалифицированно провести такое, в общем не слишком сложное исследование невозможно. [c.36]
В связи с вопросом об ускорении химических реакций катализаторами логически возник вопрос, может ли катализатор инициировать такие реакции, которые вообще не способны протекать.
 [c.37]
[c.37]Катализатор — вещество, которое вызывает или ускоряет протекание данной химической реакции. Катализатор не расходуется в самой реакции, которую ои катализирует, но может расходоваться или терять свою активность в результате побочных процессов. [c.9]
Влияние катализаторов на скорость химических реакций. При добавлении к реагирующей смеси катализаторов происходит резкое изменение скорости химической реакции. Катализаторы могут быть неорганической и органической природы, в том числе биологические катализаторы — ферменты, синтезирующиеся в живых организмах. [c.87]
IV. Катализатор. Катализ представляет собой распространенное явление, которое состоит в том, что введение в систему малых количеств посторонних веществ, получивших название катализаторы, существенным образом изменяет скорость химической реакции. Катализаторами называют вещества, которые изменяют скорость химической реакции, но не входят в стехиометрическое уравнение реакции.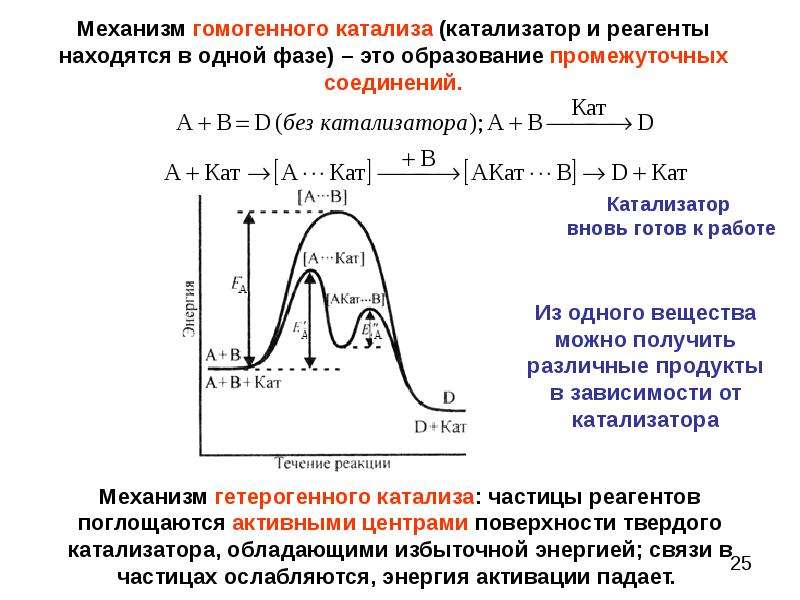 [c.43]
[c.43]
В настоящее время имеется уже достаточно большое число экспериментальных данных, доказывающих ошибочность представлений о неизменности катализатора в условиях химической реакции катализаторы часто оказываются весьма мобильными. В системе, состоящей из катализатора и реагирующих веществ, изменению подвергаются не только реагирующие вещества под действием катализатора, но и сам катализатор. [c.115]
Экспериментальное и теоретическое исследование катализа привело к важному результату, что действие катализатора состоит в его эффективном участии в химической реакции. Катализатор отличается от обычного реагента лишь тем, что он непрерывно регенерируется в процессе реакции. Пе существует никаких указаний, что ферменты ведут себя в этом отношении иначе, чем простые катализаторы. На основании того, что специфичность ферментов является общим явлением, казалось бы следует, что участие фермента в ферментативной реакции состоит в образовании молекулярного продукта присоединения между ферментом и субстратом. [c.797]
[c.797]
Однако развитие химической промышленности во многих случаях невозможно без применения ускорителей химических реакций — катализаторов. В химических производствах, основанных на каталитических процессах, дешевое и доступное сырье — природные газы и воздух, нефть и уголь — перерабатывается в синтетический каучук, пластмассы, аммиак, азотную и серную кислоты, бензин, органические растворители и т. д. [c.179]
Прежде всего, катализатор, изменяющий скорость различных процессов, является не пассивным, а активным участником химической реакции. Катализатор участвует в промежуточных стадиях, благодаря которым реакция протекает как бы ио более легкому пути и в конечном итоге с гораздо большей скоростью, чем без участия катализатора. По окончании реакции катализатор полностью регенерируется, т. е. выходит из реакции таким же, каким он вступил в нее. Он вновь и вновь возрождается из тех сложных химических превращений, которые он претерпел.
 Так, платиновая чернь, ускоряющая реакцию окисления водорода, сохраняет после реакции все свойства платины и, кроме того, не изменяется в весе. Она может снова использоваться для ускорения той же реакции. Таким образом, в идеальном случае катализатор сохраняет свои свойства очень долгое время. [c.183]
Так, платиновая чернь, ускоряющая реакцию окисления водорода, сохраняет после реакции все свойства платины и, кроме того, не изменяется в весе. Она может снова использоваться для ускорения той же реакции. Таким образом, в идеальном случае катализатор сохраняет свои свойства очень долгое время. [c.183]Запарка автоклав и его работа, химическая реакция, катализатор и его концентрация, транспортировка готового продукта на склад. [c.241]
Существенной особенностью, учитываемой моделью (7.41), является то, что деятельность хищников на данной территории формально аналогична поведению ферментов или катализаторов в химических реакциях катализаторы постоянно преобразовывают реагенты в химической реакции, однако сами не исчезают в ней. Питаясь жертвами, постоянная популяция хищников производит аналогичный эффект. Этой аналогии можно придать количественный характер, если предположить, что взаимодействие между хищниками и жертвами описывается системой уравнений, подобных уравнениям химической кинетики [c. 239]
239]
Для реакции СОз+С, которая в ряде технологических процессов протекает при недостаточно высоких температурах в условиях кинетической или промежуточных областей, где скорость суммарного процесса зависит от кинетических характеристик химических реакций, катализаторы оказывают ускоряющ,ее воздействие на скорость ее течения. [c.158]
Вы говорили, что после химической реакции катализатор остается в том же количестве, как в начале реакции, и не изменяет свой состав. Выходит, что он влияет на реакцию, вызывает изменение ее скорости, не реагируя химически с веществами, участвующими в ней. Как же это возможно Что это за особая сила, которой обладает катализатор Выходит, что он вроде философского камня алхимиков. [c.273]
В некоторых химических реакциях катализаторами являются продукты реакции. Такие реакции называются автокаталитическими. Для обычного катализа выход продукта л возрастает с течением времени по кривой (рис. 58), выражаюш,ей закон действуюш,их масс, а для автокатализа вначале реакция протекает медленно, а затем ускоряется при накоплении продукта —катализатора и, наконец, снова замедляется при приближении к равновесию. К числу авто-каталитических процессов относятся реакции, притекающие по цепному механизму, где катализаторами служат свободные радикалы. Для возбуждения же цепных реакций в реакционную смесь вводят инициатор, который, взаимодействуя с исходными веществами, приводит к образованию первых свободных радикалов, т. е. к зарождению цепи. Инициатор ускоряет процесс за счет снижения энергии активации, как и катализатор, но в отличие от обычных катализаторов расходуется в процессе реакции. К числу автокаталитических относятся и некоторые реакции разложения взрывчатых веществ, горения и полимеризации. [c.135]
58), выражаюш,ей закон действуюш,их масс, а для автокатализа вначале реакция протекает медленно, а затем ускоряется при накоплении продукта —катализатора и, наконец, снова замедляется при приближении к равновесию. К числу авто-каталитических процессов относятся реакции, притекающие по цепному механизму, где катализаторами служат свободные радикалы. Для возбуждения же цепных реакций в реакционную смесь вводят инициатор, который, взаимодействуя с исходными веществами, приводит к образованию первых свободных радикалов, т. е. к зарождению цепи. Инициатор ускоряет процесс за счет снижения энергии активации, как и катализатор, но в отличие от обычных катализаторов расходуется в процессе реакции. К числу автокаталитических относятся и некоторые реакции разложения взрывчатых веществ, горения и полимеризации. [c.135]
Использование катализатора приводит к существенному понижению величины энергии активации и соответственно увеличению скорости химической реакции. Катализатор ие влияет на положение равновесия между исходными и конечными продуктами, т. е. на изменение свободной энергии процесса. Для реакций in vivo особенно важен ферментативный катализ, который осуществляется при помощи ферментов (энзимов) — высокоспецифичных биокатализаторов белковой природы. На рис. 4.1 приведены примеры энергетических диаграмм для каталитических и некаталитических процессов. [c.89]
е. на изменение свободной энергии процесса. Для реакций in vivo особенно важен ферментативный катализ, который осуществляется при помощи ферментов (энзимов) — высокоспецифичных биокатализаторов белковой природы. На рис. 4.1 приведены примеры энергетических диаграмм для каталитических и некаталитических процессов. [c.89]
Жизнедеятельность микроорганизмов поддерживается энергией различных химических реакций, катализаторами которых они тем самым и являются. Поэтому микроорганизмы ускоряют окислительно-восстановительные процессы, способствуя изменению валентного состояния многих элементов. Мобишизирующее действие микроорганизмов заключается в переводе твердых элементов в жидкую фазу и в выделении по ходу биохи- [c.230]
Такой способ есть—это применение в химических реакциях катализаторов. [c.14]
Катализ. Вещество, которое увеличивает скорость химической реакции, причем количество его в результате суммарной реакции не изменяется, носит название катализатора. Имеется много различных видов катализаторов и много различных способов, посредством которых катализаторы оказывают воздействие на химические реакции. Катализатор проходит через циклы, в которых он сначала связывается, затем регенерируется, снова связывается и так многократно. В гомогенном катализе катализатор представляет собой молекулу или ион, находящийся в гомогенном растворе. В гетерогенном катализе реакция протекает на поверхности. [c.359]
Имеется много различных видов катализаторов и много различных способов, посредством которых катализаторы оказывают воздействие на химические реакции. Катализатор проходит через циклы, в которых он сначала связывается, затем регенерируется, снова связывается и так многократно. В гомогенном катализе катализатор представляет собой молекулу или ион, находящийся в гомогенном растворе. В гетерогенном катализе реакция протекает на поверхности. [c.359]
Наиболее последовательной является, по-видимому, теория эволюционного катализа, разрабатываемая профессором Московского университета А. П. Руденко. В основе этой теории лежит предстасленне об изменяющемся в ходе химической реакции катализаторе. [c.15]
При введении в реакционнзпо систему вещества-катализатора, ускоряющего химический процесс, происходит так называемая каталитическая химическая реакция. Катализатор многократно вступает в промежуточные химические реакции и регенерируется к моменту образования конечных продуктов. Если катализатор образуется в процессе химической реакции, то такая реакция называется автокаталитической. [c.27]
Если катализатор образуется в процессе химической реакции, то такая реакция называется автокаталитической. [c.27]
Катализ является основным и наиболее эффективным методом, обеспечивающим ход промышленных химических процессов, Химические производства, основанные на использовании ускорителей химических реакций — катализаторов, перерабатывают самое дешевое и доступное сырье природные газы и воздух, нефть и угсль, преобразуя их в синтетический каучук, полимеры, высококачественные бензины, аммиак, азотную и серную кислоту, различные органические растворители, краски и многие другие ценные продукты, столь нужные химической прэмышленности и всему народному хозяйству. [c.45]
Очевидно, не каждый адсорбированный ион каталитически активен. Должна происходить еше химическая реакция. Катализатор цианамид кальцияЧ-Со++ (или Мп + + ) в этой связи нужно упомянуть не только потому, что он очень активен при разложении Н2О2, но и потому, что он пригоден для демонстрации во время лекции и в лаборатории многокомпонентных катализаторов и моделей ферментов. Ниже приводится. — ом-плексная структура этого радикального катализатора вместе с механизмом цепной реакции разложения Н2О2 [c.388]
Ниже приводится. — ом-плексная структура этого радикального катализатора вместе с механизмом цепной реакции разложения Н2О2 [c.388]
Начало XX в. характеризуется последующим усилением развития производства красителей, лекарственных и взрывчатых веществ. Интенсифицируется производство серной кислоты путем замены малопроизводительных камерных установок установками башенного типа. В целях удовлетворения запросов анилино-кра-сочной промын1ленности, взрывчатых веществ и других производств в концентрированной кислоте и олеуме разрабатывается и внедряется контактный способ ее производства. Дальнейшее развитие химической промышленности связано с усилением воздействия на ход химических реакций-катализаторов, электрического тока, с механизацией производственных процессов. [c.9]
Для второго этапа развития химической технологии и химической промышленности характерным является применение в промышленности новых, более активных методов воздействия на течение химических реакций катализаторов, электрического тока, механизация производства. Значительно расширяется ассортимент продуктов химической промышленности, особенно продуктов органического синтеза на основе ароматических углеводородов. Возникают мсщные комбинаты, в которых объединяется производство неорганических и органических продуктов. [c.14]
Значительно расширяется ассортимент продуктов химической промышленности, особенно продуктов органического синтеза на основе ароматических углеводородов. Возникают мсщные комбинаты, в которых объединяется производство неорганических и органических продуктов. [c.14]
тепло реакции | химия
теплота реакции , количество теплоты, которое необходимо добавить или отвести во время химической реакции, чтобы поддерживать все присутствующие вещества при одной и той же температуре. Если давление в сосуде, содержащем реагирующую систему, поддерживается на постоянном уровне, то измеренная теплота реакции также представляет собой изменение термодинамической величины, называемой энтальпией, или теплосодержанием, сопровождающее процесс — , т. е. разность между энтальпией веществ, присутствующих в конце реакции, и энтальпий веществ, присутствующих в начале реакции.Таким образом, теплота реакции, определенная при постоянном давлении, также обозначается как энтальпия реакции, обозначаемая символом Δ H . Если теплота реакции положительна, то говорят, что реакция эндотермическая; если отрицательный, экзотермический.
Если теплота реакции положительна, то говорят, что реакция эндотермическая; если отрицательный, экзотермический.
Прогнозирование и измерение тепловых эффектов, сопровождающих химические изменения, важны для понимания и использования химических реакций. Если сосуд, содержащий реагирующую систему, изолирован таким образом, что тепло не поступает в систему или не выходит из нее (адиабатические условия), тепловой эффект, сопровождающий превращение, может проявляться в повышении или понижении температуры, в зависимости от обстоятельств. присутствующих веществ.Точные значения теплот реакций необходимы для правильного проектирования оборудования, используемого в химических процессах.
Подробнее по этой теме
термодинамика: энтальпия и теплота реакции
Как обсуждалось выше, изменение свободной энергии Wmax = −ΔG соответствует максимально возможной полезной…
Поскольку измерение теплоты для каждой протекающей реакции нецелесообразно, а для некоторых реакций такое измерение может быть даже неосуществимым, принято оценивать теплоту реакции на основе подходящих комбинаций скомпилированных стандартных тепловых данных. Эти данные обычно принимают в виде стандартных теплот образования и теплот сгорания. Стандартная теплота образования определяется как количество тепла, поглощенного или выделенного при 25°C (77°F) и давлении в одну атмосферу, когда один моль соединения образуется из составляющих его элементов, причем каждое вещество находится в своем нормальном физическом состоянии. (газообразное, жидкое или твердое). Теплоте образования элемента произвольно присваивается нулевое значение. Стандартная теплота сгорания определяется аналогичным образом как количество теплоты, выделяющееся при 25°С и давлении в одну атмосферу, когда один моль вещества сгорает в избытке кислорода.Метод расчета теплот реакций по измеренным значениям теплот образования и сгорания основан на принципе, известном как закон суммирования теплот Гесса.
Эти данные обычно принимают в виде стандартных теплот образования и теплот сгорания. Стандартная теплота образования определяется как количество тепла, поглощенного или выделенного при 25°C (77°F) и давлении в одну атмосферу, когда один моль соединения образуется из составляющих его элементов, причем каждое вещество находится в своем нормальном физическом состоянии. (газообразное, жидкое или твердое). Теплоте образования элемента произвольно присваивается нулевое значение. Стандартная теплота сгорания определяется аналогичным образом как количество теплоты, выделяющееся при 25°С и давлении в одну атмосферу, когда один моль вещества сгорает в избытке кислорода.Метод расчета теплот реакций по измеренным значениям теплот образования и сгорания основан на принципе, известном как закон суммирования теплот Гесса.
Определение катализатора — Химический словарь
Что такое катализатор?
Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ходе реакции; следовательно, катализатор может быть восстановлен химически неизмененным в конце реакции, для ускорения которой он использовался, или катализирует .
Обсуждение
Чтобы химические вещества вступили в реакцию, их связи должны быть перестроены, потому что связи в продуктах отличаются от связей в реагентах. Самый медленный этап перестройки связи приводит к тому, что называется переходным состоянием. — химическое вещество, которое не является ни реагентом, ни продуктом, но является промежуточным звеном между ними.
Реагент ⇄ Переходное состояние ⇄ Продукт
Энергия необходима для формирования переходного состояния. Эта энергия называется энергией активации , или E a .Чтение приведенной ниже диаграммы слева направо показывает ход реакции, когда реагенты проходят через переходное состояние и становятся продуктами.
Преодоление барьера
Энергию активации можно рассматривать как барьер для химической реакции, барьер, который необходимо преодолеть.
Если барьер высокий, лишь немногие молекулы обладают достаточной кинетической энергией, чтобы столкнуться, сформировать переходное состояние и пересечь барьер.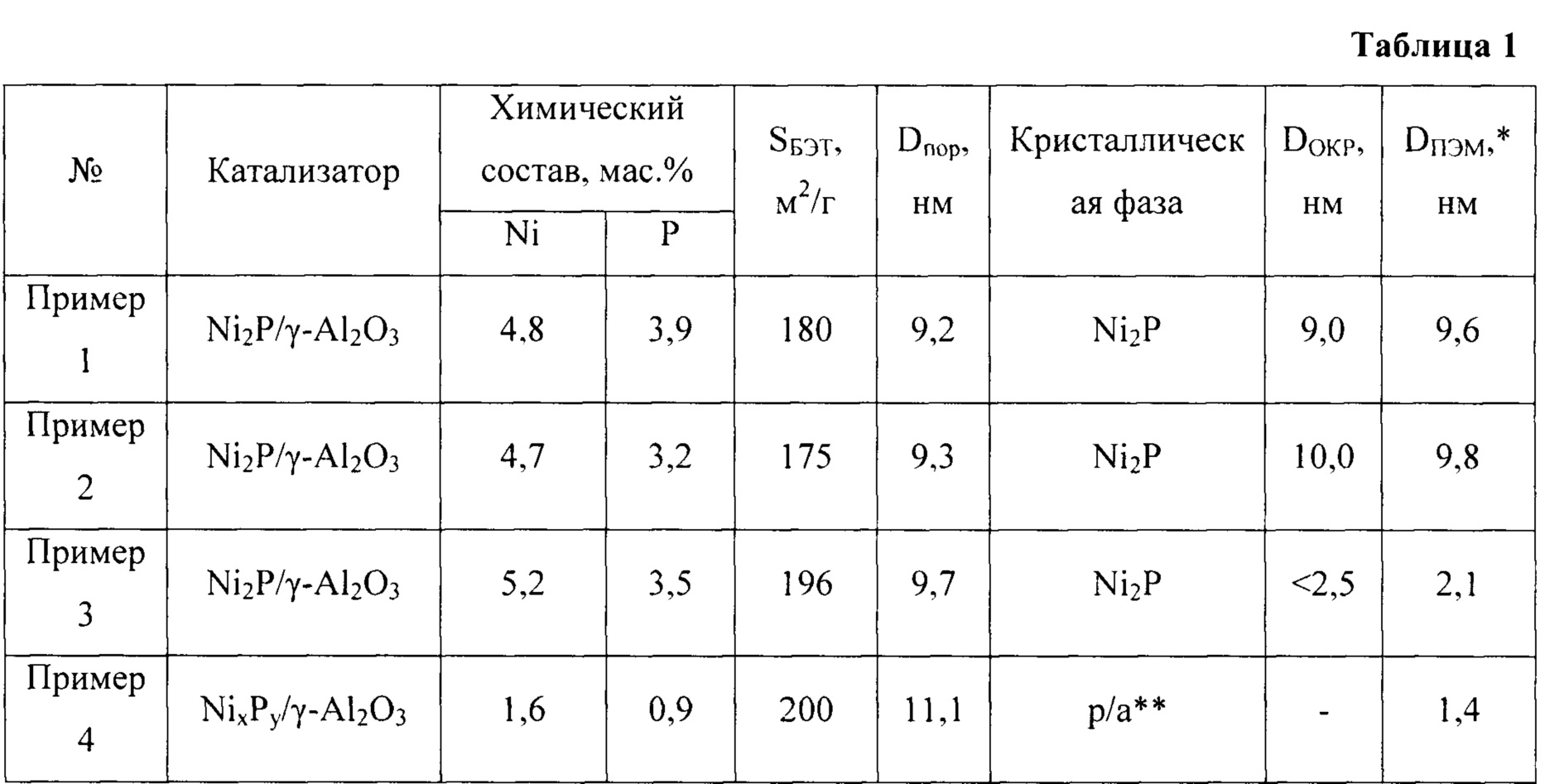 Реагенты с энергией ниже E a не могут пройти через переходное состояние, чтобы вступить в реакцию и стать продуктами.
Реагенты с энергией ниже E a не могут пройти через переходное состояние, чтобы вступить в реакцию и стать продуктами.
Катализатор работает, обеспечивая другой маршрут реакции с более низким E a . Катализаторы снижают энергетический барьер. Другой путь позволяет легче перегруппировывать связи, необходимые для превращения реагентов в продукты, с меньшими затратами энергии. В любой заданный интервал времени присутствие катализатора позволяет большей части реагентов набирать достаточную энергию, чтобы пройти через переходное состояние и стать продуктами.
Пример 1: процесс Габера
Процесс Габера, который используется для получения аммиака из водорода и азота, катализируется железом, которое обеспечивает атомные позиции, на которых реагентные связи могут легче перестраиваться для образования переходного состояния.
N 2 (газ) + 3H 2 (газ) ⇌ 2NH 3 (газ)
Пример 2: Ферменты
В нашем организме и других живых существах ферменты используются для ускорения биохимических реакций. Фермент — это тип катализатора.
Сложная жизнь была бы невозможна без ферментов, обеспечивающих протекание реакций с подходящей скоростью.
Формы ферментов вместе с местами на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя определенным молекулам собираться вместе, чтобы сформировать переходное состояние с уменьшенным энергетическим барьером активации.
Фермент — это тип катализатора.
Сложная жизнь была бы невозможна без ферментов, обеспечивающих протекание реакций с подходящей скоростью.
Формы ферментов вместе с местами на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя определенным молекулам собираться вместе, чтобы сформировать переходное состояние с уменьшенным энергетическим барьером активации.
На приведенной ниже схеме фермент с длинной цепью обеспечивает места для соединения молекул реагентов с образованием переходного состояния с низкой энергией активации.
Катализаторы не могут сдвинуть положение химического равновесия — и прямая, и обратная реакции ускоряются, так что константа равновесия K eq не меняется. Однако, удаляя продукты из реакционной смеси по мере их образования, на практике можно увеличить общую скорость образования продукта.
Химический катализатор — определение, реакция, типы и примеры
Катализатор химической реакции
Химический катализатор представляет собой постороннее вещество, которое увеличивает скорость реакции за счет снижения энергии активации без изменений в конце химического или биологического процесса. Катализатор в химии можно просто определить как вещество, которое увеличивает скорость самой химической реакции, оставаясь неизменной по массе, активности и химическому составу.Катализатор играет важную роль во многих химических и реальных биологических процессах и работает, чтобы найти альтернативный путь, при котором энергия активации уменьшается, но кинетическая скорость реакции увеличивается.
Катализатор в химии можно просто определить как вещество, которое увеличивает скорость самой химической реакции, оставаясь неизменной по массе, активности и химическому составу.Катализатор играет важную роль во многих химических и реальных биологических процессах и работает, чтобы найти альтернативный путь, при котором энергия активации уменьшается, но кинетическая скорость реакции увеличивается.
Что такое катализ?
Явление, при котором катализаторы проявляют свою активность, в химии называют реакцией катализа. В основном это два типа, такие как гомогенный или гетерогенный катализ. Например, ион водорода действует как положительный катализатор при гидролизе сложного эфира или сахара, не влияя на химическое равновесие.
Что такое отрицательный катализатор?
Иногда инородное вещество замедляет скорость процесса химического синтеза или даже останавливает реакцию, что называется отрицательным катализатором. Но такое общее определение не полностью удовлетворяет отрицательным катализаторам, потому что отрицательные катализаторы иногда навсегда изменяют химический процесс.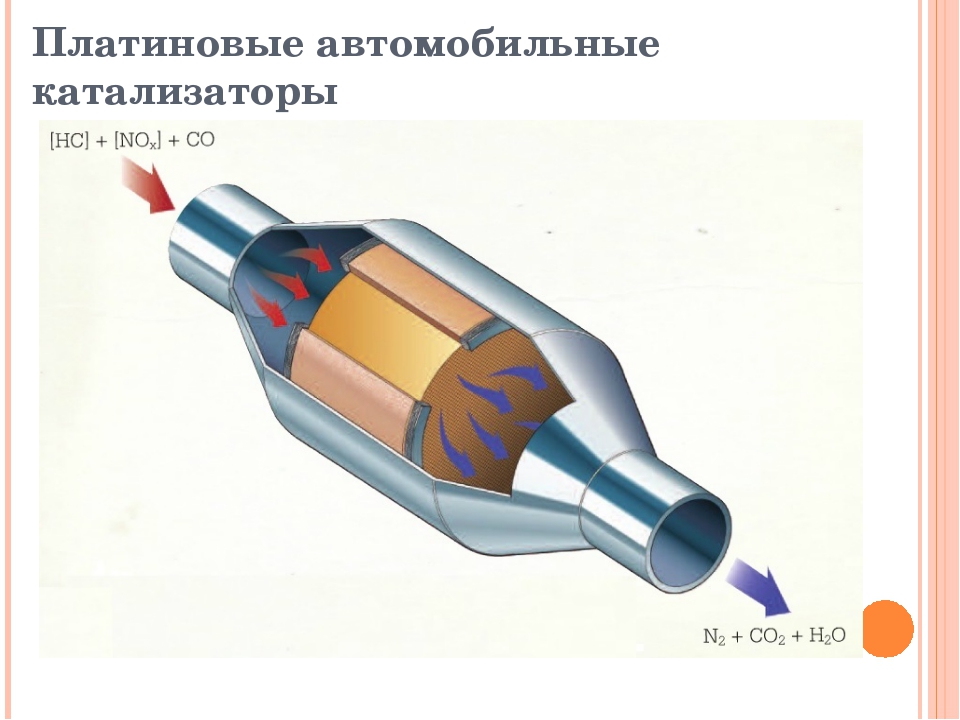 Поэтому такие вещества в химии правильно называют ингибитором. Например, серная кислота действует как ингибитор при разложении перекиси водорода.
Поэтому такие вещества в химии правильно называют ингибитором. Например, серная кислота действует как ингибитор при разложении перекиси водорода.
Характеристики катализатора
Катализатор, используемый в реакции катализа, имеет некоторые общие и определенные характеристики в химии или химической науке.
- Важнейшие характеристики катализатора остаются неизменными в виде молекулярной массы, плотности, концентрации и химической формулы составляющих элементов в конце реакции. Однако физическое состояние химических веществ, например размер частиц или цвет химического катализатора, может быть изменено. Например, диоксид марганца, используемый для разложения хлората калия, после завершения химической реакции превращается в мелкодисперсный порошок.
- Катализатор может увеличить скорость или скорость химических реакций.
- Не может запустить реакцию, а только увеличивает или уменьшает скорость реакции.
- Катализатор не влияет на конечное состояние химического равновесия.
 Это означает, что сам катализатор не расходуется во время химической реакции. Он регенерирует в конце реакции. Например, 1,7 г платины производят 1,8 см3 кислорода в минуту при разложении перекиси водорода. Но платина остается активной даже при образовании 10 л кислорода в реакции катализа.
Это означает, что сам катализатор не расходуется во время химической реакции. Он регенерирует в конце реакции. Например, 1,7 г платины производят 1,8 см3 кислорода в минуту при разложении перекиси водорода. Но платина остается активной даже при образовании 10 л кислорода в реакции катализа.
Как катализаторы влияют на равновесие?
Катализатор не влияет на конечное состояние равновесия, полученное из уравнения Вант-Гоффа, ΔG 0 = – RT lnk, где k = константа равновесия. Поскольку катализаторы не вносят никакой энергии в систему, они увеличивают свободную энергию, но увеличивают энтропию системы. Определение термодинамики или уравнение свободной энергии показывает тот факт, что катализатор не изменяет свободную энергию и константу равновесия химической реакции.
Константа равновесия (k) = k 1 /k 2 , где k 1 и k 2 = скорость прямой и обратной реакции. Следовательно, если катализатор увеличивает скорость прямого процесса или k 1 увеличивается, то при сохранении k постоянным k 2 также увеличивается в той же степени.
 Катализаторы, повышающие скорость обоих типов, таких как прямая и обратная реакции, способствуют более быстрому достижению равновесия, но не влияют на равновесие по принципу Ле Шателье.
Катализаторы, повышающие скорость обоих типов, таких как прямая и обратная реакции, способствуют более быстрому достижению равновесия, но не влияют на равновесие по принципу Ле Шателье. Каталитическое действие катализаторов
Исходя из определения и примера, катализаторы играют особую роль в конкретной каталитической реакции в науке. Поэтому мы не можем использовать один и тот же общий катализатор для каждого химического процесса. Например, диоксид марганца может катализировать разложение хлората калия, но не нитрата калия. Однако смена катализатора определяет характер химического продукта реакции в химии. Например, монооксид углерода и водород в присутствии никелевого катализатора образуют газообразный метан, а в присутствии оксида цинка — молекулу метилового спирта.
| Химические реакции | химический катализатор |
| CO + H 2 → CH 4 + H 2 O | наличие Ni |
| CO + H 2 → CH 3 OH | присутствие ZnO |
| HCOOH → H 2 + CO 2 | присутствие Cu или ZnO |
| HCOOH → H 2 O + CO | наличие Al 2 O 3 |
Оптимальная температура, при которой эффективность или роль природного катализатора, такого как фермент, наиболее заметна в химической науке и биологии.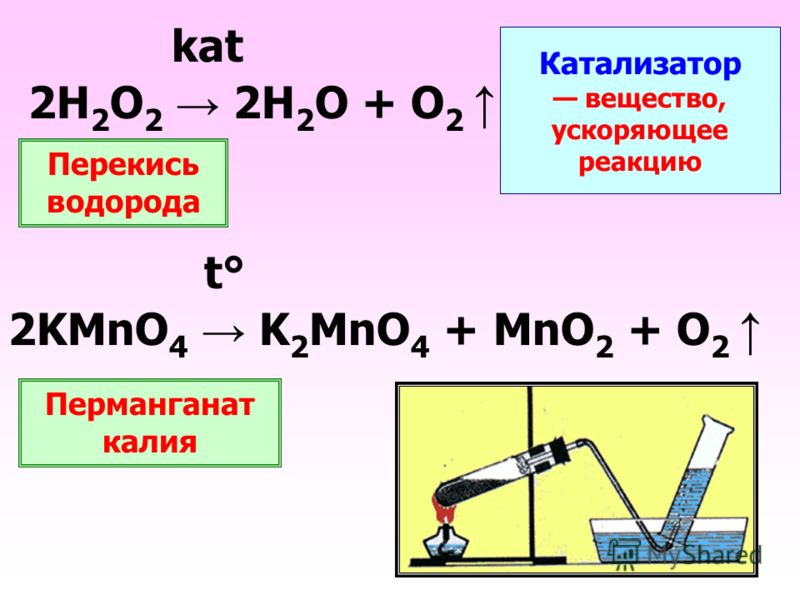 В реакции биологического катализа каталитическое действие фермента увеличивается с повышением удельной теплоемкости или температуры, но эффективность падает после определенной температуры из-за коагуляции фермента.
В реакции биологического катализа каталитическое действие фермента увеличивается с повышением удельной теплоемкости или температуры, но эффективность падает после определенной температуры из-за коагуляции фермента.
Типы катализаторов химической реакции
В реальной жизни наиболее распространенные химические катализаторы и катализируемые реакции подразделяются на два типа:
- гомогенный катализатор
- гетерогенный катализатор
Гомогенный катализатор
В реакциях гомогенного катализа катализатор образует одну фазу с реагентами.Многие гомогенные катализируемые реакции были изучены в газовой фазе и жидкой фазе.
Примеры гомогенного катализатора
Скорость реакции в реакции гомогенного катализа неизменно пропорциональна концентрации катализатора. Наиболее распространенными примерами таких катализирующих химических реакций в газовой фазе являются
- Окисление SO 2 в SO 3 , катализируемое NO 2 .
- Разложение закиси азота на азот и кислород, катализируемое NO 2 .
- Разложение эфиров или ацетальдегида с помощью йодного катализатора.
В гетерогенном катализе химический катализатор и реагенты образуют отдельные фазы, и часто поверхность или поверхность раздела отвечают за каталитические свойства.
Гетерогенный катализатор
Реакции гетерогенного катализа означают, что твердые вещества служат катализатором, а реагенты представляют собой газообразные или жидкие фазы. Один или несколько из этих реагентов абсорбируются на поверхности твердого тела. Следовательно, поверхность обеспечивает альтернативный путь для снижения энергии активации или увеличения скорости реакции.В большинстве реакций теплота адсорбции увеличивает энергию активации реагента, и равновесие достигается легко. Реакция твердого поверхностного катализатора, состоящая из четырех последовательных химических стадий,
- Диффузия газов на поверхность
- Адсорбция газов на поверхности
- Реакции на поверхности
- Десорбция или диффузия продуктов с поверхности в объем.
Процессы диффузии и десорбции очень быстрые и не играют существенной роли в реакциях гетерогенного катализа.
Пример гомогенного катализатора
Каталитическая функция на поверхности катализаторов специфична по своей природе, и разные каталитические элементы эффективны для разных типов каталитических реакций.
| Гомогенная реакция | Примеры катализаторов |
| гидрирование/дегидрирование | Ni, Cu, ZnO, Cr 2 O 3 |
| дегидратация/гидратация | Ал 2 О 3 |
| крекинг нефти | SiO 2 -Al 2 O 3 гель |
| синтез аммиака | железо |
| полимеризация | Al(Et) 3 , TiCl 4 |
Поверхности переходных металлов, таких как никель или медь, представляют собой очень хороший список гетерогенных поверхностей для гидрирования алкенов или олефинов. Глинозем является подходящим катализатором для синтеза углеводородов из вторичного спирта. Это связано с тем, что водород сильно поглощается поверхностью никелевого или медного катализатора, а молекулы воды сильно поглощаются поверхностью алюмооксидного катализатора.
Глинозем является подходящим катализатором для синтеза углеводородов из вторичного спирта. Это связано с тем, что водород сильно поглощается поверхностью никелевого или медного катализатора, а молекулы воды сильно поглощаются поверхностью алюмооксидного катализатора.
Катализ | Химический факультет
Разрабатывая и понимая новые каталитические процессы, мы производим общественно важные продукты, материалы и химические вещества более эффективно и с большей точностью.
Катализ — это ускорение химической реакции веществом, которое само не расходуется и имеет решающее значение для всех областей современной жизни. Подсчитано, что 85% всех производимых продуктов включают катализ где-то в своей производственной цепочке, и такие продукты оказывают значительное влияние на энергетику (нефтехимия), здравоохранение (фармацевтика), новые материалы (полимеры), транспорт (каталитические преобразователи) и окружающую среду.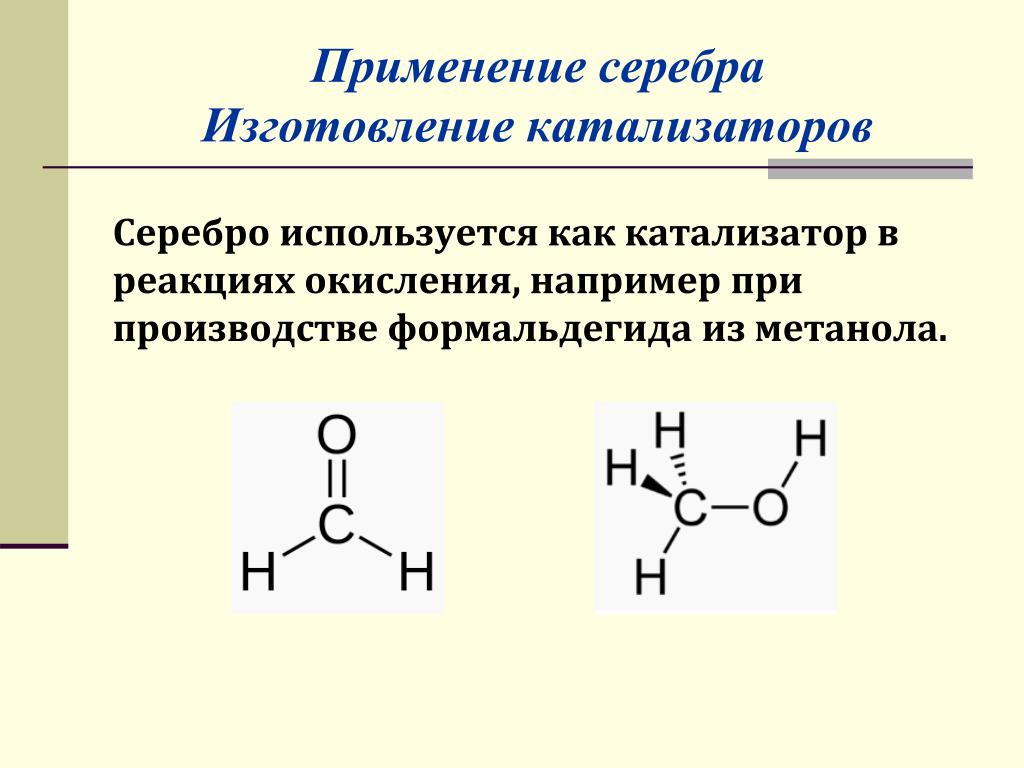 вода, качество воздуха, возобновляемые и биоматериалы).Подсчитано, что 90% всех химических процессов катализируются, и поэтому экономическое влияние катализа огромно, на его долю приходится 30–40% мирового ВВП. Представьте себе, например, мир без аммиака (удобрений), пластмасс, каталитических нейтрализаторов или возможности синтезировать химические вещества тонкой очистки для решений в области здравоохранения.
вода, качество воздуха, возобновляемые и биоматериалы).Подсчитано, что 90% всех химических процессов катализируются, и поэтому экономическое влияние катализа огромно, на его долю приходится 30–40% мирового ВВП. Представьте себе, например, мир без аммиака (удобрений), пластмасс, каталитических нейтрализаторов или возможности синтезировать химические вещества тонкой очистки для решений в области здравоохранения.
На химическом факультете Оксфордского университета имеется критическая масса исследователей мирового уровня, занимающихся катализом. Области их исследований разнообразны по тематике и охватывают: синтез малых молекул и новых материалов, разработку путей к новым фармацевтическим и терапевтическим средствам, новые векторы энергии, новые полимерные материалы, эффективное использование возобновляемых ресурсов, новые гетерогенные системы для химических веществ, необходимых для современное общество, электрокатализ, инновационные решения в области здравоохранения, химическая биология, теория и вычисления. Ключевым аспектом исследований в области катализа в Оксфорде является наше стремление к глубокому фундаментальному пониманию разрабатываемых и изучаемых каталитических процессов в сочетании с сильным стремлением предоставить практические и полезные решения, которые имеют положительное влияние на общество и промышленность.
Ключевым аспектом исследований в области катализа в Оксфорде является наше стремление к глубокому фундаментальному пониманию разрабатываемых и изучаемых каталитических процессов в сочетании с сильным стремлением предоставить практические и полезные решения, которые имеют положительное влияние на общество и промышленность.
Иллюстрация, показывающая многие области катализа, которыми занимается кафедра: металлорганический, органический, биоорганический, материальный и твердотельный.
Зоны катализа
Катализ для синтеза тонких химикатов
Катализ изучается для изучения фундаментальной реакционной способности молекул на основе углерода и открытия новых способов создания или разрыва связей.Большая часть нашей работы направлена на поиск неудовлетворенных потребностей в более широком сообществе и часто выполняется в сотрудничестве с ведущими химическими и фармацевтическими компаниями. Катализ не только обеспечивает более эффективные методы, но и открывает новые пути доступа к молекулам, которые иначе было бы нелегко получить. Департамент обладает огромным опытом в разработке катализа, опосредованного металлами, малыми молекулами и ферментами, в применении к целевому синтезу и определении механизмов реакции для облегчения разработки новых и дальнейшего улучшения процессов.
Департамент обладает огромным опытом в разработке катализа, опосредованного металлами, малыми молекулами и ферментами, в применении к целевому синтезу и определении механизмов реакции для облегчения разработки новых и дальнейшего улучшения процессов.
Катализ для химической биологии и бионеорганической химии
Катализ может позволить модифицировать химически сложные биологические маркеры, такие как углеводы, белки, нуклеотиды и вторичные метаболиты, чтобы понять или использовать биологическую функцию. Природный каталитический механизм также можно задействовать, иммобилизовать, модифицировать и использовать для создания биотехнологических решений для тонкого химического синтеза. Методы биологического происхождения также предоставляют возможности для изучения методов одиночных молекул, реакций в необычных средах, таких как пиколитры и иммобилизованные фазы, и позволяют механистическим исследованиям понять химию катализа, которая лежит в основе важных аспектов биологии.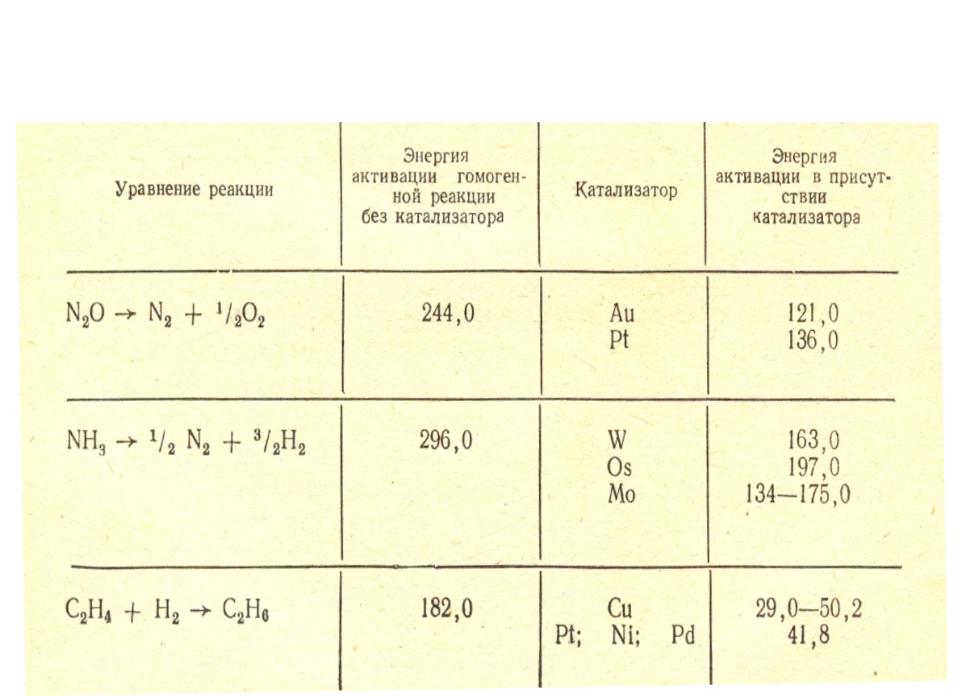
Катализ для энергетических применений
Исследования в этой подтеме сосредоточены на предоставлении решений для новых решений по хранению и производству энергии (например, катализ топливных элементов), а также на более чистой, эффективной и селективной переработке основных сыпучих химических веществ, используемых при транспортировке энергии. – например, нефтехимия.
Катализ для синтеза новых функциональных материалов и молекул
Катализ лежит в основе развития современной химии материалов, и ряд групп разрабатывает новые каталитические методологии для производства новых высокоэффективных полимеров и синтеза новых молекулярных материалов которые обладают специфическими и адаптированными электронными, структурными и функциональными свойствами.
Катализ с использованием возобновляемого и рециркулируемого сырья
Катализ занимает центральное место в эффективном использовании антропоморфно полученного CO2, и ряд групп активно изучает разработку инновационных катализаторов, использующих CO2 в качестве химического сырья для производства широкого спектра полезных химические вещества. Разработка катализаторов, обеспечивающих точный контроль над образованием полимеров из возобновляемого или перерабатываемого сырья биологического происхождения, которые находят применение в качестве биовозобновляемых полимеров, эластомеров, покрытий, матриц для тканевой инженерии или антимикробных поверхностей.
Разработка катализаторов, обеспечивающих точный контроль над образованием полимеров из возобновляемого или перерабатываемого сырья биологического происхождения, которые находят применение в качестве биовозобновляемых полимеров, эластомеров, покрытий, матриц для тканевой инженерии или антимикробных поверхностей.
Catalysis также охватывает многие темы в области химии, включая передовые функциональные материалы и интерфейсы, химию на стыке биологии и медицины, кинетику, динамику и механизм, энергетику и устойчивую химию, синтез и теорию и моделирование сложных систем.
Катализатор, управляющий химическими реакциями с помощью света
Схематическое изображение ламинирования плазмонных нанокристаллов. 1 кредит Компания POSTECH и группа исследователей разработали технологию, которая значительно улучшает характеристики плазмонных фотокатализаторов с использованием нанокристаллов типа «ядро@оболочка» с атомно-конформными металлическими слоями.
Нанокристаллы Core@shells, которые имеют структуру ядра, окруженного оболочкой, могут использовать межфазную синергию от аналогов ядра и оболочки, создавая приложения для катализа, электроники и дисплеев. В частности, поверхность плазмонных наночастиц ядра (золота) равномерно покрыта каталитически активными переходными металлами (платиной, палладием, рутением и родием) в структурах ядро@оболочка.Под воздействием света поверхность этого фотокаталитического гибрида может эффективно преобразовывать энергию света в химическую энергию.
Для создания эффективной плазмонно-каталитической гибридной системы решающее значение имеет метод нанесения очень тонкой металлической оболочки на плазмонное ядро. Однако традиционные стратегии, о которых сообщалось до сих пор, создают толстые оболочки, повреждая или деформируя материалы ядра, что значительно ухудшает их плазмонные характеристики.
Исследовательская группа под руководством профессора Ин Су Ли из химического факультета POSTECH изготовила систему удержания наноструктуры для устранения факторов, вызывающих рост толстой оболочки в обычных методах, и систему, в которой плазмонные наночастицы могут быть индивидуально разделены в растворе. Здесь, облучая источник света, исследователям удалось покрыть поверхность плазмонных нанокристаллов очень тонкими и однородными пластинами толщиной в атом. Это можно выразить аналогично покрытию тонкой пленкой поверхности таблетки в капсуле.
Здесь, облучая источник света, исследователям удалось покрыть поверхность плазмонных нанокристаллов очень тонкими и однородными пластинами толщиной в атом. Это можно выразить аналогично покрытию тонкой пленкой поверхности таблетки в капсуле.
Это ламинирование металла с тонким покрытием не повлияло на оптические свойства материала ядра, и эта стратегия обеспечивает платформу для синтеза гибридных фотокаталитических материалов, в которых эффективно сочетаются каталитические характеристики оболочки и плазмонные свойства материала ядра. .В частности, гибридные нанокристаллы золото-платина, покрытые тонкой платиновой пленкой на плазмонных золотых наностержнях, продемонстрировали очень высокое преобразование энергии, что привело к увеличению скорости катализа фотокаталитической реакции, которая преобразует органические молекулы с использованием лазера ближнего инфракрасного диапазона в качестве источника энергии без каких-либо потерь. в каталитической активности даже после многократного использования. Более того, используя этот подход, различные кривизны поверхности плазмонных нанокристаллов могут быть независимо покрыты и активированы с использованием различных источников света, так что активность конкретного катализатора среди смешанных каталитических материалов может быть управляемой избирательно и дистанционно.
в каталитической активности даже после многократного использования. Более того, используя этот подход, различные кривизны поверхности плазмонных нанокристаллов могут быть независимо покрыты и активированы с использованием различных источников света, так что активность конкретного катализатора среди смешанных каталитических материалов может быть управляемой избирательно и дистанционно.
«С помощью подхода к синтезу, разработанного в этом исследовании, каталитически активные металлы могут быть нанесены тонким слоем на поверхность различных типов плазмонных наночастиц на атомном уровне», — отметил профессор Ин Су Ли, руководивший исследованием. «Благодаря синергии с металлической оболочкой его можно использовать в качестве высокоэффективного фотокатализатора в различных областях, включая устойчивое преобразование энергии, биотехнологии и биомедицину. »
»
Исследовательская группа POSTECH под руководством профессора Ин Су Ли, профессора-исследователя Амита Кумара и доктора философии. кандидат Анубхаб Ачарья с химического факультета POSTECH в сотрудничестве с профессорами Джунсуком Ро из POSTECH, Юн-Кён Чо из UNIST и Санг Хо О из Университета Сунгкьюнкван. Основываясь на уникальном исследовании «химической реакции в нанопространстве (NCCR)», которое изучает исследовательский центр, ожидается, что это исследование может быть преобразовано в технологию искусственного регулирования функций клеток.
Исследование было опубликовано в качестве обложки в Журнале Американского химического общества
Наноструктура кремнезема с химико-ферментативной компартментализацией
Дополнительная информация: Анубхаб Ачарья и др.
 , Атомно-конформные ламинирования металлов на плазмонных нанокристаллах для эффективного катализа, , Журнал Американского химического общества, (2021).DOI: 10.1021/jacs.1c05753
, Атомно-конформные ламинирования металлов на плазмонных нанокристаллах для эффективного катализа, , Журнал Американского химического общества, (2021).DOI: 10.1021/jacs.1c05753
Предоставлено Пхоханский университет науки и технологий (POSTECH)
Цитата : Катализатор, управляющий химическими реакциями со светом (2021, 19 августа) получено 6 февраля 2022 г. с https://физ.org/news/2021-08-catalyst-chemical-reactions.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
бел.рублей | Химия | Катализ: реакционная способность и структура
Группа катализа, реакционной способности и структуры является частью катализа BNL.
научная программа, которая продвигает фундаментальное понимание устойчивого
пути топливного и химического синтеза с текущим акцентом на катализ
для C1-химии, такой как конверсия CO 2 .Эта программа преследует
улучшить понимание химического катализа для
усовершенствованные процессы синтеза топлива и преобразования энергии путем выяснения
каталитически важные свойства на четко определенных поверхностях, порошках и
наноструктуры. Мы изучаем и манипулируем систематически рядом
многофункциональные катализаторы, содержащие оксид металла, карбид металла или
границы раздела металл-сульфид.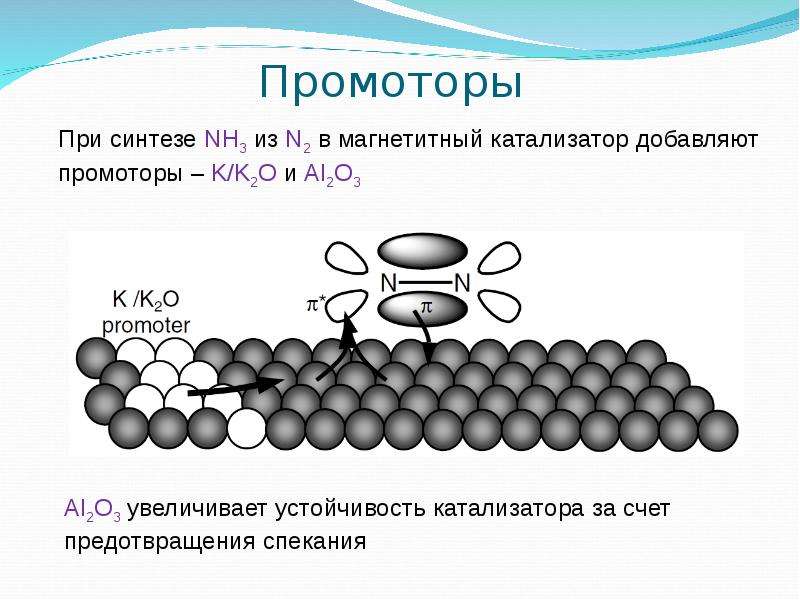 Наша комплексная исследовательская программа изучает
эффекты размера, морфологии и химической среды, обеспечивая действительно
атомистический взгляд на объяснение/предсказание каталитической активности.
Наша комплексная исследовательская программа изучает
эффекты размера, морфологии и химической среды, обеспечивая действительно
атомистический взгляд на объяснение/предсказание каталитической активности.
In-situ AP-STM / AP-XPS / AP-IRRAS (модели катализаторов)
Мы готовим наноструктурированные материалы для катализа, уделяя особое внимание характеристике и реакционная способность металлооксидных наноструктур. Цель состоит в том, чтобы выявить и охарактеризовать каталитически активные центры нанесенных нанокатализаторов и исследовать влияние размера частиц, морфологии и поддержки реакционной способности наноструктуры.
Сложности, возникающие из присущих многокомпонентных аспектов гетерогенных
катализ изучаются с использованием как исследований поверхности в сверхвысоком вакууме,
четко определенных модельных систем, порошковой дифракции и рентгеновских исследований поглощения
«реальных» систем.Мы привносим различные методы в общие темы реакции в
синтез топлива, такой как производство водорода и синтез оксигенатов.
Комбинированные рентгеновские дифрактометры и вибрационная спектроскопия на месте DRIFTS (порошковый катализатор).
Комбинированный ДПФ и кинетический метод Монте-Карло (моделирование).
Мы разрабатываем и применяем новые подходы для определения характеристик гетерогенных катализаторы с использованием оборудования, доступного в Национальном источнике синхротронного света (NSLS-II) для дифракции рентгеновских лучей, поглощения рентгеновских лучей и фотоэмиссии при атмосферном давлении.Квантово-химический вычисление играет существенную роль для базового понимания каталитических реакций и интерпретация экспериментальных результатов.
Катализ: активные центры для CO 2 Гидрирование в метанол на катализаторах Cu/ZnO
Мы продвинулись в фундаментальном понимании давних дебатов, активных сайтов
обычно используемые катализаторы на основе оксида меди/цинка (Cu/ZnO) для диоксида углерода (CO 2 )
гидрирование до метанола.Превращение поверхностного Zn сплава ZnCu в ZnO под
условия реакции были зафиксированы, в результате чего образовалась каталитически активная межфазная поверхность ZnO-Cu. площадки по производству метанола. Оптимизация интерфейса ZnO-Cu должна быть движущей силой
Принцип создания лучших катализаторов.
площадки по производству метанола. Оптимизация интерфейса ZnO-Cu должна быть движущей силой
Принцип создания лучших катализаторов.
Каттел, С.; Рамирес, П.Дж.; Чен, Дж. Г.; Родригес, Дж. А.; Лю, П., Активные сайты для CO 2 гидрирование до метанола на катализаторах Cu/ZnO. Наука 2017, 355 (6331), 1296-1299.(http://science.sciencemag.org/cgi/content/full/355/6331/1296?ijkey=e.EnqESKxFRv2&keytype=ref&siteid=sci)
Химический катализатор превращает «мусор» в «сокровище»
Уроженец Уэльса Хью Дэвис поступил в Университет Восточной Англии в Англии, где получил докторскую степень в области органической химии. Однако именно в Нью-Джерси, куда он переехал, чтобы получить докторскую степень в Принстоне, он нашел свой карьерный путь.
«Я начал работать с дирродиевым катализатором, — вспоминает Дэвис, — и был впечатлен тем, насколько чисто он проводит карбеновые реакции.Он был невероятно реактивным и хорошо себя вел. Я решил сосредоточить на этом свою карьеру, потому что думал, что это изменит правила игры».
Я решил сосредоточить на этом свою карьеру, потому что думал, что это изменит правила игры».
Его инстинктивная реакция в сочетании с его готовностью искать новые методы изучения химии окупились. Дэвис возглавил разработку серии дирродиевых катализаторов, которые ускоряют, упрощают и расширяют возможности органической химии, создавая основу для синтеза новых молекул.
Американское химическое общество недавно выбрало Дэвиса для получения премии Герберта С.Брауна за творческие исследования в области синтетических методов. Четверо из 21 предыдущего лауреата престижной премии получили Нобелевские премии, и все они считаются суперзвездами в своей области.
«Для меня большая честь быть среди них», — говорит Дэвис, который присоединился к Эмори в 2008 году в качестве профессора химии Асы Григгс Кэндлер.
В 1996 году Дэвис запатентовал свой первый мощный катализатор из дирродия, кристаллизованного в виде спирали. Родий, член платиновой группы, является одним из самых редких и ценных драгоценных металлов. Катализатор, однако, вызывает реакции настолько эффективно, что теоретически менее унции каталитического материала можно использовать для создания тонны синтезированного продукта. Это делает его масштабируемым и экономически эффективным для производства лекарств.
Родий, член платиновой группы, является одним из самых редких и ценных драгоценных металлов. Катализатор, однако, вызывает реакции настолько эффективно, что теоретически менее унции каталитического материала можно использовать для создания тонны синтезированного продукта. Это делает его масштабируемым и экономически эффективным для производства лекарств.
Вскоре после прихода в Эмори Дэвис стал директором-основателем Центра селективной функционализации C-H (CCHF) Национального научного фонда, консорциума, базирующегося в Эмори и объединяющего 15 крупных исследовательских университетов со всей страны, а также промышленных партнеров.
Традиционно органическая химия сосредоточивалась на разделении между реактивными молекулярными связями и инертными связями углерод-углерод (C-C) и углерод-водород (C-H). Инертные связи обеспечивают прочную и стабильную основу для проведения химического синтеза с реакционноспособными группами. Функционализация C-H переворачивает эту модель с ног на голову, делая связи C-H реактивными.
Функционализация C-H переворачивает эту модель с ног на голову, делая связи C-H реактивными.
CCHF возглавляет смену парадигмы в стратегии синтеза, которая сулит большие перспективы для создания новых путей открытия лекарств и производства новых материалов, которые принесут пользу всему, от сельского хозяйства до электроники.
Посмотреть видео о создании Центра селективной функционализации C-H NSF
«Когда вы разрабатываете новое лекарство, может быть большим преимуществом не делать это так, как все делали последние 100 лет», — говорит Дэвис. «Новые методы могут позволить вам ввести новые структуры, которые приведут к новым потенциальным кандидатам в лекарства».
В совокупности CCHF опубликовал более 200 статей и разработал десятки новых катализаторов для функционализации CH, в том числе пять основных новых дирродиевых катализаторов из лаборатории Дэвиса.
Центр также революционизирует способы исследования и преподавания химии, разрушая стены отдельных лабораторий и институтов, чтобы организовать сотрудничество и обмен студентами, которые охватывают всю страну и континенты.
Кэтрин «Кэти» Чепига проводила исследования в Японии в качестве аспиранта Эмори. Она опубликовала данные о том, что функционализация C-H ускоряет синтез морских алкалоидов из морской губки, которые продемонстрировали потенциал для лекарственной терапии.Чепига получила докторскую степень в 2018 году и сейчас работает в Bayer Pharmaceuticals в Германии. (Кей Хинтон, фото/видео Эмори)
Кэтрин «Кэти» Чепига проводила исследования в Японии в качестве аспиранта Эмори. Она опубликовала данные о том, что функционализация C-H ускоряет синтез морских алкалоидов из морской губки, которые продемонстрировали потенциал для лекарственной терапии. Чепига получила докторскую степень в 2018 году и сейчас работает в Bayer Pharmaceuticals в Германии.(Кей Хинтон, фото/видео Эмори)
Программа NSF Science Across Virtual Institutes (SAVI) в этом году выделила CCHF еще 300 000 долларов на продолжение программы обмена студентами, включая лаборатории в США, Южной Корее, Японии и Германии. Студенты, аспиранты и докторанты могут участвовать в национальных и международных обменах, изучая методы других лабораторий и привнося свои собственные новые идеи.
Студенты, аспиранты и докторанты могут участвовать в национальных и международных обменах, изучая методы других лабораторий и привнося свои собственные новые идеи.
«У нас потрясающая среда для совместной работы, в которой химики-органики не просто делятся результатами — они делятся идеями», — говорит Дэвис. «Это редкость. И мы расширили эту среду за пределы нашей сети университетов, чтобы задействовать и фармацевтическую промышленность».
Премия Герберта С. Брауна — это лишь последнее признание новаторской карьеры Дэвиса в области органического синтеза. Среди других недавних наград Дэвиса — звание члена Королевского химического общества (2007 г.), члена Американского химического общества (2009 г.), члена Американской ассоциации содействия развитию науки (2012 г.), члена Национальной академии изобретателей. (2015) и получение премии Пола Райландера от Общества органических реакций и катализа в синтезе (2018).
.