Химическое равновесие и способы его смещения
Скорость прямой реакции в начале обратимых процессов является максимальной, однако после она уменьшается из-за того, что сокращается концентрация исходных веществ, которые расходуются на создание продуктов реакции. И напротив, скорость обратной реакции вначале является минимальной, она возрастает по мере увеличения концентрации продуктов реакции. Немного позже, наступает момент, когда скорость прямой и обратной реакции становятся равными.
Состояние химически обратимого процесса называется химическим равновесием, если при этом скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие является движущимся, т.к. при его наступлении реакция продолжается и концентрации компонентов остаются неизменными, другими словами, за единицу времени образуется такое же количество продуктов реакции, какое преобразуется в исходные вещества. Если температура и давление являются постоянными величинами, то равновесие в данной реакции может длиться неопределенно долгое время.
В промышленности в большинстве случаев заинтересованы в преимущественном протекании прямой реакции. К примеру, при получении аммиака, оксида серы (VI), оксида азота (II). Каким образом можно вывести данную систему из равновесия? Как влияет на него изменение внешних условий, при которых протекает тот или иной химический процесс? В этом нам поможет принцип Ле Шателье.
Любая система, которая находится в состоянии термодинамического равновесия, при внешнем воздействии (изменение температуры, давления и т.д.) стремится вернуться в исходное состояние химическоой устойчивости, при этом компенсируя оказанное воздействие.
Такой принцип было бы проще назвать так: «делай все с точностью до наоборот и добьешься желаемого». Давайте проанализируем, что нужно сделать, чтобы сдвинуть равновесие, если трансформировать каждое из условий реакции, на примере реакции синтеза аммиака: N 2 + 3H2 ↔ 2NH3 + Q.
Рассмотрим подробнее характеристику данного процесса.
1) Прямая реакция является реакцией соединения, т.к. из двух простых веществ – азота и водорода – создается одно сложное вещество – аммиак. Естественно, обратная реакция по этому признаку относится к реакциям разложения.
2) Т.к. обе реакции – и прямая, и обратная – проходят в присутствии катализатора (им может стать универсальная платина, или недорогой железный катализатор с добавками оксидов К и Al) то обе реакции являются каталитическими. Необходимо отметить, что катализатор не является причиной смещения равновесия. Он в равной мере изменяет скорость как прямой, так и обратной реакции.
3) Прямая реакция проходит с образованием теплоты, поэтому ее относят к экзотермическим реакциям. Будет логично предположить, что обратная реакция станет эндотермической (проходит с поглощением теплоты).
А теперь давайте рассмотрим, как применим принцип Ле Шателье, или принцип противодействия, для сдвига равновесия в реакции синтеза аммиака.
1) Трансформация равновесных концентраций. Чтобы сдвинуть равновесие в сторону образования аммиака, следует увеличить концентрацию начальных веществ (концентрацию азота и водорода) и свести к минимуму концентрацию аммиака. Равновесные концентрации принято обозначать на письме квадратными скобками, в отличие от неравновесных, которые обозначаются буквой с. Таким образом, если мы хотим изменить равновесие реакции в право, следует повысить концентрацию азота и водорода ([N2] и [H2]) и свести к минимуму концентрацию аммиака ([NH3]), т.е. вывести его из сферы реакции. Разумеется, для изменения равновесия влево, нужно сделать все наоборот.
Чтобы сдвинуть равновесие в сторону образования аммиака, следует увеличить концентрацию начальных веществ (концентрацию азота и водорода) и свести к минимуму концентрацию аммиака. Равновесные концентрации принято обозначать на письме квадратными скобками, в отличие от неравновесных, которые обозначаются буквой с. Таким образом, если мы хотим изменить равновесие реакции в право, следует повысить концентрацию азота и водорода ([N2] и [H2]) и свести к минимуму концентрацию аммиака ([NH3]), т.е. вывести его из сферы реакции. Разумеется, для изменения равновесия влево, нужно сделать все наоборот.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
|
Химическое равновесие реакции
Существуют обратимые и необратимые химические реакции. Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях с сопоставимыми скоростями, называют обратимыми, например:
CH3COOH + CH3OH CH3COOCH3 + H 2O
В тот момент, когда скорости прямой и обратной реакций выравниваются, устанавливается химическое равновесие, то есть соотношение между продуктами реакций и исходными веществами остается постоянным. Состояние системы, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием. Такое состояние может сохраняться бесконечно долго, если не происходит изменения условий реакции (концентрации, температуры, давления). При изменении этих условий происходит смещение (или сдвиг) равновесия.
При изменении этих условий происходит смещение (или сдвиг) равновесия.
Смещение равновесия определяется принципом Ле-Шателье, который гласит: если на систему, находящуюся в равновесии, оказывается какое-либо внешнее воздействие, то система реагирует так, чтобы уменьшить это воздействие. Например:
Реакция протекает в газовой фазе, обратима, прямая реакция экзотермична. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми.
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево – обратной (константа скорости обратной реакции k2). В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратимая реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной – увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
И наоборот, обратимая реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной – увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Константа химического равновесия является количественной характеристикой химического равновесия и характеризует выход продуктов реакции. Если К >1, то в равновесной системе больше продуктов реакции, т.е. в данном случае выход продуктов реакции больше, чем исходных веществ.
 Если К<1, химическое равновесие смещено в сторону образования исходных веществ, которых находится больше в равновесной системе.
Если К<1, химическое равновесие смещено в сторону образования исходных веществ, которых находится больше в равновесной системе.Способы смещения химического равновесия
1. а). Увеличение концентрации одного из реагирующих веществ вызовет смещение равновесия в сторону его потребления, так, добавление в систему азота или водорода вызовет сдвиг равновесия вправо, а аммиака — влево. Уменьшение концентрации какого-либо из участников равновесия вызовет его образование. Так, например, связывая аммиак в соль, можно равновесие полностью сместить вправо.
2. б). Изменение давления вызовет в равновесной системе смещения в сторону той реакции, которая может компенсировать это изменение. В данном случае увеличение давления ускорит реакцию, идущую с уменьшением общего количества газообразных веществ, то есть равновесие сместится вправо, а уменьшение давления — реакцию, идущую с увеличением общего количества газообразных веществ, то есть равновесие сместится влево.
3. в). Увеличение температуры, то есть подвод тепла, смещает равновесие в сторону реакции, идущей с поглощением тепла, то есть эндотермической, а уменьшение температуры, то есть отнятие тепла, — в сторону реакции, идущей с выделением тепла, то есть экзотермической. В данном примере повышение температуры смещает равновесие влево, а понижение — вправо (в сторону синтеза аммиака).
4. г) Катализатор не влияет на положение равновесия, поскольку он в равной степени изменяет скорости прямой и обратной реакций.
Урок химии по теме «Химическое равновесие и условия его смещения». 9-й класс
Цель урока: формирование представлений учащихся о химическом равновесии, условиях его смещения.
Задачи:
Образовательные: дать понятия об обратимости
химических реакций, о химическом равновесии.
Формировать умение применять знания о
закономерностях смещения химического
равновесия.
Развивающие: развивать умение устанавливать причинно-следственные связи, развивать познавательный интерес к предмету и творческую активность.
Воспитательные: воспитывать личные качества учащихся: коммуникативность, самостоятельность.
Коррекционные: развивать грамотную речь, расширять словарь учащихся, корректировать произношение сложных химических терминов.
Реактивы: хлорид железа (III), роданид аммония, крахмальный клейстер, йод.
Тип урока: изучение нового материала.
Ход урока
1. Организационный момент.
Приветствие.
Определение отсутствующих.
Проверка готовности учащихся к уроку.
2. Мотивация и актуализация знаний.
Начинается наш урок, эпиграф к которому звучит
так: “Ум заключается не только в знании, но и в
умении прилагать знание на деле”. (Аристотель).
(Аристотель).
Мы ещё вернёмся к этому эпиграфу, и вы сами сможете объяснить, почему именно его я взяла, чтобы озаглавить наш урок. А на уроке мы будем говорить о химических реакциях.
Самое интересное в окружающем нас мире – это то, что он очень сложно устроен, и к тому же постоянно изменяется. Каждую секунду в нём происходит множество химических реакций, образуется множество химических веществ.
Фронтальный опрос.
– В чём суть химических реакций?
– Каковы условия, необходимые для возникновения химических реакций?
– Перечислите признаки химических реакций?
– Дайте определение скорости химической реакции.
– Что является гомогенной и гетерогенной реакциями?
– Какие реакции относят к экзотермическим, а какие к эндотермическим?
– От каких факторов зависит скорость химической реакции?
3. Вводная информация учителя и формирование цели урока.

Сегодня на уроке мы познакомимся с новым понятием “химическое равновесие”. Понятие это имеет очень большое значение, как для химии, так и для химической технологии. Знание о химическом равновесии необходимы для предсказания условий, при которых можно осуществлять химические превращения, а так же помогут добиться максимального выхода продукта реакции.
Итак, давайте вместе сформулируем цель нашего занятия.
Цель урока: изучить химическое равновесие и условия его смещения.
4. Изучение нового материала
.Большинство химических реакций может протекать в двух противоположных направлениях, т.е. являются обратимыми.
Откроем учебник (Кузнецова Н.Е., Титова И.Н., Гара Н.Н., Химия 9 класс) параграф 2. Найдите в тексте определение, какие реакции называют обратимыми.
(Обратимыми – называются реакции, которые
протекают при данных условиях одновременно в
двух противоположных направлениях – прямом и
обратном). В уравнениях обратимых реакций
используют знак обратимости ().
В уравнениях обратимых реакций
используют знак обратимости ().
Примером обратимой реакции может служить синтез йодоводорода из водорода и йода:
h3 (г) + I2(г) 2HI(г)
Скорость прямой реакции (V1) вначале максимальна, а скорость обратной (V2) – равняется нулю. Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов реакции увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. В определённый момент времени скорости прямой и обратной реакций становятся равными (V1=V2).
Это означает, что реакция достигла состояния равновесия.
Отметим, что понятие равновесие можно использовать только по отношению к закрытой системе.
Запишем определение: состояние обратимой
реакции, при котором скорость прямой реакции
равна скорости обратной реакции, называется химическим
равновесием.
Если записать реакцию, в которой наступило равновесие, в общем виде следующим образом: aA + bB cC + dD
То равновесие можно охарактеризовать через константу равновесия K. Эта величина показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Если константа равновесия больше единицы, что это значит? (Значит, на момент установления равновесия большая часть исходных веществ превратилась в продукт).
Вы часто встречались с механическим равновесием. Приведите примеры. (Весы в состояния равновесия, маятник).
В отличие от механического равновесия, при
котором всякое движение прекращается, при
химическом равновесии обе реакции (прямая и
обратная) продолжают идти, но скорости их равны, и
поэтому никакие изменения в системе не
происходят. Если изменение условий не
происходит, то состояние равновесия может
продолжаться бесконечно долго. По вашему мнению,
можно ли сместить химическое равновесие? Как вы
предлагаете это делать?
По вашему мнению,
можно ли сместить химическое равновесие? Как вы
предлагаете это делать?
Химическое равновесие легко нарушить. Изменяя определённые условия можно добиться смещения химического равновесия. При этом скорости прямой и обратной реакций становятся не одинаковыми.
Направление смещения равновесия определяется принципом, который был сформулирован французским учёным Ле Шателье: Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
Факторы, которые могут приводить к смещению химического равновесия:
А) Концентрация реагирующих веществ.
Б) Температура.
В) Давление.
Рассмотрим влияние этих факторов более подробно.
Влияние концентрации реагирующих веществ.
Повышение концентрации исходных веществ
смещает равновесие в сторону прямой реакции,
понижение – в сторону обратной реакции.
Демонстрация опыта. В качестве равновесной системы используется реакция образования роданида железа (III) из хлорида железа (III) и роданида аммония.
FeCI3 + 3Nh5CNS –> Fe(CNS)3 + 3Nh5CI
Признаком, указывающим на смещение равновесия в ту или иную сторону, служит изменение интенсивности окраски раствора, обусловленной концентрацией роданида железа (III).
Проводим реакцию. Содержимое делим на две части. В один стакан добавляем 10 мл. исходного 0.1М раствора хлорида железа (III).Наблюдаем увеличение интенсивности окраски. Вопрос к классу “почему”? Во второй стакан добавляем 20мл. насыщенного раствора хлорида аммония. Анализируем, почему идёт ослабление окраски.
Влияние температуры.
При нагревании системы равновесие смещается в сторону эндотермической реакции; при охлаждении в сторону экзотермической реакции.
Демонстрация опыта.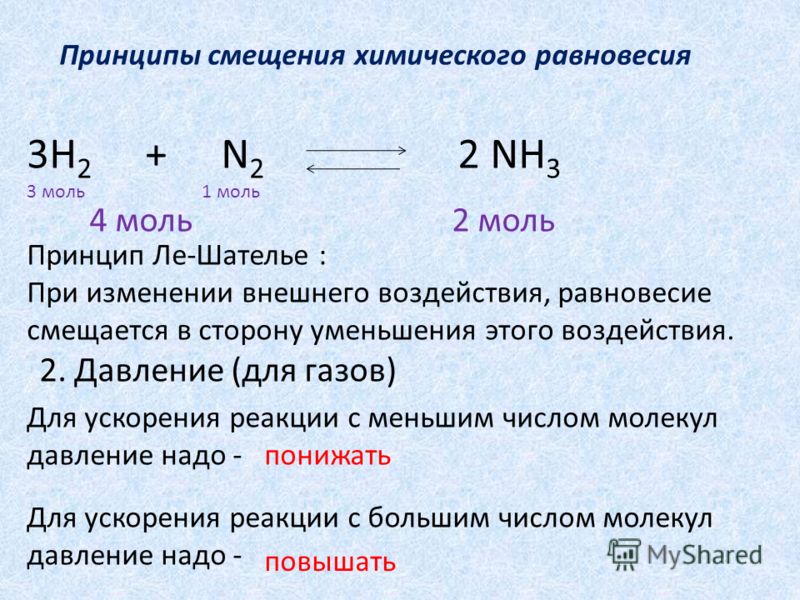 В две пробирки
крахмального клейстера добавляем две капли йода.
Появляется синий цвет.
В две пробирки
крахмального клейстера добавляем две капли йода.
Появляется синий цвет.
Крахмал + I2 –> вещество синего цвета
При нагревании пробирки окраска исчезает. Почему? В какую сторону смещается равновесие. При понижении температуры (охлаждаем пробирку) окраска проявляется. Почему? Куда смещается равновесие.
Какой знак теплового эффекта отвечает данной реакции?
Влияние давления.
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. При увеличении давления равновесие смещается в сторону меньшего объема, при уменьшении давления равновесие смещается в сторону большего объема.
Так для увеличения выхода аммиака необходимо повышать давление в системе. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при которой число молекул газа уменьшается.
N2(г) + 3h3(г) 2Nh4(г)
Если же реакция протекает без изменения числа
молекул газообразных веществ, то давление не
влияет на равновесие в данной системе.
Как вы думаете, катализатор может повлиять на смещение химического равновесия?
Использование катализатора, приводящего к ускорению данной обратимой реакции, никак не влияет на состояние равновесия.
5. Закрепление нового материала
.А сейчас мы вернёмся к эпиграфу нашего урока и постараемся полученные знания использовать при решении заданий.
Задание №1 (решаем, рассуждаем совместно).
Какой знак теплового эффекта, отвечающего процессу растворения кислорода в воде? Учитывайте тот факт, что с нагреванием растворимость кислорода в воде снижается.
O2 + вода водный раствор кислорода
Задание №2 (решаем совместно).
При термическом разложении карбоната кальция может установиться равновесие. В каком направлении оно будет смещаться при повышении температуры?
Задание №3 (самостоятельная работа).
Используя принцип Ле Шателье, определите в какую сторону сместится химическое равновесие при повышении или понижении температуры, давления, и концентрации:
N2 + O2 2NO — Q
Учащиеся решают самостоятельно, затем осуществляют самоконтроль, опираясь на материал слайда.
6. Подведение итогов.
Что нового и интересного вы узнали на данном уроке?
Почему нужно знать способы смещения химического равновесия?
В каких областях эти знания необходимы?
7. Рефлексия. Выставление оценок.
8. Домашнее задание.
Параграф 2, знать основные понятия, внимательно прочитать выводы. Задача: укажите знак теплового эффекта растворения азота в воде (при нагревании растворимость азота в воде уменьшается).
Литература, используемая при составления конспекта урока:
- Бердоносов С.
 С., Менделеева Е.А. Материалы курса
“Особенности содержания и методики
преподавания избранных тем курса химии 8-9-х
классов” – М.: Пед.университет “Первое
сентября”, 2006.
С., Менделеева Е.А. Материалы курса
“Особенности содержания и методики
преподавания избранных тем курса химии 8-9-х
классов” – М.: Пед.университет “Первое
сентября”, 2006. - Кушнарев А.А. Экспресс – курс по неорганической химии с примерами, задачами, реакциями. 8-9 классы – М.: Школьная пресса, 2002.
- Химия. Пособие – репетитор для поступающих в вузы. /Под ред. Егорова – Ростов н/Д, Феникс, 2003
- Химия. Базовый уровень. Книга для учителя./ Под ред. О.С. Габриелян и др. – М.: Дрофа, 2009.
Влияние на смещение химического равновесия. Химическое равновесие
Изучение параметров системы, включающей исходные вещества и продукты реакции, позволяет выяснить, какие факторы смещают химическое равновесие и ведут к желаемым изменениям. На выводах Ле Шателье, Брауна и других ученых о способах проведения обратимых реакций основаны промышленные технологии, позволяющие осуществить ранее казавшиеся невозможными процессы, получить экономическую выгоду.
Разнообразие химических процессов
По особенностям теплового эффекта многие реакции относят к экзо- или эндотермическим. Первые идут с образованием теплоты, например, окисление углерода, гидратация концентрированной серной кислоты. Второй тип изменений связан с поглощением тепловой энергии. Примеры эндотермических реакций: распад карбоната кальция с образованием гашеной извести и углекислого газа, образование водорода и углерода при термическом разложении метана. В уравнениях экзо- и эндотермических процессов необходимо указывать тепловой эффект. Перераспределение электронов между атомами реагирующих веществ происходит в окислительно-восстановительных реакциях. Четыре типа химических процессов выделяют по особенностям реагентов и продуктов:
Для характеристики процессов важна полнота взаимодействия реагирующих соединений. Этот признак лежит в основе деления реакций на обратимые и необратимые.
Обратимость реакций
Обратимые процессы составляют большинство среди химических явлений.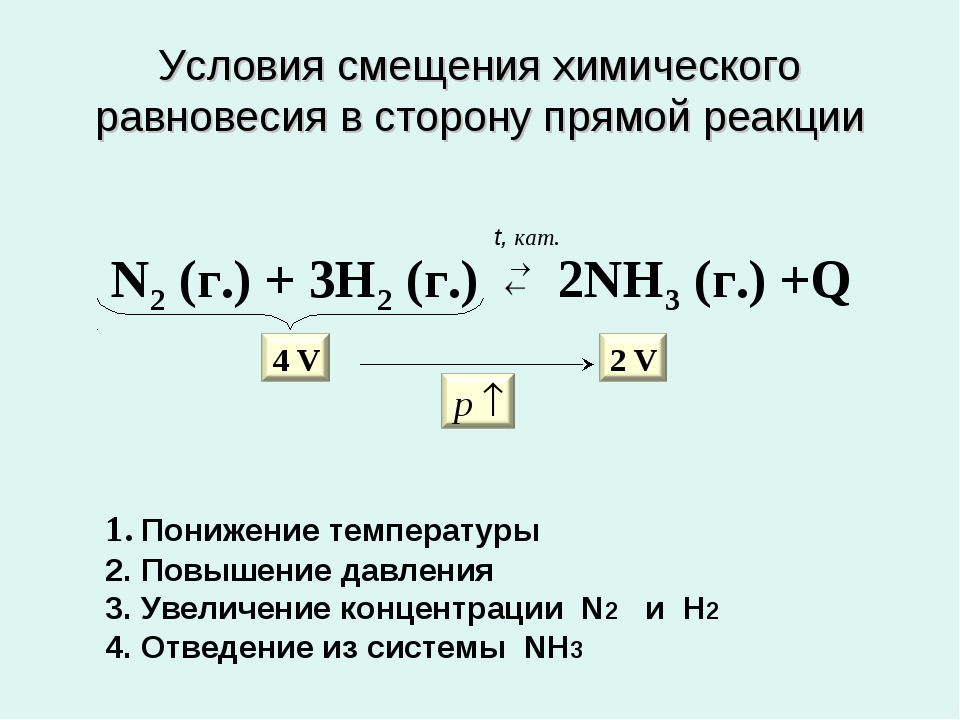 Образование конечных продуктов из реагентов является прямой реакцией. В обратной же исходные вещества получаются из продуктов своего разложения или синтеза. В реагирующей смеси возникает химическое равновесие, при котором получается столько же соединений, сколько разлагается исходных молекул. В обратимых процессах вместо знака «=» между реагентами и продуктами используются символы «↔» или «⇌». Стрелки могут быть неодинаковыми по длине, что связано с доминированием одной из реакций. В химических уравнениях можно указывать агрегатные характеристики веществ (г — газы, ж — жидкости, т — твердые). Огромное практическое значение имеют научно обоснованные приемы влияния на обратимые процессы. Так, производство аммиака стало рентабельным после создания условий, сдвигающих равновесие в сторону образования целевого продукта: 3Н 2(г) + N 2(г) ⇌ 2NH 3(г) . Необратимые явления приводят к появлению нерастворимого или малорастворимого соединения, образованию газа, покидающего сферу реакции. К таким процессам можно отнести ионный обмен, распад веществ.
Образование конечных продуктов из реагентов является прямой реакцией. В обратной же исходные вещества получаются из продуктов своего разложения или синтеза. В реагирующей смеси возникает химическое равновесие, при котором получается столько же соединений, сколько разлагается исходных молекул. В обратимых процессах вместо знака «=» между реагентами и продуктами используются символы «↔» или «⇌». Стрелки могут быть неодинаковыми по длине, что связано с доминированием одной из реакций. В химических уравнениях можно указывать агрегатные характеристики веществ (г — газы, ж — жидкости, т — твердые). Огромное практическое значение имеют научно обоснованные приемы влияния на обратимые процессы. Так, производство аммиака стало рентабельным после создания условий, сдвигающих равновесие в сторону образования целевого продукта: 3Н 2(г) + N 2(г) ⇌ 2NH 3(г) . Необратимые явления приводят к появлению нерастворимого или малорастворимого соединения, образованию газа, покидающего сферу реакции. К таким процессам можно отнести ионный обмен, распад веществ.
Химическое равновесие и условия его смещения
На характеристики прямого и обратного процессов влияет несколько факторов. Один из них — время. Концентрация взятого для реакции вещества постепенно снижается, а конечного соединения — возрастает. Реакция прямого направления идет все медленнее, обратный процесс набирает скорость. В определенный промежуток два противоположных процесса идут синхронно. Взаимодействие между веществами происходит, но концентрации не меняются. Причина — динамическое химическое равновесие, установившееся в системе. Его сохранение или изменение зависит от:
- температурных условий;
- концентрации соединений;
- давления (для газов).
Смещение химического равновесия
В 1884 году выдающийся ученый из Франции А. Л. Ле Шателье предложил описание способов вывода системы из состояния динамического равновесия. В основе метода лежит принцип нивелирования действия внешних факторов. Ле Шателье обратил внимание, что в реагирующей смеси возникают процессы, компенсирующие влияние посторонних сил. Сформулированный французским исследователем принцип гласит, что изменение условий в состоянии равновесия благоприятствует протеканию реакции, ослабляющей постороннее воздействие. Смещение равновесия подчиняется этому правилу, оно соблюдается, когда меняется состав, температурные условия и давление. Технологии, основанные на выводах ученых, используются в промышленности. Многие химические процессы, считавшиеся практически неосуществимыми, проводятся благодаря способам смещения равновесия.
Сформулированный французским исследователем принцип гласит, что изменение условий в состоянии равновесия благоприятствует протеканию реакции, ослабляющей постороннее воздействие. Смещение равновесия подчиняется этому правилу, оно соблюдается, когда меняется состав, температурные условия и давление. Технологии, основанные на выводах ученых, используются в промышленности. Многие химические процессы, считавшиеся практически неосуществимыми, проводятся благодаря способам смещения равновесия.
Влияние концентрации
Сдвиг равновесия происходит, если изъять из зоны взаимодействия определенные компоненты или дополнительно ввести порции вещества. Удаление продуктов из реакционной смеси обычно вызывает увеличение скорости их образования, добавление веществ, наоборот, приводит к их преимущественному распаду. В процессе этерификации для обезвоживания используют серную кислоту. При введении ее в сферу реакции повышается выход метилацетата: СН 3 СООН + СН 3 ОН ↔ СН 3 СООСН 3 + Н 2 О. Если добавлять кислород, взаимодействующий с диоксидом серы, то химическое равновесие смещается в сторону прямой реакции образования триоксида серы. Кислород связывается в молекулы SO 3 , его концентрация понижается, что согласуется с правилом Ле Шателье для обратимых процессов.
Если добавлять кислород, взаимодействующий с диоксидом серы, то химическое равновесие смещается в сторону прямой реакции образования триоксида серы. Кислород связывается в молекулы SO 3 , его концентрация понижается, что согласуется с правилом Ле Шателье для обратимых процессов.
Изменение температуры
Процессы, идущие с поглощением или выделением тепла, — эндо- и экзотермические. Для смещения равновесия используется нагревание или отвод тепла от реагирующей смеси. Рост температуры сопровождается повышением скорости эндотермических явлений, в которых дополнительная энергия поглощается. Охлаждение приводит к преимуществу экзотермических процессов, идущих с выделением тепла. При взаимодействии диоксида углерода с углем нагревание сопровождается увеличением концентрации монооксида, а охлаждение ведет к преимущественному образованию сажи: СО 2(г) + С (т) ↔ 2СО (г) .
Влияние давления
Изменение давления — важный фактор для реагирующих смесей, включающих в себя газообразные соединения. Также следует обратить внимание на разницу объемов исходных и получившихся веществ. Понижение давления ведет к преимущественному протеканию явлений, в которых увеличивается общий объем всех компонентов. Рост давления направляет процесс в сторону снижения объема всей системы. Такая закономерность соблюдается в реакции образования аммиака: 0,5N 2(г) + 1,5Н 2(г) ⇌ NH 3(г) . Изменение давления не повлияет на химическое равновесие в тех реакциях, которые идут при неизменном объеме.
Также следует обратить внимание на разницу объемов исходных и получившихся веществ. Понижение давления ведет к преимущественному протеканию явлений, в которых увеличивается общий объем всех компонентов. Рост давления направляет процесс в сторону снижения объема всей системы. Такая закономерность соблюдается в реакции образования аммиака: 0,5N 2(г) + 1,5Н 2(г) ⇌ NH 3(г) . Изменение давления не повлияет на химическое равновесие в тех реакциях, которые идут при неизменном объеме.
Оптимальные условия осуществления химического процесса
Создание условий для смещения равновесия во многом определяет развитие современных химических технологий. Практическое использование научной теории способствует получению оптимальных результатов производства. Наиболее яркий пример — получение аммиака: 0,5N 2(г) + 1,5Н 2(г) ⇌ NH 3(г) . Повышение содержания в системе молекул N 2 и Н 2 благоприятно для синтеза сложного вещества из простых. Реакция сопровождается выделением теплоты, поэтому снижение температуры вызовет увеличение концентрации NH 3 . Объем исходных компонентов больше, чем целевого продукта. Рост давления обеспечит повышение выхода NH 3 .
Объем исходных компонентов больше, чем целевого продукта. Рост давления обеспечит повышение выхода NH 3 .
В условиях производства подбирают оптимальное соотношение всех параметров (температуры, концентрации, давления). Кроме того, имеет большое значение площадь соприкосновения между реагентами. В твердых гетерогенных системах увеличение поверхности ведет к росту скорости реакции. Катализаторы увеличивают скорость прямой и обратной реакции. Применение веществ с такими свойствами не приводит к смещению химического равновесия, но ускоряет его наступление.
Если система находится в состоянии равновесия, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменятся, то система выйдет из равновесия — скорости прямого и обратного процессов изменятся неодинаково — будет протекать реакция. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесии, давления или температуры.
Рассмотрим каждый из этих случаев.
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции. Пусть водород, иодоводород и пары иода находятся в равновесии друг с другом при определенных температуре и давлении. Введем в систему дополнительно некоторое количество водорода. Согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции — реакции синтеза HI, тогда как скорость обратной реакции не изменится. В прямом направлении реакция будет теперь протекать быстрее, чем в обратном. В результате этого концентрации водорода и паров иода будут уменьшаться, что повлечет за собою замедление прямой реакции, а концентрация HI будет возрастать, что вызовет ускорение обратной реакции. Через некоторое время скорости прямой и обратной реакций вновь сравняются- установится новое равновесие. Но при этом концентрация HI будет теперь выше, чем она была до добавления , а концентрация — ниже.
Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят, что равновесие смещается вправо, т. е. в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево — в направлении обратной реакции. В рассмотренном примере равновесие сместилось вправо. При этом то вещество , увеличение концентрации которого вызвало нарушение равновесия, вступило в реакцию — его концентрация понизилась.
Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят, что равновесие смещается вправо, т. е. в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево — в направлении обратной реакции. В рассмотренном примере равновесие сместилось вправо. При этом то вещество , увеличение концентрации которого вызвало нарушение равновесия, вступило в реакцию — его концентрация понизилась.
Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема системы). Когда в реакции участвуют газы, равновесие может нарушиться при изменении объема системы.
Рассмотрим влияние давления на реакцию между монооксидом азота и кислородом:
Пусть смесь газов , и находится в химическом равновесии при определенной температуре и давлении. Не изменяя температуры, увеличим давление так, чтобы объем системы уменьшился в 2 раза. В первый момент парциальные давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакций — равновесие нарушится.
В самом деле, до увеличения давления концентрации газов имели равновесные значения , и , а скорости прямой и обратной реакций были одинаковы и определялись уравнениями:
В первый момент после сжатия концентрации газов увеличатся вдвое по сравнению с их исходными значениями и будут равны соответственно , и . При этом скорости прямой и обратной реакций будут определяться уравнениями:
Таким образом, в результате увеличения давления скорость прямой реакции возросла в 8 раз, а обратной — только в 4 раза. Равновесие в системе нарушится — прямая реакция будет преобладать над обратной. После того как скорости сравняются, вновь установится равновесие, но количество в системе возрастет, равновесие сместится вправо.
После того как скорости сравняются, вновь установится равновесие, но количество в системе возрастет, равновесие сместится вправо.
Нетрудно видеть, что неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и в правой частях уравнения рассматриваемой реакции различно число молекул газов: одна молекула кислорода и две молекулы монооксида азота (всего три молекулы газов) превращаются в две молекулы газа — диоксида азота. Давление газа есть результат ударов его молекул о стенки сосуда; при прочих равных условиях давление газа тем выше, чем больше молекул заключено в данном объеме газа. Поэтому реакция, протекающая с увеличением числа молекул газов, приводит к возрастанию давления, а реакция, протекающая с уменьшением числа молекул газов, — к его понижению.
Помня об этом, вывод о влиянии давления на химическое равновесие можно сформулировать так:
При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т. е. в сторону понижения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т. е. в сторону увеличения давления.
е. в сторону понижения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т. е. в сторону увеличения давления.
В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе
равновесие не нарушается при изменении объема; выход HI не зависит от давления.
Нарушение равновесия вследствие изменения температуры. Равновесие подавляющего большинства химических реакций сдвигается при изменении температуры. Фактором, который определяет направление смещения равновесия, является при этом знак теплового эффекта реакции. Можно показать, что при повышении температуры равновесие смещается в направлении эндотермической, а при понижении — в направлении экзотермической реакции.
Так, синтез аммиака представляет собой экзотермическую реакцию
Поэтому при повышении температуры равновесие в системе сдвигается влево — в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты.
Наоборот, синтез оксида азота (II) представляет собой эндотермическую реакцию:
Поэтому при повышении температуры равновесие в системе сдвигается вправо — в сторону образования .
Закономерности, которые проявляются в рассмотренных примерах нарушения химического равновесия, представляют собою частные случаи общего принципа, определяющего влияние различных факторов на равновесные системы. Этот принцип, известный под названием принципа Ле Шателье, в применении к химическим равновесиям можно сформулировать так:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Действительно, при введении в систему одного из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества. «При повышении давления оно смещается так, что давление в системе снижается; при повышении температуры равновесие смещается в сторону эндотермической реакции — температура в системе падает.
Принцип Ле Шателье распространяется не только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация, растьорение, происходит в соответствии с принципом Ле Шателье.
Если внешние условия химического процесса не изменяются, то состояние химического равновесия может сохраняться сколь угодно долго. Изменением условий проведения реакции (температуры, давления, концентрации) можно добиться смещения или сдвига химического равновесия в требуемом направлении.
Смещение равновесия вправо приводит к увеличению концентрации веществ, формулы которых находятся в правой части уравнения. Смещение равновесия влево будет приводить к увеличению концентрации веществ, формулы которых находятся слева. При этом система перейдет в новое состояние равновесия, характеризующееся другими значениями равновесных концентраций участников реакции .
Смещение химического равновесия, вызванное изменением условий, подчиняется правилу, сформулированному в 1884 году французским физиком А. Ле Шателье (принцип Ле Шателье).
Ле Шателье (принцип Ле Шателье).
Принцип Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, например, изменить температуру, давление или концентрации реагентов, то равновесие сместится в направлении той реакции, которая ослабляет оказываемое воздействие.
Влияние изменения концентрации на смещение химического равновесия.
Согласно принципу Ле Шателье увеличение концентрации любого из участников реакции вызывает смещение равновесия в сторону той реакции, которая приводит к уменьшению концентрации этого вещества.
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ возрастает скорость прямой реакции и равновесие сдвигается в направлении образования продуктов реакции и наоборот;
При повышении концентрации одного из продуктов реакции возрастает скорость обратной реакции, что приводит к смещению равновесия в направлении образования исходных веществ и наоборот.
Например, если в равновесной системе:
SO 2(г) + NO 2(г) SO 3(г) + NO (г)
увеличить концентрации SO 2 или NO 2 , то, в соответствии с законом действующих масс, возрастет скорость прямой реакции. Это приведет к смещению равновесия вправо, что обусловит расходование исходных веществ и увеличение концентрации продуктов реакции. Установится новое состояние равновесия с новыми равновесными концентрациями исходных веществ и продуктов реакции. При уменьшении концентрации, например, одного из продуктов реакции, система отреагирует таким образом, чтобы концентрацию продукта увеличить. Преимущество получит прямая реакция, приводящая к увеличению концентрации продуктов реакции.
Влияние изменения давления на смещение химического равновесия.
Согласно принципу Ле Шателье повышение давления приводит к смещению равновесия в сторону образования меньшего количества газообразных частиц, т.е. в сторону меньшего объема.
Например, в обратимой реакции:
2NO 2(г) 2NO (г) + O 2(г)
из 2 моль NO 2 образуется 2 моль NO и 1 моль O 2 . Стехиометрические коэффициенты перед формулами газообразных веществ указывают, что протекание прямой реакции приводит к увеличению числа моль газов, а протекание обратной реакции, наоборот, уменьшает число моль газообразного вещества. Если на такую систему оказать внешнее воздействие путем, например, путем увеличения давления, то система отреагирует таким образом, чтобы это воздействие ослабить. Давление может снизиться, если равновесие данной реакции сместится в сторону меньшего числа молей газообразного вещества, а значит, и меньшего объема.
Стехиометрические коэффициенты перед формулами газообразных веществ указывают, что протекание прямой реакции приводит к увеличению числа моль газов, а протекание обратной реакции, наоборот, уменьшает число моль газообразного вещества. Если на такую систему оказать внешнее воздействие путем, например, путем увеличения давления, то система отреагирует таким образом, чтобы это воздействие ослабить. Давление может снизиться, если равновесие данной реакции сместится в сторону меньшего числа молей газообразного вещества, а значит, и меньшего объема.
Наоборот, повышение давления в этой системе связано со смещением равновесия вправо — в сторону разложения NO 2 , что увеличивает количество газообразного вещества.
Если число моль газообразных веществ до и после реакции остаетсяпостоянным, т.е. объем системы в ходе реакции не меняется, то изменение давления одинаково изменяет скорости прямой и обратной реакций и не оказывает влияния на состояние химического равновесия.
Например, в реакции:
H 2(г) + Cl 2(г) 2HCl (г) ,
общее количество моль газообразных веществ до и после реакции остается постоянным и давление в системе не меняется. Равновесие в данной системе при изменении давления не смещается.
Равновесие в данной системе при изменении давления не смещается.
Влияние изменения температуры на смещение химического равновесия.
В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому. Так в реакции синтеза аммиака прямая реакция — экзотермическая, а обратная реакция — эндотермическая.
N 2(г) + 3H 2(г) 2NH 3(г) + Q (-ΔH).
При изменении температуры изменяются скорости как прямой, так и обратной реакций, однако, изменение скоростей происходит не в одинаковой степени. В соответствии с уравнением Аррениуса в большей степени на изменение температуры реагирует эндотермическая реакция, характеризующаяся большим значением энергии активации.
Следовательно, для оценки влияния температуры на направление смещения химического равновесия необходимо знать тепловой эффект процесса. Его можно определить экспериментально, например, с помощью калориметра, или рассчитать на основе закона Г. Гесса . Следует отметить, что изменение температуры приводит к изменению величины константы химического равновесия (K p).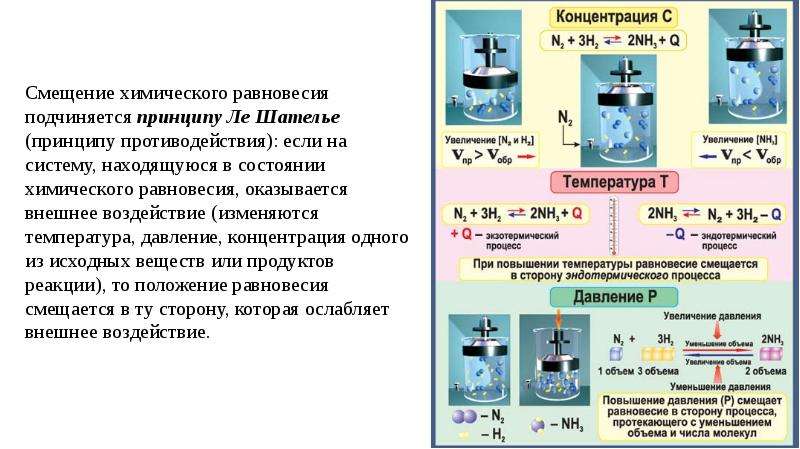
Согласно принципу Ле Шателье повышение температуры смещает равновесие в сторону эндотермической реакции. При понижении температуры равновесие смещается в направлении экзотермической реакции.
Таким образом, повышение температуры в реакции синтеза аммиака приведет к смещению равновесия в сторону эндотермической реакции, т.е. влево. Преимущество получает обратная реакция, протекающая с поглощением тепла.
Состояние, при котором скорости прямой и обратной реакций равны между собой, называется химическим равновесием. Уравнение обратимой реакции в общем виде:
Скорость прямой реакции v 1 =k 1 [A] m [B] n , скорость обратной реакции v 2 =k 2 [С] p [D] q , где в квадратных скобках – равновесные концентрации. По определению, при химическом равновесии v 1 =v 2, откуда
К с =k 1 /k 2 = [С] p [D] q / [A] m [B] n ,
где К с – константа химического равновесия, выраженная через молярные концентрации. Приведенное математическое выражение нередко называют законом действия масс для обратимой химической реакции: отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ.
Приведенное математическое выражение нередко называют законом действия масс для обратимой химической реакции: отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
Факторы, влияющие на химическое равновесие.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое — эндотермическому.
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
2. Влияние давления.
Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом.
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Вопросы для самоконтроля:
1. Что такое скорость химической реакции и от каких факторов она зависит? От каких факторов зависит константа скорости?
2. Составить уравнение скорости реакции образования воды из водорода и кислорода и показать, как измениться скорость, если концентрацию водорода увеличить в три раза.
Составить уравнение скорости реакции образования воды из водорода и кислорода и показать, как измениться скорость, если концентрацию водорода увеличить в три раза.
3. Как изменяется скорость реакции с течением времени? Какие реакции называются обратимыми? Чем характеризуется состояние химического равновесия? Что называется константой равновесия, от каких факторов она зависит?
4. Какими внешними воздействиями можно нарушить химическое равновесие? В каком направлении смешается равновесие при изменении температуры? Давления?
5. Каким образом можно сместить обратимую реакцию в определенном направлении и довести до конца?
Лекция № 12 (проблемная)
Растворы
Цель: Дать качественные заключения о растворимости веществ и количественную оценку растворимости.
Ключевые слова:
Растворы – гомогенные и гетерогенные;истинные и коллоидные; растворимость веществ; концентрация растворов; растворы неэлектроилов; законы Рауля и вант-Гоффа.
План.
1. Классификация растворов.
2. Концентрация растворов.
3. Растворы неэлектролитов. Законы Рауля.
Классификация растворов
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG
Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре. Растворы с меньшей концентрацией называются ненасыщенными.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
д.)
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
Концентрация растворов
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах:
где V i – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами *) .
Объемные проценты называют градусами *) .
*) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн –1), ppm.
Мольная доля растворенного вещества χ(B) выражается соотношением
Сумма мольных долей k компонентов раствора χ i равна единице
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества C m (B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.
Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м 3 , или чаще моль/литр:
где μ(B) – молярная масса B, V – объем раствора.
Молярная концентрация эквивалентов вещества B C Э (B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль/литр:
где n Э (B) – количество вещества эквивалентов, μ Э – молярная масса эквивалента.
Титр раствора вещества B(T B) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
Г/мл или г/мл.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (вода-бензол, вода-бутиловый спирт, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-BaSO 4 , вода-бензин).
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
1. Среди всех известных реакций различают реакции обратимые и необратимые. При изучении реакций ионного обмена были перечислены условия, при которых они протекают до конца. ().
Известны и такие реакции, которые при данных условиях до конца не идут. Так, например, при растворении в воде сернистого газа происходит реакция: SO 2 +H 2 O → H 2 SO 3 . Но оказывается, что в водном растворе может образоваться только определенное количество сернистой кислоты. Это объясняется тем, что сернистая кислота непрочная, и происходит обратная реакция, т.е. разложение на оксид серы и воду. Следовательно, данная реакция не идет до конца потому, что одновременно происходит две реакции – прямая (между оксидом серы и водой) и обратная (разложение сернистой кислоты). SO 2 +H 2 O ↔ H 2 SO 3 .
Химические реакции, протекающие при данных
условиях во взаимно противоположных направлениях, называются обратимыми.
2.
Поскольку скорость химических реакций зависит
от концентрации реагирующих веществ, то вначале скорость прямой реакции(υ
пр
) должна быть максимальной,а скорость обратной реакции (υ
обр
) равняется нулю. Концентрация реагирующих
веществ с течением времени уменьшается, а концентрация продуктов реакции
увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной
реакции увеличивается. В определенный момент времени скорость прямой и обратной
реакций становятся равными:
Концентрация реагирующих
веществ с течением времени уменьшается, а концентрация продуктов реакции
увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной
реакции увеличивается. В определенный момент времени скорость прямой и обратной
реакций становятся равными:
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия:
υ пр = υ обр
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
В состоянии химического
равновесия количественное соотношение между реагирующими веществами и
продуктами реакции остается постоянным: сколько молекул продукта реакции в
единицу времени образуется, столько их и разлагается. Однако состояние
химического равновесия сохраняется до тех пор, пока остаются неизменными
условия реакции: концентрация, температура и давление.
Количественно состояние химического равновесия описывается законом действующих масс.
При равновесии отношение произведения концентраций продуктов реакции (в степенях их коэффициентов) к произведению концентраций реагентов (тоже в степенях их коэффициентов) есть величина постоянная, не зависящая от исходных концентраций веществ в реакционной смеси.
Эта постоянная величина называется константой равновесия — k
Так для реакции: N 2 (Г) + 3 H 2 (Г) ↔ 2 NH 3 (Г) + 92,4 кДжконстанта равновесия выражается так:
υ 1 = υ 2
υ 1 (прямой реакции) = k 1 [ N 2 ][ H 2 ] 3 , где – равновесные молярные концентрации, = моль/л
υ 2 (обратной реакции) = k 2 [ NH 3 ] 2
k 1 [ N 2 ][ H 2 ] 3 = k 2 [ NH 3 ] 2
K p
=
k
1
/
k
2
= [
NH
3
] 2 / [
N
2
][
H
2
] 3 – константа равновесия
.
Химическое равновесие зависит – от концентрации, давления, температуры.
Принцип определяет направление смешения равновесия:
Если на систему, находящуюся в равновесии оказали внешнее воздействие, то равновесие в системе сместится в сторону обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
Например, K p = k 1 / k 2 = [ NH 3 ] 2 / [ N 2 ][ H 2 ] 3
При
добавлении в реакционную смесь, например
азота
,
т.е. возрастает концентрация реагента, знаменатель в выражении для К
увеличивается, но так как К – константа, то для выполнения этого условия должен
увеличиться и числитель. Таким образом, в реакционной смеси возрастает
количество продукта реакции. В таком случае говорят о смещении химического
равновесия вправо, в сторону продукта.
В таком случае говорят о смещении химического
равновесия вправо, в сторону продукта.
Таким образом, увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции. Увеличение концентрации продуктов (жидких или газообразных) смещает равновесие в сторону реагентов, т.е. в сторону обратной реакции.
Изменение массы твердого вещества не изменяет положение равновесия.
2) Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции.
а) N 2 (Г) + 3 H 2 (Г) ↔ 2 NH 3 (Г) + 92,4 кДж (экзотермическая – выделение тепла)
При повышении температуры равновесие сместится в сторону реакции разложения аммиака (←)
б) N 2 (Г) + O 2 (Г) ↔ 2 NO (Г) – 180,8 кДж(эндотермическая -поглощение тепла)
При повышении температуры равновесие сместится в сторону реакции образования NO (→)
3) Влияние давления (только для газообразных
веществ)
– при увеличении
давления, равновесие смещается в сторону образовани
я
веществ, занимающих меньший о
б
ъ
ём.
N 2 (Г) + 3 H 2 (Г) ↔ 2 NH 3 (Г)
1 V — N 2
3 V — H 2
2 V – NH 3
При повышении давления ( P ): до реакции 4 V газообразных веществ → после реакции 2 V газообразных веществ, следовательно, равновесие смещается вправо ( → )
При увеличении давления, например, в 2 раза, объём газов уменьшается в такое же количество раз, а следовательно, концентрации всех газообразных веществ возрастут в 2 раза. K p = k 1 / k 2 = [ NH 3 ] 2 / [ N 2 ][ H 2 ] 3
В этом случае числитель выражения для К
увеличится в 4
раза, а знаменатель в 16
раз, т. е. равенство нарушится. Для его восстановления должны возрасти
концентрация
аммиака
и
уменьшиться концентрации
азота
и
водо
рода. Равновесие сместится вправо.
е. равенство нарушится. Для его восстановления должны возрасти
концентрация
аммиака
и
уменьшиться концентрации
азота
и
водо
рода. Равновесие сместится вправо.
Итак, при повышении давления равновесие смещается в сторону уменьшения объема, при понижении давления – в сторону увеличения объёма.
Изменение давления практически не сказывается на объёме твердых и жидких веществ, т.е. не изменяет их концентрацию. Следовательно, равновесие реакций, в которых газы не участвуют, практически не зависит от давления.
! На течение химической реакции влияют вещества – катализаторы. Но при использовании катализатора понижается энергия активации как прямой, так и обратной реакции на одну и ту же величину и поэтому равновесие не смещается.
Решите задачи:
№1. Исходные концентрации СO и O 2 в обратимой реакции
2CO (г) + O 2 (г)↔ 2 CO 2 (г)
Равны соответственно 6
и 4 моль/л. Вычислите константу равновесия, если концентрация CO
2 в момент
равновесия равна 2 моль/л.
Вычислите константу равновесия, если концентрация CO
2 в момент
равновесия равна 2 моль/л.
№2. Реакция протекает по уравнению
2SO 2 (г) + O 2 (г) = 2SO 3 (г) + Q
Укажите, куда сместится равновесие, если
а) увеличить давление
б) повысить температуру
в) увеличить концентрацию кислорода
г) введение катализатора?
Химическое равновесие, подготовка к ЕГЭ по химии
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать
внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону.
Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) — Q
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) — Q
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при
уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Принцип Ле Шателье Основы — Химия LibreTexts
Принцип Ле Шателье утверждает, что если динамическое равновесие нарушается изменением условий, положение равновесия смещается, чтобы противодействовать изменению и восстановить равновесие. Если химическая реакция находится в равновесии и испытывает изменение давления, температуры или концентрации продуктов или реагентов, равновесие смещается в противоположном направлении, чтобы компенсировать это изменение. На этой странице рассматриваются изменения положения равновесия из-за таких изменений и кратко обсуждается, почему катализаторы не влияют на положение равновесия.
Если химическая реакция находится в равновесии и испытывает изменение давления, температуры или концентрации продуктов или реагентов, равновесие смещается в противоположном направлении, чтобы компенсировать это изменение. На этой странице рассматриваются изменения положения равновесия из-за таких изменений и кратко обсуждается, почему катализаторы не влияют на положение равновесия.
Введение
Действие, которое изменяет температуру, давление или концентрацию реагентов в системе, находящейся в равновесии, стимулирует реакцию, которая частично компенсирует изменение, пока устанавливается новое состояние равновесия (2). Следовательно, принцип Ле Шателье гласит, что любое изменение в системе, находящейся в равновесии, будет корректироваться, чтобы компенсировать это изменение. В 1884 году французский химик и инженер Анри-Луи Ле Шателье предложил одну из центральных концепций химического равновесия, которая описывает, что происходит с системой, когда что-то ненадолго выводит ее из состояния равновесия.
Важно понимать, что принцип Ле Шателье является лишь полезным руководством для определения того, что происходит, когда условия изменяются в реакции, находящейся в динамическом равновесии; это не , а не дает причины изменений на молекулярном уровне (например, временной масштаб изменений и основной механизм реакции).
Изменения концентрации
Принцип Ле Шателье гласит, что если система изменяется таким образом, что увеличивается концентрация одного из реагирующих веществ, это должно способствовать реакции, в которой потребляется это вещество.Другими словами, если количество продуктов увеличивается, коэффициент реакции \(Q_c\) увеличивается, что делает его больше, чем константа равновесия \(K_c\). Рассмотрим равновесие, установившееся между четырьмя веществами \(A\), \(B\), \(C\) и \(D\):
\[ A + 2B \rightleftharpoons C + D\]
Увеличение концентрации
Что произойдет, если изменить условия за счет увеличения концентрации А?
Согласно Ле Шателье, положение равновесия сдвинется таким образом, чтобы противодействовать изменению. В этом случае положение равновесия сместится так, что концентрация А снова уменьшится за счет реакции его с В с образованием большего количества С и D. Равновесие сместится вправо (обозначено зеленой стрелкой ниже).
В этом случае положение равновесия сместится так, что концентрация А снова уменьшится за счет реакции его с В с образованием большего количества С и D. Равновесие сместится вправо (обозначено зеленой стрелкой ниже).
В практическом смысле это полезный способ преобразования максимально возможного количества B в C и D; это выгодно, если, например, В является относительно дорогим материалом, тогда как А дешев и доступен в изобилии.
Уменьшение концентрации
В противоположном случае, когда концентрация А уменьшается, согласно Ле Шателье, положение равновесия сдвинется так, что концентрация А снова возрастет.Больше C и D будут реагировать, чтобы заменить удаленный A. Положение равновесия смещается влево.
По сути, это происходит, если один из продуктов удаляется сразу после его образования. Если, например, C удалить таким образом, положение равновесия сместится вправо, чтобы заменить его. Если его постоянно удалять, положение равновесия смещается все дальше и дальше вправо, фактически создавая одностороннюю необратимую реакцию.
Изменения давления
Это относится только к реакциям с участием газов, хотя не обязательно, чтобы все вещества, участвующие в реакции, находились в газовой фазе.Общая гомогенная газообразная реакция приведена ниже:
\[ A(g) + 2B(g) \rightleftharpoons C(g) + D(g)\]
Повышение давления
Согласно Ле Шателье, если давление увеличить, положение равновесия сдвинется так, что давление снова уменьшится. Давление создается молекулами газа, ударяющимися о стенки сосуда. Чем больше молекул в сосуде, тем выше будет давление. Система может снизить давление, реагируя таким образом, чтобы производить меньше молекул.
В этом случае в левой части уравнения три родинки, а в правой только две. Формируя больше C и D, система вызывает снижение давления. Увеличение давления при газовой реакции смещает положение равновесия в сторону с меньшим количеством молей молекул газа.
Пример 1: Процесс Габера
\[ N_2 + 3H_2 \rightleftгарпуны 2NH_3 \]
Если эту смесь перелить из колбы на 1,5 л в колбу на 5 л, в каком направлении произойдет чистое изменение, чтобы вернуться к равновесию?
Раствор
Поскольку объем увеличивается (и, следовательно, давление уменьшается), сдвиг происходит в направлении образования большего количества молей газа. Для восстановления равновесия сдвиг должен произойти влево, в сторону обратной реакции.
Для восстановления равновесия сдвиг должен произойти влево, в сторону обратной реакции.
Снижение давления
Равновесие сдвинется так, что давление снова увеличится. Он может сделать это, производя больше газообразных молекул. В этом случае положение равновесия сдвинется в левую часть реакции.
Что произойдет, если по обе стороны равновесной реакции окажется одинаковое количество молекул?
В этом случае увеличение давления не влияет на положение равновесия.Поскольку с обеих сторон одинаковое количество молекул, равновесие не может измениться так, чтобы давление снова уменьшилось. Опять же, это не является строгим объяснением того, почему положение равновесия движется описанным образом. Математическая обработка объяснения может быть найдена на этой странице.
Обзор эффектов давления
Три способа изменить давление равновесной смеси: 1. Добавить или удалить газообразный реагент или продукт, 2. Добавить инертный газ в реакционную смесь постоянного объема или 3. Измените громкость системы.
Измените громкость системы.
- Добавление продуктов делает \(Q_c\) больше, чем \(K_c\). Это создает чистое изменение в обратном направлении, в сторону реагентов. Обратное происходит при добавлении большего количества реагентов.
- Добавление инертного газа к равновесию газовой фазы при постоянном объеме не приводит к сдвигу. Это связано с тем, что добавление нереакционноспособного газа не изменяет парциальные давления других газов в контейнере. В то время как общее давление в системе увеличивается, полное давление не оказывает никакого влияния на константу равновесия.
- Когда объем смеси уменьшается, чистое изменение происходит в направлении образования меньшего количества молей газа. При увеличении объема изменение происходит в направлении, при котором образуется еще молей газа.
Изменения температуры
Чтобы понять, как изменения температуры влияют на условия равновесия, необходимо знать знак энтальпии реакции. Предположим, что прямая реакция экзотермическая (выделяется тепло):
Предположим, что прямая реакция экзотермическая (выделяется тепло):
В этой реакции выделяется 250 кДж (обозначено знаком минус), когда 1 моль А полностью реагирует с 2 молями В.Для обратимых реакций значение энтальпии всегда дается так, как если бы реакция была односторонней в прямом направлении. Обратная реакция (превращение C и D в A и B) будет эндотермической, поглощая такое же количество тепла.
Основное влияние температуры на равновесие заключается в изменении значения константы равновесия.
Температура не является ни реагентом, ни продуктом
Нередко учебники и преподаватели рассматривают теплоту как самостоятельный «вид» реакции.Хотя это совершенно неверно, потому что нельзя «добавлять или отводить тепло» к реакции, как в случае с частицами, это служит удобным механизмом для предсказания сдвига реакций при изменении температуры. Например, если теплота является «реагентом» (\(\Delta{H} > 0 \)), то реакция способствует образованию продуктов при повышенной температуре. Точно так же, если теплота является «продуктом» (\(\Delta{H} < 0 \)), то реакция способствует образованию реагентов. Более точное и, следовательно, предпочтительное описание обсуждается ниже.
Точно так же, если теплота является «продуктом» (\(\Delta{H} < 0 \)), то реакция способствует образованию реагентов. Более точное и, следовательно, предпочтительное описание обсуждается ниже.
Повышение температуры
Если температуру повысить, то положение равновесия сдвинется так, что температура снова понизится. Предположим, что система находится в равновесии при 300°С, а температура повысилась на 500°С. Чтобы остыть, он должен поглотить дополнительное тепло. В данном случае обратной реакцией является та, при которой поглощается тепло. Таким образом, положение равновесия смещается влево. Новая равновесная смесь содержит больше А и В и меньше С и D.
Если цель состоит в том, чтобы максимизировать количество образующихся C и D, повышение температуры обратимой реакции, в которой прямая реакция является экзотермической, является плохим подходом.
Снижение температуры?
Равновесие сдвинется так, что температура снова повысится. Предположим, что система находится в равновесии при 500°С, а температура снижается до 400°С. Реакция будет иметь тенденцию снова нагреваться, чтобы вернуться к исходной температуре, благоприятствуя экзотермической реакции.Положение равновесия сдвинется вправо с большим количеством \(A\) и \(B\), преобразованных в \(C\) и \(D\) при более низкой температуре:
Предположим, что система находится в равновесии при 500°С, а температура снижается до 400°С. Реакция будет иметь тенденцию снова нагреваться, чтобы вернуться к исходной температуре, благоприятствуя экзотермической реакции.Положение равновесия сдвинется вправо с большим количеством \(A\) и \(B\), преобразованных в \(C\) и \(D\) при более низкой температуре:
Пример 2
Рассмотрим образование воды
\[O_2 + 2H_2 \rightleftгарпуны 2H_2O\;\;\; \Дельта{Н}= -125,7\, кДж\]
- Какая сторона реакции предпочтительнее? Поскольку теплота является продуктом реакции, предпочтение отдается реагентам.
- Будет ли превращению \(O_2\) и \(H_2\) в \(H_2O\) способствовать теплота в качестве продукта или реагента? Тепло как продукт сдвигает реакцию вперед, создавая \(H_2O\).Чем больше тепла добавляется к реакции, тем больше образуется \(H_2O\)
Обзор температурных эффектов
- Повышение температуры системы, находящейся в динамическом равновесии, способствует протеканию эндотермической реакции.
 Система противодействует изменению, поглощая дополнительное тепло.
Система противодействует изменению, поглощая дополнительное тепло. - Снижение температуры системы, находящейся в динамическом равновесии, способствует протеканию экзотермической реакции. Система противодействует этому изменению, производя больше тепла.
Катализаторы
Добавление катализатора абсолютно не меняет положения равновесия, и принцип Ле Шателье здесь неприменим.Это связано с тем, что катализатор ускоряет прямую и обратную реакции в одинаковой степени, а добавление катализатора не влияет на относительные скорости двух реакций, он не может повлиять на положение равновесия.
Однако катализаторы имеют некоторое применение в равновесных системах. Для установления динамического равновесия скорости прямой и обратной реакции должны быть равны. Это не происходит мгновенно, а при очень медленных реакциях на это могут уйти годы! Катализатор увеличивает скорость, с которой реакция достигает динамического равновесия.
Пример 3
Вы можете попытаться представить, сколько времени потребуется для установления динамического равновесия, если вы возьмете визуальную модель на вводной странице и уменьшите вероятность изменения цвета в 1000 раз — с 3 из 6 до 3 из 6000 и с 1 в 6 к 1 из 6000. Начав с синих квадратов, к концу времени, потраченного на примеры на этой странице, вы, скорее всего, все еще будете иметь полностью синие квадраты. Однако в конце концов вы получите тот же вид узоров, что и раньше, — содержащий 25% синих и 75% оранжевых квадратов.
Начав с синих квадратов, к концу времени, потраченного на примеры на этой странице, вы, скорее всего, все еще будете иметь полностью синие квадраты. Однако в конце концов вы получите тот же вид узоров, что и раньше, — содержащий 25% синих и 75% оранжевых квадратов.
Проблемы
1. Изменение концентрации
Что произойдет с равновесием, если в следующую систему добавить больше 2SO 2 (g)?
\[2SO_2(g) + O_2(g) \rightleftharpoons 2SO_3(g) \]
Решение:
Добавление большего количества реагентов смещает равновесие в сторону продуктов; следовательно, равновесие смещается вправо.
В целом, концентрация \(2SO_2\) от начального равновесия к конечному равновесию будет увеличиваться, потому что будет израсходована только часть добавленного количества \(2SO_2\).
Концентрация \(O_2\) уменьшится, поскольку по мере восстановления равновесия \(O_2\) расходуется вместе с \(2SO_2\) для создания большего количества \(2SO_3\). Концентрация \(2SO_3\) будет больше, потому что ни одна из них не теряется, а генерируется больше.
Концентрация \(2SO_3\) будет больше, потому что ни одна из них не теряется, а генерируется больше.
2. Переменное давление
Что произойдет с равновесием, когда объем системы уменьшится?
\[2SO_{2(g)} + O_{2(g)} \rightleftharpoons 2SO_{3(g)}\]
Решение:
Уменьшение объема приводит к увеличению давления, что приводит к смещению равновесия в сторону с меньшим количеством молей.В этом примере 3 моля со стороны реагента и 2 моля со стороны продукта, поэтому новое равновесие сместится в сторону продуктов (вправо).
3. Изменение температуры
Что произойдет с равновесием при понижении температуры системы?
\[N_{2(g)} + O_{2(g)} \rightleftharpoons 2NO_{(g)} \;\;\;\; \Дельта{Н} = 180,5\; кДж\]
Решение
Поскольку \(\Delta{H}\) положителен, реакция является эндотермической в прямом направлении.Удаление тепла из системы заставляет равновесие сместиться в сторону экзотермической реакции, поэтому произойдет обратная реакция и будет произведено больше реагентов.
Ссылки
- Полинг, Л., Колледж химии, 3-е изд., Фримен, Сан-Франциско, Калифорния, 1964.
- Петруччи, Р., Харвуд, В., Херринг, Ф., Мадура, Дж., Общая химия, 9-е изд., Пирсон, Нью-Джерси, 1993.
- www.jce.divched.org/Journal/I…2N08/p1190.pdf
- Хаддл, Бенджамин П.«Концептуальные вопросы» принципа Ле-Шателье». J. Chem. Educ. 1998 75 1175.
- Томсен, Фолькер Б. Е. « Принцип Ле Шателье в науках». J. Chem. Образовательный 2000 77 173.
Авторы и авторство
Принцип Ле Шателье – Химия
Цели обучения
К концу этого раздела вы сможете:
- Описать способы воздействия на равновесную систему
- Предсказать реакцию равновесия в напряженном состоянии, используя принцип Ле Шателье
Как мы видели в предыдущем разделе, реакции идут в обоих направлениях (реагенты переходят в продукты, а продукты переходят в реагенты). Мы можем сказать, что реакция находится в равновесии, если отношение реакции ( Q ) равно константе равновесия ( K ). Далее мы рассмотрим, что происходит, когда система, находящаяся в равновесии, нарушается так, что 90 202 Q 90 203 больше не равно 90 202 K 90 203 . Если система, находящаяся в равновесии, подвергается возмущению или стрессу (например, изменению концентрации), положение равновесия изменяется. Поскольку это напряжение влияет на концентрации реагентов и продуктов, значение Q больше не будет равно значению К .Чтобы восстановить равновесие, система будет либо сдвигаться в сторону продуктов (если 90 202 Q < 90 203 К), либо реагентов (если Q > 90 202 К 90 203 ) до тех пор, пока 90 202 Q 90 203 не вернется к тому же значению, что и 90 202 К 90 203 .
Мы можем сказать, что реакция находится в равновесии, если отношение реакции ( Q ) равно константе равновесия ( K ). Далее мы рассмотрим, что происходит, когда система, находящаяся в равновесии, нарушается так, что 90 202 Q 90 203 больше не равно 90 202 K 90 203 . Если система, находящаяся в равновесии, подвергается возмущению или стрессу (например, изменению концентрации), положение равновесия изменяется. Поскольку это напряжение влияет на концентрации реагентов и продуктов, значение Q больше не будет равно значению К .Чтобы восстановить равновесие, система будет либо сдвигаться в сторону продуктов (если 90 202 Q < 90 203 К), либо реагентов (если Q > 90 202 К 90 203 ) до тех пор, пока 90 202 Q 90 203 не вернется к тому же значению, что и 90 202 К 90 203 .
Этот процесс описывается принципом Ле Шателье: когда химическая система, находящаяся в равновесии, нарушается, она возвращается к равновесию, противодействуя возмущению. Как описано в предыдущем абзаце, возмущение вызывает изменение Q ; реакция сместится, чтобы восстановить Q = K .
Как описано в предыдущем абзаце, возмущение вызывает изменение Q ; реакция сместится, чтобы восстановить Q = K .
Принцип Ле Шателье можно использовать для прогнозирования изменений равновесных концентраций, когда система, находящаяся в равновесии, подвергается воздействию нагрузки. Однако, если у нас есть смесь реагентов и продуктов, которые еще не достигли равновесия, изменения, необходимые для достижения равновесия, могут быть не столь очевидны. В таком случае мы можем сравнить значения Q и K для системы, чтобы предсказать изменения.
Влияние изменения концентрации на равновесие
Химическая система, находящаяся в равновесии, может быть временно выведена из равновесия добавлением или удалением одного или нескольких реагентов или продуктов.Затем концентрации как реагентов, так и продуктов претерпевают дополнительные изменения, чтобы вернуть систему в равновесие.
Нагрузка на систему на рисунке 1 представляет собой уменьшение равновесной концентрации SCN — (снижение концентрации одного из реагентов приведет к тому, что Q будет больше, чем K ). Как следствие, принцип Ле Шателье позволяет нам предсказать, что концентрация Fe(SCN) 2+ должна уменьшиться, частично увеличив концентрацию SCN − до исходной концентрации и увеличив концентрацию Fe 3 + выше его начальной равновесной концентрации.
Как следствие, принцип Ле Шателье позволяет нам предсказать, что концентрация Fe(SCN) 2+ должна уменьшиться, частично увеличив концентрацию SCN − до исходной концентрации и увеличив концентрацию Fe 3 + выше его начальной равновесной концентрации.
 {\circ}\text{C}[/latex]
{\circ}\text{C}[/latex]
Числовые значения для этого примера были определены экспериментально.Смесь газов при 400 °C с [H 2 ] = [I 2 ] = 0,221 M и [HI] = 1,563 M находится в равновесии; для этой смеси Q c = K c = 50,0. Если H 2 ввести в систему так быстро, что его концентрация удвоится до того, как он начнет реагировать (новое [H 2 ] = 0,442 M ), реакция сместится так, что будет достигнуто новое равновесие, при котором [Н 2 ] = 0.2}{(0,374)(0,153)} = 50,0 = K_c[/латекс]
Мы усилили эту систему, введя дополнительные H 2 . Напряжение снимается, когда реакция смещается вправо, расходуя часть (но не весь) избыток H 2 , уменьшая количество несвязанного I 2 и образуя дополнительный HI.
Влияние изменения давления на равновесие
Иногда мы можем изменить положение равновесия, изменив давление в системе.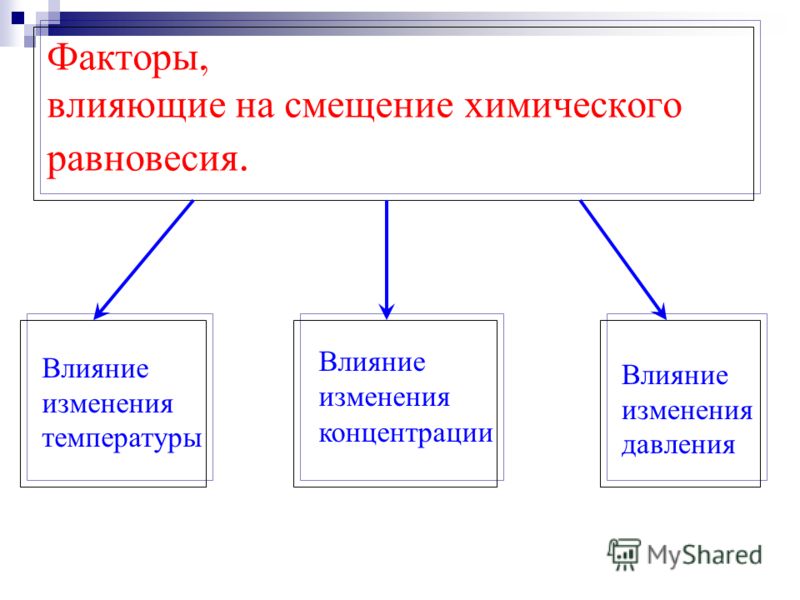 Однако изменения давления имеют измеримый эффект только в системах, в которых участвуют газы, и то только тогда, когда химическая реакция вызывает изменение общего числа молекул газа в системе.Простой способ распознать такую систему — найти разное количество молей газа на сторонах реагента и продукта равновесия. При оценке давления (а также связанных с ним факторов, таких как объем) важно помнить, что константы равновесия определяются относительно концентрации (для K c ) или парциального давления (для K P ). Некоторые изменения общего давления, такие как добавление инертного газа, который не является частью равновесия, изменят общее давление, но не парциальные давления газов в выражении константы равновесия.Таким образом, добавление газа, не участвующего в равновесии, не нарушит равновесия.
Однако изменения давления имеют измеримый эффект только в системах, в которых участвуют газы, и то только тогда, когда химическая реакция вызывает изменение общего числа молекул газа в системе.Простой способ распознать такую систему — найти разное количество молей газа на сторонах реагента и продукта равновесия. При оценке давления (а также связанных с ним факторов, таких как объем) важно помнить, что константы равновесия определяются относительно концентрации (для K c ) или парциального давления (для K P ). Некоторые изменения общего давления, такие как добавление инертного газа, который не является частью равновесия, изменят общее давление, но не парциальные давления газов в выражении константы равновесия.Таким образом, добавление газа, не участвующего в равновесии, не нарушит равновесия.
Перейдите по этой ссылке, чтобы увидеть наглядную демонстрацию того, как равновесие меняется при изменении давления.
По мере того, как мы увеличиваем давление газообразной системы, находящейся в равновесии, либо уменьшая объем системы, либо добавляя больше одного из компонентов равновесной смеси, мы вводим напряжение, увеличивая парциальные давления одного или нескольких компонентов. компоненты.В соответствии с принципом Ле-Шателье сдвиг равновесия, уменьшающий общее число молекул в единице объема, будет предпочтительным, поскольку это снимает напряжение. Обратная реакция будет благоприятствовать понижению давления.
компоненты.В соответствии с принципом Ле-Шателье сдвиг равновесия, уменьшающий общее число молекул в единице объема, будет предпочтительным, поскольку это снимает напряжение. Обратная реакция будет благоприятствовать понижению давления.
Рассмотрим, что происходит, когда мы увеличиваем давление в системе, в которой NO, O 2 и NO 2 находятся в равновесии:
[латекс]2\текст{NO}(г)\;+\;\текст{O}_2(г)\;{\rightleftharpoons}\;2\текст{NO}_2(г)[/латекс]
Образование дополнительных количеств NO 2 уменьшает общее количество молекул в системе, поскольку при каждом образовании двух молекул NO 2 расходуется всего три молекулы NO и O 2 .Это снижает общее давление, создаваемое системой, и уменьшает, но не снимает полностью напряжение повышенного давления. С другой стороны, снижение давления в системе способствует распаду NO 2 на NO и O 2 , что способствует восстановлению давления.
Теперь рассмотрим эту реакцию:
[латекс]\текст{N}_2(г)\;+\;\текст{О}_2(г)\;{\rightleftharpoons}\;2\текст{НЕТ}(г)[/латекс]
Поскольку в ходе реакции общее число молекул в системе не изменяется, изменение давления не способствует ни образованию, ни разложению газообразного монооксида азота.
Влияние изменения температуры на равновесие
Изменение концентрации или давления нарушает равновесие, потому что отношение реакции смещается от равновесного значения. Изменение температуры системы, находящейся в равновесии, имеет другой эффект: изменение температуры фактически изменяет значение константы равновесия. Однако мы можем качественно предсказать влияние изменения температуры, рассматривая его как напряжение в системе и применяя принцип Ле Шателье.
При взаимодействии водорода с газообразным йодом выделяется тепло.
[латекс]\текст{H}_2(g)\;+\;\text{I}_2(g)\;{\rightleftharpoons}\;2\text{HI}(g)\;\;\; \;\;\;\;{\Delta}H = -9,4\;\text{кДж\;(экзотермический)}[/латекс]
Поскольку эта реакция является экзотермической, мы можем записать ее как произведение тепла.
[латекс]\текст{H}_2(g)\;+\;\text{I}_2(g)\;{\rightleftharpoons}\;2\text{HI}(g)\;+\;\ текст{тепло}[/латекс]
Повышение температуры реакции увеличивает внутреннюю энергию системы. Таким образом, повышение температуры приводит к увеличению количества одного из продуктов этой реакции. Реакция смещается влево для снятия напряжения, наблюдается увеличение концентрации H 2 и I 2 и снижение концентрации HI. Понижение температуры этой системы снижает количество имеющейся энергии, способствует выработке тепла и способствует образованию йодистого водорода.
Таким образом, повышение температуры приводит к увеличению количества одного из продуктов этой реакции. Реакция смещается влево для снятия напряжения, наблюдается увеличение концентрации H 2 и I 2 и снижение концентрации HI. Понижение температуры этой системы снижает количество имеющейся энергии, способствует выработке тепла и способствует образованию йодистого водорода.
Когда мы меняем температуру системы, находящейся в равновесии, изменяется константа равновесия реакции.Понижение температуры в системе HI увеличивает константу равновесия: при новом равновесии концентрация HI увеличилась, а концентрации H 2 и I 2 уменьшились. Повышение температуры уменьшает значение константы равновесия с 67,5 при 357 °С до 50,0 при 400 °С.
Температура влияет на равновесие между NO 2 и N 2 O 4 в этой реакции
[латекс]\текст{N}_2\текст{O}_4(г)\;{\rightleftharpoons}\;2\текст{NO}_2(г)\;\;\;\;\;\;\ ;{\Дельта}H = 57. 20\;\text{кДж}[/латекс]
20\;\text{кДж}[/латекс]
Положительное значение Δ H говорит нам о том, что реакция является эндотермической и может быть записано как
[латекс]\текст{тепло}\;+\;\текст{N}_2\текст{O}_4(g)\;{\rightleftharpoons}\;2\text{NO}_2(g)[/latex ]
При более высоких температурах газовая смесь имеет темно-коричневый цвет, что свидетельствует о значительном количестве коричневых молекул NO 2 . Если, однако, мы нагружаем систему, охлаждая смесь (забирая энергию), равновесие смещается влево, чтобы компенсировать часть энергии, потерянной при охлаждении.Концентрация бесцветного N 2 O 4 увеличивается, а концентрация коричневого NO 2 уменьшается, что приводит к исчезновению коричневого цвета.
Эта интерактивная анимация позволяет применить принцип Ле Шателье для прогнозирования влияния изменений концентрации, давления и температуры на концентрации реагентов и продуктов.
Как мы узнали во время изучения кинетики, катализатор может увеличить скорость реакции. Хотя это увеличение скорости реакции может привести к более быстрому достижению равновесия системы (за счет ускорения прямой и обратной реакций), катализатор не влияет ни на значение константы равновесия, ни на равновесные концентрации.
Хотя это увеличение скорости реакции может привести к более быстрому достижению равновесия системы (за счет ускорения прямой и обратной реакций), катализатор не влияет ни на значение константы равновесия, ни на равновесные концентрации.
Взаимодействие изменений концентрации или давления, температуры и отсутствия влияния катализатора на химическое равновесие иллюстрируется промышленным синтезом аммиака из азота и водорода по уравнению
[латекс]\текст{N}_2(г)\;+\;3\текст{Н}_2(г)\;{\rightleftharpoons}\;2\текст{NH}_3(г)[/латекс]
В результате этой реакции производится большое количество аммиака. Каждый год аммиак входит в десятку крупнейших по массе химических веществ, производимых в мире.Ежегодно в США производится около 2 миллиардов фунтов.
Аммиак играет жизненно важную роль в нашей глобальной экономике. Он используется в производстве удобрений и сам по себе является важным удобрением для выращивания кукурузы, хлопка и других культур. Большие количества аммиака превращаются в азотную кислоту, которая играет важную роль в производстве удобрений, взрывчатых веществ, пластмасс, красителей и волокон, а также используется в сталелитейной промышленности.
Фриц Хабер
В начале 20-го века немецкий химик Фриц Габер (рис. 2) разработал практический процесс преобразования двухатомного азота, который не может использоваться растениями в качестве питательного вещества, в аммиак, форму азота, которую растения легче усваивают.
[латекс]\текст{N}_2(г)\;+\;3\текст{Н}_2(г)\;{\leftrightharpoons}\;2\текст{NH}_3(г)[/латекс]
Доступность азота является сильным ограничивающим фактором для роста растений. Несмотря на то, что он составляет 78% воздуха, двухатомный азот (N 2 ) недоступен для питания из-за огромной стабильности тройной связи азот-азот. Чтобы растения могли использовать атмосферный азот, азот должен быть преобразован в более биодоступную форму (это преобразование называется фиксацией азота).
Габер родился в Бреслау, Пруссия (ныне Вроцлав, Польша), в декабре 1868 года. Он продолжил изучать химию и, работая в Университете Карлсруэ, разработал то, что позже стало известно как процесс Габера: каталитическое образование аммиака. из водорода и атмосферного азота при высоких температурах и давлениях. За эту работу Габер был удостоен Нобелевской премии по химии 1918 года за синтез аммиака из его элементов. Процесс Габера был благом для сельского хозяйства, поскольку он позволил больше не зависеть от добываемого сырья, такого как нитрат натрия, при производстве удобрений.В настоящее время годовой объем производства синтетических азотных удобрений превышает 100 млн тонн, а производство синтетических удобрений увеличило количество людей, которых пахотные земли могут прокормить, с 1,9 человека на гектар в 1908 году до 4,3 человека на гектар в 2008 году.
из водорода и атмосферного азота при высоких температурах и давлениях. За эту работу Габер был удостоен Нобелевской премии по химии 1918 года за синтез аммиака из его элементов. Процесс Габера был благом для сельского хозяйства, поскольку он позволил больше не зависеть от добываемого сырья, такого как нитрат натрия, при производстве удобрений.В настоящее время годовой объем производства синтетических азотных удобрений превышает 100 млн тонн, а производство синтетических удобрений увеличило количество людей, которых пахотные земли могут прокормить, с 1,9 человека на гектар в 1908 году до 4,3 человека на гектар в 2008 году.
Помимо работы в области производства аммиака, Габер также известен в истории как один из отцов химического оружия.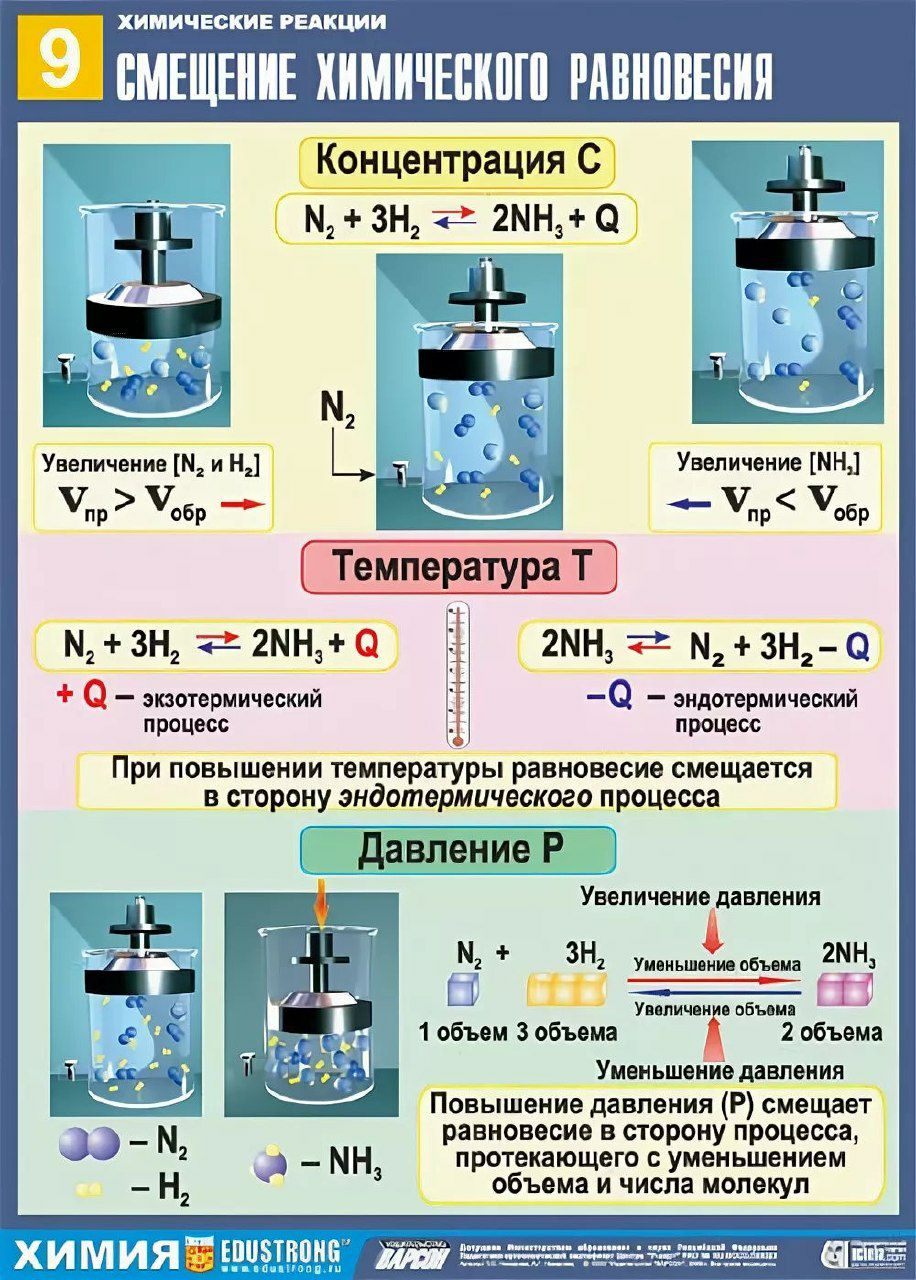 Во время Первой мировой войны он сыграл важную роль в разработке отравляющих газов, используемых для позиционной войны. Что касается его роли в этих разработках, Хабер сказал: «В мирное время ученый принадлежит миру, но в военное время он принадлежит своей стране». Хабер защищал использование газовой войны от обвинений в бесчеловечности, говоря, что смерть есть смерть, какими бы средствами она ни была нанесена. Он служит примером этических дилемм, с которыми сталкиваются ученые во время войны, и обоюдоострым характером меча науки.
Во время Первой мировой войны он сыграл важную роль в разработке отравляющих газов, используемых для позиционной войны. Что касается его роли в этих разработках, Хабер сказал: «В мирное время ученый принадлежит миру, но в военное время он принадлежит своей стране». Хабер защищал использование газовой войны от обвинений в бесчеловечности, говоря, что смерть есть смерть, какими бы средствами она ни была нанесена. Он служит примером этических дилемм, с которыми сталкиваются ученые во время войны, и обоюдоострым характером меча науки.
Как и Haber, изделия из аммиака могут быть многогранными. В дополнение к их ценности для сельского хозяйства соединения азота также могут быть использованы для достижения разрушительных целей. Нитрат аммония также использовался во взрывчатых веществах, включая самодельные взрывные устройства. Нитрат аммония был одним из компонентов бомбы, использованной при нападении на Федеральное здание Альфреда П. Мурра в центре Оклахома-Сити 19 апреля 1995 года.
Давно известно, что азот и водород вступают в реакцию с образованием аммиака. Однако производство аммиака в полезных количествах путем реакции азота и водорода стало возможным только в начале 20 века после того, как были поняты факторы, влияющие на его равновесие.
Однако производство аммиака в полезных количествах путем реакции азота и водорода стало возможным только в начале 20 века после того, как были поняты факторы, влияющие на его равновесие.
Чтобы быть практичным, промышленный процесс должен давать большой выход продукта относительно быстро. Одним из способов увеличения выхода аммиака является повышение давления в системе, в которой N 2 , H 2 и NH 3 находятся в равновесии или приближаются к равновесию.
[латекс]\текст{N}_2(г)\;+\;3\текст{Н}_2(г)\;{\rightleftharpoons}\;2\текст{NH}_3(г)[/латекс]
Образование дополнительных количеств аммиака снижает общее давление, создаваемое системой, и несколько уменьшает напряжение повышенного давления.
Хотя увеличение давления смеси N 2 , H 2 и NH 3 увеличивает выход аммиака, при низких температурах скорость образования аммиака низкая. Например, при комнатной температуре реакция настолько медленная, что если бы мы приготовили смесь N 2 и H 2 , в течение нашей жизни не образовалось бы заметного количества аммиака.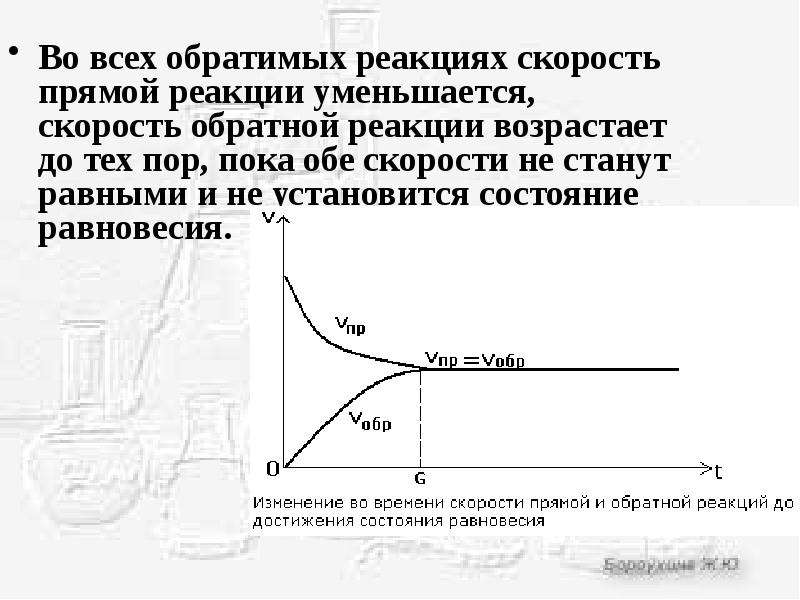 Образование аммиака из водорода и азота — экзотермический процесс:
Образование аммиака из водорода и азота — экзотермический процесс:
[латекс]\текст{N}_2(г)\;+\;3\текст{H}_2(г)\;{\longrightarrow}\;2\текст{NH}_3(г)\;\; \;\;\;\;\;{\Delta}H = -92,2\;\text{кДж}[/латекс]
Таким образом, повышение температуры для увеличения скорости снижает выход. Если мы понизим температуру, чтобы сместить равновесие в сторону образования большего количества аммиака, равновесие будет достигнуто медленнее из-за значительного снижения скорости реакции при понижении температуры.
Часть скорости образования, потерянной при работе при более низких температурах, может быть восстановлена с помощью катализатора. Чистый эффект катализатора на реакцию заключается в более быстром достижении равновесия.
В коммерческом производстве аммиака условия около 500 °C, 150–900 атм и присутствие катализатора используются для получения наилучшего компромисса между скоростью, выходом и стоимостью оборудования, необходимого для производства и содержания -газы под давлением при высоких температурах (рис. 3).
3).
Системы, находящиеся в равновесии, могут быть нарушены изменениями температуры, концентрации и, в некоторых случаях, объема и давления; изменения объема и давления будут нарушать равновесие, если количество молей газа различно на стороне реагента и продукта реакции. Реакция системы на эти возмущения описывается принципом Ле Шателье: система будет реагировать таким образом, чтобы противодействовать возмущению.Не все изменения в системе приводят к нарушению равновесия. Добавление катализатора влияет на скорость реакции, но не изменяет равновесие, а изменение давления или объема не приведет к значительному нарушению систем без газов или с равным количеством молей газа на стороне реагента и продукта.
| Нарушение | Наблюдаемое изменение по мере восстановления равновесия | Направление переключения | Влияние на К |
|---|---|---|---|
| добавленный реагент | добавленный реагент частично израсходован | к продуктам | нет |
| товар добавлен | добавленный продукт частично израсходован | по отношению к реагентам | нет |
| уменьшение объема/повышение давления газа | давление снижается | в сторону с меньшим количеством молей газа | нет |
| увеличение объема/уменьшение давления газа | давление увеличивается | в сторону с большим количеством молей газа | нет |
| повышение температуры | тепло поглощается | к продуктам для эндотермических, к реагентам для экзотермических | изменений |
| снижение температуры | выделяется тепло | к реагентам для эндотермических, к продуктам для экзотермических | изменений |
Таблица 2. Эффекты нарушения равновесия и K Эффекты нарушения равновесия и K |
|||
Химия Упражнения в конце главы
- Следующее уравнение представляет собой обратимое разложение:
[латекс]\text{CaCO}_3(s)\;{\rightleftharpoons}\;\text{CaO}(s)\;+\;\text{CO}_2 (г)[/латекс]При каких условиях разложение в закрытой емкости пройдёт до конца, чтобы не осталось CaCO 3 ?
- Объясните, как распознать условия, при которых изменения давления повлияют на системы, находящиеся в равновесии.
- Какое свойство реакции можно использовать для предсказания влияния изменения температуры на значение константы равновесия?
- Что произойдет с цветом раствора в части (b) на рис. 1, если добавить небольшое количество NaOH и осадить Fe(OH) 3 ? Поясните свой ответ.
- При зажигании горелки на газовой плите происходит следующая реакция:
[латекс]\text{CH}_4(g)\;+\;2\text{O}_2(g)\;{\rightleftharpoons}\ ;\text{CO}_2(г)\;+\;2\text{H}_2\text{O}(г)[/латекс]Установлено ли равновесие между СН 4 , О 2 , СО 2 и Н 2 О в этих условиях? Поясните свой ответ.

- Необходимым этапом производства серной кислоты является образование трехокиси серы, SO 3 , из двуокиси серы, SO 2 , и кислорода, O 2 , как показано здесь. При высоких температурах скорость образования SO 3 выше, но равновесное количество (концентрация или парциальное давление) SO 3 ниже, чем оно было бы при более низких температурах.
[латекс] 2 \ текст {SO} _2 (г) \; + \; \ текст {O} _2 (г) \; {\ longrightarrow} \; 2 \ текст {SO} _3 (г) [/латекс]а) Константа равновесия реакции увеличивается, уменьшается или остается примерно такой же при повышении температуры?
(b) Является ли реакция эндотермической или экзотермической?
- Предложите четыре способа увеличения концентрации гидразина N 2 H 4 в равновесии, описываемом следующим уравнением:
[латекс]\text{N}_2(g)\;+\; 2\text{H}_2(g)\;{\rightleftharpoons}\;\text{N}_2\text{H}_4(g)\;\;\;\;\;\;\;{\Delta }H = 95\;\text{кДж}[/latex] - Предложите четыре способа увеличения концентрации PH 3 в равновесии, описываемом следующим уравнением:
[латекс]\text{P}_4(g)\;+\;6\text{H}_2 (g)\;{\rightleftharpoons}\;4\text{PH}_3(g)\;\;\;\;\;\;\;{\Delta}H = 110. 5\;\text{кДж}[/латекс]
5\;\text{кДж}[/латекс] - Как повышение температуры повлияет на каждое из следующих равновесий? Как скажется на каждом из них уменьшение объема реакционного сосуда?
(а) [латекс]2\текст{NH}_3(г)\;{\rightleftharpoons}\;\текст{N}_2(г)\;+\;3\текст{H}_2(г)\ ;\;\;\;\;\;\;{\Delta}H = 92\;\text{кДж}[/латекс]
(b) [латекс]\text{N}_2(g)\;+\;\text{O}_2(g)\;{\rightleftharpoons}\;2\text{NO}(g)\;\ ;\;\;\;\;\;{\Delta}H = 181\;\text{кДж}[/латекс]
(c) [латекс]2\текст{O}_3(г)\;{\rightleftharpoons}\;3\текст{O}_2(г)\;\;\;\;\;\;\;{ \Delta}H = -285\;\text{кДж}[/latex]
(d) [латекс]\text{CaO}(s)\;+\;\text{CO}_2(g)\;{\rightleftharpoons}\;\text{CaCO}_3(s)\;\; \;\;\;\;\;{\Delta}H = -176\;\text{кДж}[/латекс]
- Как повышение температуры повлияет на каждое из следующих равновесий? Как скажется на каждом из них уменьшение объема реакционного сосуда?
(a) [латекс] 2\текст{H}_2\текст{O}(g)\;{\rightleftharpoons}\;2\text{H}_2(g)\;+\;\text{O} _2(g)\;\;\;\;\;\;\;{\Delta}H = 484\;\text{кДж}[/latex]
(б) [латекс]\текст{N}_2(г)\;+\;3\текст{Н}_2(г)\;{\rightleftharpoons}\;2\текст{NH}_3(г)\ ;{\Delta}H = -92.
 2\;\текст{кДж}[/латекс]
2\;\текст{кДж}[/латекс] (c) [латекс]2\text{Br}(g)\;{\rightleftharpoons}\;\text{Br}_2(g)\;\;\;\;\;\;\;{\Delta }H = -224\;\text{кДж}[/latex]
(d) [латекс]\text{H}_2(g)\;+\;\text{I}_2(s)\;{\rightleftharpoons}\;2\text{HI}(g)\;\ ;\;\;\;\;\;{\Delta}H = 53\;\text{кДж}[/латекс]
- Водяной газ представляет собой смесь монооксида углерода и водорода в соотношении 1:1 и называется водяным газом, поскольку образуется из пара и горячего углерода в результате следующей реакции: [латекс]\text{H}_2\text{O}(g )\;+\;\text{C}(s)\;{\rightleftharpoons}\;\text{H}_2(g)\;+\;\text{CO}(g)[/latex].Метанол, жидкое топливо, которое могло бы заменить бензин, может быть получен из водяного газа и водорода при высокой температуре и давлении в присутствии подходящего катализатора.
а) Напишите выражение для константы равновесия ( K c ) обратимой реакции
[латекс] 2 \ текст {H} _2 (г) \; + \; \ текст {CO} (г) \; {\ rightleftharpoons} \; \ текст {СН} _3 \ текст {ОН} (г) \ ;\;\;\;\;\;\;{\Delta}H = -90,2\;\text{кДж}[/латекс]
(b) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если добавить больше H 2 ?
(c) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если удалить CO?
(d) Что произойдет с концентрациями H 2 , CO и CH 3 OH в равновесии, если добавить CH 3 OH?
(e) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если повысить температуру системы?
(f) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если добавить больше катализатора?
- Азот и кислород реагируют при высоких температурах.

а) Напишите выражение для константы равновесия ( K c ) обратимой реакции
[латекс]\текст{N}_2(g)\;+\;\text{O}_2(g)\;{\rightleftharpoons}\;2\text{NO}(g)\;\;\; \;\;\;\;{\Delta}H = 181\;\text{кДж}[/латекс]
(b) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если добавить больше O 2 ?
(c) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если удалить N 2 ?
(d) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если добавить NO?
(e) Что произойдет с концентрациями N 2 , O 2 и NO в состоянии равновесия, если увеличить давление в системе за счет уменьшения объема реакционного сосуда?
(f) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если повысить температуру системы?
(g) Что произойдет с концентрациями N 2 , O 2 и NO при равновесии, если добавить катализатор?
- Водяной газ, смесь H 2 и CO, является важным промышленным топливом, получаемым в результате реакции пара с раскаленным докрасна коксом, в основном чистым углеродом.

а) Напишите выражение для константы равновесия обратимой реакции
[латекс]\текст{C}(s)\;+\;\text{H}_2\text{O}(g)\;{\rightleftharpoons}\;\text{CO}(g)\;+ \;\text{H}_2(g)\;\;\;\;\;\;\;{\Delta}H = 131,30\;\text{кДж}[/latex]
(b) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить больше C?
(c) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если удалить H 2 O?
(d) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить CO?
(e) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если повысить температуру системы?
- Чистое металлическое железо можно получить восстановлением оксида железа (III) газообразным водородом.
а) Напишите выражение для константы равновесия ( K c ) обратимой реакции
[латекс]\текст{Fe}_2\текст{O}_3(s)\;+\;3\text{H}_2(g)\;{\rightleftharpoons}\;2\text{Fe}(s) )\;+\;3\text{H}_2\text{O}(g)\;\;\;\;\;\;\;{\Delta}H = 98,7\;\text{kJ}[ /латекс]
(b) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить больше Fe?
(c) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если удалить H 2 O?
(d) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить H 2 ?
(e) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если давление в системе увеличить за счет уменьшения объема реакционного сосуда?
(f) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если повысить температуру системы?
- Аммиак — слабое основание, реагирующее с водой по следующему уравнению:
[латекс]\text{NH}_3(водн. {\; \;-}[/latex], в контакте с твердым AgCl.{-})[/латекс]?
{\; \;-}[/latex], в контакте с твердым AgCl.{-})[/латекс]?
Глоссарий
- Принцип Ле Шателье
- когда химическая система, находящаяся в равновесии, нарушается, она возвращается к равновесию, противодействуя нарушению
- положение равновесия
- концентрации или парциальные давления компонентов реакции в равновесии (обычно используется для описания условий до возмущения)
- напряжение
- изменение условий реакции, которое может вызвать сдвиг равновесия
Решения
Ответы на упражнения по химии в конце главы
1.Количество CaCO 3 должно быть настолько малым, чтобы [латекс]P_{\text{CO}_2}[/латекс] был меньше, чем K P , когда CaCO 3 полностью разложился. Другими словами, исходное количество CaCO 3 не может полностью генерировать полный [латекс]P_{\text{CO}_2}[/латекс], необходимый для равновесия.
3. Можно использовать изменение энтальпии. Если реакция экзотермическая, то выделяющееся тепло можно рассматривать как продукт. Если реакция эндотермическая, присоединенное тепло можно рассматривать как реагент.Дополнительное тепло сместит экзотермическую реакцию обратно к реагентам, но сдвинет эндотермическую реакцию к продуктам. Охлаждение экзотермической реакции вызывает сдвиг реакции в сторону продукта; охлаждение эндотермической реакции заставит ее сместиться в сторону реагентов.
5. Нет, не в равновесии. Поскольку система не замкнута, продукты постоянно выходят из области пламени; реагенты также непрерывно добавляются из горелки и окружающей атмосферы.
7. Добавить N 2 ; добавить H 2 ; уменьшить объем контейнера; подогреть смесь.
9. (a) Δ T увеличение = сдвиг вправо, Δ P увеличение = сдвиг влево; (b) Δ T увеличение = сдвиг вправо, Δ P увеличение = отсутствие эффекта; (c) Δ T увеличение = сдвиг влево, Δ P увеличение = сдвиг влево; (d) Увеличение Δ T = сдвиг влево, увеличение Δ P = сдвиг вправо. 2[\text{CO}]}[/latex ]; (б) [H 2 ] увеличивается, [CO] уменьшается, [CH 3 OH] увеличивается; (в) [H 2 ] увеличивается, [CO] уменьшается, [CH 3 OH] уменьшается; (г) [H 2 ] увеличивается, [CO] увеличивается, [CH 3 OH] увеличивается; (д) [H 2 ] увеличивается, [CO] увеличивается, [CH 3 OH] уменьшается; (е) без изменений.
2[\text{CO}]}[/latex ]; (б) [H 2 ] увеличивается, [CO] уменьшается, [CH 3 OH] увеличивается; (в) [H 2 ] увеличивается, [CO] уменьшается, [CH 3 OH] уменьшается; (г) [H 2 ] увеличивается, [CO] увеличивается, [CH 3 OH] увеличивается; (д) [H 2 ] увеличивается, [CO] увеличивается, [CH 3 OH] уменьшается; (е) без изменений.
13. (a) [латекс]K_c = \frac{[\text{CO}][\text{H}_2]}{[\text{H}_2\text{O}]}[/latex]; (b) [H 2 O] без изменений, [CO] без изменений, [H 2 ] без изменений; в) уменьшается [H 2 O], уменьшается [CO], уменьшается [H 2 ]; (г) [H 2 O] увеличивается, [CO] увеличивается, [H 2 ] уменьшается; (f) [H 2 O] уменьшается, [CO] увеличивается, [H 2 ] увеличивается. В (б), (в), (г) и (д) масса углерода изменится, но его концентрация (активность) не изменится.
15. Только (б)
17. Добавьте в раствор NaCl или другую соль, образующую Cl − . Охлаждение раствора сдвигает равновесие вправо, осаждая больше AgCl( s ).
Добавьте в раствор NaCl или другую соль, образующую Cl − . Охлаждение раствора сдвигает равновесие вправо, осаждая больше AgCl( s ).
19. (а)
Принцип Ле Шателье – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Описать способы воздействия на равновесную систему
- Предсказать реакцию равновесия в напряженном состоянии, используя принцип Ле Шателье
Равновесная система находится в состоянии динамического равновесия, при этом прямая и обратная реакции протекают с одинаковой скоростью.Если в равновесной системе изменить условия, по-разному влияющие на скорость этих реакций (напряжение 90, 203), то скорости перестанут быть равными, и система не будет находиться в равновесии. Впоследствии в системе произойдет результирующая реакция в направлении большей скорости (сдвиг ), которая восстановит равновесие. Это явление резюмируется принципом Ле Шателье: если равновесная система подвергается стрессу, в ответ на стресс система испытывает сдвиг, который восстанавливает равновесие .
На скорость реакции в первую очередь влияют концентрации, как описано в законе скорости реакции, и температура, как описано в уравнении Аррениуса. Следовательно, изменения концентрации и температуры являются двумя стрессами, которые могут сместить равновесие.
Эффект изменения концентрации
Если в равновесной системе изменить концентрацию реагента или продукта, скорость прямой или обратной реакции изменится.В качестве примера рассмотрим равновесную реакцию
Законы скорости прямой и обратной реакции
Когда эта система находится в равновесии, скорости прямой и обратной реакции равны.
Если система подвергается стрессу путем добавления реагента, H 2 или I 2 , результирующее увеличение концентрации приводит к увеличению скорости прямой реакции, превышающей скорость обратной реакции:
В системе произойдет временная результирующая реакция в прямом направлении для восстановления равновесия ( равновесие сместится вправо ). Такой же сдвиг произойдет, если из системы будет удален какой-то продукт HI, что уменьшит скорость обратной реакции, что опять-таки приведет к тому же дисбалансу скоростей.
Такой же сдвиг произойдет, если из системы будет удален какой-то продукт HI, что уменьшит скорость обратной реакции, что опять-таки приведет к тому же дисбалансу скоростей.
Та же самая логика может быть использована для объяснения сдвига влево, который является результатом либо удаления реагента, либо добавления продукта в равновесную систему. Оба эти напряжения приводят к увеличению скорости обратной реакции
и временная результирующая реакция в обратном направлении для восстановления равновесия.
В качестве альтернативы этой кинетической интерпретации влияние изменений концентрации на равновесие можно рационализировать с точки зрения коэффициентов реакции.Когда система находится в равновесии,
Если добавить реагент (увеличив знаменатель реакции) или удалить продукт (уменьшив числитель), то Q c < K c и равновесие сместится вправо. Обратите внимание, что три различных способа создания этого напряжения приводят к трем различным изменениям в составе равновесной смеси. Если добавить H 2 , правый сдвиг будет потреблять I 2 и производить HI по мере восстановления равновесия, давая смесь с большей концентрацией H 2 и HI и меньшей концентрацией I 2 . чем присутствовал раньше.Если добавить I 2 , новая равновесная смесь будет иметь более высокие концентрации I 2 и HI и меньшую концентрацию H 2 . Наконец, если удалить HI, новая равновесная смесь будет иметь более высокие концентрации H 2 и I 2 и меньшую концентрацию HI. Несмотря на эти различия в составе, значение константы равновесия после напряжения будет таким же, как и до (согласно закону действующих масс).Та же логика может быть применена к напряжениям, связанным с удалением реагентов или добавлением продукта, и в этом случае Q c > K c и равновесие сдвинется влево.
Если добавить H 2 , правый сдвиг будет потреблять I 2 и производить HI по мере восстановления равновесия, давая смесь с большей концентрацией H 2 и HI и меньшей концентрацией I 2 . чем присутствовал раньше.Если добавить I 2 , новая равновесная смесь будет иметь более высокие концентрации I 2 и HI и меньшую концентрацию H 2 . Наконец, если удалить HI, новая равновесная смесь будет иметь более высокие концентрации H 2 и I 2 и меньшую концентрацию HI. Несмотря на эти различия в составе, значение константы равновесия после напряжения будет таким же, как и до (согласно закону действующих масс).Та же логика может быть применена к напряжениям, связанным с удалением реагентов или добавлением продукта, и в этом случае Q c > K c и равновесие сдвинется влево.
Для таких газофазных равновесий, как это, заслуживают упоминания некоторые дополнительные перспективы изменения концентраций реагентов и продуктов. Парциальное давление P идеального газа пропорционально его молярной концентрации M ,
Парциальное давление P идеального газа пропорционально его молярной концентрации M ,
и, таким образом, изменения парциального давления любого реагента или продукта, по существу, являются изменениями концентрации и, таким образом, оказывают такое же влияние на равновесие.Помимо добавления или удаления реагента или продукта, давления (концентрации) частиц в газофазном равновесии также можно изменить, изменив объем, занимаемый системой . Поскольку все виды газофазного равновесия занимают один и тот же объем, данное изменение объема вызовет одинаковое изменение концентрации как реагентов, так и продуктов. Чтобы определить, какой сдвиг, если таковой имеется, этот тип стресса вызовет стехиометрию реакции, необходимо учитывать стехиометрию реакции.
В равновесии реакция H 2 ( г ) + I 2 ( г ) ⇌ 2HI( г ) описывается отношением реакции
Если объем, занимаемый равновесной смесью этих частиц, уменьшить в 3 раза, то парциальные давления всех трех частиц увеличатся в 3 раза:
Итак, изменение объема этой газофазной равновесной смеси не приводит к сдвигу равновесия.
Аналогичная обработка другой системы, 2NO 2 ( г ) ⇌ 2 NO( г ) + O 2 ( г ), однако дает другой результат:
В этом случае изменение объема приводит к тому, что коэффициент реакции превышает константу равновесия, поэтому равновесие сместится влево.
Эти результаты иллюстрируют взаимосвязь между стехиометрией газофазного равновесия и эффектом изменения давления (концентрации), вызванного объемом.Если суммарные молярные количества реагентов и продуктов равны, как в первом примере, изменение объема не смещает равновесие. Если молярные количества реагентов и продуктов различны, изменение объема сдвинет равновесие в сторону, которая лучше «приспосабливается» к изменению объема. Во втором примере два моля реагента (NO 2 ) дают три моля продукта (2NO + O 2 ), поэтому уменьшение объема системы приводит к смещению равновесия влево, поскольку обратная реакция дает меньше газа (2 моль), чем прямая реакция (3 моль). И наоборот, увеличение объема этой равновесной системы приведет к сдвигу в сторону продуктов.
И наоборот, увеличение объема этой равновесной системы приведет к сдвигу в сторону продуктов.
Перейдите по этой ссылке, чтобы увидеть наглядную демонстрацию того, как равновесие меняется при изменении давления.
Равновесие и безалкогольные напитки
Связь между химией и газированными безалкогольными напитками восходит к 1767 году, когда Джозеф Пристли (1733–1804) разработал метод насыщения воды углекислым газом для получения газированной воды. Подход Пристли включал производство масла купороса (серной кислоты), реагирующего с углекислым газом, с мелом (карбонатом кальция).
Затем диоксид углерода растворяли в воде, реагируя с образованием гидрокарбоната, слабой кислоты, которая впоследствии ионизировалась с образованием бикарбоната и ионов водорода:
Те же равновесные реакции лежат в основе современного процесса газирования безалкогольных напитков. Напитки подвергаются воздействию высокого давления газообразного диоксида углерода во время процесса, чтобы сместить первое равновесие вверху вправо, что приводит к желаемым высоким концентрациям растворенного диоксида углерода и, в соответствии с аналогичными сдвигами в двух других равновесиях, его продуктов гидролиза и ионизации. Затем бутылку или банку почти наполняют газированным напитком, оставляя относительно небольшой объем воздуха в контейнере над поверхностью напитка ( свободное пространство ) до того, как он будет запечатан. Давление двуокиси углерода в свободном пространстве контейнера очень низкое сразу после герметизации, но оно повышается по мере восстановления равновесия растворения за счет смещения влево. Поскольку объем напитка значительно превышает объем свободного пространства, в свободное пространство теряется лишь относительно небольшое количество растворенного диоксида углерода.
Затем бутылку или банку почти наполняют газированным напитком, оставляя относительно небольшой объем воздуха в контейнере над поверхностью напитка ( свободное пространство ) до того, как он будет запечатан. Давление двуокиси углерода в свободном пространстве контейнера очень низкое сразу после герметизации, но оно повышается по мере восстановления равновесия растворения за счет смещения влево. Поскольку объем напитка значительно превышает объем свободного пространства, в свободное пространство теряется лишь относительно небольшое количество растворенного диоксида углерода.
Когда контейнер с газированным напитком открывается, слышен шипящий звук, когда сжатый CO 2 выходит из свободного пространства. Это вызывает сдвиг равновесия растворения влево, что приводит к уменьшению концентрации растворенного CO 2 и последующему сдвигу влево равновесий гидролиза и ионизации. К счастью для потребителя, равновесие растворения обычно восстанавливается медленно, поэтому напитком можно наслаждаться, пока концентрация растворенного в нем углекислого газа остается приемлемо высокой. После восстановления равновесия концентрация CO 2 ( aq ) будет значительно снижена, и напиток приобретет характерный вкус, называемый «плоским».
После восстановления равновесия концентрация CO 2 ( aq ) будет значительно снижена, и напиток приобретет характерный вкус, называемый «плоским».
Открытие бутылки с безалкогольным напитком снижает давление CO 2 над напитком, сдвигая равновесие растворения и высвобождая растворенный CO 2 из напитка. (кредит: модификация работы «D Coetzee»/Flickr)
Влияние изменения температуры
В соответствии с законом действующих масс равновесие, нарушаемое изменением концентрации, сместится, чтобы восстановить равновесие без какого-либо изменения значения константы равновесия, K .Однако когда равновесие смещается в ответ на изменение температуры, оно восстанавливается с другим относительным составом, который показывает другое значение константы равновесия.
Чтобы понять это явление, рассмотрим элементарную реакцию
Поскольку это элементарная реакция, законы скоростей для прямого и обратного хода могут быть выведены непосредственно из стехиометрии сбалансированного уравнения:
Когда система находится в равновесии,
Подстановка в это равенство законов скорости и перестановка дает
Видно, что константа равновесия является математической функцией констант скоростей прямой и обратной реакций. Поскольку константы скорости изменяются в зависимости от температуры, как описывается уравнением Аррениуса, само собой разумеющееся, что константа равновесия будет также изменяться в зависимости от температуры (при условии, что на константы скорости в разной степени влияет изменение температуры). Для более сложных реакций, включающих многоступенчатые механизмы реакции, существует аналогичная, но более сложная математическая связь между константой равновесия и константами скорости стадий механизма. Независимо от того, насколько сложной может быть реакция, зависимость ее константы равновесия от температуры сохраняется.
Поскольку константы скорости изменяются в зависимости от температуры, как описывается уравнением Аррениуса, само собой разумеющееся, что константа равновесия будет также изменяться в зависимости от температуры (при условии, что на константы скорости в разной степени влияет изменение температуры). Для более сложных реакций, включающих многоступенчатые механизмы реакции, существует аналогичная, но более сложная математическая связь между константой равновесия и константами скорости стадий механизма. Независимо от того, насколько сложной может быть реакция, зависимость ее константы равновесия от температуры сохраняется.
Предсказание смещения равновесия в ответ на изменение температуры удобнее всего выполнять, рассматривая изменение энтальпии реакции. Например, разложение четырехокиси диазота является эндотермическим (теплоемким) процессом:
В целях применения принципа Ле Шателье теплота ( q ) может рассматриваться как реагент:
Повышение температуры системы сродни увеличению количества реагента, поэтому равновесие сдвинется вправо. Понижение температуры системы также приведет к смещению равновесия влево. Для экзотермических процессов тепло рассматривается как продукт реакции, поэтому наблюдается обратная температурная зависимость.
Понижение температуры системы также приведет к смещению равновесия влево. Для экзотермических процессов тепло рассматривается как продукт реакции, поэтому наблюдается обратная температурная зависимость.
Эта интерактивная анимация позволяет применить принцип Ле Шателье для прогнозирования влияния изменений концентрации, давления и температуры на концентрации реагентов и продуктов.
Эффект катализатора
В главе, посвященной кинетике, этого текста катализатор определяется как вещество, позволяющее реакции протекать по другому механизму с повышенной скоростью.Механизм катализируемой реакции включает переходное состояние с более низкой энергией, чем некатализируемая реакция, что приводит к более низкой энергии активации, E a , и, соответственно, большей константе скорости.
Чтобы увидеть влияние катализа на равновесную систему, рассмотрите схему простой одностадийной (элементарной) реакции, показанную на (рис. ). Пониженная энергия переходного состояния катализируемой реакции приводит к пониженной энергии активации как прямой, так и обратной реакции.Следовательно, и прямая, и обратная реакции ускоряются, и равновесие достигается быстрее , но без изменения константы равновесия .
). Пониженная энергия переходного состояния катализируемой реакции приводит к пониженной энергии активации как прямой, так и обратной реакции.Следовательно, и прямая, и обратная реакции ускоряются, и равновесие достигается быстрее , но без изменения константы равновесия .
Схемы реакций элементарного процесса в отсутствие (красный) и в присутствии (синий) катализатора. Наличие катализатора снижает энергию активации как прямой, так и обратной реакции, но не влияет на значение константы равновесия.
Интересным примером, иллюстрирующим эти концепции равновесия, является промышленное производство аммиака, NH 3 .Это вещество входит в «десятку лучших» промышленных химикатов с точки зрения производства, ежегодно в США производится около двух миллиардов фунтов. Аммиак используется в качестве химического сырья для синтеза широкого спектра коммерчески полезных соединений, включая удобрения, пластмассы, красители и взрывчатые вещества.
В большинстве случаев промышленного производства аммиака используется процесс Габера-Боша , основанный на следующей равновесной реакции:
Особенности этой реакции создают проблемы для ее использования в эффективном промышленном процессе.Константа равновесия относительно мала ( K p порядка 10 -5 при 25 ° C), что означает, что в равновесной смеси присутствует очень мало аммиака. Кроме того, скорость этой реакции относительно низкая при низких температурах. Чтобы увеличить выход аммиака, промышленный процесс разработан для работы в условиях, благоприятствующих образованию продукта:
- Применяются высокие давления (концентрации) реагентов, ~150-250 атм, для смещения равновесия вправо, способствующего образованию продуктов.
- Аммиак постоянно удаляется (собирается) из равновесной смеси во время процесса, понижая его концентрацию, а также сдвигая равновесие вправо.

- Хотя низкие температуры благоприятствуют образованию продуктов для этого экзотермического процесса, скорость реакции при низких температурах неэффективно низкая. Катализатор используется для ускорения реакции до разумных скоростей при относительно умеренных температурах (400–500 ° C).
Схема, иллюстрирующая типичную промышленную установку для производства аммиака с помощью процесса Габера-Боша, показана на (Рисунок).
На рисунке показана типичная промышленная установка для коммерческого производства аммиака по процессу Габера-Боша. Процесс протекает в условиях, которые напрягают химическое равновесие, чтобы способствовать образованию продукта.
Ключевые понятия и резюме
Системы, находящиеся в равновесии, могут быть нарушены изменениями температуры, концентрации и, в некоторых случаях, объема и давления. Реакция системы на эти возмущения описывается принципом Ле Шателье: равновесная система, подвергшаяся возмущению, сдвинется таким образом, что нейтрализует возмущение и восстановит равновесие. Катализатор увеличивает скорость как прямой, так и обратной реакции обратимого процесса, увеличивая скорость достижения равновесия, но не изменяя состав равновесной смеси ( K не меняется).
Катализатор увеличивает скорость как прямой, так и обратной реакции обратимого процесса, увеличивая скорость достижения равновесия, но не изменяя состав равновесной смеси ( K не меняется).
Химия Упражнения в конце главы
Следующее уравнение представляет собой обратимое разложение:
При каких условиях разложение в закрытой емкости пройдёт до конца, чтобы не осталось CaCO 3 ?
Количество CaCO 3 должно быть настолько малым, чтобы оно было меньше K P , когда CaCO 3 полностью разложился.Другими словами, начальное количество CaCO 3 не может полностью обеспечить полное равновесие, необходимое для равновесия.
Объясните, как распознать условия, при которых изменение объема повлияет на газофазные системы, находящиеся в равновесии.
Какое свойство реакции можно использовать для предсказания влияния изменения температуры на значение константы равновесия?
Можно использовать изменение энтальпии. Если реакция экзотермическая, то выделяющееся тепло можно рассматривать как продукт.Если реакция эндотермическая, присоединенное тепло можно рассматривать как реагент. Дополнительное тепло сместит экзотермическую реакцию обратно к реагентам, но сдвинет эндотермическую реакцию к продуктам. Охлаждение экзотермической реакции вызывает сдвиг реакции в сторону продукта; охлаждение эндотермической реакции заставит ее сместиться в сторону реагентов.
Если реакция экзотермическая, то выделяющееся тепло можно рассматривать как продукт.Если реакция эндотермическая, присоединенное тепло можно рассматривать как реагент. Дополнительное тепло сместит экзотермическую реакцию обратно к реагентам, но сдвинет эндотермическую реакцию к продуктам. Охлаждение экзотермической реакции вызывает сдвиг реакции в сторону продукта; охлаждение эндотермической реакции заставит ее сместиться в сторону реагентов.
При зажигании горелки на газовой плите происходит следующая реакция:
Установлено ли равновесие между СН 4 , О 2 , СО 2 и Н 2 О в этих условиях? Поясните свой ответ.
Нет, не в равновесии. Поскольку система не замкнута, продукты постоянно выходят из области пламени; реагенты также непрерывно добавляются из горелки и окружающей атмосферы.
Необходимым этапом производства серной кислоты является образование трехокиси серы, SO 3 , из двуокиси серы, SO 2 , и кислорода, O 2 , как показано здесь. При высоких температурах скорость образования SO 3 выше, но равновесное количество (концентрация или парциальное давление) SO 3 ниже, чем оно было бы при более низких температурах.
При высоких температурах скорость образования SO 3 выше, но равновесное количество (концентрация или парциальное давление) SO 3 ниже, чем оно было бы при более низких температурах.
а) Константа равновесия реакции увеличивается, уменьшается или остается примерно такой же при повышении температуры?
(b) Является ли реакция эндотермической или экзотермической?
Предложите четыре способа увеличения концентрации гидразина N 2 H 4 в равновесии, описываемом следующим уравнением:
Добавить N 2 ; добавить H 2 ; уменьшить объем контейнера; подогреть смесь.
Предложите четыре способа увеличения концентрации PH 3 в равновесии, описываемом следующим уравнением:
Как повышение температуры повлияет на каждое из следующих равновесий? Как скажется на каждом из них уменьшение объема реакционного сосуда?
(а)
(б)
(в)
(д)
(a) T увеличение = сдвиг вправо, V уменьшение = сдвиг влево; (b) T увеличение = сдвиг вправо, V = отсутствие эффекта; (c) T увеличение = сдвиг влево, V уменьшение = сдвиг влево; (d) T увеличение = сдвиг влево, V уменьшение = сдвиг вправо.
Как повышение температуры повлияет на каждое из следующих равновесий? Как скажется на каждом из них уменьшение объема реакционного сосуда?
(а)
(б)
(в)
(д)
Метанол можно получить из монооксида углерода и водорода при высокой температуре и давлении в присутствии подходящего катализатора.
а) Напишите выражение для константы равновесия ( K c ) обратимой реакции
(b) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если добавить больше H 2 ?
(c) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если удалить CO?
(d) Что произойдет с концентрациями H 2 , CO и CH 3 OH в равновесии, если добавить CH 3 OH?
(e) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если повысить температуру системы?
(f) Что произойдет с концентрациями H 2 , CO и CH 3 OH при равновесии, если добавить больше катализатора?
(а) (б) [H 2 ] увеличивается, [CO] уменьшается, [CH 3 OH] увеличивается; (в) [H 2 ] увеличивается, [CO] уменьшается, [CH 3 OH] уменьшается; (г) [H 2 ] увеличивается, [CO] увеличивается, [CH 3 OH] увеличивается; (д) [H 2 ] увеличивается, [CO] увеличивается, [CH 3 OH] уменьшается; (е) без изменений.
Азот и кислород реагируют при высоких температурах.
а) Напишите выражение для константы равновесия ( K c ) обратимой реакции
(b) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если добавить больше O 2 ?
(c) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если удалить N 2 ?
(d) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если добавить NO?
(e) Что произойдет с концентрациями N 2 , O 2 и NO при равновесии, если уменьшить объем реакционного сосуда?
(f) Что произойдет с концентрациями N 2 , O 2 и NO в равновесии, если повысить температуру системы?
(g) Что произойдет с концентрациями N 2 , O 2 и NO при равновесии, если добавить катализатор?
Водяной газ, смесь H 2 и CO, является важным промышленным топливом, получаемым в результате реакции пара с раскаленным докрасна коксом, в основном чистым углеродом.
а) Напишите выражение для константы равновесия обратимой реакции
(b) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить больше C?
(c) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если удалить H 2 O?
(d) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить CO?
(e) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если повысить температуру системы?
(a) (b) [H 2 O] без изменений, [CO] без изменений, [H 2 ] без изменений; в) уменьшается [H 2 O], уменьшается [CO], уменьшается [H 2 ]; (г) [H 2 O] увеличивается, [CO] увеличивается, [H 2 ] уменьшается; (д) [H 2 O] уменьшается, [CO] увеличивается, [H 2 ] увеличивается.В (б), (в), (г) и (д) масса углерода изменится, но его концентрация (активность) не изменится.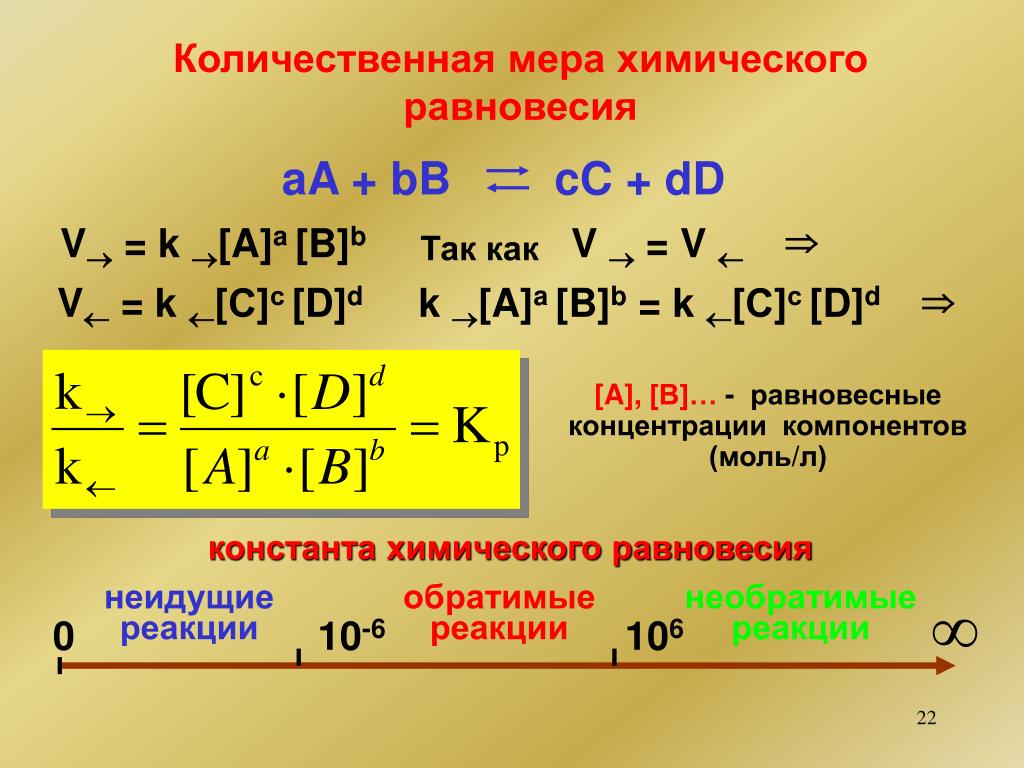
Чистое металлическое железо может быть получено восстановлением оксида железа (III) газообразным водородом.
а) Напишите выражение для константы равновесия ( K c ) обратимой реакции
(b) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить больше Fe?
(c) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если удалить H 2 O?
(d) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если добавить H 2 ?
(e) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если уменьшить объем реакционного сосуда?
(f) Что произойдет с концентрацией каждого реагента и продукта при равновесии, если повысить температуру системы?
Аммиак — слабое основание, реагирующее с водой по следующему уравнению:
Увеличит ли любое из следующих действий процент аммиака, который превращается в ион аммония в воде?
(а) Добавление NaOH
(b) Добавление HCl
(c) Добавление NH 4 Cl
Уксусная кислота — слабая кислота, реагирующая с водой по следующему уравнению:
Увеличит ли любое из следующих действий процент уксусной кислоты, которая вступает в реакцию и образует ион?
(а) Добавление HCl
(b) Добавление NaOH
(c) Добавление NaCH 3 CO 2
Предложите два способа снижения равновесной концентрации Ag + в растворе Na + , Cl — , Ag + и при контакте с твердым AgCl.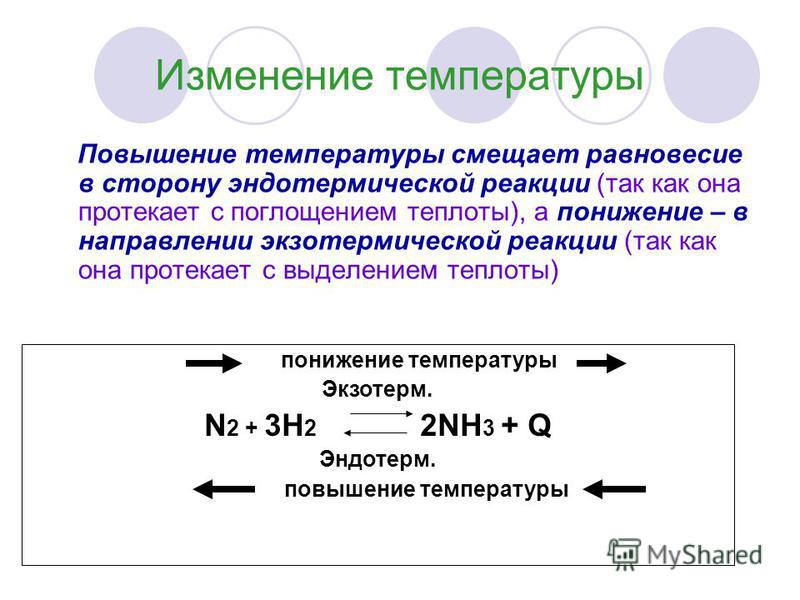
Добавьте в раствор NaCl или другую соль, образующую Cl − . Охлаждение раствора сдвигает равновесие вправо, осаждая больше AgCl( с ).
Как можно увеличить давление водяного пара в следующем равновесии?
Раствор насыщен сульфатом серебра и содержит избыток твердого сульфата серебра:
К этому раствору добавляют небольшое количество твердого сульфата серебра, содержащего радиоактивный изотоп серебра.В течение нескольких минут берется часть фазы раствора, и ее анализ дает положительный результат на радиоактивные ионы Ag + . Объясните это наблюдение.
Аминокислота аланин имеет два изомера: α-аланин и β-аланин. При растворении равных масс этих двух соединений в равных количествах растворителя раствор а-аланина замерзает при самой низкой температуре. Какая форма, α-аланин или β-аланин, имеет большую константу равновесия для ионизации?
Глоссарий
- Принцип Ле Шателье
- равновесие, подвергнутое стрессу, сместится таким образом, чтобы противостоять стрессу и восстановить равновесие
советов по определению сдвигов направления в реакциях — концепция
Вот несколько советов и приемов для определения направления, в котором сместится ваша реакция, чтобы достичь химического равновесия. Сначала я покажу вам простой способ, потому что всем нравится простой способ.
Сначала я покажу вам простой способ, потому что всем нравится простой способ.
Итак, скажем, если у меня есть один реагент, а затем он превращается в продукт. Скажем, когда я начинаю или изначально у меня есть один моляр моего реагента, и у меня нет ни одного побочного продукта B. Ну, просто исходя из здравого смысла, должно быть довольно легко понять, что направление реакции будет вправо, потому что ему нужно производить продукты. Так что в этом случае он пойдет вправо. Итак, реакция будет производить продукты, так что правильно производить продукты.
Другой простой способ, скажем, если у нас снова есть A и B, и в этом случае у нас нет моляра A, но у нас есть, скажем, 2 моляра B, и это в начале или в начале. Так в какую сторону система собирается сдвинуться? Ну, он собирается сместиться влево. И это должно иметь смысл, потому что мы собираемся производить реагенты, потому что у нас их вообще не было. Это легкий путь, простой путь. Ну вот, готовы к трудным вещам? Ну, это не так сложно.
Итак, у нас есть что-то под названием Q и что-то под названием K.Q известен как коэффициент реакции, и это происходит при начальных концентрациях. K — константа равновесия, и это при равновесных концентрациях. Как теперь их вычислить? Ну, скажем, например, если бы у нас было, скажем, чистое выражение Q, Q было бы равно, что ж, давайте воспользуемся нашим уравнением выше. Таким образом, у нас будет концентрация B, и я поставлю немного 0 или нет внизу, чтобы обозначить начальную концентрацию над концентрацией A до начальной. K будет равняться концентрации B в равновесии по сравнению с концентрацией A в равновесии.Так что это единственная разница. Поэтому, если вы вычислите их, вы сможете выяснить, в какую сторону сместится реакция, чтобы в основном достичь равновесия.
Итак, если Q равно K, то у вас вообще нет сдвига, потому что, по сути, вы уже находитесь в равновесии, если Q равно K, потому что они были бы одним и тем же числом, уже в равновесии.
Теперь, если вы вычислите Q и Q будет равно 0, тогда реакция сместится вправо или в прямом направлении.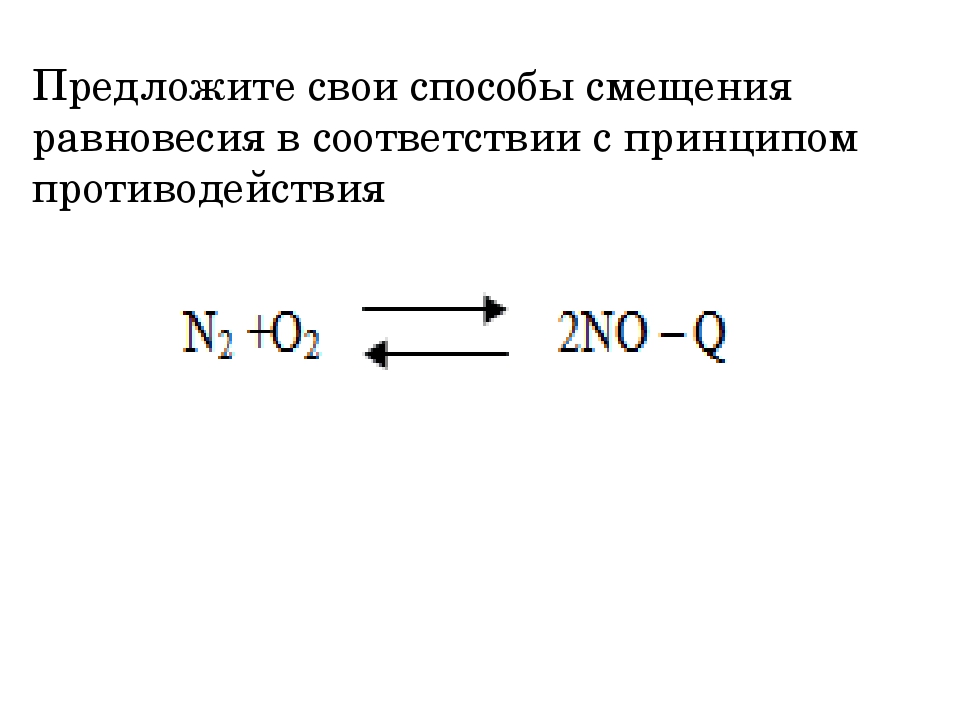 И причина этого в том, что компания собирается производить больше продуктов, чтобы попытаться получить этот Q.Так что это число больше 0. И затем, если Q равно бесконечности, и как вы получаете это, когда вы получаете в основном некоторое число больше 0, что означает, что у вас вообще нет реагентов. Так что происходит то, что, конечно, если у вас нет реагентов, реакция сдвинется влево.
И причина этого в том, что компания собирается производить больше продуктов, чтобы попытаться получить этот Q.Так что это число больше 0. И затем, если Q равно бесконечности, и как вы получаете это, когда вы получаете в основном некоторое число больше 0, что означает, что у вас вообще нет реагентов. Так что происходит то, что, конечно, если у вас нет реагентов, реакция сдвинется влево.
И если вы посмотрите на Q равно 0, взгляните на наш самый первый пример, с которого мы начали, один моляр A и 0 моляр B. Таким образом, в основном у вас будет ноль больше единицы для Q, и это равно 0.Тогда как, если Q равно бесконечности, то взгляните на наш второй пример, где у нас есть А — 0 моляр, а В — 2 моляр. Два разделить на ноль, это будет бесконечность. Таким образом, реакция сдвинется влево, как мы говорили ранее.
И тогда, если Q больше К, реакция сдвинется влево, и то потому, что Q попытается уменьшиться, чтобы стать равным К.
И затем последний, если Q меньше чем K, реакция сдвинется вправо. А затем для последних двух подумайте о смещении реакции влево, посмотрите, где находится знак больше, и посмотрите, где он пытается съесть.Итак, он пытается питаться слева. Принимая во внимание, что Q меньше, чем K, знак меньше, чем ест вправо, и поэтому это похоже на то, что он ест вправо. Значит, он сдвинется вправо. Может быть, это способ помочь.
А затем для последних двух подумайте о смещении реакции влево, посмотрите, где находится знак больше, и посмотрите, где он пытается съесть.Итак, он пытается питаться слева. Принимая во внимание, что Q меньше, чем K, знак меньше, чем ест вправо, и поэтому это похоже на то, что он ест вправо. Значит, он сдвинется вправо. Может быть, это способ помочь.
Таким образом, у вас есть простой метод сверху, и у вас есть немного более сложный метод с Q против K. Но, надеюсь, эти советы по определению направления реакции помогут вам и облегчат вам задачу. Приятного аппетита.
выражений равновесия
выражение равновесияВыражения равновесия
Равновесие Постоянные выражения
Реакции не прекращаются, когда они приходят в равновесие.Но
прямая и обратная реакции находятся в равновесии, поэтому
нет чистого изменения концентраций реагентов или
продуктов, и реакция, по-видимому, останавливается на макроскопическом
шкала. Химическое равновесие является примером динамического
баланс между противодействующими силами прямой и обратной реакции
не
статический баланс.
Химическое равновесие является примером динамического
баланс между противодействующими силами прямой и обратной реакции
не
статический баланс.
Давайте посмотрим на логические следствия предположения, что реакция между ClNO 2 и NO в конечном итоге достигает равновесие.
| ClNO 2 ( г ) | + | НЕТ( г ) | № 2 ( г ) | + | ClNO( г ) |
Скорости прямой и обратной реакции одинаковы когда эта система находится в равновесии.
| В равновесии: | скорость вперед | = | курс реверс |
Замена законов скорости для прямого и обратного
реакции в это равенство дает следующий результат.
| В равновесии: | к f (ClNO 2 )(НЕТ) | = | к р (NO 2 )(ClNO) |
Но это уравнение справедливо только тогда, когда система равновесия, поэтому мы должны заменить (ClNO 2 ), (NO), (NO 2 ) и (ClNO) термины с символами, которые указывают что реакция находится в равновесии.По соглашению мы используем квадрат кронштейны для этой цели. Уравнение, описывающее баланс между прямой и обратной реакциями, когда система находится в Поэтому равновесие должно быть записано следующим образом.
| В равновесии: | k f [ClNO 2 ][NO] | = | k r [NO 2 ][ClNO] |
Преобразование этого уравнения дает следующий результат.
Начиная с k f и k r константы, отношение k f к k r также должно быть константой. Это соотношение является равновесием . константа для реакции, K c . Соотношение концентраций реагентов и продуктов равно известное как выражение константы равновесия .
Независимо от комбинации концентраций реагентов и
продукты, с которых мы начинаем, реакция достигнет равновесия, когда
отношение концентраций, определяемое равновесием
постоянное выражение равно константе равновесия для
реакция. Мы можем начать с большого количества ClNO 2 и очень
мало NO или много NO и очень мало ClNO 2 .Это
не имеет значения. Когда реакция достигает равновесия,
зависимость между концентрациями реагентов и
продукты, описываемые выражением константы равновесия, будут
всегда быть одинаковым. При 25 o С эта реакция всегда
достигает равновесия, когда отношение этих концентраций равно 1,3
х 10 4 .
Когда реакция достигает равновесия,
зависимость между концентрациями реагентов и
продукты, описываемые выражением константы равновесия, будут
всегда быть одинаковым. При 25 o С эта реакция всегда
достигает равновесия, когда отношение этих концентраций равно 1,3
х 10 4 .
Процедура, используемая в этом разделе для получения равновесия константное выражение работает только с реакциями, происходящими в одностадийный, такой как перенос атома хлора из ClNO 2 на НЕТ.Многие реакции включают ряд стадий превращения реагентов. в продукты. Но любая реакция, которая достигает равновесия, не независимо от того, насколько он прост или сложен, имеет константу равновесия выражение, удовлетворяющее правилам следующего раздела.
Правила письма Постоянные выражения равновесия
- Даже если химические реакции, которые достигают равновесия
происходят в обоих направлениях, реагенты с правой стороны
уравнения считаются
«продукты» реакции и реагенты на
левая часть уравнения принимается равной
«реагенты.
 »
» - Продукты реакции всегда пишутся над строчка в числителе.
- Реагенты всегда пишутся под чертой в знаменатель.
- Для однородных систем константа равновесия выражение содержит термин для каждого реагента и каждого продукт реакции.
- Числитель выражения константы равновесия равен произведение концентраций «продукты» реакции, возведенные в степень равным коэффициенту для этой составляющей в сбалансированное уравнение реакции.
- Знаменатель равновесия постоянное выражение есть произведение концентраций «реагентов», возведенных в степень, равную коэффициент для этой составляющей в сбалансированном уравнение реакции.
Газофазные реакции были выбраны для этого введения в
кинетика и равновесие, потому что они являются одними из самых простых
химические реакции. Однако у некоторых может возникнуть вопрос, почему
постоянные выражения равновесия в предыдущем упражнении:
выражается через концентрации газов в единицах
моль на литр.
единицы концентрации были использованы, чтобы подчеркнуть взаимосвязь между химическим равновесием и скоростью химических реакций, которые указываются в виде концентраций реагенты и продукты. Этот выбор единиц обозначается добавление индекса « c» к символам для константы равновесия, чтобы показать, что они были рассчитаны из концентрации компонентов реакции.
Изменение или Объединение равновесных реакций
Что происходит с величиной константы равновесия для реакция, когда мы переворачиваем уравнение? Рассмотрим например, после реакции.
| ClNO 2 ( г ) | + | НЕТ( г ) | № 2 ( г ) | + | ClNO( г ) |
Выражение константы равновесия для этого уравнения:
написано следующим образом.
Поскольку это обратимая реакция, ее также можно представлен уравнением, записанным в обратном направлении.
| № 2 ( г ) | + | ClNO( г ) | ClNO 2 ( г ) | + | НЕТ( г ) |
Выражение константы равновесия теперь записывается следующим образом.
Каждое из этих выражений константы равновесия является обратным другого.Таким образом, мы можем вычислить K c путем деления К с на 1.
Мы также можем рассчитать константы равновесия, комбинируя два
или более реакций, для которых значение K c
известен. Предположим, например, что мы знаем равновесие
константы следующих газофазных реакций при 200 o С.
Предположим, например, что мы знаем равновесие
константы следующих газофазных реакций при 200 o С.
| Н 2 ( г ) | + | О 2 ( г ) | 2 НО( г ) | К c1 = 2,3 x 10 -19 | ||
| 2 НО( г ) | + | О 2 ( г ) | 2 НЕТ 2 ( г ) | К c2 = 3 x 10 6 |
Мы можем объединить эти реакции, чтобы получить общее уравнение
для реакции между N 2 и O 2 с образованием
№ 2 .
| Н 2 ( г ) | + | О 2 ( г ) | 2 НО( г ) | ||
| + | 2 НО( г ) | + | О 2 ( г ) | 2 НЕТ 2 ( г ) | |
| ______________________________________________________________ | |||||
| Н 2 ( г ) | + | 2 O 2 ( г ) | 2 НЕТ 2 ( г ) | ||
Легко показать, что выражение константы равновесия
полная реакция равна произведению
константы равновесия для двух стадий в этом
реакция.
Таким образом, константа равновесия всей реакции равна равно произведению констант равновесия для отдельные шаги.
К с = К с1 х К с2 = (2,3 х 10 -19 )(3 х 10 6 ) = 7 х 10 -13
Реакция Коэффициенты: способ определить, находится ли реакция в равновесии
У нас есть модель, описывающая, что происходит, когда реакция
достигает равновесия: на молекулярном уровне скорость
скорость прямой реакции равна скорости обратной реакции.Поскольку реакция протекает в обоих направлениях с одинаковой скоростью,
нет видимых изменений в концентрациях
реагентов или продуктов в макроскопическом масштабе уровень
предметы, видимые невооруженным глазом. Эту модель также можно использовать для
предсказать направление, в котором реакция должна сместиться, чтобы достичь
равновесие.
Если концентрации реагентов слишком велики для реакция находится в равновесии, скорость прямой реакции будет быстрее, чем обратная реакция, и часть реагенты будут превращаться в продукты до тех пор, пока не установится равновесие достигнуто.И наоборот, если концентрации реагентов слишком мала, скорость обратной реакции будет больше скорости прямая реакция, и реакция преобразует часть избыточные продукты обратно в реагенты, пока система не достигнет равновесие.
Мы можем определить направление, в котором должна идти реакция. сдвиг для достижения равновесия путем расчета реакции частное ( Q c ) для реакция.Коэффициент реакции определяется как произведение концентрации продуктов реакции, деленные на произведение концентраций реагентов в любой момент времени время.
Чтобы проиллюстрировать, как используется коэффициент реакции, давайте рассмотрим следующую газофазную реакцию.
| Н 2 ( г ) | + | I 2 ( г ) | 2 HI( г ) |
Выражение константы равновесия для этой реакции:
написано следующим образом.
По аналогии можно написать выражение для реакции частное следующим образом.
Q c может принимать любое значение между ноль и бесконечность. Если в системе много HI и очень мало H 2 и I 2 , реакция частное очень велико.Если в системе относительно мало HI и большое количество H 2 и I 2 , коэффициент реакции очень мал.
В любой момент времени есть три возможности.
1. Q c
меньше, чем K c .
Система содержит слишком много реагента и слишком мало продукта для
находиться в равновесии.Значение Q c
должна возрастать, чтобы реакция достигла равновесия. Таким образом, реакция должна превратить часть реагентов в
продукты приходят в равновесие.
Таким образом, реакция должна превратить часть реагентов в
продукты приходят в равновесие.
2. Q c равно К c . Если это так, то реакция находится в равновесии.
3. Q с больше, чем K c . Система содержит слишком много продукта и недостаточно реагента для находиться в равновесии. Значение Q c должно стать меньше, прежде чем реакция сможет прийти к равновесию. Таким образом, реакция должна превратить часть продуктов в реагентов для достижения равновесия.
| Практическая задача 2: Предположим
что концентрации H 2 , I 2 ,
и HI можно измерить для следующей реакции в любой
момент времени. H 2 ( г ) + I 2 ( г ) 2 HI( г ) К с = 60 Для каждого из следующих наборов концентраций определить, находится ли реакция в равновесии.Если оно нет, решите, в каком направлении он должен идти, чтобы достичь равновесие. (а) (H 2 ) = (I 2 ) = (HI) = 0,010 M (б) (HI) = 0,30 М ; (Н 2 ) = 0,01 М ; (I 2 ) = 0,15 М (с) (H 2 ) = (HI) = 0,10 M ; (я 2 ) = 0,0010 М Нажмите здесь, чтобы проверить свой ответ на практическое задание 2 |
Изменения в Концентрация, возникающая при достижении равновесия реакции
Относительный размер Q c и K c
поскольку реакция говорит нам, находится ли реакция в равновесии при
любой момент времени. Если это не так, относительный размер Q c
и K c сообщите нам направление в
которые должна сместить реакция, чтобы достичь равновесия. Теперь нам нужен
способ предсказать, как далеко должна зайти реакция, чтобы достичь
равновесие. Предположим, вы столкнулись со следующим
проблема.
Если это не так, относительный размер Q c
и K c сообщите нам направление в
которые должна сместить реакция, чтобы достичь равновесия. Теперь нам нужен
способ предсказать, как далеко должна зайти реакция, чтобы достичь
равновесие. Предположим, вы столкнулись со следующим
проблема.
Пентахлорид фосфора разлагается до фосфора
трихлорида и хлора при нагревании.
Константа равновесия для этого
реакция составляет 0,030 при 250 o C. Предполагая, что
начальная концентрация PCl 5 равна 0. |
Первым шагом к решению этой проблемы является организация информацию, чтобы она давала подсказки о том, как действовать дальше. Задача содержит четыре порции информации: (1) сбалансированный уравнение, (2) константа равновесия реакции, (3) a описание начальных условий и (4) указание цель расчета равновесные концентрации три компонента реакции.
Следующий формат предлагает полезный способ обобщить это Информация.
|
Начнем со сбалансированного уравнения и равновесия
постоянной для реакции, а затем добавить то, что мы знаем о
начальные и равновесные концентрации различных компонентов
реакции. Первоначально в колбе содержится 0,100 моль/л.
литр PCl 5 и без PCl 3 или Cl 2 .
Наша цель – рассчитать равновесные концентрации этих
три вещества.
Первоначально в колбе содержится 0,100 моль/л.
литр PCl 5 и без PCl 3 или Cl 2 .
Наша цель – рассчитать равновесные концентрации этих
три вещества.
Прежде чем делать что-либо еще, мы должны решить, реакция находится в равновесии. Мы можем сделать это, сравнив коэффициент реакции для начальных условий с равновесием константа для реакции.
Хотя константа равновесия мала ( K c = 3.0 x 10 -2 ), коэффициент реакции еще меньше ( Q c = 0). Единственным способом достижения равновесия этой реакции является некоторые из PCl 5 разлагаются на PCl 3 и Кл 2 .
Поскольку реакция не находится в равновесии, одно можно сказать наверняка:
концентрации PCl 5 , PCl 3 и Cl 2
все изменится, когда реакция придет к равновесию.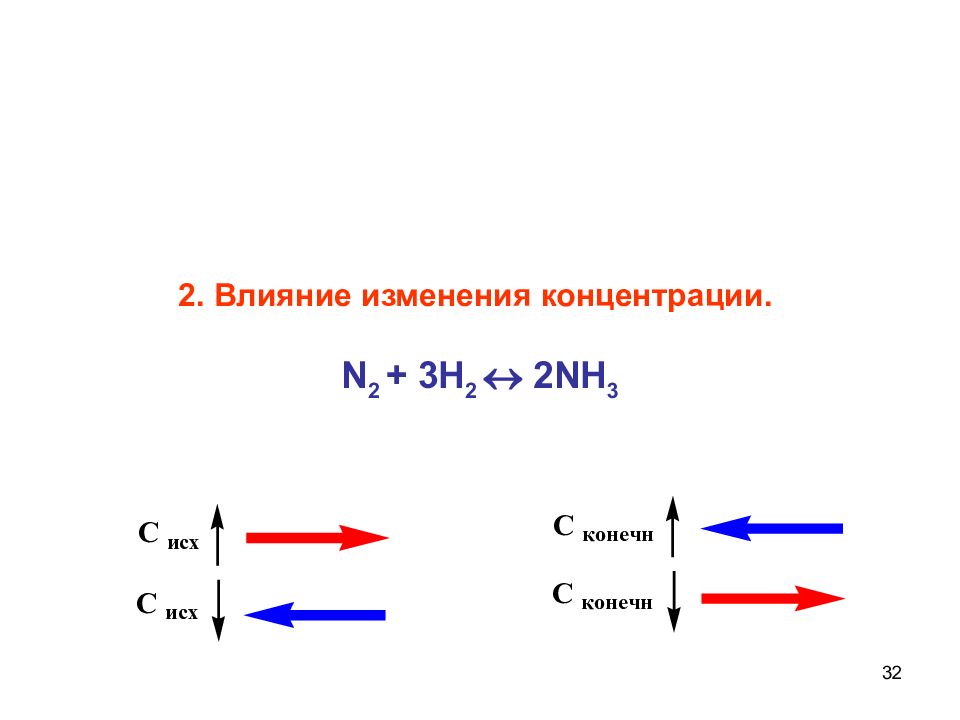 Поскольку
реакция должна сместиться вправо, чтобы достичь равновесия, PCl 5
концентрация станет меньше, а PCl 3 и
Концентрация Cl 2 станет больше.
Поскольку
реакция должна сместиться вправо, чтобы достичь равновесия, PCl 5
концентрация станет меньше, а PCl 3 и
Концентрация Cl 2 станет больше.
На первый взгляд эта проблема кажется имеют три неизвестных: равновесные концентрации PCl 5 , PCl 3 и Cl 2 . Потому что трудно решить задачу с тремя неизвестными, надо искать отношения, которые могут уменьшить сложность проблемы.В одну сторону достижения этой цели заключается в рассмотрении взаимосвязи между изменение концентраций PCl 5 , PCl 3 , и Cl 2 по мере приближения реакции к равновесию.
| Практическая задача 3: Рассчитать
увеличение PCl 3 и Cl 2
концентрации, возникающие при протекании следующей реакции
к равновесию, если концентрация PCl 5
уменьшается на 0. PCl 5 ( г ) PCl 3 ( г ) + Cl 2 ( г ) Нажмите здесь, чтобы проверить свой ответ на практическое задание 3 |
Существует простая связь между изменением в концентрации трех компонентов реакции по мере ее приходит в равновесие из-за стехиометрии реакция.
Было бы полезно иметь символ, обозначающий изменение происходящее при концентрации одного из компонентов реакции при переходе от начальных условий к равновесию. А функция состояния является свойством системы, значение которого зависит только от состояния системы. Изменение стоимости функции состояния определяется следующим уравнением.
X = X окончательный — X начальный
Мы можем распространить этот аргумент на обсуждение химических
реакции, которые приходят к равновесию, определяя ( X )
как величина изменения, которое происходит в концентрации
X , когда реакция приходит в равновесие.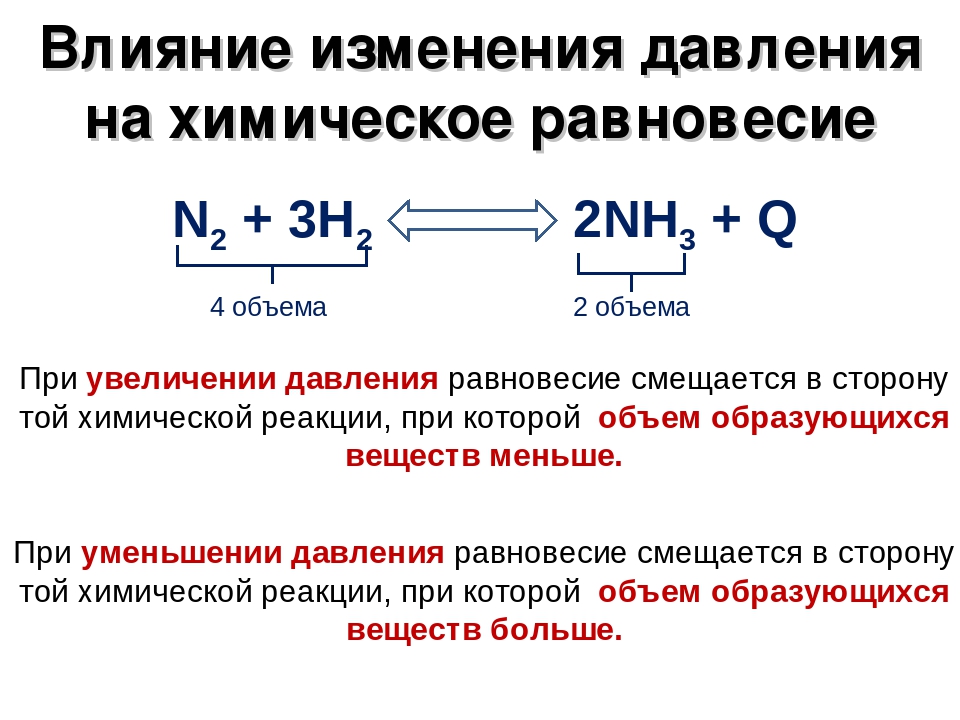 Мы можем определить
(ПКл 5 ),
например, как величина изменения концентрации
PCl 5 , который возникает при разложении этого соединения до
формы PCl 3 и Cl 2 .
Мы можем определить
(ПКл 5 ),
например, как величина изменения концентрации
PCl 5 , который возникает при разложении этого соединения до
формы PCl 3 и Cl 2 .
| (PCl 5 ) | = | (PCl 5 ) | — | [PCl 5 ] | |
| ПКл 5
потребляется как реакция доходит до равновесие |
начальный концентрация |
концентрация в равновесие |
Преобразовывая это уравнение, мы находим, что концентрация
PCl 5 в равновесии равен исходному
концентрация PCl 5 минус количество PCl 5
расходуется, когда реакция приходит в равновесие.
| [PCl 5 ] | = | (PCl 5 ) | — | (PCl 5 ) | |
| концентрация в равновесие |
начальный концентрация |
ПКл 5
потребляется как реакция доходит до равновесие |
Затем мы можем определить (PCl 3 ) и (Cl 2 )
как изменения, которые происходят в PCl 3 и Cl 2
концентрации по мере того, как реакция приходит в равновесие. То
концентрации обоих этих веществ при равновесии будут
превышает их первоначальную концентрацию.
То
концентрации обоих этих веществ при равновесии будут
превышает их первоначальную концентрацию.
| [PCl 3 ] | = | (PCl 3 ) | + | (PCl 3 ) | |
| [Кл 2 ] | = | (Кл 2 ) | + | (Кл 2 ) |
Величина изменений концентраций этих три вещества, когда реакция придет в равновесие, будет тоже самое.Из-за стехиометрии реакции 1:1:1 величина изменения концентрации PCl 5 когда реакция приходит в равновесие, равна величине изменение концентраций PCl 3 и Cl 2 .
(PCl 5 ) = (PCl 3 ) = (Кл 2 )
Таким образом, мы можем переписать уравнения, определяющие
равновесные концентрации PCl 5 , PCl 3 ,
и Cl 2 в пересчете на одно неизвестное: C.
[PCl 5 ] = (PCl 5 ) — C
[PCl 3 ] = (PCl 3 ) + C
[Кл 2 ] = (Кл 2 ) + С
Подставляя то, что мы знаем о начальных концентрациях PCl 5 , PCl 3 и Cl 2 в эти уравнений дает следующий результат.
[PCl 5 ] = 0.100 — С
[PCl 3 ] = [Cl 2 ] = 0 + C
Теперь мы можем обобщить то, что мы знаем об этой реакции, как следует.
|
Теперь у нас есть только одно неизвестное C, и нам нужно решить только одно уравнение для один неизвестный.Очевидным уравнением, к которому нужно обратиться, является равновесие постоянное выражение для этой реакции.
Подставляя то, что мы знаем о равновесных концентрациях
из PCl 5 , PCl 3 и Cl 2 в этот
уравнение дает следующий результат.
Это уравнение можно расширить, а затем преобразовать, чтобы получить квадратное уравнение
С 2 + 0.030 С — 0,0030 = 0
, которое можно решить по квадратичной формуле.
С = 0,042 или -0,072
Хотя из этого расчета вытекают два ответа, только положительный корень имеет физический смысл, потому что мы не можем иметь отрицательная концентрация. Таким образом, величина изменения концентрации PCl 5 , PCl 3 и Cl 2 когда эта реакция приходит в равновесие, равна 0.042 моля на литр.
С= 0,042 М
Подставляя это значение обратно в уравнения, определяющие
равновесные концентрации PCl 5 , PCl 3 ,
и Cl 2 дает следующие результаты.
[PCl 5 ] = 0,100 — 0,042 = 0,058 М
[PCl 3 ] = [Cl 2 ] = 0 + 0,042 = 0,042 М
Другими словами, чуть меньше половины PCl 5 присутствует первоначально разлагается на PCl 3 и Cl 2 когда эта реакция придет в равновесие.
Чтобы проверить, представляют ли результаты этого расчета допустимые значения равновесных концентраций трех компоненты этой реакции, мы можем подставить эти значения в постоянное выражение равновесия.
Эти результаты должны быть законными, потому что константа равновесия, рассчитанная по этим концентрациям, равна равно значению K c , приведенному в задача, в пределах погрешности эксперимента.
Скрытые предположения которые облегчают расчет равновесия
Предположим, вас попросили решить немного сложную задачу. проблема.
проблема.
|
Первым шагом в этой задаче является создание
представление информации в задаче.
|
Затем мы сравниваем коэффициент реакции для начального
условия с константой равновесия реакции.
Поскольку начальные концентрации SO 2 и O 2 равны нулю, реакция должна сместиться вправо, чтобы достичь равновесие. Как и следовало ожидать, некоторые из SO 3 имеют разлагаться на SO 2 и O 2 .
Стехиометрия этой реакции сложнее, чем реакция в предыдущем разделе, но изменения в концентрации трех компонентов реакции все еще Связанный.На каждые два моля SO 3 , которые разлагаются, мы получить два моля SO 2 и один моль O 2 , т.к. показано на рисунке ниже. Мы можем включить это отношение в формат, который мы использовали ранее, используя сбалансированное уравнение для реакции в качестве ориентира.
Определены знаки членов C в этой задаче
тем, что реакция должна смещаться слева направо
достичь равновесия. Коэффициенты в терминах C
отражать коэффициенты в сбалансированном уравнении для
реакция. Потому что в два раза больше молей SO 2
в виде молей O 2 , изменение
концентрация SO 2 по мере того, как реакция доходит до
равновесия должно быть в два раза больше, чем изменение
концентрация O 2 . Потому что два моля SO 3
потребляются на каждый моль произведенного O 2 , изменение
в SO 3 концентрация должна быть в два раза больше, чем
изменение концентрации O 2 .
Коэффициенты в терминах C
отражать коэффициенты в сбалансированном уравнении для
реакция. Потому что в два раза больше молей SO 2
в виде молей O 2 , изменение
концентрация SO 2 по мере того, как реакция доходит до
равновесия должно быть в два раза больше, чем изменение
концентрация O 2 . Потому что два моля SO 3
потребляются на каждый моль произведенного O 2 , изменение
в SO 3 концентрация должна быть в два раза больше, чем
изменение концентрации O 2 .
Подстановка того, что мы знаем о проблеме, в выражение для константы равновесия реакции дает следующее уравнение.
Расширить это уравнение немного сложнее, но оно можно преобразовать, чтобы получить следующее кубическое уравнение.
4 C 3 — 6,4 x 10 -10 C 2
+ 6,4 х 10 -11 С — 1. 6 х 10 -12 = 0
6 х 10 -12 = 0
Однако решать кубические уравнения сложно. Эта проблема поэтому пример семейства проблем, которые трудны, если не невозможно, то решить точно. Эти проблемы решаются с общей стратегией, которая состоит из предположения или приближение, которое превращает их в более простые задачи. То следующие общие правила будут направлять наше обсуждение методов приближение.
| ПРАВИЛА ИСПОЛЬЗОВАНИЯ ПРИБЛИЖЕНИЯ
МЕТОДЫ 1.Нет ничего плохого в том, чтобы сделать предположение. 2. Есть два смертных греха: (а) Забвение сделанных предположений. (b) Забыть проверить, верны ли предположения. действительный. |
Какое предположение можно сделать, чтобы упростить эту задачу? Поехали
вернуться к первому действию, которое мы сделали после построения представления
для проблемы. Мы начали наш расчет со сравнения
коэффициент реакции для начальных концентраций с
константа равновесия реакции.
Мы начали наш расчет со сравнения
коэффициент реакции для начальных концентраций с
константа равновесия реакции.
Затем мы пришли к выводу, что частное реакции ( Q c = 0) была меньше константы равновесия ( K c = 1,6 x 10 90 281 -10 90 282 ) и решили, что некоторые из SO 90 156 3 90 157 должны были разложиться, чтобы эта реакция пришла к равновесие.
А как быть с относительными величинами коэффициента реакции и константа равновесия реакции? Начальные значения Q c и K c относительно малы, что означает, что начальные условия достаточно близки к равновесия, как показано на рисунке ниже. В результате реакции не нужно далеко ходить, чтобы достичь равновесия. это поэтому разумно предположить, что C является относительно невелик в этой задаче.
Важно понимать природу допущения
Быть сделанным. Мы не предполагаем, что C
нуль. Если бы мы это сделали, все неизвестное исчезло бы из
уравнение! Мы только предполагаем, что C
небольшой. Так мало по сравнению с исходной концентрацией SO 3
что это не имеет существенного значения, когда 2 C
вычитается из этого числа.Мы можем записать это предположение как
следует.
Мы не предполагаем, что C
нуль. Если бы мы это сделали, все неизвестное исчезло бы из
уравнение! Мы только предполагаем, что C
небольшой. Так мало по сравнению с исходной концентрацией SO 3
что это не имеет существенного значения, когда 2 C
вычитается из этого числа.Мы можем записать это предположение как
следует.
0,100 — 2 С 0,100
Теперь вернемся к уравнению, которое мы пытаемся решить.
Предполагая, что 2 C намного меньше 0,100, мы можем заменить это уравнение на следующее приближенное уравнение.
Расширение этого дает уравнение, которое намного легче решить для .
4 C 3 1,6 x 10 -12
С 7,4 x 10 -5 М
Прежде чем двигаться дальше, мы должны проверить наше предположение. что 2 С
настолько мал по сравнению с 0,100, что не имеет значения.
существенная разница, когда она вычитается из этого числа. Является
это предположение справедливо? Является ли 2 C достаточно маленьким по сравнению с 0.от 100 до
игнорировать?
что 2 С
настолько мал по сравнению с 0,100, что не имеет значения.
существенная разница, когда она вычитается из этого числа. Является
это предположение справедливо? Является ли 2 C достаточно маленьким по сравнению с 0.от 100 до
игнорировать?
0,100 — 2(0,000074) 0,100
Да, 2 С на порядок меньше ошибки эксперимента участвует в измерении начальной концентрации SO 3 .
Таким образом, мы можем использовать это приблизительное значение C для рассчитать равновесные концентрации SO 3 , SO 2 , и О 2 .
[СО 3 ] = 0,100 — 2 С 0,100 М
[SO 2 ] = 2 C 1,5 x 10 -4 M
[O 2 ] = C 7,4 x 10 -5 M
Равновесие между SO 3 и смесями SO 2
и O 2 , поэтому решительно выступает за SO 3 , а не
СО 2 .
Мы можем проверить результаты нашего расчета, подставив эти результаты в выражение константы равновесия для реакция.
Значение константы равновесия, вытекающее из этого расчет согласуется со значением, приведенным в задаче, в пределах экспериментальная ошибка. Наше предположение, что 2 C равно пренебрежимо мала по сравнению с начальной концентрацией SO 3 поэтому действителен, и мы можем быть уверены в ответах на него. обеспечивает.
Полезное правило для Проверка достоверности предположений
Справедливость предположения о малости C не вызывала сомнений.
по сравнению с начальной концентрацией SO 3 в
предыдущий раздел. Значение С было настолько мало, что 2 С было
на порядок меньше погрешности эксперимента
при измерении начальной концентрации SO 3 .
В общем, мы можем получить некоторое представление о том, может ли C быть достаточно мала, чтобы ее можно было игнорировать при сравнении начальной реакции частное от константы равновесия реакции. Если Q c и K c оба намного меньше 1, или оба намного больше 1, реакция не очень далеко идти к равновесию, а предположение о том, что C мало достаточно, чтобы быть проигнорированным, вероятно, является законным.
Возникает интересный вопрос: как
мы решаем, допустимо ли предположить, что достаточно мало
игнорировать? Ответ на этот вопрос зависит от того, насколько
ошибку, которую мы готовы допустить в наших расчетах, прежде чем мы
больше не доверяйте результатам. Как правило, химики
предположим, что C пренебрежимо мало до тех пор, пока
прибавляется или вычитается из начальных концентраций
реагентов или продуктов составляет менее 5% от исходного
концентрация. Лучший способ решить, является ли предположение
соответствует этому эмпирическому правилу в конкретном расчете, это попробовать
и посмотрите, работает ли он.
Лучший способ решить, является ли предположение
соответствует этому эмпирическому правилу в конкретном расчете, это попробовать
и посмотрите, работает ли он.
| Практическая задача 5: Аммиак получают из азота и водорода по следующей схеме обратимая реакция. N 2 ( г ) + 3 H 2 ( г ) 2 NH 3 ( г ) Предположим, что начальная концентрация N 2 равно 0.050 молей на литр и начальная концентрация H 2 составляет 0,100 моль на литр. Рассчитать равновесные концентрации трех компонентов эта реакция при 500 o C, если равновесие константа реакции при этой температуре равна 0,040. Нажмите здесь, чтобы проверить свой ответ на практическое задание 5 Нажмите здесь, чтобы увидеть решение практической задачи 5 |
Что мы делаем, когда приближение не удается?
Легко представить задачу, в которой предположение о том, что C мало
по сравнению с начальными концентрациями не может быть достоверным.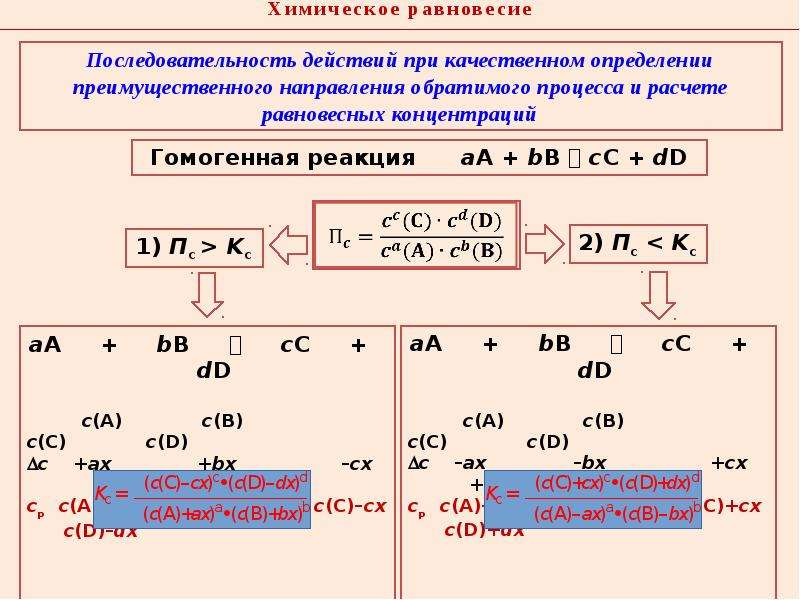 Все, что нам нужно сделать, это построить задачу, в которой
большая разница между значениями Q c
для начальных концентраций и К с
для реакции в состоянии равновесия. Рассмотрим следующую задачу,
Например.
Все, что нам нужно сделать, это построить задачу, в которой
большая разница между значениями Q c
для начальных концентраций и К с
для реакции в состоянии равновесия. Рассмотрим следующую задачу,
Например.
|
Начнем снова с представления информации в проблема следующим образом.
|
Первый шаг всегда один и тот же: сравните начальное значение коэффициента реакции при равновесии постоянный.
Связь между коэффициентом начальной реакции ( Q c
= 0) и константа равновесия ( K c
= 3 x 10 6 ) говорит нам о том, что мы, возможно, уже имеем
подозревается, реакция должна сместиться вправо, чтобы достичь
равновесие.
Кто-то может спросить: «Зачем вычислять начальное значение коэффициент этой реакции? Разве не очевидно, что реакция должна сместиться вправо, чтобы получить хотя бы какое-то NO 2 ?» Да это так.Но вычисление значения Q c ибо реакция не только говорит нам, в каком направлении она движется. смещаться, чтобы достичь равновесия. Это также дает нам указание на какой путь должна пройти реакция, чтобы достичь равновесия.
В данном случае Q c это очень много менее K c для реакции что мы должны заключить, что начальные условия очень далеки от равновесия.Поэтому было бы ошибкой полагать, что маленький.
Мы не можем считать, что в этой задаче пренебрежимо мало, но
мы можем переопределить задачу так, чтобы это предположение стало
действительный. Ключ к достижению этой цели – помнить о
условия, при которых мы можем предположить, что это достаточно мало, чтобы быть
игнорируется.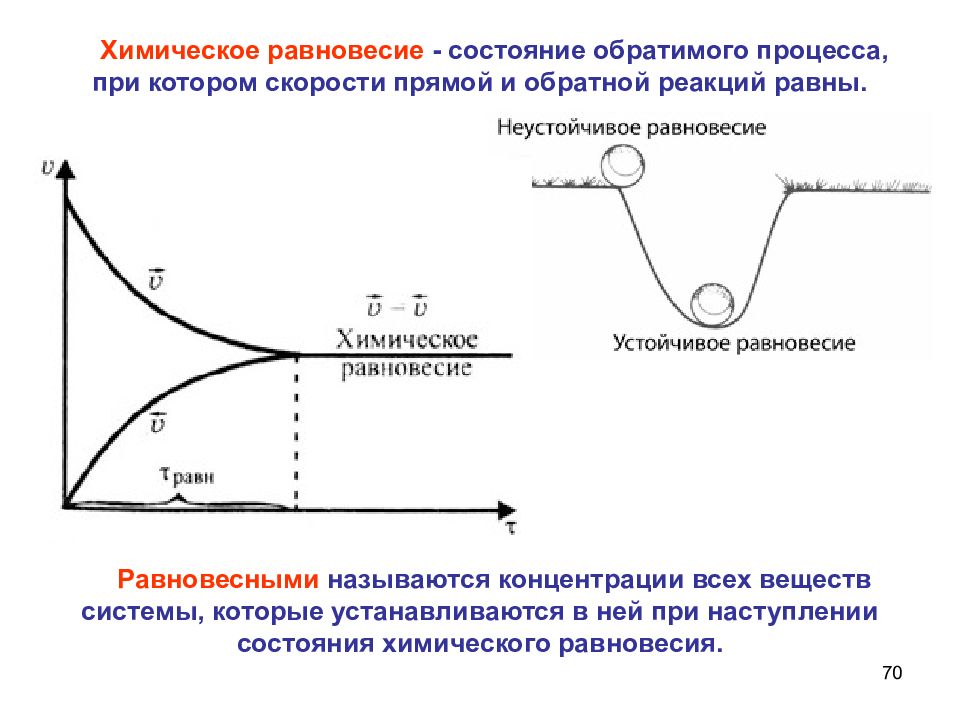 Это предположение справедливо, только если Q c
имеет тот же порядок величины, что и K c .(Когда Q c и K c
оба много больше 1 или намного меньше 1.) Мы можем решить
проблемы, для которых Q c не подходит
K c путем переопределения начального
условия так, что Q c становится близким
до K c (см. рис. ниже).
Это предположение справедливо, только если Q c
имеет тот же порядок величины, что и K c .(Когда Q c и K c
оба много больше 1 или намного меньше 1.) Мы можем решить
проблемы, для которых Q c не подходит
K c путем переопределения начального
условия так, что Q c становится близким
до K c (см. рис. ниже).
Чтобы показать, как это можно сделать, вернемся к задаче приведены в этом разделе.
Константа равновесия реакции между NO и O 2
для формирования NO 2 намного больше, чем 1 ( K c
= 3 х 10 6 ). Это означает, что равновесие благоприятствует
продукты реакции. Лучший способ справиться с этой проблемой —
провести реакцию как можно дальше вправо, а затем
пусть вернется к равновесию. Поэтому давайте определим
промежуточный набор условий, которые соответствуют тому, что
произойдет, если мы сдвинем реакцию как можно дальше вправо.
Лучший способ справиться с этой проблемой —
провести реакцию как можно дальше вправо, а затем
пусть вернется к равновесию. Поэтому давайте определим
промежуточный набор условий, которые соответствуют тому, что
произойдет, если мы сдвинем реакцию как можно дальше вправо.
|
Мы можем увидеть, к чему это приведет, рассчитав реакцию частное для промежуточных условий.
Коэффициент реакции теперь больше равновесного постоянна, и реакция должна сместиться влево, чтобы достичь равновесие. Некоторые из NO 2 теперь должны разложиться на форма NO и O 2 .Связь между изменениями в концентрация трех компонентов этой реакции равна определяется стехиометрией реакции, как показано на рисунок ниже.
| |
(NO 2 ) в два раза больше, чем (O 2 ).
Подставим теперь то, что мы знаем о реакции, в постоянное выражение равновесия.
Поскольку коэффициент реакции для промежуточных условий
и константа равновесия относительно велики, мы можем
предположим, что реакция не должна идти очень далеко, чтобы достичь
равновесие. Другими словами, мы предполагаем, что 2 C равно
небольшая по сравнению со средней концентрацией NO 2
и вывести следующее приближенное уравнение.
Другими словами, мы предполагаем, что 2 C равно
небольшая по сравнению со средней концентрацией NO 2
и вывести следующее приближенное уравнение.
Затем мы решаем это уравнение для приблизительного значения C.
Теперь проверим наше предположение, что 2 C достаточно мал по сравнению с промежуточной концентрацией NO 2 игнорировать.
Значение 2С составляет менее 2% от промежуточного концентрации NO 2 , что означает, что его можно правомерно игнорировать в этом расчете.
Поскольку аппроксимация верна, мы можем использовать новое значение для расчета равновесных концентраций NO, NO 2 , и О 2 .
Результаты этого расчета дают представление о
химия загрязняющих веществ, образующихся при внутреннем сгорании
двигатель. При сгорании смеси бензина и воздуха N 2
и O 2 на воздухе реагируют с образованием NO, который затем может реагировать
с кислородом с образованием NO 2 .
| Н 2 ( г ) | + | О 2 ( г ) | 2 НО( г ) | ||
| 2 НО( г ) | + | О 2 ( г ) | 2 НЕТ 2 ( г ) |
Хотя продукт этих реакций часто описывается как NO x для обозначения того, что это смесь NO и NO 2 это Расчет показывает, что доминирующий продукт реакции будет NO 2 , если эта реакция придет в равновесие.
Мы можем проверить наши расчеты, подставив эти концентрации обратно в выражение константы равновесия.
Еще раз, мы можем принять справедливость предположения, что мы
должны были сделать, чтобы получить эти равновесные концентрации, потому что
значение константы равновесия, которое получается из этого
расчет согласуется со значением K c
дано в задаче, в пределах погрешности эксперимента.
В общем, предположение, что C мало по сравнению с начальные концентрации реагентов или продуктов работают лучше всего при следующих условиях.
1. Когда К с << 1 и мы приближаться к равновесию слева направо. (Начнем с избытка реагенты и образуют некоторые продукты.)
2. Когда К с >> 1 и мы приближаться к равновесию справа налево.(Начнем с избытка продукты и образуют некоторые реагенты.)
Равновесия Выражено в парциальных давлениях
Химики обычно изучают газофазные равновесия, следуя парциальные давления газов в реакции. Мы можем понять почему это возможно, если преобразовать уравнение идеального газа в дайте следующую зависимость между давлением газа и его концентрация в молях на литр.
Таким образом, мы можем охарактеризовать следующую реакцию
| Н 2 ( г ) | + | 3 Н 2 ( г ) | 2 NH 3 ( г ) |
с константой равновесия, определяемой в единицах концентрация
или константа равновесия, определяемая через парциальные
давления.
Какая связь между К р и K c для газофазной реакции? Согласно перестроенной версии уравнения идеального газа, давление газа равно концентрации газа произведение постоянной идеального газа на температуру в единицах кельвина.
Следовательно, мы можем вычислить значение K p для реакции путем умножения каждого из членов в K c выражение по RT .
Сбор терминов в этом примере дает следующий результат.
К р = К с х ( РТ ) -2
В общем значение К р для реакции можно рассчитать из K c со следующим уравнением.
В этом уравнении n — это разница между числом молей
продуктов и количество молей реагентов в уравновешенном
уравнение.
Техника решения задач с использованием К р выражения такие же, как и для K c проблемы, за исключением того, что парциальные давления используются вместо концентрации для представления количества исходных материалов и продукты, которые присутствуют как изначально, так и в равновесии.
Влияние Температура химической реакции
Если константа равновесия действительно постоянна, почему мы имеем беспокоиться о температуре реакции?
Ответ прост.Оба K c и K p для реакции константы при данной температуре, но они могут меняться с температурой. Рассмотреть возможность равновесие между NO 2 и его димером N 2 O 4 , Например.
| 2 NO 2 ( г ) | Н 2 О 4 ( г ) |
На рисунке ниже показано влияние температуры на этот
равновесие.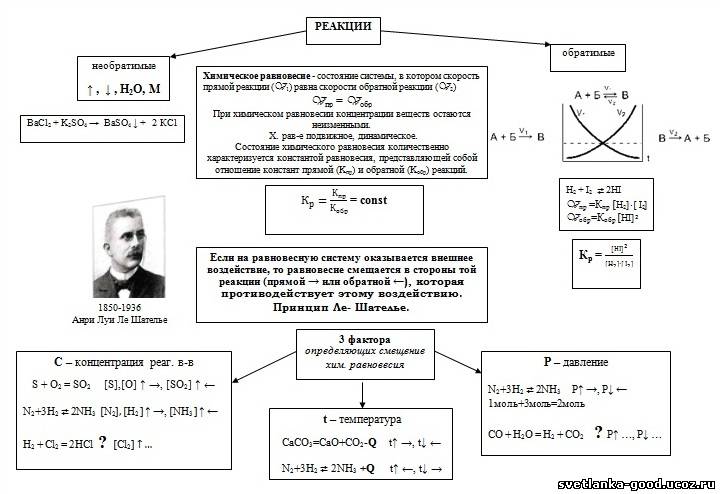 Когда мы охлаждаем запаянную пробирку, содержащую NO 2
в ванне с сухим льдом/ацетоном при -78 o C интенсивность
коричневая окраска газа NO 2 значительно уменьшается. Если
прогреваем пробирку на водяной бане, коричневый цвет становится
интенсивнее, чем при комнатной температуре.
Когда мы охлаждаем запаянную пробирку, содержащую NO 2
в ванне с сухим льдом/ацетоном при -78 o C интенсивность
коричневая окраска газа NO 2 значительно уменьшается. Если
прогреваем пробирку на водяной бане, коричневый цвет становится
интенсивнее, чем при комнатной температуре.
Константа равновесия этой реакции изменяется с температуры, как показано в таблице ниже. При низких температурах, равновесие благоприятствует димеру N 2 O 4 .В при высоких температурах равновесие благоприятствует NO 2 . То тот факт, что константы равновесия зависят от температуры объясняет, почему вы можете найти разные значения равновесия постоянной для одной и той же химической реакции.
| Температура Зависимость константы равновесия для Димеризация NO 2 | ||||
| Температура ( o С) | К р | К с | ||
| 100 | 0. 067 067 |
2,1 | ||
| 25 | 7,1 | 170 | ||
| 0 | 63 | 1400 | ||
| -78 | 25 000 000 | 400 000 000 | ||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Переключатель красно-синего света сдвигает равновесие в обе стороны | Research
Исследователи из Германии создали молекулярную ловушку, которая использует принцип Ле Шателье, управляя химическими реакциями для преодоления термодинамического равновесия. Ловушка встроена в цикл реакции, в котором свет разного цвета загорается на разных частях, поэтому она может перемещаться вперед и назад.
Ловушка встроена в цикл реакции, в котором свет разного цвета загорается на разных частях, поэтому она может перемещаться вперед и назад.
Предоставленные сами себе, некоторые обратимые реакции (например, этерификация или образование имина) достигают равновесия и никогда не завершаются. Эти реакции можно ускорить, физически удалив один из продуктов, например воду, с помощью аппарата Дина-Старка. Принцип Ле Шателье гласит, что такая возмущенная система будет реагировать движением к новому состоянию равновесия, тем самым производя больше желаемого продукта
.
Эта система работает аналогичным образом, но использует управляемые светом фотохимические реакции для удаления молекул с одной или другой стороны равновесного баланса, подталкивая реакцию дальше в этом направлении.Подобные динамические реакции можно использовать для создания самовосстанавливающихся полимеров.
«Если вы находитесь на термодинамическом минимуме, жизни нет», — говорит руководитель группы Стефан Хехт из Берлинского университета имени Гумбольдта. «Идея состоит в том, чтобы принудительно установить связь между сущностями, которые на самом деле не хотят быть связаны при данных условиях».
«Идея состоит в том, чтобы принудительно установить связь между сущностями, которые на самом деле не хотят быть связаны при данных условиях».
Гехта состоит из кетона, реагирующего с амином с образованием имина — обратимой конденсации, которая существует в термодинамическом равновесии. Но под красным светом имин превращается в анилин в результате необратимой реакции раскрытия цикла.Этот молекулярный механизм захвата нарушает равновесие конденсации, заставляя его создавать больше имина. Однако при синем свете равновесие конденсации смещается в противоположную сторону, поскольку кетоновое кольцо раскрывается и захватывается в форме фенола.
‘В зависимости от длины волны, которую мы используем, мы можем подтолкнуть систему полностью влево [где фенол и амин существуют как отдельные молекулы] или полностью вправо, где две сущности соединены [в форме анилин]», — объясняет Хехт.«Но самое интересное то, что мы также можем пойти назад — мы можем возбудить анилин [или фенол] ультрафиолетовым светом и вернуть его в термодинамически равновесную смесь».

 Ульяновска
Ульяновска )
) rar
rar ”»>
”»> 
 100 молей
за литр и отсутствует PCl 3 или Cl 2
в системе, когда мы начинаем, давайте рассчитаем
концентрации PCl 5 , PCl 3 и
Cl 2 в равновесии.
100 молей
за литр и отсутствует PCl 3 или Cl 2
в системе, когда мы начинаем, давайте рассчитаем
концентрации PCl 5 , PCl 3 и
Cl 2 в равновесии.  030
030  042 моля на литр.
042 моля на литр.  100 М
100 М  Предполагать
исходные концентрации 0,100 M
для NO и 0,050 M для O 2 .
Давайте посчитаем
концентрация трех
компоненты этой реакции при
равновесие.
Предполагать
исходные концентрации 0,100 M
для NO и 0,050 M для O 2 .
Давайте посчитаем
концентрация трех
компоненты этой реакции при
равновесие.  100 М
100 М