10. Химический состав клетки (белки, их структура и функции).
Белки,
или протеины, составляюи ри 50 до 85%
органических соединений, входящих в
состав живых организмов. Во всех тканях
любых существ важнейшей частью являются
белки. Они входят в состав всех клеток,
клеточных органоидов и межклеточных
жидкостей. Основными элементами белка
являются: кислород, водород, азот и сера.
Кроме того, в их состав могут входить
фосфор, железо, магний и другие.
Молекула
белка — типичный полимер, она состоит
из аминокислот. При соединении аминокислот
в молекуле белка образуется химическая
связь между карбоксильной группой
аминокислоты и аминной группой другой.
Связь которая образуется между молекулами
аминокислота, называется пептидной.
Белки имеют 4 структуры белка:
Первичной
структурой белковой молекулы является
полипептидная цепь.
Внутримолекулярные
силы заставляют цепь изгибаться –
возникает вторичная структура.
11. Нуклеиновые кислоты, их строение, локализация, значение
Простейшие
нуклеиновые кислоты – мононуклеотиды.
Более сложные нуклеиновые кислоты
состоят из двух или более нуклеотидов
– полинуклеотиды.

12. Роль
ДНК и РНК в передаче наследственной
информации. Основные этапы: транскрипция,
процессинг, трансляция.
Главную
роль в процессе передачи и реализации
наследственной информации играют
нуклеиновые кислоты. Основная биологическая
функция ДНК заключается в хранении,
постоянном самовозобновлении,
самовоспроизведении и передаче
генетической информации клетке.
Информация хранится в последовательности
нуклеотидов. Эта последовательность
нуклеотидов, или генетический код,
контролирует последовательность
аминокислот в молекуле белка. ДНК
является матрицей для построения иРНК.
ДНК принимает участие только в одном
этапе биосинтеза белка: транскрипции.
Транскрипция
– процесс переноса генетического кода,
записанного на молекуле ДНК на молекулу
иРНК. Транскрипция происходит при
синтезе молекул иРНК, нуклеотиды которой
присоединяются к нуклеотидам ДНК по
принципу комплементарности. Молекула
иРНК снимается с ДНК, как с матрицы,
после чего она отделяется и перемещается
в цитоплазму, где в специальных органоидах
– рибосомах происходит процесс
трансляции.
§5. Химический состав клетки | 8 класс Учебник «Биология» «Атамура»
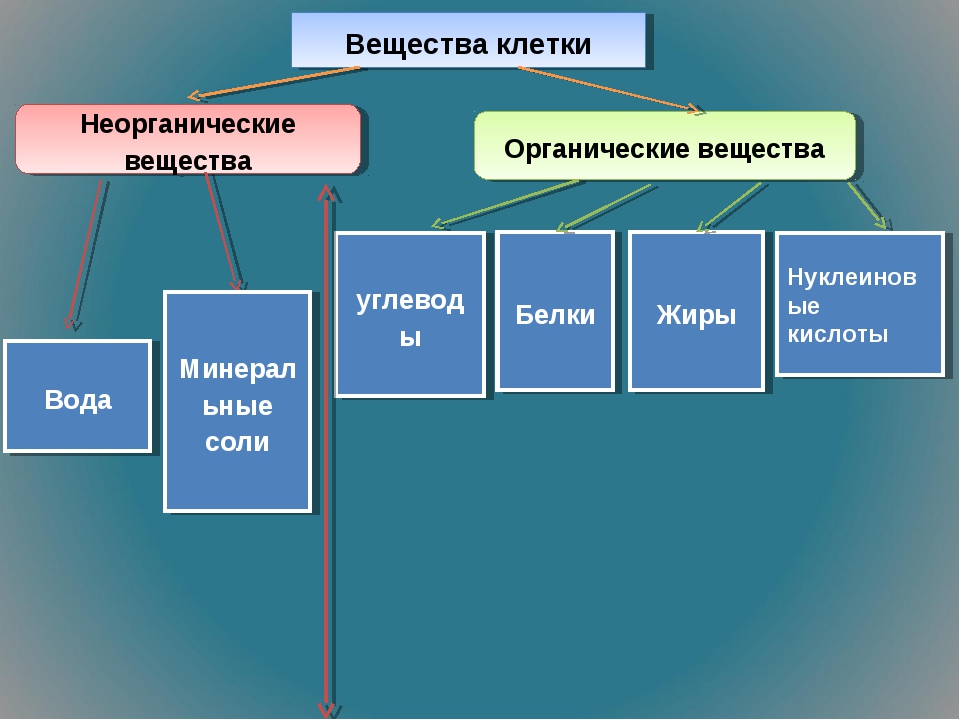
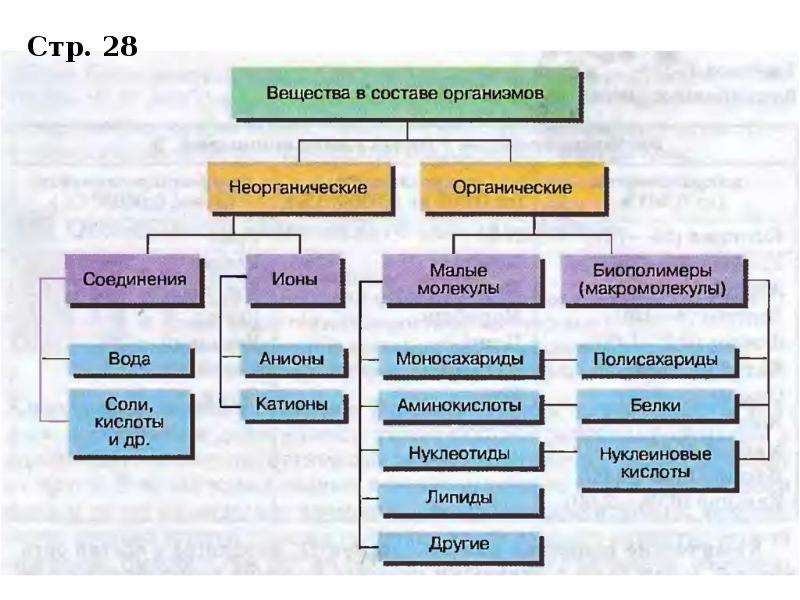
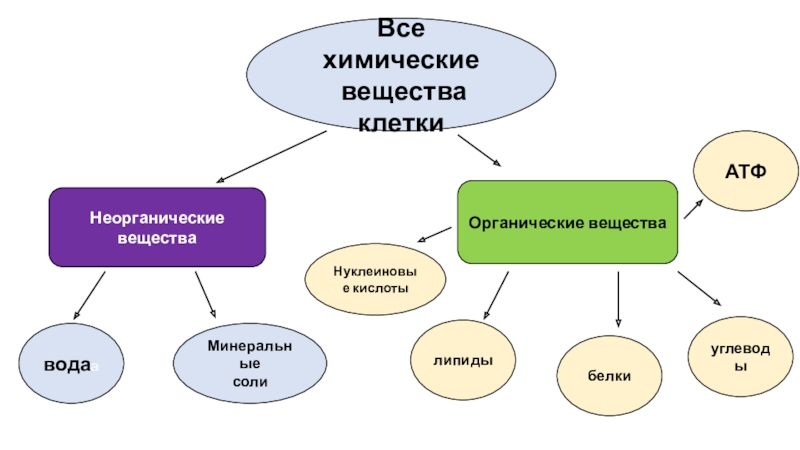
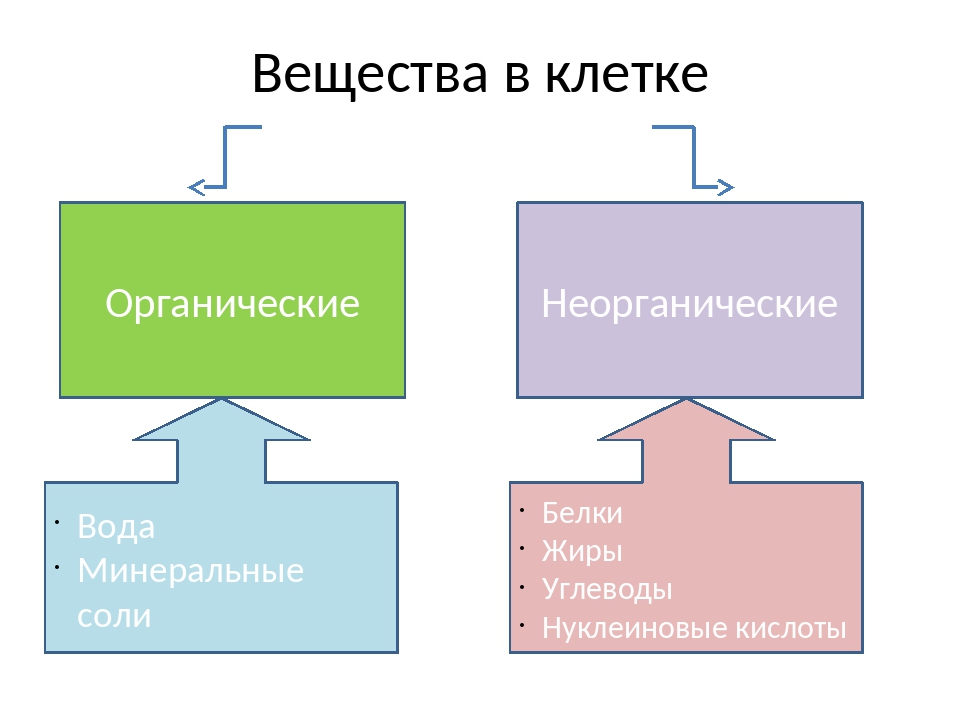
В
состав каждой клетки входят органические и неорганические соединения. Органические вещества — это белки, жиры, углеводы и нуклеиновые кислоты. Они
составляют 20-30% содержимого клетки.
Органические вещества — это белки, жиры, углеводы и нуклеиновые кислоты. Они
составляют 20-30% содержимого клетки.
Белки — сложные органические соединения. В их состав обязательно входят атомы углерода, водорода, кислорода, азота, серы. Иногда могут входить и другие вещества. Они состоят из 20 видов аминокислот.
Жиры содержат всего три элемента: углерод, водород и кисло-
рол. Жиры легче волы и не растворяются в ней. Они состоят из глицерина (простейший трехатомный спирт) и жирных кислот.
Углеводы также содержат углерод, водород и кислород. К углеводам относятся различные растворимые и нерастворимые в воде сахара. Наиболее распространенные углеводы — глюкоза (виноградный сахар) и гликоген (животный крахмал). Гликоген — запасной углевод, он накапливается в клетках печени и мышц, а глюкоза главный источник энергии.
Белки
являются основным строительным материалом клетки. Молекулы белков участвуют в
ускорении химических реакций клеток. Кроме того, при растеплении белков
выделяется энергия. Жиры входят в состав клеточных мембран. При расщеплении
жиров выделяется большое количество энергии.
Жиры входят в состав клеточных мембран. При расщеплении
жиров выделяется большое количество энергии.
Важнейшие органические вещества — нуклеиновые кислоты. Названы они так потому, что образуются в ядре (от лат. нуклеус) клетки. В состав нуклеиновых кислот входят атомы углерода, кислорода, водорода, азота, а также фосфора.
Различают 2 вида нуклеиновых кислот: дезоксирибонуклеиновую (ДНК) и рибонуклеиновую (РНК). ДНК находится в основном в хромосомах клетки и регулирует передачу наследственных признаков от родителей потомству, а также определяет строение белков клетки. РНК находится в цитоплазме и участвует в образовании собственных белков клетки.
Неорганические
соединения клетки — вода и минеральные вещества. В цитоплазме клетки все
вещества находятся в растворенном в воде состоянии. Много в ней растворенных
белков. Поэтому цитоплазма — густая, тягучая жидкость. Вода
необходима клетке как растворитель, так как различные химические реакции в клетке
проходят только между растворенными веществами.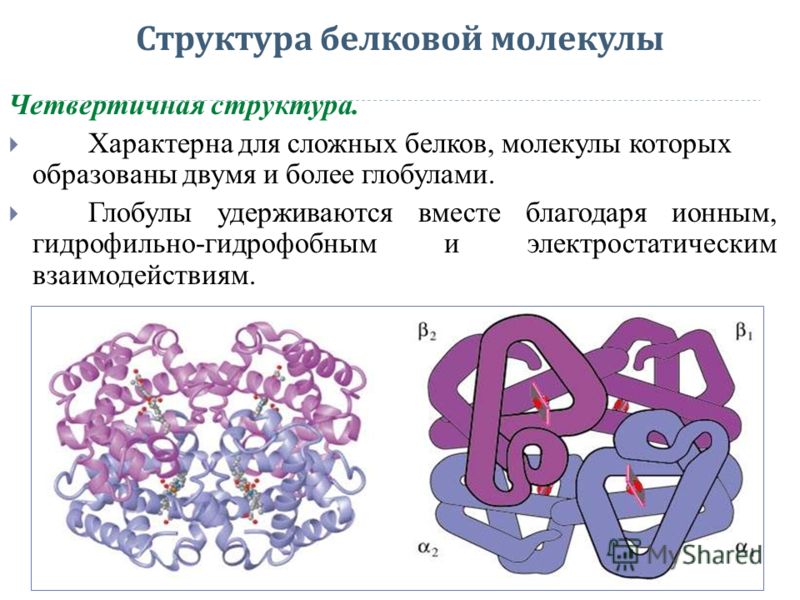
Из минеральных солей наиболее часто встречаются хлористый натрий, хлористый калий, а также фосфаты и карбонаты натрия, калия, кальция, магния. Минеральные соли способствуют распределению воды между клетками и межклеточным веществом, накапливаются в зубах и костях, делая их прочными, участвуют в процессах возбуждения.
А
1. Какие вещества входят в состав клеток? Какова роль минеральных солей в клетке?
2. Как вы понимаете термин обмен веществ? Объясните на примере.
3. Что собой представляют углеводы? Какую функцию они выполняют?
2. В какой части клетки образуются нуклеиновые кислоты? Из каких элементов они состоят?
3. Назовите элементы, входящие в состав жиров. Какие функции они выполняют?
1. Из каких химических соединений состоит
клетка?
Из каких химических соединений состоит
клетка?
2. Назовите элементы, входящие в состав углеводов. Какие вещества к ним относятся? Какова их роль?
3. Какие элементы входят в состав белков? Какую функцию они выполняют в клетках?
Химический состав клетки – онлайн-тренажер для подготовки к ЕНТ, итоговой аттестации и ВОУД
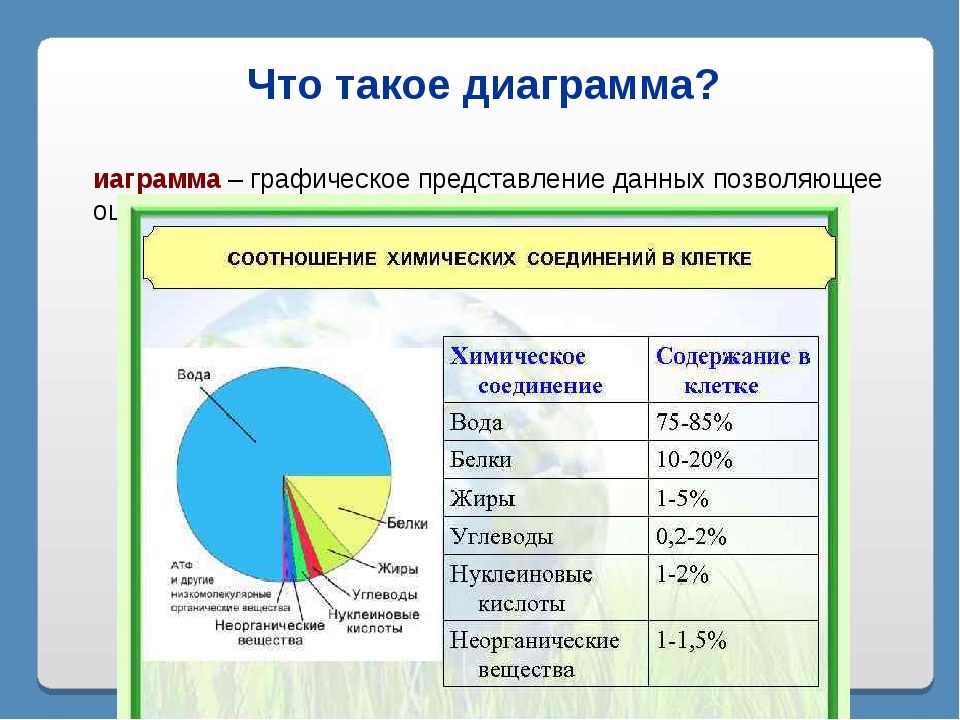
Химический состав клетки определяется наличием в ней органических и неорганических веществ.
Из неорганических веществ клетки вода составляет около 65% ее массы: она является средой и растворителем, участвует в химических реакциях, перемещении веществ, терморегуляции, образовании клеточных структур, определяет объем и упругость клетки. Большинство веществ поступает в организм и выводится из него в водном растворе.
Содержание минеральных веществ в клетках незначительно, но роль их велика: они поддерживают осмотическое равновесие, регулируют различные биохимические и физиологические процессы.
Органические вещества – составляют 20–30% состава клетки. Они могут быть простыми (аминокислоты, глюкоза, глицерин и жирные кислоты) и сложными (белки, полисахариды, нуклеиновые кислоты, липиды). Наиболее важное значение имеют белки, жиры, углеводы, нуклеиновые кислоты.
Белки – это основные и наиболее сложные вещества любой клетки. Белки являются макромолекулами, и состоят из простых соединений – аминокислот (в естественных белках содержится 20 альфа-аминокислот). Объединяясь в различной последовательности и количестве, они образуют большое разнообразие (до 1000) белков. Их роль в жизни клетки огромна: строительный материал организма, катализаторы (белки-ферменты ускоряют химические реакции), транспорт (гемоглобин крови доставляет клеткам кислород и питательные вещества и уносит углекислый газ и продукты распада).
Углеводы – органические вещества, состоящие из углерода, водорода и кислорода. Наиболее простые из них моносахариды – гексоза, фруктоза, глюкоза (содержатся в фруктах, меде), галактоза (в молоке) и полисахариды – состоящие из нескольких простых углеводов. К ним относятся крахмал, гликоген. Углеводы – основной источник энергии для всех форм клеточной активности (движение, биосинтез, секреция и т. д.), играют роль запасных веществ.
Липиды – нерастворимые в воде жиры и жироподобные вещества. Они являются основным структурным компонентом биологических мембран. Липиды выполняют энергетическую функцию, в них содержатся жирорастворимые витамины.
Нуклеиновые кислоты – (от латинского слова «нуклеус» – ядро) – образуются в ядре клетки. Они бывают двух типов: дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). Биологическая роль их очень велика. Они определяют синтез белков и передачу наследственной информации.
ГБПОУ «МССУОР № 2» Москомспорта
Об организации
История училища берет своё начало с 19 мая 1977 года, когда приказом Министра просвещения СССР и Председателем Комитета по физической культуре и спорту при Совете Министров СССР №75/505, была открыта общеобразовательная средняя школа-интернат спортивного профиля по гребным видам спорта в г. Москве.
директор ГБПОУ «МССУОР № 2» Москомспорта
Захаров Андрей Анатольевич
Подробнее >
Услуги и сервисы
ОНЛАЙН-УСЛУГА
Спортивный календарь
Перечень официальных физкультурных и спортивных мероприятий Москвы, а также официальных значимых физкультурных, спортивных и массовых спортивно-зрелищных мероприятий, проводимых в Москве.
Открытый чемпионат и первенство ГБПОУ «МССУОР № 2»
01.08.2021 — 31.08.2021
Центр технических видов спорта «Москва» (г. Москва, проезд. Проектируемый 4386-й, дом 1А)
Открытое первенство спортивной школы по велосипедному спорту
02.08.2021 — 05.09.2021
Комплекс спортивных сооружений «Крылатское» (г.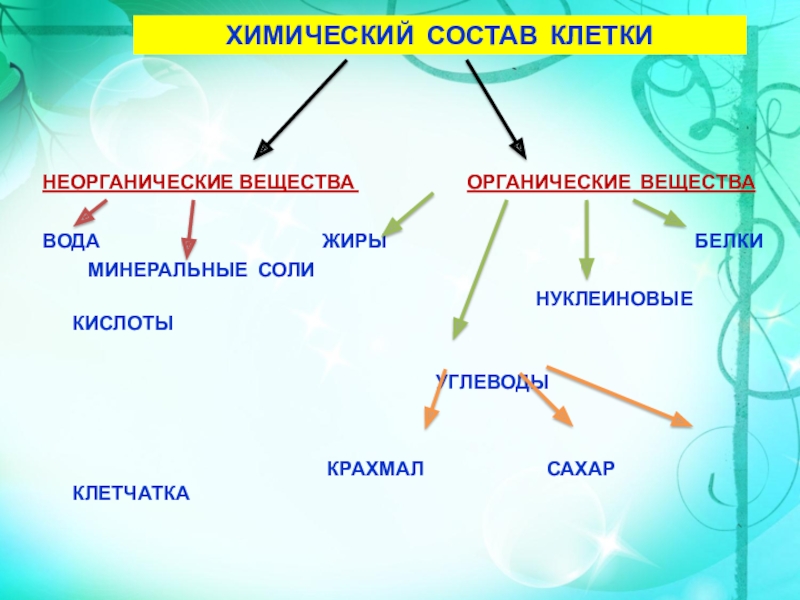 Москва, ул. Крылатская, дом 10)
Москва, ул. Крылатская, дом 10)
Открытое первенство спортивной школы по велосипедному спорту
01.09.2021 — 30.09.2021
Велодром «ВМХ «Печатники» (г. Москва, ул. Гурьянова)
Разработка практического занятия по биологии на тему «Химический состав клетки. Белки» (1 курс СПО)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КАЛУЖСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ КАЛУЖСКОЙ ОБЛАСТИ
«КАЛУЖСКИЙ БАЗОВЫЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ПРАКТИЧЕСКОГО ЗАНЯТИЯ № 7
ПО ДИСЦИПЛИНЕ «БИОЛОГИЯ»
ТЕМА: «ХИМИЧЕСКИЙ СОСТАВ КЛЕТКИ. БЕЛКИ»
Специальность: 31.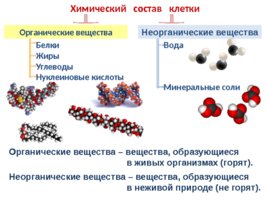 02.03 «Лабораторная диагностика»
02.03 «Лабораторная диагностика»
Курс: I
Преподаватель: В.М.Сафонова
г. Калуга, 2016г.
Специальность: 31.02.03 «Лабораторная диагностика»
Предмет: биология
Раздел 2. Учение о клетке.
Глава 2. Химический состав клетки.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №7
по теме 2.2.4: «Химический состав клетки. Белки»
Образовательные цели:
закрепить знания
о биологической роли белковых молекул,
о строении белковых молекул,
о классификации белков,
о свойствах и функциях белков;
обобщить и систематизировать знания студентов
о химическом составе клетки,
о важности органических веществ в организме;
научиться выполнять качественные реакции на белки.
Развивающие цели:
обогатить и усложнить словарный запас за счет новых терминов (актин, гистоны, инсулин, кератин, казеин, ферменты),
продолжить развитие мышления через обобщение, сравнение и анализ (сравнение простых и сложных белков, интерпретация результата),
развивать навыки самостоятельной работы и микро группами.
Воспитательные цели:
Вид практического занятия: обучающий
Метод обучения: репродуктивный
В.Д.С.: «Строение и функции клетки», «Пластический обмен», «Энергетический обмен», «Индивидуальное развитие организмов», «Химическая организация клетки».
М.Д.С.: клиническая патология «Наследственные болезни», цитология «Строение клетки», органическая химия «Белки», основы микробиологии и иммунологии «Химический состав бактерий», анатомия и физиология человека «Обмен веществ и энергии», «Кровь», «Ткани».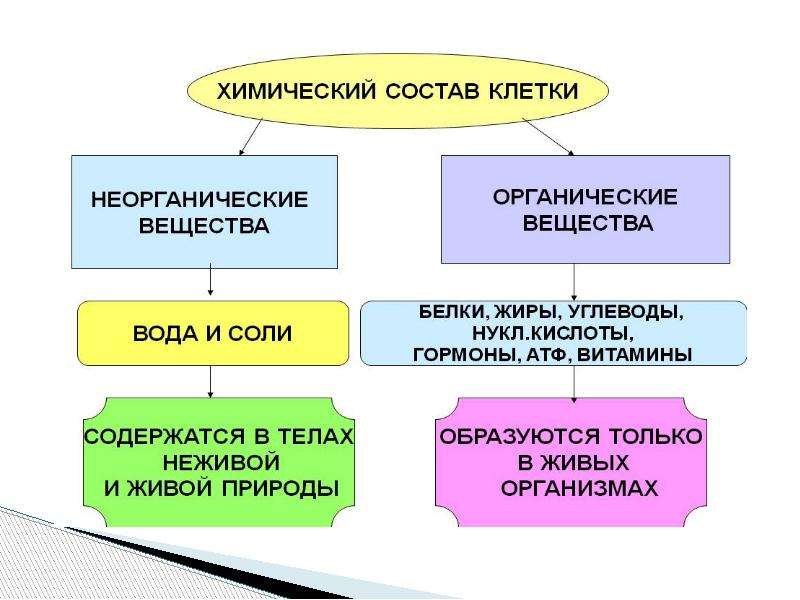
Наглядность: раздаточный материал.
СТРУКТУРА ЗАНЯТИЯ И РЕЖИМ ВРЕМЕНИ:
Организация аудитории_________________________________1_мин
Вступительное слово (тема, постановка цели, мотивация)____4_мин
Контроль знаний _____________________________________30_мин
Практическая работа__________________________________50_ мин
Подведение итогов, домашнее задание ___________________5_ мин
ХОД ЗАНЯТИЯ
Организация аудитории.
Вступительное слово преподавателя.
Преподаватель сообщает тему и цели занятия.
Мотивация:
Среди органических компонентов клетки самыми важными являются белки. Это природные органические соединения, обеспечивающие все жизненные процессы любого организма.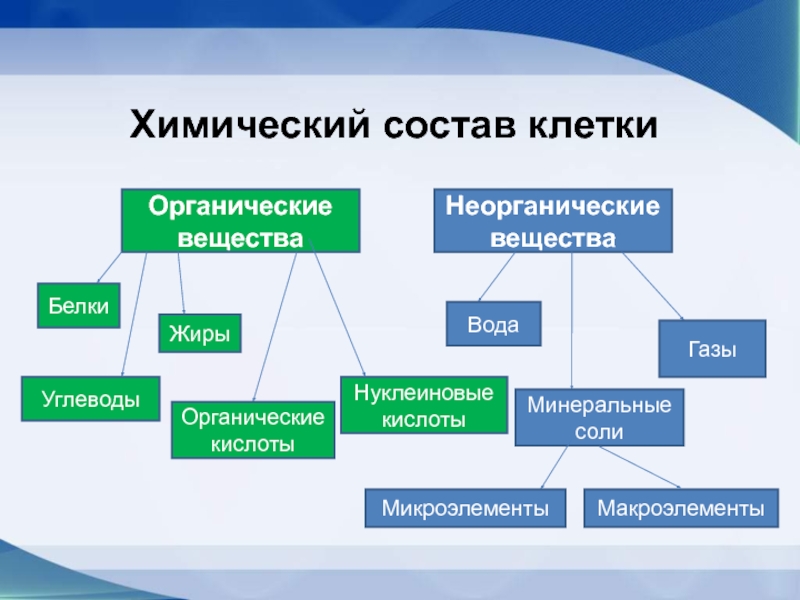 Данная тема актуальна, так как связана не только с жизнедеятельностью живых организмов, но и со строением клетки. Белки изучаются на молекулярном, клеточном, тканевом, органном, организменном уровнях. В переводе с греческого: белки – protos – первостепенный, что подчеркивает их значимость. На занятии мы закрепим знания по теме, а также проведем качественные реакции на обнаружение белковых молекул. Все знания по теме будут востребованы при изучении биохимии. Тема «Химический состав клетки. Белки» войдет в дифференцированный зачет, в экзаменационные вопросы по биологии. Без знания этой темы трудно будет усвоить тему «Пластический обмен» и обменные процессы, протекающие в организме.
Данная тема актуальна, так как связана не только с жизнедеятельностью живых организмов, но и со строением клетки. Белки изучаются на молекулярном, клеточном, тканевом, органном, организменном уровнях. В переводе с греческого: белки – protos – первостепенный, что подчеркивает их значимость. На занятии мы закрепим знания по теме, а также проведем качественные реакции на обнаружение белковых молекул. Все знания по теме будут востребованы при изучении биохимии. Тема «Химический состав клетки. Белки» войдет в дифференцированный зачет, в экзаменационные вопросы по биологии. Без знания этой темы трудно будет усвоить тему «Пластический обмен» и обменные процессы, протекающие в организме.
Контроль знаний.
1) Фронтальный опрос 5 мин. (приложение №1)
2) Письменный опрос 7 мин. (приложение №2)
3) Работа с таблицами и схемами 10 мин. (приложение №3)
4) Тестовые задания 8 мин. (приложение №4)
(приложение №4)
5) Практическое задание 50 мин (приложение №5)
Фронтальный опрос включает 10 вопросов. Длительность не более 5 минут. Его цель активизировать внимание студентов, сосредоточить на данной теме и определить первичный уровень знаний. Оценивается в 1 балл.
Письменный опрос. Предлагается 2 варианта, в каждом варианте по 3 задания. На выполнение задания отводится 7 минут. Листочки с выполненным ответом сдаются преподавателю. Цель задания – проверка знаний биологической терминологии, данной темы.
Критерий оценки: оценивается в 5 баллов.
Вопросы не раскрыты – 2 балла
3 вопроса не полностью раскрыты — 3 балла
2 вопроса раскрыты правильно, в 1 допущена ошибка – 4 балла
3 вопроса раскрыты правильно – 5 баллов
Работа с таблицами и схемами включает 3 задания по структуре белковой молекулы, ее функциям и классификации.
 На выполнение задания отводится 10 минут. Цель – закрепить знания, откорректировать знания по теме.
На выполнение задания отводится 10 минут. Цель – закрепить знания, откорректировать знания по теме.
Критерий оценки: оценивается в 5 баллов.
7 — правильных ответов — 3 балла, ниже – 2б
9 – 8 правильных ответов — 4 балла
10 — правильных ответов — 5 баллов.
Тестовые задания одного уровня сложности из 3 вариантов. Длительность 8 минут. Цель задания – глубже проконтролировать и провести коррекцию знаний.
Критерий оценки: оценивается в 5 баллов, из них:
7 – правильных ответов – 3 балла, ниже – 2 балла
9 — 8 правильных ответов -4 балла
10 — правильных ответов – 5 баллов
Практическое задание оценивается в 5 баллов. Длительность выполнения – 50 минуты. Цель: закрепить знания, полученные на лекции и при подготовке к практическому занятию через различные практические ситуации.
Подведение итогов, задание на дом.
Отметить достижение поставленной цели на занятии, активность и готовность группы студентов, выставить и объявить оценки с учетом всей работы на практическом занятии.
Преподаватель объявляет оценки за все задания. Набранные баллы переводятся в оценку по следующему критерию:
21 — 20 баллов — «5»
19 — 17 баллов — «4»
16 — 14 баллов — «3», ниже — «2».
Домашнее задание:
— конспект лекций;
— С.Г.Мамонтов «Общая биология», стр. 33-42;
— задание №3: составить тематический кроссворд.
Приложение 1
ФРОНТАЛЬНЫЙ ОПРОС.
Какие вещества называются белками?
К каким соединениям по отношению к воде относятся белки?
Какие соединения являются мономерами молекул белка?
Какая часть молекул аминокислот отличает их друг от друга?
Что такое первичная структура белка?
В каких органеллах клетки синтезируются белки?
Что такое денатурация белка?
Какую функцию выполняют белки – ферменты?
Какую роль выполняют белки – гормоны?
Почему белки редко используются в качестве источника энергии?
Приложение 2
ПИСЬМЕННЫЙ ОПРОС.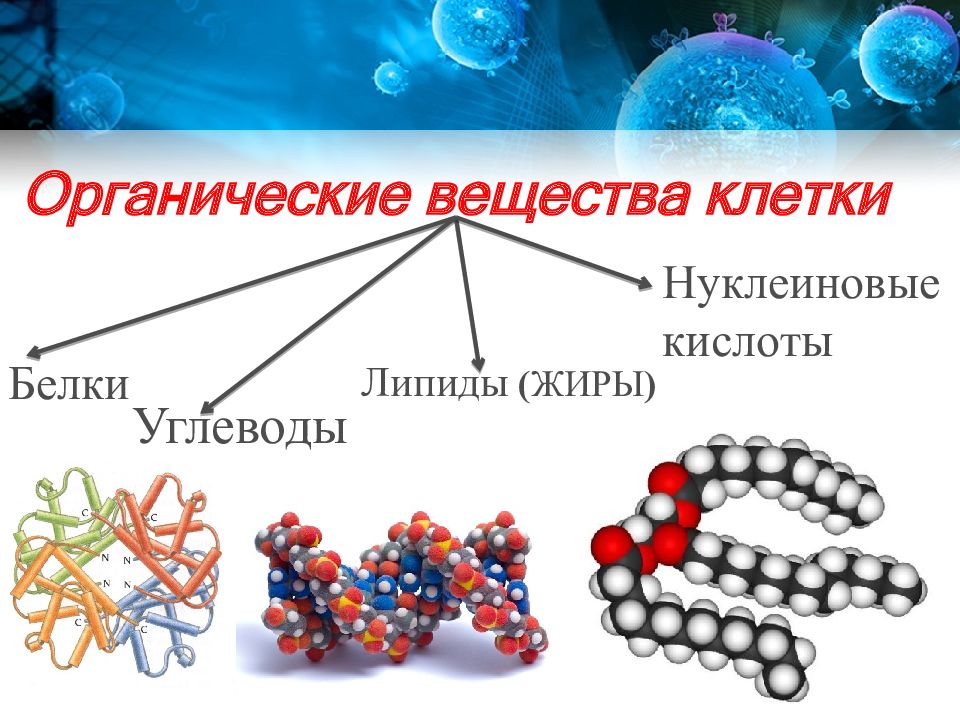
Вариант №1
Какие вещества относятся к белкам?
Какие функции выполняют белки?
Какие продукты питания богаты белками?
Вариант №2
Какое строение имеют белки?
Какова классификация белков?
Где в клетке и тканях локализованы белки?
Приложение 3
Вариант №1
Подпишите в общей формуле название частей, из которых состоит любая аминокислота.
Назовите сходство и различия в строении молекул всех аминокислот.
Заполните таблицу.
Характеристика уровней структурной организации белковой молекулы.
СтруктураХарактеристика
Первичная
Вторичная
Третичная
Четвертичная
Вариант №2
Рассмотрите схему образования дипептида.
 Подпишите название связи, соединяющей аминокислоты в молекуле белка.
Подпишите название связи, соединяющей аминокислоты в молекуле белка.Напишите название мономера белков.
Заполните таблицу.
Функции белков.
ФункцияВ чем заключается
Где осуществляется
Каталитическая (ферментативная)
Ускорение биохимических реакций (белки-ферменты)
В клетках
Структурная
Двигательная
Транспортная
Защитная
Регуляторная
Сигнальная
Энергетическая
Вариант №3
Схема какого процесса изображена на рисунке?
Какой цифрой на рисунке обозначена четвертичная структура организации белковой молекулы?
Заполните таблицу.
Классификация белков.
КлассификацияПредставители
По химическому составу
Простые
гистоны
2.
По трехмерной структуре
1.
2.
3.
По аминокислотному составу
1.
2.
Приложение 4
ВАРИАНТ 1
В тестовых заданиях выбрать один правильный ответ.
Сколько видов аминокислот относят к заменимым:
А. 8
Б. 12
В. 20
Г. 64
Какие химические связи определяют первичную структуру молекулы белка:
А. водородные
водородные
Б. пептидные
В. ионные
Г. гидрофобные
Какой из перечисленных белков имеет четвертичную структуру:
А. актин
Б. — глобулин
В. гемоглобин
Г. миозин
Какие вещества ускоряют химические реакции в клетке:
А. гормоны
Б. витамины
В. ферменты
Г. ингибиторы
Первичная структура белка – это:
А. укладка полипептидной цепи в форме спирали
Б. укладка полипептидной цепи в форме глобулы
В. порядок чередования аминокислот в полипептидной цепи
Г. структура белковых молекул доклеточных форм жизни
Факторы денатурации белковых молекул:
А. астрономические
астрономические
Б. психологические
В. химические
Г. все перечисленное
У гемоглобина есть, а у инсулина нет:
А. первичной структуры
Б. вторичной структуры
В. третичной структуры
Г. четвертичной структуры
Функции белков:
А. терморегуляторная
Б. выделительная
В. регуляторная
Г. метаболическая
Защитную функцию выполняют белки:
А. актин
Б. миозин
В. тубулин
Г. антитела
Сложные белки:
А. глобулины
Б. липопротеины
В. гистоны
Г. альбумины
альбумины
ВАРИАНТ 2
В тестовых заданиях выбрать один правильный ответ.
К классу химических соединений – «полипептиды», относятся:
А. жиры
Б. углеводы
В. белки
Г. нуклеиновые кислоты
К биологическим катализаторам относят:
жиры
Б. ферменты
В. углеводы
Г. сложные эфиры
Белок распадается на аминокислоты при разрушении его:
А. первичной структуры
Б. вторичной структуры
В. третичной структуры
Г. четвертичной структуры
Вторичная структура белка представляет собой:
спираль
глобулу
надмолекулярный агрегат
Все белковые молекулы, входящие в состав клеток живых организмов, построены из:
А. 10 типов аминокислот
10 типов аминокислот
Б. 20 типов аминокислот
В. 30 типов аминокислот
Г. бесконечного количества типов аминокислот
В каком случае показана пептидная связь:
А. – СО – NH —
Б. – СН2 – СН2 —
В. – NH – Ch3 —
Г. – NH – СН –
Белки, входящие в состав хромосом, называются:
А. гистоны
Б. протоны
В. хроматины
Г. аденины
Функции белков:
А. метаболическая
Б. анаболическая
В. структурная
Г. выделительная
Простые белки:
А. гликопротеины
Б. липопротеины
В.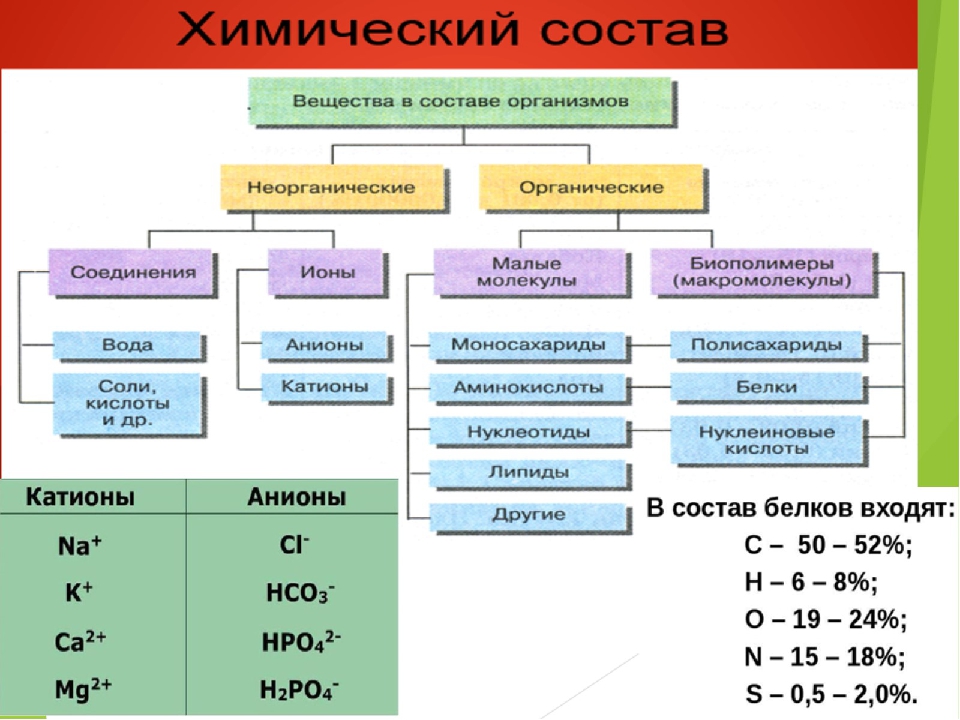 нуклеопротеины
нуклеопротеины
Г. глобулины
Защитную функцию выполняют белки:
А. фибриноген
Б. актин
В. гемоглобин
Г. тубулин
ВАРИАНТ 3
В тестовых заданиях выбрать один правильный ответ.
Третичная структура белка представляет собой:
А. линейную последовательность аминокислот
Б. спираль
В. глобулу
Г. надмолекулярный агрегат
Последовательность мономеров в белке называется:
А. первичная структура
Б. вторичная структура
В. третичная структура
Г. четвертичная структура
Шарообразные белки называются:
А.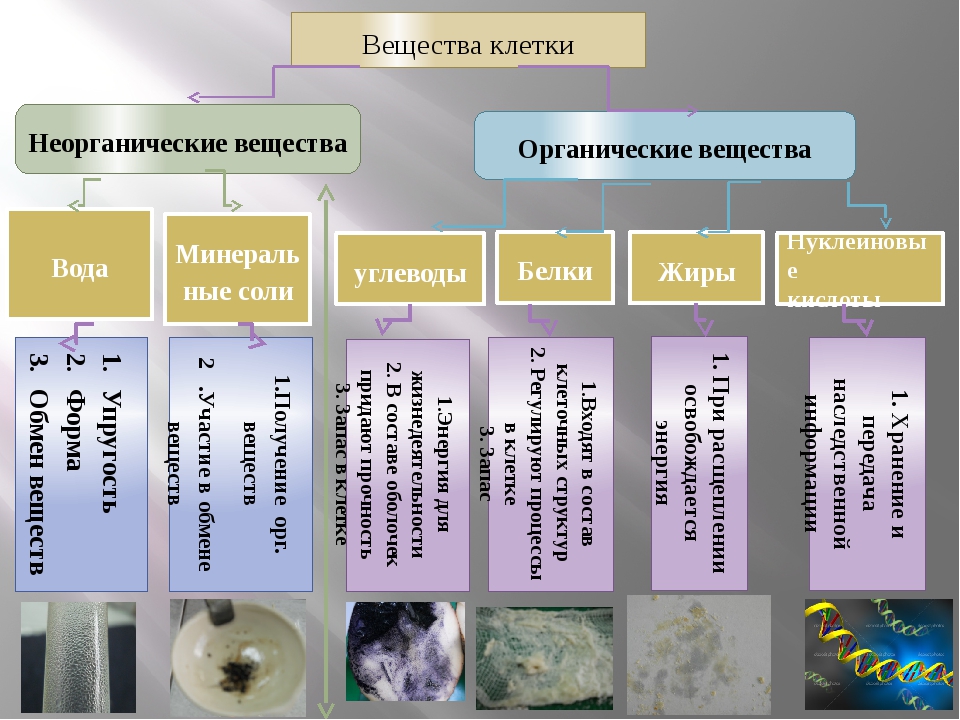 альбумины
альбумины
Б. фиброины
В. глобулины
Г. цистеины
Аминокислоты, которые не синтезируются в клетках человека, называются:
А. незаменимые
Б. невыносимые
В. невосполнимые
Г. непоправимые
Процесс утраты белковой молекулой своей структурной организации называется:
А. натурация
Б. денатурация
В. ренатурация
Г. прострация
В состав аминокислот не входит:
А. О
Б. С
В. Р
Г. N
Сложные белки:
А. гистоны
Б. гликопротеины
В. альбумины
Г. глобулины
глобулины
Вторичная структура белков обусловлена связями:
А. водородными
Б. дисульфидными
В. пептидными
Г. все перечисленное
Двигательную функцию выполняют белки:
А. гемоглобин
Б. альбумин
В. миозин
Г. антитела
Свойства белков – ферментов:
А. специфичность
Б. высокая активность при 00С
В. высокая активность при 50-700С
Г. рН среды не имеет значения
Приложение №5
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ СТУДЕНТАМ ПО ПРОВЕДЕНИЮ ПРАКТИЧЕСКОГО ЗАНЯТИЯ №7
ТЕМА 2.2.4: «Химический состав клетки. Белки»
ЦЕЛИ:
закрепить знания
1. о биологической роли белковых молекул,
о биологической роли белковых молекул,
2. о строении белковых молекул,
3. о классификации белков,
4. о свойствах и функциях белков;
обобщить и систематизировать знания студентов
о химическом составе клетки,
о важности органических веществ в организме;
научиться выполнять качественные реакции на белки.
ОСНАЩЕНИЕ ЗАНЯТИЯ:
раствора яичного белка
10% р-ра NaOH
1 % р-ра CuSO4
0,1% водного раствора нингидрина
концентрированной HNO3
20% ССК
спиртовка, держатель, пробирки
раздаточный материал.
ПЕРЕЧЕНЬ ЗАДАНИЙ ДЛЯ ВЫПОЛНЕНИЯ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ:
провести качественные реакции на белки:
а). Задание №1 Качественная реакция на пептидную связь — биуретовая реакция.
Принцип реакции:
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи. Интенсивность окраски зависит от длины пептидной цепи.
Ход определения: 2 мл раствора белка нагревают с 2 мл 10%-го раствора едкого кали или натра и несколькими каплями1%-го раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками. Наблюдаем эффект реакции.
б). Задание №2 Качественная реакция на a-Аминокислоты.
Принцип реакции: состоит в образовании окрашенного соединения, состоящего из нингидрина и продуктов гидролиза аминокислот.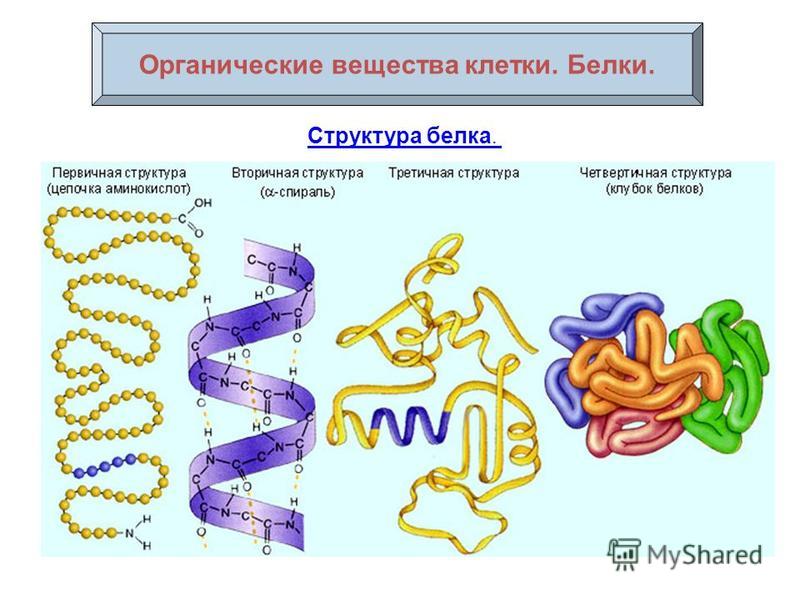
a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Ход определения: В пробирку наливают 1 мл 1%-го раствора яичного белка и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
в). Задание №3 Ксантопротеиновая реакция на циклические
аминокислоты.
Принцип реакции: состоит на образовании нитропроизводных ароматических аминокислот, например, фенилаланин, тирозин, триптофан. Нитропроизводные имеют желтую окраску в кислой среде и оранжевую – в нейтральной и щелочных средах.
Ход определения: в пробирку наливают 5 капель раствора яичного белка и добавляют 3-5 капель концентрированной азотной кислоты. Выпадает осадок свернувшегося белка (осадочная реакция). Если осадок содержит ароматические аминокислоты, то при нагревании осадок будет желтеть и растворяться. После охлаждения в пробирку добавляют по каплям 10 % р-р NaOH до появления оранжевого окрашивания вследствие образования натриевой соли динитротирозина.
провести реакции на осаждение белков:
а). Осаждение белков кипячением.
Принцип реакции: белки являются термолабильными соединениями и при нагревании свыше 50-600 С денатурируются.
Ход определения: в 2 пронумерованные пробирки налить по 5 капель раствора белка. Первую пробирку нагреть до кипения. При кипячении белок денатурирует и выпадает в осадок. Во вторую пробирку добавить 1 каплю раствора гидроокиси натрия и нагреть до кипения. Наблюдаем выпадение осадка.
Наблюдаем выпадение осадка.
б). Осаждение белков минеральными и органическими кислотами.
Принцип реакции: концентрированные кислоты (серная, азотная, соляная и др.) вызывают денатурацию белка за счет удаления факторов устойчивости белка в растворе (заряда и гидратной оболочки). Трихлоуксусная и сульфосалициловая кислоты осаждают белки. ССК используют в лабораторной диагностике для обнаружения белка в моче.
Ход определения: взять 2 пробирки, пронумеровать. В 1 пробирке провести реакцию Геллера. Реакция основана на денатурации белка в присутствии концентрированной азотной кислоты. В пробирку налить 5 капель раствора яичного белка и осторожно, под углом 450, добавить по каплям до появления осадка концентрированную азотную кислоту. Во 2 пробирку внести 5 капель раствора белка. К белку добавить 2 капли 20% раствора сульфосалициловой кислоты. Выпадает осадок, при небольшом количестве белка появляется муть или опалесценция.
В пробирки с осадками добавляем дистиллированную воду в объеме, равном содержимому пробирок, перемешиваем и проверяем, растворились ли осадки. Минеральные и сильные органические кислоты необратимо денатурируют белки, поэтому осадки не растворяются в воде.
Оформить в тетради результаты исследований.
Результаты исследований занести в таблицу
Реагент
Субстрат
Наблюдаемое окрашивание
Чем обусловлена реакция
Биуретовая
яичный белок
Нингидриновая
яичный белок
Ксантопротеиновая
яичный белок
Осадочные реакции белков
Чем обусловлена реакция и ее особенности
На явлениях денатурации белков основаны приемы и методы асептики и антисептики, дезинфекции в лечебной и практической медицине; пастеризация и консервирование продуктов в пищевой промышленности;
Фракционированное осаждение белков лежит в основе приготовления лечебных сывороток и биологических препаратов в иммунологии и фармации; разделения и очистки белков в препаративной биохимии.
Сделать вывод по работе, убрать рабочее место.
Задание на дом: тема «Химический состав клетки. Нуклеиновые кислоты. АТФ»,
— конспект лекций;
— С.Г.Мамонтов «Общая биология», М., ВШ., 2004, стр. 33-42;
— задание №3: составить тематический кроссворд.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ СТУДЕНТАМ ДЛЯ САМОПОДГОТОВКИ К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ №7
ТЕМА 2.2.4: «Химический состав клетки. Белки»
ЦЕЛИ:
I. закрепить знания
1. о биологической роли белковых молекул,
2. о строении белковых молекул,
3. о классификации белков,
4. о свойствах и функциях белков;
II. обобщить и систематизировать знания студентов
о химическом составе клетки,
о важности органических веществ в организме;
III. научиться выполнять качественные реакции на белки.
научиться выполнять качественные реакции на белки.
Время занятия: 90 мин.
Место проведения занятия: лаборатория
После подготовки к практическому занятию студенты должны:
ЗНАТЬ:
какие молекулы называют биополимерами
классификацию и функции белков
уровни организации белковой молекулы
свойства белковой молекулы
формулу аминокислоты
заменимые и незаменимые аминокислоты
Оснащение занятия: яичный белок, реактивы для проведения химических реакций, химическая посуда, раздаточный материал
ПЕРЕЧЕНЬ ЗАДАНИЙ ДЛЯ ВЫПОЛНЕНИЯ:
выполнить задания контроля знаний;
провести качественные реакции на белки;
провести реакции осаждения белков;
оформить в тетради результаты исследований;
сделать вывод по работе.

ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
Почему белковую молекулу называют полимером?
Какие вещества называют белками?
Какие соединения являются мономерами молекул белка?
Сколько из известных аминокислот участвуют в синтезе белков?
Какая часть молекул аминокислот отличает их друг от друга?
Почему аминокислоты называют амфотерными соединениями?
Посредством какой химической связи соединены между собой аминокислоты в молекуле белка первичной структуры?
Как образуются вторичная, третичная, четвертичная структуры белка?
В каких органеллах клетки синтезируются белки?
Где в клетке локализованы белки?
По какому признаку белки делятся на простые и сложные?
Какие белки и почему называются полноценные и неполноценные?
Какие свойства белков вам известны?
Что такое денатурация белка и каковы факторы, ее вызывающие?
Почему белки нежелательно использовать в качестве источника энергии?
Какие функции белков вам известны?
Ключевые понятия: мономеры и полимеры, пептидная связь, аминокислоты, радикал, незаменимые аминокислоты, амфотерность, протеины, глобула, денатурация, ренатурация, ферменты, антибиотики.
Литература:
С.Г.Мамонтов, В.Б.Захаров «Общая биология», М.,ВШ. 2004, стр. 33-42;
Биология: уч. пособие для мед. училищ/В.Н.Ярыгин, И.Н.Волков, В.И. Васильева и др. под ред. В.Н.Ярыгина – 2-е изд.-М.: изд. Юрайт, 2010-454с., с.27-30;
конспект лекций.
Тест 5. Биология. 10 класс. Химический состав клетки – белки, нуклеиновые кислоты и АТФ.
α-спираль, прошитая водородными связями
последовательность аминокислотных остатков в полипептидной цепи
взаимное расположение нескольких белковых цепей
пространственная конфигурация α-спирали, образованная за счет ковалентных полярных, неполярных и ионных связей
Химический состав клетки: органические вещества (углеводы, липиды)
Какие органические вещества входят в состав клеток и организмов? В состав клеток входят разные органические вещества. Основу их молекул образуют атомы углерода, связанные между собой и с другими атомами ковалентными связями.
Основу их молекул образуют атомы углерода, связанные между собой и с другими атомами ковалентными связями.
Для заполнения внешней электронной оболочки атому углерода не хватает четырех электронов, поэтому углерод может образовать четыре ковалентные связи с атомами водорода, кислорода или азота. Каждый атом углерода может также соединяться с другими атомами углерода.
Соединенные друг с другом атомы углерода способны образовывать разные структуры: линейные, циклические, разветвленные.
В состав клетки входят такие органические вещества, как углеводы, липиды, белки, нуклеиновые кислоты, АТФ. Крупные и сложные по строению молекулы органических соединений называют макромолекулами. Они состоят из более простых и небольших молекул-«кирпичиков». Эти «кирпичики» специфичны для разных веществ.
| Макромолекулы и их состав | ||||
| Сложные | Простые углеводы | |||
| Жиры | Спирт, глицерин и жирные кислоты | |||
| Белки | Аминокислоты | |||
| Нуклеиновые кислоты | Нуклеотиды | |||
«Кирпичиками» молекул белка являются аминокислоты, а нуклеиновых кислот — нуклеотиды.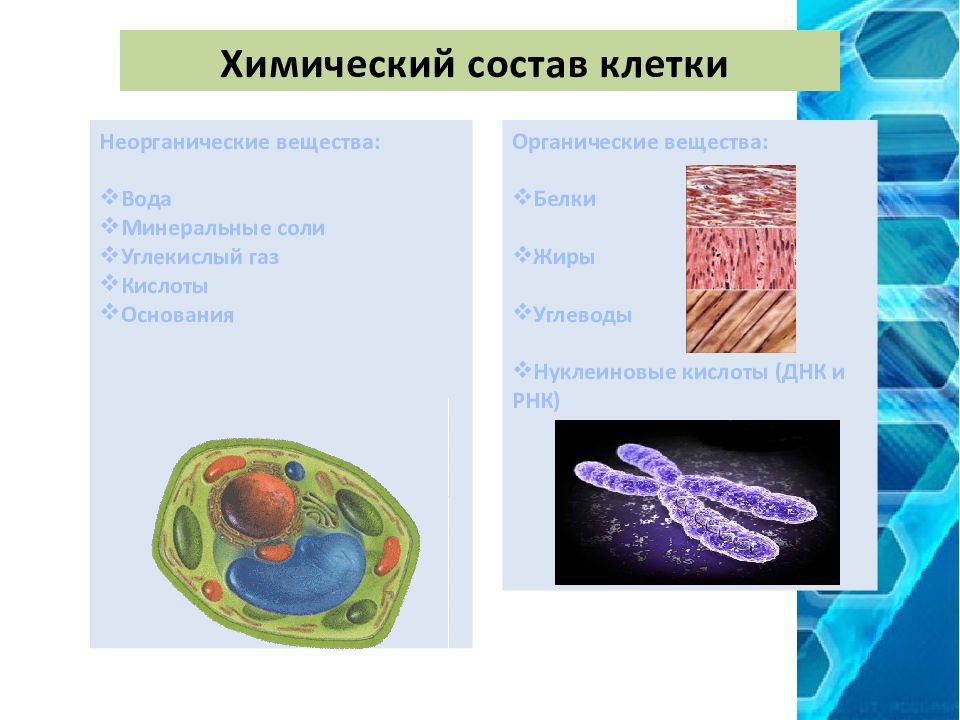 «Кирпичики» белков, нуклеиновых кислот одинаковы у всех организмов — от бактерий до человека, что говорит о единстве происхождения всего живого мира.
«Кирпичики» белков, нуклеиновых кислот одинаковы у всех организмов — от бактерий до человека, что говорит о единстве происхождения всего живого мира.
Познакомимся с некоторыми органическими веществами клетки. Углеводы — органические вещества, в состав которых входят углерод, водород и кислород. В молекулах углеводов соотношение между числом атомов углерода, водорода и кислорода составляет 1 : 2 : 1. Различают простые углеводы — моносахариды и сложные — п 1000 олисахариды.
Моносахариды — бесцветные твердые кристаллические вещества, хорошо растворимые в воде, обычно сладкие на вкус. К моносахаридам относят глюкозу, фруктозу, рибозу, дезоксирибозу и др. Глюкозы и фруктозы много в меде, фруктах. Сахар, который мы едим, состоит из остатков молекул глюкозы и фруктозы. Рибоза и дезоксирибоза входят в состав нуклеиновых кислот.
Основа молекул моносахаридов представляет собой линейную цепочку атомов углерода. Несмотря на то что углеродный остов может включать от трех и более атомов углерода, у всех углеводов один из атомов углерода связан двойной связью с атомом кислорода и образует карбонильную группу.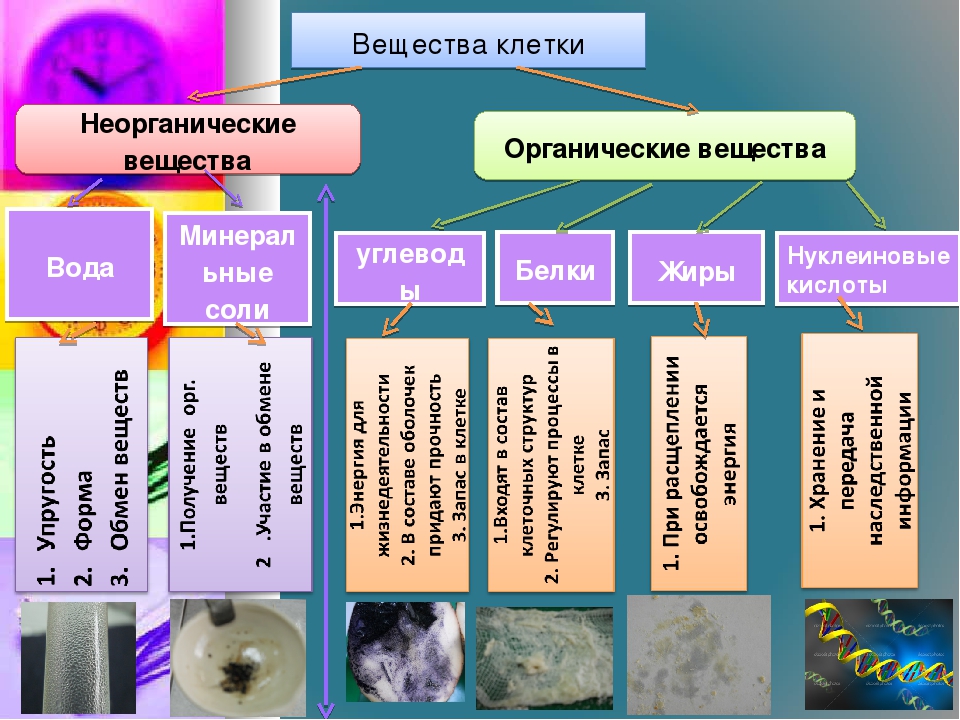 В растворах линейные молекулы моносахаридов принимают циклическую форму.
В растворах линейные молекулы моносахаридов принимают циклическую форму.
Сложные и крупные молекулы полисахаридов (крахмал, целлюлоза, гликоген) состоят из множества соединенных между собой остатков молекул моносахаридов. Такие полисахариды, как крахмал, целлюлоза, гликоген, состоят из соединенных молекул глюкозы, число которых непостоянно и может колебаться от сотен тысяч до миллионов. Поэтому общая формула крахмала, гликогена и целлюлозы выглядит так: (C6H10O5)n.
При соединении двух молекул глюкозы одна молекула воды отщепляется. Символ n означает, что число молекул глюкозы в молекулах крахмала, гликогена и целлюлозы может изменяться. Целлюлоза имеет линейную, структуру а крахмал и гликоген — разветвленную.
Различие между молекулами целлюлозы и крахмала состоит также и в том, что число n у целлюлозы больше. В состав одной макромолекулы крахмала входит от нескольких сотен до нескольких тысяч звеньев, а в состав молекулы целлюлозы — свыше 10 000 звеньев.
Целлюлоза образует волокна, которые придают растению жесткость и прочность. Так, волокно целлюлозы прочнее, чем стальная проволока такого же диаметра.
Другой тип молекул, входящих в состав клетки, — липиды (от греч. lipos — жир). Молекулы жиров образованы остатками трехатомного спирта (глицерина) и остатками молекул жирных кислот. Главное свойство липидов — гидрофобность.
Особенности структуры молекул углеводов и липидов определяют их функции в клетке. Так, благодаря тому что некоторые полисахариды и все липиды не растворяются в воде, они накапливаются в клетках как запасные питательные вещества. Известно, что крахмалом буквально «набиты» клетки клубней картофеля и корневищ многих растений, например топинамбура.
Животный крахмал — гликоген накапливается в клетках печени и мышц. Когда организму требуется энергия, молекулы гликогена расщепляются на легко растворимые молекулы глюкозы, которые доставляются кровью к различным клеткам организма животного.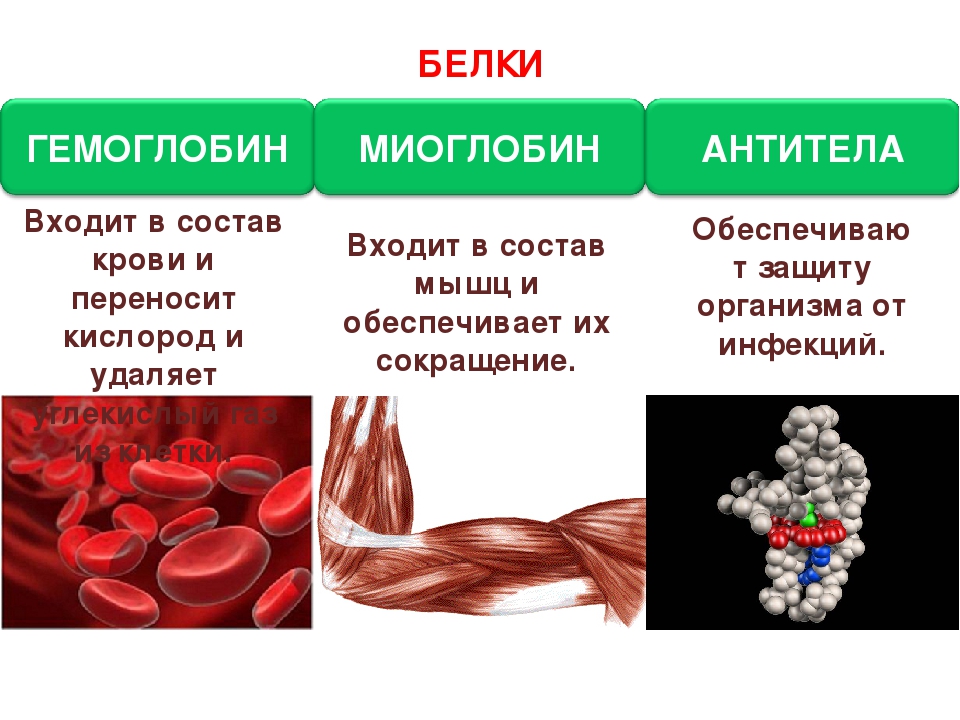
Запасы жира содержатся в клетках жировой клетчатки птиц и млекопитающих, семян некоторых растений. У хордовых животных запасы жира откладываются под кожей и служат для защиты организма от переохлаждения и механических повреждений. Так, китов, моржей, тюленей, пингвинов защищают от переохлаждения мощные жировые отложения. У кита, например, слой подкожного жира достигает 1 м.
Одна из важнейших функций углеводов и липидов — энергетическая. Заключенная в этих веществах энергия освобождается при разрыве химических связей в процессе расщепления молекул. Молекулы углеводов и жиров окисляются в клетках до углекислого газа и воды, а освобождающаяся при этом энергия используется на процессы жизнедеятельности. Так, при окислении 1 г углеводов освобождается 17,6 кДж энергии, а при окислении 1 г жиров — в два раза больше.
Углеводы и липиды выполняют также структурную функцию. Они входят в состав различных частей и органоидов клетки. Так, из целлюлозы строятся клеточные стенки растений. В древесине содержится от 40 до 60% целлюлозы. Липиды — обязательный компонент клеточной мембраны.
В древесине содержится от 40 до 60% целлюлозы. Липиды — обязательный компонент клеточной мембраны.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
сот | Определение, типы, функции, диаграмма, деление, теория и факты
Рассмотрим, как одноклеточный организм содержит необходимые структуры для питания, роста и воспроизводства.
Клетки — это основные единицы жизни.
Encyclopædia Britannica, Inc. Смотрите все видео для этой статьи клетка , в биологии, основная мембраносвязанная единица, которая содержит основные молекулы жизни и из которой состоит все живое. Одна клетка сама по себе часто является целостным организмом, например бактерией или дрожжами.По мере созревания другие клетки приобретают особые функции. Эти клетки взаимодействуют с другими специализированными клетками и становятся строительными блоками больших многоклеточных организмов, таких как люди и другие животные. Хотя клетки намного больше атомов, они все же очень маленькие. Самые маленькие из известных клеток — это группа крошечных бактерий, называемых микоплазмами; некоторые из этих одноклеточных организмов представляют собой сферы диаметром всего 0,2 мкм (1 мкм = около 0,000039 дюйма) с общей массой 10 -14 грамм, что соответствует 8 000 000 000 атомов водорода.Клетки человека обычно имеют массу в 400 000 раз больше, чем масса отдельной бактерии микоплазмы, но даже человеческие клетки имеют только около 20 мкм в поперечнике. Для того, чтобы закрыть булавочную головку, потребуется лист из примерно 10 000 человеческих клеток, а каждый человеческий организм состоит из более чем 30 000 000 000 000 клеток.
Хотя клетки намного больше атомов, они все же очень маленькие. Самые маленькие из известных клеток — это группа крошечных бактерий, называемых микоплазмами; некоторые из этих одноклеточных организмов представляют собой сферы диаметром всего 0,2 мкм (1 мкм = около 0,000039 дюйма) с общей массой 10 -14 грамм, что соответствует 8 000 000 000 атомов водорода.Клетки человека обычно имеют массу в 400 000 раз больше, чем масса отдельной бактерии микоплазмы, но даже человеческие клетки имеют только около 20 мкм в поперечнике. Для того, чтобы закрыть булавочную головку, потребуется лист из примерно 10 000 человеческих клеток, а каждый человеческий организм состоит из более чем 30 000 000 000 000 клеток.
Основные структуры животной клетки Цитоплазма окружает специализированные структуры клетки, или органеллы. Рибосомы, места синтеза белка, находятся в цитоплазме в свободном состоянии или прикреплены к эндоплазматическому ретикулуму, через который материалы транспортируются по клетке.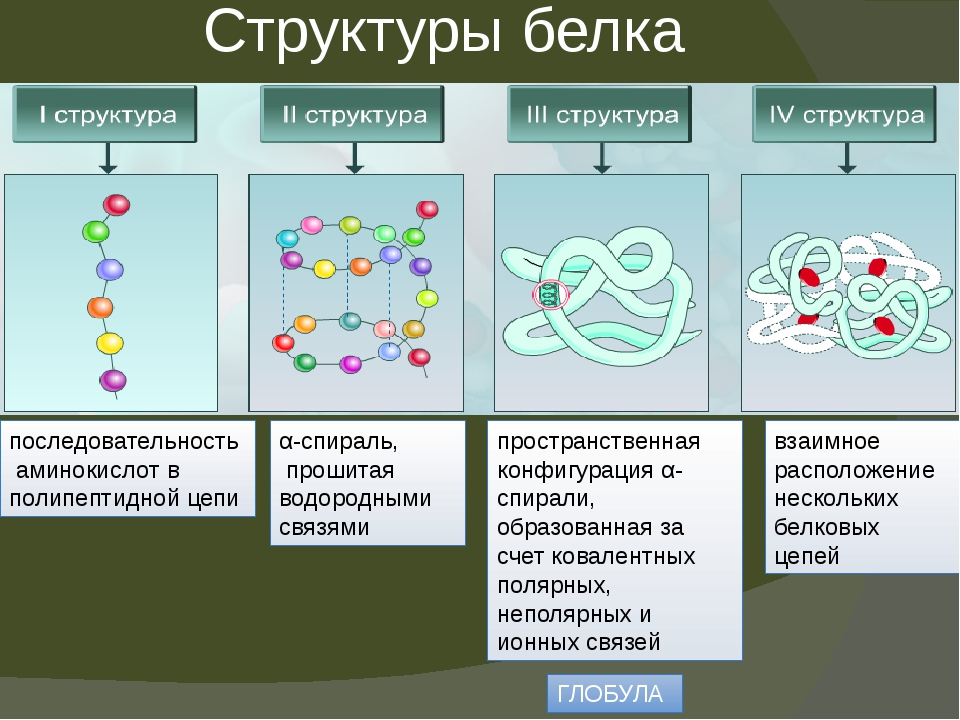 Энергия, необходимая клетке, выделяется митохондриями. Комплекс Гольджи, стопки сплющенных мешочков, обрабатывает и упаковывает материалы, которые должны быть выпущены из клетки в секреторные пузырьки. Пищеварительные ферменты содержатся в лизосомах. Пероксисомы содержат ферменты, выводящие токсины из опасных веществ. Центросома содержит центриоли, которые играют роль в делении клеток. Микроворсинки — это пальцевидные отростки, обнаруженные на определенных клетках. Реснички, похожие на волосы структуры, которые выходят на поверхность многих клеток, могут создавать движение окружающей жидкости.Ядерная оболочка, двойная мембрана, окружающая ядро, содержит поры, которые контролируют движение веществ в нуклеоплазму и из нее. Хроматин, комбинация ДНК и белков, образующих хромосомы, составляет большую часть нуклеоплазмы. Плотное ядрышко — место производства рибосом.
Энергия, необходимая клетке, выделяется митохондриями. Комплекс Гольджи, стопки сплющенных мешочков, обрабатывает и упаковывает материалы, которые должны быть выпущены из клетки в секреторные пузырьки. Пищеварительные ферменты содержатся в лизосомах. Пероксисомы содержат ферменты, выводящие токсины из опасных веществ. Центросома содержит центриоли, которые играют роль в делении клеток. Микроворсинки — это пальцевидные отростки, обнаруженные на определенных клетках. Реснички, похожие на волосы структуры, которые выходят на поверхность многих клеток, могут создавать движение окружающей жидкости.Ядерная оболочка, двойная мембрана, окружающая ядро, содержит поры, которые контролируют движение веществ в нуклеоплазму и из нее. Хроматин, комбинация ДНК и белков, образующих хромосомы, составляет большую часть нуклеоплазмы. Плотное ядрышко — место производства рибосом.
Популярные вопросы
Что такое ячейка?
Клетка — это масса цитоплазмы, которая снаружи связана клеточной мембраной. Обычно микроскопические по размеру клетки представляют собой мельчайшие структурные единицы живого вещества и составляют все живое.Большинство клеток имеют одно или несколько ядер и других органелл, которые выполняют множество задач. Некоторые отдельные клетки представляют собой полноценные организмы, такие как бактерии или дрожжи. Другие представляют собой специализированные строительные блоки многоклеточных организмов, таких как растения и животные.
Обычно микроскопические по размеру клетки представляют собой мельчайшие структурные единицы живого вещества и составляют все живое.Большинство клеток имеют одно или несколько ядер и других органелл, которые выполняют множество задач. Некоторые отдельные клетки представляют собой полноценные организмы, такие как бактерии или дрожжи. Другие представляют собой специализированные строительные блоки многоклеточных организмов, таких как растения и животные.
Что такое клеточная теория?
Теория клетки утверждает, что клетка является фундаментальной структурной и функциональной единицей живого вещества. В 1839 году немецкий физиолог Теодор Шванн и немецкий ботаник Маттиас Шлейден заявили, что клетки являются «элементарными частицами организмов» как у растений, так и у животных, и признали, что одни организмы одноклеточные, а другие — многоклеточные.Эта теория ознаменовала собой большой концептуальный прогресс в биологии и привела к возобновлению внимания к жизненным процессам, происходящим в клетках.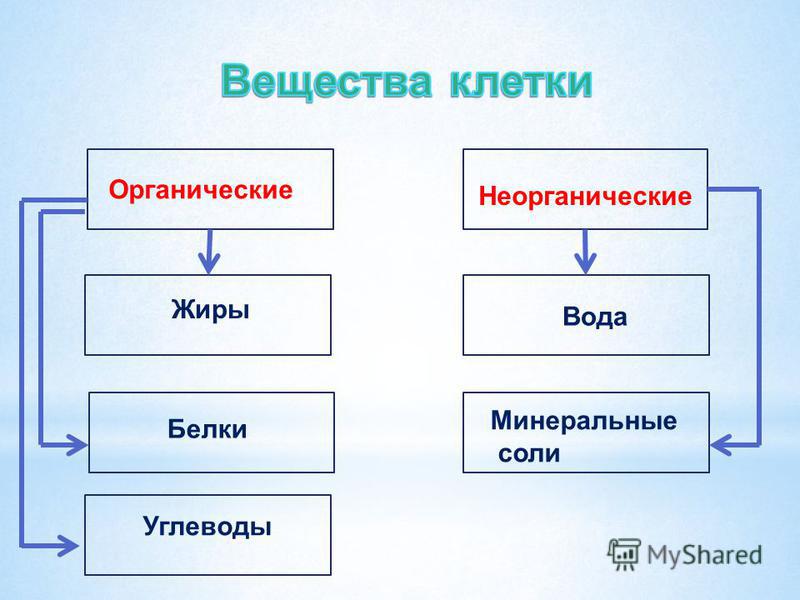
Что делают клеточные мембраны?
Клеточная мембрана окружает каждую живую клетку и отделяет клетку от окружающей среды. Он служит барьером, препятствующим проникновению содержимого клетки и проникновению нежелательных веществ. Он также функционирует как ворота для активного и пассивного перемещения основных питательных веществ в клетку и вывод продуктов жизнедеятельности из нее.Определенные белки клеточной мембраны участвуют в межклеточной коммуникации и помогают клетке реагировать на изменения в окружающей среде.
В этой статье клетка рассматривается как отдельная единица и как составляющая часть более крупного организма. Как отдельная единица, клетка способна метаболизировать свои собственные питательные вещества, синтезировать многие типы молекул, обеспечивать свою собственную энергию и воспроизводить себя, чтобы производить последующие поколения. Его можно рассматривать как закрытый сосуд, внутри которого одновременно происходят бесчисленные химические реакции.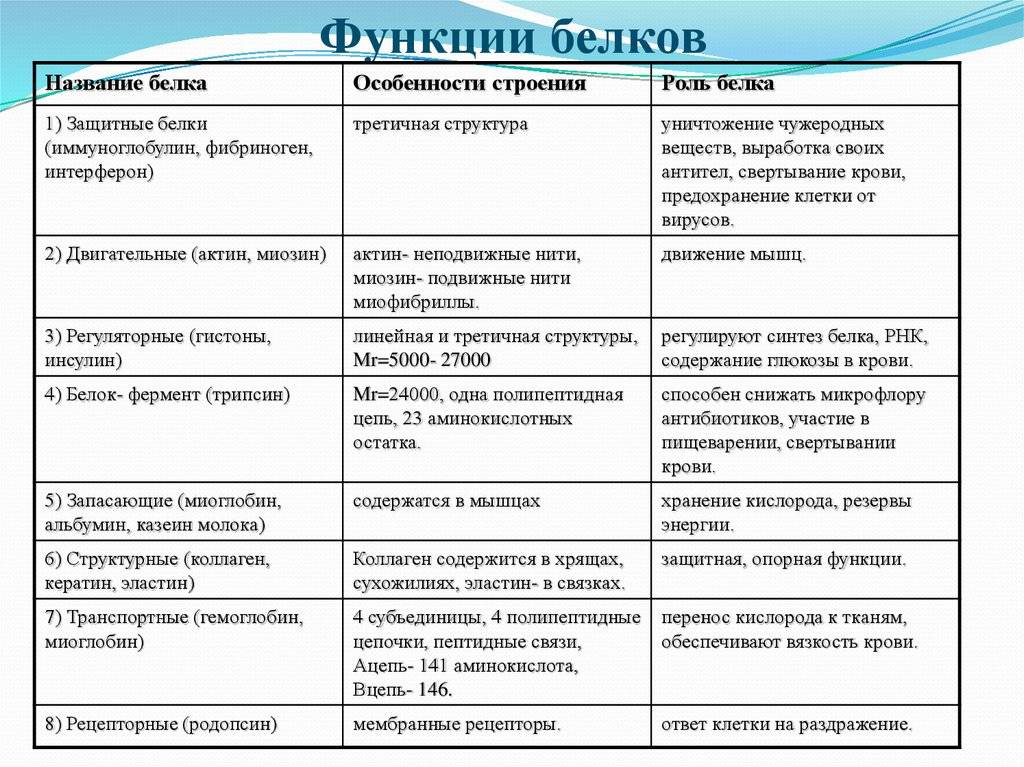 Эти реакции находятся под очень точным контролем, поэтому они способствуют жизни и размножению клетки. В многоклеточном организме клетки становятся специализированными для выполнения различных функций в процессе дифференцировки. Для этого каждая ячейка поддерживает постоянную связь со своими соседями. Получая питательные вещества из окружающей среды и выбрасывая отходы, она прилипает к другим клеткам и взаимодействует с ними. Совместные сборки подобных клеток образуют ткани, а сотрудничество между тканями, в свою очередь, формирует органы, которые выполняют функции, необходимые для поддержания жизни организма.
Эти реакции находятся под очень точным контролем, поэтому они способствуют жизни и размножению клетки. В многоклеточном организме клетки становятся специализированными для выполнения различных функций в процессе дифференцировки. Для этого каждая ячейка поддерживает постоянную связь со своими соседями. Получая питательные вещества из окружающей среды и выбрасывая отходы, она прилипает к другим клеткам и взаимодействует с ними. Совместные сборки подобных клеток образуют ткани, а сотрудничество между тканями, в свою очередь, формирует органы, которые выполняют функции, необходимые для поддержания жизни организма.
В этой статье особое внимание уделяется животным клеткам с некоторым обсуждением процессов синтеза энергии и внеклеточных компонентов, присущих растениям. (Для подробного обсуждения биохимии растительных клеток, см. Фотосинтез . Для полной обработки генетических событий в ядре клетки, см. Наследственность .)
Брюс М. АльбертсПрирода и функция клеток
A клетка окружена плазматической мембраной, которая образует селективный барьер, позволяющий питательным веществам проникать, а продукты жизнедеятельности — выходить. Внутренняя часть клетки состоит из множества специализированных отсеков или органелл, каждый из которых окружен отдельной мембраной. Одна из основных органелл, ядро, содержит генетическую информацию, необходимую для роста и размножения клеток. Каждая клетка содержит только одно ядро, тогда как другие типы органелл присутствуют в множестве копий в клеточном содержимом или цитоплазме. Органеллы включают митохондрии, которые отвечают за передачу энергии, необходимую для выживания клеток; лизосомы, которые переваривают нежелательные материалы внутри клетки; и эндоплазматический ретикулум и аппарат Гольджи, которые играют важную роль во внутренней организации клетки, синтезируя выбранные молекулы, а затем обрабатывая, сортируя и направляя их в нужное место.Кроме того, клетки растений содержат хлоропласты, которые отвечают за фотосинтез, благодаря чему энергия солнечного света используется для преобразования молекул углекислого газа (CO 2 ) и воды (H 2 O) в углеводы. Между всеми этими органеллами есть пространство в цитоплазме, называемое цитозолем.
Внутренняя часть клетки состоит из множества специализированных отсеков или органелл, каждый из которых окружен отдельной мембраной. Одна из основных органелл, ядро, содержит генетическую информацию, необходимую для роста и размножения клеток. Каждая клетка содержит только одно ядро, тогда как другие типы органелл присутствуют в множестве копий в клеточном содержимом или цитоплазме. Органеллы включают митохондрии, которые отвечают за передачу энергии, необходимую для выживания клеток; лизосомы, которые переваривают нежелательные материалы внутри клетки; и эндоплазматический ретикулум и аппарат Гольджи, которые играют важную роль во внутренней организации клетки, синтезируя выбранные молекулы, а затем обрабатывая, сортируя и направляя их в нужное место.Кроме того, клетки растений содержат хлоропласты, которые отвечают за фотосинтез, благодаря чему энергия солнечного света используется для преобразования молекул углекислого газа (CO 2 ) и воды (H 2 O) в углеводы. Между всеми этими органеллами есть пространство в цитоплазме, называемое цитозолем. Цитозоль содержит организованный каркас из волокнистых молекул, составляющих цитоскелет, который придает клетке ее форму, позволяет органеллам перемещаться внутри клетки и обеспечивает механизм, с помощью которого сама клетка может двигаться.Цитозоль также содержит более 10 000 различных видов молекул, которые участвуют в клеточном биосинтезе, процессе создания больших биологических молекул из маленьких.
Цитозоль содержит организованный каркас из волокнистых молекул, составляющих цитоскелет, который придает клетке ее форму, позволяет органеллам перемещаться внутри клетки и обеспечивает механизм, с помощью которого сама клетка может двигаться.Цитозоль также содержит более 10 000 различных видов молекул, которые участвуют в клеточном биосинтезе, процессе создания больших биологических молекул из маленьких.
Клетки животных и растений содержат мембраносвязанные органеллы, включая отдельное ядро. Напротив, бактериальные клетки не содержат органелл.
Британская энциклопедия, Inc. Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Специализированные органеллы характерны для клеток организмов, известных как эукариоты.Напротив, клетки организмов, известных как прокариоты, не содержат органелл и обычно меньше эукариотических клеток. Однако все клетки имеют сильное сходство в биохимических функциях.
Рисунок эукариотической клетки в разрезе.
Encyclopædia Britannica, Inc.Молекулы клеток
Понять, как клеточные мембраны регулируют потребление пищи и отходы и как клеточные стенки обеспечивают защиту
Клетки поглощают молекулы через свои плазматические мембраны.
Encyclopædia Britannica, Inc. Посмотреть все видео к этой статье Клетки содержат особый набор молекул, заключенных в мембрану. Эти молекулы дают клеткам возможность расти и воспроизводиться. Общий процесс клеточного воспроизводства происходит в два этапа: рост клеток и деление клеток. Во время роста клетки клетки поглощают определенные молекулы из своего окружения, избирательно перенося их через клеточную мембрану. Попав внутрь клетки, эти молекулы подвергаются действию узкоспециализированных, больших, тщательно свернутых молекул, называемых ферментами.Ферменты действуют как катализаторы, связываясь с проглоченными молекулами и регулируя скорость их химического изменения. Эти химические изменения делают молекулы более полезными для клетки. В отличие от проглоченных молекул, катализаторы не изменяются химически во время реакции, что позволяет одному катализатору регулировать конкретную химическую реакцию во многих молекулах.
Эти химические изменения делают молекулы более полезными для клетки. В отличие от проглоченных молекул, катализаторы не изменяются химически во время реакции, что позволяет одному катализатору регулировать конкретную химическую реакцию во многих молекулах.
Биологические катализаторы создают цепочки реакций. Другими словами, молекула, химически преобразованная одним катализатором, служит исходным материалом или субстратом для второго катализатора и так далее.Таким образом, катализаторы используют небольшие молекулы, принесенные в клетку из внешней среды, для создания все более сложных продуктов реакции. Эти продукты используются для роста клеток и воспроизведения генетического материала. После копирования генетического материала и наличия достаточного количества молекул для поддержки деления клетки клетка делится, образуя две дочерние клетки. Через множество таких циклов клеточного роста и деления каждая родительская клетка может дать начало миллионам дочерних клеток, в процессе преобразования больших количеств неодушевленного вещества в биологически активные молекулы.
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , образуя, таким образом, длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис.
Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
1).
Рис. 1: Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху, синий кружок; внизу, все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
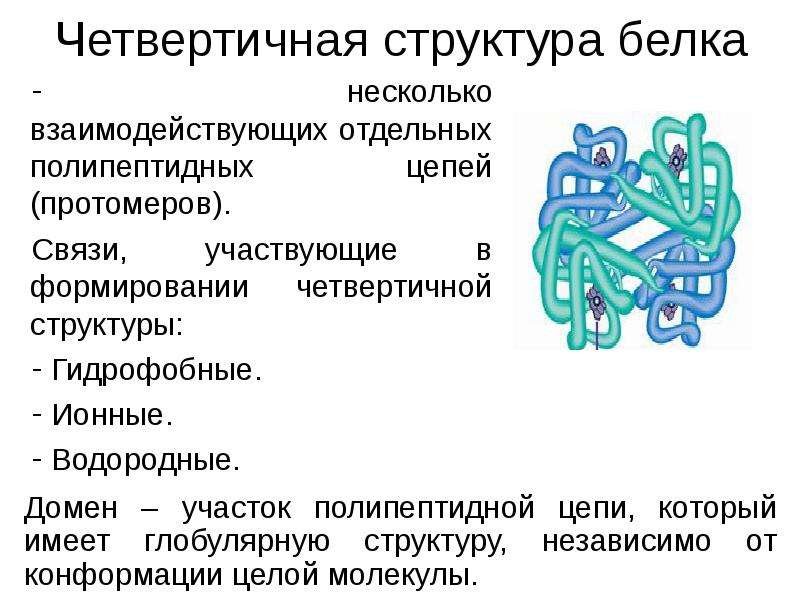
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка . Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.
Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка . Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.
Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизируются тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, растворенные в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембраны. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, растворенные в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембраны. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенный метод исследования структуры белков — это рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, а диаграмма отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, а диаграмма отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
Однако множественность белковообразующих аминокислот обусловлена не только этими вариациями числа групп COOH и NH 2 , но также числом атомов углерода, которые связаны в цепь. Мы можем получить цепи с 2, 3, 5 или 6 атомами углерода из белковой молекулы, и дальнейшие изменения могут быть вызваны отделением одного из атомов водорода от атома углерода путем введения атома кислорода или серы, или потому что сложная органическая группа, например, с 3C, 2N и 3H, занимает место одного атома H.
Наряду с этими аминокислотами, совершенно другой тип группы атомов обнаружен в серии белкообразующих строительных блоков, которая содержит один атом углерода и два атома азота, и в молекуле эта группа всегда находится в сочетании с упомянутой диамиовалериановой кислотой ранее. Комбинация этой «амидиновой группы» с диаминовалериановой кислотой или омитином, называемая «аргинином», была обнаружена Э. Шульце и продемонстрирована С.Г. Хедином как компонент белка.
Шульце и продемонстрирована С.Г. Хедином как компонент белка.
Таким образом, молекула белка состоит из таких строительных блоков. Мы не знаем, как часто каждый блок повторяется во всей структуре, но мы можем определить относительную пропорцию между количествами различных сформированных строительных блоков. Например, мы можем определить, насколько большое количество диаминокислот по сравнению с моноаминокислотами и какой процент от общего азота присутствует в форме диаминовалериановой кислоты.Уже эти соотношения, хотя и не дают представления об относительном расположении блоков, показали довольно важные различия между белками, исследованными до сих пор, и, кроме того, они показывают, что среди них ранее упомянутые слабо связанные белки ядра клетки занимают большую часть. совершенно особенное место.
Особенность этих ядерных белков зависит от того факта, что в их построении задействованы большие количества определенных видов строительных блоков, а именно богатых азотом групп. Так, например, по сравнению с остальными белками они содержат большее количество диаминокислот, особенно диаминовалериановой кислоты, и связанных с ней амидиновых групп; гистидин также может встречаться в них в больших количествах.
Так, например, по сравнению с остальными белками они содержат большее количество диаминокислот, особенно диаминовалериановой кислоты, и связанных с ней амидиновых групп; гистидин также может встречаться в них в больших количествах.
Внедрение этих азотсодержащих групп в молекулу белка, кроме того, таково, что сильно основные группы присутствуют в свободно реактивном состоянии .
Белок этого типа обнаружен, например, в ядрах эритроцитов птиц и, как я уже упоминал, может быть легко удален разбавленными минеральными кислотами.Он называется «гистон». Подобные вещества широко распространены в тканях высших и низших животных в солевой комбинации с нуклеиновой кислотой. Они также встречаются в сперматозоидах беспозвоночных, например морские ежи, головоногие моллюски, а также сперматозоиды некоторых рыб. В качестве примера я могу привести различные виды трески, из яичек которых мы могли получить гистон, очень похожий по своим химическим свойствам и составу на гистон, полученный из эритроцитов птиц или из тимуса.
Эти гистоны, свободно соединенные с нуклеиновой кислотой, таким образом, демонстрируют природу обычно сложных белков и отличаются от них только одним особым качеством, преобладанием свободных основных групп.
Если яички других рыб подвергаются такому же исследованию, получаются тела гораздо более простого состава, которые занимают место гистона в головках сперматозоидов; это протамины .
На основании целого ряда наблюдений, которые я здесь не буду упоминать, сложилось мнение о том, что эти основные белки возникли в процессе развития в результате преобразования обычных белков, в результате чего группы, более бедные азотом, постепенно растворились из них.Это преобразование может быть более или менее обширным. Он ведет от обычных белков сначала к гистонам, и если процесс выведения продолжается еще дальше, мы переходим к протаминам. Таким образом, они все еще беднее моноаминокислот и относительно богаче диаминокислотами, чем гистон. Но протамины также отличаются друг от друга и, очевидно, связаны промежуточными стадиями с гистонами.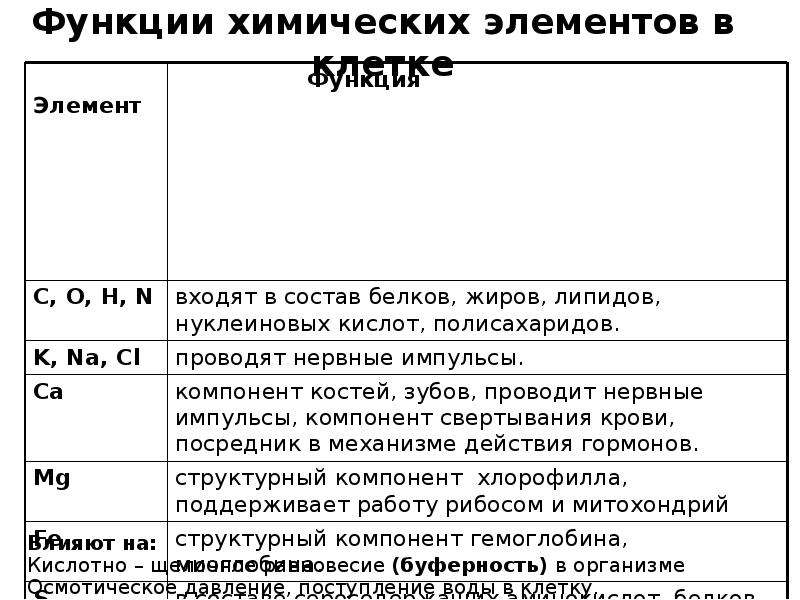 Стурин, полученный из икры осетровых, содержит, например, все четыре из ранее упомянутых богатых азотом группы белковой молекулы: две диаминокислоты, одна из которых объединена с амидиновыми группами, и, кроме того, гистидин.Другие протамины содержат только две или три из известных основных групп. Разнообразие в составе белковой молекулы заметно сокращается в головках сперматозоидов некоторых лососевых, и здесь вся молекула ограничена 5 различными типами строительных блоков. Две из них, диаминовалериановая кислота и амидиновая группа, являются основными переносчиками азота и преобладают по количеству над остальным, неся около 88% общего азота.
Стурин, полученный из икры осетровых, содержит, например, все четыре из ранее упомянутых богатых азотом группы белковой молекулы: две диаминокислоты, одна из которых объединена с амидиновыми группами, и, кроме того, гистидин.Другие протамины содержат только две или три из известных основных групп. Разнообразие в составе белковой молекулы заметно сокращается в головках сперматозоидов некоторых лососевых, и здесь вся молекула ограничена 5 различными типами строительных блоков. Две из них, диаминовалериановая кислота и амидиновая группа, являются основными переносчиками азота и преобладают по количеству над остальным, неся около 88% общего азота.
Таким образом, в этой своеобразной трансформации все больше и больше длинных углеродных цепей с низким содержанием азота, которые настолько важны для построения большинства белков, что они составляют основную часть, исчезают, и на этом фоне становится очевидной группа, показывающая C и N в чередующемся расположении.Такое расположение присутствует также в другом компоненте ядра клетки, а именно в нуклеиновой кислоте, как мы видели.
Если мы теперь суммируем результаты исследований слабосвязанных нуклеиновых субстанций, то результат будет следующим: состав хроматинового вещества ядра клетки из двух компонентов: один, богатый связанной фосфорной кислотой и обладающий качествами кислоты. ; второй показывает протеин с качествами основы. По своей химической структуре оба компонента демонстрируют заметное сходство, основанное на значительном накоплении атомов азота, и благодаря этой химической структуре образования хроматина можно резко отличить от остальных компонентов клетки; и это качество, очевидно, должно быть связано с функцией веществ хроматина.Эти группы атомов, богатые азотом и содержащие фосфор, представляют собой те группы, отложения которых в хромосомах впервые приводятся в движение во время деления клетки и чья передача другим клеткам является важной частью репродуктивного процесса.
На этом этапе мы подошли к проблемам, решение которых может быть достигнуто только совместными усилиями различных методов исследования. Представители морфологических наук видят под микроскопом структуру, отложившуюся в клетке, и изучают зависимость ее формы от состояния элементарного организма.Биохимик пытается определить состав этой структуры, ее положение в химической системе и в то же время ее отношение к другим химическим компонентам клетки, но эта задача требует теорий структурной химии и помощи синтетических методов.
Таким образом, результаты, которые я попытался изобразить сегодня, исходят от различных исследовательских институтов, и имена многих людей должны быть упомянуты, если будут признаны заслуги всех участников.
Из Нобелевских лекций по физиологии и медицине 1901-1921 гг. , Elsevier Publishing Company, Амстердам, 1967
Для цитирования этого раздела
стиль MLA: Альбрехт Коссель — Нобелевская лекция. NobelPrize.org. Нобелевская премия AB 2021. Ср. 23 июня 2021 г.
Протоплазма — обзор | Темы ScienceDirect
9.2 Химический состав протоплазмы
Протоплазма — это не химическое вещество, а сложная организация некоторых из самых сложных известных химических веществ. Более того, химический состав отличается у каждого вида и в каждой клетке одного и того же организма. Как показывают исследования транскриптома, посттранскриптома, протеома, липидома, метаболома, сигналома, ионома и всех других интимных «-омов», химический состав также меняется в течение жизни отдельной клетки. Однако в первом приближении протоплазма содержит белки, липиды, углеводы, нуклеиновые кислоты и их составляющие (таблица 9.1).
Таблица 9.1. Состав обезвоженной протоплазмы слизистой плесени Reticularia
| Вещество | в процентах от сухой массы | ||
|---|---|---|---|
| Белок | 28 | ||
| Нуклеиновые кислоты | 12 | ||
| Жиры | 18 | ||
| Лецитин | 5 | ||
| Холестерин | 1 | ||
| Углеводы 2315 | Неизвестно , А., 1930. Chemie des Protoplasmas. Протоплазматология Монография 4, Берлин. Генри Ларди (1965, 1995) Генри Ларди (1965) Генри Ларди (1995) определил цитозоль как часть клетки, которая обнаруживается во фракции супернатанта после центрифугирования при 105000 g в течение 1 часа. В то время это относилось конкретно к цитоплазме без митохондрий и эндоплазматического ретикулума (ЭР). В цитозоле E scherichia coli концентрация белка составляет около 200–320 мг / мл, концентрация РНК составляет около 75–120 мг / мл, а концентрация ДНК составляет около 11–18 мг / мл (см. Elowitz et al., 1999; Циммерман и Трач, 1991). Вещества, составляющие цитозоль, растворены в водном растворе соли, содержащем около 75% воды и 100 моль / м 3 K + , десятки моль / м 3 Cl — , 1 моль / м 3 Mg 2+ , 10 −4 моль / м 3 каждый из H + и Ca 2+ , а также следовые количества других ионов. Большая часть воды может быть свободной, образуя водную фазу, через которую ионы могут свободно диффундировать; однако часть воды связана с белками, образуя стекловидную фазу (Garlid, 2000).Некоторые Halobacteria содержат до 3000 моль / м 3 K (Гинзбург, Гинзбург, 1975). Концентрации ионов, измеренные с помощью флуоресцентных красителей, варьируются в пространстве и во времени по протоплазме (Rathore et al., 1991; Pierson et al., 1994, 1996, Pierson et al., 1994, Pierson et al., 1996; Kropf et al., 1995). Редокс-потенциал (от -0,309 до -0,325 В, в зависимости от типа клетки) и pH цитозоля (6,5-7,6, в зависимости от типа клетки и гравистимуляции) наблюдались в трансформированных клетках с использованием редокс- и pH-зависимых форм зеленый флуоресцентный белок (GFP; Fasano et al., 2001; Мосейко и Фельдман, 2001; Jiang et al., 2006a, bJiang et al., 2006aJiang et al., 2006b; Martinière et al., 2013; Шибата и др., 2013). Концентрация различных малых органических молекул, включая аденозинтрифосфат (АТФ), аминокислоты и сахара, обычно составляет от 0,1 до 10 моль / м 2 3 (Mimura et al., 1990b; Scott et al., 1995; Haritatos et al. др., 1996). Различные ионы и молекулы не обязательно равномерно распределены по клетке (Aw, 2000). Генно-инженерные сенсоры, основанные на флуоресцентном резонансном переносе энергии (FRET), были творчески разработаны и могут использоваться для определения концентрации практически любой интересующей молекулы с высоким пространственным и временным разрешением (Чудаков и др., 2010; Swanson et al., 2011; Haugh, 2012; Krebs et al., 2012; Окумото и др., 2012; Fritz et al., 2013; Jones et al., 2013, 2014; Jones et al., 2013; Jones et al., 2014; Hamers et al., 2014). Зная химический состав на этом уровне, мы мало знаем о структуре цитоплазмы. Хотя у нас может возникнуть соблазн сделать вывод, что цитоплазма может вести себя как вязкий белковый раствор, мы обнаружим, что это не так (Luby-Phelps and Weisiger, 1996). Белки: определение, состав, структура, примеры Термин « протеин » происходит от греческого слова « proteios », что означает первичный или выдающийся, и впервые был предложен Йенсом Якобом Берцелиусом, одним из отцов современной химии, своему коллеге Герарду Йоханнесу. Малдер, изучавший химический состав альбуминов в 1839 году.На самом деле Берцелиус полагал, основываясь на формуле, данной Малдером альбумину, C 40 H 62 O 12 N 10 , неправильной формуле, что белки могут быть наиболее важными биологическими веществами. Иногда D-аминокислоты обнаруживаются в некоторых бактериальных белках. СОДЕРЖАНИЕ Структура белков Белки — это самые универсальные молекулы, присутствующие в живых организмах, где они выполняют функции, необходимые для жизни. Большое разнообразие функций, которые способны выполнять, проистекает из возможности укладки полипептидной цепи на в конкретные трехмерные структуры , которые обеспечивают способность связывать различные молекулы и выполнять различные функции. Примечание: в глобулярных белках присутствуют структуры, следующие за вторичной. Первичная структура белка Бычий инсулин был первым белком, первичная структура которого была определена благодаря работе Фредерика Сэнгера в 1953 году. Вторичная структура белка Открытие вторичной структуры белков связано с работой Линуса Полинга и Роберта Кори в 1951 году, которые предложили две структуры, названные α-спиралью и β-пластинчатой структурой или β-складчатым листом. Примечание: около 32-38% аминокислот в глобулярных белках находятся в структурах α-спирали. Сверхвторичные структуры или мотивы Они представляют собой комбинацию вторичных структур , образующих область молекулы с определенной трехмерной структурой и топологией.Супервторичные структуры связаны друг с другом петлевыми областями с неопределенной структурой.
Домены Домены — это следующий уровень организации. Это глобулярных областей, которые являются результатом комбинации мотивов , которые сворачиваются независимо от остальной части полипептидной цепи с образованием стабильной структуры.
Было обнаружено более 1000 доменных семейств (члены каждого семейства называются «гомологами»), и, похоже, они произошли от общего предка. Третичная структура белка Третичная структура, также называемая «нативной структурой», представляет собой трехмерную структуру белков . Первый белок, третичная структура которого была определена, был миоглобин в 1958 году благодаря работе Джона Кендрю. Третичная структура белков, в частности белков, состоящих из более чем 200 аминокислотных остатков, образована различными доменами, связанными короткими полипептидными сегментами. Он часто стабилизируется дисульфидными мостиками между остатками цистеина, мостиками, которые образуются после того, как молекула достигла своей нативной конформации. Четвертичная структура белкаЭтот дополнительный уровень структурной организации описывает, как более одной полипептидной цепи связывают с образованием единой белковой структуры. Следовательно, это относится к пространственному расположению отдельных цепей и природе сил, связывающих их вместе, например:
Полученная структура называется олигомером (олигомерным белком) и составляющими полипептидами, которые могут быть идентичными или разными, мономерами или просто субъединицами. Список литературыЛодиш Х., Берк А., Зипурский С.Л. и др. Молекулярная клеточная биология.4-е издание. Нью-Йорк: У. Х. Фриман; 2000. Раздел 3.1, Иерархическая структура белков. Доступно по ссылке: https://www.ncbi.nlm.nih.gov/books/NBK21475/ Кессель А., Бен-Тал Н. Введение в белки: структура, функции и движение. CRC Press, 2011 doi: 10.1002 / cbic.201100254 Нельсон Д.Л., Кокс М.М. Ленингер. Основы биохимии. 6-е издание. W.H. Фримен и компания, 2012 Стипанук М.Х., Кодилл М.А. Биохимические, физиологические и молекулярные аспекты питания человека.3-е издание. Elsevier Health Sciences, 2012 г. Плазменная мембрана: введение и химический составВведениеВсе живые клетки, будь то прокариотическая клетка или эукариотическая клетка, состоят из плазматической мембраны. Эта мембрана фактически отделяет цитоплазму одной клетки от других клеток, другими словами, это граница клетки. Плазматическая мембрана проницаема только для определенных молекул. Он позволяет питательным веществам и другим важным элементам попадать в клетку, а отходам — покидать клетку.Небольшие молекулы, такие как кислород, углекислый газ и вода, могут свободно проходить через мембрану, а с другой стороны, поступление более крупных молекул, таких как аминокислоты и сахара, регулируется. Плазменная мембрана способна воспринимать внешние сигналы и помогает клетке реагировать в соответствии с окружающей средой. Плазматическая мембрана также называется цитоплазматической мембраной, клеточной мембраной или плазмалеммой. Термин «клеточная мембрана» был придуман Карлом Нагели и Карлом Эдуаром Крамером в 1865 году. Термин «плазмалемма» был придуман Джанет Плоу в 1931 году. Химический состав плазменной мембраныПлазменная мембрана очень тонкая по своей природе, поэтому ее нельзя наблюдать под световым микроскопом. На основании химического анализа клеточной мембраны красных кровяных телец человека считалось, что клеточная мембрана состоит из липидов, расположенных в два слоя. Эти липиды расположены внутри мембраны с полярной головкой к внешним сторонам и неполярными хвостами к внутренней стороне.Такое расположение гарантирует, что неполярный хвост насыщенных углеводородов защищен от водной среды. После изобретения электронного микроскопа была изучена детальная структура клеточной мембраны. Биохимическое исследование ясно показало, что клеточные мембраны также состоят из белков и углеводов. Соотношение углеводов, белков и липидов значительно различается в разных типах клеток. Рассмотрим следующую таблицу:
A) Белки: Белки являются основными компонентами всех биологических мембран, они могут составлять около 50% компонентов плазматической мембраны.Количество белков, присутствующих в мембране, значительно варьируется в зависимости от местоположения и функции клетки. Мембрана нервной клетки содержит менее 25 процентов белка, тогда как внутренние мембраны клеток, участвующих в передаче энергии, таких как митохондрии и хлоропласты, содержат около 75% белка. Белки могут действовать как ферменты, антигены, рецепторные молекулы, регуляторные молекулы и т. Д.
Расположение белков и простота экстракцииВ зависимости от положения белка и простоты экстракции мембранные белки можно разделить на два типа, а именно интегральные белки или периферические белки. Периферические белки
Интегральные белки
Периферические и интегральные белки могут быть эктопротеинами (белками, лежащими на внешней стороне цитоплазматической поверхности плазматической мембраны) или эндопротеинами (белками, лежащими на внутренней стороне цитоплазматической поверхности плазматической мембраны).
Функция белковВ зависимости от функции белков в мембране они могут быть трех основных типов, а именно структурные белки, транспортные белки и ферменты. Структурные белки Они чрезвычайно липофильны по своей природе. Они образуют основу плазматической мембраны. Транспортные белки Это белки, которые помогают транспортировать определенные вещества через плазматическую мембрану, а также через другие клеточные мембраны. Ферменты: Ферменты — это белковые молекулы, присутствующие в клетке и действующие как катализаторы. Ферменты плазматической мембраны могут быть либо эктоферментами (ферменты, лежащие на внешней стороне цитоплазматической поверхности плазматической мембраны), либо эндоферментами (ферменты, лежащие на внутренней стороне цитоплазматической поверхности плазматической мембраны).Примерами ферментов, присутствующих на плазматической мембране, являются фосфолипаза А, мальтаза, лактаза, щелочная фосфатаза, ацетилфосфатаза и т. Д. B) Липиды: На плазматической мембране присутствуют в основном три типа липидов, а именно:
Все вышеуказанные типы липидов представляют собой амфипатические молекулы с гидрофильными и гидрофобными доменами. Как и в случае с белками, количество липидов, присутствующих на плазматической мембране, также значительно варьируется в зависимости от местоположения и функции клетки.
C) Углеводы: Углеводы в плазматической мембране представляют собой короткие неразветвленные или разветвленные цепи сахаров.Они обнаруживаются либо прикрепленными к эктопротеинам, либо к полярным концам фосфолипидов на внешней поверхности плазматической мембраны. Они могут быть связаны либо с липидами (гликолипидами), либо с белками (белками). Важно отметить, что углеводы не расположены на цитоплазматической или внутренней поверхности плазматической мембраны. Шесть основных сахаров, производных глюкозы, а именно D-галактоза, D-манноза, L-фукоза, N-ацетилнейраминовая кислота, N-ацетил-D-глюкозамин и N-ацетил-D-галактозамин.
— Поделись с друзьями! — Химический состав телаТело состоит из различных молекул, которые, в свою очередь, состоят из элементов или соединений Чтобы полностью понять механизмы физиологии человека, важно иметь представление о химический состав тела.Это пригодится при рассмотрении различных взаимодействий между клетками и структурами. Мы замалчиваем основную химию; однако, если есть конкретные вопросы относительно химии и ее влияния на биологическую функцию, не стесняйтесь спрашивать на Forum . АтомыАтом — это наименьшая единица вещества с уникальными химическими свойствами. Атомы — это химические единицы клеточной структуры. Они состоят из центрального ядра с протонами и нейтронами и орбиты (орбит) электронов.Протон несет положительный заряд +1, а нейтрон не имеет заряда. Таким образом, ядро имеет чистый положительный заряд. Электроны несут отрицательный заряд –1 и, следовательно, притягиваются к положительному ядру. В общем, количество протонов обычно равно количеству электронов. Напомним, что атомы обладают уникальными (индивидуальными) химическими свойствами, и поэтому каждый тип атома называется химическим элементом или просто элементом. Атомный номер означает количество протонов в атоме, а атомный вес означает количество протонов и нейтронов в атоме, измеренное в дальтонах.Элементы могут существовать в нескольких формах, называемых изотопами; единственная разница — количество нейтронов в ядре, в то время как протоны и электроны всегда остаются такими же, как и исходный элемент. Форма и функции человеческого тела зависят от четырех основных элементов: водорода (H), кислорода (O), углерода (C) и азота (N). СвязьАтомы образуют молекулы, когда два или более соединяются вместе. A 1 —связь — A 2 = Молекула: A 1 A 2 Ковалентные связи образуются, когда электроны на внешней орбите разделяются между двумя атомами.С образованием этого типа связи молекулы могут вращаться вокруг своих общих электронов и изменять форму. Каждый атом образует характерное количество ковалентных связей. Количество связей зависит от количества электронов на внешней орбите. Например:
В общем: количество электронов на внешней орбите + общие электроны = 8 (полный октет) Обратите внимание, что любой общий электрон пытается достичь стабильного состояния.В большинстве атомов это октет или восемь электронов на внешней орбите. Обратите внимание, что у водорода есть место только для 2 электронов на его внешней орбите, одного присутствующего и одного общего. Ионы — это атомы с чистым электрическим зарядом из-за усиления или потери одного или нескольких электронов. Ионные связи — это связи, образованные между двумя противоположно заряженными ионами. Катионы — это ионы с чистым положительным зарядом, а анионы — с чистым отрицательным зарядом. Ионные формы элементов важны для организма, так как они способны проводить электричество при растворении в воде.Эти ионы называются электролитами . Отдельные атомы или атомы, которые ковалентно связаны в молекулах, могут подвергаться ионизации. См. Примеры ниже. NaCl ↔ Na + + Cl — Где R представляет собой любую молекулу, присоединенную к указанной функциональной группе . Атом с одним электроном на внешней орбитали известен как свободный радикал.Свободные радикалы очень реактивны и недолговечны. С точки зрения организма они ответственны за распад клеток. Поражение солнцем — классический пример действия свободных радикалов на клетки кожи. Полярные связи — это связи, в которых электроны распределены неравномерно. Неравное распределение дает атому с более высокой долей более отрицательный заряд, а атом с более низкой долей электронов имеет немного более положительный заряд. Водородные связи — это слабые связи между атомом водорода (более положительным, меньшая доля электрона) в одной полярной связи и атомом кислорода или азота (более отрицательным, большая доля электрона) в другой полярной связи. H – O- — — — — — — — -H – O – H Водородная связь между водородом одной молекулы воды и кислородом другой. Эти связи довольно слабые. ВодаВода — самая распространенная молекула в организме человека (~ 98-99%). Оба атома водорода присоединены к одиночному атому кислорода полярными связями. Кислород имеет слегка отрицательный заряд, а каждый атом водорода имеет слегка положительный заряд.Это позволяет образовывать водородные связи между положительными атомами водорода и отрицательными атомами кислорода соседних молекул воды. Состояние воды определяется слабыми водородными связями. Связки остаются нетронутыми при низких температурах, а вода замерзает. Когда температура повышается, связи ослабевают, и вода становится жидкостью. Если температура будет достаточно высокой, связи полностью разорвутся, и вода превратится в газ. РастворыВещества, растворенные в жидкости, называются растворенными веществами, а сама жидкость называется растворителем.Термин «раствор» относится к конечному продукту, когда растворенные вещества растворяются в растворителе. Поскольку вода является наиболее распространенной молекулой в организме человека, неудивительно, что вода является самым распространенным растворителем. В организме в большинстве химических реакций участвуют молекулы, растворенные в воде. Гидрофильные (водолюбивые) молекулы — это молекулы, которые легко растворяются в воде. Обычно к гидрофильным молекулам присоединены полярные группы (например, ОН-) и / или ионизированные (например, COO- или NH 2+ ) функциональные группы.Напротив, молекулы, которые не притягиваются к воде, называются гидрофобными молекулами (водобоязненными). Это молекулы с электрически нейтральными ковалентными связями (например, молекулы с углеродными цепями). При смешивании неполярных молекул с водой образуются две фазы (слои). Хорошим примером является смешивание масла и воды, а затем дать емкости на некоторое время застыть. Будут видны два отдельных слоя. КонцентрацияЧто касается растворов, концентрация — это количество растворенного вещества, присутствующего в единице объема раствора. Значения концентрации не отражают количество присутствующих молекул. КислотностьКислота — это молекула, которая выделяет протоны (ионы водорода) в растворе. И наоборот, основание — это молекула, которая может принимать протон. Кислоты и основания можно разделить на сильные. Сильная кислота — это кислота, которая выделяет все свои ионы водорода в раствор. Соляная кислота (HCl) — отличный пример сильной кислоты. Слабые кислоты — это кислоты, которые не полностью ионизируются или теряют свои ионы водорода в растворе. Концентрация свободных ионов водорода (протонов) называется кислотностью раствора.Единица измерения pH = -log [H + ], где [H + ] — концентрация свободных ионов водорода. pH является очень важным понятием в биологических системах и, безусловно, имеет большое значение в процессах физиологии человека. Чистая вода называется нейтральным раствором и имеет значение pH 7. Щелочные растворы также известны как щелочные растворы и поэтому имеют более низкую концентрацию ионов водорода [H + ]. PH щелочных растворов больше 7. Кислые растворы имеют высокую концентрацию ионов водорода [H + ].PH кислых растворов меньше 7. Каждое число на шкале pH указывает на 10-кратное изменение концентрации водорода [H + ]. Лакмусовая бумага — это тест-полоски, которые определяют pH на основе изменения цвета бумаги после погружения полоски в раствор. Органические молекулыОрганические молекулы содержат углеродные скелеты. Каждый атом углерода образует 4 ковалентные связи с другими атомами, в частности с другими атомами углерода, а также с атомами водорода, азота, кислорода и серы.Соединяя вместе множество более мелких молекул, углерод может образовывать очень большие полимеры (макромолекулы), многие из которых важны для физиологии человека. УглеводыЭти важные молекулы на основе углерода жизненно важны для жизни, поскольку они обеспечивают клетки энергией. Углеводы состоят из углерода, водорода и кислорода в определенной пропорции. Если n — любое целое число, формула имеет следующий вид: Cn (H 2 O) n. H— C —OH Углеводы легко растворяются в воде благодаря полярным гидроксильным (OH-) группам.Большинство из них имеют сладкий вкус и известны под общим названием сахар. Моносахариды — это простейшие сахара. Глюкоза (C 6 H 12 O 6 ) является наиболее распространенной и называется сахаром в крови, потому что это основной моносахарид в крови. Обычные моносахариды в организме содержат 5 или 6 атомов углерода и называются пентозами и гексозами соответственно. Дисахариды — это углеводы, состоящие из двух моносахаридов, связанных вместе. Сахароза состоит из глюкозы и фруктозы.Мальтоза состоит из глюкозы и цепей глюкозы. Лактоза, молочный сахар, состоит из глюкозы и галактозы. Атом кислорода связывает моносахариды за счет удаления атома водорода с одного конца и гидроксильной группы с другого. Гидроксильная группа и водород объединяются, образуя молекулу воды. Следовательно, гидролиз дисахарида приведет к разрыву образованной связи и разъединению двух моносахаридов. ЛипидыЖиры для непрофессионала. Липиды преимущественно состоят из атомов водорода и углерода, связанных между собой нейтральными ковалентными связями. Липиды неполярны и, следовательно, плохо растворяются в воде. При изучении физиологии человека необходимо знать четыре основных класса липидов. Жирные кислоты представляют собой цепочки атомов углерода и водорода с карбоксильной группой на одном конце.Как правило, они состоят из четного числа атомов углерода, поскольку синтезируются путем соединения фрагментов, состоящих из двух атомов углерода. Если все атомы углерода связаны одинарными ковалентными связями, цепь называется насыщенной жирной кислотой. Если цепь состоит из двойных связей, она называется ненасыщенной жирной кислотой. Кроме того, если в цепи присутствует только одна двойная связь, то это мононенасыщенная жирная кислота, а если присутствует более одной двойной связи, она называется полиненасыщенной жирной кислотой. Триацилглицерины или триглицериды составляют большинство липидов в организме. Они образуются путем связывания каждой из 3 гидроксильных групп глицерина с карбоксильными группами трех жирных кислот, отсюда и слово «три» в названии. Когда триацилглицерин гидролизуется, жирные кислоты высвобождаются из глицерина, и продукты могут метаболизироваться, чтобы обеспечить энергию для функций клеток. Триацилглицерины имеют близких родственников, называемых фосфолипидами. Единственное отличие состоит в том, что одна из гидроксильных групп глицерина связана с фосфатом.Фосфолипид имеет неполярный участок жирной кислоты, поэтому молекула является амфипатической. Фосфолипиды очень важны для построения мембран в организме. БелкиПомимо обычных четырех элементов: углерода, водорода, кислорода и азота, белки также содержат серу и другие элементы в небольших количествах.Белки — это очень большие молекулы связанных субъединиц, называемых аминокислотами. Они образуют очень длинные цепочки. Аминокислоты состоят из амино (NH 2 ) и карбоксильной (COOH) группы, которые связаны с концевым атомом углерода. Где R представляет собой другую функциональную группу или углеродную цепь, известную как боковая цепь аминокислоты. H Белки в живых организмах состоят из одного и того же набора из 20 аминокислот.Каждая аминокислота отличается своей боковой цепью ( R ). Поскольку аминокислоты соединяются вместе пептидными связями, они образуют полипептид или последовательность аминокислот, связанных пептидными связями. Пептидная связь возникает, когда карбоксильные группы одной аминокислоты образуют полярную ковалентную связь с аминогруппой другой аминокислоты. При образовании этой связи высвобождается одна молекула воды. Вновь образованная молекула будет иметь свободную аминогруппу на одном конце и свободную карбоксильную группу на другом, что позволяет связывать дополнительные аминокислоты. Гликопротеины образуются, когда моносахариды ковалентно связаны с боковыми цепями определенных аминокислот в белке (полипептиде). Конкретные аминокислоты, которые выделяются при образовании гликопротеина, — это серин и треонин. Структура белкаДве вещи определяют первичную структуру белка.
Важно помнить, что полипептидная цепь является гибкой, поскольку каждая аминокислота может вращаться вокруг своих пептидных связей.Следовательно, полипептидные цепи могут быть изогнуты в различные формы или конформации. Трехмерная конформация белка играет важную роль в его функционировании в организме. Конформация белков определяется несколькими факторами:
Конформация альфа-спирали образуется, когда водородные связи образуются между водородом, связанным с азотом в одной пептидной связи, и кислородом с двойной связью в другой .Водородные связи скручивают цепь в клубок. Когда водородные связи образуются между пептидными связями в областях полипептидной цепи, которая проходит параллельно, образуется прямая и протяженная область, называемая конформацией бета-листа. Конформации альфа-спирали и бета-листа очень распространены. Когда между боковыми цепями образуются ионные связи и, таким образом, прерываются повторяющиеся водородные связи, могут возникать нерегулярные области, называемые конформациями петель. Нуклеиновые кислотыНуклеиновые кислоты хранят, передают и выражают генетическую информацию. Нуклеиновые кислоты состоят из субъединиц, называемых нуклеотидами. Нуклеотиды содержат фосфатную группу, сахар и кольцо из атомов углерода и азота. Кольцо также известно как основание, потому что оно может принимать ионы водорода (протоны). Нуклеотиды связаны между собой связями между фосфатной группой одного нуклеотида и сахаром следующего. Таким образом, нуклеотиды образуют длинные цепи.ДНК (дезоксирибонуклеиновая кислота) хранит генетическую информацию в последовательности нуклеотидных субъединиц. РНК (рибонуклеиновая кислота) использует информацию, хранящуюся в ДНК, для написания инструкций по связыванию вместе определенных последовательностей аминокислот с целью образования полипептидов в соответствии с исходными инструкциями ДНК. нуклеотидов ДНК содержат пятиуглеродный сахар, называемый дезоксирибозой. ДНК имеет четыре разных нуклеотида, которые соответствуют четырем разным основаниям. Пуриновые основания аденин (A) и гуанин (G) состоят из двух конденсированных колец, состоящих из азота и водорода.Пиримидиновые основания цитозин (C) и тимин (T) состоят только из одного кольца азота и водорода. Пара гуанин и цитозин, а пара тимин и аденин. Один пурин в паре с одним пиримидином. Молекула ДНК выглядит как двойная спираль. Он состоит из двух цепочек нуклеотидов, намотанных друг на друга, удерживаемых водородными связями между пуриновым основанием на одной цепи и пиримидиновым основанием на другой.
Следующий . |

 Открытая таким образом научная область может во многом быть сравнена с наукой об анатомической структуре живых существ.
Открытая таким образом научная область может во многом быть сравнена с наукой об анатомической структуре живых существ. 
 Таким образом, были исследованы самые разнообразные клеточные структуры и бесформенные протоплазмы и определены отдельные группы соединений, которые неоднократно появляются в списках этих компонентов, и, начиная с работы Хоппе-Зейлера, нуклеины, лецитин, холестерин и, наконец, соли калия, в дополнение к белкам, добавлены в список.
Таким образом, были исследованы самые разнообразные клеточные структуры и бесформенные протоплазмы и определены отдельные группы соединений, которые неоднократно появляются в списках этих компонентов, и, начиная с работы Хоппе-Зейлера, нуклеины, лецитин, холестерин и, наконец, соли калия, в дополнение к белкам, добавлены в список. Эти химические характеристики я сейчас попытаюсь кратко описать.
Эти химические характеристики я сейчас попытаюсь кратко описать.  В то же время они показали, что нуклеиновый материал принадлежит четко определенной части ядерного вещества, которая очень заметно выделяется в процессе трансформации, количество которой в различных ядрах варьируется и которая из-за своей реакции на определенные пятна получил название «хроматин».В этом была только одна трудность, заключающаяся в обнаружении «нуклеиновых веществ» в продуктах животного происхождения, не содержащих ядер клеток, а именно в желточных мешках яиц и в казеине в молоке, и действительно были предприняты попытки объяснить эти факты с помощью специальных гипотез. прежде, чем более точные химические исследования принесли разъяснения.
В то же время они показали, что нуклеиновый материал принадлежит четко определенной части ядерного вещества, которая очень заметно выделяется в процессе трансформации, количество которой в различных ядрах варьируется и которая из-за своей реакции на определенные пятна получил название «хроматин».В этом была только одна трудность, заключающаяся в обнаружении «нуклеиновых веществ» в продуктах животного происхождения, не содержащих ядер клеток, а именно в желточных мешках яиц и в казеине в молоке, и действительно были предприняты попытки объяснить эти факты с помощью специальных гипотез. прежде, чем более точные химические исследования принесли разъяснения.  Такие «строительные блоки», собранные вместе в большом количестве и разнообразии и, по-видимому, по определенному плану, образуют молекулы белков, а также крахмала и гликогена и в меньшем количестве — жиров и фосфатидов. Сложные органические компоненты питания разбиваются на эти строительные блоки, когда они подготавливаются путем пищеварения для приема в организм, и из этих строительных блоков большие молекулы внутри организма могут затем снова соединяться вместе.
Такие «строительные блоки», собранные вместе в большом количестве и разнообразии и, по-видимому, по определенному плану, образуют молекулы белков, а также крахмала и гликогена и в меньшем количестве — жиров и фосфатидов. Сложные органические компоненты питания разбиваются на эти строительные блоки, когда они подготавливаются путем пищеварения для приема в организм, и из этих строительных блоков большие молекулы внутри организма могут затем снова соединяться вместе. Здесь вместе присутствуют четыре азотсодержащие группы: цитозин , тимин, аденин, гуанин .
Здесь вместе присутствуют четыре азотсодержащие группы: цитозин , тимин, аденин, гуанин .  Следовательно, только что упомянутые основания или их очень близкие продукты трансформации встречаются в больших количествах в жидкостях организма. Также было разрешено упомянутое ранее противоречие, которое проявлялось в предполагаемом присутствии нуклеинового материала в яичных желтках и в молоке. Более точное исследование показало, что эти элементы, которые из-за своего внешнего поведения и содержания фосфора ранее считались нуклеинами, обладают другой химической структурой.Богатые азотом строительные блоки, как я их назвал, полностью отсутствуют — таким образом, они действительно не принадлежат к группе истинных нуклеиновых веществ и образуют особый класс.
Следовательно, только что упомянутые основания или их очень близкие продукты трансформации встречаются в больших количествах в жидкостях организма. Также было разрешено упомянутое ранее противоречие, которое проявлялось в предполагаемом присутствии нуклеинового материала в яичных желтках и в молоке. Более точное исследование показало, что эти элементы, которые из-за своего внешнего поведения и содержания фосфора ранее считались нуклеинами, обладают другой химической структурой.Богатые азотом строительные блоки, как я их назвал, полностью отсутствуют — таким образом, они действительно не принадлежат к группе истинных нуклеиновых веществ и образуют особый класс.  Открытие отдельных членов этой группы и выяснение их химической природы связано с именами Шееле, Торберна Бергманна, Велера, Либиха, Штрекера и Адольфа Байера, а блестящая серия этих исследований завершилась работой Эмиля. Фишера, что привело к удовлетворительному окончательному установлению формул, показанных ниже. Два других, тимин и цитозин, показали более простой состав; эксперименты по разрушению и синтезу привели к тому, что в тимине должна быть группа атомов углерода и азота, соответствующая следующей схеме:
Открытие отдельных членов этой группы и выяснение их химической природы связано с именами Шееле, Торберна Бергманна, Велера, Либиха, Штрекера и Адольфа Байера, а блестящая серия этих исследований завершилась работой Эмиля. Фишера, что привело к удовлетворительному окончательному установлению формул, показанных ниже. Два других, тимин и цитозин, показали более простой состав; эксперименты по разрушению и синтезу привели к тому, что в тимине должна быть группа атомов углерода и азота, соответствующая следующей схеме: 
 Один из них содержит 6 атомов углерода, которые связаны с кислородом и водородом, как это характерно для углеводов ; другой, не содержащий углерода, — это фосфорная кислота .
Один из них содержит 6 атомов углерода, которые связаны с кислородом и водородом, как это характерно для углеводов ; другой, не содержащий углерода, — это фосфорная кислота .

 Это знание еще недавно; Исследования сначала проходили через формы, сложные и трудные для распознавания, прежде чем им удалось овладеть формами, которые просты и легки для понимания. Мы не знаем, имеют ли инозиновая и гуаниловая кислоты такое же значение для жизни клетки, как сложные нуклеиновые кислоты; в настоящее время, в частности, не установлено, следует ли искать место расположения двух последних названных кислот в хроматине ядра клетки.
Это знание еще недавно; Исследования сначала проходили через формы, сложные и трудные для распознавания, прежде чем им удалось овладеть формами, которые просты и легки для понимания. Мы не знаем, имеют ли инозиновая и гуаниловая кислоты такое же значение для жизни клетки, как сложные нуклеиновые кислоты; в настоящее время, в частности, не установлено, следует ли искать место расположения двух последних названных кислот в хроматине ядра клетки. Вещество ядра клетки остается вместе с частью связанной «стромы» в виде нерастворимой массы. Если эту массу ядер привести в контакт с разбавленными кислотами, большая часть белка растворяется, а нуклеиновая кислота остается. Подобные рыхлые комбинации обнаруживаются также в клетках железистых тканей: вилочковой железы, лимфатических узлов и селезенки, и во всех этих тканях также может случиться, что одна часть белков присутствует в твердой, а другая в рыхлой комбинации.Обращает на себя внимание поведение головок сперматозоидов, которые по своему происхождению и гистологическим признакам действительно относятся к ядрам клеток. Можно предположить, что в органе, который выполняет одну и ту же функцию у разных видов животных, будут обнаружены сходные химические отношения, но это не так в отношении комбинации белок-нуклеиновая кислота. В исследованиях, которые, однако, до сих пор проводились только на небольшом количестве видов теплокровных животных, было обнаружено, что в сперматозоидах теплокровных животных присутствует прочное сочетание по сравнению с неплотным у беспозвоночных — возможно, во многих случаях вместе с твердым.
Вещество ядра клетки остается вместе с частью связанной «стромы» в виде нерастворимой массы. Если эту массу ядер привести в контакт с разбавленными кислотами, большая часть белка растворяется, а нуклеиновая кислота остается. Подобные рыхлые комбинации обнаруживаются также в клетках железистых тканей: вилочковой железы, лимфатических узлов и селезенки, и во всех этих тканях также может случиться, что одна часть белков присутствует в твердой, а другая в рыхлой комбинации.Обращает на себя внимание поведение головок сперматозоидов, которые по своему происхождению и гистологическим признакам действительно относятся к ядрам клеток. Можно предположить, что в органе, который выполняет одну и ту же функцию у разных видов животных, будут обнаружены сходные химические отношения, но это не так в отношении комбинации белок-нуклеиновая кислота. В исследованиях, которые, однако, до сих пор проводились только на небольшом количестве видов теплокровных животных, было обнаружено, что в сперматозоидах теплокровных животных присутствует прочное сочетание по сравнению с неплотным у беспозвоночных — возможно, во многих случаях вместе с твердым. Сперматозоиды рыб ведут себя как ядра эритроцитов в крови птиц, в которых до сих пор всегда обнаруживалась только рыхлая комбинация, хотя еще не решено, присутствует ли прочная комбинация.
Сперматозоиды рыб ведут себя как ядра эритроцитов в крови птиц, в которых до сих пор всегда обнаруживалась только рыхлая комбинация, хотя еще не решено, присутствует ли прочная комбинация.  Когда связь этих атомов углерода прерывается другими атомами, отделение этих блоков обычно происходит, когда большие молекулы разрушаются внутри или вне организма. Количество атомов углерода, которые встречаются в прямом и прочном сочетании в этих больших строительных блоках количества белка — насколько это было достоверно установлено до настоящего времени — до максимум 9, возможно, 12, но в большинстве случаев группы меньше. Объединение этих групп друг с другом обычно индуцируется атомом азота, который одновременно связан с атомом водорода и образует так называемую «имидную» группу.Этот метод связи был определен в основном работой Эмиля Фишера. В особых случаях вполне могут применяться другие методы связывания, например открытая Э. Бауманом дисульфидная связь, в которой соединение двух углеродных цепей осуществляется двумя взаимосвязанными атомами серы. Это происходит в цистине, о котором известно из работы графа К.А.Х. Мёрнер как компонент белковой молекулы. Если сейчас молекула белка расщепляется, это обычно происходит с введением элементов воды.
Когда связь этих атомов углерода прерывается другими атомами, отделение этих блоков обычно происходит, когда большие молекулы разрушаются внутри или вне организма. Количество атомов углерода, которые встречаются в прямом и прочном сочетании в этих больших строительных блоках количества белка — насколько это было достоверно установлено до настоящего времени — до максимум 9, возможно, 12, но в большинстве случаев группы меньше. Объединение этих групп друг с другом обычно индуцируется атомом азота, который одновременно связан с атомом водорода и образует так называемую «имидную» группу.Этот метод связи был определен в основном работой Эмиля Фишера. В особых случаях вполне могут применяться другие методы связывания, например открытая Э. Бауманом дисульфидная связь, в которой соединение двух углеродных цепей осуществляется двумя взаимосвязанными атомами серы. Это происходит в цистине, о котором известно из работы графа К.А.Х. Мёрнер как компонент белковой молекулы. Если сейчас молекула белка расщепляется, это обычно происходит с введением элементов воды.