Карбоксильная группа СООН — Справочник химика 21
Глюкоза, инвертный сахар, смесь фруктозы и глюкозы также обладают способностью восстанавливать метиленовую синь до лейкометиленовой сини. Восстановителем в молекуле глюкозы является ее альдегидная группа —СНО, которая в процессе этой реакции окисляется до карбоксильной группы —СООН. Причем окисление молекулы глюкозы происходит не за счет кислорода воздуха, а за счет кислорода воды. При этом наряду с окислением молекулы глюкозы происходит процесс восстановления метиленовой сини. Схематически эту реакцию можно представить следующим образом [c.143]Комплексон HI, как и другие комплексоны, образует растворимые внутрикомплексные соли со многими металлами. При этом металл замещает атомы водорода карбоксильных групп —СООН, а также связывается координационной связью с атомами азота [c.337]
Полиакрилаты и полиакрилонитрил.
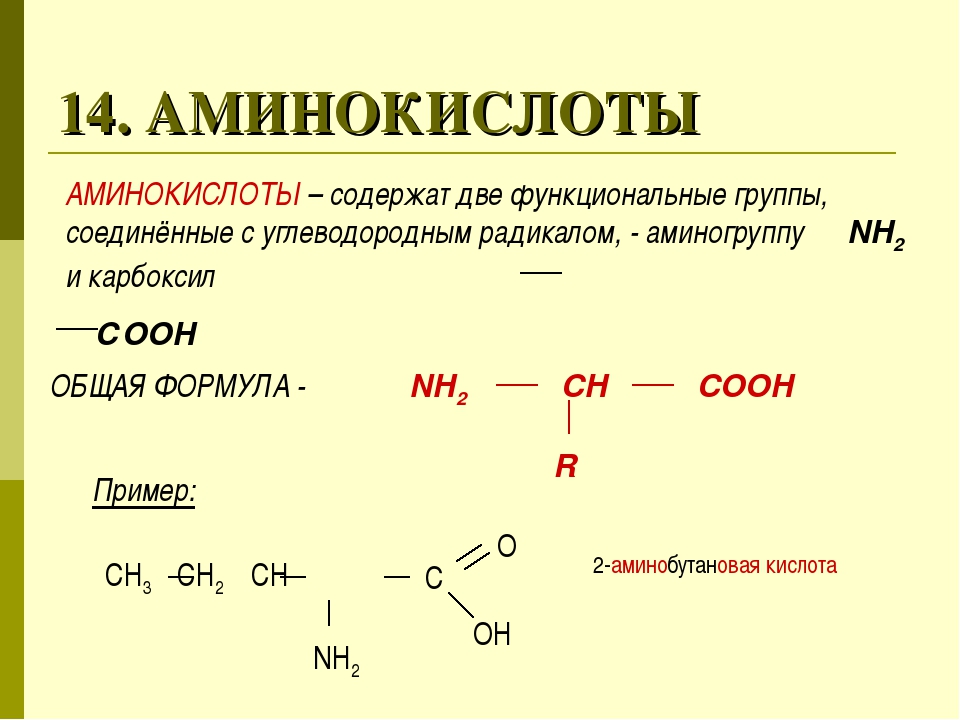
Аминокислоты и белки. Большое биологическое значение имеют аминокислоты — соединения со смешанными фунК циями, в которых, как в аминах, содержатся аминогруппы — N11 и одновременно, как в кислотах,— карбоксильные группы —СООН. В качестве примера можно привести простейшие аминоуксусную кислоту, или глицин, и аминопропионовую кислоту, или аланин. Строение других природных аминокислот этого типа можно выра-зить приведенной ниже общей формулой (где R — углеводородный радикал, который может содержать и различные функциональные группы) [c.497]
У всех органических кислот и их мыл активной является карбоксильная группа СООН, у спиртов—гидроксил ОН и т. п. Молекулы веществ, адсорбированных на поверхности твердого тела, обла- [c.59]
п. Молекулы веществ, адсорбированных на поверхности твердого тела, обла- [c.59]
Казалось бы, карбоксильная группа аминокислоты должна обладать протогенными свойствами, а аминогруппа — прото-фильными. Однако при исследовании водных растворов аминокислот жирного ряда найдено, что их спектр комбинационного рассеяния не дает линии, отвечающей карбоксильной группе СООН. Эта линия появляется лишь после добавления сильной кислоты, которая, обладая высокими протогенными свойствами, отдает протон аминокислоте. Эти опытные данные говорят о том, что в водном растворе жирные аминокислоты полностью [c.509]
Большое биологическое значение имеют аминокислоты — соединения со смешанными функциями, в которых, как в аминах, содержатся аминогруппы — Nh3 и одновременно, как в кислотах, — карбоксильные группы — СООН. В качестве примера можно привести простейшие аминоуксусную кислоту, или глицин,
Молекулы большинства жиров можно представить себе в виде комбинации молекулы спирта — глицерина, построенной из трех атомов углерода и трех ОН-групп, с тремя молекулами кислот, называемых жирными .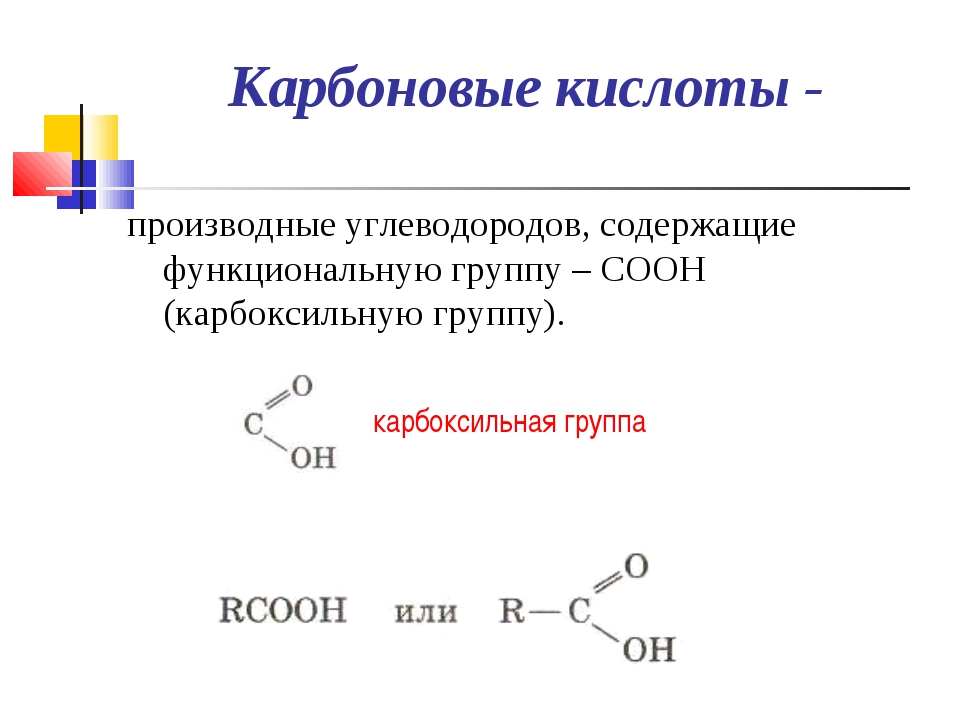 Жирные кислоты состоят из длинной углеводородной цепи, несущей на конце карбоксильную группу ( СООН). На рис. IV.6 представлена схема образования типичной молекулы жи юв. Эта реакция подобна той, что вы проводили при выполнении лабораторной работы (гл. III, разд. Г.5), когда получали сложный эфир — метилсалицилат. Отличие только в том, что в данном случае три спиртовые группы глицерина взаимодействуют с тремя молекулами кислоты. При этом выделяются три молекулы воды и получаются вещества, со- [c.247]
Жирные кислоты состоят из длинной углеводородной цепи, несущей на конце карбоксильную группу ( СООН). На рис. IV.6 представлена схема образования типичной молекулы жи юв. Эта реакция подобна той, что вы проводили при выполнении лабораторной работы (гл. III, разд. Г.5), когда получали сложный эфир — метилсалицилат. Отличие только в том, что в данном случае три спиртовые группы глицерина взаимодействуют с тремя молекулами кислоты. При этом выделяются три молекулы воды и получаются вещества, со- [c.247]
К карбоновым кислотам относят соединения, которые характеризуются. наличием в молекуле карбоксильной группы (—СООН) и радикала алифатического, ароматического или нафтенового характера. Работами акад Н. Д. Зелинского установлено, что в нефтях и нефтепродуктах преобладают кислоты, содержащие производные нафтеновых углеводородов, и, в частности, циклопентаны. [c.26]
Пусть начальные коицентрации карбоксильной группы — [—СООН] о, гидроксильной—[—ОН] о, а равновесная степень превращения кислоты — х. Тогда равновесные концентрации представим в виде [c.277]
Тогда равновесные концентрации представим в виде [c.277]
Карбоновыми кислотами называются производные углеводородов, которые содержат в молекуле одну или несколько карбоксильных групп—СООН. Карбоксильную группу можно рассматривать как формальное сочетание карбонильной группы и гидроксила ( карб-оксил ). Общая формула карбоновых кислот Н—СООН.
Производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп (—СООН), называются карбоновыми кислотами. [c.96]
По своей природе каждое звено — остаток одной нз аминокислот. Они образуют полипептидные цепи, из которых каждая содержит десятки и даже сотни остатков различных амииокислот. Все другие аминокислоты, входящие в состав белка, относятся к а-аминокислотам, у которых аминогруппа ЫНг связана с тем же атомом углерода, с которым связана и карбоксильная группа СООН. Все -аминокислоты (за исключением гетероциклических) могут быть выражены общей формулой [c. 337]
337]
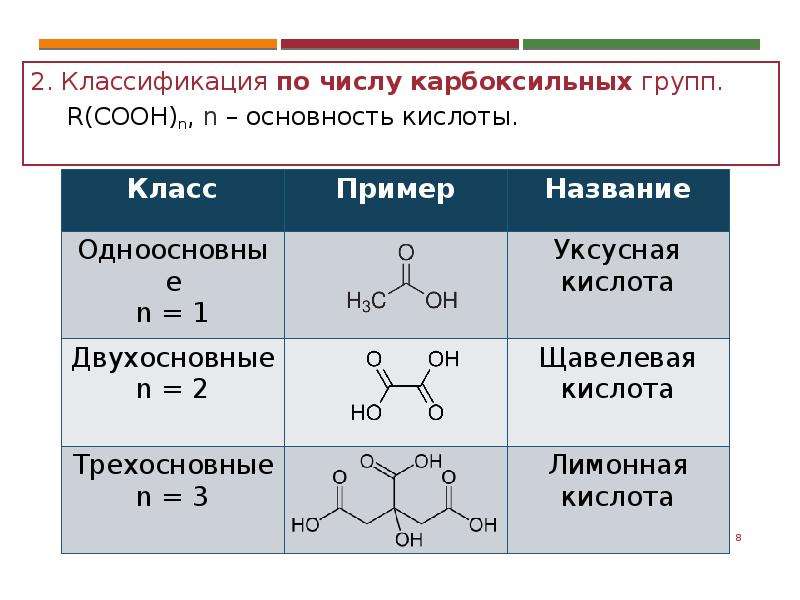
Карбоновые кислоты, имеющие в своей молекуле две карбоксильные группы (—СООН), называются двухосновными или дикарбоновыми кислотами. Дикарбоновые кислоты, как и монокарбоновые, могут быть предельного или непредельного ряда. [c.176]
ДЕКАРБОКСИЛИРОВАНИЕ — отщепление Oj от карбоксильной группы СООН, вместо которой остается один атом водорода, например [c.85]
Поскольку разные ионы обладают разной подвижностью, на основе электрофореза возможно разделение веществ, молекулы которых могут быть заряжены. К их числу относятся важнейшие биополимеры— белки и нуклеиновые кислоты. Белки содержат, как правило, много Nh3- и других групп, способных присоединять протоны и тем самым заряжаться положительно. Они содержат также много карбоксильных групп (СООН), которые, ионизуясь, дают отрицательно заряженные ионы СОО . Степень протонирования и степень ионизации отдельных групп, а следовательно, и заряд белковой молекулы зависят от pH среды. В кислой среде белки заряжены положительно, в щелочной — отрицательно. Нуклеиновые кислоты содержат остатки фосфорной кислоты, которые уже в слабо кислой, а тем более в нейтральной и щелочной средах ионизированы, т. е. несут отрицательный заряд, в связи с чем нуклеиновые кислоты находятся в растворе в виде полианионов. Поэтому электрофорез является важнейшим методом препаративного разделения и анализа смесей белков и смесей нуклеиновых кислот.
В кислой среде белки заряжены положительно, в щелочной — отрицательно. Нуклеиновые кислоты содержат остатки фосфорной кислоты, которые уже в слабо кислой, а тем более в нейтральной и щелочной средах ионизированы, т. е. несут отрицательный заряд, в связи с чем нуклеиновые кислоты находятся в растворе в виде полианионов. Поэтому электрофорез является важнейшим методом препаративного разделения и анализа смесей белков и смесей нуклеиновых кислот.
Аминокислоты — соединения со смешанными функциями, так как они содержат аминогруппу —Nh3 и карбоксильную группу —СООН, связанные с углеводородным радикалом МН2 — Й — СООН. Аминокислоты сочетают свойства карбоновых кислот и аминов. Они представляют собой кристаллические вещества, легко растворимые в воде. Аминокислоты являются основой белков. [c.266]
Катиониты, содержащие карбоксильные группы —СООН, относятся к слабокислотным катионитам. Примером отечественного слабокислотного катионита является КВ-4 — сополимер метакриловой кислоты и дивинилбензола.
Нафтеновые кислоты характеризуются наличием в молекуле карбоксильной группы СООН, связанной с углеводородным [c.20]
Карбоновые кислоты. Органические соединения, содержащие карбоксильные группы —СООН, называют карбоновыми кислотами. По числу карбоксильных групп в молекуле карбоновые кислоты делят на одно-, двух-, трех- и многоосновные (поликарбоновые) по характеру радикала, связанного с карбоксилом, — на предельные (содержат радикал алкана), непредельные (содержат радикал алкена или алкина). Общая формула предельных одноосновных карбоновых кислот С Н2 +1С00Н. Кислоты, содержащие до пяти атомов углерода, — жидкие вещества, более пяти —твердые не растворимые в воде вещества. [c.263]
Ароматические карбоновые кислоты представляют собой произ-водные ароматических углеводородов, имеющие в боковых цепях карбоксильные группы —СООН.
Аминокислотами называются азотсодержащие органические соединения, в молекулах которых содержатся аминогруппы —Л/Н2 и карбоксильные группы —СООН.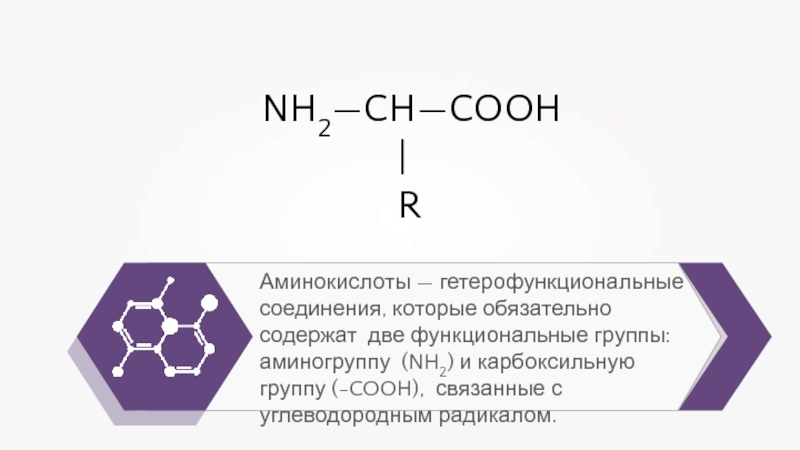 [c.8]
[c.8]
Аминокислотами называются органические соединения, в молекулах которых одновременно содержатся аминогруппы -КН2 и карбоксильные группы -СООН Названия аминокислот строятся из названий соответствующих карбоновых кислот с прибавлением приставки «амино-» и с указанием положения аминогруппы цифрой или греческой буквой. [c.80]
Аминокислоты — это органические соединения, в состав молекул которых входят карбоксильная группа —СООН н аминогруппа —NHj, например [c.244]
Нефтяные кислоты представляют собой карбоновые кислоты, у которых карбоксильная группа (-СООН) соединена с радик шом алифатического или циклического строения. В нефтях содержатся преимушественно карбоновые кислоты с пятичленным нафтеновым радиксшом — нафтеновые кислоты. При нагревании нафтеновых кислот до 200—250°С может наблюдаться их термическое разложение с образованием более устойчивых низкомолекулярных кислот жирного ряда.
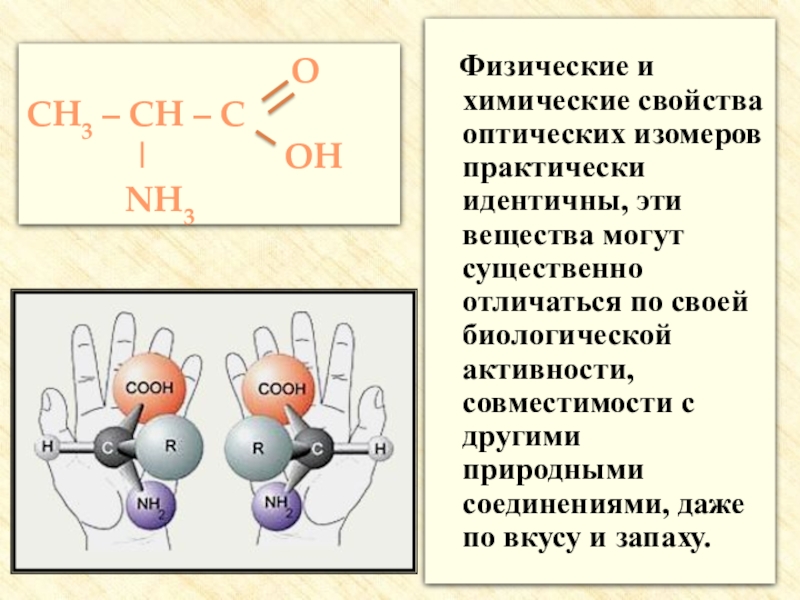 Поэтому в прямогонных бензинах содержатся главным образом кислоты жирного ряда, а в бензинах крекинга нафтеновые кислоты полностью отсутствуют. [c.78]
Поэтому в прямогонных бензинах содержатся главным образом кислоты жирного ряда, а в бензинах крекинга нафтеновые кислоты полностью отсутствуют. [c.78] Восстановление жирных кислот, т. е. производных предельных углеводородов, в которых один атом водорода замещен карбоксильной группой СООН, удается удовлетворительно осуществить преимущественно в случае высших кислот этот метод имеет значение для получения высокомолекулярных парафинов. Восстановление проводится с помощью иодистоводородной кислоты и фосфора
Обычно вода смачивает металлическую поверхность. Например, капля воды, помещенная на алюминиевую пластинку, образует краевой угол около 60°. Но если ту же пластинку предварительно погрузить на несколько минут в раствор стеариновой кислоты в бензоле, то краевой угол капли воды на ней превысит 90°. То, что алюминий перестал смачиваться водой, объясняется следующими причинами. Стеариновая кислота — типичное поверхностно-активное вещество она состоит из полярной карбоксильной группы СООН и неполярного углеводородного радикала Сх Нзд. По общему правилу уравнивания полярностей полярное стремится к полярному, а неполярное—к неполярному. Поверхность металла, покрытого оксидной пленкой, обладает ярко выраженной полярностью, поэтому молекулы стеариновой кислоты своими полярными группами прочно присоединяются к поверхности металла. При этом они ориентируются так, что их yглeвo opoдныe радикалы ( хвосты ), имеющие очень малое сродство к воде, направлены вверх, перпендикулярно поверхности металла. Вода ведет себя по отношению к обработанной стеариновой кислотой поверхности алюминия так же, как по отношению к поверхности чистого парафина, ведь наружу торчат только углеводородные хвосты. [c.225]
По общему правилу уравнивания полярностей полярное стремится к полярному, а неполярное—к неполярному. Поверхность металла, покрытого оксидной пленкой, обладает ярко выраженной полярностью, поэтому молекулы стеариновой кислоты своими полярными группами прочно присоединяются к поверхности металла. При этом они ориентируются так, что их yглeвo opoдныe радикалы ( хвосты ), имеющие очень малое сродство к воде, направлены вверх, перпендикулярно поверхности металла. Вода ведет себя по отношению к обработанной стеариновой кислотой поверхности алюминия так же, как по отношению к поверхности чистого парафина, ведь наружу торчат только углеводородные хвосты. [c.225]
Бензол устойчив к действию азотной кислоты, перманганата калия и др. Алкилбснзолы окисляются только по боковой цепи, при этом все алкильные группы окисляк тсч до карбоксильной группы -СООН. [c.337]
У катионитов в раствор переходят катионы, которые затем могут обмениваться на катионы, находящиеся в растворе. Функциональными группами у катионитов обычно служат сульфогруппы —50зН, фосфорнокислые группы —РО(ОН)г, карбоксильные группы —СООН, гидроксильные группы —ОН. При контакте ионита с раствором эти группы диссоциируют, посылая в раствор ионы №. В результате этого ионит заряжается отрицательно, раствор около ионита — положительно. В зависимости от степени диссоциации функциональных групп различают сильные и слабые катиониты. Катионит после диссоциации функциональных групп можно условно обозначать формулой Я пК1 , а ионный обмен представить уравнением [c.348]
Функциональными группами у катионитов обычно служат сульфогруппы —50зН, фосфорнокислые группы —РО(ОН)г, карбоксильные группы —СООН, гидроксильные группы —ОН. При контакте ионита с раствором эти группы диссоциируют, посылая в раствор ионы №. В результате этого ионит заряжается отрицательно, раствор около ионита — положительно. В зависимости от степени диссоциации функциональных групп различают сильные и слабые катиониты. Катионит после диссоциации функциональных групп можно условно обозначать формулой Я пК1 , а ионный обмен представить уравнением [c.348]
Карбоновые кислоты. У карбоновых кислот функциональной является карбоксильная группа —СООН. В зависимости от числа карбоксильных групп в молекуле кислоты их подразделяют на одно-, двух- и многоосновные, а в зависимости от радикала, связанного с карбоксильной группой, — на алифатические (предельные и непредельные), ароматические, алициклические и гетероциклические. По систематической номенклатуре названия кислот производят от названия углеводорода, добавляя окончание -овая и слово кислота, например СН3СН2СН2СООН — бутановая кислота. [c.309]
[c.309]
Получающиеся при окислении альдегидов продукты содержат карбоксильную группу (—СООН) и называются органическими кислотами (общая формула R OOH). Например, окисление уксусного альдегида ведет к образованию уксусной кислоты [c.540]
Активными группами у катионообменных смол могут быть сульфогруппы — SO3H (катиониты КУ-2, СДВ-3, СБС, КРС), карбоксильные группы — СООН (катиониты КБ-4, КМД, КРК), группы —РОзНа (катиониты РФ, СФ, ВФ, КФ-1, КРФ), гидроксильные — ОН и некоторые другие. [c.667]
Кислоты. Согласно теории электролитической диссоциации кислотами называют вещества, которые ири диссоциации в водных растворах образуют в качестве катионов только ионы водорода. Анионами в этих случаях становятся кислотные остатки. Число ионов водорода, образующихся при диссоциации одной молекулы кислоты, определяет ее основность. Так, НС1, HaS04 и Н3РО4 — пример одно-, двух- и трехосновных кислот. В муравьиной кислоте НСООН из двух атомов водорода, содержащихся в молекуле, способен отщепляться в виде иона только один атом, входящий в карбоксильную группу —СООН, поэтому муравьиная кислота одноосновна, [c. 40]
40]
Действие окислителей. Бензол еще более стоек к действию окислителей, чем предельные углеводороды. Он не окисляется разбавленной азотной кислотой раствором марганцовокислого калия и т. п. Гомологи бензола окисляются значительно легче. Но и в них бензольное ядро относительно более устойчиво к действию окислителей, чем соединенные с ним углеводородные радикалы. Обычно в первую очередь окисляются боковые цепи, а бензольное ядро не изменяется. Как бы ни была сложна боковая цепь, она при действии сильных окислителей разрушается, и лишь углерод, непосредственно связанный с ядром, не отрывается от него и превращается в карбоксильную группу —СООН. Таким образом, любой гомолог бензола с одной боковой цепью окисляется в одноосновную ароматическую (бензойную) кислоту [c.337]
Большую роль в красителях играют карбоксильные группы —СООН и сульфогруппы —SOjOH. Они не оказывают существенного влияния на цвет, как ауксохромные группы, но придают красителю растворимость в воде и способность фиксироваться на окрашиваемом материале. [c.401]
[c.401]
Заряд белковой молекулы в нейтральней среде определяется соотношением количества свободных групп —СООН и —ЫНд и степенью их диссоциации. Чем больше карбоксильных групп —СООН, тем выше окажется отрицательный заряд, и белок будет проявлять свойства слабой кислоты. Преобладание аминных 1 рупп —Nh3 сообшает белку основные свойства и положительный заряд. [c.188]
Аминокислотами называются органические соединения, в молекулах которых содержатся одновременно аминогруппа —N112 и карбоксильная группа —СООН. [c.345]
Тестирование по органической химии за курс 10класса
Тестирование за курс органической химии в 10 классе.
Часть А. (1 вариант)
К какому гомологическому ряду относится вещество состава С7Н8 ?
а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алканов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
3. Реакции какого типа характерны для алканов?
Реакции какого типа характерны для алканов?
а) присоединения б) замещения в) полимеризации г) гидратации
4. Какое название соответствует веществу СН3 – СН – СН2 – СН3
СН3
а) бутан б) 2-метилбутан в) 2-метилпропан г) 3-метилбутан
5. Какой газ составляет основу природного газа?
а) метан б) этан в) пропан г) бутан
6. Сколько σ -связей в молекуле этена?
а) 2 б) 3 в) 4 г) 5
7. Сколько π-связей в молекуле бутадиена-1,3
а) 1 б) 2 в) 3 г) 4
8. Гомологами являются
а) пентен и 2-метилбутан б) хлорэтен и дихлорэтан
в) пропанол и пропаналь г) 2,2-диметилпропан и 2,2-диметилбутан
9. Тип реакции взаимодействия этена с бромом
а) присоединения б) замещения в) гидрирования г) гидратации
10. Только σ – связи имеются в молекуле
а) этанола б) этаналя в) этена г) этина
11. Вещество СН3 – СН – СН = СН2 называется
СН3
а)2-метилбутан б) 3-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
12. Несколько функциональных групп -ОН содержат молекулы
Несколько функциональных групп -ОН содержат молекулы
а) глицерина и глюкозы б) фенола и пропанола
в) сахарозы и формальдегида г) фенола и формальдегида
13. Следующие признаки: sp-гибридизация, длина С-С связи 0,120 нм,
угол 1800 характерны для молекулы
а) бензола б) этана в) этина г) этена
14. Функциональная группа -ОН характерна для класса
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбоксильная группа содержится в молекуле
а) метанола б) ацетальдегида в) уксусной кислоты г) глицерина
16. Реактивом для распознавания многоатомных спиртов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами окисления предельных одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Сложный эфир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
В реакцию «серебряного зеркала» вступают
а) альдегиды б) фенолы в) спирты г) одноатомные спирты
20. Из остатков молекул α – глюкозы состоят молекулы
а) фруктозы б) крахмала в) сахарозы г) целлюлозы
21. Установите тип реакции: n C6H12O6 → (C6H10O5)n + n H2O
а) полимеризация б) присоединения
в) поликонденсации г) изомеризации
22. Для аминов характерны свойства
а) кислот б) оснований в) амфотерных соединений
23. Какое название у вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминобутановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота в) 4- аминомасляная кислота
24. В состав белков входят остатки
а) α-аминокислот б) β-аминокислот
в) γ-аминокислот г) δ-аминокислот
25. Химическая связь, образующая первичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
часть Б.
Установите формулу органического вещества, в котором С — 53,5%,
Н – 15,6%, N – 31,1% и относительная плотность по водороду 22,5
Для вещества СН2= СН-СН=СН2 составьте структурные формулы одного изомера и одного ближайшего гомолога, назовите все вещества.
Напишите уравнения для осуществления превращений:
СаС2 → С2Н2 → С6Н6 → С6Н5NO2 Укажите условия реакций, назовите продукты.
Выберите, с какими из перечисленных веществ может взаимодействовать этанол, и напишите соответствующие уравнения реакций:
натрий, гидроксид натрия, хлорид натрия, хлороводород, уксусная кислота
При полном сгорании 3 г. углеводорода получилось 4,48 л. (н.у.) углекислого газа и 5,4 г. воды. Относительная плотность по воздуху равна 1,03. Выведите формулу углеводорода.

Тестирование за курс органической химии в 10 классе.
Часть А. ( 2 вариант)
К какому гомологическому ряду относится вещество состава С5Н8 ?
а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алкенов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
3. Реакции какого типа характерны для алканов?
а) полимеризации б) гидратации в) замещения г) присоединения
4. Какое название соответствует веществу СН3 – СН – СН = СН2
СН3
а) бутан б) 2-метилбутен-3 в) 3-метилбутен-1 г) 3-метилбутан
5. Какое вещество является природным полимером?
а) глюкоза б) фруктоза в) сахароза г) целлюлоза
6. Сколько σ -связей в молекуле этина?
а) 2 б) 3 в) 4 г) 5
7. Сколько π-связей в молекуле бутена-1
Сколько π-связей в молекуле бутена-1
а) 1 б) 2 в) 3 г) 4
8. Гомологами являются
а) пентен-2 и бутен-2 б) хлорэтан и дихлорэтен
в) пропанол и пропаналь г) 2-метилпропан и 2-метилбутен
9. Тип реакции взаимодействия этена с бромоводородом
а) присоединения б) замещения в) гидрирования г) изомеризации
10. Только σ – связи имеются в молекуле
а) этаналя б) этанола в) бензола г) уксусной кислоты
11. Вещество СН3 – СН2 – С = СН2 называется
СН3
а)2-метилбутен-1 б) 2-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
12. Несколько функциональных групп -ОН содержат молекулы
а) этанола и глюкозы б) фенола и формальдегида
в) сахарозы и формальдегида г) глюкозы и глицерина
13. Следующие признаки: sp2-гибридизация, длина С-С связи 0,134 нм,
угол 1200 характерны для молекулы
а) циклобутана б) этана в) этина г) этена
14. Функциональная группа -СООН характерна для класса
Функциональная группа -СООН характерна для класса
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбонильная группа содержится в молекуле
а) метанола б) ацетальдегида в) фенола г) глицерина
16. Реактивом для распознавания фенолов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами межмолекулярной дегидратации предельных
одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Жир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
а) спирты б) фенолы в) альдегиды г) одноатомные спирты
20. Из остатков молекул β– глюкозы состоят молекулы
а) глюкозы б) крахмала в) сахарозы г) целлюлозы
21. Установите тип реакции: n CH2 = CH2 → ( — CH2 — CH2-)n
а) полимеризация б) замещения
в) поликонденсации г) изомеризации
22. Для аминокислот характерны свойства
Для аминокислот характерны свойства
а) кислот б) оснований в) амфотерных соединений
23. Какое название у вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминопропановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота г) β- аминомасляная кислота
24. В состав белков входят остатки
а) δ-аминокислот б) β-аминокислот
в) γ-аминокислот г) α- аминокислот
25. Химическая связь, образующая вторичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
часть Б.
Установите формулу органического вещества, в котором С – 52,18%,
Н – 13,04%, О – 34,78% и относительная плотность по водороду 23
Для вещества СН2= СН- СН2— СН-СН3 составьте структурные формулы
СН3
одного изомера и одного ближайшего гомолога, назовите все вещества.
Напишите уравнения для осуществления превращений:
С2Н5ОН → С2Н4 → С2Н5Сl → С4Н10 Укажите условия реакций, назовите продукты.
Выберите, с какими из перечисленных веществ может взаимодействовать этановая кислота, и напишите соответствующие уравнения реакций:
магний, гидроксид натрия, хлорид натрия, хлороводород, этанол
При полном сгорании 4,4 г. углеводорода получилось 6,72 л. (н.у.) углекислого газа и 7,2 г. воды. Относительная плотность по воздуху равна 1,517. Выведите формулу углеводорода.
Инструкция по выполнению работы.
Тест состоит из частей А и Б. На его выполнение отводится 120 минут. Задания рекомендуется выполнять по порядку. Часть А содержит тестовые задания с выбором одного правильного ответа. Ответы на вопросы части А вносятся вами в таблицу бланка ответов.
Часть Б содержит задания со свободным ответом, предусматривающие произведение расчётов, написание уравнений реакций, составление структурных формул веществ.
Каждое задание части А оценивается в 1 балл, задание Б1 – 3 балла, Б2 – 5 баллов, Б3 -3 балла, Б4 – 3 балла, Б5 – 5 баллов. Общее количество баллов равно 44.
Шкала перевода баллов в отметки:
0 -15 баллов — «2» ( 0-34 %)
16 – 26 баллов — «3» (35-60%)
27 – 37 баллов -«4» (61-85 %)
38 – 44 балла — «5» (86-100%)
Желаю успехов!
Ответы на задания 1 варианта. Часть А
1
2
3
4
5
г
а
б
б
а
6
7
8
9
10
г
б
г
а
а
11
12
13
14
15
г
а
в
г
в
16
17
18
19
20
в
а
в
а
б
21
22
23
24
25
в
б
а
а
в
Б1 ответ С2Н7N
Б2 изомер СН2=С=СН-СН3 бутадиен-1,2
гомолог СН2=СН-СН=СН-СН3 пентадиен-1,3
Б3 СаС2+2Н2О → Са(ОН)2+С2Н2 (этин и гидроксид кальция)
3 С2Н2 → С6Н6 С активир.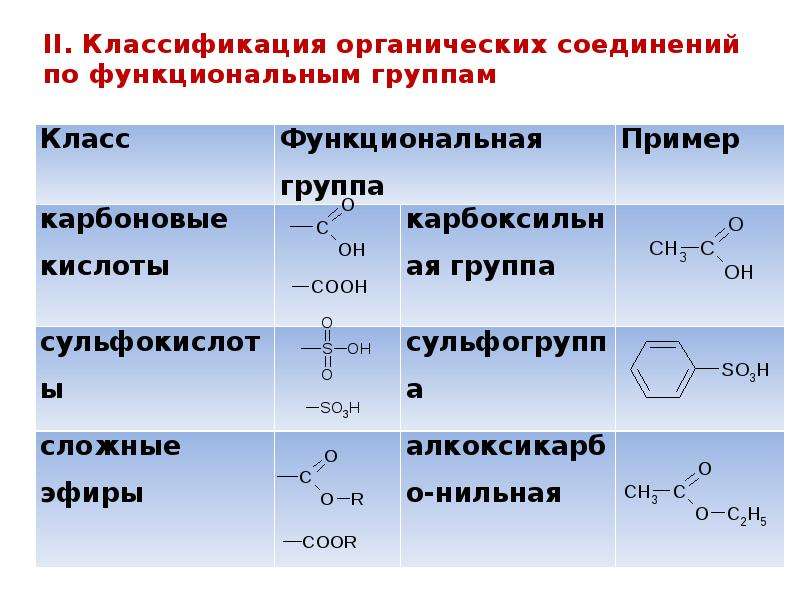 , t ̊ (бензол)
, t ̊ (бензол)
С6Н6 + НNO3 → С6Н5NO2 + Н2О Н2SO4 конц. (нитробензол)
Б4 2С2Н5ОН + 2Na → 2С2Н5ОNa + H2
С2Н5ОН + HCl → С2Н5Cl + Н2О
С2Н5ОН + СН3COОН → СН3COО С2Н5 + Н2О
Б5 ответ С2Н6
Ответы на задания 2 варианта.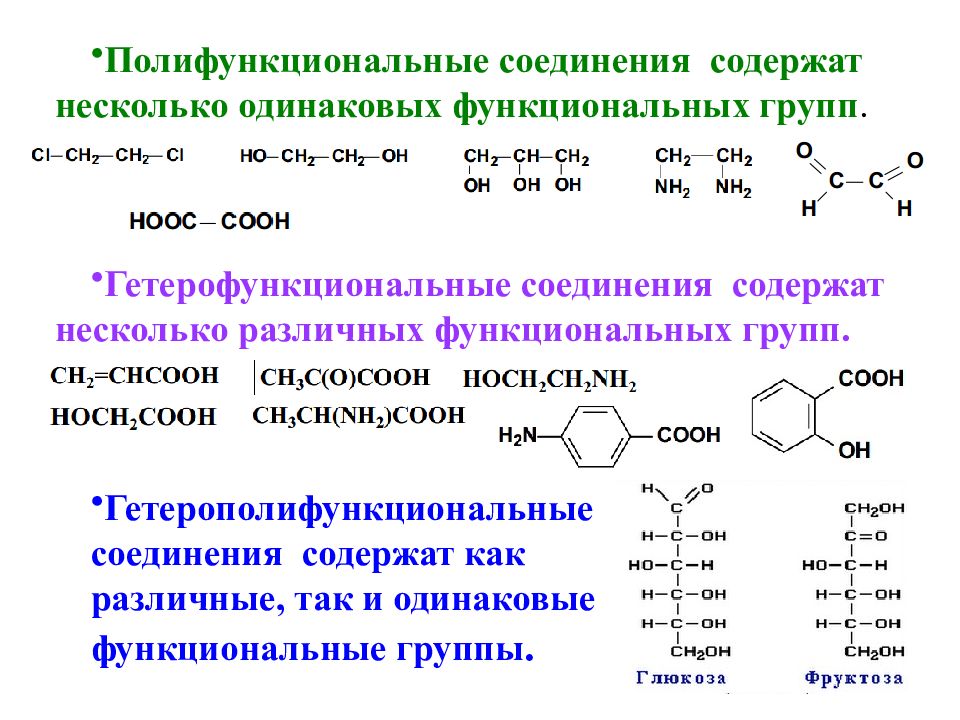 Часть А
Часть А
1
2
3
4
5
в
б
в
в
г
6
7
8
9
10
б
а
а
а
б
11
12
13
14
15
а
г
г
в
б
16
17
18
19
20
г
в
в
в
г
21
22
23
24
25
а
в
г
г
а
Б1 ответ С2Н6О
Б2 изомер СН2=СН-СН-СН2-СН3 или СН2=СН-СН2-СН2-СН2-СН3 и др.
3-метилпентен-1 СН3 гексен-1
гомолог СН2=СН-СН-СН3 или СН2=СН-СН-СН2-СН2-СН3
СН3 3-метилбутен-1 СН3
3-метилгексен-1
Б3 С2Н5ОН → С2Н4 + Н2О t ̊> 140 ̊, Н2SO4 конц. (этен и вода)
С2Н4 + НСl → С2Н5Сl (хлорэтан)
2 С2Н5Сl + 2Na → С4Н10 + 2NaСl (бутан и хлорид натрия)
Б4 СН3COОН + С2Н5ОН → СН3COОС2Н5 + Н2О
2 СН3COОН + Мg → (СН3COО)2Mg + Н2
2 СН3COОН + 2Na →2 СН3COОNa + Н2
Б5 ответ С3Н8
Functional Groups | Protocol (Translated to Russian)
21.
 1: Функциональные группы
1: Функциональные группы
Функциональные группы — это группа атомов с характерными свойствами, которые при связи с углеродным скелетом молекулы изменяют свойства этой молекулы. Например, наличие определенных функциональных групп на молекуле сделает их гидрофилами, в то время как другие сделают их гидрофобными. Эти функциональные группы являются неотъемлемой частью органической химии и важными компонентами биологических молекул, такими как углеводы, белки, липиды и нуклеиновые кислоты. Каждая функциональная группа представляет собой уникальное расположение атомов и имеет имя для комбинации атомов, которые составляют группу.
Углеводомоль
Прочные, стабильные связи между атомами углерода создают сложные молекулы, содержащие цепи, ветви и кольца. Химия этих соединений называется органической химией. Углеводомоль являются органическими соединениями, состоящими только из углерода и водорода. Алканы являются насыщенными углеводородами, то есть углеводородами, содержащими только единичные связи.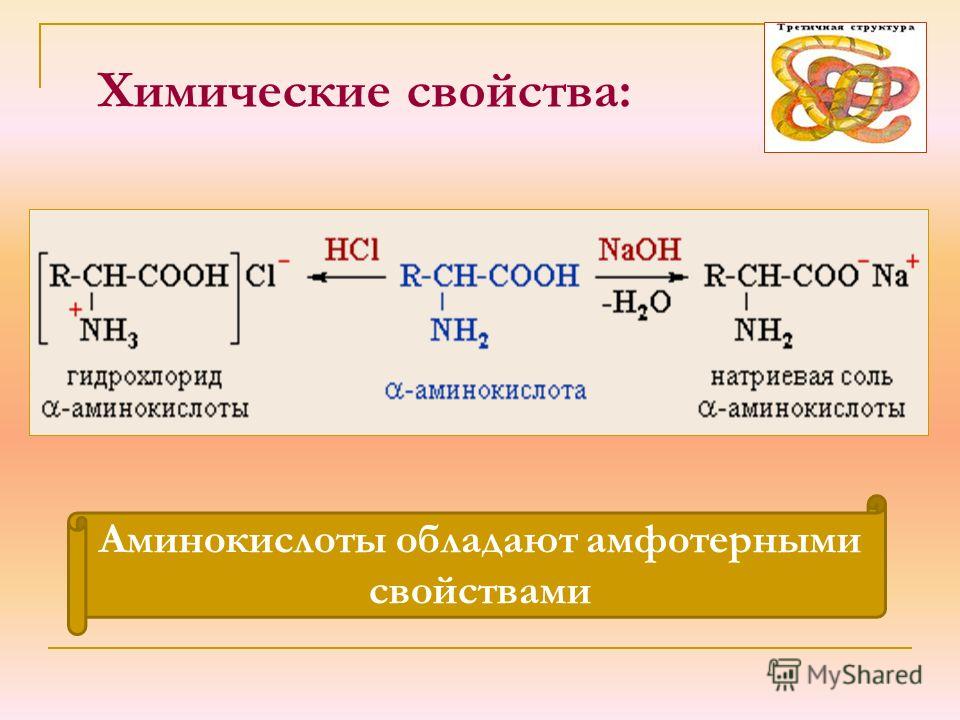 Алкенов содержит одну или несколько углеродистых двойных связей. В Alkynes есть одна или несколько углеродистых тройных связей. Ароматические углеводомоль содержат кольцевые структуры. Они также известны как арильные группы.
Алкенов содержит одну или несколько углеродистых двойных связей. В Alkynes есть одна или несколько углеродистых тройных связей. Ароматические углеводомоль содержат кольцевые структуры. Они также известны как арильные группы.
Спирты и эфиры
Многие органические соединения, которые не являются углеводородами, можно считать производными углеводородов. Производная углеводорода может быть образована путем замены одного или нескольких атомов водорода углеводорода функциональной группой, которая содержит по крайней мере один атом элемента, отличного от углерода или водорода. Свойства производных углеводородов определяются в значительной степени функциональной группой. Группа –OH, известная как гидроксильная группа, является функциональной группой спирта. Группа –R–O–R – является функциональной группой эфира.
Альдегиды, кетоны, карбоновые кислоты и Эстеры
К функциональным группам, связанным с карбонильной группой, относятся группа –CHO альдегида, группа –CO– кетона, группа –COOH карбоновой кислоты и группа –COOR эфира. Карбонильная группа, двойная связь углерода и кислорода, является ключевой структурой в этих классах органических молекул: Альдегиды содержат по крайней мере один атом водорода, присоединенный к атому карбонильного углерода, кетоны содержат две группы углерода, прикрепленные к атому карбонильного углерода, карбоксильные кислоты содержат гидроксильную группу, прикрепленную к атому карбонильного углерода, а эфиры содержат атом кислорода, присоединенный к другой группе углерода, связанной с атомом карбонильного углерода. Все эти соединения содержат окисленные атомы углерода относительно атома углерода группы спирта.
Карбонильная группа, двойная связь углерода и кислорода, является ключевой структурой в этих классах органических молекул: Альдегиды содержат по крайней мере один атом водорода, присоединенный к атому карбонильного углерода, кетоны содержат две группы углерода, прикрепленные к атому карбонильного углерода, карбоксильные кислоты содержат гидроксильную группу, прикрепленную к атому карбонильного углерода, а эфиры содержат атом кислорода, присоединенный к другой группе углерода, связанной с атомом карбонильного углерода. Все эти соединения содержат окисленные атомы углерода относительно атома углерода группы спирта.
Амины
Добавление азота в органическую структуру приводит к появлению двух семейств молекул. Соединения, содержащие атом азота, связанные в углеводородной структуре, классифицируются как амины.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 20.1: Углеводомоль, Openstax, Химия 2е изд., Раздел 20.2: Спирты и эфиры, Openstax, Химия 2е изд. , раздел 20.3: Альдегиды, кетоны, Карбоновые кислоты, и Эстеры, и Openstax, Химия 2е изд., раздел 20.4: Амины и амиды.
, раздел 20.3: Альдегиды, кетоны, Карбоновые кислоты, и Эстеры, и Openstax, Химия 2е изд., раздел 20.4: Амины и амиды.
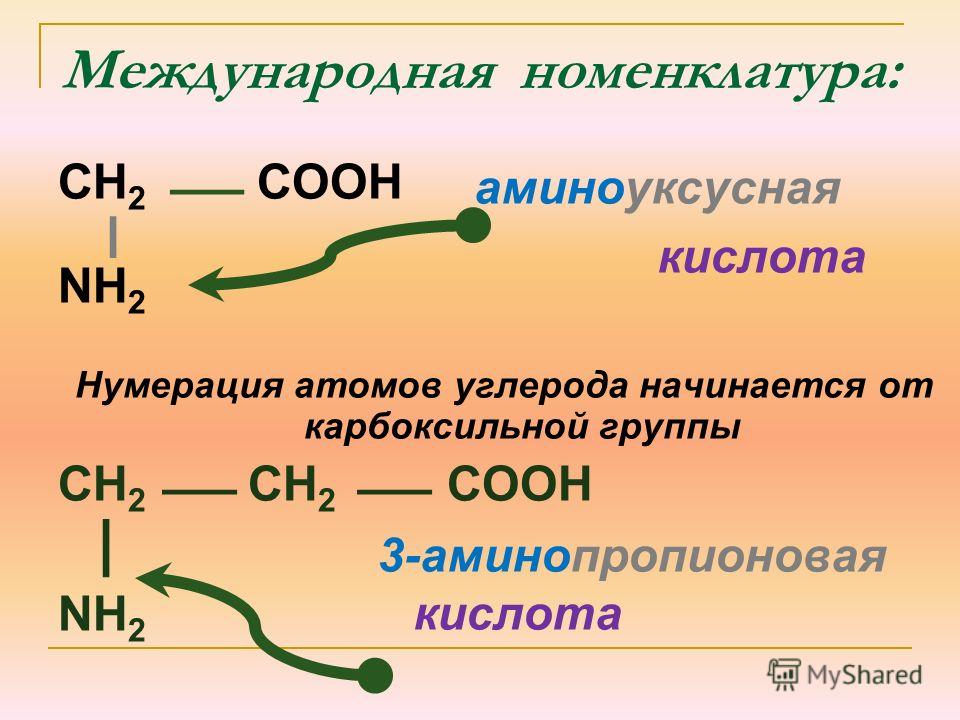
Aминокислоты — урок. Химия, 8–9 класс.
Аминокислоты — это органические вещества, в молекулах которых содержатся две функциональные группы: карбоксильная −COOH и аминогруппа −Nh3.
Состав аминокислот можно выразить формулой:
Примеры аминокислот
Аминокислоты — это производные карбоновых кислот, в молекулах которых вместо атома водорода содержится аминогруппа.
Самая простая аминокислота — аминоуксусная, или глицин .
Гомологом глицина является аланин. Его формулу можно записать следующим образом:
Аминокислоты могут содержать в радикале разные группы атомов. Так, в молекуле фенилаланина содержится бензольное кольцо. Его структурная формула:
В молекуле серина содержится гидроксильная группа:
В состав аминокислот могут также входить атомы некоторых элементов.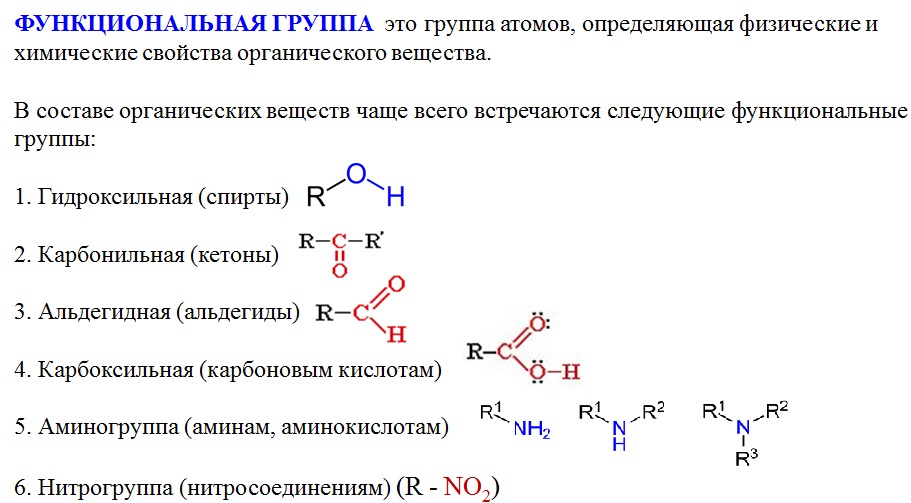 Например, в молекуле цистеина содержится атом серы. Формула цистеина может быть представлена следующим образом:
Например, в молекуле цистеина содержится атом серы. Формула цистеина может быть представлена следующим образом:
Физические свойства
Аминокислоты — кристаллические вещества, хорошо растворимые в воде. Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.Химические свойства
Функциональные группы определяют химические свойства аминокислот: карбоксильная — кислотные, а аминогруппа — основные. Основность аминогруппы связана со способностью атома азота присоединять к себе протоны водорода за счёт свободной электронной пары:
−N..h3+H+→−Nh4+.
Аминокислоты способны реагировать как с кислотами, так и с основаниями с образованием солей:
Аминокислоты — амфотерные органические соединения, имеющие одновременно кислотные и основные свойства.
Благодаря наличию двух функциональных групп аминокислоты способны взаимодействовать друг с другом и соединяться в более сложные вещества — пептиды:
При взаимодействии аминокислот образуются молекулы полимера (полипептида) и воды.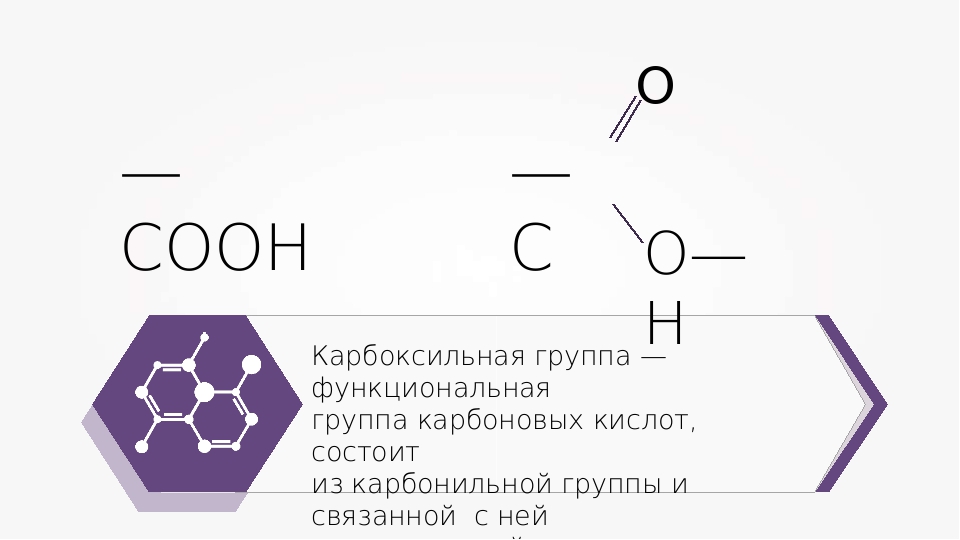
Реакция образования полимера, сопровождающаяся выделением низкомолекулярного вещества, называется реакцией поликонденсации.
При взаимодействии молекул аминокислот между их остатками возникает связь, которая называется пептидной связью.Пептидная связь — связь, возникающая между остатком аминогруппы одной молекулы аминокислоты и остатком карбоксильной группы другой молекулы аминокислоты −NH−CO− в полипептидах.
Применение аминокислот
Аминокислоты используются как лекарства. В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).карбоновых кислот. Образование сложных эфиров R’–COOR»:
карбоновых кислот.
Образование сложных эфиров R’–COOR»: Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от лат. ether — эфир).
Сложные эфиры — соединения с общей формулой R–COOR’, где R и R’ — углеводородные радикалы. Сложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Сложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Процесс — расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта — называют гидролизом сложного эфира. Гидролиз в присутствии щелочи протекает необратимо (т. к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом — спиртом). Эта реакция называется омылением сложного эфира.
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов — основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат) CH 3(CH 2)14–CO–OCH 2(CH 2)29 CH 3.
«ОДЕЖДА УКРАШАЕТ ВНЕШНОСТЬ, А ДУХИ ОТРАЖАЮТ ВНУТРЕННИЙ МИР. . . » Виды запахов: o ГОРЬКИЕ: герань, лимон, мандарин, пион, сирень, флердоранж (цветок апельсина). o ТОНКИЕ: акация, гелиотроп, ирис, левкой, магнолия, мимоза, настурция, пион, роза. o СЛАДКОВАТЫЕ: акация, мандарин, тубероза, ваниль. o ЗЕЛЕНЫЕ: гвоздика, фиалка (листья), нарцисс, гальбанум (смола), мирра. o ТЕПЛЫЕ: акация, душистый горошек, персик, сандал, тубероза, жимолость, животные запахи. o ГУСТЫЕ, ТЯЖЕЛЫЕ: гвоздика, ладан, лилия, пачули, тубероза, ладан. o ПРЯНЫЕ: жасмин, пачули, цикламен, корица, гвоздика, ветивер (корни), ладан. o ЗАПАХ КОЖИ, ТАБАКА получают из бессмертника. o ЖИВОТНЫЕ запахи: Серая амбра-железа кашалота выделяет секрет, который дает живой, теплый
. . » Виды запахов: o ГОРЬКИЕ: герань, лимон, мандарин, пион, сирень, флердоранж (цветок апельсина). o ТОНКИЕ: акация, гелиотроп, ирис, левкой, магнолия, мимоза, настурция, пион, роза. o СЛАДКОВАТЫЕ: акация, мандарин, тубероза, ваниль. o ЗЕЛЕНЫЕ: гвоздика, фиалка (листья), нарцисс, гальбанум (смола), мирра. o ТЕПЛЫЕ: акация, душистый горошек, персик, сандал, тубероза, жимолость, животные запахи. o ГУСТЫЕ, ТЯЖЕЛЫЕ: гвоздика, ладан, лилия, пачули, тубероза, ладан. o ПРЯНЫЕ: жасмин, пачули, цикламен, корица, гвоздика, ветивер (корни), ладан. o ЗАПАХ КОЖИ, ТАБАКА получают из бессмертника. o ЖИВОТНЫЕ запахи: Серая амбра-железа кашалота выделяет секрет, который дает живой, теплый
ЖИРЫ Жиры — сложные эфиры глицерина и высших одноатомных карбоновых кислот. Общееназвание таких соединений – триглицериды. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C 15 H 31 COOH, стеариновой C 17 H 35 COOH) и COOH ненасыщенных (олеиновой C 17 H 33 COOH, COOH линолевой C 17 H 29 COOH). COOH
COOH
Жиры содержатся во всех растениях и животных. Животные жиры (бараний, свиной, говяжий и т. п. ), как правило, являются твердыми веществами с невысокой температурой плавления (исключение — рыбий жир). Жиры состоят главным образом из триглицеридов предельных кислот. Растительные жиры — масла (подсолнечное, соевое, хлопковое и др. ) — жидкости (исключение — кокосовое масло). В состав триглицеридов масел входят остатки непредельных кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (гидрирования). Продукт гидрогенизации масел — твердый жир (искусственное сало, саломас). саломас Маргарин — пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др. ), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др. ).
При участии щелочей гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла — соли высших карбоновых кислот и щелочных металлов.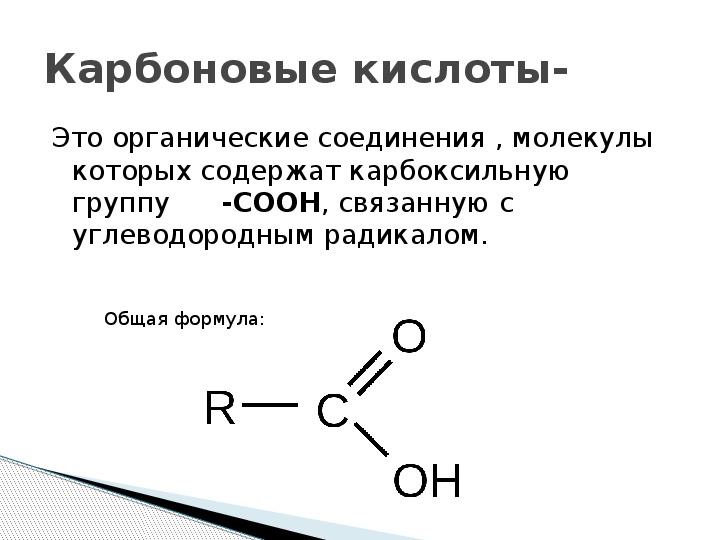 Натриевые соли — твердые мыла, калиевые — мыла жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Натриевые соли — твердые мыла, калиевые — мыла жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
КРАСОТА И ЗДОРОВЬЕ
1. Функциональную группу -СООН содержат молекулы. . . 1 : сложных эфиров; 2 : простых эфиров 3 : спиртов; 4 : альдегидов 5 : кетонов; 6 : карбоновых кислот 2. Какая из приведенных структур соответствует молекуле жира?
3. Какое вещество образуется при окислении пропаналя? 1 : пропанол 2 : пропиловый эфир уксусной кислоты 3 : пропионовая кислота 4 : метилэтиловый эфир 4. Этилацетат можно получить при взаимодействии. . . 1 : метанол + муравьиная кислота 2 : этанол + муравьиная кислота 3 : метанол + уксусная кислота 4 : этанол + уксусная кислота
5. Для получения 1, 5 моль этилового эфира муравьиной кислоты израсходовано 138 г этанола. Какова массовая доля выхода эфира в % от теоретически возможного? 1 : 50% 2 : 75% 3 : 85% 4 : 95%
Что такое гомологический ряд?
Гомологичные ряды относятся к органическим молекулам или соединениям, которые имеют сходную молекулярную формулу, в результате чего соединения имеют сходные химические свойства. Поскольку молекулярный размер соединения увеличивается в пределах гомологичного ряда, физические свойства также демонстрируют постепенное изменение. Основное различие между соединениями в таких сериях заключается в добавлении дополнительной углеродной и дигидрогеновой группы Ch3.
Поскольку молекулярный размер соединения увеличивается в пределах гомологичного ряда, физические свойства также демонстрируют постепенное изменение. Основное различие между соединениями в таких сериях заключается в добавлении дополнительной углеродной и дигидрогеновой группы Ch3.
Многие различные типы соединений имеют гомологичные ряды. Наиболее распространенные серии включают алканы, простые эфиры и спирты; другие гомологичные серии включают алкены или олефины и алкины и карбоновые кислоты. Алканы — это соединения, которые содержат только углерод и водород, связанные одинарными связями. Эфиры представляют собой соединения, которые имеют эфирную функциональную группу, состоящую из кислорода, связанного либо с двумя алканами, либо с двумя арильными соединениями, обозначенными как RO-R ‘. R и R ‘относятся к различным алкановым или арильным соединениям.
Спирты содержат функциональную группу, состоящую из кислорода, связанного с водородом (-ОН), а алкены имеют функциональную группу из углерода, двойно связанного с другим углеродом (С = С).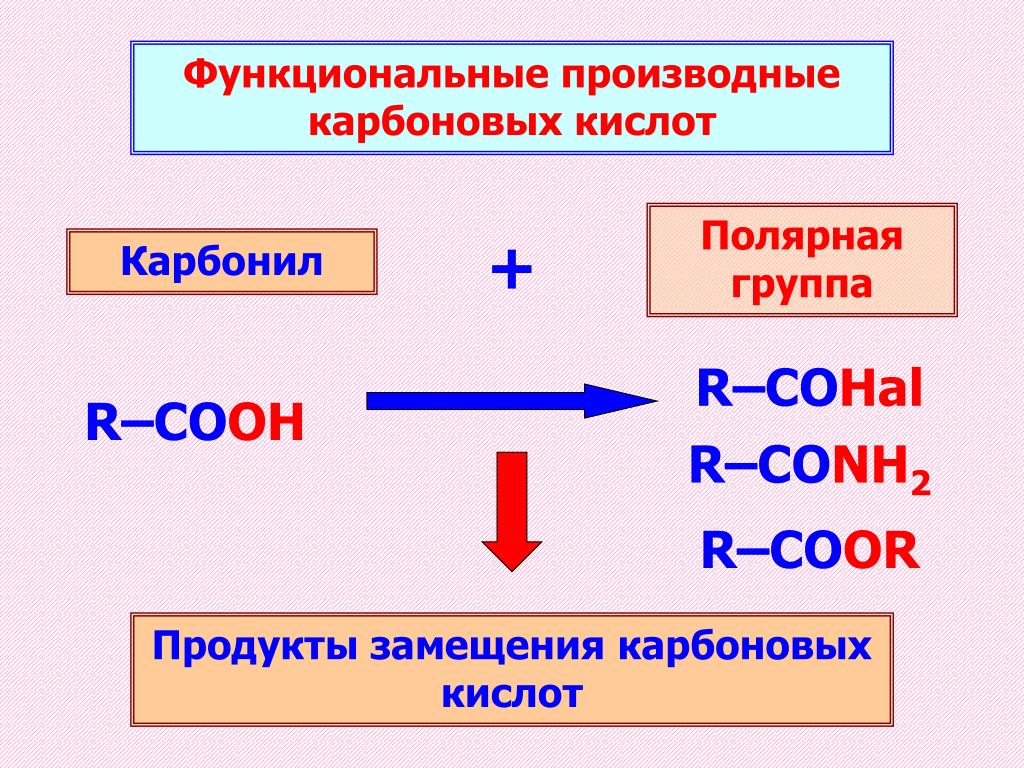 Алкины похожи на алкены, хотя функциональная группа состоит из молекулы углерода с тройной связью с другой молекулой углерода. Карбоновые кислоты представляют собой кислоты, которые содержат по меньшей мере одну карбоксильную группу (-COOH).
Алкины похожи на алкены, хотя функциональная группа состоит из молекулы углерода с тройной связью с другой молекулой углерода. Карбоновые кислоты представляют собой кислоты, которые содержат по меньшей мере одну карбоксильную группу (-COOH).
Соединения в ряду будут варьироваться в зависимости от единицы Ch3 и определенной молекулярной массы. Ряд алканов начинается с метана, с молекулярной формулой Ch5 и массой 16,04. Следующее соединение — этан, с формулой C2H6 и массой 30,07. Далее следуют бутан, формула C4h20 и масса 58,12, и пентан, формула C5h22 и масса 72,15. Как видно, этан содержит еще на один углерод и на два больше водорода, чем метан, и имеет массу на 14 больше, чем метан. То же самое происходит между этаном и бутаном, а также бутаном и пентаном.
Физические свойства этих соединений также постепенно меняются по мере увеличения молекул. Как правило, с увеличением длины углеродной цепи способность соединения растворяться в воде уменьшается, хотя это также зависит от химической природы функциональной группы, поскольку некоторые функциональные группы более растворимы в воде, чем другие. По мере того как углеродные цепи в гомологичных рядах становятся длиннее, температура кипения соединения изменяется. Хотя во многих случаях оно увеличивается, если углеродная цепь начинает разветвляться, температура кипения начнет уменьшаться. Это только одно из исключений, обнаруженных в физических изменениях.
По мере того как углеродные цепи в гомологичных рядах становятся длиннее, температура кипения соединения изменяется. Хотя во многих случаях оно увеличивается, если углеродная цепь начинает разветвляться, температура кипения начнет уменьшаться. Это только одно из исключений, обнаруженных в физических изменениях.
ДРУГИЕ ЯЗЫКИ
4.4: Функциональные группы — Chemistry LibreTexts
Результаты обучения
- Опишите важность и назначение функциональных групп в органических реакциях.
- Идентифицируйте и назовите функциональные группы в соединениях.
При существовании более двадцати миллионов известных органических соединений было бы очень сложно запомнить химические реакции для каждого из них. К счастью, молекулы со схожими функциональными группами склонны вступать в сходные реакции.Функциональная группа определяется как атом или группа атомов в молекуле, которая имеет аналогичные химические свойства, когда бы она ни появлялась в различных соединениях. Даже если другие части молекулы совершенно разные, определенные функциональные группы имеют тенденцию реагировать определенным образом.
Даже если другие части молекулы совершенно разные, определенные функциональные группы имеют тенденцию реагировать определенным образом.
Мы уже рассматривали алканы, но они, как правило, не реагируют. В первую очередь мы используем алканы в качестве источника энергии при их сжигании. Хотя большинство функциональных групп включают в себя атомы, отличные от углерода и водорода, мы также рассмотрим некоторые из них, которые включают только углерод и водород.Некоторые из наиболее распространенных функциональных групп представлены в следующих разделах.
Органические молекулы сильно различаются по размеру, и, сосредотачиваясь на функциональных группах, мы хотим направить наше внимание на атомы, входящие в функциональную группу. В результате в некоторых примерах используется сокращение R. Буква R используется в молекулярных структурах для обозначения « R изм. Молекулы». Он состоит из группы атомов углерода и водорода любого размера. Он используется как сокращение, поскольку группа атомов углерода и водорода не влияет на функциональность соединения. В некоторых молекулах вы увидите R, R ’или R’ ’, что указывает на то, что группы R в молекуле могут отличаться друг от друга. Например, R может быть –CH 2 CH 3 , а R ’- –CH 2 CH 2 CH 2 CH 3 .
В некоторых молекулах вы увидите R, R ’или R’ ’, что указывает на то, что группы R в молекуле могут отличаться друг от друга. Например, R может быть –CH 2 CH 3 , а R ’- –CH 2 CH 2 CH 2 CH 3 .
Алкены и алкины
Алкены — это углеводороды, которые содержат одну или несколько двойных связей между соседними атомами углерода. Алкины содержат одну или несколько тройных связей между соседними атомами углерода. Наличие двойной или тройной связи приводит к реакционной способности, отсутствующей в алканах, и алкины (см. Рисунок ниже) претерпевают характерные реакции, которые будут рассмотрены позже.
Рисунок \ (\ PageIndex {1} \): Алкены (слева) содержат одну или несколько двойных связей, а алкины (справа) содержат одну или несколько тройных связей.Ароматические углеводороды
Дополнительная функциональная группа, которая содержит только углерод и водород, представляет собой ароматическое кольцо, представляющее собой шестикарбонатное кольцо с альтернативными двойными связями.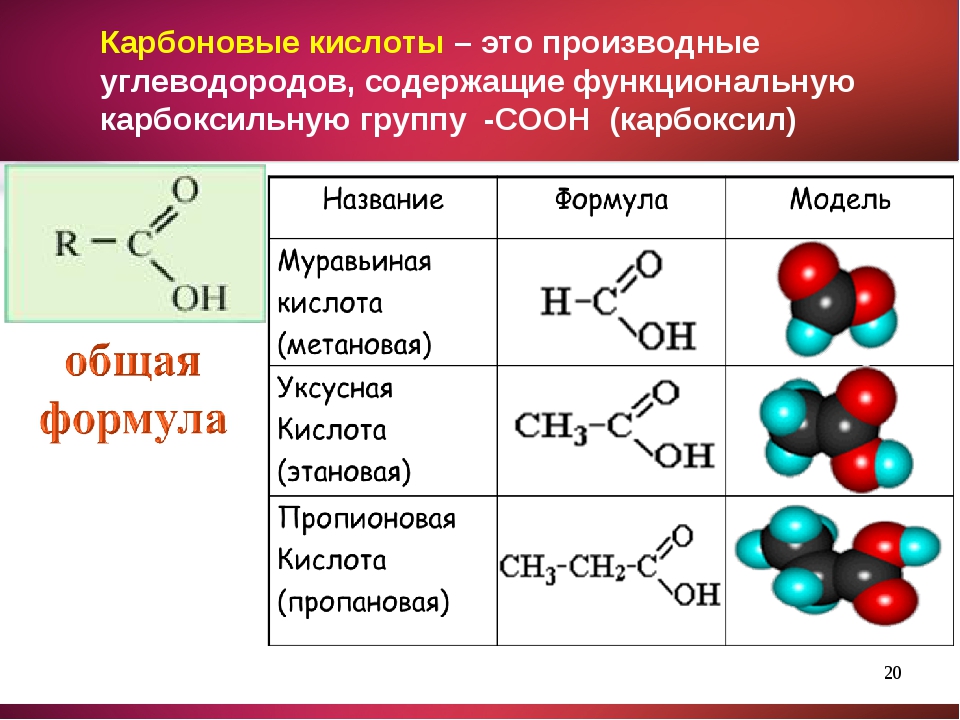 Ароматическое кольцо также показано в виде кольца с кружком в середине, представляющим двойные связи. Ароматические кольца (см. Рисунок ниже) содержатся во многих соединениях, включая стероиды и лекарства.
Ароматическое кольцо также показано в виде кольца с кружком в середине, представляющим двойные связи. Ароматические кольца (см. Рисунок ниже) содержатся во многих соединениях, включая стероиды и лекарства.
Спирты
Функциональная группа спирта включает атом кислорода, который связан с одним атомом водорода и одним атомом углерода. Атом углерода будет частью более крупной органической структуры. Один из способов обозначить универсальный алкоголь — использовать формулу \ (\ ce {R-OH} \). \ (\ ce {R} \) представляет собой любой органический фрагмент, в котором атом углерода непосредственно связан с явно указанной функциональной группой (в данном случае \ (\ ce {OH} \)).Группа \ (\ ce {R} \) обычно представляет собой цепочку атомов углерода.
Рисунок \ (\ PageIndex {3} \): Первичные, вторичные и третичные спирты. Спирты можно разделить на первичные, вторичные или третичные в зависимости от характеристик углерода, к которому они присоединены.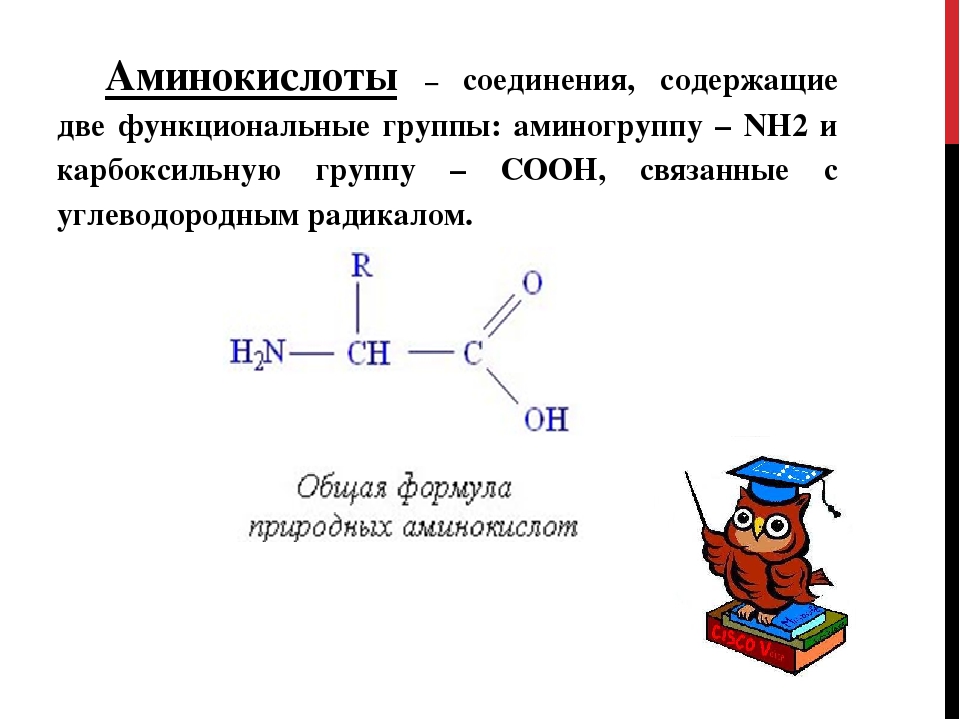 В первичном спирте углерод, связанный непосредственно с атомом кислорода, также связан ровно с одним атомом углерода, а другие связи обычно идут с атомами водорода. Во вторичном спирте углерод связан с двумя другими атомами углерода, а в третичном спирте углерод связан с тремя другими атомами углерода.Тип используемого алкоголя определяет продукт определенных реакций. Обратите внимание на названия спиртов, как показано на рисунке выше. Расположение группы \ (\ ce {-OH} \) указывается номером атома углерода, к которому она присоединена.
В первичном спирте углерод, связанный непосредственно с атомом кислорода, также связан ровно с одним атомом углерода, а другие связи обычно идут с атомами водорода. Во вторичном спирте углерод связан с двумя другими атомами углерода, а в третичном спирте углерод связан с тремя другими атомами углерода.Тип используемого алкоголя определяет продукт определенных реакций. Обратите внимание на названия спиртов, как показано на рисунке выше. Расположение группы \ (\ ce {-OH} \) указывается номером атома углерода, к которому она присоединена.
Мы уже знакомы с несколькими распространенными спиртами. Например, этанол \ (\ left (\ ce {CH_3CH_2OH} \ right) \) — это алкоголь, присутствующий в алкогольных напитках. Он также широко используется в промышленном производстве других химикатов. Метанол \ (\ left (\ ce {CH_3OH} \ right) \) используется как присадка к бензину или альтернатива.Кроме того, метанол можно использовать для производства формальдегида, который используется в производстве пластмасс, красок и других полезных веществ. Изопропанол широко известен как медицинский спирт. В дополнение к промышленному использованию изопропанол используется для очистки различных поверхностей, включая компьютерные мониторы, доски и даже кожу (например, перед взятием крови).
Изопропанол широко известен как медицинский спирт. В дополнение к промышленному использованию изопропанол используется для очистки различных поверхностей, включая компьютерные мониторы, доски и даже кожу (например, перед взятием крови).
Эфиры
Функциональная группа эфира состоит из атома кислорода, который образует одинарные связи с двумя атомами углерода.
Рисунок \ (\ PageIndex {4} \): ЭфирыЭфиры являются хорошими растворителями для других органических соединений из-за их низкой реакционной способности. Они легко растворяют неполярные молекулы. Диэтиловый эфир, пожалуй, самый известный эфир. Он широко используется как растворитель и как ингаляционный анестетик.
Хотя сами эфиры относительно инертны, они могут превращаться в пероксиды после длительного воздействия кислорода. Пероксиды очень реактивны и часто взрывоопасны при повышенных температурах.Многие коммерчески доступные эфиры содержат небольшое количество поглотителя перекиси, растворенного в них, чтобы помочь предотвратить этот тип угрозы безопасности.
Тиол
Функциональная группа тиола содержит атом серы, связанный с атомом водорода. Он очень похож на функциональную группу спирта с серой, заменяющей O.
Рисунок \ (\ PageIndex {5} \): ТиолТиолы также называют меркаптанами, что происходит от латинского слова «улавливание ртути» из-за прочных связей, которые он образует с ртутьсодержащими соединениями.Некоторые тиоловые соединения имеют характерный запах, похожий на запах тухлых яиц. Их часто добавляют в природный газ, который сам по себе не имеет запаха, как способ обнаружения утечек, поскольку его запах может быть обнаружен людьми в очень небольших количествах. Тиоловая группа также присутствует в аминокислоте цистеине, что будет обсуждаться позже.
Амины
Амин состоит из атома азота, связанного с некоторой комбинацией атомов углерода и водорода.
Рисунок \ (\ PageIndex {6} \): Амины Как и спирты, амины можно разделить на первичные, вторичные и третичные. Однако правила присвоения этих категорий немного отличаются. В спирте атом кислорода всегда связан ровно с одним атомом углерода, поэтому мы смотрим на разветвление на соседнем атоме углерода, а не на сам атом кислорода. В нейтральном амине азот может быть связан с одним, двумя или тремя атомами углерода, и именно так мы решаем, называть его первичным, вторичным или третичным амином.
Однако правила присвоения этих категорий немного отличаются. В спирте атом кислорода всегда связан ровно с одним атомом углерода, поэтому мы смотрим на разветвление на соседнем атоме углерода, а не на сам атом кислорода. В нейтральном амине азот может быть связан с одним, двумя или тремя атомами углерода, и именно так мы решаем, называть его первичным, вторичным или третичным амином.
Нейтральные амины — слабые основания, потому что неподеленная пара на азоте может действовать как акцептор протонов.Многие амины меньшего размера имеют очень сильный и неприятный запах. Например, удачно названные соединения кадаверин и путресцин представляют собой дурно пахнущие амины, образующиеся в процессе распада после смерти.
Амины служат для самых разных целей. Дифениламин действует как стабилизатор для некоторых типов взрывчатых веществ. Амины входят в состав некоторых смазочных материалов, в проявителях и входят в состав гидроизоляционных тканей. Некоторые амины, например новокаин, используются в качестве анестетиков. Многие фармацевтические соединения содержат амины, в том числе 8 из 10 лекарств, которые чаще всего выписывались в 2012 году.
Многие фармацевтические соединения содержат амины, в том числе 8 из 10 лекарств, которые чаще всего выписывались в 2012 году.
Альдегиды
Очень распространенным структурным компонентом органических структур является карбонил , который представляет собой просто атом углерода и атом кислорода, соединенные двойной связью. Реакционная способность карбонилов в первую очередь определяется поляризацией связи \ (\ ce {C = O} \), но окружающие атомы также играют роль в ее конкретных реакционных путях. Хотя карбонил является компонентом многих функциональных групп, он сам по себе не является функциональной группой.
Рисунок \ (\ PageIndex {7} \): Альдегид Альдегид представляет собой карбонил, в котором атом углерода связан по крайней мере с одним атомом водорода.Другая группа, присоединенная к карбонилу, может быть \ (\ ce {R} \) — группой или атомом водорода. Поскольку атом водорода настолько мал, частичный положительный заряд на углероде карбонила очень легко поддается другим молекулам, что делает альдегиды особенно реактивным типом карбонила. Альдегиды — универсальные реагенты для самых разных органических синтезов. Многие альдегиды также обладают отличительным вкусом и ароматом. Например, аромат корицы в первую очередь обусловлен молекулой коричного альдегида, а ванилин является альдегидом, наиболее ответственным за запах и вкус ванильного экстракта.
Альдегиды — универсальные реагенты для самых разных органических синтезов. Многие альдегиды также обладают отличительным вкусом и ароматом. Например, аромат корицы в первую очередь обусловлен молекулой коричного альдегида, а ванилин является альдегидом, наиболее ответственным за запах и вкус ванильного экстракта.
Особый альдегид — это молекула, в которой карбонил связан с двумя атомами водорода. Эта молекула, называемая формальдегидом, имеет множество применений. Сам по себе он может использоваться как консервант для тканей или как очень агрессивное дезинфицирующее средство. Он также используется в качестве предшественника различных материалов, включая пластмассы, смолы и другие полимеры.
Рисунок \ (\ PageIndex {8} \): Примеры молекул с альдегидными функциональными группами.Кетоны
Рисунок \ (\ PageIndex {9} \): Кетон Кетон включает карбонил, в котором атом углерода образует одинарные связи с двумя \ (\ ce {R} \) — группами.Кетоны претерпевают большинство тех же реакций, что и альдегиды, но они, как правило, немного менее реактивны. Самый простой кетон — это ацетон, в котором карбонильный углерод связан с двумя \ (\ ce {CH_3} \) группами. Этот кетон обычно используется для удаления лака с ногтей и служит промышленным растворителем. Метилэтилкетон используется в качестве средства для снятия краски и растворителя. Кетоны также используются в производстве различных полимеров в качестве строительного материала или растворителя. \ (\ Ce {R} \) — группа в кетоне может быть такой же или другой, как показано в примере.
Самый простой кетон — это ацетон, в котором карбонильный углерод связан с двумя \ (\ ce {CH_3} \) группами. Этот кетон обычно используется для удаления лака с ногтей и служит промышленным растворителем. Метилэтилкетон используется в качестве средства для снятия краски и растворителя. Кетоны также используются в производстве различных полимеров в качестве строительного материала или растворителя. \ (\ Ce {R} \) — группа в кетоне может быть такой же или другой, как показано в примере.
Карбоновые кислоты
Карбоновые кислоты представляют собой другую карбонилсодержащую функциональную группу, в которой атом углерода связан с группой \ (\ ce {OH} \) с одной стороны и с атомом углерода или водорода с другой.
Рисунок \ (\ PageIndex {11} \) : Карбоновая кислота Как следует из названия, карбоновые кислоты являются слабыми кислотами. Группа \ (\ ce {OH} \), которая напрямую связана с карбонилом, будет ионизироваться в небольшой степени при растворении в воде. Причина этого — относительная стабильность образующегося аниона. Карбоксилат-ион (см. Рисунок ниже), в котором отрицательный заряд распространяется на два разных атома кислорода через резонансные структуры, более стабилен, чем изолированный анион с кислородным центром. Карбоновая кислота и карбоксилат-ион взаимозаменяемы. Карбоксилат-ионы часто присутствуют в аминокислотах.
Причина этого — относительная стабильность образующегося аниона. Карбоксилат-ион (см. Рисунок ниже), в котором отрицательный заряд распространяется на два разных атома кислорода через резонансные структуры, более стабилен, чем изолированный анион с кислородным центром. Карбоновая кислота и карбоксилат-ион взаимозаменяемы. Карбоксилат-ионы часто присутствуют в аминокислотах.
Карбоновые кислоты используются в различных средах. Муравьиная кислота действует как защитное химическое вещество для многих жалящих насекомых и растений.Уксусная кислота придает уксусу характерный запах и вкус и является основным строительным материалом для биологии и промышленности. Карбоновые кислоты с более длинными углеродными цепями (жирные кислоты) используются животными как способ хранения энергии и широко используются при производстве мыла. Некоторые соединения содержат несколько карбоновых кислот в одной молекуле. Например, лимонной кислоты (три карбоксильные группы) особенно много в цитрусовых, и она используется в качестве ароматизатора и консерванта во многих пищевых продуктах и напитках.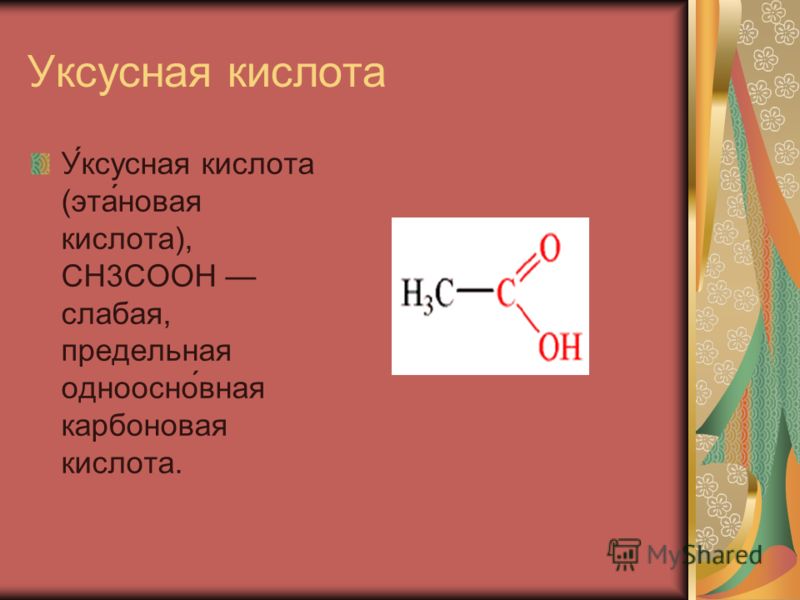
Сложные эфиры
Сложный эфир похож на карбоновую кислоту тем, что он содержит карбонил, в котором углерод связан с одним дополнительным атомом кислорода и одним атомом углерода или водорода. Однако второй атом кислорода связан с другим углеродом, а не с кислым атомом водорода. Структурно карбоновые кислоты и сложные эфиры связаны друг с другом так же, как спирты и простые эфиры.
Рисунок \ (\ PageIndex {14} \): Сложный эфирСложные эфиры могут быть образованы путем нагревания карбоновых кислот и спиртов в присутствии кислотного катализатора.Этот процесс обратим, и исходные материалы можно регенерировать путем реакции сложного эфира с водой в присутствии слабого основания.
Некоторые сложные эфиры имеют очень приятный запах, поэтому их используют при производстве многих духов. Пропилацетат придает запах грушам, а изоамилацетат придает запах бананам. Этот эфир также служит сигналом тревоги для медоносных пчел.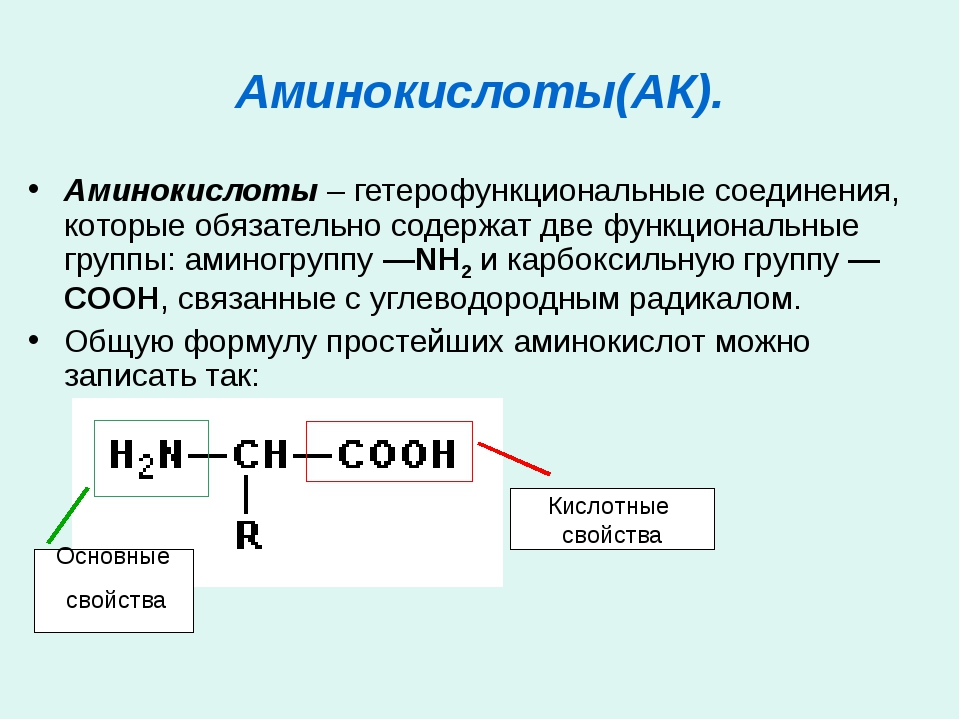 Сложные эфиры используются при производстве тканей (полиэфиров) и оргстекла. Анестетики, такие как прокаин и бензокаин, также содержат сложные эфиры.
Сложные эфиры используются при производстве тканей (полиэфиров) и оргстекла. Анестетики, такие как прокаин и бензокаин, также содержат сложные эфиры.
Амиды
Амид представляет собой карбонил, в котором углерод присоединен к одному атому азота и одному атому углерода или водорода. В качестве альтернативы мы могли бы определить амид как амин, в котором один из атомов углерода, присоединенный к азоту, является частью карбонила.
Рисунок \ (\ PageIndex {15} \): АмидАмид может быть образован путем объединения карбоновой кислоты и амина. Только первичные и вторичные амины могут быть использованы для образования амидов, поскольку они содержат водород, который можно заменить карбонильным углеродом; третичные амины не образуют амидов.Амид, показанный на рисунке выше, образовался из карбоновой кислоты и первичного амина.
Амиды используются в качестве красителей в цветных мелках, карандашах и чернилах. Они работают в бумажной, пластмассовой и резиновой промышленности.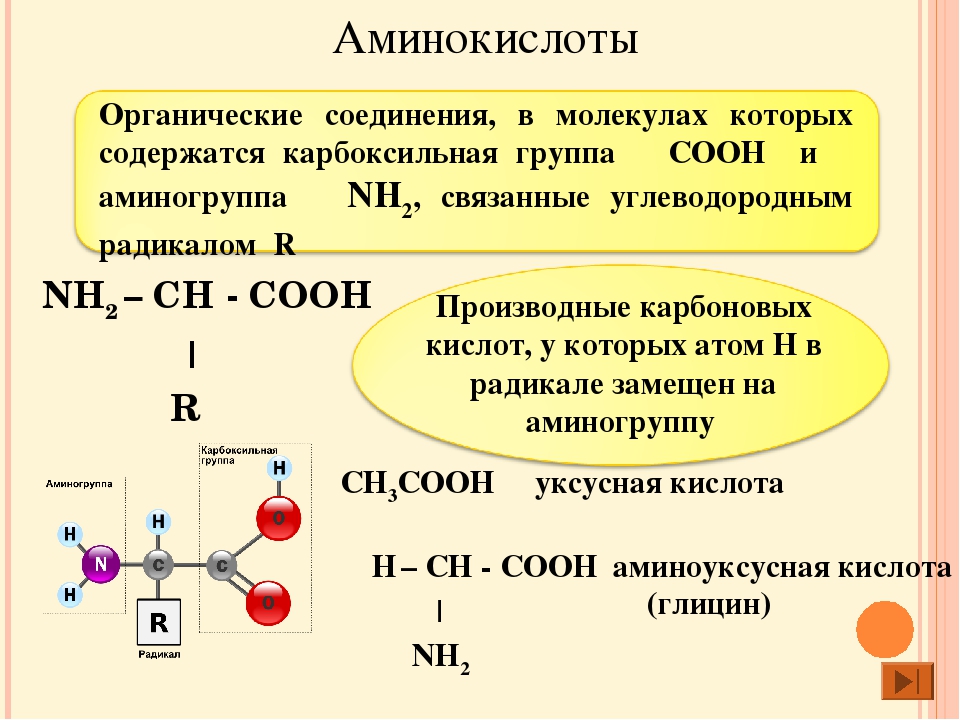 Полиакриламид — очень широко используемый амид; он участвует в очистке питьевой воды и сточных вод, а также в производстве пластмасс. Амид Кевлар широко используется для производства бронежилетов, а нейлон — еще один тип полимера на основе амида.
Полиакриламид — очень широко используемый амид; он участвует в очистке питьевой воды и сточных вод, а также в производстве пластмасс. Амид Кевлар широко используется для производства бронежилетов, а нейлон — еще один тип полимера на основе амида.
Галоалканы
Галогеналканы, также известные как алкилгалогениды, представляют собой группу химических соединений, состоящих из алкана с одним или несколькими атомами водорода, замещенными атомом галогена (атом группы 17).Существует довольно большая разница между структурными и физическими свойствами галогеналканов и структурными и физическими свойствами алканов. A
Рисунок \ (\ PageIndex {16} \): Амид Галоалканы содержатся в огнетушителях, хладагентах, пропеллентах, растворителях и лекарствах. Они также являются значительным источником загрязнения, и их использование в некоторых продуктах было сокращено или полностью исключено. Хлорфторуглероды (ХФУ) использовались в качестве хладагентов в кондиционерах, но оказалось, что они являются основной причиной разрушения озонового слоя. Исследования и разработки альтернатив начались в 1970-х годах. Гидрохлорфторуглероды (ГХФУ) используются в течение многих лет, поскольку они наносят меньший ущерб озоновому слою, но многие страны согласились ликвидировать ГХФУ к 2020 году.
Исследования и разработки альтернатив начались в 1970-х годах. Гидрохлорфторуглероды (ГХФУ) используются в течение многих лет, поскольку они наносят меньший ущерб озоновому слою, но многие страны согласились ликвидировать ГХФУ к 2020 году.
Авторы и авторство
-
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
-
Эллисон Соулт, Ph.D. (Департамент химии, Университет Кентукки)
Описание карбоновых кислот — Карбоновые кислоты
Карбоновые кислоты (-COOH) представляют собой функциональные группы, состоящие из одной карбонильной и одной гидроксильной группы.
Карбоксильная группа (COOH) представляет собой функциональную группу, состоящую из карбонильной группы (C = O) с гидроксильной группой (O-H), присоединенной к одному и тому же атому углерода. Карбоксильные группы имеют формулу -C (= O) OH, обычно обозначаемую как -COOH или CO 2 H. Карбоновые кислоты — это класс молекул, которые характеризуются наличием одной карбоксильной группы. В качестве доноров протонов карбоновые кислоты характеризуются как кислоты Бренстеда-Лоури . Кислоты с двумя или более карбоксильными группами называются дикарбоновыми, трикарбоновыми и т. Д.Соли и сложные эфиры карбоновых кислот называются карбоксилатами. Карбоксилат-ионы стабилизированы резонансом. Эта повышенная стабильность приводит к повышенной кислотности по сравнению со спиртами. Как правило, в номенклатуре ИЮПАК карбоновые кислоты имеют суффикс «-ойная кислота», хотя «-иновая кислота» является наиболее часто используемым суффиксом.
Карбоновые кислоты — это класс молекул, которые характеризуются наличием одной карбоксильной группы. В качестве доноров протонов карбоновые кислоты характеризуются как кислоты Бренстеда-Лоури . Кислоты с двумя или более карбоксильными группами называются дикарбоновыми, трикарбоновыми и т. Д.Соли и сложные эфиры карбоновых кислот называются карбоксилатами. Карбоксилат-ионы стабилизированы резонансом. Эта повышенная стабильность приводит к повышенной кислотности по сравнению со спиртами. Как правило, в номенклатуре ИЮПАК карбоновые кислоты имеют суффикс «-ойная кислота», хотя «-иновая кислота» является наиболее часто используемым суффиксом.
Номенклатура
При наименовании соединений с присутствующей группой карбоновой кислоты уместно заменить окончание (например, -e ) на -oic acid .Кислотность карбоновой кислоты обусловлена способностью отдавать протон заместителю -ОН.
Физические свойства
Из-за сильной водородной связи двумя важными факторами, связанными с карбоновыми кислотами, являются то, что они имеют высокую температуру кипения, но также растворимы в воде и других органических растворителях, таких как толуол и этанол. Карбоновые кислоты также обладают высокой реакционной способностью к двум факторам: двум богатым электронами атомам кислорода в карбонильной и спиртовой части функциональной группы и бедному электронами углероду между группой карбонилового спирта, который является желательным местом атаки нуклеофилов.
Практические вопросы
Ханская академия
Официальная подготовка MCAT (AAMC)
Официальное руководство C / P Раздел Отрывок 3 Вопрос 10
Пакет вопросов по химии, вопрос 15
Ключевые точки
• Карбоновые кислоты используются в качестве предшественников для образования других соединений, таких как сложные эфиры, альдегиды и кетоны.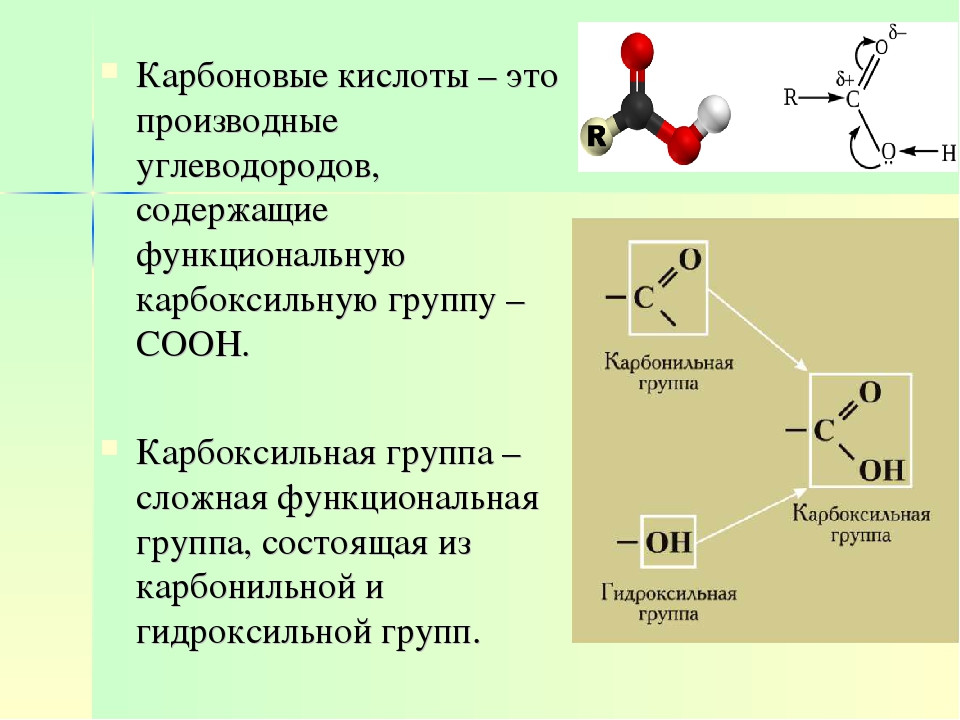
• Карбоновые кислоты могут образовывать водородные связи сами с собой, особенно в неполярных растворителях; это приводит к усилению стабилизации соединений и повышению их точек кипения.
• Поскольку карбоновые кислоты содержат как гидроксильные, так и карбонильные функциональные группы, они участвуют в образовании водородных связей как акцепторы водорода, так и доноры водорода.
• Соединения с присутствующей группой карбоновой кислоты используют суффикс -oic acid в своей номенклатуре.
• Карбоновые кислоты имеют высокую температуру кипения и имеют легко вступающий в реакцию углерод, обедненный электронами.
Ключевые термины
Кислоты Бренстеда-Лоури: Химическое соединение, которое отдает один или несколько ионов водорода в реакции.
Карбонил: Группа, содержащая углерод с двойной связью и кислород, записывается как C = O.
Спирт: Группа, содержащая гидроксил, обозначается как -OH.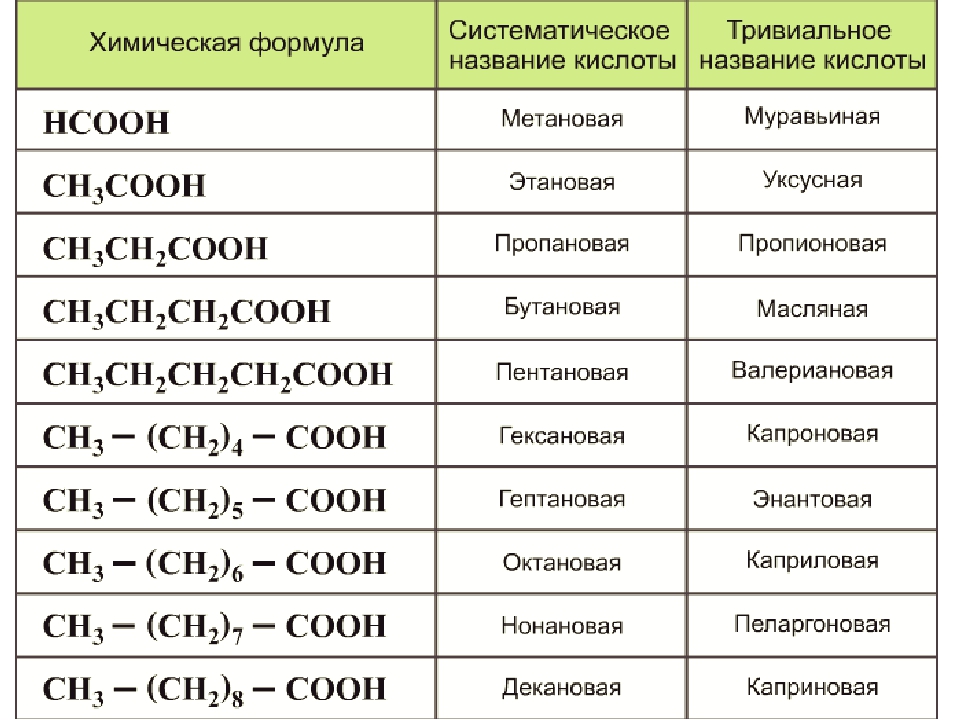
Сложный эфир: Соединение, чаще всего образующееся при конденсации спирта и кислоты с удалением воды. Он содержит функциональную группу C = O, присоединенную через углерод к другому атому кислорода.
Нитрил : любой из класса органических соединений, содержащих цианофункциональную группу (-C≡N).
Олефин: Любой из класса ненасыщенных углеводородов с открытой цепью, таких как этилен; алкен только с одной двойной связью углерод-углерод.
функциональных групп
функциональных группФункциональные группы
Функциональные группы
Бром реагирует с 2-бутеном с образованием 2,3-дибромбутана.
Он также реагирует с 3-метил-2-пентеном с образованием 2,3-дибромпентана.
Вместо того, чтобы пытаться запомнить оба уравнения, мы можем построить общее правило, что бром
реагирует с соединениями, содержащими двойную связь C = C, с образованием продукта, ожидаемого от
сложение по двойной связи.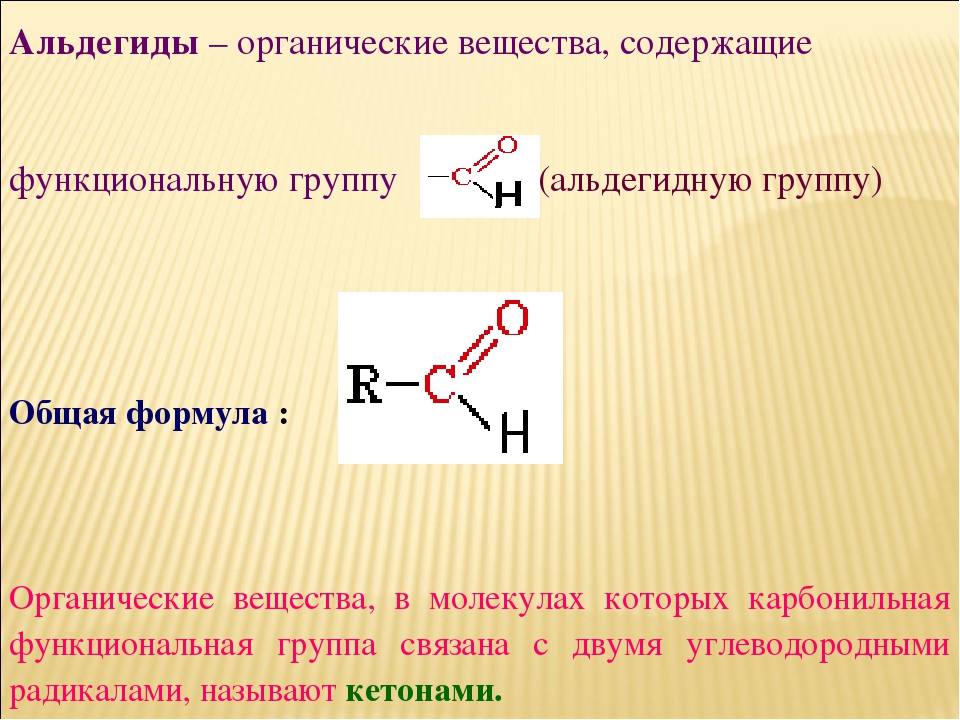 Такой подход к пониманию химии органических
соединений предполагает, что определенные атомы или группы атомов, известные как функциональные
группы придают этим соединениям их характерные свойства.
Такой подход к пониманию химии органических
соединений предполагает, что определенные атомы или группы атомов, известные как функциональные
группы придают этим соединениям их характерные свойства.
Функциональные группы сосредотачивают внимание на важных аспектах структуры молекула.Нам не нужно беспокоиться о различиях между структурами 1-бутена. и 2-метил-2-гексен, например, когда эти соединения реагируют с бромистым водородом. Мы можно сосредоточить внимание на том факте, что оба соединения являются алкенами, которые добавляют HBr через двойное соединение C = C. облигации в направлении, предсказанном Марковниковым правило.
Некоторые общие функциональные группы приведены в таблице ниже.
Общие функциональные группы
Группа C = O играет особенно важную роль в органической химии.Эта группа
называется карбонил и некоторые функциональные группы на основе карбонила
показаны в таблице ниже.
Функциональные группы, содержащие карбонил
| Практическая задача 1: Пиво из корня не было таким с тех пор использование масла сассафраса в качестве пищевой добавки было запрещено, поскольку масло сассафраса составляет 80% сафрол, который, как было доказано, вызывает рак у крыс и мышей.Определить функционал группы в составе сафрола.
Нажмите здесь, чтобы проверить свой ответ на практическая задача 1 |
| Практическая задача 2: Следующие соединения являются активными
ингредиенты в безрецептурных препаратах, используемых в качестве анальгетиков (для облегчения боли без
снижение чувствительности или сознания), жаропонижающие (для снижения температуры тела
когда он повышен) и / или противовоспалительными средствами (чтобы противодействовать отеку или
воспаление суставов, кожи и глаз).
Нажмите здесь, чтобы проверить свой ответ на практическая задача 2 |
| Практическая задача 3: Открытие пенициллина в 1928 году положило начало тому, что было названо «золотым веком химиотерапии», в котором ранее опасные для жизни бактериальные инфекции превратились в незначительные больше, чем источник дискомфорта.Для тех, у кого аллергия на пенициллин, предлагаются различные доступны антибиотики, в том числе тетрациклин. Определите многочисленные функциональные группы в молекуле тетрациклина.
Нажмите здесь, чтобы проверить свой ответ на практическая задача 3 |
Реакции окисления-восстановления
Сосредоточение внимания на функциональных группах в молекуле позволяет нам распознавать закономерности в
поведение родственных соединений.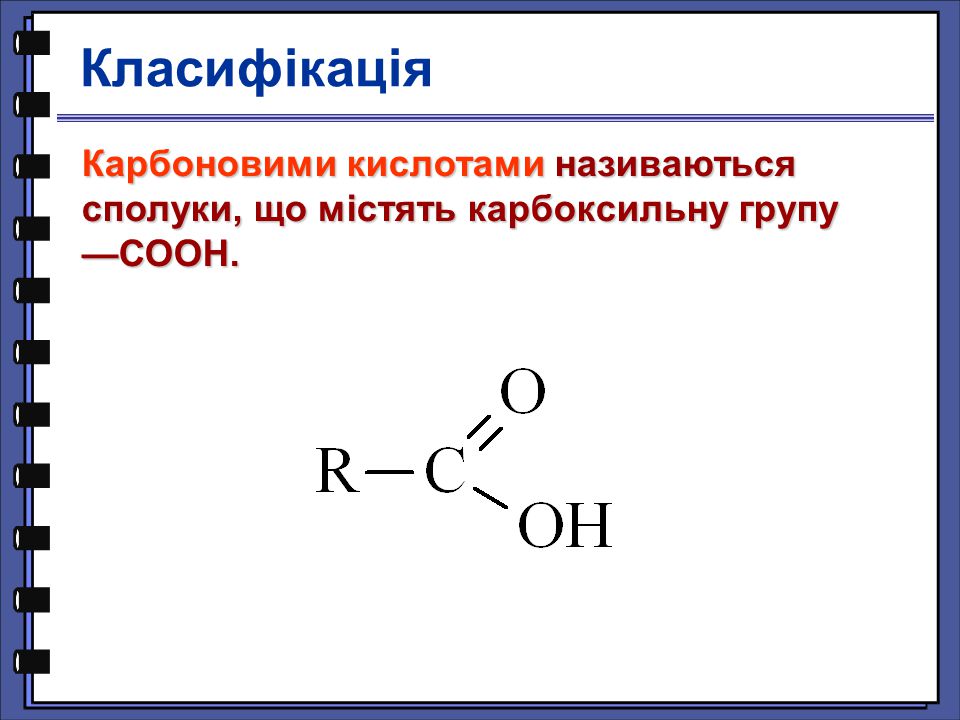 Рассмотрим, что мы знаем о реакции между натрием
металл и вода, например.
Рассмотрим, что мы знаем о реакции между натрием
металл и вода, например.
2 Na ( с ) + 2 H 2 O ( л ) H 2 ( г ) + 2 Na + ( водн. ) + 2 OH — ( водн. )
Эту реакцию можно разделить на две полуреакции. Один из них включает окисление металлический натрий с образованием ионов натрия.
| Окисление: | Na | Na + + e — |
Другой включает восстановление иона H + в воде с образованием нейтрального атом водорода, который соединяется с другим атомом водорода с образованием молекулы H 2 .
| Редукция: |
Как только мы узнаем, что вода содержит функциональную группу OH, мы сможем предсказать, что может произойти, когда металлический натрий вступит в реакцию. со спиртом, содержащим ту же функциональную группу. Металлический натрий должен реагировать с
метанол (CH 3 OH), например, чтобы получить газ H 2 и раствор
Na + и CH 3 O — ионы , растворенные в этом спирте.
со спиртом, содержащим ту же функциональную группу. Металлический натрий должен реагировать с
метанол (CH 3 OH), например, чтобы получить газ H 2 и раствор
Na + и CH 3 O — ионы , растворенные в этом спирте.
2 Na ( с ) + 2 CH 3 OH ( л ) H 2 ( г ) + 2 Na + ( alc ) + 2 CH 3 O — ( alc )
Поскольку они связаны с переносом электронов, реакция между металлическим натрием и вода или спирт являются примерами окислительно-восстановительных реакций. Но что насчет следующая реакция, в которой газообразный водород реагирует с алкеном в присутствии катализатор переходного металла с образованием алкана?
Число валентных электронов ни на одном из атомов в этом атоме не изменилось.
реакция.И до, и после реакции на каждый атом углерода приходится в общей сложности восемь
валентные электроны и каждый атом водорода разделяет два электрона.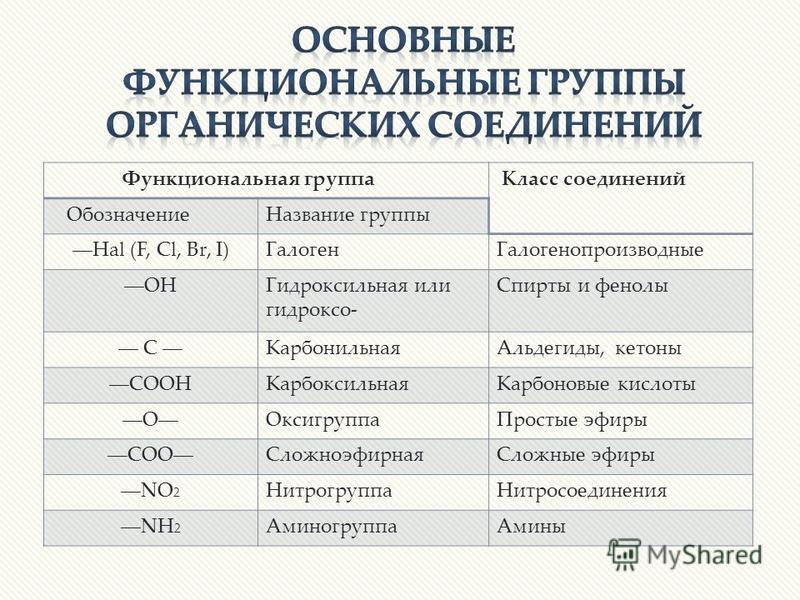 Вместо электронов это
Реакция предполагает перенос атомов, в данном случае атомов водорода. Реакций с переносом атома так много, что
химики разработали концепцию степени окисления , чтобы расширить идею
окисление и восстановление до реакций, в которых электроны не обязательно приобретаются или теряются.
Вместо электронов это
Реакция предполагает перенос атомов, в данном случае атомов водорода. Реакций с переносом атома так много, что
химики разработали концепцию степени окисления , чтобы расширить идею
окисление и восстановление до реакций, в которых электроны не обязательно приобретаются или теряются.
| Окисление включает увеличение степени окисления атома. |
| Восстановление происходит, когда степень окисления атома уменьшается на . |
При превращении этена в этан происходит уменьшение степень окисления атома углерода. Следовательно, эта реакция включает восстановление этена в этан.
Реакции, в которых ни один из атомов не претерпевает изменения степени окисления, называются метатезисом .
Реакция .Рассмотрим реакцию между карбоновой кислотой и амином, для
пример.
Или реакция между спиртом и бромистым водородом.
Это реакции метатезиса, потому что нет изменений в окислении. число любого атома в любой реакции.
Степени окисления атомов углерода в различных соединениях приведены в таблица ниже .
Типичное число окисления углерода
| Функциональная группа | Пример | Число окисления Углерод в примере |
||
| Алкан | CH 4 | -4 | ||
| Алкиллитий | CH 3 Li | -4 | ||
| Алкен | H 2 C = CH 2 | -2 | ||
| Спирт | СН 3 ОН | -2 | ||
| эфир | CH 3 OCH 3 | -2 | ||
| Алкилгалогенид | CH 3 Класс | -2 | ||
| Амин | CH 3 NH 2 | -2 | ||
| Алкин | HCCH | –1 | ||
| Альдегид | H 2 CO | 0 | ||
| Карбоновая кислота | HCO 2 H | 2 | ||
| CO 2 | 4 |
Эти степени окисления могут использоваться для классификации органических реакций.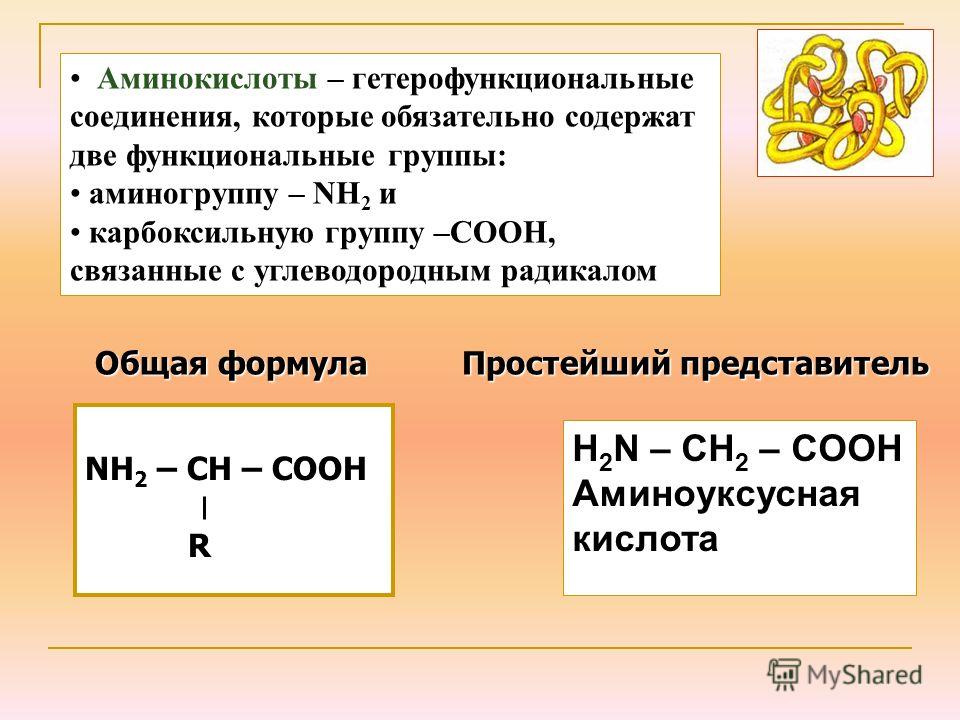 как реакции окисления-восстановления или реакции метатезиса.
как реакции окисления-восстановления или реакции метатезиса.
Поскольку электроны не создаются и не уничтожаются, окисление не может произойти при отсутствии редукции, или наоборот. Однако часто бывает полезно сконцентрируйте внимание на одном компоненте реакции и спросите: это вещество окислено или уменьшенный?
Присвоение степени окисления отдельным атомам углерода в сложной молекуле может быть трудный. К счастью, есть еще один способ распознать окислительно-восстановительные реакции в органическая химия:
Окисление происходит, когда атомы водорода удаляются из атома углерода или когда Атом кислорода присоединен к атому углерода .
Восстановление происходит, когда атомы водорода добавляются к атому углерода или когда атом кислорода удален от атома углерода.
Первая реакция на практике проблема 5 включает окисление атома углерода, потому что
пара атомов водорода удаляется из этого атома, когда спирт окисляется до
альдегид.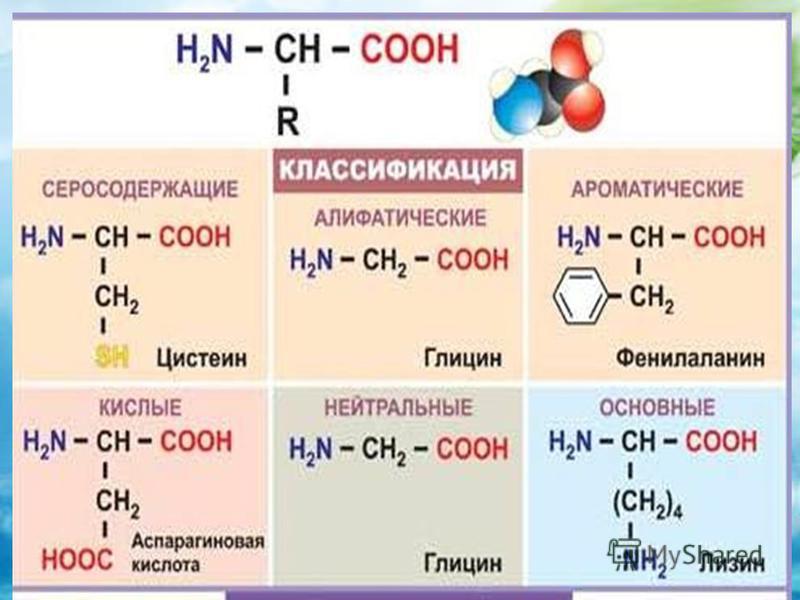
Вторая реакция на практическую задачу 5 является примером окисление, потому что атом кислорода добавляется к атому углерода, когда альдегид окисляется до карбоновой кислоты.
Восстановление, с другой стороны, происходит, когда атомы водорода присоединяются к атому углерода или когда атом кислорода удален от атома углерода. Алкен восстанавливается, например, когда он реагирует с H 2 с образованием соответствующего алкана.
Рисунок ниже представляет собой полезное руководство по окислительно-восстановительным реакциям органические соединения. Каждая из стрелок на этом рисунке связана с двухэлектронным окислением атом углерода на пути к диоксиду углерода.Через первый стрелка, потому что невозможно выполнить это преобразование за один шаг.
Органическая химия: функциональные группы
Функциональные группы | Алкилгалогениды | Спирты и эфиры | Альдегиды и Кетоны | В Карбонильная группа | Амины, алкалоиды и амиды | Реагенты Гриньяра
Исследования 1990-х годов: Химия чеснока
Периодический Стол | Глоссарий | Прохладный Апплеты
Обзор темы Gen Chem
| Главная страница справки по общей химии |
Поиск: Веб-сайт общей химии.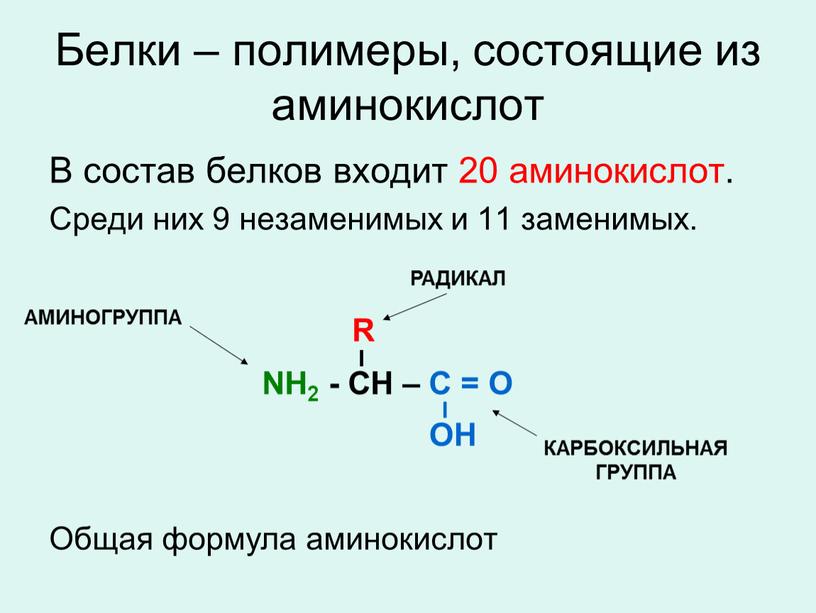
Понимание названий органических соединений
Сложные эфиры
Сложные эфиры являются одним из ряда соединений, известных под общим названием производные кислоты . В них кислотная группа каким-то образом модифицирована. В сложном эфире водород в группе -COOH заменен алкильной группой (или, возможно, какой-либо более сложной углеводородной группой).
Пример 1: Напишите структурную формулу для метилпропаноата .
Название сложного эфира состоит из двух частей — части, которая происходит от кислоты (пропаноат), и части, обозначающей алкильную группу (метил).
Для начала подумайте о пропановой кислоте — трехуглеродной кислоте без двойных углерод-углеродных связей.
Водород в группе -COOH заменен алкильной группой, в данном случае метильной группой.
Имена сложных эфиров сбивают с толку, потому что имя написано в обратном направлении от того, как нарисована структура. Этого нет — просто нужно привыкнуть!
Этого нет — просто нужно привыкнуть!
В сокращенной версии эта формула будет записана как CH 3 CH 2 COOCH 3 .
Пример 2: Напишите структурную формулу для этилэтаноата .
Это, вероятно, наиболее часто используемый пример сложного эфира. Он основан на этановой кислоте (следовательно, этаноат) — 2-угольной кислоте. Водород в группе -COOH заменен этильной группой.
Убедитесь, что этильная группа нарисована правильно. Довольно частая ошибка — попытки присоединить к кислороду группу CH 3 . Если вы посчитаете связи, если вы это сделаете, вы обнаружите, что и углерод CH 3 , и углерод CH 2 имеют неправильное количество связей.
Ацилхлориды (хлорангидриды)
Ацилхлорид — другое производное кислоты. В этом случае группа -ОН кислоты заменяется на -Cl.Все ацилхлориды содержат группу -COCl:
Пример: Напишите структурную формулу для этаноилхлорида .
Ацилхлориды обозначены окончанием ойлхлорид . Итак, этаноилхлорид основан на двухуглеродной цепи без двойных углерод-углеродных связей и группе -COCl. Углерод в этой группе считается частью цепи. В более длинной цепи с присоединенными боковыми группами углерод -COCl отводится под номером 1.
Ангидриды кислот
Еще одно производное кислоты! Ангидрид кислоты — это то, что вы получите, если обезвоживаете кислоту, то есть удаляете из нее воду.
Пример: Напишите структурную формулу для пропанового ангидрида .
Их проще всего решить, записав на клочке бумаги следующим образом:
Нарисуйте две молекулы кислоты, расположенные так, чтобы группы -ОН располагались рядом друг с другом.Выделите молекулу воды, а затем присоедините то, что осталось. В этом случае, поскольку вам нужен пропановый ангидрид, вы рисуете две молекулы пропановой кислоты.
Амиды
Еще одно производное кислоты! Амиды содержат группу -CONH 2 , где -ОН кислоты заменен на -NH 2 .
Пример: Напишите структурную формулу пропанамида .
Это основано на трехуглеродной цепи без двойных углерод-углеродных связей.В конце цепочки находится группа -CONH 2 . Углерод в этой группе считается частью цепи.
Нитрилы
Нитрилы содержат группу -CN и раньше назывались цианидами.
Пример 1: Напишите структурную формулу для этаннитрила .
Название показывает двухуглеродную цепь без двойной углерод-углеродной связи. нитрил показывает группу -CN на конце цепи.Как и в предыдущих примерах с кислотами и производными кислот, не забывайте, что углерод в группе -CN считается частью цепи.
Старое название для этого — метилцианид . Вы можете подумать, что это проще, но как только цепочка усложняется, она не работает — как показывает следующий пример.
Вы можете подумать, что это проще, но как только цепочка усложняется, она не работает — как показывает следующий пример.
Пример 2: Напишите структурную формулу 2-гидроксипропаннитрила .
Здесь у нас есть трехуглеродная цепь, без двойных углерод-углеродных связей и группа -CN на конце цепи.Углерод в группе -CN считается углеродом номер 1. На атоме углерода номер 2 находится группа -ОН ( гидрокси ). Обратите внимание, что вы не можете использовать окончание ol , потому что у вас уже есть окончание nitrile .
Первичные амины
Первичный амин содержит группу -NH 2 , присоединенную к углеводородной цепи или кольцу. Вы можете рассматривать амины в целом как производные аммиака, NH 3 .В первичном амине один из атомов водорода заменен углеводородной группой.
Пример 1: Напишите структурную формулу для этиламина .
В этом случае этильная группа присоединена к группе -NH 2 .
Это имя (этиламин) подходит, если у вас есть только короткая цепочка, в которой нет двусмысленности в том, где находится группа -NH 2 . Но предположим, что у вас есть 3-углеродная цепь — в этом случае группа -NH 2 может быть на конце или на среднем углероде.Как решить эту проблему, показано в следующем примере.
Пример 2: Напишите структурную формулу для 2-аминопропана .
Название показывает трехуглеродную цепь с аминогруппой, присоединенной ко второму атому углерода. амино показывает группу -NH 2 .
Этиламин (пример 1 выше) с таким же успехом можно было бы назвать аминоэтаном.
Вторичные и третичные амины
Вероятно, вы встретите только простые примеры из них.Во вторичном амине два атома водорода в молекуле аммиака заменены углеводородными группами.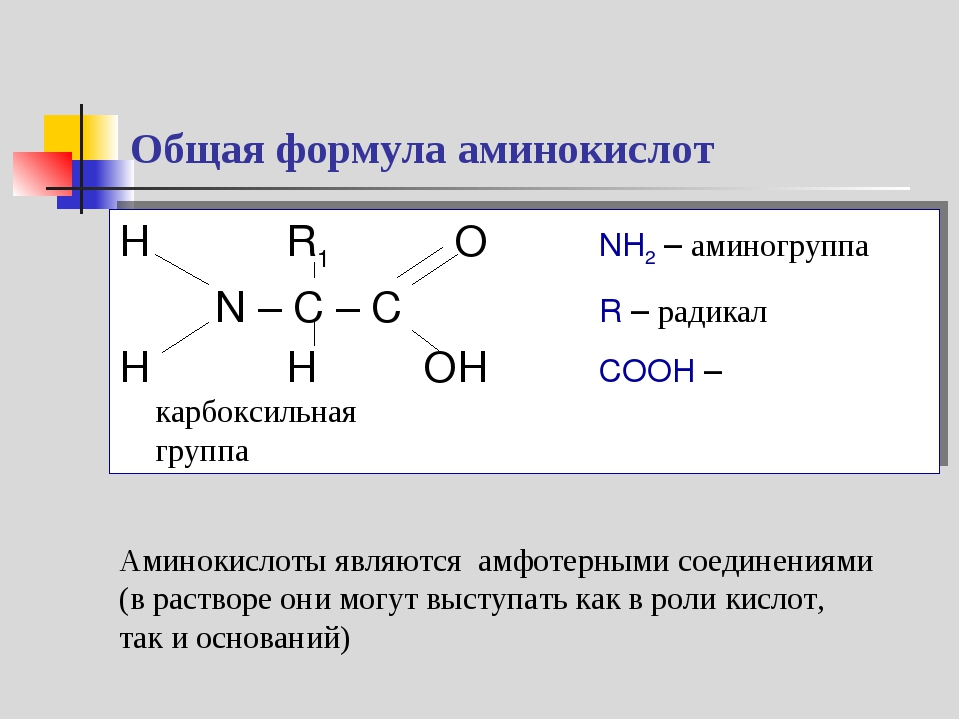 В третичном амине заменены все три атома водорода.
В третичном амине заменены все три атома водорода.
Пример 1: Напишите структурную формулу для диметиламина .
В этом случае два атома водорода в аммиаке заменены метильными группами.
Пример 2: Напишите структурную формулу для триметиламина .
Здесь все три атома водорода в аммиаке заменены метильными группами.
Аминокислоты
Аминокислота содержит как аминогруппу, -NH 2 , так и группу карбоновой кислоты, -COOH, в одной и той же молекуле. Как и у всех кислот, углеродная цепь пронумерована так, что углерод в группе -COOH считается числом 1.
Пример: Напишите структурную формулу 2-аминопропановой кислоты .
Имеет трехуглеродную цепь без двойных углерод-углеродных связей. На втором углероде (считая углерод -COOH как номер 1) есть аминогруппа, -NH 2 .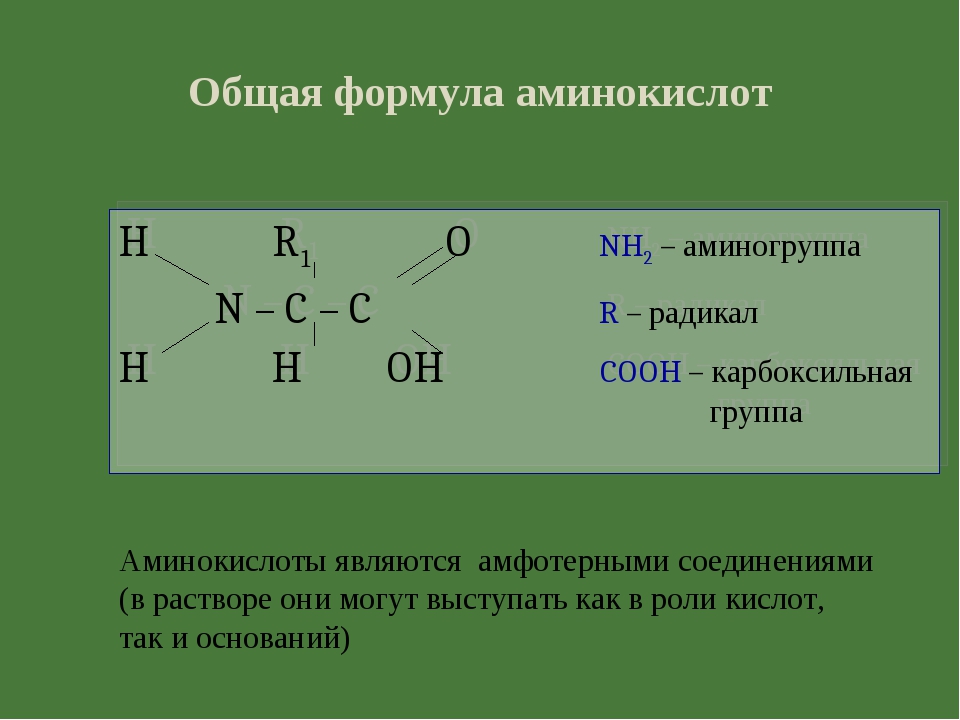
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.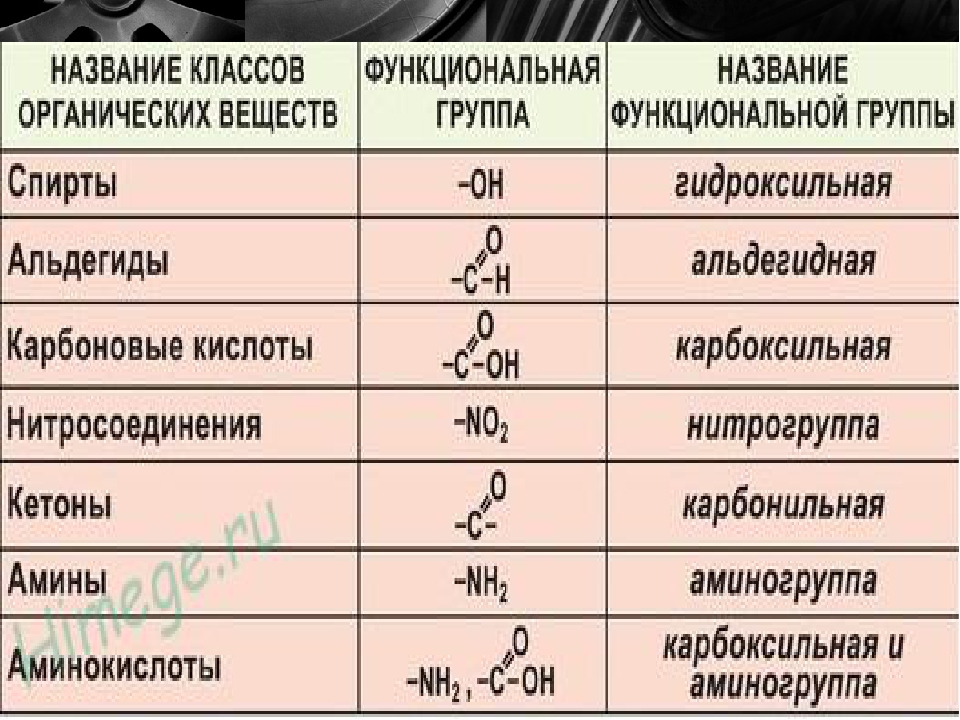
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
КАРБОНОВЫХ КИСЛОТ
КАРБОНОВЫХ КИСЛОТКАРБОНОВЫЕ КИСЛОТЫ
Ссылка: McMurry Ch 10 George et al Ch 2.7
Карбоновые кислоты содержат функциональную группу:
Номенклатура
- Самая длинная цепь, содержащая группу COOH, дает основу; окончание овая кислота
- Если заместители присутствуют, нумерацию начинайте с карбоксильной группы — C1
- Конъюгированные основания названы заменой овой кислоты , оканчивающейся на оат
- Некоторые простые карбоновые кислоты имеют несистематические названия
Примеры
- Карбоновые кислоты демонстрируют сильное поглощение около ~ 1700 см -1 (C = O) и очень широкое поглощение около ~ 3000 см -1 (O-H) в инфракрасной области
Реакции карбоновых кислот
1.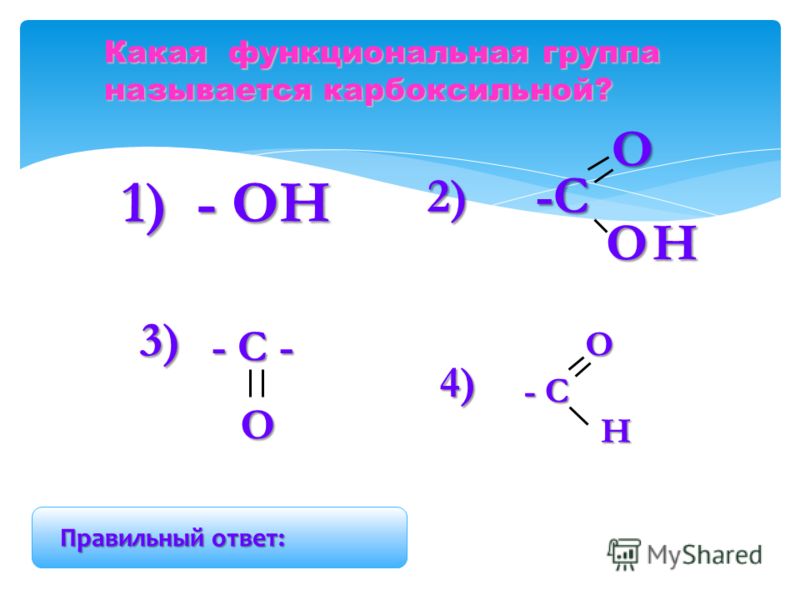 Кислотно-основная реакция
Кислотно-основная реакция
- Карбоновые кислоты — слабые кислоты со значениями p K a ~ 4-5.
- Карбоксилат-ион представляет собой стабилизированный резонансом карбанион.
- Карбоновые кислоты реагируют с разбавленным водным раствором гидроксида натрия с образованием водорастворимого карбоксилат-иона
Пример:
2. Этерификация
- Карбоновая кислота и спирт образуют сложный эфир и воду
- Реакция равновесная
- Требуется катализатор, обычно H +
Пример:
Некоторые биологически активные соединения, содержащие
функциональная группа карбоновой кислоты:
Вопросы по номенклатуре карбоновых кислот
Вернуться к списку
ПРОИЗВОДНЫЕ КАРБОКСИЛОВОЙ КИСЛОТЫ
Ссылка: McMurry Ch 10, George et al. , Ch 2.7
, Ch 2.7
- Производные карбоновых кислот все имеют ацильную группу, присоединенную к гетероатому (O, N, галоген).
- Здесь рассматриваются три класса: хлорангидриды, сложные эфиры и амиды (в лаборатории для удобства используется другое производное, ангидрид кислоты)
Реакции производных карбоновых кислот
1. Образование хлорангидридов
- Хлорангидриды образуются при обработке карбоновой кислоты тионилхлоридом, SOCl 2
Пример:
2. Взаимное преобразование деривативов
- Более реактивная производная может быть преобразована в менее реактивную
- Хлорангидриды более реакционноспособны, чем сложные эфиры, которые обладают большей реакционной способностью, чем амиды
- В результате всех реакций кислотного производного связь между ацильной группой и гетероатомом разрывается, а в реагенте разрывается связь между водородом и гетероатомом.
 Полярность фрагментов может использоваться для определения конечных продуктов.
Полярность фрагментов может использоваться для определения конечных продуктов.
Пример:
Хлористая кислота + сложный эфир спирта ® + HCl
Хлорид кислоты + амин ® амид + HCl
Сложный эфир + амин ® амид + спирт
3. Гидролиз производных
- Все производные гидролизуются водой с образованием карбоновой кислоты
- Легкость гидролиза зависит от стабильности производного: хлорангидриды гидролизуются в воде при pH 7; для сложных эфиров требуется катализатор H + или OH — и нагревание для гидролиза; амиды требуют длительного нагревания с более концентрированными H + или OH —
- Реакция прямо аналогична взаимному превращению производных
Пример:
- Гидролиз в основных условиях приводит к образованию карбоксилат-иона, а гидролиз амидов в кислых условиях приводит к образованию иона аммония
|
Производный инструмент |
Относительная реактивность |
Условия гидролиза |
Продукты кислотного гидролиза |
Продукты гидролиза оснований |
|
|
высокая
низкий
|
H 2 O |
|
|
|
|
H + / H 2 O / тепло или OH — / H 2 O / тепло |
+ ROH |
+ ROH |
|
|
|
H + / H 2 O / тепло или OH — / H 2 O / тепло |
+ R 2 NH 2 + |
+ Р 2 NH |
Механизм реакции
- Механизм один и тот же для всех реакций взаимного превращения кислотных производных и реакций гидролиза
- Это реакция нуклеофильного замещения ( присоединение + отщепление = замещение )
Аминокислоты:
Белки — важные природные амиды. Это полимерные материалы, образованные из аминокислот. Аминокислоты имеют как аминогруппу, так и функциональную группу карбоновой кислоты в одной и той же молекуле, и белки образуются путем связывания аминогруппы одной молекулы с группой карбоновой кислоты другой с образованием амидной связи.
Это полимерные материалы, образованные из аминокислот. Аминокислоты имеют как аминогруппу, так и функциональную группу карбоновой кислоты в одной и той же молекуле, и белки образуются путем связывания аминогруппы одной молекулы с группой карбоновой кислоты другой с образованием амидной связи.
Гидролиз белка обычно достигается обработкой его кипящей 6М соляной кислотой. Это гидролизует все амидные связи и высвобождает все аминокислоты, из которых состоит белок.
Белки обычно состоят из сотен аминокислотных остатков, связанных вместе, чтобы образовать единую молекулу с молекулярной массой> 100000.
Некоторые биологически активные соединения, содержащие
производных карбоновых кислот:
Вопросы по производным карбоновых кислот
Вернуться к указателю
10.2 Функциональные группы — CHEM 1114 — Введение в химию
Цели обучения
К концу этого раздела вы сможете:
- Определите функциональную группу .

- Определите и назовите упомянутые здесь функциональные группы.
- Изобразите упомянутые здесь функциональные группы.
- Знайте разницу между насыщенными и ненасыщенными углеводородами.
Функциональные группы — это структурные единицы в органических соединениях, которые определяются особыми связями между конкретными атомами. Структура капсаицина, соединения, являющегося источником тепла для острого перца чили, включает несколько функциональных групп, обозначенных на рисунке ниже и объясненных в этом разделе.
Рисунок 1. Функциональные группы в капсаицине. По мере продвижения изучения органической химии становится чрезвычайно важным уметь быстро распознавать наиболее распространенные функциональные группы, потому что они являются ключевыми структурными элементами, которые определяют реакцию органических молекул . Пока мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами, а также номенклатурой простых органических соединений.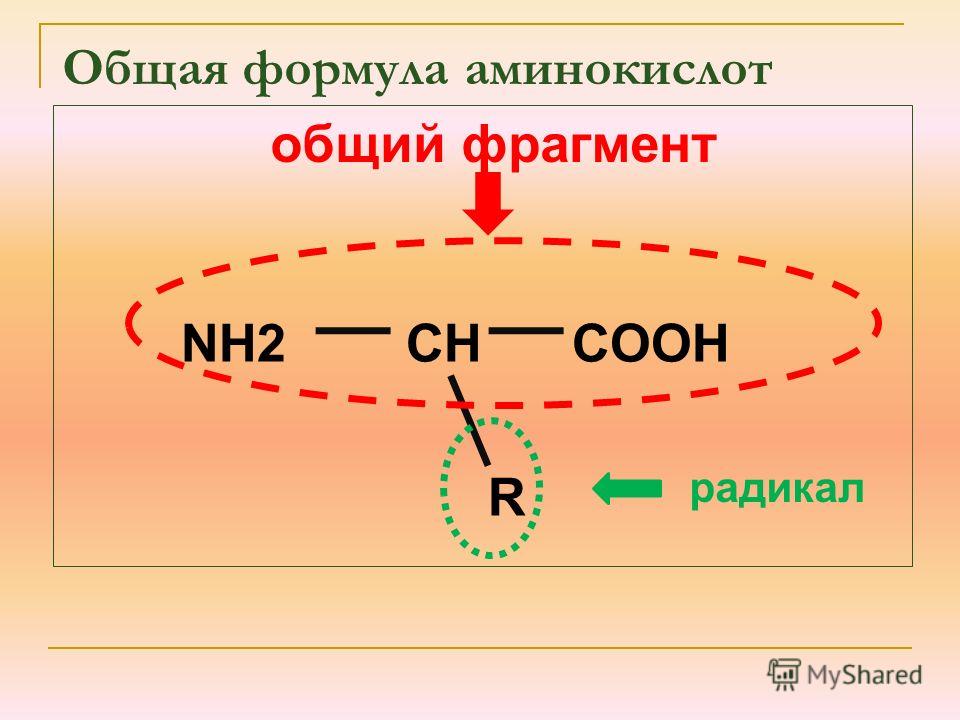 Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению того, как различные функциональные группы ведут себя в органических реакциях.
Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению того, как различные функциональные группы ведут себя в органических реакциях.
«По умолчанию» в органической химии, по сути, не имеет каких-либо функциональных групп, поэтому используется термин алкан , характеризующийся одинарными связями между углеродом и углеродом или между углеродом и водородом. Метан, CH 4 , представляет собой природный газ, который вы можете сжигать в своей печи. Октан, C 8 H 18 , входит в состав бензина.
Алканы — относительно стабильные молекулы, но тепло или свет активируют реакции, которые включают разрыв одинарных связей C – H или C – C.Горение — одна из таких реакций:
[латекс] \ text {CH} _4 (g) \; + \; 2 \ text {O} _2 (g) \; {\ longrightarrow} \; \ text {CO} _2 (g) \; + \; 2 \ text {H} _2 \ text {O} (g) [/ latex]
Алканы горят в присутствии кислорода — это сильно экзотермическая окислительно-восстановительная реакция, в результате которой образуется диоксид углерода и вода. Как следствие, алканы — отличное топливо. Например, метан, CH 4 , является основным компонентом природного газа. Бутан, C 4 H 10 , используемый в походных печах и зажигалках, представляет собой алкан.Бензин представляет собой жидкую смесь алканов с непрерывной и разветвленной цепью, каждый из которых содержит от пяти до девяти атомов углерода, плюс различные добавки для улучшения его характеристик в качестве топлива. Керосин, дизельное топливо и мазут в основном представляют собой смеси алканов с более высокими молекулярными массами. Основным источником этого жидкого алканового топлива является сырая нефть, сложная смесь, которую разделяют фракционной перегонкой. При фракционной перегонке используются различия в точках кипения компонентов смеси (см. Рисунок 2).
Как следствие, алканы — отличное топливо. Например, метан, CH 4 , является основным компонентом природного газа. Бутан, C 4 H 10 , используемый в походных печах и зажигалках, представляет собой алкан.Бензин представляет собой жидкую смесь алканов с непрерывной и разветвленной цепью, каждый из которых содержит от пяти до девяти атомов углерода, плюс различные добавки для улучшения его характеристик в качестве топлива. Керосин, дизельное топливо и мазут в основном представляют собой смеси алканов с более высокими молекулярными массами. Основным источником этого жидкого алканового топлива является сырая нефть, сложная смесь, которую разделяют фракционной перегонкой. При фракционной перегонке используются различия в точках кипения компонентов смеси (см. Рисунок 2).
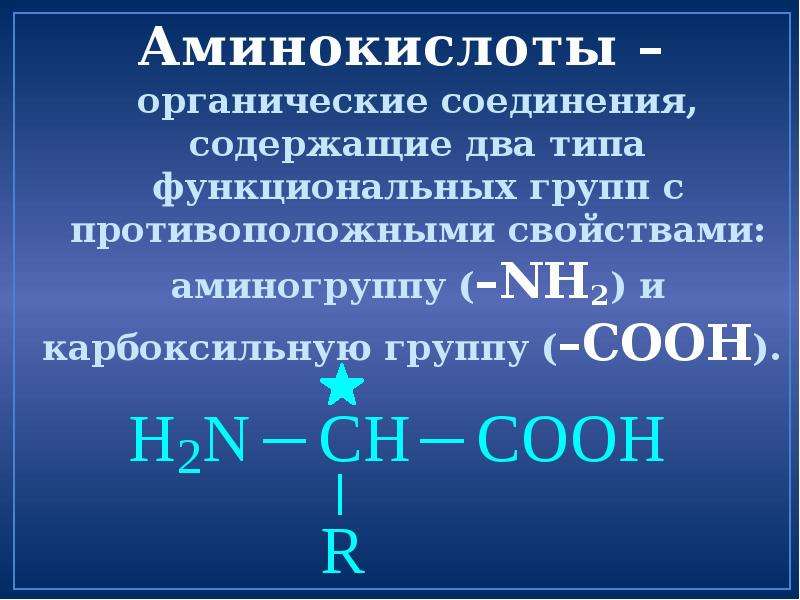 По мере постепенного охлаждения паров фракции с более высокими, а затем более низкими температурами кипения конденсируются в жидкости и удаляются. (кредит слева: модификация работы Луиджи Кьезы)
По мере постепенного охлаждения паров фракции с более высокими, а затем более низкими температурами кипения конденсируются в жидкости и удаляются. (кредит слева: модификация работы Луиджи Кьезы) Алкены , , иногда называемые олефинами , имеют двойные углерод-углеродные связи, а алкины имеют тройные углерод-углеродные связи.Этен, простейший пример алкена, представляет собой газ, который служит клеточным сигналом в фруктах для стимулирования созревания. Если вы хотите, чтобы бананы созрели быстро, положите их в бумажный пакет вместе с яблоком — яблоко выделяет газ этен, запускающий процесс созревания бананов. Алкины легко горят. Этин, обычно называемый ацетиленом, используется в качестве топлива в сварочных горелках.
Алканы, алкены и алкины классифицируются как углеводородов , потому что они состоят исключительно из атомов углерода и водорода.Алканы называются насыщенными углеводородами , потому что атомы углерода связаны с максимально возможным числом атомов водорода — другими словами, они являются насыщенными атомами водорода. Углерод с двойной и тройной связью в алкенах и алкинах имеет меньше атомов водорода, связанных с ними — поэтому они называются ненасыщенными углеводородами .
Углерод с двойной и тройной связью в алкенах и алкинах имеет меньше атомов водорода, связанных с ними — поэтому они называются ненасыщенными углеводородами .
Арен , или ароматический углеводород, представляет собой углеводород с альтернативными двойными и одинарными связями между атомами углерода, образующими кольцо . Примером этой функциональной группы является бензол, который раньше был широко используемым растворителем в органической лаборатории, но который оказался канцерогенным, и нафталин, соединение с характерным запахом «нафталина». Арены представляют собой плоские кольцевые структуры и широко распространены в природе.
Когда углерод алкана связан с одним или несколькими галогенами, группа упоминается как алкилгалогенид или галогеналкан . Хлороформ — полезный растворитель в лаборатории и был одним из первых анестетиков, используемых в хирургии. Хлордифторметан использовался в качестве хладагента и в аэрозольных распылителях до конца двадцатого века, но его использование было прекращено после того, как было обнаружено, что он оказывает вредное воздействие на озоновый слой. Бромэтан представляет собой простой алкилгалогенид, часто используемый в органическом синтезе. Алкилгалогенидные группы в биомолекулах встречаются довольно редко.
Хлордифторметан использовался в качестве хладагента и в аэрозольных распылителях до конца двадцатого века, но его использование было прекращено после того, как было обнаружено, что он оказывает вредное воздействие на озоновый слой. Бромэтан представляет собой простой алкилгалогенид, часто используемый в органическом синтезе. Алкилгалогенидные группы в биомолекулах встречаются довольно редко.
В функциональной группе спирта углерод связан одинарной связью с группой ОН. Сама по себе группа ОН обозначается как гидроксил .Этанол, CH 3 CH 2 OH, также называемый этиловым спиртом, является особенно важным спиртом для использования человеком. Этанол — это спирт, производимый некоторыми видами дрожжей, который содержится в вине, пиве и дистиллированных напитках. Его уже давно приготовили люди, использующие метаболические усилия дрожжей для ферментации различных сахаров:
За исключением метанола, все спирты можно разделить на первичные, вторичные или третичные.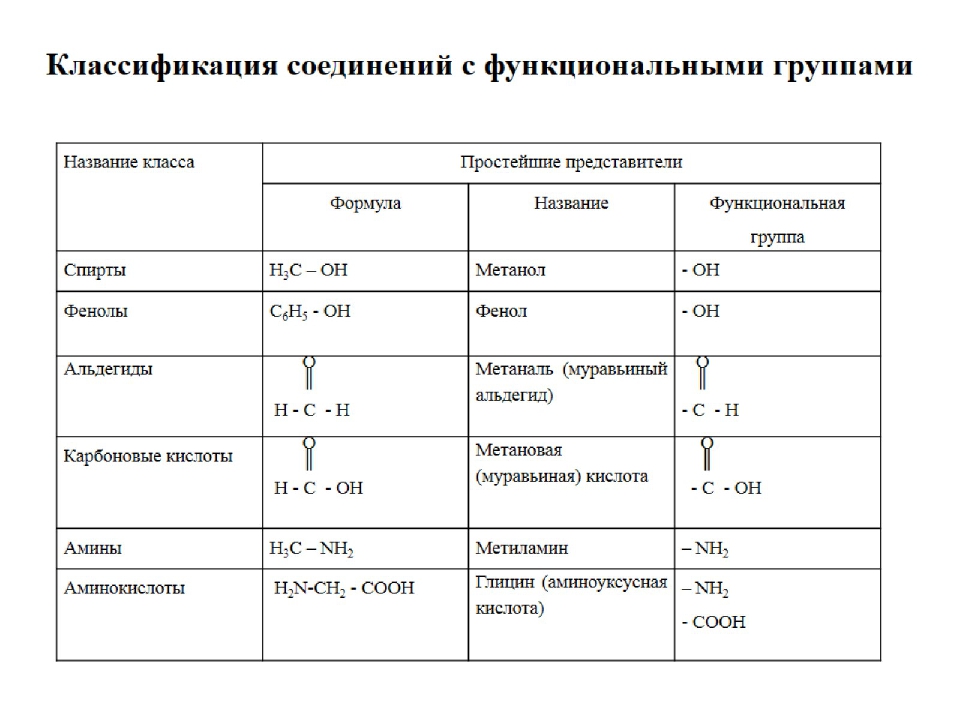 В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом.В вторичном спирте и третичном спирте , , углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа непосредственно присоединена к ароматическому кольцу, полученная группа называется фенолом . Серный аналог спирта называется тиол , от греческого thio , для серы.
В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом.В вторичном спирте и третичном спирте , , углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа непосредственно присоединена к ароматическому кольцу, полученная группа называется фенолом . Серный аналог спирта называется тиол , от греческого thio , для серы.
Обратите внимание, что определение фенола гласит, что гидроксильный кислород должен быть непосредственно присоединенным к одному из атомов углерода ароматического кольца.Таким образом, указанное ниже соединение представляет собой , а не фенол — это первичный спирт. Это различие важно, потому что существует значительная разница в реакционной способности спиртов и фенолов.
В функциональной группе простого эфира центральный кислород связан с двумя атомами углерода. Ниже представлена структура диэтилового эфира, распространенного лабораторного растворителя, а также одного из первых соединений, которые будут использоваться в качестве анестетика во время операций. Диэтиловый эфир, наиболее широко используемое соединение этого класса, представляет собой бесцветную летучую жидкость, которая легко воспламеняется.Впервые он был использован в 1846 году в качестве анестетика, но теперь его место в значительной степени заняли более качественные анестетики. Диэтиловый эфир и другие простые эфиры в настоящее время используются в основном в качестве растворителей для камедей, жиров, восков и смол. Серный аналог простого эфира называется тиоэфиром или сульфидом .
Ниже представлена структура диэтилового эфира, распространенного лабораторного растворителя, а также одного из первых соединений, которые будут использоваться в качестве анестетика во время операций. Диэтиловый эфир, наиболее широко используемое соединение этого класса, представляет собой бесцветную летучую жидкость, которая легко воспламеняется.Впервые он был использован в 1846 году в качестве анестетика, но теперь его место в значительной степени заняли более качественные анестетики. Диэтиловый эфир и другие простые эфиры в настоящее время используются в основном в качестве растворителей для камедей, жиров, восков и смол. Серный аналог простого эфира называется тиоэфиром или сульфидом .
Амины характеризуются атомами азота с одинарными связями с водородом и углеродом. Так же, как существуют первичные, вторичные и третичные спирты, существуют первичные, вторичные и третичные амины.Аммиак — это особый случай, когда нет атомов углерода. Одно из наиболее важных свойств аминов состоит в том, что они являются основными и легко протонируются с образованием катионов аммония при взаимодействии с кислотой. В случае, когда азот имеет четыре связи с углеродом, что несколько необычно для биомолекул, его называют ионом четвертичного аммония.
Одно из наиболее важных свойств аминов состоит в том, что они являются основными и легко протонируются с образованием катионов аммония при взаимодействии с кислотой. В случае, когда азот имеет четыре связи с углеродом, что несколько необычно для биомолекул, его называют ионом четвертичного аммония.
Примечание : Пусть вас не смущает то, как термины «первичный», «вторичный» и «третичный» применяются к спиртам и аминам — определения разные.В спиртах имеет значение, со сколькими другими атомами углерода связан углерод спирта , в то время как в аминах важно то, с каким количеством атомов углерода связан азот .
В некоторых аминах атом азота замещает атом углерода в ароматическом углеводороде. Пиридин является одним из таких гетероциклических аминов. Гетероциклическое соединение содержит атомы двух или более различных элементов в своей кольцевой структуре.
ПиридинДНК в судебной медицине и отцовстве
Генетический материал всех живых существ представляет собой полимер из четырех различных молекул, которые сами по себе представляют собой комбинацию из трех субъединиц. Генетическая информация, код развития организма, содержится в определенной последовательности четырех молекул, подобно тому, как буквы алфавита могут быть упорядочены для образования слов, передающих информацию. Информация в последовательности ДНК используется для образования двух других типов полимеров, одним из которых являются белки. Белки взаимодействуют, образуя особый тип организма с индивидуальными характеристиками.
Генетическая информация, код развития организма, содержится в определенной последовательности четырех молекул, подобно тому, как буквы алфавита могут быть упорядочены для образования слов, передающих информацию. Информация в последовательности ДНК используется для образования двух других типов полимеров, одним из которых являются белки. Белки взаимодействуют, образуя особый тип организма с индивидуальными характеристиками.
Генетическая молекула называется ДНК, что означает дезоксирибонуклеиновая кислота.{\; \; 3 -}) [/ latex] Когда создается новая ДНК, происходит реакция полимеризации, которая связывает фосфатную группу одного нуклеотида с сахарной группой второго нуклеотида. Азотистые основания каждого нуклеотида выступают из этой сахарно-фосфатной цепи. ДНК фактически образована из двух таких полимеров, намотанных друг на друга и удерживаемых вместе водородными связями между азотистыми основаниями. Таким образом, два каркаса находятся снаружи пары спиральных прядей, а основания — внутри.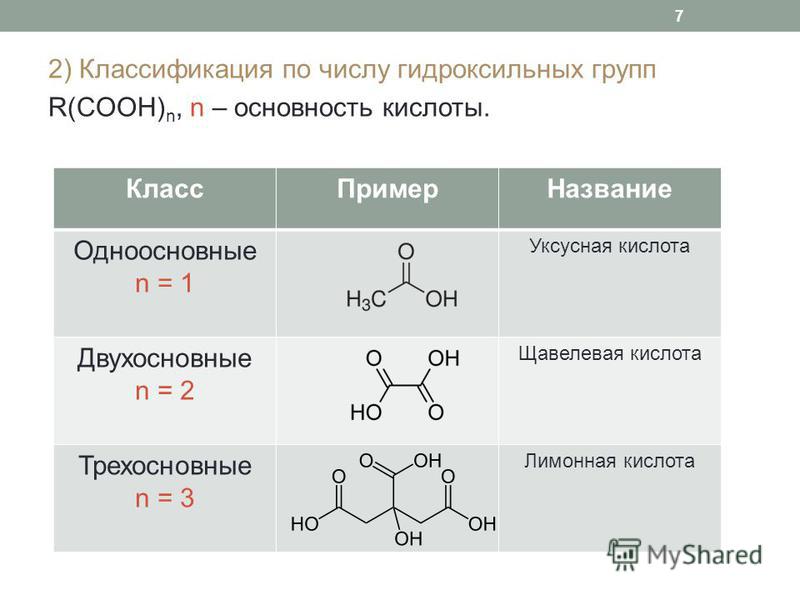 Форма двух нитей, намотанных друг на друга, называется двойной спиралью (см. Рисунок 3).
Форма двух нитей, намотанных друг на друга, называется двойной спиралью (см. Рисунок 3).
Вероятно, логично, что последовательность нуклеотидов в ДНК кошки отличается от последовательности нуклеотидов в ДНК собаки. Но верно также и то, что последовательности ДНК в клетках двух отдельных мопсов различаются. Точно так же последовательности ДНК у вас и вашего брата или сестры различаются (если только ваш брат не является идентичным близнецом), как и последовательности ДНК между вами и другим человеком. Однако последовательности ДНК двух родственных особей более похожи, чем последовательности двух неродственных особей, и это сходство в последовательностях можно наблюдать различными способами.Это принцип, лежащий в основе дактилоскопии ДНК, который представляет собой метод, используемый для определения того, взяты ли два образца ДНК от родственных (или одних) людей или от неродственных людей.
Используя сходство в последовательностях, технические специалисты могут определить, является ли мужчина отцом ребенка (личность матери редко вызывает сомнения, за исключением случая приемного ребенка и потенциальной биологической матери). Точно так же судебные генетики могут определить, содержит ли образец человеческой ткани, такой как кровь или клетки кожи, ДНК, точно совпадающую с ДНК подозреваемого, на месте преступления.
Точно так же судебные генетики могут определить, содержит ли образец человеческой ткани, такой как кровь или клетки кожи, ДНК, точно совпадающую с ДНК подозреваемого, на месте преступления.
Посмотрите этот анимационный видеоролик о том, как упакована ДНК, чтобы наглядно изучить ее структуру.
Основность атома азота амина играет важную роль в большей части химического состава соединения. Функциональные группы аминов находятся в большом количестве соединений, включая натуральные и синтетические красители, полимеры, витамины и лекарства, такие как пенициллин и кодеин. Они также содержатся во многих молекулах, необходимых для жизни, таких как аминокислоты, гормоны, нейротрансмиттеры и ДНК.
Алкалоиды, вызывающие привыкание
С давних времен растения использовались в лечебных целях. Один класс веществ, называемый алкалоидами , обнаруженный во многих из этих растений, был выделен и обнаружил, что он содержит циклические молекулы с аминогруппой.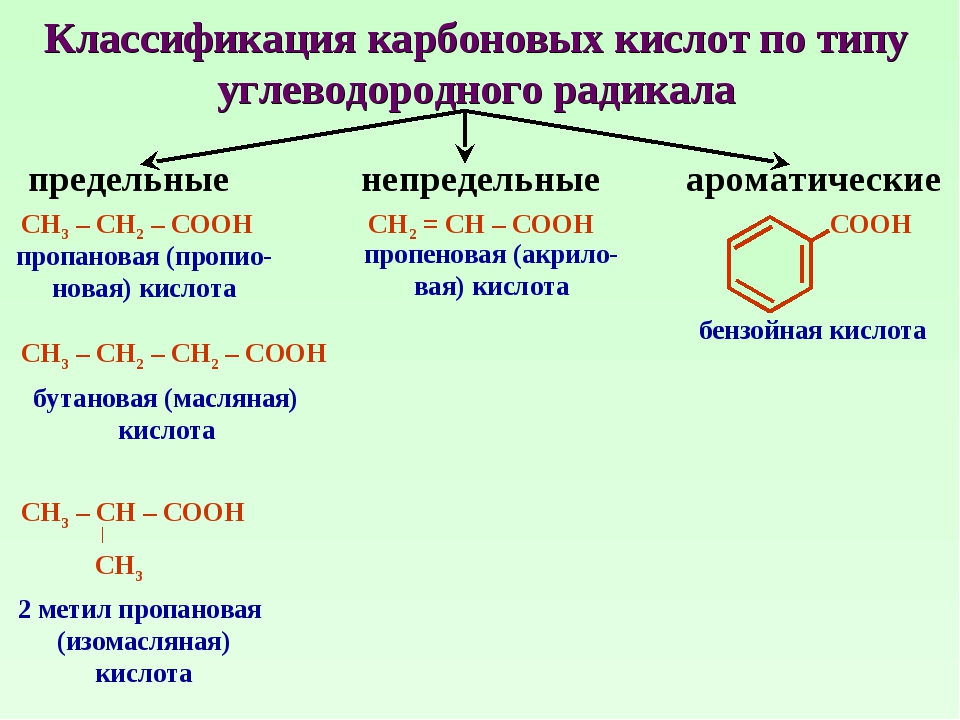 {-} \; + \; \ text {H} _2 \ text {O } [/ латекс]
{-} \; + \; \ text {H} _2 \ text {O } [/ латекс]
Название «алкалоид» означает «подобный щелочи.{-} [/ латекс]
Структура многих природных алкалоидов оказывает на человека глубокое физиологическое и психотропное действие. Примеры этих наркотиков включают никотин, морфин, кодеин и героин. Растение производит эти вещества, вместе называемые вторичными растительными соединениями, в качестве химической защиты от многочисленных вредителей, которые пытаются питаться растением:
На этих диаграммах, как это обычно бывает при представлении структур крупных органических соединений, атомы углерода в кольцах и атомы водорода, связанные с ними, опущены для ясности.Сплошные клинья обозначают скрепки, выходящие за пределы страницы. Пунктирными клиньями обозначены связи, которые простираются на страницу. Обратите внимание, что небольшие изменения в части молекулы изменяют свойства морфина, кодеина и героина. Морфин, сильный наркотик, используемый для облегчения боли, содержит две гидроксильные функциональные группы, расположенные в нижней части молекулы в этой структурной формуле. Замена одной из этих гидроксильных групп на группу метилового эфира приводит к образованию кодеина, менее сильнодействующего препарата, используемого в качестве местного анестетика.Если обе гидроксильные группы превращаются в сложные эфиры уксусной кислоты, получается сильнодействующий наркотик героин (рис. 4).
Замена одной из этих гидроксильных групп на группу метилового эфира приводит к образованию кодеина, менее сильнодействующего препарата, используемого в качестве местного анестетика.Если обе гидроксильные группы превращаются в сложные эфиры уксусной кислоты, получается сильнодействующий наркотик героин (рис. 4).
Существует ряд функциональных групп, содержащих двойную связь углерод-кислород, которую обычно называют карбонилом . Кетоны и альдегиды представляют собой две тесно связанные функциональные группы на основе карбонила, которые реагируют очень похожим образом.В кетоне атом углерода карбонила связан с двумя другими атомами углерода. В альдегиде карбонильный углерод с одной стороны связан с водородом, а с другой стороны — с углеродом.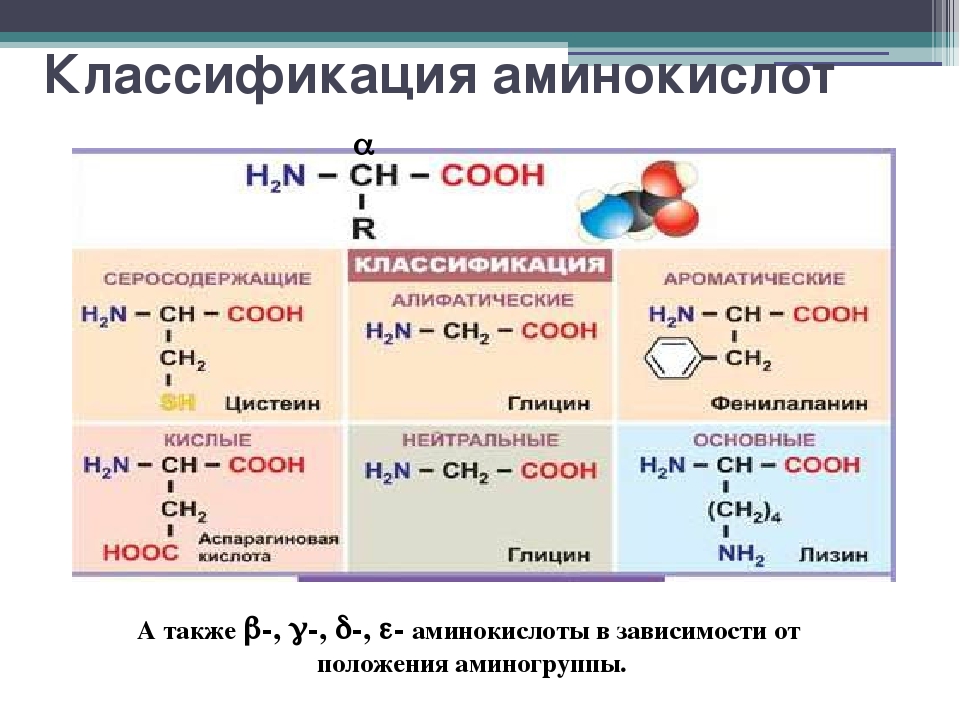 Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
Формальдегид, альдегид с формулой HCHO, представляет собой бесцветный газ с резким и раздражающим запахом. Он продается в виде водного раствора формалина, который содержит около 37% формальдегида по весу.Формальдегид вызывает коагуляцию белков, поэтому он убивает бактерии (и любые другие живые организмы) и останавливает многие биологические процессы, вызывающие разрушение тканей. Таким образом, формальдегид используется для консервирования образцов тканей и бальзамирования тел. Он также используется для стерилизации почвы или других материалов. Формальдегид используется в производстве бакелита, твердого пластика, обладающего высокой химической и электрической стойкостью.
Диметилкетон, CH 3 COCH 3 , обычно называемый ацетон, представляет собой простейший кетон.Его получают в промышленных масштабах путем ферментации кукурузы или патоки или путем окисления 2-пропанола. Ацетон — бесцветная жидкость. Среди его многочисленных применений — в качестве растворителя для лаков (включая лак для ногтей), ацетата целлюлозы, нитрата целлюлозы, ацетилена, пластмасс и лаков; как средство для снятия краски и лака; и как растворитель при производстве фармацевтических препаратов и химикатов.
Ацетон — бесцветная жидкость. Среди его многочисленных применений — в качестве растворителя для лаков (включая лак для ногтей), ацетата целлюлозы, нитрата целлюлозы, ацетилена, пластмасс и лаков; как средство для снятия краски и лака; и как растворитель при производстве фармацевтических препаратов и химикатов.
Когда карбонильный углерод связан с одной стороны с углеродом (или водородом), а с другой стороны с кислородом, азотом или серой, функциональная группа считается одной из « производных карбоновой кислоты », a обозначение, которое описывает набор связанных функциональных групп.Одноименным членом этого семейства является функциональная группа карбоновой кислоты , в которой карбонил связан с гидроксильной группой. Основание конъюгата карбоновой кислоты представляет собой карбоксилат . Сложные эфиры карбоновых кислот, обычно называемые просто «сложные эфиры» и амиды — это некоторые из других производных карбоновых кислот.
Простейшая карбоновая кислота — муравьиная кислота HCO 2 H, известная с 1670 года. Ее название происходит от латинского слова formicus , что означает «муравей»; он был впервые выделен путем дистилляции красных муравьев.Он частично отвечает за боль и раздражение укусов муравьев и ос, а также за характерный запах муравьев, который иногда можно обнаружить в их гнездах.
Уксусная кислота, CH 3 CO 2 H, составляет 3–6% уксуса. Яблочный уксус получают путем ферментации яблочного сока без присутствия кислорода. Присутствующие в соке дрожжевые клетки осуществляют реакции брожения. В результате реакций ферментации сахар, присутствующий в соке, превращается в этанол, а затем в уксусную кислоту.Чистая уксусная кислота имеет резкий запах и вызывает болезненные ожоги. Это отличный растворитель для многих органических и некоторых неорганических соединений, и он необходим для производства ацетата целлюлозы, компонента многих синтетических волокон, таких как вискоза.
Отличительный и привлекательный запах и вкус многих цветов, духов и спелых фруктов обусловлены присутствием одного или нескольких сложных эфиров (рис. 5). Среди наиболее важных природных сложных эфиров — жиры (например, сало, жир и масло) и масла (например, льняное, хлопковое и оливковое масла), которые представляют собой сложные эфиры тригидроксилового спирта, глицерина, [латекс] \ text {C } _3 \ text {H} _5 \ text {(OH)} _ 3 [/ latex], с большими карбоновыми кислотами, такими как пальмитиновая кислота, [латекс] \ text {CH} _3 \ text {(CH} _2) _ { 14} \ text {CO} _2 \ text {H} [/ латекс], стеариновая кислота, [латекс] \ text {CH} _3 \ text {(CH} _2) _ {16} \ text {CO} _2 \ text {H} [/ латекс] и олеиновая кислота [латекс] \ text {CH} _3 \ text {(CH} _2) _7 \ text {CH} = \ text {CH (CH} _2) _7 \ text {CO } _2 \ text {H} [/ латекс].Олеиновая кислота — ненасыщенная кислота; он содержит [латекс] \ text {C} = \ text {C} [/ latex] двойную связь. Пальмитиновая и стеариновая кислоты — это насыщенные кислоты, не содержащие двойных или тройных связей.
Сложные эфиры и амиды очень часто встречаются в биологических молекулах и / или метаболических путях. Амиды могут быть получены, когда карбоновые кислоты реагируют с аминами или аммиаком в процессе, называемом амидированием.Молекула воды удаляется из реакции, а амид образуется из оставшихся частей карбоновой кислоты и амина:
Реакция между аминами и карбоновыми кислотами с образованием амидов имеет биологическое значение. Именно посредством этой реакции аминокислоты (молекулы, содержащие заместители как аминов, так и карбоновых кислот) соединяются вместе в полимер с образованием белков.
Белки и ферменты
Белки — это большие биологические молекулы, состоящие из длинных цепочек более мелких молекул, называемых аминокислотами.Организмы полагаются на белки для выполнения множества функций — белки транспортируют молекулы через клеточные мембраны, реплицируют ДНК и катализируют метаболические реакции, и это лишь некоторые из их функций. Свойства белков зависят от комбинации аминокислот, из которых они состоят, и могут сильно различаться. Взаимодействия между аминокислотными последовательностями в цепях белков приводят к сворачиванию цепи в конкретные трехмерные структуры, которые определяют активность белка.
Свойства белков зависят от комбинации аминокислот, из которых они состоят, и могут сильно различаться. Взаимодействия между аминокислотными последовательностями в цепях белков приводят к сворачиванию цепи в конкретные трехмерные структуры, которые определяют активность белка.
Аминокислоты — это органические молекулы, которые содержат функциональную группу амина (–NH 2 ), функциональную группу карбоновой кислоты (–COOH) и боковую цепь (которая специфична для каждой отдельной аминокислоты).Большинство живых существ строят белки из одних и тех же 20 различных аминокислот. Аминокислоты соединяются путем образования пептидной связи, которая представляет собой ковалентную связь, образованную между двумя аминокислотами, когда группа карбоновой кислоты одной аминокислоты реагирует с аминогруппой другой аминокислоты. Образование связи приводит к образованию молекулы воды (в общем, реакции, которые приводят к образованию воды при объединении двух других молекул, называются реакциями конденсации). Образовавшаяся связь между атомом углерода карбонильной группы и атомом азота амина называется пептидной связью или пептидной связью. Поскольку каждая из исходных аминокислот имеет непрореагировавшую группу (одна содержит непрореагировавший амин, а другая — непрореагировавшую карбоновую кислоту), с другими аминокислотами может образовываться больше пептидных связей, расширяя структуру. (Рисунок 6) Цепочка связанных аминокислот называется полипептидом. Белки содержат по крайней мере одну длинную полипептидную цепь.
Ферменты — это большие биологические молекулы, в основном состоящие из белков, которые ответственны за тысячи метаболических процессов, происходящих в живых организмах. Ферменты — высокоспецифичные катализаторы; они ускоряют скорость определенных реакций. Ферменты действуют за счет снижения энергии активации реакции, которую они катализируют, что может резко увеличить скорость реакции. Скорость большинства реакций, катализируемых ферментами, в миллионы раз выше, чем у некатализируемой версии.Как и все катализаторы, ферменты не расходуются во время катализируемых ими реакций. Ферменты действительно отличаются от других катализаторов тем, насколько они специфичны для своих субстратов (молекул, которые фермент преобразует в другой продукт). Каждый фермент способен ускорить только одну или несколько очень специфических реакций или типов реакций. Поскольку функция ферментов настолько специфична, недостаток или неправильная работа фермента может привести к серьезным последствиям для здоровья. Одно из заболеваний, которое возникает в результате сбоя ферментов, — это фенилкетонурия.При этом заболевании фермент, который катализирует первую стадию разложения аминокислоты фенилаланина, не работает (рис. 7). Без лечения это может привести к накоплению фенилаланина, что может привести к умственной отсталости.
Скорость большинства реакций, катализируемых ферментами, в миллионы раз выше, чем у некатализируемой версии.Как и все катализаторы, ферменты не расходуются во время катализируемых ими реакций. Ферменты действительно отличаются от других катализаторов тем, насколько они специфичны для своих субстратов (молекул, которые фермент преобразует в другой продукт). Каждый фермент способен ускорить только одну или несколько очень специфических реакций или типов реакций. Поскольку функция ферментов настолько специфична, недостаток или неправильная работа фермента может привести к серьезным последствиям для здоровья. Одно из заболеваний, которое возникает в результате сбоя ферментов, — это фенилкетонурия.При этом заболевании фермент, который катализирует первую стадию разложения аминокислоты фенилаланина, не работает (рис. 7). Без лечения это может привести к накоплению фенилаланина, что может привести к умственной отсталости.
 При заболевании фенилкетонурия дефект формы фенилаланингидроксилазы приводит к тому, что она теряет свою функцию расщепления фенилаланина.
При заболевании фенилкетонурия дефект формы фенилаланингидроксилазы приводит к тому, что она теряет свою функцию расщепления фенилаланина.Наконец, нитрильная группа характеризуется углеродом, тройным связующим с азотом.
Одно соединение часто содержит несколько функциональных групп, особенно в биологической органической химии. Шестиуглеродные молекулы сахара, глюкоза и фруктоза, например, содержат альдегидные и кетоновые группы, соответственно, и обе содержат пять спиртовых групп, соединение с несколькими спиртовыми группами часто называют «полиолом » .
Гормон тестостерон, аминокислота фенилаланин и дигидроксиацетонфосфат метаболита гликолиза содержат несколько функциональных групп, как указано ниже.
Рисунок 7. Натуральные продукты — это соединения, вырабатываемые живым организмом. Вот три примера натуральных продуктов, которые содержат множество функциональных групп. Этот раздел никоим образом не является полным списком, но охватывает многие важные функциональные группы, встречающиеся в органической химии. В таблице 1 приводится сводка всех функциональных групп, перечисленных в этом разделе, а также некоторые другие, которые могут встретиться на втором году курса органической химии.
В таблице 1 приводится сводка всех функциональных групп, перечисленных в этом разделе, а также некоторые другие, которые могут встретиться на втором году курса органической химии.
Основные понятия и краткое изложение
Функциональные группы — это структурные единицы в органических соединениях, которые определяются особыми связями между конкретными атомами. Химик-органик учится соотносить функциональные группы с химией, которую они делают. Например, любая молекула, содержащая карбоновую кислоту, будет способна проводить кислотно-щелочную реакцию при смешивании с основанием.Это позволяет химику-органику иметь представление о различном химическом составе соединения, которое может или не может быть выполнено в зависимости от функциональных групп, присутствующих в структуре.
Действия
Сделайте себе стопку Q-карт небольшого размера. С одной стороны указано название функциональной группы (например, спирт), а с другой — ее структура (см. Таблицу 1). Составьте полный набор всех функциональных групп, которые вам следует знать (см. Таблицу 1). Вы даже можете включить некоторые соединения, подобные приведенным ниже, в упражнении 1 — на одной стороне карточки указано соединение, а на другой — названия функциональных групп.Затем используйте эти Qcards, чтобы проверить себя. Это поможет вам распознать функциональные группы в более крупных соединениях.
С одной стороны указано название функциональной группы (например, спирт), а с другой — ее структура (см. Таблицу 1). Составьте полный набор всех функциональных групп, которые вам следует знать (см. Таблицу 1). Вы даже можете включить некоторые соединения, подобные приведенным ниже, в упражнении 1 — на одной стороне карточки указано соединение, а на другой — названия функциональных групп.Затем используйте эти Qcards, чтобы проверить себя. Это поможет вам распознать функциональные группы в более крупных соединениях.
Упражнения
1. Ответьте на следующие вопросы для каждого из этих соединений.
a) Назовите функциональные группы в кружке: A =?, B =?, C =?
б) Какова химическая формула соединения?
c) Сколько неподеленных пар в соединении?
Фенилпропаноламин — психоактивный препарат, который используется в качестве стимулятора и противоотечного средства в рецептурных и безрецептурных лекарствах от кашля и простуды.
Трийодтиронин — гормон щитовидной железы, который влияет на многие физиологические процессы в организме, такие как рост, обмен веществ и частоту сердечных сокращений.
Альдостерон — гормон, отвечающий за функцию почек.
Эфедрин — это лекарство, обычно используемое в качестве стимулятора, противоотечного средства, а также в качестве средства, способствующего концентрации внимания.
Кломифен в основном используется для стимуляции яичников при женском бесплодии, вызванном аномалией.
2. Среди пяти соединений, перечисленных в вопросе 1, которые будут проводить кислотно-щелочную реакцию при смешивании с гидроксидом натрия (который является основанием).
Ответы
фенилпропаноламин:
a) A = первичный амин, B = вторичный спирт, C = арен
б) C 9 H 13 НЕТ
c) 3 неподеленных пары — одна по азоту и две по кислороду
Трийодтиронин:
a) A = карбоновая кислота, B = эфир, C = первичный амин
b) C 15 H 12 I 3 NO 4
c) 18 неподеленных пар — по одной на каждый азот, по две на каждый кислород и по три на каждый йод
Альдостерон:
a) A = вторичный спирт, B = альдегид, C = кетон
б) C 21 H 28 O 5
в) 10 неподеленных пар — по две на каждый кислород
Эфедрин:
a) A = вторичный амин, B = вторичный спирт, C = арен
б) C 10 H 15 НЕТ
c) 3 неподеленных пары — одна по азоту и две по кислороду
Кломифен:
a) A = арен, B = эфир, C = третичный амин
б) C 26 H 28 ClNO
c) 6 неподеленных пар — одна по азоту, две по кислороду и три по хлору
2.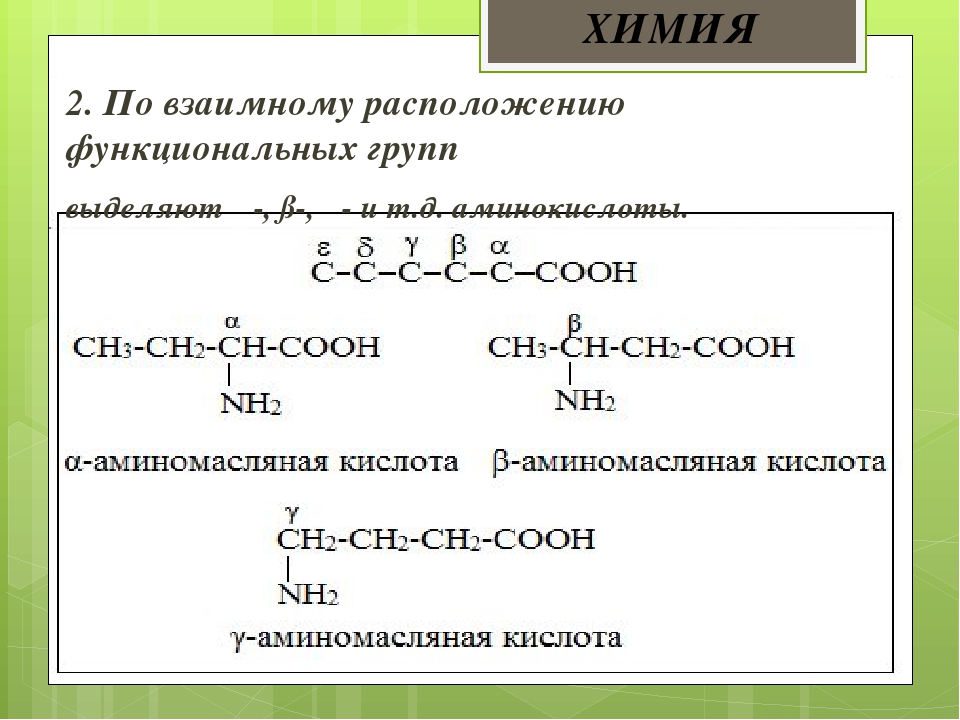

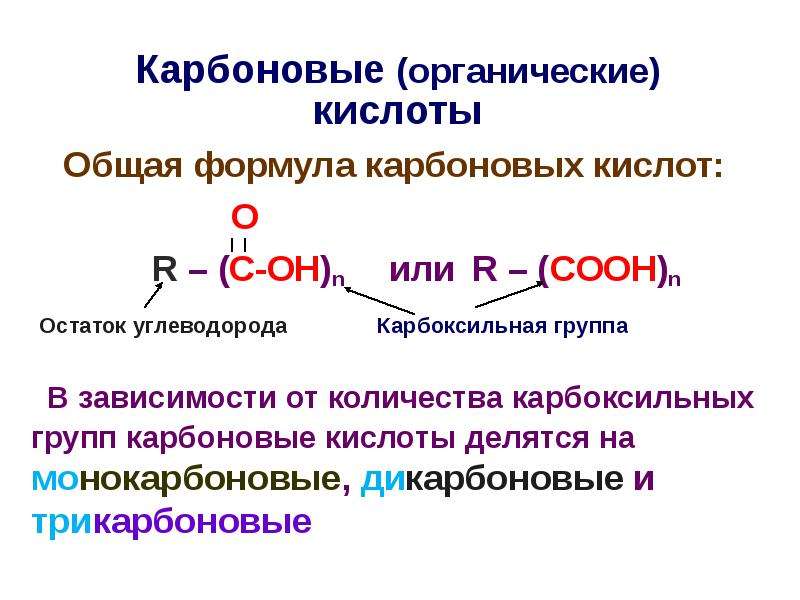 Определите функциональные группы в каждом
молекула.
Определите функциональные группы в каждом
молекула.