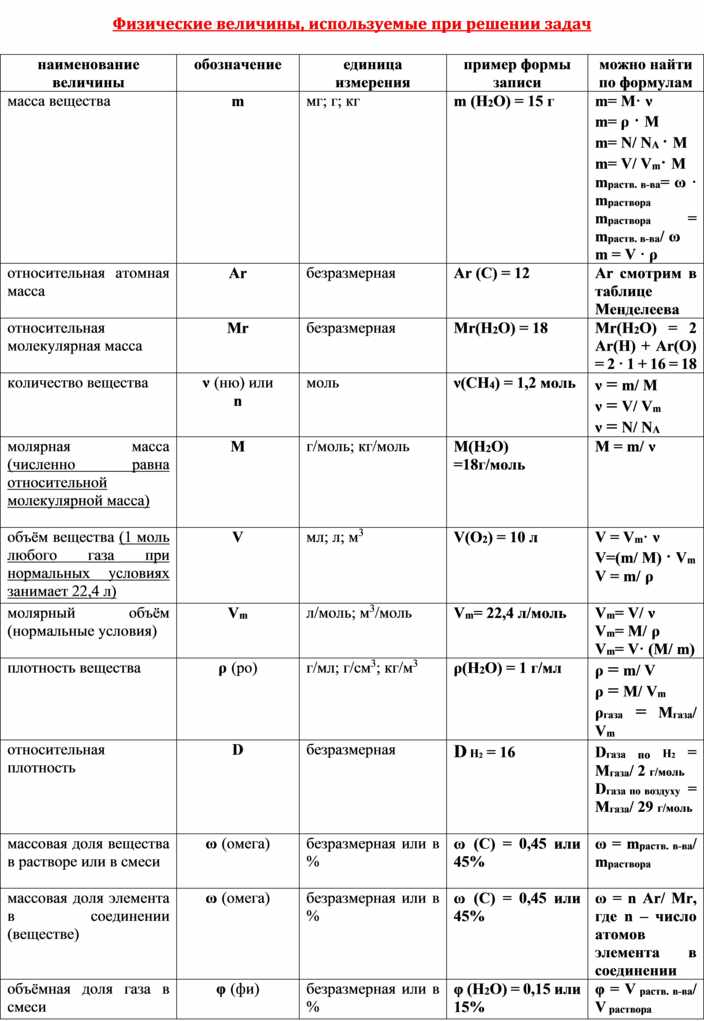
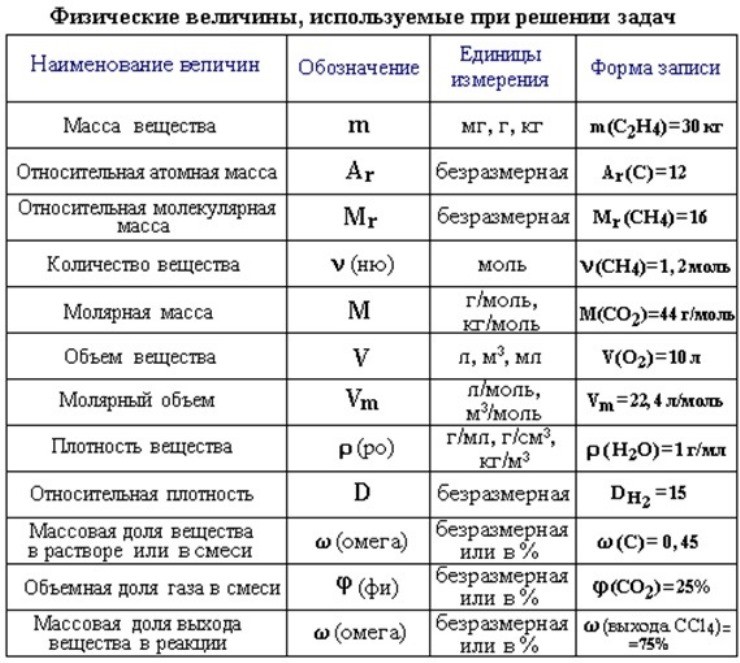
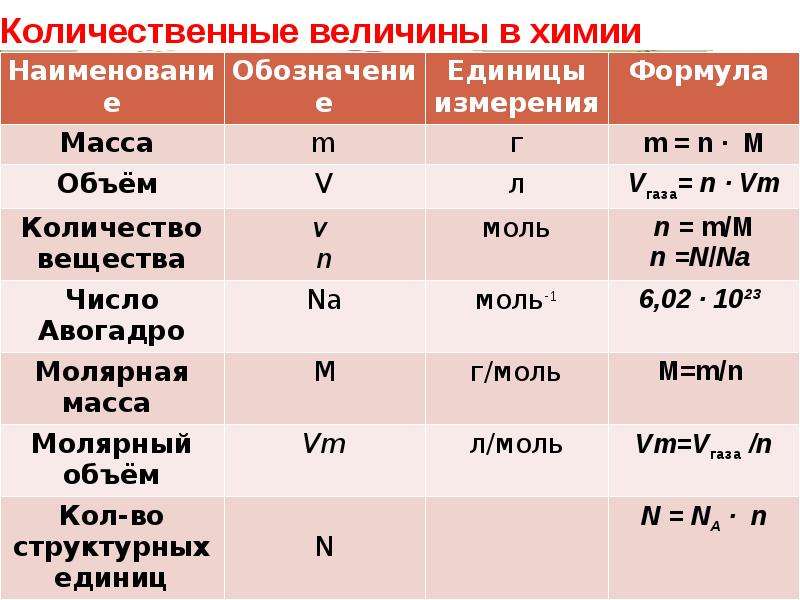
Молярная масса — что это? Как рассчитать? Формулы и примеры
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым.
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.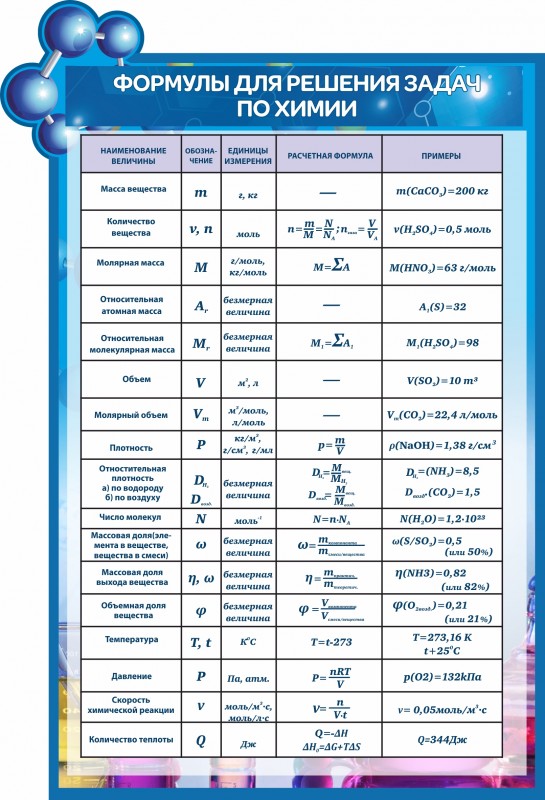
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO 2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Конспект урока по химии для 10 класса «Решение задач на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов»
Конспект урока по химии для обучающихся 10 класса
Тема урока: Решение задач на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов.
Цели урока:
познакомить обучающихся с задачами данного типа и показать
способы решения задач на нахождение молекулярной формулы органических веществ по
массовым долям и относительной плотности газов.
Задачи урока:
— научить алгоритму решения задач данного типа;
— закрепить правила грамотного оформления условия задачи;
— развивать умения осуществлять самоконтроль и взаимоконтроль;
— создать на уроке атмосферу поиска и сотрудничества,
— развивать навыки химического мышления, логики учащихся;
— формировать у учащихся предметные компетенции, основанные на знаниях, умениях и
навыках в рамках раздела «Решение задач на вывод молекулярной формулы вещества»
при подготовке к ЕГЭ по химии.
Тип урока: комбинированный урок.
Оборудование: компьютер, мультимедийный проектор, презентация, лист контроля умений и навыков у каждого учащегося, цветовые сигналы.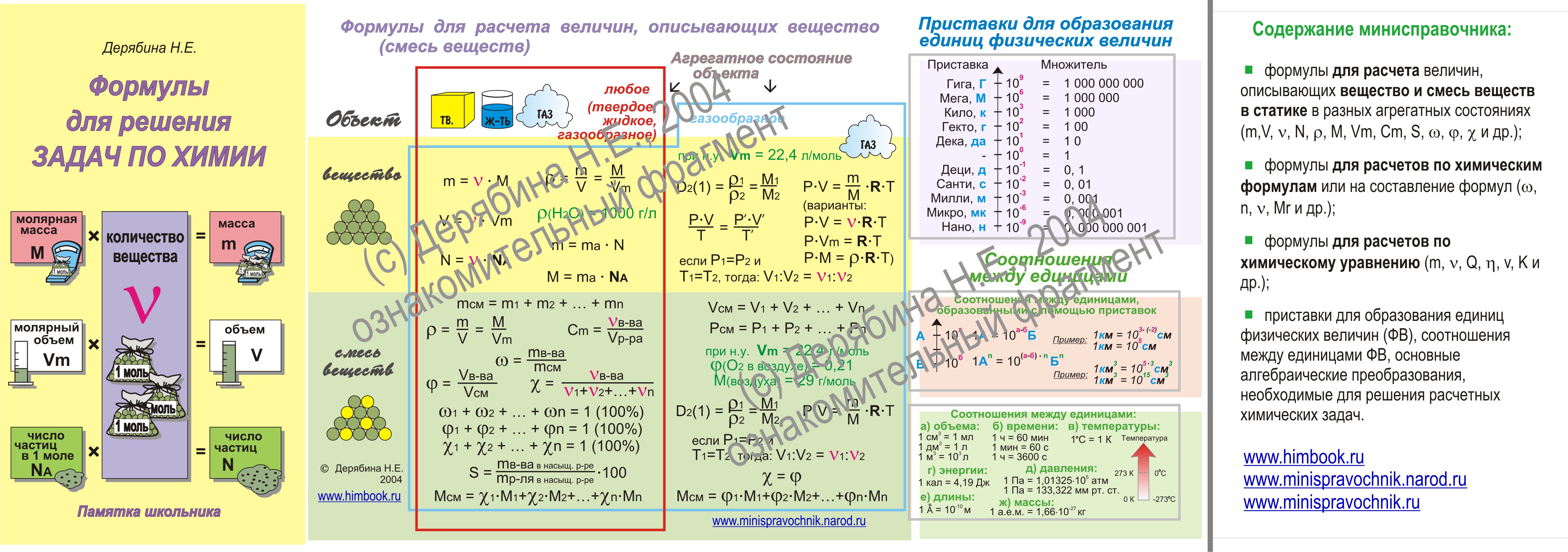
Структура урока.
I. Организационный этап. Постановка цели и мотивация учебно-познавательной деятельности учащихся.
II. Актуализация знаний (фронтальная форма работы). Решение задач .
III. Решение задач по теме «Нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов» (сочетание фронтальной и групповой форм работы, самооценка и групповая оценка).
IV. Закрепление знаний.
V. Рефлексия (самооценка).Домашнее задание.
Ход урока.
I. Организационный этап.
Умение решать химические задачи – важная составляющая знаний по предмету. Один из типов задач в курсе 10 класса – это задачи на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов. Подобные задания входят в ЕГЭ.
II. Актуализация знаний.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную).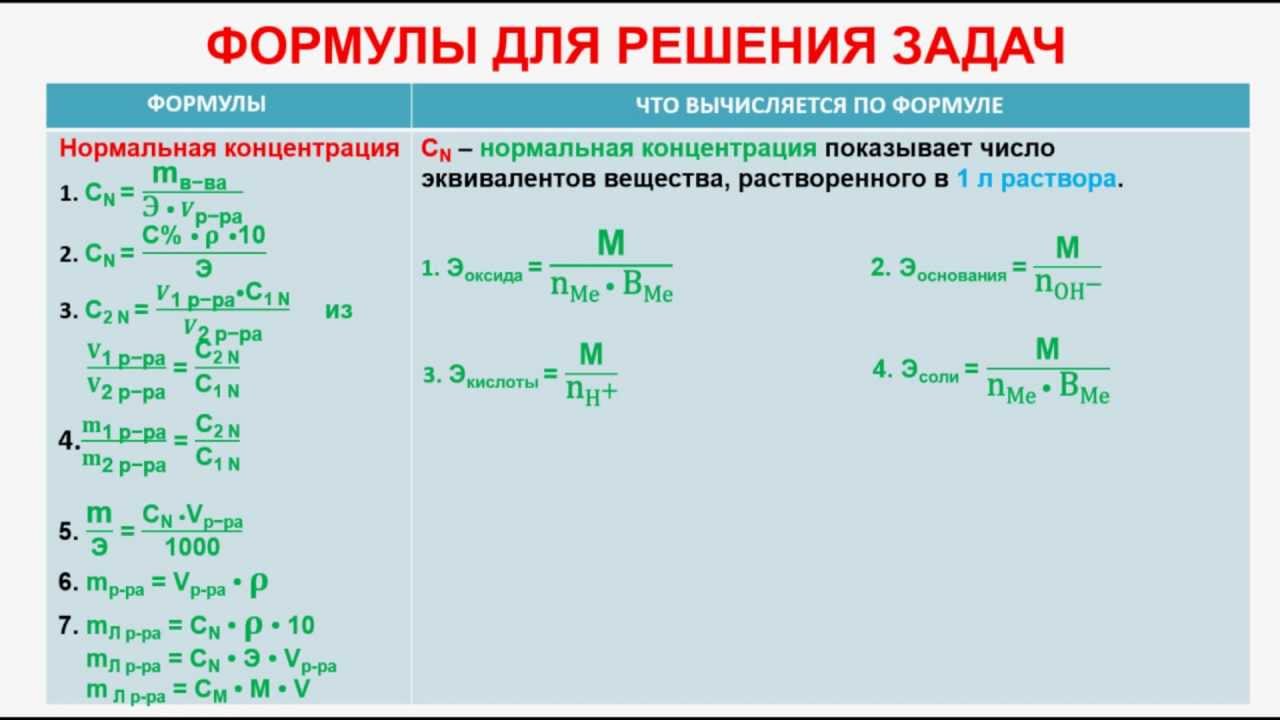 На основании данных качественного и количественного анализов вы находите сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
На основании данных качественного и количественного анализов вы находите сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Мы с вами познакомились с первым классом органических веществ. Это алканы.
Какова общая формула класса? ( Сnh3n+2)
Вы уже имеете представление о разнообразии веществ этого класса. Наша цель сегодня познакомиться с методами определения молекулярной формулы вещества по массовым долям и относительной плотности газа.
Какую информацию несет молекулярная формула? ( качественную и количественную)
Часто используется при решении задач понятие эмпирическая формула. Как вы понимает слово эмпирический ? (основанный на опыте, опирающийся на непосредственные наблюдения, эксперимент)
Эмпирическая формула любого вещества – это формула, которая выражает простейшее целочисленное отношение элементов, содержащихся в данном веществе. Эмпирические формулы иногда называют простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав ( массовые доли элементов).
Для вывода эмпирической формулы вещества достаточно знать его количественный состав ( массовые доли элементов).
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Что такое массовая доля? (массовая доля элемента — это его содержание в веществе в процентах по массе)
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 и там содержится 2 • 12 углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.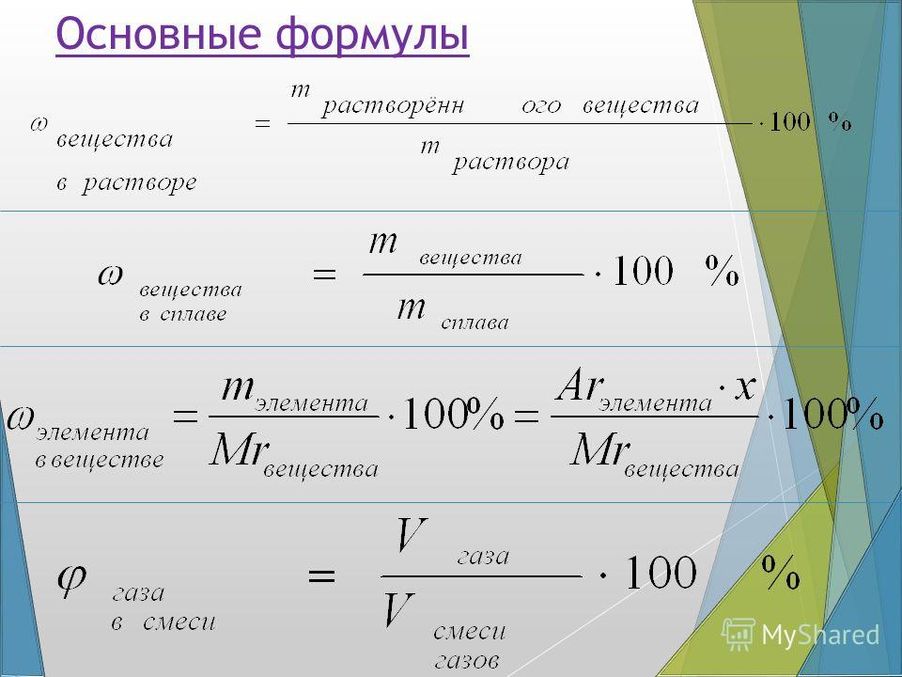
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
ω(х.э.) =
Что такое относительная плотность вещества? ( D — это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. )
D=Mr1/ Mr2
D(O₂)=Mr(газа)/Mr(O₂)
D(H₂)= Mr(газа)/Mr(H₂)
D(воздух) = Mr(газа)/Mr(воздух)
III. Решение задач по теме «Нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов»
Алгоритм решения задач.
1. Вычисляем молекулярную массу вещества.
Мr(в) = D(x)*Мr(х) (1)
2. Вычисляем количество атомов элемента:
а) если ω дана в процентах:
n(Э) = (2)
б) если ω дана в долях:
n(Э) = (3)
3. Вычисляем молекулярную массу полученного вещества.
4. Если молекулярная масса полученного вещества равна молекулярной массе вещества (1), тогда задача решена правильно; если молекулярная масса полученного вещества отличается от молекулярной массы вещества (1), вычисляем разность и определяем количество атомов.
Пример:
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
ω(C) = 82,75%
ω(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
Mr(воздуха) = 29
Решение:
1. Применяем формулу (1)
Mr(в-ва) = 29 * 2 =58
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 10
4. Вычисляем молярную массу С4Н10
Мr(С4Н10) =12 * 4 + 1 * 10 = 58
5. Вычисленная молекулярная масса совпадает с (1), задача решена.
Ответ: С4Н10
IV. Закрепление знаний.
Решить задачу в парах. Обсудить решение.
Найдите молекулярную формулу углеводорода, содержащего 80% углерода и 20% водорода. Относительная плотность по водороду равна 15.
Самостоятельная работа.
Вариант 1
Задача 1. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22. (С₃Н₈)
Задача2. В углеводороде массовая доля углерода равна84%. Относительная плотность паров углеводорода по воздуху равна 3.45. Определите формулу углеводорода.( С₇ Н₁₆)
Дополнительное задание.
Некоторое вещество имеет относительную плотность паров углеводорода по кислороду равную 1, 375. Массовая доля водорода равна 18, 2%. Выведите молекулярную формулу углеводорода.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества ;
3) составьте возможную структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества взаимодействием соответствующего органического вещества с гидроксидом натрия. (С₃Н₈)
(С₃Н₈)
Вариант 2
Задача 3.Массовая доля углерода в углеводороде составляет 83,33%. Плотность углеводорода по водороду равна 36.Определите формулу. (С₅Н₁₂)
Задача 4.Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93. (С₈Н₁₈)
Дополнительное задание.
Некоторое вещество имеет относительную плотность паров органического вещества по водороду 57. Массовая доля водорода равна 15,79%, углерода 83,33%. Выведите молекулярную формулу углеводорода. Данное соединение имеет линейный углеродный скелет.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте возможную структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества взаимодействием соответствующего органического вещества с гидроксидом натрия.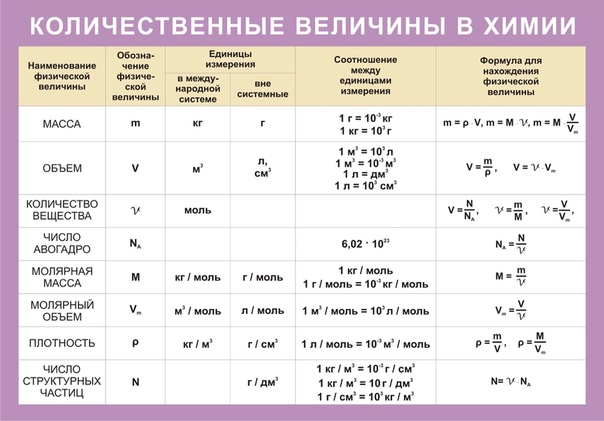 (С₈Н₁₈)
(С₈Н₁₈)
V. Рефлексия (самооценка). Домашнее задание: задача. Массовая доля углерода в углеводороде составляет 85,7%. Плотность углеводорода по воздуху равна 1,931.Определите формулу.
Конспект урока.
| Ход занятия | Деятельность учителя | Деятельность учащихся |
| Организационный этап 3 мин. | Работать будем в рабочих листах, по ходу урока заполняем. Сл. — 1 Умение решать химические задачи – важная составляющая знаний по предмету. Один из типов задач в курсе 10 класса – это задачи на вывод молекулярной формулы органического вещества по массовым долям и относительной плотности газа (ЕГЭ). | Подготовка к занятию. |
| Актуализация знаний 10 мин. | Сл.-2 Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов вы находите сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу. Сл. -3 Мы с вами познакомились с первым классом органических веществ. Что это за класс? Какова общая формула класса? Вы уже имеете представление о разнообразии веществ этого класса. Наша цель сегодня познакомиться с методами определения молекулярной формулы вещества по массовым долям и относительной плотности газа. Сл. -4 Часто используется при решении задач понятие эмпирическая формула. Эмпирическая формула любого вещества – это формула, которая выражает простейшее целочисленное отношение элементов, содержащихся в данном веществе. Эмпирические формулы иногда называют простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав ( массовые доли элементов). Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества. Сл. -5 Что такое массовая доля? Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна: Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества: Сл.- 6 Если записать эту формулу в общем виде, то получится следующее выражение: ω(х.э.) = Сл.-7 Что такое относительная плотность вещества? ( D — это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. ) D=Mr1/ Mr2 D(O₂)=Mr(газа)/Mr(O₂) D(H₂)= Mr(газа)/Mr(H₂) D(воздух) = Mr(газа)/Mr(воздух) | Внимательно слушают учителя. Фронтальная работа учащихся. Устно отвечаю на вопросы. По ходу беседы делают записи в рабочем листе. 1.Алканы. 2. Сnh3n+2 3. Качественную и количественную. 4. Основанный на опыте, опирающийся на непосредственные наблюдения, эксперимент. 5. Массовая доля элемента — это его содержание в веществе в процентах по массе. 6. D — это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. |
| Решение задач по теме «Нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов» 20 мин. | Сл.-8 Алгоритм решения задач. 1. Вычисляем молекулярную массу вещества. Мr(в) = D(x)*Мr(х) (1) 2. Вычисляем количество атомов элемента: а) если ω дана в процентах: n(Э) = (2)
б) если ω дана в долях:
n(Э) = (3) 3. Вычисляем молекулярную массу полученного вещества. 4. Если молекулярная масса полученного вещества равна молекулярной массе вещества (1), тогда задача решена правильно; если молекулярная масса полученного вещества отличается от молекулярной массы вещества (1), вычисляем разность и определяем количество атомов. Сл.-9 Давайте решим задачу на вывод молекулярной формулы. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2. Решите следующую задачу в парах на рабочих листах самостоятельно. | Внимательно слушают, делают записи по ходу рассказа. Обсуждают краткую запись задачи. Заполняют рабочий лист. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2. Дано: ω(C) = 82,75% Найти: СхНу Решение: 1. Mr(в-ва) = 29 * 2 =58 2. Находим количество атомов С по формуле (2) n(С) = = 4 3. Находим количество атомов Н по формуле (2) n(Н) = = 10 4. Вычисляем молярную массу С4Н10 Мr(С4Н10) =12 * 4 + 1 * 10 = 58 5. Вычисленная молекулярная масса совпадает с (1), задача решена. Ответ: С4Н10 Решают, обсуждают. |
| Закрепление знаний. 10 мин. | А теперь попробуем самостоятельно решить задачи, используя алгоритм. Вам выданы задачи. Самостоятельно решите задачи на предложенных рабочих листах. | Учащиеся решают задачи и записывают на предложенных листах. Выполненное задание сдают учителю. |
| Рефлексия. 2 мин. | Запишите и решите дома задачу. Домашнее задание: задача. Массовая доля углерода в углеводороде составляет 85,7%. Плотность углеводорода по воздуху равна 1,931.Определите формулу. Как вы считаете: — удалось ли вам справиться с предложенными сегодня задачами? — какое задание было для вас наиболее интересным и почему? — какое задание было для вас наиболее сложным? | Записывают домашнее задание. |
Технологическая карта урока
| Тема урока | Решение задач на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов. | |
| Цели урока | Деятельностная | Формирование УУД при изучении алгоритма решения задач на вывод молекулярной формулы и в процессе решения задач. |
| Предметно – дидактическая | Изучение алгоритма решения задач на вывод молекулярной формулы по массовым долям и относительной плотности. | |
| Планируемые результаты урока | Предметные | Знают обозначение общей молекулярной формулы, массовой доли, относительной плотности газа. Знают определение молекулярной формулы, эмпирической формулы, знают формулы массовой доли, относительной плотности. Решают задачи на нахождение молекулярной формулы по массовым долям и относительной плотности газа. |
| Метапредметные | Анализируют текст задачи, работают в группах, оценивают свою работу на уроке. | |
| Личностные | Убеждаются в познаваемости окружающего мира, проявляют интерес к премету. | |
| Тип урока | По ведущей дидактической цели | Изучение нового материала. |
| По способу организации | Комбинированный | |
| По ведущему методу обучения | Репродуктивный | |
| Методы обучения | Основной | Объяснительно-иллюстративный |
| Дополнительный | Беседа, рассказ, самостоятельная работа | |
| Основные вопросы урока | 1.Понятия массовая доля, относительная плотность газа. 2.Алгоритм решения задач на вывод молекулярной формулы вещества по массовым долям и относительной плотности. | |
| Средства обучения | ТСО, презентация, учебник, рабочие листы, карточки с задачами, лист контроля умений и навыков у каждого учащегося, цветовые сигналы. | |
Ход урока:
| Этапы урока | Методы обучения | Учебно – познавательные задачи урока | Формируемые УУД | Методы оценки / самооценки | |
| Деятельность учителя | Деятельность ученика | ||||
| 1. | Приветствует учащихся, проверяет их готовность к уроку. Предлагает обсудить тему урока. | Приветствуют учителя, готовят рабочее место. Участвуют в постановке темы урока. Записывают на рабочих листах тему урока. | Регулятивные, коммуникативные. | ||
| 2.Актуализация опорных знаний | Фронтальная беседа. |
1.Что это за класс? 2. Какова общая формула класса? 3. Какую информацию несет молекулярная формула? 4. Как вы понимает слово эмпирический?
5 Что такое массовая доля? 6. Что такое относительная плотность вещества? | Отвечают на вопросы учителя. Делают записи в рабочих листах по ходу беседы. 1.Алканы. 2. 3. Качественную и количественную. 4. Основанный на опыте, опирающийся на непосредственные наблюдения, эксперимент. 5. Массовая доля элемента — это его содержание в веществе в процентах по массе 6. D — это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. |
Общеучебные, коммуникативные. |
Совместное обсуждение. |
| 3. Формирование новых ЗУН | Беседа с элементами монологической речи. | Для решения любой задачи, что необходимо определить? Давайте определим алгоритм действий для решения задач на вывод молекулярной формулы вещества по массовым долям и относительной плотности газа. Запишем наш алгоритм действий. Теперь решим вместе одну задачу. | Отвечают на вопросы, обсуждают, приходят к общему выводу. 1.Алгоритм действий. Обсуждают, приходят к общему выводу. Полученный план действий, записывают. Обсуждают краткую запись задачи. Один ученик решает у доски , а остальные на рабочих листах |
Анализ, моделирование алгоритма, запись результатов. |
Совместное обсуждение. |
| 4. Развитие способов умственной деятельности | Самостоятельная работа в парах. Самостоятельная работа индивидуальная. | Предлагает выполнить задание в парах на рабочих листах самостоятельно. Решите две задачи самостоятельно. | Работают в парах. Обсуждают полученный результат, консультируются с учителем. Выполняют самостоятельную работу на рабочих листах. | Регулятивные, коммуникативные. | Взаимопроверка. |
| 5.Завершающий этап | Рефлексия. Домашнее задание | Даёт информацию о домашнем задании. Домашнее задание: задача. Массовая доля углерода в углеводороде составляет 85,7%. Плотность углеводорода по воздуху равна 1,931.Определите формулу. Как вы считаете: — удалось ли вам справиться с предложенными сегодня задачами? — какое задание было для вас наиболее интересным и почему? — какое задание было для вас наиболее сложным? |
Записывают домашнее задание. |
|
Самооценка |
Секретная шпаргалка по химии.
 5.1. Вывод формулы вещества по общей формуле класса | Репетитор Богунова В.Г.
5.1. Вывод формулы вещества по общей формуле класса | Репетитор Богунова В.Г.Уже который день моя статья «Тайны задач по химии? 1. Препарируем задачу ЕГЭ» вызывает нервные тики у вполне спокойных и уверенных в себе учителей. Не так они представляют себе решение задач. Им нужно, чтобы все было запутано и мало понятно, а на вопрос ученика: «Как решить задачу?» учитель, сделав умные глаза, отвечал бы: «Думай». А чем думать? Как думать? Куда думать? В какую сторону? Сие есть тайна великая! Однако, все тайное становится явным на вскрытии задач ЕГЭ. Вот и моя статья показала, какие приколы (фишки) для ЕГЭ по химии могут приготовить нашим детям сотрудники ФИПИ.
35-е задание ЕГЭ по химии (Задачи на нахождение формулы вещества) — одно из самых интересных заданий ЕГЭ. От этих задач веет немножко Копперфильдом: делаешь расчеты — проводишь анализ химических свойств — составляешь структурную формулу вещества. Но не все так однозначно и просто. Как показал анализ «вскрытия» одной из 35-х задач, ученик может столкнуться с очень накрученным (т.е. комбинированным) заданием, в которое авторы на основе нахождения формулы вещества умудрились втиснуть множество элементов из разных разделов алгоритмики и теоретической химии. Чтобы достойно справиться с решением 35-й задачи, а также других заданий ЕГЭ, нужно в процессе подготовки тщательно отрабатывать (шлифовать) каждый отдельно взятый алгоритмический элемент (алгоритмическую фишку): вначале — на простых заданиях, а затем — на комбинированных. Чем я и занимаюсь с учениками и планирую рассказывать об этом в своих статьях.
Как показал анализ «вскрытия» одной из 35-х задач, ученик может столкнуться с очень накрученным (т.е. комбинированным) заданием, в которое авторы на основе нахождения формулы вещества умудрились втиснуть множество элементов из разных разделов алгоритмики и теоретической химии. Чтобы достойно справиться с решением 35-й задачи, а также других заданий ЕГЭ, нужно в процессе подготовки тщательно отрабатывать (шлифовать) каждый отдельно взятый алгоритмический элемент (алгоритмическую фишку): вначале — на простых заданиях, а затем — на комбинированных. Чем я и занимаюсь с учениками и планирую рассказывать об этом в своих статьях.
Авторская Система Задач по Химии насчитывает несколько типов алгоритмов на вывод формулы вещества: по массовой доле, по продуктам сгорания, по стехиометрическим коэффициентам, по формуле в общем виде. Постепенно я буду рассказывать очень подробно о каждом алгоритме. Сегодня я хочу проработать специфику алгоритма Вывод формулы вещества по общей формуле класса. Итак, поехали!
Итак, поехали!
Вывод формулы вещества по общей формуле класса
Алгоритм решения строится на логической схеме М(реал) = М(общ)
М(реал) — реальная молярная масса, которая рассчитывается по многим формулам. На фото я представляют основные формулы расчета реальной молярной массы
М(общ) — молярная масса вещества в общем виде, рассчитывается по общей формуле класса веществ. На фото можно увидеть примеры расчета молярной массы вещества в общем виде
В основе алгоритма задачи лежит составление уравнение с одним неизвестным, решение которого приводит к ответу. Потренируемся решать несложные задачи по этому алгоритму
Задача 1
Углеводород имеет формулу Cnh3n-2. Определите n, если известно, что 0,8 моль углеводорода имеют массу 43,2 г.
Задача 2
Органическое вещество имеет формулу Cnh3n+2О.Определите n, если известно, что 0,7 моль углеводорода имеют массу 32,2 г.
Задача 3
Масса одной молекулы ромбической серы равна 4,252•10-22 г. Рассчитайте число атомов в одной молекуле ромбической серы
Задача 4
Алкен массой 28 г содержит 3,01∙1023 молекул. Определите структурную формулу алкена, если известно, что при его окислении подкисленным раствором перманганата калия образуется ацетон.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook.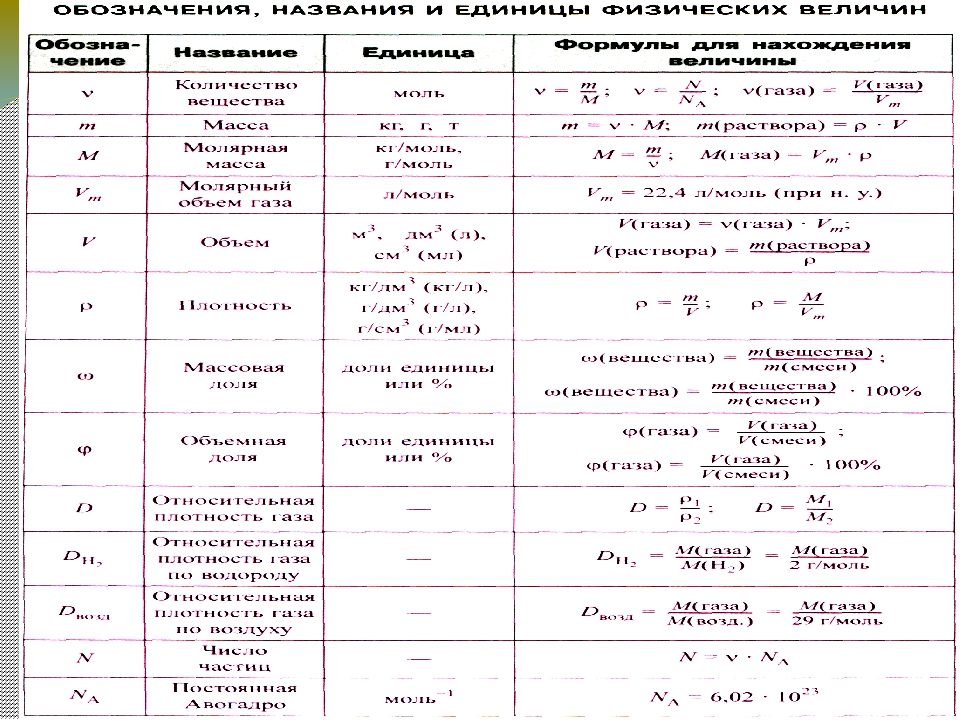 Я обязательно отвечу вам.
Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Решение задач на нахождение химической формулы органического вещества урок закрепления материала 10 класс химико-биологический профиль
РЕШЕНИЕ ЗАДАЧ НА НАХОЖДЕНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
Урок закрепления материала
10 класс
химико-биологический профиль
Учитель химии
Тарасова Н.И.
Цель. Продолжить формирование навыков решения задач на нахождение химической формулы органического вещества, довести умения решения задач до оптимального уровня.
Задачи.
Закрепить знания о физических величинах: массе, объеме, количестве вещества, молярной массе, плотности и относительной плотности по газообразному веществу, массовой доле вещества.

Отработать умение пользоваться формулами определения физических величин для нахождения химической формулы органического вещества.
Довести умения решать задачи на нахождение химической формулы органического вещества до оптимального уровня.
Продолжить формировать умения логически мыслить.
Методы. Беседа, работа с формулами, решение задач, применение ИКТ, составление алгоритмов, самостоятельная работа.
Оборудование.
Интерактивная доска.
Таблица «Основные формулы для решения задач».
ПЛАН УРОКА
Организационный момент (тема и цели урока).
Повторение и обобщение изученного ранее материала
Решение задач, составление алгоритмов.
Индивидуальное задание.
ХОД УРОКА.
Организационный момент (тема и цели урока).
Повторение и обобщение изученного ренее материала.
Устный опрос:
Какие вещества органические вещества относят к кислородсодержащим углеводородам?
Что такое функциональная группа?
Как называют и каков состав функциональных групп спиртов, альдегидов, кетонов и карбоновых кислот?
Перечислить общие формулы кислородсодержащих углеводородов.
Как расчитывают молекулярны массы по общей формуле?
Повторение расчетных формул.
|
Вывод химической формулы вещества: |
Расчетные формулы |
Задачи для решения |
|
— ПЕРВЫЙ УРОВЕНЬ на основании массовых долей атомов элементов и относительной плотности его по другому газу |
АхВу (А)/Аr(А): (В)/Аr(В) (В) = х Аr(В)/ М(АхВу)
Dвод. Dкисл.( АхВу) = М(АхВу)/32 |
№1 Уровень А 1,2 В 1,2 С 1 |
|
— ВТОРОЙ УРОВЕНЬ по массе или объёму исходного вещества и продуктам горения или образования веществ |
М =Vm·ρ V = m / ρ n = V/ Vm n = m / М Dвозд.( АхВу) = М(АхВу)/29 Dвод.( АхВу) = М(АхВу)/2 |
№2 Уровень А 1,2 В 1,2 |
III. Решение задач учениками у доски и составление алгоритмов решения задач.
Задачи для решения:
ПЕРВЫЙ
УРОВЕНЬ.
А.
1. Одноосновная карбоновая кислота имеет следующий состав: С – 26,1%, Н – 4,35%, О – 69,55%. Исходя из этих данных, найдите молекулярную формулу этой кислоты.
Решение:
СхНуОz
х : у : z = 26,1/12 : 4,35/1 : 69,55/16 = 2,175 : 4,35 : 4,35 = 1 : 2 : 2
Ответ: НСООН
2. По данным элементного анализа одноосновной карбоновой кислоты было установлено, что в ней 48,65% углерода, 8,11% водорода. Выведите молекулярную формулу этой кислоты. Напишите формулы строения изомерных соединений.
Решение:
СхНуОz
х : у : z = 48,65/12 : 8,11/1 : 43,24/16 = 4,05 : 8,11 : 2,7 = (1,5 : 3 : 1) 2 = 3 : 6 : 2
Ответ: С2Н5СООН
В.
1.
При анализе вещества
нашли, что в его состав входят 40% углерода,
6,66% водорода. 53,34% кислорода. Найдите
молекулярную формулу и назовите это
вещество, если известно, что плотность
его паров по воздуху равна 2,07.
Решение:
СхНуОz
х : у : z = 40/12 : 6,66/1 : 53,34/16 = 3,33 : 6,66 : 3,33 = 1 : 2 : 1
Простейшая формула: СН2О
М(СхНуОz) = Dвозд.∙ М(возд.) = 2,07 ∙ 29 = 60г/моль
М(СН2О) = 30г/моль
М(СхНуОz)/ М(СН2О) = 60/30 = 2
СН2О ∙ 2 = С2Н4О2
Ответ: СН3 СООН
2. Плотность по водороду вещества, имеющего массовый состав: С – 54,55%, Н – 9,09%, О – 36,36%, равна 22. Выведите молекулярную формулу этого вещества.
Решение:
СхНуОz
х : у : z = 54,55/12 : 9,09/1 : 36,36/16 = 4.55 : 9,09 : 2,27 = 2 : 4 : 1
Простейшая формула: С2Н4О
М(СхНуОz) = Dвозд.∙ М(вод.) = 2∙ 22 = 44г/моль
М(С2Н4О) = 44г/моль
Ответ: СН3 СОН
С.
1. Установите молекулярную формулу предельной одноосновной карбоновой кислоты, натриевая соль которой содержит 33,82% металла.
Решение:
М(СnH2n+1COONa) = 14n + 68
0,3382 = 23/14n + 68
23 = 23 – 4,73 n
n = 0
С0Н1СООН
Ответ: НСООН
АЛГОРИТМ. Нахождение молекулярной формулы на основании массовых долей атомов элементов и относительной плотности его по другому газу.
Запишем формулу вещества, обозначив индексы х , у и z . СхНуОz
Найдем отношение х : у : z = (С)/Аr(С): (Н)/Аr(Н) : (О)/Аr(О)
Отношения находят до целых чисел: делят на наименьшее, если необходимо, учеличивают в 2 раза.
Полученные числа – это индексы в формуле.

ВТОРОЙ УРОВЕНЬ.
А.
1. При сгорании 4,6г органического вещества с плотностью его паров по воздуху 1,586 получено 5,4г воды и 4,48л углекислого газа (н.у.). определите формулу сгоревшего углеводорода.
Решение:
СхНуОz + О2 = х СО2 + у/2 Н2О
М(СхНуОz) = Dвозд.∙ М(возд.) = 1,586 ∙ 29 = 46г/моль
n = m / М
n = 4,6г :46г/моль = 0,1 моль
n = 5,4г :18г/моль = 0,3 моль
n = V/ Vm
n = 4,48л : 22,4 л/моль = 0,2 моль
0,1 : 0,2 : 0,3 = 1 : 2 : 3
х = 2 у = 6
С2Н6
М (С2Н6) = 30г/моль
М(СхНуОz) = 46г/моль — 30г/моль = 16 г/моль
Ответ: С2Н5ОН
2.При
сжигании 7,5г органического вещества
образуется 4,5г водяных паров и 11г оксида
углерода (IV). Найдите молекулярную формулу вещества
и назовите его, если известно, что
плотность его паров по водороду равна
15.
Найдите молекулярную формулу вещества
и назовите его, если известно, что
плотность его паров по водороду равна
15.
Решение:
СхНуОz + О2 = х СО2 + у/2 Н2О
М(СхНуОz) = Dвод.∙ М(вод.) = 15 ∙ 2 = 30г/моль
n = m / М
n = 7,5г :30г/моль = 0,25 моль
n = 4,5г :18г/моль = 0,25моль
n = 11г :44г/моль = 0,25моль
0,25 : 0,25 : 0,25 = 1 : 1 : 1
х = 1 у = 2
СН2
М(СН2) = 14г/моль
М(СхНуОz) = 30г/моль — 14г/моль = 16 г/моль
Ответ: НСОН
В.
1. При взаимодействии предельного альдегида массой 5,8г с избытком гидроксида меди (II) при нагревании образовалось 14,4г осадка оксида меди (I). Установите молекулярную формулу альдегида.
Решение:
СnН2n+1 CОH + 2Cu(OH)2 = СnН2n+1 CОOH + Cu2O + 2H2O
n (СnН2n+1 CОH) = n (Cu2O) = 14,4/144 = 0,1 моль
М(СnН2n+1 CОH) = 5,8г/0,1моль = 58г/моль
М(СnН2n+1 CОH) = 14 n + 30
14 n + 30 = 58
n = 2
Ответ: С2Н5СОН
2. При
обработке некоторого количества
предельного одноатомного спирта натрием
выделилось 2.24л газа (н.у.), а при окислении
того же количества спирта образовалось
11,6г альдегида. Определите формулу
спирта.
При
обработке некоторого количества
предельного одноатомного спирта натрием
выделилось 2.24л газа (н.у.), а при окислении
того же количества спирта образовалось
11,6г альдегида. Определите формулу
спирта.
Решение:
2СnН2n+1 ОH+ 2Na → Н2 + 2 СnН2n+1 ОNa
n(Н2) = V(Н2) : Vm= 2,24 / 22,4 = 0,1моль
n(СnН2n+1 ОH) = n(Н2)∙2 = 2 ∙ 0,1 = 0,2 моль
СnН2n+1 ОH+ [О]→СnН2nО
n(СnН2nО) = n(СnН2n+1 ОH) =0,2 моль
М(СnН2nО) = 11,6/0,2 = 58г/моль
М(СnН2n+1 ОH) = М(СnН2nО) + 2 = 60г/моль
14 n + 18 = 60
n = 3
Ответ: С3Н7ОН
АЛГОРИТМ:
Нахождение
молекулярной формулы по наличию продуктов
сгорания вещества.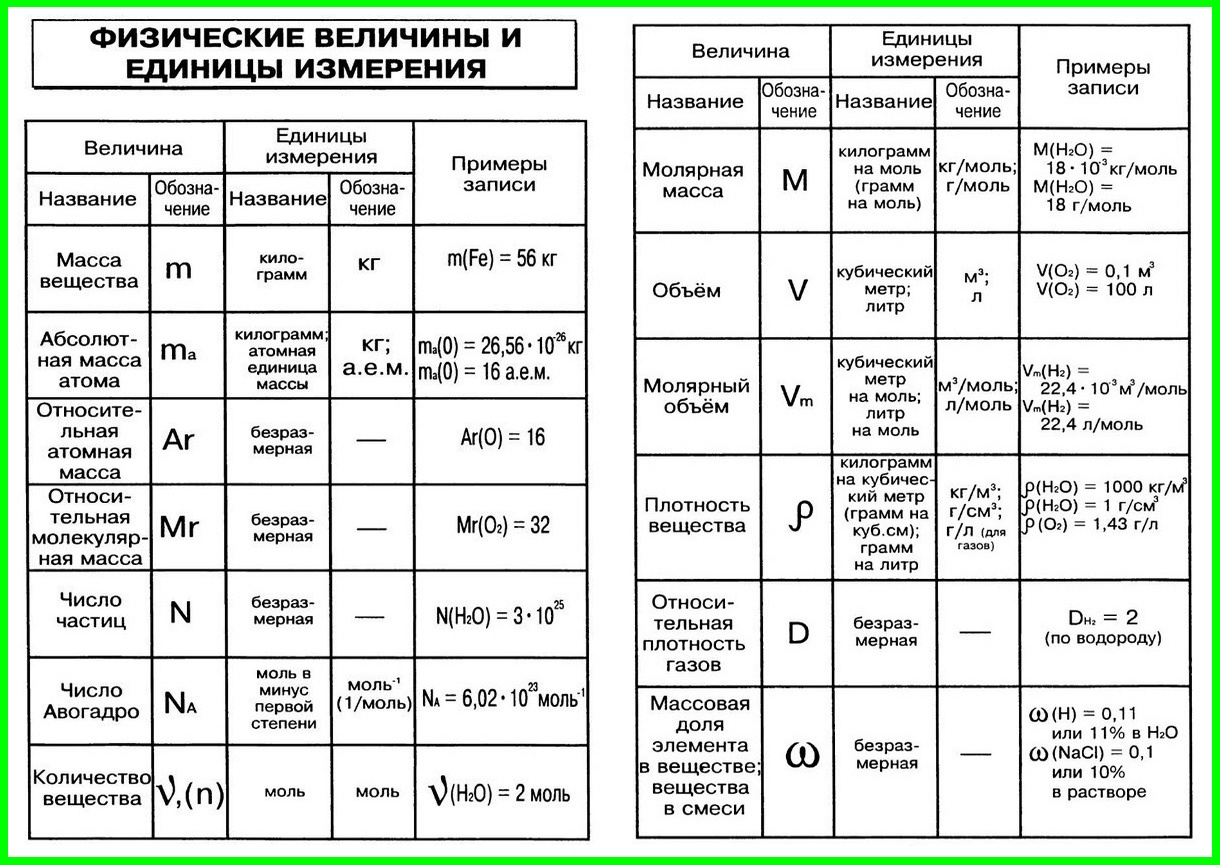
1.Определить простейшую формулу вещества: CXHYOZ= ?C😕Н😕О.
2. Определить истинную молярную массу.
3. Определить молярный фактор – отношение истинной молярной массы к простейшей p = Мист/Мпрост.
4.Найти молекулярную формулу вещества. Умножить индексы простейшей формулы на молярный фактор.
5. Найти структурную формулу. Выписать структурные формулы всех изомеров и выбрать тот, который удовлетворяет условию задачи.
IV. Индивидуальное задание:
Первый уровень (А). Вещество имеет следующий элементный состав: С – 19,4%; Н – 3,2%; О – 77,4% (по массе). Определите его формулу.

Первый уровень (В). Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения.
Второй уровень (А).Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.
Ответы:
Ответ: Н2СО3
Ответ: С6Н12О
Ответ: С6Н14О
1.8: Решение химических задач — Химия LibreTexts
Цели обучения
- Объясните подход размерного анализа (метка фактора) к математическим расчетам с использованием количественных показателей.

- Опишите, как использовать анализ размерностей для преобразования единиц измерения для заданного свойства и вычислений, включающих два или более свойства.
- Преобразование между тремя основными единицами измерения температуры: по Фаренгейту, по Цельсию и по Кельвину.
Часто бывает так, что интересующую величину нелегко (или даже невозможно) измерить напрямую, а вместо этого ее необходимо рассчитать на основе других непосредственно измеренных свойств и соответствующих математических взаимосвязей.Например, рассмотрим измерение средней скорости спортсмена, бегущего на короткие дистанции. Обычно это достигается путем измерения времени , необходимого спортсмену для бега от линии старта до линии финиша, и расстояния между этими двумя линиями, а затем вычисления скорости из уравнения, которое связывает эти три свойства:
\[\mathrm{скорость=\dfrac{расстояние}{время}}\]
Спринтер олимпийского уровня может пробежать 100 м примерно за 10 с, что соответствует средней скорости
.
\[\mathrm{\dfrac{100\: м}{10\: с}=10\: м/с}\]
Обратите внимание, что эта простая арифметика включает в себя деление чисел каждой измеренной величины, чтобы получить число вычисляемой величины (100/10 = 10) и аналогично деление единиц каждой измеряемой величины, чтобы получить единицу вычисляемой величины (m /с = м/с).Теперь рассмотрите возможность использования этого же соотношения для предсказания времени, необходимого человеку, бегущему с этой скоростью, чтобы пройти расстояние 25 м. Используется то же соотношение между тремя свойствами, но в данном случае предоставлены две величины: скорость (10 м/с) и расстояние (25 м). Чтобы получить искомое свойство, время, уравнение должно быть соответствующим образом перестроено:
\[\mathrm{время=\dfrac{расстояние}{скорость}}\]
Время может быть вычислено как:
\[\mathrm{\dfrac{25\: м}{10\: м/с}=2.5\: с}\]
Опять же, арифметика с числами (25/10 = 2,5) сопровождалась той же арифметикой с единицами (м/м/с = с), чтобы получить число и единицу результата, 2,5 с. Обратите внимание, что, как и в случае с числами, когда единица делится на идентичную единицу (в данном случае m/m), результат равен «1» или, как обычно говорят, единицы «отменяются».
Обратите внимание, что, как и в случае с числами, когда единица делится на идентичную единицу (в данном случае m/m), результат равен «1» или, как обычно говорят, единицы «отменяются».
Эти расчеты являются примерами универсального математического подхода, известного как анализ размерностей (или метод факторных меток). Анализ размерностей основан на следующем предположении: единицы величин должны подвергаться тем же математическим операциям, что и связанные с ними числа .Этот метод может применяться к вычислениям, начиная от простого преобразования единиц измерения и заканчивая более сложными многоэтапными вычислениями, включающими несколько различных величин.
Коэффициенты преобразования и размерный анализ
Отношение двух эквивалентных величин, выраженное в разных единицах измерения, может быть использовано в качестве коэффициента преобразования единиц измерения. Например, длины 2,54 см и 1 дюйм эквивалентны (по определению), поэтому коэффициент преобразования единиц измерения может быть получен из соотношения
.
\[\mathrm{\dfrac{2.54\: см}{1\: дюйм}\:(2,54\: см=1\: дюйм)\: или\: 2,54\:\dfrac{см}{дюйм}}\]
Несколько других часто используемых коэффициентов преобразования приведены в таблице \(\PageIndex{1}\).
| Длина | Том | Масса |
|---|---|---|
| 1 м = 1,0936 ярда | 1 л = 1,0567 кварты | 1 кг = 2. 2046 фунтов 2046 фунтов |
| 1 дюйм = 2,54 см (точно) | 1 кварта = 0,94635 л | 1 фунт = 453,59 г |
| 1 км = 0,62137 мили | 1 фут 3 = 28,317 л | 1 (экирдупуа) унция = 28,349 г |
| 1 миля = 1609,3 м | 1 столовая ложка = 14,787 мл | 1 (тройская) унция = 31,103 г |
Когда мы умножаем величину (например, расстояние, указанное в дюймах) на соответствующий коэффициент преобразования единиц, мы преобразуем величину в эквивалентное значение с другими единицами измерения (например, расстояние в сантиметрах).Например, вертикальный прыжок баскетболиста на 34 дюйма можно преобразовать в сантиметры следующим образом:
\[\mathrm{34\: \cancel{дюйм} \times \dfrac{2,54\: см}{1\:\cancel{дюйм}}=86\: см}\]
Поскольку эта простая арифметика включает величин , предпосылка размерного анализа требует, чтобы мы умножали как чисел, так и единиц. Числа этих двух величин перемножаются, чтобы получить число количества продукта, 86, тогда как единицы умножаются, чтобы получить
\[\ mathrm{\dfrac{дюйм.\times cm}{in.}}.\]
Так же, как и для чисел, отношение одинаковых единиц также численно равно единице,
\[\ mathrm{\dfrac{дюймы}{дюймы}=1}\]
и, таким образом, единичный продукт упрощается до см . (Когда идентичные единицы делятся, чтобы получить коэффициент, равный 1, говорят, что они «отменяются».) Используя анализ размерностей, мы можем определить, что коэффициент преобразования единиц был установлен правильно, проверив, чтобы подтвердить, что исходная единица аннулируется, и результат будет содержать искомую (преобразованную) единицу.
Пример \(\PageIndex{1}\): использование коэффициента преобразования единиц
Масса соревновательного фрисби 125 г. Преобразуйте его массу в унции, используя коэффициент преобразования единиц измерения, полученный из соотношения 1 унция = 28,349 г (таблица \(\PageIndex{1}\)).
Раствор
Если у нас есть коэффициент преобразования, мы можем определить массу в килограммах, используя уравнение, аналогичное тому, которое используется для преобразования длины из дюймов в сантиметры.
\[x\:\mathrm{oz=125\: г\единица умножения\: преобразование\: коэффициент}\нечисло\]
Мы записываем коэффициент преобразования единиц измерения в двух формах:
\[\ mathrm{\dfrac{1\: унция}}{28.349\: г}\:и\:\dfrac{28.349\: г}{1\: унция}}\номер\]
Правильным коэффициентом преобразования единиц измерения является соотношение, которое отменяет единицы измерения граммы и оставляет унции.
\[\begin{align*}
x\:\ce{oz}&=\mathrm{125\:\cancel{g}\times \dfrac{1\: oz}{28,349\:\cancel{g} }}\\
&=\mathrm{\left(\dfrac{125}{28,349}\right)\:oz}\\
&=\mathrm{4,41\: oz\: (три\: значащие\: цифры )}
\end{выравнивание*}\]
Упражнение \(\PageIndex{1}\)
Конвертировать объем 9. 345 кварты в литры.
345 кварты в литры.
- Ответить
-
8,844 л
Помимо простого преобразования единиц измерения, метод меток факторов может использоваться для решения более сложных задач, связанных с вычислениями. Независимо от деталей, основной подход один и тот же — все коэффициенты , участвующие в вычислении, должны быть соответствующим образом ориентированы, чтобы гарантировать, что их метки (единицы) будут надлежащим образом сокращаться и/или объединяться для получения желаемой единицы в результате. .Вот почему он называется методом факторной метки. По мере продолжения изучения химии у вас будет много возможностей применить этот подход.
Пример \(\PageIndex{2}\): вычисление величин по результатам измерений
Какова плотность обычного антифриза в единицах г/мл? Образец антифриза объемом 4,00 кварты весит 9,26 фунта.
Раствор
Поскольку \(\mathrm{density=\dfrac{mass}{volume}}\), нам нужно разделить массу в граммах на объем в миллилитрах. 3\:мл}=1,11\: г/мл}\без числа\]
3\:мл}=1,11\: г/мл}\без числа\]
В качестве альтернативы расчет можно настроить таким образом, чтобы последовательно использовать три коэффициента преобразования единиц измерения следующим образом:
\[\ mathrm{\dfrac{9,26\:\cancel{lb}}{4,00\:\cancel{qt}}\times\dfrac{453,59\: g}{1\:\cancel{lb}}\times \dfrac{1,0567\:\cancel{qt}}{1\:\cancel{L}}\times\dfrac{1\:\cancel{L}}{1000\: мл}=1,11\: г/мл} \номер\]
Упражнение \(\PageIndex{2}\)
Чему равен объем 1000 унций в литрах, если 1 л = 1.{-2}\:L}\)
Пример \(\PageIndex{3}\): вычисление величин по результатам измерений
Во время поездки из Филадельфии в Атланту на расстояние около 1250 км Lamborghini Aventador Roadster 2014 года потребляет 213 литров бензина.
- Какой (средний) расход топлива, в милях на галлон, получил родстер во время этой поездки?
- Если бензин стоит 3,80 доллара за галлон, сколько стоило топливо для этой поездки?
Раствор
(a) Сначала мы преобразуем расстояние из километров в мили:
\[\mathrm{1250\: км\раз\dfrac{0. 62137\: ми}{1\: км}=777\: ми}\номер\]
62137\: ми}{1\: км}=777\: ми}\номер\]
, а затем перевести объем из литров в галлоны:
\[\mathrm{213\:\cancel{L}\times\dfrac{1.0567\:\cancel{qt}}{1\:\cancel{L}}\times\dfrac{1\: gal}{4 \:\cancel{qt}}=56.3\: галлон}\номер\]
Затем,
\[\mathrm{(среднее)\: пробег=\dfrac{777\: миль}{56,3\: галлон}=13,8\: миль/галлон=13,8\: миль на галлон}\номер\]
В качестве альтернативы расчет можно настроить таким образом, чтобы все коэффициенты преобразования использовались последовательно, как показано ниже:
\[\mathrm{\dfrac{1250\:\cancel{km}}{213\:\cancel{L}}\times\dfrac{0.62137\: mi}{1\:\cancel{км}}\times\dfrac{1\:\cancel{L}}{1.0567\:\cancel{qt}}\times\dfrac{4\:\cancel{ qt}}{1\: gal}=13,8\: mpg}\nonumber \]
(b) Используя ранее рассчитанный объем в галлонах, находим:
\[\mathrm{56,3\: галлон\раз\dfrac{$3,80}{1\: галлон}=$214}\номер \]
Упражнение \(\PageIndex{3}\)
Автомобиль Toyota Prius Hybrid использует 59,7 л бензина для поездки из Сан-Франциско в Сиэтл на расстояние 1300 км (две значащие цифры).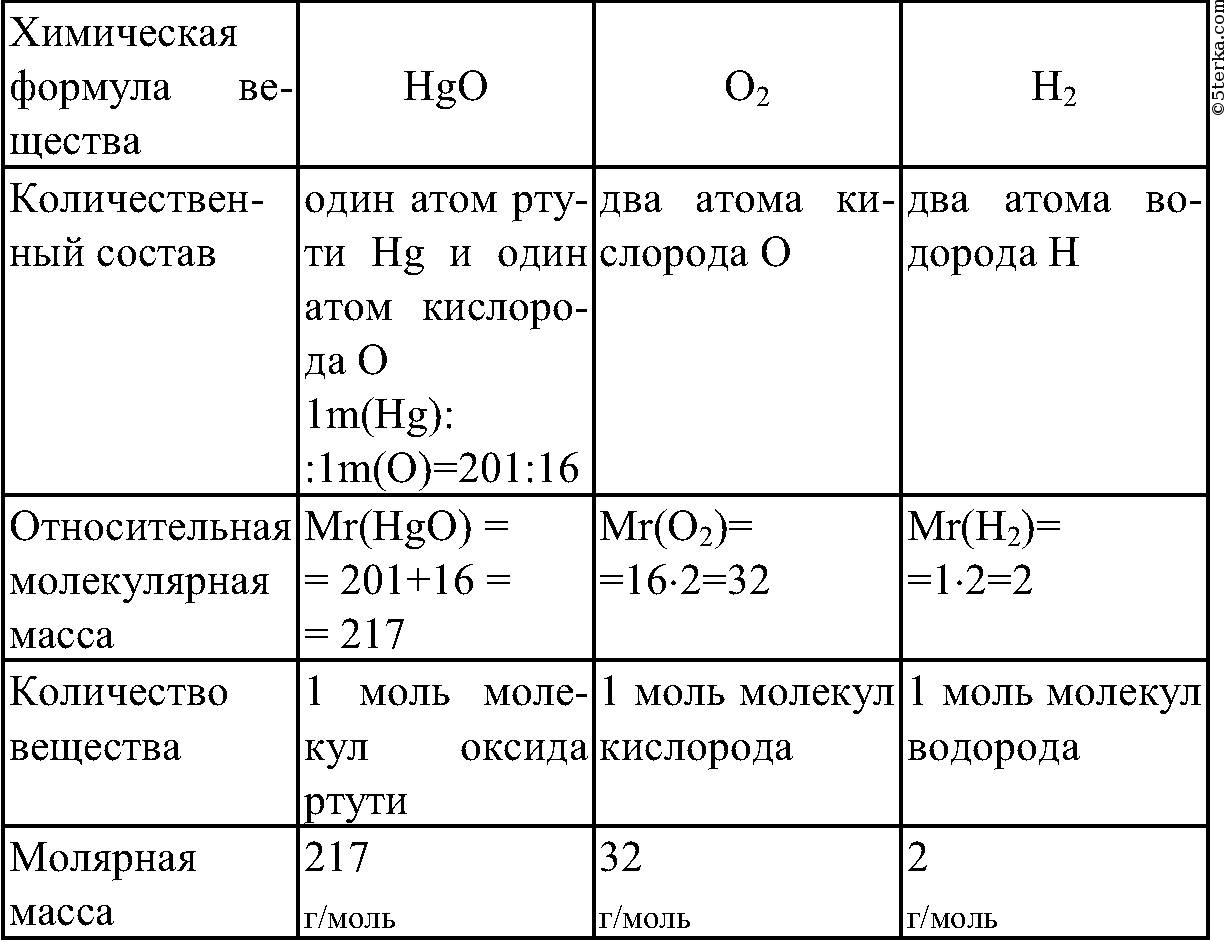
- Какой (средний) расход топлива, в милях на галлон, получил Prius во время этой поездки?
- Если бензин стоит 3 доллара.90 за галлон, сколько стоило топливо для этой поездки?
- Ответить на
-
51 миль на галлон
- Ответ б
-
$62
Преобразование единиц измерения: https://youtu.be/wSaOh58k8Wg
Преобразование единиц измерения температуры
Мы используем слово «температура» для обозначения тепла или холода вещества. Одним из способов измерения изменения температуры является использование того факта, что большинство веществ расширяются при повышении их температуры и сжимаются при понижении температуры.Ртуть или спирт в обычном стеклянном термометре меняют свой объем при изменении температуры. Поскольку объем жидкости изменяется больше, чем объем стакана, мы можем видеть, как жидкость расширяется при нагревании и сжимается при охлаждении.
Чтобы отметить шкалу термометра, нам нужен набор эталонных значений: Два наиболее часто используемых значения — это температура замерзания и кипения воды при заданном атмосферном давлении. По шкале Цельсия 0 °С соответствует температуре замерзания воды, а 100 °С — температуре кипения воды.Пространство между двумя температурами разделено на 100 равных интервалов, которые мы называем градусами. По шкале Фаренгейта точка замерзания воды определяется как 32 ° F, а температура кипения — как 212 ° F. Пространство между этими двумя точками на термометре Фаренгейта разделено на 180 равных частей (градусов).
Определение температурных шкал Цельсия и Фаренгейта, как описано в предыдущем абзаце, приводит к несколько более сложной взаимосвязи между значениями температуры по этим двум шкалам, чем для разных единиц измерения других свойств.Большинство единиц измерения для данного свойства прямо пропорциональны друг другу (y = mx). Используя знакомые единицы длины в качестве примера:
\[\mathrm{длина\: дюймы\: футы=\влево(\dfrac{1\: футы}{12\: дюймы}\справа)\умножить на длину\: дюймы\: дюймы}\]
где
- y = длина в футах,
- x = длина в дюймах и
- константа пропорциональности, m, является коэффициентом преобразования.
 \circ F}+32)}\]
\circ F}+32)}\]
Как упоминалось ранее в этой главе, единицей измерения температуры в системе СИ является кельвин (К).В отличие от шкал Цельсия и Фаренгейта, шкала Кельвина представляет собой абсолютную температурную шкалу, в которой 0 (ноль) К соответствует самой низкой температуре, которая теоретически может быть достигнута. Открытие в начале 19 века зависимости между объемом газа и температурой показало, что объем газа будет равен нулю при -273,15 ° C. В 1848 году британский физик Уильям Томпсон, позже принявший титул лорда Кельвина, предложил абсолютную температурную шкалу, основанную на этой концепции (дальнейшее рассмотрение этой темы содержится в главе этого текста, посвященной газам).\ circ C} = T _ {\ ce K} -273,15 \]
Число 273,15 в этих уравнениях определено экспериментально, поэтому оно неточно. На рисунке \(\PageIndex{1}\) показано соотношение между тремя температурными шкалами. Напомним, что мы не используем знак градуса при температурах по шкале Кельвина.
 \circ C}+273.2\,K\hspace{20px}(два\:значащие\:цифры)}\номер\]
\circ C}+273.2\,K\hspace{20px}(два\:значащие\:цифры)}\номер\] Упражнение \(\PageIndex{5}\)
Преобразование 50 °F в °C и K.
- Ответить
-
10 °С, 280 К
Единицы измерения температуры: https://youtu.be/DTPo0HDMz3o
Резюме
Измерения производятся с использованием различных единиц измерения. Часто бывает полезно или необходимо преобразовать измеренную величину из одних единиц в другие. Эти преобразования выполняются с использованием коэффициентов преобразования единиц измерения, которые получаются путем простого применения математического подхода, называемого методом факторной метки или размерным анализом.\circ C}=\ce K-273.15\)
Глоссарий
- анализ размеров
- (также метод метки фактора) универсальный математический подход, который можно применять к вычислениям, начиная от простых преобразований единиц измерения и заканчивая более сложными многоэтапными вычислениями, включающими несколько различных величин
- по Фаренгейту
- единица измерения температуры; вода замерзает при 32 °F и кипит при 212 °F по этой шкале
- коэффициент пересчета единиц измерения
- отношение эквивалентных величин, выраженное в разных единицах измерения; используется для преобразования одной единицы измерения в другую единицу измерения
Авторы и авторство
%PDF-1. 7
%
3008 0 объект
>
эндообъект
внешняя ссылка
3008 82
0000000016 00000 н
0000004624 00000 н
0000004859 00000 н
0000004896 00000 н
0000008046 00000 н
0000008161 00000 н
0000008280 00000 н
0000008437 00000 н
0000008486 00000 н
0000008515 00000 н
0000008554 00000 н
0000009454 00000 н
0000009987 00000 н
0000010346 00000 н
0000010795 00000 н
0000010908 00000 н
0000011515 00000 н
0000011772 00000 н
0000012217 00000 н
0000012890 00000 н
0000013451 00000 н
0000013702 00000 н
0000014147 00000 н
0000014513 00000 н
0000014617 00000 н
0000014703 00000 н
0000015383 00000 н
0000016267 00000 н
0000016973 00000 н
0000017770 00000 н
0000017904 00000 н
0000017933 00000 н
0000018264 00000 н
0000018968 00000 н
0000019631 00000 н
0000020269 00000 н
0000022636 00000 н
0000023375 00000 н
0000028397 00000 н
0000059658 00000 н
0000059852 00000 н
0000060116 00000 н
0000060504 00000 н
0000060892 00000 н
0000072016 00000 н
0000072105 00000 н
0000072161 00000 н
0000095211 00000 н
0000095282 00000 н
0000097932 00000 н
0000100185 00000 н
0000102438 00000 н
0000116362 00000 н
0000119624 00000 н
0000120012 00000 н
0000120111 00000 н
0000120268 00000 н
0000120376 00000 н
0000120486 00000 н
0000120874 00000 н
0000121266 00000 н
0000121388 00000 н
0000121545 00000 н
0000121662 00000 н
0000142545 00000 н
0000142586 00000 н
0000143775 00000 н
0000143816 00000 н
0000144197 00000 н
0000144296 00000 н
0000144445 00000 н
0000144602 00000 н
0000144694 00000 н
0000144793 00000 н
0000144950 00000 н
0000145042 00000 н
0000145141 00000 н
0000145298 00000 н
0000147091 00000 н
0000209582 00000 н
0000004397 00000 н
0000001974 00000 н
трейлер
]/Предыдущая 4699344/XRefStm 4397>>
startxref
0
%%EOF
3089 0 объект
>поток
ч, Wkp{%{ҮJfjC4I
+%ٲe)5/!0㆔$yhm(4N 3̴ә6tѳ+۲WF|;|JQAM:P=j@Fpw;Y4owVcbjZiMYaWn'{V|tC3{m#>6n=+îsgv@˷@^-Kĉ/l7Pbʭ >Rx[͏|4{̊kyOM?sONLG4Earcgm&fԐ%7vԘIvw9hl*OWlta7)df;lNpmF
~Wj)B_VEru4X4lDY];
7
%
3008 0 объект
>
эндообъект
внешняя ссылка
3008 82
0000000016 00000 н
0000004624 00000 н
0000004859 00000 н
0000004896 00000 н
0000008046 00000 н
0000008161 00000 н
0000008280 00000 н
0000008437 00000 н
0000008486 00000 н
0000008515 00000 н
0000008554 00000 н
0000009454 00000 н
0000009987 00000 н
0000010346 00000 н
0000010795 00000 н
0000010908 00000 н
0000011515 00000 н
0000011772 00000 н
0000012217 00000 н
0000012890 00000 н
0000013451 00000 н
0000013702 00000 н
0000014147 00000 н
0000014513 00000 н
0000014617 00000 н
0000014703 00000 н
0000015383 00000 н
0000016267 00000 н
0000016973 00000 н
0000017770 00000 н
0000017904 00000 н
0000017933 00000 н
0000018264 00000 н
0000018968 00000 н
0000019631 00000 н
0000020269 00000 н
0000022636 00000 н
0000023375 00000 н
0000028397 00000 н
0000059658 00000 н
0000059852 00000 н
0000060116 00000 н
0000060504 00000 н
0000060892 00000 н
0000072016 00000 н
0000072105 00000 н
0000072161 00000 н
0000095211 00000 н
0000095282 00000 н
0000097932 00000 н
0000100185 00000 н
0000102438 00000 н
0000116362 00000 н
0000119624 00000 н
0000120012 00000 н
0000120111 00000 н
0000120268 00000 н
0000120376 00000 н
0000120486 00000 н
0000120874 00000 н
0000121266 00000 н
0000121388 00000 н
0000121545 00000 н
0000121662 00000 н
0000142545 00000 н
0000142586 00000 н
0000143775 00000 н
0000143816 00000 н
0000144197 00000 н
0000144296 00000 н
0000144445 00000 н
0000144602 00000 н
0000144694 00000 н
0000144793 00000 н
0000144950 00000 н
0000145042 00000 н
0000145141 00000 н
0000145298 00000 н
0000147091 00000 н
0000209582 00000 н
0000004397 00000 н
0000001974 00000 н
трейлер
]/Предыдущая 4699344/XRefStm 4397>>
startxref
0
%%EOF
3089 0 объект
>поток
ч, Wkp{%{ҮJfjC4I
+%ٲe)5/!0㆔$yhm(4N 3̴ә6tѳ+۲WF|;|JQAM:P=j@Fpw;Y4owVcbjZiMYaWn'{V|tC3{m#>6n=+îsgv@˷@^-Kĉ/l7Pbʭ >Rx[͏|4{̊kyOM?sONLG4Earcgm&fԐ%7vԘIvw9hl*OWlta7)df;lNpmF
~Wj)B_VEru4X4lDY];
Гидраты: определение химической формулы на основе эмпирических данных — видео и расшифровка урока
Шаги для нахождения формулы гидрата
Вот шаги для нахождения формулы гидрата:
- Определите массу воды, выделившейся из соединения.
 Это позволяет определить массу воды, которая была в гидрате, и массу безводного. Мы делаем это, вычитая массу безводного из массы гидрата. Это равно массе воды.
Это позволяет определить массу воды, которая была в гидрате, и массу безводного. Мы делаем это, вычитая массу безводного из массы гидрата. Это равно массе воды. - Перевести массу воды в моли. Для этого мы делим массу воды на молярную массу воды, чтобы получить моли воды. Помните, что единицами измерения молярной массы являются г/моль. Когда мы делим массу (в г) на молярную массу (г/моль), граммы сокращаются, и у нас остаются моли.
- Переведите массу оставшегося ангидрида в моли. Для этого разделим массу ангидрида на молярную массу ангидрида, чтобы получить количество молей ангидрида.
- Найдите молярное отношение воды к безводному. Как правило, у вас будет больше воды, чем безводного, поэтому разделите количество молей воды на количество молей безводного. Это дает вам ваше молярное отношение (примечание к этому шагу: если ваши расчеты дают вам число, очень близкое к целому числу, обычно безопасно округлить до ближайшего целого числа.Если ваше число имеет десятичную дробь, близкую к 0,33, 0,5 или 0,66, вам нужно найти наименьшее общее кратное этого числа, которое является целым числом, и применить его ко всей формуле).
- Используйте молярное отношение, чтобы написать формулу.
Давайте посмотрим, как эти шаги работают на примере задачи:
Нагрели 210,4 г гидрата английской соли, MgSO4 n h3 O, высвободили воду, и конечная масса ангидрида составила 120,4 г. Какова формула этого гидрата?
- Определите массу воды, вышедшей из комплекса.Возьмите массу гидрата и вычтите из нее массу ангидрида, чтобы получить массу воды. 210,4 г MgSO4 n ч3 O — 120,4 г MgSO4 = 90 г ч3 O.
- Перевести массу воды в моли. Масса воды / молярная масса воды = моли воды. 90 г h3 O / (18 г/моль h3 O) = 5 моль h3 O.
- Переведите массу оставшегося ангидрида в моли. Масса безводного / молярная масса безводного = моли безводного. 120,4 г MgSO4 / (120,4 г/моль MgSO4) = 1 моль MgSO4.
- Найдите молярное отношение воды к безводному. Разделите количество молей воды на количество молей ангидрида, чтобы получить молярное соотношение. 5 молей h3O / 1 моль MgSO4 = 5:1.

- Используйте молярное отношение, чтобы написать формулу. Так как на каждый 1 моль MgSO4 приходится 5 молей h3O, формула MgSO4 5h3
Первый пример
Готовы к другому примеру? Вы можете сделать паузу в любой момент, чтобы сделать свои собственные вычисления:
Гидрат карбоната натрия, Na2CO3 n h3O, изначально содержит 17.70 г. После нагревания его конечная масса составляет 15,10 г. Какова его формула?
- Возьмите массу гидрата и вычтите массу безводного, чтобы получить массу воды. 17,70 г Na2 CO3 n h3 O — 15,10 г Na2 CO3 = 2,60 г h3 O.
- Разделите массу воды на молярную массу воды, чтобы получить количество молей воды. 2,60 г h3 O / (18,00 г/моль h3 O) = 0,144 моль h3 O.
- Разделите массу ангидрида на молярную массу ангидрида, чтобы получить количество молей ангидрида.15,1 г Na2CO3/(106 г/моль Na2CO3) = 0,142 моля Na2CO3.
- Разделите количество молей воды на количество молей ангидрида, чтобы получить молярное отношение.
 0,144 моль ч3О / 0,142 моль Na2CO3 = 1,01:1. Это безопасно округлить до соотношения 1:1.
0,144 моль ч3О / 0,142 моль Na2CO3 = 1,01:1. Это безопасно округлить до соотношения 1:1. - Используйте молярное отношение, чтобы написать формулу. Поскольку на каждый 1 моль Na2CO3 приходится только 1 моль h3O, мольное соотношение равно 1:1 и формула Na2CO3h3O.
Второй пример
Давайте попробуем пример, с которым вы можете столкнуться в лабораторных условиях.Вот мы в лаборатории после обезвоживания некоторых солей хлорида железа (III). Теперь пришло время для анализа данных. Мы хотим определить формулу гидрата хлорида железа (III) FeCl3 n h3 O. Посмотрим на наши данные:
- Масса пустой чашки, используемой для взвешивания = 2,5 г
- Масса чашки и образца до нагревания = 7,4 г
- Масса чашки и образца после нагревания = 5,4 г
Какова формула нашего гидрата? Чтобы решить эту проблему, мы можем использовать те же шаги, что и в предыдущем примере.На этот раз, однако, мы должны вычесть массу нашей чашки для взвешивания из массы нашего образца до и после нагревания.
Масса гидрата = масса чашки, а пробы до нагревания — масса пустой чашки. 7,4 г — 2,5 г = 4,9 г, масса нашего гидрата.
Масса ангидрида = масса чашки, а пробы после нагревания — масса пустой чашки. 5,4 г — 2,5 г = 2,9 г, масса ангидрида.
Масса воды = масса гидрата — масса безводного.4,9 г — 2,9 г = 2,0 г воды.
Моль воды = масса воды / молярная масса воды. 2,0 г h3O / (18 г/моль h3O) = 0,11 моль h3O.
Моль безводного = масса безводного / молярная масса безводного. 2,9 г FeCl3/(162 г/моль FeCl3) = 0,018 моль FeCl3.
Молярное соотношение — это все, что нам осталось определить. Мольное отношение = моль воды / моль безводного. 0,11 моль ч3О / 0,018 моль FeCl3 = 6,1:1. 6,1 очень близко к 6, поэтому округление в меньшую сторону безопасно. Мы назовем это 6.Поскольку на каждый 1 хлорид железа (III) приходится 6 вод, соотношение составляет 6:1. Формула нашего гидрата: FeCl3 6h3 O.
Резюме урока
Гидрат — это соединение, содержащее воду с определенной массой в форме h3 O. Ангидрат — это гидрат, потерявший молекулы воды. . Определение формулы гидрата означает открытие количества молекул воды, содержащихся в веществе. Этапы определения формулы для экспериментальных данных просты:
Ангидрат — это гидрат, потерявший молекулы воды. . Определение формулы гидрата означает открытие количества молекул воды, содержащихся в веществе. Этапы определения формулы для экспериментальных данных просты:
- Определите массу воды, которая была удалена из соединения .
- Перевести массу воды в моли
- Перевести массу оставшегося ангидрида в моли
- Найти молярное отношение воды к безводному
- Используйте молярное отношение, чтобы записать формулу
Результаты обучения
После завершения этого урока уделите несколько минут:
- Сравните гидрат и безвод
- Перечислить этапы определения формулы гидрата
- Анализ двух связанных примеров
10.6. Задача химического уравнения — создание и запуск документации курса Open edX
Примечание
EdX не поддерживает этот тип проблемы.
Тип задачи с химическим уравнением позволяет учащемуся вводить текст, который
представляет химическое уравнение в текстовом поле. Система преобразует этот текст
в химическое уравнение под текстовым полем. Оценщик оценивает
ответ учащегося с помощью скрипта Python, который вы создаете и встраиваете в
проблема.
Система преобразует этот текст
в химическое уравнение под текстовым полем. Оценщик оценивает
ответ учащегося с помощью скрипта Python, который вы создаете и встраиваете в
проблема.
Примечание
Вы можете сделать калькулятор доступным для учащихся на каждом уроке. страница блока.Дополнительные сведения см. в разделе Инструмент калькулятора.
Проблемы с химическими уравнениями используют MathJax для создания формул. Для большего информацию об использовании MathJax в Studio см. в разделе Использование MathJax для математики.
Чтобы создать описанную выше химическую задачу, выполните следующие действия.
-
В подразделении, где вы хотите создать проблему, выберите Проблема в разделе Добавить новый компонент , а затем выберите вкладку Дополнительно .
-
Выберите Пустая расширенная проблема .
-
В появившемся компоненте выберите Edit .
 -\)
<пользовательский ответ>
-\)
<пользовательский ответ>
<тип ответа="loncapa/python"> если хим.-

 Внимательно слушают учителя.
Внимательно слушают учителя. Как вы понимает слово эмпирический?
Как вы понимает слово эмпирический?

 Применяем формулу (1)
Применяем формулу (1)



 Орг. этап
Орг. этап Сnh3n+2
Сnh3n+2
 (
АхВу)
= М(АхВу)/2
(
АхВу)
= М(АхВу)/2 Алгебраическое выражение состоит из переменных, приравненных друг к другу с помощью знака равенства «=», оно называется уравнением. Уравнение со степенью один называется линейным уравнением. Математические знания обычно применяются с помощью текстовых задач, и для решения таких текстовых задач наблюдается широкое применение линейных уравнений.Вот подробное обсуждение приложений линейных уравнений и их соответствия реальному миру.
Алгебраическое выражение состоит из переменных, приравненных друг к другу с помощью знака равенства «=», оно называется уравнением. Уравнение со степенью один называется линейным уравнением. Математические знания обычно применяются с помощью текстовых задач, и для решения таких текстовых задач наблюдается широкое применение линейных уравнений.Вот подробное обсуждение приложений линейных уравнений и их соответствия реальному миру. 




 теперь оптимизировано для iOS 8, а также для новейших моделей iPhone и iPad.
теперь оптимизировано для iOS 8, а также для новейших моделей iPhone и iPad. 
 Доктор Хасэгава специализируется на обучении студентов сложным научным концепциям. Он имеет степень бакалавра в области биохимии, степень магистра в области образования и сертификат преподавателя Калифорнийского университета в Дэвисе. Он получил докторскую степень в области учебных программ и инструкций в Орегонском университете. Прежде чем стать профессором, доктор Хасэгава проводил биохимические исследования в области нейрофармакологии в Национальном институте здравоохранения.Он также преподавал физику и науки о жизни и работал учителем и администратором в государственных школах Калифорнии, Орегона и Аризоны. Эта статья была просмотрена 165 824 раза.
Доктор Хасэгава специализируется на обучении студентов сложным научным концепциям. Он имеет степень бакалавра в области биохимии, степень магистра в области образования и сертификат преподавателя Калифорнийского университета в Дэвисе. Он получил докторскую степень в области учебных программ и инструкций в Орегонском университете. Прежде чем стать профессором, доктор Хасэгава проводил биохимические исследования в области нейрофармакологии в Национальном институте здравоохранения.Он также преподавал физику и науки о жизни и работал учителем и администратором в государственных школах Калифорнии, Орегона и Аризоны. Эта статья была просмотрена 165 824 раза.
