Сайт учителя химии Сай Н.С. — My Chemistry AcadeMy
«Учитель — человек, который может делать трудные вещи легкими.»
Ральф Уолдо Эмерсон
Незаметно проходит время, меняются дети, меняются родители, меняется само общество и отношения между людьми. Но неизменной остаётся роль учителя, который понимает, что в любом времени надо учить детей.Каким же всё-таки должен быть современный учитель?
Хороший учитель должен любить свое дело, любить детей, именно это поможет ему справиться с трудностями в профессиональной деятельности. Основная миссия учителя- делать трудные вещи легкими. Современный учитель не только должен идти в ногу со временем, он должен работать на будущее. Будущее своих учеников.
Я работаю учителем химии в МАОУ СОШ №22 с углубленным изучением отдельных предметов города Тамбова, аттестована на высшую квалификационную категорию.
 Самовыражению личности в учебно-познавательном процессе способствует создание ситуаций творческой активности. Ничто не заменит ребёнку наслаждения от собственного творчества, которое доставляет радость, стимулирует процесс мышления, способствует удовлетворению эстетических потребностей и показывает внутреннюю красоту познания. Главное для нашего времени – научить детей учиться.
Самовыражению личности в учебно-познавательном процессе способствует создание ситуаций творческой активности. Ничто не заменит ребёнку наслаждения от собственного творчества, которое доставляет радость, стимулирует процесс мышления, способствует удовлетворению эстетических потребностей и показывает внутреннюю красоту познания. Главное для нашего времени – научить детей учиться.
ОГЭ (вопросы). Электролиты и неэлектролиты. Катионы и анионы
Вопрос 1.
Как называются положительно заряженные ионы?
Показать ответОтвет: катионы (ионами называются как катионы (+), так и анионы (–))
Вопрос 2.
Что такое электролиты и какие соединения относятся к сильным и слабым электролитам?
Показать ответОтвет: Электролиты – это вещества, расплавы или водные растворы которых проводят электрический ток. Сильные электролиты: щелочи (NaOH и др.), сильные кислоты (HNO ). Слабые электролиты: нерастворимые основания (Cu(OH)2 и др.), слабые кислоты (H2S и др.).
). Слабые электролиты: нерастворимые основания (Cu(OH)2 и др.), слабые кислоты (H2S и др.).
Вопрос 3.
Приведите примеры соединений, не являющихся электролитами.
Показать ответОтвет: оксиды, большинство органических соединений (этиловый спирт, глицерин, сахароза, глюкоза, C2H4 и др.), простые вещества неметаллы, например, расплав серы или фосфора.
Вопрос 4.
Сколько молей ионов образуется в результате диссоциации 2 моль сульфита натрия?
Показать ответОтвет: 6, так как Na2SO3 → 2Na+ + SO32–. Складываем коэффициенты перед Na+ и SO3 2–, получаем 3 моль. Так как изначально было взято 2 моль Na2SO3, результат умножаем на 2.
Вопрос 5.
Какие соединения нужно расписывать на ионы в полном ионном уравнении химической реакции, протекающей в водном растворе?
Показать ответОтвет: только сильные электролиты, т. е. щелочи (NaOH и др.), сильные кислоты (HNO3 и др.), хорошо растворимые соли (NaCl и др.). Такие соединения как оксиды, нерастворимые кислоты, нерастворимые основания, нерастворимые соли и слабые кислоты на ионы не расписываются.
е. щелочи (NaOH и др.), сильные кислоты (HNO3 и др.), хорошо растворимые соли (NaCl и др.). Такие соединения как оксиды, нерастворимые кислоты, нерастворимые основания, нерастворимые соли и слабые кислоты на ионы не расписываются.
Вопрос 6.
В растворе сульфата аммония находится 0,6 моль положительных ионов. Количество отрицательных ионов в этом растворе равно ___ .
Показать ответОтвет: 0.3 моль, так как (NH4)2SO4 → 2 NH4+ + SO42–. Видим, что коэффициент перед SO
Вопрос 7.
В водном растворе какого из соединений из одного моля образуется больше всего ионов водорода: HCl, H2SO4, H2S, HNO3?
Показать ответОтвет: H2SO4 (H2S не подходит, так как это слабый электролит и ионов водорода в растворе образуется очень мало).
Теория электролитической диссоциации (ТЭД) — что это такое? Основные положения и примеры
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы.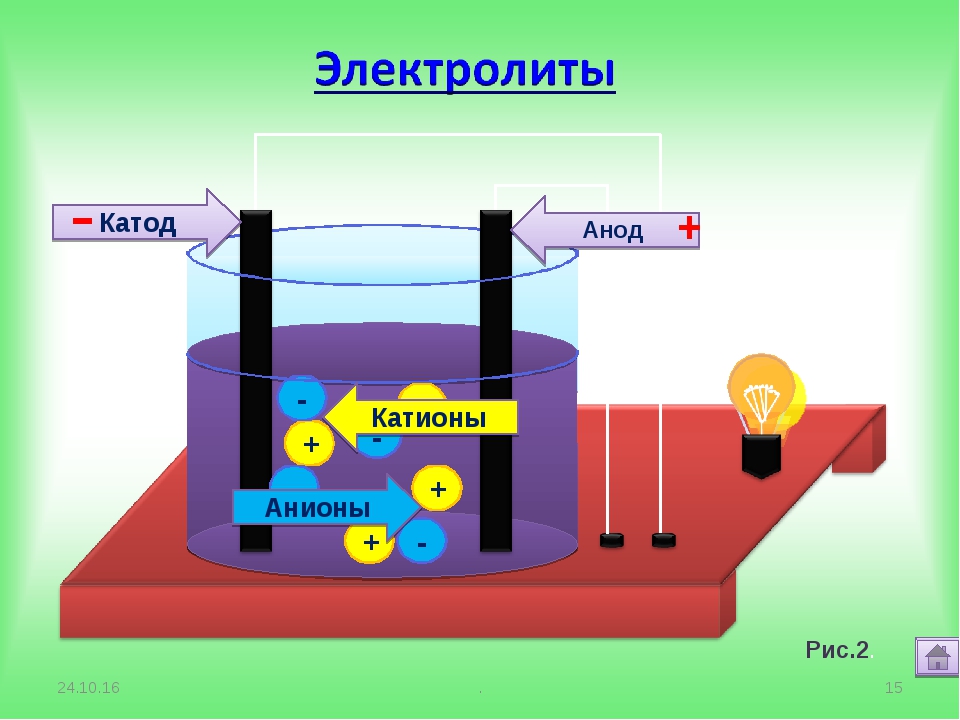 Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K+ (катион) + A— (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na+ + Cl—.
Говорите правильно 🤓
Иногда можно встретить выражение «теория электрической диссоциации», но так говорить не стоит. В этом случае можно подумать, что распад молекул на ионы обусловлен действием электротока. На самом деле процесс диссоциации не зависит от того, проходит ток в данный момент через раствор или нет.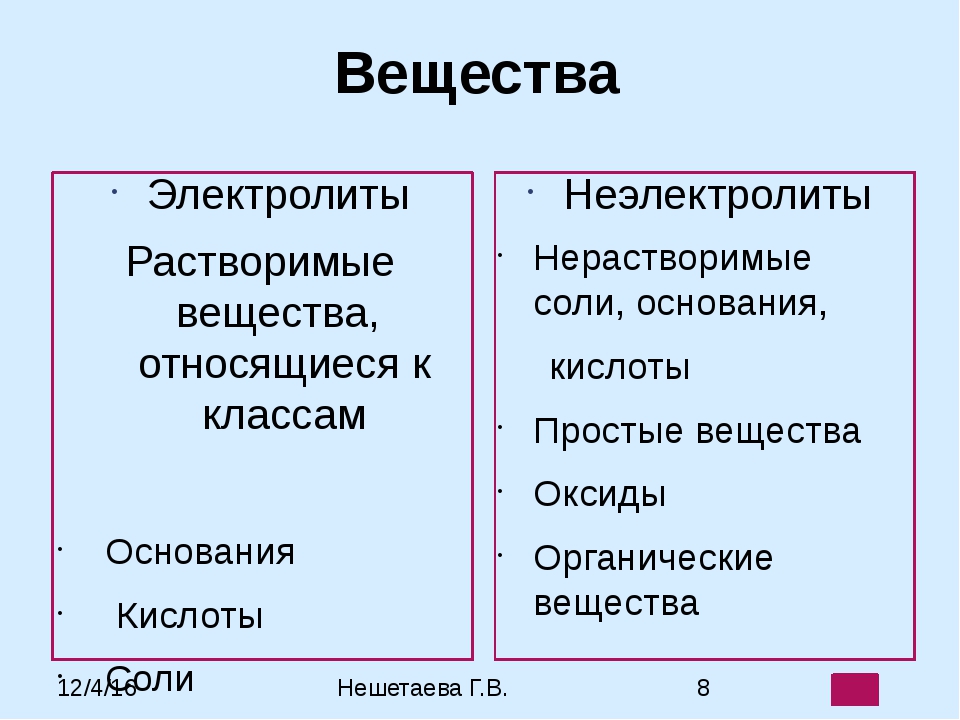 Все, что нужно — это контакт электролита с водой (растворителем).
Все, что нужно — это контакт электролита с водой (растворителем).
Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na+ и анионами хлора Cl—, которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором.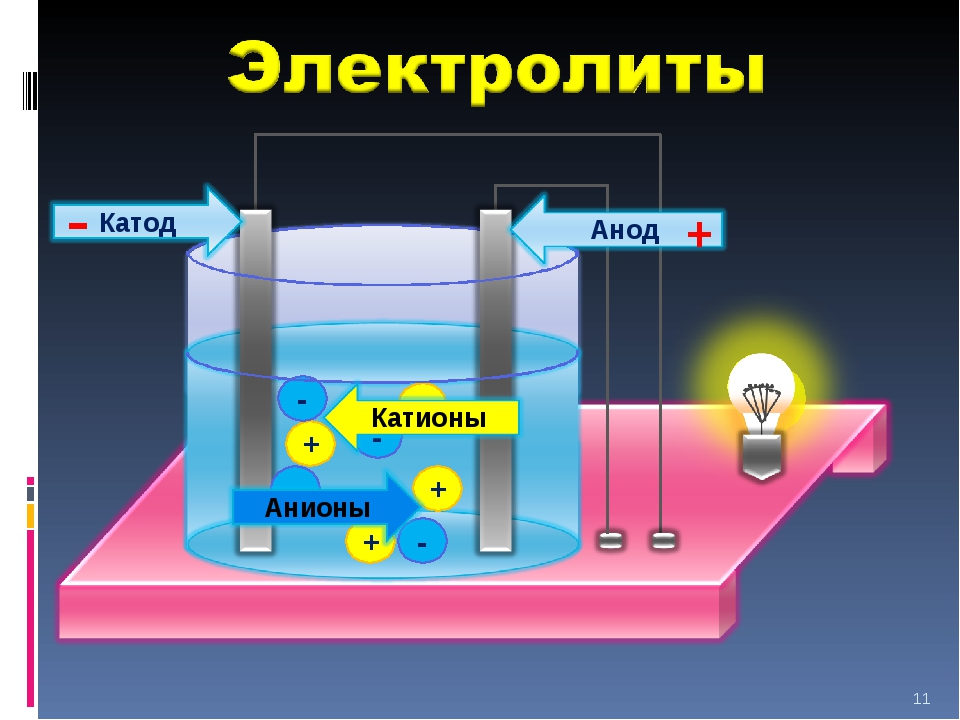 Вещество диссоциирует на ионы.
Вещество диссоциирует на ионы.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
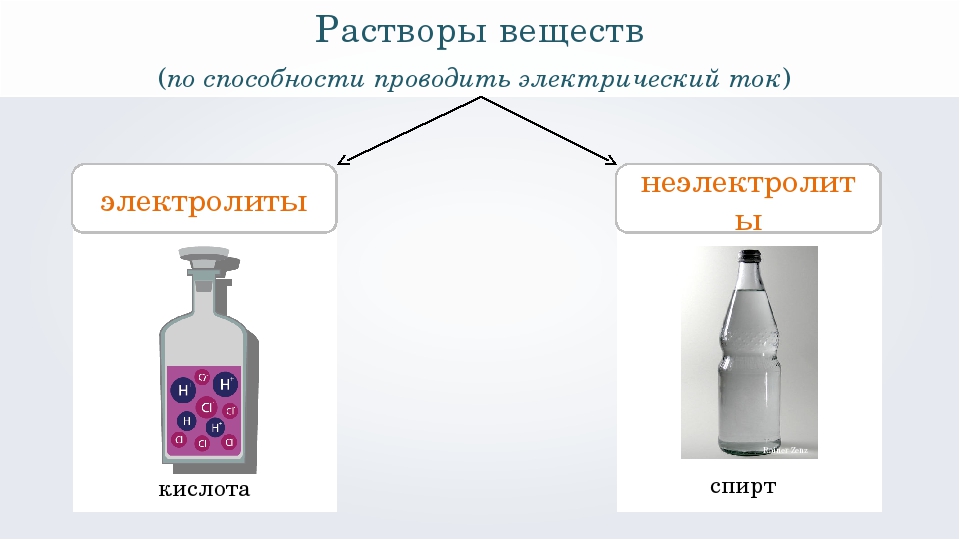
Электролиты и неэлектролиты
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток.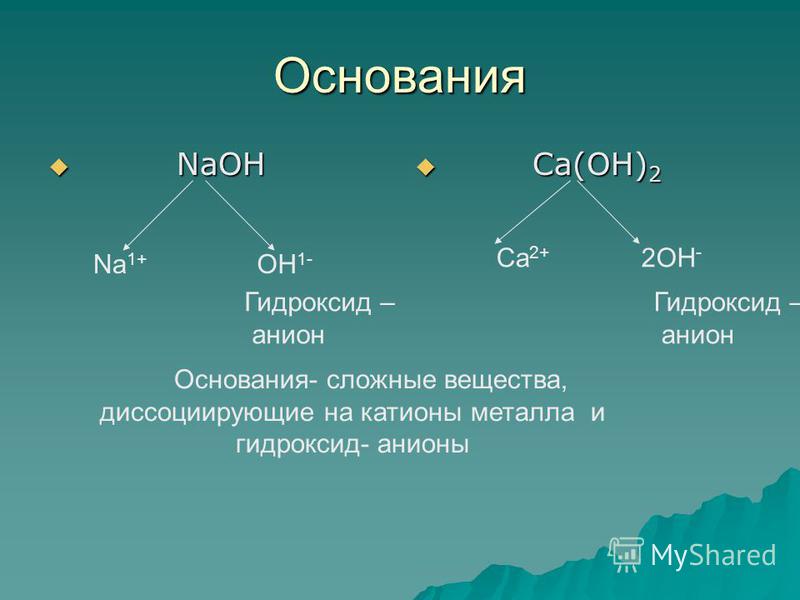
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
или .
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
слабые — ;
средние — ;
сильные — .
Важно!
Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
H3PO4 ⇄ H+ + H2PO4—
H2PO4— ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
Суммарное уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3— и слабый электролит, поэтому реакция обратима.
Ca(HCO3)2 = Ca2+ + 2HCO3—
HCO3— ⇄ H+ + CO32-
H+ + H2O = H3O+
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Как диссоциируют разные группы веществ
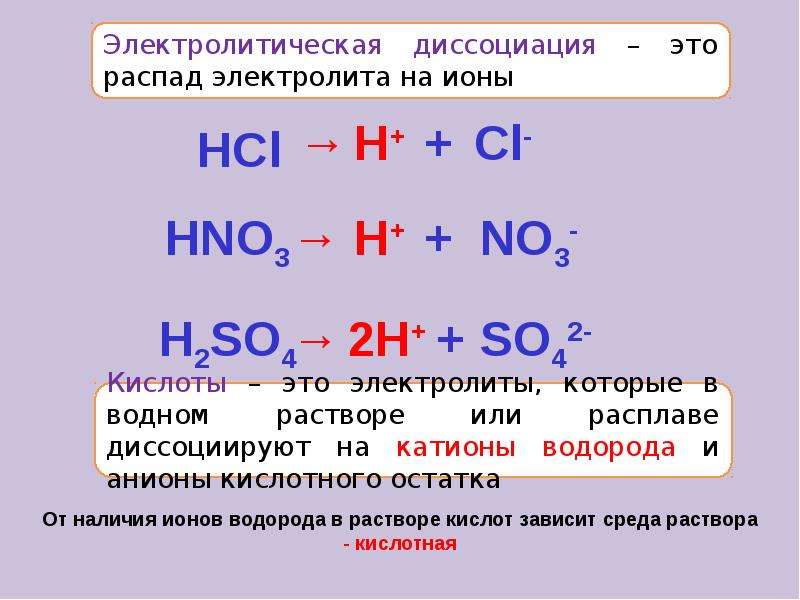
Диссоциация кислот
Приводит к образованию катионов водорода H+ и отрицательно заряженных кислотных остатков:
HCl = H+ + Cl—
H2SO4 = 2H+ + SO42-
HNO2 ⇄ H+ + NO2-
Многоосновные кислоты диссоциируют ступенчато:
AlOHCl2 = AlOH2+ + 2Cl—
AlOH2+ ⇄ Al3+ + OH—
Диссоциация оснований
Происходит с образованием гидроксильных групп OH— и положительно заряженных ионов металла.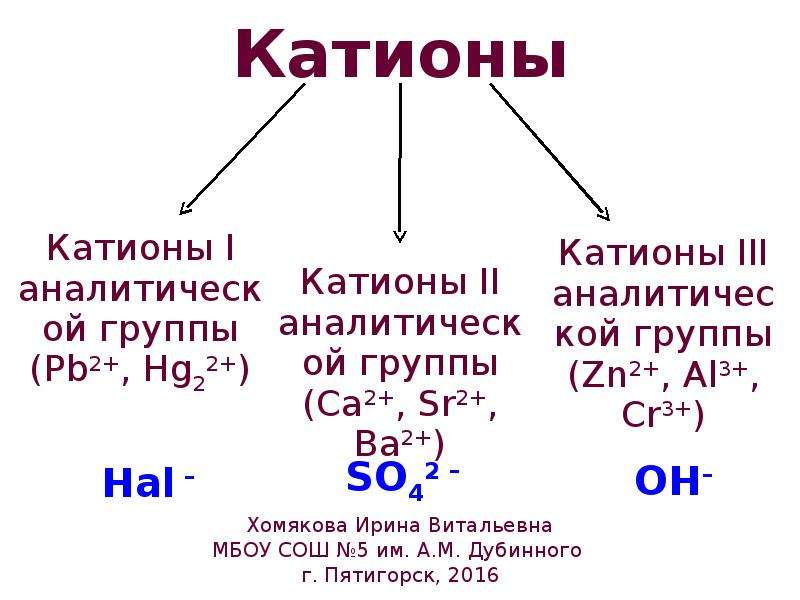 Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания:
NaOH = Na+ + OH—
Слабые основания:
Cu(ON)2 ⇄ CuOH+ + OH—
CuOH+ ⇄ Cu2+ + OH—
Диссоциация солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень.
Na3PO4 = 3Na + PO43-
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
KHSO4 = K+ + HSO4—
HSO4— ⇄ H+ + SO42-
Основные соли также диссоциируют в две ступени.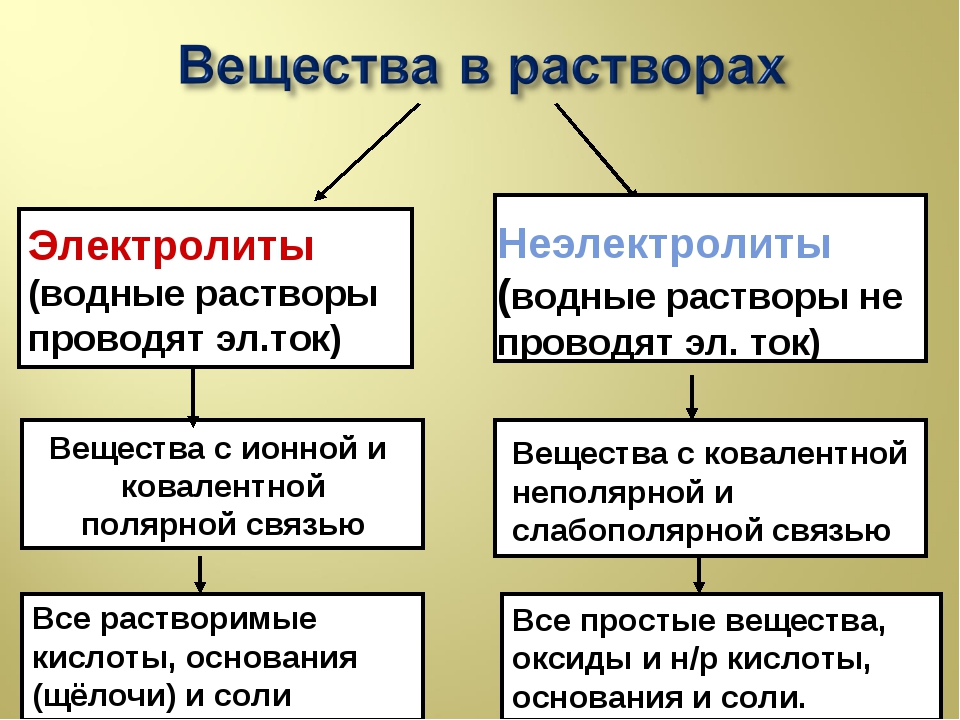 На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH—.
На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH—.
MgOHBr = MgOH+ + Br—
MgOH+ ⇄ Mg2+ + OH—
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Молекулярное уравнение: Pb(NO3)2 + H2SO4 → 2HNO3 + PbSO4↓
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb2+ + 2NO3— + 2H+ + SO42- → 2H+ + 2NO3— + PbSO4↓
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb2+ + SO42- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).
Основные положения теории электролитической диссоциации
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному.
 Раствор электролита обладает проводимостью.
Раствор электролита обладает проводимостью.Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.
Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
Согласно теории диссоциации что является причиной распада электролитов на ионы?
Что такое степень диссоциации и как она измеряется?
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
Какие компоненты ионного уравнения не раскладываются на ионы?
Разница между электролитами и неэлектролитами — Разница Между
Химические соединения можно разделить на две категории в зависимости от их способности проводить электричество через их водный раствор. Эти две категории — электролиты и неэлектролиты. Электролиты —
Эти две категории — электролиты и неэлектролиты. Электролиты —
Основное отличие — электролиты по сравнению с неэлектролитами
Химические соединения можно разделить на две категории в зависимости от их способности проводить электричество через их водный раствор. Эти две категории — электролиты и неэлектролиты. Электролиты — это химические соединения, которые могут растворяться в воде с образованием ионов. Эти ионы могут проводить электричество через раствор. Неэлектролиты — это химические соединения, которые не проводят электричество при растворении в воде. Это потому, что они не образуют ионы при растворении в воде. Основное различие между электролитами и неэлектролитами заключается в том, что электролиты могут ионизироваться при растворении в воде, тогда как неэлектролиты не могут ионизироваться при растворении в воде.
Ключевые области покрыты
1. Что такое электролиты
— Определение, объяснение электролитических свойств с примерами
2. Что такое неэлектролиты
Что такое неэлектролиты
— Определение, объяснение общих свойств с примерами
3. В чем разница между электролитами и неэлектролитами
— Сравнение основных различий
Ключевые слова: анионы, катионы, ковалентные соединения, электролиты, ионные соединения, ионизация, неэлектролиты.
Что такое электролиты
Электролиты — это химические соединения, которые могут растворяться в ионах при растворении в воде. Эти ионы могут проводить электричество через этот водный раствор. Чтобы распасться на ионы, электролит должен быть ионным соединением. Ионные соединения состоят из катионов и анионов.
При растворении в воде эти ионные соединения могут образовывать водные катионы и анионы. Эти ионы равномерно распределены по всему раствору. Тогда решение электрически нейтрально. Если на этот раствор подается электрический ток извне, ионы в растворе начинают двигаться. Катионы движутся к электроду, где плотность электронов высокая.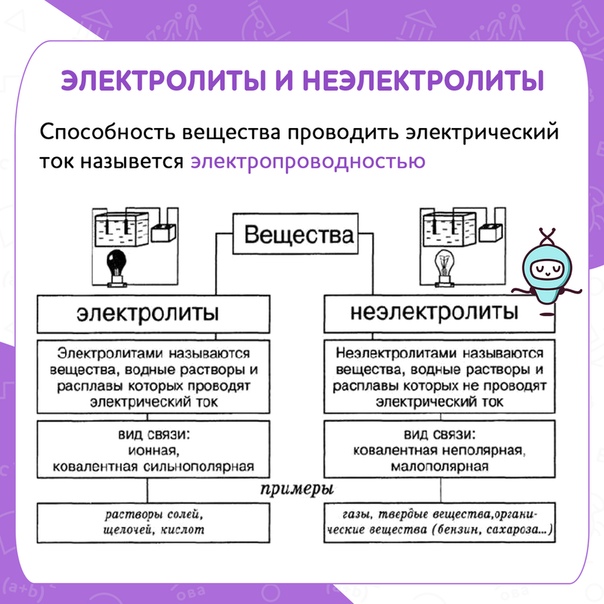 Анионы имеют тенденцию переходить на другой электрод. Это движение ионов производит электрический ток через раствор.
Анионы имеют тенденцию переходить на другой электрод. Это движение ионов производит электрический ток через раствор.
Существует два типа электролитов: сильные электролиты и слабые электролиты. Сильные электролиты полностью ионизируются в его ионы. В водном растворе сильного электролита нет нейтральных молекул. Слабые электролиты не полностью ионизируются в его ионы. Следовательно, в растворе также присутствуют некоторые нейтральные молекулы.
Рисунок 1: Электролиты используются в электрохимических методах
Сильные кислоты и сильные основания являются сильными электролитами, поскольку они могут полностью ионизироваться в воде. Соединение не обязательно должно полностью растворяться в воде, чтобы считаться сильным электролитом. Некоторые соединения частично растворяются в воде, но все же они являются сильными электролитами. Например, гидроксид стронция, Sr (OH)2 частично растворяется в воде. Но это сильный электролит, поскольку растворенное количество полностью ионизируется.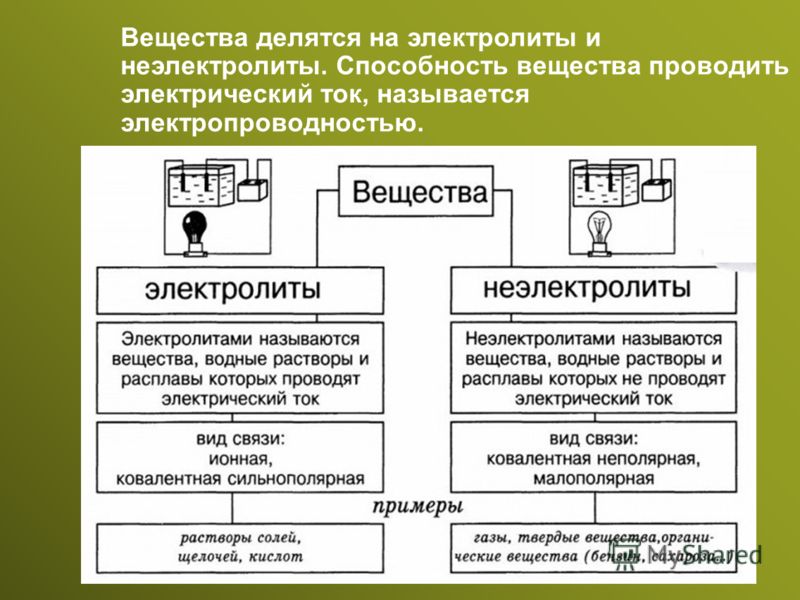 Кроме того, соли, такие как NaCl, MgCl2 также являются сильными электролитами, поскольку они представляют собой ионные соединения с высокой степенью ионных характеристик.
Кроме того, соли, такие как NaCl, MgCl2 также являются сильными электролитами, поскольку они представляют собой ионные соединения с высокой степенью ионных характеристик.
Слабые кислоты и слабые основания считаются слабыми электролитами. Это потому, что эти соединения частично диссоциируют на ионы. Большинство азотсодержащих соединений являются слабыми электролитами. Вода также считается слабым электролитом. Молекулы воды находятся в равновесии с гидроксильными ионами и ионами гидроксония.
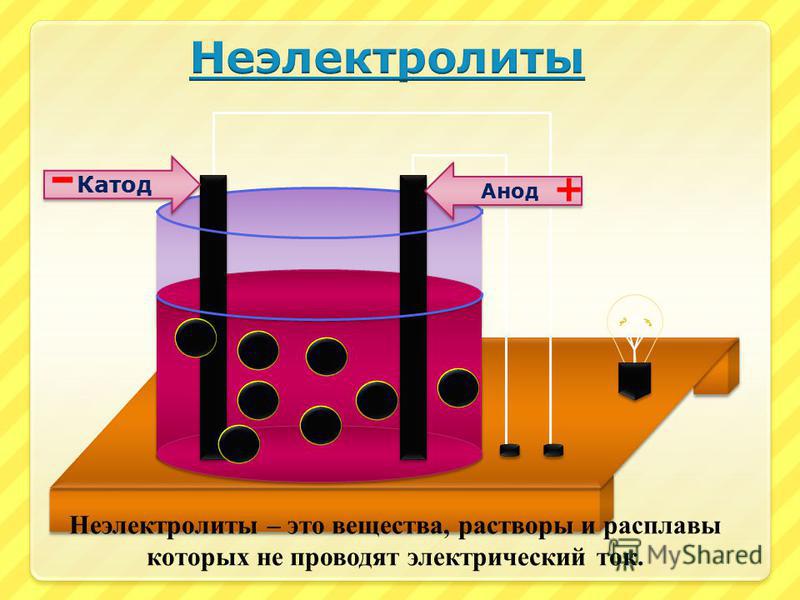
Что такое неэлектролиты
Неэлектролиты — это химические соединения, водные растворы которых не могут проводить электричество через раствор. Эти соединения не существуют в ионной форме. Большинство неэлектролитов являются ковалентными соединениями. При растворении в воде эти соединения вообще не образуют ионов.
Рисунок 2: Сахар может быть полностью растворен в воде, но это не электролит.
Большинство углеродных соединений, таких как углеводороды, являются неэлектролитами, потому что эти соединения не могут растворяться в воде. Некоторые соединения, такие как глюкоза, могут растворяться в воде, но не ионизируются. Водный раствор глюкозы состоит из молекул глюкозы. Следовательно, сахара, жир и спирты неэлектролиты. Как правило, неэлектролиты являются неполярными соединениями.
Некоторые соединения, такие как глюкоза, могут растворяться в воде, но не ионизируются. Водный раствор глюкозы состоит из молекул глюкозы. Следовательно, сахара, жир и спирты неэлектролиты. Как правило, неэлектролиты являются неполярными соединениями.
Разница между электролитами и неэлектролитами
Определение
Электролиты: Электролиты — это химические соединения, которые могут растворяться в ионах при растворении в воде.
неэлектролитов: Неэлектролиты — это химические соединения, водные растворы которых не могут проводить электричество через раствор.
Электрическая проводимость
Электролиты: Электролиты могут проводить электричество через свои водные растворы.
неэлектролитов: Неэлектролиты не могут проводить электричество через свои водные растворы.
Химическая связь
Электролиты: Электролиты состоят из ионных связей.
неэлектролитов: Неэлектролиты состоят из ковалентных связей.
соединений
Электролиты: Электролиты — это ионные соединения. Кислоты, основания и соли являются электролитами.
неэлектролитов: Неэлектролиты являются ковалентными соединениями. Углеродсодержащие соединения, жир и сахар являются неэлектролитами.
Типы
Электролиты: Электролиты могут быть найдены как сильные электролиты и слабые электролиты.
неэлектролитов: Неэлектролиты не могут быть найдены в виде водорастворимых соединений и водонерастворимых соединений.
Заключение
Электролиты и неэлектролиты представляют собой химические соединения, которые называются таковыми в зависимости от способности или неспособности проводить электричество через свои водные растворы. Эта способность зависит от ионизации соединения. Другими словами, соединение должно быть разбито на ионы, чтобы проводить электричество через ионы. Основное различие между электролитами и неэлектролитами заключается в том, что электролиты могут ионизироваться при растворении в воде, тогда как неэлектролиты не могут ионизироваться при растворении в воде.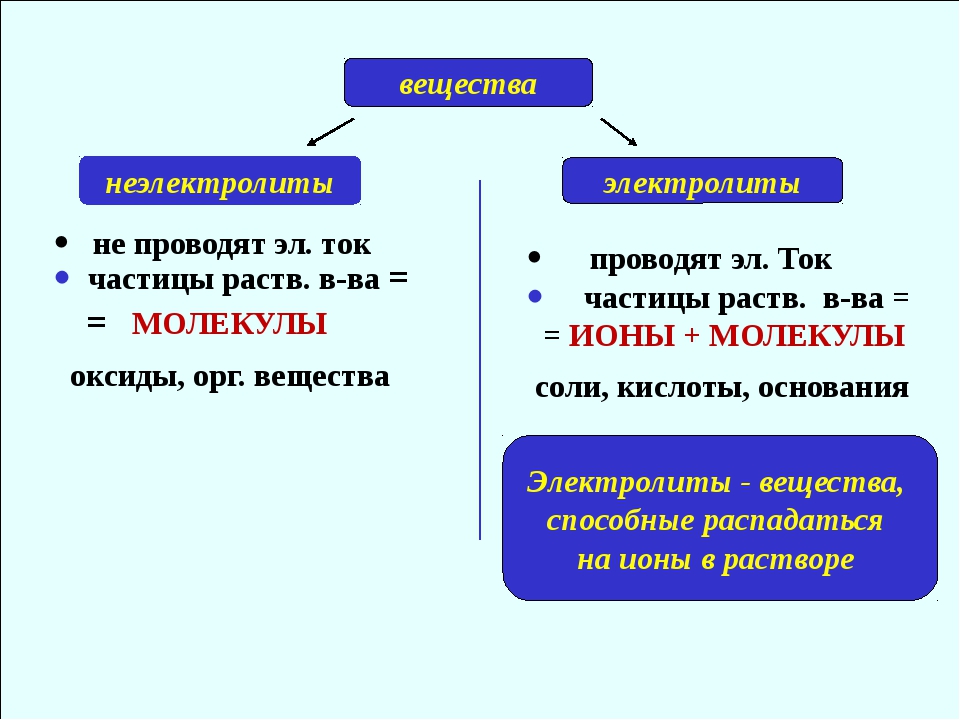
Изображение предоставлено:
1. «Химические принципы Рис. 1.9» Автор: Первоначально загрузчик был Elo 1219 на англоязычных Wikibooks — перенесен из en.wikibooks в Commons.
Электролиты и неэлектролиты.
Данный урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы Вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему температура кипения раствора электролита выше по сравнению с раствором неэлектролита.
I. Понятие электролитическая диссоциация
Посмотрите учебный фильм: “Теория электроитической диссоциации”
Сванте Аррениус
В 1887 году шведский физико — химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.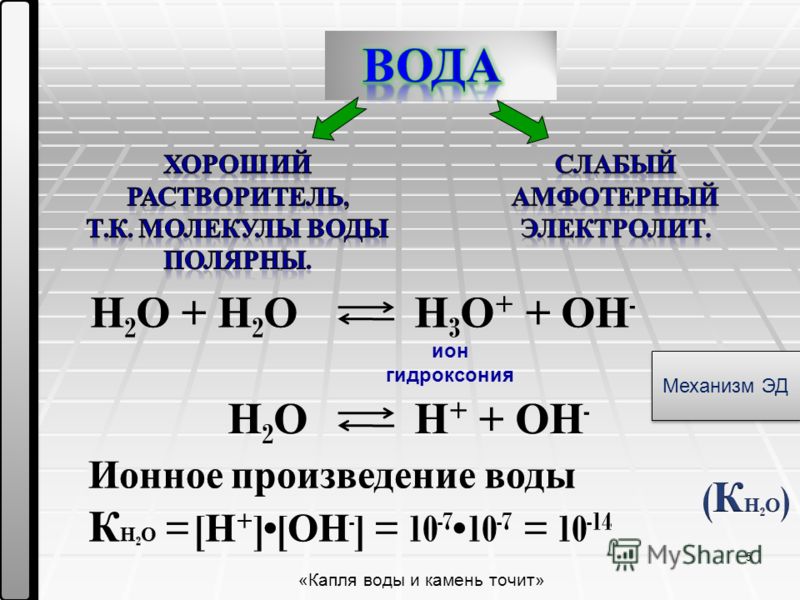
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток — это направленное движение свободных заряженных частиц. Вы уже знаете, что растворы и расплавы солей и щелочей электропроводны, так как состоят не из нейтральных молекул, а из заряженных частиц – ионов. При расплавлении или растворении ионы становятся свободными переносчиками электрического заряда.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Рис. 1. Схема распада на ионы хлорида натрия
Пронаблюдайте за следующим экспериментом: “Изучение электрической проводимости веществ”
II. Сущность процесса электролитической диссоциации. Теория ЭД
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современные положения теории электролитической диссоциации
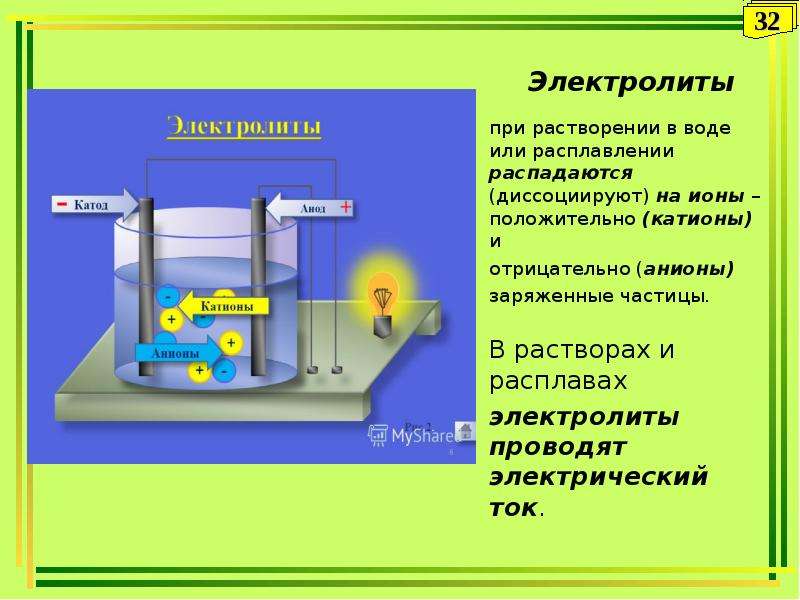
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) или из нескольких атомов — это сложные ионы (NО3—, SO2-4, РОЗ-4 и т. д.).
д.).
2. В растворах и расплавах электролиты проводят электрический ток.
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
Электропроводность расплавов
Испытание веществ на электропроводность
|
ВЕЩЕСТВА |
|
|
ЭЛЕКТРОЛИТЫ |
НЕЭЛЕКТРОЛИТЫ |
|
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток |
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток |
|
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания |
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью |
|
В растворах и расплавах образуются ионы |
В растворах и расплавах не образуются ионы |
Памятка
Электролиты и неэлектролиты
Тепловые эффекты пи растворении веществ в воде
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К+ и анион А— в общем виде записывается так: КА ↔ K+ + A—
Интерактивное объяснение материала по теме
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na+ и Сl– из кристалла в раствор происходит образование гидратов этих ионов.
2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na+ и Сl– из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na+; б – гидратация (окружение молекулами воды) ионов Na+ и Сl–
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.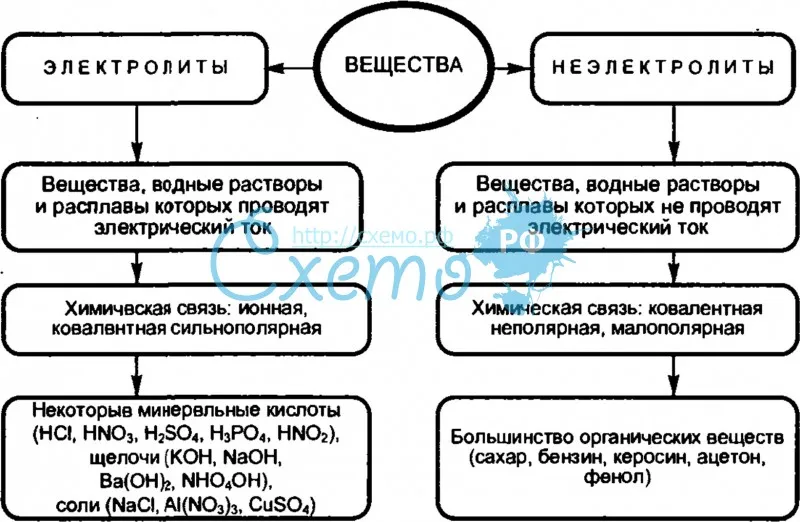 3).
3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Основные положения:
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным (катионы) или отрицательным (анионы) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
|
Атом водорода |
Ион водорода |
|
+1Н0 1s1 |
+1Н+ 1s0 |
Посмотрите опыт: “Отличие ионов водорода от молекул водорода”
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
Сравним свойства атомарного и молекулярного хлора со свойствами иона.
|
Атом хлора |
Ион хлора |
|
+17Cl0 1s22s22p63s23p5 |
+17Cl— 1s22s22p63s23p6 |
|
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются. Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма. |
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии. Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма. |
Запомните!
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
IV. Тренажеры
Тренажёр:«Определение электрической проводимости растворов веществ»
Тренажёр:«Электролиты и неэлектролиты»
ЦОРы
Учебный фильм: “Теория электроитической диссоциации”
Видео-эксперимент: “Изучение электрической проводимости веществ”
Видео:“Электропроводность расплавов”
Видео:“Испытание веществ на электропроводность”
Памятка (электролиты и неэлектролиты)
Электролиты и неэлектролиты
Анимация: “Тепловые эффекты пи растворении веществ в воде”
Интерактивное объяснение материала по теме
Опыт: “Отличие ионов водорода от молекул водорода”
Электролиты и неэлектролиты.
 Электролитическая диссоциация
Электролитическая диссоциация
Химия. 9 класс. Григорович
Вспомните: электрический ток — это направленное движение заряженных частиц.
Понятие об электролитах
В конце XIX века было экспериментально доказано, что растворы большинства неорганических соединений, например поваренной соли, соды, калийной селитры, хорошо проводят электрический ток. Такие вещества назвали электролитами. А чистая, точнее дистиллированная, вода и растворы многих органических веществ, в частности сахара, этилового спирта, не проводят ток — они являются неэлектролитами (рис. 8.1). Много солей, даже нерастворимых в воде, например барий сульфат, проводят электрический ток в расплавленном состоянии.
Рис. 8.1. Растворы кислоты, щелочи и соли проводят электрический ток, а чистая вода — нет
• Вещества, растворы или расплавы которых проводят электрический ток, называют электролитами, а вещества, не проводящие ток ни в растворе, ни в расплаве, — неэлектролитами.
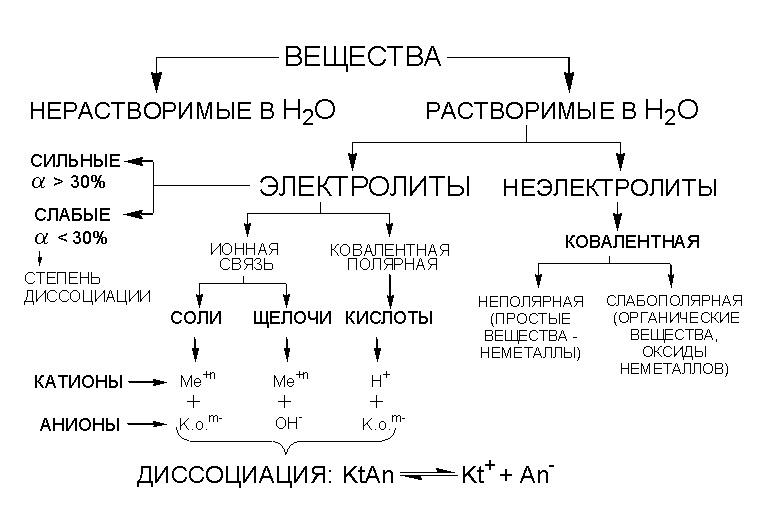
Принадлежность вещества к электролитам или неэлектролитам определяется типом его химической связи. Электролиты — это вещества с ионной или очень полярной ковалентной связью, а неэлектролиты — вещества с неполярной или слабополярной ковалентной связью (схема 4).
Схема 4. Классификация веществ на электролиты и неэлектролиты
Электролиты имеют большое значение в природе и жизни человека. Они содержатся во всех живых организмах, где обеспечивают протекание важных процессов. Биологические жидкости организма человека представляют собой растворы, содержащие ионы, на которые распадаются электролиты — соли, основания, кислоты. Разные ионы выполняют свою биологическую функцию: участвуют в процессах питания и выделения, передачи нервных импульсов, сокращения мышц. Без электролитов невозможно существование в растворах молекул белков и ДНК, а следовательно, невозможной была бы и жизнь на нашей планете.
Электролитическая диссоциация
Вам уже известно, что в веществах ионного строения, например в поваренной соли, есть заряженные частицы — ионы. Вы также знаете, что электрический ток — это направленное движение заряженных частиц. Почему же твердая поваренная соль не проводит электрический ток, а ее раствор или расплав проводят? Ответ на этот вопрос дал шведский ученый Сванте Аррениус. Он предположил, что некоторые вещества (электролиты) при растворении в воде (или расплавлении) распадаются на ионы, которые могут свободно перемещаться. При расплавлении частицы вещества становятся подвижными (рис. 8.2, а), а при растворении они равномерно распределены в воде (рис. 8.2, б ), т. е. в обоих случаях способны свободно двигаться. Благодаря этому растворы и расплавы проводят электрический ток. Ионы в составе твердой поваренной соли расположены в узлах кристаллической решетки и не могут перемещаться, поэтому твердые электролиты электрический ток не проводят (рис. 8.2, в). В дистиллированной воде ионы отсутствуют, поэтому она не проводит ток (рис. 8.2, г).
Вы также знаете, что электрический ток — это направленное движение заряженных частиц. Почему же твердая поваренная соль не проводит электрический ток, а ее раствор или расплав проводят? Ответ на этот вопрос дал шведский ученый Сванте Аррениус. Он предположил, что некоторые вещества (электролиты) при растворении в воде (или расплавлении) распадаются на ионы, которые могут свободно перемещаться. При расплавлении частицы вещества становятся подвижными (рис. 8.2, а), а при растворении они равномерно распределены в воде (рис. 8.2, б ), т. е. в обоих случаях способны свободно двигаться. Благодаря этому растворы и расплавы проводят электрический ток. Ионы в составе твердой поваренной соли расположены в узлах кристаллической решетки и не могут перемещаться, поэтому твердые электролиты электрический ток не проводят (рис. 8.2, в). В дистиллированной воде ионы отсутствуют, поэтому она не проводит ток (рис. 8.2, г).
Рис. 8.2. В растворах и расплавах электролитов ионы свободно перемещаются, поэтому они способны проводить электрический ток: а — расплав поваренной соли; б — раствор поваренной соли в воде; в — твердая поваренная соль; г — чистая вода
• Процесс распада вещества на ионы при растворении в воде или плавлении называют электролитической диссоциацией.
При растворении солей и оснований (веществ ионного строения) в раствор переходят ионы, содержащиеся в их составе. Молекулярные вещества диссоциируют несколько иначе. Гидроген хлорид — это газ, состоящий из полярных молекул HCl. Каждую молекулу, которая попадает в раствор, сразу окружают диполи воды, притягиваясь к ней противоположно заряженными сторонами. В результате такого взаимодействия полярная связь в молекуле HCl превращается в ионную, а образующиеся ионы переходят в раствор (рис. 8.3).
Рис. 8.3. Электролитическая диссоциация гидроген хлорида
Кислоты — это электролиты с ковалентными полярными связями. Поэтому диссоциировать на ионы кислоты могут только в водном растворе под действием молекул воды. Чистые кислоты ток не проводят.
Итак, главное отличие электролитов от неэлектролитов заключается в том, что электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Под действием электрического поля положительно заряженные ионы (катионы) направленно движутся к отрицательному электроду (катоду), а отрицательно заряженные ионы (анионы) — к положительному электроду (аноду) (рис.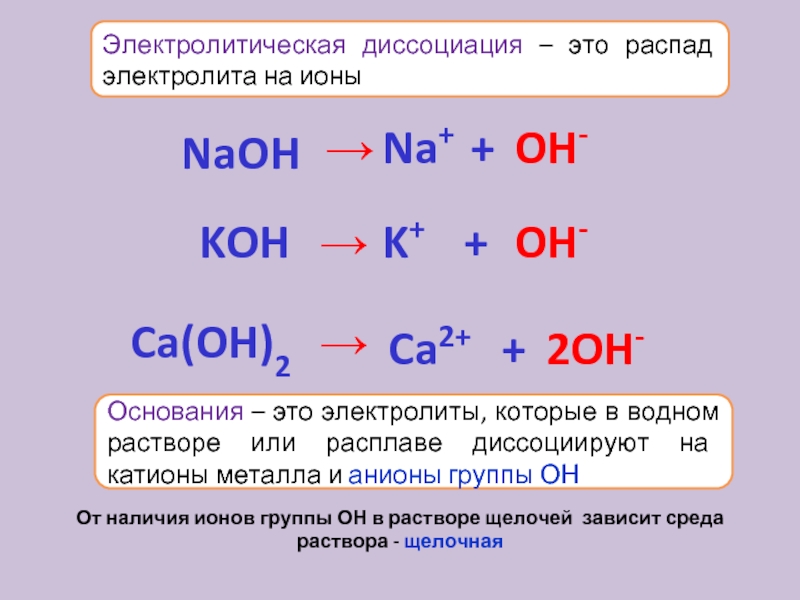 8.4). Эти выводы, сделанные Аррениусом, являются основой сформулированной им теории электролитической Диссоциации.
8.4). Эти выводы, сделанные Аррениусом, являются основой сформулированной им теории электролитической Диссоциации.
Рис. 8.4. Движение ионов в растворе под действием электрического поля
Вещества или их смеси, способные проводить электрический ток, называют проводниками электрического тока. Их разделяют на два типа: проводники І и ІІ рода. Они принципиально отличаются частицами, являющимися носителями электрического заряда, т. е. теми частицами, которые свободно направленно движутся в электрическом поле. В проводниках І рода носителями заряда являются электроны, к таким проводникам относятся все металлы и их сплавы. А растворы и расплавы электролитов — это проводники ІІ рода, носителями заряда в них выступают ионы. То есть металлы хоть и являются проводниками электрического тока, но электролитами их называть нельзя, поскольку металлы всегда проводят электрический ток благодаря наличию свободных электронов, а электролиты — только в растворах или расплавах, в которых происходит электролитическая диссоциация.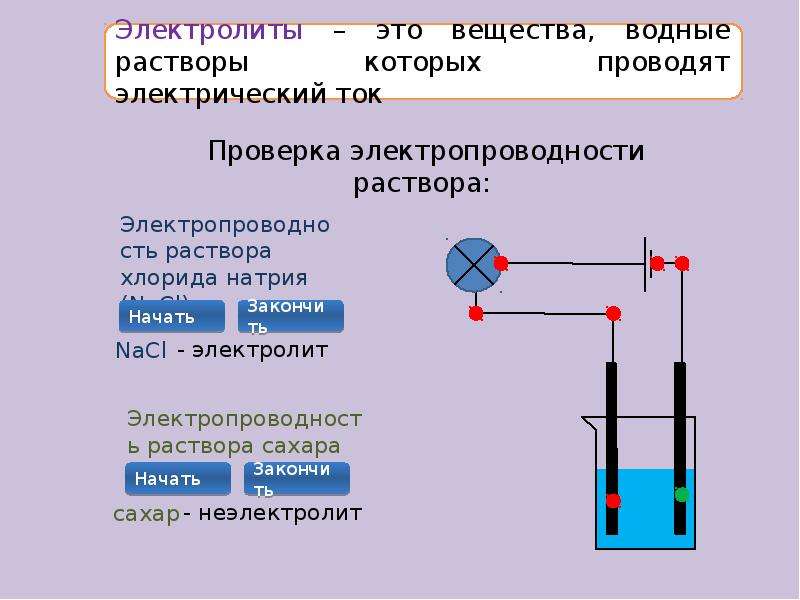
Уравнение электролитической диссоциации
Электролитическая диссоциация — это не химическая реакция, поскольку не происходит превращения одних веществ в другие. Но для удобства электролитическую диссоциацию записывают в форме уравнения, где вместо знака равенства ставят стрелку. Записывая формулы ионов в растворе, заряд ионов указывают немного иначе, чем в записи степени окисления: сначала записывают цифровое значение, а затем знак заряда (в однозарядных ионах цифру 1 обычно не пишут).
Уравнение электролитической диссоциации натрий хлорида:
NaCl → Na+ + Cl—
Аналогично записывают уравнение электролитической диссоциации кальций хлорида:
CaCl2 → Ca2+ + 2Cl—
В водных растворах электролитов вода — важнейший участник процесса диссоциации. Но вода — это среда, в которой происходит диссоциация. Во время процесса электролитической диссоциации вода не расходуется и не образуется, поэтому в уравнениях воду не указывают.
Лингвистическая задача
Хотя по-гречески «электрон» означает «янтарь», сегодня это слово используют для обозначения всего, что связано с электричеством. Второй корень слова «электролит» происходит от греческого слова «литос», которое, согласно разным источникам, означает «камень» либо «тот, который может раствориться». С учетом этого поясните смысл термина «электролит». Как вы считаете, почему греческое название янтаря используют для обозначения электрических явлений?
Сванте-Август Аррениус (1859-1927)
Выдающийся шведский химик и физик, лауреат Нобелевской премии, один из основателей физической химии. В 17 лет поступил в университет Уппсалы и уже через два года получил степень бакалавра. Работал в Физическом институте Шведской академии наук в Стокгольме. За разработку теории электролитической диссоциации в 1903 году был награжден Нобелевской премией. Аррениус известен не только как ученый, но и как автор многочисленных учебников, научно-популярных статей и книг по геофизике, астрономии, биологии и медицине. В течение многих лет занимал должность директора Нобелевского института в Стокгольме.
В течение многих лет занимал должность директора Нобелевского института в Стокгольме.
Для обнародования теории электролитической диссоциации Аррениусу понадобилась незаурядная смелость. Идея была крайне необычной: казалось невероятным, что ионы появляются не под действием электрического тока, а просто в процессе растворения. К тому же многие современники Аррениуса не понимали разницы между понятиями «атом» и «ион» и, услышав, что в водном растворе солей Калия существуют ионы Калия, возражали: если бы такое случилось, то образованный калий должен бурно реагировать с водой.
Ключевая идея
Существование электролитов обусловлено возможностью некоторых веществ распадаться на ионы (катионы и анионы) при растворении или расплавлении.
Контрольные вопросы
- 92. Сформулируйте определение электролитов и неэлектролитов. Приведите примеры веществ.
- 93. Что такое электролитическая диссоциация? Могут ли при растворении электролита в воде образоваться только катионы или только анионы? Почему?
- 94.
 Выпишите из текста параграфа основные положения теории электролитической диссоциации: 1) касательно распада электролитов на ионы; 2) касательно движения ионов в электрическом поле.
Выпишите из текста параграфа основные положения теории электролитической диссоциации: 1) касательно распада электролитов на ионы; 2) касательно движения ионов в электрическом поле.
Задания для усвоения материала
95. Из приведенного перечня выпишите отдельно формулы веществ, которые являются: а) электролитами; б) неэлектролитами.
NaI, HBr, O2, CH4, CaCl2, KOH, H2SO4, C12H22O11(сахар).
96. Какое количество вещества частиц образуется при растворении в воде таких веществ количеством вещества 1 моль: а) гидроген хлорид; б) калий йодид; в) кальций бромид; г) магний нитрат? Составьте уравнения электролитической диссоциации этих веществ.
97. Почему нельзя ремонтировать электропроводку, стоя в воде или на влажной поверхности?
98. Как вы считаете, почему раствор гидроген хлорида в воде проводит электрический ток, а раствор гидроген хлорида в бензине — нет?
99*. При некоторых заболеваниях врачи рекомендуют «пополнить организм электролитами». О каких электролитах идет речь? Каким образом это можно осуществить? При каких заболеваниях и по какой причине необходима такая процедура?
При некоторых заболеваниях врачи рекомендуют «пополнить организм электролитами». О каких электролитах идет речь? Каким образом это можно осуществить? При каких заболеваниях и по какой причине необходима такая процедура?
Подробно об ошибке IIS 7.5 — 404.11
Описание ошибки:
Ошибка HTTP 404.11 — Not Found
Модуль фильтрации запросов настроен для блокировки запросов, содержащих последовательности двойного преобразования символов.
Подробные сведения об ошибке| Модуль | RequestFilteringModule |
|---|---|
| Уведомление | BeginRequest |
| Обработчик | StaticFile |
| Код ошибки | 0x00000000 |
| Запрашиваемый URL-адрес | http://nc.sch34.ru:80/%d0%a3%d0%a7%d0%95%d0%91%d0%9d%d0%98%d0%9a%d0%98/%d0%bc%d0%b5%d1%82%d0%be%d0%b4_%d0%bb%d0%b8%d1%82_%d1%80%d0%b0/metodik_himiya/%d0%a5%d0%b8%d0%bc%d0%b8%d1%8f%20%d0%9a%d0%be%d0%b7%d0%bb%d0%be%d0%b2%d0%b8%d1%87%20%d0%ae%d0%9f/%d0%9e%d0%93%d0%ad%20%d1%85%d0%b8%d0%bc%d0%b8%d1%8f/gia%20him%209%20%20zadanija/%d0%90%207. docx docx |
|---|---|
| Физический путь | C:\Program Files\NetCity2\Web\%d0%a3%d0%a7%d0%95%d0%91%d0%9d%d0%98%d0%9a%d0%98\%d0%bc%d0%b5%d1%82%d0%be%d0%b4_%d0%bb%d0%b8%d1%82_%d1%80%d0%b0\metodik_himiya\%d0%a5%d0%b8%d0%bc%d0%b8%d1%8f%20%d0%9a%d0%be%d0%b7%d0%bb%d0%be%d0%b2%d0%b8%d1%87%20%d0%ae%d0%9f\%d0%9e%d0%93%d0%ad%20%d1%85%d0%b8%d0%bc%d0%b8%d1%8f\gia%20him%209%20%20zadanija\%d0%90%207.docx |
| Способ входа | Пока не определено |
| Пользователь, выполнивший вход | Пока не определено |
- Этот запрос содержал последовательность двойного преобразования символов, тогда как средства фильтрации запросов настроены на веб-сервере для блокировки таких последовательностей.
- Проверьте настройку configuration/system.webServer/security/requestFiltering@allowDoubleEscaping в файлах applicationhost.config или web.config
 ..
Это средство безопасности. Изменять его параметры можно лишь в том случае, если вы до конца понимаете последствия своих действий. Перед тем как изменить это значение, вам следует провести трассировку в сети, дабы удостовериться в том, что данный запрос не является злонамеренным. Если сервер допускает последовательности двойного преобразования символов, измените настройку configuration/system.webServer/security/requestFiltering@allowDoubleEscaping. Причиной этого может быть неверный URL-адрес, направленный на сервер злонамеренным пользователем.
..
Это средство безопасности. Изменять его параметры можно лишь в том случае, если вы до конца понимаете последствия своих действий. Перед тем как изменить это значение, вам следует провести трассировку в сети, дабы удостовериться в том, что данный запрос не является злонамеренным. Если сервер допускает последовательности двойного преобразования символов, измените настройку configuration/system.webServer/security/requestFiltering@allowDoubleEscaping. Причиной этого может быть неверный URL-адрес, направленный на сервер злонамеренным пользователем.
Дополнительные сведения…»
6.2: Электролиты — Химия LibreTexts
Цели обучения
- Дайте определение электролиту и перечислите примеры распространенных электролитов.
Когда некоторые вещества растворяются в воде, они претерпевают физические или химические изменения, в результате которых в растворе образуются ионы. Эти вещества составляют важный класс соединений, называемых электролитами . Вещества, которые при растворении не выделяют ионов, называются неэлектролитами. Если физический или химический процесс, который генерирует ионы, эффективен практически на 100% (все растворенные соединения дают ионы), то это вещество известно как сильный электролит.Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, его называют слабым электролитом.
Вещества, которые при растворении не выделяют ионов, называются неэлектролитами. Если физический или химический процесс, который генерирует ионы, эффективен практически на 100% (все растворенные соединения дают ионы), то это вещество известно как сильный электролит.Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, его называют слабым электролитом.
Вещества могут быть идентифицированы как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество. Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомым является проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны.Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается по мере увеличения концентрации ионов. Приложение напряжения к электродам, погруженным в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, путем измерения протекающего электрического тока, либо качественно, наблюдая за яркостью включенной в цепь лампочки (рис. \(\PageIndex {1}\)).
\(\PageIndex {1}\)).
Ионные электролиты
Вода и другие полярные молекулы притягиваются к ионам, как показано на рисунке \(\PageIndex{2}\). Электростатическое притяжение между ионом и молекулой с диполем называется ионно-дипольным притяжением. Эти притяжения играют важную роль в растворении ионных соединений в воде.
Рисунок \(\PageIndex{2}\): Когда хлорид калия (KCl) растворяется в воде, ионы гидратируются. Полярные молекулы воды притягиваются зарядами ионов K + и Cl − . Молекулы воды впереди и позади ионов не показаны. Когда ионные соединения растворяются в воде, ионы в твердом состоянии разделяются и равномерно распределяются по всему раствору, потому что молекулы воды окружают ионы и сольватируют их, уменьшая сильные электростатические силы между ними.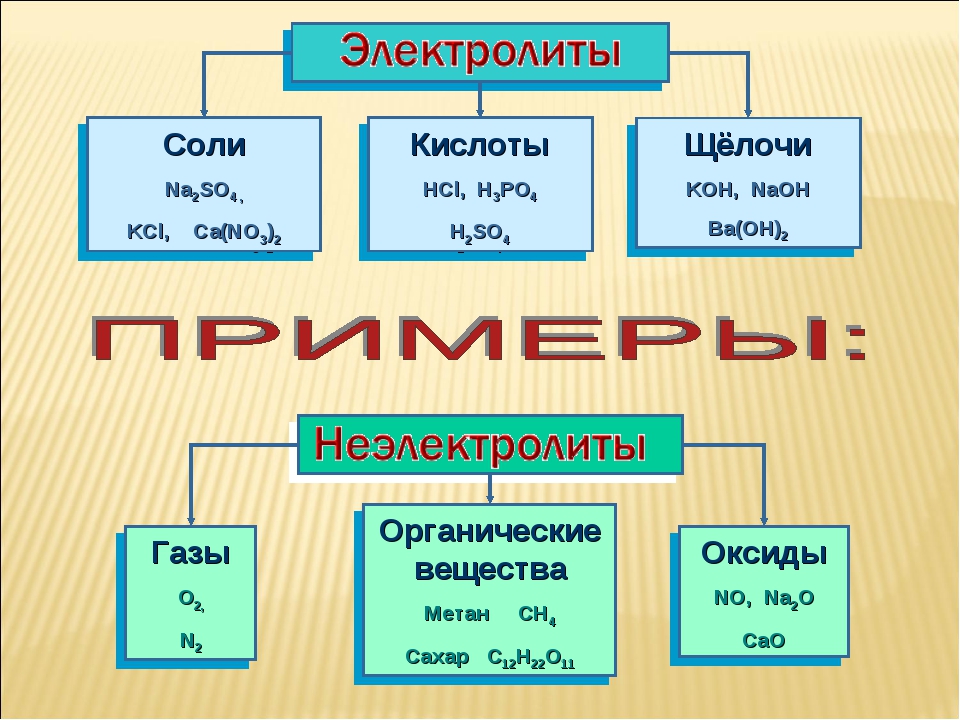 Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве случаев ионные соединения почти полностью диссоциируют при растворении, поэтому их относят к сильным электролитам.
Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве случаев ионные соединения почти полностью диссоциируют при растворении, поэтому их относят к сильным электролитам.
Давайте рассмотрим, что происходит на микроскопическом уровне, когда мы добавляем твердый KCl в воду. Ионно-дипольные силы притягивают положительные (водородные) концы полярных молекул воды к отрицательным ионам хлора на поверхности твердого тела, а отрицательные (кислородные) концы — к положительным ионам калия.Молекулы воды проникают между отдельными ионами K + и Cl — и окружают их, уменьшая сильные межионные силы, которые связывают ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов, как показано на рисунке. Уменьшение электростатического притяжения делает возможным независимое движение каждого гидратированного иона в разбавленном растворе, что приводит к увеличению беспорядка в системе по мере того, как ионы переходят из своего фиксированного и упорядоченного положения в кристалле в подвижное и гораздо более неупорядоченное состояние в кристалле. решение.Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются при поглощении тепла.
решение.Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются при поглощении тепла.
В других случаях электростатическое притяжение между ионами в кристалле настолько велико или ионно-дипольные силы притяжения между ионами и молекулами воды настолько слабы, что увеличение беспорядка не может компенсировать энергию, необходимую для разделения ионов. , а кристалл нерастворим. Так обстоит дело с такими соединениями, как карбонат кальция (известняк), фосфат кальция (неорганический компонент костей) и оксид железа (ржавчина).{−} (водн.)} \label{11.3.2}\]
В некоторых случаях мы обнаруживаем, что растворы, приготовленные из ковалентных соединений, проводят электричество, потому что молекулы растворенного вещества химически реагируют с растворителем с образованием ионов. Например, чистый хлористый водород представляет собой газ, состоящий из ковалентных молекул HCl. Этот газ не содержит ионов. Однако, когда мы растворяем хлористый водород в воде, мы обнаруживаем, что раствор является очень хорошим проводником. Молекулы воды играют существенную роль в образовании ионов: растворы хлороводорода во многих других растворителях, например в бензоле, не проводят электричество и не содержат ионов.+\)) и ионы хлора (Cl — ):
Молекулы воды играют существенную роль в образовании ионов: растворы хлороводорода во многих других растворителях, например в бензоле, не проводят электричество и не содержат ионов.+\)) и ионы хлора (Cl — ):
Эта реакция практически завершена на 100% для HCl (т. е. это сильная кислота и, следовательно, сильный электролит). Точно так же слабые кислоты и основания, которые реагируют лишь частично, образуют относительно низкие концентрации ионов при растворении в воде и классифицируются как слабые электролиты. Читатель может пожелать просмотреть обсуждение сильных и слабых кислот, приведенное в предыдущей главе этого текста, посвященное классам реакций и стехиометрии.
Резюме
Вещества, растворяющиеся в воде с образованием ионов, называются электролитами. Электролиты могут быть ковалентными соединениями, которые химически реагируют с водой с образованием ионов (например, кислот и оснований), или они могут быть ионными соединениями, которые диссоциируют с образованием составляющих их катионов и анионов при растворении. Растворению ионного соединения способствует ионно-дипольное притяжение между ионами соединения и полярными молекулами воды. Растворимые ионные вещества и сильные кислоты полностью ионизируются и являются сильными электролитами, а слабые кислоты и основания ионизируются лишь в незначительной степени и являются слабыми электролитами.Неэлектролиты – вещества, не образующие ионов при растворении в воде.
Растворению ионного соединения способствует ионно-дипольное притяжение между ионами соединения и полярными молекулами воды. Растворимые ионные вещества и сильные кислоты полностью ионизируются и являются сильными электролитами, а слабые кислоты и основания ионизируются лишь в незначительной степени и являются слабыми электролитами.Неэлектролиты – вещества, не образующие ионов при растворении в воде.
Глоссарий
- диссоциация
- физический процесс, сопровождающий растворение ионного соединения, при котором составляющие его ионы сольватируются и диспергируются в растворе
- электролит
- вещество, образующее ионы при растворении в воде
- ионно-дипольное притяжение
- электростатическое притяжение между ионом и полярной молекулой
- неэлектролит
- вещество, не образующее ионов при растворении в воде
- сильный электролит
- вещество, которое полностью диссоциирует или ионизируется при растворении в воде
- слабый электролит
- вещество, которое лишь частично ионизируется при растворении в воде
Список электролитов
Список электролитов
Определение электролитов: Электролит – это вещество, которое ионизируется с образованием положительных и отрицательных ионов при растворении в водном растворе. Эти свободные ионы в растворе состоят из свойства проводить электричество в водном состоянии. Прочность электролита зависит от его способности диссоциировать и проводить электричество.
Эти свободные ионы в растворе состоят из свойства проводить электричество в водном состоянии. Прочность электролита зависит от его способности диссоциировать и проводить электричество.
Есть в основном три типа электролитов:
Сильный электролит: Сильный электролит при растворении в воде образует раствор, который является очень хорошим проводником электричества. Это означает, что сильный электролит представляет собой растворенное вещество, которое полностью или почти полностью диссоциирует на все свои ионы в растворе.При одинаковой температуре раствор сильных электролитов имеет большую упругость паров, чем чистая вода. К сильным электролитам относятся сильные кислоты, сильные основания и ионные соли.Ниже в таблице приведены несколько примеров сильных электролитов:
| Сильный электролит | Имя |
| Перечень кислот | |
| HCl | Соляная кислота |
| HBr | бромистоводородная кислота |
| привет | Йодоводородная кислота |
| ХИО 4 | На йодистую кислоту |
| H 2 SO 3 | Сернистая кислота |
| H 2 SO 4 | Серная кислота |
| HNO 3 | Азотная кислота |
| HBrO 3 | Бромная кислота |
| HBrO 4 | Пербромовая кислота |
| HClO 3 | Хлорная кислота |
| HClO 4 | Хлорная кислота |
| Список баз | |
| LiOH | Гидроксид лития |
| NaOH | Гидроксид натрия |
| КОН | Гидроксид калия |
| Ва(ОН) 2 | Гидроксид бария |
| Са(ОН) 2 | Гидроксид кальция |
| Ср(ОН) 2 | Гидроксид стронция |
| РбОН | Гидроксид рубидия |
| CsOH | Гидроксид цезия |
| Мг(ОН) 2 | Гидроксид магния |
| NaH 2 | Амид натрия |
| НаН | Гидрид натрия |
| Список солей | |
| NaNO 3 | Нитрат натрия |
| NaCl | Хлорид натрия |
| LiCl | хлорид лития |
| KCl | Хлорид калия |
| CuSO 4 | Сульфат меди |
| КНО 3 | Нитрат калия |
| CaCl 2 | Хлорид кальция |
| CH 3 COONa | Ацетат натрия |
| NaHCO 3 | Бикарбонат натрия |
| AgNO 3 | Нитрат серебра |
 Приведенное ниже уравнение упоминается в водном состоянии, потому что сильный электролит проводит электричество только в водном состоянии.
Приведенное ниже уравнение упоминается в водном состоянии, потому что сильный электролит проводит электричество только в водном состоянии. Катионы и анионы: Ионы можно разделить на два типа: катионы и анионы.
Катионы представляют собой положительно измененные ионы, которые образуются в результате потери электронов.
Анионы — это отрицательно измененные ионы, которые образуются за счет присоединения электронов.
Вот пример, показывающий диссоциацию NaCl в воде. Это приводит к образованию двух ионов: катиона натрия и аниона хлорида в водном растворе.Диссоциация необратима, так как NaCl является сильным электролитом.
Слабый электролит: Электролиты, в которых растворенное вещество не полностью диссоциирует в растворе, называются слабыми электролитами. Это означает, что в таких растворах есть диссоциированные ионы, а также молекулы электролитов. Поэтому слабые электролиты меньше ионизируются в водных растворах и проводят очень меньше электричества.

Ниже в таблице приведен список нескольких слабых электролитов:
| Слабые электролиты | Имя |
| Кислоты | |
| СН 3 СООН | Уксусная кислота |
| Н 2 СО 3 | Угольная кислота |
| H 2 CrO 4 | Хромовая кислота |
| ВЧ | Плавиковая кислота |
| С 6 Н 5 СООН | Бензойная кислота |
| HNO 2 | Азотистая кислота |
| H 3 Заказ на покупку 4 | Фосфорная кислота |
| Н(С 3 Н 5 О 3 ) | Молочная кислота |
| (COOH) 2 | Щавелевая кислота |
| Основания | |
| НХ 3 | Аммиак |
| NH 4 ОН | Гидроксид аммония |
| ХКН | Цианистый водород |
| С 5 Н 5 Н | Пиридин |
| (CH 3 ) 2 NH | Диметиламин |
| (СН 3 ) 3N | Триметиламин |
| C 2 H 5 NH 2 | Этиламин |
| С 2 Н 3 Н 2 | Глицин |
 Это связано с тем, что слабые электролиты частично диссоциируют на положительные и отрицательные ионы. Ниже приведены два примера диссоциации слабого электролита:
Это связано с тем, что слабые электролиты частично диссоциируют на положительные и отрицательные ионы. Ниже приведены два примера диссоциации слабого электролита: Цианистый водород при растворении в водном растворе частично диссоциирует, являясь слабым электролитом. HCN диссоциирует на катион водорода и анион цианида в водном состоянии.
Гидроксид аммония диссоциирует на катион аммония и анион гидроксида в водном состоянии.
Неэлектролит: Вещество, в котором при растворении в воде отсутствуют ионы, из-за которых не происходит диссоциация, называется неэлектролитом.У неэлектролита нет ионизации, поэтому он не может проводить электричество. Большинство неэлектролитов представляют собой полярные или неполярные молекулы, поскольку они растворяются в воде в виде молекул, но не диссоциируют в виде ионов.
| Не электролит | Имя |
| О 2 | Кислород |
| СО 2 | Диоксид серы |
| СО 2 | Углекислый газ |
| КС 2 | Сероуглерод |
| ККл 4 | Четыреххлористый углерод |
| Н 2 О | Вода |
| СН 3 ОН | Метанол |
| С 2 Н 5 ОХ | Этанол |
| С 12 Н 22 О 11 | сахароза |
| С 6 Н 12 О 6 | Глюкоза |
| NH 2 CONH 2 | Мочевина |
| CH 2 Класс 2 | Дихлорметан |
| CH 3 H 8 O 3 | Глицерин |
Электролиз: Электролиз — это процесс пропускания тока через раствор электролита.
 В этом процессе электролиза отрицательные и положительные ионы движутся к своим электродам. Электрод притягивает к себе ионы противоположного заряда.
В этом процессе электролиза отрицательные и положительные ионы движутся к своим электродам. Электрод притягивает к себе ионы противоположного заряда. Электролитическая ячейка: Электролитическая ячейка — это место, где проводится процесс электролиза.
Электролитическая ячейка состоит из стакана, заполненного раствором электролита.
Затем эта ячейка соединяется с двумя проводящими пластинами, называемыми анодом и катодом.
Анод представляет собой положительный электрод, который извлекает электроны из отрицательно заряженных ионов, которые являются анионами.Катод представляет собой отрицательный электрод, который передает электроны положительно заряженным ионам, называемым катионами.
Эти два электрода подключены к клеммам источника питания постоянного тока. Электрический ток входит через положительный электрод, который является анодом, проходит через раствор электролита и выходит через катод.
На аноде происходит процесс окисления , который представляет собой потерю электронов.

На катоде происходит процесс восстановления , то есть присоединения электронов.
Что именно делают электролиты?
Организм не может функционировать без электролитов из-за важной роли, которую они играют в клетках.- Они регулируют нервную и мышечную функции в организме.
- Они помогают поддерживать стабильность в клетках и при необходимости генерируют энергию.
- Они контролируют гидратацию организма, уровень pH в крови и кровяное давление.
- Они отвечают за восстановление поврежденных тканей.
- Электрические ткани в организме – это мышцы и нейроны. Электролиты активируют эти электрические ткани:
o Интерстициальная жидкость (жидкость внутри клеток)
o Внутриклеточная жидкость. (Жидкость между клетками.)
- Кальций (ca 2+ ), натрий (Na + ) и калий (K + ) необходимы для сокращения мышц.
 Упражнения помогают избавиться от ионов, таких как натрий и калий, и сохранить баланс. Употребление сбалансированной пищи, особенно свежих фруктов и овощей, восстанавливает потерянные уровни натрия и калия в организме.
Упражнения помогают избавиться от ионов, таких как натрий и калий, и сохранить баланс. Употребление сбалансированной пищи, особенно свежих фруктов и овощей, восстанавливает потерянные уровни натрия и калия в организме. Растворы электролитов и неэлектролитов | Химия
4.6: Растворы электролитов и неэлектролитов
Вещества, которые претерпевают физические или химические изменения в растворе с образованием ионов, способных проводить электричество, называются электролитами.Если вещество в растворе отдает ионы, т. е. соединение подвергается 100%-ной диссоциации, то вещество является сильным электролитом. Полная диссоциация обозначена одной стрелкой вперед. Например, водорастворимые ионные соединения, такие как хлорид натрия, в водном растворе диссоциируют на катионы натрия и анионы хлорида.
Другими примерами сильных электролитов являются гидроксиды металлов группы 1 и группы 2 и сильные кислоты, такие как HCl и HNO 3 .
Если только незначительная часть вещества диссоциирует на ионы, то есть если соединение подвергается частичной диссоциации в растворе, его называют слабым электролитом. Частичная диссоциация указана обратимой стрелкой. Например, слабые кислоты, такие как уксусная кислота, частично ионизируются в воде с образованием ионов ацетата и ионов гидроксония.
Частичная диссоциация указана обратимой стрелкой. Например, слабые кислоты, такие как уксусная кислота, частично ионизируются в воде с образованием ионов ацетата и ионов гидроксония.
Другими примерами слабых электролитов являются плохо растворимые соли, такие как AgCl и PbCl 2 , и слабые основания, такие как аммиак.
Электростатическое притяжение между ионом и молекулой с диполем, называемое ионно-дипольным притяжением, играет важную роль в растворении ионных соединений в воде. Когда ионные соединения растворяются в воде, ионы в твердом состоянии разделяются и равномерно распределяются по всему раствору, потому что молекулы воды окружают ионы и сольватируют их, уменьшая сильные электростатические силы между ними.
Растворы ковалентных соединений проводят электричество, потому что молекулы растворенного вещества химически реагируют с растворителем с образованием ионов.Например, чистый хлористый водород представляет собой газ, состоящий из ковалентных молекул HCl.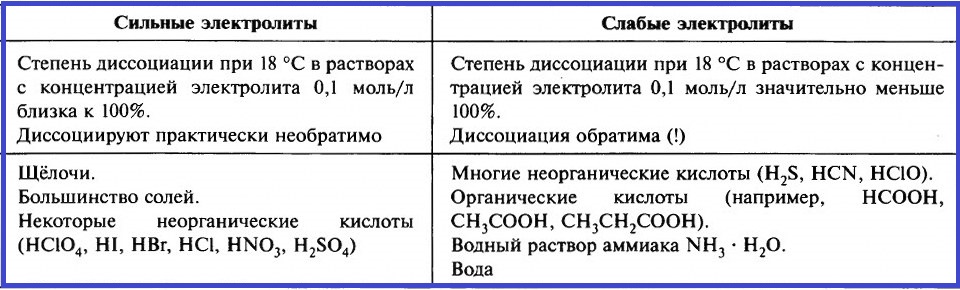 Этот газ не содержит ионов. Однако водный раствор HCl является очень хорошим проводником, что указывает на то, что в растворе существует заметная концентрация ионов.
Этот газ не содержит ионов. Однако водный раствор HCl является очень хорошим проводником, что указывает на то, что в растворе существует заметная концентрация ионов.
Поскольку HCl является кислотой, ее молекулы реагируют с водой, передавая ионы H+ с образованием ионов гидроксония (H 3 O + ) и ионов хлорида (Cl — ):
Эта реакция практически завершена на 100% для HCl (сильный электролит).Точно так же слабые кислоты и основания, которые реагируют лишь частично, образуют относительно низкие концентрации ионов при растворении в воде и классифицируются как слабые электролиты.
Вещества, которые не выделяют ионов при растворении в воде, называются неэлектролитами. Такие вещества растворяются в виде нейтральных молекул в растворе, каждая из которых окружена молекулами воды. Например, такое молекулярное соединение, как сахароза, растворяется в воде в виде целых молекул.
Таким образом, вещества могут быть идентифицированы как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество. Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомым является проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается по мере увеличения концентрации ионов. Приложение напряжения к электродам, погруженным в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя протекание электрического тока, либо качественно, наблюдая за яркостью включенной в цепь лампочки.
Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомым является проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны. Растворы также могут проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается по мере увеличения концентрации ионов. Приложение напряжения к электродам, погруженным в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя протекание электрического тока, либо качественно, наблюдая за яркостью включенной в цепь лампочки.
Этот текст взят из Openstax, Chemistry 2e, Section 11.2: Electrolytes.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.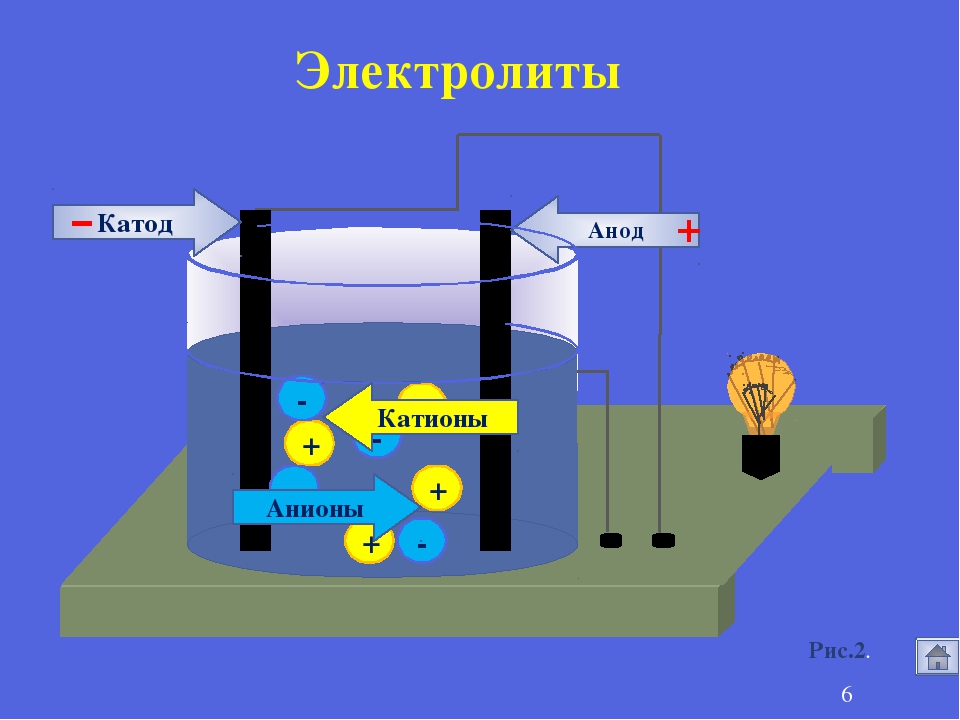
Проклятие Хофмайстера | Nature Chemistry
Kunz, W., Henle, J. & Ninham, B. W. Curr. мнение Коллоидный интерфейс Sci. 9 , 19–37 (2004).
КАС Статья Google Scholar
Collins, K.D. & Washabaugh, M.W. Q. Rev. Biophys. 18 , 323–422 (1985).
КАС Статья Google Scholar
Хамагучи, К. и Гейдушек, Э. П. Дж. Ам. хим. соц. 84 , 1329–1338 (1962).
КАС Статья Google Scholar
van der Vegt, N. F. et al. Хим. Ред. 116 , 7626–7641 (2016).
Артикул Google Scholar
Hawkes, S. J. J. Chem. Образовательный 73 , 421–423 (1996).
КАС Статья Google Scholar

Jungwirth, P. & Cremer, P. S. Nat. хим. 6 , 261–263 (2014).
КАС Статья Google Scholar
McPherson, A. & Gavira, J.A. Acta Crystallogr. F 70 , 2–20 (2014).
КАС Статья Google Scholar
Хайд, А. М. и др. Орг. Процесс Рез. Дев. 21 , 1355–1370 (2017).
КАС Статья Google Scholar
Sullivan, M.R., Yao, W., Tang, D., Ashbaugh, H.S. & Gibb, B.C. J. Phys. хим. B 122 , 1702–1713 (2018).
КАС Статья Google Scholar
Paterová, J. et al. Дж.физ. хим. B 117 , 8150–8158 (2013).
Артикул Google Scholar
Zhang, Y. & Cremer, P. S. Proc. Натл акад. науч. США 106 , 15249–15253 (2009 г.).
науч. США 106 , 15249–15253 (2009 г.).
КАС Статья Google Scholar
Marcus Y. Ion Properties 1st edn (Marcel Dekker, 1997).
Маркус Ю. Ионы в растворе и их сольватация (Wiley, 2015).
Типы, назначение и нормальные уровни
Обзор
Что такое электролиты?
Электролиты – это вещества, обладающие естественным положительным или отрицательным электрическим зарядом при растворении в воде. Тело взрослого человека примерно на 60% состоит из воды, а это означает, что почти каждая жидкость и каждая клетка вашего тела содержат электролиты. Они помогают вашему телу регулировать химические реакции, поддерживать баланс между жидкостями внутри и снаружи ваших клеток и многое другое.
Ваш организм получает электролиты или их компоненты из того, что вы едите и пьете. Ваши почки фильтруют избыточные электролиты из вашего тела и попадают в мочу. Вы также теряете электролиты, когда потеете.
Вы также теряете электролиты, когда потеете.
Основные термины, которые необходимо знать:
- Гипер-: Состояние, начинающееся со слова «гипер», означает, что оно включает в себя слишком много чего-то.
- Гипо-: Состояние, начинающееся с «гипо», означает, что в нем участвует слишком мало чего-то.
- Ион: Атом, имеющий электрический заряд.
- Катионы: Ионы с положительным зарядом.
- Анионы: Ионы с отрицательным зарядом.
- рН: Шкала, которая измеряет, является ли жидкость кислотой или основанием. Естественный рН крови вашего тела составляет от 7,36 до 7,44.
- Кислотный: имеет pH менее 7.
- Нейтральный: имеет рН 7.
- Основной: имеет рН более 7 (основной также известен как «щелочной»).
Что делают электролиты?
Ваши клетки используют электролиты для проведения электрических зарядов, благодаря которым ваши мышцы сокращаются.Те же электрические заряды также помогают в химических реакциях, особенно когда речь идет о гидратации и балансе жидкостей внутри и снаружи клеток.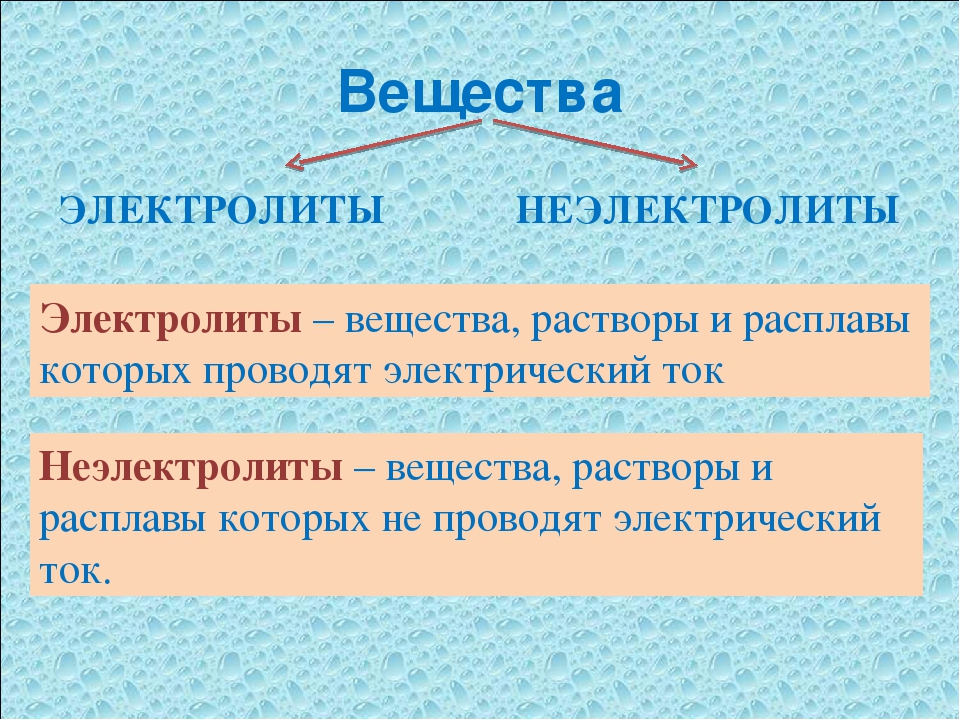
Ключевой принцип, на котором основаны электролиты, заключается в том, что определенные химические элементы могут естественным образом удерживать положительный или отрицательный электрический заряд. Когда эти элементы растворяются в жидкости, эта жидкость может проводить электричество.
Примером этого является соленая вода, которая легко проводит электричество. Соль состоит из натрия (положительно заряженного) и хлора (отрицательно заряженного), и при объединении их заряды уравновешивают друг друга.Атомы с электрическим зарядом называются ионами (положительные ионы называются катионами, а отрицательные ионы называются анионами).
При растворении соли в воде атомы натрия и хлора расщепляются, а это означает, что они снова становятся положительно и отрицательно заряженными. Электричество скачет между ионами натрия и хлора, а не между молекулами воды, потому что они имеют противоположные электрические заряды.
На самом базовом химическом уровне электролиты помогают вашему телу поддерживать баланс. Точно так же, как электричество использует ионы для перемещения с места на место в соленой воде, ваше тело использует ионы для транспортировки химических соединений в клетки и из них.
Точно так же, как электричество использует ионы для перемещения с места на место в соленой воде, ваше тело использует ионы для транспортировки химических соединений в клетки и из них.
Каковы ключевые компоненты электролита?
Есть несколько ключевых элементов, которые необходимы вашему организму для поддержания нормального уровня электролитов. Следующий раздел включает в себя основные элементы, отмеченные как положительные (+) или отрицательные (-), и что происходит, когда этого элемента слишком много или слишком мало.
Натрий (+)
Натрий играет решающую роль, помогая вашим клеткам поддерживать правильный баланс жидкости. Он также используется, чтобы помочь клеткам поглощать питательные вещества. Это самый распространенный ион электролита в организме.
- Гипернатриемия (слишком много натрия): может вызвать спутанность сознания или изменение поведения, необычно сильные рефлексы и потерю мышечного контроля, судороги и кому.
- Гипонатриемия (недостаток натрия): спутанность сознания, раздражительность, ослабление рефлексов, тошнота и рвота, судороги и кома.

Магний (+)
Магний помогает вашим клеткам превращать питательные вещества в энергию. Ваш мозг и мышцы в значительной степени зависят от магния, чтобы выполнять свою работу.
- Гипермагниемия (избыток магния): изменения сердечного ритма и аритмии, ослабление рефлексов, снижение способности дышать и остановка сердца (остановка сердца).
- Гипомагниемия (недостаток магния): мышечная слабость, подергивания и потеря контроля, сердечные аритмии. Обычно это происходит в связи с дефицитом кальция и калия.
Калий (+)
Ваши клетки используют калий наряду с натрием. Когда ион натрия входит в клетку, ион калия выходит, и наоборот. Калий также особенно важен для работы сердца. Слишком много или слишком мало может вызвать серьезные проблемы с сердцем.
- Гиперкалиемия (слишком много калия): слабость, неспособность двигаться мышцами, спутанность сознания, нарушение сердечного ритма (аритмии).
- Гипокалиемия (недостаток калия): мышечная слабость и судороги, чувство необычной жажды и частая потребность в мочеиспускании, головокружение или потеря сознания при слишком быстром вставании.
 При более высоких уровнях мышечная ткань начинает разрушаться (состояние, называемое рабдомиолизом, которое может серьезно повредить ваши почки), и сердечные аритмии становятся серьезной угрозой.
При более высоких уровнях мышечная ткань начинает разрушаться (состояние, называемое рабдомиолизом, которое может серьезно повредить ваши почки), и сердечные аритмии становятся серьезной угрозой.
Кальций (+)
Кальций является ключевым элементом в вашем организме, но он делает больше, чем просто укрепляет кости и зубы.Он также используется для управления мышцами, передачи сигналов по нервам, управления сердечным ритмом и многого другого. Слишком много или слишком мало кальция в крови может вызвать широкий спектр симптомов в различных системах организма.
Гиперкальциемия (слишком много кальция)
- Головной мозг: головная боль, усталость, апатия и спутанность сознания.
- Пищеварительный тракт: запор, боль в животе и рвота.
- Почки: частые позывы к мочеиспусканию, камни в почках и почечная недостаточность.
- Сердце: аритмии, некоторые из которых могут быть тяжелыми.
- Скелет: Боль в костях и суставах.
Гипокальциемия (недостаток кальция)
- Мозг: спутанность сознания и изменения в поведении.
- Мышцы: необычно сильные рефлексы и потеря мышечного контроля, подергивание мышц, спазмы мышц горла, затрудняющие речь или дыхание.
Хлорид (-)
Хлорид (название иона хлора) является вторым по распространенности ионом в организме.Это также ключевая часть того, как ваши клетки поддерживают внутренний и внешний баланс жидкости. Он также играет роль в поддержании естественного баланса рН организма.
Гиперхлоремия (слишком много хлоридов)
Это может вызвать ацидоз, когда кислотность вашей крови слишком высока. Это приводит к тошноте, рвоте и усталости, а также к учащенному и глубокому дыханию и спутанности сознания. Обычно это происходит в связи с избытком или недостатком калия.
- В связи с гиперкалиемией: в сочетании со слишком большим количеством калия может вызвать серьезные проблемы с почками или почечную недостаточность.

- В связи с гипокалиемией: в сочетании со слишком низким содержанием калия может вызвать диарею, утечку жидкости из поджелудочной железы и другие серьезные проблемы с мочевыводящими путями.
Гипохлоремия (недостаток хлорида)
- Это приводит к тому, что ваша кровь становится более щелочной, состояние, называемое алкалозом. Обычно это происходит при гипонатриемии или рвоте. Симптомами алкалоза являются апатия, спутанность сознания, аритмии и мышечные подергивания или потеря контроля.
Фосфат (-)
Фосфат — это молекула на основе фосфора, которая играет ключевую роль в транспортировке химических соединений и молекул за пределы ваших клеток.Он помогает вашим клеткам усваивать питательные вещества, а также является ключевой частью молекул, называемых нуклеотидами, которые являются строительными блоками, составляющими вашу ДНК.
- Гиперфосфатемия (слишком много фосфатов): Обычно это вызывает у вас гипокальциемию, потому что ваше тело пытается использовать кальций в качестве заменителя фосфора.
 Обычно это не вызывает симптомов, пока не становится тяжелым, и при этом также часто возникают симптомы гипокальциемии. Это также может быть связано с чрезмерным зудом.
Обычно это не вызывает симптомов, пока не становится тяжелым, и при этом также часто возникают симптомы гипокальциемии. Это также может быть связано с чрезмерным зудом. - Гипофосфатемия (недостаток фосфатов): ранним симптомом этого состояния обычно является мышечная слабость. По мере ухудшения состояния появляются более серьезные симптомы. К ним относятся рабдомиолиз (распад мышечной ткани, который может вызвать серьезное повреждение почек), судороги, снижение функции сердца и проблемы с дыханием (вызванные мышечной слабостью).
Бикарбонат (-)
Не весь углекислый газ, который производит ваше тело, попадает в ваши легкие, чтобы вы могли его выдохнуть. Вместо этого некоторые из них перерабатываются в бикарбонат, который ваш организм использует для поддержания нормального уровня pH крови.
- Ацидоз. Слишком малое количество бикарбоната вызывает ацидоз, когда ваша кровь слишком кислая. Это вызывает усталость, тошноту и рвоту, и вы будете дышать быстрее и глубже.
 Это также может вызвать путаницу.
Это также может вызвать путаницу. - Алкалоз. Слишком много бикарбоната вызывает алкалоз, когда ваша кровь становится слишком щелочной. Симптомы включают спутанность сознания, апатию, аритмии и подергивания мышц.
Детали теста
Какие тесты помогают выявить проблемы с электролитом?
Проблемы с электролитом можно обнаружить с помощью нескольких различных лабораторных тестов.Тестирование обычно включает в себя более широкий тип теста, называемый метаболической панелью. Если эти результаты не соответствуют норме, ваш лечащий врач может назначить дополнительные тесты, которые могут сузить круг причин электролитного дисбаланса. Эти последующие тесты имеют решающее значение, поскольку конкретная причина дисбаланса электролитов может потребовать определенного типа лечения, которое не будет работать для других причин.
Более широкие тесты, которые могут выявить проблемы с электролитами, включают следующие анализы крови:
Базовая метаболическая панель
Этот тест рассматривает несколько различных процессов в вашем организме и показывает данные, связанные с:
- АМК (азот мочевины крови).
 Это тест, который показывает, насколько хорошо функционируют ваши почки, и может указывать на обезвоживание.
Это тест, который показывает, насколько хорошо функционируют ваши почки, и может указывать на обезвоживание. - Баланс жидкостей и нескольких электролитов, включая уровни натрия, калия, углекислого газа и хлоридов.
- Сахар крови. Этот тест может указывать на диабет или преддиабет, если вы голодаете.
Комплексная метаболическая панель
Этот тест аналогичен базовой панели метаболизма, но с дополнительными данными. Дополнительные собранные предметы включают:
- Уровень кальция.
- Альбумин (белок, вырабатываемый вашей печенью).
- Уровень общего белка крови.
- Билирубин (химическое соединение, образующееся в печени).
- Уровни аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ), ферментов, которые связаны с функцией вашей печени.
Электролитная панель
Это более широкий тест, как и вышеупомянутые метаболические панели, но он ищет только электролиты. Анализируемые электролиты включают натрий, хлорид, калий и бикарбонат.
Тесты, которые более специфичны для проблем с электролитом, включают:
- Анализ крови на альдостерон. Этот тест ищет определенный гормон, вырабатываемый вашими почками. Результаты могут указывать на определенные типы проблем с электролитом.
- Суточный анализ мочи на альдостерон. Этот тест также ищет альдостерон, но делает это с использованием нескольких образцов мочи, собранных в течение 24 часов.
- Анализ крови на анионный разрыв. Тест сравнивает уровни определенных электролитов, чтобы увидеть, есть ли разница между измеренными уровнями электролитов с положительным и отрицательным зарядом, что может быть признаком определенных состояний.
- Анализ на антидиуретический гормон (кровь). Этот тест определяет уровень антидиуретического гормона. Это может помочь исключить определенные заболевания, которые имеют общие симптомы — особенно чрезмерную жажду или дисбаланс жидкости — с состояниями, связанными с электролитами.

- Анализ крови на углекислый газ. Этот тест измеряет количество углекислого газа в крови. Этот уровень может указывать на то, является ли ваша кровь слишком кислой или слишком щелочной (основной).
- Анализ крови на хлориды. Этот тест анализирует образец крови на уровень хлорида, обнаруженного в вашей крови.
- Анализ мочи на хлориды. Этот тест измеряет количество хлоридов в образце мочи. В некоторых случаях это может включать в себя несколько образцов, взятых в течение 24 часов.
- Анализ крови на магний. Этот тест анализирует уровень магния в крови.
- Анализ осмоляльности крови. Этот тест измеряет количество определенных веществ в организме. Он часто используется в тех случаях, когда вы обезвожены, гипергидратированы или когда отравление возможно или подозревается.
- Анализ осмоляльности мочи. Этот тест проверяет баланс жидкости, особенно при изменении частоты мочеиспускания.
 В тестах на осмоляльность мочи используется метод «чистого улова», который требует получения образца таким образом, чтобы не было заражения микробами, которые могут быть на ваших гениталиях.
В тестах на осмоляльность мочи используется метод «чистого улова», который требует получения образца таким образом, чтобы не было заражения микробами, которые могут быть на ваших гениталиях. - Анализ крови на фосфор. Этот тест измеряет количество фосфора в крови.
- Анализ мочи на фосфор. Этот тест измеряет количество фосфора в моче.Это может включать более одного образца, взятого в течение 24-часового периода.
- Анализ крови на содержание натрия. Этот тест измеряет уровень натрия в крови.
- Анализ мочи на содержание натрия. Этот тест измеряет количество натрия в моче. Он может включать в себя несколько образцов, собранных в течение 24 часов.
- Анализ концентрации мочи. Этот тест показывает поставщикам медицинских услуг, насколько хорошо функционируют ваши почки, особенно их способность управлять количеством жидкости в организме.Он специально ищет концентрацию частиц в моче, уровень электролитов и концентрацию частиц (осмоляльность).

Результаты и последующие действия
Какие результаты я получу?
Большинство лабораторных результатов включают ваш номер результата и контрольный диапазон. Референтный диапазон имеет верхний и нижний пределы, и любой результат, находящийся между ними, считается «нормальным» результатом. Большинство этих результатов сообщается как «сколько вещества можно найти в образце определенного размера.»
Масса — это единица измерения «сколько». Это не то же самое, что вес. В качестве единиц массы используются миллимоли, миллиэквиваленты или миллиграммы.
- Миллимоли являются наиболее постоянными и могут использоваться для всех атомов и молекул электролита. Вместо миллимолей часто используют
- миллиэквивалентов на литр. Это связано с тем, что миллиэквиваленты учитывают силу заряда иона, поэтому ионы с более сильным зарядом имеют разные количества, чем те же результаты испытаний в миллимолях.
- миллиграммов на децилитр иногда может использоваться для более крупных атомов и молекул.
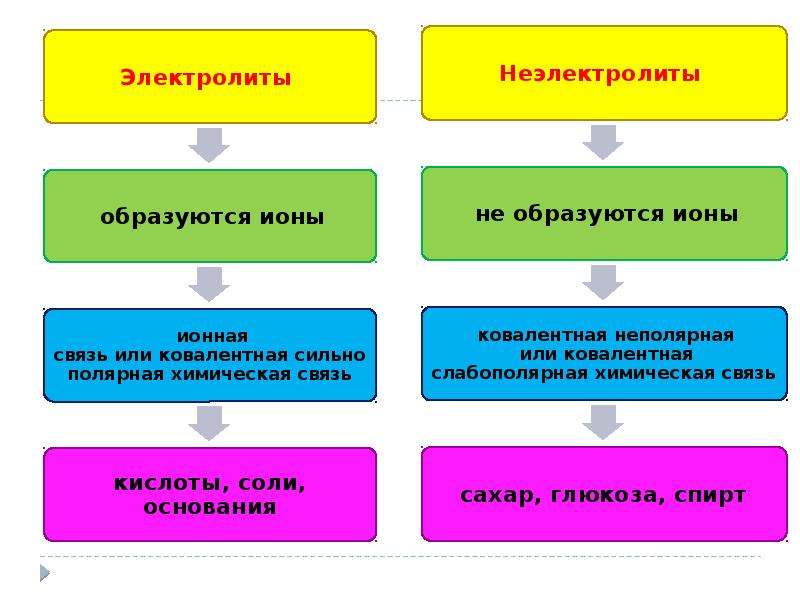
Приставка «милли-» означает «1/1000». Единицы объема обычно отображаются как литр или доли литра, например децилитр (дл, что составляет 1/10 литра) или миллилитр (мл, что составляет 1/1000 литра).
Каков нормальный диапазон уровней электролита?
В крови нормальные количества электролитов следующие:
| Meq | Милликвиваленты на литр MEQ / L) | миллиграмма на децилитра | миллимолей на литр | миллимолей на литр (ммоль / л) | 0 |
|---|---|---|---|
| натрий | 136 — 144 meq /л | — | 136 — 144 ммоль/л |
| Калий · Сыворотка (плазма) | 3.7–5,1 мэкв/л | — | 3,7–5,1 ммоль/л | 0 | Хлорид | 97 — 105 MEQ / L | — | 97 — 105 ммоль / л | 97 — 105 ммоль / л |
| бикарбонат | 22 — 30 meq / l | — | 22 — 30 ммоль / л |
| Кальций · Всего | — | 8,5–10,2 мг/дл | 2,12–2,54 ммоль/л |
| Магний · Сыворотка (плазма) | 1,4–1,9 мэкв/л | 1,7–2,3 мг/дл | 0.7 — 0,95 ммоль/л | 0 | Фосфат | 0,87 — 1.55 MEQ / L | — 1.55 MEQ / L2,7 — 4,8 мг / дл | 0,87 — 1,55 ммоль / л |
в моче, стуле или другие измеримые формы, нормальные количества для электролитов являются как следует:
| Электролит | Миллиграммы на децилитр (мг/дл) | Миллимоли на литр (ммоль/л) |
|---|---|---|
| 10
· Моча (случайная) | — | 14 — 216 ммоль/л |
| Калий · Моча (случайная) | — | 10–160 ммоль/л |
| Хлорид · Моча (случайная) | — | 16–250 ммоль/л |
| Бикарбонат | — | Н/Д |
| Кальций · Моча (случайная) | 0. | — |
| Магний · Моча (случайно) | 23,2 мг/дл или менее | — |
| Фосфат · Моча (случайно) | 7 — 140 мг/дл | — |
Нормальный результат означает, что все в порядке, или ненормальный результат всегда означает, что у меня проблема?
Поскольку все люди разные, иногда вы можете получить результат, выходящий за пределы референсного диапазона.В других случаях у вас может быть нормальный результат, но симптомы, которые у вас есть, и результаты других анализов покажут, что у вас проблемы со здоровьем.
Один из способов понять это — вспомнить карнавальный трюк, когда артист крутит тарелку на конце деревянной палочки.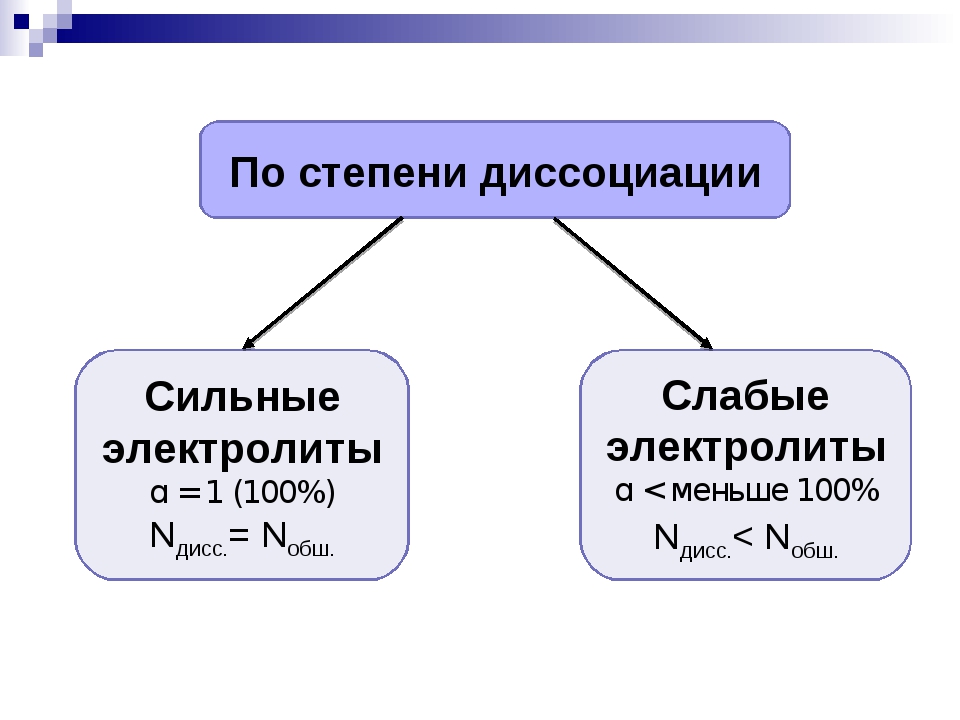 Если тарелка наклонится слишком далеко в любом направлении, она упадет, поэтому баланс имеет решающее значение. Ваш уровень электролитов и результаты лабораторных анализов основаны на подобном уравновешивании, и ваше тело всегда пытается сохранить равновесие, насколько это возможно.Ваше тело может маскировать проблему, компенсируя ее другой системой или процессом. Если ваш поставщик медицинских услуг проводит более одного теста, они, вероятно, следят за тем, чтобы ваше тело не скрывало одну проблему, создавая другую.
Если тарелка наклонится слишком далеко в любом направлении, она упадет, поэтому баланс имеет решающее значение. Ваш уровень электролитов и результаты лабораторных анализов основаны на подобном уравновешивании, и ваше тело всегда пытается сохранить равновесие, насколько это возможно.Ваше тело может маскировать проблему, компенсируя ее другой системой или процессом. Если ваш поставщик медицинских услуг проводит более одного теста, они, вероятно, следят за тем, чтобы ваше тело не скрывало одну проблему, создавая другую.
Когда я должен узнать результаты теста?
Ваш лечащий врач или его персонал могут сообщить вам, когда ожидать результаты анализов.
Когда я должен позвонить своему врачу?
Если вы не понимаете результаты своего теста или ваш результат выходит за пределы референтного диапазона, и у вас есть вопросы или опасения, вам следует позвонить своему поставщику медицинских услуг.Вам также следует позвонить своему лечащему врачу, если вы заметили внезапное изменение каких-либо симптомов, связанных с каким-либо тестом на уровень электролитов.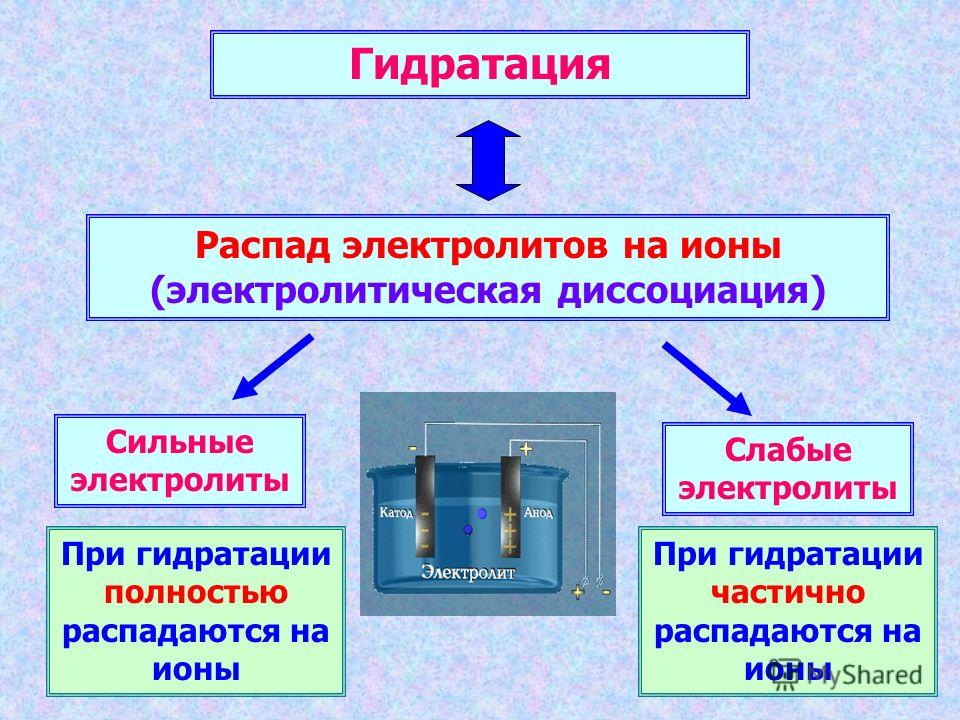
Записка из Кливлендской клиники
Электролиты являются неотъемлемой частью функционирования вашего тела, влияя на все, от гидратации до того, как бьется ваше сердце. Они также могут помочь врачам диагностировать широкий спектр заболеваний и проблем. Понимание электролитов и потенциальных проблем, которые их окружают, может помочь вам позаботиться о себе и избежать проблем со здоровьем в будущем.Таким образом, вы можете взять на себя ответственность за свои электролиты и не допустить их негативного влияния на вашу жизнь и распорядок дня.
границ | Перспективы и идеи дизайна чистых ионных жидкостей в качестве суперконденсаторных электролитов
Введение
Суперконденсаторы (SC) представляют собой электрохимические системы накопления энергии, которые играют важную роль в решении глобальной проблемы интеграции возобновляемых источников энергии в энергетический баланс. Электролиты являются основными компонентами электрохимических систем накопления энергии, таких как SC.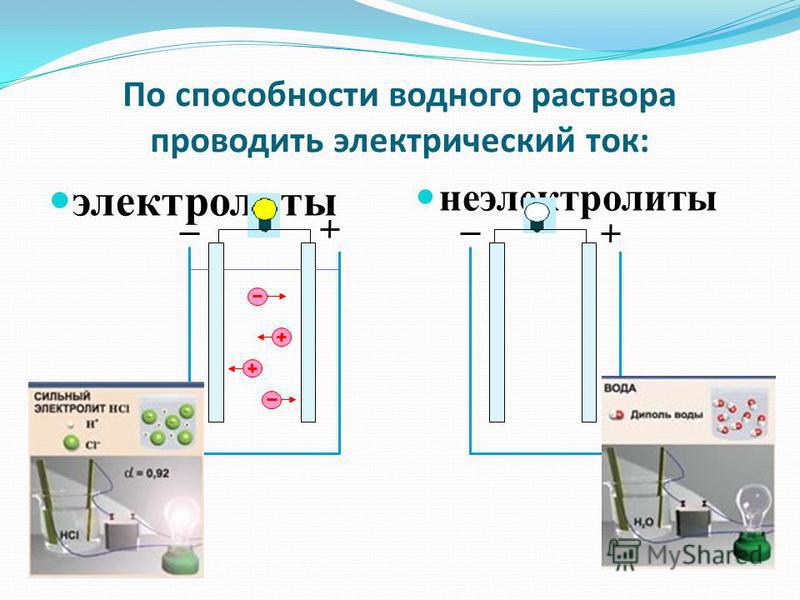 Функции электролитов включают; транспортировка реагентов или поддерживающих веществ в больших количествах и обеспечение электронной изоляции между электродами / клеммами (Dühnen et al., 2020). Электролиты, применяемые в настоящее время в электрохимических накопителях энергии, включают водные (Susantyoko et al., 2019; Huang et al., 2019; Sharma et al., 2020; Sundaram and Appadoo, 2020; Minakshi Sundaram et al., 2016), органические растворители ( Xia et al., 2017), глубинные эвтектические растворители (Dinh et al., 2020; Jaumaux et al., 2020) и ионные жидкости (ИЖ) (Gunday et al., 2019; Гандай и др., 2020 г.; Мартинс и Торрези, 2018 г.; Челлаппан и др., 2020). В SC электролиты на основе органических растворителей особенно страдают от различных недостатков, таких как; высокая стоимость, проблемы безопасности, громоздкие процедуры синтеза и очистки и низкая ионная проводимость (Bamgbopa et al., 2017). Следовательно, возникает необходимость в разработке электролитных систем, лишенных этих недостатков.
Функции электролитов включают; транспортировка реагентов или поддерживающих веществ в больших количествах и обеспечение электронной изоляции между электродами / клеммами (Dühnen et al., 2020). Электролиты, применяемые в настоящее время в электрохимических накопителях энергии, включают водные (Susantyoko et al., 2019; Huang et al., 2019; Sharma et al., 2020; Sundaram and Appadoo, 2020; Minakshi Sundaram et al., 2016), органические растворители ( Xia et al., 2017), глубинные эвтектические растворители (Dinh et al., 2020; Jaumaux et al., 2020) и ионные жидкости (ИЖ) (Gunday et al., 2019; Гандай и др., 2020 г.; Мартинс и Торрези, 2018 г.; Челлаппан и др., 2020). В SC электролиты на основе органических растворителей особенно страдают от различных недостатков, таких как; высокая стоимость, проблемы безопасности, громоздкие процедуры синтеза и очистки и низкая ионная проводимость (Bamgbopa et al., 2017). Следовательно, возникает необходимость в разработке электролитных систем, лишенных этих недостатков.
SC можно разделить на три класса по механизму хранения заряда: 1) электрические двухслойные конденсаторы (EDLC), 2) псевдоконденсаторы и 3) гибридные суперконденсаторы (Pal et al., 2019). EDLC накапливает заряд за счет образования двойного электрического слоя на границе раздела электрод-электролит. Образование двойного электрического слоя происходит за счет адсорбции ионов (катионов и анионов) на соответствующих электродах. Быстрая диффузия ионов в электролите способствует высокой плотности мощности EDLC. В псевдоконденсаторе энергия запасается за счет обратимых окислительно-восстановительных реакций с быстрым внедрением ионов электролита на поверхность электродов и образованием двойного электрического слоя.Гибридный SC представляет собой комбинацию EDLC и псевдоконденсатора, и он показал превосходную производительность, поскольку сочетает в себе механизм накопления заряда как EDLC, так и псевдоконденсатора (Muzaffar et al., 2019). Более подробное описание типов суперконденсаторов и их механизма накопления заряда можно найти в другом месте (Raza et al. , 2018) (Pal et al., 2019).
, 2018) (Pal et al., 2019).
Быстрое накопление и высвобождение энергии являются характерными характеристиками СК из-за их более быстрого процесса заряда-разряда, который ограничивается диффузией.Эквивалентная удельная емкость (Ceq, в Fg -1 ) является основным критерием, используемым для оценки характеристик материала электрода SC. Удельную емкость СК можно рассчитать по кривым заряда-разряда по уравнению. 1, с плотностью энергии, определяемой уравнением. 2.
Ceq=Δt∫I dtm∫V dt(1)Energy Density=∫I Vdtm(2) где I – ток в процессе разряда, m – масса активного материала электрода, V – регистрируемый потенциал устройства, Δt – общее время разряда.Как видно из уравнения (2), значительное увеличение плотности энергии может быть достигнуто за счет расширения окна рабочих потенциалов СК. ИЖ привлекают большое внимание в качестве электролитов СК в первую очередь из-за возможности более широких окон электрохимического потенциала (Lei et al., 2013; DeVos et al., 2014), что может значительно помочь СК достичь более высоких плотностей энергии по сравнению с применением водных электролитов. Кроме того, большинство чистых электролитов IL могут работать при повышенных температурах (>100°C) из-за их высокой термической стабильности и негорючести (Torrecilla et al., 2008) по сравнению с органическими растворителями. IL также связаны с замечательными свойствами, такими как; жидкое состояние в широком диапазоне температур, незначительное давление пара, высокая термическая стабильность (Wasserscheid and Welton, 2008; Van Aken et al., 2015; Lethesh et al., 2014b). Более высокая электрохимическая и термическая стабильность ИЖ делает их подходящими для разработки высоковольтных и высокотемпературных СЭ (Zhang et al., 2018).
Кроме того, большинство чистых электролитов IL могут работать при повышенных температурах (>100°C) из-за их высокой термической стабильности и негорючести (Torrecilla et al., 2008) по сравнению с органическими растворителями. IL также связаны с замечательными свойствами, такими как; жидкое состояние в широком диапазоне температур, незначительное давление пара, высокая термическая стабильность (Wasserscheid and Welton, 2008; Van Aken et al., 2015; Lethesh et al., 2014b). Более высокая электрохимическая и термическая стабильность ИЖ делает их подходящими для разработки высоковольтных и высокотемпературных СЭ (Zhang et al., 2018).
ИЖ представляют собой органические соли, состоящие из катионов и анионов, с температурой плавления предпочтительно ниже 100°C (Hallett and Welton, 2011; Abbas et al., 2015; Летеш и др., 2012). Если они остаются жидкими в условиях окружающей среды, их называют ионными жидкостями при комнатной температуре (Tokuda et al., 2006; Welton, 2018; Venkatraman et al. , 2019). Наиболее часто используемые анионы и катионы для синтеза ИЖ представлены на рис. , 2018; Grøssereid et al., 2019), и функционализированные (для конкретных задач) (Davis, 2004; Butt et al., 2020) IL (рис. 1).
, 2019). Наиболее часто используемые анионы и катионы для синтеза ИЖ представлены на рис. , 2018; Grøssereid et al., 2019), и функционализированные (для конкретных задач) (Davis, 2004; Butt et al., 2020) IL (рис. 1).
РИСУНОК 1 . Обычно используемые катионы и анионы в ИЖ и классификация ИЖ (H-протон, R 1 — Алкильная цепь, X — электроотрицательный атом, FG — функциональная группа).
Как правило, катионы большие и громоздкие, что препятствует эффективной упаковке ионов в кристаллической решетке и приводит к низкой температуре плавления. Анионы могут быть органическими или неорганическими, и их свойства во многом определяют общие характеристики ИЖ (Marsh et al., 2004; Chellappan et al., 2011; Летеш и др., 2014b). Физико-химические и электрохимические свойства ИЖ также можно настроить путем тщательного подбора пар катион/анион и введения желаемых функциональных групп (Davis, 2004) (Giernoth, 2010) на ионы в соответствии с требованиями (Li et al. , 2006; Tang и др., 2012). Эта гибкость позволяет рассматривать ИЖ как дизайнерские растворители.
, 2006; Tang и др., 2012). Эта гибкость позволяет рассматривать ИЖ как дизайнерские растворители.
Значительные усилия были направлены на разработку электролита ИЖ для СК (Varzi et al., 2014; Aradilla et al., 2019; Ма и др., 2018). На рисунке 2 обобщены примеры применения SC с электролитами на основе IL, механизм накопления заряда псевдоконденсатора и EDLC (Wang et al., 2016) и графическое представление кривых циклической вольтамперометрии (CV) псевдоконденсатора и EDLC (Lin Z. et al. , 2011). Тем не менее, некоторые проблемы все еще необходимо решить для более широкого / крупномасштабного применения ИЖ в качестве электролитов для СК. Хотя во многих интересных работах рассматривалось применение электролита IL при SC (Zhong et al., 2015; Ван Акен и др., 2015 г.; Шахзад и др., 2019; Lian C. et al., 2019), (Pan et al., 2020; Xu et al., 2021; Miao et al., 2021), специализированный обзор, объясняющий взаимосвязь между химическим составом ИЖ и эффективностью ИЖ в качестве электролитов в СК. не получил большого внимания. Кроме того, также отсутствуют четкие объяснения стратегий разработки для улучшения транспортных свойств и электрохимических характеристик электролитов ИЖ для СК. Здесь мы пытаемся восполнить этот пробел подробной оценкой физико-химических свойств ИЖ и их вклада в характеристики СК, в дополнение к соображениям дизайна и проблемам применения чистых ИЖ в качестве электролитов в СК.Особое внимание мы уделяем чистым ИЖ, используемым в качестве электролитов СК, чтобы исключить влияние других растворителей. В чистых ИЖ природа катиона, длина алкильного спейсера на катионе и тип анионов играют главную роль в определении их электрохимических свойств и характеристик электролита. Следовательно, они дают возможность настраивать свойства электролита путем правильного подбора комбинаций катион-анион. Кроме того, при использовании ИЖ можно избежать эффекта сольватации, поскольку они состоят из катионов и анионов.Предыдущие исследования электролитов IL, опубликованные с 2010 года, рассматривались только как краткий обзор.
не получил большого внимания. Кроме того, также отсутствуют четкие объяснения стратегий разработки для улучшения транспортных свойств и электрохимических характеристик электролитов ИЖ для СК. Здесь мы пытаемся восполнить этот пробел подробной оценкой физико-химических свойств ИЖ и их вклада в характеристики СК, в дополнение к соображениям дизайна и проблемам применения чистых ИЖ в качестве электролитов в СК.Особое внимание мы уделяем чистым ИЖ, используемым в качестве электролитов СК, чтобы исключить влияние других растворителей. В чистых ИЖ природа катиона, длина алкильного спейсера на катионе и тип анионов играют главную роль в определении их электрохимических свойств и характеристик электролита. Следовательно, они дают возможность настраивать свойства электролита путем правильного подбора комбинаций катион-анион. Кроме того, при использовании ИЖ можно избежать эффекта сольватации, поскольку они состоят из катионов и анионов.Предыдущие исследования электролитов IL, опубликованные с 2010 года, рассматривались только как краткий обзор.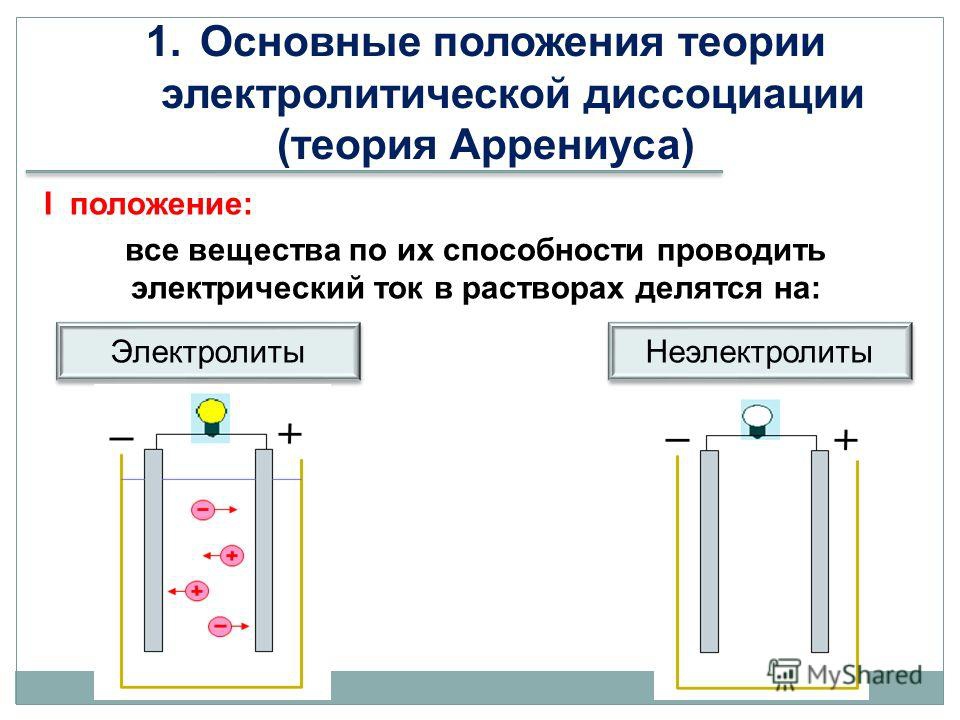 Сокращения, использованные в данном обзоре, приведены в таблице 1.
Сокращения, использованные в данном обзоре, приведены в таблице 1.
РИСУНОК 2 . (A) Применение ИЛ в СЦ. Перепечатано с разрешения (Pan et al., 2020), Frontiers in chemistry, (B) Механизм накопления заряда в конденсаторе с двойным электрическим слоем (EDLC) и псевдоконденсаторе. Перепечатано из (Panda et al., 2020), Королевского химического общества. . (C) CV конденсатора с двойным электрическим слоем (EDLC) и псевдоконденсатора.Перепечатано с разрешения (Lin Z. et al., 2011) Американского химического общества.
ТАБЛИЦА 1 . Сокращения, использованные в рукописи.
Характеристики суперконденсаторов с чистыми ионными жидкостями Электролиты
Ионные жидкости на основе имидазолия
ИЖ на основе имидазолия являются одними из наиболее широко изученных ИЖ и электролитов в SC из-за их низкой вязкости и высокой проводимости, особенно в сочетании с рядом угольных электродов. , как видно из недавнего исследования (Ortega et al., 2020). Там, где имидазолиевые ИЖ [(EMIM)(Tf 2 N)] и ([(EMIM)(BF 4 )] сочетались с различными углеродными электродными материалами, такими как активированный уголь (AC), мезопористый уголь (MES), многостенные углеродные нанотрубки (MWCNT) и восстановленный оксид графена (RGO) в SC
, как видно из недавнего исследования (Ortega et al., 2020). Там, где имидазолиевые ИЖ [(EMIM)(Tf 2 N)] и ([(EMIM)(BF 4 )] сочетались с различными углеродными электродными материалами, такими как активированный уголь (AC), мезопористый уголь (MES), многостенные углеродные нанотрубки (MWCNT) и восстановленный оксид графена (RGO) в SC
Исследование было направлено на получение информации о совместимости ионов с электродами, факторах, влияющих на накопление заряда и его влиянии на характеристики SC. Интересно, что хотя исследованные ИЖ содержат один и тот же катион, их свойства совершенно различны.Например, (EMIM)(Tf 2 N) является гидрофобным, тогда как (EMIM)(BF 4 ) является гидрофильным. Кроме того, (EMIM)(BF 4 ) показал более высокую ионную проводимость (14 мСм см -1 ), несмотря на его более высокую вязкость (42 сП). Наблюдения указывают на роль парного аниона с имидазолием в физических свойствах. На рис. 3А, В показано; удельная емкость, плотность энергии и плотность мощности, построенные с помощью (EMIM)(Tf 2 Н) и (EMIM)(BF 4 ) с выбранным материалом электрода.
3А, В показано; удельная емкость, плотность энергии и плотность мощности, построенные с помощью (EMIM)(Tf 2 Н) и (EMIM)(BF 4 ) с выбранным материалом электрода.
РИСУНОК 3 . Удельная емкость в зависимости от плотности тока для СЭ с различными пористыми углеродными электродами и электролитами (А) (ЭМИМ) (Тф 2 Н) и (Б) (ЭМИМ) (БФ 4 ) . Перепечатано с разрешения (Ortega et al., 2020), Американского химического общества.
Из рис. 3 можно сделать вывод, что ИЖ на основе имидазолия лучше SC с электродными материалами, содержащими большой объем мезопор. Повышенная плотность мощности была достигнута за счет открытых и доступных поверхностей электродного материала, таких как мезопористый углерод (Lian Y.-М. et al., 2019) и многостенные углеродные нанотрубки (Zhang et al., 2018). Эти наблюдения в целом справедливы для широкого круга СЭ с электролитами ИЖ. В электродных материалах на углеродной основе с большим объемом пор и множеством микропор (таких как активированный и мезопористый уголь) взаимодействия между катионами имидазолия и десорбцией коионов, присутствующих в порах, определяют удельную емкость и сопротивление электрохимического двойного слоя. емкость. Сводная информация о характеристиках различных SC, содержащих чистый имидазолиевый электролит ИЖ, показана в Таблице 2 .
емкость. Сводная информация о характеристиках различных SC, содержащих чистый имидазолиевый электролит ИЖ, показана в Таблице 2 .
ТАБЛИЦА 2 . Краткая информация об эффективности подкожного введения ИЛ на основе имидазолия.
Характеристики (удельная емкость и плотность энергии) СК в таблице 2 подчеркивают, что соответствие размера пор электрода размеру ионов электролита ИЖ не является единственным существенным критерием при выборе углеродных электродных материалов для СК. Другие взаимодействия ИЖ с электродными материалами, в том числе ион-ионное взаимодействие внутри ИЖ, функциональные группы на поверхности углеродного электрода, входят в число других соображений, как будет показано в последующих разделах этой работы.Характерным наблюдением, которое качественно определяет SC как суперконденсатор с двойным электрохимическим слоем, является почти прямоугольная форма отклика циклической вольтамперометрии, которая также отображает влияние ограничения диффузии ионов на предельную плотность тока. Ограничения диффузии ионов часто определяются электропроводностью и преобладающей мезопорой электрода (Hu et al., 2019). Ключевым моментом является то, что пористая структура электрода создает легкий путь для доступа ионов электролита к поверхности электрода, как показано Tamailarasan et al.(Тамаиларасан и Рамапрабху, 2012 г.).
Ограничения диффузии ионов часто определяются электропроводностью и преобладающей мезопорой электрода (Hu et al., 2019). Ключевым моментом является то, что пористая структура электрода создает легкий путь для доступа ионов электролита к поверхности электрода, как показано Tamailarasan et al.(Тамаиларасан и Рамапрабху, 2012 г.).
Ограничения диффузии ионов также могут быть исключительно результатом свойства IL, были оценены физико-химические свойства двух имидазолийсодержащих анионов трис(пентафторэтил)трифторфосфата (FAP) и тетрацианобората {[B(CN) 4 ] − } , и их эффективность в качестве электролита в SC была изучена (Seki et al., 2012) (таблица 2). Из-за большего размера аниона (FAP) — вязкость IL на основе аниона (FAP) — (43 мПа.с) выше по сравнению с аналогом [B(CN) 4 ] − на основе анионов (15 мПа·с). В то же время ионная проводимость (EMIM)(FAP) была почти в три раза ниже (6,9 мСм см -1 ), чем (EMIM) [B(CN) 4 ] (19,0 мСм см -1 ). ) при 30°С. Иными словами, природа анионов играет существенную роль в определении свойств ИЖ и работоспособности СК.
) при 30°С. Иными словами, природа анионов играет существенную роль в определении свойств ИЖ и работоспособности СК.
В дополнение к реакции на одиночный/изолированный заряд-разряд важным показателем производительности SC является сохранение емкости и стабильность циклов (Kurig et al., 2012). При исследовании химической обратимости ИЖ СЦ систем с катионом (EMIM) + и различными анионами, такими как (BF 4 ) − , (Tf 2 N) − , (FSI) − , (FPA) — , [B(CN) 4 ] — и (SCN) — (Kurig et al., 2011). Окисление (SCN) — до тиоциана вызвало отклонение от идеального емкостного поведения. Циклическая стабильность в СК также может быть связана со смачиваемостью электролитом стенок пор электрода из-за присутствия функциональных групп на стенках пор (Тангавел и др., 2018).
Как правило, из этих более ранних исследований мы наблюдали, что относительно хорошие характеристики ИЖ на основе катионов имидазолия в качестве электролитов SC могут быть связаны с малым размером ионов, заметной электрохимической стабильностью (в зависимости от парного аниона), низкой вязкостью и высокой проводимостью.
Редокс-активные ионные жидкости Электролиты
Для дальнейшего повышения плотности энергии СК были проведены исследования редокс-активных ИЖ. Дополнительный механизм накопления заряда (псевдоемкость) предлагается за счет окислительно-восстановительных частиц, присущих ИЖ, а не за счет применения псевдоемкостных материалов твердого электрода.СЭ, собранные с окислительно-восстановительными ИЖ, еще больше размывают границы между батареями и СЭ, учитывая, что гальваностатический заряд-разрядный отклик этих СЭ начинает выглядеть более «батарейным». Фик и др. (2019) воспользовались свойством псевдогалогенидного аниона и отличными транспортными свойствами ИЖ на основе аниона селеноцианата (SeCN) для разработки окислительно-восстановительной ИЖ для СК. Эти ИЖ оказались многообещающими кандидатами, поскольку ранее они широко изучались в солнечных элементах, сенсибилизированных красителем (Wang et al., 2004).
(EMIM)(SeCN) был испытан в качестве электролита SC с использованием электрода из активированного угля (Fic et al.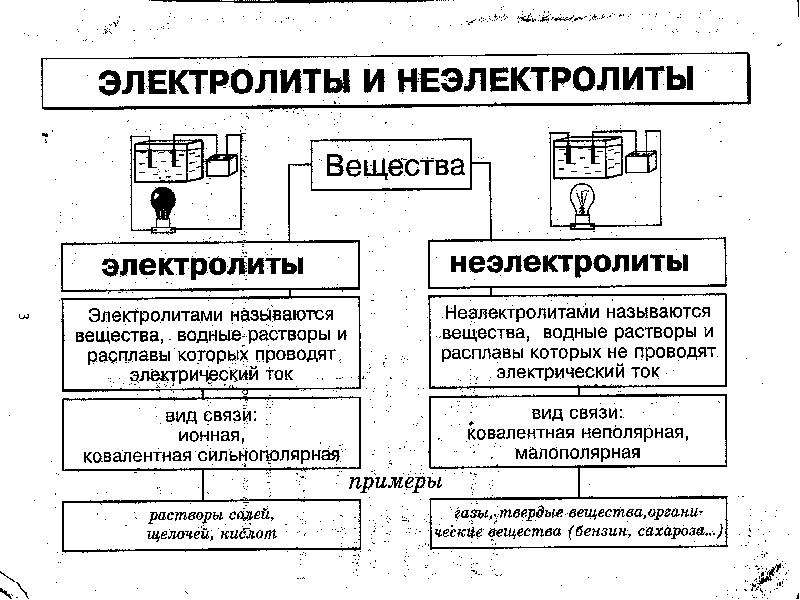 , 2019). Из-за низкой вязкости (17 мПс) и относительно высокой проводимости (25 мСм·см -1 ) (EMIM)(SeCN) показал многообещающую емкость (таблица 3), особенно при более высокой плотности тока (42 Fg -1 при 2,5 Ag). −1 ). Заметные характеристики ИЖ на основе анионов (SeCN) — могут быть связаны с их достаточной электрохимической стабильностью, низкой вязкостью, небольшими ионными объемами и, следовательно, высокой ионной проводимостью. Применены другие предыдущие исследовательские усилия; ИЖ, содержащие металл Cu(II) (Sun et al., 2010), ионы брома (Br 2 /Br 3 − ) (Yamazaki et al., 2012) и гидрохинон (Sathyamoorthi et al., 2015).
, 2019). Из-за низкой вязкости (17 мПс) и относительно высокой проводимости (25 мСм·см -1 ) (EMIM)(SeCN) показал многообещающую емкость (таблица 3), особенно при более высокой плотности тока (42 Fg -1 при 2,5 Ag). −1 ). Заметные характеристики ИЖ на основе анионов (SeCN) — могут быть связаны с их достаточной электрохимической стабильностью, низкой вязкостью, небольшими ионными объемами и, следовательно, высокой ионной проводимостью. Применены другие предыдущие исследовательские усилия; ИЖ, содержащие металл Cu(II) (Sun et al., 2010), ионы брома (Br 2 /Br 3 − ) (Yamazaki et al., 2012) и гидрохинон (Sathyamoorthi et al., 2015).
ТАБЛИЦА 3 . Резюме по эффективности SC редокс-активных ИЖ.
Более высокое значение емкости медьсодержащих ИЖ связано с псевдоемкостным вкладом окислительно-восстановительной реакции Cu(II)/Cu (табл. 3). Катион имидазолия может координироваться с металлами через свой кислый протон при атоме углерода C 2 и образовывать комплекс Cu(II) ИЖ (Blue et al.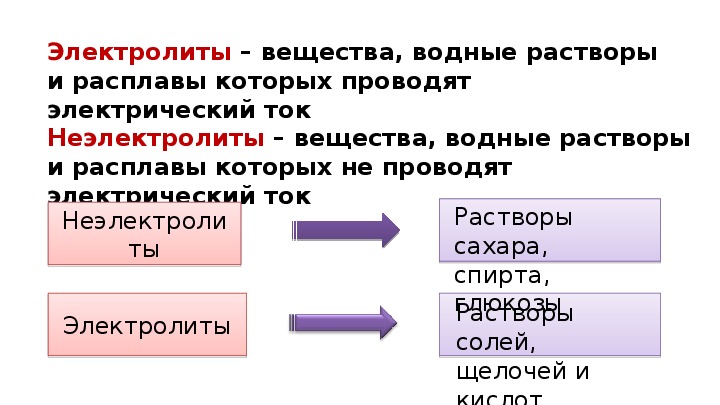 , 2006). Следует отметить, что термическая стабильность и влияние содержания галогенидов на транспортные свойства ИЖ с металлокомплексами часто не сообщаются. Известно, что даже минимальная концентрация галогенидных примесей может отрицательно сказаться на вязкости ИЖ (Seddon et al., 2000). Учитывая эти опасения и целевые показатели эффективности SC, также необходимо оценить оптимальное положение и полярность редокс-активного компонента/молекулы в IL.
, 2006). Следует отметить, что термическая стабильность и влияние содержания галогенидов на транспортные свойства ИЖ с металлокомплексами часто не сообщаются. Известно, что даже минимальная концентрация галогенидных примесей может отрицательно сказаться на вязкости ИЖ (Seddon et al., 2000). Учитывая эти опасения и целевые показатели эффективности SC, также необходимо оценить оптимальное положение и полярность редокс-активного компонента/молекулы в IL.
Биредокс-ИЖ с антрахиноном на анионе [(AQ-PFS) − ] и 2,2,6,6-тетраметилпиперидинил-1-оксил (TEMPO) на имидазолиевом катионе [(MIM-TEMPO) + ] также были продемонстрированы в качестве электролита для SC (Mourad et al., 2017). Введенный bi-redox IL должен был быть растворен в (BMIM)(Tf 2 N) (из-за высокой вязкости), чтобы можно было проводить испытания при комнатной температуре. Напротив, чистые биредокс-электролиты ИЖ были испытаны при повышенных температурах (60°С) из-за значительного снижения вязкости с повышением температуры.
При использовании только электролита (BMIM)(Tf 2 N) виден двухслойный механизм накопления заряда без каких-либо фарадеевских реакций. В случае биредокс-ИЖ, растворенных в (BMIM)(Tf 2 N), редокс-активные ионы (AQ-PFS) − и (MIM-TEMPO) + электроадсорбируются на поверхности угольного электрода, а также вступают в реакцию Фарадея.Введение восстанавливаемой части аниона и окисляемых частиц катиона помогло получить бианионы и бикатионы на аноде и катоде. Из вышеизложенного можно сделать вывод, что введение окислительно-восстановительных активных материалов позволяет улучшить характеристики СЭ. Однако это может отрицательно сказаться на транспортных свойствах и электрохимической стабильности ИЖ. Сводная информация о характеристиках окислительно-восстановительных ИЖ представлена в Таблице 3.
Электролиты на основе протонных ионных жидкостей
катионное ядро, которое может включать координацию с металлами (Menne et al. , 2014). Однако этот обменный водород на катионном ядре приводит к низкой термической стабильности PIL. Из-за относительно простой процедуры синтеза и отсутствия необходимости стадий очистки протонные ИЖ привлекают большое внимание в различных приложениях, таких как; электролит для литий-ионных аккумуляторов (Menne et al., 2013; Vogl et al., 2014), процессы экстракции (Wang et al., 2020; Rodrigues et al., 2018; Janssen et al., 2016).
, 2014). Однако этот обменный водород на катионном ядре приводит к низкой термической стабильности PIL. Из-за относительно простой процедуры синтеза и отсутствия необходимости стадий очистки протонные ИЖ привлекают большое внимание в различных приложениях, таких как; электролит для литий-ионных аккумуляторов (Menne et al., 2013; Vogl et al., 2014), процессы экстракции (Wang et al., 2020; Rodrigues et al., 2018; Janssen et al., 2016).
В недавнем исследовании (Mayrand-Provencher and Rochefort, 2009) PIL были получены из ароматических гетероциклических соединений (основания), содержащих два атома азота, и трифторуксусной кислоты.Оценивали влияние множественных центров протонного обмена и влияние кислотной силы (pKa) на физико-химические свойства этих ЛПИ и емкость СК, содержащих электроды RuO 2 . В то же время зарегистрированные удельные проводимости варьировали от 0,71 до 9,07 мСм·см -1 при 27°С. Во всех исследованных PIL проводимость улучшалась с увеличением количества используемой кислоты, и самое высокое значение было получено при соотношении основания и кислоты 1:2. Это увеличение проводимости связано с уменьшением вязкости, полученной при таком соотношении.
Это увеличение проводимости связано с уменьшением вязкости, полученной при таком соотношении.
Как и ожидалось в случае PIL, pH (потенциал водорода) полученного электролита SC оказывает значительное влияние на значение удельной емкости, как продемонстрировали Demarconnay и его коллеги (Demarconnay et al., 2013). Использовались PIL, такие как нитрат пирролидиния [(Pyr)(NO 3 )] и бис(трифторметилсульфонил)имид триэтиламмония [(N 222H )(Tf 2 N)] с высокой проводимостью, различным pH и содержанием воды. как электролиты с углеродными электродами.Изменение pH электролита от 7 до 11 увеличивало удельную емкость со 121 до 208 Fg -1 для (Pyr)(NO 3 ). Более высокое значение емкости при рН 21 было приписано псевдоемкостному вкладу, возникающему из-за повышенной подвижности протона PIL за счет присутствия нескольких аминных центров на материале электрода. Содержание воды в электролите отрицательно сказывалось на рабочем напряжении и величине удельной емкости. Учитывая сложность сушки PIL, необходимо соблюдать осторожность при выборе анионов PIL.PIL, содержащие гидрофобные анионы, имеют тенденцию снижать содержание воды в PIL и могут способствовать повышению производительности.
Учитывая сложность сушки PIL, необходимо соблюдать осторожность при выборе анионов PIL.PIL, содержащие гидрофобные анионы, имеют тенденцию снижать содержание воды в PIL и могут способствовать повышению производительности.
Таким образом, PIL, показанные в литературе, являются многообещающими кандидатами для SC угольных электродов из-за псевдофарадеевской реакции между кислородсодержащими функциональными группами на активированном угле и протоном на PIL. Низкая рабочая температура, предлагаемая некоторыми PIL (Montes-Morán et al., 2004), может быть полезна в различных приложениях, таких как аэрокосмическая промышленность.
Ионные жидкости на основе сульфония Электролит
Как и PIL, ИЖ на основе сульфония также относительно легко синтезировать для применения в качестве электролитов SC, как показано Anouti et al. (2012). Они синтезировали бис(трифторметилсульфонил)имид триметилсульфония (Me 3 S) (Tf 2 N) путем простого алкилирования диметилсульфида соответствующими алкилгалогенидами с последующей реакцией метатезиса полученной галогенидной соли с Li (Tf 2 Н). Хотя (Me 3 S)(Tf 2 N) был получен в виде твердого вещества при комнатной температуре (T m = 45.5°C), ИЖ показала высокую проводимость (20,42 мСм см -1 ) при 80°C, что значительно выше, чем у ИЖ на основе аммония, используемых в СК. (Me 3 S) (Tf 2 N) также показал очень низкую вязкость (3 мПа·с) при аналогичных экспериментальных условиях. Меньший ионный размер и высокая текучесть при 80°C способствовали высокой проводимости в (Me 3 S) (Tf 2 N) ИЖ, характерной для ИЖ, содержащих сульфониевый катион. В чистом виде (Me 3 S) (Tf 2 N) применяли в качестве электролита SC (Maton et al., 2013), окно потенциала 5,3 В (по сравнению с Ag/Ag + ) было сообщено при 50°C со значением емкости 130 Fg -1 и 140 Fg -1 при 50°C и 80°C. °С соответственно. Эти значения почти вдвое выше, чем у (Pyr 1,4 ) (Tf 2 N) при аналогичных условиях с теми же электродами из активированного угля.
Хотя (Me 3 S)(Tf 2 N) был получен в виде твердого вещества при комнатной температуре (T m = 45.5°C), ИЖ показала высокую проводимость (20,42 мСм см -1 ) при 80°C, что значительно выше, чем у ИЖ на основе аммония, используемых в СК. (Me 3 S) (Tf 2 N) также показал очень низкую вязкость (3 мПа·с) при аналогичных экспериментальных условиях. Меньший ионный размер и высокая текучесть при 80°C способствовали высокой проводимости в (Me 3 S) (Tf 2 N) ИЖ, характерной для ИЖ, содержащих сульфониевый катион. В чистом виде (Me 3 S) (Tf 2 N) применяли в качестве электролита SC (Maton et al., 2013), окно потенциала 5,3 В (по сравнению с Ag/Ag + ) было сообщено при 50°C со значением емкости 130 Fg -1 и 140 Fg -1 при 50°C и 80°C. °С соответственно. Эти значения почти вдвое выше, чем у (Pyr 1,4 ) (Tf 2 N) при аналогичных условиях с теми же электродами из активированного угля.
Наблюдаемые результаты с (Me 3 S) (Tf 2 N) усиливают влияние высокой проводимости, более низкой вязкости и небольшого размера (Me 3 S) + (0.6 нм) по сравнению с катионом (Pyr 1,4 ) + (1,1 нм). Более высокие плотности энергии и мощности, зарегистрированные для сульфониевых ИЖ, делают их перспективным классом электролитов для СЭ. Однако термическая стабильность ИЖ на основе сульфония при повышенных температурах по-прежнему вызывает беспокойство (Zhang et al., 2009; Coadou et al., 2016).
Сампайо и его коллеги (Sampaio et al., 2019) провели исследования молекулярной динамики для оценки электрических, динамических и структурных свойств трех ИЖ на основе сульфония диэтилметилсульфония бис(трифторметилсульфонил)имида [(S 221 )(Tf 2 N)], бис(трифторметилсульфонил)имид триэтилсульфония [(S 222 )(Tf 2 N)] и бис(трифторметилсульфонил)имид диэтилпропилсульфония [(S 223 )(Tf 2 )901 при атомный уровень. Было замечено, что как вязкость, так и ионная проводимость этих ИЖ варьировались в зависимости от размера катиона. Однако различия в свойствах оказали незначительное влияние на производительность SC, особенно на значение удельной емкости, что противоречит более ранним сообщениям (Li S. et al., 2016) и нашим ранее выделенным соотношениям. Мы подозреваем, что почти однородность их SC-специфической емкости связана с микропористым активированным углем в качестве материала электрода, который имеет меньший размер пор, чем ионный размер ионов в IL.Хотя легкость синтеза и благоприятные транспортные свойства ИЖ на основе сульфония делают их подходящими кандидатами в качестве электролитов SC, для их использования в высокотемпературных суперконденсаторах необходимы протоколы проектирования для улучшения их термической стабильности.
Было замечено, что как вязкость, так и ионная проводимость этих ИЖ варьировались в зависимости от размера катиона. Однако различия в свойствах оказали незначительное влияние на производительность SC, особенно на значение удельной емкости, что противоречит более ранним сообщениям (Li S. et al., 2016) и нашим ранее выделенным соотношениям. Мы подозреваем, что почти однородность их SC-специфической емкости связана с микропористым активированным углем в качестве материала электрода, который имеет меньший размер пор, чем ионный размер ионов в IL.Хотя легкость синтеза и благоприятные транспортные свойства ИЖ на основе сульфония делают их подходящими кандидатами в качестве электролитов SC, для их использования в высокотемпературных суперконденсаторах необходимы протоколы проектирования для улучшения их термической стабильности.
Ионные жидкости на основе азепания
Большинство ИЖ, используемых в качестве электролитов для СЭ, основаны на ароматических или неароматических пяти/шестичленных кольцах (имидазолиевых, пирролидиниевых или пиперидиновых). ИЖ с семичленным циклом (азепаний) также применимы и были синтезированы, при этом их физико-химические и электролитные характеристики в СК сравнивали с установленным (Pyr 1,4 )(Tf 2 N) электролитом в предыдущем исследовании ( Польманн и др., 2015). Представлены ИЖ на основе азепания (бис(трифторметансульфонил)имид N-бутил-N-метилазепания [(Azp 1,4 )(Tf 2 N)] и бис(трифторметансульфонил)имида N-метил-N-гексилазепания [( Azp 1,6 )(Tf 2 N)] показал более высокую вязкость и более низкую проводимость по сравнению с их пирролидиниевыми аналогами. Это наблюдение, возможно, связано с большим размером кольца катиона азепания. Однако ИЖ на основе азепания показали сопоставимые термостабильность (>350°С) как пирролидиниевых ИЖ.Определение максимального рабочего напряжения показало, что на предел положительного потенциала структура ИЖ не влияет. С другой стороны, на предел отрицательного потенциала влиял размер катиона. Худшие характеристики ИЖ на основе азепания в качестве электролита по сравнению с пирролидиниевым аналогом были связаны с их высокой вязкостью и меньшей проводимостью.
ИЖ с семичленным циклом (азепаний) также применимы и были синтезированы, при этом их физико-химические и электролитные характеристики в СК сравнивали с установленным (Pyr 1,4 )(Tf 2 N) электролитом в предыдущем исследовании ( Польманн и др., 2015). Представлены ИЖ на основе азепания (бис(трифторметансульфонил)имид N-бутил-N-метилазепания [(Azp 1,4 )(Tf 2 N)] и бис(трифторметансульфонил)имида N-метил-N-гексилазепания [( Azp 1,6 )(Tf 2 N)] показал более высокую вязкость и более низкую проводимость по сравнению с их пирролидиниевыми аналогами. Это наблюдение, возможно, связано с большим размером кольца катиона азепания. Однако ИЖ на основе азепания показали сопоставимые термостабильность (>350°С) как пирролидиниевых ИЖ.Определение максимального рабочего напряжения показало, что на предел положительного потенциала структура ИЖ не влияет. С другой стороны, на предел отрицательного потенциала влиял размер катиона. Худшие характеристики ИЖ на основе азепания в качестве электролита по сравнению с пирролидиниевым аналогом были связаны с их высокой вязкостью и меньшей проводимостью. Тем не менее, учитывая более низкую стоимость азепаниевых ИЖ, модификации для снижения их вязкости и улучшения ионной проводимости могут превратить их в предпочтительные электролиты для СЭ.
Тем не менее, учитывая более низкую стоимость азепаниевых ИЖ, модификации для снижения их вязкости и улучшения ионной проводимости могут превратить их в предпочтительные электролиты для СЭ.
Функционализированные ионные жидкости
Характеристики электролитов на основе ИЖ в СК могут быть улучшены за счет тщательной разработки ИЖ, включая введение функциональных групп в обычные ИЖ. Модификация катионов ИЖ путем прививки алкильной боковой цепи гетероатомами (кислородом, азотом, серой и т. д.) может значительно улучшить свойства переноса ионов. Гетероатом в алкильной цепи может изменить электронное распределение катионного ядра, что улучшит свойства переноса ионов и улучшит электрохимические характеристики.Ренни и др. (2013), связанный атом кислорода на алкильной боковой цепи (эфирная функционализация) катиона имидазолия [1-(2-этоксиэтил)-2,3-диметилимидазолия бис(трифторметилсульфонил)имид], (MMIM 202 ) [(Tf 2 N) и катион фосфония (2-метоксиэтил)триметилфосфония бис(трифторметилсульфонил)имид, [(P 222,201 ) (Tf 2 N)], что значительно улучшило удельную емкость и снизило сопротивление СЭ.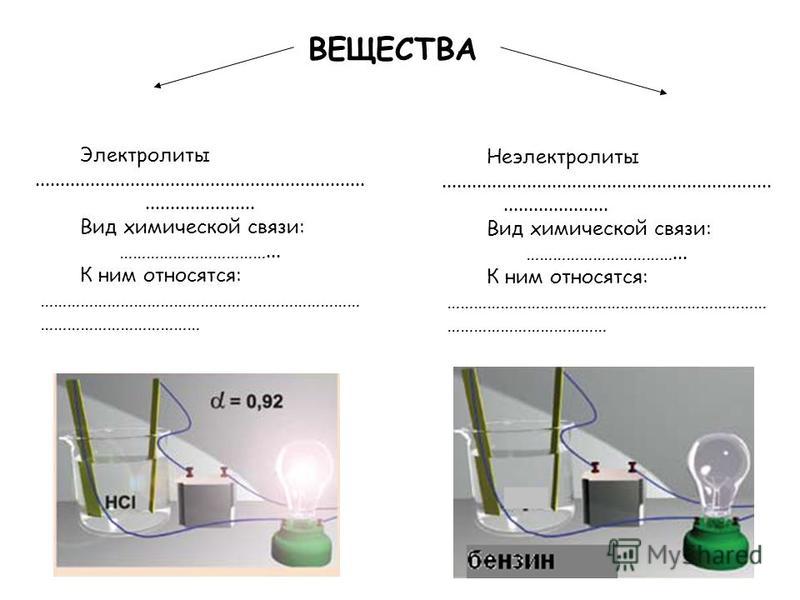 содержащий мезопористый углеродный электрод.Наличие эфирной группы снижает вязкость ИЖ. Аналогичная тенденция наблюдалась и для ИЖ, содержащих другие исследуемые катионные ядра на вязкость и термическую стабильность. Результаты спектроскопии электрохимического импеданса ИЖ показали значительное отклонение от идеального поведения из-за неоднородности сформированного двойного электрического слоя, что обычно заметно в вязких ИЖ с низкой проводимостью. Улучшение характеристик ИЖ, содержащих эфирную группу, может быть связано с наличием электроотрицательного атома кислорода, который может создавать удаленную электроотрицательную область на катионном ядре и способствовать созданию более плотного двойного слоя на поверхности электрода, что приводит к смещение большого количества заряда на электрод.В СК ( Рознятовская и др., 2015). Анион [Al(hfip) 4 ] – показал меньшее взаимодействие с электродом и улучшенные транспортные свойства по сравнению с анионом (Tf 2 N) – , когда оба были оценены с углеродными электродами, обладающими микро- и макропорами – для изучения влияние соответствия размера пор и размера иона (эффект просеивания) на поведение емкости.
содержащий мезопористый углеродный электрод.Наличие эфирной группы снижает вязкость ИЖ. Аналогичная тенденция наблюдалась и для ИЖ, содержащих другие исследуемые катионные ядра на вязкость и термическую стабильность. Результаты спектроскопии электрохимического импеданса ИЖ показали значительное отклонение от идеального поведения из-за неоднородности сформированного двойного электрического слоя, что обычно заметно в вязких ИЖ с низкой проводимостью. Улучшение характеристик ИЖ, содержащих эфирную группу, может быть связано с наличием электроотрицательного атома кислорода, который может создавать удаленную электроотрицательную область на катионном ядре и способствовать созданию более плотного двойного слоя на поверхности электрода, что приводит к смещение большого количества заряда на электрод.В СК ( Рознятовская и др., 2015). Анион [Al(hfip) 4 ] – показал меньшее взаимодействие с электродом и улучшенные транспортные свойства по сравнению с анионом (Tf 2 N) – , когда оба были оценены с углеродными электродами, обладающими микро- и макропорами – для изучения влияние соответствия размера пор и размера иона (эффект просеивания) на поведение емкости. Значения как площади, так и удельной емкости с ячейками, объединяющими электроды с различными размерами пор и IL, показаны на рисунке 4. Эффект просеивания очевиден в случае электродов с микропорами. ИЖ с более крупным катионом [(N 1444 ) + ] и анионами {[Al(hfip) 4 ] − } показали более низкое значение емкости. Анион {[Al(hfip) 4 ] – } большего размера (1,166 нм) не способен пройти через микропористый углеродный электрод со средним размером пор 0.86 нм, что приводит к более низкой емкости, чем анион {Tf 2 N} – . И наоборот, не было существенной разницы в емкости для ИЖ с мезопористыми углеродными электродами с более крупными порами, как и ожидалось.
Значения как площади, так и удельной емкости с ячейками, объединяющими электроды с различными размерами пор и IL, показаны на рисунке 4. Эффект просеивания очевиден в случае электродов с микропорами. ИЖ с более крупным катионом [(N 1444 ) + ] и анионами {[Al(hfip) 4 ] − } показали более низкое значение емкости. Анион {[Al(hfip) 4 ] – } большего размера (1,166 нм) не способен пройти через микропористый углеродный электрод со средним размером пор 0.86 нм, что приводит к более низкой емкости, чем анион {Tf 2 N} – . И наоборот, не было существенной разницы в емкости для ИЖ с мезопористыми углеродными электродами с более крупными порами, как и ожидалось.
РИСУНОК 4 . (A) Удельные емкости различных угольных электродов в ИЖ с анионами [Al(hfip) 4 ] − и (Tf 2 N) − . (B) Гравиметрические емкости различных угольных электродов в ИЖ с анионами [Al(hfip) 4 ] − и (Tf 2 N) − . Перепечатано с разрешения (Рознятовская и др., 2015), Интернет-библиотека Wiley.
Перепечатано с разрешения (Рознятовская и др., 2015), Интернет-библиотека Wiley.
Пирролидиний и пиперидиний Ионные жидкости
ИЖ с катионами пирролидиния, имеющими простую алкильную группу , 201 ) + ] в паре с анионом дицианамида (DCA) в качестве электролитов в СК с композитным электродом на основе активированного угля (Wolff et al., 2015).Ранее было замечено, что ИЖ на основе дицианамид-аниона обычно электрохимически менее стабильны, чем их аналоги (Tf 2 N) — (Zarrougui et al., 2018). Тем не менее, их высокая проводимость делает их хорошими кандидатами на роль электролитов SC. В таблице 4 показаны характеристики SC некоторых зарегистрированных пирролидиниевых и пиперидиниевых ИЖ.
ТАБЛИЦА 4 . Краткое изложение характеристик SC пирролидиниевых и пиперидиниевых ИЖ.
Катионные ядра как пирролидиния, так и пиперидиния также были исследованы для электролитов SC в сочетании с анионами трицианометанида {[C(CN) 3 ] – } и тетрацианобората [B(CN) 4 ] – 9009 ( и другие. , 2017; Мартинс и др., 2018). Было замечено, что ИЖ с комбинациями пирролидиния и трицианометанида показали одинаковую вязкость при 25°C, в то время как (Pip 1,4 )[C(CN) 3 ] и (Pip 1,4 )[B(CN ) 4 ] имели значительно более высокую вязкость из-за относительно большего размера катиона. Следовательно, ИЖ на основе пирролидиния демонстрируют лучшие характеристики в качестве электролитов SC, чем аналог из пиперидина (таблица 3), который показал значительное падение iR во время разряда.Влияние размера ионов пирролидиния на получаемые электролиты с более высокой вязкостью, такие как (Pyr 1,4 )(FAP), также было продемонстрировано (Sillars et al., 2012) на емкость SC с применением угольных электродов. Было замечено, что более высокая вязкость приводит к ослаблению взаимодействия между электродом и ионами электролита. Из вышеизложенного становится ясно, что вязкость ИЖ играет существенную роль в определении характеристик суперконденсатора, что необходимо учитывать при разработке новых электролитов ИЖ для СК.
, 2017; Мартинс и др., 2018). Было замечено, что ИЖ с комбинациями пирролидиния и трицианометанида показали одинаковую вязкость при 25°C, в то время как (Pip 1,4 )[C(CN) 3 ] и (Pip 1,4 )[B(CN ) 4 ] имели значительно более высокую вязкость из-за относительно большего размера катиона. Следовательно, ИЖ на основе пирролидиния демонстрируют лучшие характеристики в качестве электролитов SC, чем аналог из пиперидина (таблица 3), который показал значительное падение iR во время разряда.Влияние размера ионов пирролидиния на получаемые электролиты с более высокой вязкостью, такие как (Pyr 1,4 )(FAP), также было продемонстрировано (Sillars et al., 2012) на емкость SC с применением угольных электродов. Было замечено, что более высокая вязкость приводит к ослаблению взаимодействия между электродом и ионами электролита. Из вышеизложенного становится ясно, что вязкость ИЖ играет существенную роль в определении характеристик суперконденсатора, что необходимо учитывать при разработке новых электролитов ИЖ для СК.
Другие Ионные Жидкости Системы Электролитов
Недавно были разработаны и изучены другие ИЖ в электрохимических устройствах накопления энергии, таких как SC. Примером являются ИЖ, полученные из катиона типа диметилформамида (ДМФ) и тетрафторборатного аниона (ЭДМФА) (BF 4 ), полученные и изученные Ченом и его коллегами в качестве потенциального электролита с высокой емкостью для СК (Chen et al., 2019). Умеренный размер и квазилинейный характер катиона (ЭДМФ) + увеличили подвижность ионов и способствовали формированию компактного двойного электрического слоя, что привело к улучшению характеристик СЭ с электролитом (ДМФ)(BF 4 ).
Большинство ИЖ, применяемых в качестве электролитов в СК, содержат фтор в составе анионов. В недавнем исследовании (Khan and Shah, 2020) была синтезирована ИЖ с нефторированным анионом фуроата в сочетании с фуроатом тетрабутилфосфония [(P 4444 )(FuA)] и протестирована в качестве электролита для SC. Преимущество некоторых из этих разработанных «нетрадиционных» IL заключается в том, что можно сообщить о высокой ионной проводимости и окнах рабочего потенциала в приложениях SC, сравнимых с наиболее применяемыми высокопроизводительными IL, такими как (EMIM) (BF 4 ).Кроме того, их синтез может быть упрощен. Тем не менее, у недавно разработанных ИЖ все еще есть проблемы с термической стабильностью. Например; ИЖ на основе аниона фуроата, как упоминалось ранее (P 4444 ) (FuA), менее термически стабильны (<250 °C) по сравнению с их фторированными аналогами, что неудивительно, поскольку карбоксильные группы могут легко подвергаться декарбоксилированию при повышенных температурах ( Clough et al., 2013; Cao and Mu, 2014). Тем не менее, этот отчет открыл возможность разработки высокоэффективных электролитов IL, избегая фторированных анионов.
Преимущество некоторых из этих разработанных «нетрадиционных» IL заключается в том, что можно сообщить о высокой ионной проводимости и окнах рабочего потенциала в приложениях SC, сравнимых с наиболее применяемыми высокопроизводительными IL, такими как (EMIM) (BF 4 ).Кроме того, их синтез может быть упрощен. Тем не менее, у недавно разработанных ИЖ все еще есть проблемы с термической стабильностью. Например; ИЖ на основе аниона фуроата, как упоминалось ранее (P 4444 ) (FuA), менее термически стабильны (<250 °C) по сравнению с их фторированными аналогами, что неудивительно, поскольку карбоксильные группы могут легко подвергаться декарбоксилированию при повышенных температурах ( Clough et al., 2013; Cao and Mu, 2014). Тем не менее, этот отчет открыл возможность разработки высокоэффективных электролитов IL, избегая фторированных анионов.
В результате смешивания двух чистых ИЖ был получен новый электролит, который вел себя иначе, чем составные ИЖ, как показано в исследовании, показанном на рис.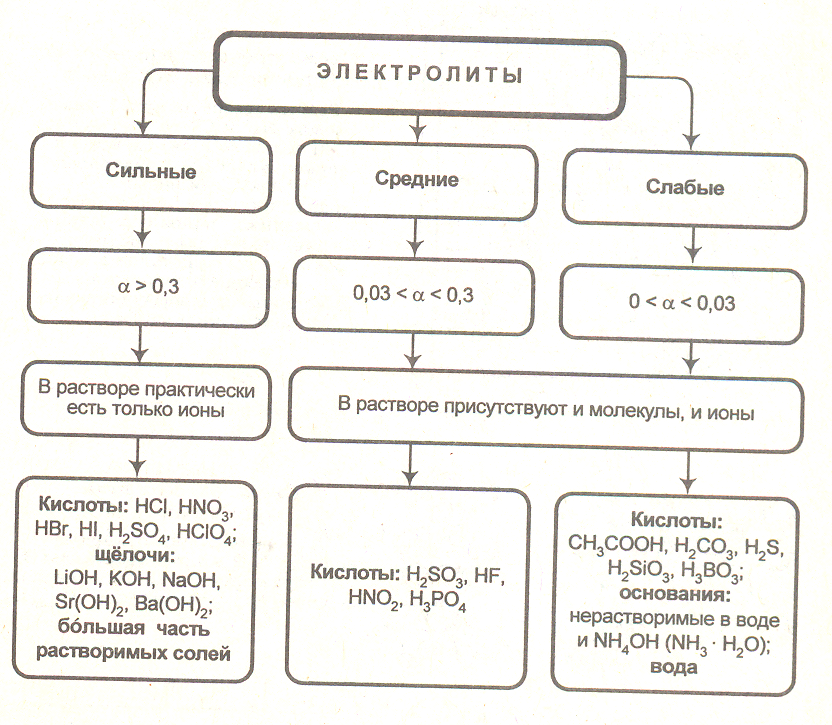 5 (Van Aken et al., 2015). Использование таких смесей IL потенциально может привести к электролитам со сбалансированным накоплением заряда, высоким потенциальным окном и высокой плотностью энергии (Van Aken et al., 2015).
5 (Van Aken et al., 2015). Использование таких смесей IL потенциально может привести к электролитам со сбалансированным накоплением заряда, высоким потенциальным окном и высокой плотностью энергии (Van Aken et al., 2015).
РИСУНОК 5 . Циклические вольтамперограммы для ячеек в сборе со смесью (EMIM)(Tf 2 N) и (EMIM)(BF 4 ) с различным объемным процентным содержанием (EMIM)(BF 4 ), в том числе (A) 0% , (B) 10 %, (C) 20 %, (D) 50 %, (E) 80 % и (F) 100 %.Окно рабочего потенциала во всех случаях составляет 2,5 В, а скорости 5, 10 и 20 мВ·с −1 . Перепечатано с разрешения (VanAken et al., 2015), онлайн-библиотеки Wiley.
В другом исследовании (Lin R. et al., 2011) изучались смеси ИЖ путем смешивания двух ИЖ с одним и тем же анионом бис(фторсульфонил)имида [(FSI] − ] с аналогичными катионами [(Pyr 1,3 ) + и (Pip 1,3 ) + , которые препятствовали упорядоченному расположению ионов в кристаллической решетке во избежание кристаллизации.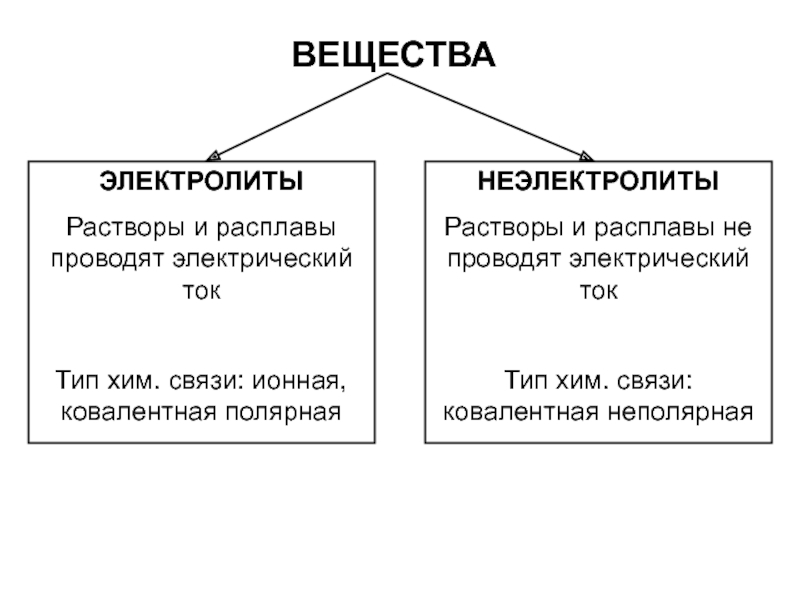 Результатом стала новая ИЖ с более широким диапазоном жидкостей по сравнению с составляющими ИЖ. Смешивание двух ИЖ расширило диапазон жидкости вновь образованной смеси до -50°С, в результате чего появилась возможность эксплуатировать СК с расширенной рабочей температурой от -50 до 100°С.
Результатом стала новая ИЖ с более широким диапазоном жидкостей по сравнению с составляющими ИЖ. Смешивание двух ИЖ расширило диапазон жидкости вновь образованной смеси до -50°С, в результате чего появилась возможность эксплуатировать СК с расширенной рабочей температурой от -50 до 100°С.
Как предполагалось ранее, электрохимические характеристики этих нетрадиционных ИЖ определяются их молекулярной структурой. Таким образом, влияние структуры на производительность всегда заслуживает изучения. Мусави и др.(2016) сообщалось о влиянии структуры ИЖ на физические свойства, электрохимическую стабильность, емкость и удельную энергию при применении в качестве электролитов в СК с использованием углеродных электродов с однородными и сильно взаимосвязанными мезопорами. Для исследования были выбраны ИЖ, содержащие различные анионы (тетрафторборат, трифторметансульфонат, трифторметансульфонимид и наиболее часто используемые катионы (имидазолий, аммоний, пиридиний, пиперидиний и пирролидиний)). эффект; (A) длина алкильной цепи на окне электрохимической стабильности, (B) анион, (C) длина алкильного спейсера на значения удельной емкости при различных скоростях для мезопористых углеродных электродов с использованием ИЖ электролитов. Перепечатано с разрешения (Mousavi et al., 2016), Американского химического общества.
эффект; (A) длина алкильной цепи на окне электрохимической стабильности, (B) анион, (C) длина алкильного спейсера на значения удельной емкости при различных скоростях для мезопористых углеродных электродов с использованием ИЖ электролитов. Перепечатано с разрешения (Mousavi et al., 2016), Американского химического общества.
Измерения электрохимической стабильности ИЖ показали, что анионы мало влияют на катодную стабильность этих ИЖ. С другой стороны, катион оказывает существенное влияние на анодный предел ИЖ.Четвертичные аммониевые ИЖ показали самую высокую анодную стабильность по сравнению с их ароматическими аналогами. Учитывая катионную структуру, существенно влияющую на катодную стабильность ИЖ, неароматические четвертичные аммониевые катионные ядра показали лучшую стабильность, чем их ароматические аналоги. Причина в том, что катионы с более низкими энергетическими уровнями НСМО (низшая незанятая молекулярная орбита) склонны к восстановлению. Исследователи заметили, что длины алкильных спейсеров на катионах не оказывали существенного влияния на электрохимическую стабильность ИЖ.Размер катионов также оказал существенное влияние на вязкость и электропроводность электролита и емкость собранных СЭ. В исследовании (Mousavi et al., 2016) ИЖ на основе имидазолия и пиридиния обеспечивали самую высокую емкость клетки, а ИЖ на основе аммония предлагают гораздо более широкие потенциальные окна, чем ИЖ на основе имидазола и пиридиния. Хотя длина алкильной цепи катиона имидазолия не влияла на окно их электрохимического потенциала, она значительно влияла на удельную емкость СК с имидазолиевыми ИЖ (рис. 6).
Исследователи заметили, что длины алкильных спейсеров на катионах не оказывали существенного влияния на электрохимическую стабильность ИЖ.Размер катионов также оказал существенное влияние на вязкость и электропроводность электролита и емкость собранных СЭ. В исследовании (Mousavi et al., 2016) ИЖ на основе имидазолия и пиридиния обеспечивали самую высокую емкость клетки, а ИЖ на основе аммония предлагают гораздо более широкие потенциальные окна, чем ИЖ на основе имидазола и пиридиния. Хотя длина алкильной цепи катиона имидазолия не влияла на окно их электрохимического потенциала, она значительно влияла на удельную емкость СК с имидазолиевыми ИЖ (рис. 6).
Увеличение длины алкильной цепи катиона имидазолия (более крупный катион) снижало гравиметрическую удельную емкость из-за уменьшения концентрации противоионов в порах электрода из-за просеивающего действия электролита. Кроме того, увеличенный размер ионов также уменьшает доступную площадь поверхности. (EMIM)(Tf 2 Н) показал наибольшую емкость среди исследованных имидазолиевых ИЖ (Mousavi et al. , 2016). Это исследование ясно показывает, что размер ионов ИЖ следует учитывать при выборе материалов электродов для суперконденсаторов на основе ИЖ.
, 2016). Это исследование ясно показывает, что размер ионов ИЖ следует учитывать при выборе материалов электродов для суперконденсаторов на основе ИЖ.
Стратегии разработки ионных жидкостей Электролит для суперконденсаторов
ИЖ имеют некоторые преимущества перед обычными органическими и водными электролитами для СК. Однако ИЖ имеют некоторые недостатки, такие как высокая вязкость, низкая ионная проводимость и низкая степень диссоциации ионов, что приводит к SC с меньшей мощностью, чем у других электролитов. Исходя из наших обсуждений различных структур ИЖ, результирующих физико-химических свойств ИЖ и их взаимодействия ИЖ с электродом в СЭ, мы предлагаем различные стратегии проектирования, применяемые к разработке ИЖ для улучшения их характеристик СЭ.
Одним из методов повышения ионной проводимости за счет снижения вязкости ИЖ является введение функциональных групп, таких как эфирные группы, в катионное ядро ИЖ (Chen et al., 2012; Raj et al., 2018; Raj и др., 2017; Чен и др. , 2016; Джин и др., 2012). Введение этих функциональных групп в катион может изменить электронную среду ИЖ из-за их очень гибкой природы, что увеличивает их свободный объем и приводит к более низкой вязкости (Chen et al., 2012). Другая стратегия снижения вязкости ИЖ заключается в создании асимметрии катиона путем присоединения алкильного замещения в соответствующих положениях катионного ядра. Например, вязкость ИЖ на основе пиридиния, как обсуждалось ранее, может быть значительно улучшена за счет присоединения алкильных групп к мета-положению (3) пиридинового кольца (Lethesh et al., 2019; Chellappan et al., 2011). .
, 2016; Джин и др., 2012). Введение этих функциональных групп в катион может изменить электронную среду ИЖ из-за их очень гибкой природы, что увеличивает их свободный объем и приводит к более низкой вязкости (Chen et al., 2012). Другая стратегия снижения вязкости ИЖ заключается в создании асимметрии катиона путем присоединения алкильного замещения в соответствующих положениях катионного ядра. Например, вязкость ИЖ на основе пиридиния, как обсуждалось ранее, может быть значительно улучшена за счет присоединения алкильных групп к мета-положению (3) пиридинового кольца (Lethesh et al., 2019; Chellappan et al., 2011). .
Анионы играют решающую роль в определении общих электрохимических свойств ИЖ.Вязкость, проводимость, термическую стабильность и гидрофобность ИЖ можно регулировать путем выбора соответствующих анионов с делокализованным зарядом или слабой координацией (Timofte and Mudring, 2006). Стоит отметить, что хотя некоординирующие анионы могут снижать вязкость и повышать проводимость ИЖ, эти анионы также могут пагубно влиять на рабочий потенциал ИЖ (Pandey, Hashmi, 2013). Соединение катионов с анионами меньшего размера имеет противоречивые эффекты. Ионы меньшего размера могут увеличить проводимость ИЖ из-за их более высокой внутренней подвижности (Tsuzuki et al., 2005; Йошида и др., 2007). И наоборот, более мелкие ионы также могут приводить к усилению ион-ионных кулоновских взаимодействий, что приводит к высокой вязкости. Следовательно, ищут оптимальное сочетание размеров ионов, чтобы максимизировать проводимость и минимизировать вязкость получаемого ИЖ.
Соединение катионов с анионами меньшего размера имеет противоречивые эффекты. Ионы меньшего размера могут увеличить проводимость ИЖ из-за их более высокой внутренней подвижности (Tsuzuki et al., 2005; Йошида и др., 2007). И наоборот, более мелкие ионы также могут приводить к усилению ион-ионных кулоновских взаимодействий, что приводит к высокой вязкости. Следовательно, ищут оптимальное сочетание размеров ионов, чтобы максимизировать проводимость и минимизировать вязкость получаемого ИЖ.
Повышение электрохимической стабильности ИЖ может быть достигнуто за счет модификации катионного ядра ИЖ. Известно, что ИЖ четвертичного аммония претерпевают разложение в первую очередь путем элиминирования Хоффмана за счет использования атомов водорода в их β-положении (DeVos et al., 2014; Летеш и др., 2014а). Замена β-водородов может ограничить скорость реакции отщепления Хоффмана и значительно улучшить окно электрохимического потенциала ИЖ. Однако стоит отметить, что замена β-водородов может повлиять на другие физико-химические свойства (в зависимости от природы заместителей) ИЖ. Следовательно, необходимо соблюдать осторожность при выборе заместителей в β-положении ИЖ четвертичного аммония. Как обсуждалось ранее, катионы фосфония могут увеличить электрохимическую стабильность и окно рабочего потенциала SC (Khan and Shah, 2020).Использование катионов тетраалкилфосфония также может увеличить окно электрохимической стабильности ИЖ из-за их уникального механизма электрохимического разложения (Bradaric et al., 2003). Однако при использовании в качестве электролита в СК необходимо учитывать более высокую вязкость ИЖ на основе фосфония (Del Sesto et al., 2005).
Следовательно, необходимо соблюдать осторожность при выборе заместителей в β-положении ИЖ четвертичного аммония. Как обсуждалось ранее, катионы фосфония могут увеличить электрохимическую стабильность и окно рабочего потенциала SC (Khan and Shah, 2020).Использование катионов тетраалкилфосфония также может увеличить окно электрохимической стабильности ИЖ из-за их уникального механизма электрохимического разложения (Bradaric et al., 2003). Однако при использовании в качестве электролита в СК необходимо учитывать более высокую вязкость ИЖ на основе фосфония (Del Sesto et al., 2005).
Добавки к органическим растворителям или смеси с ИЖ также могут оптимизировать электролиты ИЖ для приложений SC. Хотя электролиты смеси ИЖ и органического растворителя улучшают емкость по сравнению с чистой системой ИЖ (Lian et al., 2016; Siinor et al., 2013), плотность энергии иногда снижается, когда смесь приводит к более узкому потенциальному окну. Поэтому ожидается, что добавление органических растворителей с хорошей проводимостью и высокой анодной стабильностью улучшит как емкость, так и плотность энергии в электролитных системах IL-органический растворитель. Более того, даже при использовании в СЭ ИЖ с окном высокого электрохимического потенциала, ИЖ может не полностью использоваться в обоих электродах СЭ при наличии асимметрии емкостей анода и катода.Этот дисбаланс может привести к разложению электролита и может быть устранен для достижения высокого напряжения элемента путем смешивания двух подходящих ИЖ вместо смеси ИЖ-органического растворителя.
Более того, даже при использовании в СЭ ИЖ с окном высокого электрохимического потенциала, ИЖ может не полностью использоваться в обоих электродах СЭ при наличии асимметрии емкостей анода и катода.Этот дисбаланс может привести к разложению электролита и может быть устранен для достижения высокого напряжения элемента путем смешивания двух подходящих ИЖ вместо смеси ИЖ-органического растворителя.
Заключение и перспектива на будущее
Целью данной работы было дать представление о перспективах использования чистых ионных жидкостей (ИЖ) в качестве электролитов для суперконденсаторов (СК). Мы уделяем особое внимание конструкции электролита ИЖ-СК, исходя из наших наблюдений и выводов, сделанных в предыдущих работах, в отношении эффективности чистых ИЖ в СК.
Химия реакций накопления заряда в различных классах электролитов ИЖ была подробно объяснена до того, как мы представили стратегии разработки новых систем электролитов ИЖ для СЭ. Обсуждена роль физико-химических свойств ИЖ, таких как вязкость, ионная проводимость, размер ионов, термическая стабильность, электрохимическая стабильность (потенциальное окно) на работоспособность СЭ — удельная емкость, плотность энергии. Кроме того, мы также выделили вероятные механизмы стабильности при циклировании ИЖ в сочетании с типичными электродными материалами на основе углерода в СК.
Кроме того, мы также выделили вероятные механизмы стабильности при циклировании ИЖ в сочетании с типичными электродными материалами на основе углерода в СК.
Подробно рассмотрены влияние структуры ИЖ и влияние отдельных функциональных групп на их физико-химические свойства. Несмотря на то, что были достигнуты заметные достижения в области электролитов IL для SC, многие проблемы еще предстоит решить в коммерциализации SC с электролитами IL. Практический метод расширения окна рабочих потенциалов и диапазона рабочих температур электролитов на основе IL еще предстоит установить. Мы обнаружили отсутствие четкого понимания механизма электрохимической деградации электролита ИЖ в SC, что является серьезным препятствием на пути разработки новых ИЖ с широким окном рабочего потенциала.
Мы полагаем, что требуются дополнительные усилия как экспериментально, так и теоретически для установления связи между транспортными и тепловыми свойствами ИЖ с учетом их молекулярной структуры, что поможет разработать перспективные электролиты ИЖ для электрохимических накопителей энергии. Необходимы также дополнительные исследования для стандартизации методов электрохимической характеристики электролитов ИЖ.
Необходимы также дополнительные исследования для стандартизации методов электрохимической характеристики электролитов ИЖ.
Составление электролитов с широким окном электрохимической стабильности имеет важное значение для разработки высокоэффективных SC, и ИЖ продемонстрировали огромный потенциал в этом отношении.Хотя ИЛ могут расширить рабочий потенциал устройств SC, конструкция ИЛ, подходящих для различных условий эксплуатации, необходима для полного использования их потенциала. Например, отсутствуют ИЖ с перспективными транспортными свойствами при отрицательных температурах и ИЖ с долговременной термостабильностью более 200°С. Следовательно, необходимо сосредоточиться на разработке ИЖ для работы в различных экспериментальных условиях. Еще одним интересным направлением исследований будет создание подходящего метода для определения наилучшей комбинации электрод-ИЖ, поскольку литературные данные подтвердили, что структура электрода может влиять на расположение ИЖ на границе раздела. Методика поможет улучшить емкость СК без ущерба для мощности и плотности энергии. Обычно используемые ИЖ в качестве электролита в СК обладают токсичностью от умеренной до высокой и плохо поддаются биологическому разложению. Использование таких токсичных ИЖ в промышленных масштабах может вызвать проблемы с окружающей средой и здоровьем. Следовательно, жизненно важно разработать нетоксичные и легко биоразлагаемые ИЖ без ущерба для их электрохимических и транспортных свойств в крупномасштабных электрохимических приложениях.
Методика поможет улучшить емкость СК без ущерба для мощности и плотности энергии. Обычно используемые ИЖ в качестве электролита в СК обладают токсичностью от умеренной до высокой и плохо поддаются биологическому разложению. Использование таких токсичных ИЖ в промышленных масштабах может вызвать проблемы с окружающей средой и здоровьем. Следовательно, жизненно важно разработать нетоксичные и легко биоразлагаемые ИЖ без ущерба для их электрохимических и транспортных свойств в крупномасштабных электрохимических приложениях.
Несмотря на уникальные преимущества электролитов IL, их стоимость и вопросы очистки являются серьезной проблемой при их использовании в коммерческих целях. Необходимо изучить разработку простой стадии очистки после синтеза (или отсутствие стадии очистки) и использование недорогого сырья, чтобы сделать ИЖ более дешевой альтернативой электролитам на органической основе. Очистка ИЖ имеет решающее значение, поскольку даже следовые количества примесей (вода/галогенид) уменьшают рабочее окно потенциала и увеличивают саморазряд. Из-за огромного роста спроса на носимые устройства электролит «ionogel» (чистые ИЖ с полимерным скелетом) может стать будущим электролитов на основе ИЖ, обеспечивая адекватные улучшения механической стабильности. Ионогели могут обеспечить гибкие SC с превосходными характеристиками из-за их высокой ионной проводимости и быстрой диффузии ионов. Появляются сообщения о твердых электролитах на основе полимеризованных ИЖ для СК. Мы считаем, что эти электролиты будут по-прежнему перспективными, поскольку их заметная проводимость часто сопровождается заметной электрохимической стабильностью.
Из-за огромного роста спроса на носимые устройства электролит «ionogel» (чистые ИЖ с полимерным скелетом) может стать будущим электролитов на основе ИЖ, обеспечивая адекватные улучшения механической стабильности. Ионогели могут обеспечить гибкие SC с превосходными характеристиками из-за их высокой ионной проводимости и быстрой диффузии ионов. Появляются сообщения о твердых электролитах на основе полимеризованных ИЖ для СК. Мы считаем, что эти электролиты будут по-прежнему перспективными, поскольку их заметная проводимость часто сопровождается заметной электрохимической стабильностью.
Авторские вклады
Идея этого обзора принадлежит К.Л. KL написал рукопись при значительном участии MB и RS. Все авторы прочитали и одобрили окончательный вариант рукописи.
Финансирование
Это исследование (высоковольтная суперконденсаторная ячейка для сетевых приложений) спонсировалось научно-исследовательским центром Управления электроэнергетики и водоснабжения Дубая (DEWA), Дубай, Объединенные Арабские Эмираты.
Конфликт интересов
KL, MB и RS работали в компании Dubai Electricity and Water Authority (DEWA).
Примечание издателя
Все утверждения, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Ссылки
Abbas, T., Kallidanthiyil Chellappan, L., Mutalib, M.I.A., Cheun, K.Y., Насир Шах С., Назир С. и др. (2015). Стабильность и эффективность физически иммобилизованных ионных жидкостей для адсорбции ртути из газового потока. Индивидуальный инж. хим. Рез. 54, 12114–12123. doi:10.1021/acs.iecr.5b01738
Полный текст CrossRef | Google Scholar
Анути М., Тимперман Л., Эль Хилали М., Буассе А. и Гальяно Х. (2012). Сульфоний-бис(трифторсульфонимид) Пластиковый кристалл Ионная жидкость в качестве электролита при повышенной температуре для высокоэнергетических суперконденсаторов. J. Phys. хим. С 116, 9412–9418. doi:10.1021/jp3012987
J. Phys. хим. С 116, 9412–9418. doi:10.1021/jp3012987
Полный текст CrossRef | Google Scholar
Арадилла Д., Садки С. и Бидан Г. (2019). Помимо обычных суперконденсаторов: иерархически проводящие 3D-наноструктуры с полимерным покрытием для встроенных микросуперконденсаторов, использующих электролиты с ионной жидкостью. Синтез. Встретились. 247, 131–143. doi:10.1016/j.synthmet.2018.11.022
Полный текст CrossRef | Google Scholar
Бамгбопа, М.О., Шао-Хорн Ю. и Альмхейри С. (2017). Потенциал неводных окислительно-восстановительных проточных батарей в качестве решений для хранения энергии с возможностью быстрой зарядки: демонстрация с помощью химии ацетилацетоната железа и хрома. Дж. Матер. хим. А. 5, 13457–13468. doi:10.1039/c7ta02022h
Полный текст CrossRef | Google Scholar
Блю, Э. Д., Гунно, Т. Б., Петерсен, Дж. Л., и Бойл, П. Д. (2006). Протонирование N-гетероциклического карбенового лиганда, координированного с медью (I): режим координации катиона имидазолия как функция противоиона, определяемый структурами твердого тела. Дж. Органомет. хим. 691, 5988–5993. doi:10.1016/j.jorganchem.2006.09.051
Полный текст CrossRef | Google Scholar
Bradaric, C.J., Downard, A., Kennedy, C., Robertson, A.J., and Zhou, Y. (2003). Промышленное получение фосфониевых ионных жидкостей. Симптом ACS. сер. , 41–56. doi:10.1021/bk-2003-0856.ch004
Полный текст CrossRef | Google Scholar
Батт, Х.С., Летеш, К.С., и Фиксдал, А. (2020). Десульфуризация мазута двухфункциональными ионными жидкостями на основе имидазолия. Разделение Purif. Technology 248, 116959. doi:10.1016/j.seppur.2020.116959
CrossRef Полный текст | Google Scholar
Цао Ю. и Му Т. (2014). Всестороннее исследование термической стабильности 66 ионных жидкостей с помощью термогравиметрического анализа. Индивидуальный инж. хим. Рез. 53, 8651–8664. doi:10.1021/ie5009597
Полный текст CrossRef | Google Scholar
Челлаппан К. К., Ван Хекке К., Ван Мирвельт Л., Нокеманн П., Киршнер Б., Зан С., и другие. (2011). Нитрил-функционализированные пиридиниевые, пирролидиниевые и пиперидиниевые ионные жидкости. J. Phys. хим. В 115, 8424–8438. doi:10.1021/jp2027675
Полный текст CrossRef | Google Scholar
Chellappan, L.K., Kvello, J., Tolchard, J.R., Dahl, P.I., Hanetho, S.M., Berthelot, R., et al. (2020). Ненуклеофильный электролит на основе ионной жидкости и бис(диизопропил)амида магния для перезаряжаемых ионно-магниевых аккумуляторов. Приложение ACS Энерг. Матер. 3, 9585–9593.doi:10.1021/acsaem.0c01026
Полный текст перекрестной ссылки | Google Scholar
Чен Ю., Лю З., Сунь Л., Лу З. и Чжо К. (2018). Легированный азотом и серой пористый графеновый аэрогель как эффективный электродный материал для высокопроизводительного суперконденсатора в электролите с ионной жидкостью. Дж. Источник питания. 390, 215–223. doi:10.1016/j.jpowsour.2018.04.057
Полный текст CrossRef | Google Scholar
Чен З., Хуо Ю., Цао Дж., Сюй Л. и Чжан С. (2016). Физико-химические свойства ионных жидкостей, функционализированных эфиром: понимание их неравномерных изменений в зависимости от длины эфирной цепи. Индивидуальный инж. хим. Рез. 55, 11589–11596. doi:10.1021/acs.iecr.6b02875
Полный текст CrossRef | Google Scholar
Чен З. Дж., Сюэ Т. и Ли Дж.-М. (2012). Чем обусловлена низкая вязкость ионных жидкостей, функционализированных эфиром? его зависимость от увеличения свободного объема. RSC Adv. 2, 10564–10574. doi:10.1039/c2ra21772d
Полный текст CrossRef | Google Scholar
Чен З., Ли З., Ма X., Ван Ю., Чжоу К. и Чжан С. (2019). Новая ионная жидкость на основе ДМФ со сверхвысокой проводимостью для электролита большой емкости в двухслойном электрическом конденсаторе. Электрохимика Acta 319, 843–848. doi:10.1016/j.electacta.2019.07.015
Полный текст CrossRef | Google Scholar
Клаф, М. Т., Гейер, К., Хант, П. А., Мертес, Дж., и Велтон, Т. (2013). Термическое разложение карбоксилатных ионных жидкостей: тенденции и механизмы. Физ. хим. хим. физ. 15, 20480–20495. doi:10.1039/c3cp53648c
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коаду Э., Гудрич П., Нил А. Р., Тимперман Л., Hardacre, C., Jacquemin, J., et al. (2016). Синтез и теплофизические свойства сульфониевых ионных жидкостей, функционализированных эфиром, как потенциальных электролитов для электрохимических применений. Chem Phys Chem 17, 3992–4002. doi:10.1002/cphc.201600882
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дель Сесто, Р. Э., Корли, К., Робертсон, А., и Уилкс, Дж. С. (2005). Ионные жидкости на основе тетраалкилфосфония. Дж. Органомет. хим. 690, 2536–2542.doi:10.1016/j.jorganchem.2004.09.060
Полный текст CrossRef | Google Scholar
Демарконне Л., Кальво Э. Г., Тимперман Л., Анути М., Лемордан Д., Раймундо-Пиньеро Э. и др. (2013). Оптимизация работы суперконденсаторов на основе угольных электродов и протонных ионных жидкостей в качестве электролитов. Электрохимика Acta 108, 361–368. doi:10.1016/j.electacta.2013.07.001
Полный текст CrossRef | Google Scholar
Де Вос Н., Матон К. и Стивенс К.В. (2014). Электрохимическая стабильность ионных жидкостей: общие факторы влияния и механизмы деградации. Chem Electro Chem 1, 1258–1270. doi:10.1002/celc.201402086
Полный текст CrossRef | Google Scholar
Dinh, T.T.A., Huynh, T.T.K., Le, LTM, Truong, T.T.T., Nguyen, O.H., Tran, K.T.T., et al. (2020). Глубокий эвтектический растворитель на основе бис[(трифторметил)сульфонил]имида лития (LiTFSI) и 2,2,2-трифторацетамида (TFA) как перспективный электролит для высоковольтной литий-ионной батареи с катодом LiMn2O4. АСУ Омега 5, 23843–23853. doi:10.1021/acsomega.0c03099
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дюнен С., Бетц Дж., Колек М., Шмуч Р., Винтер М., Плаке Т. и др. (2020). На пути к зеленым аккумуляторным элементам: взгляд на материалы и технологии. Малые методы 4, 2000039. doi:10.1002/smtd.202000039
CrossRef Полный текст | Google Scholar
Фик К., Горска Б., Буевска П., Беген Ф. и Фраковяк Э. (2019).Ионная жидкость на основе селеноцианата как редокс-активный электролит для гибридных электрохимических конденсаторов. Электрохимика Acta 314, 1–8. doi:10.1016/j.electacta.2019.04.161
Полный текст CrossRef | Google Scholar
Гроссерейд И., Летеш К. К., Венкатраман В. и Фиксдал А. (2019). Новые двойные функционализированные цвиттерионы и ионные жидкости; Исследования синтеза и растворения целлюлозы. Дж. Мол. Жидкости 292, 111353. doi:10.1016/j.molliq.2019.111353
CrossRef Полный текст | Google Scholar
Gunday, S.Т., Чевик Э., Юсуф А. и Бозкурт А. (2019). Нанокомпозиты, состоящие из сульфированного полисульфона/гексагонального нитрида бора/ионной жидкости для применения в суперконденсаторах. Дж. Энерг. Склад 21, 672–679. doi:10.1016/j.est.2019.01.008
Полный текст CrossRef | Google Scholar
Гандай С. Т., Чевик Э., Юсуф А. и Бозкурт А. (2020). Синтез, характеристика и применение в суперконденсаторах нанокомпозитов, содержащих ионную жидкость, на основе SPSU/диоксида кремния. J. Phys. хим. Сол. 137, 109209. doi:10.1016/J.JPCS.2019.109209
CrossRef Полный текст | Google Scholar
Хуан Дж., Го З., Ма Ю., Бин Д., Ван Ю. и Ся Ю. (2019). Недавний прогресс в области перезаряжаемых батарей с использованием мягких водных электролитов. Малые методы 3, 1800272. doi:10.1002/smtd.201800272
CrossRef Полный текст | Google Scholar
Hurilechaoketu, H., Wang, J., Cui, C., and Qian, W. (2019). Мезопористые активированные углеродные волокна с высокой электропроводностью и их эффективность в электрических двухслойных конденсаторах на основе ионной жидкости. Углерод 154, 1–6. doi:10.1016/j.carbon.2019.07.093
CrossRef Полный текст | Google Scholar
Янссен, С. Х. К., Масиас-Рувалькаба, Н. А., Агилар-Мартинес, М., и Кобрак, М. Н. (2016). Экстракция меди с использованием протонных ионных жидкостей: свидетельство эффекта Хофмейстера. Разделение Purif. Технология 168, 275–283. doi:10.1016/j.seppur.2016.05.031
Полный текст CrossRef | Google Scholar
Жомо, П., Лю, К., Чжоу, Д., Сюй, X., Ван, Т., Ван, Ю., и другие. (2020). Самовосстанавливающийся полимерный электролит на основе глубоко эвтектического растворителя для безопасных и долговечных литий-металлических батарей. Анжю. хим. Междунар. Эд. 59, 9134–9142. doi:10.1002/anie.202001793
Полный текст CrossRef | Google Scholar
Джин Ю., Фанг С., Чай М., Ян Л. и Хирано С.-и. (2012). Ионные жидкости триалкилимидазолия, функционализированные простым эфиром: синтез, характеристика и свойства. Индивидуальный инж. хим. Рез. 51, 11011–11020. doi:10.1021/ie300849u
Полный текст CrossRef | Google Scholar
Хан И.А. и Шах Ф.У. (2020). Электролит на основе ионной жидкости, не содержащий фтора, для суперконденсаторов, работающих при повышенных температурах. ACS Устойчивая хим. англ. 8, 10212–10221. doi:10.1021/acssuschemeng.0c02568
Полный текст CrossRef | Google Scholar
Куриг Х., Вестли М., Янес А. и Люст Э. (2011). Электрические двухслойные конденсаторы на основе двух ионных жидкостей 1-этил-3-метилимидазолия с разными анионами. Электрохим. Твердотельный латыш. 14, А120.doi:10.1149/1.3596722
Полный текст CrossRef | Google Scholar
Куриг Х., Вестли М., Тынурист К., Янес А. и Луст Э. (2012). Влияние анионного химического состава ионной жидкости при комнатной температуре и делокализации электрического заряда на свойства суперконденсатора. Дж. Электрохим. соц. 159, А944–А951. doi:10.1149/2.022207jes
CrossRef Full Text | Google Scholar
Лей, З., Лю, З., Ван, Х., Сунь, X., Лу, Л. и Чжао, X. С. (2013). Суперконденсатор высокой плотности энергии с графеном-CMK-5 в качестве электрода и ионной жидкостью в качестве электролита. Дж. Матер. хим. А. 1, 2313–2321. doi:10.1039/c2ta01040b
Полный текст CrossRef | Google Scholar
Летеш К.С., Дехаен В. и Биннеманс К. (2014a). Основные стабильные четвертичные аммониевые ионные жидкости. RSC Adv. 4, 4472–4477. doi:10.1039/c3ra45126g
Полный текст CrossRef | Google Scholar
Летеш К.С., Эвьен С., Радж Дж.Дж., Ру Д.К.Д., Венкатраман В., Джаясайи К. и др. (2019). Гидроксифункционализированные пиридиниевые ионные жидкости: экспериментальное и теоретическое исследование физико-химических и электрохимических свойств. Фронт. хим. 7. doi:10.3389/fchem.2019.00625
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Летеш К.С., Парментье Д., Дехан В. и Биннеманс К. (2012). Фенолатная платформа для анионного обмена в ионных жидкостях. RSC Adv. 2, 11936–11943. doi:10.1039/c2ra22304j
Полный текст CrossRef | Google Scholar
Летеш К.С., Шах С.Н. и Муталиб М.И.А. (2014b). Синтез, характеристика и теплофизические свойства 1,8-диазобицикло[5.4.0] ундек-7-ен на основе тиоцианатных ионных жидкостей. J. Chem. англ. Данные 59, 1788–1795 гг. doi:10.1021/je400991s
Полный текст CrossRef | Google Scholar
Li, J., Tang, J., Yuan, J., Zhang, K., Shao, Q., Sun, Y., et al. (2016а). Взаимодействие между графеном и электролитом ионной жидкости в суперконденсаторах. Электрохимика Acta 197, 84–91. doi:10.1016/j.electacta.2016.03.036
Полный текст CrossRef | Google Scholar
Ли С., Чжу М. и Фэн Г.(2016б). Влияние дикатионной симметрии на электролиты ионной жидкости в суперконденсаторах. J. Phys. Конденс. Matter 28, 464005. doi:10.1088/0953-8984/28/46/464005
CrossRef Полный текст | Google Scholar
Li X., Zhao D., Fei Z. и Wang L. (2006). Применение функционализированных ионных жидкостей. Науч. Китай сер. В 49, 385–401. doi:10.1007/s11426-006-2020-y
CrossRef Полный текст | Google Scholar
Лиан К., Лю Х., Ли К. и Ву Дж.(2019а). Поиск ионных жидкостей с большими окнами электрохимического потенциала. Айше Дж. 65, 804–810. doi:10.1002/aic.16467
Полный текст CrossRef | Google Scholar
Лиан К., Лю К., Ван Акен К. Л., Гогоци Ю., Весоловски Д. Дж., Лю Х. Л. и др. (2016). Повышение емкостных характеристик двухслойных электрических конденсаторов с помощью смесей ионных жидкостей. АСУ Энерг. лат. 1, 21–26. doi:10.1021/acsenergylett.6b00010
Полный текст CrossRef | Google Scholar
Лиан Ю.-M., Utetiwabo, W., Zhou, Y., Huang, Z.-H., Zhou, L., Faheem, M., et al. (2019б). От переработанного полиэтиленового пластика до графена/мезопористого углерода для высоковольтных суперконденсаторов. J. Colloid Interf. науч. 557, 55–64. doi:10.1016/j.jcis.2019.09.003
Полный текст CrossRef | Google Scholar
Р. Лин, П.-Л. Таберна, С. Фантини, В. Прессер, С. Р. Перес, Ф. Мальбоск и др. (2011а). Емкостное хранение энергии от -50 до 100 ° C с использованием электролита с ионной жидкостью. J. Phys. хим. лат. 2, 2396–2401. doi:10.1021/jz201065t
Полный текст CrossRef | Google Scholar
Лин З., Лю Ю., Яо Ю., Хилдрет О. Дж., Ли З., Мун К. и др. (2011б). Превосходная емкость функционализированного графена. J. Phys. хим. С 115, 7120–7125. doi:10.1021/jp2007073
Полный текст CrossRef | Google Scholar
Liu, C., Yu, Z., Neff, D., Zhamu, A., and Jang, B. Z. (2010). Суперконденсатор на основе графена со сверхвысокой плотностью энергии. Нано Летт. 10, 4863–4868. doi:10.1021/nl102661q
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ma, K., Zhang, C., Woodward, C.E., and Wang, X. (2018). Преодоление разрыва между макроскопическими электрохимическими измерениями и микроскопическим моделированием молекулярной динамики: пористый углеродный суперконденсатор с ионными жидкостями. Электрохимика Acta 289, 29–38. doi:10.1016/j.electacta.2018.09.016
Полный текст CrossRef | Google Scholar
Марш, К.Н., Боксалл, Дж. А., и Лихтенталер, Р. (2004). Обзор ионных жидкостей и их смесей при комнатной температуре. Равновесия в жидкой фазе 219, 93–98. doi:10.1016/j.fluid.2004.02.003
Полный текст CrossRef | Google Scholar
Мартинс В. Л., Ренни А. Дж. Р., Санчес-Рамирес Н., Торреси Р. М. и Холл П. Дж. (2018). Улучшенные характеристики суперконденсаторов с ионными жидкостями за счет использования тетрацианоборатных анионов. ХимЭлектроХим 5, 598–604. doi:10.1002/celc.201701164
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мартинс, В.Л., Ренни, А.Дж.Р., Торрези, Р.М., и Холл, П.Дж. (2017). Ионные жидкости, содержащие анионы трицианометанидов: физико-химическая характеристика и характеристики в качестве электролитов электрохимических двухслойных конденсаторов. Физ. хим. хим. физ. 19, 16867–16874. doi:10.1039/C7CP03377J
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мартинс В.Л. и Торреси Р.М. (2018). Ионные жидкости в электрохимическом накопителе энергии. Курс. мнение Электрохимия 9, 26–32.doi:10.1016/j.coelec.2018.03.005
Полный текст CrossRef | Google Scholar
Матон, К., Де Вос, Н., и Стивенс, К.В. (2013). Термическая стабильность ионных жидкостей: механизмы разложения и инструменты анализа. Хим. соц. Ред. 42, 5963–5977. doi:10.1039/c3cs60071h
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Mayrand-Provencher, L., and Rochefort, D. (2009). Влияние проводимости и вязкости электролитов протонных ионных жидкостей на псевдоемкость электродов RuO2. J. Phys. хим. C 113, 1632–1639. doi:10.1021/jp8084149
Полный текст CrossRef | Google Scholar
Менне С., Пирес Дж., Анути М. и Бальдуччи А. (2013). Протонные ионные жидкости как электролиты для литий-ионных аккумуляторов. Электрохимия Комм. 31, 39–41. doi:10.1016/j.elecom.2013.02.026
Полный текст CrossRef | Google Scholar
Л. Мяо, З. Сун, Д. Чжу, Л. Ли, Л. Ган и М. Лю (2021). Ионные жидкости для сверхемкостного хранения энергии: мини-обзор. Энергетическое топливо 35, 8443–8455. doi:10.1021/acs.energyfuels.1c00321
Полный текст CrossRef | Google Scholar
Минакши Сундарам М., Бисвал А., Митчелл Д., Джонс Р. и Фернандес К. (2016). Корреляция между физическим и электрохимическим поведением наноструктурированного электролитического диоксида марганца из раствора выщелачивания и синтетического асимметричного конденсатора на водной основе. Физ. хим. хим. физ. 18, 4711–4720. doi:10.1039/c5cp07141k
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Монтес-Моран, М.А., Суарес Д., Менендес Дж. А. и Фуэнте Э. (2004). О природе базовых сайтов на углеродных поверхностях: обзор. Углерод 42, 1219–1225. doi:10.1016/j.carbon.2004.01.023
CrossRef Full Text | Google Scholar
Мурад Э., Кустан Л., Ланнелонг П., Зига Д., Мехди А., Виу А. и др. (2017). Ионные жидкости Biredox с твердоподобной окислительно-восстановительной плотностью в жидком состоянии для высокоэнергетических суперконденсаторов. Нац. Матер 16, 446–453. doi:10.1038/NMAT4808
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мусави, М.P.S., Wilson, B.E., Kashefolgheta, S., Anderson, E.L., He, S., Bühlmann, P., et al. (2016). Ионные жидкости как электролиты для электрохимических двухслойных конденсаторов: структуры, оптимизирующие удельную энергию. Приложение ACS Матер. Интер. 8, 3396–3406. doi:10.1021/acsami.5b11353
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
М. С. С. Эсперанса, Дж., Канонгия Лопес, Дж. Н., Тарик, М., Сантос, Л. М. Н. Б. Ф., Маги, Дж. В., и Ребело, Л. П. Н. (2010). Летучесть апротонных ионных жидкостей — обзор. J. Chem. англ. Данные 55, 3–12. doi:10.1021/je8w
Полный текст CrossRef | Google Scholar
Музаффар А., Ахамед М. Б., Дешмукх К. и Тирумалай Дж. (2019). Обзор последних достижений в области гибридных суперконденсаторов: проектирование, изготовление и применение. Продлить. Устойчивая энергия. Ред. 101, 123–145. doi:10.1016/j.rser.2018.10.026
Полный текст CrossRef | Google Scholar
Ортега, П.Ф.Р., Сантос, Г.А.Д., Тригейру, Х.П.К., Сильва, Г.Г., Кинтанал Н., Бланко С. и др. (2020). Взгляд на поведение имидазолиевых ионных жидкостей в качестве электролитов в суперконденсаторах на основе углерода: прикладной электрохимический подход. J. Phys. хим. С 124, 15818–15830. doi:10.1021/acs.jpcc.0c04217
Полный текст CrossRef | Google Scholar
Пал Б., Ян С., Рамеш С., Тангадурай В. и Хосе Р. (2019). Выбор электролита для сверхемкостных устройств: критический обзор. Расширенный наноразмер. 1, 3807–3835.doi:10.1039/c9na00374f
Полный текст CrossRef | Google Scholar
Пан С., Яо М., Чжан Дж., Ли Б., Син С., Сун С. и др. (2020). Признание ионных жидкостей высоковольтными электролитами для суперконденсаторов. Фронт. хим. 8. doi:10.3389/fchem.2020.00261
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Панда П.К., Григорьев А., Мишра Ю.К. и Ахуджа Р. (2020). Прогресс в суперконденсаторах: роль двумерных нанотрубчатых материалов. Расширенный наноразмер. 2, 70–108. doi:10.1039/c9na00307j
Полный текст CrossRef | Google Scholar
Панди, Г. П., и Хашми, С. А. (2013). Исследования электрического двухслойного конденсатора с маловязкой ионной жидкостью тетрацианоборатом 1-этил-3-метилимидазолия в качестве электролита. Бык. Матер. науч. 36, 729–733. doi:10.1007/s12034-013-0511-y
Полный текст CrossRef | Google Scholar
Полманн С., Олишлегер Т., Гудрич П., Альварес Висенте Дж., Жакемен, Дж., и Бальдуччи, А. (2015). Ионные жидкости на основе азепания в качестве зеленых электролитов для высоковольтных суперконденсаторов. Дж. Источник питания. 273, 931–936. doi:10.1016/j.jpowsour.2014.09.167
Полный текст CrossRef | Google Scholar
Радж Дж. Дж., Магарет С., Пранеш М., Летеш К. К., Деви В. К. и Муталиб М. И. А. (2018). Экстрактное обессеривание модельного мазута с использованием имидазолиевых ионных жидкостей, функционализированных сложными эфирами. Разделение Purif. Технология 196, 115–123.doi:10.1016/j.seppur.2017.08.050
CrossRef Full Text | Google Scholar
Радж, Дж. Дж., Уилфред, К. Д., Шах, С. Н., Пранеш, М., Абдул Муталиб, М. И., и Летеш, К. К. (2017). Физико-химические и термодинамические свойства имидазолиевых ионных жидкостей с двойными функциональными группами нитрила и эфира. Дж. Мол. Жидкости 225, 281–289. doi:10.1016/j.molliq.2016.11.049
CrossRef Полный текст | Google Scholar
Раза В., Али Ф., Раза Н., Луо Ю., Ким К.-Х., Ян Дж. и др. (2018). Последние достижения в технологии суперконденсаторов. Nano Energy 52, 441–473. doi:10.1016/j.nanoen.2018.08.013
CrossRef Полный текст | Google Scholar
Ренни А. Дж. Р., Санчес-Рамирес Н., Торреси Р. М. и Холл П. Дж. (2013). Ионные жидкости, содержащие эфирную связь, как электролиты суперконденсаторов. J. Phys. хим. лат. 4, 2970–2974. doi:10.1021/jz4016553
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
Родригес, Р.Д.П., де Кастро, Ф.К., Сантьяго-Агияр, Р.С.д., и Роша, М.В.П. (2018). Ультразвуковая экстракция фикобилипротеинов из Spirulina (Arthrospira) Platensis с использованием протонных ионных жидкостей в качестве растворителя. Водорослевые рез. 31, 454–462. doi:10.1016/j.algal.2018.02.021
Полный текст CrossRef | Google Scholar
Рознятовская Н., Рупп А.Б.А., Тюбке Дж. и Кроссинг И. (2015). Эффекты просеивания в двухслойных электрических конденсаторах на основе чистых ионных жидкостей [Al(hfip)4]- и [NTf2]-. Chem Electro Chem 2, 829–836. doi:10.1002/celc.201500024
Полный текст CrossRef | Google Scholar
Сампайо, А. М., Филети, Э. Э., и Сикейра, Л. Дж. А. (2019). Атомистическое исследование физических свойств ионных жидкостей на основе сульфония как электролита для суперконденсаторов. Дж. Мол. Liquids 296, 112065. doi:10.1016/j.molliq.2019.112065
CrossRef Полный текст | Google Scholar
Сатьямурти С., Сурьянараянан В. и Велаютам Д.(2015). Органо-окислительно-восстановительный электролит, продвигаемый Shuttle, протонный ионный жидкий электролит для суперконденсатора. Дж. Источник питания. 274, 1135–1139. doi:10.1016/j.jpowsour.2014.10.166
Полный текст CrossRef | Google Scholar
Седдон К.Р., Старк А. и Торрес М.-Дж. (2000). Влияние хлоридов, воды и органических растворителей на физические свойства ионных жидкостей. Чистое приложение. хим. 72, 2275–2287. doi:10.1351/pac200072122275
Полный текст CrossRef | Google Scholar
Секи, С., Serizawa, N., Hayamizu, K., Tsuzuki, S., Umebayashi, Y., Takei, K., et al. (2012). Физико-химические и электрохимические свойства трис(пентафторэтил)трифторфосфата 1-этил-3-метилимидазолия и тетрацианобората 1-этил-3-метилимидазолия. Дж. Электрохим. соц. 159, А967–А971. doi:10.1149/2.032207jes
CrossRef Full Text | Google Scholar
Шахзад С., Шах А., Ковсари Э., Ифтихар Ф. Дж., Наваб А., Пиро Б. и др. (2019). Ионные жидкости как экологически безопасные электролиты для высокоэффективных суперконденсаторов. Глоб. Challenges 3, 1800023. doi:10.1002/gch3.201800023
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шао, К., Тан, Дж., Линь, Ю., Ли, Дж., Цинь, Ф., Юань, Дж., и другие. (2015). Графеновые аэрогели, расположенные на углеродных нанотрубках, с повышенной емкостью в водных и ионных жидких электролитах. Дж. Источник питания. 278, 751–759. doi:10.1016/j.jpowsour.2014.12.052
Полный текст CrossRef | Google Scholar
Шарма П., Минакши Сундарам М., Сингх, Д., и Ахуджа, Р. (2020). Высокоэнергетический и стабильный молибдат гадолиния/висмута с быстрореактивными частицами, окислительно-восстановительный механизм водного электролита. Приложение ACS Энерг. Матер. 3, 12385–12399. doi:10.1021/acsaem.0c02380
Полный текст CrossRef | Google Scholar
Siinor, L., Siimenson, C., Lust, K. and Lust, E. (2013). Смесь тетрафторбората 1-этил-3-метилимидазолия и йодида 1-этил-3-метилимидазолия: новый потенциальный электролит с высокой емкостью для EDLC. Электрохимия Комм. 35, 5–7. doi:10.1016/j.elecom.2013.07.023
Полный текст CrossRef | Google Scholar
Силларс Ф. Б., Флетчер С. И., Мирзаян М. и Холл П. Дж. (2012). Изменение характеристик электрохимического конденсатора в зависимости от вязкости электролита ионной жидкости при комнатной температуре и размера ионов. Физ. хим. хим. физ. 14, 6094–6100. doi:10.1039/c2cp40089h
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сан, Г., Ли, К., и Сун, К. (2010). Электрохимические характеристики электрохимических конденсаторов с использованием Cu(II)-содержащей ионной жидкости в качестве электролита. Микропористый мезопористый материал. 128, 56–61. doi:10.1016/j.micromeso.2009.07.027
CrossRef Full Text | Google Scholar
Сундарам, М. М., и Аппаду, Д. (2020). Традиционный электролит соль-в-воде против электролита вода-в-соли с бинарным оксидом металла для симметричных суперконденсаторов: емкостный против фарадеевского. Далтон Транс. 49, 11743–11755. doi:10.1039/d0dt01871f
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Susantyoko, R. A., Parveen, F., Mustafa, I., и Almheiri, S. (2019). Отдельно стоящие листы MWCNT/активированный уголь: другой подход к изготовлению гибких электродов для суперконденсаторов. Ионика 25, 265–273. doi:10.1007/s11581-018-2585-4
Полный текст CrossRef | Google Scholar
Тамайларасан П. и Рамапрабху С. (2012). Гибридный электродный материал на основе углеродных нанотрубок, графена и твердой ионной жидкости для высокопроизводительного суперконденсатора. J. Phys. хим. С 116, 14179–14187. doi:10.1021/jp302785j
CrossRef Полный текст | Google Scholar
Тан С., Бейкер Г. А. и Чжао Х. (2012). Функционализированные эфиром и спиртом ионные жидкости для конкретных задач: привлекательные свойства и применение. Хим. соц. Ред. 41, 4030–4066. doi:10.1039/c2cs15362a
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тангавел Р., Каннан А. Г., Понрадж Р., Тангавел В., Ким Д.-В. и Ли Ю.-С. (2018). Высокоэнергетический зеленый суперконденсатор, управляемый ионными жидкими электролитами, как сверхвысокостабильное устройство хранения энергии следующего поколения. Дж. Источник питания. 383, 102–109. doi:10.1016/j.jpowsour.2018.02.037
Полный текст CrossRef | Google Scholar
Тимофте Т. и Мудринг А.-В. (2006). Ионные жидкости со слабокоординирующими анионами. З. Анорг. Allg. хим. 632, 2164. doi:10.1002/zaac.200670175
CrossRef Full Text | Google Scholar
Токуда, Х., Цузуки С., Сьюзан М.А.Б.Х., Хаямидзу К. и Ватанабэ М. (2006). Насколько ионны ионные жидкости при комнатной температуре? Индикатор физико-химических свойств. J. Phys. хим. Б 110, 19593–19600. doi:10.1021/jp064159v
Полный текст CrossRef | Google Scholar
Торресилья, Дж. С., Рафионе, Т., Гарсия, Дж., и Родригес, Ф. (2008). Влияние относительной влажности воздуха на плотность, кажущийся молярный объем, вязкость, поверхностное натяжение и содержание воды в ионной жидкости этилсульфата 1-этил-3-метилимидазолия. J. Chem. англ. Данные 53, 923–928. doi:10.1021/je700523b
CrossRef Полный текст | Google Scholar
Тран, К., Лоуренс, Д., Ричи, Ф.В., Диллард, К., Элабд, Ю.А., и Калра, В. (2015). Трехмерные электроды высокой плотности энергии без связующего вещества для суперконденсаторов с ионной жидкостью. Хим. коммун. 51, 13760–13763. doi:10.1039/c5cc04359j
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цузуки С., Токуда Х., Хаямидзу К. и Ватанабэ М.(2005). Величина и направленность взаимодействия в ионных парах ионных жидкостей: связь с ионной проводимостью. J. Phys. хим. Б 109, 16474–16481. doi:10.1021/jp0533628
Полный текст CrossRef | Google Scholar
Вадияр М.М., Патил С.К., Бхисе С.К., Гуле А.В., Хан С.-Х. и Колекар С.С. (2015). Улучшение электрохимических характеристик электрода суперконденсатора на основе наночешуек ZnFe2O4 с использованием тиоцианат-функционализированных ионных жидких электролитов. евро. Дж. Неорг. хим. 2015, 5832–5838. doi:10.1002/ejic.201500870
Полный текст CrossRef | Google Scholar
Ван Акен, К.Л., Бейдаги, М., и Гогоци, Ю. (2015). Состав электролита с ионной жидкостью для расширения диапазона напряжений суперконденсаторов. Анжю. хим. Междунар. Эд. 54, 4806–4809. doi:10.1002/anie.201412257
Полный текст CrossRef | Google Scholar
Варци А., Бальдуччи А. и Пассерини С. (2014). Натуральная целлюлоза: экологичное альтернативное связующее для высоковольтных электрохимических двухслойных конденсаторов, содержащих электролиты на основе ионной жидкости. Дж. Электрохим. соц. 161, А368–А375. doi:10.1149/2.063403jes
CrossRef Full Text | Google Scholar
Венкатраман В., Эвьен С., Летеш К. К., Радж Дж. Дж., Кнуутила Х. К. и Фиксдал А. (2019). Быстрый, всесторонний скрининг ионных жидкостей для устойчивого применения. Устойчивая энергетика. Топливо 3, 2798–2808. doi:10.1039/c9se00472f
Полный текст перекрестной ссылки | Google Scholar
Фогль Т., Менне С., Кюнель Р.-С. и Бальдуччи А.(2014). Благотворное влияние протонных ионных жидкостей на литиевую среду в электролитах для аккумуляторных батарей. Дж. Матер. хим. А. 2, 8258–8265. doi:10.1039/c3ta15224c
Полный текст CrossRef | Google Scholar
Ван П., Закируддин С. М., Мозер Дж.-Э., Хамфри-Бейкер Р. и Гретцель М. (2004). Не содержащий растворителей ионный жидкий электролит на основе SeCN-/(SeCN)3 для высокоэффективных нанокристаллических солнечных элементов, сенсибилизированных красителем. Дж. Ам. хим. соц. 126, 7164–7165.doi:10.1021/ja048472r
CrossRef Полный текст | Google Scholar
Ван К., Чжан Т., Чжан С., Фан Ю. и Чен Б. (2020). Экстрактное обессеривание топлив с использованием протонных ионных жидкостей на основе триалкиламинов. Разделение Purif. Technology 231, 115923. doi:10.1016/j.seppur.2019.115923
CrossRef Полный текст | Google Scholar
Ван Ю., Сун Ю. и Ся Ю. (2016). Электрохимические конденсаторы: механизм, материалы, системы, характеристика и применение. Хим. соц. Ред. 45, 5925–5950. doi:10.1039/c5cs00580a
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вассершайд П. и Велтон Т. (2008). Ионные жидкости в синтезе . Второе издание. doi:10.1002/9783527621194
CrossRef Полный текст
Вольф К., Чон С., Пайяр Э., Бальдуччи А. и Пассерини С. (2015). Мощные, не содержащие растворителей электрохимические двухслойные конденсаторы на основе пирролидинийдицианамидных ионных жидкостей. Дж. Источник питания. 293, 65–70. doi:10.1016/j.jpowsour.2015.05.065
Полный текст CrossRef | Google Scholar
Ву, Б., Курода, К., Такахаши, К., и Кастнер, Э. У. (2018). Структурный анализ цвиттерионных жидкостей по сравнению с гомологичными ионными жидкостями. J. Chem. физ. 148, 193807. doi:10.1063/1.5010983
CrossRef Full Text | Google Scholar
Ся Л., Ю Л., Ху Д. и Чен Г. З. (2017). Электролиты для электрохимического накопления энергии. Матер.хим. Фронт. 1, 584–618. doi:10.1039/c6qm00169f
Полный текст CrossRef | Google Scholar
Сюй К., Ян Г., Ву Д., Яо М., Син К., Чжан Дж. и др. (2021). Дорожная карта по ионным жидким электролитам для накопителей энергии. Хим. Азиат Дж. 16, 549–562. doi:10.1002/asia.202001414
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ямадзаки С., Ито Т., Ямагата М. и Исикава М. (2012). Неводный электрохимический конденсатор, использующий электролитические окислительно-восстановительные реакции бромистых соединений в ионной жидкости. Электрохимика Acta 86, 294–297. doi:10.1016/j.electacta.2012.01.031
Полный текст CrossRef | Google Scholar
Йошида Ю., Баба О. и Сайто Г. (2007). Ионные жидкости на основе дицианамид-аниона: влияние структурных изменений в катионных структурах на ионную проводимость†. J. Phys. хим. В 111, 4742–4749. doi:10.1021/jp067055t
Полный текст CrossRef | Google Scholar
Заругуи Р., Хачича Р., Рьяб Р., Мессауди С. и Годбейн О.(2018). Физико-химические характеристики новых ионных жидкостей на основе дицианамида, применяемых в качестве электролитов для суперконденсаторов. RSC Adv. 8, 31213–31223. doi:10.1039/C8RA05820B
Полный текст перекрестной ссылки | Google Scholar
Zhang, Q., Liu, S., Li, Z., Li, J., Chen, Z., Wang, R., et al. (2009). Новые циклические ионные жидкости на основе сульфония: синтез, характеристика и физико-химические свойства. Хим. Евро. J. 15, 765–778. doi:10.1002/chem.200800610
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжан, С.


 16 — 2,60 мэкв/л
16 — 2,60 мэкв/л  0–21,0 мг/дл
0–21,0 мг/дл