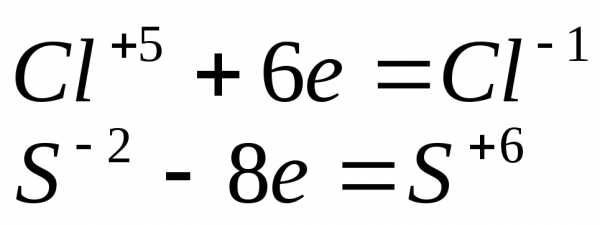|
|
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Горение и взрывы. Окисление и восстановление. / / Важнейшие восстановители и окислители (коротко и подробно)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
dpva.ru
Важнейшие окислители и восстановители
К
числу сильных окислителей, широко
используемых на практике, относятся
галогены (Fe2,
Cl2,
Br2,
I2),
оксид марганца Mn+4O2,
перманганат калия KMn+7O4,
манганат калия K2Mn+6O4,
оксид хрома (хромовый ангидрид) Cr+6O3,
хромат калия K2Cr+6O4,
бихромат калия K2Cr2+6O7,
азотная кислота HN+5O3
и ее соли, кислород О2,
озон О3,
перекись водорода Н2О2,
концентрированная серная кислота
Н2S+6О4,
оксид меди (II)
Сu+2О,
оксид серебра Ag2+1O,
оксид свинца Рb
Щелочные и щелочноземельные металлы являются сильными восстановителями. К числу других восстановителей относятся: водород, углерод, оксид углерода С+2О, сероводород Н2S-2, оксид серы S+4О2, сернистая кислота Н2S+4О3 и ее соли, галогенводороды (кроме HF), хлорид олова (II) Sn+2Cl2, сульфат железа (II) Fe+2SO4.
Типы окислительно-восстановительных реакций. Окислительно–восстановительный эквивалент
Различают три типа окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные и реакции самоокисления–самовосстановления.
Межмолекулярные – это такие реакции, в которых молекулы, атомы или ионы элементов, входящие в состав одного вещества и являющиеся окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2H2O.
Во внутримолекулярных реакциях изменяется СО элементов одного и того же вещества таким образом, что одни из них окисляются, а другие — восстанавливаются. К таким реакциям относится, например, разложение бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
2Hg+2O-2 = 2Hg0 + O20.
В реакциях самоокисления–самовосстановления (диспропорционирования) атомы одного и того же вещества так взаимодействуют друг с другом, что одни отдают электроны (окисляются), а другие их присоединяют (восстанавливаются). Например, растворение хлора в воде:
Cl20 + H2O = HCl+1O + HCl-1 или
(Cl0Cl0 + H2O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное от деления молярной массы вещества на число приобретаемых (или теряемых) электронов. Так, в реакции
5H2S + 2KMnO4 + 3H3SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
для KMnO4 окислительный эквивалент равен 158,15/5, а для сероводорода восстановительный эквивалент – половине его молярной массы.
Методика составления окислительно–восстановительных реакций на основе электронного баланса
С точки зрения электронной теории окислительно–восстановительными реакциями называются такие реакции, при протекании которых происходит переход электронов от одних атомов, молекул или ионов к другим. Поскольку электроны в окислительно–восстановительных реакциях переходят только от восстановителя к окислителю, а молекулы исходных веществ и продуктов реакции электронейтральны, то число электронов, отданных восстановителем всегда равно числу электронов, принятых окислителем. Это положение называется принципом электронного баланса и лежит в основе нахождения коэффициентов в уравнениях окислительно–восстановительных реакций.
Согласно этому принципу число молекул окислителя и число молекул восстановителя в уравнении окислительно-восстановительных реакций должны быть такими, чтобы количество принимаемых и отдаваемых электронов было одинаковым.
Рассмотрим применение принципа электронного баланса при нахождении коэффициентов в уравнениях окислительно–восстановительных реакций на конкретных примерах.
При каталитическом окислении аммиака NH3 кислородом О2 образуется оксид азота NO и вода Н2О. Запишем схему процесса с помощью формулы:
NH3 + O2 NO + H2O.
Над символами элементов, изменяющих в процессе реакции СО, подпишем их значения:
N-3H3 + O20 N+2O-2 + H2O-2.
Из изменения величины СО видно, что азот в молекуле аммиака окислился, а молекула кислорода – восстановилась, то есть аммиак является восстановителем, а кислород – окислителем. Из этой схемы также вытекает, что атом азота, изменяя СО от -3 до +2, отдает кислороду пять электронов. Поскольку водород СО не меняет, то молекула аммиака будет отдавать всего 5 электронов. Атом кислорода принимает 2 электрона (СО меняется от 0 до -2), следовательно, молекула кислорода будет принимать 4 электрона. Запишем указанные процессы в виде схемы:
-
N-3 — 5ē N+2 5
20
O20 + 4ē 2O-2 4
4 окисление – восстановитель
5 восстановление — окислитель
Согласно принципу электронного баланса количества молекул окислителя и восстановителя нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были равными. Для этого находится общее кратное, а затем делится на число отдаваемых или приобретаемых электронов; полученные коэффициенты ставятся соответственно перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4 молекулы NH3 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты электронного баланса называются основными коэффициентами. Они никаким изменениям не подлежат:
4NH3 + 5O2 NO + H2O.
Все остальное уравнивается в соответствии с их величиной:
4NH3 + 5O2 4NO + 6H2O.
При окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая кислота H3AsO4, серная H2SO4 и оксид азота NO.
Составим схему реакции, указывая СО над символами тех элементов, у которых в процессе реакции они изменяются:
As2+3S3-2+ HN+5O3 H3As+5O4 + H2S+6O4 + N+2O.
Подсчитаем количество электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3 электрона. Запишем это в виде схемы:
|
As2+3S3-2 — 28ē = 2As+5 + 3S+6 (окисление) 84 N+5 + 3ē = N2+ (восстановление) |
3 28 |
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и 28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6H3AsO4 + 9H2SO4 + 28NO.
Подсчет атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода в правой части 84 атома, в правой – 88. Если водород или кислород не входят в уравнение реакции в виде простых веществ, то они уравниваются добавлением нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому подсчет атомов кислорода или водорода проводят в последнюю очередь, причем уравнивание водорода добавлением молекул воды приводит к автоматическому уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение реакции в виде простых веществ, то их необходимо уравнивать независимо друг от друга.
Окончательно рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6H3AsO4+ 9H2SO4 + 28NO.
Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:
|
|
8 24 6 |
4 3 |
(восстановление) (окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3H2S = 4HCl + 3H2SO4.
Электронный баланс в данном случае .
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:
|
3 3 1 |
6 2 |
(окисление) (восстановление) |
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул H2SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:
-
1
3 группы по два иона хлора, всего шесть ионов хлора
(восстановление)
(окисление)
K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
K2Cr2O7 + 6HCl + 8HCl 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды H2O, и получим окончательно:
K2Cr2O7 + 14HCl 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
6.
-
8
2
4
1
(окисление)
(восстановление)
Основные коэффициенты 4 и 1:
4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:
4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
на окисление на связывание
7. Оба элемента — и отдающий и принимающий электроны — находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:
|
6 24 4 |
4 6 |
2 3 |
(окисление) (восстановление) |
2KСlO3 = 2KCl + 3O2.
8. Один и тот же элемент окисляется и восстанавливается. Такие реакции называются реакциями диспропорционирования. В этом случае, так же как и в предыдущем, электронный баланс составляется справа налево:
4K2SO3+4 = 3K2SO4+6 + K2S-2
|
S+6 + 2ē = S+4 12 S-2— 6ē = S+4 |
6 2 |
3 (восстановление) 1 (окисление) |
Рассмотренный способ подбора коэффициентов в окислительно–восстановительных реакциях не является единственным. Существуют и другие способы. Однако во всех случаях главным остается нахождение основных коэффициентов электронного баланса.
Литература:
Глинка Н.Л. Общая химия. – М.: Химия, 1978. — С. 261-270.
Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. — С. 90-106.
Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. — С. 14-32.
Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. — С. 4-9, 65-75.
studfiles.net
Классификация окислителей и восстановителей
Окислительно-восстановительные свойства атомов различных элементов и образуемых ими соединений зависят от положения этих элементов в периодической системе Д.И. Менделеева.
Элементы и их соединения, участвующие в окислительно-восстановительных реакциях, можно отнести к одной из трех групп:
I — безусловные восстановители;
II — безусловные окислители;
III — в зависимости от условий могут быть и окислителями и восстановителями.
I группа. Только восстановителями могут быть:
а) свободные атомы металлов всех семейств (s-, р-, d- и f) и металлы в конденсированном состоянии;
б) элементы в форме существования с наиболее отрицательным окислительным числом.
Проявление свободными металлами только восстановительных свойств объясняется способностью их атомов терять полностью или частично валентные электроны. Свободные атомы металлов способны отдавать столько электронов (максимально) каков номер группы. Na+1; Са+2; Мп+7.
Восстановительная активность металлов проявляется по-разному. Мерой её для свободных атомов металлов является потенциал ионизации (I), а в водных растворах — электродный потенциал (Е). Самыми энергичными восстановителями в соответствии со значениями I и Е являются щелочные металлы, а самыми пассивными — переходные металлы VII периода (Hf, Та, W, Re).
Только восстановителями могут быть и атомы неметаллических элементов с отрицательным окислительным числом, например элементы IV А — VII А подгрупп в , и других соединениях, а также ион Н-1 (гидрид-анион). В ряду сходных водородных соединений неметаллов HF, НСl, НВr и HI их восстановительная функция усиливается в том направлении, которое соответствует уменьшению электроотрицательности неметалла. HI — сильный восстановитель, a HF — в
водных растворах восстановленные свойства не проявляет.
II группа. Только окислителями могут быть атомы элементов с наивысшим положительным окислительным числом в соединениях, а также атомы и молекулы фтора и кислорода (за исключением соединений фтора с кислородом).
Атомы с максимальным окислительным числом содержатся в высших оксидах и их производных — гидроксидах и солях: , , , , . Окислительная способность оксидов, как правило, выше, чем у соответствующих гидроксидов и особенно солей
, , ,
В этом ряду окислительная способность возрастает.
Слабыми окислителями являются катионы щелочных и щелочно-земельных металлов. В отличие от них сильными окислителями являются катионы пассивных металлов (Bi3+, Сu2+, Ag+, Аu3+). Это свойство используется, например, при изготовлении печатных плат, химическое меднение которых проводят восстановлением ионов Сu2+ (из растворов комплексных соединений) формальдегидом.
III группа. Некоторые вещества в реакциях окисления-восстановления могут выступать и окислителями, и восстановителями (в зависимости от условий). Ими могут быть:
а) Атомы и молекулы неметаллов IV А — VII А подгрупп, бор, водород;
H-1 H0 H+1
S-2 S0 S+4 S+6
|
б) Ионы элементов с промежуточным (между низшим и высшим) положительным окислительным числом в соединении.
Например, для марганца окислительными числами могут быть: Мn0, , , , , . Все формы его соединений с О.Ч. +2, +3, +4, +6 в зависимости от условий могут проявлять как окислительные, так и восстановительные функции.
в) Перекисные соединения (Н2О2, ВаО2 и др.).
Это связано со способностью соответствующих элементов отдавать или принимать электроны, повышая или понижая своё окислительное число. Двойственный характер поведения, например, Н2О2 обусловлен природой связи. Атомы кислорода связаны друг с другом единичной неполярной ковалентной связью. Так как при этом общая пара электронов симметрично расположена относительно обоих ядер, то данная связь не изменяет окислительного числа атомов кислорода. Зато полярная ковалентная связь атомов кислорода с водородом обеспечивает О.Ч. -1 каждому кислородному атому.
С одной стороны, молекула Н2О2может распадаться с разрывом кислородной связи и образованием новых связей кислорода с атомами других элементов, в результате О.Ч. кислорода уменьшается до -2. При таком превращении перекись ведет себя как окислитель: 2Н+ + Н2O2-1 + 2 → 2Н2O-2.
С другой стороны в Н2O2могут разрываться связи О-Н, в результате образуются молекулы O2 и О.Ч. кислорода повышается до 0. В этом случае Н2O2 проявляет восстановительные свойства.
Во многих реакциях, протекающих в водных растворах, участвуют соединения, атомы которых не изменяют О.Ч. Такие вещества в окислительно-восстановительных процессах вводят для создания среды: нейтральной, щелочной и кислотной.
Похожие статьи:
poznayka.org