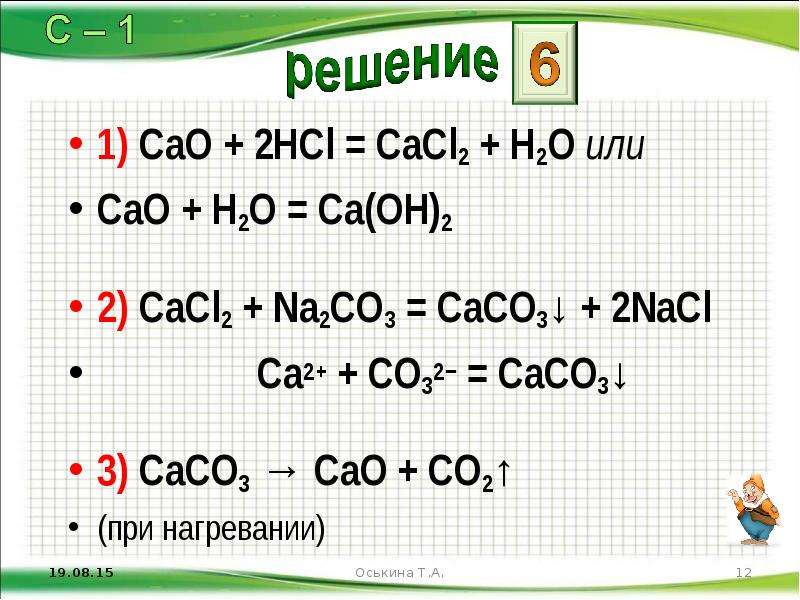
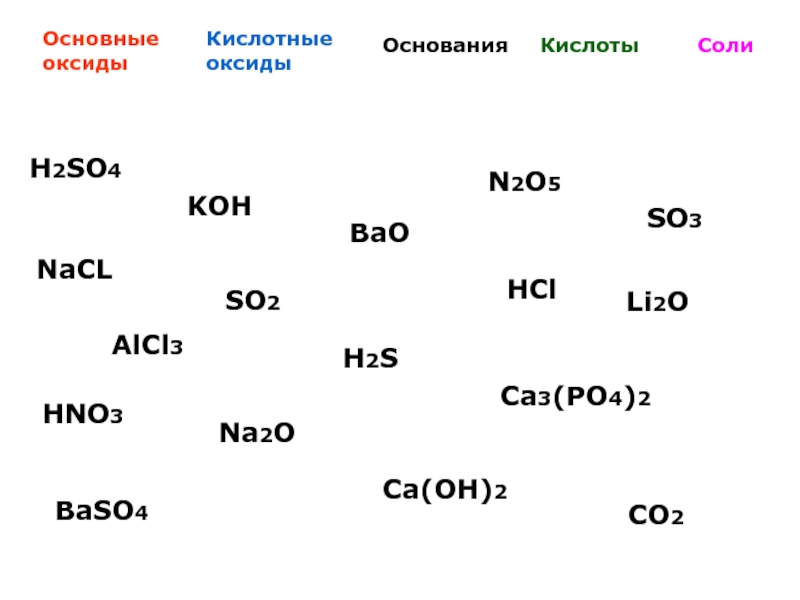
Установите соответствие между формулой вещества и его принадлежностью к определенному классу
НУЖНО РЕШЕНИЕ ЗАДАЧИ ПО ХИМИИ При сжигании метилового и этилового спиртов образовалось 15,68л (н.у.) углекислого газа. А при взаимодействии такой же м … ассы смеси с избытком металлического натрия выделилось 5.6 л водорода. Определите массу исходной смеси и массовую долю метанола в ней Ответ масса смеси 18,8г массовая доля метанола 51%
CO (a) + Cl₂ (a) ₂ COCl₂ Как достигается скорость реакции, если концентрации CO и Cl₂ удваиваются?
НУЖНО РЕШЕНИЕ ЗАДАЧИ ПО ХИМИИ При сжигании метилового и этилового спиртов образовалось 15,68л (н.у.) углекислого газа. А при взаимодействии такой же м … ассы смеси с избытком металлического натрия выделилось 5.6 л водорода. Определите массу исходной смеси и массовую долю метанола в ней Ответ масса смеси 18,8г массовая доля метанола 51%
Обязательная контрольная работа № 2Вариант 21. Выпишите приведенные ниже формулы.
В какой массе воды растворить 200 г поваренной соли, чтобы получился 10% раствор
НУЖНО РЕШЕНИЕ ЗАДАЧИ ПО ХИМИИ При сжигании метилового и этилового спиртов образовалось 15,68л (н.у.) углекислого газа. А при взаимодействии такой же … массы смеси с избытком металлического натрия выделилось 5.6 л водорода. Определите массу исходной смеси и массовую долю метанола в ней Ответ масса смеси 18,8г массовая доля метанола 51%
помогите пожалуйста!написать изомеры веществ:c-c-c-c-c-oh. | ohc-c-c-c |. |. |oh oh oh c |c — c- c. — c — oh |. |. | c. oh. c | c
Какие количества (моль) веществ участвуют в реакции нейтрализации при смешивании 2 молей гидроксида калия и 3 молей растворов азотной кислоты?
Какие количества (моль) веществ участвуют в реакции нейтрализации при смешивании 2 молей гидроксида калия и 3 молей растворов азотной кислоты?
1Чем отличается химическая от электрохимической коррозии? Приведите примеры. 2 Какие факторы влияют на коррозию металлов.
3. Протектор, лужение, ли
…
гированная сталь, никилирование, пассивация. Объясните значение этих слов.
4. Почему считают, что рядом со стальной коронкой (Fе) не рекомендуется ставить золотую (Аu)?
5. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
2 Какие факторы влияют на коррозию металлов.
3. Протектор, лужение, ли
…
гированная сталь, никилирование, пассивация. Объясните значение этих слов.
4. Почему считают, что рядом со стальной коронкой (Fе) не рекомендуется ставить золотую (Аu)?
5. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
Новости школы -Подготовка к ЕГЭ по химии. Часть А-3.
Неорганические вещества, их номенклатура, классификация.
Характерные химические свойства неорганических веществ
различных классов
Обязательный минимум знаний
Схема 2
Вещества
Простые Сложные
Металлы Благородные Оксиды Соли
газы
Неметаллы Кислоты Основания
Схема 3
Оксиды и их классификация
Оксиды – бинарные соединения с кислородом в с. о. – 2
о. – 2
Несолеобразующие Солеобразующие
N2O, NO, CO 1. Основные
– оксиды металлов в с.о. +1, +2(оксиды металлов IА и IIА групп но не ZnO,
BeO), оксиды металлов в низших с.о. (СrO, FeO)
2. Кислотные – оксиды неметаллов (N2O5, SO2,
SO3) и металлов с высокой с.о. +5,+6,+7, (CrO3, Mn2O7).
3. Амфотерные — ZnO, BeO, Al2O3,
оксиды металлов в промежуточных с.о. (Cr2O3, Fe2O3).
Таблица 2
Характерные химические свойства солеобразующих оксидов
|
Гр. Свойства |
Основные оксиды |
Кислотные оксиды |
Амфотерные оксиды |
|
Образуют соль и воду в реакции обмена при взаимодействии |
с кислотами |
с основаниями |
и с кислотами, и с основаниями |
|
Образуют соль в реакции соединения при взаимодействии |
с кислотными и амфотерными оксидами |
с основными и амфотерными оксидами |
с основными и кислотными оксидами |
|
Образуют растворимый гидроксид при взаимодействии с водой |
щелочи |
кислородсодержащие кислоты |
не взаимодействуют с водой |
Основания
Основания (в свете атомно-молекулярного учения) – сложные вещества, состоящие из металла и гидроксогрупп.
Основания (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп.
Основания (в свете протонной теории) – акцепторы катионов водорода.
Таблица 3
Классификация оснований
Характерные химические свойства оснований
и амфотерных гидроксидов
1. 1) Основание (или амфотерный гидроксид) + кислота = соль + вода
2) Бескилородное основание (аммиак, амины) + кислота = соль
2. Основание + кислотный оксид = соль + вода
3. Щелочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ)
4. Щелочь + амфотерный гидроксид = соль + вода
t
5. Нерастворимые основания (или амфотерный гидроксид) =
= оксид металла + вода
Кислоты
Кислоты (в свете атомно-молекулярного учения) – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты (в свете протонной теории) – доноры катионов водорода.
Характерные химические свойства кислот
1. Кислота + металл = соль + водород, если:
— металл находится в ряду напряжений до водорода,
— образуется растворимая соль,
— кислота растворима,
Примечания:
· щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют, в первую очередь, с водой,
· азотная кислота любой концентрации и концентрированная серная кислота взаимодействует с простыми веществами по-особому (см. табл. 5)
2. Кислота + оксид металла (основный или амфотерный) = соль + вода
3. Кислота + основание (гидроксид или бескислородное основание) = соль +
+ вода (для бескилородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок, газ или слабый электролит).
Таблица 4
Классификация кислот
Соли
Соли (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
Примечание. Эти определения справедливы только для нормальных или средних солей.
Схема 4
Классификация солей
Соли
Средние Кислые Основные Двойные Комплексные
или нормальные Сa (HCO3)2, (CuOH)CO3, (NH4)2Fe (SO4)2, K3[Fe (CN)6]
NaCl, K2SO4, NaHSO4, Al (OH)2Cl, KAl (SO4)2, K4[Fe (CN)6]
CaCO3, RCOONa KH2PO4 Fe (OH)SO4 KCl∙NaCl
Характерные химические свойства солей
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щелочь = новая соль + новое основание (если образуется осадок или газ)
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок)
4. Соль (раствор) + металл = новая соль + новый металл, если:
· металл находится в ряду напряжений до металла соли,
· образуется растворимая соль.
Примечание: щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют, в первую очередь, с водой.
Примеры тестовых заданий и
рекомендации к их выполнению
1. Только солеобразующие оксиды находятся в ряду
1) P2O5, ZnO, NO
2) CO, N2O5, Na2O
3) Al2O3, N2O, N2O3
4) SiO2, BeO, CaO
Это задание следует выполнить методом исключения тех рядов веществ, в которых содержаться формулы несолеобразующих оксидов, так как таких оксидов немного и их нужно знать. Исключаются варианты ответов 1-3. Ответ 4.
Исключаются варианты ответов 1-3. Ответ 4.
2. Амфотерными гидроксидами являются вещества, формулы которых
1) CsOH и Cr (OH)2
2) KOH и Ca (OH)2
3) Be (OH)2и Cr (OH)3
4) NaOH и Mg (OH)2
Это задание также следует выполнить методом исключения тех пар веществ, в которых содержатся формулы щелочей, так как таких веществ в школьном курсе изучается немного и их следует знать. Ответ 3.
3. Кислотными оксидами являются вещества, формулы которых
1) N2O3, N2O5, CrO3
2) Cr2O3, CrO, N2O
3) NO, Na2O, P2O5
4) SiO2, BeO, CaO
Для быстрого определения верного ответа из предложенных вариантов необходимо исключить те, в которых встречаются оксиды металлов в с. о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
4. Содержит все три типа гидроксидов ряд веществ, формулы которых
1) H2SO4, Ca (OH)2, NaOH
2) Cr (OH)3, Cr (OH)2, H2CrO4
3) NaOH, HNO3, Mg (OH)2
4) KOH, HClO4, Ba (OH)2
Достаточно сложное, многофакторное задание, которое требует знания ряда химических понятий: гидрооксиды (это понятие объединяет основания, амфотерные гидрооксиды и кислородсодержащие кислоты), зависимость свойств оксидов и гидроксидов металлов от величины с.о. (как правило, оксид и гидроксид с низшей с. о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
5. Формулы только кислых солей записаны в ряду
1) K2SO4, KOH, H2SO4, NaHCO3
2) Fe (HSO4)2, CaHPO4, CaCO3, Ca (OH)NO3
3) NH4HSO4, NH4NO3, (NH4)2HPO4, (NH4)2 CO3
4) NaH2PO4, Na2HPO4, NaHCO3, NaHS
Для быстрого определения верного ответа нужно ориентироваться на ключевое словосочетание «кислая соль», т. е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
6. Двухосновная, растворимая, кислородсодержащая, сильная и стабильная кислота имеет формулу
1) H2SO3 2) H2S 3) H2SO4 4) H2S2O3
Условию задания отвечает вариант 3, т.к. любому школьнику известно, что сернистая кислота нестабильна, а сероводородная – слабая. Тиосерная кислота для обычного школьника представляет собой «экзотику», поэтому необходимо остановиться на привычной и хорошо известной серной кислоте. Ответ 3.
7. Средняя соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Сa (НСO3)2, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
Для успешного выполнения этого задания необходимо мысленно разделить предложенные ответы на три подстолбика. Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3)FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
Успешное выполнение этого задания зависит от ключевого слова «соответственно», которое задает порядок поиска верного ответа: средняя, кислая и основная соли.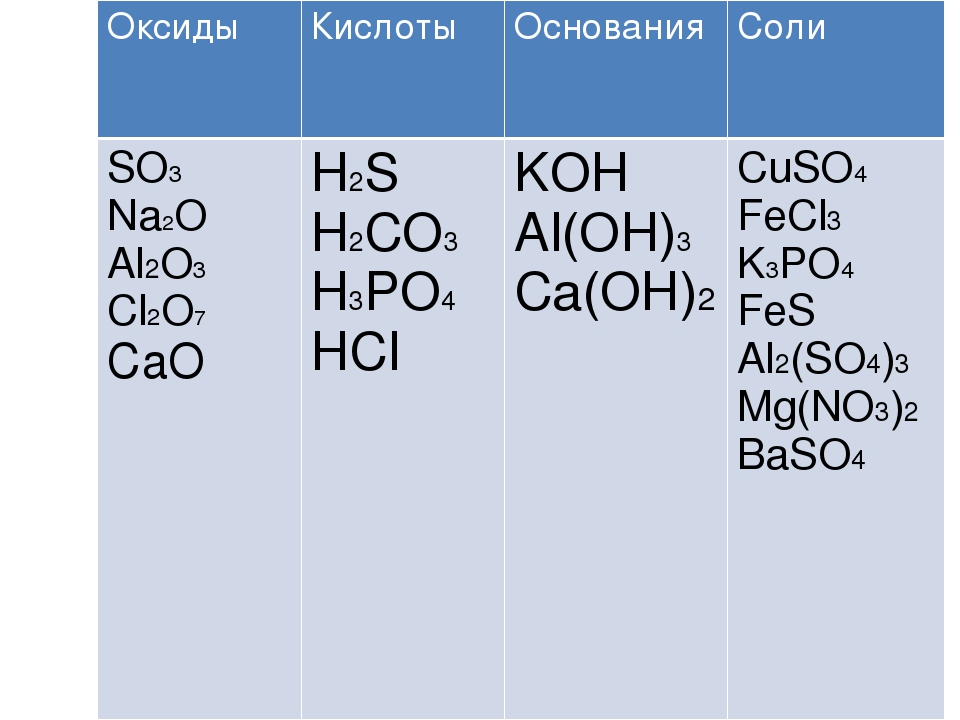 Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
9. В следующей характеристике гидроксида бария неверно положение
1) кислородсодержащее основание, щелочь
2) сильное двухкислотное основание
3) способно образовать два ряда солей – средние и основные
4) летучее, непрочное соединение
Ключевым словосочетанием к выполнению задания является «неверно положение», оно и позволит определить искомый ответ. Ответ 4.
10. Оксиду фосфора (V) не соответствует кислота, формула которой
1) H3PO4 2) H4P2O7 3)H3PO3 4) HPO3
Ключом к решению этого задания является положение о том, что с. о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
11. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) Al, Zn, Cu 2) Zn, Fe, Pb 3) Mg, Zn, Fe 4) Pb, Cu, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II) – практически нерастворимая соль, о чем свидетельствует соответствующая клеточка в таблице растворимости. Ответ 3.
Ответ 3.
12. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1, 2 и 4. Ответ 3.
13. С раствором хлорида меди (II) не реагирует
1) Mg 2) Zn 3) Fe 4) Ag
Легкое заданий на знание ряда напряжений металлов. Ответ 4.
14. С раствором сульфата меди (II) не реагирует
1)Pb 2)Zn 3) Fe 4) Mg
Задание аналогично предыдущему, но с учетом условий протекания реакций между раствором соли и металлом. Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
15. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида – щелочи. Следовательно, это должен быть оксид щелочного или щелочноземельного металла. Ответ 3.
16. Серебро из раствора нитрата серебра вытесняют все металлы ряда
1) Na, Cr, Zn 2) K, Fe, Cu 3) Fe, Zn, Cu 4) Zn, Fe, Au
Задание на знание свойств солей и ряда напряжений металлов. Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
17. При взаимодействии меди с концентрированной серной кислотой образуются
1) CuSO4, SO2, H2O
2) CuSO4, H2
3) CuO, SO2, H2O
4) Cu2SO4, SO2, H2O
Задание на знание свойств концентрированной серной кислоты, которая при взаимодействии с металлами, стоящими в ряду напряжений до и после водорода, образует соль, воду и один из продуктов восстановления сульфат-иона (SO2, S или H2S). Это знание позволит выбрать ответы 1 и 4. Более вероятен ответ 1, так как серная кислота – сильный окислитель и образование Cu2SO4 неневозможно.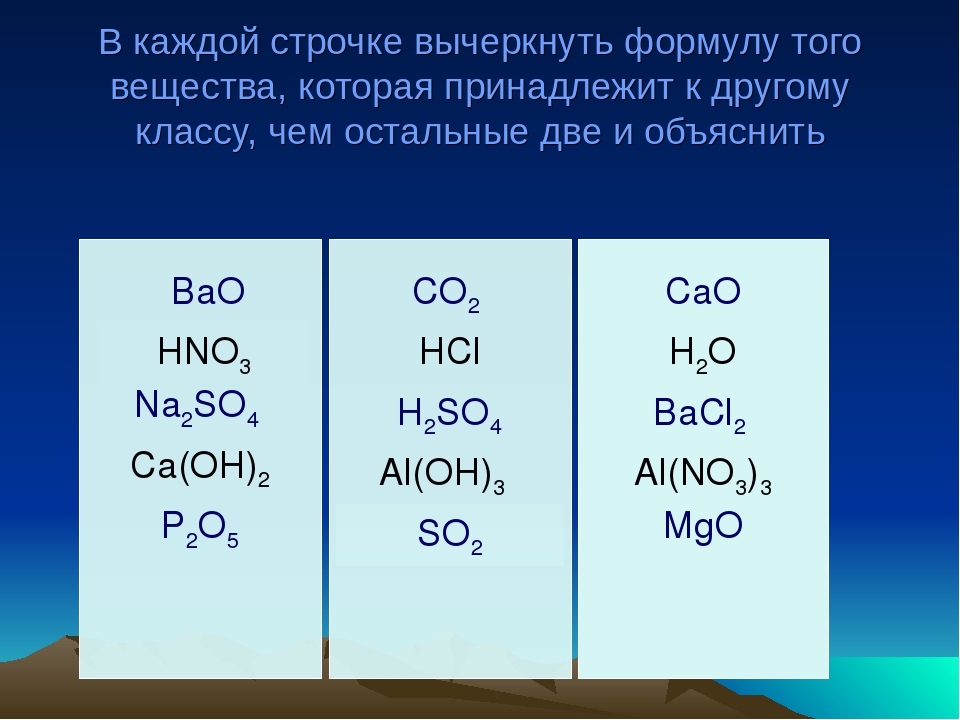 Ответ 1.
Ответ 1.
18. Железо способно вытеснять из растворимых солей – нитратов магния, свинца (II), меди (II), ртути (II), серебра – металлы
1) Mg, Pb, Cu, Hg, Ag
2) Pb, Cu, Hg, Ag
3) Cu, Hg, Ag
4) Hg, Ag
Задание на знание свойств солей и ряда напряжений металлов. Ответ 2.
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
Так как разбавленная серная кислота проявляет характерные свойства растворов кислот, то она не взаимодействует с металлами, стоящими в ряду напряжений металлов после водорода. Верный ответ, записанный в вариантах первым, позволит другие ответы не рассматривать. Ответ 1.
20. И с гидроксидом натрия, и с соляной кислотой реагирует
И с гидроксидом натрия, и с соляной кислотой реагирует
1) СaO 2) BeO 3) SiO2 4) P2O5
И с кислотой, и со щелочью взаимодействует амфотерный оксид. Ответ 2.
21. С гидроксидом бария реагирует ряд веществ, имеющих формулы
1) NaCl, Na2SO4, Na2CO3
2) HNO3, NaOH, K2SO4
3) ZnO, K2O, CO2
4) Al (OH)3, CuSO4, HCl
Так как Ba (OH)2 – щелочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ – 4. К такому результату можно прийти, исключив варианты 2 (он включает щелочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
22. Сульфат железа (II) не может быть получен взаимодействием
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) гидроксида железа (II) с разбавленной серной кислотой
Задание на знание свойств классов неорганических соединений: кислот, солей, гидроксидов. Это знание позволит определить верный ответ. Ответ 3.
23. Веществами, при взаимодействии которых образуется соль, являются
1) щелочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Несложное задание на знание химических свойств оксидов. Ответ 3.
Ответ 3.
24. В цепочке превращений
S →X1→SO3→X2→CuSO4→X3→CuO→Cu
веществами X1,X2 и X3 являются соответственно
1) H2S, H2SO4, Cu (OH)2
2) FeS, H2SO4, Cu (OH)2
3) SO2, H2SO4, CuCl2
4) SO2, H2SO4, Cu (OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, а SO2.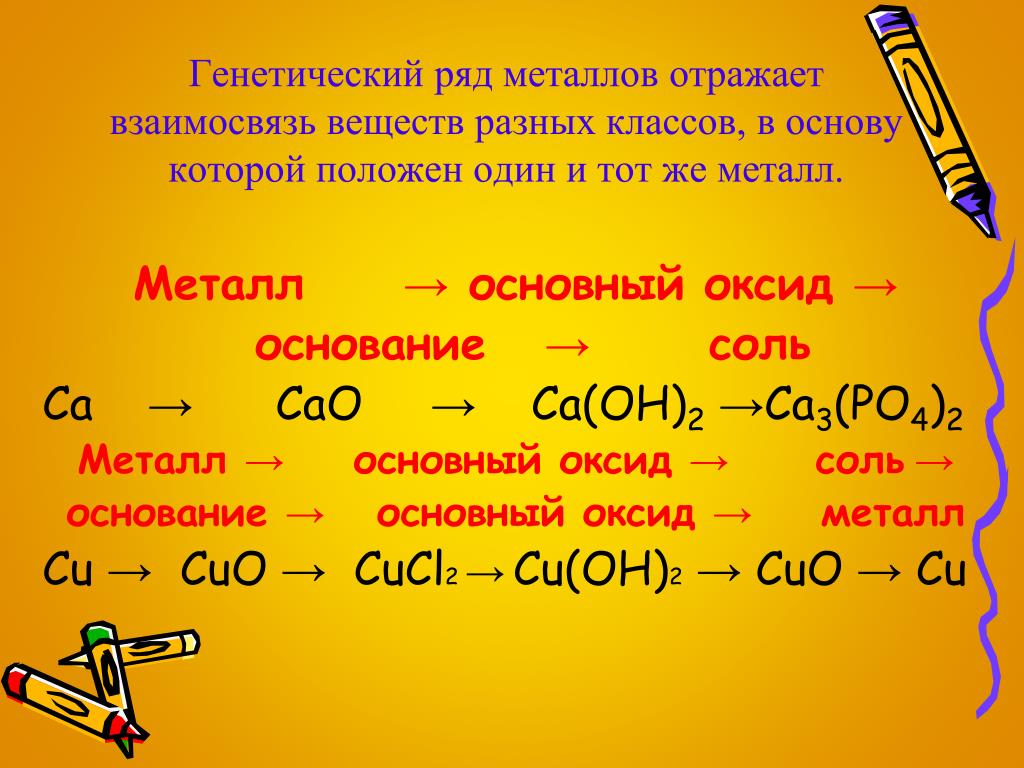 В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
25. В цепочке превращений
Сa → X1 → Ca (OH)2 →X2 →Ca (HCO3)2 → X2 → CaO
веществами X1, X2 являются соответственно
1) CaCl2, СaCO3,
2) CaO, Ca (NO3)2
3) CaО, СaCO3
4) CaО, Ca3 (PO4)2
Вещество X1 определить несложно – это CaO. Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
26. В цепочке превращений
Zn → X1 → Zn (NO3)2 → X2 → Na2ZnO2 →ZnCl2→AgCl→X3
веществами X1, X2 и X3 являются соответственно
1) ZnCl2, ZnO, Ag
2) ZnO, Zn (OH)2, Ag
3) ZnSO4, Zn (OH)2, PbCl2
4) ZnO, Zn (OH)2, AgNO3
Рассуждения, аналогичные приведенным выше, но с учетом амфотерности гидроксида цинка, позволят определить вещества X1, X2 — ZnO, Zn (OH)2 соответственно. Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
27. В схеме превращений
X1 X2 X3
AlCl3 → Al (OH)3 → NaAlO2 → AlCl3
веществами X1,X2 и X3 являются соответственно
1) H2O, NaOH, NaCl
2) H2O, Cu (OH)2, HCl
3) NaOH, NaCl, HCl
4) NaOH, Na2O, HCl
Непростое задание на знание свойств солей и амфотерных гидроксидов. Для выпускников определение X2 представляет сложность, т. к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
28. Вещество, которое может реагировать с фосфорной кислотой, гидроксидом натрия и цинком, имеет формулу
1) Al (OH)3 2) Ba (NO3)2 3) CuCl2 4) NaHCO3
Для решения этого задания необходимо отнести каждое из предложенных веществ к соответствующей группе: амфотерный нерастворимый гидроксид, две средние соли, кислая соль. Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
Ответ 3.
29. Веществу, которое может реагировать с хлором, нитратом серебра и ацетатом свинца, соответствует формула
1) KI 2) Cu 3) K2SO4 4) NaF
Задание более сложное, чем 28, так как требует знания о «ряде активности галогенов» (каждый предыдущий галоген вытесняет каждый последующий из растворов галогеноводородных кислот и их солей), а также знание номенклатуры солей органических кислот: ацетату свинца соответствует формула (CH3COO)2Pb. Обращение к таблице растворимости и учет условий взаимодействия растворов солей между собой позволят прийти к правильному решениию. Ответ 1.
30. Верны ли следующие суждения применительно к солям
А) В результате взаимодействия кислых солей со щелочами образуются средние соли
Б) В результате взаимодействия средних солей с основаниями образуются кислые соли
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Второе утверждение неверно, т. к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
Задания для самостоятельной работы
1. В перечне веществ
1) N2O
2) N2O5
3) N2O3
4) CO2
5) NO
6) CO
к несолеобразующим оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1,4,6 2) 3,5,6 3) 1,5,6 4) 4,5,6
2. Амфотерными оксидами являются вещества
1) оксид серы (IV), оксид железа (III)
2) оксид цинка, оксид кальция
3) оксид хрома (III), оксид бериллия
4) оксид алюминия, оксид магния
3. Основными оксидами являются вещества
1) оксид кальция, оксид хрома (II)
2) оксид калия, оксид олова (IV)
3) оксид меди (I), оксид алюминия
4) оксид бериллия, оксид железа (П)
4. Содержит все три типа гидроксидов ряд веществ
Содержит все три типа гидроксидов ряд веществ
1) H3AlO3, Fe (OH)3, H2SO4
2) H2ZnO2, H3PO4, Ba (OH)2
3) H2BeO2, HCI, Cu (OH)2
4) H2CO3, H2CrO4, NaOH
5. Формулы только основных солей записаны в ряду
1) (CaOH)2SO4, Ca (OH)2, CaOHCl
2) Fe (OH)3, Fe (OH)2NO3, [Fe (OH)2]SO4
3) MnOHNO3, CuOHCl2, Mg (OH)2
4) FeOHCl2, FeOHCl, [Fe (OH)2]SO4
6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) Mg (OH)2 2) NH3 3) NaOH 4) Ва (ОН)2
7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Na2SO4, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3) FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
9. Гидроксид алюминия – это
1) амфотерный гидроксид
2) трехкислотное основание
3) щелочь
4) летучее основание
10. Оксиду марганца (VII) соответствует гидроксид, формула которого
Оксиду марганца (VII) соответствует гидроксид, формула которого
1) Mn (OH)2 2) MnO (OH) 3) H2MnO4 4) HMnO4
11. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
12. При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
13. С раствором щелочи не реагирует
1) Mg 2) Zn 3) Al 4) Be
14. С раствором сульфата меди (II) взаимодействует
1) Pb 2) Hg 3) Fe 4) Ag
15. Взаимодействием соответствующего оксида с водой нельзя получить
Взаимодействием соответствующего оксида с водой нельзя получить
1) Cu (OH)2 2) Ba (OH)2 3) H2SO4 4) NaOH
16. Медь из раствора сульфата меди (II) вытесняет все металлы ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
17. При взаимодействии меди с концентрированной азотной кислотой образуются
1) CuO, NO2, H2O
2) Cu (NO3)2, H2
3) Cu (NO3)2, NO, H2O
4) Cu (NO3)2, NO2, H2O
18. Окислительно-восстановительная реакция протекает при разложении соли, формула которой
1) NH4Cl 2) KMnO4 3) CaCO3 4) (CuOH)2CO3
19. C концентрированной азотной кислотой при комнатной температуре не взаимодействует
C концентрированной азотной кислотой при комнатной температуре не взаимодействует
1) медь
2) железо
3) серебро
4) цинк
20. С раствором серной кислоты реагируют все три вещества набора
1) СaO, NaOH, KCl
2) Cu (OH)2, HCl, CH3COONa
3) BaCl2, Zn, SiO2
4) MgCO3, Fe, Al (OH)3
21. И с соляной кислотой, и с водой реагирует
1) аммиак 2) хлор 3) никель 4) карбонат кальция
22. Сульфат железа (III) может быть получен взаимодействием железа с
1) разбавленной серной кислотой
2) раствором сульфата меди (II)
3) хлором
4) серой
23. Веществами, при взаимодействии которых не образуется соль, являются
1) кислотный оксид и щелочь
2) кислотный оксид и вода
3) основный оксид и кислота
4) кислота и основание
24. В цепочке превращений
В цепочке превращений
Ca →X1→Ca (OH)2 → X2→ CaO → X3→ AgCl
веществами X1,X2 и X3 являются соответственно
1) CaO, CaCO3, CaCl2
2) CaSO4, CaCO3, CaCl2
3) CaO, CaSO4, CaCl2
4) CaO, Ca (HCO3), CaCO3
25. В цепочке превращений
N2 → X1 → NO →X2 → HNO3
веществами X1, X2 являются соответственно
1) N2O, NO2
2) NO2, NH3
3) N2O3, N2O
4) NH3, NO2
26. В цепочке превращений
Al → X1 → Al2 (SO4)3 → X2 → KAlO2 →AlCl3→X2®Al2O3
веществами X1 и X2 являются соответственно
1) AlCl3, AlN
2) Al (OH)3, KAl (SO4)2
3) Al2O3, Al2S3
4) Al2O3, Al (OH)3
27. В схеме превращений
В схеме превращений
X1 X2 X3
SO2 → SO3 → H2SO4 → (NH4)2SO4
веществами X1,X2 и X3 являются соответственно
1) O2, H2O, NH3
2) NO2, H2, NH3
3) O2, H2O, N2
4) O2, H2, NH3∙H2O
28. Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
1) Cl2 2) H2SO4 3) Сr2O3 4) Na2CO3
29. При нагревании не разлагается на простые вещества
1) аммиак 2) хлорид натрия 3) оксид ртути (II) 4) иодоводород
30. Верны ли следующие суждения применительно к кислотам
Верны ли следующие суждения применительно к кислотам
А) Любую кислоту можно получить растворением соответствующего кислотного оксида в воде
Б) Кислоты способны взаимодействовать со щелочами
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
03 Октябрь 2011, 15780 просмотров.
Комментарии
Установите соответствие между формулой вещества и его — КиберПедия
Принадлежностью к определенному классу (группе) неорганических
Соединений.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) h4AsO4 Б) BeO В) Ca(OH)Cl Г) SO3 | 1) кислота 2) основание 3) основной оксид 4) амфотерный оксид 5) кислотный оксид 6) соль |
Установите соответствие между веществом и его принадлежностью к
Соответствующему классу (группе) неорганических соединений.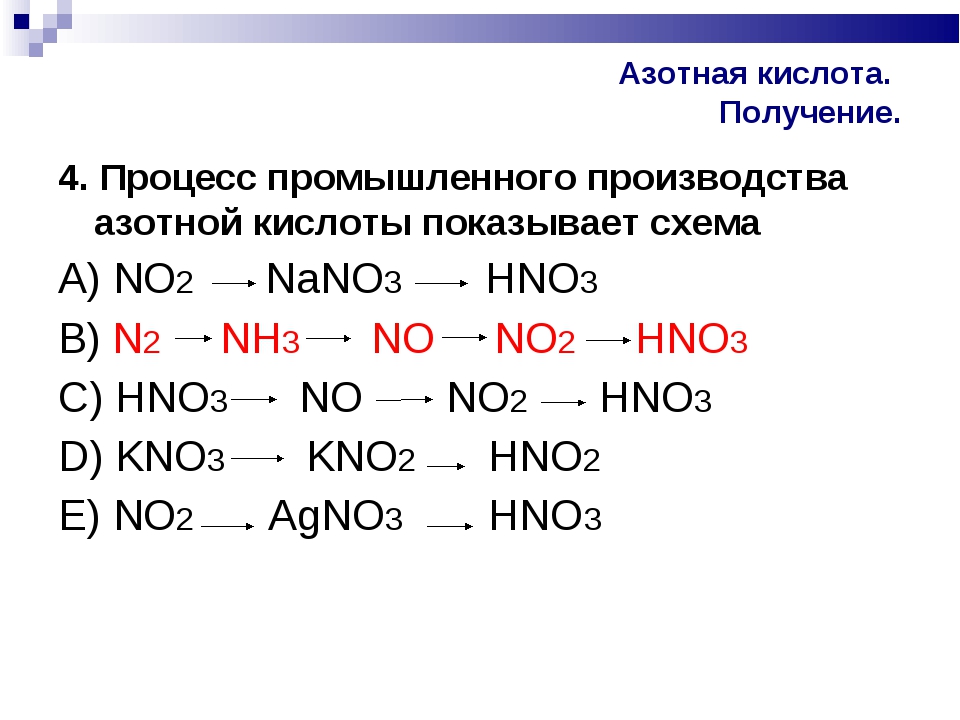
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) CsOH Б) MnO В) Cr2O3 Г) K4[Fe(CN)6] | 1) амфотерный оксид 2) основной оксид 3) соль 4) щелочь 5) амфотерный гидроксид |
Общая формула алкенов
1) Сnh3n–6 2) Cnh3n–2 3) Cnh3n 4) Cnh3n+2
К простым эфирам относится вещество, формула которого
1) Ch4COOH 2) Ch3OH – Ch3OH 3) C2H5OC2H5 4) C6H5COOC2H5
Функциональную группу альдегидов содержит молекула
1) муравьиной кислоты
2) пропанона
3) диэтилового эфира
4) пропанола-1
Этановую кислоту можно классифицировать как
1) предельная, одноосновная
2) предельная, трехосновная
3) непредельная, одноосновная
4) непредельная, двухосновная
В перечне веществ, формулы которых
А) Ch3O
Б) HCOOH
В) HCOOK
Г) Ch4CHO
Д) Ch4COOH
Е) C2H5CHO,
к альдегидам относятся
1) ГДЕ
2) АБВ
3) БГД
4) АГЕ
В перечне веществ, формулы которых
А) Ch4CONh3
Б) C6H5Nh3
В) (Ch4)2NH
Г) NН4НCО3
Д) Nh4
Е) Ch4Nh3,
к аминам относятся
1) АБВ
2) БВЕ
3) ВГД
4) БВД
Установите соответствие между названием вещества и его
Принадлежностью к определенному классу органических соединений.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) толуол Б) децен-2 В) бутаналь Г) аланин | 1) углеводороды 2) спирты 3) аминокислота 4) альдегиды 5) сложные эфиры 6) карбоновые кислота |
Установите соответствие между названием соединения и его
Принадлежностью к определенному классу органических веществ.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) стирол Б) анилин В) этилформиат Г) гексанол-1 | 1) углеводороды 2) амины 3) кетоны 4) спирты 5) сложные эфиры 6) простые эфиры |
Ответы:
1 — 3
2 — 3
3 — 4
4 — 2
5 — 2341
6 — 1465
7 — 4213
8 — 3
9 — 3
10 — 1
11 — 1
12 — 4
13 — 2
14 — 1143
15 – 1254
Тест 9 класс. Щелочные металлы.
Щелочные металлы.
Вариант 1
А 1. Щелочные металлы – это:
а) р-элементы б) f-элементы в) s-элементы
А 2. В ряду от лития к францию атомный радиус:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании лития пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид калия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. На внешнем энергетическом уровне атомы щелочных металлов имеют:
а) 1 электрон б) 2 электрона в) 3 электрона
А 6. В реакциях с неметаллами щелочные металлы являются:
а) окислителями б) восстановителями
А 7. Натрий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии натрия с кислородом образуется:
а) оксид натрия б) гидроксид натрия в) пероксид натрия
А 9. Пищевая сода имеет формулу:
Пищевая сода имеет формулу:
а) Na2SO4 б) Na2CO3 в) NaHCO3 г) NaCl
А 10. Гидроксид натрия реагирует с каждым из двух веществ:
а) CO2, KNO3 б) Al(OH)3, CuCl2
в) Cu(NO3)2, K2SO4 г) CaO, H2SO4
Тест 9 класс. Щелочные металлы.
Вариант 2
А 1. На внешнем энергетическом уровне щелочные металлы содержат
а) 1 электрон б) 2 электрона в) 3 электрона
А 2. В ряду от лития к францию восстановительные свойства:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании натрия пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид натрия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. Вид химической связи в молекуле хлорида натрия:
Вид химической связи в молекуле хлорида натрия:
а) ковалентная полярная б) ковалентная неполярная
в) ионная г) металлическая
А 6. Верны ли суждения:
1) Соли щелочных металлов твердые кристаллические вещества ионного строения.
2) Гидроксиды щелочных металлов – твердые белые вещества, очень гигроскопичны.
а) верны оба суждения б) верно только 1 в) верно только 2
А 7. Калий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии калия с кислородом образуется:
а) оксид калия б) гидроксид калия в) надпероксид калия
А 9. Кислая соль имеет формулу:
а) Na2SO4 б) Na2CO3 в) NaHCO3 г) NaCl
А 10. Оксид натрия реагирует с каждым из двух веществ:
а) CO2, KNO3 б) Al(OH)3, CuCl2
в) Cu(NO3)2, K2SO4 г) CO2, H2SO4
Ответы:
1 вариант.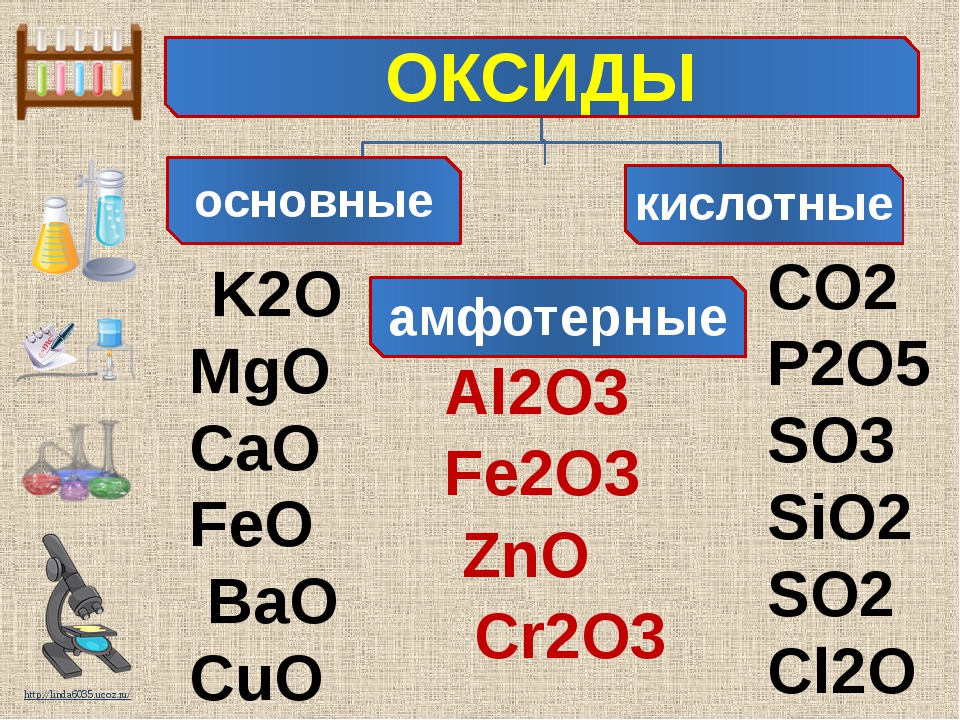
А1. в)
А2. а)
А3. а)
А4. а)
А5. а)
А6. б)
А7. в)
А8. в)
А9. в)
А10. б)
2 вариант.
А1. а)
А2. а)
А3. б)
А4. а)
А5. в)
А6. а)
А7. в)
А8. в)
А9. в)
А10. г)
Классификация и номенклатура веществ
Классификация неорганических веществ. Классификация и номенклатура органических соединений.
1. Установите соответствие формулы оксида его типу
|
|
ФОРМУЛА ОКСИДА |
|
ТИП ОКСИДА |
|
А) |
NО |
1) |
кислотный |
|
Б) |
СrО3 |
2) |
несолеобразующий |
|
В) |
BaO |
3) |
основный |
|
Г) |
BeO |
4) |
амфотерный |
2. Установите соответствие формулы соли типу соли
Установите соответствие формулы соли типу соли
|
|
ФОРМУЛА СОЛИ |
|
ТИП СОЛИ |
|
А) |
KAl(SO4)2 |
1) |
комплексная |
|
Б) |
Na3[Al(OH)6] |
2) |
двойная |
|
В) |
[Fe(OH)2]2SO4 |
3) |
смешанная |
|
Г) |
Fe(HSO4)3 |
4) |
кислая |
|
|
|
5) |
основная |
3. Установите соответствие между веществом и его типом
Установите соответствие между веществом и его типом
|
|
ВЕЩЕСТВО |
|
ТИП ВЕЩЕСТВА |
|
А) |
бромная вода |
1) |
индивидуальное вещество |
|
Б) |
нашатырный спирт |
2) |
смесь |
|
В) |
водород |
|
|
|
Г) |
формалин |
|
|
4. Установите соответствие между формулой органического вещества и классом (группой) соединений, к которому(-ой) оно принадлежит.
Установите соответствие между формулой органического вещества и классом (группой) соединений, к которому(-ой) оно принадлежит.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
А) С6Н6O |
1) одноатомные спирты |
|
Б) С6Н12O6 |
2) многоатомные спирты |
|
В) С2Н6О |
3) углеводы |
|
Г) С2Н6O2 |
4) фенолы |
|
|
5) карбоновые кислоты |
|
|
6) сложные эфиры |
5. Установите соответствие между химической формулой соединения и классом (группой) неорганических соединений.
Установите соответствие между химической формулой соединения и классом (группой) неорганических соединений.
|
ФОРМУЛА СОЕДИНЕНИЯ |
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИИ |
|
A) NH4N03 |
1) средняя соль |
|
Б) (СuОН)2СОэ |
2) кислотный оксид |
|
В) H2[SiF6l |
3) бескислородная кислота |
|
Г) NO |
4) основная соль |
|
|
5) несолеобразующий оксид |
|
|
6) кислородсодержащая кислота |
6. Установите соответствие между структурной формулой вещества и названием гомологического ряда, к которому оно принадлежит
Установите соответствие между структурной формулой вещества и названием гомологического ряда, к которому оно принадлежит
|
ФОРМУЛА ВЕЩЕСТВА |
ГОМОЛОГИЧЕСКИЙ РЯД |
|
А) С6Н5-СН2-СН3 |
1) алкадиены |
|
Б) СН2-С(СН3)2-СН2-СН3 |
2) алканы |
|
В) сн2=с=сн-сн3 |
3) арены |
|
Г) сн3-сºс-сн3 |
4) алкены |
|
|
5) алкины |
7. Установите соответствие между названием вещества и классом (группой) органические соединение, к которой оно принадлежит.
Установите соответствие между названием вещества и классом (группой) органические соединение, к которой оно принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИИ |
|
А) толуол |
1) спирт |
|
Б) 2-метил-1-бутанол |
2) простой эфир |
|
В) изопропилэтаноат |
3) кетон |
|
Г) ацетон |
4) альдегид |
|
|
5) сложный эфир |
|
|
6) ароматический углеводород |
8. Установите соответствие между формулой вещества и его названием.
Установите соответствие между формулой вещества и его названием.
|
ФОРМУЛА ВЕЩЕСТВА |
НАЗВАНИЕ ВЕЩЕСТВА |
|
А) СН3СН2СНО |
1) пропаналь |
|
Б) |
2) хлоруксусная кислота 3) 4-броманилин |
|
В) С1-СН2СООН |
4) 4-метилфенол 5) этанол |
|
Г)
|
|
9. Установите соответствие между названием соединения и его принадлежностью к определенному классу органических веществ
|
НАЗВАНИЕ СОЕДИНЕНИЯ |
КЛАСС ОРГАНИЧЕСКИХ ВЕЩЕСТВ |
|
А) глицин Б) 1,2-диметилбензол |
1) спирты 2) аминокислоты |
|
В) метилбензол |
3) фенолы |
|
Г) 1,2-пропандиол |
4) сложные эфиры |
|
|
5) ароматические углеводороды |
10. Установите соответствие между названием вещества и формул его гомолога.
Установите соответствие между названием вещества и формул его гомолога.
|
НАЗВАНИЕ ВЕЩЕСТВА |
ФОРМУЛА ГОМОЛОГА |
|
А) 2-метилпропан |
1) С6Н5С1 |
|
Б) бензол |
2) С4Н7С2Н5 |
|
В) 2-хлорпентан |
3) СН3СН(СНз)СН2СНз |
|
Г) метилциклобутан |
4) С6Н5СН3 |
|
|
5) СН3СН(Сl)СН2СН3 |
11. Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
|
НАЗВАНИЕ ВЕЩЕСТВА |
|
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
А) |
гидрокарбонат свинца (II) |
1) |
бескислородная кислота |
|
Б) |
серная кислота |
2) |
щелочь |
|
В) |
соляная кислота |
3) |
основная соль |
|
Г) |
гидроксид бериллия |
4) |
кислородсодержащая кислота |
|
|
|
5) |
амфотерный гидроксид |
|
|
|
6) |
кислая соль |
12. Установите соответствие между веществом и его принадлежностью к соответствующему классу (группе) неорганических соединений.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
A) CsOH |
1) амфотерный оксид |
|
Б) МnО2 |
2) основный оксид |
|
В) Сr203 |
3) соль |
|
Г) K4[Fe(CN)6] |
4) щелочь |
|
|
5) амфотерный гидроксид |
13. Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно относится.
|
|
ВЕЩЕСТВО |
|
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) |
гидрокарбонат натрия |
1) |
основание |
|
Б) |
гидроксид меди (II) |
2) |
средняя соль |
|
В) |
сульфат хрома (III)-калия |
3) |
кислота |
|
Г) |
сульфат хрома (III) |
4) |
основная соль |
|
|
|
5) |
двойная соль |
|
|
|
6) |
кислая соль |
14. Установите соответствие между солью и классом (группой) солей, к которому она принадлежит.
|
|
СОЛЬ |
|
КЛАСС (ГРУППА) СОЛЕЙ |
|
А) |
CH3COONa |
1) |
основные |
|
Б) |
KCl × MgCl2 × 6H2O |
2) |
кислые |
|
В) |
Ca(HCO3)2 |
3) |
средние |
|
Г) |
(CuOH)2CO3 |
4) |
двойные |
|
|
|
5) |
комплексные |
15. Установите соответствие между солью и классом (группой) солей, к которому она принадлежит.
|
|
СОЛЬ |
|
КЛАСС (ГРУППА) СОЛЕЙ |
|
А) |
Ca(OCl)Cl |
1) |
основные |
|
Б) |
NaH2PO4 |
2) |
кислые |
|
В) |
Al(OH)SO4 |
3) |
средние |
|
Г) |
Fe(SCN)2 |
4) |
двойные |
|
|
|
5) |
смешанные |
16. Установите соответствие между веществом и классом (группой), к которому(-ой) оно принадлежит.
|
|
ВЕЩЕСТВО |
|
КЛАСС (ГРУППА) |
|
А) |
NaHS |
1) |
средняя соль |
|
Б) |
Mg(ClO4)2 |
2) |
кислота |
|
В) |
Ca(OCl)2 |
3) |
амфотерный гидроксид |
|
Г) |
H3AlO3 |
4) |
оксид |
|
|
|
5) |
основание |
|
|
|
6) |
кислая соль |
17. Установите соответствие между названием вещества и классом (группой) веществ, к которому(-ой) оно принадлежит.
|
|
ВЕЩЕСТВО |
|
КЛАСС (ГРУППА) ВЕЩЕСТВ |
|
А) |
гидроксид хрома (VI) |
1) |
кислая соль |
|
Б) |
гидросульфат кальция |
2) |
основание |
|
В) |
хлорат калия |
3) |
амфотерный гидроксид |
|
Г) |
гидроксид хрома (III) |
4) |
кислота |
|
|
|
5) |
средняя соль |
18. Установите соответствие между формулой вещества и его названием.
|
|
ФОРМУЛА ВЕЩЕСТВА |
|
НАЗВАНИЕ |
|
А) |
1) |
глицин |
|
|
Б) |
CH3CH2Cl |
2) |
аланин |
|
В) |
3) |
стирол |
|
|
Г) |
H2NCH2 – CООН
|
4) |
метилбензоат |
|
|
|
5) |
хлорэтан |
19. Установите соответствие между названием органического соединения и классом, к которому оно принадлежит.
|
НАЗВАНИЕ СОЕДИНЕНИЯ |
КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) 1,2-диметилбензол |
1) сложные эфиры |
|
Б) гексанол-3 |
2) углеводороды |
|
В) метилформиат |
3) спирты |
|
Г) стирол |
4) карбоновые кислоты |
|
|
5) аминокислоты |
|
|
6) простые эфиры |
20. Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
А) Н4Р2О7 |
1) кислота |
|
Б) НРОз |
2) основание |
|
В) Ва(ОН)2 |
3) основный оксид |
|
Г) ZnO |
4) амфотерный оксид |
|
|
5) кислотный оксид |
|
|
6) соль |
21. Установите соответствие между формулой вещества и классом веществ, к которому оно относится.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС ВЕЩЕСТВ |
|
А) NaH2PО4 |
1) кислая соль |
|
Б) Ве(ОН)2 |
2) основание |
|
В) N2О |
3) кислотный оксид |
|
Г) KNО3 |
4) основный оксид |
|
|
5) несолеобразующий оксид 6) амфотерный гидроксид |
|
|
7) средняя соль |
|
|
3) кислая соль |
22. Установите соответствие между названием органического вещества и классом соединений, к которому оно принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС СОЕДИНЕНИЙ |
|
А) аланин |
1) углеводороды |
|
Б) пропен |
2) альдегиды |
|
В) диметиловый эфир |
3) сложные эфиры |
|
Г) пропаналь |
4) простые эфиры |
|
|
5) амины |
|
|
6) аминокислоты |
23. Установить соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
А) гидросульфид натрия |
1) основание |
|
Б) оксид хрома (III) В) оксид серы(IV) |
2) основная соль 3) основный оксид |
|
Г) тетрагидроксоалюминат натрия |
4) комплексная соль |
|
|
5) кислая соль |
|
|
6) кислотный оксид |
|
|
7) амфотерный оксид |
|
|
8) амфотерный гидроксид |
24. Установите соответствие между формулой вещества и классом веществ, к которому оно относится.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС ВЕЩЕСТВ |
|
А) р2о5 |
1) кислота |
|
Б) Сr(ОН)2 |
2) основание |
|
В) NО |
3) кислотный оксид |
|
Г) КСlOз |
4) основный оксид |
|
|
5) несолеобразующий оксид |
|
|
6) амфотерный гидроксид |
|
|
7) средняя соль |
|
|
8) кислая соль |
25. Установите соответствие между классом соединений и названием органического вещества.
|
КЛАСС СОЕДИНЕНИЙ |
НАЗВАНИЕ ВЕЩЕСТВА |
|
А) спирты |
1) глицин |
|
Б) простые эфиры |
2) глюкоза |
|
В) сложные эфиры |
3) метилацетат |
|
Г) аминокислоты |
4) диметиловый эфир |
|
|
5) пропанол-1 |
|
|
6) пропаналь |
26. Установить соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА
А) оксид хрома(III) |
КЛАСС (ГРУППА) СОЕДИНЕНИЙ
1) основание |
|
Б) гидросульфат натрия |
2) основная соль |
|
В) бромид магния |
3) основный оксид |
|
Г) оксид марганца(VII) |
4) средняя соль |
|
|
5) кислая соль |
|
|
6) кислотный оксид |
|
|
7) амфотерный оксид |
|
|
8) амфотерный гидроксид |
27. Установить соответствие между формулой вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
А) N2О5 |
1) кислая соль |
|
Б) К3[Сг(ОН)6] |
2) основная соль |
|
В) CuOHCI |
3) комплексная соль |
|
Г) Сг2О3 |
4) основный оксид |
|
|
5) кислотный оксид |
|
|
6) амфотерный оксид |
|
|
7) основание |
28. Установите соответствие между классом соединений и названием органического вещества.
|
КЛАСС СОЕДИНЕНИЙ |
НАЗВАНИЕ ВЕЩЕСТВА |
|
А) алканы |
1) глицин |
|
Б) алкены |
2) глюкоза |
|
В) арены |
3) толуол |
|
Г) амины |
4) пропан |
|
|
5) бутен |
|
|
6) анилин |
29. Установить соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС (ГРУППА) СОЕДИНЕНИЙ |
|
А) оксид брома (V) |
1) основание |
|
Б) гидроксид цинка |
2) основная соль |
|
В) нитрат аммония |
3) основный оксид |
|
Г) оксид азота(II) |
4) средняя соль |
|
|
5) кислая соль |
|
|
6) кислотный оксид |
|
|
7) несолеобразующий оксид |
|
|
8) амфотерный гидроксид |
30. Установите соответствие между названием органического вещества и классом соединений, к которому оно принадлежит.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС СОЕДИНЕНИЙ |
|
А) этилформиат |
1) углеводороды |
|
Б) винилбензол |
2) спирты |
|
В) бутанол-1 |
3) сложные эфиры |
|
Г) пропаналь |
4) простые эфиры |
|
|
5) альдегиды |
|
|
6) аминокислоты |
Ответы: 1-2134, 2-2154, 3-2212, 4-4315, 5-1435, 6-3215, 7-6153, 8-1423, 9-2551, 10-3452, 11-6415, 12-4113, 13-6152, 14-3421, 15-5213, 16-6113, 17-4153, 18-4531, 19-2312, 20-1124, 21-1657, 22-6142, 23-5764, 24-3257, 25-5431, 26-7546, 27-5326, 28-4536, 29-6847, 30-3125.
Классификация и номенклатура неорганических веществ. Часть 1
Чтобы поделиться, нажимайте
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Задание 5
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) SO
2 1) оксид основныйБ) CО 2) оксид кислотный
В) Cs
2O 3) оксид амфотерный4) оксид несолеобразующий
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) NaHCO
3 1) кислотаБ) NH
4Cl 2) кислая сольВ) HClO
4 3) средняя соль4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) SiO 1) основный оксид
Б) KOH 2) несолеобразующий оксид
В) NH
4NO3 3) средняя соль4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) оксид магния 1) амфотерный оксид
Б) сульфид цинка 2) кислая соль
В) гидрокарбонат натрия 3) средняя соль
4) основный оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) KHCO
3 1) кислотаБ) Cu(OH)
2 2) кислая сольВ) HClO
3 3) средняя соль4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) H
2CrO4 1) кислотаБ) NO 2) несолеобразующий оксид
В) ZnO 3) амфотерный оксид
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид железа (II) 1) кислота
Б) оксид азота (V) 2) основный оксид
В) оксид кальция 3) кислотный оксид
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) сульфид натрия 1) несолеобразующий оксид
Б) гидроксид хрома (II) 2) кислая соль
В) дигидрофосфат калия 3) средняя соль
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) Fe
2O3 1) кислотаБ) ZnO 2) основный оксид
В) HCl 3) средняя соль
4) амфотерный оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид магния 1) кислотный оксид
Б) гидрофосфат натрия 2) кислая соль
В) гидрокарбонат кальция 3) основный оксид
4) основание
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА ФОРМУЛА
А) соль 1) SiO
Б) амфотерный оксид 2) SiO
2В) основный оксид 3) Al
2O34) Al(OH)
35) NaAlO
26) Ag
2OЗапишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой соли и группой, к которой эта соль принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ ГРУППА
А) (CuOH)
2CO3 1) средние солиБ) MgCl(ClO) 2) кислые соли
В) NaAl(SO
4)2 3) основные соли4) двойные соли
5) смешанные соли
6) комплексные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА ФОРМУЛА
А) соль 1) NO
2Б) кислотный оксид 2) K
2OВ) основный оксид 3) KO
24) OF
25) NCl
36) Na
3[Al(OH)6]Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и его тривиальным названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CO 1) угарный газ
Б) Fe
3O4 2) негашеная известьВ) CaO 3) железная окалина
4) гипс
5) известковое молоко
6) нашатырь
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CaO
2 1) пероксидБ) FeO 2) основный оксид
В) H
2O2 3) кислотный оксид4) амфотерный оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) Cr(OH)
3 1) щёлочьБ) Ca(OH)
2 2) соль кислаяВ) Be(OH)
2 3) гидроксид кислотный4) гидроксид амфотерный
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) NH
4HSO3 1) соли средниеБ) NaI 2) оксиды кислотные
В) CO 3) оксиды несолеобразующие
4) соли кислые
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид алюминия 1) средние соли
Б) гидроксид хрома (VI) 2) кислые соли
В) хлорид аммония 3) амфотерные гидроксиды
4) основания
5) кислоты
6) смешанные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) гидроксид магния 1) средние соли
Б) гидроксид меди (II) 2) кислые соли
В) гидросульфид калия 3) амфотерные гидроксиды
4) основания
5) кислоты
6) смешанные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) нитрат натрия 1) средние соли
Б) гидроксид хрома (II) 2) кислые соли
В) гидрофосфат калия 3) амфотерные гидроксиды
4) основания
5) кислоты
6) двойные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) оксид азота (V) 1) основные оксиды
Б) гидроксид серы (VI) 2) кислотные оксиды
В) оксид магния 3) амфотерные оксиды
4) основания
5) кислоты
6) несолеобразующие оксиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) N
2O3 1) основные гидроксидыБ) BeO 2) кислотные гидроксиды
В) HClO 3) оксиды несолеобразующие
4) оксиды амфотерные
5) оксиды основные
6) оксиды кислотные
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) HClO
3 1) основанияБ) KHS 2) кислоты
В) Cu(OH)
2 3) комплексные соли4) средние соли
5) кислые соли
6) основные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) (NH
4)2HAsO4 1) основанияБ) NH
4H2AsO4 2) кислотыВ) NaNO
2 3) оксиды4) средние соли
5) кислые соли
6) основные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CuS 1) основания
Б) H
2SiO3 2) кислотыВ) Fe(OH)
2NO3 3) оксиды4) средние соли
5) кислые соли
6) основные соли
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) кварцевый песок 1) амфотерные гидроксиды
Б) гидроксид серы (VI) 2) водородные соединения
В) гидроксид алюминия 3) щёлочи
4) несолеобразующие оксиды
5) двухосновные кислоты
6) кислотные оксиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между названием вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА
А) ортофосфорная кислота 1) амфотерные гидроксиды
Б) фосфин 2) водородные соединения
В) гидроксид цезия 3) щёлочи
4) несолеобразующие оксиды
5) трёхосновные кислоты
6) кислотные оксиды
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между классом (группой) неорганических веществ и химической формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА ФОРМУЛА
А) соли 1) CO
Б) оксиды 2) HClO
В) кислоты 3) NaAlO
24) Fe(OH)
3Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) CaOHCl 1) основание
Б) NO
2 2) амфотерный гидроксидВ) Al(OH)
3 3) кислотный оксид4) основная соль
Запишите в таблицу выбранные цифры под соответствующими буквами.
-
Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА КЛАСС/ГРУППА
А) Fe(OH)
3 1) основаниеБ) NO 2) амфотерный гидроксид
В) SO
2 3) кислотный оксид4) несолеобразующий оксид
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответы:
- 241
- 231
- 243
- 432
- 241
- 123
- 432
- 342
- 441
- 422
- 536
- 354
- 612
- 132
- 121
- 414
- 413
- 351
- 442
- 142
- 251
- 642
- 251
- 554
- 426
- 651
- 523
- 312
- 432
- 243
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Взаимосвязь различных классов неорганических веществ / Справочник :: Бингоскул
Как уже известно, существует четыре класса неорганических соединений. К ним относятся оксиды, основания, кислоты и соли. При подробном изучении способов получения каждого класса соединений можно проследить определенную взаимосвязь между всеми классами. Например, из кислот можно получить соли, из оксидов основания и так далее. Такая связь называется генетической.
Следовательно, генетическая связь – это связь между классами неорганических соединений, которая основана на получении веществ одного класса из веществ другого класса, а также их химических свойств.
На основании данной связи составляют генетические ряды, которые включают в себя представителей разных классов, но состоящие из одного элемента.
Генетическую связь можно представить в виде схемы.
Из данной схемы видно, что существует определенная взаимосвязь между классами. Основополагающими элементами генетического ряда являются либо металл, либо неметалл.
- Для получения оксида необходимо осуществить взаимодействие металла либо неметалла с кислородом.
- При взаимодействии с водой из основного оксида можно получить основание, а из кислотного – кислоту.
- Соль образуется при различных реакциях между всеми классами неорганических соединений. Например, металл + неметалл, основный оксид + кислотный оксид, основание + кислота и так далее.
Можно выделить два типа генетических рядов, которые мы и рассмотрим.
1. Генетический ряд металла
Металл → Основный оксид → Основание → Соль
- Ряд кальция: Ca → CaO → Ca(OH)2 → Ca Cl2;
- Ряд натрия: Na → Na2O → NaOH → Na3PO4;
- Ряд магния: Mg → MgO → Mg(OH)2 → Mg(NO3)2;
- Ряд железа: Fe → FeO → Fe(OH)2 → FeSO4.
Рассмотрим взаимосвязь в данных рядах на примере магния.
- Для получения оксида магния из чистого металла, осуществим реакцию взаимодействия с кислородом.
Mg + O2 → MgO
- При взаимодействии основного оксида с водой, в частности оксида магния, получим основание – гидроксид магния.
MgO + h3O → Mg(OH)2
- Для получения соли из нерастворимого основания, необходимо добавить кислоту.
Mg(OH)2 + HNO3 → Mg(NO3)2 + H2O
2. Генетический ряд неметалла
Неметалл → Кислотный оксид → Кислота → Соль
- Ряд фосфора: P → P2O5 →H3PO4 → Na3PO4;
- Ряд углерода: C → CO2 → H2CO3 → CaCO3;
- Ряд серы: S → SO2 → H2SO3→ MgSO3;
- Ряд кремния: Si → SiO2 → H2SiO3→ K2SiO3.
Рассмотрим взаимосвязь в данных рядах на примере углерода.
- Для получения оксида углерода осуществим реакцию взаимодействия с кислородом – горение. Протекает с выделением энергии.
C + O2 → CO2
- При взаимодействии кислотного оксида с водой, в частности оксида углерода, получим угольную кислоту.
CO + H2O → H2CO3
- Для получения соли из кислоты, необходимо добавить основание.
Ca(OH)2 + H2CO3 → CaCO3↓ + 2H2O
Для составления генетических цепочек необходимо знать химические свойства каждого класса неорганических соединений, а также валентные возможности того элемента, который лежит в основе генетического ряда.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Химия
- Подробности
-
Просмотров: 19099
8 класс
Готовимся к контрольной работе по теме
«Основные классы неорганических соединений»
Написать уравнения реакций с помощью которых можно осуществить превращения:
Zn → ZnO → ZnCl2 →Zn(OH)2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO реакция соединения
2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
4) Zn(OH)2 = ZnO + H2O реакция разложения
ZnO + H2 = Zn + H2O реакция замещения
Ca → Ca(OH)2 → CaSO4 → BaSO4
1) Ca + 2H2O = Ca(OH)2 + H2↑ реакция замещения
2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакцияобмена
3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2 реакцияобмена
S → SO2 → SO3 → H2SO4→ Na2SO4
1) S + O2 = SO2 реакция соединения
2) 2SO2 + O2 = 2SO3 реакция соединения
3) SO3 + H2O = H2SO4 реакция соединения
4) Na2O + H2SO4 = Na2SO4 + H2O реакцияобмена
C → CO2 → CaCO3 → CO2 → CaCO3 → Ca(NO3)2
1) C + O2 = CO2 реакция соединения
2) CO2 + Ca(OH)2 =CaCO3 + H2O реакция обмена или
CO2 + CaO =CaCO3 реакция соединения
3) CaСO3 + 2HСl = CaCl2 + H2O + CO2↑ реакция обмена
4) см.реакцию №2
5) CaСO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑ реакция обмена
Как работать с цепочками превращений.
Цепочки превращений являются важным механизмом проверки знаний и умений, умению применять их на практике, способствуют развитию логического мышления учащихся.
Разберемся с выполнением подобных заданий на конкретном примере:
Mg → MgO → MgCl2 → Mg(OH)2 → MgO → Mg
Итак, первое задание – исходя из магния, получить оксид магния. Анализируя предложенные вещества, видим, что необходимо металл превратить в оксид металла. Различие между двумя веществами в наличии у оксида магния кислорода. Вспомним свойства металлов. Металлы взаимодействуют с неметаллами, в том числе, и с кислородом. Осталось записать уравнение химической реакции и расставить коэффициенты:
2Mg + O2 = 2MgO
Второе задание – исходя из оксида магния, получить хлорид магния. Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
MgO + 2HCl = MgCl2 + H2O
Третье задание – исходя из хлорида магния, получить гидроксид магния. Анализируем: имеем соль, необходимо получить основание. Вспоминаем свойства солей. Соли взаимодействуют с растворимыми основаниями (щелочами) с образованием нового основания и новой соли. Записываем уравнение реакции:
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Четвертое задание – исходя из гидроксида магния, получить оксид магния. Анализируем: имеем основание, необходимо получить основный оксид. Вспоминаем свойства оснований. Нерастворимые основания при нагревании разлагаются на основный оксид и воду. Записываем уравнение химической реакции термического разложения гидроксида магния:
Mg(OH)2 = MgO + H2O
Пятое задание – исходя из оксида магния, получить чистый металл магний. Анализируем: имеем основный оксид, необходимо получить металл. Вспоминаем свойства основных оксидов. Из оксида металла можно получить чистый металл несколькими способами с помощью восстановителей (C, CO, H2, более активный металл, электролиз). Записываем уравнение химической реакции восстановления металла из его оксида:
MgO + H2 = Mg + H2O
Всё! Задание выполнено!
Вы убедились в том, что если хорошо знаешь свойство классов неорганических веществ, выполнить задания цепочек превращений не представляет труда. Ну а если не знаешь, можно воспользоваться следующей шпаргалкой.
Свойства классов неорганических веществ.
(шпаргалка)
Основные оксиды:
1. Взаимодействуют с кислотными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с более активными металлами с образованием нового оксида и металла.
Пример: СuO + Mg = Cu + MgO
3. Взаимодействуют с восстановителями (С, CO, H2) с образованием чистого металла и нового оксида.
Пример: Fe2O3 + 3H2 = 2Fe + 3H2O
4. Взаимодействуют с кислотами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
5. Взаимодействуют с водой (оксиды щелочных и щелочноземельных металлов) с образованием щелочей.
Пример: Na2O + H2O = 2NaOH
Кислотные оксиды:
1. Взаимодействуют с основными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с основаниями с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
3. Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Основания:
1. Взаимодействуют с кислотными оксидами с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
2. Щелочи взаимодействуют с солями с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3. Взаимодействуют с кислотами с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
Кислоты:
1. Взаимодействуют с металлами, стоящими в ряду активности перед водородом с образованием соли и водорода.
Пример: Zn + 2HCl = ZnCl2 + H2↑
2. Взаимодействуют с основными оксидами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
3. Взаимодействуют с основаниями с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
4. Взаимодействуют с солями с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
Соли:
1. Взаимодействуют с солями с образованием новых солей.
Пример: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Взаимодействуют с металлами, если в ряду активности металл стоит перед металлом входящим в состав соли с образованием новой соли и металла.
Пример: CuCl2 + Mg = Cu + MgCl2
3. Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
4. Взаимодействуют со щелочами с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
5. Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Выполнить задания:
Осуществите цепочки превращений:
а Sr →SrO → Sr(OH)2,
б Р → Р2О5 → Н3РО4.
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
1.К2ОАl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Домашнее задание.
9АБВГД
| Железо. Нахождение в природе. Свойства железа. |
* 43 у 1-5 с 135 задача 102 с 136 |
| Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 44 у 6-11 з 3-4 с 136 |
91
|
Железо. Нахождение в природе. Свойства железа. Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 43 у 1-5 с 135 з 102 с 136 * 44 у 6-11 з 3-4 с 136 |
|
Понятие о металлургии. Способы получения металлов. Проблемы безотходных производств в металлургии и охрана окружающей среды. Сплавы. Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей |
* 45 у 1-4 з 1-3 с 147, * 46- *47 у 5-14 з 4-6с147 |
10АБ
|
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации. Получение карбоновых кислот и применение. Краткие сведения о непредельных карбоновых кислотах. Генетическая связь карбоновых кислот с другими классами органических соединений |
**27 -29 у 1-4, 11- 18 с 117-118 З 1 с118 |
111
|
Окислительно–восстановительные реакции |
* 11, записи в тетради |
12АБ
| Металлы побочных подгрупп (Б — групп) периодической системы химических элементов |
** 22 – 27 У 1- 12 с 118 з 1-4 с 118 |
| Оксиды и гидроксиды металлов |
*29 у 16-18 с 118 З 6 с 118 |
| Сплавы металлов. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. | * 28 у 13- 15 с 118 |
121
|
Генетическая связь неорганических и органических веществ |
* 33 у с 143 |
4.3 Стехиометрия реакции — Химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните понятие стехиометрии применительно к химическим реакциям
- Используйте сбалансированные химические уравнения для получения стехиометрических факторов, связывающих количества реагентов и продуктов
- Выполнение стехиометрических расчетов с учетом массы, молей и молярности раствора
Сбалансированное химическое уравнение предоставляет большой объем информации в очень сжатом формате.Химические формулы идентифицируют реагенты и продукты, участвующие в химическом изменении, что позволяет классифицировать реакцию. Коэффициенты обеспечивают относительное количество этих химических соединений, позволяя количественно оценить взаимосвязь между количествами веществ, потребляемых и производимых в результате реакции. Эти количественные отношения известны как стехиометрия реакции , термин, производный от греческих слов stoicheion (что означает «элемент») и metron (что означает «мера»).В этом модуле исследуется использование сбалансированных химических уравнений для различных стехиометрических приложений.
Общий подход к использованию стехиометрических отношений по своей концепции аналогичен тому, как люди занимаются многими обычными делами. Например, приготовление пищи предлагает подходящее сравнение. Рецепт приготовления восьми блинов требует 1 чашки смеси для блинов, чашки молока [latex] \ frac {3} {4} [/ latex] и одного яйца. «Уравнение», описывающее приготовление блинов по этому рецепту, —
.[латекс] 1 \; \ text {смесь чашки} + \ frac {3} {4} \; \ text {чашка молока} + 1 \; \ text {яйцо} \ longrightarrow 8 \; \ text {блины} [ / латекс]
Если для большого семейного завтрака необходимы две дюжины блинов, количество ингредиентов должно быть пропорционально увеличено в соответствии с количеством, указанным в рецепте.Например, для приготовления 24 блинов требуется
яиц.[латекс] 24 \; \ rule [0.5ex] {4em} {0.1ex} \ hspace {-4em} \ text {pancakes} \ times \ frac {1 \; \ text {egg}} {8 \; \ правило [0.25ex] {3em} {0.1ex} \ hspace {-3em} \ text {pancakes}} = 3 \; \ text {яйца} [/ latex]
Сбалансированные химические уравнения используются почти таким же образом для определения количества одного реагента, необходимого для реакции с заданным количеством другого реагента или для получения заданного количества продукта и т. Д. Коэффициенты в сбалансированном уравнении используются для получения стехиометрических коэффициентов , которые позволяют вычислить желаемую величину.Чтобы проиллюстрировать эту идею, рассмотрим производство аммиака реакцией водорода и азота:
[латекс] \ text {N} _2 (g) + 3 \ text {H} _2 (g) \ longrightarrow 2 \ text {NH} _3 (g) [/ latex]
Это уравнение показывает, что молекулы аммиака образуются из молекул водорода в соотношении 2: 3, и стехиометрические коэффициенты могут быть получены с использованием любой единицы количества (числа):
[латекс] \ frac {2 \; \ text {NH} _3 \; \ text {молекулы}} {3 \; \ text {H} _2 \; \ text {молекулы}} \; \ text {или} \ ; \ frac {2 \; \ text {doz NH} _3 \; \ text {молекулы}} {3 \; \ text {doz H} _2 \; \ text {молекулы}} \; \ text {или} \; \ frac {2 \; \ text {моль NH} _3 \; \ text {молекулы}} {3 \; \ text {mol H} _2 \; \ text {молекулы}} [/ латекс]
Эти стехиометрические коэффициенты можно использовать для вычисления количества молекул аммиака, произведенных из данного количества молекул водорода, или количества молекул водорода, необходимых для производства данного количества молекул аммиака.Подобные коэффициенты могут быть получены для любой пары веществ в любом химическом уравнении.
Пример 1
Моль реагента, необходимого для реакции
Сколько молей I 2 требуется для реакции с 0,429 моль Al в соответствии со следующим уравнением (см. Рисунок 1)?
[латекс] 2 \ text {Al} + 3 \ text {I} _2 \ longrightarrow 2 \ text {AlI} _3 [/ латекс]
Рисунок 1. Реакция взаимодействия алюминия и иода с образованием иодида алюминия. Теплота реакции испаряет часть твердого йода в виде пурпурного пара.(кредит: модификация работы Марка Отта) Решение
Ссылаясь на сбалансированное химическое уравнение, стехиометрический фактор, связывающий два интересующих вещества, равен [латекс] \ frac {3 \; \ text {mol I} _2} { 2 \; \ text {mol Al}} [/ латекс]. Молярное количество йода получается путем умножения указанного молярного количества алюминия на этот коэффициент:
[латекс] \ begin {array} {r @ {{} = {}} l} \ text {mol I} _2 & 0.429 \; \ rule [0.5ex] {3.25em} {0.1ex} \ hspace {- 3.25em} \ text {mol Al} \ times \ frac {3 \; \ text {mol I} _2} {2 \; \ rule [0.25ex] {2em} {0.1ex} \ hspace {-2em} \ text {mol Al}} \\ [1em] & 0.644 \; \ text {mol I} _2 \ end {array} [/ latex]
Проверьте свои знания
Сколько молей Ca (OH) 2 необходимо для реакции с 1,36 моль H 3 PO 4 для получения Ca 3 (PO 4 ) 2 согласно в уравнение [латекс] 3 \ text {Ca (OH)} _ 2 + 2 \ text {H} _3 \ text {PO} _4 \ longrightarrow \ text {Ca} _3 \ text {(PO} _4) _2 + 6 \ текст {H} _2 \ text {O} [/ latex]?
Пример 2
Количество молекул продукта, образовавшихся в результате реакции
Сколько молекул диоксида углерода образуется при 0.75 моль пропана сжигается по этому уравнению?
[латекс] \ text {C} _3 \ text {H} _8 + 5 \ text {O} _2 \ longrightarrow 3 \ text {CO} _2 + 4 \ text {H} _2 \ text {O} [/ latex]
Раствор
Подход здесь тот же, что и в примере 1, хотя требуется абсолютное количество молекул, а не количество молей молекул. Это просто потребует использования коэффициента преобразования молей в числа, числа Авогадро.
Сбалансированное уравнение показывает, что диоксид углерода получается из пропана в соотношении 3: 1:
[латекс] \ frac {3 \; \ text {mol CO} _2} {1 \; \ text {mol C} _3 \ text {H} _8} [/ latex]
Используя этот стехиометрический коэффициент, полученное молярное количество пропана и число Авогадро,
[латекс] 0.{24} \ text {CO} _2 \; \ text {молекулы} [/ латекс]
Проверьте свои знания
Сколько молекул NH 3 образуется в результате реакции 4,0 моль Ca (OH) 2 в соответствии со следующим уравнением:
[латекс] (\ text {NH} _4) _2 \ text {SO} _4 + \ text {Ca (OH)} _ 2 \ longrightarrow 2 \ text {NH} _3 + \ text {CaSO} _4 + 2 \ text { H} _2 \ text {O} [/ latex]
Ответ:
4.8 × 10 24 NH 3 молекул
Эти примеры иллюстрируют легкость, с которой могут быть связаны количества веществ, участвующих в химической реакции известной стехиометрии.Однако прямое измерение числа атомов и молекул — непростая задача, и практическое применение стехиометрии требует, чтобы мы использовали более легко измеряемое свойство массы.
Пример 3
Соотношение масс реагентов и продуктов
Какая масса гидроксида натрия, NaOH, потребуется для получения 16 г антацидного молока магнезии [гидроксид магния, Mg (OH) 2 ] по следующей реакции?
[латекс] \ text {MgCl} _2 (водный) + 2 \ text {NaOH} (водный) \ longrightarrow \ text {Mg (OH)} _ 2 (s) + \ text {NaCl} (водный) [/ латекс]
Решение
Подход, использованный ранее в Примере 1 и Примере 2, также используется здесь; то есть, мы должны получить соответствующий стехиометрический коэффициент из сбалансированного химического уравнения и использовать его, чтобы связать количества двух интересующих веществ.В этом случае, однако, указываются и запрашиваются массы (не молярные количества), поэтому требуются дополнительные шаги, подобные изученным в предыдущей главе. Необходимые расчеты представлены на этой блок-схеме:
[латекс] 16 \; \ rule [0.5ex] {5em} {0.1ex} \ hspace {-5em} \ text {g Mg (OH)} _ 2 \ times \ frac {1 \; \ rule [0.25ex] {4.75em} {0.1ex} \ hspace {-4.75em} \ text {mol Mg (OH)} _ 2} {58.3 \; \ rule [0.25ex] {3.5em} {0.1ex} \ hspace {-3.5em } \ text {g Mg (OH)} _ 2} \ times \ frac {2 \; \ rule [0.25ex] {3.5em} {0.1ex} \ hspace {-3.5em} \ text {моль NaOH}} {1 \; \ rule [0.25ex] {4.5em} {0.1ex} \ hspace {-4.5em} \ text {моль Mg (OH)} _2} \ times \ frac {40.0 \; \ text {g NaOH}} {1 \; \ rule [0.25ex] {3.25em} {0.1ex} \ hspace {-3.25em} \ text {моль NaOH}} = 22 \; \ text {г NaOH} [/ латекс]
Проверьте свои знания
Какую массу оксида галлия Ga 2 O 3 можно получить из 29,0 г металлического галлия? Уравнение реакции: [латекс] 4 \ text {Ga} + 3 \ text {O} _2 \ longrightarrow 2 \ text {Ga} _2 \ text {O} _3.[/ латекс]
Пример 4
Относительные массы реагентов
Какая масса газообразного кислорода, O 2 , из воздуха расходуется при сжигании 702 г октана C 8 H 18 , одного из основных компонентов бензина?
[латекс] 2 \ text {C} _8 \ text {H} _ {18} + 25 \ text {O} _2 \ longrightarrow 16 \ text {CO} _2 + 18 \ text {H} _2 \ text {O} [/ латекс]
Решение
Подход, требуемый здесь, такой же, как и в Примере 3, отличаясь только тем, что предоставленные и запрошенные массы относятся как к реагентам.
[латекс] 702 \; \ rule [0.5ex] {3.5em} {0.1ex} \ hspace {-3.5em} \ text {g C} _8 \ text {H} _ {18} \ times \ frac {1 \; \ rule [0.25ex] {3.5em} {0.1ex} \ hspace {-3.5em} \ text {mol C} _8 \ text {H} _ {18}} {114.23 \; \ rule [0.25ex] {2.75em} {0.1ex} \ hspace {-2.75em} \ text {g C} _8 \ text {H} _ {18}} \ times \ frac {25 \; \ rule [0.25ex] {2.5em} {0.1ex} \ hspace {-2.5em} \ text {mol O} _2} {2 \; \ rule [0.25ex] {3.5em} {0.1ex} \ hspace {-3.5em} \ text {mol C} _8 \ text {H} _ {18}} \ times \ frac {32.00 \; \ text {g O} _2} {\ rule [0.25ex] {2.5em} {0.1ex} \ hspace {-2.3 \; \ text {g O} _2 [/ латекс]
Проверьте свои знания
Какая масса CO требуется для реакции с 25,13 г Fe 2 O 3 в соответствии с уравнением
[латекс] \ text {Fe} _2 \ text {O} _3 + 3 \ текст {CO} \ longrightarrow 2 \ text {Fe} + 3 \ text {CO} _2 [/ латекс]
Эти примеры иллюстрируют лишь несколько примеров расчета стехиометрии реакции. Возможны многочисленные варианты начального и конечного этапов вычислений в зависимости от того, какие конкретные количества предоставляются и требуются (объемы, концентрации раствора и т. Д.).Независимо от деталей, все эти расчеты имеют общий важный компонент: использование стехиометрических факторов, полученных из сбалансированных химических уравнений. На рис. 2 представлен общий план различных этапов вычислений, связанных с расчетами стехиометрии многих реакций.
Рис. 2. Блок-схема изображает различные вычислительные этапы, участвующие в большинстве расчетов стехиометрии реакции.Подушки безопасности
Подушки безопасности(рис. 3) — это средство безопасности, установленное в большинстве автомобилей с 1990-х годов.Эффективная работа подушки безопасности требует, чтобы она быстро накачивалась соответствующим количеством (объемом) газа, когда транспортное средство участвует в столкновении. Это требование удовлетворяется во многих системах автомобильных подушек безопасности за счет использования взрывоопасных химических реакций, одним из распространенных вариантов является разложение азида натрия, NaN 3 . Когда датчики в автомобиле обнаруживают столкновение, электрический ток пропускается через тщательно отмеренное количество NaN 3 , чтобы инициировать его разложение:
[латекс] 2 \ text {NaN} _3 (s) \ longrightarrow 3 \ text {N} _2 (g) + 2 \ text {Na} (s) [/ latex]
Эта реакция очень быстрая, образуя газообразный азот, который может раскрыть и полностью надуть типичную подушку безопасности за доли секунды (~ 0.03–0,1 с). Среди многих инженерных соображений, количество используемого азида натрия должно быть подходящим для выработки достаточного количества газообразного азота, чтобы полностью надуть воздушную подушку и обеспечить ее надлежащее функционирование. Например, небольшая масса (~ 100 г) NaN 3 даст примерно 50 л N 2 .
Рис. 3. Подушки безопасности срабатывают при ударе, чтобы минимизировать серьезные травмы пассажиров. (кредит: Джон Сейдман)Сбалансированное химическое уравнение может использоваться для описания стехиометрии реакции (отношения между количествами реагентов и продуктов).Коэффициенты из уравнения используются для получения стехиометрических факторов, которые впоследствии могут использоваться для вычислений, связывающих массы реагента и продукта, молярные количества и другие количественные свойства.
Химия: упражнения в конце главы
- Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения информации, запрашиваемой в каждом из следующих пунктов:
(a) Число молей и масса хлора Cl 2 , необходимые для реакции с 10.0 г металлического натрия Na, чтобы получить хлорид натрия NaCl.
(b) Число молей и масса кислорода, образовавшегося при разложении 1,252 г оксида ртути (II).
(c) Число молей и масса нитрата натрия NaNO 3 , необходимые для производства 128 г кислорода. (Другой продукт — NaNO 2 .)
(d) Число молей и масса диоксида углерода, образующегося при сгорании 20,0 кг углерода в избытке кислорода.
(e) Число молей и масса карбоната меди (II), необходимых для получения 1.500 кг оксида меди (II). (CO 2 — другой продукт.)
(ж)
- Определите количество молей и массу, требуемую для каждой реакции в упражнении 1. Конец главы «Химия».
- Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения информации, запрашиваемой в каждом из следующих пунктов:
(a) Число молей и масса Mg, необходимые для реакции с 5,00 г HCl и образования MgCl 2 и H 2 .
(b) Число молей и масса кислорода, образовавшегося при разложении 1,252 г оксида серебра (I).
(c) Количество молей и масса карбоната магния, MgCO 3 , необходимых для производства 283 г диоксида углерода. (Другой продукт — MgO.)
(d) Число молей и масса воды, образовавшейся при сгорании 20,0 кг ацетилена, C 2 H 2 , в избытке кислорода.
(e) Количество молей и масса пероксида бария, BaO 2 , необходимые для получения 2.500 кг оксида бария, BaO (другой продукт O 2 )
(ж)
- Определите количество молей и массу, требуемую для каждой реакции в разделе «Химия». Конец главы Упражнения 3.
- H 2 получают реакцией 118,5 мл 0,8775-М раствора H 3 PO 4 в соответствии со следующим уравнением: [латекс] 2 \ text {Cr} + 2 \ text {H} _3 \ text {PO} _4 \ longrightarrow 3 \ text {H} _2 + 2 \ text {CrPO} _4 [/ latex].
(a) Обрисуйте шаги, необходимые для определения количества молей и массы H 2 .
(b) Выполните указанные вычисления.
- Хлорид галлия образуется в результате реакции 2,6 л 1,44 М раствора HCl согласно следующему уравнению: [латекс] 2 \ text {Ga} + 6 \ text {HCl} \ longrightarrow 2 \ text {GaCl} _3 + 3 \ text {H} _2 [/ латекс].
(a) Обрисуйте шаги, необходимые для определения количества молей и массы хлорида галлия.
(b) Выполните указанные вычисления.
- I 2 получается по реакции 0.4235 моль CuCl 2 согласно следующему уравнению: [латекс] 2 \ text {CuCl} _2 + 4 \ text {KI} \ longrightarrow 2 \ text {CuI} + 4 \ text {KCl} + \ text {I } _2 [/ латекс].
(а) Сколько молекул I 2 образуется?
(б) Какая масса производится I 2 ?
- Серебро часто извлекается из руд, таких как K [Ag (CN) 2 ], а затем извлекается реакцией
[латекс] 2 \ text {K} [\ text {Ag (CN)} _ 2] (водный) + \ text {Zn} (s) \ longrightarrow 2 \ text {Ag} (s) + \ text {Zn (CN)} _ 2 (aq) + 2 \ text {KCN} (aq) [/ latex](а) Сколько молекул Zn (CN) 2 образуется при реакции 35.27 г K [Ag (CN) 2 ]?
(б) Какая масса Zn (CN) 2 производится?
- Какая масса оксида серебра Ag 2 O требуется для получения 25,0 г сульфадиазина серебра AgC 10 H 9 N 4 SO 2 в результате реакции оксида серебра и сульфадиазина?
[латекс] 2 \ text {C} _ {10} \ text {H} _ {10} \ text {N} _4 \ text {SO} _2 + \ text {Ag} _2 \ text {O} \ longrightarrow 2 \ text {Ag} \ text {C} _ {10} \ text {H} _ {9} \ text {N} _4 \ text {SO} _2 + \ text {H} _2 \ text {O} [/ latex ] - Карборунд — это карбид кремния, SiC, очень твердый материал, используемый в качестве абразива для наждачной бумаги и для других целей.Его получают реакцией чистого песка SiO 2 с углеродом при высокой температуре. Окись углерода, CO, является другим продуктом этой реакции. Напишите сбалансированное уравнение реакции и вычислите, сколько SiO 2 требуется для производства 3,00 кг SiC.
- Автомобильные подушки безопасности надуваются, когда образец азида натрия, NaN 3 , очень быстро разлагается.
[латекс] 2 \ text {NaN} _3 (s) \ longrightarrow 2 \ text {Na} (s) + 3 \ text {N} _2 (g) [/ latex]Какая масса азида натрия требуется для получения 2.6 футов 3 (73,6 л) газообразного азота плотностью 1,25 г / л?
- Мочевина, CO (NH 2 ) 2 , производится в больших масштабах для использования в производстве карбамидоформальдегидных пластмасс и в качестве удобрений. Какова максимальная масса мочевины, которую можно получить из CO 2 , полученного сжиганием 1,00 × 103 кг1,00 × 103 кг углерода с последующей реакцией?
[латекс] \ text {CO} _2 (g) + 2 \ text {NH} _3 (g) \ longrightarrow {\ text {CO (NH} _2}) _ 2 (s) + \ text {H} _2 \ text {O} (l) [/ латекс] - При аварии раствор, содержащий 2.Вылилось 5 кг азотной кислоты. Два килограмма Na 2 CO 3 быстро распространились по площади, и в результате реакции был выделен CO 2 . Было ли использовано достаточно Na 2 CO 3 для нейтрализации всей кислоты?
- Компактный автомобиль проезжает по шоссе 37,5 миль на галлон. Если бензин содержит 84,2% углерода по массе и имеет плотность 0,8205 г / мл, определите массу углекислого газа, образовавшегося во время поездки на 500 миль (3,785 литра на галлон).
- Какой объем 0.750 М раствор соляной кислоты можно приготовить из HCl, полученного реакцией 25,0 г NaCl с избытком серной кислоты? [Латекс] \ text {NaCl} (s) + \ text {H} _2 \ text {SO} _4 ( l) \ longrightarrow \ text {HCl} (g) + \ text {NaHSO} _4 (s) [/ latex]
- Какой объем раствора 0,2089 M KI содержит достаточно KI для точной реакции с Cu (NO 3 ) 2 в 43,88 мл 0,3842 M раствора Cu (NO 3 ) 2 ? [латекс] 2 \ text {Cu (NO} _3) _2 + 4 \ text {KI} \ longrightarrow 2 \ text {CuI} + \ text {I} _2 + 4 {\ text {KNO} _3} [/ latex ]
- Протрава — это вещество, которое в сочетании с красителем обеспечивает устойчивый фиксированный цвет окрашенной ткани.Ацетат кальция используется как протрава. Его получают реакцией уксусной кислоты с гидроксидом кальция. [Латекс] 2 \ text {CH} _3 \ text {CO} _2 \ text {H} + \ text {Ca (OH)} _ 2 \ longrightarrow \ text {Ca (CH} _3 \ text {CO} _2) _2 + 2 \ text {H} _2 \ text {O} [/ latex]
Какая масса Ca (OH) 2 требуется для реакции с уксусной кислотой в 25,0 мл раствора, имеющего плотность 1,065 г / мл и содержащего 58,0% уксусной кислоты по массе?
- Токсичный пигмент, называемый белым свинцом, Pb 3 (OH) 2 (CO 3 ) 2 , был заменен в белых красках рутилом TiO 2 .Сколько рутила (г) можно получить из 379 г руды, содержащей 88,3% ильменита (FeTiO 3 ) по массе? [Латекс] 2 \ text {FeTiO} _3 + 4 \ text {HCl} + \ text { Cl} _2 \ longrightarrow 2 \ text {FeCl} _3 + 2 \ text {TiO} _2 + 2 \ text {H} _2 \ text {O} [/ latex]
Глоссарий
- стехиометрический коэффициент
- отношение коэффициентов в сбалансированном химическом уравнении, используемое в вычислениях, связывающих количества реагентов и продуктов
- стехиометрия
- отношения между количествами реагентов и продуктов химической реакции
Решения
Ответы на упражнения в конце главы по химии
2.(а) 0,435 моль Na, 0,217 моль Cl 2 , 15,4 г Cl 2 ; (б) 0,005780 моль HgO, 2,890 × 10 −3 моль O 2 , 9,248 × 10 −2 г O 2 ; (в) 8,00 моль NaNO 3 , 6,8 × 10 2 г NaNO 3 ; (d) 1665 моль CO 2 , 73,3 кг CO 2 ; (д) 18,86 моль CuO, 2,330 кг CuCO 3 ; (е) 0,4580 моль C 2 H 4 Br 2 , 86,05 г C 2 H 4 Br 2
4.(а) 0,0686 моль Mg, 1,67 г Mg; б) 2,701 × 10 −3 моль O 2 , 0,08644 г O 2 ; (в) 6,43 моль MgCO 3 , 542 г MgCO 3 (г) 713 моль H 2 O, 12,8 кг H 2 O; (д) 16,31 моль BaO 2 , 2762 г BaO 2 ; (е) 0,207 моль C 2 H 4 , 5,81 г C 2 H 4
6. (a) [латекс] \ text {объем раствора HCl} \ longrightarrow \ text {моль HCl} \ longrightarrow \ text {моль GaCl} _3 [/ латекс]; (б) 1.25 моль GaCl 3 , 2.2 × 10 2 г GaCl 3
8. (а) 5,337 × 10 22 молекул; (б) 10,41 г Zn (CN) 2
10. [латекс] \ text {SiO} _2 + 3 \ text {C} \ longrightarrow \ text {SiC} + 2 \ text {CO} [/ latex], 4,50 кг SiO 2
12. 5,00 × 10 3 кг
14. 1,28 × 10 5 г CO 2
16. 161,40 мл раствора KI
18,176 г TiO 2
(PDF) Синтез и характеристика нового хлорида гидроксида марганца γ-Mn (OH) Cl
Full Paper
, программное обеспечение TOPAS
[24]
для сравнения со значениями, полученными из кристалла sin-
gle-кристалл определение структуры.
Для определения структуры монокристалла были выделены подходящие кристаллы γ-
Mn (OH) Cl, покрытые защитным перфторполиалкилэфирным маслом (вязкость 1800 сСт, ABCR Chemicals, Карлсруэ, Германия)
под поляризацией. микроскоп. Данные об интенсивности были собраны при
173 K с помощью дифрактометра Bruker D8 Quest, оборудованного детектором Pho-
ton 100 и генератором источника Incoatec Microfocus
(многослойная оптика монохроматизирована) с использованием излучения Mo-K
α
( λ =
71.073 вечера). Поправки на поглощение при многократном сканировании на основе эквивалентных
и избыточных интенсивностей применялись с помощью программы Bruker
Sadabs-2014/5.
[25,26]
Атом водорода был уточнен с параметром тропического смещения iso-
, ограничивающим расстояние O – H значением
, равным 83 ± 2 пм. Все неводородные атомы были уточнены анизотропно-
, в результате чего значения R1 и wR2 составили 0,019 и 0,039 (все данные).
Соответствующие экспериментальные детали сбора и оценки данных
сведены в Таблицу 1.
CCDC 1856185 (для y-Mn (OH) Cl) содержит дополнительные таллографические данные кристалла
для этой статьи. Эти данные можно получить бесплатно по тарифу
в Кембриджском центре структурных данных.
ИК-спектроскопия: для подтверждения гидроксидной группы и получения информации о водородных связях
был получен спектр соединения FTIR-ATR (общее ослабленное отражение
). Поэтому порошкообразный образец γ-Mn (OH) Cl
был измерен с помощью спектрометра Bruker
ALPHA Platinum-ATR (Bruker, Billerica, США) с алмазным кристаллом ATR
(2 × 2 мм), оборудованным с детектором ДТГС в
спектральный диапазон 400–4000 см
–1
(спектральное разрешение 4 см
–1
).Было выполнено 24 сканирования образца
, и была проведена коррекция на атмосферные влияния
с использованием программного обеспечения opus 7.2
[27]
.
DFT-расчеты: скалярно-релятивистские спин-поляризованные расчеты ab initio cal-
были выполнены в рамках полнопотенциального метода дополненных плоских волн (FP-LAPW), реализованного
в Код лося.
[28]
Релаксация структуры не проводилась, и реляционные эффекты
не учитывались.Электронные корреляции
3d-электронов Mn обрабатывались путем назначения штрафов за энергию U
и J в рамках формализма LSDA + U
[29]
. Была применена схема двойного счета полностью локализованного предела (FLL)
с локальным членом кулоновского отталкивания
U = 6 эВ и параметром обмена Хунда J =
0,9 эВ. Эти параметры были оптимизированы для антиферромагнитно-упорядоченного MnO, имеющего экспериментальный магнитный момент
, равный 4.58–4,79 мкм
B
.
[17]
Наши тестовые расчеты дали 4,63 мкм
B
/ f. u. в
MnO. Кроме того, мы подтвердили, что изменение значения U
d
= U – J
на величину до 0,5 эВ в Mn (OH) Cl не привело к качественному изменению
наших результатов. Для четырех атомов Mn в элементарной ячейке Mn (OH) Cl были проанализированы только коллинеарные конфигурации спина вне плоскости. Сначала был выполнен самосогласованный спин-поляризованный расчет без
, а затем был использован
для начала спин-поляризованных расчетов с различными спин-поляризованными конфигурациями.Все рассмотренные сценарии магнитного упорядочения вернулись в изолирующее состояние. Всего было использовано 384 k-точки.
Критерии сходимости были установлены на 10
–6
для потенциала и поля Кона – Шама
и на 10
–4
для общей энергии. Для сравнения
мы провели тот же набор расчетов в пределах
приближения обобщенного градиента (GGA), которые дали качественно похожие результаты.
Магнитные характеристики. Крупнозернистый порошок (общая масса
27,4 мг) помещали в желатиновую капсулу и фиксировали ватой
в условиях аргона. Магнитные свойства анализировали на
CRYOGENIC Cryogen Free Measurement System (CFMS). Температурно-зависимые измерения восприимчивости
проводились в диапазоне температур
от 2 до 300 К с охлаждением и нагревом
евро. J. Inorg. Chem. 2018, 4630–4637 www.eurjic.org © 2018 Авторы. Опубликовано Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim4637
ставки ок. 2 К / мин при внешнем магнитном поле 0,1 Тл. Каждая последовательность измерений
состояла из разверток с нулевым охлаждением (zfc) и
с подогревом с полевым охлаждением (fc). Для полевых измерений
, образец подвергался воздействию плотностей магнитного потока от
до 9 Тл и 9 Тл со скоростью развертки 0,25 Тл / мин при различных температурах
.Все измеренные данные были записаны с использованием вибрационного магнитометра
Sample Magnetometer (VSM, 21 Гц).
Благодарности
Авторы хотели бы поблагодарить доктора Гюнтера Хеймана за сбор данных по монокристаллу
. Работа выполнена при финансовой поддержке
Австрийского научного фонда (FWF): Project no. I 2179
и Проект Немецкого исследовательского совета (DFG) No. RU 776 / 15-
1.
Ключевые слова: Синтез под высоким давлением · Галогенид гидроксида ·
Слоистые соединения · Магнитные свойства · Марганец
[1] W.Feitknecht, H. R. Oswald, H. E. Forsberg, Chimia 1959, 13, 113.
[2] H. R. Oswald, W. Feitknecht, Helv. Чим. Acta 1961,44, 847–858.
[3] Y. Cudennec, A. Riou, Y. Gérault, A. Lecerf, J. Solid State Chem. 2000,151,
308–312.
[4] Х. Д. Лутц, К. Бекенкамп, С. Петер, Spectrochim. Acta 1995, A51, 755–
767.
[5] S. Peter, H. D. Lutz, Z. Anorg. Allg. Chem. 1998, 624, 1067–1077.
[6] Й. Иитака, С. Локки, Х. Р. Освальд, Helv.Чим. Acta 1961,44, 2095–2103.
[7] R. E. Dinnebier, I. Halasz, D. Freyer, J. C. Hanson, Z. Anorg. Allg. Chem.
2011 637, 1458–1462.
[8] H. Möller, K. Beckenkamp, T. Kellersohn, H. D. Lutz, J. K. Cockcroft, Z.
Kristallogr. 1994, 209, 157.
[9] Р. У. Г. Вайкофф, Кристаллические структуры, 2
nd
ed., Vol. 1, Interscience Publishers,
Inc. 1965.
[10] Э. Риби, Über Hydroxyverbindungen des Mangans, Диссертация, Университет
Берн, 1948.
[11] J. D. Tornero, J. Fayos, Z. Kristallogr. 1990,192, 147–148.
[12] А. Н. Кристенсен, Г. Оливье, Solid State Commun. 1972,10, 609–614.
[13] С. Питер, Дж. К. Кокрофт, Т. Ройнель, Х. Д. Лутц, Acta Crystallogr., Sect. В
1996,52, 423–427.
[14] W. Kagunya, R. Baddour-Hadjean, F. Kooli, W. Jones, Chem. Phys. 1998,
236, 225–234.
[15] М. В. Анант, С. Петкар, К. Дакшинамурти, J. Power Sources 1998,75,
278–282.
[16] Т. Колер, Т. Армбрустер, Э. Либовицкий, J. Solid State Chem. 1997, 133,
,, 486–500.
[17] Ф. Тран, П. Блаха, К. Шварц, П. Новак, Phys. Rev. B 2006,74, 155108.
[18] К. Старр, Ф. Биттер, А. Р. Кауфманн, Phys. Ред. 1940,58, 977–983.
[19] M. McGuire, Crystals 2017,7, 121.
[20] J. L. Manson, Q.-z. Хуан, К. М. Браун, Дж. В. Линн, М. Б. Стоун, Дж. Сингл —
тонны, Ф. Сяо, Inorg. Chem. 2015,54, 11897–11905.
[21] Дж.N. McElearney, S. Merchant, R.L. Carlin, Inorg. Chem. 1973,12, 906–
908.
[22] RDW Kemmitt, RD Peacock, The Chemistry of Marganese, Technetium
and Rhenium, Pergamon Press, Oxford, UK, 1973.
[23] H. Huppertz, Z. Kristallogr. 2004, 219, 330–338.
[24] Topas, 4.2, Bruker Analytical X-ray Instruments Inc., Мэдисон, Висконсин,
USA, 2009.
[25] Sadabs-2014/5, Bruker AXS, Мэдисон, Висконсин (США), 2015
[26] Л.Krause, R. Herbst-Irmer, G. M. Sheldrick, D. Stalke, J. Appl. Кристаллогр.
2015,48, 3–10.
[27] Opus, v.7.2, Bruker Optik GmbH, Биллерика, Массачусетс, США, 2012.
[28] Код Elk Fp-lapw, версия 3.1.12.2010, http: //elk.sourceforge. сеть.
[29] J. P. Perdew, Y. Wang, Phys. Rev. B 1992,45, 13244–13249.
Поступила: 30 июля 2018 г.
Именование соединений | Химия [Магистр]
Обозначение ионных соединений
Ионное соединение сначала называют по катиону, а затем по аниону.
Цели обучения
Преобразование между химической формулой ионного соединения и его названием
Основные выводы
Ключевые моменты
- Большинство катионов и анионов могут объединяться с образованием нейтральных соединений (обычно твердых веществ при нормальных условиях), которые обычно называют солями.
- Чистый заряд ионного соединения должен быть равен нулю. Следовательно, количество катионов и анионов в ионном соединении должно быть сбалансировано, чтобы образовалась электрически нейтральная молекула.
- При названии ионных соединений катион сохраняет то же название, что и элемент. Имя аниона похоже на имя элементаля, но окончание имени было удалено и заменено на «-ide».
- Если металлический элемент имеет катионы с разными зарядами, то используемый катион должен быть указан суффиксом (более старый метод) или римскими цифрами в скобках после его названия в письменной форме (система Stock).
Ключевые термины
- Складская система : Система именования, которая включает использование римских цифр для обозначения заряда переходных металлов.
В химии ионное соединение — это химическое соединение, в котором ионы удерживаются вместе ионными связями. Обычно положительно заряженная часть состоит из катионов металлов, а отрицательно заряженная часть представляет собой анион или многоатомный ион. Ионные соединения имеют высокие температуры плавления и кипения, а также имеют тенденцию быть твердыми и хрупкими.
Ионы могут быть одиночными атомами, как натрий и хлор в обычной поваренной соли (хлорид натрия), или более сложными (многоатомными) группами, такими как карбонат в карбонате кальция.Но чтобы считаться ионами, они должны нести положительный или отрицательный заряд. Таким образом, в ионной связи одна «связка» должна иметь положительный заряд, а другая — отрицательный. Придерживаясь друг друга, они разрешают или частично устраняют дисбаланс своих отдельных зарядов. Связи между положительными и отрицательными ионами не возникают.
Большинство катионов и анионов могут объединяться с образованием твердых соединений, которые обычно называют солями. Главное требование состоит в том, что полученное соединение должно быть электрически нейтральным: поэтому ионы Ca 2+ и Br — объединяются только в соотношении 1: 2 с образованием бромида кальция CaBr 2 .Поскольку никакая другая более простая формула невозможна, нет необходимости называть ее «бромид кальция ди ». CaBr 2 можно назвать с использованием метода Stock или более старого, классического способа именования.
Например, CuCl 2 обозначает молекулу, в которой один катион Cu 2+ связывается с двумя анионами Cl — с образованием нейтрального соединения. Его систематическое название — хлорид меди (II), где в скобках указана степень окисления меди. Его старое название — хлорид меди.
Метод наименования акций
Ионное соединение сначала называют по катиону, а затем по аниону. Катион имеет то же имя, что и его элемент. Например, K +1 называется ионом калия, так же как K называется атомом калия. Анион назван, взяв имя элемента, убрав окончание и добавив «-ide». Например, F -1 называется фторидом, по названию элемента, фтор. «-Ine» был удален и заменен на «-ide». Чтобы назвать соединение, имя катиона и названный анион складываются вместе.Например, NaF также известен как фторид натрия.
Если катион или анион являются многоатомным ионом, имя многоатомного иона используется в названии всего соединения. Название многоатомного иона остается прежним. Например, Ca (NO 3 ) 2 называется нитратом кальция.
Для катионов, которые берут на себя несколько зарядов (обычно переходные металлы), заряд записывается римскими цифрами в скобках сразу после имени элемента. Например, Cu (NO 3 ) 2 является нитратом меди (II), потому что заряд двух нитрат-ионов (NO 3 -1 ) равен 2 (-1) = -2.Поскольку чистый заряд ионного соединения должен быть равен нулю, ион Cu имеет заряд 2+. Таким образом, это соединение является нитратом меди (II). Римские цифры на самом деле показывают степень окисления, но в простых ионных соединениях она всегда будет такой же, как заряд иона металла.
Старый, классический или общепринятый способ наименования
Названия некоторых ионных соединений : Обычные или тривиальные названия соединений иногда используются в неформальных беседах между химиками, особенно старшими химиками.Систематические имена — это формальные имена, которые всегда используются в печати.
Поскольку некоторые металлические элементы образуют катионы с разными положительными зарядами, названия ионных соединений, производных от этих элементов, должны содержать некоторое указание заряда катиона. В более старом методе используются суффиксы -ous и -ic для обозначения более низкой и высокой платы соответственно. В случае железа и меди используются латинские названия элементов (железо / трехвалентное железо, медь / медь). Эта система все еще используется, хотя официально она была заменена более точной, хотя и немного громоздкой, системой Stock.В обеих системах название аниона оканчивается на -ide.
Присвоение имен соединениям — Часть 1 — YouTube : В этом видео объясняется, как давать названия ковалентным и ионным соединениям.
Обозначение молекулярных соединений
Молекулярные соединения названы с использованием систематического подхода префиксов, чтобы указать количество каждого элемента, присутствующего в соединении.
Цели обучения
Применить правила наименования молекулярных соединений
Основные выводы
Ключевые моменты
- В номенклатуре простых молекулярных соединений более электроположительный атом записывается первым, а более электроотрицательный элемент записывается последним с суффиксом -ide.
- Греческие префиксы используются для обозначения количества данного элемента, присутствующего в молекулярном соединении.
- Префиксы могут быть сокращены, если конечная гласная префикса «конфликтует» с начальной гласной в составе.
- Существуют общие исключения для наименования молекулярных соединений, где вместо систематических названий используются тривиальные или общепринятые названия, такие как аммиак (NH 3 ) вместо тригидрида азота или вода (H 2 O) вместо монооксида дигидрогена.
Ключевые термины
- номенклатура : Набор правил, используемых для формирования имен или терминов в определенной области искусства или науки.
- электроотрицательный : имеет тенденцию притягивать электроны в пределах химической связи.
- электроположительный : не притягивает электроны (не отталкивает) в пределах химической связи.
Химическая номенклатура
Основная функция химической номенклатуры — гарантировать, что устное или письменное химическое название не оставляет двусмысленности в отношении того, к какому химическому соединению относится это название.Каждое химическое название должно относиться к одному веществу. Сегодня ученые часто называют химические вещества общими названиями: например, воду не часто называют оксидом водорода. Однако важно уметь распознавать и давать названия всем химическим веществам стандартизированным способом. Наиболее широко принятый формат номенклатуры был установлен IUPAC.
Молекулярные соединения образуются, когда два или более элемента разделяют электроны ковалентной связью для соединения элементов. Обычно неметаллы имеют тенденцию делить электроны, образовывать ковалентные связи и, таким образом, образовывать молекулярные соединения.
Правила наименования молекулярных соединений:
- Удалите окончание второго элемента и добавьте «ид», как в ионных соединениях.
- При именовании молекулярных соединений префиксы используются для определения количества данного элемента, присутствующего в соединении. «Mono-» означает один, «di-» означает два, «tri-» — три, «tetra-» — четыре, «penta-» — пять, «hexa-» — шесть, «hepta-» — семь, «Окто-» — восемь, «нона» — девять, а «дека» — десять.
- Если есть только один из первых элементов, вы можете отбросить префикс.Например, CO — это монооксид углерода, а не монооксид углерода.
- Если в строке есть две гласные, которые звучат одинаково после добавления префикса (они «конфликтуют»), лишняя гласная в конце префикса удаляется. Например, один кислород может быть монооксидом, а вместо этого — монооксидом. Дополнительный o опускается.
Обычно сначала пишется более электроположительный атом, за ним следует более электроотрицательный атом с соответствующим суффиксом. Например, H 2 O (вода) можно назвать монооксидом дигидрогена (хотя обычно это не так).Органические молекулы (молекулы, состоящие из C и H вместе с другими элементами) не подчиняются этому правилу.
Примеры названий молекулярных соединений:
- SO 2 называется диоксид серы
- SiI 4 называется тетраиодидом кремния
- SF 6 называется гексафторидом серы
- CS 2 называется сероуглеродом
Присвоение имен соединениям — Часть 2 — YouTube : В этом видео объясняется, как использовать химическое название для написания формулы этого соединения.
Обозначение кислот и оснований
Названия кислот основаны на анионе, который они образуют при растворении в воде; базовые имена соответствуют правилам для ионных, органических или молекулярных соединений.
Цели обучения
Преобразование между структурой кислоты или основания и ее химическим названием
Основные выводы
Ключевые моменты
- Кислоты названы на основе их аниона — иона, присоединенного к водороду. В простых бинарных кислотах один ион присоединен к водороду.Названия таких кислот состоят из приставки «гидро-», первого слога аниона и суффикса «-ic».
- Сложные кислотные соединения содержат кислород. Для кислоты с многоатомным ионом суффикс «-ат» от иона заменяется на «-ic».
- Многоатомные ионы с одним дополнительным кислородом (по сравнению с типичным многоатомным ионом) имеют префикс «per-» и суффикс «-ic».
- Многоатомные ионы с на один кислород меньше имеют суффикс «-ous»; ионы с двумя меньшими числами имеют приставку «гипо-» и суффикс «-ous».”
- Сильные основания с группами «-ОН» (гидроксид) называются как ионные соединения. Слабые основания называют молекулярными соединениями или органическими соединениями.
Ключевые термины
- многоатомный ион : заряженная разновидность (ион), состоящая из двух или более атомов, ковалентно связанных. Также известен как молекулярный ион.
Обозначение кислот
Кислоты названы по аниону, который они образуют при растворении в воде. В зависимости от того, к какому аниону присоединен водород, кислоты будут иметь разные названия.
Простые кислоты, известные как бинарные кислоты, содержат только один анион и один водород. Эти анионы обычно имеют окончание «-ид». Эти соединения называются кислотами, начиная с приставки «гидро-», затем добавляя первый слог аниона, а затем суффикс «-ic». Например, HCl, представляющий собой водород и хлор, называется соляной кислотой.
Номенклатура распространенных кислот : В этой таблице представлена номенклатура некоторых распространенных анионов и кислот
В составе более сложных кислот есть кислород.Для этих кислот существует простой набор правил.
- Любой многоатомный ион с суффиксом «-ат» использует суффикс «-ic» как кислоту. Итак, HNO 3 будет азотной кислотой.
- Если у вас есть многоатомный ион, у которого на один кислород больше, чем у «-атного» иона, тогда ваша кислота будет иметь префикс «per-» и суффикс «-ic». Например, хлорат-ион — это ClO 3 —. Поэтому HClO 4 называется хлорной кислотой.
- Если у кислоты на один кислород меньше, чем у «-атного» иона, то у кислоты будет суффикс «-ous».Например, хлорноватистой кислотой является HClO 2 .
- Если у иона кислорода на два меньше, чем у иона «-ат», префикс будет «гипо-», а суффикс — «-ous». Например, вместо бромной кислоты HBrO 3 мы имеем бромистоводородную кислоту HBrO.
Именные базы
Самые сильные основания содержат гидроксид, многоатомный ион. Поэтому сильные основания называют в соответствии с правилами наименования ионных соединений. Например, NaOH — гидроксид натрия, KOH — гидроксид калия, а Ca (OH) 2 — гидроксид кальция.Слабые основания, состоящие из ионных соединений, также называются с помощью ионной системы именования. Например, NH 4 OH — гидроксид аммония.
Слабые основания также иногда являются молекулярными соединениями или органическими соединениями, поскольку имеют ковалентные связи. Поэтому их называют в соответствии с правилами для молекулярных или органических соединений. Например, метиламин (CH 3 NH 2 ) является слабым основанием. Некоторые слабые базы имеют «общие» имена. Например, NH 3 называется аммиаком; его название не происходит от какой-либо системы именования.
Именование гидратов
Название гидрата следует установленному шаблону: название ионного соединения, за которым следует числовой префикс и суффикс -гидрат.
Цели обучения
Создает химическую формулу и систематическое название данного неорганического гидрата
Основные выводы
Ключевые моменты
- Гидраты обозначаются по ионному соединению, за которым следуют числовой префикс и суффикс «-гидрат». Обозначение «· nH 2 O» указывает на то, что число «n» (описывается греческим префиксом) слабосвязанных молекул воды связано с одной формульной единицей соли.
- Ангидрид — это гидрат, потерявший воду. Вещество, не содержащее воды, называется безводным.
- В органической химии гидрат — это соединение воды или ее элементов с другой молекулой. Глюкоза, C 6 H 12 O 6 , первоначально рассматривалась как углевод (углерод и вода), но эта классификация не описывает ее структуру и свойства должным образом.
Ключевые термины
- гидрат : твердое соединение, содержащее или связанное с молекулами воды.
- углевод : сахар, крахмал или целлюлоза, являющиеся пищевым источником энергии для животных или растений; сахарид
- ангидрид : любое соединение, формально полученное из другого (или из других) путем потери молекулы воды; молекула без воды.
Неорганические гидраты
«Гидрат» — термин, используемый в неорганической химии и органической химии для обозначения того, что вещество содержит слабосвязанную воду. Название гидрата следует установленному шаблону: название ионного соединения, за которым следует числовой префикс и суффикс «-гидрат».Например, CuSO 4 · 5 H 2 O представляет собой «пентагидрат сульфата меди (II)». Обозначение водного соединения · nH 2 O, где n — количество молекул воды на формульную единицу соли, обычно используется, чтобы показать, что соль гидратирована. Знак «[латекс] \ cdot [/ латекс]» указывает на то, что вода слабо связана с ионным соединением. «N» обычно является малым целым числом, хотя могут существовать дробные значения. Префиксы — это те же греческие префиксы, которые используются для обозначения молекулярных соединений.Следовательно, в моногидрате «n» равно единице; в гексагидрате «n» равно 6 и так далее.
Греческие префиксы, используемые в именах гидратов для чисел от 1/2 до 10, следующие:
- 1/2: пол-
- 1: моно-
- 2: di-
- 3: три-
- 4: тетра-
- 5: пента-
- 6: шестнадцатеричный
- 7: гепта-
- 8: окта
- 9: нона
- 10: дека
Гидрат, потерявший воду, называется ангидридом.Ангидрид обычно может терять воду только при значительном нагревании. Вещество, которое больше не содержит воды, называется безводным.
Органические гидраты
В органической химии гидраты встречаются реже. Органический гидрат — это соединение, образованное добавлением воды или ее элементов к другой молекуле. Например, этанол, CH 3 –CH 2 –OH, можно рассматривать как гидрат этена, CH 2 = CH 2 , образованный добавлением H к одному C и OH к другому C .Другой пример — хлоралгидрат CCl 3 –CH (OH) 2 , который может быть образован реакцией воды с хлоралем CCl 3 –CH = O.
Молекулы были названы гидратами по историческим причинам. Глюкоза, C 6 H 12 O 6 , первоначально считалась C 6 (H 2 O) 6 и описывалась как углевод, но это очень плохое описание ее структура с учетом того, что о нем известно сегодня.Метанол часто продается как «метилгидрат», что подразумевает неправильную формулу: CH 3 OH 2 . Правильная формула — CH 3 –OH.
Гексагидрат хлорида кобальта (II) : CoCl 2 · 6H 2 O имеет систематическое название гексагидрат хлорида кобальта (II).
Обозначение знакомых неорганических соединений
Знакомые неорганические и органические соединения часто известны под своими обычными или «банальными» названиями.
Цели обучения
Определите, когда уместно использовать общее химическое название
Основные выводы
Ключевые моменты
- Многие часто используемые химические вещества имеют знакомые названия. У одного вещества может быть несколько таких названий.
- Некоторые общепринятые названия химических веществ имеют исторические корни и используются на протяжении тысячелетий.
- Общепринятые химические названия используются химиками в устной или неформальной письменной коммуникации.Для некоторых простых соединений их систематические и общие названия совпадают.
Ключевые термины
- общее название : название, под которым вид известен широкой публике, а не его таксономическое или научное название.
Общие имена v. Систематические имена
Многие химические вещества настолько вошли в повседневную жизнь, что люди знают их по знакомым названиям. Обычный тростниковый сахар, например, более формально известен как сахароза, но просьба о нем за обеденным столом под этим именем, вероятно, будет препятствием для разговора.А теперь представьте, что вы используете его систематическое название в том же контексте: «Пожалуйста, передайте α-D-глюкопиранозил- (1,2) -β-D-фруктофуранозид!» Но сказать «сахароза» было бы вполне уместно, если бы вам нужно было отличить этот конкретный сахар от сотен других названных сахаров. И единственное место, где вы могли бы встретить систематическое название, такое как довольно громоздкое, упомянутое выше, — это научная документация, относящаяся к сахару, у которого нет простого общего названия.
Многие распространенные химические названия имеют очень старое и интересное происхождение, о чем свидетельствуют следующие два примера.
У большинства людей название аммиак (NH 3 ) ассоциируется с газом с резким запахом. Хотя его систематическое название «тригидрид азота» (которое редко используется) говорит вам о его формуле, он не расскажет вам интересную историю его открытия. Дым от горящего верблюжьего навоза (основное топливо Северной Африки) конденсируется на прохладных поверхностях с образованием кристаллического осадка, который древние римляне впервые заметили на стенах и потолке храма, построенного египтянами богу солнца Амону в Фивах.Они назвали этот материал «нашатырный спирт», что означает «соль Амона». В 1774 году Джозеф Пристли (первооткрыватель кислорода) обнаружил, что при нагревании нашатырного спирта выделяется резкий запах, который Т. Бергман восемь лет спустя назвал «аммиаком».
Арабская алхимия дала нам ряд химических терминов. Например, считается, что алкоголь происходит от арабского слова al-khwl или al-ghawl, что первоначально означало металлический порошок, используемый для затемнения женских век (kohl). Алкоголь вошел в английский язык в 17, -м, -м веке со значением «сублимированного» вещества, затем изменился на «чистый дух» чего-либо и стал ассоциироваться с «винным спиртом» только в 1753 году.Наконец, в 1852 году он стал частью химической номенклатуры, обозначавшей общий класс органических соединений. Но до сих пор существует обычная практика называть конкретное вещество CH 3 CH 2 OH «спиртом», а не использовать его систематическое название — этанол.
Общие методы присвоения имен
Обычно химики используют наиболее распространенные химические названия всякий раз, когда это целесообразно, особенно при устном или неформальном письменном общении. Многие из «общих» имен известны и используются в основном научным сообществом.Химические вещества, которые используются дома, в искусстве или в промышленности, получили традиционные или «популярные» названия, которые до сих пор широко используются. Многие из них, например, упомянутый выше салиновый аммиак, имеют за своими именами увлекательные истории.
Серная кислота : Историческое название серной кислоты — «купоросное масло». Средневековые европейские алхимики готовили его, обжигая «зеленый купорос» (сульфат железа (II)) в железной реторте. Его химическая формула: H 2 SO 4 .
Вкладыши, основы и цементы: выбор материала и клиническое применение
Asa написала, что когда стоматологи собираются вносить изменения, они должны делать это не просто ради изменений, а, скорее, для улучшения определенного результата. 1 Далее он заявил, что процесс выбора нового стоматологического материала включает чтение литературы (включая инструкции производителей) и общение с коллегами. Производители стоматологических материалов постоянно представляют новые версии существующих продуктов, утверждая, что эти новые версии являются улучшенными.Кроме того, стоматологические школы не согласны с преподаванием протокола использования лайнеров и базисов. 2 Это означает, что ни один продукт или методика не являются единственно правильным выбором. Следовательно, решение об использовании определенных материалов может быть сложной задачей для врача.
Таблица. Материалы, используемые для облицовок, оснований и цементов.
|
В попытке справиться с неопределенностью, касающейся использования подкладок и оснований, было предложено постоянно пересматривать используемые в настоящее время продукты. 3 Эта статья исследует, почему врачи используют лайнеры, основы и цементы, типы материалов, которые доступны в настоящее время, и как их можно использовать. Приведены примеры типов продуктов в каждой категории, но эти примеры не единственные коммерчески доступные продукты. Сначала будут обсуждены вкладыши и основы, а затем — цементы. Как видно из таблицы, определенные материалы могут использоваться более чем в одной категории.
ЗАЧЕМ ИСПОЛЬЗОВАТЬ ЛАЙНЕРЫ И ОСНОВАНИЯ?
Обоснование использования лайнеров и баз менялось с годами.Первоначально считалось, что перед установкой окончательной реставрации на поверхность дентина необходимо нанести медикамент для защиты зуба и пульпы. В стоматологических школах учили, что это лекарство предназначено для защиты зуба от токсического воздействия реставрации, хотя раздражение от реставрации носит умеренный и временный характер. Когда действительно произошло послеоперационное воспаление пульпы, причиной этого воспаления были бактерии и их побочные продукты в дентине. 4,5 Бактерии в дентине могут вызвать сильное воспаление и даже некроз тканей пульпы. 6
Появилась новая модель причины послеоперационной чувствительности. Согласно Браннстрому, 7 послеоперационная чувствительность вызвана не бактериями или их побочными продуктами, а жидкостью, которая обнаруживается в промежутках между зубами и реставрацией. Именно движение этой жидкости вызывает изменение осмотического давления под реставрацией, что приводит к послеоперационной чувствительности. 7 В канальцах более глубоких полостей содержится больше дентинной жидкости, чем в неглубоких, поэтому осмотический эффект будет выше при более глубоких реставрациях.Следовательно, сохранение дентина поможет бороться с послеоперационной чувствительностью. Кроме того, увеличение остаточной толщины дентина снизит количество бактерий, достигающих пульпы. Это было показано Мерионом, который продемонстрировал, что увеличение остаточной толщины дентина (RDT) на 0,5 мм уменьшило бы количество бактерий, достигающих пульпы, на 75%, а увеличение RDT на 1,0 мм уменьшило бы количество бактерий на столько же. 90%. 8
Фактически, послеоперационная чувствительность может быть результатом сочетания этих различных факторов.Кэмпс и др. Сообщили, что факторы, влияющие на реакцию пульпы, следующие (в порядке убывания): присутствие бактерий, остаточная толщина дентина и послеоперационная задержка (время между восстановлением полости и воспалением пульпы). Наличие бактерий на стенках полости является основным фактором, влияющим на реакцию пульпы под реставрационными материалами, а не сам реставрационный материал. 9 Напротив, Мюррей и его коллеги наблюдали различия в способности реставрационных материалов предотвращать бактериальную утечку и воспаление пульпы.В порядке от наиболее эффективных до наименее эффективных были модифицированные смолой стеклоиономеры, связанная амальгама, эвгенол оксида цинка и композитная смола. 10
Зубы с тонкой РДТ также могут испытывать послеоперационный дискомфорт из-за теплового шока. Это особенно актуально для металлических реставраций, поскольку изменения температуры, передаваемые через реставрацию, могут вызвать движение жидкости в дентине. 11
Микроутечка определяется как поток ротовой жидкости и бактерий в микроскопические промежутки между подготовленной поверхностью зуба и реставрационным материалом. 12 Это движение экстракороновых жидкостей и связанного с ними мусора в дентин может вызывать вторичный кариес, воспаление пульпы, некроз пульпы и заболевания пародонта или быть связанным с ними. 13 В настоящее время существует ряд методов подготовки зубов к реставрации, включая использование бора, абразивов, лазеров и ручных инструментов. Способ удаления структуры зуба не влияет на микроподтекание. 14
Для комфорта пациента необходимо добиться уменьшения / устранения микроподтекания и устранения любых зазоров между структурой зуба и реставрационным материалом.Этой цели помогают лайнеры, основы и цементы.
ВИДЫ ЛАЙНЕРОВ И ОСНОВЫ
Желательные свойства лайнеров и основ включают отсутствие вредного воздействия на пульпу, высокую прочность на сжатие и растяжение, а также рентгеноконтрастность. 15 Некоторые идеальные свойства временных цементов также желательны для облицовок и оснований. К идеальным характеристикам временных цементов относятся контролируемое дозирование, компактный комплект (с минимальным количеством отходов), легкое смешивание и легкая очистка, а также быстрое схватывание. 16 Идеальный лайнер или основа должны иметь свойства из обоих списков. При использовании любого такого материала необходима надлежащая изоляция для уменьшения бактериального заражения препарированной полости. Использование резиновой дамбы — идеальный метод для достижения изоляции.
Многочисленные продукты могут использоваться в качестве футеровки, основы или цемента. Сюда могут входить продукты на основе лака и гидроксида кальция, на основе оксида цинка, эвгенола / неугенола, на основе фосфата цинка (оксифосфат цинка), на основе поликарбоксилата цинка, на основе стеклоиономера или на основе смол (таблица).
ЛАЙНЕРЫ
Лайнер — это материал, который наносится тонким слоем, обычно толщиной 0,5 мм, для герметизации дентина на полу и стенках полости от проникновения бактерий или раздражителей из реставрационных материалов и процедур. 17,18 Кроме того, подкладка (кроме лака) может дать некоторые терапевтические преимущества. 19 В качестве подкладки можно использовать лак, гидроксид кальция, фосфат цинка, стеклоиономер и смолу.
ОСНОВЫ
Основы наносятся толстыми слоями для обеспечения тепловой защиты пульпы.Эти материалы должны быть достаточно прочными, чтобы поддерживать реставрационный материал при установке и функционировании. 18 Они способствуют восстановлению поврежденной пульпы. По сути, основы служат заменой дентина, разрушенного кариесом или удаленного во время препарирования полости. 20 Основаниям можно придать определенную форму и контуры. 17 Craig and Powers 19 подразделяет основания на категории низкой и высокой прочности, при этом низкопрочные основания называются вкладышами.Лаки и материалы на основе гидроксида кальция не подходят для использования в качестве основы.
ЛАК
Стоматологи, недавно прошедшие обучение, обычно используют восстановительные методы, которым их научили в стоматологической школе. Количество школ, обучающих использованию лака, со временем уменьшилось. 3 Целью нанесения лака (например, Copalite, Cooley & Cooley; Copaliner, Bosworth) является герметизация дентинных канальцев, что снизит эффект микроподтекания.Это достигается за счет испарения растворителя в жидкости (которая обычно является органической по природе и включает ацетон, эфир или хлороформ) после размещения. Это оставляет растворенное вещество, которое представляет собой натуральную камедь (смолу или копал), чтобы запечатать дентин. 20
Лаки наносятся в препаровку полости перед установкой реставрации из амальгамы. Со временем лак растворяется в жидкостях полости рта и заменяется коррозионными побочными продуктами амальгамы. 21 В дополнение к герметизации дентина лак может предотвратить миграцию ионов металлов из амальгамы в зуб; это отвечает за потемнение зуба, прилегающего к амальгаме. 18 Поскольку лаки герметизируют дентинные канальцы, они противопоказаны при окончательной реставрации с использованием материала на основе смолы.
Некоторые лаки содержат фтор. Впервые они были изготовлены около 35 лет назад, чтобы предоставить врачам средство, увеличивающее время контакта фторида с эмалью. 22 Использование фторидных лаков в сочетании с другими фторидными препаратами снижает частоту возникновения кариеса. 23 Кроме того, было показано, что один фторидный лак снижает микроподтекание при использовании в качестве фиксирующего агента для временных коронок. Этот агент также увеличил удержание временного цемента на основе оксида цинка и эвгенола. 24
FDA одобрило использование фторсодержащих лаков (например, Duraphat, Colgate Oral Pharmaceuticals; Durashield, Sultan Dental Products) в качестве вкладышей для полости и для лечения гиперчувствительных зубов. FDA не одобрило использование лаков в качестве противокариесных средств.
Средства, с помощью которых фторидные лаки уменьшают кариес, аналогичны средствам для полоскания рта, содержащих фторид. Фторид кальция
осаждается на поверхности зуба и затем превращается во фторапатит в результате реакции реминерализации. Увеличенное время контакта с поверхностью фторидных лаков по сравнению с фторсодержащими жидкостями для полоскания рта является преимуществом, особенно для тех, кто подвержен риску корневого кариеса. 19 Недостатком этих материалов является горьковато-сладкий вкус и кратковременное (обычно 24 часа) изменение цвета зуба.
Было замечено, что некоторые фторидные лаки не выглядят однородными (наличие темных полос) при нанесении. Шен и Аутио-Голд показали, что содержание фторида может варьироваться в зависимости от дозы при дозировании из одной и той же пробирки. 25 Кроме того, противопоказаний к применению лаков не выявлено. Например, лаки могут снизить поверхностную твердость стеклоиономеров. 26
Наконец, лаки не имеют многократного применения; их можно использовать только в качестве облицовки, но не в качестве основы или цемента.
Гидроксид кальция
Гидроксид кальция (CaOH) — материал, популярность которого снижается. Это иронично, поскольку CaOH имеет несколько полезных свойств. Одним из них является антибактериальное свойство каталитической части материала ,27 Кислая природа побочных продуктов бактерий нейтрализуется СаОН, который имеет щелочной pH (pH около 11). Этот pH означает, что материал действует как раздражитель, что приводит к образованию репаративного дентина.Кроме того, CaOH обладает способностью извлекать факторы роста из дентиновой матрицы, вызывая образование дентинного мостика. 28
Гидроксид кальция (например, Dycal, DENTSPLY / Caulk; Pre-line, Schein) доступны как в светоотверждаемой, так и в самоотверждаемой версиях, и их прочность на сжатие продолжает расти в течение 24 часов. 19 Несмотря на это увеличение и тот факт, что CaOH иногда называют основой, эти продукты следует использовать только в качестве лайнеров.CaOH хорошо растворяется в воде, и незначительная утечка вымывает материал. Это может объяснить, почему был сделан вывод о том, что CaOH не обеспечивает долговременную изоляцию. 29 В случае растворения материала реставрация останется в некоторой степени без опоры и, следовательно, склонной к разрушению.
Оксифосфат цинка
Этот материал доступен уже много лет и обычно считается как основой, так и цементом. Оксифосфат цинка (ZOP) является идеальной основой, так как ему можно придать форму и контур в течение нескольких минут после нанесения.Амальгама может уплотняться в течение нескольких минут после нанесения ZOP.
ПродуктыZOP (например, Fleck’s Cement, Mizzy) доступны в виде смеси порошок-жидкость, где порошок содержит оксид цинка (90%) и оксид магния (10%). Жидкость содержит ортофосфорную кислоту. Жидкость дает ZOP начальный pH около 3,5, который повышается до 6,9 примерно через неделю. 20 Считалось, что послеоперационная чувствительность при использовании продукта ZOP связана с кислотной природой продукта, что привело к нанесению лака на обнаженный дентин до использования ZOP. 3
Поскольку при смешивании порошка и жидкости выделяется тепло, рекомендуется проводить распыление на холодную стеклянную плиту. Кроме того, это приведет к увеличению рабочего времени и позволит добавить в смесь больше порошка, что улучшит физические свойства. Стеклянная плита должна быть полностью сухой перед смешиванием, потому что влага на поверхности для смешивания приведет к более быстрому схватыванию цемента.
Спецификация ADA No.96 относится к фосфату цинка и другим цементам на водной основе. (К цементам на водной основе относятся те материалы, которые содержат воду как минимум в качестве одного из компонентов жидкой части продукта.) В этой спецификации указано, что упаковки ZOP должны содержать на 20% больше жидкости, чем необходимо для смешивания с соответствующим порошком. Это будет составлять жидкость, которая испарится при снятии крышки упаковки. Потеря воды из жидкого компонента сделает смесь более кислой, что сделает ее менее биосовместимой.Использование ZOP в качестве основы потребует, чтобы смесь была более вязкой, в результате чего получился бы похожий на замазку материал, который можно было бы легко нанести на пол препарированной полости.19 При смешивании в такой форме остается меньше доступной свободной кислоты, которая раздражает зуб и пульпа.
Один продукт ZOP (Doc’s Best Copper Cement, Cooley & Cooley) был предложен для использования в качестве подкладки и основы, поскольку, как заявляет производитель, медный компонент обладает антибактериальными свойствами. Кроме того, поскольку одна версия продукта не имеет цвета зубов (коричневого цвета), она идеально подходит для использования в качестве основы.В случае необходимости повторной препарирования зуба коричневый цвет отличает ZOP от дна препарирования полости.
Оксид цинка Эвгенол
Оксид цинка и эвгенол (ZOE) обеспечивает превосходное краевое уплотнение. Смеси с более низким соотношением порошка и жидкости обеспечивают лучшее краевое уплотнение, чем смеси с более высоким соотношением.30 Эта характеристика, наряду с ее нейтральным pH, обеспечивает седативный эффект. Этот эффект также можно объяснить антибактериальными свойствами этих материалов. 31 ZOE также является легким раздражителем пульпы. Это раздражение вызывает хроническую воспалительную реакцию пульпы, приводящую к образованию репаративного дентина. Это особенно верно при препарировании глубоких полостей, когда вода в дентинных канальцах вызывает вымывание эвгенола из ZOE. 32,33 Было показано, что эвгенол мешает клеточному дыханию, что может привести к некрозу пульпы. 34 Следовательно, материалы ZOE (например, IRM, DENTSPLY / Caulk) не должны использоваться в качестве агентов для прямого покрытия пульпы.
Оксид цинка и эвгенол доступны в 4 различных вариантах, в зависимости от способа их использования. Тип I считается временным или краткосрочным цементом; тип II — постоянный или окончательный цемент; тип III — для временных реставраций; и тип IV представляет собой материал для облицовки полостей. 35 Когда материал ZOE будет использоваться в качестве основы, клиницисты должны подождать примерно 24 часа после размещения этого материала перед установкой окончательной реставрации, поскольку ZOE изначально не может противостоять силам конденсации.
Поликарбоксилат цинка
Представленный в 1970-х годах поликарбоксилат цинка (ZPC), также известный как полиакрилат цинка, аналогичен ZOP. Основное различие между 2 — жидкий компонент. В случае ZPC жидкость представляет собой полиакриловую кислоту. Несмотря на то, что его сложно смешивать и обрабатывать, ZPC прилипает к структуре зуба. Это результат взаимодействия карбоновой кислоты и ионов кальция в дентине. Считается, что размер молекулы полиакрилатной кислоты слишком велик, чтобы проникнуть в дентинные канальцы и, таким образом, достичь пульпы, и считается, что эта характеристика обеспечивает биосовместимость ZPC. 17
ZPC (например, поликарбоксилат HyBond, Shofu; Durelon, 3M ESPE) имеет очень короткое время схватывания, что делает его удобной базой. Как и ZOP, ZPC следует смешивать на холодной стеклянной плите, чтобы увеличить время работы. При использовании в качестве основы под амальгаму ZPC можно разместить под любой тонкой эмалью, чтобы металлический цвет амальгамы не просвечивался.
Стеклоиономеры
Материал этой категории может использоваться как лайнер или основа и доступен уже более 30 лет.Стеклоиономерные материалы (GI) представляют собой порошкообразный жидкий продукт, в котором порошок представляет собой силикатное стекло, содержащее кальций, алюминий и фторид. 18 Жидкость полиакриловая кислота.
Стеклоиономерные продукты доступны в виде смешанных вручную составов (например, Vitrebond, 3M ESPE), капсулированных / картриджных составов (например, Ketac-bond Aplicaps, 3M ESPE; Fuji Lining LC, GC America), а также самоотверждающихся или легких вылеченные сорта. Обычный GI имеет более низкую герметизирующую способность, чем светоотверждаемые (модифицированные смолой) материалы. 36
Стеклоиономеры имеют 2 преимущества. Первое преимущество — способность прикрепляться к структуре зуба. Это ионная связь между карбоксильными группами GI и ионами кальция в зубе. 37 Что касается выделения фторида, когда стеклоиономер размещается на краю (как в сэндвич-методике) или в качестве цемента, было обнаружено уменьшение рецидивирующего кариеса из-за выделения фторида. 38 Фторид в GI позволяет реминерализовать структуру соседнего зуба. 39 Когда GI используется в качестве облицовки, уменьшается количество проблем, связанных с микроподтеканием. Это объясняется его антимикробными свойствами. 40 Кроме того, в отличие от вышеупомянутых материалов, когда адгезивная реставрация накладывается на GI, она может быть прикреплена к GI. Еще одно преимущество GI состоит в том, что использование модифицированного смолой стеклоиономера в качестве подкладки значительно снижает объемное сжатие при полимеризации для реставраций из светоотверждаемой смолы. 41
Стеклоиономеры обычно продвигаются не в качестве основы, а скорее для использования в качестве продукта для наращивания сердцевины (например, Fuji IILC Core Material, GC America; Vitremer, 3M ESPE). Однако их можно использовать в качестве основы, поскольку они соответствуют характеристикам основы, как отмечалось ранее. Есть преимущество использования GI в качестве основы. Одно исследование показало, что частичное удаление кариеса и наложение GI или композитного материала на лайнер из CaOH с последующим удалением пломбировочного материала через несколько месяцев привело к образованию твердой и сухой поверхности дентина. 42 Этот метод, по-видимому, привел к снижению количества микроорганизмов, обнаруживаемых при препарировании полости.
Стеклоиономеры действительно имеют недостатки. Эти материалы не следует использовать в качестве агентов, непосредственно покрывающих пульпу, поскольку они вызывают стойкую воспалительную реакцию пульпы. Считается, что это связано с отсутствием образования дентинных мостиков. 43 Это противоречит другому отчету, в котором было заявлено, что реакции ткани пульпы не отличаются от реакций, наблюдаемых при ZOE. 19
Как и материалы ZOP и ZPC, стеклоиономеры можно смешивать на холодной стеклянной пластине, чтобы замедлить время схватывания. Однако это может отрицательно сказаться на прочности готовой смеси. 19 Клиницисты должны помнить, что при смешивании GI в качестве лайнера соотношение порошка к жидкости будет уменьшено по сравнению с тем, когда этот материал смешивается в виде цемента. Это приведет к более низкому уровню pH в течение более длительного периода времени, что может привести к краткосрочной послеоперационной чувствительности.Более прочная связь желудочно-кишечного тракта с дентином может быть достигнута путем предварительной очистки препарирования полости. Также было показано, что кондиционеры (такие как полиакриловая кислота или фосфорная кислота) значительно улучшают сцепление с эмалью как для обычных, так и для армированных смолой стеклоиономеров. 44 Это может быть полезно для зубов, страдающих флюорозом, поскольку было продемонстрировано, что флюороз снижает прочность сцепления ЖКТ с дентином при сдвиге. 45
Смола
Новейшая категория лайнеров и основ, быстро набирающая популярность, — это смола.Смолы обычно имеют низкую растворимость, доступны во множестве оттенков и различной вязкости и обладают высокой прочностью на сжатие и растяжение. В данной статье эта категория разделена на грунтовки / связующие (ненаполненные смолы) и смолы с наполнителями.
Что касается смол в качестве облицовки полостей, следует помнить, что с дентином контактирует связывающий дентин агент, а не наполненная смола. Это уровень, который клиницист должен оценить на предмет эффективности.Со временем клинические методы изменились. Первоначально адгезивная стоматология (бондинг) выполнялась без кислотного травления дентина. В настоящее время травление дентина является стандартной процедурой, при этом травитель содержится в адгезиве к дентину. Эти продукты стали связующим веществом шестого поколения. Версии шестого поколения бывают двух типов. Тип 1 (например, Clearfil SE, Kuraray) требует, чтобы компоненты (самопротравливающаяся грунтовка и адгезив) наносились отдельно. В продуктах типа 2 (Adper Prompt L-Pop, 3M ESPE) компоненты смешиваются перед нанесением.Эти материалы образуют так называемую гибридную зону. Эта гибридная зона служит как для герметизации поверхности полости, так и для удержания реставрации. Как правило, эти продукты шестого поколения имеют более низкий pH, что делает их несовместимыми с самоотверждающимися смолами.
Эти адгезивы для дентина чувствительны к технике. Это связано с количеством задействованных шагов. Возникает вопрос: нужно ли поддерживать дентин влажным, и если да, то насколько влажным? Клиницисты должны помнить, что по мере приближения препарирования полости к пульпе в дентине повышается содержание жидкости.Это может снизить прочность сцепления материала. 46,47 Поскольку различные области препарирования полости не являются равномерно влажными из-за гидравлических сил, Пэшли и Тэй рекомендуют пересушить зуб, особенно при глубоком препарировании. .48 Следовательно, это важно для клиницист должен понимать и строго следовать инструкциям производителя. Peutzfeldt и Vigild сообщили, что степень, в которой стоматологи соблюдают инструкции по применению, зависит от того, насколько стоматологи удовлетворены инструкциями, предоставленными производителем. 49
Недавно было представлено седьмое поколение связующего. Они добавляют компоненты к продуктам предыдущего поколения, которые делают их однокомпонентной системой (например, I-Bond, Heraeus Kulzer; G-Bond, GC America). В некоторых случаях эти продукты обладают антибактериальным действием 50 и сокращают количество этапов, необходимых для клинициста. Как правило, эти материалы имеют очень низкую толщину пленки. Это важно, потому что при использовании правильной техники не произойдет слипания материала, как это может случиться с ненаполненными смолами.В результате послеоперационные рентгенограммы не будут показывать рентгенопрозрачную линию под окончательной реставрацией, которую можно спутать с рецидивирующим кариесом.
Есть признаки того, что адгезивы, помещенные под реставрации из амальгамы, уменьшают микроподтекание. 51,52 Этот метод имеет дополнительное преимущество. Размещение клея в препарированной полости вместе с амальгамой (соединение амальгамы) частично восстановит прочность и жесткость, утраченные при препарировании полости.Это также может привести к уменьшению изгиба бугорка и снижению частоты переломов зубов из-за усталости. 53 Дентин-бондинговые агенты (DBA) не рекомендуются для использования в качестве непосредственного покрытия пульпы, поскольку они, как и стеклоиономеры, не способствуют образованию дентинных мостиков. 54 Кроме того, DBA может оказывать вредное воздействие на пульпу. 55
Использование композитных материалов для восстановления зубов за последние несколько лет увеличилось. Хорошо известно, что эти смолы подвержены полимеризационной усадке, которая может привести к образованию зазоров на границе раздела смола-зуб.Чтобы преодолеть последствия этой усадки, производители разработали разбавленную смолу, известную как текучий композит. Идеи, лежащие в основе использования этих продуктов, заключаются в их пониженной эластичности и лучшей текучести. Эти 2 фактора позволяют улучшить адаптацию материала к препарированию полости и формирование слоя, поглощающего напряжение. 56 Это происходит даже после того, как учесть, что текучие смолы имеют пониженное содержание наполнителя, что позволяет увеличить усадку при полимеризации.Конечным результатом является уменьшение зазора и уменьшение микроподтекания, вторичного кариеса и воспаления пульпы. В конечном итоге это приведет к более прочной реставрации. 57
Как отмечалось ранее, учитывая, что прочность связи ослабевает по мере уменьшения RDT, было продемонстрировано, что самая слабая связь находится на стыке текучей смолы и зуба. Полимеризация смолы позволит образоваться зазорам. 58 Кристенсен отметил, что многие стоматологи используют текучие композиты (например, Tetric Flow, Ivoclar Vivadent; Virtuso Flowable, DenMat) в качестве вкладыша для полости, даже если эти продукты не предназначены для этой цели.Вместо этого он рекомендует использовать выделяющий фтор материал. 59 По словам производителей, многие текучие смолы выделяют фторид. Однако сообщалось, что любое высвобождение фторида невелико, и что скорость неуклонно и значительно снижается в течение первых 3 недель. 60
За последние несколько лет были представлены новые полимеризационные лампы. Было показано, что некоторые из этих огней имеют ограниченную способность полимеризовать некоторые полимерные продукты.Некоторые продукты требуют большего времени для отверждения, чем предлагают производители. Таким образом, практика использования узкоспектральных источников света, включая большинство светодиодных ламп, должна подтверждать совместимость используемого света и смолы. 61
ЦЕМЕНТОВ
Процесс выбора подходящего цемента / фиксирующих материалов может быть осложнен тем фактом, что некоторые описания продукта могут вводить в заблуждение. Например, в названии некоторых продуктов есть слова «цемент для футеровки», даже если продукт не предназначен для использования в качестве цемента.Другие называются цементами (в частности, когда речь идет о стеклоиономерах), даже если продукт предназначен для использования в качестве реставрационного материала, а не в качестве фиксирующего агента. Поэтому клиницисты должны быть осторожны при выборе нового продукта и делать свой выбор на основе предполагаемого использования продукта, а не его названия.
Цементы служат для фиксации реставраций или приспособлений в фиксированном положении во рту. 19 Зубной цемент, также известный как фиксирующий агент, действует как барьер против микроподтекания, герметизируя границу раздела между зубом и реставрацией и удерживая их вместе с помощью некоторой формы крепления.Это приспособление механическое, химическое или их комбинация. 37
Стоматологические цементы могут рассматриваться как временные, краткосрочные или слабые, или они могут быть названы постоянными, долгосрочными, окончательными или прочными. Стоматологические цементы показаны только при работе с несъемными протезами. Лаки нельзя использовать в качестве цемента.
Ниже приводится обсуждение типов цемента / фиксирующих материалов.
Гидроксид кальция
Продукты гидроксида кальция (например, Dycal, DENTSPLY Caulk; Life, Kerr) доступны как в светоотверждаемом, так и в самоотверждаемом вариантах.Хотя эти продукты обычно не считаются цементом, они являются идеальным временным цементом. Это связано с тем, что материал легко наносится, легко очищается с краев временных или постоянных коронок, позволяет легко снимать временные коронки и не содержит эвгенола (который может мешать окончательному цементированию на основе смолы).
Светоотверждаемые разновидности CaOH не рекомендуются в качестве временных цементов для отливок или временных коронок, поскольку свет полимеризации не достигает материала.
Оксид цинка Эвгенол /
Неугенол оксид цинка
Из 4 существующих типов ZOE только 2 предназначены для цементирования. Тип I считается временным или краткосрочным цементом (например, Tempbond, Kerr), а тип II — постоянным или окончательным цементом (например, Fynal, DENTSPLY / Caulk).
Имеются сообщения о том, что материалы ZOE оказывают неблагоприятное воздействие на продукты на основе смол.62,63 Другие данные не подтверждают этот вывод.64 Замена эвгенола карбоновой кислотой приводит к получению неугенольного оксида цинка (не-ZOE). формула.В отличие от ZOE, эти продукты не оказывают седативного действия на пульпу. По сравнению с продуктами ZOE, продукты других производителей медленнее схватываются и не размягчают временные акриловые коронки.19 Тем не менее, Кристенсен заявляет, что потребность в неугенольных оксидных материалах цинка (например, NoMix, Centrix; Prevision, Heraeus Kulzer) до Необходимость окончательной фиксации смоляным цементом не подтверждена. 65
В настоящее время ZOE не популярен как окончательный цемент, но популярен как временный цемент. То же самое нельзя сказать о материалах сторонних производителей, поскольку они могут использоваться как для временной, так и для окончательной фиксации.
Фосфат цинка
Удерживание при использовании фосфата цинка в основном связано с физическим взаимодействием, а не с химической реакцией. Следовательно, любое покрытие, нанесенное на поверхность зуба для защиты пульпы, уменьшит ретенцию. Исследование, проведенное Джонсоном и соавторами66, показало, что использование герметика из смолы с ZOP снижает остаточное напряжение отливки на 42%. Послеоперационный дискомфорт, связанный с использованием ZOP, вероятно, связан с плохой герметизирующей способностью этого материала.
ZOP (например, цемент Fleck’s, Mizzy) следует отпускать, когда материал готов к использованию. Если материал распределяется и остается открытым перед использованием, вода испарится из жидкого компонента (то же самое верно для всех цементов на водной основе). В результате получается слишком вязкий материал, что затрудняет посадку отливок. Потеря воды также может увеличить время схватывания продукта.
Было предложено нанести лак или другое непроницаемое покрытие по краям отливок, чтобы фосфат цинка созрел и, таким образом, развил повышенную устойчивость к растворению жидкостями полости рта.Это должно быть сделано после того, как излишки цемента будут удалены с полей.20
Что касается способности ZOP противостоять микроподтеканию, исследования не являются окончательными. Было показано, что фосфат цинка обеспечивает наибольшую микропротекание по сравнению с другими типами фиксирующих агентов, но также было показано, что он эффективен в сопротивлении микроподтеканию.67,68
Как упоминалось ранее, ZOP имеет долгую историю использования в стоматологии. Фактически, более 100 лет назад были представлены продукты из фосфата цинка, содержащие 7% оксида меди.Причиной добавления оксида меди было то, что медный компонент делает материал бактерицидным. Изначально медь придавала материалу красновато-коричневый цвет, что делало его непригодным для использования с современными неметаллическими реставрациями. Медный цемент теперь доступен в двух цветах: оригинальном и белом (Doc’s Best Copper Cement, Cooley & Cooley).
Поликарбоксилат цинка
Материалы из поликарбоксилата цинка доступны уже около 30 лет.Жидкость содержит полиакриловую кислоту (которая делает ее вязкой), и при добавлении к порошку она может образовывать смесь с большей толщиной пленки. Следовательно, если не смешать должным образом, вязкость может помешать полной посадке отливок.69 Поликарбоксилаты также известны как псевдопластики, что означает, что материал, при смешивании до нужной вязкой консистенции, все равно будет стекать обратно под собственным весом. .19 В некоторые продукты ZPC добавлен фторид олова с целью уменьшить толщину пленки.
ZPC (например, поликарбоксилат с Hy-связью, Shofu; Livcarbo, GC America) изначально имеют pH около 1,7 (из-за кислоты). При смешивании с порошком pH быстро повышается до нейтрального. Этот тип материала имеет эластичную консистенцию при схватывании, поэтому любые излишки следует удалять только после того, как цемент полностью схватится. Удаление до полной сборки может привести к разрыву материала из-под края. Это приведет к образованию зазора на границе восстановления зуба.
При использовании ZPC клиницист должен знать, что граница раздела цемент-отливка — это место, где может произойти отказ (ZPC химически прилипает к зубу). Это контрастирует с ZOP, где контакт цемент-зуб является местом, где может произойти отказ.17
Li и White показали, что по сравнению с другими фиксирующими агентами модуль упругости поликарбоксилатов (и стеклоиономеров) со временем увеличивается70.
Стеклянные иономеры
МатериалыGI можно использовать в качестве цементирующих агентов, а также в качестве облицовки или основы.Некоторые из этих продуктов содержат гидрофильный мономерный компонент. Эти материалы затем называют стеклоиономерами, армированными смолой или модифицированными смолами.12 Стеклоиономерный цемент, модифицированный смолой (например, FujiCem, GC America), имеет дополнительное преимущество в виде выделения фтора (особенно важно для пациентов с повышенным риском кариеса). умеренная прочность и простота использования. 71 GI также можно использовать в качестве ортодонтического цемента. Преимущество в этой ситуации состоит в том, что из-за выделения фтора материал минимизирует декальцинацию, связанную с ортодонтическими приспособлениями.Выделяющийся фторид в GI можно заменить. Этого можно добиться с помощью зубных паст, гелей для местного применения и ополаскивателей для рта. Фторидные гели являются наиболее эффективным средством замещения фторидов.72,73
Следует соблюдать осторожность при использовании GI в качестве цемента, особенно когда края несъемных протезов чувствительны к контакту с влагой во время установки. Известно, что материалы GI чувствительны к влаге и должны быть защищены от попадания воды и слюны в течение как минимум 15 минут после размещения.74 Также было предложено использовать полимерный клей в качестве агента для защиты поверхности для уменьшения маргинальной микроподтекания во время начального периода схватывания.75
Сообщалось, что материалы на основе стеклоиономеров (которые являются гидрофильными) расширяются при контакте с водой. Следовательно, краевое уплотнение отливок, замазанных этими материалами, может быть улучшено за счет этого гигроскопического расширения и может также продемонстрировать большую прочность сцепления.76 Однако это расширение является наиболее вероятной причиной разрушения цельнокерамических реставраций, замазанных стеклоиономерным цементом и может объяснить, почему некоторые производители разрабатывают цементы GI с более низкими характеристиками расширения.77 Кроме того, цементы GI обладают значительно меньшей растворимостью, чем цементы из фосфата цинка или поликарбоксилата цинка.78
Как упоминалось ранее, стеклоиономерные продукты доступны в версиях с ручным смешиванием (например, CX-Plus Glasionomer Cement, Shofu), инкапсулированными (например, Vivaglass, Ivoclar Vivadent) и картриджами (например, RelyX Luting Plus, 3M ESPE). . Было показано, что составы, смешанные вручную, обладают значительно большей прочностью на сжатие.79
Смола
Поскольку смолы доступны в виде самоотверждаемых материалов, светоотверждаемых материалов или материалов двойного отверждения, их можно использовать в качестве цемента или фиксирующего агента как на временной (краткосрочной), так и на постоянной (окончательной) основе.Кроме того, поскольку эти материалы окрашены в цвет зубов и доступны во многих оттенках, они хорошо подходят для фиксации эстетических реставраций. Благодаря своей способности связываться со структурой зуба, они могут использоваться в ситуациях, связанных с неидеальными препаратами. Фактически, при использовании временного полимерного цемента (например, TNE Noneugenol Temporary Cement, Temrex) иногда может быть трудно удалить временную реставрацию.
Продукты химического отверждения (например, Multilink Universal Luting Cement, Ivoclar Viva-dent) имеют короткое время работы, так как материал начинает схватываться при смешивании.Однако их можно использовать под металлическую, полимерную или керамическую реставрацию независимо от ее толщины. Светоотверждаемые продукты (например, IntegraCem, Premier) подвергаются фотоинициированию и имеют большее время работы. Это снижает эффект потемнения, наблюдаемый при использовании самоотверждаемых материалов. Эти продукты необходимо защищать от окружающего света в период между выдачей и использованием. Продукты двойного отверждения (например, Permacem, Zenith /
DMG) идеальны, когда необходимо замазать толстую или непрозрачную реставрацию (полимеризационная лампа не проникает дальше 4.0 мм). При использовании этих цементов клиницист может отверждать свет на краю и, таким образом, удерживать реставрацию на месте, в то время как остаток цемента, до которого не может добраться свет для полимеризации, затвердевает80
Что касается микроподтекания, было проведено сравнение кислотно-щелочного цемента и полимерного цемента. Смоляной цемент показал значительно меньшую микроподтекание, чем другие фиксирующие агенты.81
Некоторые врачи считают, что адгезивная стоматология не может быть проведена на зубе, обработанном материалом на основе ZOE.Однако есть сообщения, которые опровергают это. 82,83 Кроме того, при цементировании штифта смоляные цементы изначально являются наиболее удерживающими, хотя со временем ZOP становится сильнее. Это приписывают оставшемуся незакрепленным герметиком корневого канала или эвгенолу в герметике, который остается в канале.84 Эти авторы продолжают объяснять, что если пространство для штифта создается во время обтурации, то, вероятно, не имеет значения, какой тип цемента. Однако, если штифтовое пространство создается месяц или более позже, следует избегать использования полимерного цемента для постцементации, потому что эвгенол проник в дентин, и это будет мешать схватыванию полимерного цемента.Эти трудности с последующей цементацией с использованием полимерных цементов также могут быть связаны с напряжениями от усадки при полимеризации и проблемами с адекватным доступом к корневому каналу. Они затрудняют образование высокопрочных связей при цементировании столбов полимерным цементом.85
Кроме того, важно отметить, что опорные зубы, очищенные с помощью профилактического стакана и пемзовой муки, имеют наименьшее количество остаточного временного цемента.86 Применение геля гипохлорита натрия после травления фосфорной кислотой устраняет ингибирующее влияние остатков временного цемента на адгезию. между смоляным цементом и дентином.87
Ряд производителей называют свои цементы двойного отверждения «универсальными» фиксаторами. Проблема здесь в том, что не все товары соответствуют этому описанию. Фактически, было показано, что выбор двойного полимеризованного цемента должен основываться на его предполагаемом использовании, поскольку не все продукты полимеризуются адекватно в каждой клинической ситуации.88 Напротив, в другом отчете сделан вывод, что цементы двойного отверждения продемонстрировали наилучшие результаты. сочетание механических и физических свойств.89
Поскольку полимерные цементы имеют цвет зуба, клиницисты должны обязательно удалить излишки цемента с края, так как оставшийся цемент может усилить удержание зубного налета.Субклиническая ретенция цемента действительно возникает после цементирования коронки, и это зависит от множества факторов, включая морфологию зуба.90
Обсуждение
Помимо выбора подходящих материалов для данной клинической ситуации, важно правильно использовать эти материалы. Все новые работники кафедры должны быть проверены на предмет их знания цемента, и все должны быть осведомлены о любом новом цементе, вводимом в практику. Если у человека возникают проблемы со смешиванием продукта вручную, следует определить, доступен ли этот продукт в другой системе доставки, например в инкапсулированной форме (которую можно растирать).Кроме того, при цементировании реставрации следует проверить окклюзию сразу после установки и при необходимости исправить. Некоторые цементы схватываются быстро, что затрудняет снятие отливки. Персонал должен не забывать проверять время растирания до и после использования этих продуктов, так как время растирания может отличаться от времени растирания амальгамы.
Клиницисты отметили увеличение количества продуктов, которые были упакованы в капсулы и картриджи / шприцы для автоматического смешивания (например, TempAd-vantage, GC America) из-за простоты их использования.Этот формат не требует разбрызгивания, упрощает очистку и обеспечивает равное дозирование всех компонентов. Кроме того, недавно появились самопротравливающиеся полимерные цементы (например, Embrace Wetbond Universal Resin Cement, Pulp -dent; RelyX Unicem, 3M ESPE). Первоначально было показано, что эти продукты снижают степень послеоперационной чувствительности, связанной с цементацией.91 Еще одним преимуществом этих продуктов является простота использования. Для клинициста требуется меньше клинических шагов, поскольку все необходимые материалы включены в сам цемент.
Заключение
Материалы футеровки, основы и цемента постоянно меняются. Клиницисты обязаны быть в курсе, читая литературу, чтобы подходящие материалы были выбраны для конкретных клинических ситуаций. F
Список литературы
1. Аса Р. Стоматологические материалы уже не те, что были раньше. AGD Impact. 2004; 32: 10-13.
2. Вайнер Р.С., Вайнер Л.К., Кугель Г. Обучение использованию оснований и вкладышей: обзор стоматологических школ Северной Америки.J Am Dent Assoc. 1996; 127: 1640-1645.
3. Cox CF, Suzuki S. Переоценка защиты пульпы: прокладки из гидроксида кальция в сравнении с когезионной гибридизацией. J Am Dent Assoc. 1994; 125: 823-831.
4. Стэнли HR, Going RE, Chauncey HH. Реакция пульпы человека на кислотную обработку дентина и композитную реставрацию. J Am Dent Assoc. 1975; 91: 817-825.
5. Cox CF, Keall CL, Keall HJ, et al. Биосовместимость стоматологических материалов с запечатанной поверхностью и обнаженной пульпы. J Prosthet Dent.1987; 57: 1-8.
6. Ватт А, Патерсон RC. Бактериальное заражение как фактор, влияющий на токсичность материалов для обнаженной пульпы зуба. Oral Surg Oral Med Oral Pathol. 1987; 64: 466-474.
7. Браннстрем М. Этиология гиперчувствительности дентина. Proc Finn Dent Soc. 1992; 88 (приложение 1): 7-13.
8. Мерион SD. Метод модельной полости с добавлением дентина. Инт Эндод Дж. 1988; 21: 79-84.
9. Кэмпс Дж., Дежу Дж., Ремусат М. и др. Факторы, влияющие на реакцию пульпы на реставрацию полостей.Dent Mater. 2000; 16: 432-440.
10. Мюррей П.Е., Хафез А.А., Смит А.Дж. Бактериальное протекание и воспаление пульпы, связанное с использованием различных реставрационных материалов. Dent Mater. 2002; 18: 470-478.
11. Идет RE. Лайнеры для кариеса и обработка дентина. J Am Dent Assoc. 1964; 69: 416-422.
12. Anusavice KJ, Phillips RW, eds. Филлиповская наука о стоматологических материалах. 11-е изд. Сент-Луис, Миссури: У. Б. Сондерс; 2003.
13. Watts A, Paterson RC. Бактериальное заражение как фактор, влияющий на токсичность материалов для обнаженной пульпы зуба.Oral Surg Oral Med Oral Pathol. 1987; 64: 466-474.
14. Сетиен В.Дж., Кобб Д.С., Денехи Г.Е. и др. Устройства для препарирования полости: влияние на микроподтекание композитных реставраций на основе смолы класса V. Am J Dent. 2001; 14: 157-162.
15. Кугель Г. Классификация и применение альтернатив цементирования. Подпись. 1997; 4: 8-11.
16. Фарах Дж. Временные цементы. Стоматологический консультант. 1998; 15 (9): 2.
17. Баум Л., Филлипс Р. В., Лунд MR. Учебник оперативной стоматологии.3-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс; 1995: 117.
18. Ферракан JL. Материалы в стоматологии: принципы и применение. 2-е изд. Нью-Йорк, Нью-Йорк: Липпинкотт Уильямс и Уилкинс; 2001: 60.
19. Craig RG, Powers JM, eds. Реставрационные стоматологические материалы. 11-е изд. Сент-Луис, Миссури: Мосби; 2001: 623.
20. Филипс RW. Наука Скиннера о стоматологических материалах. 9 изд. Филадельфия, Пенсильвания: У. Б. Сондерс; 1991: 445.
21. Эндрюс Дж. Т., Хембри Дж. Мл. Предельная утечка амальгамных сплавов с высоким содержанием меди: лабораторное исследование.Oper Dent. 1980; 5: 7-10.
22. Бельтран-Агилар Э.Д., Гольдштейн Д.В., Локвуд С.А. Лаки фторсодержащие. Обзор их клинического использования, кариостатического механизма, эффективности и безопасности. J Am Dent Assoc. 2000; 131: 589-596.
23. von der Fehr FR. Распространенность кариеса в странах Северной Европы. Инт Дент Дж. 1994; 44 (4 доп. 1): 371-378.
24. Левинштейн И., Фюрер Н., Ганор Ю. Влияние фторидного лака на подтекание края и удержание фиксированных временных коронок. J Prosthet Dent.2003; 89: 70-75.
25. Шен К., Аутио-Голд Дж. Оценка однородности концентрации фторида и выделения фторида из трех лаков. J Am Dent Assoc. 2002; 133: 176-182.
26. Ян Ю.К., Чан К.С. Влияние лаков на микротвердость поверхности материалов основы. J Esthet Dent. 1991; 3: 103-105.
27. Прати С., Фава Ф, Ди Джойа Д. и др. Антибактериальная эффективность дентиновых бондинговых систем. Dent Mater. 1993; 9: 338-343.
28. Смит А.Дж., Гард С., Кэссиди Н. и др.Солюбилизация внеклеточного матрикса дентина гидроксидом кальция [аннотация]. J Dent Res. 1995; 74: 829.
29. Schuurs AH, Gruythuysen RJ, Wesselink PR. Покрытие пульпы адгезивным композитом на основе смолы по сравнению с гидроксидом кальция: обзор. Endod Dent Traumatol. 2000; 16: 240-250.
30. Андерсон Р.В., Пауэлл Б.Дж., Пэшли Д.Х. Микропротечка ИРМ, используемая для восстановления препаратов эндодонтического доступа. Endod Dent Traumatol. 1990; 6: 137-141.
31. Берри К. В., Миллер Б. Х., Миллер А. В. и др.Антибактериальная активность стоматологических цементов. J Dent Res. 1999; 78: Реферат 966.
32. Abou Hashieh I, Camps J, Dejou J, et al. Распространение эвгенола через дентин связано с его гидравлической проводимостью. Dent Mater. 1998; 14: 229-236.
33. Hume WR. Фармакологические и токсикологические свойства оксида цинка-эвгенола. J Am Dent Assoc. 1986; 113: 789-791.
34. Cox CF. Биосовместимость стоматологических материалов при отсутствии бактериальной инфекции. Oper Dent. 1987; 12: 146-152.
35. Weiner RS. Вкладыши, основания и цементы: прочный фундамент. Gen Dent. 2002; 50: 442-446.
36. Арвайлер Н.Б., Auschill TM, Reich E. Эффективно ли предварительная обработка полостей способствует хорошей краевой адаптации стеклоиономерных цементов? J Adhes Dent. 2000; 2: 289-295.
37. Диас-Арнольд AM, Варгас MA, Haselton DR. Текущее состояние фиксирующих агентов для несъемного протезирования. J Prosthet Dent. 1999; 81: 135-141.
38. Донли К.Дж., Сегура А., Канеллис М. и др.Клинические характеристики и подавление кариеса реставраций из модифицированного смолой стеклоиономерного цемента и амальгамы. J Am Dent Assoc. 1999; 130: 1459-1466.
39. Jang KT, Garcia-Godoy F, Donly KJ, et al. Реминерализующее действие стеклоиономерных реставраций на прилегающий межзубный кариес. ASDC J Dent Child. 2001; 68: 125-128, 142.
40. Прати С., Фава Ф, Ди Джоя Д. и др. Антибактериальная эффективность дентиновых бондинговых систем. Dent Mater. 1993; 9: 338-343.
41.Толидис К., Нобекорт А., Рэндалл Р.К. Влияние модифицированной смолой стеклоиономерной футеровки на объемную полимеризационную усадку различных композитов. Dent Mater. 1998; 14: 417-423.
42. Рикеттс Д. Лечение глубокого кариозного поражения и дентинового комплекса витальной пульпы. Бр Дент Дж. 2001; 191: 606-610.
43. do Nascimento AB, Fontana UF, Teixeira HM, et al. Биосовместимость модифицированного смолой стеклоиономерного цемента, применяемого в качестве покрытия пульпы в человеческих зубах. Am J Dent. 2000; 13: 28-34.
44. Glasspoole EA, Erickson RL, Davidson CL. Влияние обработки поверхности на прочность связи стеклоиономеров с эмалью. Dent Mater. 2002; 18: 454-462.
45. Awliya WY, Akpata ES. Влияние флюороза на прочность сцепления реставрационных материалов на основе стеклоиономеров с дентином на сдвиг. J Prosthet Dent. 1999; 81: 290-294.
46. Periera PN, Okuda M, Sano H, et al. Влияние внутренней влажности и региональных различий на прочность сцепления с дентином. Dent Mater. 1999; 15: 46-53.
47. Кониси Н., Ватанабэ Л.Г., Хилтон Дж. Ф. и др. Прочность дентина на сдвиг: влияние расстояния от пульпы. Dent Mater. 2002; 18: 516-520.
48. Тай FR, Пэшли DH. Дентиновые адгезивы стали слишком гидрофильными? J Can Dent Assoc. 2003; 69: 726-731.
49. Peutzfeldt A, Vigild M. Обзор использования дентиновых бондинговых систем в Дании. Dent Mater. 2001; 17: 211-216.
50. Имазато С. Антибактериальные свойства композитов на основе смол и систем бондинга дентина.Dent Mater. 2003; 19: 449-457.
51. Хаган К., Дэвис А., Белчер М. и др. Микроподтекание реставраций II класса. J Dent Res. 2003; 82: Реферат 933.
52. Веттрейно Дж., Неме А., Пинк Ф. и др. Влияние обработки полости на утечку амальгамы in vitro. J Dent Res. 2003; 82: Реферат 1322.
53. Зидан О., Абдель-Керием У. Влияние адгезии амальгамы на жесткость зубов, ослабленных препарированием полости. Dent Mater. 2003; 19: 680-685.
54.Перейра JC, Сегала AD, Коста CA. Реакция пульпы человека на прямое покрытие пульпы адгезивной системой. Am J Dent. 2000; 13: 139-147.
55. Chen RS, Liu CC, Tseng WY, et al. Цитотоксичность трех агентов, связывающих дентин, на клетки пульпы зуба человека [опубликованная поправка опубликована в J Dent. 2003; 31 (7): 519]. J Dent. 2003; 31 (3): 223-229.
56. Bayne SC, Thompson JY, Swift EJ Jr, et al. Характеристика текучих композитов первого поколения. J Am Dent Assoc. 1998; 129: 567-577.
57. Bergenholtz G, Cox CF, Loesche WJ, et al. Протекание бактерий вокруг зубных реставраций: влияние на пульпу зуба. J Oral Pathol. 1982; 11: 439-450.
58. Гордан В., Шен С., Майор И. Ремонт краевых зазоров текучим композитом: где слабое звено? J Dent Res. 2003; 82: Резюме 441.
.59. Christensen GJ. Прямые реставрационные материалы. Что куда? J Am Dent Assoc. 2003; 134: 1395-1397.
60. Информационный бюллетень CRA Руководство клинициста по стоматологическим продуктам и методам.2002; 26 (10): 4.
61. Информационный бюллетень CRA. Руководство клинициста по стоматологическим продуктам и методам. 2003; 27 (6): 2.
62. Дилтс В.Е., Миллер Р.К., Миранда Ф.Дж. и др. Влияние оксида цинка и эвгенола на прочность сцепления при сдвиге выбранных комбинаций стержень / цемент. J Prosthet Dent. 1986; 55: 206-208.
63. Миллштейн П.Л., Натансон Д. Влияние эвгенола и эвгеноловых цементов на отвержденную композитную смолу. J Prosthet Dent. 1983; 50: 211-215.
64. Лейрскар Дж., Нордбо Х.Влияние оксида цинка-эвгенола на прочность скрепления при сдвиге в обычно используемой системе скрепления. Endod Dent Traumatol. 2000; 16: 265-268.
65. Christensen GJ. Сделать временные реставрации простыми, предсказуемыми и экономичными. J Am Dent Assoc. 2004; 135: 625-627.
66. Johnson GH, Hazelton LR, Bales DJ и др. Влияние герметика на основе смолы на ретенцию коронки для трех типов цемента. J Prosthet Dent. 2004; 91: 428-435.
67. Линдквист Т.Дж., Коннолли Дж.In vitro микроподтекание фиксирующих цементов и материала основы коронки. J Prosthet Dent. 2001; 85: 292-298.
68. Коулман А.Дж., Моисей М.С., Рикерби Х.Х. Макромолекулярная утечка под цельнолитыми коронками: двухлетнее исследование in vitro. J Prosthet Dent. 2001; 85: 20-25.
69. Белый СН. Адгезивные цементы и цементация. J Calif Dent Assoc. 1993; 21: 30-37.
70. Li ZC, Белый SN. Механические свойства зубных фиксирующих цементов. J Prosthet Dent. 1999; 81: 597-609.
71. Информационный бюллетень CRA Руководство клинициста по стоматологическим продуктам и методам. 2004; 29: 1.
72. Угарте Дж., Лагравере М., Реворедо Дж. И др. Эффект поглощения фторида двумя стеклоиономерными цементами и стеклоиономерным цементом, модифицированным смолой. J Dent Res. 2003; 82: Реферат 938.
73. Гао В., самцы RJ. Высвобождение / поглощение фторидов обычными и модифицированными смолами стеклоиономерами и компомерами. J Dent. 2001; 29: 301-306.
74. Mojon P, Kaltio R, Feduik D, et al.Кратковременное загрязнение фиксирующих цементов водой и слюной. Dent Mater. 1996; 12: 83-87.
75. Чуанг С.Ф., Цзинь Ю.Т., Цай П.Ф. и др. Влияние различных защитных покрытий на микроподтекание края стеклоиономерных цементов, модифицированных смолами. J Prosthet Dent. 2001; 86: 309-314.
76. Ирие М., Сузуки К. Влияние накопления воды на краевое уплотнение реставраций из стеклоиономеров, модифицированных смолой. Oper Dent. 1999; 24: 272-278.
77.CRA Newsletter Руководство клинициста по стоматологическим продуктам и методам.Февраль 1999г.
78. Hersek NE, Canay S. Растворимость трех типов цемента для фиксации in vivo. Quintessence Int. 1996; 27: 211-216.
79. Номото Р., Маккейб Дж. Ф. Влияние методов смешения на прочность на сжатие стеклоиономерных цементов. J Dent. 2001; 29: 205-210.
80. Вайнер Р. Прокладки, основы и цементы в клинической стоматологии: обзор и обновление. Вмятина сегодня. Август 2003; 22: 88-93.
81. Piemjai M, Miyasaka K, Iwasaki Y, et al. Сравнение микроподтекания трех кислотно-щелочных фиксирующих цементов и одного связанного смолой цемента для прямых композитных вкладок класса V.J Prosthet Dent. 2002; 88: 598-603.
82. Лейрскар Дж., Нордбо Х. Влияние оксида цинка-эвгенола на прочность скрепления при сдвиге в обычно используемой системе скрепления. Endod Dent Traumatol. 2000; 16: 265-268.
83. Peutzfeldt A, Asmussen E. Влияние эвгенолсодержащего временного цемента на эффективность дентиновых систем. Eur J Oral Sci. 1999; 107: 65-69.
84. Хагге М., Вонг Р., Линдермут Дж. И др. Пятикомпонентная ретенция после обтурации канала с помощью герметика на основе оксида цинка и эвгенола.J Dent Res. 2003; 82: Реферат 1277.
85. Bouillaguet S, Troesch S, Wataha JC и др. Прочность связи между адгезивными цементами и дентином корневого канала при микропластике. Dent Mater. 2003; 19: 199-205.
86. Grasso CA, Caluori DM, Goldstein GR, et al. Оценка in vivo трех методов чистки препарированных опорных зубов. J Prosthet Dent. 2002; 88: 437-441.
87. Ватанабэ Е.К., Ятани Х., Исикава К. и др. Пилотное исследование влияния кондиционера / грунтовки на адгезию смола-дентин после предварительного загрязнения цемента с использованием SEM, энергодисперсионной рентгеновской спектроскопии и мер по оценке прочности адгезии.J Prosthet Dent. 2000; 83: 349-355.
88. Caughman WF, Chan DC, Rueggeberg FA. Потенциал отверждения двойных полимеризуемых полимерных цементов в смоделированных клинических ситуациях. J Prosthet Dent. Июль 2001 г .; 86: 101-106.
89. Attar N, Tam LE, McComb D. Механические и физические свойства современных стоматологических фиксаторов. J Prosthet Dent. 2003; 89: 127-134.
90. Mitchell CA, Pintado MR, Geary L, et al. Удержание адгезивного цемента на поверхности зуба после фиксации коронки.J Prosthet Dent. 1999; 81: 668-677.
91. Информационный бюллетень CRA Руководство клинициста по стоматологическим продуктам и методам. 2004; 28 (8).
Доктор Вайнер получил DMD в Университете Тафтса в 1986 году. Он является научным сотрудником Академии общей стоматологии, Американского колледжа стоматологов и Академии Пьера Фошара. Он ведет частную практику в области семейной и косметической стоматологии в Миллисе, штат Массачусетс, с ним можно связаться по этому адресу электронной почты, защищенному от спам-ботов.У вас должен быть включен JavaScript для просмотра.
Медицинская клиника Риверсайд
КлиникаRiverside Medical Clinic находится в Броктоне, в самом центре Риверсайда. Помимо ведущих педиатров, акушеров и терапевтов, в этом кампусе есть практически любой специалист, который может понадобиться.
Кампус Brockton также предлагает неотложную помощь, самые современные возможности визуализации во Внутренней Империи, комплексные лабораторные услуги и аптеку.На территории также есть центр полного обзора. Кроме того, в этом кампусе есть наш хирургический центр, классы здоровья и фитнеса, административные офисы и наш отдел кадров.
В кампусе Brockton есть просторная парковка со множеством мест для инвалидов. Рядом с главным входом есть остановка общественного транспорта. В этом учреждении врачи и специалисты доступны с понедельника по пятницу, а служба неотложной помощи открыта 7 дней в неделю.
Для услуг для лиц с нарушениями слуха — TTY 711. Чтобы бесплатно получить доступ к языковым услугам или услугам LEP (ограниченное владение английским языком), позвоните по номеру, указанному в вашей страховой идентификационной карточке, или по телефону (951) 683-6370.
Мы находимся по адресу:
|
7117 Brockton Ave. Riverside, CA |
8:30 — 17:30 | (951) 683-6370 |
| Неотложная помощь 7117 Brockton Ave. Риверсайд, Калифорния |
пн-пт 8:00 — 21:00 сб и вс 9:00 — 21:00 |
(951) 782-3789 |
| Лаборатория |
пн-пт 7:00 — 18:00 сб 7:00 — 12:00 |
(951) 782-3637 |
| Аптека |
пн-пт 8:30 до 17:30 сб с 9:00 до 13:00 |
(951) 782-3653 |
| Медицина труда |
пн – пт с 8:00 до 17:00 | (951) 782-3709 |
| |
Будний день В нерабочее время: пн – пт 17:00 — 21:00 | |
| |
Сб и Вс 9: 00–21: 00 | |
| Обработка изображений |
пн-пт 8:00 — 21:00 сб-вс 10:00 — 21:00 | (951) 782-3720 |
| |
||
| акушерство / гинекология и дерматология 7160 Brockton Ave. 2-й этаж Риверсайд, Калифорния |
пн-пт 8:30 — 17:30 | (951) 683-6370 |
| Хирургический центр |
(951) 782-3801 | |
| |
||
| Спортивная клиника 7150 Brockton Ave.Люкс 103 Риверсайд |
(951) 321-6338 | |
| |
Извините! — Страница не найдена
Пока мы разбираемся, возможно, поможет одна из ссылок ниже.
Дом Назад- Класс
- Онлайн-тесты
- Ускоренный онлайн-курс JEE
- Двухлетний курс для JEE 2021
- Класс
- Онлайн-курс NEET
- Серия онлайн-тестов
- CA Foundation
- CA Средний
- CA Финал
- Программа CS
- Класс
- Серия испытаний
- Книги и материалы
- Тренажерный зал
- Умный взломщик BBA
- Обучение в классе
- Онлайн-коучинг
- Серия испытаний
- Взломщик Smart IPM
- Книги и материалы
- GD-PI
- CBSE, класс 8
- CBSE, класс 9
- CBSE, класс 10
- Класс 11 CBSE
- CBSE, класс 12
- Обучение в классе
- Онлайн-классы CAT
- Серия испытаний CAT
- MBA Жилой
- Умный взломщик CAT
- Книги и материалы
- Онлайн-классы без CAT
- Серия испытаний без CAT
- Тренажерный зал
- GD-PI
- Обучение в классе
- Серия испытаний
- Интервью с Civils
- Класс
- Онлайн-классы
- Серия испытаний SSC
- Переписка
- Практические тесты
- Электронные книги SSC
- SSC JE Study Package
- Класс
- RBI, класс B
- Банковский тест серии
- Переписка
- Банковские электронные книги
- Банк ПДП
- Онлайн-коучинг
- Обучение в классе
- Серия испытаний
- Книги и материалы
- Класс
- Программа моста GRE
- GMAT Онлайн-коучинг
- Консультации по приему
- Консультации по GMAT
- Стажировка
- Корпоративные программы
- Студенты колледжа
- Рабочие специалисты
- Колледжи
- Школы
Гомеостаз и клеточная функция — химия
Глава 8: Гомеостаз и клеточная функция
Этот текст опубликован под лицензией Creative Commons.Для ссылки на эту работу нажмите здесь .
8.1 Концепция гомеостаза
8,2 Болезнь как гомеостатический дисбаланс
8,3 Измерение гомеостаза для оценки здоровья
8.4 Растворимость
8,5 Концентрация раствора
8.5.1 Молярность
8.5.2 Количество частей в решениях
8.5.3 Эквиваленты
8,6 Разведения
8,7 Концентрации ионов в растворе
8.8 Движение молекул через мембрану
8.9 Резюме
8.10 Ссылки
8.1 Концепция гомеостаза
Гомеостаз относится к способности организма физиологически регулировать свою внутреннюю среду, чтобы обеспечить ее стабильность в ответ на колебания внешних или внутренних условий.Печень, поджелудочная железа, почки и мозг (гипоталамус, вегетативная нервная система и эндокринная система) помогают поддерживать гомеостаз. Печень отвечает за метаболизм токсичных веществ и с помощью сигналов от поджелудочной железы поддерживает углеводный обмен. Печень также помогает регулировать метаболизм липидов и является основным местом производства холестерина. Почки отвечают за регулирование уровня воды в крови, повторное всасывание веществ в кровь, поддержание уровней солей и ионов в крови, регулирование pH крови и выведение мочевины и других продуктов жизнедеятельности.Гипоталамус участвует в регулировании температуры тела, частоты сердечных сокращений, артериального давления и циркадных ритмов (включая циклы бодрствования / сна).
На гомеостаз могут влиять внутренние или существующие условия (внутренние факторы ) или внешние или окружающие условия ( внешние факторы ) и поддерживается множеством различных механизмов. Все механизмы гомеостатического контроля имеют как минимум три взаимозависимых компонента для регулируемой переменной:
- A датчик или приемник, который обнаруживает изменения во внутренней или внешней среде.Примером могут служить периферические хеморецепторы, которые обнаруживают изменения pH крови.
- Интегрирующий центр , , , или центр управления получает информацию от датчиков и инициирует реакцию для поддержания гомеостаза. Самый важный пример — гипоталамус, область мозга, которая контролирует все, от температуры тела до частоты сердечных сокращений, артериального давления, насыщения (сытости) и циркадных ритмов (включая циклы сна и бодрствования).
- Эффектор , , , — это любой орган или ткань, которые получают информацию от интегрирующего центра и действуют, чтобы вызвать изменения, необходимые для поддержания гомеостаза.Одним из примеров является почка, которая задерживает воду, если артериальное давление слишком низкое.
Датчики, интегрирующий центр и эффекторы являются основными компонентами каждого гомеостатического ответа. Положительная и отрицательная обратная связь — более сложные механизмы, которые позволяют этим трем основным компонентам поддерживать гомеостаз для более сложных физиологических процессов.
Отрицательная обратная связь
Отрицательная обратная связь Механизмы используют один из продуктов реакции для снижения производительности или активности процесса с целью возврата органа или системы к нормальному диапазону функционирования.Большинство гомеостатических процессов используют регулирование с отрицательной обратной связью для поддержания определенного параметра в пределах диапазона уставки, который поддерживает жизнь. Рис. 8.1. Однако следует отметить, что процессы отрицательной обратной связи также используются для других процессов, которые не являются гомеостатическими.
В области гомеостаза регулирование температуры является хорошим примером использования отрицательной обратной связи. Нервные клетки (датчики) передают информацию о температуре тела в гипоталамус (интегрирующий центр). Затем гипоталамус подает сигнал нескольким эффекторам вернуть температуру тела до 37 o ° C (заданное значение).При слишком высокой внутренней температуре в процессе активируются два эффектора: потовые железы, которые служат для охлаждения кожи, и кровеносные сосуды, которые подвергаются расширению сосудов (или расширению), чтобы тело могло выделять больше тепла. Как только внутренняя температура вернется в нормальный диапазон, датчик отправит отрицательные сообщения обратной связи в центр интеграции, чтобы остановить процесс (т.е. выключить потовые железы и предотвратить дальнейшее расширение сосудов). Как внутренние, так и внешние события могут вызывать механизмы отрицательной обратной связи.Два приведенных выше примера представляют внутренние механизмы, используемые для возврата тела в нормальный температурный диапазон. Однако мы также можем обеспечить охлаждение тела внешними факторами, такими как снятие теплой шапки и перчаток или наливание стакана прохладной воды на голову. Как внешние, так и внутренние механизмы охлаждения могут возвращать температуру тела в нормальный диапазон и вызывать отрицательную обратную связь. Точно так же, если температура тела ниже заданного значения, мышцы дрожат, выделяя тепло, а сужение кровеносных сосудов помогает телу сохранять тепло.
Гомеостатические процессы очень сложны, потому что уставка или нормальный диапазон могут изменяться в зависимости от обстоятельств. Например, гипоталамус может изменять заданную температуру тела, например повышать ее во время лихорадки, чтобы помочь бороться с инфекцией.
Рис. 8.1. Гомеостатическое регулирование температуры у человека. Внутренняя температура тела поддерживается на нормальном заданном уровне 37 o C. Если внутренняя температура поднимается выше (правая сторона) или опускается ниже (левая сторона) заданного значения, инициируются внутренние биологические реакции, чтобы вернуть внутреннюю температуру обратно. в заданный диапазон.Как только это будет достигнуто, запускаются петли отрицательной обратной связи, чтобы снизить внутренние биологические реакции, чтобы внутренняя температура не превышала требуемого изменения.
Этот рисунок взят из: Академия Кана
Положительный отзыв
Положительная обратная связь — это механизм, в котором активированный компонент усиливает или дополнительно активирует процесс, который вызвал сам себя, чтобы создать еще более сильный ответ.Механизмы положительной обратной связи предназначены для ускорения или усиления вывода, создаваемого уже активированным стимулом. Механизмы положительной обратной связи предназначены для вывода уровней за пределы нормального диапазона и не так часто используются в гомеостатических реакциях. Для достижения положительной обратной связи серия событий запускает каскадный процесс, который усиливает действие стимула.
Примером петли положительной обратной связи является каскад свертывания крови, который первоначально инициируется внешним повреждением сосудистой сети (Рисунок 8.2). Во время события повреждения внешние факторы запускают каскад свертывания крови. Белки, участвующие в этом процессе, обычно остаются неактивными, поскольку производятся в гораздо большей форме, чем требуется. Чтобы активировать белок, белок нужно расщепить на более мелкий активный комплекс. Когда белок находится в большом неактивном состоянии и расщепляется с образованием активного компонента, он называется зимогеном . Каскад свертывания крови содержит много зимогенов.Первым активируемым зимогеном является фактор X. Когда фактор X расщепляется, он становится активным и переходит к расщеплению следующей нижестоящей мишени, Протромбина II. Это производит активный компонент, тромбин IIa, который имеет множество эффектов. Во-первых, он расщепляет белок фибриноген с образованием фибрина. Затем фибрин начинает образовывать комплекс свертывания крови сам с собой. Это называется свободной ячеистой сетью. Активированный тромбин IIa также расщепляет неактивную форму фактора XIII. Активированный фактор XIIIa вызывает образование поперечных связей в рыхлой ячеистой сети, создавая окончательную стабильную сетку, которая формирует сгусток крови.Чтобы еще больше ускорить этот процесс, тромбин IIa также имеет два положительных эффекта обратной связи. Он также может расщеплять неактивный фактор X, создавая больше активированного фактора X и, в конечном итоге, более активированного Throbmin IIa. Он также увеличивает активность внутреннего каскада свертывания крови, который дополнительно усиливает активацию фактора X.
Рис. 8.2. Механизм положительной обратной связи каскада свертывания крови. Внешние факторы, такие как повреждение или травма, активировали расщепление зимогенных белков в каскаде свертывания крови.Активация зимогена, тромбина IIa, начинает формирование фибриновой сети свертывания, а также вызывает положительную обратную связь, которая дополнительно активирует весь каскад свертывания.
Этот рисунок адаптирован из: MPT-Matthew
Многие параметры регулируются в организме в пределах узкого гомеостатического окна для поддержания надлежащего функционирования и баланса в биологических системах. Некоторые примеры гомеостатических параметров включают:
Температура
Люди теплокровные или эндотермические , поддерживающие почти постоянную температуру тела.Терморегуляция — важный аспект гомеостаза человека. Тепло в основном вырабатывается печенью и мышечными сокращениями. Люди смогли адаптироваться к большому разнообразию климатов, включая жаркую влажную и жаркую засушливую среду. Высокие температуры создают серьезную нагрузку на человеческий организм, создавая большую опасность получения травм или даже смерти. Чтобы справиться с этими климатическими условиями, люди разработали физиологические и культурные способы адаптации. Когда внутренняя температура достигает предела 45 ° C (113 ° F), возникает гипертермия , состояние, при котором температура тела человека повышается сверх нормы, и клеточные белки денатурируют, что приводит к остановке метаболизма и, в конечном итоге, к смерти. Гипотермия — обратное состояние, при котором внутренняя температура тела падает ниже гомеостатических норм. Гипотермия возникает, когда внутренняя температура тела опускается ниже 35,0 ° C (95,0 ° F). Симптомы зависят от температуры. При умеренном переохлаждении наблюдается дрожь и спутанность сознания. При умеренном переохлаждении прекращается дрожь и усиливается спутанность сознания. При сильном переохлаждении может наблюдаться парадоксальное раздевание, при котором человек снимает одежду, а также повышенный риск остановки сердца.Гипотермия имеет два основных типа причин. Обычно это происходит от сильного холода. Это также может произойти из-за любых условий, которые уменьшают выработку тепла или увеличивают теплопотери. Обычно это включает алкогольную интоксикацию, но также может включать низкий уровень сахара в крови, анорексию и пожилой возраст.
Утюг
Железо — незаменимый элемент для человека. Контроль над этим необходимым, но потенциально токсичным веществом — важная часть многих аспектов здоровья и болезней человека.Гематологов особенно интересовала система метаболизма железа, потому что железо необходимо для красных кровяных телец. Фактически, большая часть железа в организме человека содержится в белке гемоглобина эритроцитов, где он помогает связывать и транспортировать кислород для клеточного дыхания, а дефицит железа является наиболее частой причиной анемии.
Когда уровень железа в организме слишком низкий, в эпителии двенадцатиперстной кишки (слизистой оболочке тонкой кишки) снижается содержание гормона, чувствительного к железу, называемого гепсидином.Это вызывает повышение активности ферропортина, железоселективного белкового канала, встроенного в мембрану клеток кишечника. Активация этого канала стимулирует поглощение железа пищеварительной системой. Избыток железа будет стимулировать обратный процесс.
Сахар
Уровень глюкозы в крови регулируется двумя гормонами, инсулином и глюкагоном , оба высвобождаются из поджелудочной железы.
Когда уровень сахара в крови становится слишком высоким, поджелудочная железа выделяет инсулин.Глюкоза или сахар поглощается клетками (особенно печенью и мышечной тканью), где хранится в виде гликогена. Это приводит к снижению уровня сахара в крови. С другой стороны, когда уровень сахара в крови становится слишком низким, поджелудочная железа выделяет глюкагон. Он способствует расщеплению гликогена на мономеры глюкозы в клетках печени. Затем клетки печени высвобождают свободную глюкозу обратно в кровоток и восстанавливают уровень сахара в крови.
Неправильное функционирование глюкагона приводит к гипогликемии , состоянию, при котором уровень сахара в крови слишком низкий.Это может быть опасно для жизни, приводя к коме и смерти, если не лечить вовремя. Неправильная функция инсулина приводит к гипергликемии или повышению уровня сахара в крови. Если это состояние затягивается, развивается болезнь, называемая диабетом. Более подробно диабет будет рассмотрен ниже в разделе 8.2.
Осморегуляция
Осморегуляция — это активное регулирование осмотического давления жидкостей организма для поддержания гомеостаза содержания воды в организме; то есть он не дает жидкостям организма становиться слишком разбавленными или слишком концентрированными.Осмотическое давление — это мера тенденции воды переходить из одного раствора в другой посредством осмоса. Чем выше осмотическое давление раствора, тем больше воды хочет войти в раствор.
Почки используются для удаления избыточных ионов (таких как Na + , K + и Ca 2+ ) из крови, тем самым влияя на осмотическое давление. Затем они выводятся в виде мочи. Почки также важны для поддержания кислотно-щелочного уровня, так что pH крови остается близким к нейтральной точке.
Объем воды
Почки также определяют общий объем воды в организме. Гормоны антидиуретический гормон (АДГ), также известные как вазопрессин, и альдостерон играют важную роль в регулировании функции почек.
- Если в организме наблюдается дефицит жидкости , будет увеличиваться секреция АДГ из гипофиза. Затем этот гормон перемещается в дистальные канальцы или собирающие протоки почек, вызывая задержку жидкости и снижение диуреза.Точно так же гормон альдостерон, минеральный кортикоидный гормон со стероидной основой, секретируется корой надпочечников. Альдостерон заставляет почки реабсорбировать Na + . При повторной абсорбции Na + вода также реабсорбируется. Таким образом, удерживание Na + также приводит к удержанию жидкости (рис. 8.3).
- И наоборот, если уровень жидкости составляет чрезмерно , секреция гормона (альдостерона) подавляется, что приводит к меньшей задержке жидкости почками и последующему увеличению объема продуцируемой мочи.
Рис. 8.3. Влияние альдостерона и АДГ на функцию почек. Когда уровень жидкости в организме низкий, АДГ (вазопрессин) секретируется гипофизом, а альдостерон секретируется надпочечниками. АДГ снижает потерю воды, тогда как альдостерон увеличивает реабсорбцию Na + в собирательном канале почек. Вода реабсорбируется с Na +, вызывая увеличение задержки жидкости и снижение диуреза.
Эта цифра была изменена по материалам EEOC и Wikimedia Commons.
Гемостаз
Гемостаз — это процесс остановки кровотечения. Основная часть этого — каскад коагуляции, показанный на Рисунке 8.2.
Накопление тромбоцитов вызывает свертывание крови в ответ на разрыв или разрыв оболочки кровеносных сосудов. В отличие от большинства механизмов контроля в организме человека, гемостаз использует положительную обратную связь: чем больше растет сгусток, тем больше происходит свертывание, пока кровь не остановится.
Спящий режим
Время сна зависит от баланса между склонностью к гомеостатическому сну , потребностью во сне как функцией количества времени, прошедшего с момента последнего адекватного эпизода сна, и циркадными ритмами , которые определяют идеальное время для сна. правильно структурированный и восстанавливающий эпизод сна. Дефицит сна вызывает компенсирующее увеличение интенсивности и продолжительности сна, в то время как чрезмерный сон снижает склонность ко сну.
(Вернуться к началу)
8.2 Болезнь как гомеостатический дисбаланс
Что такое болезнь?
Болезнь — это нарушение нормальной физиологической функции, которое приводит к негативным симптомам. Хотя заболевание часто является результатом инфекции или травмы, большинство заболеваний связано с нарушением нормального гомеостаза. Все, что препятствует правильной работе системы положительной или отрицательной обратной связи, может привести к болезни, если механизмы нарушения станут достаточно сильными.
Старение — это общий пример болезни в результате гомеостатического дисбаланса. По мере старения организма ослабление петель обратной связи постепенно приводит к нестабильности внутренней среды. Это отсутствие гомеостаза увеличивает риск заболевания и отвечает за физические изменения, связанные со старением. Сердечная недостаточность является результатом подавления механизмов отрицательной обратной связи, что позволяет деструктивным механизмам положительной обратной связи компенсировать отказавшие механизмы обратной связи.Это приводит к высокому кровяному давлению и увеличению сердца, которое в конечном итоге становится слишком жестким, чтобы эффективно перекачивать кровь, что приводит к сердечной недостаточности. Тяжелая сердечная недостаточность может привести к летальному исходу.
Диабет: болезнь нарушения гомеостаза
Диабет, нарушение обмена веществ, вызванное повышенным уровнем глюкозы в крови, является ключевым примером заболевания, вызванного нарушением гомеостаза. В идеальных условиях механизмы гомеостатического контроля должны предотвращать возникновение этого дисбаланса.Однако у некоторых людей механизмы работают недостаточно эффективно или количество глюкозы в крови слишком велико для эффективного управления. В этих случаях необходимо медицинское вмешательство для восстановления гомеостаза и предотвращения необратимого повреждения органов.
Нормальный уровень сахара в крови Положения
Организм человека поддерживает постоянный уровень глюкозы в течение дня. После еды уровень глюкозы в крови повышается, поскольку глюкоза транспортируется из тонкой кишки в кровоток.В ответ на это поджелудочная железа (сенсор) выделяет инсулин в кровоток, где он действует как гормон . Как вы узнали из главы 6, гормонов — это молекулы, которые вырабатываются в одной части тела, секретируются в кровоток и транспортируются в отдаленную часть тела, где они опосредуют эффект или реакцию на эту вторичную цель. . Инсулин — это пептидный гормон, который выделяется поджелудочной железой в ответ на повышенный уровень глюкозы в крови.Инсулин с высокой эффективностью связывается с рецепторными белками на поверхности клеток печени, где он включает передачу сигналов в печени, чтобы увеличить захват глюкозы из кровотока (рис. 8.4). Другие клетки организма, такие как скелетные мышцы, жировая ткань и клетки мозга, также активируются инсулином. Когда молекула оказывает на организм несколько различных эффектов, эти множественные эффекты называются плейотропными эффектами . Эти другие типы клеток также потребляют глюкозу для использования в качестве источника энергии.Это снижает уровень глюкозы в крови до нормального уровня. Печень может поглощать больше глюкозы, чем другие типы тканей, и преобразовывать ее в большую углеводную молекулу, называемую гликогеном, о которой вы узнали в главе 6. Он хранится в виде этого углевода до тех пор, пока не понадобится глюкоза, после чего ее можно расщепить и высвободить. в кровоток. До 10% объема клеток печени находится в форме гликогена.
Рисунок 8.4 Гомеостаз глюкозы. Когда уровень сахара в крови повышается из-за приема пищи (Путь 1), поджелудочная железа ощущает повышение уровня глюкозы в крови.В ответ он высвобождает пептидный гормон инсулин. Инсулин взаимодействует с нижележащими клетками-мишенями в организме, включая печень и мышечную ткань, где он вызывает захват глюкозы из кровотока в клетку. Избыток глюкозы хранится в виде углеводов, гликогена. Это возвращает нормальный уровень глюкозы в крови. Если после приема пищи прошло несколько часов, уровень глюкозы в крови начнет падать (Путь 2). Это сигнализирует клеткам печени о расщеплении гликогена на мономеры глюкозы.Затем глюкоза может быть возвращена в кровоток.
Рисунок предоставлен: Шеннан Маскопф из Biologycorner.com
Между приемами пищи или во время голодания уровень глюкозы в крови начинает падать. Это активирует выработку поджелудочной железой другого гормона, называемого глюкагоном. Передача сигналов глюкагона активирует печень, чтобы начать расщепление запасающей молекулы гликогена на свободную глюкозу. Затем глюкоза возвращается в кровоток, повышая уровень глюкозы в крови (Рисунок 8.4).
В течение дня уровни глюкозы в крови будут незначительно колебаться около гомеостатической уставки (рис. 8.5). Когда едят пищу, это вызывает повышение уровня глюкозы в крови, которому противодействует секреция инсулина. В перерывах между приемами пищи уровень глюкозы в крови падает, и поджелудочная железа высвобождает глюкагон, чтобы подать сигнал печени высвободить глюкозу обратно в кровоток.
Рисунок 8.5. Гомеостаз метаболизма глюкозы : Это изображение иллюстрирует метаболизм глюкозы в течение дня.Гомеостаз может стать несбалансированным, если поджелудочная железа подвергается чрезмерной нагрузке, что делает ее неспособной сбалансировать метаболизм глюкозы. Это может привести к диабету.
Причины нарушения гомеостаза
Люди с диабетом 1 типа не вырабатывают инсулин из-за аутоиммунного разрушения клеток, продуцирующих инсулин, в то время как люди с диабетом 2 типа имеют хронический высокий уровень глюкозы в крови, который вызывает развитие инсулинорезистентности. При диабете уровень глюкозы в крови повышается за счет нормальной активности глюкагона, но отсутствие инсулина или резистентность к нему означает, что уровень сахара в крови не может вернуться к норме.Это вызывает метаболические изменения, которые приводят к таким симптомам диабета, как ослабление кровеносных сосудов и частое мочеиспускание. Диабет обычно лечат инъекциями инсулина, которые заменяют недостающую отрицательную обратную связь нормальной секреции инсулина. Если диабет не лечить или становится устойчивым к лечению, наблюдаются более серьезные побочные эффекты, в том числе периферическая невропатия (потеря чувствительности в конечностях), потеря кровообращения в конечностях, нечеткость зрения и / или слепота.
В целом, Диабет — это заболевание, вызванное нарушенной петлей обратной связи с участием гормона инсулина.Нарушенная петля обратной связи затрудняет или делает невозможным для организма снижение высокого уровня сахара в крови до здорового уровня.
(Вернуться к началу)
8.3. Измерение гомеостаза для оценки здоровья
Поскольку гомеостатический дисбаланс может привести к болезненным состояниям или даже смерти, гомеостаз был определен как одна из восьми основных концепций биологии. Американская ассоциация медицинских колледжей сообщает, что способность врачей определять и применять знания о гомеостазе следует рассматривать как одну из их ключевых компетенций.Таким образом, врачам нужен способ оценки гомеостатического здоровья своих пациентов. Им необходимо уметь оценивать смеси соединений, которые содержатся в организме человека.
Напомним, что в главе 2 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Также напомним, что смеси могут быть двух типов: , , гомогенные и гетерогенные, , , где , , гомогенные смеси, , сочетаются так тесно, что их можно рассматривать как единое вещество, хотя это не так. Гетерогенные смеси , с другой стороны, неоднородны и имеют участки смеси, которые выглядят иначе, чем другие участки смеси. Гомогенные смеси можно разделить на две классификации: Коллоиды и растворы . Коллоид представляет собой смесь, содержащую частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но являются мутными или непрозрачными.Кровь — хороший пример коллоида. Истинные растворы , с другой стороны, имеют размер частиц типичного иона или небольшой молекулы (от ~ 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В оставшихся разделах этой главы основное внимание будет уделено характеристикам истинных решений.
Решения вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем не является чистым H 2 O, но, скорее всего, является решением.Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворах, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом . Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент — растворенным веществом . Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).(Вернуться к началу)
Типы решений
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы .Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами .Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, в которых вода является растворителем.
- Многие сплавы, керамика и полимерные смеси — это твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью. Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду.Сплавы и другие твердые растворы важны в мире химии материалов.
(Вернуться к началу)
8,4 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 8.6 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 более высокая разность электроотрицательностей — это полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Нравится Растворяется Нравится.
Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже имеют свои составляющие частицы, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рис. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода — это высокополярный растворитель, способный растворять многие ионные соли. На рис. 8.7 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 8.7: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разрушены частичными зарядами молекул воды.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество.Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита. Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом.Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме.Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl —. Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей. Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем .Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не имеют одинаковых характеристик и не могут смешиваться вместе, называются несмешивающимися . Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды.Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)
8,5 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, тогда как слишком мало приводит к разбавленному раствору, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
8.5.1 Молярность
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:
Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении вычислений.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Дважды проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Перепишите приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворов
Обратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рис. 8.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше , чем желаемый общий объем раствора.
Рисунок 8.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
моль / литр.
2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде молей
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
8.5.2 Количество частей в решениях
В потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в обоих (т. Е. массе растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах, и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетии . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежная единица цент . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:
В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2
Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3
Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются доли на миллион (10 6 ppm) и доли на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей, как правило, очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 8.9).
Рисунок 8.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (b) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
8.5.3 Эквиваленты
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равно 1 экв / л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении, эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагирует или поставляет один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)
8,6 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 8.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества.Помните, что разбавление данного количества исходного раствора растворителем не приводит к изменению , а не количества присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора может быть математически выражено как:
где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рис. 8.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: Объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в данном случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе) .
(Вернуться к началу)
8,7 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2-.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2- ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 8.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 8.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2- и 2 моль катионов NH 4 + . (Молекулы воды для ясности не показаны с молекулярной точки зрения.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 при растворении в воде образует трех ионов (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно затем рассчитать, разделив 1,43 M на 4,29 M, получив 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Пример 1
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильнодействующий электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация такая же, как молярность раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия — это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 —, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 —, поэтому 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)
8.8 Движение молекул через мембрану
Одно из величайших чудес клеточной мембраны — это ее способность регулировать концентрацию веществ внутри клетки. Эти вещества включают ионы, такие как Ca ++ , Na + , K + и Cl — ; питательные вещества, включая сахара, жирные кислоты и аминокислоты; и продукты жизнедеятельности, особенно диоксид углерода (CO 2 ), которые должны покидать ячейку.
Двухслойная липидная структура мембраны обеспечивает первый уровень контроля. Фосфолипиды плотно упакованы вместе, и мембрана имеет гидрофобную внутреннюю часть. Эта структура делает мембрану избирательно проницаемой. Мембрана с селективной проницаемостью позволяет только веществам, отвечающим определенным критериям, проходить через нее без посторонней помощи. В случае клеточной мембраны только относительно небольшие неполярные материалы могут перемещаться через липидный бислой (помните, липидные хвосты мембраны неполярны).Некоторыми примерами этого являются другие липиды, кислород и углекислый газ, а также спирт. Однако водорастворимые материалы, такие как глюкоза, аминокислоты и электролиты, нуждаются в некоторой помощи для прохождения через мембрану, потому что они отталкиваются гидрофобными хвостами фосфолипидного бислоя. Все вещества, которые проходят через мембрану, делают это одним из двух общих методов, которые подразделяются на категории в зависимости от того, требуется ли энергия. Пассивный транспорт — это движение веществ через мембрану без затрат клеточной энергии.Напротив, активный транспорт — это движение веществ через мембрану с использованием энергии аденозинтрифосфата (АТФ). Вы видели примеры этих типов транспортных механизмов в главе 4, где мы узнали о генерации потенциала действия в нейроне.
Пассивный транспорт
Чтобы понять , как вещества пассивно перемещаются через клеточную мембрану, необходимо понимать градиенты концентрации и диффузию.Градиент концентрации — это разница в концентрации вещества в пространстве. Молекулы (или ионы) будут распространяться / диффундировать от места, где они более сконцентрированы, к месту, где они менее концентрированы, до тех пор, пока они не будут равномерно распределены в этом пространстве. (Когда молекулы движутся таким образом, они, как говорят, перемещаются на вниз, на их градиент концентрации.) Диффузия — это перемещение частиц из области с более высокой концентрацией в область с более низкой концентрацией.Несколько общих примеров помогут проиллюстрировать эту концепцию. Представьте, что вы находитесь в закрытой ванной. Если распылить флакон духов, молекулы аромата естественным образом распространятся из места, где они оставили флакон, во все углы ванной комнаты, и это распространение будет продолжаться до тех пор, пока градиент концентрации не исчезнет. Другой пример — ложка сахара, помещенная в чашку чая. В конце концов сахар будет распространяться по всему чаю, пока не исчезнет градиент концентрации. В обоих случаях, если в комнате теплее или чай горячее, диффузия происходит еще быстрее, поскольку молекулы сталкиваются друг с другом и распространяются быстрее, чем при более низких температурах.Таким образом, внутренняя температура тела около 98,6 ° F также способствует диффузии частиц внутри тела.
Посетите эту ссылку, чтобы увидеть диффузию и то, как она приводится в движение кинетической энергией молекул в растворе.Когда какое-либо вещество существует в большей концентрации на одной стороне полупроницаемой мембраны, такой как клеточные мембраны, любое вещество, которое может двигаться вниз по градиенту своей концентрации через мембрану, будет делать это. Рассмотрим вещества, которые могут легко диффундировать через липидный бислой клеточной мембраны, такие как газы кислород (O 2 ) и CO 2 .O 2 обычно диффундирует в клетки, потому что он более сконцентрирован вне них, а CO 2 обычно диффундирует из клеток, потому что он более сконцентрирован внутри них. Ни один из этих примеров не требует энергии со стороны клетки, и поэтому они используют пассивный транспорт для перемещения через мембрану.
Прежде чем двигаться дальше, необходимо рассмотреть газы, которые могут диффундировать через клеточную мембрану. Поскольку клетки быстро потребляют кислород во время метаболизма, обычно внутри клетки концентрация O 2 ниже, чем снаружи.В результате кислород будет диффундировать из межклеточной жидкости непосредственно через липидный бислой мембраны в цитоплазму внутри клетки. С другой стороны, поскольку клетки продуцируют CO 2 в качестве побочного продукта метаболизма, концентрации CO 2 повышаются в цитоплазме; следовательно, CO 2 будет перемещаться из клетки через липидный бислой в интерстициальную жидкость, где его концентрация ниже. Этот механизм движения молекул через клеточную мембрану со стороны, где они более сконцентрированы, в сторону, где они менее сконцентрированы, представляет собой форму пассивного транспорта, называемого простой диффузией (Рисунок 8.12).
Рисунок 8.12. Простая диффузия через клеточную (плазменную) мембрану. Структура липидного бислоя позволяет небольшим незаряженным веществам, таким как кислород и углекислый газ, и гидрофобным молекулам, таким как липиды, проходить через клеточную мембрану вниз по градиенту их концентрации путем простой диффузии.
Большие полярные или ионные молекулы, которые являются гидрофильными, не могут легко пересечь бислой фосфолипидов. Очень маленькие полярные молекулы, такие как вода, могут пересекаться посредством простой диффузии из-за своего небольшого размера.Заряженные атомы или молекулы любого размера не могут пересечь клеточную мембрану посредством простой диффузии, поскольку заряды отталкиваются гидрофобными хвостами внутри бислоя фосфолипидов. Растворенные вещества, растворенные в воде по обе стороны от клеточной мембраны, будут стремиться диффундировать вниз по градиенту их концентрации, но поскольку большинство веществ не могут свободно проходить через липидный бислой клеточной мембраны, их движение ограничивается белковыми каналами и специализированными транспортными механизмами в мембране. . Облегченная диффузия — это процесс диффузии, используемый для тех веществ, которые не могут пересекать липидный бислой из-за своего размера, заряда и / или полярности (рис. 8.13). Типичным примером облегченной диффузии является перемещение глюкозы в клетку, где она используется для производства АТФ. Хотя глюкоза может быть более концентрированной вне клетки, она не может пересекать липидный бислой посредством простой диффузии, потому что он является одновременно большим и полярным. Чтобы решить эту проблему, специальный белок-носитель, называемый переносчиком глюкозы, будет переносить молекулы глюкозы в клетку, чтобы облегчить ее внутреннюю диффузию.
Рисунок 8.13. Облегченная диффузия. (a) Облегченная диффузия веществ через клеточную (плазматическую) мембрану происходит с помощью белков, таких как канальные белки и белки-носители. Канальные белки менее селективны, чем белки-носители, и обычно легко различают свой груз в зависимости от размера и заряда. (б) Белки-носители более селективны, часто позволяя пересекаться только одному конкретному типу молекул.
В качестве примера, хотя ионы натрия (Na + ) сильно сконцентрированы вне клеток, эти электролиты заряжены и не могут проходить через неполярный липидный бислой мембраны.Их диффузии способствуют мембранные белки, которые образуют натриевые каналы (или «поры»), так что ионы Na + могут перемещаться вниз по градиенту их концентрации из-за пределов клеток внутрь клеток. Есть много других растворенных веществ, которые должны пройти через облегченную диффузию, чтобы попасть в клетку, например, аминокислоты, или выйти из клетки, например, отходы. Поскольку облегченная диффузия — это пассивный процесс, он не требует затрат энергии клеткой.
Вода также может свободно перемещаться через клеточную мембрану всех клеток либо через белковые каналы, либо скользя между липидными хвостами самой мембраны. Осмос — это диффузия воды через полупроницаемую мембрану (рис. 8.14).
Рисунок 8.14. Осмос. Осмос — это диффузия воды через полупроницаемую мембрану вниз по градиенту ее концентрации. Если мембрана проницаема для воды, но не для растворенного вещества, вода выровняет свою концентрацию, диффундируя в сторону более низкой концентрации воды (и, следовательно, в сторону более высокой концентрации растворенного вещества). В стакане слева раствор с правой стороны мембраны гипертонический.
Движение молекул воды само по себе не регулируется клетками, поэтому важно, чтобы клетки подвергались воздействию среды, в которой концентрация растворенных веществ вне клеток (во внеклеточной жидкости) равна концентрации растворенных веществ внутри клетки (в цитоплазме). T onicity используется для описания изменений растворенного вещества в растворе с растворенным веществом внутри ячейки. Три члена — гипотонический, изотонический и гипертонический — используются для сравнения относительной концентрации растворенного вещества в клетке и внеклеточной жидкости, окружающей клетки.
В гипотоническом растворе , таком как водопроводная вода, внеклеточная жидкость имеет более низкую концентрацию растворенных веществ, чем жидкость внутри клетки, и вода поступает в клетку. (Обратите внимание, что вода движется вниз по градиенту концентрации). Если это происходит в животной клетке, клетка может лопнуть или лизировать .
В гипертоническом растворе (префикс hyper — относится к внеклеточной жидкости, имеющей более высокую концентрацию растворенных веществ, чем цитоплазма клетки), жидкость содержит меньше воды, чем клетка.Поскольку в ячейке концентрация растворенных веществ ниже, вода будет покидать ячейку. Фактически растворенное вещество вытягивает воду из клетки. Это может привести к сморщиванию клетки животного или зубчатой .
В изотоническом растворе внеклеточная жидкость имеет ту же концентрацию растворенного вещества, что и клетка. Если концентрация растворенных веществ в клетке совпадает с концентрацией внеклеточной жидкости, чистого движения воды внутрь или из клетки не будет.
Клетки крови в гипертонических, изотонических и гипотонических растворах приобретают характерный вид, как показано на рис. 8.15. Важнейшим аспектом гомеостаза живых существ является создание внутренней среды, в которой все клетки тела находятся в изотоническом растворе. Различные системы органов, особенно почки, работают над поддержанием этого гомеостаза.
Рисунок 8.15. Состояния тоничности. Гипертонический раствор имеет более высокую концентрацию растворенного вещества, чем другой раствор.Изотонический раствор имеет концентрацию растворенного вещества, равную другому раствору. Гипотонический раствор имеет меньшую концентрацию растворенного вещества, чем другой раствор.
У некоторых организмов, таких как растения, грибы, бактерии и некоторые простейшие, есть клеточные стенки, которые окружают плазматическую мембрану и предотвращают лизис клеток. Плазматическая мембрана может расширяться только до предела клеточной стенки, поэтому клетка не будет лизироваться. Фактически, цитоплазма растений всегда слегка гипертоническая по сравнению с клеточной средой, и вода всегда будет поступать в клетку, если она доступна.Этот приток воды создает тургорное давление, которое укрепляет клеточные стенки растения (рис. 8.16). У недревесных растений давление тургора поддерживает растение. Если клетки растения становятся гипертоническими, как это происходит во время засухи, или если растение не поливают надлежащим образом, вода будет уходить из клетки. В этом состоянии растения теряют тургорное давление и вянут.
Рис. 8.16. Тургорное давление в растительной клетке зависит от тоничности окружающего раствора.
Другой механизм помимо диффузии для пассивной транспортировки материалов между отсеками — фильтрация.В отличие от диффузии вещества от более концентрированного к менее концентрированному, фильтрация использует градиент гидростатического давления, который выталкивает жидкость — и растворенные в ней вещества — из области с более высоким давлением в область с более низким давлением. Фильтрация — чрезвычайно важный процесс в организме. Например, кровеносная система использует фильтрацию для перемещения плазмы и веществ через эндотелиальную выстилку капилляров в окружающие ткани, снабжая клетки питательными веществами. Кроме того, давление фильтрации в почках обеспечивает механизм удаления отходов из кровотока.
(Вернуться к началу)
Активный транспорт
Для всех способов транспортировки, описанных выше, ячейка не расходует энергию. Мембранные белки, которые помогают в пассивном переносе веществ, делают это без использования АТФ. Во время активного транспорта требуется АТФ для перемещения вещества через мембрану, часто с помощью белков-переносчиков, и обычно против его градиента концентрации.
Один из наиболее распространенных типов активного транспорта включает белки, которые служат насосами. Слово «насос», вероятно, вызывает в воображении мысли об использовании энергии для накачки шины велосипеда или баскетбольного мяча. Точно так же энергия АТФ требуется этим мембранным белкам для переноса веществ — молекул или ионов — через мембрану, как правило, против градиентов их концентрации (из области с низкой концентрацией в область с высокой концентрацией).
Натрий-калиевый насос , который также называется Na + / K + АТФаза, транспортирует натрий из клетки, одновременно перемещая калий в клетку.Насос Na + / K + — это важный ионный насос, обнаруженный в мембранах многих типов клеток. Эти насосы особенно распространены в нервных клетках, которые постоянно выкачивают ионы натрия и притягивают ионы калия для поддержания электрического градиента через клеточные мембраны. Электрический градиент , , , — это разница в электрическом заряде в пространстве. В случае нервных клеток, например, существует электрический градиент между внутренней и внешней частью клетки, при этом внутренняя часть заряжена отрицательно (около -70 мВ) относительно внешней стороны.Отрицательный электрический градиент сохраняется, потому что каждый насос Na + / K + перемещает три иона Na + из ячейки и два иона K + в ячейку для каждой используемой молекулы АТФ (рис. 8.17). . Этот процесс настолько важен для нервных клеток, что на него приходится большая часть использования ими АТФ.
Рисунок 8.17. Натрий-калиевый насос. Натрий-калиевый насос находится во многих клеточных (плазматических) мембранах. Насос, работающий от АТФ, перемещает ионы натрия и калия в противоположных направлениях, каждый против своего градиента концентрации.За один цикл насоса три иона натрия вытесняются из ячейки, а два иона калия импортируются в ячейку.
Активные транспортные насосы могут также работать вместе с другими активными или пассивными транспортными системами для перемещения веществ через мембрану. Например, натрий-калиевый насос поддерживает высокую концентрацию ионов натрия вне клетки. Следовательно, если клетке нужны ионы натрия, все, что ей нужно сделать, это открыть пассивный натриевый канал, поскольку градиент концентрации ионов натрия заставит их диффундировать в клетку.Таким образом, действие активного транспортного насоса (натрий-калиевый насос) обеспечивает пассивный транспорт ионов натрия, создавая градиент концентрации. Когда активный транспорт обеспечивает перенос другого вещества таким образом, это называется вторичным активным транспортом.
Симпортеры — это вторичные активные транспортеры, которые перемещают два вещества в одном направлении. Например, симпортер натрий-глюкоза использует ионы натрия, чтобы «втягивать» молекулы глюкозы в клетку.Поскольку клетки хранят глюкозу для получения энергии, глюкоза обычно находится в более высокой концентрации внутри клетки, чем снаружи. Однако из-за действия натрий-калиевого насоса ионы натрия легко диффундируют в клетку при открытии симпортера. Поток ионов натрия через симпортер обеспечивает энергию, которая позволяет глюкозе перемещаться через симпортер в клетку против градиента ее концентрации.
И наоборот, антипортеры — это вторичные активные транспортные системы, которые транспортируют вещества в противоположных направлениях.Например, антипортер ионов натрия-водорода использует энергию поступающего внутрь потока ионов натрия для перемещения ионов водорода (H +) из клетки. Натрий-водородный антипортер используется для поддержания pH внутри клетки.
Другие формы активного транспорта не связаны с мембранными переносчиками. Эндоцитоз (внесение «в клетку») — это процесс поглощения клеткой материала путем охвата его частью своей клеточной мембраны с последующим отщипыванием этой части мембраны (рис. 8.18). После защемления часть мембраны и ее содержимое становятся независимыми внутриклеточными пузырьками. Везикула представляет собой мембранный мешок — сферическую полую органеллу, ограниченную двухслойной липидной мембраной. Эндоцитоз часто приносит в клетку материалы, которые необходимо расщепить или переварить. Фагоцитоз («поедание клеток») — это эндоцитоз крупных частиц. Многие иммунные клетки участвуют в фагоцитозе вторгающихся патогенов. Как и маленькие пакмены, их работа — патрулировать ткани тела на предмет нежелательных веществ, таких как вторжение в бактериальные клетки, фагоцитировать и переваривать их.В отличие от фагоцитоза, пиноцитоз («питье клетки») переносит жидкость, содержащую растворенные вещества, в клетку через мембранные везикулы.
Рисунок 8.18. Три формы эндоцитоза. Эндоцитоз — это форма активного транспорта, при котором клетка окружает внеклеточные материалы, используя свою клеточную мембрану. (а) При фагоцитозе, который является относительно неселективным, клетка поглощает крупную частицу. (б) При пиноцитозе клетка поглощает мелкие частицы жидкости.(c) Напротив, рецепторно-опосредованный эндоцитоз довольно селективен. Когда внешние рецепторы связывают определенный лиганд, клетка отвечает эндоцитозом лиганда.
Фагоцитоз и пиноцитоз захватывают большие части внеклеточного материала, и они, как правило, не обладают высокой селективностью в отношении веществ, которые они вносят. Клетки регулируют эндоцитоз определенных веществ через рецептор-опосредованный эндоцитоз. Эндоцитоз, опосредованный рецепторами — это эндоцитоз части клеточной мембраны, которая содержит множество рецепторов, специфичных для определенного вещества.Как только поверхностные рецепторы свяжут достаточное количество специфического вещества (лиганда рецептора), клетка будет эндоцитозировать часть клеточной мембраны, содержащую комплексы рецептор-лиганд. Таким образом, эритроциты эндоцитируют железо, необходимый компонент гемоглобина. Железо связано с белком, который называется трансферрином в крови. Специфические рецепторы трансферрина на поверхности эритроцитов связывают молекулы железо-трансферрин, и клетка эндоцитирует комплексы рецептор-лиганд.
В отличие от эндоцитоза, экзоцитоз («извлечение из клетки») представляет собой процесс экспорта клеточного материала с использованием везикулярного транспорта (рис. 8.19). Многие клетки производят вещества, которые необходимо секретировать, как фабрика, производящая продукт на экспорт. Эти вещества обычно упакованы в мембраносвязанные везикулы внутри клетки. Когда мембрана везикулы сливается с клеточной мембраной, везикула выделяет свое содержимое в интерстициальную жидкость. Затем везикулярная мембрана становится частью клеточной мембраны.Клетки желудка и поджелудочной железы производят и секретируют пищеварительные ферменты посредством экзоцитоза (рис. 8.20). Эндокринные клетки производят и секретируют гормоны, которые разносятся по всему телу, а некоторые иммунные клетки производят и секретируют большое количество гистамина, химического вещества, важного для иммунных реакций.
Рисунок 8.19. Экзоцитоз. Экзоцитоз очень похож на эндоцитоз в обратном направлении. Материал, предназначенный для экспорта, упаковывается в пузырьки внутри клетки. Мембрана везикулы сливается с клеточной мембраной, и содержимое выходит во внеклеточное пространство.
Рисунок 8.20. Ферментные продукты клеток поджелудочной железы. Ацинарные клетки поджелудочной железы производят и секретируют множество ферментов, которые переваривают пищу. Крошечные черные гранулы на этой электронной микрофотографии представляют собой секреторные везикулы, заполненные ферментами, которые будут выводиться из клеток посредством экзоцитоза. LM × 2900. (Микрофотография предоставлена Медицинской школой Риджентс Мичиганского университета © 2012 г.) Просмотрите WebScope Мичиганского университета, чтобы изучить образец ткани более подробно.
(Вернуться к началу)
8.9 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой однородную смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворенные вещества — это растворимые или нерастворимые , что означает, что они растворяются или не растворяются в конкретном растворителе.Термины смешивающийся, и несмешивающийся, вместо «растворимый и нерастворимый» используются для жидких растворенных веществ и растворителей. Утверждение « подобно растворяется подобно » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора. Для водных растворов используется слово гидратация .Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества. Такими решениями являются насыщенные . Растворы, у которых количество меньше максимального, — это ненасыщенные . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объемный / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Клеточная мембрана обеспечивает барьер вокруг клетки, отделяя ее внутренние компоненты от внеклеточной среды. Он состоит из фосфолипидного бислоя с гидрофобными внутренними липидными «хвостами» и гидрофильными внешними фосфатными «головками».По всему бислою разбросаны различные мембранные белки, вставленные в него и прикрепленные к нему на периферии. Клеточная мембрана избирательно проницаема, позволяя лишь ограниченному количеству материалов диффундировать через ее липидный бислой. Все материалы, которые проходят через мембрану, делают это с использованием пассивных (не требующих энергии) или активных (энергозатратных) процессов переноса. Во время пассивного транспорта материалы перемещаются за счет простой диффузии или облегченной диффузии через мембрану вниз по градиенту их концентрации.Вода проходит через мембрану в процессе диффузии, называемом осмосом. Во время активного переноса энергия расходуется на содействие движению материала через мембрану в направлении против градиента их концентрации. Активный транспорт может происходить с помощью протеиновых насосов или везикул.
Контрольные вопросы
1. Поскольку ионные каналы встроены в мембрану, они являются примерами ________.
- рецепторные белки
- интегральных белков
- периферические белки
- гликопротеинов
2.Диффузия веществ в растворе имеет тенденцию перемещать эти вещества ________ их ________ градиента.
- up; электрический
- up; электрохимический
- вниз; давление
- вниз; концентрация
3. Ионные насосы и фагоцитоз являются примерами ________.
- эндоцитоз
- пассивный транспорт
- активный транспорт
- облегченная диффузия
4. Выберите ответ, который лучше всего завершает следующую аналогию: Распространение — к ________, как эндоцитоз — к ________.
- фильтрация; фагоцитоз Осмос
- ; пиноцитоз
- растворенных веществ; жидкость
- градиент; химическая энергия
Вопросы о критическом мышлении
1. Какие материалы могут легко диффундировать через липидный бислой и почему?
2. Почему рецептор-опосредованный эндоцитоз считается более избирательным, чем фагоцитоз или пиноцитоз?
3. Что общего между осмосом, диффузией, фильтрацией и движением ионов от одного заряда? Чем они отличаются?
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
-
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- ВЧ
- Канал 3 Канал 2 Канал 2 Канал
-
Na 2 SO 4
-
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
-
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
-
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
-
Каковы преимущества использования решений для количественных расчетов?
Ответ
-
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF — слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, поскольку только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
-
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
-
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
-
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
-
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 Мбайн 2
- 1,135 M Na 2 SO 4
- 1,428 млн NH 4 Br
- 0,889 М ацетат натрия
-
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
-
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 -
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
-
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
-
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
-
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
-
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
-
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали основной раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
-
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
-
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
-
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
-
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
-
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
-
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
-
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
-
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
-
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1,08 М, h4PO4 = 0,816 М, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
-
1,74 × 10 −3 M кофеин
(Вернуться к началу)
8.10 Ссылки
- Чанг (Питер) Чие (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions .
- Болл, Д.У., Хилл, Дж. У. и Скотт, Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Нижний, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
- Открытых учебников для Гонконга. (2015) Глава «Тоничность» из «Биологических понятий». получено 31 декабря 2018 г. с сайта http: // www.opentextbooks.org.hk/ditatopic/34633
- Университет Райса () Раздел 3.1 Клеточная мембрана из анатомии и физиологии. До н.э. Открытый сборник учебников. Получено 31 декабря 2018 г. с https://opentextbc.ca/anatomyandphysiology/chapter/the-cell-membrane/ .
- Kahn Academy (2019) Гомеостаз. В системах человеческого тела. Получено 2 января 2019 г. по адресу https://www.khanacademy.org/science/high-school-biology/hs-human-body-systems/hs-body-structure-and-homeostasis/a/homeostasis .
- Lumen Learning (2019) Гомеостаз безграничной анатомии и физиологии.Получено 2 января 2019 г. с https://courses.lumenlearning.com/boundless-ap/chapter/homeostasis/ .
- авторов Википедии. (2019, 9 февраля). Переохлаждение. В Википедия, Бесплатная энциклопедия . Получено 18:47, 25 февраля 2019 г., с https://en.

