Формула алканов — энциклопедический справочник и словарь для студента от А до Я
ОПРЕДЕЛЕНИЕАлканы (парафины, предельные углеводороды, насыщенные алифатические углеводороды) – ациклические углеводороды линейного или разветвлённого строения, в которых атомы углерода связаны между собой только простыми (одинарными) связями.
Общая формула алканов: \(\ \mathrm{C}_{\mathrm{n}} \mathrm{H}_{2 \mathrm{n}+2} \)\(\ (n \geq 1) \)
Молекулярные и структурные формулы алканов
Первые представители гомологического ряда алканов:
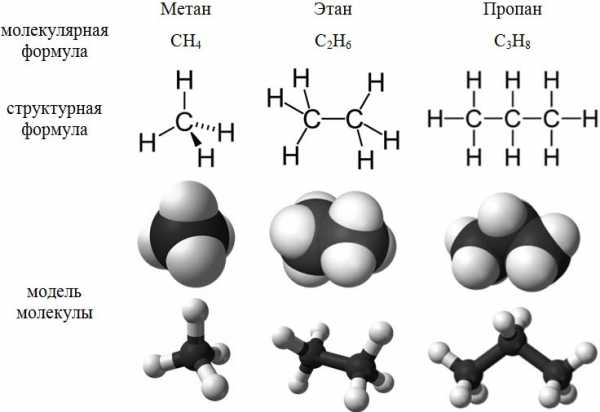
Молекулярные и структурные формулы алканов
Алканы называются насыщенными углеводородами, поскольку содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp {3} -гибридизации – 4 гибридные орбитали атома углерода равнозначны по форме и энергии и направлены к вершинам тетраэдра:
Тетраэдрическое расположение гибридных орбиталей одинаково для всех атомов углерода в алканах, поэтому молекулы алканов имеют зигзагообразное строение:
Тетраэдрическое расположение гибридных орбиталей одинаково для всех атомов углерода в алканах
При \(\ n > 3 \) у алканов возможна изомерия углеродного скелета:
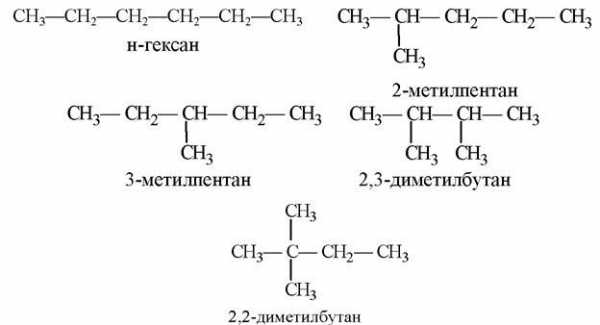
а при \(\ n > 6 \) – оптическая изомерия.
Алканы химически малоактивны, поскольку одинарные связи \(\ \mathrm{C}-\mathrm{H} \) и \(\ \mathrm{C}-\mathrm{C} \) довольно прочные. Все связи в молекулах алканов являются \(\ \sigma \) -связями, малополярны и слабо поляризуются, поэтому алканы, в основном, вступают в реакции по радикальному механизму (радикальное галогенирование, сульфохлорирование, нитрование, автоокисление).
Основным практически значимым химическим свойством алканов является реакция горения:
\(\ \mathrm{CH}_{4}+2 \mathrm{O}_{2} \rightarrow \mathrm{CO}_{2}+2 \mathrm{H}_{2} \mathrm{O}+\Delta Q \)
Из-за большого теплового эффекта таких реакций алканы используются в качестве топлива.Примеры решения задач по теме «формула алканов»
ПРИМЕР 1
Массовая доля углерода в алкане составляет 83,72%. Определите его молекулярную формулу.
Общая формула алканов \(\
\mathrm{CnH} 2 \mathrm{n}+2
\)
Масса 1 моля алкана равна:
\(\
m\left(C_{n} H_{2 n+2}\right)=(12 n+2 n+2)=14 n+2
\)
Масса углерода в алкане равна:
\(\
m(C)=12 n
\)
Массовая доля углерода в алкане равна:
\(\
\omega(C)=\frac{12 n \cdot 100}{14 n+2}
\)
\(\
\frac{12 n \cdot 100}{14 n+2}=83,72
\)
\(\
27,92 n=167,44
\)
\(\
n=6
\)
Следовательно, молекулярная формула алкана \(\
\mathrm{C} 6 \mathrm{H} 14
\).
Молекулярная формула алкана \(\
\mathrm{C} 6 \mathrm{H} 14
\)
ПРИМЕР 2
Газ, который образовался при полном сгорании 0,1 моль неизвестного алкана, пропустили через избыток известковой воды, при этом выпал осадок массой 60 г. Определите молекулярную формулу и строение данного алкана, если известно, что в его составе есть один четвертичный атом углерода.
Запишем уравнение реакции горения алкана:
\(\
C_{n} H_{2 n+2}+(3 n+1) / 2 O_{2} \rightarrow n C O_{2}+(n+1) H_{2} O
\)
Из уравнения реакции следует, что при сгорании 1 моля алкана, образуется n моль \(\
\mathrm{CO} 2
\).
При пропускании углекислого газа через известковую воду выпадает осадок карбоната кальция:
\(\
C a(O H)_{2}+C O_{2}=C a C O_{3} \downarrow+H_{2} O
\)
Количество вещества карбоната кальция равно:
\(\
n\left(C a C O_{3}\right)=m / M=60 / 100=0,6
\)
По уравнению реакции
\(\
n\left(C O_{2}\right)=n\left(C a C O_{3}\right)=0,6
\) моль
Поскольку при сгорании 0,1 моль алкана выделилось 0,6 моль \(\
\mathrm{CO} 2
\), то n = 6.
Следовательно, молекулярная формула алкана – \(\
\mathrm{CGH} 14
\)
Среди алканов, имеющих формулу \(\
\mathrm{CGH} 14
\), четвертичный атом углерода имеет 2,2-диметилбутан:
\(\
\mathrm{C} 6 \mathrm{H} 14
\) — 2,2-диметилбутан.
sciterm.ru
общие сведения. Физические и химические свойства
Алканы с химической точки зрения представляют собой углеводороды, то есть общая формула алканов включает в себя исключительно атомы углерода и водорода. Помимо того, что эти соединения не содержат никаких функциональных групп, они образуются только за счет одинарных связей. Такие углеводороды называются насыщенными.
Типы алканов
Все алканы можно выделить в две большие группы:
- Алифатические соединения. Их структура имеет вид линейной цепочки, общая формула алканов алифатического типа CnH2n+2, где n — количество атомов углерода в цепи.
- Циклоалканы. Эти соединения имеют циклическую структуру, что обуславливает существенное отличие их химических свойств от линейных соединений. В частности, структурная формула алканов этого типа обуславливает сходство их свойств с алкинами, то есть углеводородами с тройной связью между атомами углерода.
Электронная структура алифатических соединений
Эта группа алканов может иметь либо линейную, либо разветвленную углеводородную цепь. Их химическая активность является невысокой по сравнению с другими органическими соединениями, поскольку все связи внутри молекулы являются насыщенными.
Молекулярная формула алканов алифатического типа говорит о том, что их химическая связь имеет sp3-гибридизацию. Это означает, что все четыре ковалентные связи вокруг атома углерода по своим характеристикам (геометрическим и энергетическим) являются абсолютно равноправными. При таком типе гибридизации электронные оболочки уровней s и p атомов углерода имеют одинаковую форму вытянутой гантели.
Между атомами углерода связь в цепи является ковалентной, а между атомом углерода и водорода она частично поляризована, при этом электронная плотность оттягивается к углероду, как к элементу более электроотрицательному.
Из общей формулы алканов следует, что в их молекулах существуют только связи C-C и C-H. Первые образуются в результате перекрывания двух электронных гибридизованных орбиталей sp3 двух атомов углерода, а вторые образуются при перекрывании орбитали s водорода и орбитали sp3 углерода. Длина связи C-C равна 1,54 ангстрема, а связи C-H — 1,09 ангстрема.
Геометрия молекулы метана
Метан является самым простым алканом, который состоит всего из одного атома углерода и четырех атомов водорода.
Благодаря энергетической равноправности его трех 2p и одной 2s орбиталей, полученной в результате sp3-гибридизации, все орбитали в пространстве расположены под одинаковым углом друг к другу. Он равен 109,47°. В результате такой молекулярной структуры в пространстве образуется подобие треугольной равносторонней пирамиды.
Простые алканы
Самым простым алканом является метан, который состоит из одного атома углерода и четырех атомов водорода. Следующие в ряду алканов за метаном пропан, этан и бутан образованы тремя, двумя и четырьмя атомами углерода соответственно. Начиная с пяти атомов углерода в цепи, соединения получили название согласно номенклатуре ИЮПАК.
Таблица с формулами алканов и их названиями приведена ниже:
| Название | метан | этан | пропан | бутан | пентан | гексан | гептан | октан | нонан | декан |
| Формула | CH4 | C2H6 | C3H8 | C4H10 | C5H12 | C6H14 | C7H16 | C8H18 | C9H20 | C10H22 |
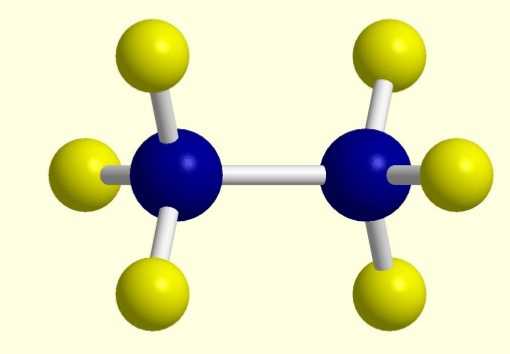
При потере одного водородного атома у молекулы алкана образуется активный радикал, окончание которого меняется с «ан» на «ил», например, этан C2H6 — этил C2H5. Структурная формула алкана этана приведена на фото.
Номенклатура органических соединений
Правила определения названий алканов и соединений на их основе установлены международной номенклатурой ИЮПАК. Для органических соединений действуют следующие правила:
- Название химического соединения базируется на названии его самой длинной цепи из атомов углерода.
- Нумерацию атомов углерода следует начинать с конца, ближе к которому начинается разветвление цепи.
- Если в соединении присутствуют две или более углеродные цепи одинаковой длины, то в качестве основной выбирается та, которая имеет меньше всего радикалов, и они имеют более простую структуру.
- Если в молекуле имеются две и более одинаковые группы радикалов, тогда в названии соединения используются соответствующие префиксы, которые удваивают, утраивают и так далее названия указанных радикалов. Например, вместо выражения «3-метил-5-метил» используется «3,5-диметил».
- Все радикалы записываются в алфавитном порядке в общее название соединения, при этом префиксы не берутся во внимание. Последний радикал пишется слитно с названием самой цепи.
- Числа, отражающие номера радикалов в цепи, отделяются от названий дефисом, а сами цифры записываются через запятую.
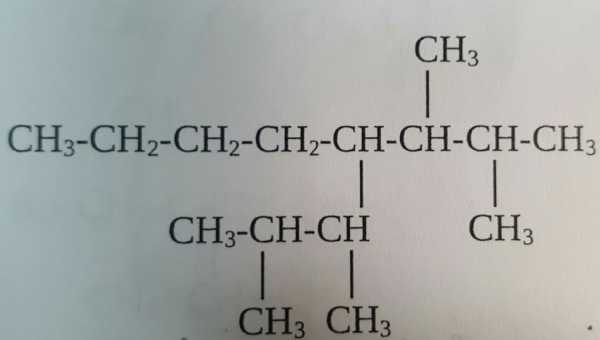
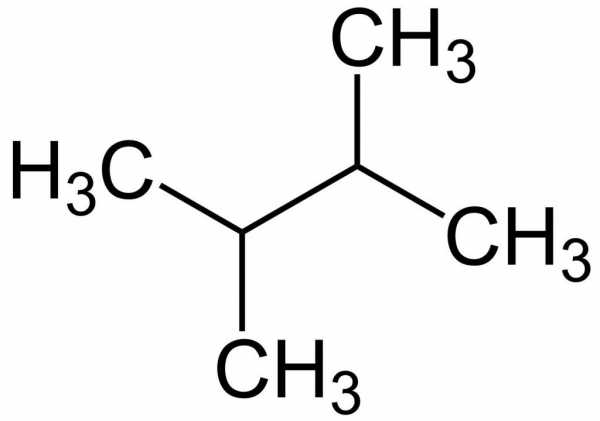
Соблюдение правил номенклатуры ИЮПАК позволяет легко определить молекулярную формулу алкана по названию вещества, например, 2,3-диметилбутан имеет следующий вид.
Физические свойства
Физические свойства алканов во многом зависят от длины углеродной цепи, образующей конкретное соединение. Основными свойствами являются следующие:
- Первые четыре представителя, согласно общей формуле алканов, при нормальных условиях находятся в газообразном состоянии, то есть это бутан, метан, пропан и этан. Что касается пентана и гексана, то они существуют уже в виде жидкостей, а начиная с семи атомов углерода, алканы представляют собой твердые вещества.
- При увеличении длины углеродной цепи увеличивается и плотность соединения, а также его температуры фазовых переходов первого рода, то есть температуры плавления и кипения.
- Поскольку полярность химической связи в формуле вещества алканов является незначительной, они не растворяются в полярных жидкостях, например, в воде.
- Соответственно их можно использовать в качестве хороших растворителей таких соединений, как неполярные жиры, масла и воски.
- В домашней газовой плите используется смесь алканов, богатая третьим членом химического ряда — пропаном.
- При кислородном горении алканов выделяется большое количество энергии в виде тепла, поэтому эти соединения используют в качестве горючего топлива.
Химические свойства
Ввиду наличия стабильных связей в молекулах алканов, их реакционная способность в сравнении с другими органическими соединениями является низкой.
С ионными и полярными химическими соединениями алканы практически не реагируют. Они ведут себя инертно в растворах кислот и оснований. Алканы вступают в реакцию только с кислородом и галогенами: в первом случае речь идет о процессах окисления, во втором — о процессах замещения. Некоторую химическую активность они проявляют и в реакциях с переходными металлами.
Во всех этих химических реакциях важную роль играют разветвления углеродной цепи алканов, то есть наличие в них радикальных групп. Чем их больше, тем сильнее изменяется идеальный угол между связями 109,47° в пространственной структуре молекулы, что приводит к созданию напряжений внутри нее и, как следствие, увеличивает химическую активность такого соединения.
Реакция простых алканов с кислородом происходит по следующей схеме: CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2.
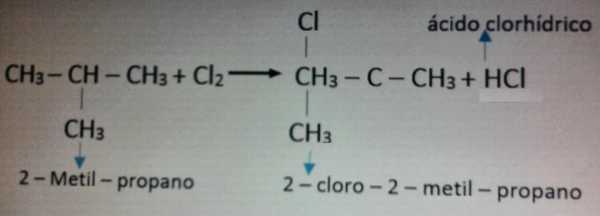
Пример реакции с хлором приведен на фото ниже.
Опасность алканов для природы и человека
При содержании метана в воздухе в интервале концентраций 1-8% образуется взрывная смесь. Опасность для человека заключается еще и в том, что этот газ не имеет цвета и запаха. Кроме того, метан обладает сильным парниковым эффектом. Остальные алканы, имеющие в своем составе несколько атомов углерода, также образуют взрывные смеси с воздухом.
Гептан, пентан и гексан представляют собой легко воспламеняющиеся жидкости и являются опасными как для окружающей среды, так и для здоровья человека, поскольку они токсичны.
fb.ru
Органическая химия: алканы
С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность.
Алканы от СН4 до С4Н10– газы,
от С5Н12 до С17Н36 – жидкости,
далее – твердые вещества
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Смесь метана с кислородом взрывоопасна!
Метан еще называют болотным или рудничным газом, он встречается в земной коре в виде свободных скоплений (залежей), в растворённом (в нефти, пластовых и поверхностных водах). И если посмотреть информацию из новостей — довольно часто происходят взрывы в шахтах. Гибнут люди…
Химические свойства:
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.).
Общее уравнение горения:
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом — «синтез-газ»:
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью
Крекинг алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел и т.п., а также сырья для химической и нефтехимической промышленности.
Как написать уравнение крекинга?
Берем исходное вещество и как бы делим его напополам: 4:2 — получается С2
“Достраиваем” его до алкана по общей формуле- С2Н6
А оставшееся вещество составляем из “остатков” — 2 и 4: С2Н4 — это алкен
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr
2O3, Fe2O3, ZnO) происходит их каталитическое дегидрирование – отщепления атомов водорода за счет разрыва связей С—Н.
Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например
:Почти все реакции с участием алканов идут при нагревании и в присутствии катализатора, при обычных условиях они пассивны.
Получение:
organichimik.blogspot.com
Алканы, гомологический ряд и общая формула алканов, строение молекулы метана и его гомологов, sp3- гибридизация, изомерия и номенклатура алканов
Матвеева Светлана Анатольевна, учитель химии
КГУ «Средняя школа № 6» г.Лисаковск
Тема урока : Алканы, гомологический ряд и общая формула алканов, строение молекулы метана и его гомологов, sp3— гибридизация, изомерия и номенклатура алканов
Цель урока: 1.Знать понятие и номенклатуру алканов, общую формулу их строение и изомерию.
2.Уметь составлять структурные формулы алканов и называть их.
Задачи обучения: 1.Изучить понятие алканов их строение, номенклатуру- международную и рациональную.
2. Развивать навыки составления изомеров.
Виды деятельности учащихся: Индивидуальная работа с учебником, работа в паре, групповая работа
Оборудование : интерактивная доска, проектор, флипчарт, листы с заданиями, учебник, дескрипторы для оценивания, листы самооценивания
Идеи модулей Новой программы: Новые подходы в обучении; Обучение критическому мышлению; ИКТ, возрастные особенности
Интеграция с другими предметами—
с геометрией ( форма молекул-тетраэдрическая у алканов),
с русским языком (слова синонимы-алканы=парафины=предельные=насыщенные)
Функциональная грамотность— развитие коммуникативной компетенции учащихся в процессе групповой работы
Ход урока.
1.Организационый момент
2. Деление учащихся на группы (по 4-5) по цветам
3. Мозговой штурм
На столе стоит парафиновая свеча — зажигаем и читаем стихотворение
Когда в душе покоя нет —
Зажги свечу на радость людям!
Пусть золотой не меркнет свет,
А все невзгоды — позабудем!
Когда в душе покоя нет —
Зажги свечу на благо людям —
Пусть свет не меркнет золотой,
(стихотворение сайта http://www.inpearls.ru)
Вопрос: Каким образом свеча связана с темой нашего урока? (Предположения учащихся)
« Разгадаем ребус» — на доске зашифровано слово «Парафины»
Тема урока «Алканы, гомологический ряд и общая формула алканов, строение молекулы метана и его гомологов, sp3— гибридизация, изомерия и номенклатура алканов .
Сегодня на уроке : Цель урока (формулируют учащиеся)
знать (формулируют учащиеся)
уметь (формулируют учащиеся)
4. Изучение нового материала. Работа группах
А) Изучение состава и строения алканов
Групповая работа – создание коллаборативной среды. Вырабатываем правила работы в группе
Задание 1 для группы 1
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле метана и бутана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу метана и бутана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол, расстояние между атомами углерода (используйте рис.9 стр. 69).
5. Какую форму имеют данные молекулы углеводородов?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы метана и бутана.
7. Что называют конформацией и возможна ли она у ваших соединений? Если да, то покажите.
Учащиеся проводят взаимооценивание ( критериальное -оценивание по дискрипторам)
Задание 1 для группы 2
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле этана и пентана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу этана и пентана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода (используйте рис.10,12 стр. 70-71).
5. Какую форму имеют данные молекулы углеводородов?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы этана и пентана.
7. Что называют конформацией и возможна ли она у ваших соединений? Если да, то покажите.
Задание 1 для группы 3
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле пропана и гексана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу пропана и гексана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода(используйте рис.11 и 12 стр. 71).
5. Какую форму имеют данные молекулы углеводородов?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы пропана и гексана.
7.Покажите конформеры для гексана.
Задание 1 для группы 4
Строение, состав алканов .
Цель: Изучить гомологический ряд, номенклатуру, строение, состав, тип гибридизации электронных облаков атома углерода в молекуле гептана.
Задание 1. Прочитайте в учебнике стр 64-73 §3.1-3.2 об алканах, и ответьте на следующие вопросы в группе.
1. Алканы-это…
2. Какова общая формула алканов? Приведите примеры
3. Что такое радикалы? Приведите примеры.
4. Напишите структурную формулу гептана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода(используйте рис.11 и 12 стр. 71).
5. Какую форму имеют данная молекула алкана?
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы гептана.
7.Покажите конформеры для гептана.
Б) Изомерия и Номенклатура алканов-международная и рациональная.
Объяснение с использованием интерактивной доски
Цель: Изучить изомерию алканов-структурную и номенклатуру -международную и рациональную, научиться самим составлять изомеры и называть их и научить других .
Для алканов характерна структурная изомерия(углеродного скелета)
Номенклатура:
Международная
Задание-образец: дать название следующему углеводороду по международной( систематической) номенклатуре
1) Выбираем наиболее длинную цепь атомов углерода и нумеруем ее с того конца, к которому ближе радикалы1 2 3 4 5 6 7
2) Приставка:
место – (число) — название заместителей
у 2 и у 4 атомов углерода имеется 2 одинаковых
радикала метила
2,4-диметил
3) Корень слова:
число атомов углерода в главной цепи (7 – гепт)
2,4-диметил гепт
4) Суффикс:
Только одинарные связи между атомами углерода
2,4-диметил гепт ан
Рациональная ( называют как производные метана)
метилдиэтилметан
в) Работа в паре (взаимообучение)
1 вариант. Объяснить своему соседу как называют вещества по международной номенклатуре на примере алканов.
,
2 вариант. Объяснить своему соседу как называют алканы по рациональной номенклатуре.
На взаимообучение друг друга отводится 5 минут
Дайте друг другу обратную связь- рекомендации по теме ( над чем поработать и что еще сделать необходимо для лучшего понимания данного вопроса.)
Г) Закрепление. Учащиеся работают в парах. Ответьте на вопросы ( в паре) по теме «Алканы»:
Цель: повторить и закрепить изученный материал по алканам (общая формула, строение, номенклатура).
Алканы-это…
Назовите общую формулу предельных углеводородов.
Напишите формулу алканов, имеющих в своем составе 8, 12, 16 атомов углерода.
Какой вид гибридизации характерен для алканов?
Назовите валентный угол и длину «С – С» связи в молекулах алканов.
Объясните, каким образом даются названия алканам по международной номенклатуре.
Сравните, чем отличается международная номенклатура от рациональной? Какая для вас легче? Почему?
Проанализируйте, в чем трудность составления изомеров алканов и их называния, если она есть? Что для этого необходимо предпринять?
Взаимооценивание проводится учащимися.
5. Первичное закрепление знаний
Тест.
1.Укажите, какие из веществ, формулы которых приведены ниже, являются изомерами н-гексана:
2.Общая формула гомологического ряда алканов:
а) СnH2n+2 в) СnH2n
б) СnH2n-2 г) СnH2n-6
3. Выберите название приведенного алкана по международной номенклатуре
А) 2,2,3,3-метилбутан
Б) 2,3-тетраметилбутан
В)2,2,3,3.-тетраметилбутан
Г) октан
4. Тип гибридизации алканов:
а) sp³ —
б) sp² —
в) sp –
5.Тип ковалентной связи у алканов:
а) σ – связи
б) π — связи
в) σ и π связи
6. Типы изомерии у алканов:
а) структурная б) межклассовая
в) геометрическая г) структурная, межклассовая и геометрическая
Самооценивание производится самим учеников и записываются баллы в лист оценивания и подсчитываются баллы.
6.Рефлексия.
Сегодня я узнал….
Я на уроке понял…
Мне удалось…
Данная тема мне ….
Я для себя сегодня взял..
Работа на уроке для меня…
7. Домашнее задание: § 3.1 стр 73 у.2-3( на оценку «3») у 6-5( на оценку « 4») у.7-8 (на оценку «5»)
Приложение.
Дескрипторы к критериям оценки по работе в группе « Гомологический ряд, строение, состав свойства алканов».
грамотно, указано, что алканы углеводороды, общая формула указана, но не указано, что это насыщенные углеводороды .
Определение дано с подсказками, наводящими вопросами ,не указана общая формула
Определение не сформулировано
2. Общая формула
Приведена формула СnH2n+2 .Приведены 2 примера.
Приведена формула СnH2n+2 .
Приведен 1 пример.
Приведена формула СnH2n+2 , но не приведены примеры
Формула не приведена.
3.Что такое радикалы? Приведите примеры.
Определение дано-указано, что это частицы с неспаренным электроном, приведены примеры
Определение пытался сформулировать, приведены примеры
Приведены примеры, но определение не дано
Не пытался привести примеры и дать определение
4.Напишите структурную формулу алкана, и укажите связи в молекуле, определите тип гибридизации атома углерода, валентный угол , расстояние между атомами углерода
Написана структурная формула правильно, указаны связи в молекуле, длина связи, определен тип гибридизации атома углерода, указан валентный угол
Написана структурная формула правильно, указаны связи в молекуле, длина связи, определен тип гибридизации атома углерода, не указан валентный угол
Написана структурная формулуа правильно, указаны связи в молекуле, не указаны длина связи, не определен тип гибридизации атома углерода, не указан валентный угол
Написана структурная формулу, но с недочетами.
5. Какую форму имеют данная молекула алкана?
Указал (а),что угол между атомами углерода 109°28′ , поэтому молекула имеет зигзагообразную форму .
Указал (а) ,что молекула имеет зигзагообразную форму , но не указано почему.
Пытался указать какую форму молекула имеет ( зигзагообразную форму), высказывал предположения.
Не указал (а) ,что молекула имеет зигзагообразную форму и не пытался .
6.Используя молекулярный конструктор соберите шаростержневую модель молекулы.
Принимал активное участие в сборке молекулы, пояснял, используя ТХС А.Бутлерова, как правильно собрать молекулу, какая валентность у атома углерода
Помогал собирать молекулу, пытался пояснять, как правильно собрать молекулу.
Комментировал, как можно собрать молекулу.
Не принимал участие в сборке молекулы
7. Что называют конформацией и возможна ли она у ваших соединений? Если да, то покажите.
Указал(а),что конформация-это различные геометрические формы молекул в пространстве за счет вращения С-С связей.
Продемонстрировал конформеры молекул.
Указал, что конформация -это различные геометрические формы молекул в пространстве , но не пояснил за счет чего образуется
Предположил, что такое конформеры и у каких соединений возможны.
Не пытался принимать участие в обсуждении.
Дескрипторы по работе в паре
Ответы на вопросы ( в паре) по теме «Алканы»:
Даны ответы на вопросы
За каждый ответ на 1-5 вопрос по 1 баллу
6-8 вопрос по 2 балла
Тест. «Алканы»
1.в2.а
3.в
4.а
5.а
6.а
Оцените себя за тест «Алканы»
(самооценка)
Подсчитайте общее количество баллов и переведите в оценку
34-37 баллов- «5»
26-33 балла –«4»
25- 18 баллов- «3»
менее 18 баллов – «2»
Фамилия имяПодсчитайте общее количество баллов и переведите в оценку
34-37 баллов- «5»
26-33 балла –«4»
25- 18 баллов- «3»
менее 18 баллов – «2»
Форма работы
Самооценка ( баллы)
Взаимооценка ( баллы)
Групповая работа
Работа в паре
Диалог-ответы на вопросы Ответы на вопросы ( в паре) по теме «Алканы»:
Тест по теме
Оценка учителя ______________________________________
infourok.ru
Формула алкенов в химии
Общая формула алкенов: CnH2n(n 2)
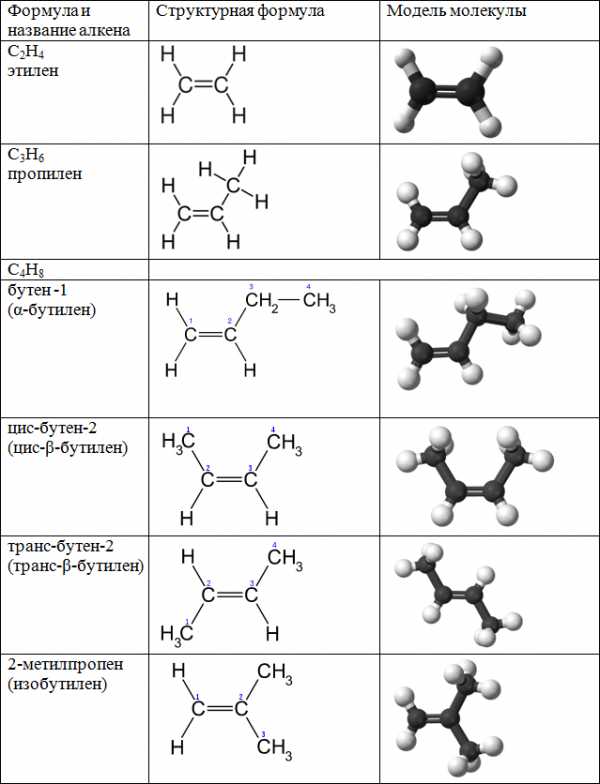
Молекулярные и структурные формулы алкенов
Первые представители гомологического ряда алкенов:
Формулы алкенов можно составить из соответствующих формул алканов (предельных углеводородов). Названия алкенов образуют заменой суффикса -ан соответствующего алкана на -ен или –илен: бутан – бутилен, пентан –пентен и т.д. Номер атома углерода с двойной связью обозначается арабской цифрой после названия.
Атомы углерода, участвующие в образовании двойной связи находятся в состоянии sp-гибридизации. Три -связи, образованные гибридными орбиталям и, расположены в одной плоскости под углом 120° друг к другу. Дополнительная -связь образуется путем бокового перекрывания негибридных р-орбиталей:
Длина двойной связи С=С (0,133нм) меньше длины одинарной связи (0,154 нм). Энергия двойной связи меньше удвоенного значения энергии одинарной связи, поскольку энергия -связи меньше энергии -связи.
Изомеры алкенов
Все алкены кроме этилена имеют изомеры. Для алкенов характерна изомерия углеродного скелета, изомерия положения двойной связи, межклассовая и пространственная изомерии.
Межклассовым изомером пропена (C3H6) является циклопропан. Начиная с бутена (C4H8) появляется изомерия по положению двойной связи (бутен-1 и бутен-2), изомерия углеродного скелета (метилпропен или изобутилен), а также пространственная изомерия (цис-бутен-2 и транс-бутен-2). В цис- изомерах заместители расположены по одну сторону, а в транс- изомерах – по разные стороны от двойной связи.
Химические свойства и химическая активность алкенов определяются наличием в их молекулах двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения: гидрогалогенирование, гидратация, галогенирование, гидрирование, полимеризация.
Качественная реакция на двойную связь – обесцвечивание бромной воды:
Примеры решения задач по теме «формула алкенов»
ru.solverbook.com
Ответы@Mail.Ru: какая формула у алкана?
* Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. Алканы – название предельных углеводородов по международной номенклатуре. Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный) . Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода. Простейшие представители алканов: Формулы алканов Модели молекул: Модели молекул Модели молекул При сравнении этих соединений видно, что они отличаются друг от друга на группу -СН2- (метилен) . Добавляя к пропану еще одну группу -СН2-, получим бутан С4Н10, затем алканы С5Н12, С6Н14 и т. д. Теперь можно вывести общую формулу алканов. Число атомов углерода в ряду алканов примем за n, тогда число атомов водорода составит величину 2n+2. Следовательно, состав алканов соответствует общей формуле Cnh3n+2. Поэтому часто используется такое определение: * Алканы — углеводороды, состав которых выражается общей формулой Cnh3n+2, где n – число атомов углерода.
Алканы — это гомологический ряд органических соединений с общей ф-лой Cnh3n+2 Например: Ch5-метан C2H6-этан C3H8-пропан C4h20-бутан …
Вы идиоты или как? У вас формулу спросили а вы строчите на пол экрана дохера ненужной игры Форумала: Cnh3n+2
touch.otvet.mail.ru
Предельные углеводороды | Kursak.NET
Тема: Предельные углеводороды
План лекции:
- Общее понятие об алканах.
2. Гомологический ряд метана;
- Электронное строение алканов.
- Нахождение в природе и получение.
- Физические и химические свойства.
- Применение алканов.
Алканы.
Предельные углеводороды имеют общую формулу Cn H2n+2 , где n – число атомов углерода. Все связи C–C и C–H в алканах одинарные, поэтому алканы не способны к реакциям присоединения.
Принадлежность веществ к группе предельных углеводородов определяется характером их строения. Рассмотрим сначала строение наиболее простого углеводорода – метана.
Метан CH4 – газ без цвета и запаха, почти в 2 раза легче воздуха. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому он может быть обнаружен, например, в заболоченных водоёмах, в каменно угольных шахтах. В значительных количествах метан содержится в природном газе, который широко используется сейчас в качестве топлива в быту и на производстве.
Гомологическим рядом метана называется ряд алканов, в котором каждый последующий член отличается от предыдущего на одну метиленовую группу CH2.
|
Название углеводорода |
Молекулярная формула |
Формула строения |
Температура (в °C) |
|
|
плавление |
кипение |
|||
|
Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан И т.д. |
C1H4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 |
CH4 CH3 – CH3 CH3 – CH2 – CH3 CH3– CH2 – CH2 – CH3 CH3 – (CH2)3 – CH3 CH3 – (CH2)4 – CH3 CH3 – (CH2)5 – CH3 CH3 – (CH2)6 – CH3 CH3 – (CH2)7 – CH3 CH3 – (CH2)8 – CH3 |
-182 -183 -187 -138 -130 -95 -91 -57 -54 -30 |
-162 -89 -42 -0.5 +36 +69 +98 +126 +151 +174 |
Модели молекул:
Первые 4 вещества этого ряда имеют исторически сложившиеся названия. Названия углеводородов, начиная с пентана, образованы преимущественно от греческих названий чисел. Для наименования всех предельных углеводородов принят суффикс -ан.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях. Для алканов (начиная с бутана) характерна изомерия скелета: существования множества разветвлённых структур. Число изомеров резко возрастает с увеличением числа атома углерода.
Электронное строение алканов.
Все связи в молекулах алканов ковалентные неполярные или малополярные. Электронная конфигурация изолированного атома углерода 1s22s22p2. При образовании связи один из 2s-электронов переходит на p-орбиталь, при этом все 4 электронов (2s1 и2p3) становятся энергетически равноценными и занимают 4 одинаковые орбитали. Эти орбитали по способу образования называются sp3-гибридными. В алканах четыре sp3-гибридные орбитали направлены от центрального атома углерода к вершинам тетраэдра с углом между ними около 110 °C – именно в этом случае отталкивание между электронами и энергия системы минимальны.
Нахождение в природе и получение.
Алканы составляют значительную часть нефти, которая образовалась в результате разложения растительных и животных остатков. Метан составляет основную массу природного газа; в нём присутствуют также в небольших количествах этан, пропан и бутан. Метан содержится в выделениях болот и угольных пластов. Наряду с лёгкими гомологами метан присутствует в попутных нефтяных газах. Эти газы растворены в нефти под давлением и находятся также над ней.
Множество разнообразных углеводородов содержатся в нефти. При ее перегонке получают всё более высококипящие смеси углеводородов: газойль, бензин, керосин, соляровое масло (дизельное топливо), смазочные масла, вазелин, парафин. Жидкая смесь тяжёлых углеводородов называется мазутом. Для перегонки без разложения тяжёлых углеводородов используют пониженное давление. Чтобы нефть хорошо разделялась на отдельные фракции, используют перегонку на ректификационных колоннах с множеством тарелок; вверх поднимаются пары кипящей нефти, а навстречу им вниз стекают жидкие углеводороды. В результате самые тяжёлые фракции собираются в нижней части колонны, более лёгкие, включая газы, – в верхней.
Чтобы увеличить долю лёгких углеводородов при переработке нефти производят расщепление (крекинг) тяжёлых фракций. Процесс ведут при высокой температуре (термический крекинг), часто в присутствии катализаторов (каталитический крекинг). Реакция идёт по свободно-радикальному механизму и приводит к смеси предельных и непредельных углеводородов с прямой и разветвлённой цепью. Такие смеси используют для получения моторных топлив высокого качества.
При пиролизе нефти (нагрев без доступа воздуха выше 700 °C) образуются в значительных количествах газообразные углеводороды, в том числе не предельные, а также ароматические.
Углеводороды получают также путём пиролиза (коксования) каменного угля и его гидрирования (получение жидкого синтетического топлива).
Метан можно получить в лаборатории нагреванием ацетата натрия с твёрдой щелочью:
CH3COONa + NaOH →CH4 + Na2CO3.
Гомологи метана можно получить по реакции Вюрца:
2CH3Br + 2Na →CH3–CH3 + 2NaBr.
Физические свойства.
Первые 4 члена ряда – газы при обычных условиях, пропан и бутан легко сжижаются подавлением. Высшие гомологи – жидкости со слабым запахом бензина или твёрдые вещества, не растворяющиеся в воде. Температуры плавления и кипения алканов возрастают с увеличением числа атомов углерода в молекуле.
Химические свойства.
1) Для алканов характерны реакции замещения атомов водорода на другие атомы и группы атомов. Эти реакции идут по цепному механизму с промежуточным образованием свободных радикалов. Так, при хлорировании метана молекулы хлора при облучении или при облучении или при высокой температуре распадаются на атомы:
CH4 + Cl2 → CH3Cl + HCl;
CH3Cl + Cl2 →CH2Cl2 + Cl и т.д.
2) Алканы горят с выделением тепла, например:
C5H12 + 2 →5CO2 + 6H2O.
Газообразные алканы, например метан, образуют с воздухом взрывчатые смеси. Такие смеси могут образоваться в шахтах, а также в жилых домах при большой утечке бытового газа.
3) При высоких температурах происходит разложение (пиролиз) алканов, например:
CH4 →C + 2H2 (1000°C)
2CH4 →H–C C–H + 3H2 (1500°C)
H3C–CH3 → H2C=CH2 +H2 (825-830°C)
4) При нагревании и под действием катализаторов (например, AlCl3) неразветвлённые (нормальные) алканы превращаются в разветвлённые с тем же числом атомов углерода (изомеризуются).
5) Каталитическое дегидрирование (отщепление водорода) приводит к непредельным углеводородам, например:
C2H6 →C2H4 + H2.
Реакция идёт в присутствии катализатора (Ni).
6) Метан при высокой температуре в присутствии катализатора реагирует с водяным паром и оксидом углерода (IV) с образованием синтез – газа:
CH4 + H2O →CO + 3H2,
CH4 + CO2 →2CO + 2H2.
Синтез-газ используют для получения моторных топлив.
Применение алканов
Алканы используются в качестве топлива. Они служат сырьём для получения многих органических соединений – спиртов, кислот и др. Хлоропроизводные алканов используют в качестве растворителей, например, трихлорметан (хлороформ) CHCl3, тетрахлорметан CCl4. Смесь высших алканов – парафин используется в медицине, в производстве свеч, для синтеза жирных кислот.
kursak.net
