Теория электролитической диссоциации – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ. - В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.

Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ имени М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
КупитьСтепень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
α = ν / ν0.
Где ν — количество вещества, распавшееся на ионы,
ν0
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника
«Химия. 9 класс» под редакцией В.В. Еремина.
Как это сделать, можно узнать в § 11 учебника
«Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
NaCl → Na+ + Cl—
CaCl2 → Ca2+ + 2Cl—
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
Сh4COOH ⇄ Сh4COO— + H+
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике
«Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Реакции ионного обмена и условия их протекания» в учебнике
«Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Что еще почитать?
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
#ADVERTISING_INSERT#Пособие–памятка по теме:«Электролитическая диссоциация» (9 класс). | Методическая разработка по химии (9 класс) на тему:
Электролитическая диссоциация
Электролитическая диссоциация – распад электролитов в водных растворах на ионы.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД), С.А. Аррениус:
- Электролиты в водных растворах диссоциируют на ионы: положительные (катионы) и отрицательные (анионы). Перешедшие в раствор ионы окружены молекулами воды – гидратированы.
- Сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов (раствор в целом электронейтрален)
- Процесс электролитической диссоциации обратимый. Наряду с диссоциацией происходит обратный процесс – ассоциация ионов.
Процесс диссоциации записывают в виде уравнений (уравнений электролитической диссоциации):
KCl = K+ + Cl-; Al2(SO4)3 = 2Al3+ + 3SO42-; h4PO4 ↔ H+ + h3PO4-
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Сила электролита определяется степенью диссоциации ά. На степень диссоциации влияют: виды связей в веществе, природа растворителя, концентрация раствора (с уменьшением концентрации ά увеличивается), температура ( с ростом t ά увеличивается, т. к. диссоциация — процесс эндотермический).
к. диссоциация — процесс эндотермический).
Сильные электролиты диссоциированы практически нацело. В растворе нет молекул, есть только ионы.
сильные кислоты (не все кислоты!)- HNO3- азотная; HCl- соляная; h3SO4-серная; HBr- бромоводородная; HI- иодоводородная
сильные основания (все щелочи) – LiOH — гидроксид лития; NaOH — гидроксид натрия; KOH — гидроксид калия; Ca(OH)2 – гидроксид кальция; Ba(OH)2 – гидроксид бария
все растворимые соли
Неперечисленные вещества являются слабыми или средней силы электролитами или неэлектролитами.
Н2О – очень слабый электролит.
Кислоты, основания и соли в свете ТЭД
Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода
HNO3 = Н+ + NO3- h3SO4 = 2Н+ + SO42- сероводородная кислота Н2S ↔ Н+ + НS-
Знак обратимости ↔ используется в уравнениях диссоциации
слабых и средней силы электролитов
Основания – это электролиты, диссоциирующие в растворах с образованием гидроксид — ионов (ОН-)
KOH = K+ + OH- Ba(OH)2 = Ba2+ + 2OH-
Соли – это электролиты, диссоциирующие в растворах с образованием катионов металлов и анионов кислотных остатков
К3РО4 = 3K+ + PO42- Al2(SO4)3 = 2Al3+ + 3SO42-
Формулы и заряды катионов металлов и анионов кислотных остатков есть в
таблице растворимости кислот, оснований, солей !
Итак.
1.Электролиты в водных растворах диссоциируют:
- кислота = катионы водорода + анион кислотного остатка HCl = H+ + Cl-
- основание = катион металла и гидроксид-анионы NaOH = Na+ + OH-
- соль = катионы металла + анионы кислотного остатка КCl = К+ + Cl-
2. Индекс в формуле вещества становится коэффициентом перед формулой иона в уравнении диссоциации
Na2CO3 = 2Na+ + CO32- FeCl3 = Fe3+ 3Cl-
ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции, протекающие с участием растворов электролитов, являются реакциями между ионами. Их принято записывать с помощью ионных уравнений.
Правила составления ионных уравнений:
- Напишите молекулярное уравнение (не забудьте про коэффициенты). По таблице растворимости определите растворимость всех веществ и запишите над формулами
Р Р Н Р
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
- Перепишите это уравнение, записывая сильные электролиты как сумму соответствующих ионов, а слабые электролиты, нерастворимые и газообразные вещества – в молекулярной форме.
 Получите полное ионное уравнение
Получите полное ионное уравнение
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
- «Сократите» одинаковые ионы (выделены курсивом) в левой и правой части уравнения и запишите сокращенное ионно-молекулярное уравнение, отражающее суть процесса (показывает участвующие в реакции частицы и продукты реакции)
Ba2+ + SO42- = BaSO4↓
Реакции в растворах могут протекать: 1)необратимо; 2) обратимо; 3) практически не идут
Реакции идут до конца (необратимо), если концентрация
ионов в растворе уменьшается за счет связывания их c образованием:
А) нерастворимых и малорастворимых веществ
p p н p
KCl + AgNO3 = AgCl↓ + KCl
K+ + Cl- + Ag+ + NO3- = AgCl↓ + K+ + NO3-
Ag+ + Cl- = AgCl↓
p p н р
2h4PO4 + 3BaCl2 = Ba3(PO4)2↓ + 6HCl (h4PO4 – не сильный электролит, h4PO4↔Н+ + h3PO4-.
Иногда h4PO4 записывают в недиссоциированном виде)
Вариант 1. 2h4PO4 + 3Ba2+ + 6Cl- = Ba3(PO4)2↓ + 6H+ + 6Cl-
2h4PO4 + 3Ba2+ = Ba3(PO4)2↓ + 6H+
Вариант 2. 2H+ + 2h3PO4- + 3Ba2+ + 6Cl- = Ba3(PO4)2↓ + 6H+ + 6Cl-
2h3PO4- + 3Ba2+ = Ba3(PO4)2↓ + 4H+
В) газов
р р р
K2S + 2HCl = 2KCl + h3S↑ (↑ — газ)
2K+ + S2- + 2H+ + 2Cl- = 2K+ + 2Cl- + h3S↑
2H+ + S2- = h3S↑
Газ получается также при образовании нестойких: угольной кислоты h3CO3 = h3O + CO2↑
сернистой кислоты h3SO3 = h3O + SO2↑
гидроксида аммония Nh5OH = h3O + Nh4↑
например:
p p p
Na2CO3 + 2HCl = 2NaCl + CO2↑ + h3O
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + CO2↑ + h3O
CO32- + 2H+ = CO2↑ + h3O
В) слабых электролитов (обычно воды):
р р p
Ba(OH)2 + 2HCl = BaCl2 + 2h3O
Ba2+ + 2OH- + 2H+ + 2Cl- = Ba2+ + 2Cl- + 2h3O
2H+ + 2OH- = 2h3O
упростим коэффициенты H+ + OH- = h3O
Пример реакции, которая не идет до конца:
p p p p
2NaCl + Ba(NO3)2 = BaCl2 + 2NaNO3
2Na+ +2Cl- + Ba2+ + 2NO3- = Ba2+ + 2Cl- + 2Na+ + 2NO3-
Все ионы «сокращаются» — нет ионов, связывающихся и образующих продукты реакции.
▶▷▶ тема теория электролитической диссоциации контрольная работа
▶▷▶ тема теория электролитической диссоциации контрольная работа| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 03-11-2018 |
тема теория электролитической диссоциации контрольная работа — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по теме «Теория электролитической kopilkaurokovru/himiya/prochee/kontrol-naia Cached Контрольная работа по теме » Теория электролитической диссоциации » на два варианта для Контрольная работа по теме: quot;Электролитическая infourokru/kontrolnaya-rabota-po-teme Cached Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления Тестовая контрольная работа в 9 классе по теме: «Теория infourokru/testovaya-kontrolnaya-rabota-v Cached Контрольная работа №1 по теме: « Теория электролитической диссоциации » Вариант 1 Контрольная работа по химии в 9 классе на тему Теория wwwmetod-kopilkaru/kontrolnaya_rabota_po_himii Cached Скачать: контрольная работа по химии в 9 классе на тему теория электролитической Контрольная работа «Теория электролитической диссоциации» nsportalru/shkola/khimiya/library/2011/09/28/ Cached Методическая разработка по химии (9 класс) по теме: Контрольная работа » Теория Контрольная работа по теме «Электролитическая диссоциация wwwmetod-kopilkaru/kontrolnaya_rabota_po_teme Cached Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Урок №15 Контрольная работа №1 по теме «Электролитическая sitesgooglecom/site/himulacom/zvonok-na-urok/9 Версия 1 1 Напишите уравнения электролитической диссоциации следующих веществ: Проверочные и контрольные работы по теме «Электролитическая videourokinet/razrabotki/provierochnyie-i Cached Теория электролитической диссоциации Проверочная работа «Электролитическая диссоциация Контрольная работа №2 по теме: «Электролитическая диссоциация» lib2podeliseru/docs/16302/index-27299-6html Cached Контрольная работа №3 Тема : «Металлы» Учебно-тематический план Предмет химия, класс 9 (базовый уровень, 2 часа в неделю, всего 68 часов) № п п Тест по химии для 8 класса «Электролитическая диссоциация» globuss24ru/doc/test-po-himii-dlya-8-klassa Cached Контрольная работа для 8 класса «Атомы химических элементов, химическая связь» Контрольная работа для 8 класса «Водород», «Вода Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28,400 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты
- карбонат магния
- 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты
3При взаимодействии раствором каких веществ одним из продуктов реакции является вода: а)гидроксид натрия и фосфорная кислота) б) HNO3и Скрыть 5 Тестовая контрольная работа по теме : « Теория » урокрф › …testovaya_kontrolnaya_rabota_po…teoriya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) Читать ещё Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) 4) 3К электролитам относится 1) (раствор) 2) (газ) 3)глюкоза (раствор) 4) (газ) 4Электролитом является раствор Скрыть 6 « Теория электролитической диссоциации » nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Опубликовано 17012014 — 20:38 — Тусупаева Валерия Темирбековна Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между Скрыть 7 Тема I Электролитическая диссоциация Работа 5terkacom › Электролитическая диссоциация Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например
могут ли
- easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28
- химическая связь» Контрольная работа для 8 класса «Водород»
- smarter
тема теория электролитической диссоциации контрольная работа — Все результаты КарточкаКонтрольная работа по теме: «Теория — Инфоурок › Химия 16 мая 2018 г — Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 1 1Что такое катод и анод Контрольная работа по теме «Теория — Инфоурок › Химия Похожие 11 окт 2016 г — 9 класс Контрольная работа по теме « Теория электролитической диссоциации » 1 вариант 1 Составьте возможные уравнения Контрольная работа по теме: «Теория электролитической 16 мар 2013 г — Материал по химии (9 класс) по теме : Контрольная работа по теме : « Теория электролитической диссоциации » Опубликовано Тест по химии (9 класс) на тему: Контрольная работа по химии 9 15 сент 2018 г — Контрольная работа по теме « теория электролитической диссоциации » Вариант №1 Часть А выбрать только ОДИН правильный Тестовая контрольная работа по теме: «Теория — Урокрф 8 нояб 2017 г — Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 1 Часть 1 При выполнении заданий Контрольная работа по теме «Теория электролитической Похожие 15 окт 2015 г — Контрольная работа по теме Теория электролитической диссоциации на два варианта для учащихся 9 класса к учебнику Рудзитис ГЕ, Контрольная работа по химии «Теория электролитической Похожие 23 окт 2014 г — Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в Урок-конкурс по теме «Теория электролитической диссоциации» 8 открытыйурокрф/статьи/594230/ закрепление и обобщение знаний по теме , подготовка к контрольной работе ,; развитие творческой и познавательной активности учащихся, Теория электролитической диссоциации (3) — Лабораторная работа Лабораторная работа №1 Тема : Теория электролитической диссоциации 1 Цель: Провести реакции ионного обмена между электролитами 2 Контрольная работа по химии в 9 классе на тему Теория Похожие 5 янв 2015 г — Урок № 17 Тема : Контрольная работа Цель: Обобщение, повторение и закрепление темы « Электролитическая диссоциация » Задачи Контрольная работа по химии 9 класс по теме «Теория newteacherjournalru//1438-kontrolnaya-rabota-po-khimii-9-klass-po-teme-teoriya 13 февр 2017 г — Контрольная работа по химии 9 класс по теме » Теория электролитической диссоциации » Автор: Виктория Юрьевна Сергеева вкл Коваленко Л | Теория электролитической диссоциации | Журнал him1septemberru/articlephp?ID=200404512 Похожие Поэтому я предлагаю разработку урока коррекции, проведенного после контрольной работы по теме « Теория электролитической диссоциации », МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ ИЗУЧЕНИЯ ТЕМЫ «ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ Полная версия работы доступна во вкладке «Файлы работы» в формате PDF Контрольная работа по теме « Теория электролитической диссоциации » химия 9 wwwsc109ru/content/distant/chime/9html Похожие Закончится повторение контрольной работой , которая определит готовность учащихся к Тема 1 Теория электролитической диссоциации (10 уроков) контрольная работа 9 класс — Химия — Мультиурок Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между веществами: Подготовка к контрольной работе по теме «Теория iighjghblogspotcom/2012/10/blog-post_31html 31 окт 2012 г — Напишите уравнение электролитический диссоциации: к контрольной работе по теме » Теория электролитической диссоциации » Контрольная работа «Химические реакции Растворы Теория uchitelyacom/himiya/66665-kontrolnaya-rabota-himicheskie-reakcii-rastvoryhtml «Химические реакции Растворы Теория электролитической диссоциации » Контрольная работа по теме «Химические реакции Растворы Теория контрольная работа по теме: «Строение вещества Теория wwwzavuchru/methodlib/134/55724/ Похожие Теория электролитической диссоциации » Методической библиотеки портала Контрольная работа для учащихся 9 класса в виде теста по теме Контрольная работа по теме «Теория электролитической wwwseznaikaru › Химия/ › Контрольные/ Контрольная работа по теме » Теория электролитической диссоциации » 11 класс Вариант 1 Какие из следующих жидкостей проводят электрический Контрольная работа по теме: «Теория электролитической pedsovetpro/indexphp?option=com_content&view=article&id=16036 19 мар 2016 г — Вариант №1 1 Напишите уравнения возможных реакций между веществами: а) нитратом бария и сульфатом калия; б) сульфатом контрольная работа теория электролитической диссоциации 9 класс riggiru/userfiles/kontrolnaia-rabota-teoriia-elektroliticheskoi-dissotsiatsii-9-klassxml контрольная работа теория электролитической диссоциации 9 класс — Все результаты Контрольная работа по теме «Теория — Инфоурок › Химия Теория электролитической диссоциации — Электролитическая › › Электролитическая диссоциация Для объяснения особенностей водных растворов электролитов шведским ученым САррениусом в 1887 г была предложена теория электролитической Вопросы по теме «Теория электролитической диссоциации» www150solradymedusiteru/p270aa1html Вопросы по теме « Теория электролитической диссоциации » Как разделили все электролиты по степени диссоциации? 10 Контрольная работа Методика изучения темы «Теория электролитической диссоциации» Место и значение темы » Теория электролитической диссоциации » в курсе химии Основные понятия и контрольная работа , добавлен 17012018 4 Теория электролитической диссоциации Гидролиз солей (14 часа) Раздел № 1, Теория электролитической диссоциации лабораторных опытов – 2, · расчетных задач – 1, · контрольная работа — 1, 14 ч п\п, Дата, Наименование раздела, темы 1 четверть, количество часов, всего часов, Д/з Контрольная работа по теме: «Теория — Pandiaru Контрольные работы Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между Контрольная работа 2 по теме «Электролитическая диссоциация Контрольная работа 2 по теме «Электролитическая диссоциация» последнее превращение с точки зрения теории электролитической диссоциации Химия 9 класс Теория электролитической диссоциации > Реакции Тест по предмету Химия для 9 класса по теме Теория электролитической Контрольная работа по математике 6 класс, по теме : » Делимость чисел» Контрольная работа по теме «Теория Электролитической nenudaru/контрольная-работа-по-теме-теория-электролитической-диссоцhtml Контрольная работа по теме « Теория Электролитической диссоциации » Задание 1 Сильным электролитом является Тема I Электролитическая диссоциация Работа 3 Химические Тема I Электролитическая диссоциация Работа 3 Химические свойства кислот, солей и оснований в свете теории электролитической диссоциации Реферат: Теория электролитической диссоциации — Xreferatcom Лабораторная работа Тема : ” Теория электролитической диссоциации ” Опыт № 1 Разная сущность взаимодействия разбавленной и Контрольная работа по теме: «Теория электролитической › Библиотека › Химия Контрольная работа по теме : « Теория электролитической диссоциации » Контрольная работа по теме : « Теория электролитической диссоциации » Контрольная работа по теме Теория электролитической › Учителю › Химия 1 окт 2016 г — Материал по химии Контрольная работа по теме Теория электролитической диссоциации , 9 класс, Химия, УМК ФГФельдман, Теория электролитической диссоциации — ПОМОЩЬ — Форум химиков на forumxumukru › Школьникам и студентам — решение задач › ПОМОЩЬ 11 окт 2011 г — Здраствуйте, проверьте пожалуйста задание Домашняя контрольная по теме » Теория Электролитической диссоциации » Вариант 1 Контрольная работа по теме: «Теория электролитической 27 нояб 2017 г — Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс 1Напишите уравнения возможных реакций между Контрольная работа по теме: «Теория электролитической studydocru/doc//kontrol_naya-rabota-po-teme—«teoriya-e-lektroliticheskoj-dis Похожие Скачать No category Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс Вариант №1 1 К кислотам относится каждое из [DOC] Тема 6 Теория электролитической диссоциации и свойства Свойства солей в свете теории электролитической диссоциации 16, 9, Контрольная работа №1 по теме «Атомы химических элементов», 1 Тема 3 [DOC] ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Программа по химии разработана Похожие Основные положения теории электролитической диссоциации Тепловые Контрольная работа по теме « Теория электролитической диссоциации » 1 Теория электролитической диссоциации : Лабораторная работа Похожие Лабораторная работа Тема : ” Теория электролитической диссоциации ” Опыт № 1 Разная сущность взаимодействия разбавленной и [DOC] Контрольные работы по русскому языку — Школа № 939 sch939umskobrru/files/obwie%20svedenia/himiyadoc Контрольные работы по химии ( темы контроля) Классы Учитель Тема контроля 8 А К/р №4 Теория электролитической диссоциации ; 8 Б Электролитическая диссоциация — Википедия Похожие Перейти к разделу Классическая теория электролитической диссоциации — Классическая теория электролитической диссоциации была создана С [DOC] Электролитическая диссоциация (10ч+1) — Джинабинская СОШ djinabidagschoolcom/_http_schools/1718/djinabi//5_%20%20%20doc физическую и химическую теорию растворов; насыщенные и ненасыщенные Контрольная работа №1 по теме « Электролитическая диссоциация » Контрольная работа по химии по теме Теория электролитической 5 сент 2017 г — Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1 С какими из перечисленных веществ может Контрольная работа по теме: «Теория электролитической › Каталог › Остальные рефераты 15 авг 2016 г — Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс 1Напишите уравнения возможных реакций между контрольна работа по теме теория электролитической диссоциации hkonlinecomhk//kontrolna-rabota-po-teme-teoriia-elektroliticheskoi-dissotsiatsiix контрольна работа по теме теория электролитической диссоциации — Все результаты Тестовая контрольная работа в 9 классе по теме : «Теория [PDF] Поурочное планирование по химии 9 класс s_39_specedu54ru/DswMedia/ximiya9klassrppdf основных положениях теории электролитической диссоциации , отработки умений учащихся по теме и проведения контрольной работы • Введен Реферат: Теория электролитической диссоциации — BestReferatru Название: Теория электролитической диссоциации Раздел: Биология и химия Тип: реферат Добавлен 00:56:58 13 января 2004 Похожие работы Контрольная работа для 9 класса по теме: «Теория — Педпортал Похожие Контрольная работа для 9 класса по теме : » Теория электролитической диссоциации » (Разное) Учебное пособие для учителей Курсовая работа (Теория) на тему «Определение константы studentlibcom/kursovaya_rabota_teoriya-133370-opredelenie_konstanty_dissociacii_ 20 авг 2016 г — Курсовая работа ( Теория ) по химии на тему : Определение При электролитической диссоциации разрываются обычно лишь [DOC] Таблица 1 Тематическое планирование курса «Химия 9 класс» из 10/10 Контрольная работа № 1, 1 Тема 2 Химическая реакция, 17 1/11 соединений в свете теории электролитической диссоциации , 1 8/18 Вместе с тема теория электролитической диссоциации контрольная работа часто ищут ответы на контрольную работу по химии электролитическая диссоциация контрольная работа по теме теория электролитической диссоциации ответы 8 класс тест по теме теория электролитической диссоциации вариант 2 теория электролитической диссоциации вариант 1 тест 6 теория электролитической диссоциации 8 класс контрольная работа № 1 по теме электролитическая диссоциация контрольная работа по химии 9 класс рудзитис электролитическая диссоциация контрольная работа по химии 8 класс электролитическая диссоциация Навигация по страницам 1 2 3 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Музыка Переводчик Диск Почта Коллекции Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Контрольная работа по химии « Теория » videourokinet › …rabota…teoriya…dissotsiatsiihtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в молекулярном и ионном виде между следующими Читать ещё Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в молекулярном и ионном виде между следующими веществами: а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; в) карбонатом натрия и соляной кислотой; г) оксидом углерода (IV) и гидроксидом натрия Скрыть 2 Контрольная работа по теме : « Теория » pandiaru › text/80/295/4728php Показать ещё с сайта Пожаловаться Информация о сайте « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами Задания для вступительных контрольных работ по математике Задания для вступительных контрольных работ по физике Основные порталы, построенные редакторами Домашний очаг Читать ещё « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами: Вариант №1 а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; в) сульфидом натрия и соляной кислотой; г) оксидом углерода (IV) и гидроксидом натрия Задания для вступительных контрольных работ по математике Задания для вступительных контрольных работ по физике Основные порталы, построенные редакторами Домашний очаг Скрыть 3 Методическая разработка по химии (9 класс) по теме nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между Контрольная работа по химии 9 класс Тема контрольной работы » Теория электролитической диссоциации » на два варианта Мне нравится Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами: Вариант №1 Контрольная работа по химии 9 класс Тема контрольной работы » Теория электролитической диссоциации » на два варианта Мне нравится Поделиться Скрыть 4 Карточка Контрольная работа по теме : « Теория » infourokru › …rabota…teme-teoriya…dissociacii-dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 2 1Что такое электролиты и не электролиты определения с примерами веществ 2Что такое ионы и какие они бывают и как называются Какие из формулы веществ не электролиты выберите : гидроксид натрия Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 2 1Что такое электролиты и не электролиты определения с примерами веществ 2Что такое ионы и какие они бывают и как называются Какие из формулы веществ не электролиты выберите : гидроксид натрия, углекислый газ, хлорид железа 2, кремниевая кислота, оксид меди 2, сульфат калия, карбонат магния, этиловый спирт, азотная кислота, 3При взаимодействии раствором каких веществ одним из продуктов реакции является вода: а)гидроксид натрия и фосфорная кислота) б) HNO3и Скрыть 5 Тестовая контрольная работа по теме : « Теория » урокрф › …testovaya_kontrolnaya_rabota_po…teoriya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) Читать ещё Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) 4) 3К электролитам относится 1) (раствор) 2) (газ) 3)глюкоза (раствор) 4) (газ) 4Электролитом является раствор Скрыть 6 « Теория электролитической диссоциации » nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Опубликовано 17012014 — 20:38 — Тусупаева Валерия Темирбековна Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между Скрыть 7 Тема I Электролитическая диссоциация Работа 5terkacom › Электролитическая диссоциация Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например, могут ли, чему равен или найти) Читать ещё Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например, могут ли, чему равен или найти): Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Скрыть 8 Контрольная работа по теме » Теория » kopilkaurokovru › himiya…naia-rabota…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Просмотр содержимого документа « Контрольная работа по теме » Теория электролитической диссоциации » » Читать ещё Просмотр содержимого документа « Контрольная работа по теме » Теория электролитической диссоциации » » Контрольная работа по теме « Теория электролитической диссоциации » 1Составьте уравнения возможных реакций в молекулярном и ионном виде Вариант 1 Скрыть 9 Тема теория электролитической диссоциации контрольная работа — смотрите картинки ЯндексКартинки › тема теория электролитической диссоциации Пожаловаться Информация о сайте 27 октября Ещё картинки 10 Тест по теме « Теория электролитической » znanijacom › task/28097474 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Нажми, чтобы увидеть ответ на свой вопрос: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Читать ещё Нажми, 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты, основания и соли с позиции теории диссоциации Читать ещё Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Часть А каждого варианта — это тестовые задания с выбором одного правильного ответа Часть Б состоит из 4 заданий с развернутыми ответами, последнее из которых — качественная задача Задания типовые, ориентированы на формат заданий итоговой аттестации Задания включают элементы знаний по следующим разделам темы : 1) электролиты и неэлектролиты; 2) электролитическая диссоциация ; 3) кислоты, основания и соли с позиции теории диссоциации ; 4) степень диссоциации , сильные и слабые элект Скрыть 1 2 3 4 5 дальше Браузер Для безопасных прогулок в сети 0+ Скачать
9 класс, учебный год, базовый уровень, химия.
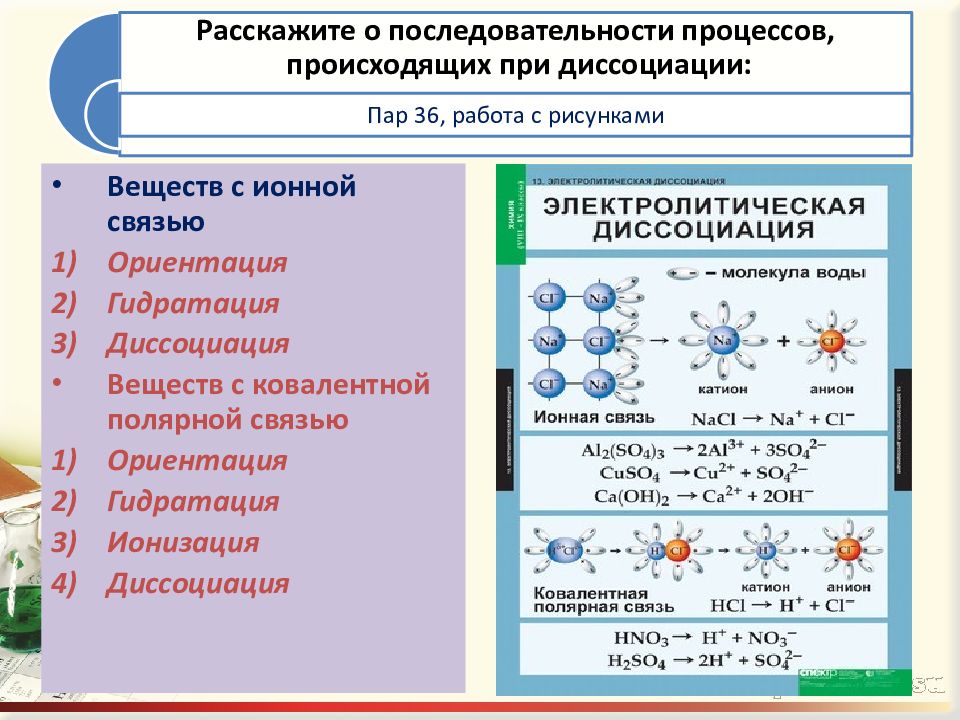 Колво. часов. Теория электролитической диссоциации (10 часов)
Колво. часов. Теория электролитической диссоциации (10 часов)
ПЛАНИРУЕМЫЕ ПРЕДМЕТНЫЕ РЕЗУЛЬТАТЫ
ПЛАНИРУЕМЫЕ ПРЕДМЕТНЫЕ РЕЗУЛЬТАТЫ (Результаты изучения учебного предмета) В результате изучения химии на базовом уровне ученик должен: знать / понимать химическую символику: знаки химических элементов,
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Данная рабочая программа по химии в 9 «А» классе составлена на основе федерального компонента образовательного стандарта и программы курса химии для 8-11 классов общеобразовательных
Подробнее1.
 ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ
ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ
1. ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ Раздел 2. Многообразие химических реакций В результате изучения раздела учащиеся должны важнейшие химические понятия: классификация химических реакций различными способами,
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа составлена на основе примерной программы основного общего образования и авторской программы Гара Н.Н для общеобразовательных учреждений к учебникам химии авторов
ПодробнееI. ПЛАНИРУЕМЫЕ ПРЕДМЕТНЫЕ РЕЗУЛЬТАТЫ
ХИМИЯ 9 КЛАСС Рабочая программа разработана на основе программы общеобразовательных учреждений Химия 8-9 классы, М.: Просвещение,2008, автор Гара Н.Н., 70 часов 9 класс из расчёта 2 часа в неделю. В рабочей
ПодробнееРАБОЧАЯ ПРОГРАММА ПЕДАГОГА
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ АЛТАЙСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА 5 Согласовано: Согласовано: Утверждено: руководитель МО зам.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА. Программа разработана на основе обязательного минимума содержания образования по химии базового уровня общеобразовательных учреждений. Исходными документами для составления рабочей
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа по химии составлена в соответствии с федеральным компонентом государственного стандарта основного общего образования, примерной программы по химии, а также программы
ПодробнееАннотация к рабочей программе по химии
. Аннотация к рабочей программе по химии Рабочая программа по химии для основной школы составлена на основе: 1. Федеральный Закон «Об образовании в РФ» от 29 декабря 2012 года, 273.
Пояснительная записка
Пояснительная записка Рабочая программа по химии разработана в соответствии с Федеральным законом «Об образовании в Российской Федерации» от 29.12.2012 г. 273-ФЗ, требованиями федерального компонента государственного
ПодробнееІX класс, XІ (ХII) классы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ «РЕСПУБЛИКАНСКИЙ ЦЕНТР РАЗВИТИЯ ОБРАЗОВАНИЯ»
ПодробнееРАБОЧАЯ ПРОГРАММА. «Химия» 9 класс
ДЕПАРТАМЕНТ СПОРТА И ТУРИЗМА ГОРОДА МОСКВЫ Государственное бюджетное профессиональное образовательное учреждение города Москвы «Московское среднее специальное училище олимпийского резерва 4 имени А. Я.
Я.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Программа разработана на основе авторской программы Н.Н. Гара: Химия. Рабочие программы. Предметная линия учебников Г. Е. Рудзитиса, Ф. Г. Фельдмана. 8 9 классы: пособие для учителей
ПодробнееПояснительная записка
Пояснительная записка Настоящая программа раскрывает содержание обучения химии учащихся в 8-9 классах общеобразовательных учреждений. В системе естественно-научного образования химия как учебный предмет
ПодробнееРАБОЧАЯ ПРОГРАММА ПО ХИМИИ ДЛЯ 9 а КЛАССА
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 15 имени Н.А.Хардиной городского округа Самара Рассмотрено на заседании МО Протокол от 2014г «Согласовано» Заместитель
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа составлена на основе федерального компонента государственного стандарта общего образования, федерального БУП 2004, примерной программы основного общего образования
ПодробнееБИЛЕТЫ ПО ХИМИИ КЛАСС.
БИЛЕТЫ ПО ХИМИИ 10-11 КЛАСС. БИЛЕТ 1 1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периоди- ческого закона для
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа составлена на основе Государственного стандарта общего образования, а также программы курса химии для 8-11 классов общеобразовательных учреждений (автор О.С. Габриелян),
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа учебного курса «Химия» для 8-9 классов составлена в соответствии с требованиями федерального компонента государственного стандарта общего образования, на основе
Подробнеедля обучающихся 9 класса базовый уровень
ПРАВИТЕЛЬСТВО САНКТ-ПЕТЕРБУРГА КОМИТЕТ ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА 33 НЕВСКОГО РАЙОНА САНКТ-ПЕТЕРБУРГА РАССМОТРЕНА на заседании
ПодробнееПояснительная записка
Пояснительная записка Рабочая программа по химии составлена на основе следующих документов: Государственный стандарт общего образования Министерства Образования РФ от 05. 03.2004г. 1089. Примерная программа,
03.2004г. 1089. Примерная программа,
Рабочая программа «химия» (8-9 класс)
Приложение 1 к ООП ООО ФК ГОС МБОУ «СОШ 19» Рабочая программа «химия» (8-9 класс) Разработала: учитель химии Абанина Д.П. Требования к уровню подготовки обучающихся по учебному предмету «Химия», 8-9 классы:
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Статус документа Рабочая программа по химии составлена для 9 класса на основе Примерной программы основного общего образования по химии. В рабочей программе определен перечень демонстраций,
ПодробнееPowered by TCPDF (www.tcpdf.org)
Powered by TCPDF (www.tcpdf.org) Пояснительная записка Рабочая программа по химии для 9 класса основной общеобразовательной школы разработана в соответствии с федеральным компонентом государственного стандарта
ПодробнееПРОГРАММА КУРСА ХИМИИ
ПРОГРАММА КУРСА ХИМИИ 9 класс 1. Пояснительная записка Настоящая программа раскрывает содержание обучения химии учащихся в 9 классе общеобразовательных учреждений. Она рассчитана на 68 ч/год (2 ч/нед.).
Пояснительная записка Настоящая программа раскрывает содержание обучения химии учащихся в 9 классе общеобразовательных учреждений. Она рассчитана на 68 ч/год (2 ч/нед.).
Билет 1 Билет 2 Билет 3 Билет 4 Билет 5
Билет 1 1. Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. 2. Предельные углеводороды,
Подробнее2018/2019 учебный год
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы среднего образования по учебному
ПодробнееУчебно-тематическое планирование
Учебно-тематическое планирование по химии Класс 9 Учитель Саликова Фарида Дамировна Количество часов всего 68 часов, в неделю 2 часа. Плановых контрольных уроков- 4, практических работ-6. Планирование
Плановых контрольных уроков- 4, практических работ-6. Планирование
2018/2019 учебный год
УТВЕРЖДЕНО Приказ Министра образования Республики Беларусь 03.12.2018 836 Билеты для проведения экзамена в порядке экстерната при освоении содержания образовательной программы базового образования по учебному
ПодробнееПояснительная записка.
Пояснительная записка. Настоящая программа разработана на основе примерной программы основного общего образования по химии (базовый уровень), соответствующей федеральному компоненту государственного стандарта
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа по химии для 9 класса составлена на основании следующих документов: 1. Закон РФ «Об образовании в Российской Федерации» 273-ФЗ от 29. 12.2012 2. Федерального компонента
12.2012 2. Федерального компонента
Урок химии «Теория электолитической диссоциации». 9 класс. Учитель Козлова О.Н. — Разработки уроков — Методические разработки
Технологическая карта урока химии «Теория электролитической диссоциации»
Преподаватель: Козлова Оксана Николаевна, учитель химии и биологии МКОУ «СШ №8» г. Ефремова Тульской области.
Предмет: химия
Класс: 9
УМК под редакцией Кузнецовой Н.Е.
Тема урока: Теория электролитической диссоциации
Цель урока: обобщить и расширить знания учащихся об электролитической диссоциации.
Задачи урока
- Образовательные: закрепить, обобщить и систематизировать знания учащихся об электролитах и неэлектролитах, механизме электролитической диссоциации, условиях течения реакций ионного обмена до конца, о свойствах кислот, оснований, солей в свете теории электролитической диссоциации.

- Развивающие: продолжить развитие речевых навыков, наблюдательности и умения выделять главное, обобщать, делать выводы на основе экспериментальных опытов и полученных знаний.
- Воспитывающие: создать условия для воспитания сознательного отношения к учебному труду, чувства ответственности, развивать интерес к знаниям.
- Здоровьесберегающие: закрепить навыки безопасного обращения с реактивами и приборами.
Тип урока: урок обобщения и систематизации полученных знаний
Вид урока: урок – игра путешествие
Формы организации учебной деятельности: индивидуальная, групповая, фронтальная.
Технологии обучения: информационно-коммуникативные, игровые, здоровьесберегающие, проблемное обучение.
Методы: частично-поисковые, практические, игровые, наглядные.
Методические приемы: презентация; работа с терминами, мозговой штурм, творческое исследовательское задание, работа в парах, сообщение учащегося.
Оборудование: проектор, экран, компьютер, мультимедийная презентация, маршрутные листы, химозы, таблица «Качественные реакции на катионы и анионы», таблица «Растворимость кислот, оснований, солей», пробирки (2), индивидуальные карточки для домашнего задания.
Реактивы: раствор хлорида бария, индикаторная бумага, раствор серной кислоты.
Место урока в изучаемой теме:
Данный урок является одиннадцатым в серии уроков (всего тринадцать) по теме «Растворы. Теория электролитической диссоциации».
Формируемые универсальные учебные действия:
- личностные — повышение мотивации учащихся через ученический химический эксперимент, интересные факты, игровую деятельность; умение использовать имеющиеся знания и личный опыт в новых условиях, рефлексия собственной деятельности, самооценка;
- коммуникативные — умение высказать суждение, ответить на поставленный вопрос, работать с информацией, умение работать в коллективе для достижения поставленной цели; адекватно воспринимать оценочную информацию со стороны одноклассников и учителя по поводу правильности ответов;
- познавательные — умение осуществлять анализ объектов; устанавливать причинно-следственные связи; выдвигать гипотезу и доказывать ее посредством химического эксперимента; строить логическую цепь рассуждений при опровержении предложенных софизмов; преобразовывать информацию из одной формы в другую;
- регулятивные – умение формулировать цели урока; принимать и сохранять учебную задачу; планировать свои действия в соответствии с поставленной задачей; корректировать деятельность: вносить изменения в процесс с учетом возникших трудностей и ошибок; развивать волевую регуляцию, оценивать результаты деятельности.

Презентация: «Сущность процесса электролитической диссоциации»
библиотека
материалов
Содержание слайдов
Номер слайда 1
Сущность процесса электролитической диссоциации
Номер слайда 2
Электролитическая диссоциация — это процесс распада молекул на ионы при его растворении или плавлении.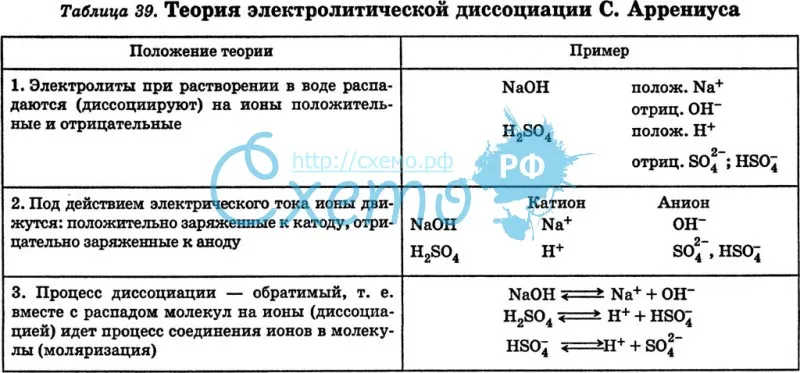
Номер слайда 3
Номер слайда 4
Номер слайда 5
Действие электрического тока на раствор или расплав вещества
Номер слайда 6
Номер слайда 7
Теория Аррениуса включала следующие основные положения: Электролиты в растворах диссоциируют на ионы. Диссоциация является неполной и к процессу дис-ции применим ЗДМ. Растворы электролитов электропроводны.
Диссоциация является неполной и к процессу дис-ции применим ЗДМ. Растворы электролитов электропроводны.
Номер слайда 8
Упражнения по изученной теме: 1. Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль 1) серная кислота 2) сульфид натрия 3) хлорид бария 4) сульфат меди 2
Номер слайда 9
Номер слайда 10
3. Одинаковое число положительных и отрицательных ионов образуется при электролитической диссоциации 1) хлорида калия 2) хлорида бария 3) карбоната натрия 4) сульфата алюминия
Одинаковое число положительных и отрицательных ионов образуется при электролитической диссоциации 1) хлорида калия 2) хлорида бария 3) карбоната натрия 4) сульфата алюминия
Номер слайда 11
Номер слайда 12
5. Электролитом является 1) поваренная соль 2) метан 3) графит 4) этиловый спирт
Номер слайда 13
Ответы: 1 — 4 2 — 3 3 — 1 4 — 4 5 — 1
Электролитическая диссоциация. 9 класс — презентация онлайн
Электролитическаядиссоциация
Автор работы
Федорова В.В.
учитель химии высшей категории
МАОУ «СОШ № 40» г.Новоуральск
11.11.2020
pptcloud.ru
1
Сванте Август
Аррениус (1859-1927)
История возникновения
теории электролитической
диссоциации связана с
именем шведского физикохимика Аррениуса. Он был
разносторонним ученым: его
перу принадлежит более
двухсот научных работ в
области химии, физики,
геофизики, метеорологии,
биологии и физиологии.
В 1887 году шведский химик
Сванте Аррениус сформулировал
основные положения теории
электролитической диссоциации
11.11.2020
3
Он родился в 1859 году в старинном шведском городе Упсале. В
гимназии он был одним из лучших учеников, особенно легко ему
давалось изучение физики и математики. В 1876 году он был принят в
Упсальский университет. И уже через два года (на полгода раньше
срока) он сдал экзамен на степень кандидата философии. Однако
впоследствии он жаловался, что обучение в университете велось по
устаревшим схемам: например, «нельзя было услышать ни единого
слова о менделеевской системе, а ведь ей было уже больше десяти
лет». Физик по образованию, он прославился своими химическими
исследованиями и стал одним из основателей новой науки —
физической химии. Больше всего он занимался изучением поведения
веществ-электролитов в растворах, а также исследованием скорости
химических реакций. За разработку теории электролитической
диссоциации ему была присуждена Нобелевская премия за 1903 год.
Веселый и добродушный великан, настоящий «сын шведской
сельской местности», он всегда был душой общества, располагал к
себе коллег и просто знакомых.
Вещества по
электропроводности
Электролиты
Неэлектролиты
вещества, растворы и
расплавы которых
проводят электрический
ток
вещества, растворы и
расплавы которых не
проводят
электрический ток
1
1. Рис.1
Вещества
Электролиты
Неэлектролиты
ХС
ионная,
ковалентная полярная
ХС
ковалентная неполярная,
малополярная
большинство
неорганических кислот,
соли, щелочи
большинство
органических веществ,
многие газы
11.11.2020
6
Вода –
хороший растворитель,
т.к. молекулы воды полярны.
Вода –
слабый амфотерный
электролит.
11.11.2020
«Капля воды и камень точит»
104,50
7
1. Электролиты и неэлектролиты
Электролиты —
это вещества, растворы и
расплавы которых
проводят электрический ток.
Кислоты: HCl; HNO3; h3SO4
Щелочи: NaOH; KOH; Ba(OH)2
Соли:
NaCl; CuSO4; Al(NO3)3
11.11.2020
8
Электролиты
—
Катод
Анод
+
—
+
+
Катионы
—
Анионы
+
+
Рис.2.
11.11.2020
9
1. Электролиты и неэлектролиты
Неэлектролиты —
это вещества, растворы или
расплавы которых не
проводят электрический ток.
Органические вещества:
сахар, ацетон,бензин, керосин, глицерин,
этиловый спирт, бензол и др.
Газы: кислород, водород, азот идр.
11.11.2020
10
Неэлектролиты
—
Катод
Анод
+
Рис.3.
11.11.2020
11
2.Электролитическая диссоциация
Электролитическая диссоциация процесс распада молекул
электролита на ионы в
растворе или расплаве.
С.Аррениус
Теория электролитической
диссоциации. 1887 г.
11.11.2020
«Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов
12
• Сторонники физической теории растворов (Вант-Гофф,
Аррениус и Освальд) считали, что процесс растворения
результат
диффузии,
т.е.
проникновения
растворенного вещества в промежутки между
молекулами воды. В растворах находятся ионы.
• Д.И. Менделеев и его сторонники доказывали, что
растворение – результат химического взаимодействия
растворенного вещества с молекулами воды.
• В результате химического взаимодействия с водой
образуются соединения – гидраты.
• И.А. Каблуков и В.А. Кистяковский применили
химическую теорию Д.И. Менделеева и доказали
что в растворе находятся не свободные ионы а
гидратированные.
• Они показали, что растворение — физикохимический процесс, включающий в себя как
образование ионов (теория электролитической
диссоциации), так и гидратацию веществ
(гидратная теория) молекулами воды.
Нагревание
усиливает колебания
ионов в узлах
кристаллической
решётки, в результате
чего она разрушается.
Образуется расплав,
состоящий из ионов.
Вода — полярная
молекула
Диполи воды
«вырывают» ионы из
кристаллической
решётки
Вода ослабляет
взаимодействие между
ионами в 81 раз
Кристаллическая
решетка
разрушается
ИОНЫ – это положительно или отрицательно
заряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи или
присоединения электронов
Механизм электролитической диссоциации
веществ с ионной связью
Раствор
Рис.4.
+
—
+
—
+
—
+
—
+
—
+
—
+
—
+
Кристалл
+
Н 2О
+
Гидратированные ионы
NaCl → Na+ + Cl —
подробнее
Механизм электролитической диссоциации
веществ с ковалентной полярной связью
Раствор
Рис.5.
+
Н 2О
—
+
Сl-
HCl
H+
Cl-
Н+
Гидратированные ионы
НCl → Н+ + Cl —
подробнее
2.Сильные и слабые электролиты
+
+
+
++
+
+
+
Сильные и слабые
Рис.6.
20
Отношение числа распавшихся молекул к общему числу
молекул в растворе
Сила электролита
2.Сильные и слабые электролиты
Электролиты
Соли
Сильные (α >30%) Слабые (α
практически все
Hg2Cl2 , некоторые
cоли тяжелых металлов
гидроксиды
щелочных и
щелочноземельных
металлов
водный раствор
аммиака
Основания
растворимые в воде
нерастворимые
—
все
Кислоты
HI, HBr, HCl
кислородосодержащие HClO4 h3SO4,
HNO3
бескислородные
HF, h3S
h3SO3, h3CO3,
h3SiO3, Н3РO4,
Ch4COOH и др.
2.Сильные и слабые электролиты
Рис.7. Степень диссоциации некоторых кислот в водных
растворах при 180С
%
Ряд 1;
соляная;
92
Ряд 1;
серная; 58Ряд 1; Ряд 1; Ряд 1;
ортофосф
плавиков
угольная;
орная ; 30
ая; 8,5
0,17
23
• 4..Электролитическая диссоциация для
слабых электролитов – процесс обратимый.
Обратный процесс – ассоциация.
• 5..Не все электролиты в одинаковой мере
диссоциируют на ионы.
• 6.Химические свойства электролитов
определяются свойствами тех ионов, которые
они образуют при диссоциации.
Диссоциация кислот
5. Диссоциация кислот, оснований, солей
Кислоты — это сложные вещества, при
диссоциации которых в водных
растворах в качестве катионов
отщепляются только ионы водорода.
НCl → Н+ + Cl —
+
Н
Н2SO4 → 2Н+ + SO4 2-
Н2 CO3
11.11.2020
2 Н+ + CO3 227
Диссоциация оснований
Основания — это сложные вещества,
при диссоциации которых в водных
растворах в качестве анионов
отщепляются только гидроксид-ионы.
KOH → K
Ca(OH)2
Мe(OH)n
11.11.2020
+
—
+ OН
2+
Ca
n+
Me
—
ОН
—
+ 2 OН
—
+ n OН
28
Диссоциация солей
Соли — это сложные вещества,
которые в водных растворах
диссоциируют на катионы металла и
анионы кислотного остатка.
NaCl →
K2SO4
Na+ + Сl→ 2 K+ + SO4 2-
Al(NO3)3 → Al3+ + 3 NO3 —
n+
Me
11.11.2020
(кислотный остаток)
в29
Электролитическая диссоциация
6. О значении электролитов для живых организмов
Электролиты – составная часть жидкостей и плотных
тканей живых организмов.
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; НCO3- имеют
большое значение для физиологических и биохимических
процессов:
ионы H+; OH- играют большую роль в работе ферментов,
обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине
применяется физиологический раствор – 0,85% раствор
NaCl;
ионы I — влияют на работу щитовидной железы.
30
6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека
Ионы
2+
Са
Mg
Fe
2+
2+
Zn
2+
Mn
2+
Типичный симптом
Замедление роста скелета
Мускульные судороги
Анемия, нарушение иммунной
системы
Повреждение кожи, замедление
полового созревания
Учащение депрессий, дерматиты
подробнее
31
• ТЭД позволила объяснить свойства водных
растворов электролитов и объяснила теорию
кислот и оснований. Она была широко и
плодотворно
применена
для
объяснения
многочисленных физических и химических
явлений в расплавах и даже твердых телах.
• Вместе с законом действующих масс она
позволила объяснить все известные практические
способы, условия и механизм аналитических
реакций (качественный анализ).
• Обосновала механизм многих органических
реакций и помогла физиологам в изучении
состава и свойств кровяных телец, мембранного
равновесия и окислительно-восстановительного
потенциала биологических реакций.
• Оказала сильное влияние на развитие
химического языка и в целом сыграла
фундаментальную
роль
в
современном
естествознании.
• ТЭД была предложена в 1887 году шведским ученым
Сванте Августом Аррениусом. Классическая теория
электролитический диссоциации применима лишь к
разбавленным растворам слабых электролитов.
• Современная теория водных растворов электролитов
кроме ТЭД Аррениуса включает представления о
гидратации ионов (И.А. Каблуков, В.А. Кистяковский)
и теорию сильных электролитов (П. Й. Дебай, Э.А.
Хюккель).
• Легче всего диссоциируют вещества с ионной связью.
• Степень диссоциации зависит от природы
электролита и его концентрации. По степени
диссоциации электролиты делят на сильные и
слабые.
• По характеру образующихся ионов различают
три типа электролитов: кислоты, основания и
соли.
• С помощью ТЭД дают определения и описыва
ют свойства кислот, оснований и солей.
Запишите формулу электролита – сульфата алюминия
Al2(SO4)3
2.Расставьте заряды ионов, используя таблицу растворимости
Al3+ 2(SO4)3 23.Это сильный электролит
4. Электролит сильный, ставим знак =
Al3+ 2(SO4)3 2- =
5. После знака равно запишите ионы так, как они выглядят в таблице
растворимости.
Al3+ 2(SO4)3 2- =Al3+ + SO4 26.Индексы, стоящие у ионов, становятся коэффициентами
Al3+ 2(SO4)3 2- = 2Al3+ + 3SO4 27.При наличии коэффициента перед формулой, необходимо каждый ион
умножить на этот коэффициент
5Al3+ 2(SO4)3 2- = 5* 2Al3+ + 5*3SO4 25Al3+ 2(SO4)3 2- = 10Al3+ + 15SO4 2-
11.11.2020
Русецкая О.П.
36
Запишите формулу электролита – гидроксида меди (II)
Cu(OH)2
2.Расставьте заряды ионов, используя таблицу растворимости
Cu2+(OH-)2
3.Это слабый электролит.
4.Электролит слабый, ставим знак обратимости (стрелки ,направленные
влево и вправо)
Cu2+(OH-)2
5. После знака обратимости запишите ионы так, как они выглядят в
таблице растворимости.
Cu2+(OH-)2 Cu2+ + OH6.Индексы, стоящие у ионов, становятся коэффициентами
Cu2+(OH-)2 Cu2+ + 2OH7.При наличии коэффициента перед формулой, необходимо каждый ион
умножить на этот коэффициент
3 Cu2+(OH-)2 3 Cu2+ + 3* 2Oh4 Cu2+(OH-)2 3Cu2+ + 6 OH-
11.11.2020
Русецкая О.П.
37
11.11.2020
Русецкая О.П.
38
ИСПОЛЬЗУЯ ПАРАГРАФЫ №4,5 И ПРЕЗЕНТАЦИЮ
1.В РАБОЧУЮ ТЕТРАДЬ ВЫПИСАТЬ ОПРЕДЕЛЕНИЯ (КТО РАБОТАЛ НА
УРОКАХ, ТОЛЬКО ТЕ ОПРЕДЕЛЕНИЯ, КОТОРЫХ НЕТ).
2. ПОДГОТОВИТЬСЯ К САМОСТОЯТЕЛЬНОЙ РАБОТЕ ПО УРАВНЕНИЯМ
ДИССОЦИАЦИИ НАПИСАТЬ ДЛЯ СЛЕДУЮЩИХ ВЕЩЕСТВ УРАВНЕНИЯ
ДИССОЦИАЦИИ
2KCl
3Na2SO3
4BaCl2
5Cu(NO2)2
h3SiO3
6Fe(NO3)3
7Cr2(SO4)3
8 NaOH
9h4PO4
Ca3(PO4)2
11.11.2020
Русецкая О.П.
39
Закажите пробную версию у наших экспертов
× ×Присоединяйтесь сейчас к JEE / NEET , а также готовьтесь к доскам Доски 10 класса отменены! Что делать дальше ? Спросите наших экспертов на бесплатном консультационном сеансе прямо сейчас! Зарегистрироваться
Привет!
Мы получили ваш запрос
Следите за обновлениями, мы свяжемся с вами в течение 1 часа
ЗакрыватьСпасибо за регистрацию.
Один из наших консультантов свяжется с вами в течение 1 рабочего дня.
Пожалуйста, проверьте свою электронную почту, чтобы узнать данные для входа.Нажмите, чтобы поговорить
1800-1023-196
+91 7353221155
КОРЗИНА 0
МОЯ КОРЗИНА (5)
Используйте купон: CART20 и получите скидку 20% на все учебные материалы онлайн
ПУНКТ
ПОДРОБНОСТИ
MRP
СКИДКА
ОКОНЧАТЕЛЬНАЯ ЦЕНА
$ {Имя}
Активация: сразу после оплаты
Rs.$ {Price}
$ {DiscountPercent}%
Rs. $ {DiscountPrice}
Rs.$ {Price}
0%
Rs. $ {Price}
$ {Имя}
Активация: сразу после оплаты
Rs.$ {CalculateBundlePrice (Темы)}
$ {DiscountPercent.toFixed ()}%
Rs. $ {CalculateBundleDiscountedPrice (Topics, DiscountPercent)}
Теория электролитической диссоциации Аррениуса
(1- α) + 2α = (1+ α) = I, где I — фактор Вант-Гоффа.
Мерой степени диссоциации (α) является коэффициент проводимости Аррениуса, который представляет собой отношение эквивалентной проводимости при любой данной концентрации t при бесконечном разбавлении. Эта теория оказалась успешной и сторонниками Аррениуса — Вант Хоффом и Освальдом, впоследствии известными как «ионисты».
Модификации и применимость теории пытались распространить на концентрированные растворы, и было развито допущение и идея свободной воды.Но, в конце концов, теория Дебая-Хюккеля межионного взаимодействия полной диссоциации объяснила концентрационную зависимость коэффициентов активности для разбавленных растворов, а затем распространилась на более концентрированные электролиты. Это привело к сложным уравнениям с неизвестными параметрами и без объяснения неидеалистичности во всем диапазоне концентраций.
Постепенно по прошествии нескольких лет было подтверждено, что степень диссоциации и числа гидратации оцениваются по данным давления пара, а не по коэффициенту проводимости.Это объяснило и доказало неидеальные свойства электролитов в большом диапазоне концентраций. Далее было обнаружено, что модальности и гидратное число свободной воды были разными на поверхности и в объеме раствора. Это привело к применению теории электролитов во всем диапазоне концентраций от нуля до насыщения на основе идеи частичной диссоциации и свободной воды.
Постулат утверждает, что; «В водном растворе молекулы электролита подвергаются самопроизвольной диссоциации с образованием положительных и отрицательных ионов.”Лучшим примером является NaCl, диссоциирующий на Na + и Cl-
NaCl (водн.) → Na + (водн.) + Cl– (водн.)
h3SO4 (водн.) → 2 H + (водн.) + SO42- (водн.)
Определение электролитической диссоциации:
Диссоциация просто означает разрушение соединения на более простые составляющие, которые могут снова рекомбинировать в других условиях. При ионной или электролитической диссоциации добавление электролита или растворителя вызывает распад молекул соединения на ионы (электрически заряженные частицы).Свойство диссоциации используется для объяснения электропроводности электролита и соединения.
Обзор:
В соответствии с современной теорией предполагается, что твердые электролиты состоят из двух типов заряженных частиц — положительных и отрицательных, которые удерживаются вместе за счет электростатической силы притяжения. Когда эти твердые электролиты растворяются в соответствующем растворителе, электростатическая сила между заряженными частицами ослабевает, что приводит к разделению или диссоциации на одно заряженное вещество.Это известно как электролитическая диссоциация или ионная сольватация. Основываясь на способности электролитов, его типы следующие:
1) Сильные электролиты — те электролиты, которые полностью диссоциируют на соответствующие ионы, даже в умеренных условиях, называются сильными электролитами. Их степень диссоциации высока, и одновременно высока их константа диссоциации. Электролиты этого типа обладают высокой проводимостью. Закон массового действия неприменим, поскольку диссоциация необратима.
Пример: сильные кислоты — h3SO4, HCl, HNO3
Сильные основания — NaOH, KOH
Соли — NaCI, KCl
2) Слабые электролиты — те электролиты, которые диссоциируют в ограниченной степени, называются слабым электролитом . Эти электролиты имеют низкую степень ионизации и меньшее значение константы диссоциации. У них низкая электропроводность. Диссоциация обратима; следовательно, применим закон массового действия. Пример: уксусная кислота, муравьиная кислота, слабое основание, такое как гидроксид аммония, и соли, такие как ацетат аммония и ацетат серебра.
Характеристики электролитической диссоциации:
1. Диссоциация — это процесс разделения заряженных частиц, которые уже существуют в соединении.
2. В диссоциации участвуют ионные соединения.
3. При диссоциации образуются заряженные или электрически нейтральные частицы.
4. Диссоциация обратима.
5. Диссоциация возможна только при наличии ионных связей в соединении.
Разница между концепциями ионизации и диссоциации:
Основное различие между ними заключается в типе используемых соединений.
Ионизация — процесс образования ионов из соединений, которые не являются ионными по своей природе. В нем участвуют ковалентные соединения. Это необратимо по своей природе. Для запуска процесса ионизации требуется соответствующий растворитель, его также называют ионной сольватацией.
Пример: В случае молекулы HCl атомы H и Cl связаны ковалентной связью.Однако при растворении в воде он образует два иона, а именно ионы H + и Cl–.
HCl (водный) → H + (водный) + Cl– (водный)
Диссоциация — это процесс спонтанного расщепления вещества на составляющие заряженные частицы. Требуемое соединение должно быть ионным по природе. По своей природе они обратимы.
Пример: В случае молекулы хлорида натрия (NaCl)
NaCl (водный) → Na + (водный) + Cl– (водный)
Эффект асимметрии:
Прохождение тока через электролитический раствор вызывает асимметрия в ионной атмосфере.Центральный ион движется к электроду, а молекула растворителя — в противоположном направлении. Из-за большого количества любого из зарядов плотность заряда увеличивается на одном конце. Это вызывает снижение проводимости, однако симметрия достигается через короткое время. Эффект представлен:
B = 8,2×105Λ0 / (DT) 3/2
D — диэлектрическая постоянная, η — вязкость в пуазах, T — абсолютная температура
Электрофоретический эффект:
A single ион окружен молекулой растворителя и другими ионами, поэтому ионная атмосфера центрального иона задействует силы обоих.Движение центрального иона в направлении, противоположном направлению ионной атмосферы, вызывает силу отвода молекулой растворителя от движения центрального иона. Эта новая сила, замедляющая действие центрального иона из-за трения между ионом и растворителем, известна как электрофоретический эффект. Это вызывает уменьшение эквивалентной существующей проводимости. Электрофоретическая сила может быть математически представлена в следующем уравнении:
A = 82,4 / (DT) 1/2 η
D — диэлектрическая проницаемость, η — вязкость в пуазах, T — абсолютная температура.
Степень диссоциации:
Доля от общего числа молей слабого электролита, который ионизируется в соответствующие ионы в водном растворе в равновесном состоянии, называется степенью диссоциации. Обозначается он «α». Его можно представить в виде уравнения:
Обнаружено, что степень диссоциации и ее значение зависят от следующих факторов:
a) Природа растворенного вещества: если ионизируемая часть молекулы связана ковалентными связями, производится меньше ионов.И если ионизируемая часть молекулы удерживается электроковалентной связью, образуется больше ионов.
б) Природа растворителя: Растворитель несет полную ответственность за уменьшение силы электростатического притяжения между двумя заряженными частицами (ионами). Согласно закону Кулона, силы между двумя заряженными частицами обратно пропорциональны диэлектрической проницаемости среды между ними. Таким образом, чем больше диэлектрическая проницаемость, тем больше способность растворителя разделять ионы.Вода имеет самую высокую диэлектрическую проницаемость, поэтому она является лучшим растворителем для диссоциации заряженных частиц.
c) Концентрация раствора: согласно закону разбавления Оствальда «Степень ионизации любого слабого электролита обратно пропорциональна квадратному корню из концентрации и прямо пропорциональна квадратному корню из разбавления». Таким образом, это означает, что если разбавление определенного вещества увеличивается, логически это означает большее добавление растворителя (концентрация уменьшается).Степень ионизации увеличивается, поскольку большее количество молекул растворителя вызывает большее образование ионов.
d) Температура: Температура прямо пропорциональна степени диссоциации. По мере увеличения температуры кинетическая энергия молекул увеличивается, что приводит к уменьшению силы притяжения между частицами и приводит к диссоциации ионов.
Доказательства в поддержку теории Аррениуса:
• Исследования дифракции рентгеновских лучей показывают присутствие ионов в электролитах.Это также показывает, что они проводят электричество в плавленом состоянии.
• Электролитические растворы подчиняются закону Ома. Это возможно, особенно если ионы уже присутствуют в растворе.
• Некоторые реакции возможны из-за присутствия ионов и ионных соединений:
• Na + (водн.) + Ag + (водн.) + NO3– (водн.) + Cl– (водн.) → AgCl (водн.) + NaNO3 (водн.)
• Согласно теории Аррениуса в какой-либо системе получается недиссоциированная вода, что приводит к изменению энтальпии системы.Это явление известно как энтальпия нейтрализации.
• Цвет электролита обусловлен присутствием иона.
• Эта теория лежит в основе произведения растворимости, гидролиза, эффекта обычных ионов, электролиза, электропроводности, электрофореза и т. Д.
• Теория ионов может объяснить аномальные и непредсказуемые коллигативные свойства. Когда электолит растворяется в воде, количество частиц в растворе всегда увеличивается, чем общее количество молекул, растворенных за счет ионизации.
Ограничения теории Аррениуса:
• Теория Аррениуса применима к водным растворам, а не к неводным растворам и газообразным растворам, поскольку она определяет электролит как водный раствор, а не как вещество.
• Растворитель не влияет на определение силы электролита. Пример: HCl — сильная кислота в присутствии воды, но слабая кислота в присутствии бензола.
• Органические растворители не исследовались так широко, как неорганические растворители.
• Теории, основанные (закон разбавления Оствальда) на теории диссоциации Аррениуса, доказали свою эффективность только для слабых электролитов.
• Доказано и замечено, что и в отсутствие воды сильный электролит проводит электричество. Это противоречит теории Аррениуса.
• Факторы, влияющие на степень диссоциации, не очень хорошо объяснены.
Электролитическая диссоциация — обзор
1.1.1 ОПРЕДЕЛЕНИЯ ЧАСТИЦ, ОБЛАДАЮЩИХ СВОЙСТВАМИ КИСЛОТЫ ИЛИ ОСНОВАНИЯ
Определение Аррениуса, известное как теория электролитической диссоциации (TED), подходящее для описания водных растворов, исторически было первым определением этот вид. В нем говорится, что кислота — это вещество, склонное к диссоциации с образованием протонов, H + :
(1.1.1) HCl⇌H ++ Cl-,
, тогда как основание является донором гидроксид-ионов, OH — :
(1.1.2) NaOH⇌Na ++ OH−.
В ионной форме кислотно-основное взаимодействие (нейтрализация) можно записать следующим образом:
(1.1.3) H ++ OH − ⇌h3O.
Подобные взаимодействия в молекулярных растворах характеризуются константой собственной кислотно-основной автоионизации, которая является важным параметром, описывающим кислотно-основные свойства растворителя. Например, константа автоионизации воды определяется следующим произведением:
(1.1.4) Kw⇌H + OH− = 10-14 298.15К.
Чем ниже значение этой константы, тем больше разница в показателях кислотности (pH) между стандартными растворами сильных кислот и оснований, что приводит к более широкому кислотно-щелочному диапазону для растворителя. Это относится не только к кислотно-основным равновесиям в водных растворах, но также относится к любому донорно-акцепторному взаимодействию в молекулярных растворителях, которые склонны к гетеролитической диссоциации с образованием «кислотных» и «основных» частиц, как предусмотрено соответствующим определением. кислот и оснований.Из уравнений (1.1.3) и (1.1.4) следует, что определение Аррениуса можно использовать только для описания кислотно-основных взаимодействий в водных растворах, поскольку реакция между «кислотой» растворителя и «основанием» растворителя может привести к образованию только молекул растворителя. В рассматриваемом случае этим растворителем является вода.
Более общее определение кислотно-основного равновесия в молекулярных растворителях было независимо предложено Бронстедом и Лоури, которые расширили термин «основание».По их словам, кислота является донором протонов, а основание они определили только как акцептор H + . Согласно определению Бренстеда – Лоури, диссоциация кислоты приводит к образованию протона и «сопряженного» основания:
(1.1.5) A⇌B + H +.
В молекулярных растворителях процесс (1.1.5) накладывается на другие кислотно-основные реакции, а именно на реакцию с нейтральными молекулами растворителя или с другими растворенными веществами кислотного или основного характера. Полный кислотно-основной процесс представлен уравнением типа:
(1.16) A1 + B2L⇌A2LH ++ B1.
Конечно, протоны не могут существовать как свободные частицы в молекулярных растворителях: они должны реагировать с молекулами растворителя, и такое взаимодействие в водных растворах приводит к образованию H 5 O 2 + (H + · 2H 2 O или [H 2 O · · · H · · · OH 2 ] + ) частиц. Точно так же ионы гидроксида в водных растворах существуют как H 3 O 2 — (OH 2 · · · OH — ).Чем сильнее кислота A 1 по сравнению с кислотой A 2 , тем полнее сдвиг реакции (1.1.6) вправо. Таким образом, определение Бренстеда-Лоури расширяет термин «кислотно-основное взаимодействие» на реакции, сопровождающиеся переносом протона от одного основания к другому. Например, согласно этому определению, гидролиз представляет собой разновидность кислотно-основного взаимодействия
(1.1.7) HCO3- + h3O⇌CO2⋅h3O + OH−
с участием двух пар сопряженных пар, состоящих из кислоты и основание, отличающееся на один протон:
(1.1.8) HCO3− + H + ⇌h3O,
(1.1.9) h3O − H + ⇌OH−.
Очевидным преимуществом определения Бренстеда – Лоури по сравнению с TED является тот факт, что кислотно-основное взаимодействие достигает равновесия между двумя парами конъюгатов в растворителе. При формулировке этого определения в качестве подходящих растворителей рассматривались только различные протолитические среды, процесс диссоциации которых можно описать следующей схемой:
(1.1.10) HL⇌H ++ L-.
Тем не менее, позднее оно использовалось для описания реакций протонного обмена в апротонных средах, поскольку это определение не имеет ограничений, касающихся химического состава частиц растворителя, а точнее их склонности к диссоциации с образованием сольватированного протон.
Следует отметить, что термины «кислота» и «основание» в теории Бренстеда – Лоури относятся только к функции данного вещества в протолитической реакции. Одно и то же вещество при определенных условиях может реагировать как кислота, а в других случаях оно может проявлять основные свойства. Кроме того, на относительную силу кислот и оснований значительно влияет сольватация реагентов и продуктов реакции.
Льюис [13] предложил электронную теорию кислот и оснований и дал более общее определение кислот и оснований в ее рамках.Кислоты определяются как акцепторы электронной пары, а ее доноры классифицируются как основания. Принципиальная схема кислотно-основного взаимодействия Льюиса описывается следующим уравнением:
(1.1.11) A +: B⇌A: B.
Согласно этому уравнению, оба рассмотренных выше определения протонной кислотности являются просто частными случаями определения Льюиса. В самом деле, протон — это электронодефицитная частица и акцептор электронной пары, поэтому его называют кислотой, а его акцепторами являются основания.Помимо протонов, к кислотам Льюиса можно отнести и другие электронодефицитные частицы, независимо от их заряда (Ni 2 + , BF 3 и т. Д.).
Наиболее общее определение кислот и оснований было сформулировано Усановичем [14,15], который предложил определение кислот как участников химической реакции, доставляющей катионы (среди них протон) или фиксирующих анион (включая один электрон). . Таким образом, основания являются донорами анионов (электронов) или акцепторами катиона (протонов).Однако это определение не стало общепринятым, главным образом из-за его чрезмерной универсальности, поскольку большинство химических реакций можно отнести к кислотно-основным в рамках определения Усановича. Например, следующая окислительно-восстановительная реакция будет кислотно-основной реакцией:
(1.1.12) Fe3 ++ Cu + ⇌Fe2 ++ Cu2 +.
здесь Fe 3 + (донор электронов) — кислота, а Cu + (акцептор электрона) — основание.
Обычно определения кислот и оснований необходимы для классификации различных видов химических реакций, т.е.е. для разделения их на кислотно-основные и «прочие». Например, определение Бренстеда – Лоури делит реакции на кислотно-основные, которые характеризуются перераспределением протонов, и другие. В более широком определении Льюиса реакции делятся на кислотно-основные и окислительно-восстановительные, что означает, что в первом случае происходит перераспределение электронной плотности за счет электронных пар, а во втором случае речь идет о реакциях с переносом отдельных электронов. Поскольку химия касается как раз перераспределения электронов внешних оболочек, мы можем классифицировать все химические реакции как кислотно-основные по определению Усановича.
Тем не менее, в определении Усановича есть и положительные моменты. Итак, кислоты и основания классифицируются на основе их реакций с ионами (анионами и катионами), которыми являются основания и кислоты Льюиса. Следовательно, эту особенность следует добавить к определению Льюиса, чтобы дать наиболее общее определение кислот и оснований [16]: кислоты являются либо акцепторами неразделенной электронной пары (или аниона), либо донорами катиона, а основания являются либо донорами электронная пара (или анион) или акцепторы катиона.
Однако рассмотрим следующую реакцию, являющуюся кислотно-основной (по принципу Люкса – Флуда):
(1.1.13) S2O72− + O2 − ⇌2SO42−.
Согласно приведенным выше определениям, оба реагента в левой части реакции (1.1.13) являются акцепторами аниона и, следовательно, должны рассматриваться как кислоты. Однако это не так, и известно, что расплавленные пиросульфаты являются очень агрессивной кислой средой. Определение Lux предоставляет один из возможных способов устранить это кажущееся противоречие.Напомним, что в 1939 году Люкс предложил определение, в котором кислоты были определены как акцепторы оксид-ионов, а основания — как оксид-ионные доноры [17]. Итак, основное кислотно-основное взаимодействие Люкс-Флада можно описать уравнением (0.1). Позже некоторые исследования были выполнены Flood et al. о расплаве пиросульфата калия [18–20]. Раздел исследований, изучающий реакции оксидного ионного обмена в расплавленных солях, теперь получил название «оксокислотность».
Следует отметить, что в литературе есть несколько любопытных интерпретаций оксокислотности, которые в большей или меньшей степени искажают исходное определение.Например, Делимарский и Барчук [3] дают «определение Люкс», где основание является донором оксидных или галогенид-ионов. Более того, по крайней мере, в русском переводе книги [21], «определение Люкс – Флад» означает, что кислота является донором оксидных ионов, а основание — акцептором O 2 — . Конечно, эти «определения» ошибочны, как можно убедиться, прочитав исходную статью Lux [17].
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
а) Напишите доказательства теории электролитической диссоциации Аррениуса
Класс 12
Химия
Химическая кинетика
Химическая кинетика
а) Напишите доказательства теории электролитической диссоциации Аррениуса.
б) Объясните любые пять терминов клеточной терминологии.
- Энтальпия нейтрализации сильной кислоты сильным основанием является постоянной величиной и равна 57,32 кДж г · м-экв-1. Этот аспект хорошо объясняется принятием. Теория Аррениуса электролитической диссоциации. Сильные кислоты и сильные основания полностью ионизируются в воде и производят ионы H + и OH− соответственно вместе с противоионами.Итоговой реакцией кислотно-щелочной нейтрализации является образование воды из ионов H + и OH–. H ++ OH− → h3 O; ΔHFO = 57,32 кДжмоль − 1
- Цвет некоторых солей или их растворов обусловлен присутствующими ионами. Например, сульфат меди имеет синий цвет из-за ионов Cu2 +. Соли никеля зеленые из-за ионов Ni2 +. Хроматы металлов имеют желтый цвет из-за ионов CrO42–.
- Закон разбавления Оствальда, общий ионный эффект и произведение растворимости и другие подобные концепции основаны на теории Аррениуса.
- Химические реакции между электролитами — это почти ионные реакции.Это потому, что это, по сути, реакция между противоположно заряженными ионами. например, Ag ++ Cl- → AgCl
- Электролитические растворы проводят ток из-за присутствия ионов, которые мигрируют в присутствии электрического поля.
- Коллигативные свойства зависят от количества частиц, присутствующих в растворе. Электролитический раствор имеет аномальные коллигативные свойства. Например, 0,1 моль раствор NaCl имеет повышение температуры кипения примерно вдвое по сравнению с 0,1 моль раствором неэлектролита.Аномальные коллигативные свойства растворов электролитов можно объяснить с помощью теории электролитической диссоциации.
- Ток — это поток электронов через провод или любой проводник.
- Электрод представляет собой материал, металлический стержень / полосу, которая проводит электроны в раствор и из него.
- Анод — это электрод, на котором происходит окисление. Он отправляет электроны во внешнюю цепь.Он имеет отрицательный заряд и показан на диаграммах как (-).
- Катод — это электрод, на который поступают электроны из внешней цепи. Он имеет положительный заряд и на схемах элементов обозначен знаком (+):
- Электролит — это солевой раствор в ячейке.
- Анодный отсек — это отсек электролизера, в котором происходит полуреакция окисления. Он содержит анод.
- Катодный отсек — это отсек электролизера, в котором происходит полуреакция восстановления.Он содержит катод.
- Полуэлемент: каждой половины электрохимической ячейки, где происходит окисление, а другая половина, где происходит восстановление, является половиной ячейки.
Определение реакции диссоциации и примеры
Реакция диссоциации — это химическая реакция, при которой соединение распадается на два или более компонентов.
Общая формула реакции диссоциации имеет следующий вид:
Реакции диссоциации обычно являются обратимыми химическими реакциями.Один из способов распознать реакцию диссоциации — это когда есть только один реагент, но несколько продуктов.
Ключевые выводы
- При написании уравнения обязательно укажите ионный заряд, если он есть. Это важно. Например, K (металлический калий) сильно отличается от K + (ион калия).
- Не включайте воду в качестве реагента, когда соединения диссоциируют на свои ионы при растворении в воде. Хотя есть несколько исключений из этого правила, в большинстве случаев вы должны использовать aq для обозначения водного раствора.
Примеры реакций диссоциации
Когда вы пишете реакцию диссоциации, в которой соединение распадается на составляющие ионы, вы помещаете заряды над символами ионов и уравновешиваете уравнение как для массы, так и для заряда. Реакция, при которой вода распадается на водород и ионы гидроксида, является реакцией диссоциации. Когда молекулярное соединение подвергается диссоциации на ионы, реакцию можно также назвать ионизацией.
Когда кислоты подвергаются диссоциации, они производят ионы водорода.Например, рассмотрим ионизацию соляной кислоты:
Хотя некоторые молекулярные соединения, такие как вода и кислоты, образуют растворы электролитов, в большинстве реакций диссоциации участвуют ионные соединения в воде или водных растворах. Когда ионные соединения диссоциируют, молекулы воды разрушают ионный кристалл. Это происходит из-за притяжения между положительными и отрицательными ионами в кристалле и отрицательной и положительной полярностью воды.
В письменном уравнении вы обычно видите состояние вещества, указанного в скобках после химической формулы: s для твердого вещества, l для жидкости, g для газа и aq для водного раствора.Примеры включают:
- NaCl (т) → Na + (водн.) + Cl — (водн.)
Fe 2 (SO 4 ) 3 (т. Е.) → 2Fe 3+ (водн.) + 3SO 4 2- (водн.)
Эксперимент по электролизу воды | Научный проект
Чистая вода сама по себе не является хорошим проводником электричества, поэтому в этом эксперименте будет добавлена пищевая сода, чтобы сделать раствор электролитом. Электролит является частью раствора, который может быть разрушен электролизом. Electro относится к энергии и электричеству и — лизис относится к разделению на части. Электролиты важны как для аккумуляторов, так и для нашего организма!
Какой электролит лучше всего проводит электричество при электролизе воды?
- Вода дистиллированная
- Водопроводная вода
- 2 кнопки серебристого цвета
- аккумулятор 9В
- Маленький прозрачный пластиковый контейнер (подойдет пластиковый контейнер для соуса на вынос из ресторана)
- 2 пробирки
- Секундомер
- Пищевая сода
- Соль поваренная
- Лимон
- Средство для мытья посуды
- Вставьте кнопки в нижнюю часть пластикового контейнера так, чтобы острие входило в контейнер.Разместите их так, чтобы они находились на том же расстоянии друг от друга, что и две клеммы батареи 9 В. Будьте осторожны, чтобы не уколоть себя!
- Поместите пластиковый контейнер с помощью кнопок на клеммы аккумулятора. Если чашка слишком велика, чтобы ее можно было уравновесить на батарее, найдите что-нибудь, на что ее можно поставить: между двумя книгами, стопкой стикеров и т. Д.
- Медленно наполните емкость дистиллированной водой. Если кнопки двигаются, воспользуйтесь этой возможностью, чтобы исправить их, прежде чем продолжить. Будет ли дистиллированная вода проводить электричество самостоятельно? Попытайся!
- Добавьте щепотку пищевой соды.
- Держите две пробирки над каждой нажимной булавкой для сбора образующегося газа. Запишите свои наблюдения. Что происходит? В одной трубке больше газа, чем в другой? Как вы думаете, какие газы образуются?
- Отменить раствор и повторить процедуру с другой комбинацией:
- Дистиллированная вода и лимонный сок
- Вода дистиллированная и поваренная соль
- Дистиллированная вода и средство для мытья посуды
- Дистиллированная вода (без добавок)
- Водопроводная вода (Подходит ли водопроводная вода? Если да, то почему?)
Дистиллированная вода не будет проводить ток, тогда как водопроводная вода будет проводить небольшой ток.Раствор с пищевой содой будет способствовать хорошему электролизу. Раствор с поваренной солью лучше всего облегчит электролиз.
Пищевая сода, известная химиками как бикарбонат натрия (NaHCO3), сама по себе не является электролитом. Помните — он должен быть в растворе! Растворенный в воде, он пропускает ток через воду между клеммами батареи. В растворе соды и воды образуются следующие газы: водород (H 2 ), кислород (O 2 ) и диоксид углерода (CO 2 ).
Поваренная сольили хлорид натрия (NaCl) также является хорошей добавкой для образования электролитов. В воде соль фактически распадается на ионы Na + и Cl — , которые очень хорошо переносят ток или поток электрических зарядов. В водно-солевом растворе образуются водород, кислород и хлор , газ (Cl 2 ) — вы не хотите вдыхать это вещество!
Лимонный сок — достойный электролит, потому что это кислота.Кислота диссоциирует в воде, и ток переносится ионами. Сама по себе дистиллированная вода не пропускает ток. Однако водопроводная вода часто может проводить ток из-за минералов и примесей (не волнуйтесь! Это неплохо для вас!).
В каждой реакции образуется разное количество газа, потому что в каждой реакции будет разное количество тока. Количество производимого газа прямо пропорционально току, протекающему в системе.
Заявление об ограничении ответственности и меры предосторожностиEducation.com предоставляет идеи проекта Science Fair для информационных только для целей. Education.com не дает никаких гарантий или заверений относительно идей проектов Science Fair и не несет ответственности за любые убытки или ущерб, прямо или косвенно вызванные использованием вами таких Информация. Получая доступ к идеям проектов Science Fair, вы отказываетесь от отказаться от любых претензий к Education.com, которые возникают в связи с этим. Кроме того, ваш доступ к веб-сайту Education.
