Подготовка к ОГЭ (ГИА) по химии. Тематические тесты для подготовки к ОГЭ по химии.
Для кого предназначены эти тесты?
Данные материалы предназначены для школьников, готовящихся к ОГЭ-2018 по химии. Их также можно использовать для самоконтроля при изучении школьного курса химии. Каждый тест посвящен определенной теме, которая встретится девятикласснику на экзамене. Номер теста — это номер соответствующего задания в бланке ОГЭ.
Как устроены тематические тесты?
Каждый тренировочный тест состоит из 10 заданий различного уровня сложности. Задачи 1-5 наиболее легкие, подойдут для тех, кто начинает готовиться к ОГЭ по химии «с нуля». Задания 6-10 соответствуют уровню ГИА или немного сложнее.
Чем отличаются тематические тесты от «обычных» тестов ОГЭ?
«Обычные» тесты проверяют общий уровень знаний по химии. Каждый из тематических тестов посвящен только одной теме.
Полные варианты ОГЭ (например, этот или этот) целесообразно использовать для периодического самоконтроля в процессе подготовки к экзамену, тематические тесты — для работы над конкретными разделами программы по химии, которые вызывают наибольшие сложности.
Какое место занимают тематические тесты в подготовке к ОГЭ по химии?
Разумеется, данные тренировочные тесты нельзя рассматривать как замену школьного учебника химии. Прежде чем начинать работать над тестом, следует внимательно изучить соответствующую тему по учебнику или обратиться к помощи преподавателя. Тесты ничего не объясняют. Они лишь помогают вам лучше усвоить соответствующий материал и оценить уровень своей подготовки.
Как интерпретировать результаты тестов?
Если вы набираете 4-5 баллов в первой части и 4-5 баллов во второй, можете считать, что соответствующая тема усвоена вами отлично. Если во второй части вы сможете решить правильно 2-3 задания и 3-4 задания в первой части, советую еще немного потренироваться.
Если вы даже в I части делаете более трех ошибок, результат неудовлетворительный! Тренируйтесь! Попробуйте еще раз разобрать соответствующую тему. Если возникают сложности, обратитесь к помощи репетитора.
Будут ли на этом сайте публиковаться другие тематические тесты?
Безусловно! Я планирую разместить тесты по 23 темам, по 10 заданий в каждом. Следите за обновлениями!Что еще есть на этом сайте для готовящихся к ОГЭ-2018 по химии?
Демонстрационные тесты ОГЭ и ЕГЭ и тесты по химии для школьников 8 — 11 классов. Статьи, посвященные решению сложных задач, и справочник по химии.Вам кажется, что чего-то не хватает? Вам хотелось бы расширить какие-то разделы? Нужны какие-то новые материалы? Что-то надо исправить? Нашли ошибки?
Пожалуйста, свяжитесь со мной.
Успехов всем готовящимся к ОГЭ и ЕГЭ!
www.repetitor2000.ru
Пробная работа ОГЭ по химии
Вариант
контрольных измерительных материалов для
проведения в 2017 году основного государственного
экзамена по ХИМИИ
.
Инструкция по выполнению работы
Экзаменационная работа состоит из двух частей, включающих в себя 22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 2 часа (120 минут).
Ответы к заданиям 1–15 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
Ответы к заданиям 16–19 записываются в виде последовательности цифр. Эту последовательность цифр запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
К заданиям 20–22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Задания выполняются на бланке ответов № 2.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.При выполнении заданий можно пользоваться черновиком. Записи в черновике не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
Часть 1
Ответом к заданиям 1–15 является одна цифра, которая соответствует номеру правильного ответа. Запишите эту цифру в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки.
Химическому элементу 3-го периода VA-группы соответствует схема распределения электронов по слоям:
1) 2, 8, 5
2) 2, 8, 3
3) 2, 5
4) 2, 3
Ответ:В периоде с увеличением атомного номера химического элемента происходит
1) уменьшение заряда ядра атома
2) усиление металлических свойств
3) уменьшение атомного радиуса
4) уменьшение числа валентных электронов
Ответ:Ионная связь характерна для каждого из двух веществ:
1) хлорид калия и хлороводород
2) хлорид бария и оксид натрия
3) хлорид натрия и оксид углерода(IV)
4) оксид лития и хлор
Ответ:В каком соединении фосфор имеет наивысшую степень окисления?
1) Ca3P2 2) H4P2O7 3) PCl3 4) H3PO3
Ответ:Сложным является каждое из двух веществ
1) вода и хлор
2) вода и водород
3) водород и кварц
4) бензол и вода
Ответ:Если в бесцветный раствор хлорида ртути(II) поместить кусочек меди красного цвета, то произойдет реакция:
1) обмена
2) соединения
3) разложения
4) замещения
Ответ:Наибольшее количество положительных ионов образуется при диссоциации 1 моль
1) серной кислоты
2) фосфата натрия
3) нитрата железа(III)
4) сульфида калия
Ответ:8. Осадок образуется при взаимодействии водных растворов
1) нитрата аммония и гидроксида калия
2) соляной кислоты и гидроксида бария
3) нитрата серебра и бромида кальция
4) азотной кислоты и карбоната натрия
Ответ:В реакцию с водой при комнатной температуре вступают оба вещества пары
1) кислород и углерод
2) магний и сера
3) алюминий и фосфор
4) натрий и кальций
Ответ:Химическая реакция возможна между
1) оксидом серы(IV) и соляной кислотой
2) оксидом алюминия и гидроксидом натрия
3) оксидом берилия и кислородом
4) оксидом железа(II) и оксидом калия
Ответ:Среди веществ: Zn, Al2O3, Cu(OH)2, BaCl2 — в реакцию с раствором серной кислоты вступает(-ют)
1) два
2) одно
3) три
4) четыре
Ответ:Соль, которая может реагировать и с соляной кислотой, и с нитратом кальция, —
1) CuSO4
2) KBr
3) Na2CO3
4) BaSO4
Ответ:Верны ли суждения о способах разделения смесей?
А. Выпаривание относят к физическим способам разделения смесей.
Б. Разделение смеси воды и этанола возможно способом фильтрования.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ:
| ||||||||||||
|
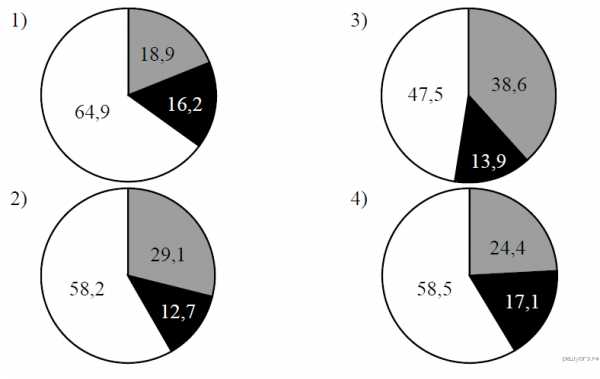
На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата лития?
Ответом к заданиям 16–19 является последовательность цифр, которые следует записать в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Ответ записывайте без пробелов, запятых и других дополнительных символов.
Каждую цифру пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
16. Общим для магния и кремния является
1) наличие трёх электронных слоёв в их атомах
2) существование соответствующих им простых веществ в виде двухатомных молекул
3) то, что они относятся к металлам
4) то, что значение их электроотрицательности меньше, чем у фосфора
5) образование ими высших оксидов с общей формулой ЭО2
Ответ:Для метилового спирта верны следующие утверждения:
1) является газообразным веществом (н. у.)
2) в молекуле имеется гидроксильная группа
3) ядовит
4) плохо растворим в воде
5) вступает в реакцию с серебром
Ответ:При выполнении заданий 18, 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
|
|
|
|
|
|
|
|
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы.
Часть 2
Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2.
Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый ответ к нему. Ответы записывайте чётко и разборчиво.
20. Используя метод электронного баланса, составьте уравнение реакции
KMnO4 + KOH → K2MnO4 + O2 + H2O
Определите окислитель и восстановитель.
21. К 376 г раствора с массовой долей нитрата меди (II) 7,5% добавили избыток раствора гидроксида калия. Определите массу выпавшего осадка.
22. Даны вещества: Zn, HCl (р-р), H3PO4, AgNO3, NH4Cl, Ba(NO3)2. Используя воду и необходимые вещества только из этого списка, получите в две стадии нитрат цинка. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
kopilkaurokov.ru
Тренировочный тест ОГЭ по химии 2017
Тренировочный тест для подготовки к ОГЭ – 2017 по химии в 9 классе
Подготовила:
Трибунская Елена Жановна,
учитель химии МАОУ СОШ №7
г.Балаково Саратовской области
Цель:
1) повторить изученный материал
2) познакомить учащихся со структурой экзаменационной работы
3) помочь учащимся подготовиться к ОГЭ.
Инструкция по выполнению работы
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 2 частей, включающих 22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развернутым ответом.
Ответы к заданиям 1-15 записываются в виде одной цифры, которая соответствует номеру правильного ответа.
Ответы к заданиям 16-19 записываются в виде последовательности цифр.
К заданиям 20-22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и решение задачи.
При выполнении работы можно пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Использованные учебники и интернет — ресурсы:
О.С Габриелян «Химия 9 класс». М., Дрофа. 2013 год.
О.С.Габриелян «Химия 8 класс».М., Дрофа. 2013 год.
Открытый БАНК заданий по химии ОГЭ
http://opengia.ru/subjects/chemistry-9/topics/1
Часть 1
1. Три электронных слоя и один электрон во внешнем электронном слое соответствуют атому:
1) хлора; 3) натрия;
2) лития; 4) водорода.
Ответ:
2. В каком ряду усиливаются металлические свойства соответствующих им простых веществ:
1) бериллий – магний — кальций;
2) фтор – бром — хлор;
3) сера – кислород — селен;
4) углерод – свинец — кремний.
Ответ:
3. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) RbCl и Cl2 3) O3 и H2S
2) HBr и N2 4) NH3 и H2O
Ответ:
4.Степень окисления +5 фосфор проявляет в соединении
1) P2O3 3) Na3P
2) PH3 4) Mg(H2PO4)2
Ответ:
5. Вещества, формулы которых – BeO и BaO, являются соответственно:
1) основный оксид и кислотный оксид
2) амфотерный оксид и основный оксид
3) кислотный оксид и основный оксид
4) основный оксид и амфотерный оксид
Ответ:
6. Реакцию, уравнение которой 2Rb+2H2O=2RbOH+H2↑ относят к реакциям:
1) замещения, экзотермическим;
2) разложения, экзотермическим;
3) присоединения, эндотермическим;
4) обмена, эндотермическим.
Ответ:
7. Ионы SO3 2- образуются при диссоциации в водном растворе:
1) сульфида калия; 3) сульфата калия;
2) серной кислоты; 4) сульфита калия.
Ответ:
8. Газ выделяется при взаимодействии:
1) гидроксида цинка и соляной кислоты; 3) гидроксид меди(II) и азотной кислоты;
2) сульфида меди и соляной кислоты 4) оксида калия и азотной кислоты.
Ответ:
9. Кальций взаимодействует с каждым из веществ, формулы которых перечислены в группе:
1) К, O2, HCl; 3) O2, H2O, N2;
2) Cu, O2, N2; 4) H2O, КOH, S.
Ответ:
10.Оксид бериллия реагирует с каждым из двух веществ:
1) Na и H2O 3) HCl и O2
2) H2O и HNO3 4) KOH и H2SO4
Ответ:
11. Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Ag и RbOH;
2) N2O и CO2;
3) NiO и HCI;
4) Ba(NO3)2 и NH3.
Ответ:
12. Среди веществ: хлорид натрия, сульфид натрия, сульфат натрия – в реакцию с нитратом меди (II) вступает(-ют)
1) два вещества; 3) одно вещество;
2) три вещества; 4) ни одно вещество.
Ответ:
13. Верны ли следующие суждения?
А. Отделить спирт от воды можно с помощью отстаивания.
Б. Водный раствор соли и мела можно разделить с помощью фильтрования
1) верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
Ответ:
14. Аммиак является окислителем в реакции схема которой:
1) N2+H2→NH3; 3) NH3+CuO→Cu+ N2+H2O;
2) NH3+O2→N2+H2O; 4) NH3+K→KNH2+H2.
Ответ:
15. На какой диаграмме распределение массовых долей элементов отвечает качественному составу фосфата аммония?
1) 3)
2) 4)
Ответ:
Часть 2
16. В ряду химических элементов Cl — S — Р
1) уменьшаются заряды ядер атомов;
2) возрастают кислотные свойства их оксидов;
3) низшая степень окисления уменьшается;
4) уменьшается радиус атомов;
5) усиливаются неметаллические свойства.
Ответ:
17. Для углеводорода С2Н6 характерно:
1) реакция замещения;
2) реакция дегидрирования;
3) обесцвечивание бромной воды;
4) реакция изомеризации;
5) реакция с водой.
Ответ:18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества: Реактив:
А) NaI и NaClO3 1) Ca(OH)2
Б) HF и Rb2SO4 2) AgNO3
В) CO2 и CaC2 3) фенолфталеин
4) Ba(NO3)2
Ответ:
19. Установите соответствие между названием веществами и реагентами, с которыми это вещество может взаимодействовать.
НАЗВАНИЕ РЕАГЕНТЫ
ВЕЩЕСТВА:
А) оксид цинка 1) K2O, Na
Б) углекислый газ 2) SO2, H2O
В) серная кислота 3) Ca(OH)2, H2O
4) HBr, Ca(OH)2
Ответ:
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
H2O2+ NH3→ N2+ H2O
Определите окислитель и восстановитель.
21. Через раствор гидроксида кальция пропустили углекислый газ. Образовалось 648 г. гидрокарбоната кальция с массовой долей 1%. Вычислите объем прореагировавшего газа
22. Даны вещества: Ве, NaNO3, KOH, H2SO4, Na2SO4, MgO. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид бериллия. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Система оценивания тестовой работы по химии
Верное выполнение каждого из заданий части 1 базового уровня сложности (1–15) оценивается 1 баллом.
Верное выполненное каждого из заданий части 1 повышенного уровня сложности (16–19) максимально оценивается 2 баллами. Задания 16 и 17 считаются верно выполненными, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются в 0 баллов.
Задания 18 и 19 считаются выполненными верно, если правильно установлены три соответствия. Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом. Остальные варианты считаются неверным ответом и оцениваются в 0 баллов.
Часть 1
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
H2O2+ NH3→ N2+ H2O
Укажите окислитель и восстановитель.
Элементы ответа(допускаются иные формулировки ответа, не искажающие его смысл)
1. Составлен электронный баланс.
3 │2О-1 + 2ē → 2О-2
1 │2N-3 — 6ē →N20
2. Расставлены коэффициенты в уравнении реакции:
3H2O2+ 2NH3→ N2+ 6H2O
3. Указано, что восстановителем является N-3, а окислителем О-1
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы
3
В ответе допущена ошибка только в одном из элементов
2
В ответе допущены ошибки в двух элементах
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
21.Через раствор гидроксида кальция пропустили углекислый газ. Образовалось 648 г. гидрокарбоната кальция с массовой долей 1%. Вычислите объем прореагировавшего газа
Элементы ответа(допускаются иные формулировки ответа, не искажающие его смысл)
1) Составлено уравнение реакции 2CO2 + Ca(OH)2= Ca(HCO3)2
2) Рассчитано масса и количество вещества гидрокарбоната калия, полученного в результате реакции:
m чист.(Ca(HCO3)2) = m р-ра (Ca(HCO3)2) * w (Ca(HCO3)2)= 648*0,01=6,48г.
M(Ca(HCO3)2)=164г/моль
n(Ca(HCO3)2)= 6,48г/ 164г/моль= 0,04моль
3) Рассчитываем объем CO2
n(CO2)=2 n(Ca(HCO3)2)=2*0,04=0,08 моль
V(CO2)= n* Vм= 0,08*22,4 = 1,8л.
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы
3
Правильно записаны 2 элемента из названных выше
2
Правильно записан 1 элемент из названных выше (1-ый или 2-ой)
1
Все элементы ответа записаны неверно
0
Максимальный балл
3
22.Даны вещества: Ве, NaNO3, KOH, H2SO4, Na2SO4, MgO. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид бериллия. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Элементы ответа(допускаются иные формулировки ответа, не искажающие его смысл)
1) Составлена цепочка превращений:
Ве ВеSO4 Ве(OH)2
Составлены два уравнения реакции:
2) Ве +H2SO4= ВеSO4+H2
3) ВеSO4+ 2KOH = Ве(OH)2↓+ K2SO4
4) Описаны признаки протекания реакций:
для первой реакции: цинк растворяется, выделяется бесцветный газ;
для второй реакции: выпадение осадка белого цвета.
5) Составлено сокращённое ионное уравнение второй реакции:
Ве 2+ + 2OH— = Ве(OH)2↓
Критерии оценивания
Баллы
Ответ правильный и полный, включает все названные элементы
5
Правильно записаны четыре элемента ответа
4
Правильно записаны три элемента ответа
3
Правильно записаны два элемента ответа
2
Правильно записан один элемент ответа
1
Все элементы ответа записаны неверно
0
Максимальный балл
5
infourok.ru
Подготовка к ОГЭ (ГИА) по химии.Тематический тест №9
Химические свойства простых веществ (металлов и неметаллов)
Данный тренировочный тест — девятый из серии тренировочных тестов по химии для подготовки к ОГЭ. Вам предстоит ответить на несколько вопросов, которые могут встретиться на реальном экзамене по химии.
Тематика данного теста соответствует тематике задания №9, предлагаемого в вариантах «настоящего» ОГЭ. Обсуждаются следующие темы: «Химические свойства простых веществ», «Свойства металлов», «Свойства неметаллов».
Чтобы сделать этот тест интересным для школьников с разным уровнем подготовки, я разделил его на две части. Первые пять вопросов — легкие. Если вы только начинаете готовиться к ГИА, используйте именно их. Вопросы 6 — 10 чуть сложнее.
Как интерпретировать результаты тестов?
Если вы набираете 4-5 баллов в первой части теста и 4-5 баллов во второй, можете считать, что тема «Химические свойства простых веществ» усвоена вами отлично. Если во второй части вы сможете решить правильно менее 4 заданий, советую еще немного поработать над данной темой.
Другие материалы для подготовки к ОГЭ и ЕГЭ по химии
Если вас интересуют полные тесты ЕГЭ и ОГЭ (ГИА) по химии или другие тематические тесты, рекомендую обратить внимание на следующие ссылки:
Желаю всем успехов на экзаменах по химии!
Тест I уровня (легкий)
Это можно использовать при решении тестов ОГЭ:
Тест II уровня (уровень ГИА или чуть выше)
Это можно использовать при решении тестов ОГЭ:
- 06. Цинк взаимодействует с каждым из веществ в группе:
- а) Br2, HNO3, Cu(NO3)2;
- б) S8, H2SiO3, CuS;
- в) H2SO4, CaO, N2O5;
- г) Na2SO4, Cl2, HBr.
- б) S8, H2SiO3, CuS;
- 07. Выберите ложное утверждение:
- а) азот — достаточно инертное соединение, в частности, реакция N2 с кислородом происходит лишь при высокой температуре;
- б) из всех аллотропных модификаций Р наиболее реакционноспособен белый фосфор;
- в) графит отлично проводит электрический ток, алмаз — диэлектрик;
- г) при окислении хлора кислородом воздуха образуется оксид хлора (VII).
- б) из всех аллотропных модификаций Р наиболее реакционноспособен белый фосфор;
- 08. С водой при комнатной температуре или умеренном нагревании реагирует каждый из металлов в группе:
- а) Cs, K, Ca;
- б) Na, Al, Pb;
- в) Cu, Ag, Au;
- г) Ca, Fe, Pt.
- б) Na, Al, Pb;
- 09. Выберите истинное утверждение:
- а) основным продуктом окисления натрия кислородом является оксид натрия;
- б) алюминий, хром, железо реагируют с концентрированной азотной кислотой, а медь и серебро — нет;
- в) практически все металлы взаимодействуют с неметаллами, кислотами и кислотными оксидами;
- г) поверхность алюминия покрыта тонкой оксидной пленкой, которая защищает металл от дальнейшего окисления.
- б) алюминий, хром, железо реагируют с концентрированной азотной кислотой, а медь и серебро — нет;
- 10. Щелочные металлы:
- а) реагируют с хлором, фосфором, углеродом, но не с серой;
- б) вытесняют медь, цинк, железо из водных растворов их солей;
- в) легкоплавки, но отличаются высокой твердостью;
- г) при хранении на воздухе быстро превращаются в смесь оксидов, пероксидов и других соединений.
- б) вытесняют медь, цинк, железо из водных растворов их солей;
www.repetitor2000.ru
ОГЭ по химии 2018
ОГЭ по химии – это один из экзаменов в конце 9-го класса, который может сдаваться по выбору ученика. Результаты этого экзамена будут рассматриваться при зачислении в 10-й класс с профильным уклоном, а также при поступлении в профессиональные училища, где требуется знание химии, например, в медицинские училища, в которые также необходимо сдавать ОГЭ по биологии. В экзамене сочетается большое количество заданий и очень ограниченное время на их выполнение – на одно задание приходится 5,5 минут.
После ознакомления с общей информацией об экзамене сразу приступайте к подготовке. Экзамен в этом году совсем не отличается от прошлых лет, потому готовиться можно по материалам и 2016-го, и 2017 года.
Оценивание ОГЭ
Минимальный порог по химии в 2018 году равен девяти баллам. Чтобы набрать необходимый минимум, достаточно верно выполнить первые девять заданий теста.
Экзамен оценивается по пятибалльной системе, в зависимости от набранных баллов выставляется соответствующая отметка. Максимальный балл, в зависимости от типа теста, может быть равен 34 или 38.
Структура ОГЭ
Тип 1. Экзамен состоит из двух частей, включающих в себя 22 задания.
- Часть 1: 19 заданий (1–19) с кратким ответом. Записывается в виде цифры либо в виде последовательности цифр.
- Часть 2: три задания (20–22) с развернутым ответом. Дайте полный ответ, включающий в себя необходимые уравнения реакций и расчеты.
Тип 2. Экзамен состоит из двух частей, включающих в себя 23 задания.
- Часть 1: 19 заданий (1–19) с кратким ответом. Записывается в виде цифры либо в виде последовательности цифр.
- Часть 2: четыре задания (20–23) с развернутым ответом и лабораторным экспериментом. Дайте полный ответ, включающий в себя необходимые уравнения реакций и расчеты, а также проведите реальный опыт с лабораторным оборудованием под наблюдением экспертов-экзаменаторов.
Подготовка к ОГЭ
- На нашем сайте вы можете пройти тесты ОГЭ онлайн бесплатно без регистрации и СМС. На данный момент раздел обновляется, и со временем в нем будут появляться новые тесты за весь период проведения ОГЭ. Представленные тесты по своей сложности и структуре идентичны реальным экзаменам, проводившимся в соответствующие годы.
- Скачайте демонстрационные варианты ОГЭ по химии, которые позволят лучше подготовиться к экзамену и легче его сдать. Все предложенные тесты разработаны и одобрены для подготовки к ОГЭ Федеральным институтом педагогических измерений (ФИПИ). В этом же ФИПИ разрабатываются все официальные варианты ОГЭ.
Задания, которые вы увидите, скорее всего, не встретятся на экзамене, но будут задания, аналогичные демонстрационным, по той же тематике или просто с другими цифрами. - Ознакомьтесь с основными формулами для подготовки к экзамену, они помогут освежить память перед тем, как приступить к выполнению демонстрационных и тестовых вариантов.
Общие сведения об ОГЭ
Время проведения экзамена: 120 минут (2 часа) / 140 минут (2 часа 20 минут).
Разрешенные материалы: периодическая система химических элементов Д.И. Менделеева, таблица растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов, непрограммируемый калькулятор.
Минимальный балл (соответствует тройке): 9.
Максимальный балл: 34/38.
Количество заданий: 22.
К списку вопросов об ОГЭ >>
Полезные ссылки:
www.examen.ru
Тесты ОГЭ 2019 по химии с ответами
Успешные результаты невозможно показать без наличия базовых знаний. Рекомендуем вам начать подготовку к экзамену с изучения теории. Проверяйте свой уровень с помощью тестов ОГЭ по химии 2018 года с подробными ответами. Решая демонстрационные и тренировочные варианты, вы познакомитесь с заданиями реального государственного экзамена, приобретете практические навыки решения. Не оставляйте без внимания свои пробелы.
Почему самостоятельное тестирование — это оптимально?
Проходя тесты ОГЭ по химии вы повторяете нужный материал, знакомитесь с правилами испытаний, видите бланки, заполняете их и сразу выясняете, какой балл можете получить за ваши старания.
Все актуальные данные берутся из базы Федерального института педагогических измерений. Конечно, вам может попасться любой билет, предугадать невозможно. Но в каждом задании вы можете найти ответ и грамотный разбор решения. Это очень важно для эффективной подготовки и существенно упрощает ее, придает уверенность в собственных силах.
Рекомендации для занятий
- Пройдите тесты, оцените свой уровень, проработайте те моменты, которые беспокоят.
- Повторите основные формулы перед выполнением проверки.
- Составьте свой личный план, поставьте цель, которой вы хотите достичь.
Во всех вариантах есть вопросы трех типов: с выбором предложенного решения, с кратким и с развернутым ответом. Есть две модели (различия в них относятся только к практико-ориентированным заданиям последней части), первая – аналог работ предыдущих лет, вторая включает реальный эксперимент, как знаменитый Шерлок Холмс. Что будет на испытаниях, указывает орган управления образованием субъектов Российской Федерации.
Даже если вы еще не выбрали будущий вуз, то познания по химии пригодятся вам обязательно. Многие интересные профессии требуют ориентирования именно в этом предмете. Возможно, вы поступите в профильный класс, а после окончания школы захотите стать врачом, биологом, спасателем — мало ли есть специальностей.
Чтобы решить все тесты ОГЭ 2018 и получить достойный балл, придется старательно повторить всю (порой уже забытую) школьную программу. Вы можете делать это самостоятельно или же прибегнуть к помощи репетитора, но по статистике самые хорошие результаты показывают ученики, которые использовали тестовые версии. Важно разобраться, вникнуть, а не заучивать ответы. Разбирайтесь в структуре, применяйте полученные ранее знания, и все будет в полном порядке.
examer.ru
