Разбор задания №1 ЕГЭ по химии
Система оценивания экзаменационной работы по химии
За правильный ответ на каждое из заданий 1-8, 12-16, 20, 21, 27-29 ставиться 1 балл.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Теория по заданию:
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) F 2) S 3) I 4) Na 5) Mg
Определите, атомам каких из указанных элементов в основном состоянии до завершения внешнего электронного слоя недостаёт одного электрона.
1
Решение
Восьмиэлектронная оболочка соответствует оболочке инертного газа. Для каждого из веществ в периоде котором они находятся соответствуют инерный газ, для фтора неон, для серы аргон, для йода ксенон, для натрия и магния аргон, но из перечисленных элементов, лишь фтору и йоду не хватает одного электрона до восьмиэлектронной оболочки, так как они находятся в седьмой группе.
1) Be 2) H 3) N 4) K 5) C
Определите, атомам каких из указанных элементов в основном состоянии содержат одинаковое число неспаренных электронов.
1
Решение
Для решения данного задания необходимо расписать верхний электронный уровень элементов:4 Be Бериллий : 1s2 2s2
Число неспаренных электронов — 0
1 H Водород : 1s1
Число неспаренных электронов — 1
7 N Азот : 1s2 2s2 2p3
| 1s2 | 2s2 | 2p3 | ||
| ↑↓ | ↑↓ | ↑ | ↑ | ↑ |
Число неспаренных электронов — 3
19 K Калий : [Ar] 4s1
Число неспаренных электронов — 1
6 C Углерод : 1s2 2s2 2p2
| 1s2 | 2s2 | 2p3 | ||
| ↑↓ | ↑↓ | ↑ | ↑ | |
Число неспаренных электронов — 2
Отсюда очевидно что для водорода и для калия число неспаренных электронов одинаково.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Ge 2) Fe 3) Sn 4) Pb 5) Mn
Определите, атомам каких из указанных в ряду элементов валентные электроны находятся как на s- так и на d-подуровнях.
1
Решение
Для решения данного задания необходимо расписать верхний электронный уровень элементов:- 32 Ge Германий : [Ar] 3d10 4s2 4p2
- 26 Fe Железо : [Ar] 3d6 4s2
- 50 Sn Олово : [Kr] 4d10 5s2 5p2
- 82 Pb Свинец : [Xe] 4f14 5d10 6s2 6p2
- 25 Mn Марганец : [Ar] 3d5 4s2
У железа и марганца валентные электроны находятся на s- и на d-подуровнях.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Br 2) Si 3) Mg 4) C 5) Al
Определите, атомам каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns1np3
1
Решение
Для не возбужденного состояния электронная формула ns1np3 будет представлять собой ns2np2, именно элементы такой конфигурации нам нужны. Распишем верхний электронный уровень элементов (либо простой найдем элементы четвертой группы):- 35 Br Бром : [Ar] 3d10 4s2 4p5
- 14 Si Кремний : [Ne] 3s2 3p
- 12 Mg Магний : [Ne] 3s2
- 6 C Углерод : 1s22s2 2p2
- 13 Al Алюминий : [Ne] 3s2 3p1
У кремния и углерода верхний энергетический уровень совпадает с искомым
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Si 2) F 3) Al 4) S 5) Li
Определите, у наиболее распространенных изотопов каких из указанных в ряду двух элементов в составе атомного ядра число протонов равно числу нейтронов.
1
Решение
Сверим по таблице Менделеева порядковые номера элементов и их массы:- Порядковый номер 14 Si Кремний — масса 28
- Порядковый номер 9 F Фтор — масса 19
- Порядковый номер 13 Al Алюминий — масса 27
- Порядковый номер 16 S Сера — масса 32
- Порядковый номер 3 Li Литий — масса 7
Количество нейтронов равно массе элемента минус количество протонов, а количество протонов равно порядковому номеру и количеству электронов, тогда:
- Кремний — количество нейтронов равно: 28 — 14 = 14
- Фтор — количество нейтронов равно: 19 — 9 = 10
- Алюминий — количество нейтронов равно: 27 — 13 = 14
- Сера — количество нейтронов равно: 32 — 16 = 16
- Литий — количество нейтронов равно: 7 — 3 = 4
У кремния и серы количество протонов равно количеству нейтронов.
Таблица Менделеева и таблица растворимости:
Таблица Менделеева Таблица растворимостиЗадание С1 на ЕГЭ по химии. Особенности, советы, рекомендации.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Часть С на ЕГЭ по химии начинается с задания С1, которое предполагает составление окислительно-восстановительной реакции (содержащей уже часть реагентов и продуктов). Оно сформулировано таким образом:
С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
Часто абитуриенты считают, что уж это задание не требует особой подготовки. Однако оно содержит подводные камни, которые мешают получить за него полный балл. Давайте разберёмся, на что обратить внимание.
Теоретические сведения.
Перманганат калия как окислитель.
Дихромат и хромат как окислители.
Повышение степеней окисления хрома и марганца.
Азотная кислота с металлами.
— не выделяется водород
, образуются продукты восстановления азота.Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
| Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) | и |
| Фосфор + щелочь фосфин и соль гипофосфит |
и |
| Хлор, бром, иод + вода (без нагревания) 2 кислоты, Хлор, бром, иод + щелочь (без нагревания) 2 соли, и и вода |
и |
| Бром, иод + вода (при нагревании) 2 кислоты, Хлор, бром, иод + щелочь (при нагревании) 2 соли, и и вода |
и |
Диспропорционирование оксида азота (IV) и солей.
Ты нашел то, что искал? Поделись с друзьями!
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
Запомните! Азот — более активный неметалл, чем хлор!
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Ряд электроотрицательности неметаллов:
| увеличение электроотрицательности |
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю. - Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0. - Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример:
В этой реакции надо увидеть, что иодид калия может являться только восстановителем, поэтому нитрит калия будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из в ближайшую степень окисления . - Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия , когда он в роли окислителя переходит в :Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием? - Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции: - Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк?
Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
(водн.р-р) - Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию:
- Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из в , обычно окисление идёт только до .
И наоборот, если — сильный восстановитель и может восстановить серу из до , то — только до . Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10: Сколько ещё продуктов в этой реакции, и каких?
- Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
- Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
-
Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
Возможные ошибки.
- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях: Задание 14: Допишите и уравняйте:
Задание 15: Допишите и уравняйте: - Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот. Пример: в реакции свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
- Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Ответы и решения к заданиям с пояснениями.
Задание 1:
Задание 2:
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.
Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент .
Задание 5:
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:
Задание 7:
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.
Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
ЕГЭ по химии А1 и А2 теория
А1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов.
Число электронов, протонов и нейтронов в атоме.
Число электронов равно порядковому номеру и числу протонов, число нейтронов равно разности между массовым числом и порядковым номером.
Физический смысл порядкового номера, номера периода и номера группы.
Порядковый номер равен числу протонов и электронов, заряду ядра; номер периода равен числу заполняемых электронных слоёв; номер А — группы равен числу электронов на внешнем слое (валентных электронов).
Максимальное число электронов на уровнях.
Максимальное число электронов на уровнях определяется по формуле N= 2· n2.
1 уровень – 2, 2 уровень – 8, 3 уровень — 18, 4 уровень – 32.
s-, p- и d— элементы.
s-элементы расположены в I и II А-группах; p- элементы в III –VIII А –группах; d- элементы в I- VIII В группах.
Порядок заполнения электронами Е уровней и орбиталей в атомах.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
«Провал» электрона — переход электрона с внешнего энергетического уровня на более
низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций. Подобное явление наблюдается у меди и хрома.
24Cr 1s22s22p63s23p63d54s1 29Cu 1s22s22p63s23p63d104s1
Особенности заполнения электронных оболочек у элементов А и В групп.
У элементов А-групп валентные электроны заполняют последний слой, а у элементов В-групп- внешний и частично предвнешний электронный слой.
Степени окисления элементов в высших оксидах и ЛВС.
Группы
I
II
III
IV
V
VI
VII
VIII
С.О. в высшем оксиде = + № гр
+1
+2
+3
+4
+5
+6
+7
+8
Высший оксид
R2О
RО
R2О3
RО2
R2О5
RО3
R2О7
RО4
С.О. в ЛВС = № гр — 8
—
—
—
-4
-3
-2
-1
—
ЛВС
—
—
—
Н4R
Н3R
Н2R
НR
—
Строение электронных оболочек ионов.
У катиона – меньше электронов на величину заряда, у анионов — больше на величину заряда.
Напимер: Na0 — 11 электронов, Na+ — 10 электронов; P0 – 15 электронов, P3- — 18 электронов.
Основное и возбужденное состояние атомов.
Основное состояние – состояние атома, в котором его энергия минимальна.
Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов (например, под действием излучения или при нагревании) с занятых орбиталей на свободные (или занятые лишь одним электроном).
Пример: Al — …3s2 3p1, *Al — 3s13p2; Р …3s2 3p3, Р* — 3s13p3 3d1.
11. Изотопы.
Изотопы — разновидности атомов одного ХЭ, имеющие одинаковое число электронов и протонов, но разную массу атома (разное число нейтронов).
Пример:
Элементарные частицы
Изотопы
40 Ca
42 Ca
é
20
20
p+
20
20
n0
20
22
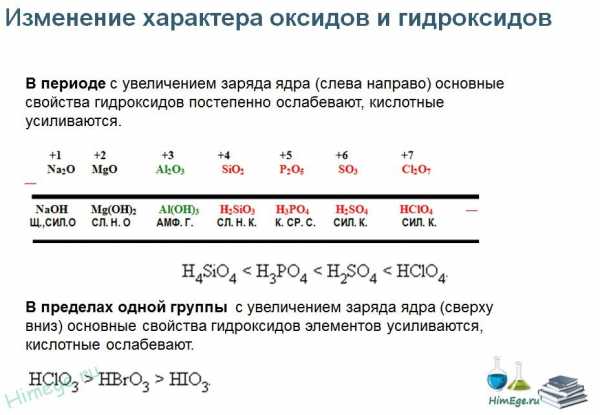
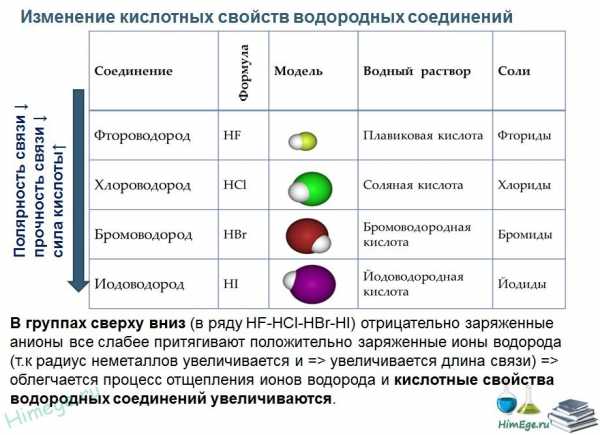
А2. Периодический закон и Периодическаясистема
химических элементов Д.И.Менделеева
Закономерности изменения свойств элементов и их
соединений по периодам и группам



infourok.ru
Видеоразбор 1-го задания ЕГЭ 2017 по химии про число электронов
Видео по заданию 1 ЕГЭ 2017 по химии поможет вам подготовиться и не допустить ошибок в этом задании. Если у вас есть с ним проблемы — ниже выкладываем видео, готовьтесь. Задание 1 посвящено определению количества электронов на внешнем уровне.
Также у нас есть информация о других заданиях ЕГЭ по химии. Выбрать задание вы можете справа сверху.
Видеоурок задание 1 ЕГЭ 2017 по химии
Посмотров 1074
Может вас заинтересовать
Видеоразбор 10 задания ЕГЭ 2017 по химии по окислительно-восстановительным свойствам
ЕГЭ по химии Видео
Чем можно пользоваться на ЕГЭ 2017 по химии?
ЕГЭ по химии
Видеоразбор 30 задания ЕГЭ 2017 по химии по методу электронного баланса
ЕГЭ по химии Видео
vuzopedia.ru
Разбор задания №3 ЕГЭ по химии
Система оценивания экзаменационной работы по химии
За правильный ответ на каждое из заданий 1-8, 12-16, 20, 21, 27-29 ставиться 1 балл.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Теория по заданию:
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Br 2) Si 3) Mg 4) C 5) Al
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
1
Решение
Для решения данного задания обратимся к теме №4А именно к правилам определения степени окисления:
 Отсюда мы узнаем, что металлы I-III групп главных подгрупп имеют постоянную степень окисления (кроме меди и золота), в задании у нас есть два элемента металла с находящихся в соответствующих группах (II и III), а именно алюминий и магний.
Отсюда мы узнаем, что металлы I-III групп главных подгрупп имеют постоянную степень окисления (кроме меди и золота), в задании у нас есть два элемента металла с находящихся в соответствующих группах (II и III), а именно алюминий и магний.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Fe 2) Al 3) F 4) B 5) N
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в оксидах степень окисления как +2, так и +3.
1
Решение
Сначала исключим элементы проявляющие одну степень окисления, это алюминий (т.к. металлы I-III групп главных подгрупп имеют постоянную степень окисления) и F (фтор всегда проявляет степень окисления -1). Элемент бор мы также исключим, хоть он и является неметаллом, но он стоит в III группе главной подгруппы, и может проявлять -3 и +3 степени окисления.Железо и азот могут проявлять степени окисления как +2, так и +3 согласно их валентностям:
Постоянные валентности:
- H, Na, Li, К, Rb, Cs — Степень окисления I
- О, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd — Степень окисления II
- B, Al, Ga, In — Степень окисления III
Переменные валентности:
- Сu — I и II
- Fe, Со, Ni — II и III
- С, Sn, Pb — II и IV
- P— III и V
- Cr — II, III и VI
- S — II, IV и VI
- Mn—II, III, IV, VI и VII
- N—II, III, IV и V
- Cl—I, IV, VI и VII
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) S 2) Li 3) K 4) Be 5) N
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять отрицательную степень окисления.
1
Решение
Исключим элементы проявляющие положительную степень окисления, это литий, калий и бериллий (т.к. металлы проявляют положительную степень окисления).Сера и азот могут проявлять отрицательные будучи неметаллами.
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) P 2) Rb 3) Cr 4) Mg 5) Al
Из числа указанных в ряду элементов выберите два элемента, для которых не характерна постоянная степень окисления.
1
Решение
Как мы уже обсуждали «металлы I-III групп главных подгрупп имеют постоянную степень окисления», следовательно остались фосфор, и хром:- P— III и V
- Cr — II, III и VI
Для выполнения задания используйте следующий ряд химических элементов. Ответом в задании является последовательность трех цифр, под которыми указаны химические элементы в данном ряду.
1) Ge 2) Fe 3) Sn 4) Pb 5) Mn
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6.
1
Решение
Германий олово и свинец находятся в четвертой группе, поэтому они не могут отдать валентных электронов больше чем есть на уровне — 4. Отсюда и их максимальная положительная степень окисления — +4- 32 Ge Германий : [Ar] 3d10 4s2 4p2
- 50 Sn Олово : [Kr] 4d10 5s2 5p2
- 82 Pb Свинец : [Xe] 4f14 5d10 6s2 6p2
Железо и марганец могут проявлять степень окисления +6, находясь в седьмой и восьмой группе, согласно их валентностям:
- Fe, Со, Ni — II и III
- Mn—II, III, IV, VI и VII
Таблица Менделеева и таблица растворимости:
Таблица Менделеева Таблица растворимостиwww.chem-mind.com
Теория строения органических соединений » HimEge.ru
Лимит времени: 0
Информация
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Тест загружается…
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
Правильных ответов: 0 из 10
Ваше время:
Время вышло
Вы набрали 0 из 0 баллов (0)
| Место | Имя | Записано | Баллы | Результат |
|---|---|---|---|---|
| Таблица загружается | ||||
| Нет данных | ||||
- С ответом
- С отметкой о просмотре
himege.ru
Задача 40 ЕГЭ по химии 2016 » HimEge.ru
Нахождение молекулярной формулы веществ
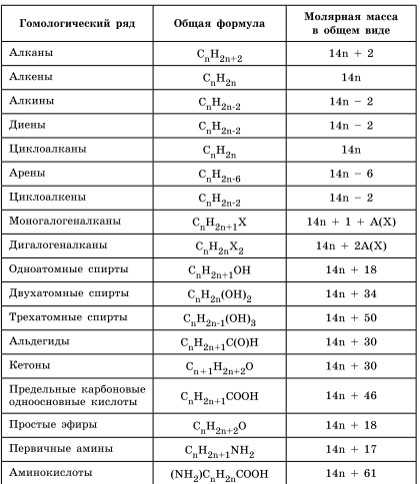
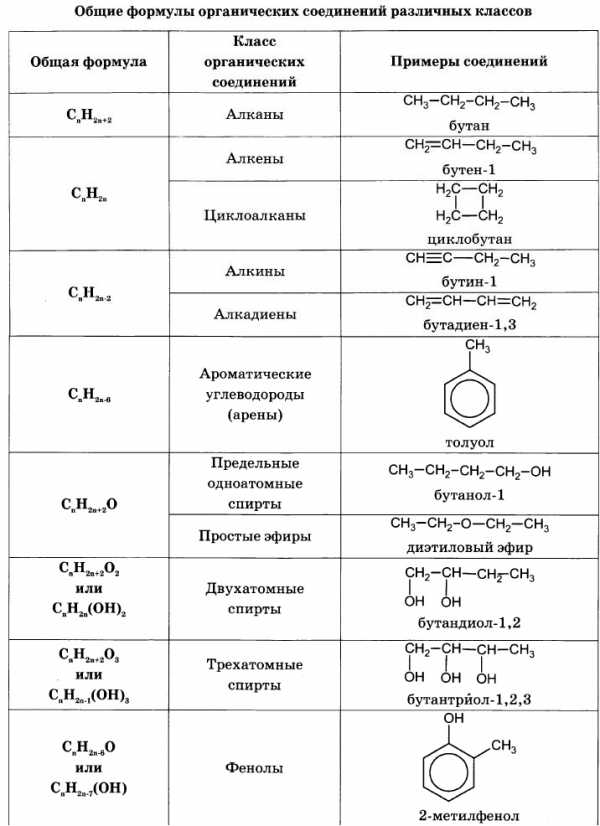
Для решения задач этого типа необходимо знать общие формулы классов органических веществ и общие формулы для вычисления молярной массы веществ этих классов:
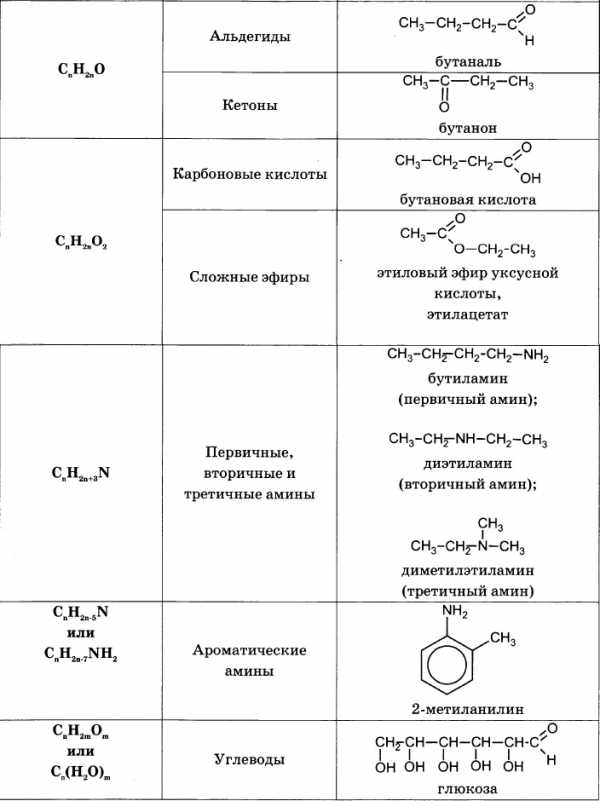
Алгоритм решения большинства задач на нахождение молекулярной формулы включает следующие действия:
— запись уравнений реакций в общем виде;
— нахождение количество вещества n, для которого даны масса или объем, или массу или объём которого можно вычислить по условию задачи;
— нахождение молярной массы вещества М = m/n, формулу которого нужно установить;
— нахождение числа атомов углерода в молекуле и составление молекулярной формулы вещества.
Примеры решения задачи 40 ЕГЭ по химии на нахождение молекулярной формулы органического вещества по продуктам сгорания с объяснением
Задача 1.
При сгорании 11,6 г органического вещества образуется 13,44 л углекислого газа и 10,8 г воды. Плотность паров этого вещества по воздуху равна 2. Установлено, что это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
Решение: общая формула органического вещества СxHyOz.
Переведем объем углекислого газа и массу воды в моли по формулам:
n= m/М и n= V/Vm,
Молярный объем Vm = 22,4 л/моль
n(CO2) = 13,44/22,4= 0,6 моль, =>в исходном веществе содержалось n(C) =0,6 моль,
n(H2O) = 10,8/18 = 0,6 моль, => в исходном веществе содержалось в два раза больше n(H) = 1,2 моль,
Узнаем, содержался ли кислород в органическом соединении. Для этого от массы органического вещества отнимаем массу углерода и массу водорода: m(O)= 11,6 – 0,6* 12 – 1,2= 3,2 г,
Значит, искомое соединение содержит кислород количеством:
n(O)= 3,2/16 = 0,2 моль
Посмотрим соотношение атомов С, Н и О, входящих в состав исходного органического вещества:
n(C) : n(H) : n(O) = x : y : z = 0,6 : 1,2 : 0,2 = 3 : 6 : 1
Нашли простейшую формулу: С3H6О
Чтобы узнать истинную формулу, найдем молярную массу органического соединения по формуле:
М(СxHyOz) = Dвозд(СxHyOz) *M(возд)
Mист(СxHyOz) = 29*2 = 58 г/моль
Проверим, соответствует ли истинная молярная масса молярной массе простейшей формулы:
М (С3H6О) = 12*3 + 6 + 16 = 58 г/моль — соответствует, => истинная формула совпадает с простейшей.
Молекулярная формула: С3H6О
Из данных задачи: » это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты» делаем вывод, что это альдегид.
2) При взаимодействии 18,5 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
3) Некоторая предельная карбоновая одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
4) Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше,чем молярная масса исходного углеводорода
5) При сгорании органического вещества массой 3,9 г образовались оксид углерода (IV) массой 13,2 г и вода массой 2,7 г. Выведите формулу вещества, зная, что плотность паров этого вещества по водороду равна 39.
6) При сгорании органического вещества массой 15 г образовались оксид углерода (IV) объемом 16,8 л и вода массой 18 г. Выведите формулу вещества, зная, что плотность паров этого вещества по фтороводороду равна 3.
7) При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
8) При сгорании бескислородного органического вещества образовалось 4,48 л (н.у.) углекислого газа, 3,6 г воды и 3,65 г хлороводорода. Определите молекулярную формулу сгоревшего соединения.
9) При сгорании органического вещества массой 9,2 г образовались оксид углерода (IV) объёмом 6,72 л (н.у.) и вода массой 7,2 г. Установите молекулярную формулу вещества.
10) При сгорании органического вещества массой 3 г образовались оксид углерода (IV) объёмом 2,24 л (н.у.) и вода массой 1,8 г. Известно, что это вещество реагирует с цинком.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4 ) напишите уравнение реакции этого вещества с цинком.
himege.ru
