|
Информационный портал Всероссийской олимпиады школьников |
Общая информация о Всероссийских предметных олимпиадах школьников, итоги, задания и решения |
|
Олимпиады для школьников: информационный сайт |
Календарь текущих и предстоящих мероприятий. Поиск олимпиады по региону, предмету, классу и типу тура. Архив заданий и результатов. Форум. |
|
Центр дистанционного образования «Эйдос» (всероссийские дистанционные эвристические олимпиады) |
Сегодня — один из лидеров отечественного дистанционного образования. |
|
Интернет-олимпиада для школьников «Кенгуру» |
Международный математический конкурс-игра под девизом «Математика для всех». Главная цель конкурса — привлечь как можно больше ребят к решению математических задач, показать каждому школьнику, что обдумывание задачи может быть делом живым, увлекательным, и даже веселым! |
|
Всероссийский конкурс юношеских исследовательских работ им. В.И. Вернадского |
|
|
Олимпиада по русскому языку. Подготовка к олимпиаде |
Возможность подготовиться к лингвистическим олимпиадам по русскому языку, творческим конкурсам, соревнованиям. Нет сухих, скучных правил, есть только жизнь языка, его законы, отражающие эту жизнь. |
|
Юность, наука, культура: Всероссийский открытый конкурс исследовательских и творческих работ учащихся |
Олимпиады и иные конкурсные мероприятия, по итогам которых присуждаются премии для поддержки талантливой молодёжи. |
|
Умник. Всероссийский детский Интернет-фестиваль |
На сайте созданы условия для развития способностей к самообразованию детей различных социальных категорий вне зависимости от места проживания и удаленности от центров образования и культуры жителей регионов. |
|
Турнир Городов — международная математическая олимпиада |
Задания рассчитаны на учащихся 8-11 классов. Особенность Турнира городов в том, что он ориентирует участников не на спортивный успех, а на углублённую работу над задачей, т.е. развивает качества, необходимые в исследовательской работе |
| Олимпиада «Сократ» |
На страницах данного ресурса ведётся повествование детским языком о президенте, конституции, демократии, власти, правах и свободах граждан, армии и многом другом. |
kimhimik628181.jimdo.com
ГДЗ по химии 8 класс контрольно-измерительные материалы Троегубова
ГДЗ > Химия > 8 класс > Контрольно-измерительные материалы (КИМ) по химии 8 класс. ФГОС Троегубова Вако
- Химия – наука с характером! Одержать победу над мудреными формулами и вычислениями, постичь суть веществ и проследить их связи, разобраться в особенностях элементов и тонкостях реакций поможет решебник онлайн – талантливый наставник, шустрый помощник и постоянный спутник школьника.
- КИМы по химии, подготовленные Н.П. Троегубовой – сокровищница знаний и эффективный инструмент для их применения. Пособие составлено в формате ЕГЭ к учебнику Габриэляна. Вниманию восьмиклассников предлагаются задания разного уровня сложности и ключи к ним. Пройдя по проторенному специалистами пути, школьники смогут:
— повторить пройденный материал;
— сформировать необходимые навыки;
— опробовать умения на практике;
— проверить результаты и закрепить достижения.
Химия в 8 классе: курс на уровень «ас»! - ГДЗ онлайн требуют особого подхода. Они созданы не для обмана. Миссия этого бесплатного репетитора облегчить жизнь школьников и их родителей, предложив скорректировать путь к новым открытиям и вершинам науки. Помните! Только правильное использование решебника гарантирует отличные отметки, уверенность на ЕГЭ и фундаментальные знания по предмету.
- Списать готовые ответы и блеснуть безупречной «домашкой» может каждый, но что потом? Испорченная репутация, крах на самом важном в жизни экзамене, отсутствие элементарного кругозора. Списывать готовые ответы на КИМы онлайн не запретит никто, но стоит ли поступать таким образом, решать только вам!
www.euroki.org
Контрольно-измерительные материала по химии
Филиал ГБПОУ Дуванский многопрофильный колледж с. Малояз
Комплект контрольно-измерительных материалов
(для итоговой аттестации)
по учебной дисциплине
Химия
Малояз, 2016
СОДЕРЖАНИЕ
| 1 | ПАСПОРТ КОМПЛЕКТА КИМ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ …………………………………………. | 3 |
| 2 | СТРУКТУРА И ПЕРЕЧЕНЬ КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫХ МАТЕРИАЛОВ ДЛЯ ИТОГОВОЙ АТТЕСТАЦИИ ПО ДИСЦИПЛИНЕ …………………………………………. | 6 |
| 3 | ПЕРЕЧЕНЬ МАТЕРИАЛОВ И ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ ……………. | 10 |
1. ПАСПОРТ КОМПЛЕКТА ИЗМЕРИТЕЛЬНЫХ МАТЕРИАЛОВ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
1.1. Общие положения
Контрольно-измерительные материалы (КИМ) предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины «Химия».
Содержание современного курса химии тесно связано не только с задачей получения фундаментального естественно — научного образования, но и с задачей формирования представлений о химии как о необходимой для каждого человека составляющей общих знаний о мире и понимания значимости этой науки для общественного прогресса. Важной частью общей культуры является широкий набор знаний, которые человек активно использует в быту, в профессиональной деятельности, на протяжении всей жизни. Умение применять полученные теоретические знания на практике может служить критерием оценки уровня культурного развития человека. Поэтому одним из традиционных направлений в преподавании химии является освещение вопросов прикладной направленности. Прикладная направленность химии осуществляется с целью повышения качества химического образования обучающихся, применения их химических знаний к решению задач повседневной практики и в профессиональной деятельности.
течение двух семестров. Формой промежуточной аттестации после изучения является дифференцированный зачет.
-
Результаты освоения дисциплины, подлежащие проверке
В ходе аттестации по дисциплине осуществляется проверка следующих умений, знаний и формирования общих компетенций
| Результаты обучения (умения, знания) | Основные показатели оценки результатов |
| У.1. Применять основные законы химии для решения задач в области профессиональной деятельности; У.2 Использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологических процессов; У.3 Описывать уравнениями химических реакций процессы, лежащие в основе производства пищевых продуктов; У.4 Проводить расчеты по химическим формулам и уравнениям реакций; У.5 Использовать химическую посуду и оборудование; У.6 Выбирать метод и ход химического анализа, подбирать реактивы и оборудование; У.7 Проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений; У.8 Выполнять количественные расчеты состава вещества по результатам измерений; У.9 Соблюдать правила техники безопасности при работе в химической лаборатории. | — Обоснованное применение законов химии в профессиональной деятельности; — Способность оптимизировать технологические процессы, основываясь на свойствах веществ, дисперсных и коллоидных систем; — Способность представить химизм процесса производства пищевых продуктов с помощью уравнений реакций; — Достоверный результат расчета; — Использование химической посуды и оборудования по назначению; — Обоснованный выбор метода проведения химического анализа; — Способность выполнить качественный анализ; — Способность провести количественный анализ с получением достоверного результата; — Умение соблюдать правила техники безопасности при работе в химической лаборатории; |
| З.1 Основные понятия и законы химии; З.2 Теоретические основы органической, физической и коллоидной химии; З.3 Понятия химической кинетики и катализа; З.4 Классификацию химических реакций и закономерности их протекания; З.5 Обратимые и необратимые химические реакции, химическое равновесие, химическое равновесие и его смещение под действием различных факторов; З.6 Окислительно-восстановительные реакции, реакции ионного обмена; З.7 Гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; З.8 Тепловой эффект химических реакций, термохимические уравнения; З.9 Характеристики различных классов органических соединений, входящих в состав сырья и готовой пищевой продукции; З.10 Свойства растворов и коллоидных систем высокомолекулярных соединений; З.11 Дисперсные и коллоидные системы пищевых производств; З.12. Роль и характеристики поверхностных явлений в природных и технологических процессах; З.13 Основы аналитической химии; З.14 Основные методы классического количественного и физико-химического анализа; З.15 Назначение и правила использования лабораторного оборудования и аппаратуры; З.16 Методы и технику выполнения химических анализов; З.17 Приемы безопасной работы в химической лаборатории. | – Знание основных понятий и законов химии – Знание основ органической, физической и коллоидной химии; – Знание сущности химической кинетики и катализа, в т.ч. факторов на него влияющих; — Знание различных вариантов классификации химических реакций; — Знание сущности химического равновесия и условий его смещения; — Знание сущности окислительно-восстановительных и обменных процессов; — Знание сущности процесса гидролиза и факторов на него влияющих; — Знание основных понятий и законов термохимии; — Знание общей характеристики и особенностей органических соединений, входящих в состав сырья и готовой пищевой продукции; — Знание свойств растворов и коллоидных систем высокомолекулярных соединений; — Знание дисперсных и коллоидных систем пищевых производств; — Знание сущности поверхностных явлений и их роли в природных и технологических процессах; — Знание основ аналитической химии; — Знание основных приемов и методов количественного и физико-химического анализа; — Знание назначений и правил использования лабораторного оборудования и аппаратуры; — Знание методов и техники выполнения химических анализов; — Знание приёмов безопасной работы в химической лаборатории. |
1.3 Критерии оценки знаний и умений
Итоговый тест за курс основной общей школы
Итоговый тест содержит задания по основным темам курса химии: «Строение атома», «Периодический закон и периодическая система химических элементов Д.И. Менделеева», «Строение вещества», «Химические реакции», «Основные закономерности протекания химических реакций», «Растворы. Теория электролитической диссоциации», «Окислительно-восстановительные реакции», «Классификация веществ», «Основные классы неорганических и органических соединений».
Задания оцениваются в 1 балл. Максимальная сумма баллов — 20.
Баллы, полученные за правильно выполненные задания, переводятся в традиционные отметки по шкале:
«5» — 18-20 балла «4» — 15-17 балла,
«3» — 12-14 баллов «2» — 11 баллов и менее.
Вариант 1
1. Число электронов, которые содержатся в атоме углерода равно:
1) 6; 2) 12; 3) 8
2. Электронная формула атома 1s 22s 22p 63s 23p2 . Химический знак этого элемента:
1) C; 2) O; 3) Si
3. Радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий:
1) увеличиваются; 2) уменьшаются; 3) не изменяются.
4. Химическая связь в молекуле воды:
1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная.
5. Формулы кислотных оксидов:
1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3
6. Формула сероводородной кислоты: 1) h3S; 2) h3SO4; 3) h3SO3
7. К реакциям обмена относится:
1) CaO + h3O= Ca(OH)2;
2) Сu(OH)2= CuO + h3O;
3) KOH + HNO3= KNO3 + h3O
8. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются:
1) кислотами;
2) солями;
3) основаниями.
9. Какая степень окисления хрома в К2Сr2О7?
1) +6; 2) +3; 3) -3; 4) -6.
10. Присутствие в растворе кислоты можно доказать с помощью:
1) лакмуса;
2) фенолфталеина;
3) щелочи
11. Вещества с общей формулой CnH2n относятся к классу
1) алканов 2) алкенов 3) алкинов 4) аренов
12. Вещество, формула которого С2Н6 относится к классу
1) алканов 2) алкенов 3) алкинов 4) Аренов
13. Вещество, формула которого СН3 – СН2 – СН2 – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Вещество, формула которого СН2 = СН – СН – СН3 называется
СН3
1) 2-метилбутен-3 2) 2-метилбутин-3 3) 3-метилбутен-1 4) 3-метилбутин-1
15. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n+2, является реакция
1) замещения 2) гидрирование 3) присоединение 4) дегидрирование
16.Укажите «лишнее» вещество в ряду:
1) 3 -метилбутаналь; 2) изопропанол;
3) метаналь; 4) ацетальдегид.
17. Дайте название соединению

1) 3-метилбутанол-2; 2) 2-метилбутанол-3;
3) 3-метилпропанон-2; 4) 2-метилпропаналь-2.
18. Функциональная группа – СОН характерна для:
1) альдегидов; 2) сложных эфиров;
3) простых эфиров; 4) спиртов.
19. Вещество, относящееся к аминам, имеет формулу
1)С6Н5—NO2 2) С6Н5—Nh3
3)С6Н5—СН3 4) С6Н5—OH
20. Мономерами белков выступают:
1) аминокислоты; 2) моносахариды;
3) нуклеотиды; 4) остатки фосфорной кислоты.
Вариант 2
1. Число нейтронов, которые содержатся в атоме кислорода равно:
1) 6; 2) 12; 3) 8.
2. Формула высшего оксида элемента, электронная формула которого 1s 22s22p 63s 23p3 :
1) N2 O5 ; 2) P2 O5; 3) B2O3 .
3. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
4. Формула вещества с ковалентной полярной связью:
1) h3O; 2) O2; 3) CaCl2
5. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ;
2) NaOH и KHSO4;
3) Al(OH)3 и HNO3
6. Формула сульфита натрия:
1) Na2SO4; 2) Na2SO3; 3) Na2S
7. К реакциям замещения относится:
1) Ca + h3SO4= CaSO4 + h3;
2) Сu(OH)2= CuO + h3O;
3) KOH + HNO3= KNO3 + h3O
8. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются:
1) солями; 2) кислотами; 3) основаниями.
9. В ПСХЭМ в группе сверху вниз увеличивается:
1) металлические свойства; 2) сила высших кислот;
3) электроотрицательность атома; 4) неметаллические
10.Назовите элемент, электронная формула которого:
1s2, 2s2, 2p6, 3s2, 3p5
1) фосфор; 2) сера; 3) хлор; 4) кислород.
11. Для алканов характерна общая формула
1)Cnh3n 2)Cnh3n+2 3)Cnh3n-2 4)Cnh3n-6
12. К классу алкенов относится вещество с молекулярной формулой
1) С6Н10 2) С6Н6 3) С6Н12 4) С6Н14
13. Вещество, формула которого СН3 – С ≡ С – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Гомологом этана является
1) С2Н4 2) С2Н6 3) С3Н8 4) С3Н6
15. Укажите название соединения СН2 = СН — СН2 — СН2 — СН2 — СН3
1) 3,3-диметилбутин-1; 2) октин-1; 3) 3,3-диметилпентин-1; 4) гексен-1
16. Для алкенов характерна реакция
1) замещения 2) обмен 3) присоединения 4) дегидратации
17. Дайте название соединению:
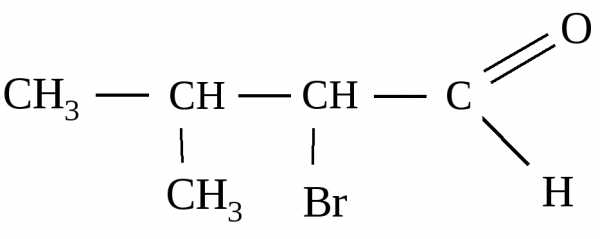
1) 2-метил-3-бромбутанол-1; 2) 2-бром-З-метилбутаналь;
3) 2-бром-З-метилпропаналь; 4) 2-метил-З-бромбутаналь.
18.Укажите «лишнее» вещество в ряду:
1) метанол; 2) этаналь; 3) пентанол; 4) бутиловый спирт.
19. Функциональная группа – СОО- характерна для
1) альдегидов; 2) сложных эфиров; 3) углеводов; 4) спиртов.
20. В состав белков может входить
1)пять аминокислот; 2) двадцать аминокислот;
3)десять аминокислот; 4) тридцать аминокислот
КЛЮЧИ К ДИФФЕРЕНЦИРОВАННОМУ ЗАЧЕТУ
| В1 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 1 | 3 | 1 | 2 | 2 | 1 | 3 | 2 | 1 | 1 | 2 | 1 | 1 | 3 | 1 | 2 | 1 | 1 | 2 | 1 | |
| В2 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 3 | 2 | 2 | 1 | 3 | 2 | 1 | 3 | 1 | 3 | 2 | 3 | 3 | 3 | 4 | 3 | 2 | 2 | 2 |
|
Список использованной литературы
1. Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
2. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2006.
3. ПЕРЕЧЕНЬ МАТЕРИАЛОВ, ОБОРУДОВАНИЯ И ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ
3.1 Рекомендуемая литература для разработки оценочных средств и подготовки обучающихся к аттестации
Габриелян О.С., Остроумов И.Г. Химия: — М.: Академия, 2010. – 257с.
Глинка Н.Л. Общая химия:- М.: Юрайт,2012. – 898с.
Харитонов Ю.Я. Аналитическая химия (аналитика). В 2кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учеб. Для вузов. – 2-е изд., испр. – М.:Высш.шк., 2003. – 559с.: ил.
Физическая и коллоидная химия (в общественном питании): Учебное пособие/ С.В.Горбунцова, Э.А.Муллоярова, Е.С.Оробейко, Е.В.Федоренко. – М.: Альфа-М;ИНФРА-М, 2008. – 270с.: ил. – (Серия «Профиль»).
Белик В.В. Физическая и коллоидная химия: учебник для студ. сред. проф. учеб. заведений – 4-е изд., стер. – М.:Издательский центр «Академия», 2008. – 288 с.
Задачи и упражнения и упражнения по общей химии6 Учеб. пособие/ Б.И.Адамсон, О.Н.Гончарук, В.Н. Камышова и др.; Под ред. Н.В.Коровина. – 2-е изд., испр. – М.:Высш. шк., 2004. – 255 с.: ил.
xn--j1ahfl.xn--p1ai
КИМ-химия — химия, тесты
КИМ
итоговой работы для учащихся 9 класса общеобразовательных учреждений по химии
Инструкция для обучающихся:
На выполнение итоговой работы по химии отводится 45 минут. Работа состоит из трех частей, включающих 15 заданий.
Часть 1 включает 10 заданий (1-10). К каждому заданию предлагается 4 ответа, один из которых верный.
Часть 2 содержит 3 задания (11-13): 1- с выбором нескольких правильных ответов из шести, 2 – на установление соответствия.
Часть 3 содержит 2 задания (14-15), на которые следует дать развернутый ответ.
Внимательно прочитайте задания к каждому виду работы.
Задания не нужно переписывать, советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу и переходите к следующему. При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжения металлов. Если после выполнения всей работы у Вас останется время, то можно вернуться к пропущенным заданиям.
Не забудьте перед началом работы указать своё имя, фамилию и класс.
Желаю успеха!
| При выполнении заданий 1 — 10 укажите одну цифру, которая соответствует номеру правильного ответа. |
1. Схема строения электронной оболочки: +ZЭ 2ē3ē соответствует атому химического элемента:
1) 3-го периода IIA-группы;
2) 3-го периода IIA-группы;
3) 3-го периода IIA-группы;
4) 3-го периода IIA-группы.
2. Ионная связь не характерна для соединения, образованного атомами:
1) бария и серы;
2) натрия и хлора;
3) фосфора и хлора;
4) кальция и фтора.
3. Вещества, формулы которых – Al(OH)3 и SO3, являются соответственно:
1) основанием и кислотным оксидом;
2) солью и амфотерным оксидом;
3) амфотерным гидроксидом и кислотным оксидом;
4) основанием и основным оксидом.
4. Признаком протекания химической реакции между хлоридом бария и серной кислотой является:
1) выпадение осадка;
2) появление запаха;
3) выделение газа;
4) растворение осадка.
5. Какая запись соответствует процессу электролитической диссоциации?
1) NaOH = Na+ + OH—;
2) C2H4 = C2H2 + H2;
3) 2HI = H2 + I2;
4) Ag+ + Cl— = AgCl.
6. Железо вытесняет металл из растворов:
1) AlCl3;
2) Ba(OH)2;
3) CuSO4;
4) Zn(NO3).
7. Верны ли следующие суждения о свойствах кислот?
А. Все кислоты реагируют с металлами с выделением водорода.
Б. Концентрированная серная кислота реагирует с медью.
1) верно только А;
2) верно только Б;
3) верны оба суждения;
4) оба суждения неверны.
8. С раствором сульфата цинка реагирует:
1) свинец;
2) углерод;
3) оксид кремния;
4) гидроксид калия.
9. Верны ли осуждения о химическом загрязнении окружающей среды и его последствиях?
А. Ионы тяжёлых металлов, содержащиеся в овощах, выращенных у дорог, никак не влияют на здоровье человека.
Б. Использование бензина, содержащего соединения свинца, отрицательно сказывается на состоянии окружающей среды и на здоровье человека.
1) верно только А;
2) верно только Б;
3) верны оба суждения;
4) оба суждения неверны.
10. Углерод является окислителем в реакции, схема которой:
1) CO + O2 → CO2;
2) CO2 + Na2O → Na2CO3;
3) CO2 + Mg → C + MgO;
4) C + Cl2 → CCl4.
| При выполнении заданий 11 и 12 из предложенного перечня ответов выберите несколько правильных и запишите в бланк ответов. |
11. Ослабление кислотных свойств высших оксидов наблюдается в рядах образующих их элементов:
1) P → S → Cl;
2) Te → Se → S;
3) C → Si → Ge;
4) As → Se → Br;
5) Si → Al → Mg.
Ответ:
12. Для метанола верны следующие суждения:
1) состав молекулы отражает общая формула CnH2n+1OH;
2) атомы углерода и водорода соединены ионной связью;
3) плохо растворим в воде;
4) вступает в реакцию присоединения с водородом;
5) сгорает с образованием углекислого газа и воды.
Ответ:
| При выполнении задания 13 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите в бланк ответов выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться. |
13. Установите соответствие между ионами и реактивами, которыми можно их распознать:
ИОН: РЕАКТИВ:
А) H+ 1) Ba2+
Б) Cl— 2) Ag+
В) SO42- 3) лакмус
Г) OH— 4) Na+
Ответ:
| Для ответов на задания 14 и 15 используйте отдельный лист. Запишите сначала номер задания, а затем развернутый ответ к нему. |
14. Дана схема превращений:
Na →+H2O X → Na2SO4 → NaCl
15. 170г раствора хлорида бария смешали с избытком раствора сульфата натрия. Выпал осадок массой 8,65г. Вычислите массовую долю соли в растворе хлорида бария.
kopilkaurokov.ru
Педагогическая деятельность — Сайт учителя химии Ким Н.В.
Мое жизненное кредо: считаю главной заповедь педагога «Не навреди» и девиз «Я не над вами – я вместе с вами».
Педагогическая цель: показать каждому ученику красоту химии и её значимость, как части общечеловеческой культуры.
Педагогические задачи:
научить учиться, не бояться того, чего ещё просто не знаешь;
показать, что химия опирается на знания математики, географии, физики, биологии, иностранного языка;
развить умения: думать, говорить, рассуждать, спорить, считать;
познакомить с достижениями современной науки и её возможностями в будущем.
Квалификационная категория: высшая.
Стаж педагогической работы: 25 лет.
kimhimik628181.jimdo.com
Ким А.М. Органическая химия [DJVU]
Учебное пособие. — 4-е изд., испр. и доп. — Новосибирск: Сибирское университетское издательство, 2004. — 844 с. — ISBN 5-94087-156-9.Рассматриваются современные теоретические представления, синтетические аспекты органической химии, экологические проблемы производства и применения органических продуктов.Большое внимание уделено методологии изучения органической химии. Пособие снабжено многочисленными методическими рекомендациями, примерами, задачами и упражнениями.
Для студентов и преподавателей высших учебных заведений, учителей, а также учащихся химико-биологических классов средних учебных заведений.Предисловие к четвертому изданию.
Предисловие к третьему изданию.
Предисловие ко второму изданию.
Предисловие к первому изданию.
Введение.
Предмет органической химии.
Краткий исторический обзор органической химии.
Первые теоретические воззрения.
Теория химического строения А. М. Бутлерова.
Атомы, молекулы, химическая связь.
Введение.
Электронная теория строения атомов.
Корпускулярные свойства света и волновые свойства частиц.
Квантовая или волновая механика.
Многоэлектронные атомы.
Природа химической связи.
Типы химической связи.
Межмолекулярные взаимодействия.
Химические связи элементов второго периода.
Физические свойства ковалентной связи.
Задачи и упражнения.
Механизмы взаимного влияния.
Межмолекулярные электронные взаимодействия.
Внутримолекулярные электронные взаимодействия.
Задачи и упражнения.
Изомерия.
Структурная изомерия.
Пространственная изомерия.
Задачи и упражнения.
Статистические основы химии.
Химические реакции.
Термодинамика химических реакций.
Кинетика химических реакций.
Типы элементарных процессов.
Классификация химических реакций.
Реагирующие органические частицы.
Задачи и упражнения.
Кислотно-основные взаимодействия.
Теория электролитической диссоциации.
Протолитическая теория Брёнстеда — Лоури.
Теория кислот и оснований Льюиса.
Теория жестких и мягких кислот и оснований.
Задачи и упражнения.
Классификация органических соединений.
Номенклатура органических соединений.
Задачи и упражнения.
Алканы.
Практическое значение алканов.
Нахождение алканов в природе.
Строение алканов.
Физические свойства алканов.
Химические свойства алканов.
Нефть, продукты нефтепереработки.
Препаративные способы получения алканов.
Экологическое послесловие.
Задачи и упражнения.
Алкены.
Физические свойства алкенов.
Строение алкенов.
Химические свойства алкенов.
Практическое значение алкенов.
Полимеризация алкенов. Полиолефины.
Получение алкенов.
Экологическое послесловие.
Задачи и упражнения.
Алкины.
Физические свойства алкинов.
Строение алкинов.
Химические свойства алкинов.
Практическое значение алкинов.
Получение алкинов.
Экологическое послесловие.
Задачи и упражнения.
Алкадиены.
Строение сопряженных алкадиенов.
Химические свойства 1,3-алкадиенов.
Получение 1,3-алкадиенов.
Экологическое послесловие.
Задачи и упражнения.
Природные изопреноиды. Терпены.
Монотерпены.
Сесквитерпены.
Дитерпены.
Каротиноиды.
Задачи и упражнения.
Циклоалканы
Номенклатура циклоалканов.
Строение моноциклоалканов.
Химические свойства циклоалканов.
Получение карбоциклических соединений.
Полиэдрические органические соединения.
Практическое значение циклоалканов.
Задачи и упражнения.
Ароматические углеводороды (арены).
Строение бензола.
Ароматичность.
Химические свойства бензола.
Замещенные бензолы.
Многоядерные ароматические углеводороды.
Источники ароматических углеводородов.
Экологическое послесловие.
Задачи и упражнения.
Галогенуглеводороды.
Физические свойства галогенуглеводородов.
Строение галогенуглеводородов.
Химические свойства алкилгалогенидов.
Химические свойства арил галогенидов.
Винилгалогениды.
Аллил-, бензилгалогениды.
Ди- и полигалогенуглеводороды.
Фторуглеводороды.
Практическое значение галогенуглеводородов.
Способы получения галогенуглеводородов.
Экологическое послесловие.
Задачи и упражнения.
Спирты, фенолы.
Физические свойства спиртов и фенолов.
Химические свойства спиртов и фенолов.
Количественное рассмотрение реакционной способности органических соединений.
Многоатомные спирты и фенолы.
Природные спирты и фенолы.
Практическое значение спиртов и фенолов.
Способы получения спиртов и фенолов.
Экологическое послесловие.
Задачи и упражнения.
Простые эфиры.
Химические свойства простых эфиров.
Циклические простые эфиры.
Макроциклические простые эфиры (краун-эфиры).
Задачи и упражнения.
Альдегиды и кетоны.
Физические свойства альдегидов и кетонов.
Особенности строения альдегидов и кетонов.
Химические свойства альдегидов и кетонов.
Природные альдегиды и кетоны.
Практическое значение альдегидов и кетонов.
Получение альдегидов и кетонов.
Экологическое послесловие.
Задачи и упражнения.
Карбоновые кислоты.
Физические свойства карбоновых кислот.
Химические свойства карбоновых кислот.
Дикарбоновые кислоты.
Галоген- и гидроксикарбоновые кислоты.
Непредельные карбоновые кислоты.
Нахождение карбоновых кислот в природе.
Практическое применение карбоновых кислот.
Получение карбоновых кислот.
Экологическое послесловие.
Задачи и упражнения.
Производные карбоновых кислот.
Химические свойства производных карбоновых кислот.
Дикарбонильные соединения.
Практическое значение производных карбоновых кислот.
Получение производных карбоновых кислот.
Жиры (липиды).
Экологическое послесловие.
Задачи и упражнения.
Органический синтез.
Общая стратегия синтеза.
Методы и приемы органического синтеза.
Исходные вещества органического синтеза.
Задачи и упражнения.
Углеводы.
Моносахариды.
Олигосахариды.
Полисахариды.
Практическое значение углеводов.
Экологическое послесловие.
Задачи и упражнения.
Органические азотсодержащие соединения.
Нитросоединения.
Амины.
Диазониевые соли.
Природные амины.
Практическое значение аминов.
Получение аминов.
Экологическое послесловие.
Задачи и упражнения.
Аминокислоты, пептиды, белки.
Строение аминокислот. Кислотно-основные свойства.
Химические свойства аминокислот.
Полипептиды, пептидный синтез.
Структура белков.
Задачи и упражнения.
Гетероциклические соединения.
Номенклатура гетероциклических систем.
Строение гетероциклов.
Пяти- и шестичленные гетероциклы с одним гетероатомом.
Пяти- и шестичленные гетероциклы с двумя гетероатомами.
Нуклеиновые кислоты.
Алкалоиды.
Задачи и упражнения.
Металлорганические соединения.
Строение металлорганических соединений.
Способы получения металлорганических соединений.
Химические свойства магнийорганических соединений.
Практическое значение металлорганических соединений.
Задачи и упражнения.
Литература.
Предметный указатель.
www.twirpx.com
Ким химия 4 | Образовательный портал EduContest.Net — библиотека учебно-методических материалов
Вопросы для проведения контрольной работы по темам:
« Кислородосодержащие соединение. Азотосодержащие соединения»
По учебной дисциплине «Химия»
Профессии: « Хозяйка усадьбы», «Автомеханик».
Вариант 1.
Инструкция к заданиям № 1,2,3,4,5,6: Выберите буквы, соответствующие варианту правильных ответов.
1.Углеводом не является вещество, формула которого: (1б)
а) C5h20O5
б) C6h22O2
в) C12h32O11
г) C6h22O6
2.К дисахаридам относится: (1б)
а) фруктоза
б) крахмал
в) сахароза
г) рибоза
3.Моносахаридами являются оба вещества пары: (1б)
а) крахмал, глюкоза
б) фруктоза, сахароза
в) галактоза, мальтоза
г) дезоксирибоза, глюкоза
4.Даны два утверждения: (1б)
1) метиламин – это производное аммиака, в котором один атом водорода замещен на метильную группу;
2) метиламин – это производное метана, в котором один атом водорода замещен на аминогруппу.
Вы считаете, что:
а) оба утверждения не верны
б) оба утверждения верны
в) первое утверждение верное, второе – нет
г) второе утверждение верное, первое – нет
5.Общая формула предельных одноатомных спиртов:
а) Cnh3n-1OH
б) Cnh3nOHв) Cnh3n+1OH
г) Cnh3n-2OH
6.Этиленгликоль – это жидкость:
а) хорошо растворимая в воде
б) вязкая бесцветная
в) ядовитая
г) все ответы верны
Инструкция к заданию №7: Установите соответствие между элементами столбцов. Соотнесите формулу вещества и класс органического вещества:
7. Соотнесите вещества с формулами:
1)жир а) C17h45COOC16h43
2)воск б) C17h45COO Na
3) твердое мыло в) Ch3OCOC17h43
4)жидкое мыло ∣
CHOCOC17h43
∣
Ch3OCOC17h43
г) C15h41COOK
Часть Б. Задания со свободным ответом. За задание 2 балла.
Инструкция к заданию №8: Продолжите определение.
8. Спиртами называют…
Инструкция к заданию №9: Выберите правильные ответы.
Инструкция к заданию №11:Закончите определение.
11.Степень полимеризации обозначается буквой …
Часть С. За задание 4 балла.
12. Осуществите цепочку превращений. Укажите тип органической реакции.
C → CH
educontest.net
