Диссоциация кислот, оснований и солей в водных растворах — Электролитическая диссоциация — Физико-химическая теория растворов электролитов и неэлектролитов — Теоретические основы химии
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 Н+ + Н2РО—4(первая ступень)
Н2РО—4 Н+ + НРO2-4 (вторая ступень)
НРО2-4 Н+ PОЗ—4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например:
KOH K+ + OH—; NH4OH NH+4 + OH—
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН4ОН — однокислотное основание, Са(ОН)2 — двухкислотное, Fе(ОН)3 — трехкислотное и т.д. Двух— и многокислотные основания диссоциируют ступенчато
Ca(ОН)2Са(ОН)+ + OH— (первая ступень)
Ca(OH) +Ca2++OH— (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид—ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН— (в незначительных количествах):
Н2O Н+ + ОН—
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+, и щелочные свойства, обусловленные наличием ионов ОН—.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2можно выразить уравнением
2ОН— + Zn2+ + 2Н2О Zn(ОН)2 + 2Н2О [Zn(ОН)4]2-+ 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH
Например:
(NH4)2SO4 2NH+4 + SO2-4; Na3PO4 3Na+ + PO3-4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4 K+ + HSO—4
и далее
HSO—4 H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид—ионы.
Mg(OH)Cl Mg(OH)++Cl—
и далее
Mg(OH)+ Mg2++OH—
Например:
Например:
НCl Н++ Сl—; СН3СООН Н+ + СН3СОО—Основностъ кислоты определяется числом катионов водорода, вторые образуются при диссоциации. Так, НCl, HNO3 — одноосновные кислоты — образуется один катион водорода; Н2S, Н2СО3, Н2SO4 — двухосновные, а Н3РО4, Н3АsО4 — трехосновные, так как образуются соответственно два и три катиона водорода. Из четырех атомов водорода, содержащихся в молекуле уксусной кислоты СН3СООН, только один, входящий в карбоксильную группу — СООН, способен отщепляться в виде катиона Н+, — уксусная кислота одноосновная.
Двух— и многоосновные кислоты диссоциируют ступенчато (постепенно).
Например:
www.himhelp.ru
ДИССОЦИАЦИЯ в химии — Большая Медицинская Энциклопедия
ДИССОЦИАЦИЯ в химии (лат. dissociatio разделение, разъединение) — обратимое разложение сложного вещества на несколько более простых веществ.
В зависимости от того, под влиянием какого фактора происходит диссоциация вещества (взаимодействие электролита с растворителем, изменение температуры, воздействие света), различают Д. электролитическую, термическую, или тепловую, и фотохимическую (см. Фотохимические реакции, Электролиты). Физ.-хим. свойства и многообразные функции белков определяются их свойствами амфотерных электролитов (см. Амфолиты), концентрацией ионов в р-ре, гл. обр. водородных и гидроксильных. Практика физиол, исследований, микробиол, работ, изучения фармакол, действия лекарственных средств показывает, что для правильных выводов необходимы верные представления о характере Д. электролитов. Широкое распространение в биол, и мед. практике и в клин, анализе получило определение величины pH. С явлением фотохим. Д. связаны явления светового раздражения. Во многих случаях для получения представления о сущности физиол, процесса необходимо учитывать сложную совокупность явлений электролитической и других видов хим. Д. Напр., дыхательная функция крови определяется связанными между собой термической Д. угольной к-ты на углекислый газ и воду, термической Д. оксигемоглобина на гемоглобин (см.) и кислород и электролитической Д. этих соединений на ионы H+ и кислотные остатки, влиянием ионов других электролитов крови. Если в числе продуктов Д. имеются ионы, то вместо термина «диссоциация» часто применяют термин «ионизация». Так, напр., электролитическую Д. электролитов называют ионизацией электролитов, говорят об ионизации газов или паров при действии на них ионизирующего излучения. В большинстве случаев процесс Д. вещества протекает с поглощением энергии, но иногда при Д. происходит и выделение энергии.
Термической Д. называют явление обратимого хим. разложения вещества при его нагревании на такие вещества, которые могут, соединяясь друг с другом, снова давать исходное вещество. Термической Д. могут подвергаться соединения различного типа, напр, оксиды, основания, к-ты, соли, кристаллогидраты и др. Простые вещества также способны к термической Д., напр, двухатомные молекулы галогенов могут распадаться на атомы (I
Если при Д. твердого вещества только один из продуктов Д. находится в газообразном состоянии, то процесс Д. в значительной мере аналогичен испарению.
Библиография: Даниэльс Ф. и Альберти Р. А. Физическая химия, пер. с англ., М., 1967; Некрасов Б. В. Основы общей химии, т. 1—2, М., 1973; Уильямс В. и Уильямс Х. Физическая химия для биологов, пер. с англ., М., 1976.
В. К. Низовкин.
xn--90aw5c.xn--c1avg
Электролитическая диссоциация. Видеоурок. Химия 9 Класс
Тема: Химическая связь. Электролитическая диссоциация
Урок: Электролитическая диссоциация
Тема нашего урока – «Электролитическая диссоциация». Мы попробуем объяснить некоторые удивительные факты:
— Почему растворы кислот, солей и щелочей проводят электрический ток.
— Почему температура кипения раствора электролита всегда будет выше, чем температура кипения раствора не электролита той же концентрации.
Сванте Аррениус
В 1887 году шведский физико — химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток — это направленное движение свободных заряженных частиц. Вы уже знаете, что растворы и расплавы солей и щелочей электропроводны, так как состоят не из нейтральных молекул, а из заряженных частиц – ионов. При расплавлении или растворении ионы становятся свободными переносчиками электрического заряда.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
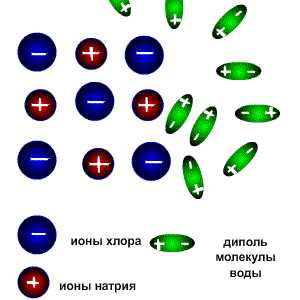
Рис. 1. Схема распада на ионы хлорида натрия
Сущность электролитической диссоциации заключается в том, что ионы становятся свободными под влиянием молекулы воды. Рис.1. Процесс распада электролита на ионы отображают с помощью химического уравнения. Запишем уравнение диссоциации хлорида натрия и бромида кальция. При диссоциации одного моля хлорида натрия образуются один моль катионов натрия и один моль хлорид — анионов.
При диссоциации одного моля бромида кальция образуется один моль катионов кальция и два моля бромид — анионов.
CaBr2⇄Ca2+ + 2Br—
Обратите внимание: так как в левой части уравнения записана формула электронейтральной частицы, то суммарный заряд ионов должен быть равен нулю.
Вывод: при диссоциации солей образуются катионы металла и анионы кислотного остатка.
Рассмотрим процесс электролитической диссоциации щелочей. Запишем уравнение диссоциации в растворе гидроксида калия и гидроксида бария.
При диссоциации одного моля гидроксида калия образуются один моль катионов калия и один моль гидроксид-анионов. KOH⇄K+ + OH—
При диссоциации одного моля гидроксида бария образуются один моль катионов бария и два моля гидроксид — анионов. Ba(OH)2⇄Ba2+ + 2 OH—
Вывод: при электролитической диссоциации щелочей образуются катионы металла и гидроксид — анионы.
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
Рис. 2. Строение молекул хлороводорода и воды
Рассмотри процесс электролитической диссоциации кислот. Молекулы кислот образованы ковалентной полярной связью, а значит, кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды. Рис.2.
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О+.
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H+ + Cl—
При диссоциации одного моля хлороводорода образуются один моль катиона водорода и один моль хлорид — анионов.
Ступенчатая диссоциация серной кислоты
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
II — я стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат — анионов. HSO4—⇄H+ + SO42-
Эта стадия является обратимой, то есть, образующиеся сульфат — ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат — анионы. Это показано знаком обратимости.
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
Теперь мы можем объяснить, почему температура кипения раствора электролита будет выше, чем температура кипения раствора неэлектролита.
При растворении молекулы растворенного вещества взаимодействуют с молекулами растворителя, например – воды. Чем больше частиц растворенного вещества находится в одном объеме воды, тем будет выше его температура кипения. Теперь представим, что в одинаковых объемах воды растворили равные количества вещества-электролита и вещества — неэлектролита. Электролит в воде распадется на ионы, а значит – число его частиц будет больше, чем в случае растворения неэлектролита. Таким образом, наличие свободных частиц в электролите объясняет, почему температура кипения раствора электролита будет выше, чем температура кипения раствора неэлектролита.
Подведение итога урока
На этом уроке вы узнали, что растворы кислот, солей и щелочей электропроводны, так как при их растворении образуются заряженные частицы – ионы. Такой процесс называется электролитической диссоциацией. При диссоциации солей образуются катионы металла и анионы кислотных остатков. При диссоциации щелочей образуются катионы металла и гидроксид-анионы. При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Список рекомендованной литературы
1. Рудзитис Г.Е. Неорганическая и органическая химия. 9 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2009 г.119с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с .
Рекомендованные ссылки на ресурсы интернет
1. Chemport.ru (Источник).
2. Химик (Источник).
3. Hemi.nsu.ru (Источник).
Рекомендованное домашнее задание
1. №№ 1,2 6 (с.13) Рудзитис Г.Е. Неорганическая и органическая химия. 9 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2009 г.119с.:ил.
2. Что такое электролитическая диссоциация? Вещества, каких классов относятся к электролитам?
3. Вещества, с каким типом связи являются электролитами?
interneturok.ru
5.4 Диссоциация кислот, оснований и солей
5.4. Диссоциация кислот, оснований и солей в водных растворах С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей. Диссоциация кислот Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +). HNO 3 -> H + + NO 3 — Многоосновные кислоты диссоциируют ступенчато : Н3РО4 ↔ Н+ + Н2РО—4 (первая ступень) – дигидроортофосфат ион Н2РО—4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Диссоциация оснований Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH —).| Диссоциация щелочей | Диссоциация амфотерных оснований (амфолитов) |
| Щёлочи – это основания, растворимые в воде. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также N Н4ОН | Амфолиты — это электролиты, которые при диссоциации одновременно образуют катионы водорода (H +) и гидроксид-ионы ( OH —). |
| Примеры уравнений диссоциации щелочей NH 4OH ↔ NH +4 + OH — Многокислотные основания диссоциируют ступенчато: Ba(ОН)2 -> Bа(ОН)+ + OH— (первая ступень) Ba(OH)+ ↔ Ba2++OH— (вторая ступень) | Примеры уравнений диссоциации амфолитов Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением: 2ОН— + Zn2+ + 2Н2О ↔ Zn (ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+ |
| Диссоциация кислых солей | Диссоциация основных солей |
| У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. KHSO4 -> K + + HSO —4 HSO —4 ↔ H + + SO 2-4 | У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg( OH )Cl -> Mg( OH )++ Cl — Mg ( OH )+↔ Mg2+ + OH— |
1. Сильными электролитами являются: Решение: По определению, сильные электролиты – это вещества, которые в водном растворе полностью распадаются на ионы. СО2 и О2 сильными электролитами являться не могут. Н2S – слабый электролит. Правильный ответ 4. _____________________________________________________________ 2. Раствор одного моль сульфата натрия содержит 6,02 ионов натрия. Рассчитайте степень диссоциации соли.
Решение: Напишем уравнение электролитической диссоциации сульфата натрия:
Распалось на ионы 0,5 моль сульфата натрия.
_____________________________________________________________ 3. Напишите схемы диссоциации электролитов HNO3, H2S, LiOH, H3AsO4, Cu(OH)NO3. H3AsO4 ↔ AsO4− + 3H+ Cu(OH)NO3 ↔ Cu(OH)+ + NO3− Cu(OH)+ ↔ Cu2+ + OH− _____________________________________________________________ 4. Изобразите схемы диссоциации амфотерных электролитов Al(OH)3, Be(OH)2. Al(OH)3 ↔ Al3+ + 3OH− (основный механизм) Al(OH)3 + 3H2O ↔ 3H+ + [Al(OH)6]3- (кислотный механизм) Be(OH)2 ↔ Be2+ + 2OH− (основный механизм) Be(OH)2 + 2H2O ↔ 2H+ + [Be(OH)4]2- (кислотный механизм)
_____________________________________________________________ ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
HF, Mg(OH)2, CaCl2, Zn(NO3)2,Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4
2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Ca(OH)2,
Na2CO3
Na3PO4
HNO3
KOH
Ba(OH)2
H2SO3
Ca(NO3)2
Ca3(PO4)2
H2S
NaOH
HBr 3. Составьте четыре уравнения электролитической диссоциации веществ, образующих в качестве анионов только нитрат-анионы. 4. Запишите уравнения электролитической диссоциации веществ: а) гидроксида лития; б)карбоната калия; в)нитрата бария; г)сернистой кислоты; д) нитрата аммония; е) кремниевой кислоты; ж) гидроксида магния; з) нитрата кальция. 5. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах: HCl, HNO3, H2SiO3 Назовите класс данных веществ. 6. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах: NaCl, KNO3, BaSO4 Назовите класс данных веществ. 7. Пользуясь таблицей растворимости, приведите примеры трех веществ, которые в растворах образуют сульфат-ионы. Запишите уравнения электролитической диссоциации этих веществ. H2SO4 ↔ H+ + SO4—
HSO4 ↔ H+ + SO42-
8. Составьте уравнения электролитической диссоциации следующих электролитов:
Какие их этих электролитов образуют катионы водорода. 9. Заполните таблицу: 10. Заполните таблицу:
| 1. Вещества, которые при диссоциации образуют в качестве катионов только ионы водорода называются: | |
| б) кислыми солями | |
| г) амфотерными гидроксидами | |
| 2. В три стадии протекает электролитическая диссоциация: | |
| а) хлорида алюминия | б) гидроксида натрия |
| в) ортофосфата калия | г) ортофосфорной кислоты |
| 3. Ионы Cl— не образуются при диссоциации: | |
| в) все ответы верны | |
| 4. Концентрация каких частиц минимальна в водном растворе Н3РО4: | |
| 5. Какие частицы присутствуют в разбавленном водном растворе азотной кислоты: | |
| в) все ответы верны | |
| 6. Какие частицы отсутствуют в разбавленном водном растворе сульфата меди (II): | |
| б) все ответы верны | |
| в)молекулы CuSO4 | г) негидратированные ионы SO42- |
| 7. Укажите схему реакции, в которой ортофосфорная кислота выступает как двухосновная: | |
| а) NH3 + H3PO4 → NH4H2PO4 | б) 2KOH + H3PO4 → K2HPO4 + 2H2O |
| в)2H3PO4 + 3Ba(OH)2 →Ba3(PO4)2 + 6H2O | г) NaOH + H3PO4 → NaH2PO4 + H2O |
| 8. Какие кислоты могут выступать как основные: | |
| г) все ответы верны | |
| 9. Какие кислоты не могут выступать как основные: | |
| б) нет верного ответа | |
| 10. Степень диссоциации основания ХОН равна 20 %. Какое число гидроксид-ионов приходится в ее растворе на каждые 40 не распавшихся молекул: | |
himiy88.blogspot.com
Электролитическая диссоциация
- Подробности
- Категория: Статьи
Электролитическая диссоциация — это процесс распада вещества на ионы при его растворении или расплавлении.
Электролиты — вещества, распадающиеся на ионы в растворе или в расплаве. Положительные ионы называют катионами, отрицательные — анионами. При растворении веществ с ионной кристаллической решеткой в воде происходят разрыв ионных связей и гидратация образующихся ионов, например:
KCl → K+ + Cl–
В этом случае процесс диссоциации практически необратим. При растворении веществ с ковалентной полярной связью также могут происходить разрыв этой связи и гидратация образующихся ионов, например:
HCl ↔ H+ + Cl–
В этих случаях процесс диссоциации, как правило, обратим.
Количественной мерой электролитической диссоциации является степень диссоциации — отношение числа продиссоциировавших молекул к общему числу молекул вещества:
В зависимости от степени диссоциации электролиты делят на сильные и слабые.
К сильным электролитам относят те, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л больше 0.3 (30%). Это практически все соли, сильные кислоты (НС1, Н2SО4, НNО3, НСlO4 и т.д.), гидроксиды щелочных и щелочно-земельных металлов.
К слабым электролитам относят те, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л меньше 0.03 (3%). К ним относятся слабые кислоты (Н2СО3, Н2S, НNО2, НСlO, Н2SО3 и т. д., большинство органических кислот) и слабые основания (Аl(ОН)3, Zn(ОН)2 и т. д.). К слабым электролитам относится также вода.
Вещества, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л составляет от 0.03 до 0,3 (3 — 30%), относят к электролитам средней силы. Например, Н3РО4, Н2SО3, НF, ССl3СООН и т.д.
Степень диссоциации зависит от концентрации вещества (она увеличивается при разбавлении раствора) и от температуры (при повышении температуры она также увеличивается).
Некоторые электролиты диссоциируют ступенчато (это многоосновные кислоты и многокислотные основания, а также кислые и основные соли), например:
Степень диссоциации по каждой последующей ступени на несколько порядков меньше по сравнению с предыдущей:
а1 >> a2 >> A3
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
buzani.ru
Диссоциация кислот, оснований и солей в водных растворах
Вещества, способные диссоциировать в водных растворах или расплавах, называют электролитами. К ним относятся кислоты, щелочи, соли. Рассмотрим особенности их диссоциации.
Запишем уравнение электролитической диссоциации кислот:
HCl → H + + Cl-
HNO3 → H + + NO3-
h3SO4 → 2H + + SO42-.
Кислотные остатки в различных кислот разные, но общим признаком всех кислот является наличие в их растворах гидратированных катионов водорода Н3О + (в уравнениях для упрощения пишем Н +).
Кислотами называют электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только гидратированные ионы водорода.
Наличие катионов водорода в растворах кислот приводит их общие свойства: кислый вкус, общие химические свойства, действие на индикаторы. Именно благодаря этому все кислоты одинаково изменяют окраску индикаторов в своих растворах.
По количеству катионов водорода, которые образуются в результате диссоциации одной молекулы кислоты, определяют основность кислоты. Хлоридная HCl и нитратная HNO3 кислоты являются одноосновных. Серная кислота h3SO4 — двух основных, а ортофосфатна кислота h4PO4 — трех основных:
h4PO4 → 3H + + PO43-.
Многоосновные кислоты диссоциируют ступенчато, постепенно отщепляя по одному катиону водорода. Диссоциация по первой ступенью обычно происходит в большей степени, чем за второй или третьей.
Запишем уравнение электролитической диссоциации щелочей:
NaOH → Na + + OH-
Ba (OH) 2 → Ba2 + + 2OH-
Общим признаком всех лугов является наличие в их растворах гидроксид-анионов.
Лугами называют электролиты, при диссоциации которых в водных растворах в качестве анионов образуются только гидроксид-анионы.
Гидроксид-анионы в растворах щелочей предопределяют их общие свойства: милкисть на ощупь, разрушительное воздействие на кожу, бумагу, волосы и т.д., действие на индикаторы.
Луга — ионные вещества, поэтому их диссоциация является полной.
Рассмотрим примеры диссоциации солей:
NaNO3 → Na + + NO3-
K2SO4 → 2К + + SO42-
BaCl2 → Ba2 + + 2Cl-.
Солями называют электролиты, при диссоциации которых в водных растворах образуются гидратированные катионы металлических элементов и анионы кислотных остатков.
Cоли — ионные вещества, поэтому их диссоциация является полной.
xn—-7sbfhivhrke5c.xn--p1ai
Слово ДИССОЦИАЦИЯ — Что такое ДИССОЦИАЦИЯ?
Слово диссоциация английскими буквами(транслитом) — dissotsiatsiya
Слово диссоциация состоит из 11 букв: а д и и и о с с ц ц я
Значения слова диссоциация. Что такое диссоциация?
Диссоциация
ДИССОЦИАЦИЯ (от лат. dissociatio — разделение, разъединение), обратимый распад частицы в-ва (молекулы, радикала или иона). Различают электролитическую диссоциацию (ионизацию) в р-рах или расплавах электролитов…
Химическая энциклопедия
Диссоциация (от лат. dissociatio — разделение, разъединение), процесс, заключающийся в распаде молекул на несколько более простых частиц — молекул, атомов, радикалов или ионов.
БСЭ. — 1969—1978
ДИССОЦИАЦИЯ (от лат. dissociatio — разъединение), распад молекулы, радикала, иона или комплексного соединения на две или неск. частей. В зависимости от фактора, индуцирующего Д.
Физическая энциклопедия. — 1988
ДИССОЦИАЦИЯ, в химии — реакция, при которой молекулы соединения расщепляются на меньшие составные части. Во многих реакциях диссоциации эти части способны вновь группироваться в других условиях; такую диссоциацию называют обратимой.
Научно-технический энциклопедический словарь
Диссоциация химических соединений представляет одну из хорошо изученных форм так назыв. обратимых химических реакций, т. е. таких, которые идут в обе стороны химического равновесия (см. это слово, а также «Реакция», «Вытеснение»)…
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Диссоциация, физ. хим. разложение химических соединений, не идущее до конца, а ограниченное некоторым пределом, вследствие обратного соединения разложенных химических тел., Если распадается, например, углекальциевая соль в закрытом пространстве…
Брокгауз и Ефрон. — 1907—1909
Диссоциация бактерий
Диссоциация бактерий диссоциация бактерий ВАРИАЦИЯ фаз – расщепление однородной популяции бактерий на варианты. От случайных мутаций Д. б. отличается высокой частотой возникновения и реверсии вариантов…
Словарь микробиологии
Диссоциация бактерий, одно из проявлений изменчивости микроорганизмов, в результате чего бактерии, образующие на плотных питательных средах крупные, гладкие, блестящие колонии и обычно обозначаемые как S-формы (от англ. smooth — гладкий)…
БСЭ. — 1969—1978
ДИССОЦИАЦИЯ БАКТЕРИЙ (от лат. dissociatio — разъединение), появление в популяции бактерий особей, отличающихся от исходного типа внешним видом и структурой колоний, а также наследственно закреплёнными [закрепленными] изменениями нек-рых морфологич.
https
Диссоциация (Dissociation)
Диссоциация (Dissociation) — (в психиатрии) бессознательный процесс, при котором мысли и убеждения могут отделяться от их осознания и функционировать независимо, например…
Медицинские термины от А до Я
Диссоциация (Dissociation) (в психиатрии) бессознательный процесс, при котором мысли и убеждения могут отделяться от их осознания и функционировать независимо, например…
Медицинские термины. — 2000
ДИССОЦИАЦИЯ (dissociation) — (в психиатрии) бессознательный процесс, при котором мысли и убеждения могут отделяться от их осознания и функционировать независимо, например…
vocabulary.ru
Диссоциация психического Я
Диссоциация психического Я — утрата способности осознавать единство своего Я, отчего последнее воспринимается разделённым на 2 фрагмента и более (например, на Я думающее и Я чувствующее; на Я действующее, Я наблюдающее и Я оценивающее…
Жмуров В.А. Большой толковый словарь терминов по психиатрии
Диссоциация психического Я – утрата способности осознавать единство своего Я, отчего последнее воспринимается разделённым на 2 фрагмента и более (например, на Я думающее и Я чувствующее, Я действующее, Я наблюдающее и Я оценивающее…
vocabulary.ru
Личности диссоциация
Личности диссоциация (лат. dissociatio- разъединение, разделение) — нарушение целостной структуры личности, её фрагментация на относительно независимые и одновременно или в какой-то последовательности функционирующие подсистемы в силу распада…
vocabulary.ru
Личности диссоциация — (лат. dissociatio- разъединение, разделение) — нарушение целостной структуры личности, её фрагментация. Проявляется внутренней противоречивостью…
Жмуров В.А. Большой толковый словарь терминов по психиатрии
Психическая диссоциация
Психическая диссоциация — нарушения согласованности, координации психических процессов. Например, распад мышления, ослабление связей между мышлением и эмоциями, мышлением и поведением и т.п.
Жмуров В.А. Большой толковый словарь терминов по психиатрии
Психическая диссоциация – нарушения согласованности, координации психических процессов. Например, распад мышления, ослабление связей между мышлением и эмоциями, мышлением и поведением и т.п.
vocabulary.ru
Термическая диссоциация
Термическая диссоциация, химическая реакция обратимого разложения вещества, вызываемая повышением температуры. При Т. д. из одного вещества образуется несколько (2Н₂О Û2Н₂ + О₂, CaCO₃ ÛCaO + СО₂) или одно более простое (N₂O₄Û2NO₂, Cl₂Û201).
БСЭ. — 1969—1978
ТЕРМИЧЕСКАЯ ДИССОЦИАЦИЯ — термическое разложение, — хим. реакция, в к-рой при нагревании одного в-ва образуется 2 или большее число в-в или одно — более простое.
Большой энциклопедический политехнический словарь
Электролитическая диссоциация
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад молекул растворенного в-ва на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении.
Химическая энциклопедия
Электролитическая диссоциация, распад вещества на ионы при растворении. Э. д. происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов…
БСЭ. — 1969—1978
Электролитическая диссоциация или ионизация (литер. Svante Arrhenius, «Ueber die Dissociation der in Wasser gelösten Stoffe», «Zeitschr. für physikalische Chemie», 1887; Sv. Arrhenius, «La dissociation électrolytique des solutions.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Русский язык
Диссоциа́ция, -и.
Орфографический словарь. — 2004
Степень диссоциации
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. «Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%»…
ru.wikipedia.org
Степень диссоциации — отношение числа диссоциированных молекул электролита к общему числу растворенных молекул. Степень диссоциации зависит от природы растворенного электролита и от концентрации раствора.
glossary.ru
- диссонируют
- диссонирующий
- диссоциативный
- диссоциация
- диссоциировавший
- диссоциировать
- диссоциирует
wordhelp.ru
