S*Fe — Бинарные химические соединения — Каталог статей — «МАТИ»
Fe10S11 Fe11S12 Fe7S8 FeS FeS2 Fe2S3
Известны Fe7S8, Fe3S4, Fe2S3 и др. сульфиды.
Реакция железа с серой экзотермична, начинается при слабом нагревании, при этом образуется нестехиометрический сульфид, близкий по составу к FeS. Все три сульфида для Fe, Co, Ni могут быть получены взаимодействием элементов.
Сульфиды Fe, Co, Ni выпадают при прибавлении (NH4)2S к растворам их солей в виде черных осадков. На воздухе влажный осадок сернистого железа легко окисляется до FeSO4.
При температурах порядка 12000С многие сульфиды восстанавливаются до металла углем по уравнению
2MS +
FeS
Моносульфид железа FeS – коричневые или черные кристаллы, т. пл. 11930С, ∆Нобр0 = — 100,5 кДж/моль. Встречается в виде минерала и в метеоритах.
FeS практически не растворяется в воде, разлагается в разбавленных кислотах с выделением сероводорода H2S. На воздухе влажный FeS легко окисляется до FeSO4.
Практически сероводород получают обычно действием разбавленных кислот на сернистое железо FeS
FeS + 2HCl = H2S + FeCl2
Получают FeS нагреванием железа с серой при 6000С, при действии H2S (или серы) на Fe2O3 при 750-10500С, реакцией сульфидов щелочных металлов или аммония с солями двухвалентного железа в водном растворе.
FeS2
Дисульфид FeS2 — золотисто-желтые кристаллы с металлическим блеском, встречается в природе, т. пл. 7430С, ∆Нобр0 = — 163,3 кДж/моль, обладает свойствами полупроводника.
FeS2 практически не растворяется в воде, разлагается HNO3. На воздухе или в кислороде сгорает с образованием Fe2O3.
В металлургии широко используется реакция горения пирита FeS2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Температура в печи достигает 8000С.
Природный FeS2 – сырье для получения серы, железа, серной кислоты, сульфатов железа, компонент шихты при переработке марганцевых руд и концентратов, используется при выплаке чугуна, кристаллы пирита
Сульфи́д желе́за(II) — сложное неорганическое вещество с химической формулой FeS класса неорганических сульфидов .
Сульфид железа(II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой[1], тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом[2].
Получение
1. Взаимодействие железа с серой[3]:
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты [2].
2. Взаимодействие оксида железа(III) с водородом и сероводородом:
Химические свойства
1. Взаимодействие с концентрированной HCl:
2. Взаимодействие с концентрированной HNO3:
Применение
Сульфид железа(II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.
Дисульфид железа(II)[1] (дисульфид(2-) железа(II)) — бинарное неорганическое соединение железа и серы с формулой FeS2, светло-жёлтые или тёмно-жёлтые кристаллы, нерастворимые в воде.
Получение
- В природе распространёны минералы марказит — α-FeS2 и пирит — β-FeS2.
- Нагревание порошкообразного железа с серой:
Дисульфид железа(II), α-форма образует светло-жёлтые кристаллы ромбической сингонии,
Химические свойства
- Разлагается при нагревании:
- Реагирует с горячими концентрированными кислотами-окислителями:
- Окисляется при прокаливании на воздухе:
Применение
- Сырьё для получения железа, серы и их соединений.
Сульфид железа(II,III) — неорганическое соединение, соль железа и сероводородной кислоты с формулой Fe3S4, кристаллы, не растворяется в воде.
Не растворяется в воде. Проявляет ферромагнитные свойства.
Сульфид железа(III) — неорганическое соединение, соль железа и сероводородной кислоты с формулой Fe2S3
, жёлто-зелёные кристаллы, не растворяется в воде.Получение
Физические свойства
Сульфид железа(III) образует жёлто-зелёные кристаллы кубической сингонии, пространственная группа F d3m, параметры ячейки a = 0,99342 нм, Z = 12.
Весьма слабо растворяется в воде.
Кристаллы образуются при длительной выдержке аморфной суспензии под давлением сероводорода в 10 ат.
Химические свойства
- Разлагается при нагревании в инертной атмосфере:
- При хранении на воздухе разлагается несколькими путями:
-
- присутствие влаги ускоряет разложение.
Результаты поиска:
Результаты поиска:
| Химическая реакция | Условия |
| 2FeCl3 + 3Na2S = Fe2S3 |
реакция уравнена без электронного баланса |
Результаты поиска:
| Химическая реакция | Условия |
| 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 | реакция уравнена без электронного баланса |
Результаты поиска:
Результаты поиска:
mati-himia.3dn.ru
MnS, ZnS, FeS, CoS, NiS — Мегаобучалка
Сульфиды нерастворимые в воде и в кислотах:
CuS, Ag2S, As2S3, HgS, Bi2S3, PbS, Sb2S3, CdS и др.
Получение сульфидов:
· Если сульфид металла нерастворим в кислотах, то его получают действием H2S на соли: CdCl2 + H2S → CdS + HCl.
· Если сульфид металла растворим в кислотах, то его получают действием Na 2S на соли: MnCl2 + Na2S → MnS + NaCl.
· Если растворим в воде, то реакцией нейтрализации:
NaOH + H2S → Na2S + H2O.
v Взаимодействием простых веществ:
Zn + S t→ ZnS
Hg + S t→ HgS.
Некоторые сульфиды имеют характерную окраску: CuS и PbS— черную, CdS — желтую, ZnS— белую, MnS — розовую, SnS — коричневую, Sb2S3— оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.
Нахождение в природе. Сероводород встречается в природе в вулканических газах и в водах некоторых минеральных источников, например Пятигорска, Мацесты. Он образуется при гниении серосодержащих органических веществ различных растительных и животных остатков. Этим объясняется характерный неприятный запах сточных вод, выгребных ям и свалок мусора.
Ранее отмечалось, что атомы серы склонны соединятся в зигзагообразные цепочки, это приводит к образованию многосернистых водородах (называются сульфаны).
Общая формула H2Sn (n = 2÷23) – жёлтые маслянистые жидкости, образуются при действии кислот на полисульфиды. Полисульфиды можно получить при кипячении сульфидов с серой: Na2S + S → Na2S2.
(FeS2 – пирит)
Могут быть окислителями (Na2S2 + SnS → Na2S + SnS2) и восстановителями (FeS2 + O2 → Fe2O3 + SO2), участвовать в реакциях диспропорционирования (Na2S2 → Na2S + S).
Оксид серы (IV).Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
Он хорошо растворим в воде (40 объемов в 1 объеме воды при 20 °С).
Получение.В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой:
а также нагреванием меди с концентрированной серной кислотой:
Оксид серы (IV) образуется также при сжигании серы:
S + O2t→ SO2
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO2 употребляется, главным образом, для получения оксида серы (VI) SO3 и серной кислоты.
FeS2 + O2t→ Fe
ZnS + O2t→ ZnO + SO2↑
Структурная формула молекулы SO2:
Как видим, в образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и неподеленной электронной пары атома серы придает молекуле угловую форму.
Оксид серы (IV) проявляет все свойства кислотных оксидов.
Сернистая кислота. При растворении SO2 в воде частично происходит реакция с водой и образуется слабая сернистая кислота H2SO3:
которая малоустойчива, легко распадается вновь на SO2 и Н2О. В водном растворе сернистого газа одновременно существуют следующие равновесия:
Константа диссоциации H2SO3 по первой ступени равна K1 = 1,6∙10-2, по второй — K2 = 6,3∙10-8. Являясь двухосновной кислотой, она дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Сульфиты образуются при полной нейтрализации кислоты щелочью:
Из сульфитов в воде растворимы соли щелочных металлов.
Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты):
Гидросулифиты легко растворимы.
Как и оксид серы (IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. Так, H2SO3 и её соли легко окисляется в серную кислоту даже кислородом воздуха:
H2SO3 + O2 → H2SO4
Na2SO3 + O2 → Na2SO4.
Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:
SO2 + Cl2 + H2O → H2SO4 + HCl
Химические реакции, характерные для SO2, сернистой кислоты и ее солей, можно разделить на три группы:
1. Реакции, протекающие без изменения степени окисления, например:
PCl5 + SO2 → SOCl2+ POCl3
Хлорид тионила – это хлорангидрид сернистой кислоты.
SOCl2 + H2O ↔ H2SO3 + HCl (гидролиз)
2. Реакции, сопровождающиеся повышением степени окисления серы от 4+ до 6+:
SO2 + Cl2 → SO2Cl2
Хлорид сульфурила – это хлорангидрид серной кислоты.
SO2Cl2 + H2O ↔ H2SO4 + HCl
Кислородом воздуха SO2 окисляется с большим трудом в присутствии катализатора.
При кипячении сульфитов с серой образуются тиосульфаты:
Na2SO3 + S t→ Na2S2O3
Почти все тиосульфаты растворимы, кроме солей свинца, серебра, таллия и бария. Тиосульфаты устойчивы в нейтральной и щелочной среде, в кислой они разлагаются:
Na2SO3 + HCl → H2S2O3 + NaCl
H2S2O3 → S + SO2 + H2O
Так как один атом серы находится в степени окисления -2, тиосульфаты являются сильными восстановителями:
Na2S2O3 + Cl2 + H2O → Na2SO4 + HCl + H2SO4
Na2S2O3 + I2 → Na2S4O6 + NaI
Тетратионат натрия – образуется при действии более мягких окислителей (I2).
3. Реакции, протекающие с понижением степени окисления серы, например уже отмеченное выше взаимодействие SO2 с H2S.
Таким образом, SO2, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
Применение.Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие SO2 и H2SO3 отличается от белящего действия хлора. Обычно оксидом серы (IV) белят шерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Оксид серы (IV) убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используют также при перевозке и хранении фруктов и ягод. В больших количествах оксид серы (IV) используется для получения серной кислоты.
Важное применение находит раствор гидросульфита кальция Са(НSO3)2 (сульфитный щелок), которым обрабатывают волокна древесины и бумажную массу.
Оксид серы (VI).SO3 — вещество с tпл= 16,8 °С и tкип= 44,8 °С. Оксид серы (VI), или триоксид серы, — это бесцветная жидкость, затвердевающая при температуре ниже 17° С в твердую кристаллическую массу. Оксид серы (VI) обладает всеми свойствами кислотных оксидов. Он является промежуточным продуктом производства серной кислоты.
При обычных условиях это снегообразная гигроскопичная масса (жадно поглощает воду). В парообразном состоянии – мономер, в жидком – триммер, в твёрдом – полимер.
Получение. Оксид серы (VI) в промышленности получают окислением SO2 кислородом только в присутствии катализатора (kt – V2O5):
SO2 + O2 ↔ SO3
Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3 (т. е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Молекула SO3 имеет форму треугольника, в центре которого находится атом серы:
Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил все шесть внешних электронов.
Серная кислота. Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
SO3 очень хорошо растворяется в 100%-ной серной кислоте. Раствор S03 в такой кислоте называется олеумом.
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтомунельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надосерную кислоту приливать небольшими количествами к воде.
Безводная серная кислота растворяет до 70% оксида серы (VI). При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий 98,3% Н2SO4. Безводная Н2SO4 почти не проводит электрический ток.
Химические свойства. Концентрированная серная кислота обугливает органические вещества — сахар, бумагу, дерево, волокна и т. д., отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением
Образовавшийся уголь частично вступает во взаимодействие с кислотой:
Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота H2SO4 вытесняет другие кислоты из сухих солей:
Однако если Н2SO4 добавляется к растворам солей, то вытеснения кислот не происходит.
Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, за счет ионов Н+:
Cu + H2SO4(разб.) ≠
C + H2SO4(разб.) ≠
Концентрированная серная кислота – сильный окислитель, реагирует с неметаллами и металлами, стоящими до и после водорода.
С активными металлами, например, цинком:
Zn + H2SO4(конц.) → ZnSO4 + H2S + H2O
Цинк восстанавливает серу до минимальной степени окисления.
Побочные продукты – S, SO2.
Отношение серной кислоты к железу и свинцу:
Железо хорошо растворимо в разбавленной и умеренно концентрированной H2SO4, но не растворяется в H2SO4(конц.), т.к. происходит пассивация металла (образуются оксиды железа). Поэтому H2SO4(конц.) перевозят в железных цистернах.
Свинец в разбавленной H2SO4 с поверхности покрывается мало растворимой плёнкой PbSO4, поэтому реакция дальше не идёт. В H2SO4(конц.) свинец легко растворяется.
Получений в промышленности.Два метода получения – контактный (основной) и нитрозный.
Контактный метод: оксид серы (IV), предварительно очищенный от примесей, окисляют при температуре ~5000С в присутствии катализаторов (V2O5 с добавками-активаторами Na2O и SiO2) кислородом воздуха в контактных аппаратах. Далее полученный SO3 поступает в абсорбер, орошается концентрированной 96-98%-ной серной кислотой, и образует олеум (H2S2O7).
Нитрозный метод: получают окислением SO2 в сернокислотном растворе, причём катализатором служит смесь оксидов азота NO и NO2. По нитрозному методу получают ~75% -ную H2SO4.
2 SO2 + O2 + 2 H2O NO, NO2 2 H2SO4
Значение серной кислоты. Серная кислота является важнейшим
megaobuchalka.ru
|
Калькулятор молярной массы, молекулярной массы и строения элементов
| |||||
ru.webqc.org
Соединения серы (II). Сероводород и сульфиды.
Строение молекул H2S
Химическое строение молекул H2S аналогично строению молекул Н2O: (угловая форма)
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства
При обычной температуре H2S — бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м3 вызывает смертельное отравление). Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость.H2S растворим в воде (при обычной температуре в 1 л H2O растворяется — 2,5 л газа).
Сероводород в природе
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Способы получения
1. Синтез из простых веществ:
S + Н2 = H2S
2. Действие неокисляющих кислот на сульфиды металлов:
FeS + 2HCI = H2S↑ + FeCl2
3.Действие конц. H2SO4 (без избытка) на щелочные и щелочно-земельные Me:
5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
4. Образуется при необратимом гидролизе некоторых сульфидов:
AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
Химические свойства H2S
Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SО2, H2SO4),
Окисление кислородом воздуха
2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
2H2S + О2(недостаток) = 2S↓ + 2Н2О
Окисление галогенами:
H2S + Br2 = S↓ + 2НВr
3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
Сероводородная кислота H2S 2-основная кислота диссоциирует ступенчато
1-я ступень: H2S → Н+ + HS—
2-я ступень: HS— → Н+ + S2-
Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота. Взаимодействует:
а) с активными металлами
H2S + Mg = Н2↑ + MgS
б) с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
в) с основными оксидами
H2S + ВаО = BaS + Н2O
г) со щелочами
H2S + NaOH(недостаток) = NaHS + Н2O
д) с аммиаком
H2S + 2NH3(избыток) = (NH4)2S
Несмотря на то, что сероводородная кислота — очень слабая, она реагирует с некоторыми солями сильных кислот, например:
CuSO4 + H2S = CuS↓ + H2SO4
Реакции протекают в тех случаях, если образующийся сульфид Me нерастворим не только в воде, но и в сильных кислотах.
Одна из таких реакций используется для обнаружения анионов S2- и сероводорода:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный осадок.
Газообразный H2S обнаруживают с помощью влажной бумаги, смоченной раствором Pb(NO3)2, которая чернеет в присутствии H2S.
Сульфиды
Сульфидами называют бинарные соединения серы с менее ЭО элементами, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
Наибольшее значение имеют сульфиды металлов, поскольку многие из них представляют собой природные соединения и используются как сырье для получения свободных металлов, серы, диоксида серы.
Сульфиды щелочных Me и аммония хорошо растворимы в воде, но в водном растворе они подвергаются гидролизу в очень значительной степени:
S2- + H2O → HS— + ОН—
Поэтому растворы сульфидов имеют сильнощелочную реакцию
Сульфиды щелочно-земельных Me и Mg, взаимодействуя с водой, подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
2CaS + 2НОН = Ca(HS)2 + Са(ОН)2
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
HS— + H2O → H2S↑ + ОН—
Сульфиды некоторых металлов подвергаются необратимому гидролизу и полностью разлагаются в водных растворах, например:
Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
Аналогичным образом разлагаются Cr2S3, Fe2S3
Большинство сульфидов тяжелых металлов в воде практически не растворяются и поэтому гид ролизу не подвергаются. Некоторые из них растворяются под действием сильных кислот, например:
FeS + 2HCI = FeCl2 + H2S↑
ZnS + 2HCI = ZnCl2 + H2S↑
Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
Окисление сульфидов кислородом воздуха при высокой температуре является важной стадией переработки сульфидного сырья. Примеры:
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
1. Непосредственное соединение простых веществ:
Fe + S = FeS
2.Взаимодействие H2S с растворами щелочей:
H2S + 2NaOH = 2H2O + Na2S сульфид натрия
H2S + NaOH = H2O + NaHS гидросульфид натрия
3.Взаимодействие H2S или (NH4)2S с растворами солей:
H2S + CuSO4 = CuS↓ + H2SO4
H2S + 2AgNO3 = Ag2S↓ + 2HNO3
4. Восстановление сульфатов прокаливанием с углем:
Na2SO4 + 4С = Na2S + 4СО
Этот процесс используют для получения сульфидов щелочных и щелочно-земельных металлов.
examchemistry.com
Упражнение: 1 Запишите формулы оксидов азота (II), (V), (I), (III), (IV).
Оксид азота (II) N+2O-2 Упражнение: 3 Найдите по справочникам и словарям всевозможные названия веществ с формулами: а) CO2 и CO; б) SO2 и SO3; в) и. Объясните их этимологию. Дайте по два названия этих веществ по международной номенклатуре в соответствии с правилами, изложенными в параграфе. а) б) Упражнение: 5 Найдите объем, который имеют при н.у. 17 г сероводорода. Сколько молекул его содержится в этом объеме?
|
Упражнение: 2 Дайте названия бинарных соединений, формулы которых: а) Cl2O7, Cl2O, ClO2; б) FeCl2, FeCl3; в) MnS, MnO2, MnF4, MnO, MnCl4; г) Cu2O, Mg2Si, SiCl2, Na3N, FeS. а) б) в) г) Упражнение: 4 Какое еще название можно дать аммиаку H3N? H3N – аммиак, нитрид водорода. Упражнение: 6 Вычислите массу 33,6 м3 метана CH4 при н.у. и определите число молекул его, содержащихся в этом объеме.
|
reshebnikxim.narod.ru
Классификация и номенклатура неорганических веществ » HimEge.ru
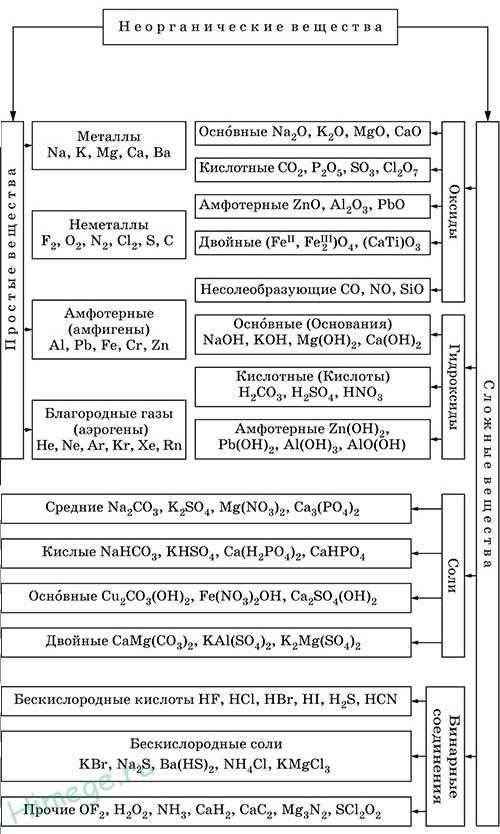
Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна -2.
Оснóвные оксиды образуют типичные металлы со С.О. +1,+2 (Li2O, MgO, СаО,CuO и др.).
Кислотные оксиды образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2,SiO2 , CrO3 и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды образованы амфотерными металлами со С.О. +2,+3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды – оксиды неметаллов со С.О.+1,+2 (СО, NO, N2O, SiO).
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из иона металла (или иона аммония) и гидроксогруппы (-OH).
Кислотные гидроксиды (кислоты) — сложные вещества, которые состоят из атомов водорода и кислотного остатка.
Амфотерные гидроксиды образованы элементами с амфотерными свойствами.
Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками.
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.
Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН — групп, входящих в состав соли.
Например, (CuOH)2CO3 — гидроксокарбонат меди (II).
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например,KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Тривиальные названия часто употребляемых неорганических веществ:
| Формула | Тривиальное название |
| NaCl | галит, каменная соль, поваренная соль |
| Na2SO4*10H2O | глауберова соль |
| NaNO3 | Натриевая, чилийская селитра |
| NaOH | едкий натр, каустик, каустическая сода |
| Na2CO3*10H2O | кристаллическая сода |
| Na2CO3 | Кальцинированная сода |
| NaHCO3 | пищевая (питьевая) сода |
| K2CO3 | поташ |
| КОН | едкое кали |
| KCl | калийная соль, сильвин |
| KClO3 | бертолетова соль |
| KNO3 | Калийная, индийская селитра |
| K3[Fe(CN)6] | красная кровяная соль |
| K4[Fe(CN)6] | желтая кровяная соль |
| KFe3+[Fe2+(CN)6] | берлинская лазурь |
| KFe2+[Fe3+(CN)6] | турнбулева синь |
| NH4Cl | Нашатырь |
| NH3*H2O | нашатырный спирт, аммиачная вода |
| (NH4)2Fe(SO4)2 | соль Мора |
| СаO | негашеная (жженая) известь |
| Са(OH)2 | гашеная известь, известковая вода, известковое молоко, известковое тесто |
| СaSO4*2H2O | Гипс |
| CaCO3 | мрамор, известняк, мел, кальцит |
| СаНРO4×2H2O | Преципитат |
| Са(Н2РO4)2 | двойной суперфосфат |
| Са(Н2РO4)2+2СаSO4 | простой суперфосфат |
| CaOCl2(Ca(OCl)2 + CaCl2) | хлорная известь |
| MgO | жженая магнезия |
| MgSO4*7H2O | английская (горькая) соль |
| Al2O3 | корунд, боксит, глинозем, рубин, сапфир |
| C | алмаз, графит, сажа, уголь, кокс |
| AgNO3 | ляпис |
| (CuОН) 2СO3 | малахит |
| Cu2S | медный блеск, халькозин |
| CuSO4*5H2O | медный купорос |
| FeSO4*7H2O | железный купорос |
| FeS2 | пирит, железный колчедан, серный колчедан |
| FeСО3 | сидерит |
| Fe2О3 | красный железняк, гематит |
| Fe3О4 | магнитный железняк, магнетит |
| FeО × nH2О | бурый железняк, лимонит |
| H2SO4 × nSO3 | олеум раствор SO3 в H2SO4 |
| N2O | веселящий газ |
| NO2 | бурый газ, лисий хвост |
| SO3 | серный газ, серный ангидрид |
| SO2 | сернистый газ, сернистый ангидрид |
| CO | угарный газ |
| CO2 | углекислый газ, сухой лед, углекислота |
| SiO2 | кремнезем, кварц, речной песок |
| CO + H2 | водяной газ, синтез-газ |
| Pb(CH3COO)2 | свинцовый сахар |
| PbS | свинцовый блеск, галенит |
| ZnS | цинковая обманка, сфалерит |
| HgCl2 | сулема |
| HgS | киноварь |
himege.ru
