Оксиды азота
Оксиды азота
При описании свойств азота отмечалось, что при непосредственном взаимодействии азота с кислородом образуется только оксид азота (II) NO. Однако существуют оксиды азота со всеми возможными степенями окисления (от +1 до +5).
N2O — оксид азота (I), «веселящий газ»
При обычной температуре N2O — бесцветный газ со слабым приятным запахом и сладковатым вкусом; обладает наркотическим действием, вызывая сначала судорожный смех, затем — потерю сознания.
Способы получения
1. Разложение нитрата аммония при небольшом нагревании:
NH4NO3 = N2O↑ + 2Н2О
2. Действие HNO3 на активные металлы
10HNO3(конц.) + 4Са = N2O↑ + 4Ca(NO3)2 + 5Н2О
Химические свойства
N2O не проявляет ни кислотных, ни основных свойств, т. е. не взаимодействует с основаниями, с кислотами, с водой (несолеобразующий оксид).
При Т > 500’С разлагается на простые вещества. N
N2O + SO2 + Н2О = N2↑ + H2SO4
NO — оксид азота (II), монооксид азота.
При обычной температуре NO — бесцветный газ без запаха, малорастворимый в воде, очень токсичный (в больших концентрациях изменяет структуру гемоглобина).
Способы получения
1. Прямой синтез из простых веществ может быть осуществлен только при очень высокой Т:
N2 + O2 = 2NО — Q
2. Получение в промышленности (1-я стадия производства HNO3).
4NH3 + 5O2 = 4NО + 6Н2О
3. Лабораторный способ — действие разб. HNO3 на тяжелые металлы:
8HNO3 + 3Cu = 2NO + 3Cu(NO3)2 + 4Н2О
Химические свойства
NO — несолеобразующий оксид (подобно N2О). Обладает окислительно-восстановительной двойственностью.
2NO + SO2 + Н2О = N2O↑ + H2SO4
2NO + 2H2 = N2 + 2Н2О (со взрывом)
2NO + O2 = 2NO2
10NO + 6KMnO4 + 9H2SO4 = 10HNO3 + 3K2SO4 + 6MnSO4 + 4Н2О
NO2 — оксид азота (IV), диоксид азота
При обычной температуре NO2 — красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
Способы получения
I. Промышленный — окисление NO: 2NO + O2 = 2NO2
II. Лабораторные:
действие конц. HNO3 на тяжелые металлы: 4HNO3 + Сu = 2NO2↑ + Cu(NO3)2 + 2Н2О
разложение нитратов: 2Pb(NO3)2 = 4NO2↑ + O
Химические свойства
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
2NO2 + Н2О = HNO3 + HNO2
Если растворение происходит в присутствии O2, то образуется одна кислота — азотная:
4NO2 + 2Н2О + O2 = 4HNO3
Аналогичным образом происходит взаимодействие NO2 со щелочами:
в отсутствие O2: 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2О
в присутствии O2: 4NO2 + 4NaOH + O2 = 4NaNO3 + 2Н2О
По окислительной способности NO 2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
10NO2 + 8P = 5N2 + 4P2O5
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
2NO2 + 7Н2 = 2NH3 + 4Н2О
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
2NO2 + 2N2H4 = 3N2 + 4Н2О + Q
N2O3 и N2O5 — неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-10
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
examchemistry.com
Диоксид азота
Химический элемент азот с порядковым номером 7 расположен в 5 группе периодической системы Менделеева. Этот двухатомный газ при нормальных условиях достаточно инертен. В земной атмосфере на его долю приходится три четверти. Элемент характеризуется следующими степенями окисления: −3, −1, 0, 1, 2, 3, 4, 5. Он входит в состав многих соединений. Одним из них является красновато-коричневый ядовитый газ (отличается способностью раздражать дыхательные пути, вызывает отек легких при больших концентрациях), имеющий характерный резкий, едкий запах — это диоксид азота. Формула имеет вид NO2. Молярная масса 46,01 г/моль. Плотность 2,62 г/дм³. Температура кипения 21 °C. При растворении в воде реагирует с ней. Показатель преломления 1,449 (при 20 ° C).
Диоксид азота играет важную роль в химии атмосферы, в том числе в формировании тропосферного озона. Одновременно он является крупным загрязнителем воздуха и промежуточным продуктом в промышленном синтезе азотной кислоты, миллионы тонн которой производятся каждый год. Это один из нескольких оксидов азота (бинарные неорганические соединения азота с кислородом) со степенями окисления:
I — закись азота N2O;
II — монооксид азота NO;
III — триоксид диазота N2O3;
IV — диоксид азота NO2 и тетраоксид диазота N2O4;
V — пентаоксид диазота N2O5;
тринитрамид N(NO2)3.
Диоксид азота легко сжижается. Он тяжелее воздуха. При нормальных условиях NO2 смешан (примерно, 1:1) с бесцветным веществом (своим димером) N2O4. Химия NO2 хорошо изучена.
При взаимодействии с водой гидролизуется, в результате образуются две кислоты (азотистая и азотная): 2NO2 + h3O → HNO2 + HNO3.
В реакциях со щелочами образуются соли этих же двух кислот: 2NaOH + 2NO2 → NaNO2 + NaNO3 + h3O.
Он является сильным окислителем, способен окислять SO2 до SO3. На этом его свойстве основан метод нитрозного получения серной кислоты. В среде NO2 многие вещества, включая органические соединения, серу, уголь и фосфор, горят.
Диоксид азота обычно образуется в результате окисления оксида азота кислородом воздуха: O2 + 2NO → 2NO2
В лаборатории NO2 получают в два этапа: дегидратацией азотной кислоты до пентаоксида диазота, который затем разлагают термическим путем:
2HNO3 → N2O5 + h3O,
2N2O5 → 4NO2 + O2.
В результате термического разложения нитратов некоторых металлов также можно получить NO2:
2Pb(NO3)2 → 4NO2 + 2PbO + O2.
Окисел может образовываться при взаимодействии азотной кислоты (концентрированной) с металлами (например, медью):
4HNO3 + Cu → 2NO2 + Cu(NO3)2 + 2h3O.
При воздействии азотной кислоты (концентрированной) на олово, кроме диоксида азота, образуется оловянная кислота в качестве побочного продукта:
4HNO3 + Sn → h3O + h3SnO3 + 4NO2.
В некоторых источниках окисел N2O4(IV) называют не иначе, как тетраоксид азота. Но это неправильное название, так как вещество является тетраоксидом диазота. NO2 существует в равновесии с бесцветным газом N2O4: 2NO2↔N2O4.
Так как это равновесие является экзотермическим, то оно сдвигается в сторону NO2 при более высоких температурах, а при более низких — в сторону N2O4. Димер переходит в твердое состояние при температуре минус 11,2 оС. При температуре 150 градусов разлагается: N2O4 → 2NO2, затем 2NO2 → 2NO + O2.
Азотная кислота медленно выделяет NO2, который придает характерный желтый цвет большинству образцов этой кислоты:
4HNO3 → 4NO2 + 2h3O + O2.
Диоксид азота легко обнаружить по запаху уже при низких концентрациях, вдыхания его паров лучше избегать. Одним из потенциальных источников NO2 является дымящая азотная кислота, которая выделяет NO2 при температурах выше 0 градусов. Симптомы отравления (отек легких), как правило, появляются после вдыхания потенциально смертельных доз через несколько часов. Существует ряд доказательств, что долгосрочное воздействие NO2 при концентрациях выше 40—100 мкг/м³ может снизить функцию легких и увеличить риск респираторных симптомов. В исследованиях некоторых ученых установлена связь между концентрацией NO2 и синдромом внезапной детской смерти.
Диоксид азота образуется в большинстве процессов горения, где используется воздух в качестве окислителя.
При повышенных температурах азот соединяется с кислородом с образованием оксида азота: O2 + N2 → 2NO, затем NO окисляется на воздухе с образованием диоксида O2 + 2NO → 2NO2:
При нормальных атмосферных концентраций это очень медленный процесс.
Наиболее вероятным источниками NO2 являются двигатели внутреннего сгорания, тепловые электростанции и, в меньшей степени, целлюлозные заводы.
Газовые обогреватели и печи являются также источниками этого окисла. Необходимый для горения избыток воздуха вносит азот, который при высоких температурах преобразуется в оксиды азота.
В домашних хозяйствах керосиновые обогреватели и газовые обогреватели являются также источниками NO2.
Диоксид азота вырабатывается при атмосферных ядерных испытаниях (красноватый цвет грибовидного облака).
В некоторых сельскохозяйственных районах его приземные концентрации могут достигать 30 мкг/м³.
NO2 также естественным образом вырабатывается при грозе, дожде.
fb.ru
Оксид азота(IV) — это… Что такое Оксид азота(IV)?
Бурый газОксид азота (IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO 2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
Химические свойства
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
Применение
В производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Физиологическое действие
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.«Лисий хвост»
На фото справа — «лисий хвост» на Нижнетагильском металлургическом комбинате«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Вредное воздействие
Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек.
Двуокись азота воздействует в основном на дыхательные пути и легкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
В специальной литературе также указывается на то, что воздействие на организм человека диоксида азота снижает сопротивляемость к заболеваниям, вызывает кислородное голодание тканей, особенно у детей. Усиливает действие канцерогенных веществ, способствуя возникновению злокачественных новообразований.
Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом.
dic.academic.ru
N2 -> NO -> NO2 -> HNO3 осуществить цепочку превращений
Цепочка превращений:
N2 -> NO -> NO2 -> HNO3.
В результате сжигания азота в кислороде при температуре и в присутствии катализаторов платины или диоксида марганца, образуется оксид азота (II):
Окисление монооксида азота кислородом приводит к образованию двуокиси этого неметалла:
При растворении диоксида азота в горячей воде образуется азотная кислота:
В отличие от других элементов азот образует большое число оксидов: , а также неустойчивые и . Кратность связи N-O оказывается больше единицы за счет -связывания. Энтальпии образования оксидов азота выше нуля. Реакции образования оксидов из простых веществ сопровождаются уменьшением числа молей газов, а значит, уменьшением энтропии. Таким образом, стандартная энергия Гиббса оказывается положительной, т.е. при стандартных условиях на один оксид азота не может быть получен из простых веществ. В стандартных условиях оксиды азота термодинамически неустойчивы к распаду на простые вещества. Однако при температурах ниже реакции разложения оксидов азота кинетически заторможены.
ru.solverbook.com
Оксиды азота. Задачи 898 — 900
Задача 898.
Описать химические свойства N
Решение:
а) Химические свойства N2O:
1) При нагревании выше 500 0С оксид азота (I) разлагается на азот и кислород:
2N2O ↔ 2N2 + O2
2)Оксид азота (I) – сильный окислитель. Реакции N2O с аммиаком и водородом могут сопровождаться взрывом:
В водном растворе N2O взаимодействует с катионом Sn2+, восстанавливаясь до NH2OH, а раствор SO2 в воде восстанавливает N2O до N2:
б) Химические свойства NO. В NO атом азота находится в своей промежуточной степени окисления +2, поэтому для него характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей – восстанавливается.
1) NO как восстановитель:
2) NO как окислитель:
3) При взаимодействии NO с щелочными металлами образуется нитроксил-ион NO–, который является электронным аналогом молекулы О2 и имеет кратность связи 2:
NO + Na ↔ Na+ + NO–
Нитроксил-ион играет роль промежуточного соединения в обратимых процессах нитрификации. Он димеризуется с образованием гипонитрит-иона:
2NO– ↔ N2O22-
4) Молекула NO относительно легко теряет электрон, превращаясь в прочный катион нитрозила NO+, изоэлектронный молекулам N2 и СО. Этот катион образует соли нитрозила:
NOF + BF3 ↔ [BF4]–
Тетрафторо-
борат (III) нитрозила
В водных растворах соли нитрозила гидролизуются:
NO+ + Н2О ↔ HNO2 + H+
Монооксид азота может быть лигандом в комплексных соединениях. Как лиганд NO называют «нитрозил». Например, [Fe(NO)4] – тетранитрозилжелезо, [Fe(H2O)5NO]Cl2 – хлорид нитрозилпентаакважелеза(II), K2[Fe(NO)(CN)5] – пентацианонитрозилферрат(III).
Оксиды N2O и NO – не солеобразующие сосуды. Они не взаимодействуют с водой, растворами кислот и оснований.
Задача 899.
Что представляет собой бурый газ, выделяющийся при действии концентрированной азотной кислоты на металлы? Из каких молекул он состоит? Почему его окраска усиливается при повышении температуры и ослабляется при ее понижении? Будет ли этот газ подчиняться закону Бойля — Мариотта, если подвергать его сжатию при постоянной температуре? Составить уравнения реакций, происходящих при растворении этого газа в воде и в растворе щелочи.
Решение:
При действии на металлы концентрированной азотной кислотой выделяется оксид азота (IV) NO2 – бурый очень токсичный газ:
Сu + HNO3(конц.) ↔ Сu(NO3)2 + NO2↑ + H2O
Молекула NO2 нелинейная:
Угол ONO равен 134,1 0
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
2ОN. + .NO2 ↔ 2ОN—NO2
При температуре от -11,2 0С до 140 0С бурый газ состоит из молекул NO2 и N2O4, которые в интервале этих температур находятся в равновесии друг с другом:
N2O4 ↔ 2NO2; ΔН = -56,9 кДж.
При повышении температуры до 140 0С окраска бурого газа усиливается до почти чёрной. Это объясняется тем, что при нагревании равновесие в системе
N2O4 —2NO2 сместится в сторону образования NO2, т. е. при нагревании идёт диссоциация молекул N2O4 до образования в системе преимущественно молекул NO2, которые и придают тёмно-бурую окраску. Наоборот, при охлаждении в системе N2O4 —2NO2 происходит преимущественно димеризация молекул NO2 с образованием молекул N2O4, что и приводит к ослаблению окраски бурого газа.
Если мы будем повышать температуру системы больше 140 0С, то начнётся диссоциация молекул NO2 на NO и О2 (2NO2 ↔ 2NO + О2) и газ будет обесцвечиваться.
Если же бурый газ подвергнуть сжатию при постоянной температуре, то равновесие в системе N2O4 ↔ 2NO2, согласно принципу Ле Шателье, сместится влево, в сторону уменьшения числа газообразных веществ (в сторону уменьшения объёма в системе). При этом объём системы уменьшится, окраска будет становиться светлее.
Задача 900.
Почему молекула NO2 легко димеризуется, а для SO2 подобный процесс не характерен?
Решение:
Молекула NO2 нелинейная, имеет угловую форму с sp2-гибридизацией орбиталей атома азота:
Угол ONO равен 134,10
Её неспаренный электрон находится на связывающей орбитали. Благодаря этому при повышении давления и понижении температуры NO2 переходит в бесцветный димер:
угол ONO = 1350
или
2ОN. + .NO2 ↔ 2ОN—NO2
Молекула N2O4 плоская. Таким образом, связь между двумя молекулами NO2 происходит за счёт объединения неспаренных электронов атомов азота обеих молекул.
Молекула SO2 имеет также как молекула NO2 угловую форму с sp2-гибридизацией орбиталей атома серы:
Угол OSO равна 119,50, длина связи O—S равна 143 пм.
На связывающей орбитали в молекуле SO2 находятся два спаренных электрона, поэтому молекулы не могут димеризоваться.
buzani.ru
NO2, степень окисления азота и кислорода в нем
Общие сведения об оксиде азота (IV) и степени окисления в NO2
Плотность – 2,0527 г/л (н.у.). Брутто-формула – NO2. Молярная масса – 46,01 г/моль. Электронное и пространственное строение молекулы диоксида азота представлено на рис. 1.
Хорошо растворяется в холодной воде (насыщенный раствор ярко-зеленого цвета), полностью реагируя с ней.
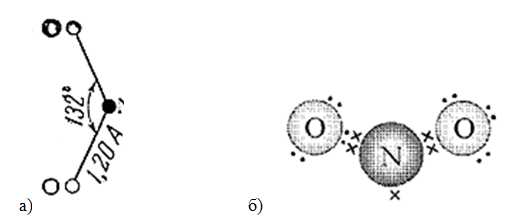
Рис. 1. Строение молекулы оксида азота (IV): а) пространственное с указанием валентного угла и длины связи; б) электронное.
В ОВР проявляет свойства очень сильного окислителя. Вызывает коррозию металлов.
NO2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав диоксида азота, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-2) = 0;
x — 4 = 0;
x = +4.
Значит степень окисления азота в оксиде азота (IV) равна (+4):
N+4O-22.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Оксиды азота. Азотная кислота | АЛХИМИК
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Солеобразующие оксиды: N2O3, NO2, N2O4, N2O5
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
2N2O = 2N2 + O2
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 = 2NO
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4NH3 + 5O2 = 4NO + 6H2O
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):
2NO + O2 = 2NO2

 Оксид азота (IV)
Оксид азота (IV)Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
2NO2 + H2O = HNO2 + HNO3
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
4NO2 + O2 + 2H2O ⇄ 4HNO3
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
В избытке кислорода образуется только нитрат натрия:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Ниже 22 0С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

 Оксид азота (III)
Оксид азота (III)N2O3 + H2O = 2HNO2
Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 ⇄ 2H2O + 4NO2↑ + O2↑
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства

 Азотная кислота
Азотная кислотаКислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
HNO3 ⇄ H+ + NO3—
Как и все кислоты, она реагирует:
а) с оксидами металлов:
MgO + 2HNO3 = Mg(NO3)2 + H2O
б) с основаниями:
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
в) с солями более слабых кислот:
K2CO3 + HNO3 = KNO3 + CO2↑ + H2O
Окислительно – восстановительные свойства
Азотная кислота является одним из сильнейших окислителей. Ее окислительно-восстановительные свойства обусловлены присутствием в молекуле HNO3 атома азота в высшей степени окисления N+5 в составе кислотного остатка NO3—. Окислительные свойства кислотного остатка NO3— значительно сильнее, чем ионов водорода Н+, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины, находящимися в конце ряда напряжений. Так как окислителем в HNO3 являются ионы NO3—, а не ионы Н+, то при взаимодействии HNO3 с металлами практически никогда не выделяется водород. Нитрат-ионы NO3— при взаимодействии HNO3 с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл. На следующей схеме показано, какие продукты могут образоваться при восстановлении HNO3:
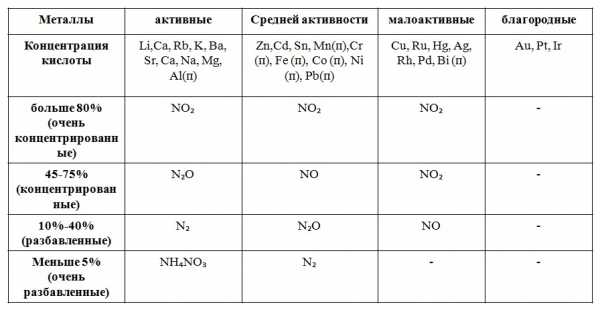
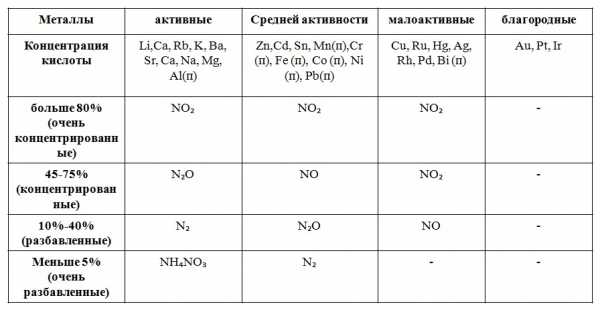 Общая схема взаимодействия азотной кислоты с металлами
Общая схема взаимодействия азотной кислоты с металламиКонцентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
10HNO3 + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni = Ni(NO3)2 + 2NO2↑ + 2H2O
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
5HNO3 + P = HPO3 + 5NO2↑ + 2H2O
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
3Al + 12HNO3 = Al(NO3)3 + Al2O3 + 9NO2↑ + 6H2O
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:
2HNO3 + S = H2SO4 + 2NO↑
Взаимодействие азотной кислоты с медьюПолучение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
В промышленности получение азотной кислоты идет в три стадии:
- Окисление аммиака до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
- Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
- Растворение оксида азота (IV) в воде и избытком кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
Примеры:
2NaNO3 = 2NaNO2 + O2↑
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
*на изображении записи кристаллы нитрата меди (II)
Похожее
al-himik.ru
