Проверочная работа по химии Строение атома 9 класс
Проверочная работа по химии Строение атома 9 класс с ответами. Работа представлена в 3 вариантах в виде теста. В каждом варианте по 15 заданий.
1 вариант
1. В состав ядра атома входят:
1) протоны и нейтроны
2) протоны и электроны
3) нейтроны и электроны
4) нуклоны и электроны
2. Число нейтронов одинаково в атомах:
1) 18F и 31P
2) 18F и 20Ne
3) 27Al и 20Ne
4) 18F и 56Fe
3. Изотопами одного элемента являются:
1) 412Э и 94Э
2) 4018Э и 4020Э
3) 11Э и 31Э
4) 3518Э и 8035Э
4. Число электронов различно в частицах:
1) 16O и 18O
2)
3) 38Ar и 39K+
4) 35Cl и 37Cl
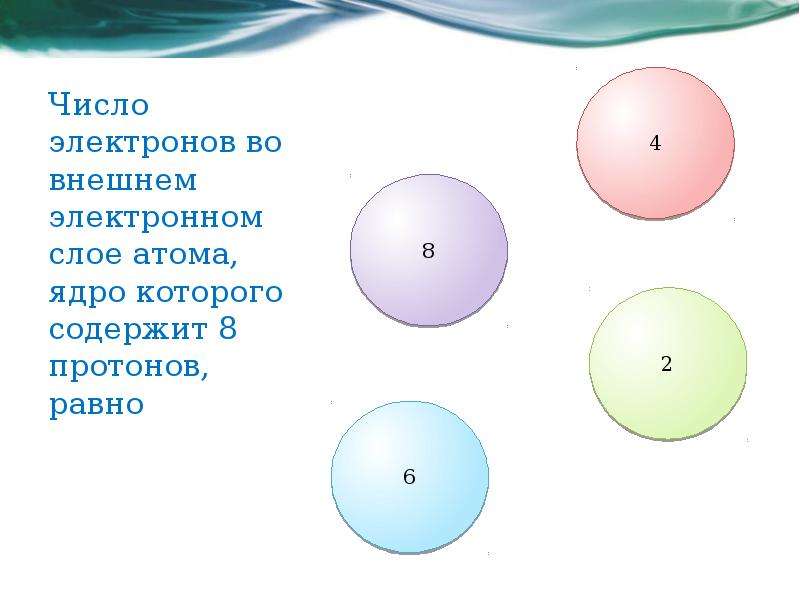
5. В атоме элемента, находящегося в 4 периоде IA группе периодической системы, число электронов равно:
В атоме элемента, находящегося в 4 периоде IA группе периодической системы, число электронов равно:
1) 29
2) 39
3) 9
4) 19
6. 13 протонов находится в ядре атома элемента, расположенного:
1) в 3 периоде, VA группе
2) в 3 периоде, IIIA группе
3) в 5 периоде, IIIA группе
4)во 2 периоде, IIIA группе
7. В порядке возрастания энергии атомные орбитали расположены в ряду:
1) 3р, 2р, 3s
2) 3s, 3р, 2s
3) 1s, 2s, 2р
4) Зр, 4s, 1s
8. Из приведенных примеров наименьшей энергией обладает электрон, находящийся на энергетическом уровне:
1) 5
2) 4
3) 3
4) 2
9. Форму гантели имеет:
1) s-орбиталь
3) d-орбиталь
4) f-орбиталь
10. Три энергетических уровня, занятых электронами, имеется в атоме с порядковым номером:
1) 3
2) 12
3) 19
4) 36
11. В атоме кремния в основном состоянии число энергетических уровней, занятых электронами, равно:
В атоме кремния в основном состоянии число энергетических уровней, занятых электронами, равно:
1) 30
2) 5
3) 14
4) 3
12. В атоме хлора число электронов на внешнем уровне равно:
1) 7
2) 3
3) 17
4) 13
13. В одном периоде расположены элементы, в атомах которых одинаковое число
1) электронов на внешнем слое
2) нейтронов в ядре
3) энергетических уровней, занятых электронами
4) массовое число
14. Электронная формула 1s22s22p4 соответствует атому
15. Номер периода периодической системы, в котором находится элемент с электронной формулой атома 1s
2 вариант
1. Число электронов в атоме равно числу:
1) нуклонов
2) протонов
3) нейтронов
4) позитронов
2. Число протонов и нейтронов одинаково в атоме
1) 40Ar
2) 7Li
3) 24Mg
4) 39K
3. Изотопами одного элемента не являются:
Изотопами одного элемента не являются:
1) 168Э и 188Э
2) 73Э и 63Э
3) 2412Э и 2612Э
4) 4018Э и 4019Э
4. Число протонов различно в частицах:
1) 28Si и 28Al
2) 39К и 39К+
4) 65Cu и 63Cu
5. Число электронов равно четырем в атоме элемента, находящегося в периодической системе:
1) в 1 периоде, IА группе
2) в 3 периоде, IIА группе
3) в 3 периоде, IIА группе
4) во 2 периоде, IIА группе
6. В ядре атома элемента, находящегося в 3 периоде, VIIA группе, число протонов равно:
1) 27
2) 17
3) 37
4) 7
7. В порядке уменьшения энергии атомные орбитали расположены в ряду:
1) 2s, 2p, 3s
2) 3p, 3s, 2p
3) 3d, 1s, 4p
4) 1s, 3s, 4s
8. Из приведенных примеров наибольшей энергией обладает электрон, находящийся на энергетическом уровне
Из приведенных примеров наибольшей энергией обладает электрон, находящийся на энергетическом уровне
1) 5
2) 3
3) 2
4) 1
9. Сферическую форму имеет:
1) s-орбиталь
2) p-орбиталь
3) d-орбиталь
4) f-орбиталь
10. В атоме с порядковым номером 15 число энергетических уровней, занятых электронами, равно:
1) 1
2) 2
3) 3
4) 4
11. В атоме кальция число энергетических уровней, занятых электронами, равно:
1) 20
2) 40
3) 3
4) 4
12. В атоме азота число электронов на внешнем уровне равно:
1) 2
2) 7
3) 5
4) 14
13. В главных подгруппах периодической системы расположены элементы, в атомах которых одинаковое число
1) электронов на внешнем слое
2) нейтронов в ядре
3) энергетических уровней
4) массовое число
14. Электронная формула 1s22s22p63s1 соответствует атому
15. Номер периода периодической системы, в котором находится элемент с электронной формулой атома 1s
22s22p5, равен
Номер периода периодической системы, в котором находится элемент с электронной формулой атома 1s
22s22p5, равен
3 вариант
1. В состав ядра атома не входят:
1) нуклоны
2) протоны
3) электроны
4) нейтроны
2. Число протонов и нейтронов различно в атоме:
1) 56Fe
2) 20Ne
3) 24Mg
4) 4Не
3. Изотопы одного элемента приведены в ряду:
1) 168Э, 188Э, 2412Э
2) 11Э, 21Э, 31Э
3) 2612Э, 4018Э, 4020Э
4) 3518Э, 8035Э, 63Э
4. Число электронов одинаково в частицах:
1) 35Cl и 37Cl
2) 32S и
3) 20Ne и 23Na
4) 39K и 40Ca
5. В атоме элемента, находящегося во 2 периоде, IIIA группе, число протонов в
В атоме элемента, находящегося во 2 периоде, IIIA группе, число протонов в
1) 2
2) 4
3) 5
4) 6
6. 19 электронов имеется в электронной оболочке атома элемента, расположенного в периодической системе:
1) в 1 периоде, IVА группе
2) в 3 периоде, IIА группе
3) во 2 периоде, IА группе
4) в 4 периоде, IА группе
7. В атоме не существует орбитали:
1) 2s
2) 1p
3) 2p
4) 1s
8. Из приведенных примеров наибольшей энергией обладает электрон, находящийся на подуровне:
1) 1s
2) 3s
3) 3p
4) 2p
9. d-орбиталь в атоме имеет форму:
1) сферы
2) трех скрещенных гантелей
3) гантели
4) двух скрещенных гантелей
10.
Два энергетических уровня, занятых электронами, имеется в атоме:1) кислорода
2) водорода
3) серы
4) кальция
11. В атоме элемента с порядковым номером 18 число энергетических уровней, занятых электронами, равно:
1) 2
2) 3
3) 4
4) 5
12. В атоме фосфора число электронов на внешнем энергетическом уровне равно:
В атоме фосфора число электронов на внешнем энергетическом уровне равно:
1) 15
2) 3
3) 5
4) 6
13. Литий, натрий и калий относятся к электронному семейству:
1) s-элементов
2) d-элементов
3) p-элементов
4) f-элементов
14. Электронная формула 1s22s22p63s23p6 соответствует атому
15. Номер группы периодической системы, в которой находится элемент с электронной формулой атома 1s22s2
Ответы на проверочную работу по химии Строение атома 9 класс
1 вариант
1-1
2-2
3-3
4-2
5-4
6-2
7-3
8-4
9-2
10-2
11-3
12-1
13-3
14-O
15-3
2 вариант
1-2
2-3
3-4
4-1
5-4
6-2
7-2
8-1
9-1
10-3
11-4
12-3
13-1
14-Na
15-2
3 вариант
1-3
2-1
3-2
4-1
5-3
6-4
7-2
8-3
9-4
10-1
11-2
12-3
13-1
14-Ar
15-4
| 1. |
Металлические свойства
Сложность: лёгкое |
1 |
| 2. |
Элементы одного периода
Сложность: лёгкое |
1 |
3.
|
Свойства металлов и неметаллов
Сложность: среднее |
1 |
| 4. |
Изменение свойств в периоде
Сложность: среднее |
1 |
5.
|
Относительные атомные массы
Сложность: среднее |
2 |
| 6. |
Сущность и значение Периодического закона
Сложность: среднее |
2 |
7.
|
Высшие валентности элементов
Сложность: сложное |
3 |
| 8. |
Установи последовательность элементов
Сложность: сложное |
3 |
9.
|
Общие формулы высших оксидов и водородных соединений
Сложность: сложное |
3 |
Тест по химии на тему «Строение атома» — 4ЕГЭ
9 класс.stroenie-atoma.pdf
Вопрос №1
В периодической системе, химический элемент со строением электронной оболочки 2e, 8e, 8e, 1e находится
A) в 4-м периоде,IIA группе
B) в 3-м периоде, IIБ группе
C) во 2-м периоде, IV Б группе
D) в 4-м периоде, I А группе
Вопрос №2
Как будет распределение электронов по электронным слоям атома кремния?
A) 2e, 4e
B) 2e, 2e, 2e
C) 2e, 4e
D) 2e, 4e, 2e
Вопрос №3
Число электронных слоев и число электронов во внешнем слое в атоме хлора равны соответственно:
A) 6 и 4
B) 2 и 5
C) 3 и 7
D) 4 и 5
Вопрос №4
Химическому элементу, в атоме которого распределение электронов по слоям 2e, 8e, 5e соответствуют симол элемента, формула высшего оксида и водородного соединения:
A) Cl, Cl2O, HCl
B) N, N2O5, Nh4
C) P, P2O5, Ph4
D) C, CO2, Ch5
Вопрос №5
Химический элемент имеет распределение электронов в атоме: 2e, 8e, 4e Каково будет его водородное соединение?
A) Ch5
B) Nh4
C) Sih5
D) h3S
Вопрос №6
Химический элемент, в котором содержится 7 электронов:
A) неон
B) сера
C) азот
D) кремний
Вопрос №7
В атоме серы общее число электронов и число электронных слоев соответственно равны:
A) 14 и 3
B) 16 и 3
C) 16 и 2
D) 32 и 3
Вопрос №8
Химический элемент, в ядре которого содержится 13 протонов:
A) алюминий
B) натрий
C) азот
D) бор
Вопрос №9
Химический элемент, на внешнем электронном слое которого находится пять электронов, образует водородное соединение, формула которого
A) НЭ
B) Н2Э
C) Н3Э
D) Н4Э
Вопрос №10
Химический элемент, атом которого имеет распределение по электронным слоям 2е, 8е, 8е, 2е, в периодической системе Д. И.Менделеева находится в периоде, номер которого
И.Менделеева находится в периоде, номер которого
A) 1
B) 2
C) 3
D) 4
Ответы
Вопрос №1 — D
Вопрос №2 — C
Вопрос №3 — C
Вопрос №4 — A
Вопрос №5 — C
Вопрос №6 — C
Вопрос №7 — B
Вопрос №8 — A
Вопрос №9 — C
Вопрос №10 — D
|
Извините! — Страница не найдена
Пока разбираемся, возможно, поможет одна из ссылок ниже.
Домой Назад- Класс
- Онлайн-тесты
- Ускоренный онлайн-курс JEE
- Двухлетний курс для ЕГЭ 2021
- Класс
- Онлайн-курс NEET
- Серия онлайн-тестов
- Фонд CA
- CA Промежуточный
- Финал CA
- Программа CS
- Класс
- Тестовая серия
- Книги и материалы
- Тестовый зал
- Умный взломщик BBA
- Обучение в классе
- Онлайн-коучинг
- Тестовая серия
- Интеллектуальный взломщик IPM
- Книги и материалы
- ГД-ПИ
- CBSE класс 8
- CBSE Класс 9
- CBSE класс 10
- CBSE Класс 11
- CBSE класс 12
- Обучение в классе
- Онлайн-классы CAT
- Серия тестов CAT
- МВА Жилой
- Умный взломщик CAT
- Книги и материалы
- Онлайн-классы без CAT
- Серия испытаний без CAT
- Тестовый зал
- ГД-ПИ
- Обучение в классе
- Тестовая серия
- Гражданские интервью
- Класс
- Онлайн-классы
- Серия испытаний SSC
- Корреспонденция
- Практические тесты
- Электронные книги SSC
- Пакет исследований SSC JE
- Класс
- RBI класс B
- Серия тестов банка
- Корреспонденция
- Банковские электронные книги
- Банк ПДП
- Онлайн-коучинг
- Коучинг в классе
- Тестовая серия
- Книги и материалы
- Класс
- Программа моста GRE
- Онлайн-обучение GMAT
- Консультации по приему
- Коучинг GMAT в классе
- Стажировка
- Корпоративные программы
- Студенты колледжа
- Работающие специалисты
- Колледжи
- Школы
Важные вопросы для CBSE Class 9 Science Chapter 4
Вопросы с очень короткими ответами (1 балл)
1. Что такое канальные лучи?
Что такое канальные лучи?
Ответ: Положительно заряженные лучи, открытые Э. Гольдштейном, называются канальными лучами.
2. Если атом содержит один электрон и один протон, будет ли он нести заряд или нет?
Ответ: Один электрон содержит один отрицательный заряд, а один протон содержит один положительный заряд, поэтому они нейтрализуются друг другом. Этот атом не будет содержать никакого заряда.
3. Назовите три субатомные частицы атома.
Ответ: Три субатомные частицы атома — это протон, нейтрон и электрон.
4. Эксперимент по разбросанию альфа-частицы Rutherford отвечал за открытие
-
атомное ядро
-
Electall
-
Proton
-
Neuton
ANS: (D) Proton
5 , Изотопы элемента имеют
-
Одинаковые физические свойства
-
Различные химические свойства
-
Различное количество нейтронов
-
Различные атомные числа
ANS: (a) Те же физические свойства. {-}} $ ION:
{-}} $ ION:
-
16
-
8
-
18
17
17
18
ANS: (B) 8
7. Что из следующего является правильным электронная конфигурация натрия?
-
-
2,8
-
8,2,1
-
2,1,8
-
2,8,1
ANS: (B) 2,8
8. Атомное число элемента равно:
-
Количество протонов
-
Количество электронов
-
Количество нейтронов
-
как (а) и (b)
ANS 🙁 ) Количество протонов
9.
 {+}}$ находится во внешней оболочке?
{+}}$ находится во внешней оболочке? -
-
10
-
11
11
-
18
-
-
8
ANS: (D) 8
14. Атомное число элемента во время химической реакции.
-
-
Увеличение
-
остаются постоянными
-
Уменьшение
-
Может быть (A) или (C)
ANS: (B) остаются постоянными
15.
 Молекулярная формула хлорида алюминия:
Молекулярная формула хлорида алюминия: -
$A{{l}_{3}}Cl$
-
$AlC{{l}_{3}}$
-
$AlC{{l} _{3}}$
-
Оба (b) и (c)
Ответ: (c) $AlC{{l}_{3}}$
16. Атомность фтора:
-
1
-
2
-
3
3
-
-
4
ans: (b) 2
ans: (b) 2
17. Молекулярная формула для фторида кальция IS-
-
$ CA {{f} _ {2}}$
-
$CaF$
-
$C{{a}_{2}}F$
-
$2CaF$
$a{Fa)
18. Электронная конфигурация кальция:
Электронная конфигурация кальция:
ans: (a) 2,8,8,2
19. азот:
-
Monatomic
-
-
-
Triatomic
Tetratomic
ANS: (B ) Двухатомный
Вопрос с кратким ответом (2 балла)
1.На основе модели атома Томсона объясните, почему атом в целом нейтрален.
Ответ: Согласно модели атома Томсона, количество электронов и количество протонов в атоме равны. Электроны заряжены положительно, а протоны отрицательно, поэтому + и — заряды нейтрализуются друг другом, что делает атомы в целом нейтральными.
2. Основываясь на модели атома Резерфорда, какая субатомная частица присутствует в ядре атома?
Основываясь на модели атома Резерфорда, какая субатомная частица присутствует в ядре атома?
Ответ: Согласно модели атома Резерфорда, субатомная частица протон присутствует в ядре атома.
3. Нарисуйте набросок боровской модели атома с тремя оболочками.
Ответ: Боровская модель атома с тремя оболочками выглядит следующим образом:
(Изображение будет загружено в ближайшее время)
4. Как вы думаете, что будет наблюдаться, если провести эксперимент по рассеянию $\alpha -$ частиц с использованием фольги из металла, отличного от золота?
Ответ: Если провести эксперимент по рассеянию $\alpha -$ частиц с использованием фольги из металла, отличного от золота, мы получим другое наблюдение.
5. Атом гелия имеет атомную массу 4 u и два протона в ядре. Сколько у него нейтронов?
Ответ: Атомная масса атома представляет собой сумму масс протонов и нейтронов, присутствующих в его ядре.
Учитывая, что масса атома гелия равна 4 ед., а в его ядре присутствуют два протона.
Значит количество нейтронов будет
$\text{Количество нейтронов = атомная масса }-\text{ количество протонов}$
$\Rightarrow \text{Количество нейтронов = 4}-2$
$\therefore \text{Количество нейтронов = }2$
Следовательно, атом гелия имеет 2 нейтрона.
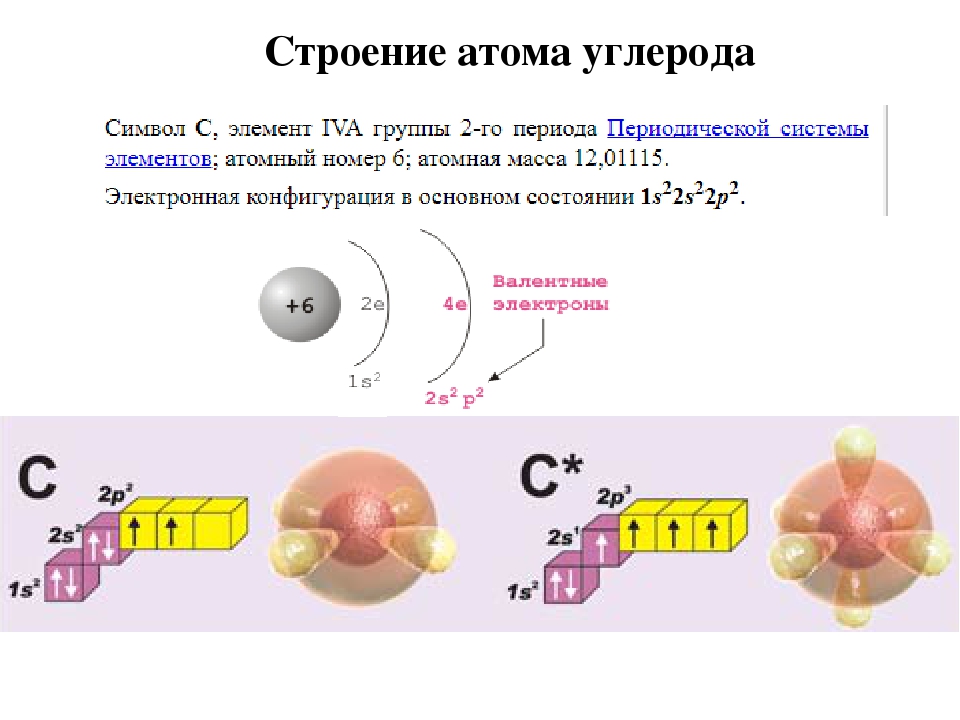
6. Напишите распределение электронов в атомах углерода и натрия.
Ответ: Атомный номер углерода равен 6, а атомный номер натрия равен 11.
Таким образом, распределение электронов в атоме углерода 6 = 2,4
Распределение электронов в атоме натрия 11 = 2,8, 1.
7. Если К- и L-оболочки атома заполнены, то каково общее число электронов в атоме?
Ответ: К-оболочка содержит всего 2 электрона, а L-оболочка содержит максимум 8 электронов.Если К и L оболочки атома заполнены, то общее количество электронов в атоме будет равно 10.
8. Если количество электронов в атоме равно 8 и количество протонов также равно 8, то
-
Каков порядковый номер атома?
Ответ: Атомный номер атома равен количеству протонов или электронов, присутствующих в его ядре. Таким образом, атомный номер атома с 8 электронами и 8 протонами равен 8.
-
Каков заряд атома?
Ответ: Один электрон содержит один отрицательный заряд, а один протон содержит один положительный заряд.В атоме одинаковое количество электронов и протонов, поэтому они нейтрализуют друг друга. Атом будет нейтрален.
9. С помощью таблицы 4.1 найдите массовое число атомов кислорода и серы.
Ответ: Массовое число атома равно сумме протонов и нейтронов, присутствующих в его ядре.
\[Mass\text{ }number\text{ }of\text{ }oxygen=8+8\]
\[Mass\text{ }number\text{ }of\text{ }oxygen=16\]
\[Масса\текст{ }количество\текст{ }из\текст{ Сера}=16+16\]
\[Масса\текст{ }количество\текст{ }из\текст{ Сера}=32\]
10. {+}}$ полностью заполнил оболочки K и L.
{+}}$ полностью заполнил оболочки K и L.
12. Если $z=3$, какой будет валентность элемента? Также назовите элемент.
Ответ: $z=3$ означает, что элемент имеет 3 электрона на своих оболочках. Электронная конфигурация 2,1. Это означает, что электрон внешней оболочки имеет 1 электрон, поэтому его валентность равна 1. Элемент — литий.
Состав ядер двух видов атомов X и Y указан как в
13. Укажите массовые числа X и Y. Какова связь между этими двумя видами?
Ответ: Массовое число атома равно сумме протонов и нейтронов, присутствующих в его ядре.
Таким образом, массовое число X равно $=6+6=12$
Массовое число Y равно $=6+8=14$
Количество протонов в X и Y одинаково, но атомные номера разные . X и Y изотопы.
Для следующих утверждений напишите T вместо True и F вместо False.
-
Дж.
 Дж. Томсон предположил, что ядро атома состоит только из нуклонов.
Дж. Томсон предположил, что ядро атома состоит только из нуклонов.
Ответ: Неверно
-
Нейтрон образуется в результате объединения электрона и протона.Поэтому он нейтрален.
Ответ: Правда
-
Масса электрона примерно в 12000 раз больше массы протона.
Ответ: True
-
Изотоп йода используется для приготовления йодной настойки, которая используется в качестве лекарства.
Ответ: False
14. Ядро атома Bi – 210 (атомный номер = 83) испускает $\beta -$ частицу и становится нуклидом полония. Запишите в виде уравнения для описанного ядерного изменения.{0}е$.
16. Как можно заключить, что электроны являются элементарными частицами?
Ответ: Отношение электронов $\dfrac{e}{m}$ остается одинаковым независимо от природы газа и электродов внутри разрядной трубки. Таким образом, мы можем сделать вывод, что электроны являются фундаментальными частицами.
Таким образом, мы можем сделать вывод, что электроны являются фундаментальными частицами.
17. Что происходит с ядром атома, когда оно испускает $\gamma -$ луч?
Ответ: Масса и заряд нуклида не изменяются, когда он излучает $\gamma -$ лучи. Энергия ядра уменьшается пропорционально энергии испускаемых фотонов.{3+}}$ ион равен 2,8.
-
$O$
Ответ: Электронная конфигурация $O$ равна 2,6.
19. Периодический закон Менделеева?
Ответ: Периодический закон Менделеева гласит, что свойства элементов являются периодическими функциями их атомной массы. Свойства элементов зависят от атомной массы.
20. Дайте определение энергии ионизации и сродству к электрону?
Ответ: Энергия ионизации компонента – это количество энергии, которое необходимо передать хотя бы одному молю элемента в газообразном состоянии, чтобы получить один моль катализатора в газообразном состоянии.
Точка сродства к электрону – это изменение энергии, сопровождающее образование 1 моля анионов в газообразном состоянии из одного моля атомов элемента в газообразном состоянии.
21. Почему атомный номер важнее атомного веса при предсказании химических свойств элементов?
Ответ: Атомный номер состоит в том, что количество протонов в атоме и в результате реакции количество протонов остается неизменным. Атомный номер также дает количество электронов.Электроны присутствуют в оболочках, которые участвуют в химических реакциях и определяют химические свойства. Принимая во внимание, что относительная атомная масса представляет собой сумму количества протонов и числа нейтронов, поэтому число более важно для предсказания химических свойств элементов.
22. Каковы преимущества Периодической таблицы?
Ответ: В периодической таблице элементы расположены в табличной форме. Так что легко запомнить свойства элементов, если известна позиция.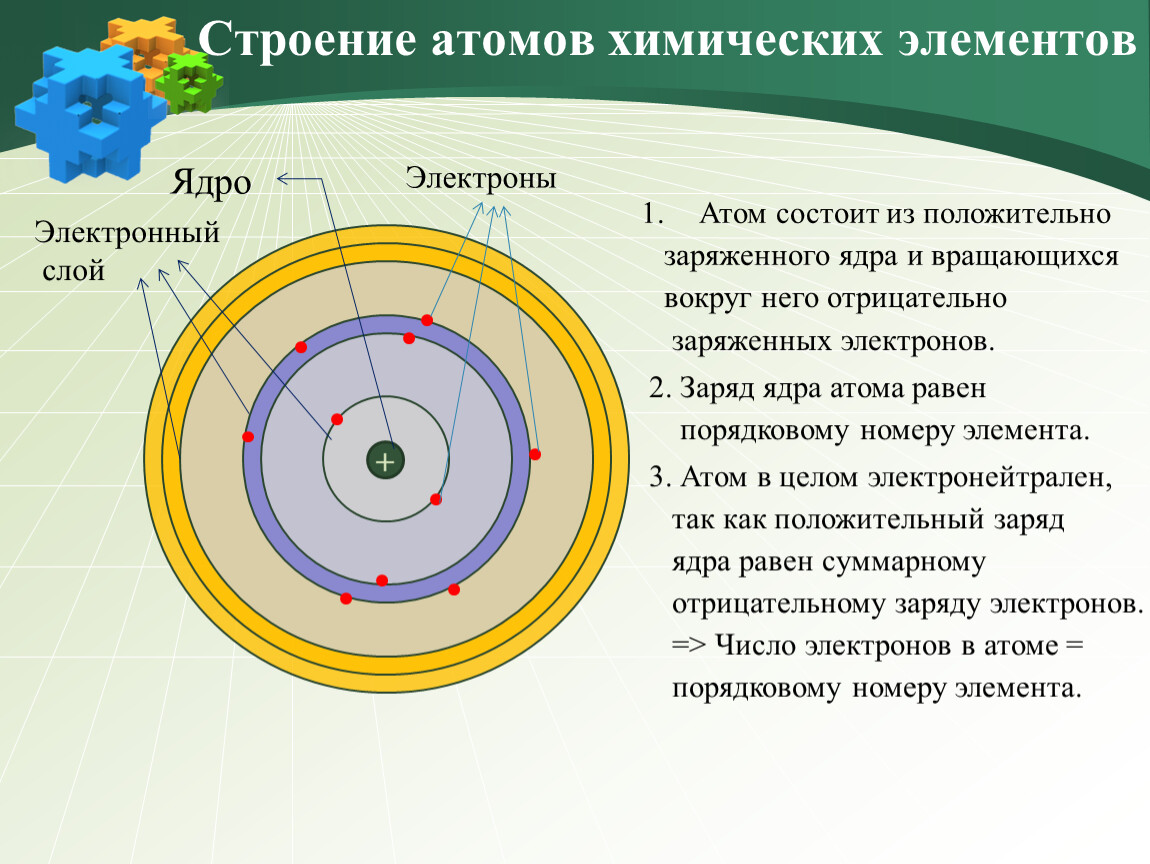 Также соединения, образованные элементами, предсказуемы, если известно положение элемента.Периодическая таблица облегчила и систематизировала изучение химии.
Также соединения, образованные элементами, предсказуемы, если известно положение элемента.Периодическая таблица облегчила и систематизировала изучение химии.
23. Какая из следующих электронных конфигураций неверна и почему?
-
2,8,2
-
2,8,8,2
-
2,8,9,1.
Ответ: Из данной электронной конфигурации 2,8,9,1 неверны, потому что в третьей оболочке максимальное количество электронов равно 8. Правильная электронная конфигурация 2,8,8,2.
24. Что такое ионы? Каковы его два типа?
Ответ: Когда один или несколько электронов отрываются от нейтрального атома, образуется положительно заряженная частица, называемая ионом.{40} тыс. $.
Вопросы с кратким ответом (3 балла)
27. Для символов H, D и T занесите в таблицу три субатомные частицы, содержащиеся в каждом из них.
Для символов H, D и T занесите в таблицу три субатомные частицы, содержащиеся в каждом из них.
Ответ: H представляет собой атом водорода, D представляет собой атом дейтерия и T представляет собой атом трития. Три субатомных частица, присутствующие в каждом из них, представлены следующим образом:
|
| Количество протонов | Количество нейтронов | ||
| Н (водород) | 1 | 1 | 0 | |
| D (дейтерий) | 1 | 1 | 1 | |
| Т (тритий) | 1 | 1 | 2 |
| Протоны |
| Электроны |
| Нейтроны нейтральны (бесплатны). Масса нейтрона равна массе протона. Нейтрон находится внутри ядра атома. | Электроны заряжены отрицательно. Масса электрона равна \[\dfrac{1}{1838}\] массы протона. Электроны находятся вне ядра атома. |
30. Каковы ограничения модели атома Резерфорда?
Ответ: Модель атома Резерфорда не может объяснить стабильность атома, потому что, согласно его модели, электроны вращаются вокруг ядра и при движении по орбите должны излучать энергию, и эта потеря энергии приведет к сокращению орбиты, и, в конце концов, электрон ударится о ядро. и, таким образом, атом нестабилен, но это неверно.
и, таким образом, атом нестабилен, но это неверно.
31. Дайте определение валентности, взяв примеры кремния и кислорода.
Ответ: Валентность электронов определяется электронами, присутствующими в самой внешней оболочке атома. Электроны, присутствующие во внешней оболочке атома, известны как валентные электроны. Электроны приобретают или теряют электроны, чтобы завершить свой октет. Валентность кремния 14, электронная конфигурация 2,8,4. Таким образом, кремний может получить или потерять 4 электрона. Итак, валентность кремния равна +4 или -4.
Атомный номер кислорода 8 и электронная конфигурация 2,6.{18}Х(10%)$.
34. В эксперименте с золотой фольгой:
-
Почему многие $\alpha -$ частицы прошли сквозь золотую фольгу не преломившись?
Ответ: Большая часть пространства внутри атома была пуста, поэтому многие $\alpha -$ частицы прошли сквозь золотую фольгу не преломившись.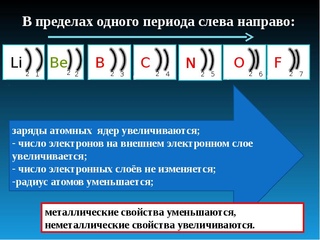
-
Почему несколько $\alpha -$ частиц отклоняются на малые углы.
Ответ: В центре золотой фольги имеется положительный заряд, поэтому несколько $\alpha -$ частиц отклоняются на малые углы.
-
Почему несколько $\alpha -$ частиц после удара о золотую фольгу повторяют свой путь.
Ответ: В золотой фольге есть положительно заряженное ядро, очень маленькое, поэтому лишь немногие $\альфа-$ частицы после удара о золотую фольгу повторяют свой путь.
-
Сравните три основные частицы в атомах по их массе и заряду?
ANS: Сравнение трех основных частиц протона, нейтронов и электрона в отношении их массы и заряда следующая:
| | Частицы | Символ | Mass | Заряд |
| 1 | 9072 1 | Proton | $ {{p} ^ {+}} $ | $ 1836 \ lever (9. |
Внутри атома электрон вращается вокруг ядра по круговой траектории. Протоны и нейтроны находятся внутри ядра.
35. Напишите эксперимент, показывающий, что катодные лучи отклоняются магнитными полями?
Ответ: Эксперимент, показывающий, что катодные лучи отклоняются магнитными полями, выглядит следующим образом:
-
Сначала возьмите газоразрядную трубку с флуоресцентным материалом внутри.
-
Поместите подковообразный магнит в центр разрядной трубки.
-
Когда катодные лучи образуются и проходят через газоразрядную трубку, они отклоняются магнитным полем магнитов в направлении анода. Также они заряжены отрицательно.
Схема эксперимента выглядит следующим образом:
(Изображение скоро будет загружено)
36. Напишите постулаты теории Бора?
Напишите постулаты теории Бора?
Ответ: Постулат теории Бора таков:
-
Электрон вращается вокруг ядра по орбите атома по определенной траектории, известной как орбиты или оболочки.
-
Энергия каждой орбиты фиксирована.
-
Энергия увеличивается от внутренней оболочки к внешней оболочке, т.е. энергия для орбиты, ближайшей к ядру, самая низкая.
-
Если подается энергия, то электрон перемещается с более низкой орбиты на более высокую орбиту.
37. Объясните изменение атомного радиуса по периоду и вниз по группе.
Ответ: Атомный радиус атома увеличивается, когда мы движемся вниз по мере добавления дополнительной оболочки.Атомный радиус уменьшается при движении слева направо по мере увеличения заряда ядра элемента.
38. Почему металлы электроположительны, а неметаллы электроотрицательны?
Ответ: Металлы электроположительны по своей природе, потому что все металлы отдают электроны из своей внешней оболочки, чтобы завершить октет и стать стабильными. Так металлы становятся положительно заряженными. Неметаллы электроотрицательны по своей природе, потому что все неметаллы приобретают электроны, чтобы завершить октет и стать стабильными.{3+}}$ ион.
(Изображение скоро будет загружено)
40. Найдите процентный состав сахарозы $\left( {{C}_{12}}{{H}_{22}}{{O}_{11}} \справа)$.
Ответ: Молекулярная масса сахарозы $\left( {{C}_{12}}{{H}_{22}}{{O}_{11}} \right)$ равна
$\left ( {{C}_{12}}{{H}_{22}}{{O}_{11}} \right)=12\times 12+22+11\times 16$
$\left( {{C}_{12}}{{H}_{22}}{{O}_{11}} \right)=144+22+176$
$\left( {{C}_{12 }}{{H}_{22}}{{O}_{11}} \right)=342 г/моль$
342 г сахарозы содержат 144 г углерода, 22 г водорода и 176 г кислорода. {-}} _ {35} $
{-}} _ {35} $
36
35
45
80793
80
-
Количество граммов — атомов кислорода
ANS: атомы кислорода представлены как $ {{o} _ { 2}}$.{23}}\].
Таким образом, 2 г воды будут содержать такое же количество молекул, как 8 г оксида железа.
Вопросы с развернутым ответом (5 баллов)
42. Как найти валентность хлора, серы и магния?
Ответ: Валентность электронов определяется электронами, присутствующими в самой внешней оболочке атома. Электроны, присутствующие во внешней оболочке атома, известны как валентные электроны. Эти электроны определяют валентность этого атома.
Электроны, присутствующие во внешней оболочке атома, известны как валентные электроны. Эти электроны определяют валентность этого атома.
Атомный номер хлора 17 и электронная конфигурация 2,8,7.
Таким образом, хлор имеет 7 электронов на внешней оболочке, и для завершения своего октета ему нужен еще 1 электрон. Значит, валентность хлора одна.
Атомный номер серы 16 и электронная конфигурация 2,8,6.
Таким образом, Sulphur имеет 6 электронов на внешней оболочке, и для завершения своего октета ей нужно еще 2 электрона. Итак, валентность Серы равна двум.
Атомный номер магния 12 и электронная конфигурация 2,8,2.
Таким образом, магний имеет 2 электрона на внешней оболочке.Легко отдать два валентных электрона. Таким образом, валентность магния равна двум.
43. Опишите модель атома Бора.
Ответ: Модель атома Резерфорда имеет некоторые недостатки. Поэтому, чтобы преодолеть это и подробно объяснить строение атомов, Нил Бор в 1912 году предложил модель атомов. Постулаты модели Бора приведены ниже:
Постулаты модели Бора приведены ниже:
-
Электрон обращается вокруг ядра по орбите атома с фиксированной энергией.
-
Энергия орбит возрастает от внутренней оболочки к внешней i.е. энергия для орбиты, ближайшей к ядру, самая низкая.
-
Если поступает энергия, то электрон перемещается с более низкой орбиты на более высокую орбиту, а если электрон прыгает с более высокой орбиты (энергетического уровня) на более низкую орбиту (энергетический уровень), то энергия излучается в виде электромагнитных волн.
-
Каждая орбита или оболочка представляет уровень энергии целым числом как n=1,2,3,…. Такие орбиты характеризуются как K,L,M,N……….. и озаглавлены от ядра наружу.
44.Сравните все предложенные модели атома, приведенные в этой главе.
Ответ: Подробно обсуждаются три предложенные модели атома, т. е. модель Томсона, модель Резерфорда и модель Бора.
Сравнение между тремя приведена ниже:
| Thomson’s Model | модель Rutherford | Модель BOR | ||||||||||||||||||||||||||||||||||||
| По словам модели Томсона, атом отрицательно заряженные электроны в положительно заряженной сфере.Таким образом, атом в целом нейтрален, так как отрицательный и положительный заряды равны по величине. Эта модель не может объяснить стабильность атома. | Эта модель объясняет, что в центре атома находится ядро, вокруг которого вращаются электроны. В этой модели не объясняется расположение электронов, поэтому она кажется неполной. | Согласно модели Бора, электроны вращаются вокруг ядра по определенному пути, известному как орбиты или оболочки с фиксированной энергией.
46. Объясните следующие примеры и приведите любые два способа использования изотопов.
Ответ: Атомный номер атома равен количеству протонов, присутствующих внутри ядра этого атома.Он представлен Z.
Ответ: Атомная масса атома представляет собой сумму масс протонов и нейтронов, присутствующих в его ядре. Он представлен буквой A. Два вида использования изотопов: 47. Заполните следующую таблицу.
|
ANS: полная таблица выглядит следующим образом:
|
| Mass Number | Количество нейтронов | Протонов | 9 | Количество электронов 9079 9 | Название атомных видов |
| 19 | 10 | 9 | 9 | 3 |||
| 16 | 32 | 16 | 16 | 16 | Сера | |
| 12 | 24 | 12 | 12 | 12 | магния | |
| 1 | 2 | 1 | 1 | 1 | дейтерий | |
| 1 | 1 | 0 | 1 | 0 | 9072 0 Ион водорода |
Глава 4 Наука класса 9 Важные вопросы
Глава 4 Структура атома является частью атомной физики. Некоторые из ученых, которые внесли большой вклад в современную атомную теорию, найдя фактические доказательства, это Джон Дальтон, Дж.Дж. Томпсон, Эрнест Резерфорд, Нильс Бор, Джеймс Чедвик и Эрнест Шредингер.
Некоторые из ученых, которые внесли большой вклад в современную атомную теорию, найдя фактические доказательства, это Джон Дальтон, Дж.Дж. Томпсон, Эрнест Резерфорд, Нильс Бор, Джеймс Чедвик и Эрнест Шредингер.
Темы, охватываемые структурой атома Важными вопросами класса 9 являются заряженные частицы в веществе, структура атома, модель атома Томсона, модель атома Резерфорда, модель атома Бора, нейтроны, распределение электронов в различных орбиты, валентность, атомный номер, массовое число, изотопы и изобары.В этой главе мы также узнаем об открытии электронов и протонов Дж.Дж. Томсон и Э. Гольдштейн соответственно. Из упомянутых тем можно сформулировать множество различных вопросов в важных вопросах Главы 4 Естествознания Класса 9.
Структура атома
Он состоит из трех основных частиц: протонов, электронов и нейтронов. Ядро атома содержит положительно заряженные протоны и незаряженные нейтроны. Самая внешняя область атомов называется электронной оболочкой и содержит электрон, который является отрицательно заряженной частицей.
Заключение
Студенты могут найти важный вопрос о структуре атома 9 класса на Веданту, который был подготовлен экспертами, чтобы помочь студентам в их ежегодной подготовке к экзамену. Правильное решение важных вопросов дано в PDF. Таким образом, студенты могут сэкономить много времени при поиске правильного ответа на соответствующий вопрос. Чтобы узнать больше об этой главе, загрузите решение Class 9 Chapter 4 с нашего сайта. Глава 4 имеет хороший вес на выпускном экзамене.Повторяя концепции главы 4, вы можете получить почти 10 баллов по этой главе.
Структура атома Дополнительные вопросы и ответы для 9 класса по естественным наукам —
Q 1. Что такое канальные лучи?
Ответ. Канальные лучи, также называемые анодными лучами, движутся от анода к катоду в разрядной трубке специальной конструкции. Однако они не исходят от анода.
В 2. Если атом содержит один электрон и один протон, будет ли он нести заряд или нет?
Ответ. Нет, он не будет нести никакого заряда, потому что электрон имеет единичный отрицательный заряд, а протон — единичный положительный заряд. Они нейтрализуют друг друга.
Нет, он не будет нести никакого заряда, потому что электрон имеет единичный отрицательный заряд, а протон — единичный положительный заряд. Они нейтрализуют друг друга.
В 3. На основе модели атома Томсона объясните, почему атом в целом нейтрален.
Ответ. Согласно модели атома Томсона, атом можно рассматривать как положительно заряженную сферу, в которой присутствуют протоны. Считается, что отрицательно заряженные электроны усеяны или встроены в сферу.Поскольку отрицательные заряды электронов и положительные заряды протонов уравновешивают друг друга, атом в целом нейтрален.
В 4. На основании модели атома Резерфорда, какая субатомная частица присутствует в ядре атома?
Ответ. Ядро атома заряжено положительно в соответствии с моделью атома Резерфорда. Таким образом, все протоны в атоме находятся в ядре.
Вопрос 5.Нарисуйте модель атома Бора с тремя оболочками.
Ответ.
В 6. Как вы думаете, что можно было бы наблюдать, если бы эксперимент по рассеянию а-частиц проводился с использованием фольги из другого металла, кроме золота?
Ответ. Если металл тяжелый, такой как золото (например, серебро, платина и т. д.), будут получены аналогичные результаты. Однако, если металл достаточно легкий (например, натрий, магний и т. д.), вполне возможно, что быстро движущиеся и массивные α-частицы (массой 4u) могут оттолкнуть ядро в сторону и пройти насквозь лишь с небольшими отклонениями
Вопрос 7.Назовите три субатомные частицы в атоме.
Ответ. Субатомные частицы в атоме: протоны, электроны и нейтроны.
Q 8. Атом гелия имеет атомную массу 4u и имеет в ядре два протона. Сколько у него нейтронов?
Ответ. Массовое число гелия равно его атомной массе, но не имеет единиц.
∴ Массовое число (A) гелия = 4
Количество протонов в ядре = 2 Атомный номер (Z) элемента = 2
№нейтронов (n) = A – Z = 4 – 2 = 2.
Q 9. Напишите распределение электронов в атомах углерода и натрия.
Ответ. Углерод (Z = 6): 2 (K-оболочка); 4(L-оболочка)
Натрий (Z = 11): 2 (K-оболочка) ; 10 (L-образная оболочка); 1 (М-оболочка)
В 10. Если К- и L-оболочки атома заполнены, то каково будет число электронов в атоме?
Ответ. Максимальное количество электронов в K-оболочке = 2
Максимальное кол-во.электронов в L-оболочке = 8
Всего кол. электронов в атоме = 2 + 8 = 10
В 11. Если число электронов в атоме равно 8 и число протонов также равно 8, то:
(i) Какой будет атомный номер атома?
(ii) Каков заряд атома?
Ответ.
(i) Атомный номер (Z) атома = Количество протонов = Количество электронов = 8
(ii) Заряд атома = Нет заряда
На самом деле, когда количество протонов и электронов одинаково, атом нейтрален.
В 12. Каковы ограничения J.J. Модель атома Томсона?
Ответ. Ограничения модели атома Томсона
(i) Она не могла объяснить результат эксперимента по рассеянию, проведенного Резерфордом.
(ii) В его поддержку не было никаких экспериментальных данных.
В 13. Каковы ограничения модели атома Резерфорда?
Ответ. Ограничения атома модели Резерфорда
- Модель атома Резерфорда не могла объяснить стабильность атома.
- Модель атома Резерфорда не могла объяснить, как el эктроны распределяются во внеядерной части атома.
В 14. Опишите модель атома Бора.
Ответ. В 1913 году Нильс Бор выдвинул теорию распределения электронов во внеядерном пространстве атома. Перечислены основные постулаты теории:
- Во внеядерной части атома электроны вращаются по четко определенным круговым траекториям, известным как орбиты.

- Эти круговые орбиты также известны как энергетические уровни или энергетические оболочки.
- Они были обозначены как K, L, M, N, O, … (или как 1, 2, 3, 4, 5, …) в зависимости от присутствующей энергии.
- Порядок энергии этих энергетических оболочек:
K - При обращении по орбите электрон не имеет возможности ни терять, ни приобретать энергию. Другими словами, его энергия остается неизменной.Поэтому эти энергетические состояния для электрона с также известны как стационарные состояния.
В 15. Сравните все предложенные модели атома, приведенные в этой главе.
Ответ. Для модели атома воздуха Томсона:
- Это не могло объяснить результат эксперимента по рассеянию, проведенного Резерфордом.
- В его поддержку не было никаких экспериментальных доказательств.
Для модели атома Резерфорда:
- Модель атома Резерфорда не могла объяснить стабильность атома.
- Модель атома Резерфорда не могла объяснить, как электроны распределяются во внеядерной части атома.
Для модели атома воздуха Бора:
- Он не давал представления о формах молекул, образованных комбинацией атомов.
- Согласно теории Бора, электрон в атоме движется по четко определенной круговой траектории, называемой орбитой. Однако более поздние исследования показали, что путь электрона нельзя отследить точно.Это только вероятностная природа, а не точная, как утверждает Бор. Однако обсуждать это понятие на нынешнем уровне учащихся не представляется возможным.
В 16. Обобщите правила записи распределения электронов на различных оболочках для первых восемнадцати элементов.
Ответ. Поскольку масса электронов незначительна, вся масса атома равна массе протонов и нейтронов, присутствующих в его ядре. Поскольку каждый протон и нейтрон имеют массу, равную 4 u, следовательно, масса атома должна быть равна сумме протонов и нейтронов, присутствующих в ядре.Последнее известно как массовое число элемента. Обозначается символом А’. Массовое число элемента может быть определено как:
Сумма количества протонов и нейтронов, присутствующих в ядре его атома.
Массовое число (A) = количество протонов + количество нейтронов
Q 17. Опишите валентность на примере кремния и кислорода.
Ответ. Валентность элемента может быть определена как способность его атома объединяться с атомами других элементов для приобретения 8 электронов (в некоторых исключительных случаях 2).
Валентность кремния (Si): Атомный номер элемента 14. Его электронное распределение ; К(2), L(8), М(4).
Его электронное распределение ; К(2), L(8), М(4).
Поскольку атом кремния имеет четыре валентных электрона, он может потерять их все. В то же время он также может получить четыре электрона, чтобы получить полный октет. Следовательно, валентность кремния равна 4.
Валентность кислорода (O): Атомный номер элемента равен 8. Его электронное распределение равно ; K(2), L(6)
Поскольку атом кислорода имеет шесть валентных электронов, ему нужно еще два электрона, чтобы завершить свой октет (8-6 = 2).Следовательно, валентность кислорода равна 2.
Q 18. Объясните на примерах
(i) Атомный номер
(ii) Массовый номер
(iii) Изотопы
(iv) Изобары.
Ответ. (i) Атомный номер: Резерфорд заявил, что количество единичных положительных зарядов, присутствующих в ядре атома, известно как атомный номер элемента. Он обозначается символом Z. (Z) = количество протонов = количество электронов
(ii) Массовое число: Массовое число элемента может быть определено как сумма количества протонов и нейтронов, присутствующих в ядре его атома.
Массовое число (A) = количество протонов + количество нейтронов
(iii) Изотопы: Изотопы могут быть определены как различные атомы одного и того же элемента, имеющие одинаковый атомный номер, но разные массовые числа.
(iv) Изобары: Изобары могут быть определены как атомы, принадлежащие разным элементам с одинаковыми массовыми числами, но разными атомными номерами.
Q 19. Какая из трех известных субатомных частиц называется универсальной частицей?
Ответ.Электрон известен как универсальная частица.
В 20. Сколько электронов присутствует в ионе He 2+ ? Предложите другое название.
Ответ. Ион He 2+ не имеет электронов. Его также называют альфа (α) частицей.
В 21. Во сколько раз радиус внеядерной проции больше радиуса ядра атома?
Ответ. Радиус внеядерной части почти в 10 5 раз больше, чем у ядра.
Радиус внеядерной части почти в 10 5 раз больше, чем у ядра.
В 22. Всегда ли атомный номер атома равен числу электронов?
Ответ. Нет, это тот случай, когда атом не имеет заряда. В случае катиона (положительно заряженного) атомный номер больше числа электронов, а в случае аниона (отрицательно заряженного) меньше числа электронов.
В 23. Что из протона и нейтрона тяжелее?
Ответ. Нейтрон немного тяжелее (1.675 х 10 -27 кг), чем протон (1,67 х 10 -27 кг).
В 24. Объясните, почему относительная атомная масса хлора составляет около 35,5 ед.?
Ответ. Хлор всегда существует в виде двух изотопа. Это изотопы Cl-35 и Cl-37 в соотношении 3:1. Таким образом, атомная масса элемента является дробной и считается относительной атомной массой.
В 25. Почему протон так назван?
Ответ. Протон (H + ) образуется, когда атом водорода, также называемый протием, теряет электрон. Поэтому его называют протоном.
Протон (H + ) образуется, когда атом водорода, также называемый протием, теряет электрон. Поэтому его называют протоном.
Q 26. Катион представлен как M 3+ . В чем разница между числом присутствующих протонов и электронов?
Ответ. В катионе М 3+ на три электрона меньше по сравнению с протонами.
В 27. Если К и L оболочки атома полностью заполнены, как он будет называться?
Ответ.Атом будет принадлежать элементу благородного газа неону (Ne).
В 28. Имеют ли изобары такие же химические характеристики, как и изотопы?
Ответ. Нет, они не идентичны, потому что изобары имеют разные атомные номера, а также разные электронные конфигурации. ‘
Q 29. Электронная конфигурация элемента: 2(K), 8(L), 5(M). Предсказать его валентность.
Ответ. Валентность элемента равна 3.Он рассчитывается как: 8 – 5 = 3.
Валентность элемента равна 3.Он рассчитывается как: 8 – 5 = 3.
В 30. Напишите два важных постулата боровской модели атома.
Ответ. Перечислены 2 основных постулата теории:
- Во внеядерной части атома электроны вращаются по четко определенным круговым траекториям, известным как орбиты.
- Эти круговые орбиты также известны как энергетические уровни или энергетические оболочки.
Вопрос 31.В чем принципиальная разница между изотопами элемента?
Ответ. Изотопы элемента различаются по количеству нейтронов, что приводит к разным массовым числам.
Q 32. Элемент алюминий обозначается символом fgAI. Запишите количество протонов, электронов и нейтронов, содержащихся в нем.
Ответ. Количество протонов = 13; Количество электронов = 13; Количество нейтронов = 27 – 13 = 14.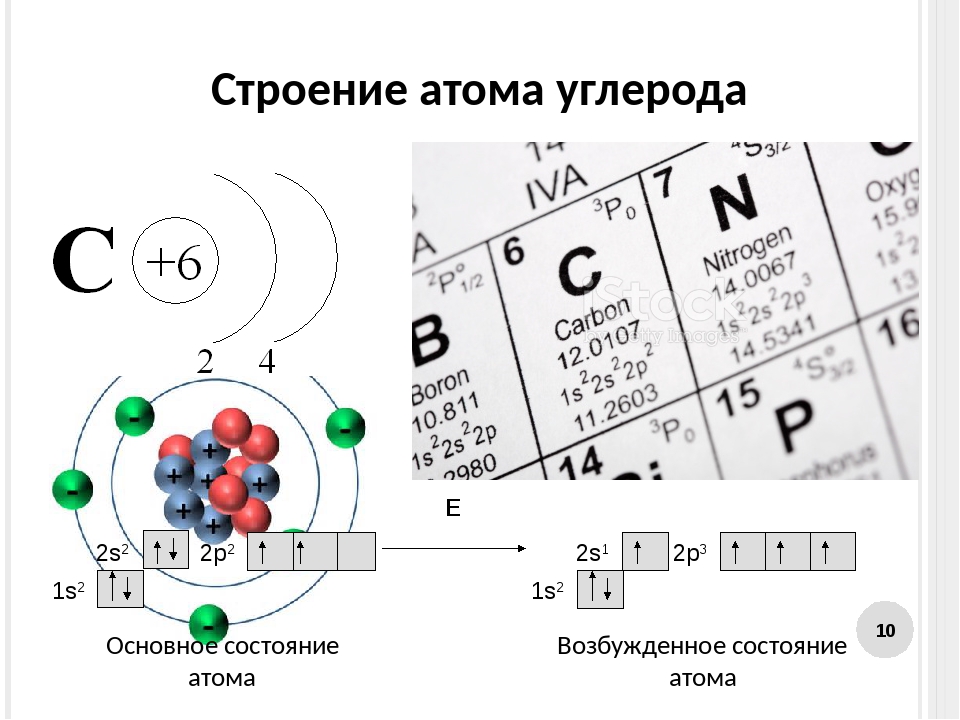
В 33. Каково число электронов в валентной оболочке хлора (Z = 17) ?
Ответ.Электронное распределение элемента: K(2), L(8), M(7). Это означает, что валентная оболочка хлора имеет 7 электронов.
В 34. Какой радиоизотоп используется для лечения рака?
Ответ. Радиоизотоп Co-60 используется для лечения рака.
Q 35. Из изотопов углерода С-12 и С-14, который имеет радиоактивную природу?
Ответ. Изотоп С-14 имеет радиоактивную природу.
В 36. Если атом имеет один протон и один электрон, укажите заряд атома. Обосновать ответ.
Ответ. Атомы нейтральны. Одна единица положительного заряда протона компенсируется единицей отрицательного заряда электрона.
В 37. Электронная конфигурация элемента Z равна 2, 8, 6. Сколько электронов требуется, чтобы иметь стабильную конфигурацию
?
Ответ. Чтобы иметь стабильную конфигурацию, элемент Z должен иметь 8 электронов на валентной оболочке.Для этого ему нужно (8 – 6) = 2 электрона.
Чтобы иметь стабильную конфигурацию, элемент Z должен иметь 8 электронов на валентной оболочке.Для этого ему нужно (8 – 6) = 2 электрона.
В 38. Будут ли 12 6 C и 14 6 C иметь разные валентности?
Ответ. Оба вида являются изотопами одного и того же элемента, то есть углерода. Поскольку их атомные номера одинаковы, их электронные конфигурации, а также валентности также будут одинаковыми.
Q 39. Атом элемента A’ имеет три электрона на внешней оболочке.Он теряет один из них атому другого элемента «В». Каковы будут природа и величина заряда иона, образовавшегося в результате «А»?
Ответ: Так как атом A’ потерял один электрон, образовавшийся ион будет положительным и будет иметь заряд +1. Его можно представить как A+.
Q 40. Атом элемента имеет электронную конфигурацию 2, 8, 6. Принимает ли он два электрона или теряет шесть электронов, чтобы иметь конфигурацию ближайшего элемента благородного газа?
Ответ.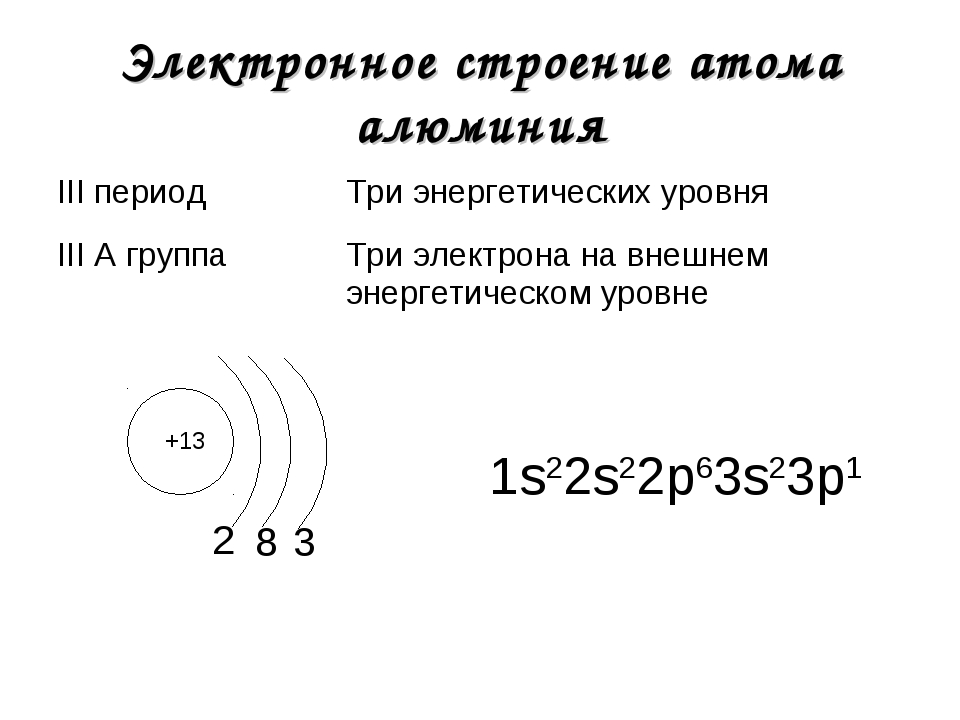 Атом имеет шесть электронов на валентной оболочке. Ему очень трудно потерять шесть электронов. Однако он может получить два электрона от соседнего атома другого элемента. Таким образом, он будет иметь электронную конфигурацию ближайшего элемента благородного газа аргона (2, 8, 8).
Атом имеет шесть электронов на валентной оболочке. Ему очень трудно потерять шесть электронов. Однако он может получить два электрона от соседнего атома другого элемента. Таким образом, он будет иметь электронную конфигурацию ближайшего элемента благородного газа аргона (2, 8, 8).
Q 41. Элементы X и представляют собой пару изотопов ?
Ответ. Нет, потому что эти два элемента различаются по своим атомным номерам. Изотопы имеют одинаковые атомные номера
.
В 42. Элемент «X» имеет массовое число 4 и атомный номер 2. Найдите валентность «X».
Ответ. Электронная конфигурация: K(2). Поскольку К-оболочка заполнена, валентность «Х» равна нулю.
Q 43. Назовите частицы, определяющие массу атома.
Ответ. Протоны и нейтроны, присутствующие в ядре, определяют массу атома.
В 44. Каково число валентных электронов у
(i) иона натрия (Na + )
(ii) оксид-иона (O 2-)?
Ответ.
(i) Ион натрия (Na + ):
Число электронов: (11 – 1) = 10; Электронная конфигурация = 2, 8.
∴ Ион Na + имеет 8 валентных электронов.
(ii) Оксид-ион (O 2-):
Число электронов: (8 + 2) = 10; Электронная конфигурация = 2, 8
∴ O 2- ион имеет 8 валентных электронов.
И ион Na + , и ион O 2- известны как изоэлектронные частицы, поскольку они имеют одинаковое количество электронов, т.е.е. 10. Их электронная конфигурация аналогична неону (Z = 10), который является элементом инертных газов.
Это означает, что ион O 2-, ион Na + и атом Ne являются изоэлектронными частицами.
Q 45. Элементы A и B имеют атомные номера 18 и 16 соответственно. Какой из этих двух будет более реактивным и почему?
Ответ. Электронная конфигурация A (Z = 18) ; 2, 8, 8
Электронная конфигурация B (Z = 16) ; 2, 8, 6
Элемент A’ имеет полностью заполненную внешнюю оболочку (M-оболочку). Следовательно, он будет наименее реактивным.
Следовательно, он будет наименее реактивным.
Элемент «B» имеет только неполную внешнюю оболочку (M-оболочка имеет 6 электронов).
Следовательно, элемент «В» будет более реактивным, чем элемент «А».
В 46. Укажите, верны или нет следующие утверждения.
(i) Один моль метана содержит четыре атома водорода.
(ii) Изотопы элемента отличаются числом электронов.
(iii) Элементы идентифицируются по их атомным номерам.
(iv) Массовое число элемента имеет определенные единицы.
(v) К-оболочка элемента не может иметь более восьми электронов.
Ответ.
(i) Неверно
(ii) Неверно
(iii) Верно
(iv) Неверно
(v) Неверно
Q 47. Назовите элементы, имеющие следующую электронную конфигурацию:
(i) 2, 6
(ii) 2, 7
(iii) 2, 8, 1
(iv) 2, 8, 7
(v) ) 2, 8
Ответ.
(i) кислород
(ii) фтор
(iii) натрий
(iv) хлор
(v) неон.
Q 48. (a) Какое максимальное число электронов может быть размещено на внешней энергетической оболочке атома?
(b) На основе модели атома Томсона объясните, почему атом в целом нейтрален.
в) Сколько нейтронов содержится в атоме водорода?
(d) Принадлежат ли изобары одному и тому же элементу?
(e) Элемент имеет пять электронов на М-оболочке, которая является самой внешней оболочкой. Напишите его электронную конфигурацию.
Ответ.
а) Самая внешняя энергетическая оболочка атома может иметь максимум восемь электронов.
(b) Согласно модели атома Томсона, все протоны в атоме находятся в положительно заряженной сфере, а отрицательно заряженные электроны сосредоточены в этой сфере. Поскольку число электронов и протонов одинаково, каждый несет единичный заряд, атом в целом электрически нейтрален.
(c) Атом водорода не имеет нейтрона.
(d) Нет, изоляты принадлежат к разным элементам, так как они различаются по своим атомным номерам.
(e) Электронная конфигурация элемента: K(2) L(8) M(5).
В 49. Как Бор распределил электроны по разным оболочкам в атоме?
Ответ. В 1913 году Нильс Бор выдвинул теорию распределения электронов во внеядерном пространстве атома. Перечислены основные постулаты теории:
- Во внеядерной части атома электроны вращаются по четко определенным круговым траекториям, известным как орбиты.
- Эти круговые орбиты также известны как энергетические уровни или энергетические оболочки.
- Они были обозначены как K, L, M, N, O, … (или как 1, 2, 3, 4, 5, …) в зависимости от присутствующей энергии.
- Порядок энергии этих энергетических оболочек:
K - При обращении по орбите электрон не имеет возможности ни терять, ни приобретать энергию. Другими словами, его энергия остается неизменной.
 Поэтому эти энергетические состояния для электронов также известны как стационарные состояния
Поэтому эти энергетические состояния для электронов также известны как стационарные состояния
Q 50. Объясните следующее:
(а) Изотопы элемента химически подобны.
(б) Атом электрически нейтрален.
(c) Благородные газы обладают наименьшей реакционной способностью
(d) Ядро атома тяжелое и положительно заряженное.
(e) Ионы более стабильны, чем атомы.
Ответ.
(a) Изотопы элемента имеют одинаковый атомный номер и электронное распределение.Поскольку химические свойства элементов связаны с их электронным распределением или конфигурацией, элементы с аналогичной конфигурацией имеют сходные свойства. Таким образом, изотопы элемента химически подобны.
(б) В атоме число протонов в ядре равно числу электронов во внеядерной части. Поскольку каждый протон и каждый электрон имеют одинаковый заряд, но с противоположной величиной, атом, следовательно, электрически нейтрален.
(c) Атомы элементов благородных газов имеют полные внешние электронные оболочки. За исключением гелия (He), который имеет два электрона на своей единственной оболочке (K-оболочке), остальные члены семейства имеют восемь электронов на самой внешней или валентной оболочке. Это означает, что атомы этих элементов не имеют тяги к химическому соединению или они наименее реакционноспособны по своей природе.
За исключением гелия (He), который имеет два электрона на своей единственной оболочке (K-оболочке), остальные члены семейства имеют восемь электронов на самой внешней или валентной оболочке. Это означает, что атомы этих элементов не имеют тяги к химическому соединению или они наименее реакционноспособны по своей природе.
(d) Положительно заряженные: Альфа-частицы имеют положительный заряд. Так как они отталкивались или отклонялись назад, то препятствие также должно нести такой же заряд, т. е. положительный заряд (одинаково заряженные частицы всегда отталкиваются друг от друга
(e) Когда атом превращается в ион (катион или анион), валентная оболочка иона имеет полный октет (т.е. у него восемь электронов на самой внешней или валентной оболочке). У некоторых ионов валентная оболочка представляет собой К-оболочку и имеет только два электрона (например, ион Li + или ион H – ). Таким образом, ионы довольно стабильны по своей природе.
CBSE Class 9 Научные заметки к главе 4
В этой статье представлены научные заметки CBSE Class 9 по главе 4 «Структура атома». Эти примечания к главам подготовлены профильными экспертами и охватывают все важные темы главы.В промежутках между этими заметками вы можете попробовать задать вопросы из обсуждаемого набора тем. Эти вопросы помогут вам отследить уровень вашей подготовки и овладеть предметом.
Эти примечания к главам подготовлены профильными экспертами и охватывают все важные темы главы.В промежутках между этими заметками вы можете попробовать задать вопросы из обсуждаемого набора тем. Эти вопросы помогут вам отследить уровень вашей подготовки и овладеть предметом.
Основные темы, охватываемые CBSE Class 9 Science, Structure of the Atom: Chapter Notes:
- Субатомные частицы атома и их открытие
- Модель атома Томсона
- Модель атома Резерфорда
- Модель атома Бора
- Расположение электронов в атоме:
- Орбита
- Валентность
- Атомный номер
- Массовый номер
- Изотопы
- Изобары
Также проверьте: CBSE Class 9 Science Syllabus 2021-22
Примечания к главе «Структура атома»:
Введение:
Теория атома Дальтона предполагала, что атом неделим.Однако открытие внутри атома двух фундаментальных частиц, называемых электронами и протонами, привело к краху атомной теории Дальтона.
Основные частицы атома:
Три частицы; электрон, протон и нейтрон, из которых состоит атом, называются элементарными частицами атома или субатомными частицами.
Открытие электрона:
Дж. Дж. Томсон, 1897 г.
Он провел эксперимент с катодными лучами, в котором наблюдал поток отрицательно заряженных частиц, выходящий из катода к аноду.Эти частицы были названы электронами.
Открытие протона:
Эрнест Гольдштейн в 1886 году.
Он наблюдал в одной и той же газоразрядной трубке в различных ситуациях, когда анод испускал положительные частицы, которые он назвал канальными лучами. Его эксперимент привел к открытию протона.
Открытие нейтрона:
Дж. Чедвик, 1932 г.
Нейтрон присутствует в ядре всех атомов.
1. Модель атома Томсона (Джозеф Джеймс Томсон, 1897 г.)
Модель атома Томсона предполагала, что:
→ Атом представляет собой однородную сферу положительных зарядов (из-за присутствия протонов), а также отрицательных зарядов (из-за присутствия электронов).
→ Атом в целом электрически нейтрален, потому что отрицательный и положительный заряды равны по величине.
Эта модель также известна как модель арбуза, модель сливового пудинга и модель яблочного пирога.
Ограничения модели Томсона:
→ Не удалось объяснить, как протоны и электроны располагались в атоме так близко друг к другу.
2. Модель атома Резерфорда (Эрнест Резерфорд в 1909 г.)
Это было основано на эксперименте, в котором α-частицы бомбардировали тонкую золотую фольгу.
Наблюдения за экспериментом Резерфорда по рассеянию α-частиц:
(а) Большая часть α – частиц прошла беспрепятственно.
(б) Часть α-частиц отклонилась от своей первоначальной траектории на заметный угол.
(c) Очень немногие α-частицы отскочили назад по своей первоначальной траектории.
Решения NCERT для CBSE Class 9 Science
Постулаты модели атома Резерфорда:
(а) Большая часть атома пуста.
(б) В атоме имеется положительно заряженный центр, который содержит почти всю массу атома. Центр называется ядром.
(c) Размер ядра очень мал по сравнению с атомом.
(г) Электроны вращаются вокруг ядра.
Недостатки модели Резерфорда
(а) Согласно модели Резерфорда, электрон вращается вокруг положительно заряженного ядра, которое не должно быть стабильным. Но заряженная частица при ускоренном движении по круговой траектории непрерывно теряла бы энергию и в конце концов попала бы в ядро. Это делает атом нестабильным, в то время как атомы вполне стабильны.
(b) Модель Резерфорда не могла решить проблему атомной массы атома, так как предполагала только существование протонов в ядре.
3. Модель атома Бора (Составлена Нильсом Бором в 1913 г.)
Эта модель атома утверждает, что:
→ Атом состоит из тяжелого положительно заряженного ядра. Вся масса атома сосредоточена в ядре.
→ Электроны в атоме вращаются вокруг ядра по определенным круговым траекториям, называемым орбитами или энергетическими уровнями.
→ Каждый энергетический уровень связан с определенным количеством энергии.
→ Изменение энергии происходит, когда электрон перескакивает с одного энергетического уровня на другой энергетический уровень.
Попробуйте ответить на следующие вопросы:
Q.1 Почему относительная масса электрона считается незначительной?
Q.2 Какое наблюдение эксперимента по рассеянию Резерфорда установило наличие большого пустого пространства в атоме?
В.3 Что такое канальные лучи? Какова природа составляющих канальных лучей?
Q.4 Почему модель атома Резерфорда не смогла объяснить стабильность атома?
Расположение электронов в атоме:
Расположение электронов в различных оболочках (энергетических уровнях) атома элемента известно как Электронная конфигурация.
. Максимальное число электронов, которые можно поместить в конкретную оболочку, т. е. энергетические уровни, было дано Бором и Бери.
е. энергетические уровни, было дано Бором и Бери.
Согласно схеме Бора-Бери:
→ Максимальное количество электронов, которые могут разместиться на любом энергетическом уровне, определяется выражением 2n 2 , где n = 1, 2, 3, 4, …. (для К, Л, М, Н…..)
→ Максимальное количество электронов на самой внешней орбите будет 8 электронов, даже если она способна вместить больше электронов.
→ Электроны не помещаются в данной оболочке. Если ранние оболочки не заполняются, то происходит ступенчатое заполнение оболочек.
Орбита
Круговой путь вокруг ядра называется орбитой, энергетическим уровнем или оболочкой. Уровень энергии представлен английскими буквами: K, L, M, N, …. и так далее.
Следовательно,
→ 1 st орбита обозначается K
→ 2 -я -я орбита обозначается L
→ 3 rd орбита обозначается буквой M и так далее.
Распределение электронов на орбите или оболочке
Распределение электронов на орбите может быть получено с помощью формул 2n 2 , где n — номер этой орбиты.
Например:
Количество электронов в K-оболочке, т.е. на 1 ст орбите
Здесь n = 1
Следовательно, 2n 2 = 2 × 1 2 = 2
Таким образом, максимальное количество электронов в К-оболочке, т.е. 1 ст оболочки = 2
Число электронов в L-оболочке, т.е. на 2 -й орбите
Здесь n = 2, поэтому
2n 2 = 2 × 2 2 = 8
Таким образом, максимальное число электронов в L-оболочке = 8
Аналогичным образом можно рассчитать максимальное количество электронов на любой оболочке.
Валентные электроны
Электроны, присутствующие во внешней оболочке атома, известны как валентные электроны. Эти электроны определяют валентность атома.
Валентность
Валентность – это объединяющая способность атома, т. е. их склонность реагировать и образовывать молекулы с атомами одного и того же или разных элементов.
Для атомов, имеющих число валентных электронов меньше или равное 4, валентность равна числу валентных электронов в этом атоме.
Например, валентность магния (2, 8, 2) = 2
Если количество валентных электронов превышает 4, то валентность = 8 – количество валентных электронов.
Например, валентность кислорода (2, 6) = 8 – 6 = 2.
Валентность атомов с 8 валентными электронами равна нулю, поскольку они имеют полностью заполненную валентную оболочку и не могут приобретать или терять электроны, образуя молекулы или соединения.
Атомный номер (Z)
Атомный номер элемента равен количеству протонов, присутствующих в ядре атома.
Так как атом электрически нейтрален, то количество протонов и количество электронов равны, следовательно:
Атомный номер (z) = количество протонов = количество электронов.
Массовое число (A)
Общее количество протонов и нейтронов, присутствующих в ядре атома, называется массовым числом. Обозначается А.
Обозначается А.
Протоны и нейтроны вместе называются нуклонами.
Число нейтронов, присутствующих в ядре атома, обозначается буквой N.
Изотопы
Атомы одного и того же элемента, имеющие одинаковый атомный номер, но разные массовые числа, известны как изотопы.
Например:
Применение изотопов
→ Изотоп урана используется в качестве топлива в ядерном реакторе
→ Изотоп кобальта используется для лечения рака
→ Изотоп йода применяют при лечении зоба.
Изобары
Атомы различных элементов, имеющие одинаковые массовые числа, известны как изобары,
Например:
Калий, K и аргон.Оба Ar имеют массовые числа, равные 40,
.Попробуйте ответить на следующие вопросы:
Q 1. Атом гелия имеет атомную массу 4 u и два протона в ядре. Сколько у него нейтронов?
Q 2. Количество электронов и нейтронов в атоме равно 3 и 4 соответственно. Найдите его:
Количество электронов и нейтронов в атоме равно 3 и 4 соответственно. Найдите его:
(а) Атомный номер
(b) Массовое число?
Q 3. Назовите частицы, определяющие массу атома.
Q 4. Что такое правило октетов?
Q 5. Почему гелий имеет нулевую валентность?
Q 6. Изотопы атома химически одинаковы. Почему?
Также проверьте:
CBSE, класс 9, научные примечания по разделам на 2021–2022 годы
CBSE Class 9 Science Complete Study Material for 2021-2022
Structure of the Atom Class 9 Extra Questions Science Chapter 4
Structure of the Atom Class 9 Extra Questions Science Chapter 4
Дополнительные вопросы к 9 классу по естественным наукам Глава 4 Структура атома
Структура класса Atom 9 Дополнительные вопросы Вопросы с очень короткими ответами
Вопрос 1.
Какая субатомная частица отсутствует в обычном атоме водорода?
Ответ:
Нейтрон.
Вопрос 2.
Дж. Чедвик открыл субатомную частицу, которая не имеет заряда и имеет массу, почти равную массе протона. Назовите частицу и укажите ее положение в атоме.
Ответ:
Частица нейтрон и она присутствует в ядре атома.
Вопрос 3.
Может ли атом элемента иметь один электрон, один протон и ни одного нейтрона? Если да, то назовите элемент.{1} \mathrm{H}\).
Вопрос 4.
Электрон приписывает отрицательный заряд, протоны приписывают положительный заряд. У атома есть и то, и другое, но почему нет заряда?
Ответ:
Положительные и отрицательные заряды протонов и электронов равны по величине. Итак, атом в целом электрически нейтрален.
Вопрос 5.
Напишите электронную конфигурацию элемента с атомным номером 12.
Ответ:
К, Л, М
2, 8, 2
Вопрос 6.
Что вы понимаете под основным состоянием атома?
Ответ:
Состояние атома, в котором все электроны в атоме находятся на самых низких энергетических уровнях, называется основным состоянием. { 34 }{ X }\) более реактивен, потому что его внешняя оболочка неполна.
{ 34 }{ X }\) более реактивен, потому что его внешняя оболочка неполна.
Вопрос 12.
Один электрон находится на самой внешней оболочке атома элемента X. Каковы будут природа и величина заряда образовавшегося иона, если этот электрон удалить с самой внешней оболочки? [NCERT Exemplar]
Ответ:
Плата будет +1.
Вопрос 13.
В атоме элемента X на внешней оболочке находится 6 электронов. Если он приобретает конфигурацию благородного газа, принимая необходимое количество электронов, то каков будет заряд образовавшегося таким образом иона? [Пример NCERT]
Ответ:
– 2.{2} \mathrm{H}\)) содержится в тяжелой воде.
Вопрос 16.
Химическая формула сульфата металла: MSO 4 . Какой будет формула его хлорида?
Ответ:
MCl 2
Вопрос 17.
Элемент «А» имеет валентность +3, а другой элемент «В» имеет валентность -2. Назовите формулу их соединений, образующихся при взаимодействии «А» с «В».
Ответ:
Элемент «А» валентность +3 (слева)
Элемент «В» валентность – 2 (справа)
Химическая формула = А 2 В 3
Вопрос 18.
Валентность элемента X равна 3. Напишите химическую формулу его оксида.
Ответ:
X 2 O 3
Вопрос 19.
Будут ли 35 Cl и 37 Cl иметь разные валентности? Обосновать ответ. [NCERT Exemplar]
Ответ:
Нет, 35 Cl и 37 Cl являются изотопами элемента.
Вопрос 20.
Атомные номера кальция и аргона равны 20 и 18 соответственно, но массовое число обоих этих элементов равно 40.Как называется такая пара элементов? [Пример NCERT]
Ответ:
Изобары
Структура дополнительных вопросов класса 9 Atom Вопросы с краткими ответами — I
Вопрос 1.
Откуда вы знаете, что ядро очень мало по сравнению с размером атома?
Ответ:
Резерфорд заметил, что когда а-частицы бомбардируются очень тонкой фольгой, они отскакивают назад. Но количество отскакивающих а-частиц удвоилось, когда он удвоил толщину золотой фольги.Затем он пришел к выводу, что площадь ядра очень мала по сравнению с общей площадью атома.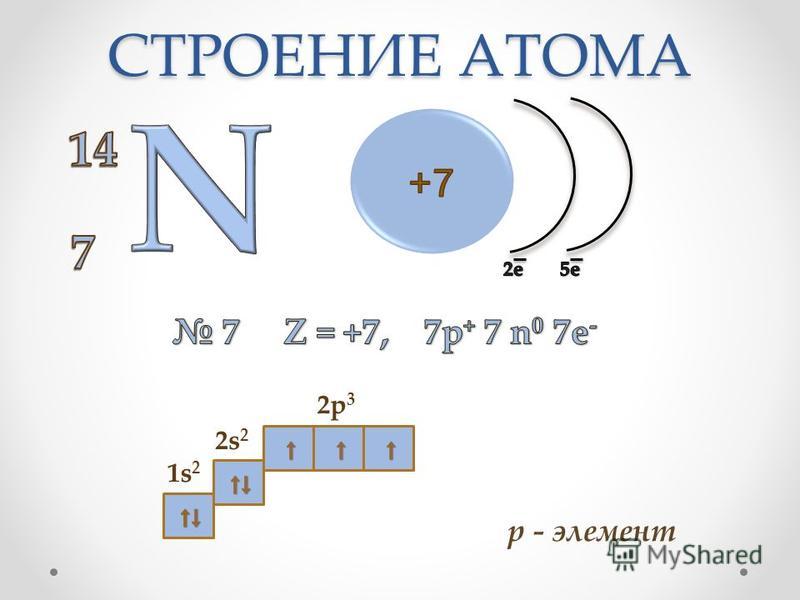
Вопрос 2.
Напишите две характеристики канальных лучей.
Ответ:
- Канальные лучи отклоняются магнитными полями в направлении, противоположном направлению катодных лучей.
- Они состоят из положительно заряженных частиц.
Вопрос 3.
Напишите электронную конфигурацию положительно заряженного иона натрия (Na + ).Атомный номер натрия равен 11.
Ответ:
Число электронов в атоме Na = Атомный номер = 11
Число электронов в ионе Na + = 11 – 1 = 10
Электронная конфигурация иона Na + : 2, 8
Вопрос 4.
Электронная конфигурация атома фосфора 2, 8, 5. Укажите электронную конфигурацию иона P 3-.
Ответ:
Электронная конфигурация P = 2, 8, 5
Атом P получает 3e – с образованием P 3-
∴ P 3- имеет конфигурацию = 2, 8, (5 + 3) = 2 , 8, 8
Вопрос 5.
Атомные номера Al и Cl равны 13 и 17 соответственно. Какое число электронов будет у Al 3+ и Cl – ?
Какое число электронов будет у Al 3+ и Cl – ?
Ответ:
Атомный номер Al = Число электронов = 13
Число электронов в Al 3+ = 13 – 3 = 10
Атомный номер хлора = Число электронов = 17
Число электронов в Cl – = 17 + 1 = 18
Вопрос 6.
Запишите электронное распределение атома хлора. Сколько электронов находится в L-оболочке? (Атомный номер хлора 17).[NCERT Exemplar]
Ответ:
Электронное распределение Cl: 2, 8, 7. L-оболочка имеет восемь электронов.
Вопрос 7.
Дайте определение валентным электронам. Какие электроны атома участвуют в образовании химической связи с другими атомами?
Ответ:
Электроны, присутствующие во внешней оболочке атома или иона, известны как валентные электроны.
В образовании химической связи принимают участие только валентные электроны атома.
Вопрос 8.
Почему гелий, неон и аргон имеют нулевую валентность? [NCERT Exemplar]
Ответ:
Гелий имеет два электрона в своей энергетической оболочке, в то время как аргон и неон имеют 8 электронов в своих валентных оболочках. Поскольку они имеют максимальное количество электронов на своих валентных оболочках, они не имеют тенденции к соединению с другими элементами. Следовательно, они имеют валентность, равную нулю.
Поскольку они имеют максимальное количество электронов на своих валентных оболочках, они не имеют тенденции к соединению с другими элементами. Следовательно, они имеют валентность, равную нулю.
Вопрос 9.
Атом гелия имеет 2 электрона на валентной оболочке, но его валентность не равна 2. Объясните. [NCERT Exemplar]
Ответ:
Атом гелия имеет 2 электрона в своей валентной оболочке, и его дуплет завершен. Следовательно, валентность равна нулю.
Вопрос 10.
Выясните валентность атомов, представленных на рис.{ 31 }{ X }\) [Пример NCERT]
Ответ:
Массовое число = Количество протонов + Количество нейтронов = 31
∴ Количество нейтронов = 31 – Количество протонов
= 31 – 15 = 16
Вопрос 13.
Почему изотопы проявляют схожие химические свойства?
Ответ:
Изотопы имеют одинаковые атомные номера и, следовательно, одинаковое количество электронов. Следовательно, они имеют одинаковую электронную конфигурацию, которая обеспечивает им сходные химические свойства.
Вопрос 14.
Элемент X имеет валентность 3(+):
а) Напишите формулу его фосфида.
б) Напишите формулу его карбоната.
Ответ:
(a) XP
(b) X 2 (CO 3 ) 3
Вопрос 15.
Элемент «Z» образует следующее соединение при взаимодействии с водородом, хлором, кислородом и фосфором.
ZH 3 , ZCl 3 , Z 2 O 3 и ZP
(a) Какова валентность элемента Z?
(6) Элемент «Z» — металл или неметалл?
Ответ:
(а) Валентность «Z» равна 3.
(b) Элемент «Z» является металлом, потому что он электроположителен и реагирует с неметаллами.
Структура класса Atom 9 Дополнительные вопросы Вопросы с краткими ответами-II
Вопрос 1.
Перечислите любые три отличительных признака между моделями атома, предложенными Дж.Дж. Томсон и Эрнест Резерфорд.
Ответ:
| Модель атома Дж. Дж. Томсона | Модель Резерфорда |
1. Положительный заряд образует ядро. Положительный заряд образует ядро. |
1. В центре находится ядро (положительный заряд). |
| 2. Электроны присутствуют во всем атоме. | 2. Электроны вращаются по орбитам. |
| 3. Пустых мест нет. | 3.Большая часть пространства пуста. |
Вопрос 2.
В эксперименте Гейгера и Марсдена с золотой фольгой, который проложил путь к модели атома Резерфорда, было обнаружено, что ~ 1,00% α-частиц отклоняются под углами > 50°. Если на золотую фольгу бомбардируется один моль а-частиц, вычислите число а-частиц, которые отклонятся на угол менее 50°.{23}\)
= 5,96 × 10 23
Вопрос 3.
Предскажите валентность следующих элементов:
(i) A (атомный номер 5)
(ii) B (атомный номер 12)
(iii) C (атомный номер 14)
(iv) D (атомный номер 17)
Ответ:
(i) Валентность элемента «А» = 8 – 5 = 3
(ii) Валентность элемента «В» = 12 – 10 = 2
(iii) Валентность элемента «С» = 14 – 10 = 4
(iv) Валентность элемента D = 18 – 17 = 1
Вопрос 4.
Элемент «Х» содержит 6 электронов в «М» оболочке в качестве валентных электронов:
(а) Каков атомный номер «Х»?
(b) Определите, является ли «X» металлом или неметаллом.
Ответ:
(a) Если ‘X’ содержит 6 электронов в оболочке ‘M’ в качестве валентных электронов, то электронная конфигурация ‘X’ будет K = 2, L = 8, M = 6
∴ Атомный номер = 16
б) «Х» — неметалл.
Вопрос 5.
Атомный номер лития равен 3. Его массовое число равно 7.
а) Сколько протонов и нейтронов содержится в атоме лития?
б) Нарисуйте схему атома лития.
Ответ:
(a) Количество нейтронов = массовое число – атомный номер
Количество нейтронов = 7 – 3 = 4
Количество протонов = атомный номер
∴ Количество протонов = 3
(b) Структура атома лития
Вопрос 6.
Заполните таблицу на основе информации, представленной в символах, приведенных ниже [NCERT Exemplar]
Ответ:
Вопрос 7.
В атоме элемента Z на внешней оболочке находится 5 электронов. Для этого требуется конфигурация благородного газа, принимая необходимое количество электронов, тогда каков будет заряд образовавшегося таким образом иона? Напишите формулу соединения, которое образуется при взаимодействии «Z» с атомом Na.
Для этого требуется конфигурация благородного газа, принимая необходимое количество электронов, тогда каков будет заряд образовавшегося таким образом иона? Напишите формулу соединения, которое образуется при взаимодействии «Z» с атомом Na.
Ответ:
Количество электронов на самой внешней оболочке = 5
Количество электронов, необходимых для создания конфигурации благородного газа = 8 – 5 = 3
Заряд образующегося при этом иона = Z + 3e –
= Z 3-
Валентность Z = 3
Химическая формула соединения:
Вопрос 8.{ 222 }{ Rn }\) — изотоп благородного газа радона. Сколько протонов, нейтронов и электронов содержится в одном атоме этого изотопа радона?
Ответ:
Атомный номер радона = 86
Число протонов = 86
Число электронов = Число протонов
= 86
Число нейтронов = Атомная масса – Атомный номер
= 222 – 86 = 136
Вопрос 9.
Какую информацию вы получаете из цифр об атомном номере, валентности атомов X, Y и Z? Дайте ответ в виде таблицы.
Ответ:
Вопрос 10.
Напишите молекулярные формулы следующих соединений:
(a) Бромид меди (II)
(b) Нитрат алюминия (III)
(c) Фосфат кальция (II)
(d) Сульфид железа (III)
(e) Хлорид ртути (II)
(f) Ацетат магния (II) [NCERT Exemplar]
Ответ:
(a) CuBr 2
(b) Al(NO 3 ) 3
(c ) Ca 3 (Po 4 ) 2
(D) Fe 2 S 3
(E) HGCl 2
(F) MG (CH 3 COO) 2
Вопрос 11.{3-}\)
Ответ:
CuCl 2 ; CuSO 4 ; Cu 3 (PO 4 ) 2
NaCl; Na 2 SO 4 ; Na 3 PO 4
FeCl 3 ; Fe 2 (SO 4 ) 3 ; FePO 4
Вопрос 12.
Напишите формулы соединений, образованных следующими ионами.
(a) Mg 2+ и S 2-
(b) Cu 2+ и OH
Назовите соединения, образующиеся в каждом случае.
Ответ:
(a) Ионы Mg 2+ S 2-
Валентности 2 2
Соединение: Mg 2 S 2 или MgS; Сульфат магния
(b) Ионы Cu 2+ OH –
Валентность 2 1
Соединение: Cu(OH) 2 ; Гидроксид меди (II).
Структура класса Atom 9 Дополнительные вопросы Вопросы с длинными ответами
Вопрос 1.
(i) Укажите метод определения валентности элемента, если известен его атомный номер.
(ii) Определите валентность следующих элементов, атомные номера которых указаны в скобках:
Хлор (17), Сера (16), Алюминий (13)
Ответ:
(i) Количество полученных электронов, потерянный или разделенный, чтобы сделать октет электронов (в самой внешней оболочке), дает нам непосредственно комбинирующую способность элемента, то есть валентность.
Вопрос 2.
Что такое эксперимент с золотой фольгой? Назовите ученого, проводившего этот эксперимент. Запишите выводы и недостатки модели атома Резерфорда.
Ответ:
В 1911 году Резерфорд провел эксперимент с золотой фольгой. Он бомбардировал потоком а-частиц золотую фольгу — тонкий лист толщиной 0,00006 см в вакуумной камере. А-частица — это положительно заряженный ион гелия (Не 2+ ). Упрощенная картина этого эксперимента показана на рисунке.
В этом знаменитом эксперименте были сделаны следующие наблюдения.
- Большинство а-частиц прошли прямо через фольгу без каких-либо отклонений.Это привело к выводу, что большая часть пространства внутри атома пуста.
- Несколько α-частиц отклонились на малый угол и несколько на больший угол. Это произошло за счет положительного заряда а-частицы и ядра (ядра) атома. Тяжелое положительно заряженное «ядро» было названо ядром.
- Количество отскочивших α-частиц было очень небольшим. Это привело к выводу, что объем ядра очень мал по сравнению с общим объемом атома.
На основании опыта с золотой фольгой Резерфорд пришел к выводу, что атом состоит из ядра, имеющего положительный заряд и окруженного электронами, которые движутся вокруг ядра. Число электронов и протонов равно и вся масса атома сосредоточена в его ядре.
Число электронов и протонов равно и вся масса атома сосредоточена в его ядре.
Недостатки модели Резерфорда
- Согласно классической электромагнитной теории, движущаяся заряженная частица, такая как электрон, под действием силы притяжения непрерывно теряет энергию в виде излучений. В результате этого электрон должен терять энергию и, следовательно, двигаться по еще меньшим орбитам, в конечном итоге попадая в ядро.Но коллапса не происходит. Объяснения такому поведению нет.
- Резерфорд не указал число орбит и число электронов на каждой орбите.
Вопрос 3.
Чем модель атома Резерфорда отличается от модели атома Томсона? [NCERT Exemplar]
Ответ:
Резерфорд предложил модель, в которой электроны вращаются вокруг ядра по четко определенным орбитам. В атоме есть положительно заряженный центр, называемый ядром.Он также предположил, что размер ядра очень мал по сравнению с размером атома и почти вся масса атома сосредоточена в ядре. Принимая во внимание, что Томсон предложил модель атома, подобную рождественскому пудингу.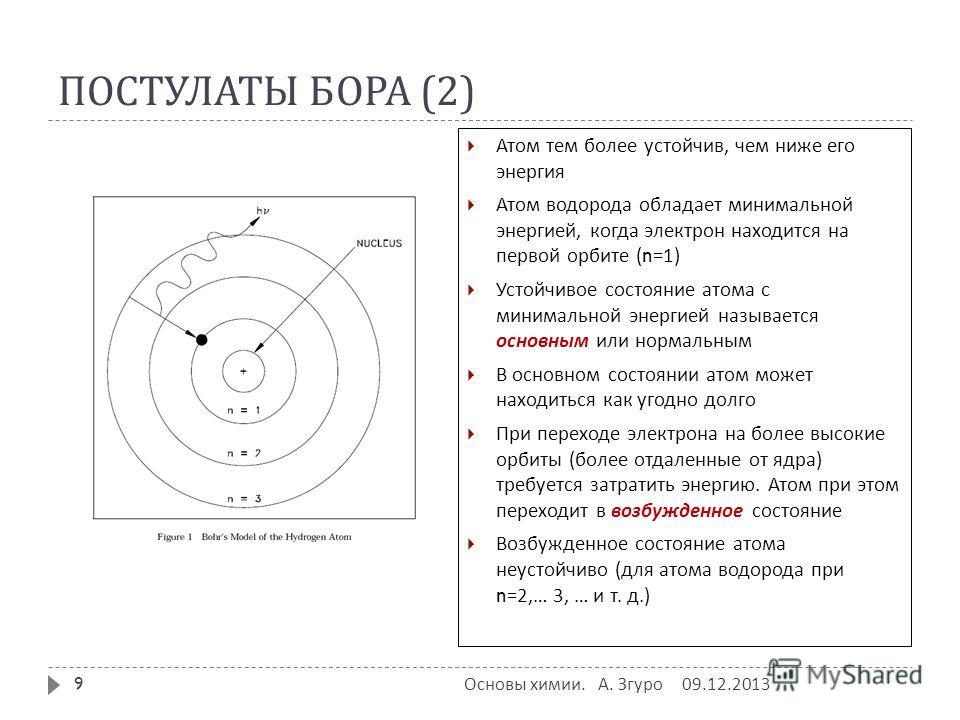 Электроны усеяны, как смородина, положительно заряженной сферой, подобной рождественскому пудингу, и предполагалось, что масса атома распределена равномерно.
Электроны усеяны, как смородина, положительно заряженной сферой, подобной рождественскому пудингу, и предполагалось, что масса атома распределена равномерно.
Вопрос 4.
Каковы постулаты боровской модели атома? [NCERT Exemplar]
Ответ:
Постулаты, выдвинутые Нильсом Бором о модели атома:
- Внутри атомов разрешены только определенные особые орбиты, известные как дискретные орбиты электронов.
- При вращении по дискретным орбитам электроны не излучают энергию. Эти орбиты называются энергетическими уровнями. Энергетические уровни в атоме показаны кружками.
Эти орбиты обозначаются буквами K, L, M, N, … или числами n = 1, 2, 3, 4, ………..
Вопрос 5.
Отношение радиусов атома водорода и его ядра составляет ~10 5 . Предполагая, что атом и ядро имеют сферическую форму,
(i) каково будет отношение их размеров?
(ii) Если атом представлен планетой Земля ‘R e ’ = 6.4 × 10 6 м. Оцените размер ядра. [Пример NCERT]
[Пример NCERT]
Ответ:
(i) Объем сферы = \(\frac{4}{3}\) πr 3
Пусть R — радиус атома, а r — радиус ядра.
Вопрос 6.
Изобразите схематически распределение электронов в атоме натрия и ионе натрия, а также укажите их атомные номера. [NCERT Exemplar] Ответ:
Поскольку атомный номер натрия равен 11, он имеет 11 электронов. Положительно заряженный ион натрия (Na + ) образуется при отрыве одного электрона от атома натрия.Итак, ион натрия имеет 11 – 1 = 10 электронов. Таким образом, электронное распределение иона натрия будет 2, 8. Атомный номер элемента равен числу протонов в его атоме. Так как атом натрия и ион натрия содержат одинаковое количество протонов, то их атомный номер равен 11.
Вопрос 7.
На данном рисунке изображена атомная структура атома элемента «Х».
Запишите следующую информацию об элементе «X».
(a) Атомный номер «X»
(b) Атомная масса «X»
(c) Валентные электроны
(d) Валентность «X»
(e) «X» должен быть металлом или неметаллом .
Ответ:
(a) Атомный номер = количество протонов = 8
(ib) Атомная масса = количество протонов + количество нейтронов
= 8 + 10 = 18 u
(c) Валентные электроны = 6
(d) Валентность из ‘X’ = 8 – 6 = 2
(e) ‘X’ должен быть неметаллом, потому что имеется шесть валентных электронов, следовательно, потребуется еще два электрона, чтобы завершить его внешнюю оболочку.
Структура дополнительных вопросов класса 9 HOTS (навыки мышления высшего порядка)
Вопрос 1.
Один электрон находится на внешней оболочке атома элемента «Z».
(а) Какова будет природа этого элемента?
(б) Какова будет величина заряда образовавшегося иона, если этот электрон удалить с внешней оболочки?
Ответ:
(а) Элемент «Z» будет металлом, потому что у него есть только один электрон на внешней оболочке, поэтому он электроположителен.
(b) После потери одного электрона «Z» приобретет один положительный заряд.
Z → Z + + 1 e –
Вопрос 2.
Состав ядер двух видов атомов «X» и «Y» приведен ниже:
Укажите массовые числа «X» и «Y».Какова связь между двумя видами?
Ответ:
(i) Атомная масса элемента «X» = количество протонов + количество нейтронов
= 8 + 8 = 16 u
(ii) Атомная масса элемента «Y» = количество нейтронов + количество протонов
= 10 + 8 = 18 u
Связь между X и Y: Атомный номер обоих элементов одинаков, но их атомные массы различны. Следовательно, они являются изотопами друг друга.
Вопрос 3.
Атом «М» элемента реагирует с кислородом с образованием М 2 O 3 .Рассчитайте валентность элемента «М».
Ответ:
Два атома элемента «М» соединяются с 3 атомами кислорода.
∴ Количество атомов кислорода, связанных с одним атомом элемента ‘M’ = \(\frac{3}{2}\)
Следовательно, валентность элемента ‘M’ = \(\frac{3}{2}\ ) × 2 = 3
Вопрос 4.
Заполните следующие пропуски в данной таблице:
Ответ:
Мы знаем, что число протонов = атомному номеру
Число протонов = числу электронов
Массовое число = числу протонов + числу нейтронов
Используя эти отношения, мы можем заполнить эти пробелы следующим образом:
Вопрос 5. {37} \mathrm{Cl}\).
{37} \mathrm{Cl}\).
Следовательно, относительная атомная масса хлора = \(\frac{3}{4} \times 35+\frac{1}{4} \times 37\)
= 35,5 u
Вопрос 6.
Элемент «X» имеет массовое число 4 и атомный номер 2. Напишите валентность этого элемента. Будет ли он реагировать с другими атомами других элементов? [NCERT Exemplar]
Ответ:
Мы знаем, что только валентные электроны принимают участие в образовании связи с различными атомами. В атоме элемента «Х» всего два электрона, так как атомный номер равен 2.{-31}}\) × 10 -3 электрона
= 1,098 × 10 27 электрона.
Дополнительные вопросы для класса 9 по естественным наукам
ПЛАН УРОКАATOMS – ПОЛНЫЙ УРОК НАУКИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА ОБУЧЕНИЯ 5E
В конце этого плана урока по атомам учащиеся смогут описать структуру атомов, включая массы, электрические заряды и расположение протонов, нейтронов , и электроны. Кроме того, учащиеся смогут определить, что протоны определяют идентичность элемента. Каждый урок разработан с использованием метода обучения 5E, чтобы обеспечить максимальное понимание учащимися.
Каждый урок разработан с использованием метода обучения 5E, чтобы обеспечить максимальное понимание учащимися.
Следующий пост проведет вас через каждый из шагов и действий из плана урока по атомам.
ЗАЯВЛЕНИЕ
Цель Введение
В начале урока класс проводит «Подумай-пары-поделись», чтобы обсудить цель.
Классовая активность
Спросите класс (используйте PowerPoint, чтобы показать вопросы):
- Какая самая маленькая часть материи?
- Что такое атом?
- Какие три основные части атома?
- Где эти части расположены в атоме?
- Что означает, если атомная частица имеет электрический заряд?
Деятельность учащихся
Используя шаблон модели Бора, включая PowerPoint, и конфеты трех разных цветов, попросите учащихся сделать модель этих атомов.Присвойте код протонам, нейтронам и электронам:
- Водород
- Гелий
- Литий
- Бериллий
- Борон – (Дебил)
Работая с этими моделями атомов, спросите учащихся, стали ли они замечать закономерности.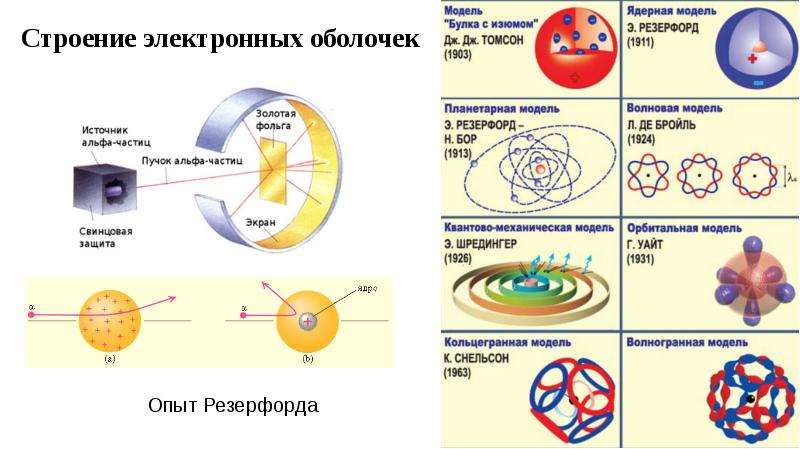 Кроме того, введите атомную массу. Студенты будут практиковаться во время лабораторной станции, так что это нормально, если они не уверены после этого занятия.
Кроме того, введите атомную массу. Студенты будут практиковаться во время лабораторной станции, так что это нормально, если они не уверены после этого занятия.
Учитель поможет развеять любые заблуждения об атомах.Основное заблуждение состоит в том, что студенты могут думать, что атомы двумерны, используя эту модель.
Расчетное время занятия: 20-30 минут
РАЗВЕДКА
Эта студенческая лаборатория создана для того, чтобы студенты могли начать исследовать кислоты и основания. Четыре станции считаются входными станциями, где учащиеся узнают новую информацию о естественном отборе, а четыре станции являются выходными станциями, где учащиеся будут демонстрировать свое мастерство в отношении входных станций.Каждая из станций дифференцирована, чтобы бросить вызов учащимся, использующим другой стиль обучения. Вы можете прочитать больше о том, как я создал лабораторию станции здесь.
ИССЛЕДУЙ!
Учащиеся будут работать в парах над созданием моделей атомов с использованием шаблона Бора.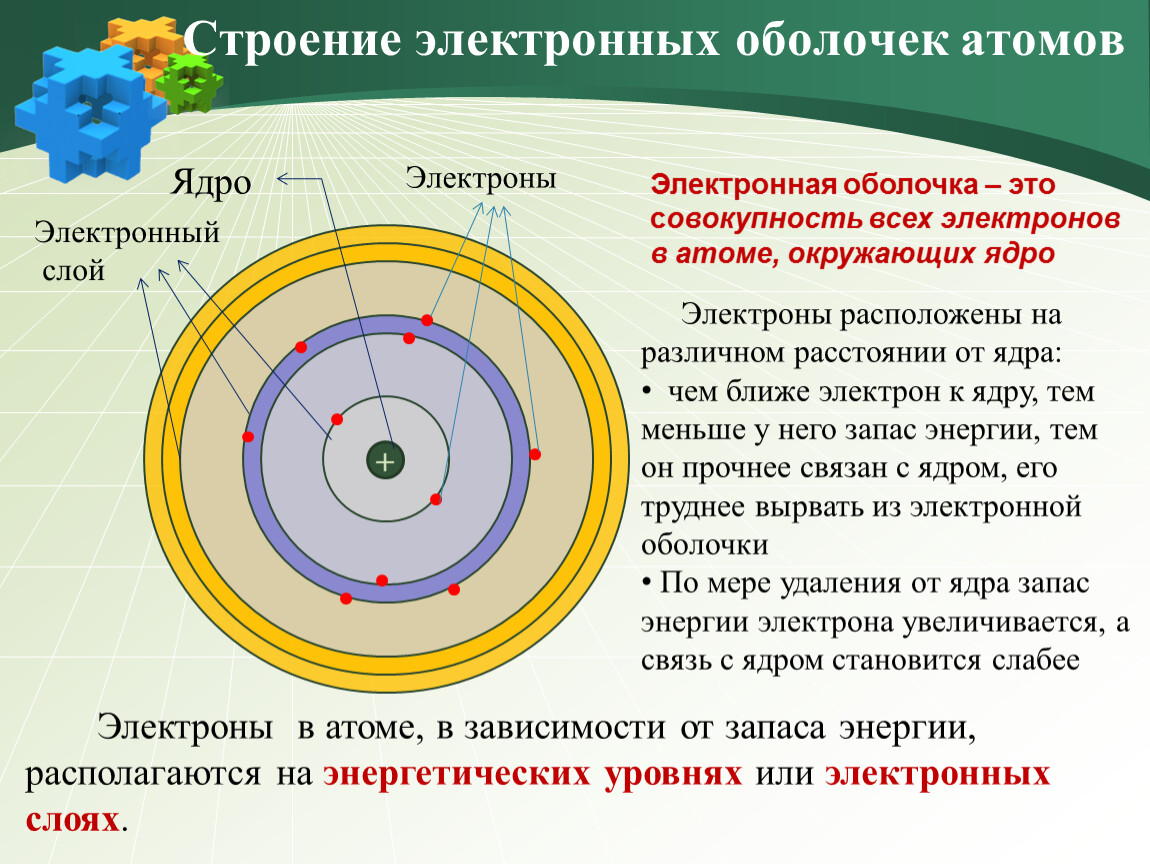 Студенты должны будут следовать указаниям на карточках с заданиями и, используя маленькие квадраты, представляющие субатомные частицы (протоны, нейтроны и электроны), создавать определенные атомы. Карточки также информируют учащихся о зарядах каждой субатомной частицы.
Студенты должны будут следовать указаниям на карточках с заданиями и, используя маленькие квадраты, представляющие субатомные частицы (протоны, нейтроны и электроны), создавать определенные атомы. Карточки также информируют учащихся о зарядах каждой субатомной частицы.
ПОСМОТРЕТЬ!
На этой станции учащиеся будут смотреть видео с описанием атомов. Затем учащиеся ответят на некоторые вопросы, относящиеся к видео, и запишут свои ответы на листе лабораторной станции. Например, что такое атом? Что находится в центре атома? Какие две субатомные частицы составляют центр атома? Какой заряд имеют протонов, нейтронов, и электронов ?
ИССЛЕДУЙТЕ!
Исследовательская станция позволит учащимся взаимодействовать с создателем виртуального атома с помощью веб-сайта PhET.Учащиеся будут следовать указаниям на карточках с заданиями, чтобы создать атомы на основе указанного количества протонов, нейтронов и электронов. Студенты должны будут построить и идентифицировать атом. Когда учащиеся строят случайный атом, они обнаружат, какая субатомная частица определяет идентичность атома.
Когда учащиеся строят случайный атом, они обнаружат, какая субатомная частица определяет идентичность атома.
ПРОЧИТАЙТЕ ЭТО!
Эта станция предоставит учащимся одностраничное чтение об атомной структуре. При чтении учащиеся узнают, что атом является наименьшей единицей материи.Они узнают об основной структуре атома. Студенты узнают о зарядах каждой из частей, протонов, нейтронов, электронов. Есть 4 дополнительных вопроса, на которые учащиеся должны ответить, чтобы продемонстрировать понимание прочитанного предмета.
ОЦЕНИТЕ ЭТО!
Станция оценки — это место, куда учащиеся доказывают свое мастерство в изучении концепций, изученных в лаборатории. Вопросы составлены в стандартном формате с несколькими вариантами ответов. Некоторые вопросы будут заданы учащимся: Определите правильное утверждение из 4 четырех вариантов, в которых говорится об атомах.Какую роль играют электроны в атоме? Какие из следующих субатомных частиц определяют идентичность атома? Сколько электронов в литии?
НАПИШИ ЭТО!
Учащиеся, которые могут ответить на открытые вопросы о лабораторной работе, действительно понимают изучаемые концепции. На этой станции учащиеся будут отвечать на три карточки с заданиями, чтобы объяснить разницу между протонами, нейтронами и электронами. Опишите ядро атома. Какая субатомная частица определяет сущность атома?
На этой станции учащиеся будут отвечать на три карточки с заданиями, чтобы объяснить разницу между протонами, нейтронами и электронами. Опишите ядро атома. Какая субатомная частица определяет сущность атома?
ИЛЛЮСТРАЦИЯ!
Эта станция понравится вашим ученикам-зрителям.Учащиеся воссоздадут атом кислорода на своем лабораторном листе. Затем учащиеся должны будут обозначить все, что касается их модели.
ОРГАНИЗУЙТЕ ЭТО!
Станция организации позволяет вашим учащимся размещать карточки в правильном столбце и строке, описывающих расположение, заряд и размер протонов, нейтронов и электронов.
Расчетное время занятий для исследования: 1-2, 45-минутные уроки
ПОЯСНЕНИЕ
Занятия по объяснению станут намного более увлекательными для класса, как только они закончат лабораторию исследовательской станции.Во время пояснительной части учитель будет устранять любые неправильные представления об атомах с помощью интерактивной PowerPoint, опорных диаграмм и интерактивных заданий в тетради.
Урок по атомам включает в себя PowerPoint с разбросанными по всему тексту заданиями, чтобы заинтересовать учащихся.
Студенты также будут взаимодействовать со своими журналами, используя шаблоны INB для атомов. Каждое задание INB предназначено для того, чтобы помочь учащимся разделить информацию для лучшего понимания концепции.Шаблоны INB атомов позволяют учащимся сосредоточить свои заметки на определении описаний и зарядов каждой субатомной частицы. Кроме того, шаблоны INB помогут учащимся понять информацию, представленную в химическом символе, и как определить атомную массу и количество протонов и электронов из символа, используя аббревиатуры APE-MAN.
Расчетное время занятий для исследования: 2-3, 45-минутные уроки
РАЗРАБОТКА
Уточняющий раздел метода обучения 5E предназначен для того, чтобы дать учащимся выбор того, как они могут доказать свое владение концепцией.Когда учащимся предоставляется выбор, «покупка» намного выше, чем когда учитель сообщает им проект, который им предстоит создать. Уточняющий проект позволит учащимся создать презентацию об атомах.
Уточняющий проект позволит учащимся создать презентацию об атомах.
Расчетное время занятий для проработки: 2-3 урока по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E предназначена для оценки понимания учащимися. В каждый урок 5E входит домашнее задание, оценивание и модифицированное оценивание.Исследования показали, что домашняя работа должна быть значимой и применимой к реальной деятельности, чтобы быть эффективной. Когда это возможно, я предпочитаю давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Приблизительное время занятий для оценки: 1, 45 минут занятия
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полный урок доступен для скачивания в моем магазине TpT. Сэкономьте себе массу времени и возьмите его сейчас.
|
Учащиеся, демонстрирующие понимание, могут:
|

 Химия, 8–9 класс: уроки, тесты, задания.
Химия, 8–9 класс: уроки, тесты, задания.  Жиры, белки, углеводы» онлайн (71 вопрос)
Жиры, белки, углеводы» онлайн (71 вопрос) Химическое загрязнение окружающей среды. Полимеры» онлайн (71 вопрос)
Химическое загрязнение окружающей среды. Полимеры» онлайн (71 вопрос) Механизмы реакций» онлайн (70 вопросов)
Механизмы реакций» онлайн (70 вопросов) )» онлайн (1361 вопрос)
)» онлайн (1361 вопрос)
 {-19}}C$
{-19}}C$  {2}}=18$ (n=3) и так далее.
{2}}=18$ (n=3) и так далее.  {14}C$.{40} тыс. $. Общее число нейтронов одинаково в атомах.
{14}C$.{40} тыс. $. Общее число нейтронов одинаково в атомах. 
