Окислительно-восстановительные реакции в органической химии
1. ОВР в органической химии
ОВР в органическойхимии
2. Цель работы:
Цель работы:изучить и показать
применение окислительно
восстановительных реакций в
органической химии.
3. Содержание
• Степень окисления в органической химии
• Метод электронного баланса
• Метод полуреакций
• Вывод
• Список используемой литературы
4. Степень окисления в органической химии
Степень окисления ворганической химии
• В неорганической химии степень
окисления – одно из основных
понятий, в органической химии –
нет.
• Для органической химии важна не
степень окисления атома, а смещение
электронной плотности, в результате
которого на атомах появляются
частичные заряды, никак не
согласующиеся со значениями
степеней окисления.
6. Метод электронного баланса
Метод электронногобаланса
• При составлении уравнений ОВР,
протекающих с участием органических
веществ, в простейших случаях можно
применить степень окисления.

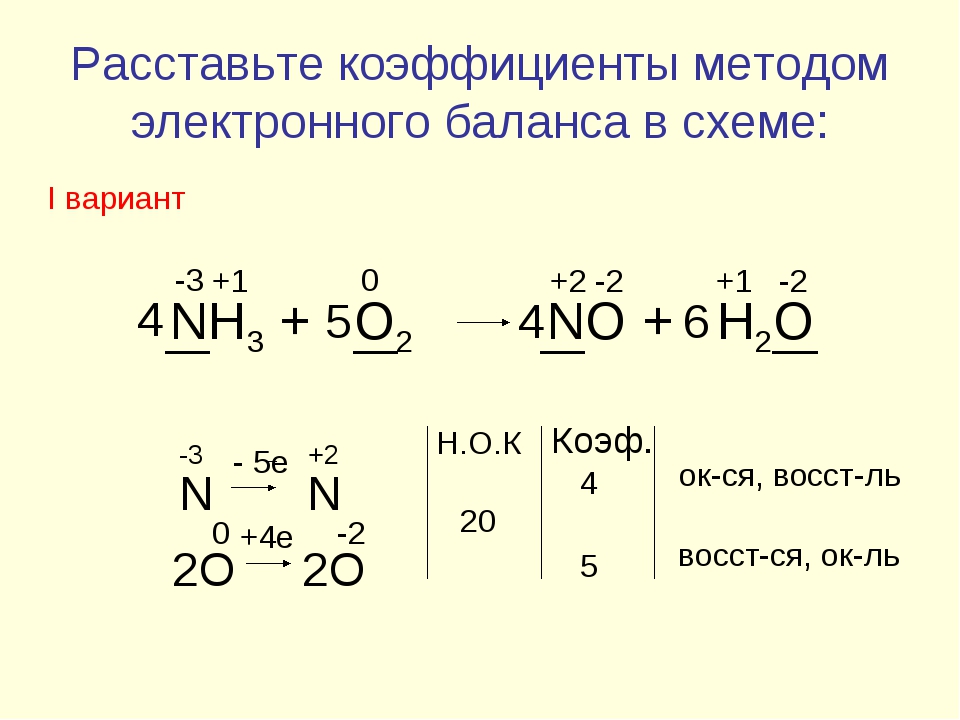
Ch4Ch3OH+ KMnO4 = Ch4 COOK + MnO2 + KOH + h3O
Определяем степени окисления элементов
C 3 H
+1
3 C
1
H+12O2H+1+ K+1Mn+7O24 = C3H+13 – C+3O2O2K+1
+Mn+4O22 + K+1O2H+1 + H+12O2
Составляем электронные уравнения,
выражающие процессы отдачи и
присоединения электронов, и найдем
коэффициенты при восстановителе и
окислителе:
C1 4ē = C+3 (процесс окисления) 3
Mn+7 + 3ē =Mn+4(процесс восстановления)4
Числа 3 и 4 в электронных уравнениях
справа от вертикальной черты и
являются коэффициентами в уравнении
реакции.
В левой части уравнения пишем
исходные вещества с найденными
коэффициентами, а в правой – формулы
образующихся веществ с
соответствующими коэффициентами.
3Ch4Ch3OH+ 4KMnO4 = 3Ch4 COOK +
4MnO2 + KOH + 4h3O
10. Метод полуреакций
Метод полуреакцийC6h22O6+KMnO4+h3SO4=CO2+MnSO4+K2SO4+h3O
1. Расписываем все растворимые вещества на
ионы.

C6h22O6+K++MnO4+2H++SO42=
=CO2+Mn2++SO42+2K++SO42+h3O
2. Выпишем отдельно ионы, которые в
результате реакции претерпели изменения, и
ионы, определяющие среду
C6h22O6 +MnO4+2H+= CO2+Mn2++h3O
3. Надо разобраться в процессах,
происшедших с ионами. Кислород,
очевидно, отщепился от воды.
C6h22O6 +6h3O=6CO2+24H+
Посчитать заряды левой и правой частей
схемы:
C6h22O6 +6h3O=6CO2+24H+
0 +24
Они различны. Это связано с переходом
электронов.
C6h22O6 +6h3O24e=6CO2+24H+
• Рассмотрим, что произошло с ионом MnO4. Он
превратился в Mn2+, т.е. полностью потерял 4
атома кислорода. Они будут связаны ионами
водорода, которых в кислой среде избыток:
Для того чтобы связать четыре атома кислорода
в молекулах воды, требуется 8 ионов H+:
MnO4+8H+=Mn2++4h3O
Посчитаем заряды левой и правой частей схемы:
MnO4+8H+=Mn2++4h3O
+7 +2
MnO4+8H++5e=Mn2++4h3O
Изменение заряда системы от +7 до +2 связано
с принятием 5 электронов (восстановление).

Электроны принял ион MnO4. Этот ион
является окислителем.
5. Итак, мы получили два электронноионных
уравнения. Запишем их вместе:
MnO4+8H++5e=Mn2++4h3O
24
C6h22O6 +6h3O24e=6CO2+24H+
5
Уравниваем число отданных и принятых
электронов, найдя доп. множители. Теперь
Умножаем каждое уравнение на свой множите
и одновременно складываем их. Получаем:
5C6h22O6+24MnO4+30h3O+192 H+ =
=30CO2+24Mn2++120H+ +96h3O
Найдя коэффициенты перед ионами, ставим их
в молекулярное уравнение:
5C6h22O6+24MnO4+72 H+ =
=30CO2+24Mn2++66h3O
Найденные коэффициенты подставляем в
исходное уравнение:
5C6h22O6+24KMnO4+36h3SO4=
=30CO2+24MnSO4+12K2SO4+66h3O
15. Преимущества метода полуреакций
Преимущества методаполуреакций
1.Рассматриваются реально существующие ионы:
MnO4; Mn2+, и вещества C6h22O6; CO2;
2.Не нужно знать все получающиеся вещества, они
появляются при его выводе.

3.При использовании этого метода нет необходимости
определять степени окисления атомов отдельных
элементов, что особенно важно в случае ОВР,
протекающих с участием органических соединений,
для которых подчас очень сложно сделать это.
4.Этот метод дает не только сведения о числе
электронов, участвующих в каждой полуреакции, но
и о том, как изменяется среда.
смысл протекающих процессов и позволяют делать
определенные предположения о строении продуктов
реакции.
16. Список использованной литературы.
Список использованнойлитературы.
1.
2.
Н.Б. Сухоржевская. Применение метода
полуреакций в органической
химии..//Приложение к газете «Первое
сентября», Химия.№20,1996г.
Г.М. Чернобельская, И.Н. Чертков Химия,
«Учебная литература для медицинских
училищ». М.: Медицина, 1986г.
Окислительно-восстановительные реакции.
 Готовимся к ЕГЭ
Готовимся к ЕГЭ
1. Готовимся к ЕГЭ
Окислительновосстановительныереакции
Из опыта работы учителя химии «МОУ СОШ № 73»
г. Оренбурга Кочулевой Л. Р.
2. Окислительно-восстановительные реакции (ОВР) —
Окислительновосстановительные реакции(ОВР) – химические реакции, в
которых происходит
изменение степеней
окисления атомов,
входящих в состав
реагирующих веществ.
3. Степень окисления
Степень окисления атомов элементовпростых веществ равна нулю
Степень окисления водорода в
соединениях +1, кроме гидридов
Степень окисления кислорода в
соединениях -2, кроме пероксидов и
соединений с фтором
Сумма всех степеней окисления атомов
в соединении равна нулю
Сумма всех степеней окисления атомов
в ионе равна значению заряда иона
Mgº, Cl2º, O2º
+1
+1
-1
HCl, h3O, NaH
-2
-1
+2
h3O, Н2О2, OF2
+1 +6 -2
h3SO4
2(+1)+6+4(-2)=0
+6 -2
SO4
6+4(-2)=-2
4.
 Распознавание уравнений ОВР Запишите значения степеней окисления атомов
Распознавание уравнений ОВР Запишите значения степеней окисления атомоввсех элементов в уравнении реакции
Определите изменяется ли степень окисления
атомов элементов.
+2 -2
+1 -1
+2 -1
+1 -2
PbO + 2HCl → PbCl2 + h3O
Степень окисления не изменяется => реакция не окислительновосстановительная
+4 -2
+1 -1
+2 -1
0
+1
-2
PbO2 + 2HCl → PbCl2 + Cl2 + 2h3O
Степень окисления изменяется => реакция окислительно-восстановительная
5. Распознавание окислителя и восстановителя
+4 -20
SO2 + 2h3S → 3S + 2h3O
+4
SO2
окислитель
4
3
2
1
0
-1
-2
h3S
восстановитель
6. Метод электронного баланса
+4 -2+1
0
-2
SO2 + 2h3S → 3S + 2h3O
+4
0
S →S
_
+4
0
S +4 e → S
1
_
+4 → 0
взял e – восстановление
+4 +(-4)=0
-2
0
S →S
-2 → 0
-2 — (-2)=0
_
-2
0
S–2e→S
_
отдал e – окисление
2
7.
 Влияние среды на характер протекания реакции +
Влияние среды на характер протекания реакции +H
2+
Mn
+7
Mn
h3O
MnO2↓
_
(MnO4)
+4
—
OH
+6
Mn
2-
(MnO4)
8. Используя метод электронного баланса, составьте уравнение реакции: FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Степень окисления Mn изменяетсяот +7 до +6 в щелочной среде!
FeSO4 окисляется в щелочной среде
до Fe(OH)3
FeSO4+KMnO4+3KOH→ Fe(OH)3
+K2SO4+K2MnO4
FeSO4 – восстановитель, KMnO4 –
окислитель
9. Используя метод электронного баланса, составьте уравнение pеакции: Zn+KMnO4+…→…+K2SO4+MnSO4 +Н2О
Степень окисления Mn изменяется от+7 до +2 в кислой среде!
Электронный баланс:
Mn+7 + 5e- → Mn+2 2
Zn0 – 2e- → Zn+2
5
5Zn+2KMnO4+8h3SO4→5ZnSO4 +
+K2SO4+2MnSO4 +8Н2О
10. Используя метод электронного баланса, составьте уравнение реакции: K2SO3+KMnO4+…→…+MnO2 +…
Степень окисления Mn изменяетсяот +7 до +4 в нейтральной среде!
Электронный баланс:
Mn+7 + 3e- → Mn+4 2
S+4 – 2e- → S+6
3
3K2SO3+2KMnO4+h3O→3K2SO4+2MnO2
+2KОH
11.
 Влияние среды на характер протекания реакции +
Влияние среды на характер протекания реакции +H
Cr
+6
Cr
3+
h3O
Cr(OH)3↓
2-
(Cr2O7 )
2-
(CrO4)
—
OH
[Cr(OH)6]3-
12. Используя метод электронного баланса, составьте уравнение pеакции: h3S+K2Cr2O7+…→…+Cr2(SO4)3+…+h3O
Соли Cr(III) образуются в кислойсреде!
Электронный баланс:
2Cr+6 + 6e- →2Cr+3 1
S-2 – 2e- → S0
3
3h3S+K2Cr2O7+4h3SO4 →
3S ↓ +Cr2(SO4)3+K2SO4+7h3O
13. Используя метод электронного баланса, составьте уравнение pеакции: h3S+K2CrO4+…→…+Cr(OH)3 ↓ +KOH
Гидроксид хрома(III) образуется внейтральной среде.
Электронный баланс:
Cr+6 +3e- →Cr+3
2
S-2 – 2e- → S0
3
3h3S+2K2CrO4+2h3O →3S↓ +2Cr(OH)3 ↓
+4KOH
14. Используя метод электронного баланса, составьте уравнение pеакции: K2CrO4+h3O2+…→K3[Cr(OH)6]+O2↑+…
Комплексный анион [Cr(OH)6]3образуется в щелочной среде.Электронный баланс:
Cr+6 +3e- →Cr+3
2
2O-1 – 2e- → O2
2K2CrO4+3h3O2+2KOH+2h3O
→2K3[Cr(OH)6]+3O2↑
Т.
 к. в правой части уравнения в составе гидроксокомплекса содержится уже
к. в правой части уравнения в составе гидроксокомплекса содержится уже6 атомов водорода, вода переносится в левую часть уравнения.
15. Используя метод электронного баланса, составьте уравнение pеакции: NaCrO2+…+NaOH→…+NaBr +h3O
Соединения хрома(III) при окислении в щелочной средеобразуют хроматы (CrO42-). Степень окисления хрома
увеличивается от +3 до +6, следовательно NaCrO2
является восстановителем, а окислителем будет служить
Br2, степень окисления которого снижается от 0 до -1.
Электронный баланс:
Cr+3-3e-→ Cr+6 2
Br2+2e-→2Br- 3
2NaCrO2+3Br2+8NaOH→2 Na2 CrO4+6NaBr +4h3O
16. ОВР азотной кислоты
17. ОВР азотной кислоты
0+5
+2
+1
4Ca + 10HNO3(конц.) → 4Ca(NO3)2 + N2O + 5h3O
0
_
+2
Ca – 2 e → Ca
+5
_
+1
2N + 8 e → 2N
4
1
Ca – восстановитель
HNO3 – окислитель
0
+5
+2
+4
Cu + 4HNO3(конц.)→Cu(NO3)2 +2NO2 + 2h3O
18.
 ОВР азотной кислоты S0 + 6HNO3(конц) = h3S+6O4 + 6NO2 + 2h3O
ОВР азотной кислоты S0 + 6HNO3(конц) = h3S+6O4 + 6NO2 + 2h3OB0 + 3HNO3 (конц)= h4B+3O3 + 3NO2
3P0 + 5HNO3 + 2h3O = 5NO + 3h4P+5O4
P0 + 5HNO3 (конц) = 5NO2 + h4P+5O4+h3O
19. ОВР азотной кислоты
+2 -1+5
+3
+6
+4
FeS2 + 18HNO3(конц.)→Fe(NO3)3+2h3SO4+15NO2+7h3O
+2
_
+3
Fe – 1 e → Fe
-1
_
+6
_
– 15 e
1
2S – 14 e → 2S
+5
_
+4
N+ e→N
FeS2 – восстановитель
HNO3 – окислитель
15
20. ОВР с участием органических соединений
Окисление алкенов в нейтральной среде:C2h5 + 2KMnO4 + 2h3O→ Ch3OH–Ch3OH +
2MnO2 + 2KOH
Окисление алкенов в кислой среде:
Ch4CH=Ch3 +2KMnO4 +3h3SO4
→Ch4COOH +CO2 +2MnSO4 +K2SO4 +4h3O
Окисление алкенов в щелочной среде:
Ch4CH=Ch3 + 10KMnO4 + 13KOH→ Ch4COOK +
K2CO3 + 8h3O + 10K2MnO4
21. Окисление алкинов
в нейтральной среде:3CH≡CH +8KMnO4→3KOOC – COOK +8MnO2
+2КОН +2Н2О
2C-1 – 8e- → 2C+3
3
Mn+7 +3e- →Mn+4
8
5CH≡CH +8KMnO4 +12h3SO4 →5HOOC– COOH
+8MnSO4 +4К2SO4 +12Н2О
CH≡CH + 2KMnO4 +3h3SO4 =2CO2 + 2MnSO4
+ 4H O + K SO
22.
 Окисление гомологов бензола H
Окисление гомологов бензола H↓-3
H→C ←H
|
O
+3
C
|
+7
5
+2
+ 6KMnO4 + 9h3SO4 → 5
восстано- окисливитель
тель
-3
_
+3
С–6e→C
+7
_
O–H
среда
5
+2
Mn + 5 e → Mn
6
+ 6MnSO4 + 3K2SO4 +4h3O
23. Окисление гомологов бензола
Обратите внимание, что только α-углеродныеатомы (непосредственно связанные с бензольным
кольцом) окисляются до карбоксильных групп,
остальные атомы углерода – до углекислого газа.
5C6H5-Ch3Ch4 + 12KMnO4+18h3SO4→
→5С6Н5СООН+CO2+12MnSO4 +6K2SO4 +28h3O
C-2 -5e- →C+3
5
C-3 -7e- →C+4
Mn+7 +5e-→Mn+2 12
24. Окисление стирола
В нейтральной среде:3C6H5-CH =Ch3+2 KMnO4+ h3O→
3C6H5-CH(OH) -Ch3(OH)+2MnO2+2KOH
В кислой среде:
C6H5-CH=Ch3 +2KMnO4+3h3SO4→
С6Н5СООН+CO2+2MnSO4 +K2SO4 +h3O
25. Окисление спиртов
3C2H5OH + K2Cr2O7 + 4h3SO4 = 3Ch4CHO +K2SO4 + Cr2(SO4)3 + 7h3O
3СН2(ОН) – СН2(ОН) + 8КMnO4→
3KOOC – COOK +8MnO2 +2КОН +8Н2О
5СН2(ОН) – СН2(ОН) + 8КMnO4-+12h3SO4→
→5HOOC – COOH +8MnSO4 +4К2SO4 +22Н2О
26.
 Окисление альдегидов 3Ch4CH=O + 2KMnO4 = Ch4COOH +
Окисление альдегидов 3Ch4CH=O + 2KMnO4 = Ch4COOH ++ 2Ch4COOK + 2MnO2 + h3O
3Ch4CH=O + K2Cr2O7 + 4h3SO4 =
= 3Ch4COOH + Cr2(SO4)3 + 7h3O
3СН2О + 2K2Cr2O7 + 8h3SO4 =
= 3CO2 +2K2SO4 + 2Cr2(SO4)3 + 11h3O
27. Окисление карбоновых кислот
НСООН + HgCl2 =CO2 + Hg + 2HClHCOOH+ Cl2 = CO2 +2HCl
HOOC-COOH+ Cl2 =2CO2 +2HCl
28. Список источников и литературы
Список источников илитературы
1. Ахлебинин А.К., Нифантьев Э.Е., Анфилов К.Л.
Органическая химия. Решение качественных задач. – М.:
Айрис-пресс, 2006
2. Габриелян О.С. Химия: пособие для школьников старших
классов и поступающих в вузы. – М.: Дрофа, 2006
3. Слета Л.А. Химия: Справочник. – Харьков: Фолио; М.:
ООО «Издательство АСТ», 2000
4. Новошинский И.И., Новошинская Н.С. Переходные
металлы. – Краснодар: «Советская Кубань», 2006
4.http://www1.ege.edu.ru/
5. http://www.it-n.ru (сообщества «Химоза» и «Подготовка
к ЕГЭ по химии»)
Классификация химических реакций, с примерами
Наиболее часто под химическими реакциями
понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы, число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения, а формулы продуктов – в правой. Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой химической реакции будет выглядеть следующим образом:
A + B (+D) = C
Например:
СаСО3 + СО2 + Н2О = Са(НСО3)2
SO3 + H2O = H2SO4
2Mg + O2 = 2MgO.
2FеСl2 + Сl2 = 2FеСl3
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции
чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция
соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения. В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
A= B+ C + D
Например:
CaCO3CaO + CO2 ↑ (1)
2H2O =2H2 ↑+ O2↑ (2)
CuSO4 × 5H2O = CuSO4 + 5H2O (3)
Cu(OH)2 = CuO + H2O (4)
H2SiO3 = SiO2 + H2O (5)
2SO3 =2SO2 + O2 ↑ (6)
(NH4)2Cr2O7 = Cr2O3 + N2↑ +4H2O (7)
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
С18H38 = С9H18 + С9H20 (8)
C4H10 = C4H6 + 2H2 ↑ (9)
При реакциях замещения простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение химической реакции замещения будет выглядеть следующим образом:
A + BC = AB + C
Например:
2Аl + Fe2O3 = 2Fе + Аl2О3 (1)
Zn + 2НСl = ZnСl2 + Н2 (2)
2КВr + Сl2 = 2КСl + Вr2 (3)
2КСlO3 + l2 = 2KlO3 + Сl2 (4)
СаСО3+ SiO2 = СаSiO3 + СО2 (5)
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5 (6)
СН4 + Сl2 = СН3Сl + НСl (7)
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Реакциями обмена называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
АВ + СD = АD + СВ
Например:
CuO + 2HCl = CuCl2 + H2O (1)
NaOH + HCl = NaCl + H2O (2)
NаНСО3 + НСl = NаСl + Н2О + СО2↑ (3)
AgNО3 + КВr = АgВr ↓ + КNО3 (4)
СrСl3 + ЗNаОН = Сr(ОН)3 ↓+ ЗNаСl (5)
Реакции обмена не являются окислительно-восстановительными. Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO2 = 2MgO + C (1)
Mg0 – 2e = Mg2+ (восстановитель)
С4+ + 4e = C0 (окислитель)
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O (2)
Fe2+ -e = Fe3+ (восстановитель)
N5+ +3e = N2+ (окислитель)
AgNO3 +HCl = AgCl ↓ + HNO3 (3)
Ca(OH)2 + H2SO4 = CaSO4 ↓ + H2O (4)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и
эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
N2 + 3H2 = 2NH3 +46,2 кДж (1)
2Mg + O2 = 2MgO + 602, 5 кДж (2)
N2 + O2 = 2NO – 90,4 кДж (3)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
А + В ↔ АВ
Например:
СН3СООН + С2Н5ОН↔ Н3СООС2Н5+ Н2О
Примерами необратимых реакций может служить следующие реакции:
2КСlО3 → 2КСl + ЗО2↑
С6Н12О6 + 6О2 → 6СО2↑+ 6Н2О
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего
соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание некоторых реакций вообще невозможно без присутствия катализатора:
2H2O2 = 2H2O + O2 ↑ (катализатор MnO2)
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF2 + H2O, где Ме – металл.
Примеры решения задач
Химия. ОВР — метод полуреакций
Сегодня мы научимся расставлять коэффициенты в окислительно-восстановительных реакциях (сокращенно ОВР) методом электронно-ионного баланса.
Задание обычно звучит так:
Подберите коэффициенты к уравнениям окислительно-восстановительной реакции, используя метод электронно-ионного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
Для примера разберем следующую ОВР:
Cl2 + K2S + KOH → KCl + K2SO4 + H2O
С чего начать?
Первым делом «растворяем то, что растворяется», иначе говоря, растворимые соединения разбиваем на анионы (отрицательно заряженные ионы) и катионы (положительно заряженные ионы).
Для нашей реакции:
Сl20 + K21+ + S2- + K1+ + OH1- → K1+ + Cl1- + K21+ + SO42- + H2O
Сокращаем те ионы, которые повторяются и слева, и справа и получаем уравнение реакции в ионно-молекулярном виде:
Сl20 + S2- + OH1- → Cl1- + SO42- + H2O
Определим среду нашей ОВР. Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Расставим степени окисления над каждым атомом. Принцип очень простой: степень окисления кислорода (почти) всегда 2-; водорода – 1+; степень окисления металлов равна порядковому номеру группы в таблице Менделеева, где живет этот металл. Степени окисления оставшихся атомов вычисляем, вычитая из степени окисления всего иона степени окисления известных атомов.
Сl20 + S2- + O2-H1+ → Cl1- + S6+O42- + H2O2-
Видно, что в ОВР изменяются степени окисления хлора (было 0, стало 1-) и серы (было 2-, стало 6+).
Степень окисления хлора уменьшилась, т.е. он забрал себе лишние электроны. Степень окисления серы увеличилась, т.е. она электроны отдала. Ион, отдавший ионы, называется восстановителем; получивший электроны – окислителем.
Теперь записываем две полуреакции для серы и для хлора:
Cl20 → Cl1- — окислитель, полуреакция восстановления
S2- → SO42- — восстановитель, полуреакция окисления
После десятка-другого ОВР все описанное выше делается в уме за несколько секунд.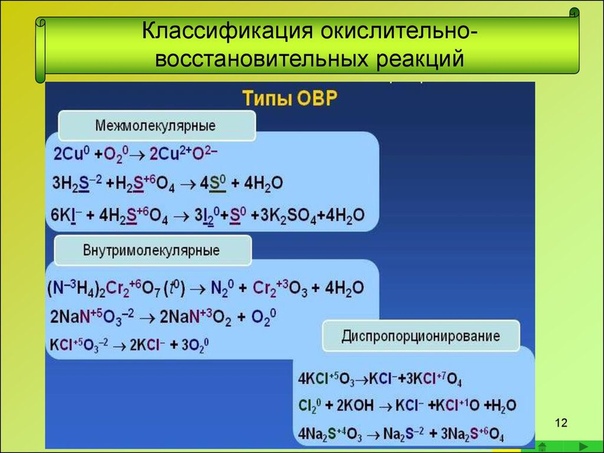
Теперь начинаем работать с выделенными полуреакциями.
Cl20 → Cl1-
Шаг первый: уравниваем количество атомов главного элемента (хлора).
Cl20 → 2Cl1-
Шаг второй: уравниваем количество атомов кислорода. У нас кислорода нет, едем дальше.
Шаг третий: уравниваем количество атомов водорода. Водорода тоже нет, едем дальше.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд 0, справа 2 заряда по -1, достаточно очевидно, что нужно добавить 2 электрона слева. Что мы и делаем:
Cl20 + 2е → 2Cl1-
Одна полуреакция готова. Принимаемся за вторую.
S2- → SO42-
Шаг первый: уравниваем количество атомов главного элемента (серы). У нас они уже равны, едем дальше.
Поскольку среда щелочная, шаг второй и шаг третий объединяем: нужно уравнять количества атомов кислорода и водорода, причем делать это нужно, добавляя слева ионы OH-, а справа молекулы воды. Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
S2- + 8OH— → SO42- + 4H2O
Все атомы уравнялись.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд -10, справа -2, вычитаем слева 8 электронов:
S2- + 8OH— — 8e → SO42- + 4H2O
Теперь выписываем наши уравненные полуреакции рядом. Хлор забирает 2 электрона, сера отдает 8 электронов, значит, чтобы все сошлось, необходимо умножить полуреакцию хлора на 4.
А если делать на автомате, то записываем количество электронов, сокращаем (если сокращается) и меняем местами. На получившееся число умножаем полуреакцию и собираем обратно в молекулярно-ионную запись.
Cl20 + 2е → 2Cl— 2→1→4
S2- + 8OH— — 8e → SO42- + 4H2O 8→4→1
4Сl20 + S2- + 8OH— → 8Cl— + SO42- + 4H2O
Проверяем, все ли сходится: хлора – по 8 атомов с каждой стороны, серы – по 1, водорода – по 8, кислорода – по 8.
С теми же коэффициентами переписываем полную ОВР.
4Cl2 + K2S + 8KOH → 8KCl + K2SO4 + 4H2O
Готово.
Для закрепления рассмотрим еще одну реакцию, на этот раз с кислой средой. Не буду расписывать так же подробно, только ключевые моменты.
K2Cr2O7 + Al + H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + H2O
Наметанным глазом сразу видно: степени окисления меняются у алюминия и у хрома. Выписываем полуреакции и уравниваем их.
Первая полуреакция:
Al0 → Al3+
Шаг первый: уравниваем количество атомов главного элемента – выполнено.
Шаг второй: уравниваем количество атомов кислорода – выполнено.
Шаг третий: уравниваем количество атомов водорода – выполнено.
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Al0 – 3e → Al3+
Вторая полуреакция:
Cr2O72- → Cr3+
Шаг первый: уравниваем количество атомов главного элемента.
Cr2O72- → 2Cr3+
Шаг второй: уравниваем количество атомов кислорода с помощью воды.
Cr2O72- → 2Cr3+ + 7H2O
Шаг третий: уравниваем количество атомов водорода c помощью ионов H+, потому что среда кислая. О том, что она кислая, нам говорит наличие кислоты в левой части реакции (если бы мы записали ионно-молекулярную форму реакции, слева остались бы ионы H+)
Cr2O72- + 14H+ → 2Cr3+ + 7H2O
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Выписываем полуреакции рядом и производим манипуляции с электронами:
Al0 – 3e → Al3+ 3→1→2
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O 6→2→1
Собираем две полуреакции в ионно-молекулярную реакцию, домножив, соответственно, на полученные числа.
Cr2O72- + 2Al0 + 14H+ → 2Cr3+ + 2Al3+ + 7H2O
Восстанавливаем полную реакцию, расставляя найденные коэффициенты:
K2Cr2O7 + 2Al + 7H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + 7H2O
Для проверки я обычно считаю, сходятся ли количества атомов кислорода: слева у нас 7+7*4=35 атомов, справа – 3*4+3*4+4+7=35 атомов.
Кислород сошелся, значит, все верно.
Любую ОВР можно уравнять описанным методом. Бывают, конечно, более сложные варианты, но смысл всегда один и тот же.
Дерзайте, и у вас все получится.
Если у Вас есть вопросы по решению данной задачи (или другой), пишите на наш e-mail [email protected], мы всегда готовы помочь.
С уважением, Botva-Project
Химические реакции в свете электронной теории. Окислительно-восстановительные реакции 10 класс онлайн-подготовка на
Окислительно-восстановительные реакции — ОВР
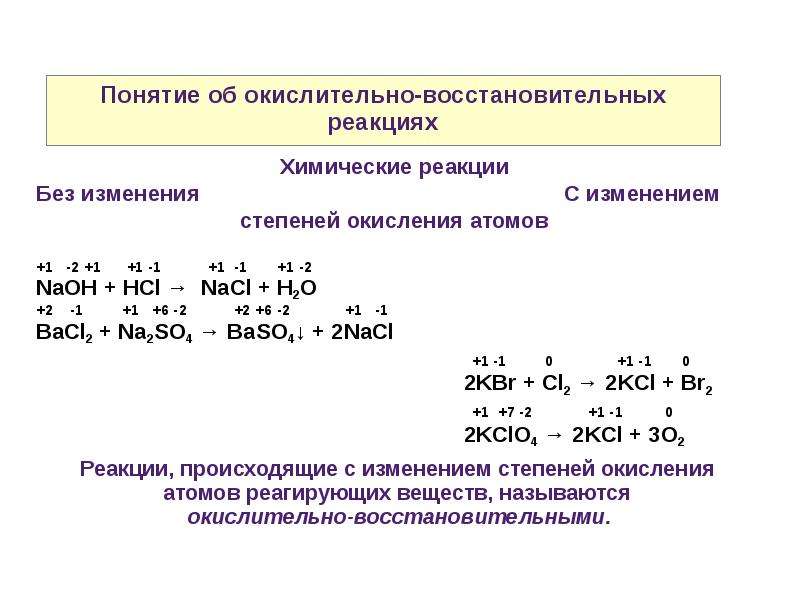
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
ОВР протекают с участием окислителя и восстановителя, и состоят из двух противоположных процессов:
1. Окисление — процесс отдачи электронов (восстановитель отдает электроны окислителю, восстановитель окисляется — окислитель восстанавливается).
2. Восстановление — процесс присоединения электронов (окислитель присоединяет электроны от восстановителя, окислитель восстанавливается — восстановитель окисляется).
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается, а окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается и восстановители при этом окисляются.
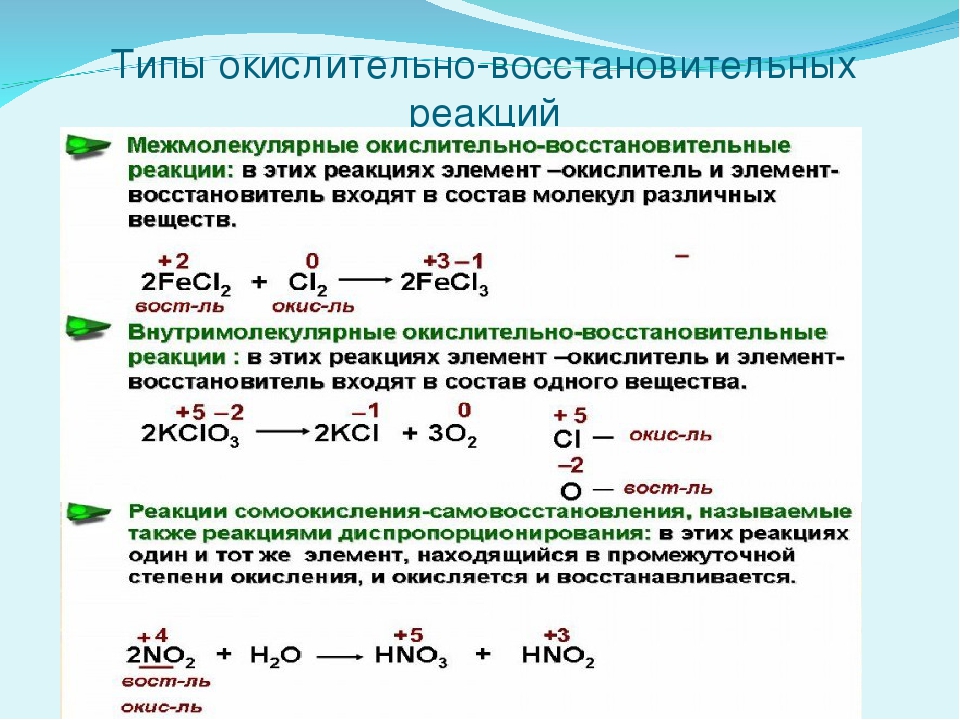
Классификация окислительно-восстановительных реакций:
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты. Реакции контрдиспропорционирования.
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Методы составления окислительно-восстановительных реакций (ОВР):
- метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами.
хімія онлайн калькулятор
Вычислить массу реагентов и продуктов. Уравнять реакцию, расставить коэффициенты. Рассчитать массу чистого вещества по массовой доле. Определить избыток и недостаток. Найти количество вещества. Балансировка химического уравнения — онлайн балансировкa. Введите химические уравнения, чтобы их сбалансировать: Инструкция по балансировке химических уравнений: Введите уравнение химической реакции и нажмите «Уравнять». Ответ на этот вопрос появится ниже. Всегда используйте верхний регистр для первого символа в названии химического элемента и нижнем регистре для второго символа. Например: Fe, Au, Co, C, O, N, F. Сравните: Co — кобальт и CO — угарный газ. Калькулятор химических реакций. База данных 10000 химических реакций — инструменты химии — информация о веществах. Быстрый поиск. Реклама. Основные определения в химии. Что такое химическое уравнение? Химическое уравнение — это форма описания химической реакции, в которой название каждого химического вещества будет заменено его химическим символом. Калькуляторы по химии. Химия онлайн на нашем сайте в виде справочников и калькуляторов расчета для решения задач и уравнений.
Уравнять реакцию, расставить коэффициенты. Рассчитать массу чистого вещества по массовой доле. Определить избыток и недостаток. Найти количество вещества. Балансировка химического уравнения — онлайн балансировкa. Введите химические уравнения, чтобы их сбалансировать: Инструкция по балансировке химических уравнений: Введите уравнение химической реакции и нажмите «Уравнять». Ответ на этот вопрос появится ниже. Всегда используйте верхний регистр для первого символа в названии химического элемента и нижнем регистре для второго символа. Например: Fe, Au, Co, C, O, N, F. Сравните: Co — кобальт и CO — угарный газ. Калькулятор химических реакций. База данных 10000 химических реакций — инструменты химии — информация о веществах. Быстрый поиск. Реклама. Основные определения в химии. Что такое химическое уравнение? Химическое уравнение — это форма описания химической реакции, в которой название каждого химического вещества будет заменено его химическим символом. Калькуляторы по химии. Химия онлайн на нашем сайте в виде справочников и калькуляторов расчета для решения задач и уравнений. Все разделы: аналитическая химия, органическая химия и т.д. бесплатные. Молярная масса газа, онлайн расчет. Расчет молярной массы газа по его объему, массе, температуре, давлению. Молярная масса газа, онлайн расчет. Валентность химических элементов, онлайн калькулятор. Определение валентности химических элементов. Калькулятор химических реакций. Введите схему реакции и нажмите кнопку «Уравнять». Программа подберёт коэффициенты и выведет полученное уравнение: h3 + O2 = h3O Na + h3O = NaOH + h3 KMnO4 + K2SO3 + h3SO4 = K2SO4 + MnSO4 + h3O KMnO4 + K2SO3 + h3O = MnO2 + K2SO4 + KOH KMnO4 + K2SO3 + KOH = K2MnO4 +. Бесплатный сервис по решению математических задач даст ответы к вашему домашнему заданию по химии с пошаговым объяснением Mathway currently only computes linear regressions. We are here to assist you with your math questions. You will need to get assistance from your school if you are having problems entering the answers into your online assignment. Phone support is available Monday-Friday, 9:00AM-10:00PM ET.
Все разделы: аналитическая химия, органическая химия и т.д. бесплатные. Молярная масса газа, онлайн расчет. Расчет молярной массы газа по его объему, массе, температуре, давлению. Молярная масса газа, онлайн расчет. Валентность химических элементов, онлайн калькулятор. Определение валентности химических элементов. Калькулятор химических реакций. Введите схему реакции и нажмите кнопку «Уравнять». Программа подберёт коэффициенты и выведет полученное уравнение: h3 + O2 = h3O Na + h3O = NaOH + h3 KMnO4 + K2SO3 + h3SO4 = K2SO4 + MnSO4 + h3O KMnO4 + K2SO3 + h3O = MnO2 + K2SO4 + KOH KMnO4 + K2SO3 + KOH = K2MnO4 +. Бесплатный сервис по решению математических задач даст ответы к вашему домашнему заданию по химии с пошаговым объяснением Mathway currently only computes linear regressions. We are here to assist you with your math questions. You will need to get assistance from your school if you are having problems entering the answers into your online assignment. Phone support is available Monday-Friday, 9:00AM-10:00PM ET. Наш же сборник онлайн-калькуляторов поможет решить или проверить решение наиболее популярных задач из курса школьной химии. Юрий Дудь: «Путин — красавчик?» {$ item.name $}. number:1 $%. {$ item.name $}. number $ {$ vote_pluralize(total) $}. О проекте. На нашем сайте вы можете найти химические уравнения онлайн, реакции различных химических веществ и продукты этой реакции. Советы по поиску химический реакций онлайн. Если вам нужно найти уравнение, в котором присутствуют вещества, например HCl напишите в поле выше. Если вам нужно найти вещества которые вступают в реакцию, напишите Ag3PO4 + HCl =. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Іонні рівняння реакцій. Як користуватись. Уроки хімії. Блог. Контакти. Головна. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Редактор химических уравнений позволяет уравнять как простейшие химические реакции, так и ОВР онлайн. Также поможет рассчитать массу реагентов или продуктов реакции В любом случае, система дает подсказки, поэтому, ориентируясь на них, записать химическое уравнение неправильно практически нереально.
Наш же сборник онлайн-калькуляторов поможет решить или проверить решение наиболее популярных задач из курса школьной химии. Юрий Дудь: «Путин — красавчик?» {$ item.name $}. number:1 $%. {$ item.name $}. number $ {$ vote_pluralize(total) $}. О проекте. На нашем сайте вы можете найти химические уравнения онлайн, реакции различных химических веществ и продукты этой реакции. Советы по поиску химический реакций онлайн. Если вам нужно найти уравнение, в котором присутствуют вещества, например HCl напишите в поле выше. Если вам нужно найти вещества которые вступают в реакцию, напишите Ag3PO4 + HCl =. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Іонні рівняння реакцій. Як користуватись. Уроки хімії. Блог. Контакти. Головна. Онлайн-сервіси. Пошук і розв’язання хімічних рівнянь. Калькулятор молекулярної (молярної) маси. Редактор химических уравнений позволяет уравнять как простейшие химические реакции, так и ОВР онлайн. Также поможет рассчитать массу реагентов или продуктов реакции В любом случае, система дает подсказки, поэтому, ориентируясь на них, записать химическое уравнение неправильно практически нереально. Если результат уравнивания не помещается на странице, воспользуйтесь полосой прокрутки внизу страницы. Химический Калькулятор онлайн. Впишите свою молекулярную формулу и нажмите кнопку «Выполнить». Варианты вписания формул: (Nh5)6Mo7O24.4h3O; KFe[Fe(CN)6]3; HOOC(Ch3)4COOH. Интерактивные таблицы и онлайн-калькулятор помогут учащимся и профильным специалистам. Например, медики и диетологи быстро распишут рацион пациенту. Студенты выполнят контрольную по химии. А тренеры рассчитают количество калорий, необходимых для спортсмена Чтобы сделать раствор, надо знать принципы взаимодействия веществ. Вряд ли кто-то будет высчитывать плотность молока или воды для приготовления еды. Полезно посетить. Химический калькулятор. Возможности химического калькулятора на schoolchemistry: 1. Вычисление массы вещества. 2. Вычисление количества вещества. 3. Определение орбиталей (электронной формулы). Данный ресурс позволяет автоматически расставить коэффициенты в уравнении химической реакции онлайн. Для для этого нужно указать реагенты и продукты Рекомендации по пользованию сервисом.
Если результат уравнивания не помещается на странице, воспользуйтесь полосой прокрутки внизу страницы. Химический Калькулятор онлайн. Впишите свою молекулярную формулу и нажмите кнопку «Выполнить». Варианты вписания формул: (Nh5)6Mo7O24.4h3O; KFe[Fe(CN)6]3; HOOC(Ch3)4COOH. Интерактивные таблицы и онлайн-калькулятор помогут учащимся и профильным специалистам. Например, медики и диетологи быстро распишут рацион пациенту. Студенты выполнят контрольную по химии. А тренеры рассчитают количество калорий, необходимых для спортсмена Чтобы сделать раствор, надо знать принципы взаимодействия веществ. Вряд ли кто-то будет высчитывать плотность молока или воды для приготовления еды. Полезно посетить. Химический калькулятор. Возможности химического калькулятора на schoolchemistry: 1. Вычисление массы вещества. 2. Вычисление количества вещества. 3. Определение орбиталей (электронной формулы). Данный ресурс позволяет автоматически расставить коэффициенты в уравнении химической реакции онлайн. Для для этого нужно указать реагенты и продукты Рекомендации по пользованию сервисом. 1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять». 2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Онлайн калькуляторы. Calculatorium.ru — это бесплатные онлайн калькуляторы для самых разнообразных целей: математические калькуляторы, калькуляторы даты и времени, здоровья, финансов. Инструменты для работы с текстом. Конвертеры. Удобное решение различных задач — в учебе, работе, быту. Актуальная информация. Помимо онлайн.
1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять». 2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Онлайн калькуляторы. Calculatorium.ru — это бесплатные онлайн калькуляторы для самых разнообразных целей: математические калькуляторы, калькуляторы даты и времени, здоровья, финансов. Инструменты для работы с текстом. Конвертеры. Удобное решение различных задач — в учебе, работе, быту. Актуальная информация. Помимо онлайн.
хімія онлайн калькулятор
Химия в кармане: 10 мобильных приложений для детей и их родителей / Newtonew: новости сетевого образования
В современном мире человек всё больше времени проводит за смартфоном или планшетом. Однако это вовсе не означает, что использование гаджетов вредит уровню сегодняшнего образования и мешает увлечённости детей наукой. Мы предлагаем вам ознакомиться с десятью самыми интересными и практически применимыми приложениями, которые помогут полюбить химию, облегчат учебный процесс, а некоторые даже пригодятся профессионалам.
Инструментальный ящик (Android)
Очень удобный обучающий сервис для школьников и студентов. Включает в себя периодическую таблицу, в которой высвечивается полная информация о физических и электронных свойствах выбранного элемента. В бесплатной версии открыты таблица растворимости, физические константы, сведения о длинах волн в ЯМР, что особенно полезно для студентов профильных вузов. Кроме того, в Инструментальном ящике можно посмотреть различные характеристики растворителей, такие как вязкость, показатели преломления света и т.д. Из недостатков — в бесплатной версии приложение не пишет уравнения реакций и не производит расчётов, но диапазон данных и без того весьма велик.
Удобное приложение, ориентированное на российских школьников. Похоже, что его создатели действительно смогли предусмотреть всё, что требуется для учёбы в 8−11 классе. Химия Х10 включает в себя периодическую таблицу с краткими сведениями об элементе, конвертер, а также великолепно решает задачи. Как показывает практика, приложение приводит подробные решения всех задач основного курса школьной химии, не требуя написания текста — нужно просто ввести данные в специальных графах. Программа совмещает в себе множество теоретического и практически применимого материала с красивой графикой и понятным интерфейсом.
Как показывает практика, приложение приводит подробные решения всех задач основного курса школьной химии, не требуя написания текста — нужно просто ввести данные в специальных графах. Программа совмещает в себе множество теоретического и практически применимого материала с красивой графикой и понятным интерфейсом.
Химия для детей (Android)
Достойное приложение, позволяющее разнообразить семейный досуг и заинтересовать детей наукой. Ориентировано на ребят 8−10 лет. Обладает красочной трёхмерной графикой, которая просто не может не заинтересовать ребёнка. Состоит примерно из 25−30 химических опытов, установку для которых можно быстро и легко собрать с помощью подсказок. Также есть возможность посмотреть основные свойства химических веществ и процессов, таких как горение пламени и его цвет, способность к воспламенению, красивые взрывы и т. д. Предлагается описание реакций, но не даётся объяснения, почему они протекают именно так, в чём и заключается существенный минус этого приложения.
Сhemistry Allie (Android, iOS)
Химическая англоязычная викторина с красочной графикой. Любители химии смогут оттачивать свои знания в самых различных областях: определение атомного номера, названий элементов, формул основных классов соединений, нахождение коэффициента уравнения и т.д. Время ответа на каждый вопрос ограничено десятью секундами. Предлагается 5 вариантов ответа, после пятой ошибки приложение «вылетает». Вопросы по органике и неорганике поделены на 9 уровней с повышением сложности. Хорошее знание языка не требуется, хотя Chemistry Allie и на английском. Приложение очень достойно и всем заинтересованным рекомендуется.
Chemistry calculations (Android)
Американское образовательное приложение, ориентированное на студентов химических вузов. Для пользования достаточно базового уровня владения языком. Вместе с тем Chemistry calculations имеет огромный диапазон применения, что крайне необходимо среднестатистическому студенту. Использование такого приложения дарит отличную возможность быстро и правильно посчитать pH, молекулярный вес, вычислить любые параметры по уравнению идеального газа, провести расчёты по уравнению Нернста и т. п. Содержит конвертер, периодическую таблицу, таблицу физических констант. Великолепное приложение, которое рекомендуется к скачиванию всем заинтересованным студентам.
Использование такого приложения дарит отличную возможность быстро и правильно посчитать pH, молекулярный вес, вычислить любые параметры по уравнению идеального газа, провести расчёты по уравнению Нернста и т. п. Содержит конвертер, периодическую таблицу, таблицу физических констант. Великолепное приложение, которое рекомендуется к скачиванию всем заинтересованным студентам.
Chemistry Lab (iOS)
Исходя из увиденного, можно сказать, что данное приложение уверенно входит в тройку самых полезных и увлекательных онлайн-игр. Оно понравится всем без исключения и действительно поможет полюбить химию как науку. Chemistry Lab представляет собой онлайн-лабораторию с очень реалистичной графикой в стиле американской школы. Можно выбирать на свой вкус колбу или химический стакан, присутствует горелка. И, что самое потрясающее, приложение содержит ВСЕ реально существующие неорганические соли, гидроксиды, кислоты, простые вещества и оксиды. На экране реагенты находятся в прозрачных пробирках, а цвет и агрегатное состояние самих веществ соответствуют действительным. Все реакции также протекают очень красочно, при этом сопровождающие их процессы отражают реальную картину (например, взрыв, выпадение в осадок и т. д.). По завершении реакции высвечивается уравнение, показывающее, что же произошло. Приложение действительно учит химии, лучше некоторых школ. Единственный существенный минус — скачать его могут только обладатели гаджетов Apple.
Все реакции также протекают очень красочно, при этом сопровождающие их процессы отражают реальную картину (например, взрыв, выпадение в осадок и т. д.). По завершении реакции высвечивается уравнение, показывающее, что же произошло. Приложение действительно учит химии, лучше некоторых школ. Единственный существенный минус — скачать его могут только обладатели гаджетов Apple.
Сhemistry Quiz (Android)
К сожалению, мир химических обучающих сервисов весьма беден стоящими викторинами на русском языке, поэтому вот ещё одно англоязычное приложение. Надо сказать, что язык в нём весьма прост и вполне понятен для школьников 7−8 класса, ведь именно в этом возрасте начинается изучение химии в непрофильных школах. Вопросы викторины удобно разбиты на темы преимущественно из курса общей и неорганической химии. Chemistry Quiz будет интересен как детям, так и взрослым: вопросы разнообразны и нетривиальны, заставляют подумать и вспомнить некоторые детали из школьного и вузовского курса, а также позволяют узнать много новой информации.
Очень красиво оформленные карточки для запоминания на названия, символы, группу или картинку, связанную с элементом. Сначала предлагается вопрос, над которым можно подумать неограниченное количество времени и, нажав на экран, увидеть ответ. Запоминать, где расположен тот или иной элемент, удобно благодаря длиннопериодной таблице. Приложение английское, но это его не портит, так как языком пользоваться вообще не приходится. Существенным недостатком является то, что картинки на запоминание элемента не всегда бывают однозначными, и даже студенту профильного вуза будет сложно догадаться, о каком именно элементе идёт речь. Но, даже несмотря на это, Flash Cards — крайне достойное приложение с качественной HD-графикой.
Learning Science (iOS)
Невероятно красивое приложение с мультяшной качественной графикой для детей 3−6 лет. Подобранные специально для детей младшего возраста задания очень просты и эффектны. Например: собрать гальванический элемент, перетаскивая детали по экрану, после чего загорится лампочка. Такие «научные» эксперименты разработаны для изучения химии, физики и биологии, всего их около 20 для каждого предмета. Красиво и со вкусом, приятное развлечение для всей семьи.
Такие «научные» эксперименты разработаны для изучения химии, физики и биологии, всего их около 20 для каждого предмета. Красиво и со вкусом, приятное развлечение для всей семьи.
Одно из лучших существующих приложений по визуализации молекул, которое доступно пользователям как Android, так и iOS. Выгодно отличается от своих аналогов разнообразием представленных молекул, которые можно посмотреть на экране или с помощью очков виртуальной реальности. Молекулы представлены в разных видах: так, как они нарисованы в учебниках, и в форме масштабной модели. Также у пользователей есть возможность покрутить молекулу в разные стороны, что действительно очень наглядно и удобно.
16 февраля 2016, 12:00
Мнение автора может не совпадать с позицией редакции.
MEL Science
Хотите, чтобы ваш ребёнок занимался чем-то полезным и на всю жизнь получил фундаментальное представление об устройстве природы? А ведь вы можете узнать много нового вместе с детьми! Рассказываем о том, как войти в мир науки и по-настоящему полюбить его.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Руководство по химии FIFA Mobile 22, советы и рекомендации
Последнее обновление
Сыгранность возвращается в FIFA Mobile 22. Командная сыгранность — это система, которая повышает ваш стартовый XI, когда вы включаете игроков из одного клуба, лиги, страны или особых событий.
В этом руководстве мы объясним вам все, что вам нужно знать о том, как работает химия в FIFA Mobile.
Содержание
Базовое руководство по химии
Командная сыгранность так же важна, как и общий рейтинг команды.Хорошая сыгранность даст вам больше шансов в матчах против атаки (VSA) или лиги против лиги (LvL). 10+ Командная сыгранность равняется 1+ ОБЩ команды.
Чтобы получить рейтинг Team Chemistry, у вас должно быть как минимум 2 элитных игрока, связанных чем-либо похожим (Клуб/Лига/Нация/Событие).
Химия показана на экране «Начальный 11» цветной линией между игроками. Зеленый цвет указывает на хорошую химию, зеленый (светлый) цвет указывает на отличную химию, а серый цвет указывает на отсутствие химии.
Зеленый цвет указывает на хорошую химию, зеленый (светлый) цвет указывает на отличную химию, а серый цвет указывает на отсутствие химии.
Химия открывается на 8 уровне.
НАШИ ПОСЛЕДНИЕ ВИДЕО
Умения FIFA Mobile Икс
Для просмотра этого видео включите JavaScript и рассмотрите возможность перехода на веб-браузер, который поддерживает HTML5 видео
Чтобы просмотреть статистику сыгранности каждого игрока в вашем стартовом составе, щелкните значок «Сыгранность» слева от вкладки «Starting 11».
Важно отметить, что числа справа от каждого игрока — это химия, которую этот игрок дал всем связанным игрокам, а числа слева — это химия, полученная этим игроком от связанных игроков.
Team Chemistry работает только с игроками с ОБЩ 80+. Это означает, что если вы свяжете бронзового, серебряного или золотого игрока с элитным игроком, это не сработает. Вы должны сначала обучить этого бронзового / серебряного / золотого игрока до элиты.
Индикатор рядом с ОБЩ вашей команды показывает, сколько общей сыгранности вы получили от всех игроков в вашем стартовом составе.
Максимальная командная химия
| Уровень | Макс химии | |
|---|---|---|
| 1 | — | |
| 2 | — | |
| 3 | — | |
| 4 | — | |
| 5 | — | |
| 6 | — | |
| 7 | — | |
| 8 | 56 | |
| 9 | 58 | |
| 10 | 60 | |
| 11 | 62 | |
| 12 | 64 | |
| 13 | 66 | |
| 14 | 68 | |
| 15 | 70 | |
| 16 | 72 | |
| 17 | 74 | |
| 18 | 76 | |
| 19 | 78 | |
| 20 | 80 | |
| 82 | ||
| 22 | 84 | |
| 23 | 86 | |
| 24 | 88 | |
| 25 | 90 | |
| 26 | 92 | |
| 27 | 94 | 94 |
| 28 | 96 | |
| 30+ | 100 | 100 | 2 |
Как увеличить и максимизировать свою команду Chemistry
Вот несколько советов и приемов, которые вы можете использовать, чтобы повысить и максимизировать сыгранность вашей команды.
Не будь слишком тематическим
Составление команды только из 1 клуба или 1 страны, безусловно, облегчает максимизацию командной сыгранности. Но ваш отряд потеряет свою гибкость, и новым игрокам будет сложно войти в него.
Кроме того (когда я пишу эту статью) сейчас только начало сезона и будет много событий, в которых, конечно же, будут участвовать новые и лучшие игроки (TOTY, TOTS, Carniball, Easter, Boxing Day, Heartbreakers, Retro Stars, Лига Европы, День Благодарения и т. д.).
Посмотрите статистику сыгранности, прежде чем покупать игроков на рынке
Химическую статистику можно увидеть в правом нижнем углу страницы профиля. Просматривая статистику сыгранности перед покупкой игроков на рынке, вы можете рассчитать, сколько очков сыгранности игрок даст команде и сколько очков сыгранности он получит. Это потому, что каждая карта имеет разные значения химии.
Если возможно, выбирайте карты из новых событий, а не из базовых или старых событий.

Обычно игроки, участвующие в таких событиях, как UCL, Football Freeze, STPD, Top Transfer, TOTW, Treasure Hunt, National Heroes, Ultimate Memories: Flashbacks или Lunar, получают и дают больше очков сыгранности, чем базовые карты.
При этом, если все игроки в ваших стартовых 11 участвуют в специальных событиях и хорошо связаны (один и тот же клуб/региональные лиги/нация/программа), ваша сыгранность будет расти быстрее.
В середине и конце сезона EA всегда будет выпускать новые карты с более высоким максимальным количеством очков сыгранности.
Я надеюсь, что это руководство по сыгранности в FIFA Mobile 22 Season 6 поможет вам создать лучшую команду. Если у вас есть какие-либо вопросы, сообщите нам об этом в комментариях ниже.
Архив (FIFA Mobile 21)
Краеведческая химия
В FIFA Mobile 21 EA изменила способ определения сыгранности игроков. Сыгранность в точных лигах теперь расширена до региональных групп.
Что такое Chem Group Players? Chem Group Players — это региональные химические группы, включающие несколько лиг, так что теперь у вас есть больше возможностей объединить больше игроков для добавления химии.Например, игроки химической группы Германии — это игроки из Бундеслиги, у которых будут химические связи с игроками из Бундеслиги 2, 3. Лиги и наоборот. Игроки Химической группы Италии — это игроки из Серии А TIM, которые будут иметь Химические связи с игроками из «Calcio B», и наоборот.
Региональные химические группы
Ниже приведен полный список игроков региональной химической группы в FIFA Mobile.
Игроки England Chem Group:
- Премьер-лига
- Чемпионат EFL
- EFL League 1
- EFL League 2
France Chem Group Игроки:
- Лига 1 Uber Eats
- Лига 2 BKT
Италия Chem Group Игроки:
- Серия А TIM
- «Кальчо Б»
Игроки химической группы Германии
- Бундеслига
- Бундеслига 2
- 3.
 Лига
Лига
Испания Chem Group Игроки:
- LaLiga Santander
- LaLiga Smartbank
Игроки Западной Европы Chem Group:
- Liga Nos (Португалия)
- eredivisie (Нидерланды)
- 1a Pro League (Бельгия)
- Scottish Prem (Шотландия)
- SSE Airtriacity Lge (Ирландия)
Восточная Европа Chem Group Players:
- RSL (Швейцария)
- О.Bundesliga (Австрия)
- 3F Superliga (Дания)
- Eliteserien (Норвегия)
- Allsvenskan (Швеция)
- PKO Ektstraklasa (Польша)
- Liga I (Румыния)
- Super Lig (Турция)
- «Finnliga» Финляндия)
- «Ческа Лига» (Чехия)
- «Лига России» (Россия)
- «Украина Лиха» (Украина)
- «Лига Хорватская» (Хорватия)
- «Эллада Лига» (Греция) 9076
Остальные игроки World Chem Group:
- MLS (США/Канада)
- Liga BBVA MX (Мексика)
- LPF (Аргентина)
- CSL (Китай)
- K-League 1 (Южная Корея)
- A-League (Австралия)6
- Hero ISL (Индия)
- MBS Pro League (Саудовская Аравия)
- United Emirates League (ОАЭ)
- South African FL (Южная Африка)
|
|---|

 Liga
Liga  Участвуйте в турнирах лиги и зарабатывайте очки способностей, а затем обменивайте их на усиление сыгранности и максимальную сыгранность. Все о перках читайте здесь.
Участвуйте в турнирах лиги и зарабатывайте очки способностей, а затем обменивайте их на усиление сыгранности и максимальную сыгранность. Все о перках читайте здесь. 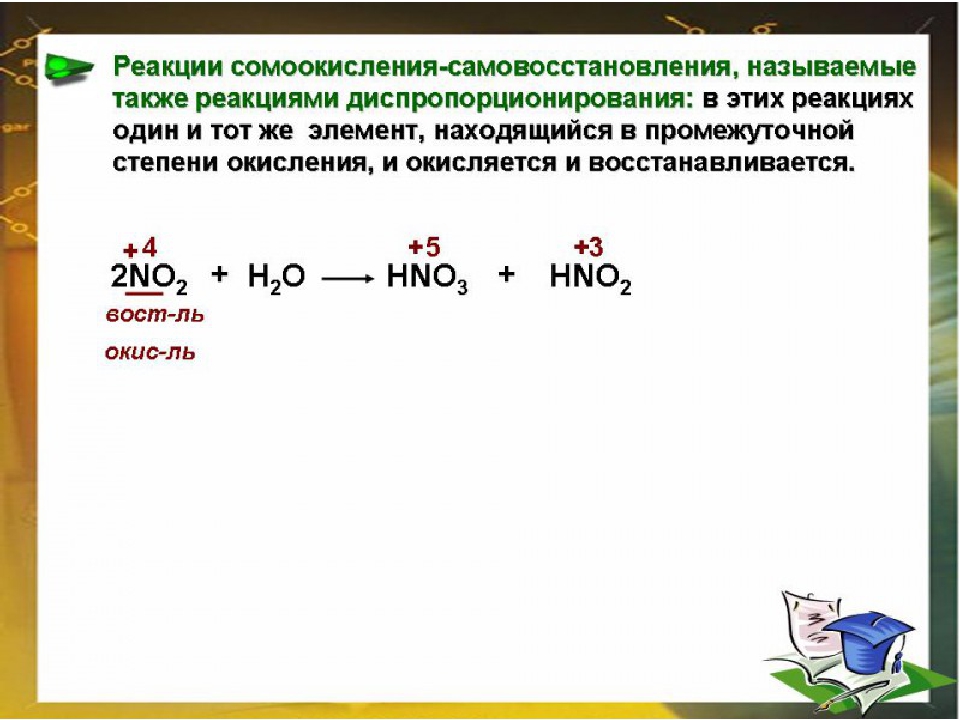 Повышая максимальную сыгранность с помощью очков навыков, вы тем выше сможет подняться сыгранность вашей команды.
Повышая максимальную сыгранность с помощью очков навыков, вы тем выше сможет подняться сыгранность вашей команды.  После долгих раздумий сообщества над статистикой, атрибутами и маленькими зелеными шевронами, EA Sports наконец раскрыла некоторые цифры, поэтому мы объясним, как все это работает, ниже в нашем руководстве по , как увеличить химию в FIFA 21 Ultimate Team .
После долгих раздумий сообщества над статистикой, атрибутами и маленькими зелеными шевронами, EA Sports наконец раскрыла некоторые цифры, поэтому мы объясним, как все это работает, ниже в нашем руководстве по , как увеличить химию в FIFA 21 Ultimate Team . 
 Другими словами, гораздо важнее, чтобы ваша карта Обамеянга имела максимум 10 Player Chemistry, чем то, что ваша Team Chemistry составляет 100 — хотя это, конечно, все еще помогает.
Другими словами, гораздо важнее, чтобы ваша карта Обамеянга имела максимум 10 Player Chemistry, чем то, что ваша Team Chemistry составляет 100 — хотя это, конечно, все еще помогает.  Подробнее об этом ниже!).
Подробнее об этом ниже!).  5 + 22,5, в сумме общая химия 90 из 100. Это выше 50, поэтому атрибуты Роналду увеличатся , и это тоже немного больше 50, так что они увеличатся довольно сильно — почти максимальное количество, в факт.
5 + 22,5, в сумме общая химия 90 из 100. Это выше 50, поэтому атрибуты Роналду увеличатся , и это тоже немного больше 50, так что они увеличатся довольно сильно — почти максимальное количество, в факт.  Как вы увидите в большом списке, который мы составили в нашем руководстве по стилям сыгранности, «Максимальное значение повышения» для завершающего атрибута, предоставляемого стилем сыгранности снайпера, равно 15. Или, другими словами, с максимальной сыгранностью, карта Роналду с Снайперский химический стиль получит +15 к завершению.
Как вы увидите в большом списке, который мы составили в нашем руководстве по стилям сыгранности, «Максимальное значение повышения» для завершающего атрибута, предоставляемого стилем сыгранности снайпера, равно 15. Или, другими словами, с максимальной сыгранностью, карта Роналду с Снайперский химический стиль получит +15 к завершению. 

 Зеленый означает два или более общих качества, увеличивая сыгранность игрока и команды более чем на оранжевый цвет. Однако реальный результат определяется всеми ссылками от игрока: см. красный как -1, оранжевый как +1 и зеленый как +2. Суммируя все ссылки, вы хотите, чтобы этот игрок получил от них повышение химии.
Зеленый означает два или более общих качества, увеличивая сыгранность игрока и команды более чем на оранжевый цвет. Однако реальный результат определяется всеми ссылками от игрока: см. красный как -1, оранжевый как +1 и зеленый как +2. Суммируя все ссылки, вы хотите, чтобы этот игрок получил от них повышение химии.
 Вместо этого все заменители вступают в игру с фиксированным рейтингом индивидуальной сыгранности 5 из 10, а это означает, что при вводе в приведенную выше формулу их скрытый общий показатель сыгранности будет иметь максимальное значение 62,5 из 100. Командная химия ниже 100. конечно понизит еще больше.
Вместо этого все заменители вступают в игру с фиксированным рейтингом индивидуальной сыгранности 5 из 10, а это означает, что при вводе в приведенную выше формулу их скрытый общий показатель сыгранности будет иметь максимальное значение 62,5 из 100. Командная химия ниже 100. конечно понизит еще больше. 



 Простой! Иш. Тогда давайте начнем с общей химии.
Простой! Иш. Тогда давайте начнем с общей химии. 
 Для достижения максимальных результатов вам нужно получить 10 и 100 баллов в обоих случаях соответственно, но стоит подчеркнуть, что индивидуальная химия более важна, чем командная химия, когда дело доходит до ее подсчета в целом.
Для достижения максимальных результатов вам нужно получить 10 и 100 баллов в обоих случаях соответственно, но стоит подчеркнуть, что индивидуальная химия более важна, чем командная химия, когда дело доходит до ее подсчета в целом.  Красный не имеет ничего общего, уменьшая сыгранность игрока и команды.Желтый означает одну общую черту: повышение сыгранности игроков и команд. Обратите внимание, что это отличается от результата желтого индикатора позиции игрока. Зеленый означает два или более общих качества, увеличивая сыгранность игрока и команды более чем на желтый. Однако реальный результат определяется всеми ссылками от игрока: см. красный как -1, желтый как +1 и зеленый как +2. Суммируя все ссылки, вы хотите, чтобы этот игрок получил от них повышение химии.
Красный не имеет ничего общего, уменьшая сыгранность игрока и команды.Желтый означает одну общую черту: повышение сыгранности игроков и команд. Обратите внимание, что это отличается от результата желтого индикатора позиции игрока. Зеленый означает два или более общих качества, увеличивая сыгранность игрока и команды более чем на желтый. Однако реальный результат определяется всеми ссылками от игрока: см. красный как -1, желтый как +1 и зеленый как +2. Суммируя все ссылки, вы хотите, чтобы этот игрок получил от них повышение химии. На это указывает значок зеленого щита на их карточке.
На это указывает значок зеленого щита на их карточке. добавив менеджера или бонус за лояльность.
добавив менеджера или бонус за лояльность.  Подставьте 62,5 Общей Химии в приведенную выше формулу, и Финишный Атрибут Роналду будет увеличен всего на 4 балла (округлено с 3,75) из максимальных 15.По сути, сабвуферы отлично подходят для привлечения игроков, у которых в противном случае была бы плохая химия, например, из другой лиги, но они никогда не будут такими сильными, как если бы они начали с полной сыгранностью в целом.
Подставьте 62,5 Общей Химии в приведенную выше формулу, и Финишный Атрибут Роналду будет увеличен всего на 4 балла (округлено с 3,75) из максимальных 15.По сути, сабвуферы отлично подходят для привлечения игроков, у которых в противном случае была бы плохая химия, например, из другой лиги, но они никогда не будут такими сильными, как если бы они начали с полной сыгранностью в целом.  Тем не менее, в программе химии в средней школе Кварц-Хилл очень мало лабораторий с опасными химическими веществами или вообще физических лабораторий.
Тем не менее, в программе химии в средней школе Кварц-Хилл очень мало лабораторий с опасными химическими веществами или вообще физических лабораторий.  Он признал, что эти искусственные эксперименты не так увлекательны, как традиционные лаборатории, но студенты все равно «понимают, что это значит».
Он признал, что эти искусственные эксперименты не так увлекательны, как традиционные лаборатории, но студенты все равно «понимают, что это значит».  Чтобы у студентов не было этой проблемы, г-н Глэнси просит студентов, не имеющих необходимых технических средств, сообщить ему об этом заранее. Он объяснил: «Я пытаюсь уловить это в начале и заставить людей сказать мне это, чтобы я мог найти им подходящее место.
Чтобы у студентов не было этой проблемы, г-н Глэнси просит студентов, не имеющих необходимых технических средств, сообщить ему об этом заранее. Он объяснил: «Я пытаюсь уловить это в начале и заставить людей сказать мне это, чтобы я мог найти им подходящее место. Глэнси объяснил: «С конца третьей четверти мы видим, что у нас есть все эти блоки, и нет никакого способа пройти через них все». Тем не менее, Smoot не считает себя обязанным охватывать каждую единицу, которую делает Honors Chemistry, предпочитая качество количеству.
Глэнси объяснил: «С конца третьей четверти мы видим, что у нас есть все эти блоки, и нет никакого способа пройти через них все». Тем не менее, Smoot не считает себя обязанным охватывать каждую единицу, которую делает Honors Chemistry, предпочитая качество количеству. 
 Менее благородные студенты прибегают к тому, чтобы платить другим за выполнение своих заданий. В качестве недостатка Глэнси признал: «Вы можете заплатить кому-нибудь — «вот мой пароль, я заплачу вам, чтобы вы ответили на все вопросы за меня».’”
Менее благородные студенты прибегают к тому, чтобы платить другим за выполнение своих заданий. В качестве недостатка Глэнси признал: «Вы можете заплатить кому-нибудь — «вот мой пароль, я заплачу вам, чтобы вы ответили на все вопросы за меня».’”  Они могут помогать друг другу в процессе выполнения домашнего задания, но каждый ученик должен решать свои индивидуальные задачи.
Они могут помогать друг другу в процессе выполнения домашнего задания, но каждый ученик должен решать свои индивидуальные задачи. 
 «Хотя содержание курса доступно в Интернете, студентам часто требуется больше взаимодействия с учителями. Онлайн-формат позволяет учащимся выполнять все домашние задания без особых хлопот, но учащиеся не совсем понимают содержание курса.
«Хотя содержание курса доступно в Интернете, студентам часто требуется больше взаимодействия с учителями. Онлайн-формат позволяет учащимся выполнять все домашние задания без особых хлопот, но учащиеся не совсем понимают содержание курса.  Прежде всего, программа нуждается в большем финансировании и поддержке, особенно для специализированных устройств для выполнения классных и домашних заданий. Кроме того, в онлайн-формате все еще есть недостатки и несоответствия, которые необходимо устранить. Онлайн-химия — хорошая идея с точки зрения концепции, но у нее все еще есть много недостатков, которые необходимо исправить, чтобы концепция была реализована в полной мере.
Прежде всего, программа нуждается в большем финансировании и поддержке, особенно для специализированных устройств для выполнения классных и домашних заданий. Кроме того, в онлайн-формате все еще есть недостатки и несоответствия, которые необходимо устранить. Онлайн-химия — хорошая идея с точки зрения концепции, но у нее все еще есть много недостатков, которые необходимо исправить, чтобы концепция была реализована в полной мере.  В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя.Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.
В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя.Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.  В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя. Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.
В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя. Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.  В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя.Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.
В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя.Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.  В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя. Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.
В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя. Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.  В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя.Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности.
В одних картинах четкие, стилизованные формы хрустальных бокалов выделяются на фоне нежных, пастельных цветовых переходов, а в другой серии работ обнаженное человеческое тело (части), в том числе и художника, показывает, а иногда и обнажает себя. к взгляду зрителя.Силуэты от гладких до хрупких раскрывают большую часть трехмерных скульптурных качеств этих тел, текстуры их поверхностей, их мягкости или холодности. 
 Чтобы обеспечить бесперебойную работу, вот несколько полезных советов, о которых следует помнить:
Чтобы обеспечить бесперебойную работу, вот несколько полезных советов, о которых следует помнить: 
 Почти для всех типов спектров это не имеет значения, но
установка этого параметра в значение true требуется в некоторых случаях, связанных с большими
сверхтонкая структура, такая как у йода.По умолчанию
в настоящее время false (что быстрее), но следующая версия будет
измените это на true, так как стало ясно, что это слишком легко
выполнять неверные расчеты. Требование вызывается
экзотические члены в гамильтониане, χ ab , χ ac
и χ до н.э. в случае йода и других необычных
условия, включающие возмущения, также могут привести к срабатыванию этого требования.
Спасибо Susanna Stephens за обсуждение, вызвавшее это изменение.
Почти для всех типов спектров это не имеет значения, но
установка этого параметра в значение true требуется в некоторых случаях, связанных с большими
сверхтонкая структура, такая как у йода.По умолчанию
в настоящее время false (что быстрее), но следующая версия будет
измените это на true, так как стало ясно, что это слишком легко
выполнять неверные расчеты. Требование вызывается
экзотические члены в гамильтониане, χ ab , χ ac
и χ до н.э. в случае йода и других необычных
условия, включающие возмущения, также могут привести к срабатыванию этого требования.
Спасибо Susanna Stephens за обсуждение, вызвавшее это изменение.  1039/c8cp06493h; принятая рукопись доступна здесь.
1039/c8cp06493h; принятая рукопись доступна здесь. 
 0 теперь доступен онлайн: «Автоматическое назначение и
Подгонка спектров с помощью PGOPHER». C.M. Western and B.
Э. Биллингхерст, Физическая химия Химическая физика ,
19 , 10222–10226 (2017), doi:10.1039/c7cp00266a.
Принятая рукопись также доступна.
0 теперь доступен онлайн: «Автоматическое назначение и
Подгонка спектров с помощью PGOPHER». C.M. Western and B.
Э. Биллингхерст, Физическая химия Химическая физика ,
19 , 10222–10226 (2017), doi:10.1039/c7cp00266a.
Принятая рукопись также доступна.
 То
.pgo
файлы остаются по существу совместимыми со старыми версиями, хотя
ожидайте предупреждающих сообщений, если используются новые функции. Дои для
версия 10.0: doi:10.5523/bris.160i6ixoo4kir1jxvawfws047m
То
.pgo
файлы остаются по существу совместимыми со старыми версиями, хотя
ожидайте предупреждающих сообщений, если используются новые функции. Дои для
версия 10.0: doi:10.5523/bris.160i6ixoo4kir1jxvawfws047m  к
предоставить простой эмпирический способ определения квантового числа
зависимая ширина и интенсивность линий и значительная доработка
из
окно переходов к
позволять
отбор по большему количеству квантовых чисел и другие параметры.Более подробную информацию см. в примечаниях к выпуску.
список. В виде
когда-либо, файлы .pgo из более старых версий будут работать без
изменение в новой версии, за исключением нескольких необычных случаев,
который выдаст предупреждающее сообщение при загрузке. ..pgo
файлы остаются по существу совместимыми со старыми версиями, хотя
ожидать предупреждающих сообщений, если используются новые функции
к
предоставить простой эмпирический способ определения квантового числа
зависимая ширина и интенсивность линий и значительная доработка
из
окно переходов к
позволять
отбор по большему количеству квантовых чисел и другие параметры.Более подробную информацию см. в примечаниях к выпуску.
список. В виде
когда-либо, файлы .pgo из более старых версий будут работать без
изменение в новой версии, за исключением нескольких необычных случаев,
который выдаст предупреждающее сообщение при загрузке. ..pgo
файлы остаются по существу совместимыми со старыми версиями, хотя
ожидать предупреждающих сообщений, если используются новые функции
 0.100 (17 июня 2015 г.): Черновая версия
версия 9. Новые функции включают более быстрые вычисления для
большие проблемы, Лумис-Вуд
графики, более широкий выбор единиц измерения рассчитываемых величин (для
пример ангстрем и сила осциллятора), вибрационный
Раздел Функция для расчета полного раздела
функции, чек
Команда производных для оценки точности численных
производные, другие инструменты для помощи в настройке и многие другие
небольшие улучшения и исправления ошибок.Более подробную информацию см. в примечаниях к выпуску.
список. Файлы .pgo из более старых версий будут работать без
изменение в новой версии, за исключением нескольких необычных случаев,
который выдаст предупреждающее сообщение при загрузке. Постоянный DOI
будет доступна для новой версии в ближайшее время.
Сообщения об ошибках принимаются по адресу
0.100 (17 июня 2015 г.): Черновая версия
версия 9. Новые функции включают более быстрые вычисления для
большие проблемы, Лумис-Вуд
графики, более широкий выбор единиц измерения рассчитываемых величин (для
пример ангстрем и сила осциллятора), вибрационный
Раздел Функция для расчета полного раздела
функции, чек
Команда производных для оценки точности численных
производные, другие инструменты для помощи в настройке и многие другие
небольшие улучшения и исправления ошибок.Более подробную информацию см. в примечаниях к выпуску.
список. Файлы .pgo из более старых версий будут работать без
изменение в новой версии, за исключением нескольких необычных случаев,
который выдаст предупреждающее сообщение при загрузке. Постоянный DOI
будет доступна для новой версии в ближайшее время.
Сообщения об ошибках принимаются по адресу  : При моделировании сверхтонкой структуры на
молекулы с эквивалентными ядрами, то статистические веса
вычисляются неправильно, если эквивалентные ядра со спином 0
явно включены в расчет.Это исправлено в версии
8.0.308; для более ранних версий просто удалите все объекты ядра
с нулевым спином. Документация о том, как обрабатывать эквивалентные
ядер при расчете сверхтонкой структуры.
осветленные — см. линейные и
асимметричный топ
документация.
: При моделировании сверхтонкой структуры на
молекулы с эквивалентными ядрами, то статистические веса
вычисляются неправильно, если эквивалентные ядра со спином 0
явно включены в расчет.Это исправлено в версии
8.0.308; для более ранних версий просто удалите все объекты ядра
с нулевым спином. Документация о том, как обрабатывать эквивалентные
ядер при расчете сверхтонкой структуры.
осветленные — см. линейные и
асимметричный топ
документация. 
 список исправленных проблем; новых функций нет
список исправленных проблем; новых функций нет 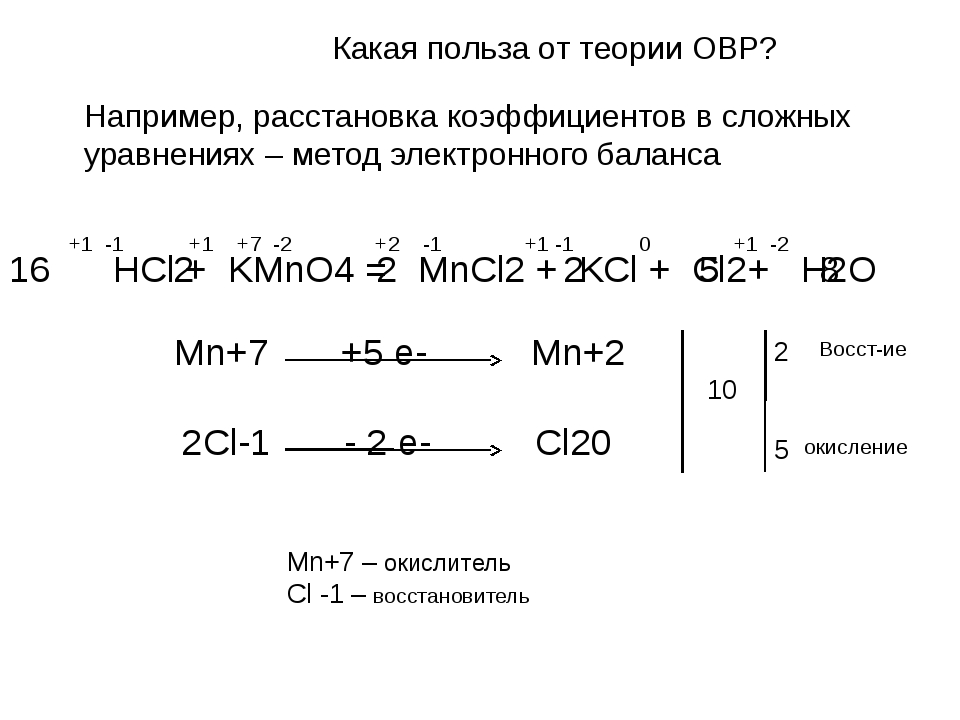
 Это
представляет
дистилляция нескольких
программы, написанные и используемые за последнее десятилетие или около того в пределах
Бристоль
Laser Group и в других местах, но это переписывание
от
нуля, чтобы создать универсальную и гибкую программу. PGOPHER будет
обрабатывать линейные молекулы и симметричные и асимметричные вершины,
в том числе
эффекты, связанные с неспаренными электронами и ядерным спином, с
отдельная мода для колебательной структуры.То
программа может
обрабатывать многие виды переходов, в том числе рамановские,
мультифотон и
запрещенные переходы. Он может имитировать несколько видов и
состояния
одновременно, включая специальные эффекты, такие как
возмущения
и предиссоциация, зависящая от состояния. Установка может быть в линию
позиции,
интенсивность
или контуры полос.
Это
представляет
дистилляция нескольких
программы, написанные и используемые за последнее десятилетие или около того в пределах
Бристоль
Laser Group и в других местах, но это переписывание
от
нуля, чтобы создать универсальную и гибкую программу. PGOPHER будет
обрабатывать линейные молекулы и симметричные и асимметричные вершины,
в том числе
эффекты, связанные с неспаренными электронами и ядерным спином, с
отдельная мода для колебательной структуры.То
программа может
обрабатывать многие виды переходов, в том числе рамановские,
мультифотон и
запрещенные переходы. Он может имитировать несколько видов и
состояния
одновременно, включая специальные эффекты, такие как
возмущения
и предиссоциация, зависящая от состояния. Установка может быть в линию
позиции,
интенсивность
или контуры полос.
