Закономерности изменения свойств элементов и их соединений.
Периодический закон изменения свойств химических элементов был открыт в 1869 году великим русским ученым Д.И. Менделеевым и в первоначальной формулировке звучал следующим образом:
«… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Атомным весом в те времена называли атомную массу химического элемента. Следует отметить, что в то время не было ничего известно о реальном строении атома и господствовала идея о его неделимости, в связи с чем Д.И. Менделеев сформулировал свой закон периодичного изменения свойств химических элементов и образованных ими соединений исходя из массы атомов. Позже после установления строения атома закон был сформулирован в следующей формулировке актуальной и в настоящий момент.
Свойства атомов химических элементов и образованных ими простых веществ находятся в периодической зависимости от зарядов ядер их атомов.
Графическим изображением периодического закона Д.И. Менделеева можно считать периодическую таблицу химических элементов, впервые построенную самим великим химиком, но несколько усовершенствованную и доработанную последующими исследователями. Фактически используемый в настоящее время вариант таблицы Д.И. Менделеева отражает современные представления и конкретные знания о строении атомов разных химических элементов.
Рассмотрим более детально современный вариант периодической системы химических элементов:
В таблице Д.И. Менделеева можно видеть строки, называемые периодами; всего их насчитывается семь. Фактически номер периода отражает число энергетических уровней, на которых расположены электроны в атоме химического элемента. Например, такие элементы, как фосфор, сера и хлор, обозначаемые символами P, S, и Cl, находятся в третьем периоде. Это говорит о том, что электроны в этих атомах расположены на трех энергетических уровнях или, если говорить более упрощенно, образуют трехслойную электронную оболочку вокруг ядер.
Каждый период таблицы, кроме первого, начинается щелочным металлом и заканчивается благородным (инертным) газом.
Все щелочные металлы имеют электронную конфигурацию внешнего электронного слоя ns1, а благородные газы — ns2np6, где n – номер периода, в котором находится конкретный элемент. Исключением из благородных газов является гелий (He) с электронной конфигурацией 1s2 .
Также можно заметить, что помимо периодов таблица делится на вертикальные столбцы — группы, которых насчитывается восемь. Большинство химических элементов имеет равное номеру группы количество валентных электронов. Напомним, что валентными электронами в атоме называются те электроны, которые принимают участие в образовании химических связей.
В свою очередь, каждая группа в таблице делится на две подгруппы – главную и побочную.
Для элементов главных групп количество валентных электронов всегда равно номеру группы. Например, у атома хлора, расположенного в третьем периоде в главной подгруппе VII группы, количество валентных электронов равно семи:
Элементы побочных групп имеют в качестве валентных электроны внешнего уровня или нередко электроны d-подуровня предыдущего уровня. Так, например, хром, находящийся в побочной подгруппе VI группы, имеет шесть валентных электронов – 1 электрон на 4s-подуровне и 5 электронов на 3d-подуровне:
Общее количество электронов в атоме химического элемента равно его порядковому номеру. Другими словами, общее количество электронов в атоме с номером элемента возрастает. Тем не менее, количество валентных электронов в атоме изменяется не монотонно, а периодически – от 1-го у атомов щелочных металлов до 8-ми для благородных газов.
Иными словами, причина периодического изменения каких-либо свойств химических элементов связана с периодическими изменениями в строении электронных оболочек.
При движении вниз по подгруппе атомные радиусы химических элементов возрастают ввиду увеличения количества электронных слоев. Тем не менее, при движении по одному ряду слева направо, то есть с ростом количества электронов для элементов, расположенных в одном ряду, происходит уменьшение радиуса атома. Данный эффект объясняется тем, что при последовательном заполнении одной электронной оболочки атома ее заряд, как и заряд ядра, увеличивается, что приводит к усилению взаимного притяжения электронов, в результате чего электронная оболочка «поджимается» к ядру:
Вместе с тем, внутри одного периода с ростом количества электронов происходит уменьшение радиуса атома, а также возрастает энергия связи каждого электрона внешнего уровня с ядром. Это означает, что, например, ядро атома хлора будет удерживать электроны своего внешнего уровня намного сильнее, чем ядро атома натрия единственный электрон внешнего электронного уровня. Более того, при столкновении атома натрия и хлора хлор «отберет» единственный электрон у атома натрия, то есть электронная оболочка хлора станет такой же, как у благородного газа аргона, а у натрия — такой же, как у благородного газа неона. Способность атома какого-либо химического элемента оттягивать на себя «чужие» электроны при столкновении с атомами другого химического элемента называется электроотрицательностью. Более подробно про электроотрицательность будет рассказано в главе, посвященной химическим связям, но нужно отметить, что, электроотрицательность, как и многие другие параметры химических элементов, также подчиняется периодическому закону Д.И. Менделеева. Внутри одной подгруппы химических элементов электроотрицательность убывает, а при движении по ряду одного периода вправо электроотрицательность возрастает.
Следует усвоить один полезный мнемонический прием, позволяющий восстановить в памяти то, как меняются те или иные свойства химического элемента. Заключается он в следующем. Представим себе циферблат обычных круглых часов. Если его центр поместить в правый нижний угол таблицы Д.И. Менделеева, то свойства химических элементов будут однообразно изменяться при движении по ней вверх и вправо (по часовой стрелке) и противоположно вниз и влево (против часовой стрелки):
Попробуем применить данный прием к размеру атома. Допустим, что вы точно помните, что при движении вниз по подгруппе в таблице Д.И. Менделеева радиус атома увеличивается, поскольку растет число электронных оболочек, но напрочь забыли, как изменяется радиус при движении влево и вправо.
Тогда нужно действовать следующим образом. Поставьте большой палец правой руки в правый нижний угол таблицы. Движение вниз по подгруппе будет совпадать с движением указательного пальца против часовой стрелки, как и движение влево по периоду, то есть радиус атома при движении влево по периоду, как и при движении вниз по подгруппе, увеличивается.
Аналогично и для других свойств химических элементов. Точно зная, как изменяется то или иное свойство элемента при движении вверх-вниз, благодаря данному методу вы сможете восстановить в памяти то, как меняется это же свойство при движении влево или вправо по таблице.
scienceforyou.ru
Закономерности изменения химических свойств элементов. Характеристика элементов
-
Дан ряд элементов: 1) C; 2) H; 3) O; 4) Mg; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения восстановительной способности их атомов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Sn; 2) Fe; 3) C; 4) Pb; 5) Cr.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите выбранные элементы в порядке усиления основных свойств образуемых ими высших оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) O; 2) H; 3) Be; 4) Cu; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите эти элементы в порядке уменьшения атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) H; 2) S; 3) F; 4) Na; 5) Mg.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите эти элементы в порядке усиления основных свойств образуемых ими оксидов.
Запишите в поле ответа номера выбранных элементов в нужной
последовательности.
-
Дан ряд элементов: 1) Mg; 2) Al; 3) Na; 4) S; 5) Si.
Из указанных в ряду химических элементов выберите три металла.
Расположите выбранные элементы в порядке увеличения восстановительных
свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) B; 2) Al; 3) F; 4) Fe; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) H; 2) He; 3) Al; 4) Si; 5) P.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке усиления их неметаллических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Li; 2) Be; 3) C; 4) Si; 5) P.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке усиления их металлических свойств.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Cl; 2) F; 3) N; 4) Li; 5) S.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Be; 2) N; 3) Na; 4) C; 5) Cu.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания восстановительных свойств соответствующих им простых веществ. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Na; 2) Cl; 3) Si; 4) Mn; 5) Cr.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке убывания их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) C; 2) N; 3) F; 4) Be; 5) Ne.
Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке уменьшения кислотного характера их высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Al; 2) C; 3) Cl; 4) P; 5) Ca.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения основных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Na; 2) Al; 3) Zn; 4) P; 5) Kr.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения восстановительных свойств соответствующих им простых веществ. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) O; 2) Fe; 3) Mn; 4) Si; 5) C.
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке увеличения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Cl; 2) He; 3) Mg; 4) Al; 5) Cu.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения кислотных свойств их высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Li, 2) Ca, 3) Cs, 4) N, 5) K.
Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке уменьшения металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Na, 2) Be, 3) Cl, 4) Ba, 5) Mg.
Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке усиления металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения радиуса атома.
1) H;
2) Li;
3) F;
4) Al;
5) N.
Запишите в поле ответа номера выбранных элементов.
-
Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке усиления неметаллических свойств.
1) N;
2) B;
3) Si;
4) O;
5) Al.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) H; 2) S; 3) I; 4) Na; 5) Mg.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите эти элементы в порядке усиления основных свойств образуемых ими оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Be; 2) H; 3) O; 4) Cu; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите эти элементы в порядке уменьшения атомного радиуса.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Mg; 2) H; 3) O; 4) C; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке уменьшения восстановительной способности их атомов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) C; 2) Fe; 3) Sn; 4) Pb; 5) Cr.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите эти элементы в порядке ослабления кислотных свойств образуемых ими высших оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Al; 2) Si; 3) Mg; 4) C; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) B; 2) Al; 3) F; 4) Fe; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Al; 2) Li; 3) Mg; 4) C; 5) N.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите эти элементы в порядке ослабления кислотных свойств образуемых ими высших оксидов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Rb; 2) P; 3) Mg; 4) Cr; 5) Al.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения числа валентных электронов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) Sn; 2) F; 3) Al; 4) Cr; 5) N.
Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке уменьшения числа валентных электронов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
-
Дан ряд элементов: 1) S; 2) F; 3) Al; 4) Si; 5) Li.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке усиления восстановительной способности их атомов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответы:
-
351
-
314
-
351
-
254
-
213
-
351
-
345
-
321
-
234
-
241
-
132
-
214
-
143
-
421
-
154
-
341
-
351
-
254
-
352
-
214
-
254
-
153
-
453
-
134
-
213
-
351
-
542
-
253
-
413
-
143
-
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
www.yoursystemeducation.com
А2. Закономерности изменения химических свойств элементов и их соединений по
Documents войти Загрузить ×- Естественные науки
- Химия
Related documents

А 2

А2. Периодический закон 1. В ряду Na —>Mg —>Al —

Тест А2-1 1. Химические элементы расположены в порядке

a_2 (format DOC / 16 КБ )

А2. Периодический закон и периодическая система химических

Вопросы на конференц

1.2.2. Расширенный метод Хюккеля
Викторина по химии9 класс
1. В ряду элементов мышьяк селен бром возрастает 1)атомный

Графический диктант

ТЕСТ по теме «Периодический закон и периодическая система Вариант № 1

О3 — Narod.ru

Периодический закон и система химических элементов Д.И

studydoc.ru
Закономерности изменения химических свойств элементов и их соединений по периодам и группам (1)
Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
1. В ряду Na —>Mg —>Al —>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 —> P2O5 —> As2O5 —> Sb2O5
1) ослабевают 2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле Rh4?
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва 2) Na, Mg, A1
3) K,Ca,Fe 4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li 2) Na,Mg,Al, S 3) О, S, Se, Те 4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий 2) алюминий 3) фосфор 4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4} S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1)увеличивается 2)уменьшается 3)не изменяется 4)изменяется периодически
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1)хлор 2)германий 3)мышьяк 4) селен
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиус атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4} углерода
35. В ряду химических элементов
Na —>Mg —> Al —> Si
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1)1s22s22p1 2)1s22s22p63s1 3)1s22s2 4) 1s22s22p63s23p1
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2.
|
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. |
Упражнения.
1. Определите элемент:
|
ОПИСАНИЕ |
ЭЛЕМЕНТ |
|
…..4s24p3 |
|
|
…..4d15s2 |
|
|
IV период, VI группа, главная подгруппа |
|
|
V период, высшая валентность II, не образует гидридов |
|
|
VI период, высшая валентность IV, не образует водородных соединений |
|
|
III период, высшая степень окисления +4 |
|
|
V период, высший оксид Э2О7, имеет летучее водородное соединение |
2. Сравните свойства атомов, поставьте знак > ,
1) Радиус атома Са ______ Ва
2) Радиус атома Na ______ Al
3) Электроотрицательность атома Са _____ Ва
4) Металлические свойства Li _____ Rb
5) Неметаллические свойства As _____ Br
6) Число внешних электронов у атома Са _______Cu
3. Составить формулы высших оксидов и определить их характер (кислотный, основный, амфотерный):
|
Элемент |
Высшая степень окисления |
Высший оксид |
Характер оксида |
|
Са |
|||
|
Zn |
|||
|
As |
|||
|
Br |
Тесты A2.
1. Номер периода, в котором расположен химический элемент, характеризует
1) число заполненных энергетических уровней 2) число валентных электронов
3) формулу высшего оксида 4) высшую валентность
2. Номер группы элемента в периодической системе соответствует
1) заряду ядра атома этого элемента 2) числу электронов на валентной оболочке атома
3) числу электронных уровней атома этого элемента
4) среднему значению массовых чисел изотопов этого элемента.
3. У соединений элементов 3 периода слева направо возрастают
1) основные свойства высших гидроксидов
2) восстановительные свойства водородных соединений;
3) кислотные свойства высших гидроксидов
4) основные свойства высших оксидов.
4. Среди всех элементов 3-го периода элемент натрий обладает…
1) самой высокой электроотрицательностью
2) наиболее выраженными металлическими свойствами
3) самым маленьким радиусом атома
4) самой большой плотностью
5. Какую из электронных конфигураций валентных электронов может иметь элемент, проявляющий в соединениях максимальную степень окисления +6
2s22p5 2) 3s22d4 3) 4s13d5 4) 2s22p4
6. Элемент проявляет в соединениях максимальную степень окисления +3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 2s22p5 2) 2s22p3 3) 3s24d3 4) 4s24p1
7. В какой группе находится элемент, имеющий электронную конфигурацию 4d105s25p4
1) в пятой 2) в четвертой 3) в десятой 4) в шестой
8. В какой группе находится элемент, имеющий электронную конфигурацию 4d85s2
1) в пятой 2) во второй 3) в восьмой 4) в десятой
9. Элемент IV периода, который с кислородом образует высший оксид ЭО3, а с водородом не образует летучих соединений – это 1) селен 2) свинец 3)германий 4) хром
10. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22р63з23р4
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна +4. .
1)верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
11. Элемент четвертого периода, высший оксид которого имеет формулу ЭО и который с водородом образует солеобразное соединение состава ЭН2 – это…
1) кальций 2) цинк 3) бериллий 4) селен
12. Формула высшего оксида элемента – Э2О. Какая конфигурация валентных электронов возможна у этого атома? 1) 3s1 2) 3d14s2 3) 2s22p1 4) 2s22p5
13.Формула высшего оксида некоторого элемента — ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 4d6 3) 3s2 Зр4 2) 2s22р4 4) 3s1 3d5
14. Формула высшего оксида элемента с электронной конфигурацией атома 1s22s22p63s23p63d34s2 1) ЭО 2) Э2О 3) Э2О3 4) Э2О5
15. Какое летучее водородное соединение характерно для элемента, высший оксид которого имеет формулу Э2О7: 1) НЭ 2) Н2Э 3) ЭН3 4) ЭН7
16. Формулы высшего оксида и высшего гидроксида элемента, имеющего
электронную конфигурацию 1s22s22p63s23p64s2
1) SrO и Sr(OH)2 3) СаО и Са(ОН)2 2) К2О и КОН 4) Rb2O и RbOН
17. Формула водородного соединения элемента с электронной конфигурацией атома 1s22s22p63s23p63d104s24p4 – это 1) ЭН3 2) ЭН2 3) ЭН 4) ЭН4
18. Неметалл образует высший оксид состава ЭО3, его водородное соединение будет иметь формулу 1) НЭ 2) Н2Э 3) ЭН3 4) ЭН4
19. Некоторый элемент-неметалл X образует летучее водородное соединение состава ХН3. Какова формула высшего оксида данного неметалла?
1)Х2О5 2)ХО2 3)Х2О3 4)ХО3
20. Формула высшей кислородсодержащей кислоты, образованной некоторым элементом, — H2ЭО4. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии? 1) 2s22p4 2) 3s23p4 3) 4s24d4 4) 4f6
21. Формула высшей кислородсодержащей кислоты, образованной некоторым элементом, — HЭО4. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии? 1) 2s22p5 2) 3s23p5 3) 4s24d5 4) 4f7
22. Характер оксидов в ряду Na2O -MgO — Al2O3 изменяется от
1) основного к кислотному 2) основного к амфотерному
3) амфотерного к кислотному 4) кислотного к основному
23.Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) хлор 2) германий 3) мышьяк 4) селен
24. Наиболее электроотрицательным элементом является 1) кремний 2) азот 3) фосфор 4) калий
25. Из перечисленных элементов наиболее электроотрицательным является
1) азот 2) кислород 3) хлор 4) фтор
26 . Наибольшей электроотрицательностью обладает элемент, который в Периодической системе находится в:
1) 2 периоде, III группе 2) 2 периоде, VI группе 3) 3 периоде, III группе 4) 3 периоде, VI группе
27.Химические элементы расположены в порядке возрастания их атомного радиуса в ряду:
1) Be, B, C, N 2)O, S, Se, Te 3)Rb, K, Na, Li 4)Mg, Al, Si, Р
28. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li -Be -B -C 2) Ar –Cl- S- P 3) Si -Al -Mg -Na 4) Ne -F -O -N
29. Какой из приведенных ниже рядов химических элементов характеризуется возрастанием атомных радиусов? 1)Te, Se, S, O 2)Na, Mg, Al, Si 3)C, B, Be, Li 4)Ba, Al, Ga, Ge
30. Какие из приведенных ниже рядов ионов характеризуются уменьшением ионных радиусов?
1)S2- , Cl — , K+ , Ca2+ 2)As5+ , V5+ , Cl5+ , I5+ 3)Rb+ , K+ , Ag+ , Cu+ 4)F— , Si4+ , Mg2+ , Na+
31. Атом какого химического элемента, из числа приведенных ниже, имеет наименьший радиус?
1)K 2)Al 3)Sn 4)C 5)O 6)S
32. Способность отдавать электроны атомом элемента увеличивается в ряду
l)Ca, Mg, Be 2)B, C, F 3) Al, Mg, Na 4) S, Cl, F
33. Способность принимать электроны атомом элемента увеличивается в
ряду с порядковыми номерами: 1) 16,20 2) 6, 11 3) 12,17 4) 9,10
34. Наименьшую энергию нужно затратить на отрыв электрона от атома
1) Аs 2) Sе 3) S 4) Р
35. Притяжение электронов внешнего слоя к ядру ослабевает в ряду:
1) Al — Mg — Ca 2) Al — Si — C 3) Na — Mg — Be 4) Se — S — Cl
36. В ряду Be – B – C – N происходит
увеличение радиуса атомов
увеличение электроотрицательности
увеличение силы притяжения валентных электронов к ядру
уменьшение числа неспаренных электронов в основном состоянии атома
37.B ряду химических элементов Na Mg Al Si
1)увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев в атомах
3) уменьшается число протонов в ядрах атомов
4)увеличиваются радиусы атомов
38. У К и Rb одинаковы…
1) атомные радиусы 2) значения относительной электроотрицательности
3) заряды ядер 4) высшие степени окисления
39. У Rb и Sr одинаковы…
1) атомные радиусы 2) значения относительной электроотрицательности
3) степени окисления 4) количества электронных
gigabaza.ru
Химия, тест помогите решить. Химики срочно помогите!
1- Планетарная модель строения атома не могла объяснить:а) Излучение и поглощение энергии атомом.
б) Наличие электронов в атоме
в) Существование атомного ядра
г) Все ответы верны
2- Номер периода соответствует:
а) Заряду ядра атома
б) Числу электронов в наружном слое
в) Числу электронных слоев
г) Числу электронов в атоме
3- Группа элементов, относящихся к p-электронному семейству:
а) бром, марганец, фтор
б) аргон, гелий, неон
в) Алюминий, кремний, фосфор
г) Галлий, германий, скандий
4- Число s-орбиталей на четвертом энергетическом уровне равно:
а) 0
б) 1
в) 2
г) 4
5- Нуклид, в ядре которого содержится 30 нейтронов:
а) 54Fe
б) 56Fe
в) 57Fe
г) 58Fe
6- Атомные радиусы у элементов одинакового периода с увеличением порядкового номера:
а) увеличивается
б) уменьшается
в) изменяются периодически
г) не изменяются
7- Ряд элементов, расположенных в порядке ослабевания неметаллических свойств:
а) Fe, Cl, o
б) Si, P, N
в) S, Se, Br
г) C, Si, P
8- Закономерность изменения свойств элементов в ряду:
Be-Mg-Ca
а) Возрастает степень окисления в оксидах
б) увеличивается число энергетических уровней
в) ослабевают металлические свойства
г) уменьшаются атомные радиусы
9- Даны элементы: Al, Be, Ca, Si, Mg, B.
Выберите три любых элемента и расположите их так чтобы для них в ряду с увеличением зарядов ядер атомов были справедливы следующие утверждения:
а) атомные радиусы возрастают
б) электроотрицательность увеличивается
в) возрастает число электронов на наружном электронном слое
г) металлические свойства ослабевают
10- Составьте электронные формулы двух ионов, имеющих одинаковый заряд, но различное число энергетических уровней.
Люди добрые помогите пожалуйста, срочно нужна помощь, буду очень благодарен за помощь!
otvet.mail.ru
Тест «Закономерности изменения химических свойств элементов и их соединений по периодам и группам»
Пояснительная записка
Задания составлены по аналогии с тестами, опубликованными в пособии «ЕГЭ. Химия: типовые экзаменационные варианты: 30 вариантов/ под ред. А.А. Кавериной», вышедшем в издательстве «Национальное образование» (Москва, 2017 год)
| 1) Cl | 2) K | 3) Si | 4) S | 5) O |
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке возрастания кислотных свойств их водородных соединений.
| 1) P | 2) Cl | 3) Br | 4) S | 5) F |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения их металлических свойств.
| 1) Al | 2) K | 3) Mg | 4) Rb | 5) Na |
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания кислотных свойств их высших гидроксидов.
| 1) B | 2) P | 3) N | 4) C | 5) As |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения числа внешних электронов в атомах этих элементов.
| 1) N | 2) P | 3) Li | 4) Na | 5) Al |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания радиуса их атомов.
| 1) O | 2) S | 3) F | 4) Se | 5) Be |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке усиления окислительных свойств их атомов.
| 1) Se | 2) Br | 3) Cl | 4) As | 5) I |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке усиления основных свойств образуемых ими оксидов.
| 1) Sn | 2) Na | 3) C | 4) Mg | 5) Si |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три металла. Расположите выбранные элементы в порядке уменьшения восстановительных свойств.
| 1) Mg | 2) Na | 3) Ba | 4) Ca | 5) Al |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите эти элементы в порядке увеличения силы притяжения валентных электронов.
| 1) P | 2) Cl | 3) S | 4) As | 5) N |
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
ОтветыВопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
Вопрос 6
Вопрос 7
Вопрос 8
Вопрос 9
Вопрос 10
xn--j1ahfl.xn--p1ai
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
 ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
 В пределах одного периода 1. Возрастают: I II IV V VI VIII Li Be B C N O F Ne +3 +4 +5 +6 +7 +8 +9 +10 2 1 2 2 23 24 25 26 27 28 üЗаряд атомного ядра üЧисло электронов во внешнем слое атомов üВысшая степень окисления элементов в соединениях Li+1 Be+2 B+3 C+4 N+5 üЭлектроотрицательность üОкислительные свойства üНеметаллические свойства простых веществ üКислотные свойства высших оксидов и гидроксидов
В пределах одного периода 1. Возрастают: I II IV V VI VIII Li Be B C N O F Ne +3 +4 +5 +6 +7 +8 +9 +10 2 1 2 2 23 24 25 26 27 28 üЗаряд атомного ядра üЧисло электронов во внешнем слое атомов üВысшая степень окисления элементов в соединениях Li+1 Be+2 B+3 C+4 N+5 üЭлектроотрицательность üОкислительные свойства üНеметаллические свойства простых веществ üКислотные свойства высших оксидов и гидроксидов
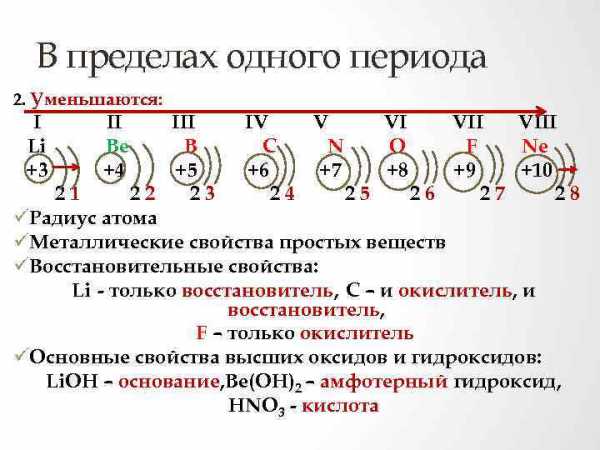 В пределах одного периода 2. Уменьшаются: I Li +3 II Be +4 III IV V VI VIII B C N O F Ne +5 +6 +7 +8 +9 +10 21 22 23 24 25 26 27 28 üРадиус атома üМеталлические свойства простых веществ üВосстановительные свойства: Li — только восстановитель, С – и окислитель, и восстановитель, F – только окислитель üОсновные свойства высших оксидов и гидроксидов: Li. OH – основание, Be(OH)2 – амфотерный гидроксид, HNO 3 — кислота
В пределах одного периода 2. Уменьшаются: I Li +3 II Be +4 III IV V VI VIII B C N O F Ne +5 +6 +7 +8 +9 +10 21 22 23 24 25 26 27 28 üРадиус атома üМеталлические свойства простых веществ üВосстановительные свойства: Li — только восстановитель, С – и окислитель, и восстановитель, F – только окислитель üОсновные свойства высших оксидов и гидроксидов: Li. OH – основание, Be(OH)2 – амфотерный гидроксид, HNO 3 — кислота
 В пределах одного периода 3. Не изменяется: I II III Li Be B +3 +4 +5 2 1 22 23 IV V C N +6 +7 24 25 VI VIII O F Ne +8 +9 +10 26 27 28 Число электронных слоёв (энергетических уровней) в атоме – равно номеру периода
В пределах одного периода 3. Не изменяется: I II III Li Be B +3 +4 +5 2 1 22 23 IV V C N +6 +7 24 25 VI VIII O F Ne +8 +9 +10 26 27 28 Число электронных слоёв (энергетических уровней) в атоме – равно номеру периода
 Закрепим! В периодах слева направо заряд ядра атома 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
Закрепим! В периодах слева направо заряд ядра атома 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
 Закрепим! В периодах справа налево число энергетических уровней 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
Закрепим! В периодах справа налево число энергетических уровней 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
 Закрепим! В периодах слева направо восстановительные свойства элемента 1) 2) 3) 4) Усиливаются Ослабевают Не изменяются Сначала ослабевают, а затем усиливаются
Закрепим! В периодах слева направо восстановительные свойства элемента 1) 2) 3) 4) Усиливаются Ослабевают Не изменяются Сначала ослабевают, а затем усиливаются
 Закрепим! Атомы химических элементов алюминия и кремния имеют одинаковое: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Число электронов
Закрепим! Атомы химических элементов алюминия и кремния имеют одинаковое: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Число электронов
 Закрепим! Атомы химических элементов серы и хлора имеют различное: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов
Закрепим! Атомы химических элементов серы и хлора имеют различное: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов
 В пределах одной А группы 1. Возрастают: IА • Заряд атомного ядра Li +3 • Число электронных слоёв в атоме • Радиус атома 21 • Восстановительные свойства • Металлические свойства Na +11 простых веществ 281 • Основные свойства высших оксидов и гидроксидов • Кислотные свойства (степень K +19 диссоциации) 2881 бескислородных кислот неметаллов Rb +37 2 8 18 8 1
В пределах одной А группы 1. Возрастают: IА • Заряд атомного ядра Li +3 • Число электронных слоёв в атоме • Радиус атома 21 • Восстановительные свойства • Металлические свойства Na +11 простых веществ 281 • Основные свойства высших оксидов и гидроксидов • Кислотные свойства (степень K +19 диссоциации) 2881 бескислородных кислот неметаллов Rb +37 2 8 18 8 1
 В пределах одной А группы 2. Уменьшаются: VII А • Электроотрицательность; F +9 27 • Окислительные свойства; Cl +17 287 Br +35 2 8 18 7 I +53 2 8 18 18 7 • Неметаллические свойства простых веществ; • Прочность (устойчивость) летучих водородных соединений.
В пределах одной А группы 2. Уменьшаются: VII А • Электроотрицательность; F +9 27 • Окислительные свойства; Cl +17 287 Br +35 2 8 18 7 I +53 2 8 18 18 7 • Неметаллические свойства простых веществ; • Прочность (устойчивость) летучих водородных соединений.
 В пределах одной А группы 3. Не изменяются: II А Be +4 22 • Число электронов во внешнем электронном слое Mg +12 282 Ca +20 • Степень окисления элементов в высших оксидах и гидроксидах (как правило, равная номеру группы) 2882 Sr +38 2 8 18 8 2 • Be+2 Mg+2 Ca+2 Sr+2
В пределах одной А группы 3. Не изменяются: II А Be +4 22 • Число электронов во внешнем электронном слое Mg +12 282 Ca +20 • Степень окисления элементов в высших оксидах и гидроксидах (как правило, равная номеру группы) 2882 Sr +38 2 8 18 8 2 • Be+2 Mg+2 Ca+2 Sr+2
 Закрепим! • В главных подгруппах снизу вверх заряд ядра атома 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
Закрепим! • В главных подгруппах снизу вверх заряд ядра атома 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
 Закрепим! В главных подгруппах снизу вверх число электронов на внешнем уровне 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
Закрепим! В главных подгруппах снизу вверх число электронов на внешнем уровне 1) 2) 3) 4) Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем уменьшается
 Закрепим! В главных подгруппах снизу вверх окислительные свойства элемента 1) 2) 3) 4) Усиливаются Ослабевают Не изменяется Сначала увеличивается, а затем уменьшается
Закрепим! В главных подгруппах снизу вверх окислительные свойства элемента 1) 2) 3) 4) Усиливаются Ослабевают Не изменяется Сначала увеличивается, а затем уменьшается
 Закрепим! Атомы химических элементов углерода и кремния имеют одинаковое: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов в атоме
Закрепим! Атомы химических элементов углерода и кремния имеют одинаковое: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов в атоме
 Закрепим! Атомы химических элементов азота и фосфора имеют различное: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов
Закрепим! Атомы химических элементов азота и фосфора имеют различное: 1) 2) 3) 4) Значение зарядов ядер атомов; Число электронов на внешнем слое; Число электронных слоёв; Общее число электронов
present5.com
