Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl 3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na 2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO 3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Методы получения основных классов неорганических соединенийНазвания некоторых неорганических кислот и солей
www.repetitor2000.ru
Химические свойства основных классов неорганических соединений Классы
 Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений
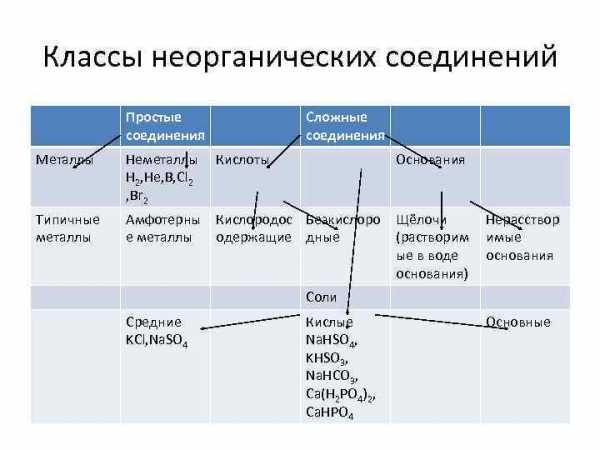 Классы неорганических соединений Простые соединения Сложные соединения Металлы Неметаллы H 2, He, B, Cl 2 , Br 2 Кислоты Основания Типичные металлы Амфотерны Кислородос Безкислоро е металлы одержащие дные Щёлочи (растворим ые в воде основания) Нерасствор имые основания Соли Средние KCl, Na. SO 4 Кислые Na. HSO 4, KHSO 3, Na. HCO 3, Ca(H 2 PO 4)2, Ca. HPO 4 Основные
Классы неорганических соединений Простые соединения Сложные соединения Металлы Неметаллы H 2, He, B, Cl 2 , Br 2 Кислоты Основания Типичные металлы Амфотерны Кислородос Безкислоро е металлы одержащие дные Щёлочи (растворим ые в воде основания) Нерасствор имые основания Соли Средние KCl, Na. SO 4 Кислые Na. HSO 4, KHSO 3, Na. HCO 3, Ca(H 2 PO 4)2, Ca. HPO 4 Основные
 Кислотные оксиды • Кислотный оксид + вода = кислота (исключение — Si. O 2) SO 3 + H 2 O = H 2 SO 4 Cl 2 O 7 + H 2 O = 2 HCl. O 4 Кислотный оксид + щелочь = соль + вода SO 2 + 2 Na. OH = Na 2 SO 3 + H 2 O P 2 O 5 + 6 KOH = 2 K 3 PO 4 + 3 H 2 O Кислотный оксид + основный оксид = соль CO 2 + Ba. O = Ba. CO 3 Si. O 2 + K 2 O = K 2 Si. O 3
Кислотные оксиды • Кислотный оксид + вода = кислота (исключение — Si. O 2) SO 3 + H 2 O = H 2 SO 4 Cl 2 O 7 + H 2 O = 2 HCl. O 4 Кислотный оксид + щелочь = соль + вода SO 2 + 2 Na. OH = Na 2 SO 3 + H 2 O P 2 O 5 + 6 KOH = 2 K 3 PO 4 + 3 H 2 O Кислотный оксид + основный оксид = соль CO 2 + Ba. O = Ba. CO 3 Si. O 2 + K 2 O = K 2 Si. O 3
 Основные оксиды • Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов) Ca. O + H 2 O = Ca(OH)2 Na 2 O + H 2 O = 2 Na. OH Основный оксид + кислота = соль + вода Cu. O + 2 HCl = Cu. Cl 2 + H 2 O 3 K 2 O + 2 H 3 PO 4 = 2 K 3 PO 4 + 3 H 2 O Основный оксид + кислотный оксид = соль Mg. O + CO 2 = Mg. CO 3 Na 2 O + N 2 O 5 = 2 Na. NO 3
Основные оксиды • Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов) Ca. O + H 2 O = Ca(OH)2 Na 2 O + H 2 O = 2 Na. OH Основный оксид + кислота = соль + вода Cu. O + 2 HCl = Cu. Cl 2 + H 2 O 3 K 2 O + 2 H 3 PO 4 = 2 K 3 PO 4 + 3 H 2 O Основный оксид + кислотный оксид = соль Mg. O + CO 2 = Mg. CO 3 Na 2 O + N 2 O 5 = 2 Na. NO 3
 Амфотерные оксиды • Амфотерный оксид + кислота = соль + вода Al 2 O 3 + 6 HCl = 2 Al. Cl 3 + 3 H 2 O Zn. O + H 2 SO 4 = Zn. SO 4 + H 2 O Амфотерный оксид + щелочь = соль (+ вода) Zn. O + 2 KOH = K 2 Zn. O 2 + H 2 O (Правильнее: Zn. O + 2 KOH + H 2 O = K 2[Zn(OH)4]) Al 2 O 3 + 2 Na. OH = 2 Na. Al. O 2 + H 2 O (Правильнее: Al 2 O 3 + 2 Na. OH + 3 H 2 O = 2 Na[Al(OH)4])
Амфотерные оксиды • Амфотерный оксид + кислота = соль + вода Al 2 O 3 + 6 HCl = 2 Al. Cl 3 + 3 H 2 O Zn. O + H 2 SO 4 = Zn. SO 4 + H 2 O Амфотерный оксид + щелочь = соль (+ вода) Zn. O + 2 KOH = K 2 Zn. O 2 + H 2 O (Правильнее: Zn. O + 2 KOH + H 2 O = K 2[Zn(OH)4]) Al 2 O 3 + 2 Na. OH = 2 Na. Al. O 2 + H 2 O (Правильнее: Al 2 O 3 + 2 Na. OH + 3 H 2 O = 2 Na[Al(OH)4])
 Амфотерные оксиды 1. Амфотерный оксид + кислотный оксид = соль Zn. O + CO 2 = Zn. CO 3 2. Амфотерный оксид + основный оксид = соль (при сплавлении) Zn. O + Na 2 O = Na 2 Zn. O 2 Al 2 O 3 + K 2 O = 2 KAl. O 2 Cr 2 O 3 + Ca. O = Ca(Cr. O 2)2 •
Амфотерные оксиды 1. Амфотерный оксид + кислотный оксид = соль Zn. O + CO 2 = Zn. CO 3 2. Амфотерный оксид + основный оксид = соль (при сплавлении) Zn. O + Na 2 O = Na 2 Zn. O 2 Al 2 O 3 + K 2 O = 2 KAl. O 2 Cr 2 O 3 + Ca. O = Ca(Cr. O 2)2 •
 Кислоты • Кислота + основный оксид = соль + вода 2 HNO 3 + Cu. O = Cu(NO 3)2 + H 2 O 3 H 2 SO 4 + Fe 2 O 3 = Fe 2(SO 4)3 + 3 H 2 O Кислота + амфотерный оксид = соль + вода 3 H 2 SO 4 + Cr 2 O 3 = Cr 2(SO 4)3 + 3 H 2 O 2 HBr + Zn. O = Zn. Br 2 + H 2 O Кислота + основание = соль + вода H 2 Si. O 3 + 2 KOH = K 2 Si. O 3 + 2 H 2 O 2 HBr + Ni(OH)2 = Ni. Br 2 + 2 H 2 O
Кислоты • Кислота + основный оксид = соль + вода 2 HNO 3 + Cu. O = Cu(NO 3)2 + H 2 O 3 H 2 SO 4 + Fe 2 O 3 = Fe 2(SO 4)3 + 3 H 2 O Кислота + амфотерный оксид = соль + вода 3 H 2 SO 4 + Cr 2 O 3 = Cr 2(SO 4)3 + 3 H 2 O 2 HBr + Zn. O = Zn. Br 2 + H 2 O Кислота + основание = соль + вода H 2 Si. O 3 + 2 KOH = K 2 Si. O 3 + 2 H 2 O 2 HBr + Ni(OH)2 = Ni. Br 2 + 2 H 2 O
 Кислоты 1. Кислота + амфотерный гидроксид = соль + вода 3 HCl + Cr(OH)3 = Cr. Cl 3 + 3 H 2 O 2 HNO 3 + Zn(OH)2 = Zn(NO 3)2 + 2 H 2 O Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты 2 HBr + Ca. CO 3 = Ca. Br 2 + H 2 O + CO 2 H 2 S + K 2 Si. O 3 = K 2 S + H 2 Si. O 3 Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород 2 HCl + Zn = Zn. Cl 2 + H 2 SO 4 (разб. ) + Fe = Fe. SO 4 + H 2 Важно: кислоты-окислители (HNO 3, конц. H 2 SO 4) реагируют с металлами по-другому.
Кислоты 1. Кислота + амфотерный гидроксид = соль + вода 3 HCl + Cr(OH)3 = Cr. Cl 3 + 3 H 2 O 2 HNO 3 + Zn(OH)2 = Zn(NO 3)2 + 2 H 2 O Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты 2 HBr + Ca. CO 3 = Ca. Br 2 + H 2 O + CO 2 H 2 S + K 2 Si. O 3 = K 2 S + H 2 Si. O 3 Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород 2 HCl + Zn = Zn. Cl 2 + H 2 SO 4 (разб. ) + Fe = Fe. SO 4 + H 2 Важно: кислоты-окислители (HNO 3, конц. H 2 SO 4) реагируют с металлами по-другому.
 Амфотерные гидроксиды 1. Амфотерный гидроксид + кислота = соль + вода 2 Al(OH)3 + 3 H 2 SO 4 = Al 2(SO 4)3 + 6 H 2 O Be(OH)2 + 2 HCl = Be. Cl 2 + 2 H 2 O 2. Амфотерный гидроксид + щелочь = соль + вода (при сплавлении) Zn(OH)2 + 2 Na. OH = Na 2 Zn. O 2 + 2 H 2 O Al(OH)3 + Na. OH = Na. Al. O 2 + 2 H 2 O 3. Амфотерный гидроксид + щелочь = соль (в водном растворе) Zn(OH)2 + 2 Na. OH = Na 2[Zn(OH)4] Sn(OH)2 + 2 Na. OH = Na 2[Sn(OH)4] Be(OH)2 + 2 Na. OH = Na 2[Be(OH)4] Al(OH)3 + Na. OH = Na[Al(OH)4] Cr(OH)3 + 3 Na. OH = Na 3[Cr(OH)6]
Амфотерные гидроксиды 1. Амфотерный гидроксид + кислота = соль + вода 2 Al(OH)3 + 3 H 2 SO 4 = Al 2(SO 4)3 + 6 H 2 O Be(OH)2 + 2 HCl = Be. Cl 2 + 2 H 2 O 2. Амфотерный гидроксид + щелочь = соль + вода (при сплавлении) Zn(OH)2 + 2 Na. OH = Na 2 Zn. O 2 + 2 H 2 O Al(OH)3 + Na. OH = Na. Al. O 2 + 2 H 2 O 3. Амфотерный гидроксид + щелочь = соль (в водном растворе) Zn(OH)2 + 2 Na. OH = Na 2[Zn(OH)4] Sn(OH)2 + 2 Na. OH = Na 2[Sn(OH)4] Be(OH)2 + 2 Na. OH = Na 2[Be(OH)4] Al(OH)3 + Na. OH = Na[Al(OH)4] Cr(OH)3 + 3 Na. OH = Na 3[Cr(OH)6]
 Щелочи 1. Щелочь + кислотный оксид = соль + вода Ba(OH)2 + N 2 O 5 = Ba(NO 3)2 + H 2 O 2 Na. OH + CO 2 = Na 2 СO 3 + H 2 O 2. Щелочь + кислота = соль + вода 3 KOH + H 3 PO 4 = K 3 PO 4 + 3 H 2 O Bа(OH)2 + 2 HNO 3 = Ba(NO 3)2 + 2 H 2 O 3. Щелочь + амфотерный оксид = соль + вода 2 Na. OH + Zn. O = Na 2 Zn. O 2 + H 2 O (Правильнее: 2 Na. OH + Zn. O + H 2 O = Na 2[Zn(OH)4])
Щелочи 1. Щелочь + кислотный оксид = соль + вода Ba(OH)2 + N 2 O 5 = Ba(NO 3)2 + H 2 O 2 Na. OH + CO 2 = Na 2 СO 3 + H 2 O 2. Щелочь + кислота = соль + вода 3 KOH + H 3 PO 4 = K 3 PO 4 + 3 H 2 O Bа(OH)2 + 2 HNO 3 = Ba(NO 3)2 + 2 H 2 O 3. Щелочь + амфотерный оксид = соль + вода 2 Na. OH + Zn. O = Na 2 Zn. O 2 + H 2 O (Правильнее: 2 Na. OH + Zn. O + H 2 O = Na 2[Zn(OH)4])
 Щелочи 1. Щелочь + амфотерный гидроксид = соль (в водном растворе) 2 Na. OH + Zn(OH)2 = Na 2[Zn(OH)4] Na. OH + Al(OH)3 = Na[Al(OH)4] 2. Щелочь + растворимая соль = нерастворимое основание + соль Ca(OH)2 + Cu(NO 3)2 = Cu(OH)2 + Ca(NO 3)2 3 KOH + Fe. Cl 3 = Fe(OH)3 + 3 KCl 3. Щелочь + металл (Al, Zn) + вода = соль + водород 2 Na. OH + Zn + 2 H 2 O = Na 2[Zn(OH)4] + H 2 2 KOH + 2 Al + 6 H 2 O = 2 K[Al(OH)4] + 3 H 2
Щелочи 1. Щелочь + амфотерный гидроксид = соль (в водном растворе) 2 Na. OH + Zn(OH)2 = Na 2[Zn(OH)4] Na. OH + Al(OH)3 = Na[Al(OH)4] 2. Щелочь + растворимая соль = нерастворимое основание + соль Ca(OH)2 + Cu(NO 3)2 = Cu(OH)2 + Ca(NO 3)2 3 KOH + Fe. Cl 3 = Fe(OH)3 + 3 KCl 3. Щелочь + металл (Al, Zn) + вода = соль + водород 2 Na. OH + Zn + 2 H 2 O = Na 2[Zn(OH)4] + H 2 2 KOH + 2 Al + 6 H 2 O = 2 K[Al(OH)4] + 3 H 2
 Соли 1. Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота Na 2 Si. O 3 + 2 HNO 3 = 2 Na. NO 3 + H 2 Si. O 3 Ba. CO 3 + 2 HCl = Ba. Cl 2 + H 2 O + CO 2 (H 2 CO 3) 2. Растворимая соль + растворимая соль = нерастворимая соль + соль Pb(NO 3)2 + K 2 S = Pb. S + 2 KNO 3 Сa. Cl 2 + Na 2 CO 3 = Ca. CO 3 + 2 Na. Cl
Соли 1. Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота Na 2 Si. O 3 + 2 HNO 3 = 2 Na. NO 3 + H 2 Si. O 3 Ba. CO 3 + 2 HCl = Ba. Cl 2 + H 2 O + CO 2 (H 2 CO 3) 2. Растворимая соль + растворимая соль = нерастворимая соль + соль Pb(NO 3)2 + K 2 S = Pb. S + 2 KNO 3 Сa. Cl 2 + Na 2 CO 3 = Ca. CO 3 + 2 Na. Cl
 Соли 1. Растворимая соль + щелочь = соль + нерастворимое основание Cu(NO 3)2 + 2 Na. OH = 2 Na. NO 3 + Cu(OH)2 2 Fe. Cl 3 + 3 Ba(OH)2 = 3 Ba. Cl 2 + 2 Fe(OH)3 2. Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*) Zn + Cu. SO 4 = Zn. SO 4 + Cu Cu + 2 Ag. NO 3 = Cu(NO 3)2 + 2 Ag Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Соли 1. Растворимая соль + щелочь = соль + нерастворимое основание Cu(NO 3)2 + 2 Na. OH = 2 Na. NO 3 + Cu(OH)2 2 Fe. Cl 3 + 3 Ba(OH)2 = 3 Ba. Cl 2 + 2 Fe(OH)3 2. Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*) Zn + Cu. SO 4 = Zn. SO 4 + Cu Cu + 2 Ag. NO 3 = Cu(NO 3)2 + 2 Ag Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
present5.com
Таблица «Химические свойства неорганических веществ»
Химические свойства неорганических веществ
Кислотный оксид (кроме SiO2) + вода = кислотаКислотный оксид + основный оксид = соль
Кислотный оксид + щёлочь = соль + вода
Основные оксиды
Основный оксид + вода = щёлочь
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
Основания
Основание + кислота = соль + вода (реакция нейтрализации)
Щёлочь + кислотный оксид = соль + вода
Щёлочь + соль = новая соль + новое основание (Примечание 1)
Нерастворимое основание оксид + вода
Кислоты
Кислота + основный оксид = соль + вода
Кислота + основание = соль + вода
Кислота + металл = соль + водород (Примечание 2)
Кислота + соль = новая кислота + новая соль (Примечание 3)
Соли
Соль + щёлочь = новая соль + новое основание (Примечание 1)
Соль + кислота = новая соль + новая кислота (Примечание 3)
Соль 1 + соль 2 = соль 3 + соль 4 (Примечание 1)
Соль + металл = новая соль + новый металл (Примечание 4)
Металлы
Металл + неметалл = соль
Металл + кислота = соль + водород (Примечание 2)
Металл + соль = новый металл + новая соль (Примечание 4)
Металл + вода:
Металл активный + вода = щёлочь + водород
Металл средней активности + вода = оксид металла + водород
Металл малоактивный + вода
Вода
Вода + основный оксид = щёлочь
Вода + кислотный оксид (кроме SiO2) = кислота
Вода + металл (см. свойства Металлов)
Примечание 1
До реакции оба вещества должны быть растворимыми в воде
После реакции одно или оба вещества – нерастворимые (т.е., должен быть осадок)
Примечание 2
Металл должен находиться в ряду металлов до водорода
Нельзя брать кислоту азотную и серную концентрированную
Кислота должна быть растворимая в воде
Соль должна быть растворимая в воде
Примечание 3
Одно из двух:
Кислота, вступающая в реакцию, должна быть сильная
Кислота, полученная после реакции, должна быть слабая
ИЛИ: В результате реакции выпадает осадок
Примечание 4
Нельзя брать для реакции металлы, стоящие в ряду активности металлов до магния
Металл, вступающий в реакцию, должен быть активнее того металла, который получается
Обе соли должны быть растворимыми в воде
Примечание 5
Азотная кислота + металл (не любой) = соль + вода + какое-либо соединение азота (например, NO2)
Серная кислота (конц.) + металл (не любой) = соль + вода + какое-либо соед-е серы (например, SO2)
LiOH; H2O; Нg; BaCl2; K2SO4; HCl; Na2O; Zn; Fe(OH)3; P2O5; MgO; AgNO3; K; CuSO4; HNO3; CO2; Cl2
infourok.ru
|
№ |
Реакция |
Пример* |
|
1 |
металл + неметалл = соль |
Hg + S = HgS↓ |
|
2 |
металл + кислород = основной оксид |
2Ca + O2 = 2CaO |
|
3 |
металл + кислород = амфотерный оксид |
Zn + O2 = ZnO |
|
4 |
неметалл + кислород = кислотный оксид |
S + O2 = SO2 |
|
5 |
основной оксид + кислотный оксид = соль |
CaO + SiO2 = CaSiO3↓ |
|
6 |
основной оксид +амфотерный оксид = соль |
Al2O3+CaO=Ca(AlO2)2 |
|
7 |
амфотерный оксид + кислотный оксид = соль |
ZnO + CO2 = ZnCO3 |
|
8 |
основной оксид + вода = основание |
BaO + H2O = Ba(OH)2 BaO + H2O = Ba2+ + 2OH– |
|
9 |
кислотный оксид + вода = кислота |
P2O5 + 3H2O = 2H3PO4 P2O5 + 3H2O = 2H+ + 2H2PO4– |
|
10 |
кислота + температура = разложения |
H2CO3 = H2O + CO2↑ |
|
11 |
основание + кислота = соль + вода |
Cu(OH)2↓ + 2HCl = CuCl2+ 2H2O Cu(OH)2↓ + 2H+ + 2Cl– = Cu2++ 2Cl–+ 2H2O Cu(OH)2↓ + 2H+ = Cu2++ 2H2O |
|
основание (избыток) + кислота = соль (основная) + вода |
Cu(OH)2↓ + HCl = Cu(OH)Cl↓ + H2O Cu(OH)2↓ + H+ + Cl– = Cu(OH)Cl↓+ H2O | |
|
основание + кислота (избыток) = соль (кислая) + вода |
NaOH+H2S=NaHS+H2O Na+ + OH–+H2S=Na+ + HS–+H2O OH–+H2S= HS–+H2O | |
|
12 |
основной оксид + кислота = соль + вода |
CaO + 2HCl = CaCl2 + H2O CaO + 2H+ + 2Cl– = Ca2+ + 2Cl– + H2O CaO + 2H+ = Ca2+ + H2O |
|
13 |
кислотный оксид + основание = соль + вода |
CO2+2NaOH = Na2CO3 + H2O CO2 + 2Na+ + 2OH– = 2Na+ + CO32–+H2O CO2 + 2OH– = CO32–+H2O |
|
14 |
амфотерный оксид + основание (щелочь) = соль + вода |
ZnO + 2KOH = K2ZnO2 + H2O ZnO + 2K+ + 2OH– = 2K+ + ZnO2 + H2O ZnO + 2OH– = ZnO2 + H2O |
|
15 |
металл+кислота = соль + водород |
Zn+2HCl=ZnCI2+H2↑ Zn0 + 2H+ + 2Cl– = Zn2+ + 2CI– + H20↑ Zn0 + 2H+ = Zn2+ + H20↑ |
|
16 |
металл (активный) + вода = основание (щелочь) + водород |
2Na + 2H2O = 2NaOH + H2 2Na0 + 2H2O = 2Na+ + 2OH– + H20 |
|
17 |
соль + основной оксид |
реакция не идет |
|
18 |
соль + амфотерный оксид = кислотный оксид (летучий) + соль |
CaCO3 + Аl2О3 = CO2+ Ca(АlO2) 2 |
|
19 |
соль + кислотный оксид = кислотный оксид (летучий) + соль |
Na2CO3 + SiO2 = CO2 + Na2SiO3 |
|
20 |
соль + кислота (сильная) = соль + кислота (слабая или летучая) |
ВаCl2 + H2SO4 = ВаSO4↓ + 2HCl Ва2+ + 2Cl– + 2H+ + SO42– = ВаSO4↓ + 2H+ + 2Cl– Ва2+ + SO42– = ВаSO4↓ |
|
21 |
соль + кислота = соль (трудно растворимая) + кислота |
AgNO3 + HCl = AgCl + HNO3 Ag+ + NO3– + H++ Cl– = AgCl + H+ + NO3– Ag+ + Cl– = AgCl |
|
22 |
соль (раствор) + соль (раствор)=соль (трудно растворимая) + соль |
ВаCl2 + Na2SO4 = ВаSO4↓ + 2NaCl Ва2+ + 2Cl–+2Na++SO42–=ВаSO4↓+ 2Na+ + 2Cl– Ва2+ SO42–=ВаSO4↓ |
|
23 |
соль + металл активный = соль+ металл неактивный |
CuSO4 + Zn = ZnSO4 + Cu Cu2+ + SO42– + Zn0 = Zn2+ + SO42– + Cu0 Cu2+ + Zn0 = Zn2+ + Cu0 |
|
24 |
соль + неметалл = соль + неметалл (или другие вещества) |
Na2S + Br2 = 2NaBr + S 2Na+ + S2– + Br20 = 2Na+ + 2Br– + S0 S2– + Br20 = 2Br– + S0 |
|
25 |
соль + температура = основной оксид + кислотный оксид |
CaCO3 = CaO + CO2 |
|
26 |
соль + температура = продукты разложения |
2КClO3 = 2КCl +3O2 2К + + 2ClO3– = 2К + + 2Cl– +3O2 2ClO3– = 2Cl– +3O2 |
|
27 |
соль + вода = гидролиз |
K2S + H2O = KHS + KOH 2K+ + S2– + H2O = 2K+ + HS– + OH– S2– + H2O = HS– + OH– |
|
28 |
соль + вода = комплексные соли (аквакомплексы) |
CuSO4 + 5H2O = [Cu (H2O)4]SO4·H2O Cu2+ + SO42– + 5H2O = [Cu(H2O)4] 2+ + SO42– +·H2O Cu2+ + 4H2O = [Cu(H2O)4]2+ |
|
30 |
соль + щелочь (недостаток) = соль (основанная) + соль |
ZnCl2+NaOH=ZnOHCl↓+NaCl Zn2+ + 2Cl–+Na+ + OH–=ZnOHCl↓+Na+ + Cl– Zn2+ + Cl–+OH–=ZnOHCl↓ |
|
Номер задания |
Цепочки реакций | |
|
31 |
Fe(OH)3 → Fe2O3 → Fe → FeCl3 → FeOHCl2 | |
|
32 |
Fe → FeCl3 → FeOHCl2 → Fe2(SO4)3 → Fe(NO3)3 | |
|
33 |
P → P2O5 → H3PO4 → Ca3(PO4)2 → Ca(H2PO4)2 | |
|
34 |
Сu(OH)2 → CuO → Cu → CuSO4 → Cu2(OH)2 | |
|
35 |
Al2O3 → KAlO2 → Al(OH)3 → Al2(SO4)3→ ВаSO4 | |
|
36 |
Zn → Zn(НSO4)2 → ZnSO4 →Zn(OH)2 → Na2[Zn(OH)4] | |
|
37 |
Zn(OH)2 → Na2ZnO2 → ZnCl2 → ZnCO3 → ZnO | |
|
38 |
CO2 → CaCO3 → CaCl2 → CaCO3 → CO2 | |
|
39 |
НCl → CaCl2 → Ca(OH)2 → CaCO3 → CO2 | |
|
10 |
Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2 | |
|
41 |
AlCl3 → AlOHCl2 → Al(OH)3 → Na[Al(OH)4] → Na3[Al(OH)6] | |
|
42 |
CaCl2 → Ca(OH)2 → CaCO3 → CO2 → CaCO3 | |
|
43 |
Fe(OH)3 → FeOHSO4 → Fe2(SO4)3 → Fe(HSO4)2 → Fe(OH)3 | |
|
44 |
CrCl3 → Cr(OH)3 → Na3[Cr(OH)6] → CrCl3 →AgCl | |
|
45 |
Al → NaAlO2 → HAlO2 → K[Al(OH)4] → Al2O3 | |
|
46 |
NaHCO3 → Na2CO3 → Na2O → Na2SO4 → NaOH | |
|
47 |
Ва(OH)2 → ВаCO3 → ВаO → ВаCl2 → ВаSO4 | |
|
48 |
NaOH→ Cr(OH)3 → Na3[Cr(OH)6] → Na2CrO4 → Na2Cr2O7 | |
|
49 |
Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → [Cu(NH3)4]Cl2 | |
|
50 |
Fe → FeO → Fe(NO3)2 → FeSO4 → Fe(HSO4)2 | |
|
51 |
NH3 → NO → NO2 → HNO3 → KNO3 | |
|
52 |
CuSO4 → Cu → CuSO4→ Cu (OH)2 → CuO | |
|
53 |
B → B2O3 → H3BO3 → HBO2 → KBO2 | |
|
54 |
Cu → CuO → Cu (OH)2 → Na2[Cu(OH)4] → CuSO4 | |
|
55 |
CuSO4 → CuCl2 → CuOHCl → Cu(OH)2 →Na2[Cu(OH)4] | |
|
56 |
NH3 → NO → NO2 → HNO3 → H2SO4 | |
|
57 |
Na2CO3 → Na2SO4 → NaOH → Cr(OH)3 → CrOHSO4 | |
|
58 |
K2S → KHS → H2S → SO2 → H2SO3 | |
|
59 |
CuSO4 → [Cu (H2O)4]SO4·H2O → CuCl2 → CuOHCl → Cu(OH)2 | |
|
60 |
N2 → NH3 → NH4Cl → NH4OH → NH4NO3 |
studfiles.net
Классификация и общие свойства основных классов неорганических веществ – HIMI4KA

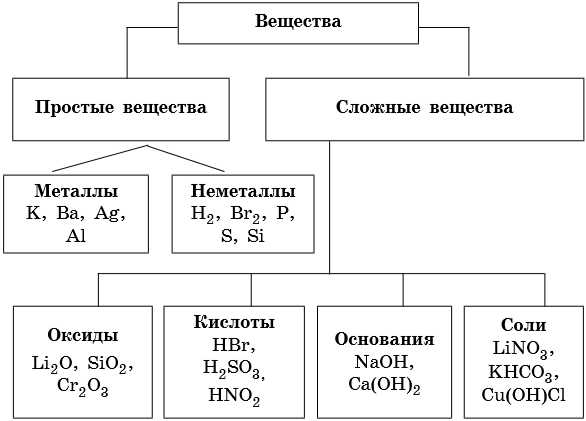
Неорганические вещества классифицируют по различным классифицирующим признакам. По химическому составу их делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента; сложными — вещества, которые образуют атомы двух и более химических элементов.
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В Периодической таблице Д. И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведенной через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и кислорода со степенью окисления –2.
Оксиды классифицируют так.
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни оснОвные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Кислотные оксиды образуют неметаллы и некоторые металлы в высших степенях окисления. Примеры кислотных оксидов: CO2, SiO2, N2O3, NO2, N2O5, P2O3, P2O5, SO2, SO3, Cl2O5, Cl2O7, CrO3, Mn2O7.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями с образованием солей и воды или кислых солей, а также с водой в том случае, если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, MgO, CaO, BaO, HgO, Ag2O.
Их характерные свойства: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
С водой амфотерные оксиды не взаимодействуют.
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щелочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:
Основания могут вступать в реакцию с кислыми солями:
Щелочи при сплавлении с амфотерными оксидами дают соль и воду:
Щелочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:
Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:
Кислотами называют класс химических соединений, которые содержат в своем составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Неорганическими кислотами называют вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний-катионы Н3О+ и анионы кислотных остатков А–:
Исключение составляет борная кислота В(ОН)3, которая акцептирует гидроксид-ионы ОН–, в результате чего в водном растворе создается избыток гидроксоний-катионов:
Именно поэтому формулу H3BO3 и соответственно название борная кислота применять не рекомендуется, поскольку все три атома водорода молекулы В(ОН)3 не являются кислотными, т. е. не подвергаются кислотной диссоциации по Аррениусу или кислотному протолизу по Бренстеду.
Основностью кислоты называют число способных замещаться на металл атомов водорода в ее молекуле. По основности кислоты делят на одно-, двух- и трехосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3.
Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
Все кислоты вступают в реакцию с основаниями с образованием солей и воды (реакция нейтрализации), с основными и амфотерными оксидами с образованием солей и воды, например:
Водные растворы сильных кислот вступают в реакцию с металлами, которые стоят в ряду напряжений металлов левее водорода, с образованием соли и выделением водорода:
Исключением является азотная кислота в любой концентрации и концентрированная серная кислота. В этих случаях водород не выделяется, а происходит восстановление атомов азота и серы соответственно.
Сильные кислоты вытесняют более слабые кислоты из их солей. При этом образуется новая кислота и новая соль:
Сильные кислоты: HI, HBr, HCl, HClO4, H2SO4, HNO3, H2CrO4, H2Cr2O7, HMnO4.
Кислоты средней силы: H2SO3, H3PO4, HF, HNO2.
Слабые кислоты: CH3COOH, H2CO3, H2S.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2 Некоторые гидроксиды (Cu(OH)2, Fe(OH)3) проявляют амфотерные свойства с преобладанием основных. Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка.
Химические свойства гидроксида:
Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
По составу соли классифицируют на средние, кислые и основные.
Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3, CaHPO4.
Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)Br2, Cu(OH)I.
Комплексными называют соли, которые содержат в своем составе комплексные катионы и/или анионы, например: K4[Fe(CN)6], [Ag(NH3)2]Cl.
Двойными называют соли, формально представляющие собой продукты взаимодействия двух простых солей, например: KAl(SO4)2.
Смешанными называют соли, являющиеся производными нескольких кислот и/или оснований, например: BaClBr.
Соли могут реагировать с кислотами с образованием кислых солей; более сильные кислоты могут вытеснять более слабые из их солей:
Соли взаимодействуют со щелочами:
Растворимые в воде соли могут вступать друг с другом в реакции обмена, если один из продуктов уходит из сферы реакции в виде осадка, например:
Растворы или расплавы солей вступают во взаимодействие с металлами, стоящими левее, чем металл, входящий в состав соли, в ряду стандартных электродных потенциалов:
Кислые соли вступают в реакции со щелочами с образованием средних солей и воды:
Некоторые кислые соли, например угольной кислоты, разлагаются под действием более сильных кислот:
ОснОвные соли вступают в реакции с кислотами:
Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами, например:
При нагревании комплексные соли теряют воду:
Классификацию неорганических веществ можно представить следующей самой общей схемой:
himi4ka.ru
| Химические свойства | ПРАВИЛА | ИСКЛЮЧЕНИЯ | |
| МЕТАЛЛ + НЕМЕТАЛЛ СОЛЬ | Чем активнее, тем легче реагируют. | 1. При взаимодействии железа с галогенами образуется соль Fe 3+ ,а с остальными – соль Fe 2+ | |
| МЕТАЛЛ + О2 ОКСИД | Кроме благородных металлов | 1.У щелочных металлов пероксид, или надпероксид (кроме лития) 2. У железа – окалина Fe3O4 | |
| МЕТАЛЛ + ОКСИД МЕТАЛЛА 1 МЕТАЛЛ + ОКСИД МЕТАЛЛА2 | Металл в оксиде1 — переходный | ||
| МЕТАЛЛ + Н2О ЩЕЛОЧЬ + Н2 | Только для металлов, которым соответствует растворимое основание — щелочь | ||
| МЕТАЛЛ + КИСЛОТА СОЛЬ + Н2 | 1.Металлы должны стоять в ряду напряжения до водорода 2. Кроме азотной и концентрированной серной кислот. | ||
| МЕТАЛЛ + СОЛЬ СОЛЬ + МЕТАЛЛ | Соль должна содержать металл, который в ряду напряжения стоит правее. | ||
| (Ме до Mg) соль + Н2О + NH3 (соль) МЕТАЛЛ + HNO3 (РАЗБ) (отМg) соль + Н2О + NO (Ме до Mg) соль + Н2О + N2О МЕТАЛЛ + HNO3 (конц) (отМg) соль + Н2О + NO2 (Ме до Mg) соль + Н2О + H2S МЕТАЛЛ + H2SO4 (конц) (отМg по Н2) соль + Н2О + S (после Н2) соль + Н2О + SO2 | 1.На самом деле образуется соль аммония, так как аммиак быстро реагирует с избытком кислоты. 2. При определенной концентрации кислоты может образовываться и свободный азот. 3.При взаимодействии железа с раствором азотной кислоты образуется соль Fe 3+. 4. Железо реагирует с концентрированной серной кислотой только при нагревании, образуется соль Fe 3+. 5. Благородные металлы, железо, хром, алюминий пассивируются концентрированными серной, азотной кислотой. | ||
| МЕТАЛЛ + ЩЕЛОЧЬ + Н2О КОМПЛЕКСНАЯ СОЛЬ + Н2 | Так реагируют металлы, которые образуют амфотерные соединения. | ||
| НЕМЕТАЛЛ + ВОДОРОД летучее водородное соединение | Только активные неметаллы (кроме Si, P, As, Te, Se, B.) | ||
| НЕМЕТАЛЛ + О2 ОКСИД НЕМЕТАЛЛА | Кроме галогенов, а (S+ О2 S О2 , N2 + O2 2NO) | ||
| НЕМЕТАЛЛ + ЩЕЛОЧЬ Н2О + СОЛЬ + СОЛЬ | Только для галогенов и кремния.(Si + NaOH+H2O H2 + Na2SiO3 | ||
| НЕМЕТАЛЛ + HNO3 + Н2О КИЛОТА + NO(NO2) + Н2О | Кроме галогенов. | ||
multiurok.ru
Свойства основных классов неорганических соединений. Оксиды
Свойства основных классов неорганических соединений.-
Оксиды
1.Основные (оксиды МЕ со степенью окисления +1, +2) 2. Кислотные (оксиды Неметаллов)
+ кислота + щелочь = соль + вода
+ кислотный оксид + основный оксид
+ вода = щелочь + вода = кислота
3. Амфотерные (МЕО со степ.окисл. +3,+4 и оксиды цинка, бериллия, олова, свинца)
+МЕОН (раствор) = комплексная соль
+МЕОН (тв.) = соль + вода
+ кислота
ПОЛУЧЕНИЕ ОКСИДОВ:
-
Ме или НЕМЕ + кислород (с кислородом не взаимодействуют хлор, фтор, -
Сложные бинарные соединения + кислород = образуется два оксида -
Разложение нерастворимых солей, оснований, кислот
КИСЛОТЫ
-
Классификация
-
Бескилородные или кислородсодержащие (по наличию кислорода) -
Одноосновные, двухосновные, … многоосновные (по числу атомов водорода) -
Сильные или слабые (по степени диссоциации) -
Летучие или нелетучие -
Стабильные или нестабильные
-
Физические свойства: кислоты в основном являются жидкостями, хорошо растворяются в воде, например, соляная, серная, уксусная кислоты. Встречаются кислоты – твердые вещества, нерастворимые в воде, например, борная (Н3ВО3), кремниевая (Н2SiO3).
-
Химические свойства
-
Диссоциируют при растворении в воде, поэтому одинаково изменяют окраску индикатора. НnК.О= nН+ + К.О.—n -
Взаимодействуют с МЕ, стоящими в ряду напряжений до водорода. -
Взаимодействуют с основными и амфотерными оксидами МЕ. -
Взаимодействуют с основаниями. -
Взаимодействуют с солями. При составлении ур.р. учитывается возможность осуществления реакции. -
Нерастворимые кислоты разлагаются при нагревании. -
Азотная кислота и концентрированная серная кислота взаимодействуют с металлами по-особому, проявляя сильные окислительные свойства.
Взаимодействие серной кислоты с металлами.
|
МЕ | |||
|
Активные |
малоактивные |
Неактивные | |
|
Раствор кислоты |
H2SO4 + Ме = соль+водород |
H2SO4 + Ме= соль+водород |
Не взаимод. |
|
Концентр. кислота |
H2SO4 + Ме= соль+вода +сероводород |
H2SO4 + Ме= соль+вода +сера (оксид серы (IV) |
[Только медь, серебро, ртуть] H2SO4 + Ме= соль+вода +оксид серы (IV) |
|
Конц. Кислота не взаимодействует (пассивирует) при обычных условиях с железом, хромом | |||
Взаимодействие азотной кислоты с металлами.
|
МЕ | |||
|
Активные |
малоактивные |
Неактивные | |
|
Раствор кислоты |
=соль + вода + нитрат аммония |
=соль + вода + оксид азота (II) | |
|
Концентр. кислота |
=соль + вода + азот (или оксид азота (I) |
=соль + вода + оксид азота (IV) | |
|
Конц. Кислота не взаимодействует при обычных условиях с железом, хромом, алюминием (пассивирует) Не взаимодействует ни при каких условиях с золотом, платиной, таллием. | |||
-
Получение.
-
Н2 + НЕМЕ -
Оксид НЕМЕ + вода -
Нерастворимые и слабые кислоты можно получать реакцией обмена
(см. п. 5)
-
Промышленное получение важнейших кислот:
А) Получение серной кислоты. Б) получение азотной кислоты
S + O2 = SO2 4NH3 + 5O2 = 4NO + 6H2O
2 SO2 + O2 = 2SO3 2NO + O2 = 2NO2
SO3 + H2O = H2SO4 4NO2 + O2 +2 H2O = 4HNO3
В) получение фосфорной кислоты.
Ca3(PO4)2 + H2SO4 += 3CaSO4 + 2H3PO4
-
Основания (однокислотные и многокислотные; сильные – слабые; стабильные-нестабильные)
|
Химические свойства | |||
|
Растворимые (щелочи) |
нерастворимые |
Амфотерные | |
|
|
1.+кислота 2. +щелочь (раствор)=комплексная соль 3. + щелочь (ТВ.) = соль + вода | |
|
Получение | |||
|
| ||
СОЛИ: средние – МЕ К.ОС.
Кислые – Ме Н К.Ос.
Основные – МЕ ОН К.ОС.
|
Растворимые (средние и кислые) |
Нерастворимые (средние и основные) |
|
Химические свойства | |
|
1.Электролиты, диссоциируют |
1.+ кислотами более сильными |
|
2. + МЕ (согласно активности МЕ, активные Ме участвуют по-особому) |
2. разлагаются при нагревании (если соль слабой кислородсодержащей кислоты) |
|
3. + кислотами более сильными | |
|
4. + щелочь | |
|
5. + растворимая соль | |
|
6. подвергаются гидролизу | |
Особые свойства нитратов:
МЕNO3 MeNO2 + O2
MeO + NO2 + O2
Me + NO2 + O2
Получение:
Способы получения солей — химические свойства оснований, кислот, солей, оксидов, МЕ и НЕМЕ.
Значение солей:
Карбонат кальция – мел, мрамор, известняк
Карбонат натрия – кальцинированная сода
Гидрокарбонат натрия – питьевая или пищевая сода
Карбонат калия – поташ
Сульфат натрия – глауберова соль
Сульфат кальция – гипс
Фосфат кальция – апатит, фосфорит
Сульфат бария – баритова каша
Силикат натрия – силикатный клей
Взимопревращения средних, кислых, основныхсолей:
-
Средняя соль А) кислая Б) средняя
А) + соответствующую кислоту
Б) + щелочь или кислую соль нагреть
2. средняя соль А) основная Б) средняя
А) +избыток щелочи
Б) + кислота
takya.ru
