Внутренняя энергия системы
Важнейшей характеристикой термодинамической системы является величина ее внутренней энергии.
Все термодинамические системы представляют собой совокупность какого-то числа различных частиц: молекул, атомов, ионов и т.д. Частицы эти находятся в состоянии движения (поступательного, колебательного или вращательного) и, следовательно, обладают некоторым количеством кинетической энергии. Кроме того, они взаимодействуют друг с другом, т.е. обладают определенным запасом потенциальной энергии.
В самом общем виде можно определить внутреннюю энергию системы как сумму потенциальной и кинетической энергии всех составляющих ее частиц.
Это определение не позволяет, однако, дать однозначный ответ на вопрос о том, чему равна энергия конкретной системы, состоящей из определенного числа структурных единиц, например, молекул. На первый взгляд кажется, что данная задача решается достаточно просто. Для этого необходимо учесть кинетическую энергию движения молекул и потенциальную энергию их взаимодействия между собой. Но энергией молекулы не исчерпывается энергия системы. Существует потенциальная и кинетическая энергия атомов, входящих в состав каждой молекулы. Если учесть и эту энергию, то возникает вопрос, учитывать ли энергию электронов, принадлежащих атомам, и надо ли учитывать энергию атомных ядер? А так как сложность элементарных частиц неисчерпаема, то ни на каком уровне этой сложности нет оснований останавливаться.
Таким образом, в рамках термодинамики задача определения абсолютного значения внутренней энергии системы не имеет решения и в связи с этим не рассматривается. Первостепенное значение приобретает другой вопрос: как изменится энергия системы в результате осуществления термодинамического процесса.
Если мы обозначим энергию системы в каком-нибудь исходном состоянии символом U1, а в любом другом состоянии символомU2, то задача сводится к вычислению разности:
U=U2–U1
В такой постановке она сразу приобретает четкость и допускает строгий ответ.
Величина Uсчитается положительной, если внутренняя энергия системы при протекании процесса возрастает, и отрицательной – если убывает.
Внутренняя энергия не включает в себя кинетическую энергию системы (ЕК), которая присуща ей в результате движения как единого целого во внешней среде, и потенциальную энергию (ЕП), обусловленную действием на систему внешних силовых полей: гравитационного, электромагнитного и пр.
Таким образом, внутренняя энергия системы является составной частью
Е = ЕК+ ЕП+U
Первые два слагаемых данного равенства составляют предмет рассмотрения в механике.
Величина внутренней энергии системы определяется лишь ее состоянием, но не зависит от способа достижения данного состояния (рис. 5), поэтому U принадлежит к термодинамическим параметрам, которые называются иначефункциями состояния.
Рис. 5. Схема, иллюстрирующая независимость изменения внутренней энергии системы от пути протекающего в ней процесса
Форма обмена энергии с окружающей средой
При протекании термодинамических процессов внутренняя энергия системы может увеличиваться или уменьшаться. В первом случае говорят, что система поглотила часть энергии из внешней среды, во втором случае, наоборот – передала часть своей энергии в окружающую среду. Существуют две основные формы (способа) обмена энергией между системой и внешней средой: теплота и работа.
Теплота– это процесс обмена энергией через неупорядоченное хаотическое движение структурных единиц вещества: молекул, ионов.
Из данных частиц состоит как сама система, так и ее граница раздела (стенки системы), а также окружающий систему внешний мир. В результате столкновения частиц системы и внешнего мира с частицами, образующими стенки, энергия одного коллектива частиц (например, частиц системы), может возрасти, а другого коллектива (расположенного во внешнем мире), соответственно, уменьшиться. Микроскопический механизм этого процесса состоит в обмене энергией при каждом единичном столкновении частиц. Пользуясь макроскопическими понятиями, говорят, что какая-то порция энергии перешла в систему из окружающей среды в форме теплоты.
Система может обмениваться энергией с окружающей средой в форме теплоты и без столкновения молекул, путем поглощения или излучения лучистой энергии. В этом случае излучение или поглощение единичного кванта есть аналог единичного столкновения частиц. Обмен макроскопическими порциями энергии есть результат излучения либо поглощения огромного числа квантов.
Под термином «теплота» часто понимают не сам процесс, а количество передаваемой таким способом энергии (Q).
Если система получает из внешнего мира некоторое количество энергии в форме теплоты, то Qсчитают положительной величиной. При переходе энергии в противоположном направлении величинуQсчитают отрицательной (рис. 6).
Работа – это процесс обмена энергией в результате организованного макроскопического перемещения частей системы друг относительно друга или макроскопического изменения свойств системы либо ее частей.Работа может бытьмеханической, электрической, химической.
Примером механической работыявляется расширение или сжатие системы, примеромэлектрической работыявляется перенос заряда в электрическом поле.
Мерой количества механической работы служит произведение действующей силы (точнее, проекции силы на направление движения) на величину перемещения (l). Если действующая сила (F) при этом перемещении остается постоянной, то работа (А) определяется следующим образом:
А = F·l
Работа может совершаться внутренними силами системы против внешних сил, т.е. над окружающей средой (расширение системы) или, наоборот, внешними силами против внутренних (сжатие системы).
В первом случае она считается положительной величиной (при этом энергия переходит из системы во внешнюю среду). Во втором – отрицательной (энергия переходит из внешней среды в систему) (рис. 6).
Рис. 6. Соглашение о знаках работы и теплоты
Процесс обмена энергией системы и окружающей среды только в форме теплоты, т.е. через хаотическое движение частиц вполне реален.Для этого достаточно окружить систему, заключенную в жесткую (непроницаемую для вещества) оболочку, средой с более высокой или более низкой температурой.
В то же время, невозможно реализовать ни один процесс, в котором обмен энергией совершался бы только в форме работы.Тепловое движение частиц в любой системе существует, и поэтому неизбежен обмен энергией также и в форме теплоты. Кроме того, всякое механическое перемещение частей системы обязательно сопровождается трением, а это тоже означает участие тепловой формы обмена энергией при механических процессах.
В термодинамике часто вводится представление о том, что система может быть окружена идеально нетеплопроводными стенками, непрозрачными также и для лучистой энергии. В этом случае обмен энергией с окружающей средой в форме теплоты невозможен, но совершение работы над системой возможно. Такие системы называются адиабатными системами, а процесс их перехода из одного состояния в другое называют адиабатным процессом.
В отличие от внутренней энергии, теплота и работа зависят от пути или способа совершения процесса и поэтому функциями состояния не являются. В связи с этим определяют абсолютные значения Qи А, а не их изменения.
Системы в термодинамике
Определение 1
Термодинамическая система — совокупность и постоянство макроскопических физических тел, которые всегда взаимодействуют между собой и с другими элементами, обмениваясь с ними энергией.
Под системой в термодинамике ими принято понимать макроскопические физические формы, которые состоят из огромного количества частиц, не предполагающие применение макроскопических показателей для описания каждой отдельного элемента. Нет определенных ограничений в природе материальных тел, являющиеся составными компонентами таких концепций. Они могут быть представлены в виде атомов, молекул, электронов, ионов и фотонов
Термодинамические системы бывают трех основных видов:
- изолированные – обмен с веществом или энергией с окружающей средой не выполняется;
- закрытые — тело не взаимосвязано с окружающей средой;
- открытые — есть и энерго- и массообмен с внешним пространством.
Энергию любой термодинамической системы можно разделить на зависящую от положения и движения системы энергию, а также энергию, которая определяется движением и взаимодействием микрочастиц, образующих концепцию. Вторую часть называют в физике внутренней энергией системы.
Особенности термодинамических систем
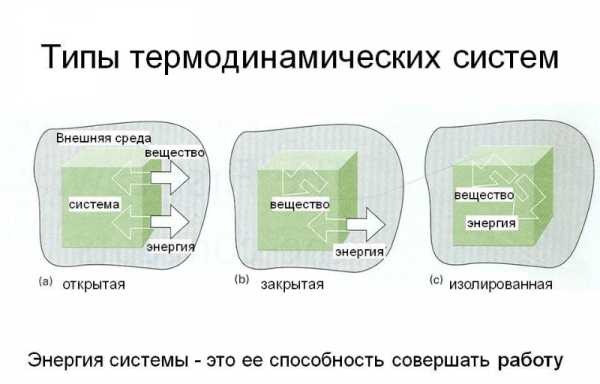
Рисунок 1. Типы термодинамических систем. Автор24 — интернет-биржа студенческих работ
Замечание 1
В качестве отличительных характеристик систем в термодинамике можно привести любой предмет, наблюдаемый без использования микроскопов и телескопов.
Чтобы предоставить полноценное описание такой концепции, необходимо подобрать макроскопические детали, посредством которых возможно точно определить давление, объем, температуру, величину магнитной индукции, электрическую поляризацию, химический состав, массу движущихся компонентов.
Для любых термодинамических систем есть условные, либо реальные пределы, отделяющие их от окружающей среды. Вместо них часто рассматривают понятие термостата, которое характеризуется таким высоким показателем теплоемкости, что в случае теплообмена с анализируемой концепцией температурный параметр сохраняет неизменное значение.
В зависимости от общего характера взаимодействия термодинамической системы с окружающей средой, принято выделять:
- изолированные виды, которые не обмениваются ни веществом, ни энергией с внешней средой;
- адиабатически изолированные- системы, не совершающие обмена с внешней средой веществом, но вступающие в обмен энергией;
- закрытые системы- те, у которых нет обмена с веществом, допускается только незначительное изменение величины внутренней энергии;
- открытые системы — те что характеризуются полноценной передачей энергии, вещества;
- частично открытые – обладают полупроницаемыми перегородками, поэтому не в полной мере участвуют в материальном обмене.
В зависимости от формулировки, значения термодинамической концепции, могут подразделяться на простые и сложные варианты.
Внутренняя энергия систем в термодинамике

Рисунок 2. Внутренняя энергия термодинамической системы. Автор24 — интернет-биржа студенческих работ
Замечание 2
К основным термодинамическим показателям, которые непосредственно зависят от массы системы, относят внутреннюю энергию.
Она включает в себя кинетическую энергию, обусловленную движением элементарных частиц вещества, а также потенциальную энергию, появляющуюся во время взаимодействия молекул между собой. Этот параметр всегда является однозначным. То есть значение и реализация внутренней энергии постоянны всякий раз, как концепция оказывается в нужном состоянии, независимо от того, каким методом это положение было достигнуто.
В системах, химический состав которых в процессе энергетических преобразований остается неизменным, при определении внутренней энергии важно учитывать только энергию теплового движения материальных частиц.
Хорошим примером такой системы в термодинамике является идеальный газ. Свободная энергия есть определенная работа, которую могло бы совершить физическое тело в изотермическом обратимом процессе, или свободная энергия представляет собой максимально возможной функционал, который может совершить концепция, обладая существенным запасом внутренней энергии. Внутренняя энергия системы приравнивается сумме связанное и свободной напряженности.
Определение 2
Связанная энергия – это та часть внутренней энергии, которая не способна самостоятельно превратиться в работу, – это обесцененный элемент внутренней энергии.
При одной и той же температуре указанный параметр увеличивается с ростом энтропия. Таким образом, энтропия термодинамической системы есть мера обеспеченности ее начальной энергии. В термодинамике есть еще определение – энергетическая потеря в стабильной изолированной системе
Обратимый процесс является термодинамическим процессом, который может быстро проходить как в обратном, так и в прямом направлении, проходя через одинаковые промежуточные положения, причем концепция в итоге возвращается в исходное состояние без затрат внутренней энергии, и в окружающем пространстве не остается макроскопических изменений.
Обратимые процессы дают максимальную работу. Самый лучший результат работы от системы на практике получить невозможно. Это придает обратимым явлениям теоретическую значимость, которая протекает бесконечно медленно, и можно только на небольшие расстояния приблизиться к нему.
Определение 3
Необратимым в науке называется процесс, который нельзя осуществить в противоположную сторону через все те же промежуточные состояния.
Все реальные явления в любом случае необратимы. Примеры таких эффектов: термодиффузия, диффузия, вязкое течение и теплопроводность. Переход кинетической и внутренней энергии макроскопического движения через постоянное трение в теплоту, то есть в саму систему, является необратимым процессом.
Переменные состояния систем

Рисунок 3. Переменные состояния. Автор24 — интернет-биржа студенческих работ
Состояние любой термодинамической системы можно определить по текущему сочетанию ее характеристик или свойств. Все новые переменные, которые в полной мере определяются только в определенный момент времени и не зависят от того, как именно концепция пришла в это положение, называются термодинамическими параметрами состояния или основными функциями пространства.
Система в термодинамике считается стационарной, если переменные значения с течением времени остаются стабильными и не изменяются. Один из вариантов стационарного состояния — это термодинамическое равновесие. Любое, даже самое незначительное изменение в концепции, — уже физический процесс, поэтому в нем может быть от одного до нескольких переменных показателей состояния. Последовательность, в которой состояния системы систематически переходят друг в друга, носит название «путь процесса».
К сожалению, путаница с терминами и детальным описанием все еще существует, ибо одна и та же переменная в термодинамике может быть, как независимой, так и итогом сложения сразу нескольких функций системы. Поэтому такие термины, как «параметр состояния», «функция состояния», «переменная состояния» могут иногда рассматриваться в виде синонимов.
spravochnick.ru
Внутренняя энергия системы
Важнейшей характеристикой термодинамической системы является величина ее внутренней энергии.
Все термодинамические системы представляют собой совокупность какого-то числа различных частиц: молекул, атомов, ионов и т.д. Частицы эти находятся в состоянии движения (поступательного, колебательного или вращательного) и, следовательно, обладают некоторым количеством кинетической энергии. Кроме того, они взаимодействуют друг с другом, т.е. обладают определенным запасом потенциальной энергии.
В самом общем виде можно определить внутреннюю энергию системы как сумму потенциальной и кинетической энергии всех составляющих ее частиц.
Это определение не позволяет, однако, дать однозначный ответ на вопрос о том, чему равна энергия конкретной системы, состоящей из определенного числа структурных единиц, например, молекул. На первый взгляд кажется, что данная задача решается достаточно просто. Для этого необходимо учесть кинетическую энергию движения молекул и потенциальную энергию их взаимодействия между собой. Но энергией молекулы не исчерпывается энергия системы. Существует потенциальная и кинетическая энергия атомов, входящих в состав каждой молекулы. Если учесть и эту энергию, то возникает вопрос, учитывать ли энергию электронов, принадлежащих атомам, и надо ли учитывать энергию атомных ядер? А так как сложность элементарных частиц неисчерпаема, то ни на каком уровне этой сложности нет оснований останавливаться.
Таким образом, в рамках термодинамики задача определения абсолютного значения внутренней энергии системы не имеет решения и в связи с этим не рассматривается. Первостепенное значение приобретает другой вопрос: как изменится энергия системы в результате осуществления термодинамического процесса.
Если мы обозначим энергию системы в каком-нибудь исходном состоянии символом U1, а в любом другом состоянии символомU2, то задача сводится к вычислению разности:
U=U2–U1
В такой постановке она сразу приобретает четкость и допускает строгий ответ.
Величина Uсчитается положительной, если внутренняя энергия системы при протекании процесса возрастает, и отрицательной – если убывает.
Внутренняя энергия не включает в себя кинетическую энергию системы (ЕК), которая присуща ей в результате движения как единого целого во внешней среде, и потенциальную энергию (ЕП), обусловленную действием на систему внешних силовых полей: гравитационного, электромагнитного и пр.
Таким образом, внутренняя энергия системы является составной частью полной или общей энергии системы Е:
Е = ЕК+ ЕП+U
Первые два слагаемых данного равенства составляют предмет рассмотрения в механике.
Величина внутренней энергии системы определяется лишь ее состоянием, но не зависит от способа достижения данного состояния (рис. 5), поэтому U принадлежит к термодинамическим параметрам, которые называются иначефункциями состояния.
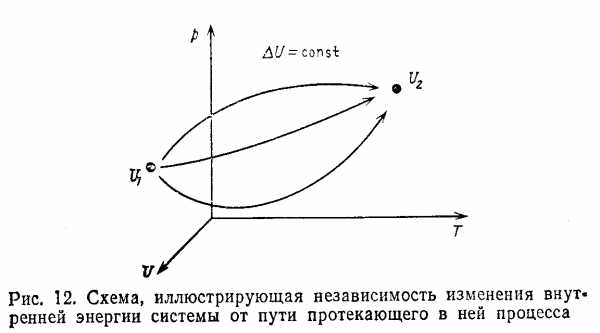
Рис. 5. Схема, иллюстрирующая независимость изменения внутренней энергии системы от пути протекающего в ней процесса
Форма обмена энергии с окружающей средой
При протекании термодинамических процессов внутренняя энергия системы может увеличиваться или уменьшаться. В первом случае говорят, что система поглотила часть энергии из внешней среды, во втором случае, наоборот – передала часть своей энергии в окружающую среду. Существуют две основные формы (способа) обмена энергией между системой и внешней средой: теплота и работа.
Теплота– это процесс обмена энергией через неупорядоченное хаотическое движение структурных единиц вещества: молекул, ионов.
Из данных частиц состоит как сама система, так и ее граница раздела (стенки системы), а также окружающий систему внешний мир. В результате столкновения частиц системы и внешнего мира с частицами, образующими стенки, энергия одного коллектива частиц (например, частиц системы), может возрасти, а другого коллектива (расположенного во внешнем мире), соответственно, уменьшиться. Микроскопический механизм этого процесса состоит в обмене энергией при каждом единичном столкновении частиц. Пользуясь макроскопическими понятиями, говорят, что какая-то порция энергии перешла в систему из окружающей среды в форме теплоты.
Система может обмениваться энергией с окружающей средой в форме теплоты и без столкновения молекул, путем поглощения или излучения лучистой энергии. В этом случае излучение или поглощение единичного кванта есть аналог единичного столкновения частиц. Обмен макроскопическими порциями энергии есть результат излучения либо поглощения огромного числа квантов.
Под термином «теплота» часто понимают не сам процесс, а количество передаваемой таким способом энергии (Q).
Если система получает из внешнего мира некоторое количество энергии в форме теплоты, то Qсчитают положительной величиной. При переходе энергии в противоположном направлении величинуQсчитают отрицательной (рис. 6).
Работа – это процесс обмена энергией в результате организованного макроскопического перемещения частей системы друг относительно друга или макроскопического изменения свойств системы либо ее частей.Работа может бытьмеханической, электрической, химической.
Примером механической работыявляется расширение или сжатие системы, примеромэлектрической работыявляется перенос заряда в электрическом поле.
Мерой количества механической работы служит произведение действующей силы (точнее, проекции силы на направление движения) на величину перемещения (l). Если действующая сила (F) при этом перемещении остается постоянной, то работа (А) определяется следующим образом:
А = F·l
Работа может совершаться внутренними силами системы против внешних сил, т.е. над окружающей средой (расширение системы) или, наоборот, внешними силами против внутренних (сжатие системы).
В первом случае она считается положительной величиной (при этом энергия переходит из системы во внешнюю среду). Во втором – отрицательной (энергия переходит из внешней среды в систему) (рис. 6).

Рис. 6. Соглашение о знаках работы и теплоты
Следует учитывать, что энергия открытых систем может изменяться не только за счет совершения работы или передачи теплоты, но еще и третьим способом – за счет перехода в систему из окружающей среды (или наоборот) некоторого количества вещества. В результате этого число молекул того или иного вида в системе изменяется, а, следовательно, изменяется сумма кинетической и потенциальной энергии частиц, т.е. изменяется общий запас энергии в системе.
Процесс обмена энергией системы и окружающей среды только в форме теплоты, т.е. через хаотическое движение частиц вполне реален.Для этого достаточно окружить систему, заключенную в жесткую (непроницаемую для вещества) оболочку, средой с более высокой или более низкой температурой.
В тоже время, невозможно реализовать ни один процесс, в котором обмен энергией совершался бы только в форме работы.Тепловое движение частиц в любой системе существует, и поэтому неизбежен обмен энергией также и в форме теплоты. Кроме того, всякое механическое перемещение частей системы обязательно сопровождается трением, а это тоже означает участие тепловой формы обмена энергией при механических процессах.
В термодинамике часто вводится представление о том, что система может быть окружена идеально нетеплопроводными стенками, непрозрачными также и для лучистой энергии. В этом случае обмен энергией с окружающей средой в форме теплоты невозможен, но совершение работы над системой возможно. Такие системы называются адиабатными системами, а процесс их перехода из одного состояния в другое называют адиабатным процессом.
В отличие от внутренней энергии, теплота и работа зависят от пути или способа совершения процесса и поэтому функциями состояния не являются. В связи с этим определяют абсолютные значения Qи А, а не их изменения.
studfiles.net
Первый закон термодинамики, внутренняя энергия, тепло, работа, энтальпия, энтропия.
1-й закон термодинамики, внутренняя энергия, тепло, работа, энтальпия, энтропия.
Первый закон термодинамики гласит, (4 разные формулировки) что :
Первый закон термодинами гласит, что энергия не может быть создана или уничтожена. Таким образом, энергия системы (замкнутой) — постоянна. Тем не менее, энергия может быть передана от одного элемента системы другому. Рассмотрим замкнутую систему, изолированную от остальных.
Передача энергии между различными подсистемами в ней может быть описана как :
E1 = E2
где
E1 = начальная энергия
E2 = конечная энергия
Внутрення энергия включает :
- Кинетическую энергию движения атомов
- Потенциальную энергию хранящуюся в химических связях
- Гравитационную энергию системы
Первый закон является основой для термодинамической науки и инженерного анализа.
Базируется на возможных типах обмена (энергии), ниже приведены 3 типа систем:
- пред — изолированные системы (isolated systems): отсутствует обмен элементами системы или энергией
- закрытые системы (closed systems): отсутствует обмен элементами системы, но присутствует некоторый обмен энергией
- открытые системы (open systems): возможен обмен как элементами системы, так и энергией
Первый закон термодинамики помогает использовать ключевые концепции внутренней энергии (internal energy), тепла (heat), и работы системы (system work). которые широко используются в описании тепловых систем (heat engines).
- Внутренняя энергия ( Internal Energy) — Внутренняя энергия определяется как энергия случайных, находящихся в неупорядченном движении молекул. Энергия молекул находится в диапазоне от высокой, необходимой для движения, до заметной лишь с помощью микроскопа энергии на молекулярном или атомном уровне. Например, у стакана с водой комнатной температы, стоящего на столе нет, на первый взгляд, никакой энергии: ни кинетической, ни потенциальной относительно стола. Но, с помощью микроскопа становится заметна «бурлящая» масса быстро двигающихся молекул. Если выплеснуть воду из стакана, эта микроскопическая энергия не обязательно заметно изменится, когда мы усредним добавленную кинетическую энергию на все молекулы воды.
- Тепло — Тепло может быть определено, как энергия, передаваемая от объекта с более высокой температурой к объекту с менее высокой температурой. Сам по себе объект не обладает «теплом»; соответствующий термин для микроскопической энергии объекта — внутренняя энергия. Внутренняя энергия может увеличиваться путем переноса энергии к объекту от объекта, имеющего температуру выше — этот процесс называется нагревом.
- Работа — Когда работа совершается термодинамической системой (чаще всего это газ, который совершает работу), то работа совершенная газом при постоянном давлении определяется как : W = p dV, где W — работа, p — давление, а dV -изменение объема.
В случаях когда давление не является постоянным, работа может быть представлена интегральным образом, как площадь поверхности под кривой в координатах давление, объем, которые представляют происходящий процесс.
Изменение внутренней энергии системы равно теплу (добавленному системе) минус работа, совершенная системой
dE = Q — W
где
dE = изменение внутренней энергии
Q = добавленное тепло
W =работа системы
1й закон не дает информации о характере процесса и не определяет конечного состояния равновесия. Интуитивно мы понимаем, что энергия переходит от объекта с более высокой температурой к объекту с менее высокой температурой. Таким образом, 2й закон нам нужен для получения информации о характере процесса.
Энтальпия —
- это «термодинамический потенциал » используемый в химической термодинамике реакций и не циклических процессов.
- однозначная функция состояния термодинамической системы при независимых параметрах энтропии и давления, связана с внутренней энергией соотношением, приведенным ниже.
- это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
H = U + PV
где
H = энтальпия
U = внутренняя энергия
P = давление
V = объем системы
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
Энтальпия является точно измеряемым параметром, когда определены способы выражения трех других поддающихся точному определению параметров формулы выше.
Энтропия.
Термин «энтропия» — величина, характеризующая степень неопределенности системы.
Однако, в термодинамике это понятие используется для определения связанной энергии системы. Энтропия определяет способность одной системы влиять на другую. Когда объекты пересекают нижнюю границу энергетического уровня необходимого для воздействия на окружающую среду, энтропия возрастает.Энтропия связана со вторым законом термодинамики.
Энтропия (обычно обозначается S), функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы.
в символьном виде записывается, как
dS=(dQ)/T
где
dS — изменение термодинамической системы
dQ — количество теплоты, сообщенное системе
T — термодинамическая температура системы
Неравновесные процессы в изолированной системе сопровождаются ростом энтропии, они приближают систему к состоянию равновесия, в котором S максимальна (закон неубывания энтропии).
Для вселенной в целом энтропия возрастает.
tehtab.ru
ВНУТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ. СПОСОБЫ ЕЕ ИЗМЕНЕНИЯ. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.
Внутренняя энергия— величина, характеризующая термодинамическое состояние тела. Каждое тело состоит из частиц, которые постоянно движутся и взаимодействуют друг с другом. Внутренняя энергия тела является суммой кинетической энергии движения частиц вещества и потенциальной энергии их взаимодействия.
Внутренняя энергия тела может изменяться при взаимодействии с окружающими телами.
Способы изменения внутренней энергии тела:теплообмен и совершение механической работы (над телом или самим телом).
Теплообмен — вид теплопередачи без совершения работы. При этом энергия передается от более нагретых тел к менее нагретым. Виды теплообмена: теплопроводность, конвекция, излучение.
Теплопроводность — передача энергии от более нагретых тел к менее нагретым или от более нагретых частей тела к менее нагретым в результате теплового движения частиц.
Конвекция — перенос энергии потоками жидкости или газа.
Излучение -перенос энергии разного рода лучами (электромагнитными волнами).
Первый закон термодинамики.
Первый закон термодинамики: изменение внутренней энергии системы равно сумме количества теплоты, переданной системе, и работы внешних сил, совершенной над системой.
ΔU = Q + A
где ΔU— изменение внутренней энергии, Q— количество теплоты, преданное системе, A— работа внешних сил.
Работа самой системыA` = —A, тогда первый закон термодинамики можно сформулировать так:
Количество теплоты, переданное системе, идёт на измене её внутренней энергии и на совершение системой работы.
ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ. АДИАБАТНЫЙ ПРОЦЕСС.
Тепловые двигатели.
Устройство, в котором происходит преобразование внутренней энергии в механическую называют тепловым двигателем.
Основные элементы теплого двигателя: нагреватель, рабочее тело, холодильник. В качестве рабочего тела чаще используют газ, который при расширении совершает работу.
Двигатель должен работать циклически, следовательно должна существовать последовательность процессов, приводящих рабочее тело в первоначальное состояние. Такую последовательность процессов называют рабочим циклом тепловой машины. В ходе цикла работа газа совершаемая при расширении должна быть больше работы внешних сил по сжатию газа, в противном случае полезной работы тепловой двигатель совершать не будет. Чтобы работа по сжатию газа оказалась меньше, необходимы нагреватель и холодильник.
КПД теплового двигателя.
Работа, совершаемая рабочим телом, равна разности получаемого от нагревателя и отданного холодильнику количеств теплоты.
КПД теплового двигателя:
.
Второй закон термодинамики.
В циклически действующей тепловой машине невозможен процесс, единственным результатом которого был бы преобразование в механическую работы всего количества теплоты, полученного от нагревателя.
АДИАБАТНЫЙ ПРОЦЕСС
Адиабатный процесс, процесс, происходящий в физической системе без теплообмена с окружающей средой. А. п. можно осуществить в системе, окруженной теплоизолирующей (адиабатной) оболочкой. Пример такого А. п. — рабочий такт тепловой машины, при котором газ (пар) расширяется в цилиндре с теплоизолирующими стенками и поршнем, при отсутствии необратимых превращений работы трения в теплоту.
А. п. можно реализовать и при отсутствии адиабатной оболочки; для этого он должен протекать настолько быстро, чтобы за время процесса не произошло теплообмена между системой и окружающей средой. Так происходит, например, сжатие газа ударной волной, при котором газ, не успевая отдать выделившуюся теплоту, сильно нагревается. При скорости волны порядка 1 км/сек (скорости, достигнутой современными сверхзвуковыми самолётами) и сжатии воздуха под действием ударной волны в 4 раза температура воздуха повышается до 700°С. Адиабатное расширение газа с совершением работы против внешних сил и сил взаимного притяжения молекул вызывает его охлаждение. Такое охлаждение газов лежит в основе процесса сжижения газов. А. п. размагничивания парамагнитных солей позволяет получить температуры, близкие к абсоллютному нулю (см. Магнитное охлаждение).
А. п. могут протекать обратимо (см. Обратимый процесс) и необратимо. В случае обратимого А. п. энтропия системы остаётся постоянной. Поэтому обратимый А. п. называют ещё изоэнтропийным. На диаграмме состояния системы он изображается кривой, называемой адиабатой, или изоэнтропой. В необратимых А. п. энтропия возрастает.
Рекомендуемые страницы:
lektsia.com
|
Внутренняя энергия 1-й закон термодинамики. |
|
|
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. |
|
|
Внимание!
|
U=U(T,V) |
|
Для идеального газа: U=U(T), т.к. взаимодействием на расстоянии пренебрегаем. — внутренняя энергия идеального одноатомного газа. Внутренняя энергия — однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) — одной и той же энергии могут соответствовать разные состояния. |
Идеальный газ:
|
|
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т.е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты. |
|
|
Р.Майер, Д.Джоуль, Г.Гельмгольц — закон сохранения энергии для тепловых процессов — 1-й закон термодинамики. |
|
|
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
|
|
|
Изменений внутренней энергии не зависит от способа, которым осуществляется этот переход. Т.о. существует два способа изменения внутренней энергии: совершение механической работы и теплопередача (теплообмен). Работа и количество теплоты характеризуют процесс изменения внутренней энергии, но не саму внутреннюю энергию. |
|
|
Если А — работа внешних сил, а А’ — работа газа, то А = — А’ (в соответствии с 3-м законом Ньютона). Тогда: — другая форма записи первого закона термодинамики.Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. |
|
|
Невозможность создания вечного двигателя 1-го рода. Вечный двигатель первого рода — устройство, которое могло бы совершать неограниченное количество работы без затраты энергии. Тогда Q=0. Следовательно: A’= — ΔU. Т.е. такой двигатель должен совершать работу за счет убыли внутренней энергии. Но ее запасы конечны. После того, как запас энергии будет исчерпан, двигатель остановится. |
|
www.eduspb.com
Термодинамическая система и ее внутренняя энергия
Внутренняя энергия
Термодинамических систем
Тема 2 Энергетические характеристики
Внутренняя энергиятермодинамической системы представляет собой сумму всех видов энергии движения и взаимодействия частиц, составляющих систему.
Это означает, что независимо от предыстории системы её энергия в данном состоянии имеет присущее этому состоянию значение, поэтому приращение внутренней энергии при переходе системы из одного состояния в другое всегда равно разности значений внутренней энергии в конечном и начальном состояниях независимо от пути перехода.
Таки образом,
. (2.1)
Внутренняя энергия является величиной аддитивной, т.е. внутренняя энергия системы равна сумме внутренних энергий отдельных ее частей.
В термодинамике часто используется понятие удельной внутренней энергии, т.е. внутренней энергии для массы системы равной 1кг.
(2.2)
где ¾ масса системы, кг.
Вопрос 45.1
Первый закон термодинамики
Первое начало (первый закон)термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формыэнергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил иколичества теплоты, переданного системе:
ΔU=A+Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU=A+Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A= 0 иQ= 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:
,
где A’ — работа, совершаемая системой (A’ = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Действительно, если к телу не поступает теплота (Q — 0), то работа A’, согласно уравнению , совершается только за счет убыли внутренней энергии А’ = -ΔU. После того, как запас энергии окажется исчерпанным, двигатель перестает работать.
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.

Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики ,
ΔU=Q,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU < 0, внутренняя энергия уменьшается.
Изотермический процесс.
Изотермический процесс графически изображается изотермой.
Изотермический процесс — это термодинамический процесс, происходящий в системе при постоянной температуре.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется, см. формулу , (Т = const), то все переданное газу количество теплоты идет на совершение работы:
Q = A’,
При получении газом теплоты (Q > 0) он совершает положительную работу (A’ > 0). Если газ отдает тепло окружающей среде Q <0 и A’ < 0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V).
Изобарный процесс.
Изобарный процесс на термодинамической диаграмме изображается изобарой.

Изобарный (изобарический) процесс— термодинамический процесс, происходящий в системе с постоянным давлением р.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле , передаваемое газу количество теплоты идет на изменение его внутренней энергии ΔUи на совершение им работы A’ при постоянном давлении:
Q = ΔU + A’.
Работа идеального газа определяется по графику зависимости p(V) для изобарного процесса (A’ = pΔV).
Для идеального газа при изобарном процессе объем пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс.
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой (Q= 0).
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия Uможет меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики (ΔU = А + Q), в адиабатной системе
ΔU = A,
где A — работа внешних сил.
При адиабатном расширении газа А< 0. Следовательно,
,
что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе. На рисунке ниже адиабата 1-2, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
infopedia.su
