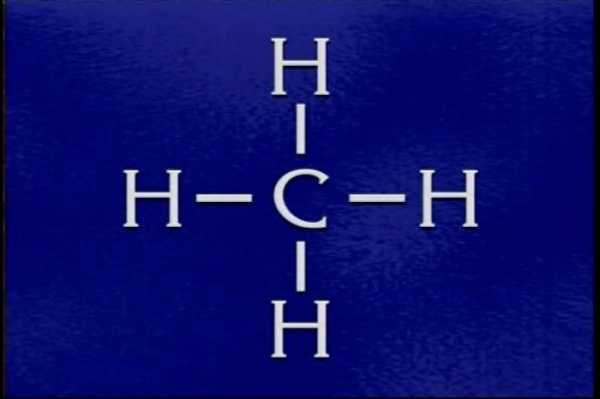
Молекулярная и структурная формула метана
Молекулярная, структурная и электронная формула метана составляются на основе теории строения органических веществ Бутлерова. Прежде чем приступать к написанию таких формул, начнем с краткой характеристики данного углеводорода.
Особенности метана
Данное вещество является взрывоопасным, его еще именуют «болотным» газом. Специфический запах этого предельного углеводорода известен всем. В процессе сгорания от него не остается химических компонентов, оказывающих негативное воздействие на организм человека. Именно метан является активным участником образования парникового эффекта.
Физические свойства
Первый представитель гомологического ряда алканов был обнаружен учеными в атмосфере Титана и Марса. Учитывая тот факт, что метан связан с существованием живых организмов, появилась гипотеза о существовании жизни на этих планетах. На Сатурне, Юпитере, Нептуне, Уране, метан появился в качестве продукта химической переработки веществ неорганического происхождения. На поверхности нашей планеты его содержание незначительное.
Общая характеристика
Метан не имеет цвета, он легче воздуха почти в два раза, плохо растворяется в воде. В составе природного газа его количество достигает 98 процентов. В нефтяном попутном газе содержится от 30 до 90 процентов метана. В большей степени метан имеет биологическое происхождение.
Копытные травоядные козы и коровы испускают при переработке в желудках бактерий довольно существенное количество метана. Среди важных источников гомологического ряда алканов выделим болота, термитов, фильтрацию естественного газа, процесс фотосинтеза растений. При обнаружении на планете следов метана, можно говорить о существовании на ней биологической жизни.

Способы получения
Развернутая структурная формула метана является подтверждением того, что в его молекуле только насыщенные одинарные связи, образованные гибридными облаками. Среди лабораторных вариантов получения данного углеводорода отметим сплавление ацетата натрия с твердой щелочью, а также взаимодействие карбида алюминия с водой.
Горит метан голубоватым пламенем, выделяя при этом порядка 39 МДж на кубический метр. Взрывоопасные смеси данное вещество образует с воздухом. Наиболее опасен метан, который выделяется во время проведения подземных разработок месторождений полезных ископаемых в горных шахтах. Высок риск взрыва метана и на обогатительных угольных и брикетных фабриках, а также на сортировочных производствах.
Физиологическое действие
Если процентное содержание метана в воздухе составляет от 5 до 16 процентов, при попадании кислорода возможно воспламенение метана. В случае существенного возрастания в смеси данного химического вещества повышается вероятность взрыва.
Если в воздухе концентрация данного алкана составляет 43 процента, он является причиной удушья.
При взрыве скорость распространения составляет от 500 до 700 метров в секунду. После того как метан контактирует с источником тепла, процесс воспламенения алкана происходит с некоторым запаздыванием.
Именно на этом свойстве базируется производство взрывобезопасного электрического оборудования и предохранительных взрывчатых компонентов.
Так как именно метан является самым термически устойчивым насыщенным углеводородом, он имеет широкое применение в виде промышленного и бытового топлива, а также используется в качестве ценного сырья для химического синтеза. Структурная формула три-этил-метана характеризует особенности строения представителей данного класса углеводородов.
В процессе его химического взаимодействия с хлором при воздействии ультрафиолетового облучения возможно образование нескольких продуктов реакции. В зависимости от количества исходного вещества, можно в ходе замещения получить хлорметан, хлороформ, четыреххлористый углерод.
В случае неполного сгорания метана образуется сажа. В случае каталитического окисления образуется формальдегид. Конечным продуктом взаимодействия с серой является сероуглерод.
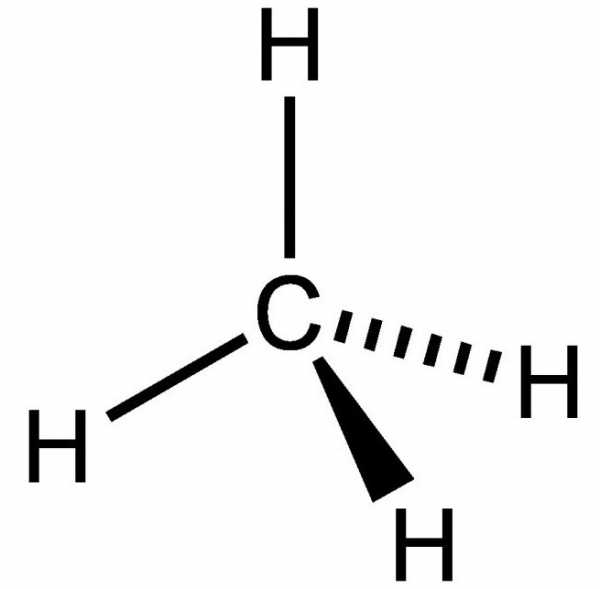
Особенности структуры метана
Какова его структурная формула? Метан относится к предельным углеводородам, имеющим общую формулу СnН2n+2. Рассмотрим особенности образования молекулы, чтобы пояснить, как образуется структурная формула.
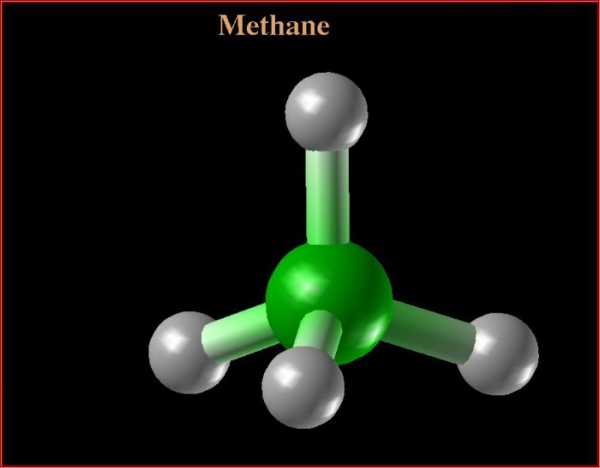
Метан состоит из одного атома углерода и четырех атомов водорода, связанных между собой ковалентной полярной химической связью. Поясним на основе строения атома углерода структурные формулы.
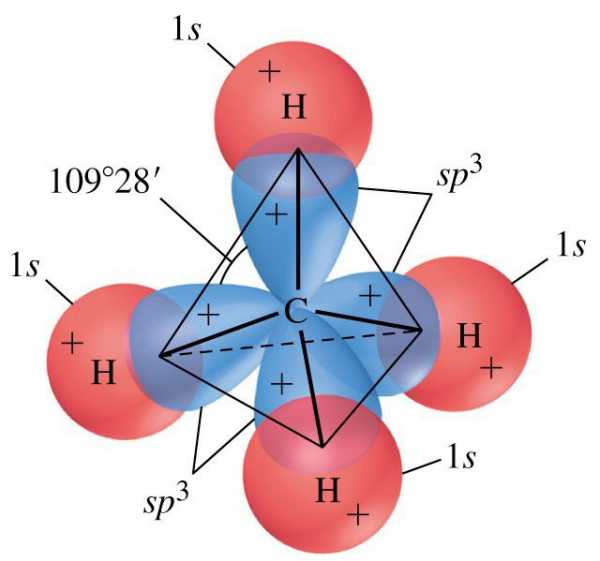
Вид гибридизации
Пространственное строение метана характеризуется тетраэдрической структурой. Так как на внешнем уровне у углерода четыре валентных электрона, при нагревании атома происходит переход электрона со второй s-орбитали на p. В итоге на последнем энергетическом уровне у углерода располагается четыре неспаренных («свободных») электрона. Полная структурная формула метана основывается на том, что происходит образование четырех гибридных облаков, которые ориентируются в пространстве под углом 109 градусов 28 минут, формируя структуру тетраэдра. Далее происходит перекрывание вершин гибридных облаков с негибридными облаками атомов водорода.
Полная и сокращенная структурная формула метана в полной мере отвечает теории Бутлерова. Между углеродом и водородами образуется простая (одинарная) связь, поэтому для данного химического вещества не характерны реакции присоединения.
Ниже представлена конечная структурная формула. Метан — это первый представитель класса насыщенных углеводородов, он обладает типичными свойствами предельного алкана. Структурная и электронная формула метана подтверждают тип гибридизации атома углерода в данном органическом веществе.
Из школьного курса химии
Данный класс углеводородов, представителем которого является «болотный газ», изучается в курсе 10 класса средней школы. Например, ребятам предлагается задание следующего характера: «Напишите структурные формулы метана». Необходимо понимать, что для этого вещества можно расписать по теории Бутлерова только развернутую структурную конфигурацию.
Его сокращенная формула будет совпадать с молекулярной, записываться в виде СН4. По новым федеральным образовательным стандартам, которые введены в связи с реорганизацией российского образования, в базовом курсе химии все вопросы, касающиеся характеристики классов органических веществ, разбираются обзорно.
Промышленный синтез
На основе метана были разработаны промышленные способы такого важного химического компонента, как ацетилен. Основой термического и электрического крекинга стала именно его структурная формула. Метан при каталитическом окислении с аммиаком образует синильную кислоту.
Применяют данное органическое вещество для производства синтез-газа. При взаимодействии с водяным паром получается смесь угарного газа и водорода, являющаяся сырьем для производства предельных одноатомных спиртов, карбонильных соединений.
Особое значение имеет взаимодействие с азотной кислотой, в результате получается нитрометан.
Применение в виде автомобильного топлива
В связи с нехваткой природных источников углеводородов, а также оскудением сырьевой базы, особую актуальность приобретает вопрос, связанный с поиском новых (альтернативных) источников для получения топлива. Одним из таких вариантов является биодизельное топливо, в составе которого есть и метан.
Учитывая разницу в плотности между бензиновым топливом и первым представителем класса алканов, существуют определенные особенности применения его в качестве источника энергии для автомобильных двигателей. Для того чтобы не было необходимости перевозить с собой огромное количества метана, путем сжатия его плотность увеличивают (при давлении порядка 250 атмосфер). Хранят метан в сжиженном состоянии в баллонах, устанавливаемых в автомобилях.
Воздействие на атмосферу
Выше уже шла речь о том, что метан оказывает воздействие на парниковый эффект. Если степень действия оксида углерода (4) на климат берется условно за единицу, то в нем доля «болотного газа» составляет 23 единицы. На протяжении двух последних столетий ученые наблюдают повышение количественного содержания метана в земной атмосфере.
На данный момент примерное количество СН4 оценивается в 1,8 части на миллион. Несмотря на то что данный показатель в 200 раз меньше, чем наличие углекислого газа, идет разговор между учеными о возможном риске удержания тепла, излучаемого планетой.
В связи с отличной теплотворной способностью «болотного газа», его применяют не только в качестве исходного сырья при осуществлении химического синтеза, но и в качестве источника энергии.
Например, на метане функционируют разнообразные газовые котлы, колонки, предназначенные для индивидуальной отопительной системы в частных домах и загородных коттеджах.
Такой автономный вариант отопления весьма выгоден для собственников жилья, не связан с авариями, систематически происходящими на централизованных отопительных системах. Благодаря газовому котлу, функционирующему на данном виде топлива, достаточно 15-20 минут для того, чтобы полностью обогреть двухэтажный коттедж.
Заключение
Метан, структурные и молекулярные формулы которого были приведены выше, является природным источником энергии. Благодаря тому, что в его составе есть только атом углерода и атомы водорода, экологи признают экологическую безопасность данного насыщенного углеводорода.
При стандартных условиях (температуре воздуха 20 градусов по Цельсию, давлении 101325 Па) это вещество является газообразным, нетоксичным, нерастворимым в воде.
В случае понижения температуры воздуха до -161 градуса, происходит сжатие метана, что широко применяют в промышленности.
Метан оказывает воздействие на здоровье человека. Он не является отравляющим веществом, но считается удушающим газом. Существуют даже предельные нормы (ПДК) по содержанию данного химического вещества в атмосфере.
Например, работы в шахтах разрешены только в тех случаях, когда его количество не превышает на метр кубический 300 миллиграммов. Анализируя особенности строения данного органического вещества, можно сделать вывод о его сходстве по химическим и физическим свойствам со всеми другими представителями класса насыщенных (предельных) углеводородов.
Мы проанализировали структурные формулы, пространственное строение метана. Гомологический ряд, который начинает «болотный газ», имеет общую молекулярную формулу СnН2n+2.
fb.ru
Метан (болотный газ) | Профилактика отравлений метаном
Метан (болотный газ; СН4) — это простейший предельный углеводород. Бесцветный, не имеющий запаха газ, t° плавления —182,48°. Метан легко загорается; смесь метана с воздухом взрывоопасна.
Метан является основным компонентом природного газа (60—99%), рудничного газа (35—40%), а также различных продуктов анаэробного разложения органических веществ, например болотного газа, газов полей орошения. В больших количествах метан образуется при коксовании каменного угля, гидрировании угля и в других промышленных производствах.
Метан используется как топливо при газификации, а также для промышленного синтеза углеводородов большого мол. веса. При неполном сгорании или каталитическом окислении метана образует метанол (см. Метиловый спирт), формальдегид (см.), ацетилен (см.). Метан используют также в производстве сажи, хлористого метила, хлорбромбензола, нитрометана, синильной кислоты и других продуктов.
Метан обнаруживается в кишечных газах (в результате метанового брожения), в крови животных и человека.
Метан является наиболее инертным соединением из группы парафиновых углеводородов. Физиологический метан индифферентен и может вызывать отравления лишь в очень высокой концентрации (из-за малой растворимости метана в воде и крови). Вместе с тем токсическое действие метана проявляется и при более низких концентрациях метана в воздухе. Так, при содержании в воздухе 25—30% метана появляются первые признаки асфиксии (учащение пульса, увеличение объема дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека головную боль. В полной мере токсическое действие метана проявляется лишь при повышенном давлении (2—3 атм).
Первая помощь при остром отравлении: удаление пострадавшего из вредной атмосферы. Грелки. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание, которое прекращается только после появления признаков трупного окоченения.
Хроническое действие метана. У работающих на шахтах или производствах, где в воздухе присутствуют метан и другие углеводороды ряда метана, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазо-сердечный рефлекс, резко выраженная атропиновая проба, гипотония). Тем не менее хроническое действие метана не вызывает тяжелых органических изменений, хотя некоторые исследователи связывают возникновение у шахтеров нистагма с длительным воздействием метана.
Профилактика отравлений метаном. В подземных выработках не допускается содержание метана выше 0,75 об.%. При повышении содержания метана рабочие должны быть непременно удалены, а помещения — проветрены. Главной мерой предупреждения скоплений метана в шахтах является наличие хорошей вентиляции. При индивидуальной защите необходимо применение шлемов с принудительной подачей воздуха или дыхательных аппаратов, снабженных запасом воздуха.
См. также Отравления, Углеводороды.
www.medical-enc.ru
Как получить метан?
Метан – это простейший представитель предельных углеводородов. Он хорошо горит с выделением большого количества тепла, поэтому широко используется промышленностью.
Как получить метан в промышленности
Метан входит в состав природного газа и газа, сопутствующего нефтяным месторождениям. Поэтому промышленность получает метан из этих газов.
Как получить метан в домашних условиях
Метан имеет и другое название – болотный газ. Для того чтобы получить его в домашних условиях следует взять немного почвы со дна болота и поместить ее в банку, залив сверху водой. Банку плотно укупоривают и помещают в темное и теплое место. Через несколько дней можно будет заметить появление на поверхности воды мелких пузырьков газа. Образующийся метан можно отвести из банки через газоотводящую трубочку.
Как получить метан в лабораторных условиях
Получить метан в условиях лаборатории можно несколькими способами:
- Пропускание смеси сероводорода и сероуглерода через трубку, на дне которой расположена раскаленная медь: CS2 + 2H2S + 8Cu = CH4+ Cu2S. Это был самый первый способ получения метана. Позже было выяснено, что получить метан можно при нагревании смеси водорода и углерода в присутствии никелевого катализатора до 475 градусов. Без использования катализатора нагревать смесь приходится до 1200 градусов. С + 2H2 = CH4
- В настоящее время метан получают нагреванием смеси гидроксида натрия и ацетата натрия: СН3СООNa + NaOH = Na2CO3 + CH4.
- Получить чистый метан можно при реакции карбида алюминия и воды: Al4C3 + 12H2O = 4 Al(OH)3 + 3CH4
- Синтез метана может вестись и на основе соединения водорода и угарного газа: CO + 3H2 = CH4 + H2
Как из метана получить ацетилен
Получить ацетилен из метана можно в рез
elhow.ru
Метан физические свойства — Справочник химика 21
Углеводородные газы резко отличаются друг от друга по температурам кипения. Метан может перейти в жидкое состояние лишь при очень низких температурах. Жидкий метан кипит и превращается в газ лишь при температуре —161° С. Критическая температура метана —82° С. Следовательно, в толщах горных пород, где температура выше 0° С, ни при каком давлении метан не перейдет в жидкое состояние. Этан кипит при довольно низкой температуре (—88° С), но его критическая температура 32° С, поэтому при температуре более низкой чем 32° С и при достаточном давлении этан может перейти в жидкое состояние. Еще легче переводят в жидкое состояние пропан, бутан и изобутан. Например, для того чтобы при комнатной температуре перевести эти углеводороды в жидкое состояние, требуется давление для пропана 7—8 ат, для изобутана около 3 ат и для бутана около 2 ат. В табл. 6 приведены основные физические свойства углеводородных и некоторых других газов. [c.235]Рассматривая физические свойства углеводородных газов, следует отметить большое различие их плотностей. Метан является наиболее легким из углеводородных газов, его плотность составляет 0,55 по отношению к атмосферному воздуху. Плотность этана близка к плотности воздуха. Пропан и бутан уже значительно тяжелее. Пары жидких углеводородов имеют плотность в 3—4 раза большую, чем плотность воздуха. [c.235]
Изотермические емкости для хранения сжиженных газов. Метан, этан, этилен в виде жидкой фазы в силу их физических свойств практически невозможно хранить в емкостях под давлением. Для этой цели применяют изотермические резервуары, в которых эти продукты хранятся под атмосферным давлением при температуре кипения. В ряде случаев пропан, бутан или их смеси (ПБФ, ШФЛУ) целесообразно хранить также в изотермических емкостях. Температура хранения для каждого
В трех запаянных ампулах находятся три разных газа метан, углекислый газ, ацетилен. Опишите, как, основываясь на различии в химических и физических свойствах, можно надежно определить, где какой газ находится. Приведите необходимые уравнения реакции. [c.61]
Гомологические ряды неразветвленных алканов обнаруживают плавное изменение физических свойств (см. табл. 2.3 и рис. 2.1.1) [12]. Метан, этан, пропан и бутан в обычных условиях — газы, углеводороды С5—С17 — жидкости, высшие углеводороды — твердые вещества. Все алканы легче воды и не растворяются в ней. [c.71]
Раздел 2. Метан Основные физические свойства метана [c.9]
Метан — бесцветный газ, в жидком состоянии его плотность меньше плотности воды (уд. вес. 0,4). В соответствии с правилом подобное растворяется в подобном он очень плохо растворим в воде, но хорошо растворим в органических жидкостях, таких, как бензин, эфир и спирт. Физические свойства метана сходны со свойствами других членов ряда алканов. [c.41]
Некоторые физические свойства используемых в настоящее время геттеров приведены в табл. 7. Из всех геттеров, указанных в таблице, наибольшее распространение получил титановый, который при распылении сорбирует значительные количества кислорода, азота, двуокиси и окиси углерода, водорода и паров воды. Инертные газы, а также метан и другие углеводороды сорбируются титаном слабо. В атмосфере поверхность титана быстро покрывается прочной и непроницаемой пленкой окислов, нитридов и карбидов, которые предотвращают дальнейшую реакцию газов с металлом. Высокая активность титана наряду со сравнительно высокой скоростью испарения и низкой стоимостью предопределили его широкое использование как геттера. [c.55]
Относительно других физических свойств предельных углеводородов следует упомянуть/ что газообразные члены ряда (метан, этан) не обладают запахом легко летучие низшие парафины имеют запах бензина , а высшие углеводороды вследствие слишком малой летучести не вызывают уже никакого ощущения запаха.
Безопасность работы с метаном требует знаний не тельно правил техники безопасности, но и физических свойств метана [c.220]
Физические свойства веществ находятся в определенной зависимости от их состава и строения. Так, типичные соединения водорода с неметаллами представляют собой или газы (как НС1, HjS, NHj и др.), или низкокипящие жидкости (как Н2О). Метан, этан, пропан и бутан также представляют собой газы (табл. I). [c.23]
Важную роль в структурообразовании играют газовые компоненты нефти азот, метан и этан. Растворенные в нефти, эти газы в зависимости от их количества изменяют ее физические свойства вязкость, объемную упругость, теплоемкость и т. д. [c.8]
Отсутствие неподеленных пар в молекуле СН4, во-первых, приводит к заметному упрочнению связей и, во-вторых, делает метан гораздо менее реакционноспособным по сравнению с соединениями элементов 15-17 й групп. Высокая симметрия sp -гиб-ридных орбиталей приводит к тому, что тетраэдрические молекулы метана лишены дипольного момента и поэтому межмолекулярные силы слабы, а отсутствие неподеленных пар на атомах углерода делает невозможным образование водородных связей в жидком СН4, что сразу же сказывается на его физических свойствах. [c.305]
Физические свойства и распростр нение в природе. Метан — бесцветный газ, почти вдвое легче воздуха, мало растворимый в воде, но хорошо в нефти и других органических растворителях. Его иначе называют болотным, или рудничным, газом, так как он выделяется со дна болот и нередко содержится в воздухе угольных шахт и рудников. В болотах он образуется при разложении растительных и животных остатков без доступа воздуха. Много его растворено в нефти. В нефтеносных районах метан с небольшой примесью других газов выделяется иногда из земли. Эту смесь называют природным газом. Некоторые месторождения природного газа содержат громадные количества метана (до 80—90%). В СССР крупные газоносные районы расположены в Поволжье (Саратов и др.), на Северном Кавказе (Ставрополь), Украине (Прикарпатье и др.), в Зауралье (Березовское) и в других местах.
Природные и нефтяные газы — это источники ценного углеводородного сырья для нефтехимической и химической промышленности. Основной компонент этих газов — метан, по физическим свойствам он резко отличается от других компонентов газа. На различии физических констант компонентов основаны процессы, применяемые для извлечения из газа целевых компонентов и их разделения. [c.212]
Примером влияния водородной связи на химические и физические свойства веществ является повышенная растворимость различных веществ в растворителях, содержащих электронодонорные атомы азота и кислорода (амины, эфиры). Причем растворимость растет по мере замещения водорода в метане или этане на галоген, например, от СНзС1 до СНС1з- Но при переходе к ССЬ растворимость резко падает. Это объясняется тем, что при увеличения числа атомов галогена повышается подвижность оставшихся в молекуле атомов водорода. При замещении же последнего из них на галоген исключается самая возможность возникновения водородной связи. [c.23]
На рис. 5.6 показана принципиальная технологическая схема станции, на которой слив сжиженного газа осуществляют с помощью газов под необходимым давлением. Например, при сливе хлора используют сжатый воздух, окиси этилена — азот, сжиженных углеводородных газов — природный газ, технологические газы е химико-физическими свойствами, аналогичными транспортируемому продукту, а также метан, азот, двуокись углерода. [c.77]
Физические свойства. Метан — бесцветный газ, лишенный запаха, мало растворим в воде (в 100 объемах воды при 20°С растворяется 9 объемов метана), легче воздуха. [c.27]
Для выяснений той роли, которую вода играет в нашем природном окружении, важно знать ее физические свойства в твердом, жидком и газообразном состояниях. Поэтому полезно начать с напоминания о некоторых особых свойствах воды, описанных в предыдущих главах. Для вещества с такой небольшой молекулярной массой вода обладает необычно высокими температурами плавления и кипения (см. разд. 11.5, ч. 1). Метан СН , имеющий приблизительно такую же молекулярную массу, как и вода, кипит при 89 К, в то время как вода кипит при 373 К. Вода обладает необьино высокой удельной теплоемкостью, равной 4,184 Дж/(г град). Удельная теплоемкость большинства простых органических жидкостей составляет лишь приблизительно половину указанной величины. Это означает, что при поглощении определенного количества теплоты температура воды повышается на меньшую величину, чем у многих других жидкостей. Теплота испарения воды тоже необычно высока, т.е. для испарения одного грамма воды требуется больше теплоты, чем для испарения [c.143]
При радиолизе алканов образуются не только метан и водород, но и насыщенные углеводороды с низким молекулярным весом — продукты с содержанием углеродных атомов, большим, чем в исходной молекуле, и ненасыщенные углеводороды с различным молекулярным весом. В основном выход разложения алканов находится между 6 и 10. Для алканов с прямой цепью количество продуктов радиолиза (см. табл. 9.1) с числом атомов углерода меньше, чем в материнском соединении, уменьшается по мере возрастания длины цепи и одновременно повышается доля высокомолекулярных продуктов. Таким образом, излучение в данном случае увеличивает средний молекулярный вес углеводородов, что легко заметить по изменению физических свойств облучаемого материала. Например, в жидких системах появляются нерастворимые гели, а у твердых соединений возрастает температура плавления. Эти явления хорошо изучены при сшивании цепей облучаемого полиэтилена (см. гл. И). [c.277]
При изучении процессов фиксации азота обычно приходится иметь дело с шестью газами, а именно с водородом, азотом, аммиаком, метаном, окисью углерода, двуокисью углерода и их смесями. Настоящая глава представляет сводку наиболее важных физических свойств этих шести газов и их смесей. [c.194]
Физические свойства. Метан СН4 — первый член ряда предельных углеводородов. Бесцветный, не имеющий запаха газ, плотность его по отношению к воздуху 0,554 (20°С) 1 г метана занимает объем 1520 мл (25°С, 101,3 кПа) в воде растворим очень мало. Объясняется это тем, что химические связи в молекуле метана имеют неполярный ковалентный характер и молекулы метана тоже неполярны, поэтому они не взаимодействуют с полярными молекулами воды. [c.238]
В органической химии парафинами называются предельные углеводороды алканового (алифатического, или жирного) ряда, имеющие формулу СпНгп+з, вне зависимости от их места, занимаемого в этом ряду, а также от физических свойств и химической структуры. Так, парафинами в органической химии считаются в равной степени и газообразный метан СН4, и н-гептаконтан С7оН]42, плавящийся при 105,2 °С. [c.7]
В гомологическом ряду наблюдается постепенное изменение физических свойств углеводородов повышаются температуры кипения и плавления, возрастает плотность. При обычных условиях (температура 22°С) первые четыре члена ряда (метан, этан, пропан, бутан) — газы, с СбНха до С1вНз4 — жидкости, а с С Нд, — твердые вещества. [c.281]
Как видно из табл. 3.1, удельная массовая теплота сгорания у одорода выше в 2,4 раза, а объемная — ниже в 3,3 раза, чем у втана. Температура кипения у водорода на 86,7 К ниже, чем у ме-Водород более пожароопасен и взрывоопасен, чем метан, олее подробно физические свойства водорода рассмотрены в Де книг и обзоров [14 46]. [c.151]
Физические свойства. Низшие тиолы — жидкости (за исключением метан-тиола) с сильным неприятным запахом. Обоняние человека обнаруживает в воздухе ничтожные количества тиола (1 часть метантиола на 5-10 частей воздуха). Поэтому некоторые тиоспирты (например, пентантиол) добавляют к природному газу в качестве одоранта (от лат. odoratio — запах) для обнаружения его утечки в газопроводах. [c.185]
Неполярные соединения. Физические свойства рассматриваемых в этом разделе неполярных соединений зависят от межмолекулярной ассоциации молекул в жидком и твердом состояниях. Силы иритяження (силы Ван-дер-Ваальса) растут с поляризуемостью этих молекул. Повышение температуры плавления и кипения при переходе от соединений с более низким молекулярным весом к соединениям с более высоким молекулярным весом в гомологических рядах обусловлено наконлением слабых ван-дер-ваальсовых взаимодействий. Две молекулы метана могут вступать во взаимодействие только посредством двух пар водородных атомов, между тем как две виолне вытянутые молекулы /(-декана имеют пять точек контакта, подобных одной паре в метане. Две вполне вытянутые молекулы к-декана изображены на рис. 7.5. [c.162]
Первые четыре представителя гомологического ряда—метан, этан, пропан, бутан и изобутан —это газы, входящие в состав природных горючих газов, а также растворенные в нефти. Следующие представители — жидкости, начиная с С16Н34 —твердые вещества. Формула каждого следующего члена гомологического ряда метана отличается от предыдущей на СНг. Нужно подчеркнуть, что это отличие выражается в изменениях физических свойств членов гомологического ряда, например в повышении температуры кипения, т. е. наблюдается переход количественных изменений в качественные. [c.49]
Если рассмотреть два органических вещества — СН4 (метан)и СН3ОН (метиловый спирт), то, кроме бросающихся в глаза различий в физических свойствах (газ и жидкость), можно заметить глубокие различия в химических свойствах реакции спирта с Na, H l и т. д. показывают, что один атом кислорода, введенный в молекулу, преображает ее. Кислород в молекуле — это не прос- [c.80]
Для образования большого количества полимера требуется легкодоступный и дешевый источник углерода. Ферментация позволяет культивировать организм-продуцент в строго определенных условиях среды, контролируя, таким образом, процесс биосинтеза и влияя на тип продукта и его свойства. Специфи- чески изменяя условия роста, можно менять молекулярную массу и структуру образующегося полимера, В ряде случаев максимальная скорость синтеза полисахарида достигается в логарифмической стадии роста, в других — в поздней логарифмической или в начале стационарной. Обычно углеводными субстратами служат глюкоза и сахароза, хотя полисахариды могут образовываться и при росте микроорганизмов на н-алка-,яах( С12-61), керосине, метаноле, метане, этаноле, глицероле и этиленгликоле. Недостатком проведения процесса в ферментерах является то, что среда часто становится очень вязкой, поэтому культура быстро начинает испытывать недостаток кислорода мы все еще не умеем рассчитывать соотношение между скоростью перемешивания неньютоновских жидкостей и подачей кислорода. Необходимо также контролировать быстрые изменения pH среды. И все же упомянутый метод позволяет быстро синтезировать полимер для того, чтобы определить его физические свойства, а также дает возможность оптимизировать состав среды, главным образом в отношении эффективно- сти различных углеводных субстратов. Часто в качестве лимитирующего фактора применяют азот (соотношение углерод азот — 10 1), хотя можно использовать и другие (серу, магний, калий и фосфор). Природа лимитирующего фактора способна определять свойства полисахарида, например его вяз- костные характеристики и степень ацилирования. Так, многие оолисахариды, синтезируемые грибами, фосфорилированы. При недостатке фосфора степень фосфорилирования может уменьшаться или становиться равной нулю в этих условиях может даже измениться соотношение моносахаридов в конечном по- [c.219]
Эти гидриды во всех агрегатных состояниях существуют в виде одних и тех же молек л. Когда твердый метан превращается последовательно в жидкость и газ, то не происходит никаких перестановок атомов углерода и водорода относительно друг друга структура молекулы СН4 сохраняется во всех этих состояниях. Между молекулами действуют только слабые ван-дер-ваальсовские силы это Идмеет. место для всех молекулярных гидридов, за исключением гидридов самы.ч электроотрицательных эле.ментов первого короткого периода (азот, кислород и фтор . Физические свойства МН.,, ОН., и РН во многих отношениях отклоняются от нормы, особенно в жидком и твердом состоянии, вследствие образования междумолеку.тярных водородных связей. В одном из следующих разделов мы вернемся к рассмотрению гидридов с этой точки зрения. Во многих случаях твердые вещества образуют плотно упакованные структуры, в которых вращаются молекулы (например, кубические плотно упакованные структуры СН , РНл, АзНд, ЗНг, ЗеН, и т. д.). [c.282]
Методы получения и некоторые простые реакции присоединения альдегидов и кетонов Ч.1 (0) — [ c.90 , c.385 ]
Начала органической химии Книга первая (1969) — [ c.62 , c.63 ]
Органическая химия Том1 (2004) — [ c.139 ]
Основы органической химии (1968) — [ c.72 ]
Основы органической химии 1 Издание 2 (1978) — [ c.86 , c.87 ]
Основы органической химии Часть 1 (1968) — [ c.72 ]
Основные начала органической химии Том 1 Издание 6 (1954) — [ c.162 , c.170 ]
Холодильная техника Кн. 1 (1960) — [ c.444 ]
Общая химическая технология Том 1 (1953) — [ c.288 , c.308 ]
Методы органической химии Том 2 Издание 2 (1967) — [ c.798 ]
Методы органической химии Том 2 Методы анализа Издание 4 (1963) — [ c.798 ]
Начала органической химии Кн 1 Издание 2 (1975) — [ c.58 , c.59 ]
chem21.info
Получение метана
 Метан является взрывоопасным газом, но, тем не менее, обладающим большой ценностью для человека. Поэтому многие лаборатории специализируются на создании этого вещества.
Метан является взрывоопасным газом, но, тем не менее, обладающим большой ценностью для человека. Поэтому многие лаборатории специализируются на создании этого вещества.
В лабораториях метан получают с помощью процесса нагревания так называемой натронной извести. Это вещество является смесью гидроксидов кальция и натрия) или нагревания гидроксида натрия (безводная форма) с замершей уксусной кислотой. Почему берут ледяную кислоту – потому что для данной химической реакции принципиально важно полное отсутствие молекул воды, вот почему пригождается гидроксид натрия, материал обладающий пониженной гигроскопичностью.
Для добычи метана в лабораторных условиях также иногда применяют гидролиз карбида алюминия либо гидролиз определенных металлорганических веществ, в частности, метилмагнийбромид.
Метан также добывают из болотного газа и газа, скапливающегося в рудах. Потому его и называют рудничным. В обоих веществах метан является основным компонентом, впрочем, и в природных, а также попутных нефтяных газообразных веществах его также содержится более других элементов. Образуется в природных условиях метан при наличии анаэробных условий. Также он возникает при коксовании отложений каменного угля, при его гидрировании, а также при гидрогенолизе углеводородов при происхождении каталитического риформинга.
Метан в зависимости от происхождения подразделяется на бактериальный(образуется в результате «работы» бактерий), биогенный (создается в результате химического превращения органического вещества), термогенный (возникает в результате термических реакций) и абиогенный (является результатом химических процессов неорганических веществ).
Науке также известно, что на поверхности одного из спутников Сатурна, на Титане, где очень низкие температурные условия, порядка -180 градусов по Цельсию, существуют огромные озера, родники и реки, но в них вместо воды течет жидкая этано-метановая смесь.
Метан – газ без запаха и цвета, именно этим он и опасен: начиная выделаться в рудах и скважинах, он может причинить много неприятностей, вплоть до трагического исхода. Его воздействие на центральную нервную систему до конца не изучено, но ясно одно — если метан накапливается в закрытом объеме – подвале, квартире или шахте, он становится попросту огне- и взрывоопасным. Когда газ подготавливают к бытовому использованию, к нему добавляют одоранты – резко пахнущие вещества, обычно ими являются меркаптаны. В промышленных условиях ставят специальные датчики. Именно этот специфический и знакомый всем газовый запах чувствует человек. Достаточно концентрации метана в воздухе от 4, 4 процентов, чтобы произошел взрыв. Но наиболее взрывоопасной концентрацией считается количество 9, 5 процентов.
Метан является легче воздуха, а в воде он практически нерастворим (или растворим очень мало). Кстати, именно благодаря этому свойству почти не проявляются наркотические качества метана – он в крови почти не растворяется.
Класс опасности метана – четвертый.


www.oilngases.ru
Синтезы органических веществ метана — Справочник химика 21
По Юри, органические соединения образовывались в атмосфере за счет действия ультрафиолетовой радиации и электрических разрядов. Миллер полагает, что в результате фотолиза метана, аммиака или воды образовались атомы водорода, которые, взаимодействуя с окисью углерода, дали формальдегид и глиоксаль активирование азота обусловило его реакцию с метаном и другими углеводородами, в результате которой образовалась синильная кислота. По-видимому, в этом процессе участвуют радикалы Н и ЫНг. Действие радиации высокой энергии, вероятно, играло не меньшую роль. В 1951—1952 гг. был проведен синтез органических соединений из углекислоты и воды, причем применялся циклотрон на 40 Мэе, в котором ускорялись а-частицы. В небольшом количестве была получена муравьиная кислота формальдегид образовывался только в присутствии ионов железа, которые, по Миллеру, служили восстановителями по-видимому, окислительные условия не способствуют синтезу органических веществ [7]. Позже Кальвин с сотрудниками повторил эти опыты, применив линейный ускоритель (5 Мэе) так, что поток частиц проходил через смесь метана, аммиака и воды. Изотопная методика позволила обнаружить в продуктах реакции аланин, глицин, другие аминокислоты, мочевину, жирные кислоты, оксикислоты и сахара. Следовательно, действия одного только фактора уже оказалось достаточным, чтобы создать целый набор веществ, крайне важных для синтеза сложных органических веществ. Пути этого синтеза, несмотря на их разнообразие, как правило, уже связаны с каталитическими процессами . [c.45]Характеристическим летучим водородным соединением углерода является метан. В обычных условиях водород с углеродом не реагирует. Синтез метана идет только при достаточно высокой температуре и в присутствии катализатора (мелкораздробленный никель). Применяются также и другие способы получения метана из сложных органических веществ. В лаборатории метан можно получить разложением карбида алюминия водой. В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется р -гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000° С. Выше этой температуры разлагается с образованием ацетилена и водорода [c.362]
Количество данных, касающихся биосинтеза аминокислот, очень велико, но о ранних стадиях биосинтеза известно меньше, чем о более поздних. Современные представления о механизмах превращения газообразного азота в аммиак у растений изложены в специальной монографии [1]. Миллер [2] сделал очень интересную попытку подойти к решению проблемы первичного образования органических веществ на земле он показал образование аминокислот (глицин, саркозин, ОЬ-аланин, р-аланин, ОЬ-а-аминомасляная кислота и а-аминоизомасляная кислота), а также других соединений (молочная, муравьиная и уксусная кислоты) в системе, содержащей метан, аммиак, водород и воду. Эту смесь, близкую к предполагаемому составу земной атмосферы на ранних стадиях ее образования, подвергали в течение недели и дольше воздействию электрических разрядов. Было найдено, что аминокислоты образуются путем гидролиза нитрилов последние в свою очередь возникают в результате реакции между альдегидами и синильной кислотой, образующимися под действием электрических разрядов. Миллер высказал любопытное предположение о возможном синтезе первых живых организмов из аминокислот и других соединений, образовавшихся в результате взаимодействия между альдегидами, синильной кислотой и аммиаком в первичном океане. [c.307]
В связи с этими особенностями цели газовой промышленности существенно расширились. Из пластового флюида месторождений со сложным составом можно получить топливный газ высокого давления (метан) этан — сырье для органического синтеза, производства пластических масс, поверхностно-активных веществ, синтетических материалов и т. д. [c.8]
Способы получения. Основными источниками метана являются природные горючие газы и каменный уголь. Синтетический метан можно получить из углерода и водорода. Эта реакция является примером синтеза органических веществ непосредственно из элементов. [c.19]
Оказалось, что эти бактерии не нуждаются в органических веществах кан и зеленые растения, они способны синтезировать органические соединения из СО2 и Н2О, но в отличие от растений не за счет энергии солнечных лучей, а за счет энергии, выделяющейся при окислении аммиака и нитрит-иона. Этот процесс получил наименование хемосинтеза. Позднее были открыты и другие бактерии, способные к хемосинтезу, окисляющие свободным кислородом серу и сероводород, двухвалентное железо, марганец, трехвалентную сурьму, водород, метан, уголь. Во всех этих случаях реакция окисления дает бактериям энергию, необходимую для синтеза органических веществ из СОа и Н2О. [c.69]
При стандартных условиях СН4 — бесцветный газ без запаха и вкуса. Метан в больших количествах содержится в природе в пустотах земной коры, в виде раствора в нефти, выделяется как продукт разложения органических веществ анаэробными бактериями в отсутствие кислорода (болотный газ). Несмотря на малое содержание в атмосфере (7 10 % объемн.), метан относится к газам, регулирующим ее парниковый эффект . Метан добывают десятками миллионов кубометров как сырье для органического синтеза и как топливо. [c.305]
Со второй половины прошлого столетия серьезное значение в качестве сырья приобрел каменный уголь. Получаемая в виде побочного продукта коксования каменноугольная смола открыла путь для промышленного получения бензола, толуола, нафталина и других ароматических углеводородов. Эти вещества в свою очередь стали сырьем для синтеза красителей, лекарственных препаратов, взрывчатых веществ. В нашем столетии все большее значение в качестве сырья стала приобретать нефть, главной составной частью которой являются парафиновые и нафтеновые углеводороды. Важным сырьем стал и природный газ, главная составная часть которого — простейший парафиновый углеводород — метан СН4. Органические вещества выделяют также из сланцев. Сохранила свое значение и древесина, запасы которой, в отличие от ископаемого сырья, постоянно возобновляются. [c.13]
Сырьем для их получения служат водород, окись углерода, метан и его гомологи, этилен, пропилен, н-бутилен, изобутилен, ацетилен, бензол, толуол, нафталин и др., получаемые при переработке жидкого, твердого и газообразного топлив. В производстве синтетических органических продуктов используются процессы окисления и восстановления, гидрирования и дегидрирования, гидратации и дегидратации, сульфирования, нитрования, галоидирования и др. На их основе осуществляется синтез самых различных соединений, служащих сырьем для получения полимеров, синтетических красителей, ядохимикатов, смазочных, моющих, душистых и лекарственных веществ и т. д. Большинство органических процессов протекает в присутствии катализаторов. [c.320]
Метан может образовываться при биохимическом разложении (метановом брожении) органических веществ при участии бактерий (например, болотный метан), при химическом — термокаталитическом — преобразовании тех же веществ в осадочной толще, наконец, при глубинном неорганическом синтезе (например, при воздействии водорода на свободный углерод и его окислы). Подавляющая часть метана газовых и газо-нефтяных залежей образуется путем термокаталитического преобразования веществ в осадочной толще. Частично непосредственным источником метана служат нефтяные углеводороды и другие компоненты нефтей. [c.216]
Гомологи метана распространены в природе значительно меньше, чем метан. Биохимическое образование их в сколько-нибудь существенных размерах, по-видимому, не происходит в зоне диагенеза п раннего катагенеза отложений они практически не встречены. Б сущности, область распространения гомологов метана в природе совпадает с таковой для нефтей (см. гл. X). Эти газы можно рассматривать и как газовую фракцию нефтей, иногда встречающуюся в обособленном от остальных фракций состоянии. Отсутствие биохимического образования гомологов метана приводит к заключению, что они представляют собой продукты исключительно термокаталитических превращений органических веществ в стратисфере. Возможность их неорганического синтеза безусловно крайне ограничена (даже в большей степени, чем метана). Очевидно, гомологи метана в газо-нефтяных и отчасти в газовых залежах в значительной мере возникли за счет превращений жидких нефтяных углеводородов, а также за счет дисперсных органических компонентов осадочных пород. [c.216]
ГАЗ КОКСОВЫЙ — горючий газ, образуется в процессе коксования каменного угля (нагревании без доступа воздуха до 900—1100° С). Г. к. содержит водород, метан, оксид углерода, углеводороды и другие горючие комю-ненты. Г. к. используется для отопления коксовых и мартеновских печей, ка керамических и Других заводах, в качестве химического сырья для получения водорода и синтеза органических веществ. [c.62]
КОНВЕРСИЯ ГАЗОВ (лат. сопуег-510 — превращение) — процесс переработки газов с целью изменения состава исходной газовой смеси. Конвертируют метан и его производные или оксид углерода для получения водорода или его смесей с оксидом углерода — так называемый синтез-газ, который используют для синтеза органических веществ, в качестве газа-восстановителя в металлургии или для получения чистого водорода. [c.133]
Исходные вещества — простые углеводороды метан, этилен, пропилен, бутилен, ацетилен, бензол, толуол и др., являющиеся основным сырьем органического синтеза, получаются при химической переработке газообразных, жидких и твердых видов топлива. В настоящее время многие из перечисленных исходных веществ выпускаются десятками и сотнями тысяч тонн. [c.160]
Тем не менее в нижних зонах земной коры, в ее магматических породах, там где температурные условия благоприятны, возможно образование некоторых количеств углеводородов в результате реакций синтеза из водорода, окиси углерода, углекислого газа, воды ж углерода. Концентрации этих углеводородов невелики. Они представлены главным образом метаном, так как жидкие углеводороды при высокой температуре (выше 200 — 250° С) не могут сохраняться. Образуются при этом некоторые битуминозные вещества. Следует, однако, иметь в виду, что жизнь на Земле возникла 2 — 3 млрд. лет назад и органические остатки и образовавшиеся из них углеводороды могут находиться в рассеянном состоянии в очень древних метаморфических породах. [c.80]
Исходные вещества — простые углеводороды метан, этилен, пропилен, ацетилен, бензол, толуол и другие, являющиеся основным сырьем органического синтеза, получаются при переработке различных видов топлива. Многие из этих углеводородов выпускаются промышленностью десятками и сотнями тысяч тонн. [c.482]
МЕТАН СН4 — первый член гомологического ряда предельных углеводородов, Бесцветный газ, не имеющий запаха, малорастворим в воде. М. образуется в природе при разложении органических веществ без доступа воздуха на дне болот, в каменноугольных залежах (отсюда другое название М.— болотный, нли рудничный газ). В большом количестве М, образуется при коксовании каменного угля, гидрировании угля, нефти. В лаборатории М. получают действием воды на карбид алюминия. Л, — главная составная часть природных горючих газов. М. легче воздуха, смеси М. с воздухом взрывоопасны, М. горит бледным синим пламенем. М, широко используется в промышленности и быту как топливо, для получения водяного и синтез-газа, применяемых для органического синтеза углеводородов с большой молекулярной массой, спиртов, ацетилена, сажи, хлористого метила, хлорбро . метана, ни-грометака, цианистоводородной кислоты и др. [c.160]
Ранее мы рассмотрели производство рада продуктов (этилбензола, стирола), получаемых последовательно алкилированием и дегидрированием на базе бензола и олефинов (в частности, этилена и пропилена). Вместе с тем для получения этих и других ценных продуктов основного органического синтеза (крезол, бензол) могут быть использованы доступные исходные вещества (толуол, метан и кислород), подвергающиеся окислительному метилированию. [c.525]
Исходные вещества — простые углеводороды метан, этилен, пропилен, бутилен, ацетилен, бензол, толуол и другие, являющиеся основным сырьем органического синтеза, получаются при химической переработке газообразных, жидких и твердых видов топлива. Раньше основным источником сырья органического синтеза была смола коксования и полукоксования. Широко использовалось сырье растительного и животного происхождения. В последние годы преобладающее значение приобрели жидкие углеводороды нефти, природный и попутный газы, а также газы нефтепереработки. В настоящее время многие из перечисленных исходных веществ выпускаются десятками и сотнями тысяч тонн. [c.494]
Продукты эти большей частью вырабатываются в значительных количествах (отсюда и название — тяжелый органический синтез), и для их получения используются чаще всего непрерывные процессы с применением катализаторов нередко реакции протекают при высокой температуре, а иногда и при высоком давлении. В качестве сырья в основном органическом синтезе используют простые по строению веп .ества, преимущественно газы. Это углеводороды жирного ряда парафины (метан и его гомологи), олефины (этилен, пропилен, бутилены) и ацетилен, а также окислы углерода (окись и двуокись), водород, водяной пар. В меньших количествах применяются также ароматические углеводороды и их производные. Все эти вещества получают переработкой нефти, ископаемых углей, природного газа они содержатся в природном и попутном нефтяном га.зе (парафины), газах нефтепереработки (парафины и олефины) и в коксовом газе (этилен, пропилен, метан, водород). Двуокись углерода обычно выделяют из различных газов — отходов других производств. [c.254]
Первые синтезы органических веществ удалось провести немецкому химику Ф. Вёлеру. В 1824 г. он наблюдал образование щавелевой кислоты из дициана, а в 1828 г.— образование мочевины из цианата аммония. Были разработаны методы для элементного анализа органических соединений Ж- Дюма разработал метод количественного определения азота, а Ю. Либих — метод определения углерода и водорода в органических соединениях. В середине XIX в. быстро расцвел органический синтез. В 1845 г. Г. Кольбе синтезировал уксусную кислоту, в 50-е годы М. Бертло из простых неорганических веществ синтезировал муравьиную кислоту, этиловый спирт, ацетилен, бензол, метан, а из глицерина и жирных кислот получил жиры. [c.10]
Кроме газов нефтепереработки, в распоряжении химиков имеются громадные, практически неисчерпаемые запасы природных газов. Основная составная часть их — метан, называемый также болотным или рудничным газом. Метан химически неактивен и поэтому применение его для органического синтеза — одна из труднейших задач. Однако и эта задача в большей мере уже разрешена. Метан может быть превращен в реакционноспособные вещества, например, в ацетилен, формальдегид и др. Ацетилен — узловое вещество в промышленности органического синтеза. Его можно сравнить с большой узловой станцией, от которой идут пути к пластическим массам и синтетическим волокнам, каучукам и взрывчатым веществам, красителям и лекарственным препаратам. [c.127]
Ряд других удачных синтезов органических веществ Дал1.ше rpo П л виталистические воззрения. Вертело удалось получить сингегпческим путем глицериды и жиры (в 1853 г.), а три года спустя (в 1856 г.) метан из сероуглерода и сероводорода. А. М. Бутлеров (в то время профессор Казанского угшверситета), действуя на полимер муравьиного альдегида известковой водой, получил смесь различных сахаров (в 1861 г.). [c.6]
Активно микробиологический синтез метана происходит в бедных кислородом донных отложениях, богатых органическим веществом. Источником метана являются также газогидраты (клатраты) — снегоподобные структуры, в которых метан включен в кристаллическую решетку воды. В 1м содержится до 170 м метана. Газогидраты устойчивы при низких температурах и высоких давлениях. Поэтому они встречаются в почвах вечной мерзлоты и на глубинах 500 м. [c.29]
Нефть и все другие горючие полезные ископаемые, так же как рассеянное органическое вещество осадочных пород, генетически связаны с живым веществом нашей планеты, с биосферой прошлых геологических эпох. Проблема происхождения нефти, нижний возрастной предел ее образования тесно связаны с возрастом возникновения жизни на Земле. Согласно наиболее распространенной гипотезе. Земля возникла 4,8-5 млрд лет назад в результате слипания первичного вешества холодных тел — плане-тозималей, затем произошел ее разогрев вследствие повышенной теплогенерации. Источники энергии — радиоактивный распад, импактные воздействия, ультрафиолетовое излучение, сейсмичность, приливные возмущения и др. В результате произошла дифференциация вещества первичной Земли и сформировались ядро, мантия и земная кора, близкая по составу к современной. Дифференциация вещества вызвала выделение газов и формирование первичных океанов и атмосферы. Первичная атмосфера отличалась от современной. Она имела восстановительный характер, в ее составе были гелий и вОдород, которые быстро улетучились, метан, пары воды, аммиак, СО, СО2. Свободный кислород отсутствовал. За счет высокой активности этих веществ, очевидно, образовывались полимеры, содержащие С, К, О и другие биофильные элементы, т.е. первые органические вещества возникали путем абиогенного синтеза. [c.104]
Кизельгур, применяемый как носитель катализатора в синтезах на основе СО, должен содержать менее 1% Fe (в противном случае образуется метан) менее 0,4о Al Og (иначе происходит значительное гелеобразование) и менее 1% органических веществ, которые могут быть разрушены прокаливанием при 600—700°. Для получения катализатора растворы o(N03)2, образовавшиеся при растворении металлического кобальта или отработанного катализатора, а также Th(N03)4 и Mg(N03)2, осаждаются в горячем состоянии содой. Затем добавляо кизельгур, фильтруют и промывает на фильтрпрессе или барабанном фильтре, продавливают образовавшуюся массу на специальном прессе, получая маленькие ко тбаски , и сушат их в полочной сушилке с вращающимися лапами. Далее рассевают массу для выделения грубозернистого, так называемого зеленого зерна. При 390—410° производится восстановление катализатора циркулирующим водородом высокой чистоты (не содержащим HjS и СО). При восстановлении выделяется большое количество воды, которую необходимо выводить из процесса. Для этого используют очень экономичный способ, широко применяемый для тонкой очистки газов. Сначала вымораживанием в холодильнике Линде прп —12° выделяют большую часть воды (содержание ее снижается с 20 до 3,5 г м ), затем газ досушивают силикагелем, доводя содержание воды в нем до 0,1 г/л . [c.154]
Ряд интересных вопросов привел нас к исследованию пентана в адсорбированном состоянии. Первым из них является рассмотрение возможности образования углеводородов нефти в результате облучения некоторых органических веществ. Ранние наблюдения Линда и Бардуэлла [4] показали, что при облучении органических соединений образуются углеводороды, подобные по своему составу имеющимся в нефти. Вычисления Белла, Гудмэна и Уайтхеда [5] и дальнейшие опыты [6, 7] показывают, что жидкие и газообразные углеводороды могут образоваться путем облз чения сложных органических веществ в нефтеносных осадках. Во всех этих исследованиях полученное отношение водорода к метану, образующемуся при облучении органическмх соединений в объеме, очень велико, в то время как газы нефти содержат фактически много метана и мало водорода. В связи с этим мы пытаемся выяснить влияние диспергирования на минеральных поверхностях органического соединения на отношение количеств водорода и метана. Другим доводом в пользу постановки этого исследования было предположение о том, что если распределение органического соединения на минеральном порошке вносило бы существенные изменения в продукты радиолиза, то это исследование могло бы открыть новые пути к практическому химическому синтезу. Более отдаленным соображением было желание пролить свет на основные процессы, заключающиеся в переносе энергии от твердой поверхности к жидкости. [c.135]
Наиболее употребительные органические соединения сохраняют исторически сложившиеся тривиальные названия, указывающие ибо на происхождение данного вещества (молочная кислота, масляная кислота, мочевина и т. д.), либо на его свойства (эфир, антифебрин, скатол и т. д.). С развитием органического синтеза количество органических соединений стало возрастать с такой быстротой, что, пользуясь прежней системой обозначения, оказалось чрезвычайно трудным придумывать тысячи различных новых названий. Решение было найдено в заместительной, или так называемой рациональной, номенклатуре (PH). Эта номенклатура рассматривает химические соединения к к производные более простых и хорошо известных соединений — прототипов, в которых один или несколько атомов водорода замещены радикалами (остатками углеводородов), другими элементами или функциональными группами (—ОН, —Nh3, —ТМОг и т. д.). В качестве прототипов используются, например, метан, этилен, ацетилен, метиловый спирт, уксусная кислота и другие простейшие соединения. Рациональная номенклатура, очень удобная для обозначения сравнительно простых соединений, теряет свои преимущества при переходе к более сложным соединениям. В связи с этим возникла потребность в создании новой, универсальной международной номенклатуры (МН). [c.36]
Ацетилен является в настоящее время одним из важнейших сырьевых веществ в промышленности органического синтеза. Наиболее выгодно получать ацетилен из углеводородных газов (электрокрекинг метана и другие способы). При производстве ацетилена путем переработки углеводородных газов его концентрация в получающихся газообразных продуктах (водород, углеводороды и др.) относительно невелика. В то же время ацетилен в отличие от предельных углеводородов хорошо растворяется в воде. Он растворяется в воде примерно в 30 раз лучше, чем метан. Ацетилен очень хорошо растворяется также в диметилформамиде, ацетоне, метаноле, бутирол-актоне и других растворителях. Эти свойства ацетилена и используются сейчас для его выделения из газовых смесей. [c.62]
Мы описали бактерий, окисляющих метан, вместе с остальными хемоавтотрофными видами потому, что использование ими метана похоже на использование сероводорода, серы, тиосульфатов или аммиака истинными автотрофными бактериями. Многие другие предположительно гетеротрофные бактерии могут жить на одном химически чистом органическом субстрате. Вполне возможно, что они также используют органический субстрат исключительно или главным образом как источник водорода и энергии, но свое клеточное вещество строят за стет восстановления двуокиси углерода. Однако обмен веществ большинства этих бактерий еще не полностью изучен, и поэтому мы не можем утверждать, что они не используют по меньшей мере части органического субстрата на прямую гетеротрофную ассимиляцию. Так, на примере пурпурных бактерий АМогко аееае) известно, что синтез углеводов посредством восстановления двуокиси углерода часто может сочетаться с гетеротрофной ассимиляцией части восстановителя. [c.126]
chem21.info
Химия -> Предельные углеводороды -> Метан. Получение метана
Метан — газ без цвета и запаха, легче воздуха, малорастворим в воде. Предельные углеводороды способны гореть, образуя оксид углерода и воду. Метан горит бледным синеватым пламенем:CH4+2O2=2H2O. В смеси с воздухом (или с кислородом, особенно в соотношении по объему 1:2, что видно из уравнения реакции) метан образует взрывчатые смеси. По этому он опасен как в быту (утечка газа через краны), так и в шахтах. При неполном сгорании метана образуется сажа. Так ее получают в промышленных условиях. В присутствии катализаторов при окислении метана получают метиловый спирт и формальделу. При сильном нагревании метан распадается по уравнению:CH4=C+2H2. Впечах специальной конструкции распад метана может быть осуществлен до промежуточного продукта — ацителена: 2CH4=C2H2+3H2. Для метана характерны реакции замещения. На свету или обычной температуре галогены — хлор и бром — постепенно (по стадиям) вытесняют из молекулы метана водород, образуя так называемые галогенопроизводные. Атомы хлора замещают атомы водорода в ней с образованием смесиразличных соединений:CH3Cl — хлорметана (хлористого метила), CH2Cl2 — дихлорметана, CCl4 — тетрахлорметана. Из этой смеси каждое соединение может быть выделено. Важное значение имеют хлороформ и тетрахлорметан как растворители смол, жиров, каучука и других органических веществ. Образование галогенопроизводных метана протекают по цепному свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы:Cl2=2Cl. Неорганический радикал Cl отрывает от молекулы метана атом водорода с одним электроном, образуя HCl и свободный радикал CH3HH. Свободный радикал взаимодействует с молекулой хлора Cl2, образуя галогенопроизводное и релоген хлора. Метан при обычной температуре обладает большой стойкостью к кислотам, щелочам и многим окислителям. Однако он вступает в реакцию с азотной кислотой: CH4+HNO3=CH3NO2+H2O. Метан не спосопен к реакциям присоединения, поскольку в его молекуле все валентности насыщены. Приведенные реакции замещения сопровождаются разрывом связей C-H. Однако известны процессы, при которых происходит не только расщепление связей C-H, но и разрыв цепи углеродных атомов(у гомологов метана). Эти реакции протекают при высоких температурах и в присутствии катализаторов. Например: C4H10+H2 — процесс дегидротации, C4H10= C2H6+ C2H4 — крекинг.
Получение метана
Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных(90-98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Метан выделяется со дна болот и из каменоугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха, поэтому метан часто называют болотным газом или рудничным газом. В лабораторных условиях метан получают при нагревании смесси ацетата натрия с гидроксидом натрия:CH3COONa+NaOH=Na2CO3+CH4 или при взаимодействии карбида алюминия с водой: Al4C3+12H2O=4Al(OH)3+3CH4. В последнем случае метан получается весьма чистым. Метан может быть получен из простых веществ при нагревании в присутствии катализатора: C+2H2=CH4. А также синтезом на основе водяного газа: CO+3H2=CH4+H2O. Гомологи метана, как и метан, в лабораторных условиях получают прокаливанием солей соответствующих органических кислот с щелочами. Другой способ — реакция Вюрца, т.е. нагревание моногалогенопроизводных с металлическим натрием, например: C2H5Br+2Na+BrC2H5=C4H10+2NaBr. В технике для получения синтетического бензина(смесь углеводородов, содержащих 6-10 атомов углерода) применяют синтез из оксида углерода и водорода в присутствии катализатора(соединение кобальта) и при повышенном давлении. Процесс можно выразить уравнением: nCO+(2n-1)H2=CnH2n+2+nH2O.
Применение алканов
Благодаря большой теплотворной способности метан в больших количествах расходуется в качестве топлива (в быту — бытовой газ) и в промышленности широко применяются получаемые из него вещества: водород, ацителен служит исходным сырьем для получения формальдегида, метилового спирта, а также различных синтетических продуктов. Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20-25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей. Жидкие углеводороды используются как горючее(они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
chemical-site.narod.ru
