Урок «Растворимые и нерастворимые в воде вещества»
Разделы: Биология, Коррекционная педагогика
Цель: узнать опытным путем, какие твердые вещества растворяются в воде, а какие не растворяются в воде.
Задачи:
Образовательные:
- Ознакомить обучающихся с понятиями: растворимые и нерастворимые вещества.
- Учить доказывать опытным путем правильность предположений о растворимости (нерастворимости) твердых веществ.
Коррекционные:
Воспитательные:
Вид урока: лабораторная работа.
Средства обучения: учебник “Естествознание” Н.В. Королева, Е.В. Макаревич
Оборудование для лабораторной работы: мензурки, фильтры, инструкции. Твердые вещества: соль, сахар, сода, песок, кофе, крахмал, земля, мел, глина.
Ход урока
I. Организационный момент
У: Здравствуйте, ребята. Поприветствуйте друг друга глазами. Рада вас видеть, присаживайтесь.
II
. Повторение пройденногоУ: Повторим то, что уже знаем о воде:
– что происходит с водой при нагревании?
– что происходит с водой при охлаждении?
– что происходит с водой при замерзании?
– в каких трех состояниях встречается вода в природе?
У: Какие вы молодцы! Все знаете!
III. Изучение нового материала
(Заранее с учениками согласую группы, которыми они будут работать, ребята сами выбирают руководителя лаборатории (на др. лабораторном занятии может быть выбран другой ребенок), который записывает показатели опыта в таблицу и дает устные комментарии при заполнении конечной части таблицы – результата.)
У: Ребята, сегодня на лабораторной работе мы узнаем, какие вещества вода может растворять, а какие – нет. Откройте тетрадь, запишите число и тему урока «Растворимые и нерастворимые в воде вещества». (Прикрепляю к доске.) Какую цель мы сегодня поставим на уроке?
Р: Узнать какие вещества растворяются в воде, а какие не растворяются. (Прикрепляю к доске.)
У: Все вещества в природе можно разделить на две группы: растворимые и нерастворимые. А какие вещества можно назвать растворимыми? (Сверимся с учебником стр.80:2) Растворимые в воде вещества – такие, которые при помещении их в воду становятся невидимыми и не оседают на фильтре при фильтрации. (Прикрепляю к доске.)
У: А какие вещества можно назвать нерастворимыми? (сверимся с учебником стр.47-2)
У: Ребята, как думаете, что нам понадобится для выполнения лабораторной работы?
Р: Вода, какие-то вещества, мензурки, фильтр (показываю воду в графине; мензурки, наполненные сл. веществами: солью, сахаром, содой, песком, кофе, крахмалом, мелом, глиной; пустые мензурки, фильтр).
У: Что такое фильтр?
Р: Устройство для очищения жидкостей от нерастворимых в ней веществ, которые оседают на нем.
У: А из каких подручных средств можно изготовить фильтр? Молодцы! А мы будем использовать вату (в воронку помещаю кусочек ваты).
У: Но прежде, чем приступить к выполнению лабораторной работы заполним таблицу (таблица начерчена на доске, использую мелки двух цветов, если ученики предполагают, что вещество полностью растворяется в воде, то отмечаю «+» во второй колонке; если ученики предполагают, что вещество останется на фильтре , то «+» в третьей колонке, и наоборот; цветным мелком фиксирую предполагаемый результат в четвертой колонке – Р (растворимое) или Н (нерастворимое))
| Наши предположения | Результат | ||
| Растворимость | Фильтрация | ||
| 1. Вода + песок | – | Н | |
| 2. Вода + глина | |||
| 3. Вода + кофе | |||
| 4. Вода + крахмал | |||
| 5. Вода + сода | |||
| 6. Вода + земля | |||
| 7. Вода + сахар | |||
| 8. Вода + мел | |||
У: А после выполнения лабораторной работы сверим наши предположения с полученными результатами.
У: Каждая лаборатория будет исследовать два твердых вещества, все результаты будете записывать в отчет «Растворимые и нерастворимые в воде вещества». Приложение 1
У: Ребята, это первая ваша самостоятельная лабораторная работа и перед тем, как вы приступите к ее выполнению, послушайте порядок ее проведения или инструкцию. (
Приложение 2
Лабораторная работа
(Помогаю если есть необходимость. Может возникнуть трудность с фильтрацией раствора кофе, т.к. фильтр окрасится. Для облегчения заполнения отчетов предлагаю использовать словосочетания, которые прикрепляю на доску. Приложение 3.)
У: А сейчас проверим наши предположения. Руководители лабораторий, проверьте, подписан ли ваш отчет и прокомментируйте полученные опытным путем результаты. (Начальник лаборатории отчитывается, фиксирую полученный результат мелком другого цвета)
У: Ребята, какие вещества для исследования оказались растворимыми? Какие нет? Сколько совпадений оказалось? Молодцы. Практически все наши предположения подтвердились.
VI. Вопросы для закрепления
У: Ребята, а где человек использует раствор соли, сахара, соды, песка, кофе, крахмала, глины?
VII. Итог урока
У: Какую цель мы сегодня ставили? Выполнили ее? Мы молодцы? Я вами очень довольна! И ставлю всем «отлично».
VIII. Домашнее задание
У: Прочитаете текст для внеклассного чтения на стр.43, ответите на вопросы.
Встаньте, пожалуйста, те ребята, кому наш урок не понравился. Спасибо за честность. А теперь те, кому понравилась наша работа. Спасибо. Всем до свидания.
xn--i1abbnckbmcl9fb.xn--p1ai
Малорастворимые и практически нерастворимые вещества
МАЛОРАСТВОРИМЫЕ И ПРАКТИЧЕСКИ НЕРАСТВОРИМЫЕ ВЕЩЕСТВА [c.79] По растворимости твердые вещества условно делят на легкорастворим) е, труднорастворимые (или малорастворимые) и практически нерастворимые. Если в 100 г воды при 20° С растворяется более
Процесс растворения твердых веществ в воде. Насыщенные, ненасыщенные и пересыщенные растворы. Растворимость веществ. Хорошо растворимые, малорастворимые и практически нерастворимые вещества. Разбавленные и концентрированные растворы. [c.54]
В некоторых случаях при действии соляной кислоты возможно образование растворимых комплексных ионов, например [РеСи] . Ниже приведены вещества, практически нерастворимые в соляной кислоте (в скобках — вещества малорастворимые в ней). [c.19]
Объем требований. Растворы. Общие представления о растворимости в воде газов, жидкостей и твердых веществ. Примеры веществ, практически нерастворимых, малорастворимых и хорошо растворимых. Тепловые явления при растворении. Зависимость растворимости газов и твердых веществ от температуры. Способы выражения концентрации растворов (процентная, молярная, нормальная). [c.104]
Растворимость. Каждое вещество при данной температуре характеризуется определенной растворимостью в воде и других растворителях (спирт, бензол, сероуглерод и др.). Б воде могут растворяться твердые вещества (сахар, поваренная соль), жидкости (спирт) и газообразные вещества (аммиак, хлористый водород). По способности растворяться в воде вещества делят на 1) хорошо растворимые (едкий натр, сахар), 2) малорастворимые (гипс, бертолетова соль) и 3) практически нерастворимые (сульфид меди). Практически нерастворимые вещества часто называют нерастворимыми, хотя абсолютно нерастворимых веществ нет. Нерастворимыми обычно называют такие вещества, растворимость которых чрезвычайно мала (1 вес. ч. вещества растворяется в 10 ООО частей растворителя). [c.19]
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым если растворяется менее 1 г вещества малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Большинство солей щелочных металлов хорошо растворимы в воде (исключение некоторые соли линя). Хлориды, бромиды, нитраты щелочноземельных металлов также хорошо растворяются в воде. Сульфаты, карбонаты, фосфаты этих металлов — малораствориМые или практически нерастворимые в воде вещества. [c.288]
Часто малорастворимые и практически нерастворимые вещества объединяют одним названием — малорастворимые. Тогда говорят только о растворимых и малорастворимых веществах. [c.117]
Твердые вещества характеризуются самой различной раство-римостью. Наряду с хорошо растворимыми веществами существуют малорастворимые и практически нерастворимые (в воде). Однако абсолютно нерастворимых веществ в природе нет. Любое вещество, хотя бы в ничтожной степени, но все же обладает растворимостью. Рассмотрим равновесие между твердым осадком труднорастворимой соли Ag l и ее ионами в водном растворе [c.270]
Часто малорастворимые и практически нерастворимые вещества объединяют одним названием — малорастворимые. Тогда говорят только о растворимых и малорастворимых веществах. Количественно растворимость выражается концентрацией насыщенного раствора. Чаще всего ее выражают максимальным числом граммов вещества, которое можно растворить в 100 г растворителя при данной температуре. Это количество называется коэффициентом растворимости или просто растворимостью вещества. Так, например, при 18°С в 100 г воды растворяется 51,7 г соли РЬ (МОз)г (т. е. растворимость этой соли при 18°С равна 51,7). Если сверх этого количества при той же температуре еще добавить нитрата свинца, то соль растворяться не будет, она будет выпадать в виде осадка. [c.111]
Методы осаждения должны удовлетворять ряду условий. Вещество, выделяемое в осадок, должно быть практически нерастворимым (малорастворимым). Осадок должен выпадать быстро и полно, без образования пересыщенных растворов. Адсорбция и соосаждение не должны искажать результатов титрования. Необходимо точно устанавливать конечную точку титрования, практически совпадающую с точкой эквивалентности. Эти требования ограничивают применимость реакции осаждения в титриметрическом анализе. [c.423]
Примечание. Р — растворимое вещество, М — малорастворимое, Н — практически нерастворимое черта означает, что вещества не существует или оно разлагается водой. [c.308]
По растворимости твердые вещества условно делят на легкорастворимые, труднорастворимые (или малорастворимые) и практически нерастворимые. Если в 100 г воды при 20 °С растворяется более 10 г вещества, то такое вещество считается легкорастворимым. Если при тех же условиях растворяется 0,01 — 1 г, то такое вещество считается трудно- [c.98]
Условные обозначения Р — растворимое вещество, М — малорастворимое,. Н — практически нерастворимое- черта означает, что [c.303]
Стекло, серебро, золото — это практически нерастворимые в воде вещества (твердые вещества). К ним также относят керосин, растительное масло (жидкие вещества), инертные газы (газообразные вещества). Малорастворимые в воде вещества — это, например, гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества). Многие вещества в воде растворяются весьма хорошо, например сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества). [c.142]
Свойства. Соли, за небольшим исключением, являются твердыми кристаллическими веществами. По растворимости в воде их можно разделить на растворимые, малорастворимые и практически нерастворимые. [c.132]
По величине растворимости в данном растворителе (например, в воде) вещества делят на хорошо растворимые (растворяется более 1 г в 100 г растворителя), малорастворимые (примерно от 0,01 до 1 г в 100 г растворителя) и практически нерастворимые (растворимость менее 0,01 г на 100 г растворителя). Конечно, такое деление очень условно, однако оно [c.84]
По растворимости в воде все вещества делятся на три группы 1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые. Последние часто называют нерастворимыми веществами. Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или палочку из золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов. [c.105]
Стекло, серебро, золото — это примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также отнести керосин, растительное масло (жидкие вещества), инертные газы (газообразные вещества). Примерами малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), серный эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества). [c.105]
Примечание. Условные обозначения буква р означает растворимое в воде соединение (более I г в 100 г воды) м — малорастворимое (от 0,01 г в 100 г воды) н — практически нерастворимое (менее 0,01 г в ЮОг воды) черта в клетке означает, что данное соединение существует, но не может быть получено с помощью реакций обмена в водных растворах знак х указывает, что вещество не существует t —вещество выделяется в виде газа или распадается с образованием газа знак ) —растворимость вещества значительно повышается в горячей воде. [c.457]
Известно, что вещества условно можно разделить на растворимые, малорастворимые и практически нерастворимые. Растворимость первых составляет примерно 1 г вещества в 100 мл растворителя (воды) или приблизительно 0,1 М по катиону, а последних — меиее 0,1 г вещества в 100 мл растворителя или примерно 0,01 М по катиону. Вещества, занимающие промежуточное положение между ними, называют малорастворимыми. (В химической и экологической литературе нередко используют термин труднорастворимые соединения , включая в него как практически нерастворимые, так и малорастворимые вещества.) [c.127]
Более полные (количественные) сведения о растворимости твердых веществ в воде (растворимых, малорастворимых) и о составе кристаллогидратов, образующихся из водного раствора, см. в разд. 5.2. Растворимость практически нерастворимых в воде веществ может быть оценена по данным разд. 4.5. О растворимости жидких и газообразных веществ в воде см. разд. 5.3. [c.8]
Из определения ионитов (см. стр. 7) следует, что онп должны быть практически нерастворимыми в рабочих средах. Степень растворимости их должна быть во много раз меньшей, чем у самых малорастворимых мономерных органических или неорганических веществ, так как иониты должны длительно находиться в растворителях. [c.60]
Растворимость твердых веществ всегда ограничена. Взятое количество жидкости способно растворить только определенное количество твердого вещества. По растворимости в воде твердые вещества делятся на растворимые (хлористый натрий, сахароза и т. д.), малорастворимые (хлористый свинец, гидроокись кальция и т. д.) и практически нерастворимые (сернокислый барий, углекислый кальций и т. д.). [c.64]
Ферроцианид-ион, или гексацианоферрат (П)-ион, является анионом железистосинеродистоводородной кислоты Н4[Ре(СМ)б]. Эта сильная кислота представляет собой кристаллическое вещество белого цвета, легкорастворимое в воде и спирте. В твердом состоянии она устойчива, в присутствии же влаги постепенно синеет вследствие окисления с образованием берлинской лазури. Соли рассматриваемой кислоты — ферроцианиды — более устойчивы. Из них растворимы в воде лишь соли щелочных и щелочноземельных металлов . Реакция их растворов близка к нейтральной. Большинство остальных ферроцианидов малорастворимо или практически нерастворимо в воде и в холодных разбавленных кислотах. Ион [Ре(СМ)б] » имеет зеленовато-желтую окраску. [c.520]
В соответствии со значениями растворимости различают вещества хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой растворителя (например, бромид калия КВг-это хорошо растворимое вещество, его растворимость равна 65,2 г/100 г Н2О), малорастворимые, масса которых в насыщенном растворе значительно меньше, чем масса растворителя (например, сульфат кальщ1я Са804 -малорастворимое вещество, так как его растворимость составляет всего 0,206 г/100 г воды при 20 С), и практически нерастворимые, масса которых в насыщенном растворе [c.56]
Поскольку мерой растворимости вещества при данных условиях служит концентрация его насыщенног о раствора, численно растворимость может быть выражена теми же способами, что и концентрация, например, процентным отношением массы растворенною всщсства к массе насыщенного раствора или числом молей растворенного вещества, содержащегося в I л насыщенного раствора. Часто раст воримость выражают также числом единиц массы исходного вещества, насыщающего приданных условиях 100 единиц массы растворителя. Выраженную этим способом растворимость называют коэффициентом растворимжти. Растворимость различных веществ в воде и органических растворителях изменяется в широких пределах. Если в 100 I растворителя растворяется болсс 10 г вещества, то такое вещество принято называть хорошо растворимым ссли растворяется менее I г вещества — малорастворимым, и, наконец, практически нерастворимым считается вещество, если в раствор переходит менее 0,01 г вегцсства. [c.238]
Оксиды. Марганец образует большой набор оксидов МпО, МП3О4, Мп Оз, МпО , МП2О7. Все оксиды, кроме Мп Оу, представляют собой кристаллические соединения, практически нерастворимые в воде. В целом оксиды марганца похожи на оксиды хрома, и мы не будем останавливаться на них подробно, но отметим некоторые свойства высших оксидов. Два высших оксида МпО и МП2О7 обладают сильными окислительными свойствами. Диоксид марганца — устойчивое малорастворимое вещество темно-бурого цвета — часто используется в лабораторной практике как сильный окислитель, например, для получения хлора при взаимодействии с соляной кислотой [c.351]
Непосредственное выделение из анализируемого продукта определяемого вещества или его составных частей в химически чистом состоянии представляет во многих случаях очень трудную, а порой и неосуществимую задачу. Поэтому очень часто определяемое вещество выделяют в осадок в виде соединения оп 1еделенного состава. Для этого взвешенное количество (навеску) анализируемого вещества переводят в раствор, к полученному раствору прибавляют соответствующий реактив, реагирующий с одним из компонентов анализируемой смеси с образованием малорастворимого соединения. При этом определяемая составная часть анализируемого вещества (катионы или анионы) выделяется из раствора в виде практически нерастворимого осадка. Выделившийся осадок отделяют от раствора фильтрованием или центрифугированием, промывают с целью удаления всех растворимых в данном растворителе примесей, высушивают или прокаливают до постоянной массы и взвешивают на аналитических весах. [c.265]
Л/-(нафтил-1)фталаминовая кислота (26) (аланап — Ыа-соль) — белое кристаллическое вещество, т. пл. 203 °С. Практически нерастворима в воде, малорастворима в большинстве органических растворителей. В воде хорошо растворяется натриевая соль кислоты. ЛДбо 8500 мг/кг. При нагревании отщепляют молекулу воды и превращается в Л -(нафтил-1)фталн- [c.212]
Вещество считается растворяющимся в данном растворителе, если взаимодействие между ним и растворителем характеризуется только разрушением кристаллической решетки (для твердых веществ), сольватацией (гидратацией), элегстролитической диссоциацией и протолизом. Все растворяющиеся (в данном растворителе при 20 °С) вещества разделены на три группы растворимые (они образуют >0,1М растворы), малорастворимые (О, 0,001м растворы) и практически нерастворимые ([c.7]
Большинство растворов образованы ограниченно растворимыми Веш,ествами, т. е. такими, для которых процесс растворения заканчивается насыщением или образованием раствора строго определенной при данных условиях концентрации. В таких случаях принято говорить о растворимости, оценивая ее как высокую, большую (или легкую), умеренную (среднюю), малую, низкую (или трудную). Например, характеризуя растворимость сахара в воде, называют его легкорастворимым, а такое вещество, как гипс aS04-2h30, растворимость которого составляет 0,2 г в 100 г воды, называют малорастворимым. Так как абсолютно нерастворимых веществ в природе нет, то обычно вещества с очень малой растворимостью называют практически нерастворимыми. Для практически нерастворимых и малорастворимых солей удобной характеристикой их растворимости является произведение растворимости (стр. 119). [c.100]
chem21.info
Высокодисперсные системы (истинные растворы)
Истинные растворы характеризуются полной гомогенностью и благодаря небольшой разнице между размерами молекул растворенного вещества и растворителя, а также отсутствию пограничных поверхностей раздела между ними представляют собой однофазные дисперсные системы.
Для истинных растворов характерна большая прочность связи между растворенным веществом и растворителем. Растворенное вещество в дальнейшем не отделяется от раствора и, находясь под непрерывным воздействием теплового движения, остается равномерно распределенным в жидкости. Раствор сохраняет гомогенность неопределенно долгое время, если только в нем не происходит никаких самопроизвольных вторичных процессов, изменяющих химическую природу (состав) растворенного вещества (гидролиз, окисление, действие света и т. п.). В дальнейшем будем рассматривать только истинные растворы.
-
Концентрация, способы ее выражения
Растворимость веществ.
По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые. Последние называют также нерастворимыми веществами. Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Стекло, металлы, некоторые соли — это примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также отнести керосин, растительное масло (жидкие вещества), благородные газы (газообразные вещества).
Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества).
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость, прежде всего, зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют растворимостью (7.3.1.) этого вещества, или коэффициентом растворимости(7.3.2.):
(7.3.1),(7.3.2).
Понятие растворимости бессмысленно для полностью растворимых веществ друг в друге (этиловый спирт – вода).
Зависимость растворимости веществ от температуры и природы растворителя. Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления. Еще в середине прошлого тысячелетия опытным путем было установлено правило, согласно которому подобное растворяется в подобном. Так, вещества с ионным (соли, щелочи) или ковалентно-полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, в первую очередь в воде. И наоборот, растворимость кислорода в бензоле, например, на порядок выше, чем в воде, так как молекулы О2 и С6Н6 неполярны.
Для подавляющего большинства твердых тел растворимость увеличивается с повышением температуры.
Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы соли, то образуется пересыщенный раствор. Пересыщенным называют раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор неустойчив, и при изменении условий (при встряхивании или внесении в раствор затравки для кристаллизации) выпадает осадок, над которым остается насыщенный раствор.
В отличие от твердых тел растворимость газов в воде с повышением температуры уменьшается, что обусловлено непрочностью связи между молекулами растворенного вещества и растворителя. Другой важной закономерностью, описывающей растворимость газов в жидкостях, является закон Генри: Растворимость газа прямо пропорциональна его давлению над жидкостью.
studfiles.net
Вещества нерастворимые в воде — Справочник химика 21
Оказалось, что между защитными веществами (желатин, казеинат натрия, альбумины и пр.) существуют качественные различия. Например, золотое число гемоглобина в 6 раз больше, чем у желатина, а рубиновое число, наоборот, меньше в три раза. Таким образом, ни золотое, ни рубиновое, ни другое число не может служить полной характеристикой стабилизатора, так как защитное действие последнего на тот или иной золь специфично. Защитное действие белков, полисахаридов и некоторых других веществ используется при изготовлении и применении высокодисперсных препаратов на основе лекарственных веществ, нерастворимых в воде. Золи в неполярных средах можно защищать от коагуляции, добавляя к дисперсионной среде мыла поливалентных металлов (нафтенат алюминия, стеарат кальция [c.115]Физические и химические свойства. Предельные углеводороды— бесцветные вещества, нерастворимые в воде. В обычных условиях они химически неактивны. При комнатной температуре не окисляются, не реагируют с концентрированной сер [c.296]
Вещества, нерастворимые в воде, [c.64]
Физические свойства некоторых полигалогенопроизводных приведены в табл. 7. Дигалогенопроизводные предельных углеводородов представляют собой тяжелые масла или твердые кристаллические вещества, нерастворимые в воде, но растворимые во многих органических растворителях. [c.98]
Вещества, нерастворимые в воде, не более. . 1,5 2 3 [c.66]
Диоксид титана ТЮз — белое тугоплавкое вещество, нерастворимое в воде и разбавленных кислотах. Это — амфотерный оксид, но как основные, так и кислотные свойства выражены у него слабо. [c.650]
Смолистые вещества, нерастворимые в воде, со стенок химической посуды хорошо удаляются концентрированной серной кислотой или концентрированным до 40 % водным раствором едкого натра или едкого кали. Смолы в большей части растворяются в кислоте или в щелочи. Отмываемый реакционный сосуд заполняют на /4 объема щелочью и слегка встряхивают. Продолжительность удаления смолистых отложений со стенок загрязненных сосудов зависит от особенностей смолы и колеблется в пределах [c.43]
Сернокислый натрий (десятиводный), не менее. Хлористый натри , не более Вещества, нерастворимые в воде, не более. . Гигроскопичная влага, не более. …… [c.64]
Кремнезем 5102 принципиально отличается по свойствам от аналогичного ему по составу углекислого газа СО2. Кремнезем — твердое, очень тугоплавкое кристаллическое вещество, нерастворимое в воде и не вступающее с ней во взаимодействие. Причина столь резкого различия в свойствах СО2 и 5102 заключается в том, что кремний не образует с кислородом молекулы 51 02. Если бы такие молекулы существовали, им следовало бы приписать аналогичную СО2 структурную формулу 0 = 51 = 0, где л-связи должны быть образованы за счет р-орбиталей кремния и кислорода, как и у СО2. Однако вследствие того что радиус кремния больше радиуса углерода, кремний я-связей образовывать не может не только друг с другом, но и с атомами других элементов. Поэтому в ЗЮг кремний связан с кислородом только а-связями за счет перекрывания своих 5р -гибридных орбиталей с р-орбиталями кислорода. Значит, кремнезем имеет пространственную атомную решетку, в которой каждый атом кремния окружен четырьмя атомами кислорода, расположенными вокруг кремния под тетраэдрическими углами. Координационное число крем- [c.250]
По химическим свойствам сульфиды нейтральные вещества, нерастворимые в воде, щелочи и не реагирующие с щелочью. [c.121]
Второй тип эмульсий образуется в присутствии поверхностноактивных веществ, нерастворимых в воде, но растворяющихся или легко диспергирующихся в масле, [c.70]
Кипение гетероазеотропа происходит при более низкой температуре, чем температуры кипения каждого компонента. Это понижение температуры кипения лежит в основе перегонки с паром, которая часто используется для дистилляции органических веществ с высокой температурой кипения и разлагающихся при нагревании. Если возможно, используют водяной пар, вводя его прямо в перегоняемое вещество, к которому добавлена вода. Тогда дистилляция происходит при температуре ниже 100° С. В приемнике конденсат расслаивается на воду и отогнанную жидкость (практически чистую, если вещество нерастворимо в воде, или азеотроп, как в рассмотренном выше случае). Далее органический слой отделяется и высушивается. Весовые количества воды и органического вещества в приемнике пропорциональны [c.193]
При перегонке высококипящих веществ, нерастворимых в воде, с водяным паром температура кипения смеси должна быть ниже температуры кипения воды при данном давлении. Таким образом, прн давлении, равном 1 атм, температура перегонки будет ниже 100° [c.481]
Отмеренное количество испытуемого раствора встряхивают с амальгамой в узкой склянке или цилиндре с хорошо пригнанной пробкой. После восстановления вливают в склянку 10—30 мл четыреххлористого углерода. Это вещество нерастворимо в воде и имеет удельный вес 1,6. Таким образом, слой четыреххлористого углерода разделяет амальгаму и водный слой. После этого, при осторожном перемешивании, титруют испытуемый раствор. [c.396]
Эта реакция более универсальна, чем реакция с бромом. Скорость ее зависит от растворимости вещества в воде. Если вещество нерастворимо в воде, реакцию ведут в ацетоне. Однако КМпОд окисляет вещества и других классов, например первичные и вторичные спирты, альдегиды, тиоспирты, ароматические амины, фенолы и др. [c.250]
Наиболее подходящие растворители (если вещество нерастворимо в воде) — чистые пиридин и ацетон. [c.111]
Наиболее распространены эмульсии, в которых роль дисперсионной среды играет вода, а роль дисперсной фазы — жиры, минеральные масла, толуол и т. д. Все эти вещества, нерастворимые в воде, условно называют одним термином масло и обозначают буквой М. Воду обозначают буквой В. Название дисперсной фазы записывают в числителе дроби, а дисперсионной среды — в знаменателе. Так, молоко, представляющее собой эмульсию масла в воде, обозначают символом [c.448]
Типичные органические вещества характеризуются определенными свойствами, отличающими их от типичных неорганических веществ. Большинство органических веществ — жидкости илн низкоплавкие твердые вещества, нерастворимые в воде. Органические соединения разрушаются при высоких температурах, многие нз них постепенно окисляются на воздухе, изменяются под действием света. В общем можно сказать, что типичные органические вещества менее прочны, чем типичные неорганические. Конечно, все сказанное о свойствах верно только в общих чертах, нередки и исключения. Так, например, пероксид водорода разлагается уже прн небольшом нагревании, а органическое соединение—нафталин — устойчиво даже при температуре красного каления. [c.219]
V. Эмульгирующие вещества, нерастворимые в воде [c.63]
Многие вещества, нерастворимые в чистой воде, в почвенной жидкости растворяются, иногда даже в значительных количествах. Это происходит потому, что почвенная жидкость в большинстве случаев обладает кислотным характером. В то же время известно, что многие вещества, нерастворимые в воде, растворяются в кислотах. Корни растений своими выделениями также принимают активное участие в растворении многих минеральных веществ почвы, нерастворимых в чистой воде. [c.168]
Карбонилы металлов представляют собой летучие жидкие или твердые вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических растворителях. Все они весьма ядовиты, а при нагревании легко распадаются на соответствующий металл и окись углерода.8 — [c.496]
Следовательно, ионные реакции, сопровождающиеся образованием осадков (труднорастворимых веществ), газов (легколетучих веществ), слабых электролитов (плохо диссоциирующих соединений), проходят до конца. При составлении уравнений ионных реакций вещества, нерастворимые в воде, а также вещества, не диссоциирующие или слабо диссоциирующие, записывают в молекулярной форме, а все остальные — в ионной форме. Например, [c.109]
FeO представляет собой черное кристаллическое вещество, нерастворимое в воде и щелочах. При действии кислот образуются соответствующие соли [c.262]
Тонкослойные хроматограммы. Приготавливают смесь носителя и осадителя или окислителя (восстановителя). Смесь тщательно перемешивают и наносят на пластинку. Смесь наносят в сухом виде или, если вещества нерастворимы в воде, в виде суспензии. [c.258]
Молекулярная масса природной клетчатки порядка миллиона. Это значит, что соединены в одну цепь десятки тысяч остатков глюкозы. Свойства клетчатки легко представить себе, вспомнив о вате, которая представляет собой почти чистую клетчатку. Это волокнистое вещество, нерастворимое в воде. [c.316]
Ослабление кислотных признаков проявляется также в ряду суль-ф и д о в ЭгЗд. Желтый AS2S3, оранжевый 5Ь25з и черно-бурый Bi- Sa — твердые вещества, нерастворимые в воде. [c.384]
А1аОз твердые неорганические вещества, нерастворимые в воде и находящиеся во взвешенном состоянии (суспензии и механические примеси). [c.8]
Перегонка в токе водяного пара дает возможность перегонять высоко-кнпящие вещества, нерастворимые в воде (например, анилин, скипидар и пр.), при ниэкнх температурах. При атмосферном давлении перегонка в токе водяного пара осуществляется при температурах ниже 100° С. [c.712]
Перегонку с водяным наром применяют для выделения из смесей высококипящих веществ, нерастворимых в воде (анилин, пидар и др.). При этом выделяемое вещество отгоняется в виде азеотропной смеси с водой, температура кипения которой ниже температуры кипения каждого мз компомеатов (стр. 666). Таким образом, температура кипения смеси всегда будет ниже 100 С и может быть еще более понижена при ведеиам перегонки в вакууме. [c.708]
Для ванадия характерны окснды УО — светло-серый, V2O3 — черный, УОа — сине-черный. Это кристаллические вещества, нерастворимые в воде. С ростом степени окисления ванадия основные оксиды УО и V2O3 сменяются амфотерным VO2 н КИСЛОТНЫМ V2O5. Амфотерные свойства УО2 проявляются в реакциях с кислотами с образованием оксосолей, например [c.372]
Парашины — это белые, воскоподобные вещества, нерастворимые в воде, этиловом спирте ш других полярных растворителях. Они хорошо растворяются в углеводородах, хлороформе, дихлорэтане и амиловом спирте. Они, в основном, представляют собой нормальные парафины С2г - [c.54]
Процесс растворения определен Макбэйном (см. ссылку 64) как непосредственный переход молекул вещества, нерастворимого в воде, в разбавленный водный раствор моющего средства, с одновременным образованием раствора, устойчивого в термодинамическом отношении. Такое определение вполне приемлемо, если исключить из него ограничительное упоминание водных растворов. Поэтому более общим будет следующее определение растворение — это непосредственный переход молекул вещества, нерастворимого в данном растворителе, в разбавленный коллоидный раствор другого вещества в этом растворителе, с одновременным образованием раствора, устойчивого в термодинамическом отношении. [c.65]
Hиtpoбeнзoйнaя кислота желтое кристаллическое вещество, нерастворимое в воде. Хорошо растворимо в органических растворителях df 1,6100. [c.101]
Отвешенную навеску затем переносят в стакан (или в чашку). Для этого стекло с навеской снимают с чашки весов и осторожно наклоняют над стаканом, причем большая часть вещества ссыпается со стекла. Оставшиеся мелкие частички вещества удаляют легким постукиванием о край часового стекла. Последние следы навески смывают в стакан струей воды из нромывалки. Если вещество нерастворимо в воде, то можно пользоваться обыкновенной, небольшого размера кисточкой, концом волосков которой тщательно сметают следы вещества в стакан, не вызывая при этом распыления. Мельчайшие частички, прилипшие к кисточке, удаляют так волоски кисточки сгибают о край стекла и затем сразу отнимают от стекла, при этом волоски быстро распрямляются, и с них слетают приставшие частички. Кисточку нужно сохранять в чистоте. Для этого конец ее деревянной ручки вставляют в отверстие пробки и помещают в чистую сухую пробирку, которую закрывают той же пробкой. [c.143]
Белое вещество, нерастворимое в воде, растворимо в разбавленном растворе аммиака. При добавлеиии к этому раствору NaOH выпадает чернокоричневый осадок. Для какого соединения характерны такие реакции [c.79]
В последние годы широко применяется потенциометрическое титрование в неводных средах. Оно позволяет значительно расширить класс исследуемых органических и неорганических веществ, нерастворимых в воде. Используя различные растворители, удает- [c.264]
С точки зрения критериев, обсуждавшихся в начале данной главы, висмут следует считать скорее металлом, чем неметаллом. Висмут обычно обнаруживает степень окисления + 3 и мало склонен проявлять высшее состояние окисления + 5, столь обычное для фосфора. Наиболее распространенным оксидом висмута является В120з. Это вещество нерастворимо в воде или в основном растворе, но растворяется в кислом растворе. Поэтому его относят к основным ангидридам. Как мы уже знаем, оксиды металлов характеризуются тем, что ведут себя как основные ангидриды. [c.327]
Стекло обычно причисляют к веществам, нерастворимым в воде. Однако при продолжительном действии воды на обычное стекло вода отчасти извлекает из него силикат натрия. Если, например, взболтать истертое в порошок стекло с водой и затем прибавить несколько капель фенолфталеина, то жидкость окрашивается в розовый цвет, обнаруживая щелочную реакцию (вследствие гидролиза Na2Si03). [c.643]
Первые работы, ставшие отправным пунктом в возникновении науки о коллоидах, были проведены в середине XIX в. Одни из наиболее ранних исследований коллоидных систем были выполнены итальянским ученым Ф. Сель-ми (1845). Он изучал системы, представляющие собой хлорид серебра, серу, берлинскую лазурь, распределенные в объеме воды. Известно, что эти вещества нерастворимы в воде и при определенных условиях выпадают в осадок. Однако системы, полученные Сельми, почти прозрачные по внешнему виду, были очень похожи на истинные растворы, к которым относятся, например, растворы хлорида натрия или сульфата меди в воде. Сельми полагал, что ни сера, ни хлорид серебра, ни ряд других веществ не могут находиться в воде в виде таких же мелких частиц, образующихся при растворении хлорида натрия и сульфата меди в воде, т. е. в виде отдельных молекул или ионов. [c.4]
Именно так и нужно записывать процесс восстановления марганца из двуокиси марганца МпОг в элгктропно-ионных уравнениях, так как МпОг представляет собой твердое вещество, нерастворимое в воде, а потому не диссоциирующее в водном растворе. [c.413]
При действии на карбонилы Эг (СО) ю галоидов образуются к а р б о н и л г а л и д ы ГЭ(СО)б (где Г — С1, Вг, I). Они представляют собой довольно устойчивые бесцветные или желтоватые кристаллические вещества, нерастворимые в воде. Их летучесть и растворимость в органических жидкостях возрастают по ряду С1 —Вг —1. Для ВгМп(СО)б и 1Мп(СО)5 были найдены большие значения дипольных моментов — 3,19 и 3,25 (в бензоле). При нагревании галогениды ГЭ(СО)5 отщепляют часть СО и переходят в димерные галокарбонилы (ГЭ(С0)4]г. структура которых отвечает, по-видимому, двум октаэдрам с общим ребром из атомов галоида. В ряду С1—Вг — I такой переход облегчается. Образующиеся бесцветные или желтые вещества плохо растворимы в органических жидкостях. [c.516]
Сравним теперь высшие гомологи обоих рядов, например, с 18 углеродными атомами. Их различия сглажены. Октадекан СкяНда — твердое вещество с температурой плавления 28 °С стеариновая кислота С17Н35СООН тоже твердое вещество, плавится при 69 » С. Оба вещества нерастворимы в воде. Химически стеариновая кислота несравненно менее активна, чем муравьиная. Хотя в принципе все свойства кислот у стеариновой кислоты сохранены, но проявляются они менее резко, соответствующие реакции идут труднее свойства функциональной группы — карбоксила теряются на фоне большого углеводородного остатка. Из сказанного следует общий вывод характерные свойства гомологического ряда (как физические, так и химические) наиболее наглядно проявляются у первых его членов (но не у самого первого ). По мере же роста углеродной цепи происходит, если можно так сказать, опарафини-вание свойств. [c.48]
chem21.info
Нерастворимые в воде вещества». разработка урока
Тема: «Нерастворимые в воде вещества».
Цель: Путем опыта, определить какие вещества не растворяются в воде.
Задачи:
1. Образовательные:
-ознакомить обучающихся с понятием нерастворимые вещества;
-научить доказывать опытным путем правильность предположений о нерастворимости и растворимости твердых веществ.
2. Коррекционно-развивающие:
-научить самостоятельно, пользоваться лабораторным оборудованием, проводить опыты;
-развивать речь через объяснение проводимой работы.
3. Воспитательные:
-воспитывать усидчивость, внимание, воображение;
-формировать умение общаться и работать в парах.
Оборудование: учебник, тетрадь, карандаши, ручка, дневник, химические стаканы, химические колбы, бумажные фильтры, стеклянные палочки, мел, крахмал, вода, химические воронки, пробирки.
Организационный момент(2 мин.)
Мы сегодня будем исследовать и наблюдать,
Выводы делать и рассуждать,
А чтобы урок пошёл каждому впрок,
Активно в работу включайся, дружок
Приветствуют учителя.
Подготовка класса к работе.
Повторение пройденного материала.
(7 мин.)
Ребята скажите, пожалуйста, о каком важном природном веществе мы говорим в течение нескольких последних уроках?
Учащиеся отвечают: вода, почва, воздух.
И так, теперь давайте вспомним что происходит с водой при нагревании?
Какое свойство воды мы с вами проходили на прошлом уроке?
Какие вещества растворяются в воде?
Учащиеся отвечают: Вода расширяется, сжимается.
Растворимость.
Соль, сахар.
Демонстрирует учитель: бумажный фильтр.
Как называется это устройство?
А для чего он нужен?
Учитель говорит определение
Учащиеся отвечают: фильтр
очищает жидкость
Фильтр-устройство для очищения жидкостей от нерастворимых веществ, которые оседают на нём.
Изучение нового материала
(10 мин.)
Откройте свои тетради, запишите сегодняшнюю дату и тему нашего урока. «Нерастворимые вещества в воде»
Учащиеся записывают дату и тему урока в тетрадь и схему веществ.
Нерастворимые в воде вещества – такие, которые не растворяются в воде и оседают на фильтре.
Работа с учебником страницы 43
Записывают определения из учебника нерастворимые вещества в тетрадь.
Прежде чем приступить к лабораторным опытам, вспомним правила техники безопасности:
1. В кабинете должна быть полная тишина?
2. При обращении со стеклянной химической посудой надо быть какими?
3. Порядок на рабочем месте надо соблюдать?
Ученики повторяют правила техники безопасности.
Да
Осторожными
Да, надо
Лабораторная работа.
(10 мин)
При выполнении опытов будем заполнять таблицу
(учитель каждому раздает распечатанную таблицу и объясняет, как делать ее заполнить)
Опыт 1. Взять мел добавить в стакан перемещать, профильтровать.
-Что вы наблюдаете?
Учащиеся повторяют за учителем и записывают в таблицу результаты:
Мел не растворяется в воде. Записывают в тетрадь.
Физкультминутка
(3 мин)
Вы, наверное, устали? Давайте немножко отдохнем!
Упражнение для улучшения мозгового кровообращения.
И.п. — сидя, руки на поясе. 1 — поворот головы направо, 2 — и.п., 3 — поворот головы налево, 4 — и.п., 5 — плавно наклонить голову назад, 6 — и.п., 7 — голову наклонить вперед.
Ребята, продолжаем наш урок, сегодня к нам пришла гостья (представляешь кто), ИО, преподаватель в учебном заведении совторговле, куда вы после окончания школы можете поступить и получить очень хорошую профессию кухонный работник. (ИО препод), тоже хочет поделится с вами интересным опытом. Преподаватель приветствует учащихся, демонстрирует опыт.
Опыт 2 стакане растворить крахмал профильтровать.
Что вы наблюдаете?
Ученики повторяют за учителем.
Проделывают опыт за учителем и записывают в таблицу.
Крахмал не растворяется в воде.
Какие нерастворимые вещества мы сегодня с вами узнали?
Молодцы.
Учащиеся отвечают: мел, крахмал.
Итог урока
(5 мин)
Ребята, а где человек использует мел, крахмал?
Чем мы сегодня занимались на уроке?
Вам понравился урок?
Учащиеся отвечают в быту, в строительстве.
Доказывали, какие вещества нерастворимы в воде.
Ответы учащихся.
Домашнее задание:
(3 мин.)
Прочитать текст на стр.43, ответите на вопросы.
Творческое задание: сделать фильтр, заготовки и инструкцию учитель раздает каждому ученику.
Мы молодцы? Я вами очень довольна!
Записывают в дневники домашнюю работу.
Приложение №1
Таблица «Нерастворимые вещества в воде»
1. В стакан с водой насыпали2. Профильтровали
1
2
2. Вода + с
1. В стакан с водой насыпали
2 Профильтровали
1
2
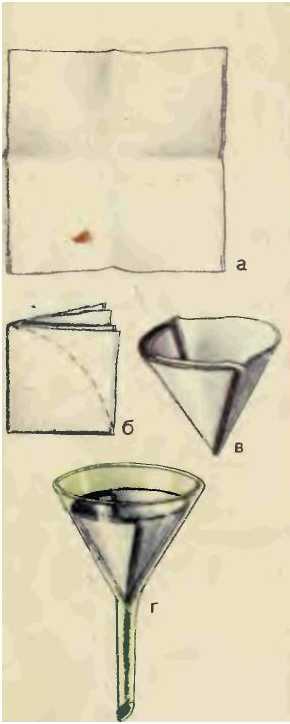
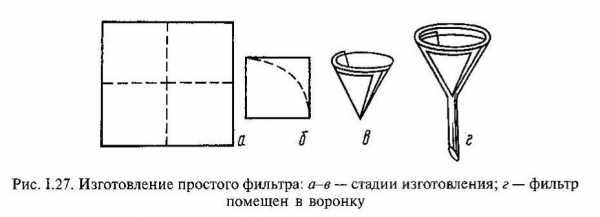
infourok.ru
Вода – растворитель. Растворимые и нерастворимые в воде вещества. Значение воды. Презентация

Познание мира
Тема: ВОДА – растворитель.
Растворимые и нерастворимые в воде вещества.
2 «б» класс
Учитель: Кожумова Г.А.
Чтобы появилась буква, дождаться руки и нажать на прямоугольник.
Чтобы вернуться к следующему вопросу, нужно нажать ещё раз на букву.

Цель: Познакомить со свойством воды – растворимость;
Задачи: 1. совершенствовать знания о воде, о ее значении; 2. показать на опытах, какие вещества растворяются и не растворяются; 3. подвести к выводу о значении воды для живой природы; 4. совершенствовать навыки анализа и обобщения учащимися полученных знаний; 5. воспитание бережного отношения к воде.
6. Умение работать в сотрудничестве;

Ход урока.
- Позитивный настрой на урок
— Как живете?
— Вот так! (Показывают поднятый вверх большой палец)
— А идете?
— Вот так! (Имитируют ходьбу)
— А бежите?
— Вот так! (Имитируют бег на месте)
— Ну, а спите?
— Вот так! (Складывают руки под щекой)
— А за партою в школе сидите?
— Вот так! (Показывают)
— Какой урок нам с вами предстоит изучить?
— Познание мира.
— Я уверена, что все вы будете в группах работать внимательно и думать самостоятельно

Вызов
Актуализация знаний
Тест
1. А) Первая
2. В) Воздушного
3. Б) Атмосфера
4. В) Несколько дней
5. В) Вода в газообразном состоянии
6. А) Без цвета
7. А) Вода в твёрдом состоянии

Критерии оценивания:
«5» — все ответы верны
«4» — 6 — 5 правильных ответов
«3» — 4 — 3 правильных ответов
«2» — 2 — 1 правильных ответов

Осмысление

Отгадай загадку
ВОДА
Я и туча, и туман,
И ручей, и океан,
И летаю, и бегу,
И стеклянной быть могу!
ВОДА

Свойства воды
1. Прозрачна
2. Бесцветна
5. Без формы
4. Вода течёт.
(свойство – текучесть)
3. Без запаха
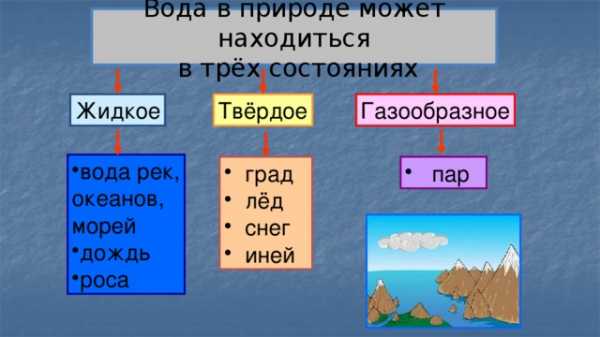
Вода в природе может находиться в трёх состояниях
Жидкое
Газообразное
Твёрдое
океанов,
морей
- град
- лёд
- снег
- иней

Песок
Сахар
Глина
Соль


Физминутка

Мы привыкли, что вода — Наша спутница всегда. Без нее нам не умыться, Не наесться, не напиться. Смею я вам доложить, Без нее нам не прожить.
Составление кластера
Роль воды в природе

Синквейн ВОДА

Люди, берегите воду!

Итог урока.
- Что нового узнали на уроке?
- Может ли человек прожить без воды?
- Назовите свойства воды.

Рефлексия

Домашнее задание:
Учебник:
с. 51 — 53 читать, пересказывать
Написать эссе на тему: «Значение воды»

kopilkaurokov.ru
Вода-растворитель. Растворимые и нерастворимые в воде вещества
Аманбаева Жанар ЖумабековнаАктюбинская область г.Шалкар
Средняя школа №5
Предмет: Начальная школа
Тема: Вода — растворитель. Растворимые и нерастворимые в воде вещетсва.
Задачи урока: дать представление о воде как растворителе, о растворимых и нерастворимых веществах; познакомить с понятием «фильтр», с простейшими способами определения растворимых и нерастворимых веществ; подготовить доклад на тему «Вода – растворитель».
Оборудование и наглядные пособия: учебники, хрестоматии, тетради для самостоятельной работы; наборы: стаканы пустые и с кипяченой водой; коробочки с поваренной солью, сахаром, речным песком, глиной; чайные ложки, воронки, фильтры из бумажных салфеток; гуашь (акварельные краски), кисти и листы для рефлексии; презентация, выполненная в Power Point, мультимедийный проектор, экран.
ХОД УРОКА
I. Организационный момент
У. Всем доброе утро! (Слайд 1)
Приглашаю вас на третье заседание школьного научного клуба «Мы и окружающий мир».
II. Сообщение темы и цели урока
Учитель. Сегодня у нас гости, учителя из других школ, которые пришли на заседание клуба. Предлагаю председателю клуба, Порошиной Анастасии, открыть заседание.
Председатель. Мы сегодня собрались на заседание клуба по теме «Вода – растворитель». Задание всем присутствующим: подготовить доклад на тему «Вода – растворитель». На этом уроке вам вновь предстоит стать исследователями свойств воды. Изучать эти свойства вы будете в своих лабораториях, с помощью «консультантов» – Макаренкова Михаила, Старковой Олеси и Стениной Юлии. Каждая лаборатория должна будет выполнить следующее задание: провести опыты и наблюдения, а в конце заседания обсудить план сообщения «Вода – растворитель».
III. Изучение нового материала
У. С разрешения председателя я хочу сделать первое сообщение. (Слайд 2) Такое же заседание по теме «Вода – растворитель» недавно провели ученики села Мирного. Открыл заседание Костя Погодин, который напомнил всем присутствующим еще об одном удивительном свойстве воды: многие вещества в воде могут распадаться на невидимые мельчайшие частицы, то есть растворяться. Следовательно, для многих веществ вода – хороший растворитель. После этого Маша предложила провести опыты и выявить способы, с помощью которых можно будет получить ответ на вопрос, растворяется вещество в воде или нет.
У. Предлагаю вам на заседании клуба определить растворимость в воде таких веществ, как поваренная соль, сахар, речной песок и глина.
Давайте предположим, какое вещество, по вашему мнению, растворится в воде, а какое не растворится. Выскажите свои предположения, догадки и продолжите высказывание: (Слайд 3)
У. Подумаем вместе, какие гипотезы будем подтверждать. (Слайд 3)
Предположим … (соль растворится в воде)
Допустим … (сахар растворится в воде)
Возможно … (песок не растворится в воде)
Что, если … (глина не растворится в воде)
У. Давайте, и мы проведем опыты, которые помогут нам в этом разобраться. Перед работой председатель напомнит вам правила при проведении опытов и раздаст карточки, на которых эти правила напечатаны. (Слайд 4)
П. Посмотрите на экран, где записаны правила.
«Правила при проведении опытов»
Необходимо бережно относиться ко всем приборам. Их можно не только разбить, ими можно и пораниться.
Во время работы можно не только сидеть, но и стоять.
Опыт проводит один из учеников (докладчик), остальные молча наблюдают или по просьбе докладчика помогают ему.
Обмен мнениями по результатам проведенного опыта начинается только после того, как докладчик разрешает его начать.
Переговариваться друг с другом нужно тихо, не мешая остальным.
Подходить к столу и проводить замену лабораторного оборудования можно только по разрешению председателя.
IV. Практическая работа
У. Предлагаю председателю выбрать «консультанта», который прочитает вслух из учебника порядок действий при проведении первого опыта. (Слайд 5)
1) П. Проведите опыт с поваренной солью. Проверьте, растворяется ли в воде поваренная соль.
«Консультант» из каждой лаборатории берет один из подготовленных наборов, и проводит опыт с поваренной солью. В прозрачный стакан наливает кипяченую воду. Всыпает в воду небольшое количество поваренной соли. Группа наблюдает, что происходит с кристалликами соли, и исследует воду на вкус.
Председатель (как в игре КВН) зачитывает один и тот же вопрос каждой группе, а представители от лабораторий отвечают на них.
П. (Слайд 6) Изменилась ли прозрачность воды? (Прозрачность не изменилась)
Изменился ли цвет воды? (Цвет не изменился)
Изменился ли вкус воды? (Вода стала соленой)
Можно ли сказать, что соль исчезла? (Да, она растворилась, исчезла, ее не видно)
У. Сделайте вывод. (Соль растворилась) (Слайд 6)
П. Прошу всех приступить к выполнению второго опыта, для которого необходимо использовать фильтры.
У. Что такое фильтр? (Прибор, устройство или сооружение для очищения жидкостей, газов от твёрдых частиц, примесей.) (Слайд 7)
У. Прочитайте вслух порядок действий при выполнении опыта с фильтром. (Слайд 8)
Учащиеся пропускают воду с солью через фильтр, наблюдают и исследуют воду на вкус.
П. (Слайд 9) Осталась ли соль на фильтре? (На фильтре пищевая соль не осталась)
Изменился ли вкус воды? (Вкус воды не изменился)
Удалось ли очистить воду от соли? (Пищевая соль прошла с водой через фильтр)
У. Сделайте вывод из своих наблюдений. (Соль растворилась в воде) (Слайд 9)
У. Подтвердилась ли ваша гипотеза?
У. Все правильно! Молодцы!
У. Результаты опыта оформите письменно в Тетради для самостоятельной работы (с. 30). (Слайд 10)
2) П. (Слайд 11) Проделаем такой же опыт еще раз, только вместо соли положим чайную ложку сахарного песка.
«Консультант» из каждой лаборатории берет второй набор и проводит опыт с сахаром. В прозрачный стакан наливает кипяченую воду. Всыпает в воду небольшое количество сахара. Группа наблюдает, что происходит и исследует воду на вкус.
П. (Слайд 12) Изменилась ли прозрачность воды? (Прозрачность воды не изменилась)
Изменился ли цвет воды? (Цвет воды не изменился)
Изменился ли вкус воды? (Вода стала сладкой)
Можно ли сказать, что сахар исчез? (Сахар стал невидимым в воде, вода его растворила)
У. Сделайте вывод. (Сахар растворился) (Слайд 12)
У. Пропустите воду с сахаром через бумажный фильтр. (Слайд 13)
Учащиеся пропускают воду с сахаром через фильтр, наблюдают и исследуют воду на вкус.
П. (Слайд 14) Остался ли сахар на фильтре? (На фильтре сахара не видно)
Изменился ли вкус воды? (Вкус воды не изменился)
Удалось ли очистить воду от сахара? (Воду от сахара очистить не удалось, вместе с водой он прошел через фильтр)
У. Сделайте вывод. (Сахар растворился в воде) (Слайд 14)
У. Подтвердилась ли гипотеза?
У. Верно. Молодцы!
У. Результаты опыта оформите письменно в Тетради для самостоятельной работы. (Слайд 15)
3) П. (Слайд 16) Проверим утверждения и проведем опыт с речным песком.
У. Прочитайте в учебнике порядок действий при проведении опыта.
Проводят опыт с речным песком. Размешивают в стакане с водой чайную ложку речного песка. Дают смеси отстояться. Наблюдают, что происходит с песчинками и водой.
П. (Слайд 17) Изменилась ли прозрачность воды? (Вода стала мутной, грязной)
Изменился ли цвет воды? (Цвет воды изменился)
Исчезли ли песчинки? (Более тяжелые песчинки опускаются на дно, а мелкие плавают в воде, делая ее мутной)
У. Сделайте вывод. (Песок не растворился) (Слайд 17)
У. (Слайд 18) Пропустите содержимое стакана через бумажный фильтр.
Учащиеся пропускают воду с сахаром через фильтр, наблюдают.
П. (Слайд 19) Что проходит через фильтр, а что остается на нем? (Вода проходит через фильтр, а речной песок остался на фильтре и песчинки хорошо видны)
Очистилась ли вода от песка? (Фильтр помогает очистить воду от частиц, которые в ней не растворяются)
У. Сделайте вывод. (Речной песок в воде не растворился) (Слайд 19)
У. Верным ли было ваше предположение о растворимости песка в воде?
У. Отлично! Молодцы!
У. Результаты опыта оформите письменно в Тетради для самостоятельной работы. (Слайд 20)
4) П. (Слайд 21) Проделайте такой же опыт с кусочком глины.
Проводят опыт с глиной. Размешивают в стакане с водой кусочек глины. Дают смеси отстояться. Наблюдают, что происходит с глиной и водой.
П. (Слайд 22) Изменилась ли прозрачность воды? (Вода стала мутной)
Изменился ли цвет воды? (Да)
Исчезли ли частицы глины? (Более тяжелые частицы опускаются на дно, а мелкие плавают в воде, делая ее мутной)
У. Сделайте вывод. (Глина не растворилась в воде) (Слайд 22)
У. (Слайд 23) Пропустите содержимое стакана через бумажный фильтр.
П. (Слайд 24) Что проходит через фильтр, а что остается на нем? (Вода проходит через фильтр, а не растворившиеся частицы остаются на фильтре.)
Очистилась ли вода от глины? (Фильтр помог очистить воду от частиц, которые не растворились в воде)
У. Сделайте вывод. (Глина не растворяется в воде) (Слайд 24)
У. Гипотеза подтвердилась?
У. Молодцы! Все правильно!
У. Прошу одного из членов группы зачитать выводы, записанные в тетради, всем присутствующим.
У. Есть ли у кого — нибудь дополнения, уточнения?
У. Сделаем выводы из опытов. (Слайд 25)
Все ли вещества растворяются в воде? (Соль, сахарный песок растворились в воде, а песок и глина не растворились.)
Всегда ли с помощью фильтра можно выявить, растворяется вещество в воде или нет? (Растворившиеся в воде вещества проходят через фильтр вместе с водой, а не растворившиеся частицы остаются на фильтре)
У. Прочитайте о растворимости веществ в воде в учебнике (с. 87).
У. Сделайте вывод о свойстве воды как растворителя. (Вода – растворитель, но не все вещества в ней растворяются) (Слайд 25)
У. Советую членам клуба прочитать рассказ в хрестоматии «Вода – растворитель» (с. 46). (Слайд 26)
Почему же ученым пока не удалось получить абсолютно чистую воду? (Потому что в воде растворены сотни, а может и тысячи разных веществ)
У. Как люди используют свойство воды растворять некоторые вещества?
(Слайд 27) Безвкусная вода становится сладкой или соленой благодаря сахару или соли, так как вода растворяет и приобретает их вкус. Это свойство человек использует, когда готовит пищу: заваривает чай, варит компот, супы, солит и консервирует овощи, заготавливает варенье.
(Слайд 28) Когда мы моем руки, умываемся или купаемся, когда стираем одежду, то используем жидкую воду и ее свойство – растворителя.
(Слайд 29) В воде также растворяются газы, в частности кислород. Благодаря этому в реках, озерах, морях живут рыбы и другие. Соприкасаясь с воздухом, вода растворяет кислород, углекислый газ и другие газы, которые находятся в нем. Для живых организмов, обитающих в воде, например, рыб, очень важен кислород, растворенный в воде. Он им нужен для дыхания. Если бы кислород не растворялся в воде, то водоемы были бы безжизненными. Зная это, люди не забывают насыщать кислородом воду в аквариуме, где живут рыбки, или прорубают зимой проруби в водоемах для улучшения жизни подо льдом.
(Слайд 30) Когда рисуем акварельными красками или гуашью.
У. Обратите внимание на задание, записанное на доске. (Слайд 31) Предлагаю составить коллективный план выступления на тему «Вода – растворитель». Обсудите его в своих лабораториях.
Заслушивание планов по теме «Вода – растворитель», составленных учащимися.
У. Давайте все вместе сформулируем план выступления. (Слайд 31)
Примерный план выступления по теме «Вода – растворитель»
Введение.
Растворение веществ в воде.
Выводы.
Использование людьми свойства воды растворять некоторые вещества.
Экскурсия в «Выставочный зал». (Слайд 32)
У. При подготовке сообщения вы можете использовать дополнительную литературу, подобранную ребятами, помощниками докладчиков по теме нашего заседания. (Обратить внимание учащихся на выставку книг, интернет – страничек)
V. Итог урока
Какое свойство воды исследовали на заседании клуба? (Свойство воды как растворителя)
К какому выводу мы пришли, исследовав это свойство воды? (Вода – хороший растворитель для некоторых веществ.)
Как вы думаете, трудно быть исследователями?
Что показалось наиболее сложным, интересным?
Пригодятся ли вам знания, приобретенные в ходе исследования этого свойства воды в дальнейшей жизни? (Слайд 33) (Очень важно помнить о том, что вода – растворитель. Вода растворяет соли, среди которых есть как полезные для человека, так и вредные. Поэтому пить воду из источника, если вы не знаете, чист ли он, нельзя. Не зря в народе есть пословица: «Не всякая водица для питья годится».)
VI. Рефлексия
Как мы используем свойство воды растворять некоторые вещества на уроках изобразительного искусства? (Когда рисуем акварельными красками или гуашью)
Предлагаю вам, используя это свойство воды, раскрасить воду в стакане в такой цвет, который наиболее полно соответствует вашему настроению. (Слайд 34)
«Желтый цвет» – радостное, светлое, хорошее настроение.
«Зеленый цвет» – спокойное, уравновешенное.
«Синий цвет» – грустное, печальное, тоскливое настроение.
Покажите свои листы с раскрашенной водой в стакане.
VII. Оценивание
Благодарю председателя, «консультантов» и всех участников заседания за активную работу.
VIII. Домашнее задание
bilimdiler.kz
