Способы выражения концентрации растворов
Сейчас принято говорить о трех видах концентрации: 1) массовой; 2) молярной; 3) молярной концентрации эквивалента.
Массовая доля растворенного вещества (ω) представляет собой отношение массы растворенного вещества к общей массе раствора:
ω
=
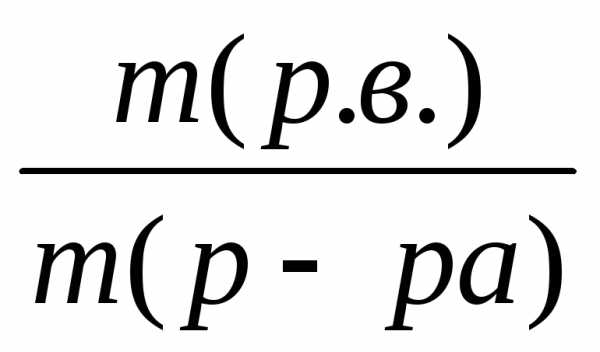 ,
(1)
,
(1)
где m (р.в.) – масса растворенного вещества, г;
m (р-ра) – масса раствора, г.
Массовая доля – величина безразмерная или может быть выражена в процентах.
Число граммов растворенного вещества, содержащего в 100 г раствора, называется
ω
=
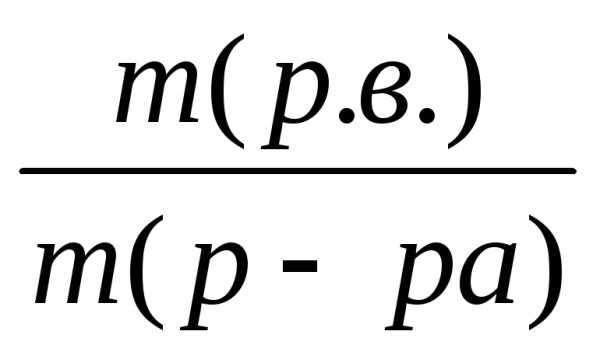 ∙ 100%
(2)
∙ 100%
(2)
Молярная концентрация вещества (С) – это количество растворенного вещества в 1 литре раствора.
С=
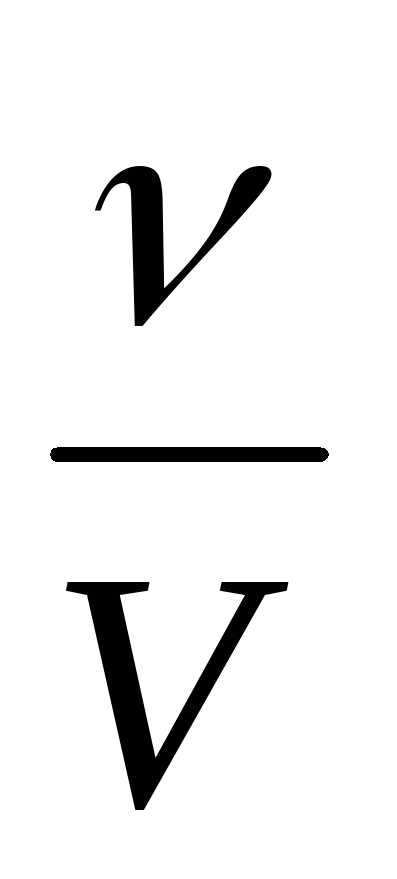 ,
(3)
,
(3)
где
ν — количество растворенного вещества, моль
V — объем раствора, л,
т.к.
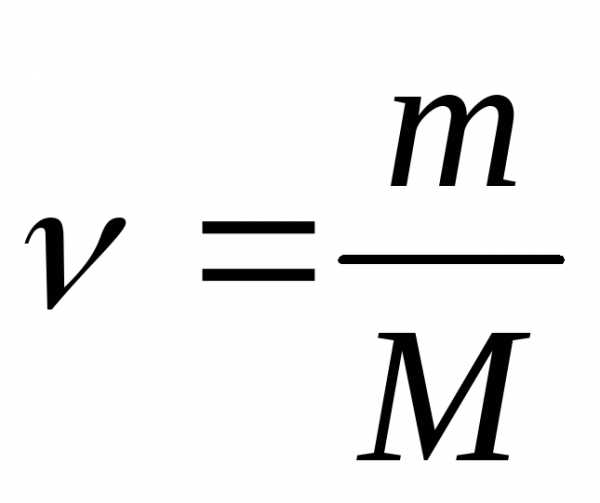 ,
(4)
,
(4)
где m– масса растворённого вещества, г;
М – молярная масса, г/моль, то
С=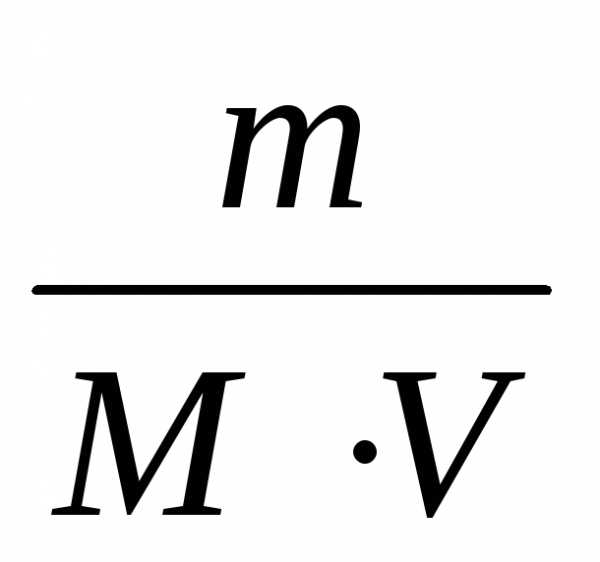 (5)
(5)
Размерность молярной концентрации [моль/л]
Обозначение С=0,1М читается “1/10 молярной массы растворенного вещества в 1 л раствора” и соответствует записи С=0,1 моль/л.
Молярная концентрация эквивалента (Сэ) или (Сн) (нормальная концентрация) — это количество эквивалентов растворенного вещества в 1 л раствора.
Здесь следует напомнить о понятии эквивалента. Эквивалентом называется реальная частица или условная единица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалента одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Единицей количества эквивалента является моль. Масса одного моль эквивалента, выраженная в граммах, называется молярной массой эквивалента. Математическое выражение для расчёта молярной концентрации эквивалента имеет вид:
Сэ
=
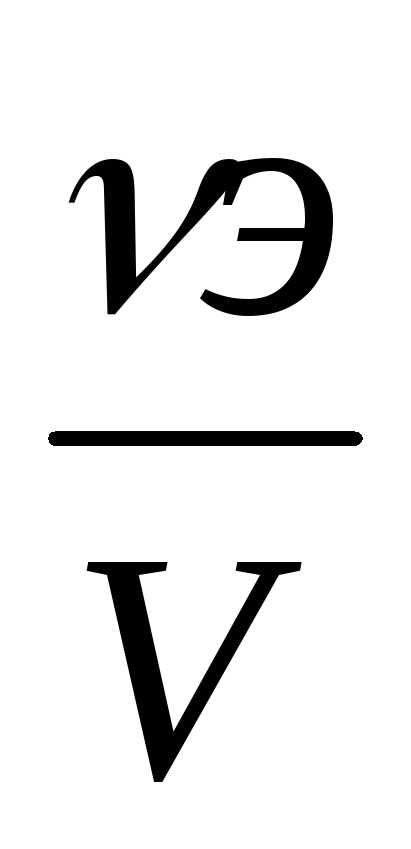 ,
(6)
,
(6)
где νэ — количество эквивалентов растворенного вещества, моль/л,
V — объем раствора, л;
т.к. νэ
=
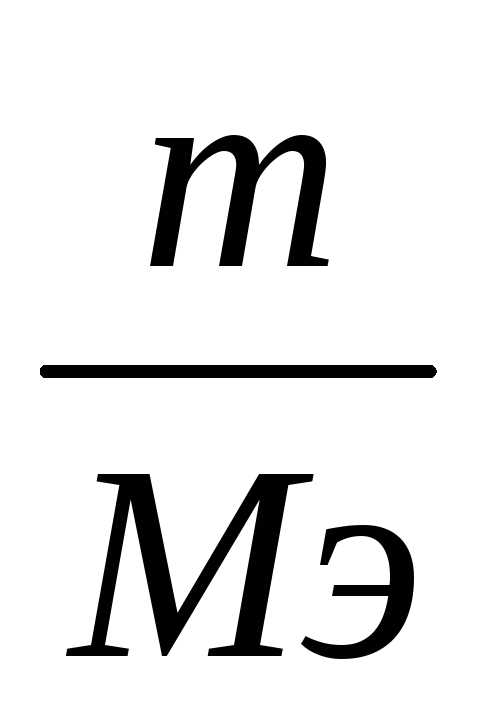
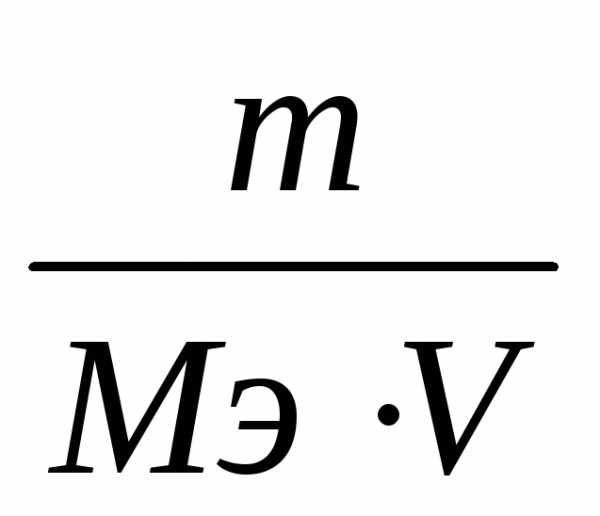 , (7)
, (7)где m– масса растворенного вещества, г;
Мэ – молярная масса эквивалента этого вещества, г/моль.
Размерность молярной концентрации эквивалента [моль/л]
Вместо «моль/л» допускается использование обозначения «Н». Так запись
Сэ (НСl) = 0,1Н читается ”1/10 молярной концентрации эквивалента НСl” и соответствует записи 0,1 моль/л.
Следует помнить, как вычисляются молярные массы эквивалентов сложных веществ:
Молярная масса эквивалента кислоты находится делением молярной массы кислоты на число атомов водорода, участвующих в реакции.
Молярная масса эквивалента основания рассчитывается делением молярной массы основания на число гидроксогрупп, участвующих в данной реакции.
Наряду с выше приведёнными способами численного выражения состава раствора сохраняются и такие способы выражения содержания растворенного вещества в растворе как моляльность раствора и титр раствора.
Моляльная концентрация вещества ( Сm) — это количество растворённого вещества в 1 кг растворителя.
Сm =
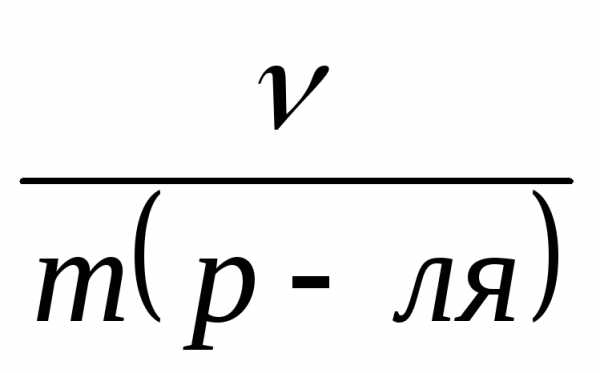 ,
(8)
,
(8)
где ν – количество растворённого вещества, моль;
m(р-ля) − масса растворителя, кг.
или
Сm
=
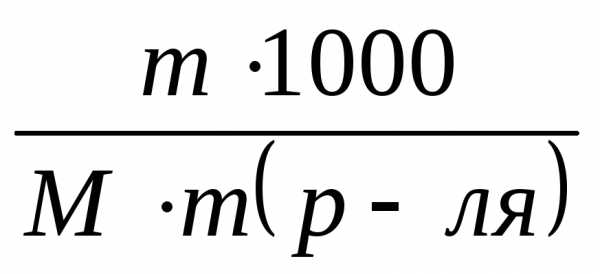 ,
(9)
,
(9)
где m − масса растворённого вещества, г;
М − молярная масса растворённого вещества, г/моль;
m (р-ля) − масса растворителя, г.
Размерность моляльной концентрации [моль/кг].
Обозначение Сm=0,1m читается “1/10 молярной массы растворенного вещества в 1 кг растворителя” и соответствует записи Сm=0,1 моль/кг.
Титром (Т) — называется число граммов растворенного вещества в 1 мл раствора.
Т
=
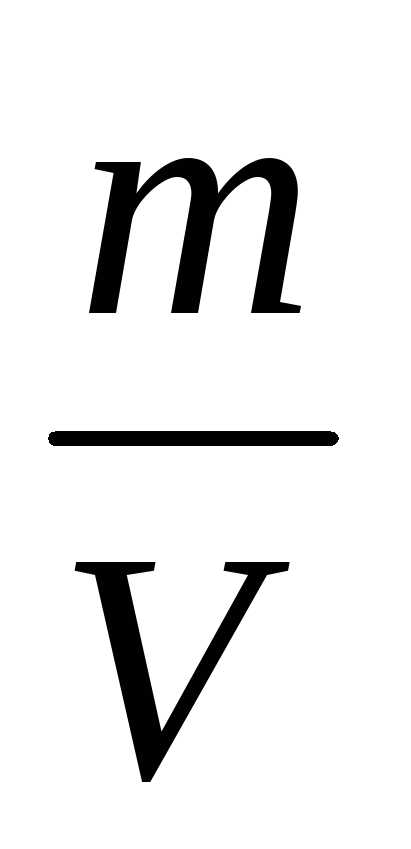 ,
,
где m − масса растворённого вещества, г;
V − объём раствора, мл,
если выразить массу растворенного вещества в 1 л раствора через молярную концентрацию эквивалента (7) m = Сэ ∙ Мэ, то
Т =
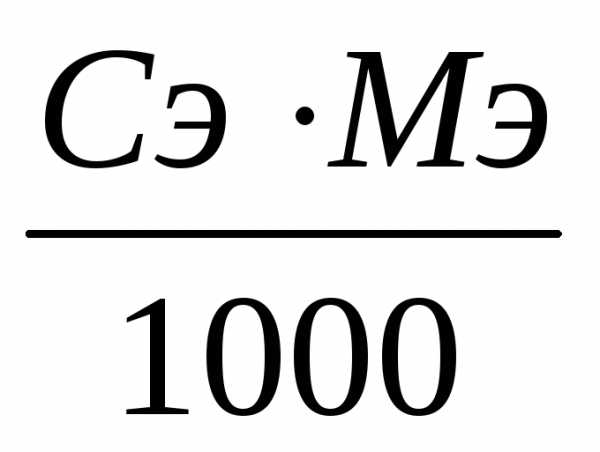 ,
(10)
,
(10)
где Сэ – молярная концентрация эквивалента, моль/л;
Мэ – молярная масса эквивалента вещества, г/моль.
Размерность титра [г/мл] или [г/см3] .
studfiles.net
Моляльность (молярная весовая концентрация)
Моляльность — количество растворённого вещества (число молей) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/ кгназывают0,5-моляльным.,
где:
ν — количество растворённого вещества,моль;
m2— масса растворителя, кг.
Hесмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массурастворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентовданного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л. Для записи концентрации таких растворов используют сокращения «н». Например, раствор содержащий 0,1 моль/л, называют децинормальным и записывают как
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — фактор эквивалентности.
Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Например, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4 (один атом водорода замещаемый в реакции), и двухнормальным в реакции с образованием Na2SO4 (два атома водорода замещаются в реакции).
Пример: Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение: Для вычисления молярности и нормальности надо знать число граммов H2SO 4в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 · 1000 / 61,92 = 1130,49 г H2SO4 Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 11,53· 2 =23,06 н
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
,
где:
m1— масса растворённого вещества, г;
V — общий объём раствора, мл;
В аналитической химииобычно концентрациютитрантапересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
,
где:
νi— количествоi-го компонента, моль;
n — число компонентов;
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя.
studfiles.net
Молярная концентрация растворов. Что такое массовая концентрация раствора? :: SYL.ru
Аналитическая химия, проведение реакций, постановка биотехнологических опытов, исследование влияния лекарственных препаратов на лабораторных животных и многие другие направления научной деятельности требуют определения, расчета, оценки влияния содержания веществ на какой-либо процесс. Концентрация растворов – величина содержания компонента. Существует много способов выражения показателей количества конкретного соединения в системе, и их использование зависит от задач исследователя.
Способы выражения концентраций
Самыми распространенными способами выражения концентрации вещества в системе являются массовая доля и молярность. Первая означает весовое процентное содержание компонента в 100 мл раствора.  В хроматографических методах исследования используются объемные проценты, то есть вместо граммов содержание вещества указывается в миллилитрах. Молярная концентрация раствора также является распространенным приемом расчета. Ее суть заключается в выражении содержания вещества в молях на 1 л. В аналитической химии часто используется такое понятие, как нормальная концентрация. Она обозначает количество эквивалентов вещества, содержащихся в растворе. Например, если в качестве вещества используется серная кислота (H2SO4), то нормальность в данном случае означает двукратное уменьшение молярной концентрации, так как в одной молекуле содержится два атома водорода. В случае соляной кислоты (HCl), оба способа выражения будут равны.
В хроматографических методах исследования используются объемные проценты, то есть вместо граммов содержание вещества указывается в миллилитрах. Молярная концентрация раствора также является распространенным приемом расчета. Ее суть заключается в выражении содержания вещества в молях на 1 л. В аналитической химии часто используется такое понятие, как нормальная концентрация. Она обозначает количество эквивалентов вещества, содержащихся в растворе. Например, если в качестве вещества используется серная кислота (H2SO4), то нормальность в данном случае означает двукратное уменьшение молярной концентрации, так как в одной молекуле содержится два атома водорода. В случае соляной кислоты (HCl), оба способа выражения будут равны.
Подробнее о молярной концентрации
Что означает молярная концентрация раствора, было указано выше. Однако у неспециалиста закономерно появляется вопрос: что означает термин «моль». В данное понятие вкладывается количество вещества, в частности его атомов, молекул, равное таковому, содержащемуся в 12 г углерода, а именно его стабильного изотопа 12С. Количество вещества рассчитывается делением его веса на молекулярную массу, которую можно рассчитать, исходя из атомного состава. В таблице Менделеева по каждому элементу есть показатель его массы, равный 1 молю.
В данное понятие вкладывается количество вещества, в частности его атомов, молекул, равное таковому, содержащемуся в 12 г углерода, а именно его стабильного изотопа 12С. Количество вещества рассчитывается делением его веса на молекулярную массу, которую можно рассчитать, исходя из атомного состава. В таблице Менделеева по каждому элементу есть показатель его массы, равный 1 молю.
Примеры использования молярной концентрации
Концентрация водного раствора кислот, как правило, рассчитывается в молях или эквивалентах. Связано это с их агрессивностью, что требует быстрого переноса вещества в воду, поэтому здесь проще посчитать нужный объем, чем взвешивать. Расчет осуществляется делением массы на моль.
 Другой причиной является применение кислот в реакциях по нейтрализации, которые, например, могут пригодиться в методах титриметрического анализа для определения концентрации щелочи. Здесь также активно используется нормальность. Проще говоря, серной кислоты для нейтрализации гидроксида калия нужно в 2 раза меньше, чем соляной, так как она содержит больше атомов водорода.
Другой причиной является применение кислот в реакциях по нейтрализации, которые, например, могут пригодиться в методах титриметрического анализа для определения концентрации щелочи. Здесь также активно используется нормальность. Проще говоря, серной кислоты для нейтрализации гидроксида калия нужно в 2 раза меньше, чем соляной, так как она содержит больше атомов водорода.
Другая область, где обязательно используется молярная концентрация – получение смесей веществ с определенным соотношением молекул или проведение реакций. Данный способ выражения содержания вещества более информативен, так как взаимодействуют друг с другом именно единицы. При работе с газами молярная концентрация является оптимальным способом расчета, так как летучее вещество взвесить сложно, поэтому расчет происходит по объему.
Массовая концентрация
Массовая концентрация раствора вещества является наиболее распространенным и самым простым способом количественного выражения. Часто она используется практически в лабораториях для взвешивания твердых соединений. Исходя из необходимости пересчет на другие концентрации осуществляется при опубликовании результатов. Объем твердого вещества измерить можно, но получается больше ненужных манипуляций.

Массовая концентрация используется при работе с многокомпонентными системами, например, со сложными природными объектами, водой, растительной массой, почвами. Она применяется при исследовании смеси неизвестного состава, приготовлении микробиологических сред. Определенная навеска смесей веществ, например, берется для исследования методом УФ спектроскопии и других аналитических методов. Такой способ измерения концентрации вещества используется, когда нет необходимости проводить четкую реакцию, для приготовления дезрастворов, при отлаженном способе пересчета, если исследователь определил нужную массу пропорцией.
Значение концентрации ионов
Как было сказано ранее, концентрация ионов в растворе часто рассчитывается с использованием нормальности. Связано это с тем, что когда взаимодействие происходит на уровне молекул, в реакцию вступают именно данные частицы.  Метод необходим также при расчете процесса электролиза солей. Последний достаточно активно применяется в практической деятельности. Например, для извлечения руд тяжелых металлов. С использованием данного метода получают фтор, хлор, очищают металлы. Сущность электролиза заключается в том, что при прохождении постоянного тока через раствор электролита с использованием отрицательного и положительного электрода (катода и анода), анионы и катионы движутся к противоположным зарядам и окисляются (или восстанавливаются).
Метод необходим также при расчете процесса электролиза солей. Последний достаточно активно применяется в практической деятельности. Например, для извлечения руд тяжелых металлов. С использованием данного метода получают фтор, хлор, очищают металлы. Сущность электролиза заключается в том, что при прохождении постоянного тока через раствор электролита с использованием отрицательного и положительного электрода (катода и анода), анионы и катионы движутся к противоположным зарядам и окисляются (или восстанавливаются).
Другие способы выражения концентрации растворов
Концентрация растворов рассчитывается различными методами потому, что в дальнейшем результаты применяются для разных целей. Мольная доля используется, как правило, для смеси газов. Она представляет собой отношение моля вещества к сумме всех других компонентов в системе, также выраженных в данных величинах.
Есть еще один способ расчета концентрации, который используется не так часто: моляльность. Это моль вещества, растворенного в 1 кг растворителя. Концентрация раствора соли или другого компонента в условиях сильного разбавления при расчете молярности и моляльности будут практически равны.
Приготовление растворов, исходя из способа расчета
В зависимости от способа выражения концентрации приготовление растворов может проводиться несколькими способами.
 Взвешивание. Если необходимо приготовить 100 мл смеси, то делается навеска вещества, равная его проценту. При необходимости сделать меньший или больший объем жидкости пересчет осуществляется пропорцией или долями. Например, нужно сделать 50 мл 2% раствора вещества. Для определения количества навески в данном случае достаточно процент разделить на 2 раза, то есть получится 1 г вещества. После взвешивания можно всегда сделать перерасчет на молярную концентрацию.
Взвешивание. Если необходимо приготовить 100 мл смеси, то делается навеска вещества, равная его проценту. При необходимости сделать меньший или больший объем жидкости пересчет осуществляется пропорцией или долями. Например, нужно сделать 50 мл 2% раствора вещества. Для определения количества навески в данном случае достаточно процент разделить на 2 раза, то есть получится 1 г вещества. После взвешивания можно всегда сделать перерасчет на молярную концентрацию.
Измерение объема применяется для приготовления жидких смесей. Пересчитать на объем можно любую концентрацию. В основном таким образом готовят молярные и нормальные растворы.
Заключение
Несмотря на простоту определения и расчета массовой доли, концентрация растворов, выраженная в молярных единицах, удобнее. Исследователи во все времена активно используют способы пересчета. Рассчитывают навеску вещества, а потом раствор выражают в молярной концентрации, объединяя таким образом преимущества двух методов. Почему последний способ расчета является более правильным в научном плане?  Вещества с равными молярными концентрациями содержат одинаковое количество молекул. Именно эта концентрация позволяет четко определить нужный объем вещества для реакции. Массовая доля является скорее вспомогательной, упрощая некоторые процессы. Ее часто применяют микробиологи для получения определенного соотношения бактериальной биомассы со средой. Связано это с тем, что данные ученые исследуют высокомолекулярные соединения, и им удобнее выражать соотношение веществ в массе. Для химиков и физиков молярная концентрация растворов является основной. Числовые характеристики содержания вещества необходимы практически во всех естественных науках.
Вещества с равными молярными концентрациями содержат одинаковое количество молекул. Именно эта концентрация позволяет четко определить нужный объем вещества для реакции. Массовая доля является скорее вспомогательной, упрощая некоторые процессы. Ее часто применяют микробиологи для получения определенного соотношения бактериальной биомассы со средой. Связано это с тем, что данные ученые исследуют высокомолекулярные соединения, и им удобнее выражать соотношение веществ в массе. Для химиков и физиков молярная концентрация растворов является основной. Числовые характеристики содержания вещества необходимы практически во всех естественных науках.
www.syl.ru
Концентрация растворов — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями». Однако на практике для обоих видов выражения состава применяют термин «концентрация» и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Массовая доля
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
- <math>\omega=\frac{m_1}{m}</math>
- <math>\omega(%)=\frac{m_1}{m}\cdot 100\%</math>
где:
- ω — массовая доля растворённого вещества в долях
- ω(%) — массовая доля растворённого вещества в процентах
- m1 — масса растворённого вещества, г;
- m — общая масса раствора (масса растворённого вещества плюс масса растворителя) г.
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
- <math>\upsilon=\frac{V_1}{V}</math>,
где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации <math>{C_M}</math> , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
- <math>{C_M}=\frac{\nu}{V}</math>,
где:
Нормальная концентрация (мольная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
- <math>{C_H}={C_N}=z\cdot{C_M}=z\cdot\frac{\nu}{V}=\frac{1}{f_{eq}}\cdot\frac{\nu}{V}</math>,
где:
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
- <math>X_j=\frac{\nu_j}{\sum_{i=1}^n \nu_i}</math>,
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
- <math>{C_m}=\frac{\nu}{m_2}</math>,
где:
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
- <math>T=\frac{m_1}{V}</math>,
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные (массо-объёмные) проценты
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[1] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[2]
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm — от англ. parts per million). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций растворов к другим
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От массовой доли к молярности:
- <math>C_m=\frac{1000\cdot\rho\omega}{M}</math>,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
- M — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
- <math>{C_n}={C_m}\cdot{z}</math>,
где:
От массовой доли к титру:
- <math>{T}={\rho}\cdot{\omega}</math>,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
От молярности к титру:
- <math>{T}=0.001{C_m}\cdot{M}</math>,
где:
- <math>{C_m}</math> — молярность, моль/л;
- M — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
- <math>m=\frac{0,001\cdot{C_m}}{\rho}</math>,
где:
- <math>{C_m}</math> — молярность, моль/л;
- ρ — плотность раствора, г/мл;
От моляльности к мольной доле:
- <math>X_i=\frac{m_i}{m_i+1000/M}</math>,
где:
- mi — моляльность, моль/1000г;
- M — молярная масса растворителя, г/моль.
Наиболее распространённые единицы
| Эта статья или раздел содержит незавершённый перевод с английского языка. Вы можете помочь проекту, закончив перевод. |
| Измеряемая величина | Запись | Формула | Типичная единица |
|---|---|---|---|
| Атомный процент/Атомная доля (A) | <math>c_{at.}</math> или at.% | <math>\left ( \frac{\rm number~of~atoms~of~dopant \times 100}{\rm number~of~atoms~of~solution} \right )</math> | % |
| Атомный процент (B) | at.% | <math>\left ( \frac{\rm number~of~atoms~of~dopant \times 100}{\rm number~of~substitutable~atoms~of~solution} \right )</math> | % |
| Массовый процент (доля) | <math>w</math> или wt% | <math>\left ( \frac{\mathrm{grams\ solute} \times 100}{\mathrm{grams\ solution}} \right )</math> | % |
| Mass-volume percentage | — | <math>\left ( \frac{\mathrm{grams\ solute} \times 100}{\mathrm{milliliters\ solution}} \right )</math> | % though strictly %г/мл |
| Volume-volume percentage | — | <math>\left ( \frac{\mathrm{milliliters\ solute} \times 100}{\mathrm{milliliters\ solution}} \right )</math> | % |
| Молярность | M | <math>\left ( \frac{\mathrm{moles\ solute}}{\mathrm{liters\ solution}} \right )</math> | моль/л (или M или моль/дм³) |
| Molinity | — | <math>\left ( \frac{\mathrm{moles\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | моль/кг |
| Моляльность | m | <math>\left ( \frac{\mathrm{moles\ solute}}{\mathrm{kilograms\ solvent}} \right )</math> | моль/кг (или m**) |
| Мольная доля | Χ (хи) | <math>\left ( \frac{\mathrm{moles\ solute}}{\mathrm{moles\ solution}} \right )</math> | (decimal) |
| Formal | F | <math>\left ( \frac{\mathrm{moles\ undissolved\ solute}}{\mathrm{liters\ solution}} \right )</math> | моль/л (или F) |
| Нормальность | N | <math>\left ( \frac{\mathrm{gram\ equivalents}}{\mathrm{liters\ solution}} \right )</math> | N |
| Частей на сотню | % (или pph) | <math>\left ( \frac{\mathrm{dekagrams\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | даг/кг |
| Частей на тысячу | ‰ (или ppt*) | <math>\left ( \frac{\mathrm{grams\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | г/кг |
| Частей на миллион | ppm | <math>\left ( \frac{\mathrm{milligrams\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | мг/кг |
| Частей на миллиард | ppb | <math>\left ( \frac{\mathrm{micrograms\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | мкг/кг |
| Частей на триллион | ppt* | <math>\left ( \frac{\mathrm{nanograms\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | нг/кг |
| Частей на квадриллион | ppq | <math>\left ( \frac{\mathrm{picograms\ solute}}{\mathrm{kilograms\ solution}} \right )</math> | пг/кг |
Напишите отзыв о статье «Концентрация растворов»
Примечания
- ↑ [www.medkurs.ru/pharmacy/technology86/section2213/11174.html Способы приготовления растворов на МедКурс. Ru]
- ↑ Бернштейн И. Я., Каминский Ю. Л. Спектрофотометрический анализ в органической химии. — 2-е изд. — Ленинград: Химия, 1986. — с. 5
Отрывок, характеризующий Концентрация растворов
Солдаты французской армии шли убивать русских солдат в Бородинском сражении не вследствие приказания Наполеона, но по собственному желанию. Вся армия: французы, итальянцы, немцы, поляки – голодные, оборванные и измученные походом, – в виду армии, загораживавшей от них Москву, чувствовали, что le vin est tire et qu’il faut le boire. [вино откупорено и надо выпить его.] Ежели бы Наполеон запретил им теперь драться с русскими, они бы его убили и пошли бы драться с русскими, потому что это было им необходимо.Когда они слушали приказ Наполеона, представлявшего им за их увечья и смерть в утешение слова потомства о том, что и они были в битве под Москвою, они кричали «Vive l’Empereur!» точно так же, как они кричали «Vive l’Empereur!» при виде изображения мальчика, протыкающего земной шар палочкой от бильбоке; точно так же, как бы они кричали «Vive l’Empereur!» при всякой бессмыслице, которую бы им сказали. Им ничего больше не оставалось делать, как кричать «Vive l’Empereur!» и идти драться, чтобы найти пищу и отдых победителей в Москве. Стало быть, не вследствие приказания Наполеона они убивали себе подобных.
И не Наполеон распоряжался ходом сраженья, потому что из диспозиции его ничего не было исполнено и во время сражения он не знал про то, что происходило впереди его. Стало быть, и то, каким образом эти люди убивали друг друга, происходило не по воле Наполеона, а шло независимо от него, по воле сотен тысяч людей, участвовавших в общем деле. Наполеону казалось только, что все дело происходило по воле его. И потому вопрос о том, был ли или не был у Наполеона насморк, не имеет для истории большего интереса, чем вопрос о насморке последнего фурштатского солдата.
Тем более 26 го августа насморк Наполеона не имел значения, что показания писателей о том, будто вследствие насморка Наполеона его диспозиция и распоряжения во время сражения были не так хороши, как прежние, – совершенно несправедливы.
Выписанная здесь диспозиция нисколько не была хуже, а даже лучше всех прежних диспозиций, по которым выигрывались сражения. Мнимые распоряжения во время сражения были тоже не хуже прежних, а точно такие же, как и всегда. Но диспозиция и распоряжения эти кажутся только хуже прежних потому, что Бородинское сражение было первое, которого не выиграл Наполеон. Все самые прекрасные и глубокомысленные диспозиции и распоряжения кажутся очень дурными, и каждый ученый военный с значительным видом критикует их, когда сражение по ним не выиграно, и самью плохие диспозиции и распоряжения кажутся очень хорошими, и серьезные люди в целых томах доказывают достоинства плохих распоряжений, когда по ним выиграно сражение.
Диспозиция, составленная Вейротером в Аустерлицком сражении, была образец совершенства в сочинениях этого рода, но ее все таки осудили, осудили за ее совершенство, за слишком большую подробность.
Наполеон в Бородинском сражении исполнял свое дело представителя власти так же хорошо, и еще лучше, чем в других сражениях. Он не сделал ничего вредного для хода сражения; он склонялся на мнения более благоразумные; он не путал, не противоречил сам себе, не испугался и не убежал с поля сражения, а с своим большим тактом и опытом войны спокойно и достойно исполнял свою роль кажущегося начальствованья.
Вернувшись после второй озабоченной поездки по линии, Наполеон сказал:
– Шахматы поставлены, игра начнется завтра.
Велев подать себе пуншу и призвав Боссе, он начал с ним разговор о Париже, о некоторых изменениях, которые он намерен был сделать в maison de l’imperatrice [в придворном штате императрицы], удивляя префекта своею памятливостью ко всем мелким подробностям придворных отношений.
Он интересовался пустяками, шутил о любви к путешествиям Боссе и небрежно болтал так, как это делает знаменитый, уверенный и знающий свое дело оператор, в то время как он засучивает рукава и надевает фартук, а больного привязывают к койке: «Дело все в моих руках и в голове, ясно и определенно. Когда надо будет приступить к делу, я сделаю его, как никто другой, а теперь могу шутить, и чем больше я шучу и спокоен, тем больше вы должны быть уверены, спокойны и удивлены моему гению».
Окончив свой второй стакан пунша, Наполеон пошел отдохнуть пред серьезным делом, которое, как ему казалось, предстояло ему назавтра.
Он так интересовался этим предстоящим ему делом, что не мог спать и, несмотря на усилившийся от вечерней сырости насморк, в три часа ночи, громко сморкаясь, вышел в большое отделение палатки. Он спросил о том, не ушли ли русские? Ему отвечали, что неприятельские огни всё на тех же местах. Он одобрительно кивнул головой.
Дежурный адъютант вошел в палатку.
– Eh bien, Rapp, croyez vous, que nous ferons do bonnes affaires aujourd’hui? [Ну, Рапп, как вы думаете: хороши ли будут нынче наши дела?] – обратился он к нему.
– Sans aucun doute, Sire, [Без всякого сомнения, государь,] – отвечал Рапп.
Наполеон посмотрел на него.
– Vous rappelez vous, Sire, ce que vous m’avez fait l’honneur de dire a Smolensk, – сказал Рапп, – le vin est tire, il faut le boire. [Вы помните ли, сударь, те слова, которые вы изволили сказать мне в Смоленске, вино откупорено, надо его пить.]
Наполеон нахмурился и долго молча сидел, опустив голову на руку.
– Cette pauvre armee, – сказал он вдруг, – elle a bien diminue depuis Smolensk. La fortune est une franche courtisane, Rapp; je le disais toujours, et je commence a l’eprouver. Mais la garde, Rapp, la garde est intacte? [Бедная армия! она очень уменьшилась от Смоленска. Фортуна настоящая распутница, Рапп. Я всегда это говорил и начинаю испытывать. Но гвардия, Рапп, гвардия цела?] – вопросительно сказал он.
– Oui, Sire, [Да, государь.] – отвечал Рапп.
Наполеон взял пастильку, положил ее в рот и посмотрел на часы. Спать ему не хотелось, до утра было еще далеко; а чтобы убить время, распоряжений никаких нельзя уже было делать, потому что все были сделаны и приводились теперь в исполнение.
– A t on distribue les biscuits et le riz aux regiments de la garde? [Роздали ли сухари и рис гвардейцам?] – строго спросил Наполеон.
– Oui, Sire. [Да, государь.]
– Mais le riz? [Но рис?]
Рапп отвечал, что он передал приказанья государя о рисе, но Наполеон недовольно покачал головой, как будто он не верил, чтобы приказание его было исполнено. Слуга вошел с пуншем. Наполеон велел подать другой стакан Раппу и молча отпивал глотки из своего.
– У меня нет ни вкуса, ни обоняния, – сказал он, принюхиваясь к стакану. – Этот насморк надоел мне. Они толкуют про медицину. Какая медицина, когда они не могут вылечить насморка? Корвизар дал мне эти пастильки, но они ничего не помогают. Что они могут лечить? Лечить нельзя. Notre corps est une machine a vivre. Il est organise pour cela, c’est sa nature; laissez y la vie a son aise, qu’elle s’y defende elle meme: elle fera plus que si vous la paralysiez en l’encombrant de remedes. Notre corps est comme une montre parfaite qui doit aller un certain temps; l’horloger n’a pas la faculte de l’ouvrir, il ne peut la manier qu’a tatons et les yeux bandes. Notre corps est une machine a vivre, voila tout. [Наше тело есть машина для жизни. Оно для этого устроено. Оставьте в нем жизнь в покое, пускай она сама защищается, она больше сделает одна, чем когда вы ей будете мешать лекарствами. Наше тело подобно часам, которые должны идти известное время; часовщик не может открыть их и только ощупью и с завязанными глазами может управлять ими. Наше тело есть машина для жизни. Вот и все.] – И как будто вступив на путь определений, definitions, которые любил Наполеон, он неожиданно сделал новое определение. – Вы знаете ли, Рапп, что такое военное искусство? – спросил он. – Искусство быть сильнее неприятеля в известный момент. Voila tout. [Вот и все.]
Рапп ничего не ответил.
– Demainnous allons avoir affaire a Koutouzoff! [Завтра мы будем иметь дело с Кутузовым!] – сказал Наполеон. – Посмотрим! Помните, в Браунау он командовал армией и ни разу в три недели не сел на лошадь, чтобы осмотреть укрепления. Посмотрим!
Он поглядел на часы. Было еще только четыре часа. Спать не хотелось, пунш был допит, и делать все таки было нечего. Он встал, прошелся взад и вперед, надел теплый сюртук и шляпу и вышел из палатки. Ночь была темная и сырая; чуть слышная сырость падала сверху. Костры не ярко горели вблизи, во французской гвардии, и далеко сквозь дым блестели по русской линии. Везде было тихо, и ясно слышались шорох и топот начавшегося уже движения французских войск для занятия позиции.
Наполеон прошелся перед палаткой, посмотрел на огни, прислушался к топоту и, проходя мимо высокого гвардейца в мохнатой шапке, стоявшего часовым у его палатки и, как черный столб, вытянувшегося при появлении императора, остановился против него.
– С которого года в службе? – спросил он с той привычной аффектацией грубой и ласковой воинственности, с которой он всегда обращался с солдатами. Солдат отвечал ему.
– Ah! un des vieux! [А! из стариков!] Получили рис в полк?
– Получили, ваше величество.
Наполеон кивнул головой и отошел от него.
В половине шестого Наполеон верхом ехал к деревне Шевардину.
Начинало светать, небо расчистило, только одна туча лежала на востоке. Покинутые костры догорали в слабом свете утра.
Вправо раздался густой одинокий пушечный выстрел, пронесся и замер среди общей тишины. Прошло несколько минут. Раздался второй, третий выстрел, заколебался воздух; четвертый, пятый раздались близко и торжественно где то справа.
Еще не отзвучали первые выстрелы, как раздались еще другие, еще и еще, сливаясь и перебивая один другой.
Наполеон подъехал со свитой к Шевардинскому редуту и слез с лошади. Игра началась.
Вернувшись от князя Андрея в Горки, Пьер, приказав берейтору приготовить лошадей и рано утром разбудить его, тотчас же заснул за перегородкой, в уголке, который Борис уступил ему.
Когда Пьер совсем очнулся на другое утро, в избе уже никого не было. Стекла дребезжали в маленьких окнах. Берейтор стоял, расталкивая его.
– Ваше сиятельство, ваше сиятельство, ваше сиятельство… – упорно, не глядя на Пьера и, видимо, потеряв надежду разбудить его, раскачивая его за плечо, приговаривал берейтор.
– Что? Началось? Пора? – заговорил Пьер, проснувшись.
– Изволите слышать пальбу, – сказал берейтор, отставной солдат, – уже все господа повышли, сами светлейшие давно проехали.
Пьер поспешно оделся и выбежал на крыльцо. На дворе было ясно, свежо, росисто и весело. Солнце, только что вырвавшись из за тучи, заслонявшей его, брызнуло до половины переломленными тучей лучами через крыши противоположной улицы, на покрытую росой пыль дороги, на стены домов, на окна забора и на лошадей Пьера, стоявших у избы. Гул пушек яснее слышался на дворе. По улице прорысил адъютант с казаком.
– Пора, граф, пора! – прокричал адъютант.
Приказав вести за собой лошадь, Пьер пошел по улице к кургану, с которого он вчера смотрел на поле сражения. На кургане этом была толпа военных, и слышался французский говор штабных, и виднелась седая голова Кутузова с его белой с красным околышем фуражкой и седым затылком, утонувшим в плечи. Кутузов смотрел в трубу вперед по большой дороге.
Войдя по ступенькам входа на курган, Пьер взглянул впереди себя и замер от восхищенья перед красотою зрелища. Это была та же панорама, которою он любовался вчера с этого кургана; но теперь вся эта местность была покрыта войсками и дымами выстрелов, и косые лучи яркого солнца, поднимавшегося сзади, левее Пьера, кидали на нее в чистом утреннем воздухе пронизывающий с золотым и розовым оттенком свет и темные, длинные тени. Дальние леса, заканчивающие панораму, точно высеченные из какого то драгоценного желто зеленого камня, виднелись своей изогнутой чертой вершин на горизонте, и между ними за Валуевым прорезывалась большая Смоленская дорога, вся покрытая войсками. Ближе блестели золотые поля и перелески. Везде – спереди, справа и слева – виднелись войска. Все это было оживленно, величественно и неожиданно; но то, что более всего поразило Пьера, – это был вид самого поля сражения, Бородина и лощины над Колочею по обеим сторонам ее.
wiki-org.ru
