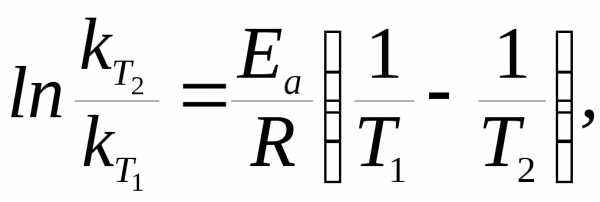Скорость
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КУРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Блок 3 занятие 2
Химических реакций
Методические указания к лабораторной работе
По дисциплине »Химия» для студентов
КУРСК 2003
Составитель В.С. Аксенов
УДК 543
Рецензент
Доктор химических наук, профессор Ф.Ф. Ниязи
Скорость химических реакций: Методические указания к лабораторной работе по дисциплине »Химия» / Курск. гос. техн. ун-т; Сост. В.С.Аксенов. Курск, 2003. 20 с.
Излагаются методические материалы по изучению темы »Скорость химических реакций», расчету скоростей в химических реакциях и выполнению лабораторной работы.
Предназначены для студентов всех специальностей, изучающих общую химию
Табл. 2. Ил. 2.
Текст печатается в авторской редакции
ИД № 06430 от 10.12.01.
Подписано в печать . Формат 60х84 1/16. Печать офсетная. Усл.печ.л. 1,16. Уч.-изд.л. 1,05. Тираж 50 экз. Заказ
Курский государственный технический университет.
Издательско-полиграфический центр Курского государственного технического университета. 305040 Курск, ул. 50 лет Октября, 94.
Контрольные вопросы по теме
1. Что такое скорость химической реакции? В каких единицах она измеряется?
2. Что такое истинная и средняя скорость реакции?
3. Что такое кинетическое уравнение реакции (закон действующих масс)?
4. Как записывается кинетическое уравнение для гомогенной реакции?
5. Каковы особенности гетерогенные реакций?
6. Что такое кинетический, диффузионный и смешанный контроль в гетерогенных реакциях?
7. Какие существуют формы записи для кинетических уравнений гетерогенных реакций?
8. Что такое константа скорости реакции? Какие условия проведения реакции влияют, а какие не влияют на величину константы скорости?
9. Как рассчитать изменение скорости реакции при повышении (понижении) концентрации газообразного или растворенного вещества?
10. Когда влияет давление на скорость химической реакции?
11. Как рассчитать изменение скорости реакции при повышении (понижении) давления в системе?
12. Как влияет температура на скорость химической реакции? Приведите уравнение Вант-Гоффа.
13. Что такое температурный коэффициент реакции?
14. Что такое катализ? На какие параметры процесса действует катализатор?
Скорость химических реакций.
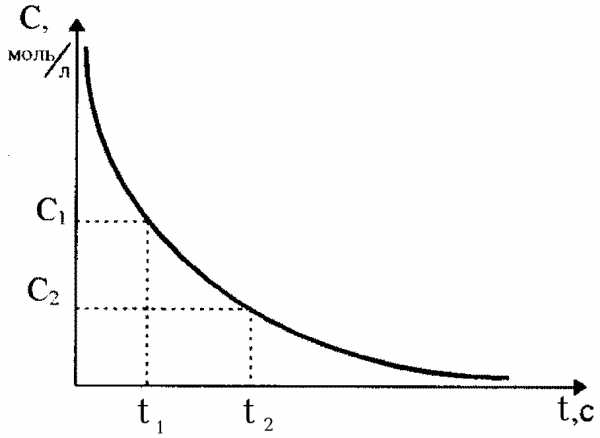
Кинетика ― учение о скорости различных процессов, в том числе химических реакций. Одним из основных понятий в химической кинетике является скорость реакции.
Скоростью химической реакции V называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
В гомогенной системе реакционным пространством служит объем сосуда, в котором протекает взаимодействие, а количество вещества в единице объёма называется концентрация С и выражается в моль/л.
Поэтому с случае гомогенного процесса, протекающего при постоянном объёме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени.
О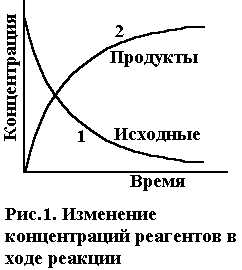 бычно
время τ выражается в сек, поэтому
размерность скорости реакции как
правило,
моль/л·сек.
При химическом взаимодействии концентрация
каждого из исходных веществ уменьшается
во времени
(С2<С1,
ΔС<0), а
концентрация каждого из продуктов
реакции возрастает (С2>С1,
ΔС>0).
Изменение
концентраций исходных веществ и продуктов
реакции во времени приведено на рис.1.
В химической кинетике различают среднюю
и истинную (или мгновенную) скорость
реакции. Средняя скорость v
равна отношению ΔС/Δτ
(ΔС = С2-С1,
Δτ = τ2-τ1).
Чтобы величина скорости была всегда
положительной, перед дробью ставят
знаки »±».
бычно
время τ выражается в сек, поэтому
размерность скорости реакции как
правило,
моль/л·сек.
При химическом взаимодействии концентрация
каждого из исходных веществ уменьшается
во времени
(С2<С1,
ΔС<0), а
концентрация каждого из продуктов
реакции возрастает (С2>С1,
ΔС>0).
Изменение
концентраций исходных веществ и продуктов
реакции во времени приведено на рис.1.
В химической кинетике различают среднюю
и истинную (или мгновенную) скорость
реакции. Средняя скорость v
равна отношению ΔС/Δτ
(ΔС = С2-С1,
Δτ = τ2-τ1).
Чтобы величина скорости была всегда
положительной, перед дробью ставят
знаки »±».
V = ± —–—
Δτ
Истинная скорость химической реакции Vист определяется пределом, к которому стремится отношение ΔС/Δτ при τ → 0, т.е. производной концентрации по времени:
dС
Vист = ± —–—
dτ
Зависимость скорости реакции от концентрации реагентов. Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходят тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени (рис.1, кривая 1) скорость реакции падает.
Количественно зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс, который в современной формулировке выглядит так:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции аА +bВ → mМ + nN
математическое выражение закона действующих масс имеет вид:
V = kСАа·СВb
где V ― скорость реакции; СА и СВ ― концентрации реагентов А и В; а, b ― стехиометрические коэффициенты в уравнении реакции; k ― коэффициент пропорциональности, называемый константой скорости химической реакции. Размерность константы скорости определяется величинами стехиометрических коэффициентов а и b и остается такой, чтобы скорость V имела размерность моль/л∙сек. Если нет точных данных, размерность k принимают сек―1. При СА = СВ = 1 моль/л k численно равна V. Выражение (1) называют также кинетическим уравнением реакции.
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Пример 1. В реакционный сосуд объемом 2 л помещены 0,06 моль вещества А и 0,02 моль вещества В. При определенной температуре протекает реакция А + 2В = АВ2 Найти значение константы скорости реакции при этой температуре, если при заданных концентрациях веществ А и В скорость реакции равна 6·10―7 моль/(л·сек).
Решение: Зная количества реагирующих веществ и объем системы, найдем молярные концентрации реагентов:
СА = 0,06/2 = 0.03 = 3·10―2моль/л; СВ = 0,02/2 = 0.01 = 10―2моль/л
Запишем выражение кинетического уравнения, связывающего скорость реакции с концентрациями реагирующих веществ:
V 6.10―7
Отсюда: k = ————— = ——————— = 0,2 л2/(моль)2∙сек
СА·СВ2· 3·10―2 (10―2)2
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно и ко всей реакции в целом.
Если в реакции участвуют два или более веществ, то скорость реакции может зависеть от концентрации только одного из них, участвующего в самой медленной стадии процесса и не зависеть от концентрации других.
Скорость гетерогенных химических реакций. Многие химические процессы, имеющие большое значение в технике, относятся к числу гетерогенных реакций. Один или несколько компонентов процесса находятся в конденсированной, обычно твердой фазе. Концентрации твердых веществ не записываются в кинетическое уравнение (закон действующих масс). Условно эти концентрации принимают постоянными и равными 1. Это первая особенность гетерогенных реакций. Они идут на поверхности раздела фаз, которая и является их реакционным пространством. Поэтому второй
Fе2О3(К) + 3СО(Г) → 2Fе + 3СО2(Г)
кинетическое уравнение может быть записано в виде: V = k∙С3СО∙S, где ССО ― молярная концентрация монооксида углерода СО(Г), единственного газообразного компонента в реагирующих исходных веществах, S ― площадь поверхности, на которой идет реакция. Твердое вещество Fе2О3(К) в кинетическое уравнение не записывается. Скорости гетерогенных химических реакций имеют размерность моль/л∙сек∙м2
Однако в большинстве случаев площадь реакционной поверхности практически невозможно измерить и она непосредственно не фигурирует в кинетическом уравнении (законе действующих масс). Она
»запрятывается» в константу скорости k и это учитывается в размерности константы скорости.
Пример 2. Для реакции: Si(ТВ) + 2Н2О(Г) SiО2(ТВ) + 2Н2(Г) напишите выражение для кинетического уравнения.
Решение: Данная реакция гетерогенная, протекает на границе раздела фаз. Из реагирующих веществ вода участвует в реакции в газообразной форме, перед ней коэффициент в уравнении равен 2 (…+ 2Н2О(Г)). Кремний (Si(ТВ)) ― твердое вещество, поэтому его концентрацию не учитываем в кинетическом уравнении. Следовательно, кинетическое уравнение (закон действующих масс) для данной реакции может иметь вид: V = k·С2Н2О. Размерность константы скорости в этом случае л/моль∙сек∙м2.
В процессе реакции уменьшается концентрация реагента в зоне реакции CS по сравнению с его концентрацией в в объеме CV из-за расхода реагента. Поэтому скорость гетерогенной химической реакции зависит от скорости подвода реагентов в зону химической реакции,
что является третьей особенностью этих реакций.
Наибольшее изменение концентрации реагента происходит в тонком слое около реакционной поверхности, называемом диффузионныом слоем. Перенос вещества здесь происходит в основном за счет диффузии.
Если скорость диффузии много больше скорости реакции (VД>> V), то реагенты без проблем подаются в реакционное пространство, к поверхности, все законы влияния концентрации на скорость, описанные выше, соблюдаются. Для таких случаев есть выражение «кинетический контроль реакции». Если скорости химической реакции и диффузии сопоставимы, имеет место смешанный контроль. И, наконец, когда скорость диффузии много меньше скорости реакции (VД<< V) то говорят о диффузионном контроле реакции.
В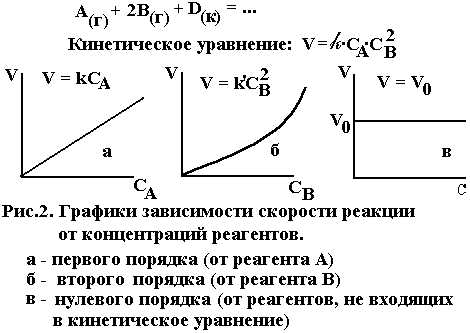 этом случае может наблюдаться нулевой
порядок реакции по всем реагентам. Это
значит, что в координатахV
―
C скорость
не зависит от концентраций реагентов,
а зависит от скорости диффузии, величины
поверхности и температуры, которые не
входят в кинетическое уравнение. Такое
явление может иметь место при реакции
на твердой поверхности в жидких средах
с высокой вязкостью. Однако большинство
гетерогенных реакций имеет порядок,
отличающийся от нулевого, нередко
дробный. На рис. 2 приведены графические
формы возможных зависимостей скорости
реакции от концентраций реагентов.
этом случае может наблюдаться нулевой
порядок реакции по всем реагентам. Это
значит, что в координатахV
―
C скорость
не зависит от концентраций реагентов,
а зависит от скорости диффузии, величины
поверхности и температуры, которые не
входят в кинетическое уравнение. Такое
явление может иметь место при реакции
на твердой поверхности в жидких средах
с высокой вязкостью. Однако большинство
гетерогенных реакций имеет порядок,
отличающийся от нулевого, нередко
дробный. На рис. 2 приведены графические
формы возможных зависимостей скорости
реакции от концентраций реагентов.
Зависимость скорости реакций от давления в системе. В тех случаях, когда среди реагирующих веществ имеются газы, скорость реакций зависит от давления в системе. При повышении давления пропорционально возрастает число молекул газа в единице объема, что эквивалентно повышению концентрации данного газа.
Пример 3. Как изменится скорость реакции 2NО + О2 → 2NО2 при уменьшении объема замкнутой системы в два раза при постоянной температуре?
Решение. Уменьшение объема в замкнутой системе эквивалентно пропорциональному увеличению давления, так как, согласно закону Менделеева-Клайперона РW = νRТ. (Здесь W ― объем системы.)
Кинетическое уравнение данной реакции имеет вид: V = kС2NО·СО2
При уменьшении объема системы в два раза и связанным с этим повышении давления в два раза концентрации реагирующих веществ тоже повышаются в два раза: С’NО = 2СNОС’О2 = 2СО2
Новая скорость реакции:
V’ = kС’NО2·С’О2 = k(2СNО)2·(2СО2) = 8kСNО2·СО2 = 8V
Вывод. При уменьшении объема замкнутой системы в два раза при постоянной температуре скорость данной реакции повышается в 8 раз.
Зависимость константы скорости реакции от температуры. Большинство реакций ускоряется при нагревании. Температура действует непосредственно на константу скорости k. Пусть V1 ― скорость реакции при температуре Т1, а V2 ― скорость этой же реакции при температуре Т2 (Т1<Т2). В таком случае имеет место эмпирическое правило Вант-Гоффа.
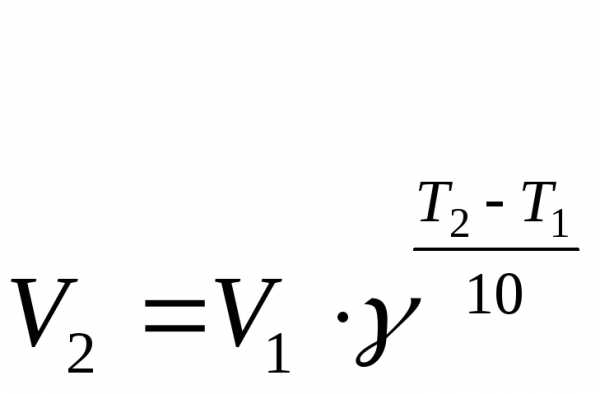
где γ – температурный коэффициент, показывающий во сколько раз повысится скорость реакции при повышении температуры на 10 0С. Для большинства реакций при температурах, близких к комнатной, γ составляет величину 2-4.
Уравнение Вант-Гоффа широко используется, однако следует помнить, что оно эмпирическое приблизительное, его можно применять только для ориентировочных расчетов.
Пример 4. При 100 0С некоторая реакция заканчивается за 20 мин. Принимая температурный коэффициент скорости реакции γ = 3,5, рассчитайте, через какое время закончится реакция при 60 0С
Решение. Скорость реакции, как и скорость всякого процесса, обратно пропорциональна времени проведения процесса. Следовательно, V2/V1 = τ1/τ2. Пусть Т1, V1 и τ1 ― параметры медленного (низкотемпературного) процесса, а Т2, V2 и τ2 ― параметры высокотемпературного процесса. Подставляем имеющиеся данные в уравнение Вант-Гоффа:
V2/V1 = 3,5(100 ― 60)/10 = (3,5)4 = 150. Так как V2/V1 = τ1/τ2 = 150,
τ1/τ2 = τ1/20 τ1 = 150·20 = 3000 мин = 50 часов.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Как и при повышении температуры, при введении катализатора повышается константа скорости реакции. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом резко повышается
studfiles.net
Понятие о скорости химической реакции. Закон действующих масс
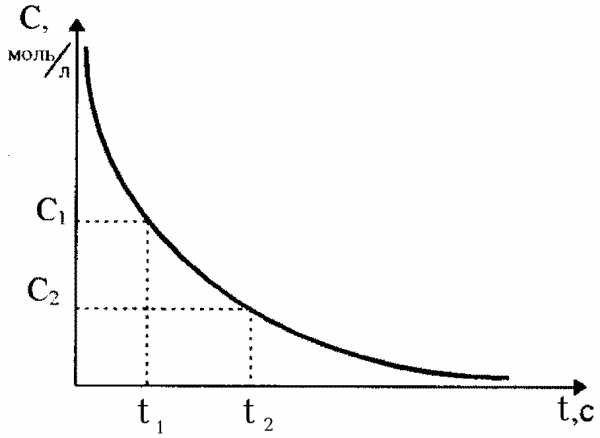
В ходе протекания необратимых химических реакций исходные вещества расходуются, их содержание (или концентрация) в системе уменьшается от начальной величины до нуля. Конечные продукты, наоборот, накапливаются, и с течением времени их концентрация возрастает от нуля до своей максимальной величины (рис.36). Чем за меньший промежуток времени осуществляется этот процесс, тем с большей скоростью протекает химическая реакция.

1 2
Рис. 36. Изменение концентрации исходного (1) и конечного (2) вещества в зависимости от времени протекания реакции
Скорости химических реакций могут лежать в самом широком диапазоне значений. Некоторые реакции заканчиваются за тысячные доли секунды (горение и разложение взрывчатых веществ, пороха), продолжительность других измеряется минутами, часами, сутками. Геохимические реакции, протекающие между веществами в земной коре, совершаются в течение многих тысячелетий.
Рассматриваемые в химической кинетике процессы целесообразно разделить на 2 группы: гомогенные и гетерогенные. Это связано с тем, что характер и способ их протекания в существенной мере зависят от данного признака. Причём, отнесение той или иной реакции к гомогенной или гетергенной определяется лишь агрегатным состоянием исходных веществ, а не её конечных продуктов.
Гомогенными называются химические реакции, у которых исходные вещества находятся в одинаковом агрегатном состоянии или в одной и той же (жидкой либо газообразной) фазе. При этом между веществами отсутствует поверхность раздела.
Например:
1) 2Н2(газ)+ О2(газ) = 2 Н2О(ж.)
гомогенная реакция, протекающая в газовой фазе;
2) KCl (p.-p.)+ AgNO3(p.-p.)=AgСl↓ (тв.)↓ + KNO3(p.-p.)
гомогенная реакция, протекающая в жидкой фазе.
Характерной особенностью гомогенных реакций является то, что они осуществляются во всём объёме системы, т.е. столкновение молекул либо ионов исходных веществ может произойти в любой её точке.
Гетерогенными называются химические реакции, в которых исходные вещества находятся в разных фазах и, как правило, отличаются друг от друга агрегатным состоянием. Но могут быть гетерогенные реакции, в которых различные фазы находятся в одном и том же агрегатном состоянии. Например, две несмешивающиеся между собой жидкости: углеводород и вода. В таких системах между исходными веществами всегда присутствует поверхность раздела, на которой и протекает гетерогенная реакция.
Например:
1) С(тв.)+ О2(г.)= СО2
2) 2Н2О(ж.)+ Са(тв.)= Са(ОН)2(р.-р.)+ Н2 (г.)
Гетерогенные реакции, протекающие на поверхности твёрдого вещества;
3) Н2О(ж.)+ 2NO2(г.)=HNO3(p.-p.)+HNO2(p.-p.)
Гетерогенная реакция, протекающая на поверхности жидкости.
При рассмотрении биохимических процессов, протекающих в живом организме, часто бывает трудно отнести их к соответствующему типу, т.к. в некоторых случаях невозможно однозначно определить агрегатное состояние всех исходных веществ. Особенно это касается реакций, протекающих внутри или на поверхности биологических мембран, а также с участием биополимеров (белков, полисахаридов). В то же время, принадлежность реакции к гомогенному или гетерогенному типу оказывает значительное влияние не только на величину скорости, но и на способ её определения.
При этом под скоростью (υ) гомогенной реакции подразумевают изменение числа молей одного из веществ (конечного или начального) за единицу времени в единице объема системы:
,
где n1 и n2 – химическое количество вещества, соответственно, в начальный (t1) и конечный (t2) момент времени; V – объём системы, в которой протекает реакция; ∆t – время протекания реакции.
Если скорость реакции определяют по возрастанию числа молей одного из конечных веществ, то перед уравнением ставят знак «+», так как в этом случае ∆n> 0 (n2>n1).
Если же скорость реакции определяют по уменьшению числа молей одного из исходных веществ, перед уравнением ставят знак «–», так как в этом случае ∆n< 0 (n2<n1), а скорость химической реакции всегда должна быть положительной величиной.
Уравнение для расчета скорости гомогенной химической реакции можно математически преобразовать с учётом того, что
,
где С1 и С2– молярная концентрация вещества в начальный (t1) и конечный (t2) моменты времени.
В соответствии с получившейся новой формулой под скоростью гомогенной реакции подразумевают изменение молярной концентрации одного из веществ (исходного или конечного) за единицу времени.
При этом, если скорость гомогенной реакции определяют на основании уменьшения молярной концентрации одного из исходных веществ, перед формулой ставят знак «–».
Скорость гомогенной реакции имеет размерность моль/дм3∙с или моль/м3 ∙ с (в системе СИ).
В практике биохимических исследований наряду с молярной концентрацией (моль/л) применяют и другие концентрации растворённых веществ: по массе – мг/100 мл; массовой доле – % /100 мл и др. Единицами измерения скорости в таком случае будут, соответственно, мг/100 мл · с, %/100 мл · с. При необходимости их можно перевести в единицы СИ.
Под скоростью гетерогенной реакции подразумевают изменение числа молей одного из веществ (исходного или конечного) за единицу времени на единице площади поверхности раздела агрегатных состояний или фаз(так как гетерогенная реакция протекает не во всём объёме системы, а на границе раздела агрегатных состояний)
,
где S – площадь поверхности раздела фаз.
Скорость гетерогенной реакции имеет размерность моль/м2 ∙ с.
Часто поверхность твёрдого вещества является особо пористой, развитой. Точное значение её площади в связи с этим определить практически невозможно. В таких случаях среднюю скорость гетерогенной реакции рассчитывают формуле
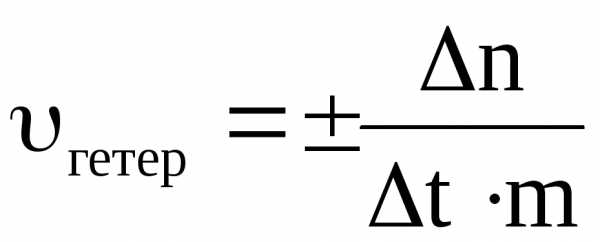 ,
,
где m – масса твёрдой фазы
При этом скорость имеет размерность моль/кг · с.
По вышеприведенным формулам мы всегда определяем, с какой скоростью расходуется или накапливается только одно из веществ, участвующих в реакции. Но так как все вещества связаны в уравнении химической реакции стехиометрическими коэффициентами, изменение количества или концентрации одного из них приводит к эквивалентному изменению количества и концентрации всех остальных. Например, пусть скорость расходования N2в химической реакции синтезаNH3
N2+ 3H2= 2NH3
равна 2 моль/дм3 ∙ с. С учётом стехиометрических коэффициентов скорость расходования Н2будет составлять 2 ∙ 3 = 6 моль/дм3∙ с, аNH3 будет накапливаться в системе со скоростью 2 ∙ 2 = 4 моль/дм3∙ с.
С помощью приведенных выше уравнений можно рассчитать так называемую среднюю скорость реакции, то есть скорость за какой-то отрезок времени ∆t. Считается, что на протяжении этого интервала скорость остаётся неизменной, но это не так. Ведь исходные вещества непрерывно расходуются, а, значит, должна постоянно уменьшаться и скорость реакции. Поэтому вводят понятие обистиннойилимгновеннойскорости, то есть скорости в данный момент времени.
Математически истинную или мгновенную скорость (ист.) реакции принято выражать отношением бесконечно малого изменения количества вещества Δ n (или его концентрации ΔС) к бесконечно малому отрезку времени Δt, в течение которого произошло это изменение, или производной по времени от химического количества вещества либо его концентрации:
Для гомогенных химических реакций справедливо выражение
Согласно закону действующих масс, истинная скорость пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Так, для реакции вида
,
где k – коэффициент пропорциональности, называемый константой скорости данной химической реакции.Он равен скорости реакции в тот момент, когда молярные концентрации исходных веществ равны 1 моль/дм3. Константа скорости не зависит от концентраций исходных веществ и при неизменной температуре и отсутствии катализаторов есть величина постоянная для данной реакции. Определяют значениеkдля каждой реакции опытным путем.
Закон действующих масс на основе большого экспериментального материала был сформулирован в 1867 г. норвежскими учёными К. Гульбергом и П. Ваге, и независимо от них в 1865 г. русским учёным Н.И. Бекетовым. В конце XIX века термин «концентрация» ещё не был введён и химики пользовались вместо него термином «действующие массы».
Для реакции синтеза HI
H2(г)+I2(г)= 2HI
истинную скорость реакции можно рассчитать по формуле:
При расчете скорости гетерогенной реакции в формулу подставляют только концентрации тех веществ, которые находятся в растворённом или газообразном состоянии, так как концентрация твёрдого вещества на протяжении всей реакции считается величиной постоянной и учитывается в значении константы скорости. Например:
С(тв.) + О2(газ) = СО2
Выведенное на основе закона действующих масс математическое уравнение, с помощью которого можно рассчитать скорость данной химической реакции, называется ее главным (основным) кинетическим уравнением.
studfiles.net
Химическая кинетика и катализ Кинетика химических реакций
Учение о химических процессах состоит из двух частей: 1) химической термодинамики; 2)химической кинетики.
Как уже было показано ранее, химическая термодинамика изучает превращения различных видов энергии при осуществлении химических реакций. Она позволяет количественно определить тепловой эффект химической реакции, возможность самопроизвольного её протекания в том или ином направлении и условия, при которых участвующие в реакции вещества будут находиться в состоянии равновесия. Причём изучение происходящих процессов с позиции термодинамики не требует знаний о их механизме, строении молекул исходных веществ и продуктов реакции.
Ограниченность химической термодинамики заключается в том, что полученных с её помощью результатов часто бывает недостаточно, чтобы осуществить принципиально возможный процесс на практике.
Например, с точки зрения термодинамики все органические вещества должны были бы уже при обычных условиях достаточно быстро окисляться молекулярным кислородом воздуха до углекислого газа и воды, т.к. этот процесс сопровождается значительным уменьшением энергии Гиббса (Δ G<<0). В связи с этим существование всего живого на Земле было бы невозможно. Но в действительности данная реакция протекает исключительно медленно.
Ответы на вопросы почему так происходит и что нужно сделать, чтобы этот и другие процессы осуществить с необходимой скоростью даёт химическая кинетика.
Химическая кинетика (от греческ. kinētikόs – движущий) – раздел физической химии, изучающей скорость протекания химической реакции во времени, факторы, влияющие на её величину, условия проведения реакции и её возможный механизм с учётом строения молекул участвующих в ней веществ.
Практическое значение её огромно. Так, зная законы кинетики и механизм реакции, можно управлять химическим процессом, сообщая ему необходимую скорость и направление. От этого, в свою очередь, зависит выход конечных продуктов и их себестоимость, производительность аппаратуры в химической промышленности.
От скорости реакции зависит очередность протекания тех или иных биохимических процессов в живых организмах, эффективность действия на них различных лекарственных препаратов, сроки и условия хранения последних до начала их применения.
Следует подчеркнуть, что управление химическим процессом с целью его интенсификации или, наоборот, ингибирования (замедления) является главной задачей химической кинетики
Химическая кинетика состоит из двух разделов: 1) формальной кинетики, дающей математическое описание скорости химической реакции в зависимости от внешних условий (температуры, давления, концентрации исходных веществ), но без учёта механизма самой реакции; 2) молекулярной кинетики, изучающей механизмы протекающих реакций.
Понятие о скорости химической реакции. Закон действующих масс
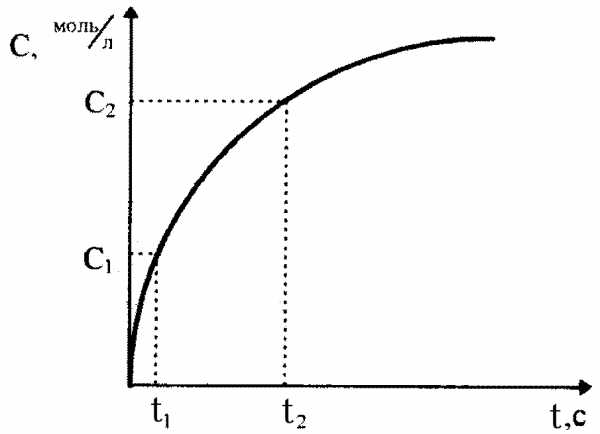
В ходе протекания необратимых химических реакций исходные вещества расходуются, их содержание (или концентрация) в системе уменьшается от начальной величины до нуля. Конечные продукты, наоборот, накапливаются и с течением времени их концентрация возрастает от нуля до своей максимальной величины (рис.36). Чем за меньший промежуток времени осуществляется этот процесс, тем с большей скоростью протекает химическая реакция.
1 2
Рис. 36.Изменение концентрации исходного (1) и конечного (2) вещества в зависимости от времени протекания реакции
Скорости химических реакций могут лежать в самом широком диапазоне значений. Некоторые реакции заканчиваются за тысячные доли секунды (горение и разложение взрывчатых веществ, пороха), продолжительность других измеряется минутами, часами, сутками. Геохимические реакции, протекающие между веществами в земной коре, совершаются в течение многих тысячелетий.
Рассматриваемые в химической кинетике процессы целесообразно разделить на 2 группы: гомогенные и гетерогенные. Это связано с тем, что характер и способ их протекания в существенной мере зависит от данного признака. Причём отнесение той или иной реакции к гомогенной или гетергенной определяется лишь агрегатным состоянием исходных веществ, а не её конечных продуктов.
Гомогенными называются химические реакции, у которых исходные вещества находятся в одинаковом агрегатном состоянии или в одной и той же (жидкой либо газообразной) фазе. При этом между веществами отсутствует поверхность раздела.
Например:
1) 2Н2(газ)+ О2(газ) = 2 Н2О(ж.)
гомогенная реакция, протекающая в газовой фазе;
2) KCl (p.-p.) + AgNO3(p.-p.) = AgI↓ (тв.)↓ + KNO3(p.-p.)
гомогенная реакция, протекающая в жидкой фазе.
Характерной особенностью гомогенных реакций является то, что они осуществляются во всём объёме системы, т.е. столкновение молекул либо ионов исходных веществ может произойти в любой её точке.
Гетерогенными называются химические реакции, в которых исходные вещества находятся в разных фазах и, как правило, отличаются друг от друга агрегатным состоянием. Но могут быть гетерогенные реакции, в которых различные фазы находятся в одном и том же агрегатном состоянии. Например, две несмешивающиеся между собой жидкости: углеводород и вода. В таких системах между исходными веществами всегда присутствует поверхность раздела, на которой и протекает гетерогенная реакция.
Например:
1) С(тв.)+ О2(г.)
2) Н2О(ж.)+ Са(тв.)= Са(ОН)2(р.-р.)+ Н2 (г.)
Гетерогенные реакции, протекающие на поверхности твёрдого вещества;
3) Н2О (ж.) +NO2(г.)=HNO3(p.-p.)+HNO2(p.-p.)
Гетерогенная реакция, протекающая на поверхности жидкости.
При рассмотрении биохимических процессов, протекающих в живом организме, часто бывает трудно отнести их к соответствующему типу, т.к. в некоторых случаях невозможно однозначно определить агрегатное состояние всех исходных веществ. Особенно это касается реакций, протекающих внутри или на поверхности биохимических мембран, а также с участием биополимеров (белков, полисахаридов). В тоже время принадлежность реакции к гомогенному или гетерогенному типу оказывает значительное влияние не только на величину скорости, но и на способ её определения.
При этом под скоростью (υ) гомогенной реакции подразумевают изменение числа молей одного из веществ (конечного или начального) за единицу времени в единице объема системы:
,
где n1 и n2 – химическое количество вещества, соответственно, в начальный (t1) и конечный (t2) момент времени; V – объём системы, в которой протекает реакция; ∆t – время протекания реакции.
Если скорость реакции определяют по возрастанию числа молей одного из конечных веществ, то перед уравнением ставят знак «+», так как в этом случае ∆n> 0 (n2>n1).
Если же скорость реакции определяют по уменьшению числа молей одного из исходных веществ, то перед уравнением ставят знак «–», так как в этом случае ∆n< 0 (n2<n1), а скорость химической реакции всегда должна быть положительной величиной.
Уравнение для расчета скорости гомогенной химической реакции можно математически преобразовать с учётом того, что
,
где С1 и С2 → молярная концентрация вещества в начальный (t1) и конечный (t2) моменты времени.
В соответствии с получившейся новой формулой под скоростью гомогенной реакции подразумевают изменение молярной концентрации одного из веществ (исходного или конечного) за единицу времени.
При этом, если скорость гомогенной реакции определяют на основании уменьшения молярной концентрации одного из исходных веществ, перед формулой ставят знак «–».
Скорость гомогенной реакции имеет размерность моль/дм3∙ с или моль/м3 ∙ с (в системе СИ).
В практике биохимических исследований наряду с молярной концентрацией (моль/л) применяют и другие концентрации растворённых веществ: по массе – мг/100 мл; массовой доле – % /100 мл и др. Единицами измерения скорости в таком случае будут, соответственно, мг/100 мл · с, %/100 мл · с. При необходимости их можно перевести в единицы СИ.
Под скоростью гетерогенной реакции подразумевают изменение числа молей одного из веществ (исходного или конечного) за единицу времени на единице площади поверхности раздела агрегатных состояний или фаз (так как гетерогенная реакция протекает не во всём объёме системы, а на границе раздела агрегатных состояний)
,
где S – площадь поверхности раздела фаз.
Скорость гетерогенной реакции имеет размерность моль/м2 ∙ с.
Часто поверхность твёрдого вещества является очень пористой, развитой. Точное значение её площади в связи с этим определить практически невозможно. В таких случаях среднюю скорость гетерогенной реакции рассчитывают формуле
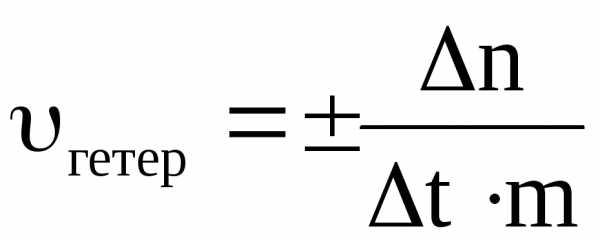 ,
,
где m – масса твёрдой фазы
При этом скорость имеет размерность моль/кг · с.
По вышеприведенным формулам мы всегда определяем, с какой скоростью расходуется или накапливается только одно из веществ, участвующих в реакции. Но так как все вещества связаны в уравнении химической реакции стехиометрическими коэффициентами, то изменение количества или концентрации одного из них приводит к эквивалентному изменению количества и концентрации всех остальных. Например, пусть скорость расходования N2в химической реакции синтезаNH3
N2+ 3H2= 2NH3
равна 2 моль/дм3 ∙ с. С учётом стехиометрических коэффициентов скорость расходования Н2будет составлять 2 ∙ 3 = 6 моль/дм3∙ с, аNH3 будет накапливаться в системе со скоростью 2 ∙ 2 = 4 моль/дм3∙ с.
Таким образом, можно рассчитать так называемую среднюю скорость реакции, то есть скорость за какой-то отрезок времени ∆t. Считается, что на протяжении этого интервала скорость остаётся неизменной, но это не так. Ведь исходные вещества непрерывно расходуются, а, значит, должна постоянно уменьшаться и скорость реакции. Поэтому вводят понятие обистиннойилимгновеннойскорости, то есть скорости в данный момент времени.
Математически истинную или мгновенную скорость (ист.) реакции принято выражать отношением бесконечного малого изменения количества вещества Δ n (или его концентрации ΔС) к бесконечно малому отрезку времени Δt, в течение которого произошло это изменение, или производной по времени от химического количества вещества либо его концентрации:
Для гомогенных химических реакций справедливо выражение
Согласно закона действующих масс, истинная скорость пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Так, для реакции вида
,
где k – коэффициент пропорциональности, называемый константой скорости данной химической реакции.Он равен скорости реакции в тот момент, когда молярные концентрации исходных веществ равны 1 моль/дм3. Константа скорости не зависит от концентраций исходных веществ и при неизменной температуре и отсутствии катализаторов есть величина постоянная для данной реакции. Определяют значениеkдля каждой реакции опытным путем.
Закон действующих масс на основе большого экспериментального материала был сформулирован в 1867 г. норвежскими учёными К. Гульбергом и П. Вааге и независимо от них в 1865 г. русским учёным Н.И. Бекетовым. В конце XIX века термин «концентрация» ещё не был введён и химики пользовались вместо него термином «действующие массы».
Для реакции синтеза HI
H2(г)+I2(г)= 2HI
истинную скорость реакции можно рассчитать по формуле:
При расчете скорости гетерогенной реакции в формулу подставляют только концентрации тех веществ, которые находятся в растворённом или газообразном состоянии, так как концентрация твёрдого вещества на протяжении всей реакции считается величиной постоянной и учитывается в значении константы скорости. Например:
С(тв.) + О2(газ) = СО2
Математическое уравнение, выведенное на основе закона действующих масс, с помощью которого можно рассчитать скорость данной химической реакции, называется ее главным (основным) кинетическим уравнением.
studfiles.net
26 Скорость химической реакции. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Порядок и молекулярность реакций. Энергия активации, ее физический смысл.
Скоростью хим. Реакции называется изменение концентраций реагирующих или образующихся веществ в единицу времени.
Гомогенная реакция – система которая протекает в системе состоящей из одной фазы. Скорость такой реакции – изменение кол-ва реагирующего или образующегося вещ-ва в единицу времени в единице объема системы.
Гетерогенная реакция протекает на границе фаз в системе, состоящей из нескольких фаз. Скоростью такой реакцией наз. изменение кол-ва реагирующего или образующегося вещ-ва в единицу времени на единице площади раздела фаз.
Скорость реакции зависит от природы реагирующих веществ, а ток же от концентрации, температуры, наличия катализатора. Закон действующих масс – скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
mA+nB=pAB где Са и Сb – молярные концентрации, k – константа скорости. Правило Ван-Гоффа. С повышением температуры на 10С скорость реакций возрастает в 2-4 раза.
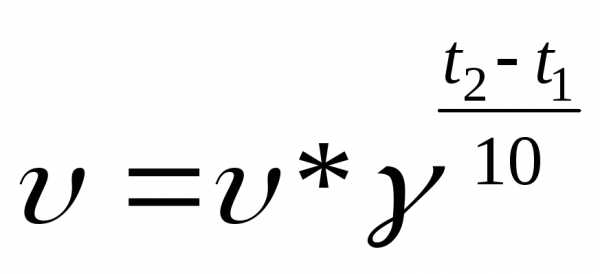
Правило Вант-Гоффа
По этому правилу, при увеличении температуры на 10 градусов, скорость химической реакции возрастает в 2-4 раза
Температурный коэффициент:
V
–объем системы не меняется, тогда
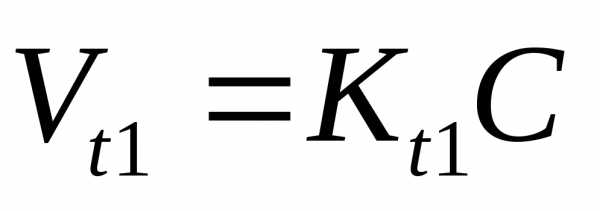
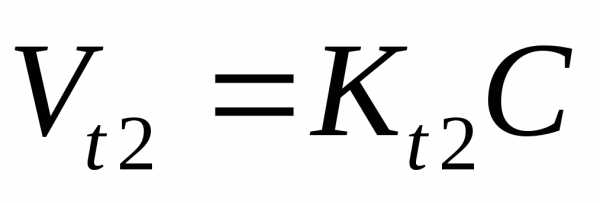
При
увеличении температуры, резко возрастает
число активных молекул, которые обладают
избыточной энергией
 скорость реакции увеличивается.
скорость реакции увеличивается.
Согласно …….. уравнению ……… константа скорости записывается:
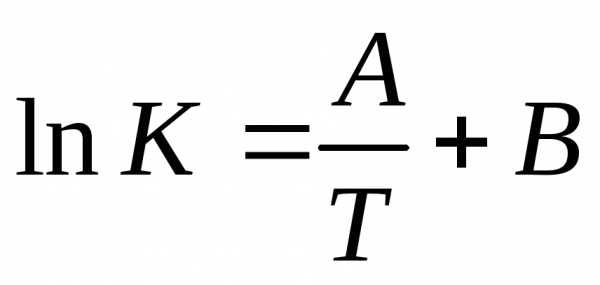
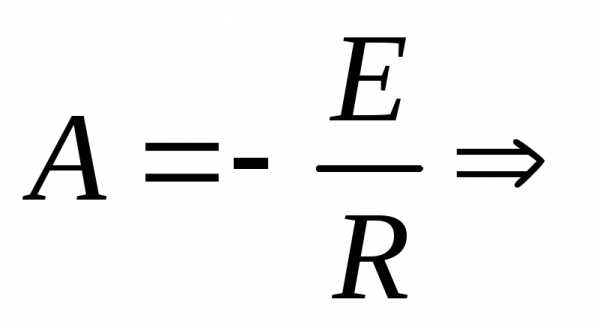
27.Влияние концентрации реагентов на скорость химической реакции. Закон действующих масс. Константа скорости химической реакции и ее физический смысл.
Скорость химической реакции равна изменению кол-ва в-ва в единицу времени в единице реакционного пространства. В зависимости от типа хим р-ии меняется характер реакционного пространства. Гомогенной реакцией наз-ся реакция, протекающая в однородной среде (в одной фазе). Гетерогенные р-ии протекают на границе раздела фаз, напр тв и жидкой, тв и газообразной.
При одной и той же температуре число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с возрастанием концентрации реагентов. Соответственно скорость реакции повышается с увеличением концентрации реагирующих в-в. Скорость необратимой р-ии:
bB+dD=lL+mM равна
v=k, где k-константа скорости р-ии, и-коэффициенты называемые порядками р-ии по в-ам B и D. Ур-ие наз-ся кинетическим ур-ем хим р-ии. Констаната скорости р-ии не зависит от концентрации реагентов, но зависит от их природы и температуры.
Закон действующих масс открыт норвежскими учеными К. Гульдбергом и П. Ваге(1867) и может быть сформулирован так: отношение произведения равновесных концентраций продуктов р-ии в стапенях, равных стехиометрическим коэффициентам исходных в-в в степенях, равных стехиометрическим коэффициентам, при Т=const, яв-ся величиной постоянной.
28 Катализ. Гомогенный, гетерогенный, ферментативный. Особенности отдельных типов катализа. Примеры.
Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе реакции. Могут увеличивать скорость реакции (активаторы) или замедлять (ингибиторы). Бывают твердыми, жидкими и газообразными. Гомогенный катализ. Реагирующие вещества и катализатор образуют однородную, однофазную систему. Например: 2SO2+O2=2SO3 Механизм катализа объясняется образованием промежуточного соединения катализатора с одним из реагирующих веществ. Схема действия катализатора в две стадии O2+2NO(катализатор)=2NO(пром. соединение)
NO2+SO2=SO3 (продукт)+NO(катализатор). Геторогенный катализ. Реагирующие вещества и катализатор составляют неоднородную, многофазную систему, в которой катализатор находится в виде отдельной фазы. Примеры: синтез аммиака
Каталитическое окисление аммиака
studfiles.net
3 Скорость химических реакций
Как известно, химические реакции могут протекать с различными скоростями. Скорость реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий проведения реакций (концентраций реагентов, температуры, давления и т. д.).
Химические реакции называются гомогенными(однородными), если молекулы реагирующих веществ находятся в одной фазе (жидкой или газообразной). Такие реакции протекают во всем объеме системы.
Химические реакции называются гетерогенными, если реагирующие вещества находятся в разных фазах. Гетерогенные реакции проходят на поверхности раздела фаз, где соприкасаются реагирующие вещества.
3.1 Количественное определение скорости химической реакции
В настоящем курсе мы будем иметь дело с гомогенными реакциями, протекающими во всем объеме в закрытых термодинамических системах при постоянном объеме. В этом случае скорость химической реакции определяется уравнениями (3.1) и (3.2):
|
|
(3.1) | |
|
|
(3.2) |
Здесь
ср.
– средняя скорость химической реакции;
– мгновенная скорость химической
реакции;
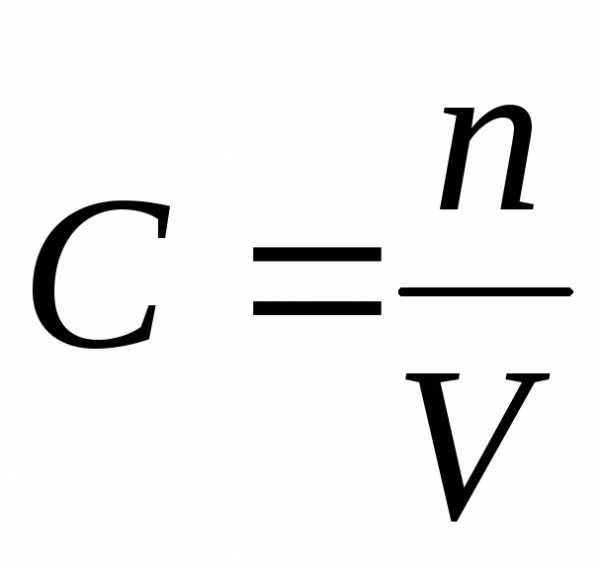 – молярная концентрация вещества, по
которому определяется скорость реакции;
– текущее время; n
– число молей одного из веществ,
участвующих в реакции; V
– объем системы, в котором протекает
гомогенная реакция. Для того чтобы
скорость химической реакции всегда
была больше нуля, знак «+» берется для
продуктов реакции, знак «–» – для
исходных реагентов. Не важно, по какому
из веществ, продукту или исходному
реагенту, определяется скорость реакции.
Если же скорость реакции задана, то
желательно указывать, по отношению к
какому веществу она определена. Изменения
количеств реагирующих веществ и продуктов
реакции однозначно связаны между собой
материальным балансом уравнения
химической реакции. Определения, данные
формулами (3.1) и (3.2), читаются так: скорость
химической реакции есть изменение
концентрации одного из веществ –
участников
реакции –
в единицу времени.
– молярная концентрация вещества, по
которому определяется скорость реакции;
– текущее время; n
– число молей одного из веществ,
участвующих в реакции; V
– объем системы, в котором протекает
гомогенная реакция. Для того чтобы
скорость химической реакции всегда
была больше нуля, знак «+» берется для
продуктов реакции, знак «–» – для
исходных реагентов. Не важно, по какому
из веществ, продукту или исходному
реагенту, определяется скорость реакции.
Если же скорость реакции задана, то
желательно указывать, по отношению к
какому веществу она определена. Изменения
количеств реагирующих веществ и продуктов
реакции однозначно связаны между собой
материальным балансом уравнения
химической реакции. Определения, данные
формулами (3.1) и (3.2), читаются так: скорость
химической реакции есть изменение
концентрации одного из веществ –
участников
реакции –
в единицу времени.
Химическая реакция – результат столкновений между частицами реагентов, приводящих к образованию продуктов реакции. Очевидно, что чем больше концентрация каждого из реагентов участников реакции, тем быстрее при данных внешних условиях протекает химическая реакция. Отсюда вытекает основной закон химической кинетики, который называется законом действующих масс, справедливый для реакций, протекающих при постоянных объёме и температуре.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для реакции, записанной в общем виде (3.3):
|
аА + bВ … , |
(3.3) |
закон действующих масс можно записать как (3.4):
|
, |
(3.4) |
где CAиCB– молярные концентрации реагентов;kС– константа скорости химической реакции.
Индекс «С» у величиныkCуказывает, что скорость химической
реакции определяется через концентрации.
ВеличинаkCзависит от природы реагентов и
температуры, но не зависит от концентраций.Физический смысл величины kC:
она численно равна скорости химической
реакции
 ,
если концентрации реагентов равны
единице(1 моль/л). Для реакций,
протекающих в газовой фазе, часто вместо
концентраций реагентов пользуются их
парциальными давлениями в системе,
тогда уравнение (3.4) запишется как (3.5):
,
если концентрации реагентов равны
единице(1 моль/л). Для реакций,
протекающих в газовой фазе, часто вместо
концентраций реагентов пользуются их
парциальными давлениями в системе,
тогда уравнение (3.4) запишется как (3.5):
|
, |
(3.5) |
где pAиpB– парциальные давления реагентов в
системе, пропорциональные их молярным
концентрациям;kP– константа скорости химической реакции.
Индекс «р» у величиныkPуказывает, что скорость химической
реакции определяется через парциальные
давления. Физический смысл величины
kP:
она численно равна скорости химической
реакции
 ,
если давления реагентов равны единице.
В кинетических уравнениях (3.4) и (3.5) не
учитываются концентрации твёрдых
веществ, если остальные реагенты–жидкости или газы. Концентрация твердого
вещества в его объеме остается неизменной,
если до окончания реакции оно полностью
не израсходуется.
,
если давления реагентов равны единице.
В кинетических уравнениях (3.4) и (3.5) не
учитываются концентрации твёрдых
веществ, если остальные реагенты–жидкости или газы. Концентрация твердого
вещества в его объеме остается неизменной,
если до окончания реакции оно полностью
не израсходуется.
Для простейших реакций степени в уравнениях (3.4) и (3.5) должны быть равны стехиометрическим коэффициентам реакции (3.3), но, как показывают опытные данные, это далеко не всегда так. В этой связи различают молекулярный и кинетический порядок реакции.
Молекулярный порядок реакции.Для определения молекулярного порядка реакции следует иметь в виду, что уравнения (3.4) и (3.5) должны описывать элементарный химический акт взаимодействия.Молекулярность есть число частиц реагентов, которые сталкиваются между собой в элементарном химическом акте, приводящем к образованию продукта.В этой связиразличают реакции мономолекулярные, бимолекулярные и тримолекулярные, которые характерны для элементарных химических актов. Столкновения более трех частиц одновременно в элементарном химическом акте крайне маловероятны. Ниже приводятся примеры реакций различных молекулярных порядков, установленных экспериментально.
Мономолекулярные реакции:
Скорость
мономолекулярной реакции:
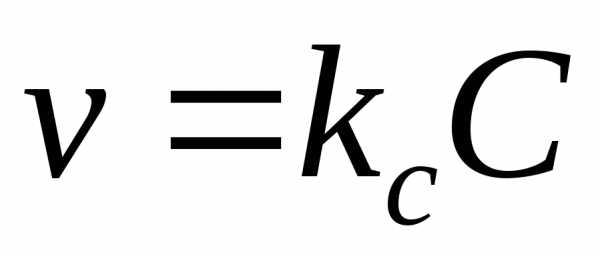 .
.
Бимолекулярные реакции:
Скорость
бимолекулярной реакции:
,
частный случай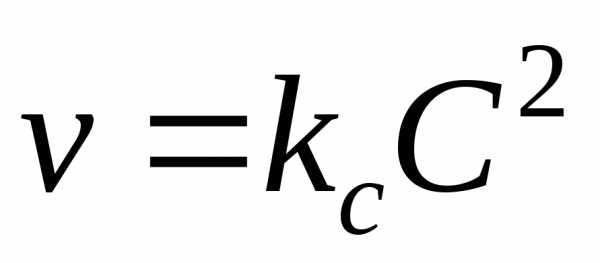 при
при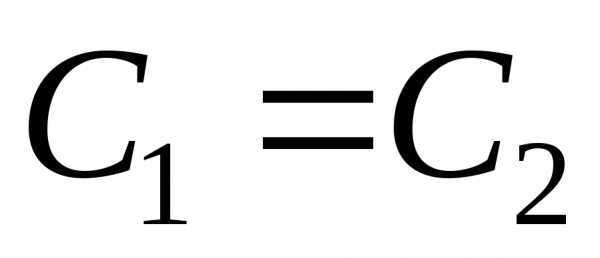 .
.
Тримолекулярные реакции:
2NO + H2 → N2O + H2O,
2NO + O2 → 2NO2,
2NO + X2 → 2NOX (X=Cl, Br).
Скорость
тримолекулярной реакции:
,
частный случай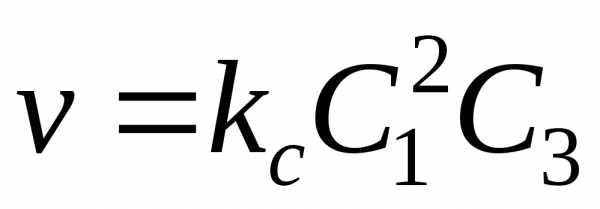 при
при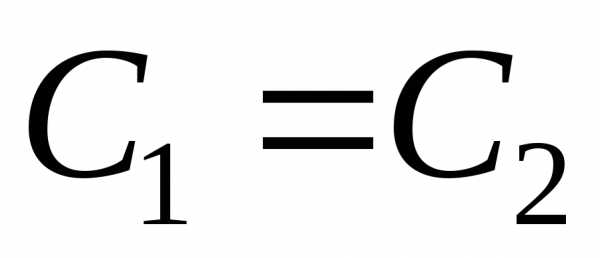 или
или
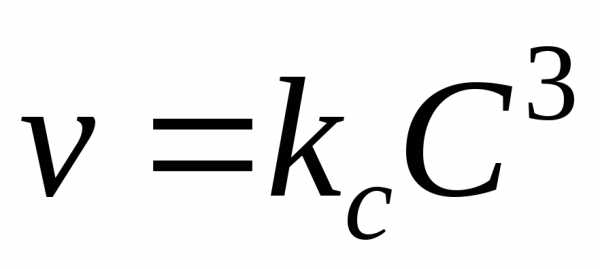 при.
при.
Показатель степени в уравнении элементарного акта (3.4) или (3.5) у концентрации или парциального давления одного из реагентов есть молекулярность реакции по этому реагенту.
Кинетический порядок реакции. Показатели степени в уравнениях закона действующих масс (3.4) и (3.5), найденные экспериментально при изучении зависимости скорости реакции от концентрации реагентов, называются кинетическими порядками по соответствующим реагентам, а их сумма – кинетическим порядком реакции.При таком определении степени в уравнениях (3.4) или (3.5), равно как и их сумма, могут оказаться и не целочисленными величинами. Это свидетельствует о том, что суммарный механизм реакции сложен и состоит из ряда различных последовательных или параллельных элементарных актов, или тех и других вместе. Для установления механизма таких реакций и соответствующих им элементарных актов требуются специальные исследования.Часто в учебниках по химии исключительно в дидактических целях рассматриваются задачи с молекулярным порядком реакции большим, чем три.
Пример 1.Как изменится скорость реакции 2NO+O2= 2NO2, если объем газовой смеси уменьшить в 3 раза?
Решение
Обозначим
начальные концентрации реагирующих
веществ [NO] =а, [O2]
=в. Согласно закону действующих
масс, скорость реакции до изменения
объема равнаν1=kа в.
После уменьшения объема гомогенной
системы в 3 раза концентрация каждого
из реагирующих веществ увеличится в 3
раза:
в.
После уменьшения объема гомогенной
системы в 3 раза концентрация каждого
из реагирующих веществ увеличится в 3
раза:
[NO]
= 3a,
[O ]
= 3b,
]
= 3b,
при новых концентрациях скорость реакции:
ν2
= k(3a) (3b)
= 27ka
(3b)
= 27ka b.
b.
Отсюда
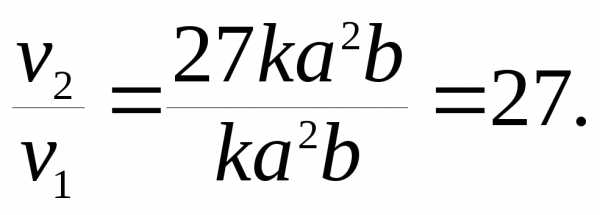
Следовательно, скорость реакции увеличится в 27 раз.
Пример
2.Реакция между веществамиАиВпротекает по уравнению 2А+В=С. Начальные концентрации равны
[A] = 6 моль/л и [B]
= 3 моль/л. Константа скорости реакции
равна 0,6 л /моль
/моль с.
Вычислите скорость реакции в начальный
момент и в момент, когда в реакционной
смеси останется 40 % веществаА.
с.
Вычислите скорость реакции в начальный
момент и в момент, когда в реакционной
смеси останется 40 % веществаА.
Решение
Удобно решать эту задачу с использованием таблицы, в которую записываются: С0– начальные концентрации веществ;C– концентрации веществ в момент, когда в реакционной смеси останется 40 % веществаА, что составляет 6 ∙ 0,4 = 2,4 моль/л;С– изменение концентрации в процессе реакций, что для веществаАсоставляет (6 – 2,4) = 3,6 моль/л. Из уравнения реакции видно, что веществаАиВвзаимодействуют в соотношении 2 : 1, поэтому концентрацияВуменьшилась на (3,6 : 2) = 1,8 моль/л и стала равной (3 – 1,8) = 1,2 моль/л.
-
Концентрация
Вещества
А
В
С0
6
3
С
3,6
1,8
C
2,4
1,2
Запишем закон действующих масс для данной реакции:
ν
= k[A] [B].
[B].
На основании найденных начальных и конечных концентраций рассчитываем скорости реакции:
ν0= 0,662 3 = 64,8 моль/лс,ν= 0,62,42 1,2 = 4,15 моль/лс.
Результаты расчета показывают, что скорость реакции с течением времени уменьшается, так как вещества расходуются в процессе реакции.
С увеличением температуры в реакционной системе интенсивность теплового движения частиц реагентов, вступающих в реакцию, увеличивается. Поэтому растет и число столкновений между ними в единицу времени, в том числе и таких столкновений, которые благоприятны для протекания химической реакции. Отсюда следует, что с ростом температуры в реакционной среде скорость химической реакции всегда увеличивается. В простейшем виде увеличение скорости реакции в зависимости от температуры даетсяправилом Вант-Гоффа, которое он установил эмпирически. Это правило формулируется так:с ростом температуры на каждые 10 градусов скорость химической реакции увеличивается в 2–4 раза и записывается с помощью формулы (3.6):
|
|
(3.6) |
где
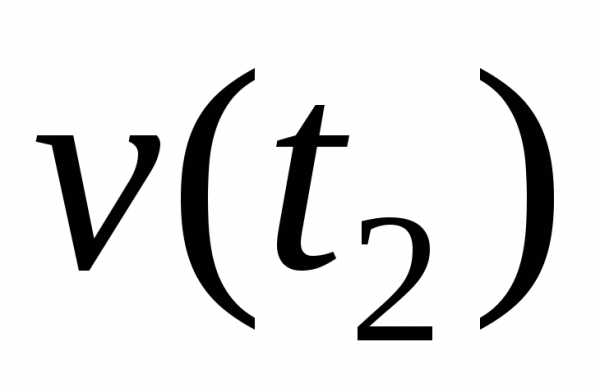 и
и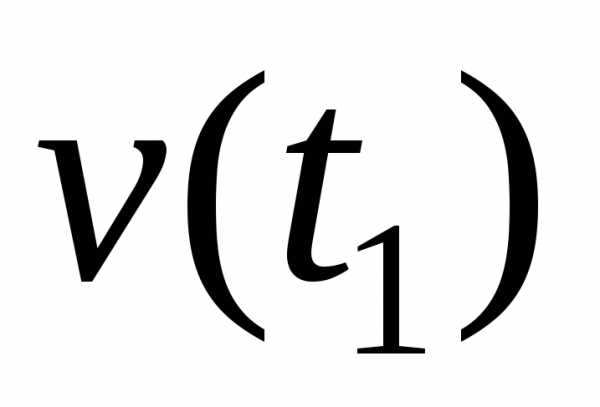 – скорости
химической реакции при температурах
– скорости
химической реакции при температурах
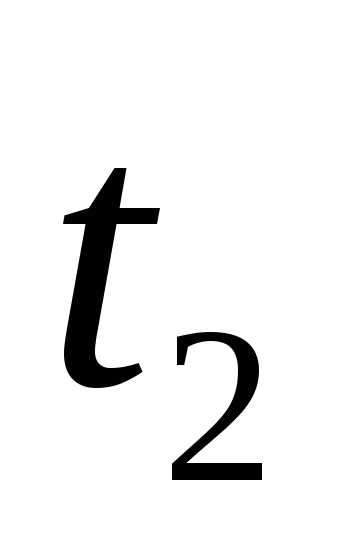 и
и соответственно;
–
температурный коэффициент реакции,
принимающий значения от 2 до 4 в зависимости
от природы реагентов.
соответственно;
–
температурный коэффициент реакции,
принимающий значения от 2 до 4 в зависимости
от природы реагентов.
Как видно из уравнения (3.6), скорость реакции сильно изменяется в зависимости от температуры, так как эта зависимость является степенной.
Пример 3.Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 70 ˚С, если температурный коэффициент равен 2?
Решение
Согласно правилу Вант-Гоффа:
,
отсюда
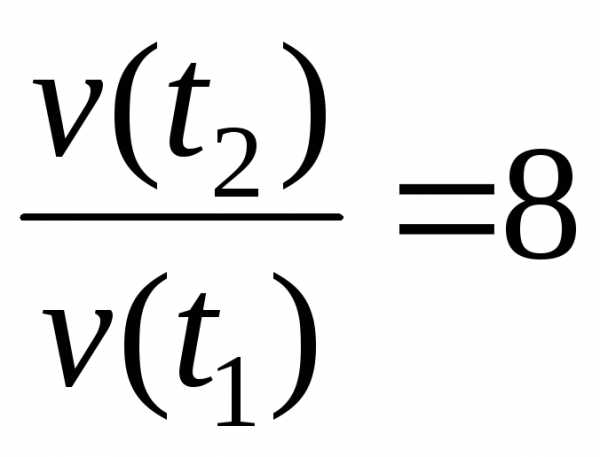 .
.
Следовательно, скорость реакции увеличится в 8 раз.
Более
точно зависимость скорости реакции от
температуры через зависимость константы
скорости от температуры передает теория
Аррениуса. Согласно этой теории,
зависимость константы скорости химической
реакции от температурыТдается уравнением
(3.7), которое называется уравнением
Аррениуса:
от температурыТдается уравнением
(3.7), которое называется уравнением
Аррениуса:
|
|
(3.7) |
где AиEa– константы, не зависящие от температуры, а зависящие только от природы реагентов.Величина A называется предэкспоненциальным множителем или частотным фактором, а величина Ea – энергией активации химической реакции.
Согласно Аррениусу, не все столкновения между частицами реагентов благоприятны образованию продуктов химической реакции. Для того чтобы между частицами реагентов произошла реакция, столкновения между ними, происходящие в результате теплового движения в реакционной системе, должны удовлетворять двум требованиям: энергетическому и пространственному.
Энергетическое требование. Благоприятны для протекания реакции только те столкновения между частицами, суммарная энергия столкновения которых не меньше некоторого минимального значенияEa, называемого энергией активации, которое зависит лишь от природы частиц реагентов (атомы, молекулы, ионы). Удобно эту величину приводить не в расчете на одну из частиц реагентов, а на моль частиц, что имеет место в уравнении Аррениуса (3.7). Выполнение энергетического требования необходимо, но не достаточно. Нужно, чтобы выполнилось и пространственное требование.
Пространственное требование.Среди всех столкновений между частицами реагентов, энергия столкновения которых не меньше, чемEa, благоприятны лишь такие, при которых взаимодействующие частицы сталкиваются между собой реакционными центрами. В уравнении Аррениуса это требование учитывается величиной предэкспоненциального множителяA, который тоже зависит только от природы реагентов, в том числе и от их пространственного строения. Свое название «частотный фактор» этот множитель получил потому, что согласно кинетическому уравнению реакции первого порядка размерность величиныAравна размерности константы скоростиkC, то есть с–1, что является размерностью частоты, в данном случае частоты столкновений.
Величину энергии активации можно рассчитать с помощью уравнения (3.8), вытекающего из уравнения Аррениуса (3.7), если известны значения констант скоростей химических реакций для двух разных температур Т1иТ2:
|
|
(3.8) |
где R– универсальная газовая постоянная, равная 8,314 Дж/мольК.
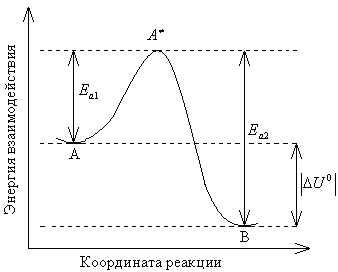
Рис. 3.1. Зависимость потенциальной энергии взаимодействия между веществами, участвующими в реакции, от координаты реакции
На рис.
3.1 изображена энергетическая схема
протекания реакции, упрощенно записанной
как А→В, гдеА– исходные
вещества,В– продукты реакции.
Здесь показана зависимость потенциальной
энергии взаимодействия между веществами– участниками реакции–от
координаты реакции. Исходные вещества
и продукты соответствуют минимумам
потенциальной энергии на графике.
Вершина кривой отвечает так называемому
переходному состоянию взаимодействующих
реагентов,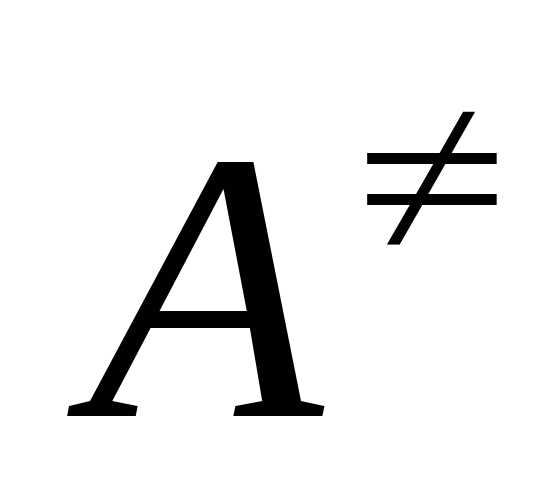 ,
или активированному комплексу. Величины
энергий активации
,
или активированному комплексу. Величины
энергий активации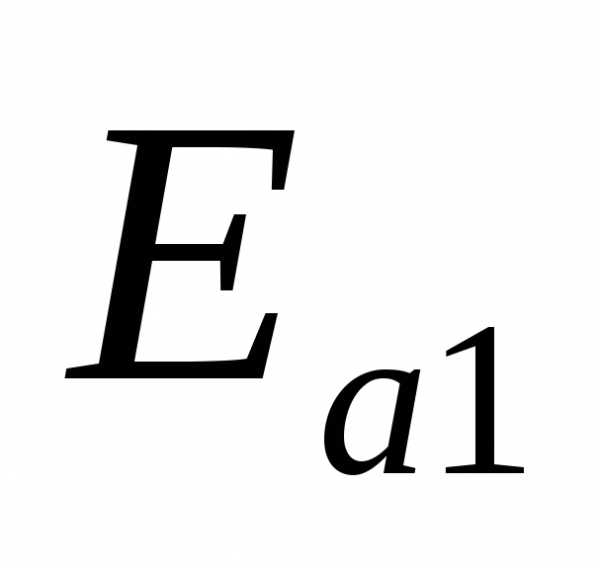 и
и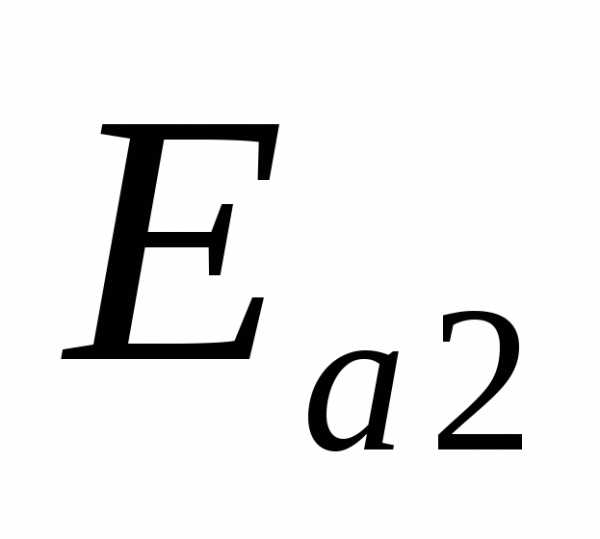 соответствуют протеканию прямой (вдоль
координаты реакции) и обратной (против
координаты реакции) реакций. Они
указывают, какой минимальной энергией
должны обладать взаимодействующие
вещества для протекания этих реакций.
На приведенной схеме прямая реакция
экзотермична (),
а обратная – эндотермична ().
соответствуют протеканию прямой (вдоль
координаты реакции) и обратной (против
координаты реакции) реакций. Они
указывают, какой минимальной энергией
должны обладать взаимодействующие
вещества для протекания этих реакций.
На приведенной схеме прямая реакция
экзотермична (),
а обратная – эндотермична ().
Пример 4.Рассчитайте энергию активации реакции, если константы скорости реакции при 273 и 283 К равны соответственно 410–5и 810–5c–1.
Решение
Из уравнения Аррениуса энергия активации равна:
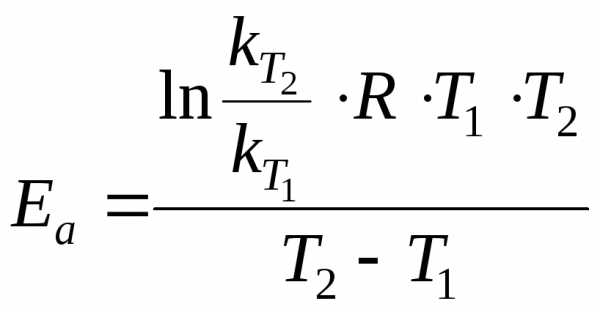 .
.
Подставив данные, получим:
studfiles.net
Билет 14. Зависимость скорости химической реакции от концентрации. Основной закон химической кинетики. Кинетическое уравнение и порядок реакции. Экспериментальное определение порядка реакции.
Для того чтобы реакция произошла, необходимо столкновение реагирующих частиц, чем выше концентрации веществ, тем чаще происходят столкновения, тем выше скорость химической реакции.
Основной закон химической кинетики — Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, называемых порядками реакции по соответствующим веществам.
Закон действующих масс: r = k*ПCi^ai. Порядок определяется экспериментально. Общий порядок реакции — сумма всех показателей степеней при концентрациях реагентов в кинетическом уравнении.
r=k*C(A)^a*C(B)^b*C(C)^y… a,b,y — порядки реакций по А, В, С. Для их определения необходимо изучить зависимость скорости реакции от концентрации каждого из реагентов по отдельности. Для этого ставят несколько опытов с различной концентрацией одного и того же реагента. все остальные берут в большом избытке. Например, чтобы определить порядок реакции а, измеряют скорость в зависимости от концентрации А, а В и С берут в избытке. Тогда r = k’*C(A)^a, где k’ = k*C(B)^b*C(C)^y в данной серии опытов является постоянной величиной.
Для порядка реакции необходимо измерить 2 значения скорости при двух разных концентрациях А С1 и С2: а = (lnr2 — lnr1)/(lnC2 — lnC1)
Для повышения точности желательно использовать результаты большего количества опытов, что позволит уменьшить влияние погрешности каждого отдельного измерения на результат. В этом случае порядок реакции можно определить графическим методом, поскольку логарифмирование выражения: lnr = lnK’ + alnC(A) дает уравнение прямой в координатах lnr — lnC(A), угловой коэффициент а — равен порядку реакции по компоненту А.
В практикуме мы делали опыты на определение порядка реакции разложения тиосерной кислоты (h3S2O3 = h3O + SO2 + S; r = k*C(h3S2O3)^a). Определяли порядок реакции по иодид-иону реакции окисления иодида калия пероксидом водорода в кислой среде (h3O2 + 2I- + 2H+ = I2 + 2h3O; r = k*C(h3O2)^a*C(I-)^b*C(H+)^y).
Билет 15. Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса, Энергетический профиль химической реакции. Экспериментальное определение Еа химической реакции (пример).
Скорость подавляющего большинства химических реакций возрастает при повышении температуры (но есть исключения: 2NO + O2 = 2NO2). Причиной этого является увеличение с ростом температуры доли активных молекул, имеющих достаточную энергию для того, чтобы вступить в реакцию.
Уравнение Аррениуса: k = A*e^(-Ea/RT). Eа — энергия активации, А — предэкспоненциальный множитель.
Энергия активации — минимальная избыточная энергия, которую необходимо иметь реагирующим молекулам, чтобы они могли вступить в химическую реакцию. При температуре Т доля молекул, имеющих энергию Еа или более равна e^(-Ea/RT). Поэтому с повышением температуры число активных молекул увеличивается, и возрастает скорость химической реакции
Кроме того, скорость зависит от частоты столкновений молекул реагентов (частотный фактор Z), а также от вероятности благоприятной ориентации молекул в пространстве при их столкновении (стерический фактор Р). Частотный и стерический факторы входят в предэкспоненциальный множитель и не очень сильно зависят от температуры
Правило Вант-Гоффа: при увеличении температуры на 10 градусов скорость реакции возрастает в 2-4 раза. r2 = r1*y^[(T2-T1)/10]
Активными являются молекулы, энергия которых превышает Еа. Чем меньше энергия активации, тем большее число молекул способно вступить при данной температуре в химическую реакцию. Чем больше энергия активации, тем сильнее ее скорость зависит от температуры
Энергетический профиль показывает, как изменяется энергия реагирующих молекула пути их превращения в продукты реакции. При взаимодействии молекул исходных веществ сначала образуется активированный комплекс [A…B], в котором старые связи в молекулах А и В уже отчасти разорваны, а новые еще не образовались. Энергия активированного комплекса больше энергии исходных молекул и продуктов, и на энергетическом профиле он соответствует вершине барьера, отделяющего исходные вещества от продуктов реакции. Образовывать активированный комплекс могут только молекулы, получившие в результате теплового движения дополнительную энергию, большую или равную Еа. Активированный комплекс существует непродолжительное время, после чего распадается, образуя частицы продуктов реакции. Активированный комплекс также называют переходным состоянием реакции (НЕ промежуточное вещество).
Экспериментальное определение энергии активации реакции проводят путем исследования зависимости константы скорости реакции от температуры в соответствии с уравнением Аррениуса, приводят его к виду lnk = lnA — Ea/RT, то есть к уравнению прямой в координатах lnk — 1/T, угловой коэффициент которой равен -Ea/R.
В практикуме мы определяли ЭА разложения тиосерной кислоты и окисления иодида калия пероксидом водород в кислой среде.
h3S2O3 = h3O + SO2 + S и h3O2 + 2I- + 2H+ = I2 + 2h3O
Билет 16. Катализ. Влияние катализатора на скорость химической реакции. Причины влияния. Гомо- и гетерогенный катализ. Автокатализ. Ферментативный катализ. Примеры практического использования катализатора для изменения скорости реакции. Ингибирование реакции.
Катализ – это явление ускорения химических реакций под действием малых количеств веществ (катализаторов), которые сами в процессе реакции не расходуются и после ее окончания остаются неизменными. Действие катализатора заключается в том, что он образует промежуточное соединение с реагирующими молекулами, которое потом распадается до продуктов реакции катализатора. Тем самым реакция направляется по более выгодному пути с меньшей энергией активации. Реакция:
А + В = С
Без катализатора протекает с энергией активации Ea. При введении в систему катализатора (Кат) реакция разбивается на две стадии: образование промежуточного соединения вещества А с катализатором: Кат + А = АКат и взаимодействие этого промежуточного соединения с В, в результате которого образуется продукт и исходный катализатор: АКат + В = С + Кат. Высвободившийся катализатор вновь связывается с А, и цикл многократно повторяется.
Схематически соотношения между энергиями активации реакции в присутствии катализатора и без него можно представить на энергетической диаграмме. В процессе каталитической реакции образуются два активированных комплекса, [A…Кат] и [A…Кат…В], с существенно меньшими энергетическими затратами, чем при образовании активированного комплекса [A…B] в отсутствие катализатора, поэтому каталитическая реакция идет с гораздо бошей скоростью при той же температуре.
Катализатор не только ускоряет реакцию, но и может направлять процесс по пути благоприятному для образования определенного продукта. Например, при взаимодействии CO и h3 в присутствии медно-цинкового катализатора практически единственным продуктом реакции является метанол, тогда как на никелевом катализаторе образуются метан и вода.
Катализатор и участники химической реакции могут находиться в одной фазе – гомогенный катализ (кислоты, основания, растворимые соли металлов). Если катализатор и участники реакции находятся в разных фазах и разделены поверхностью раздела – гетерогенный катализ (чаще всего катализатор – твердое вещество (Me и их оксиды), а реагенты газы или жидкости)
Примером гомогенного катализа является ускорение реакции разложения пероксида водорода в присутствии дихромат-ионов. Реакция происходит через образование промежуточного соединения с участием хрома, о чем свидетельствует изменение характерного для ионов Cr2O7 2- оранжевого цвета реакционной смеси на темно-синюю окраску промежуточного пероксидного комплекса хрома. По окончании реакции раствор вновь окрашивается в оранжевый цвет, так как промежуточные вещества распадаются и снова образуются дихромат-ионы.
При гомогенном процессе концентрация катализатора очень часто входит в кинетическое уравнение реакции: r = k*C^2(h3O2)*C(Cr2O7)
При гетерогенном катализе на скорость реакции влияют состояние поверхности катализатора, процессы диффузии реагентов к его поверхности, обратная диффузия продуктов и т.д. Примером гетерогенного катализа может служить реакция разложения перекиси водорода в присутствии кристаллического диоксида марганца. Поскольку при гетерогенном катализе реакция протекает на поверхности катализатора, в промышленности стремятся использовать катализаторы с максимально большой поверхностью. Обычно для этого добиваются путем создания пористых структур или используют катализатор в виде мелкодисперсном состоянии.
В реакциях отщепления и присоединения водорода катализаторами обычно являются металлы, способные хорошо растворять водород в совей кристаллической решетке, переводя его при этом в атомарное состояние (Pt, Pd, Ni). Реакции отщепления и присоединения воды катализируются высокопористыми оксидами Ме и неМе, способными временно присоединять к себе ионы Н+ и ОН- (Al2O3, SiO2, алюмосиликаты), реакции с участием кислорода ускоряются в присутствии оксидов Ме, способных изменять степень окисления (V2O5, MnO2).
Если химическая реакция ускоряется под действием образующихся в процессе реакции веществ, такой процесс называется автокаталитическим. Пример – окисление щавелевой кислоты перманганатом калия в присутствии серной кислоты:
2KMnO4 + 5h3C2O4 + 3h3SO4 = 2MnSO4 + K2SO4 + 8h3O + 10CO2
Сначала данная реакция идет очень медленно, однако, после того, как в реакционной смеси появляются ионы Mn2+, механизм реакции меняется. Ионы MnO4- быстро окисляют ионы Mn2+ до Mn3+
MnO4- + 4Mn2+ + 8H+ = 5Mn3+ + 2h3O
После чего ионы Mn3+ быстро взаимодействуют со щавелевой кислотой по схеме:
2Mn3+ h3C2O3 = 2Mn2+ + 2H+ + 2CO2
Поэтому по мере накопления ионов Mn2+ в реакционной смеси скорость реакции резко возрастает.
Практически все химические процессы, протекающие в живых организмах, ускоряются биокатализаторами – ферментами. Большинство известных ферментов имеют белковую природу. Реакция, катализируемая ферментом, протекает не в любом месте молекулы, а только в активном центре, состоящем из нескольких АК остатков. Эти остатки могут находиться в разных частях цепи, но благодаря тому, что белковая молекула определенным образом свернута в пространстве, они оказываются рядом. Помимо аминокислотных остатков, активный центр может содержать также ионы Ме, органические и неорганические и комплексные молекулы.
Каталитическая активность ферментов гораздо выше, чем обычных катализаторов. Высокая скорость ферментативных реакций обусловлена не только понижением энергии активации, но и благоприятной ориентацией молекул реагирующих веществ в активных центрах ферментов, что приводит к увеличению стерического фактора Р в уравнении Аррениуса.
Ферменты высокоспецифичны, то есть каждый из них ускоряет только реакцию определенного реагента. Специфичность ферментов связана с тем, что взаимодействие с активным центром фермента происходит, если форма точно молекулы соответствует форме активного центра.
Вещества, понижающие скорость химической реакции, называютсяингибиторами. Ингибирование не связано с повышением ее энергии активации. Роль ингибитора обычно сводится к разрушению или химическому связыванию активных частиц, являющихся промежуточными веществами в реакции. В гетерогенных реакциях, например, железа с соляной кислотой, ингибиторы обычно адсорбируются на активных участках поверхности, таких как дефекты кристаллической решетки, без участия которых реакция не может происходить.
Билет 17. Обратимые химические реакции. Скорость этих реакций. Кинетическое описание химического равновесия. Связь константы равновесия обратимой реакции с константами скоростей прямого и обратного процессов.
В начальный момент протекания обратимой реакции скорость прямой реакции имеет ненулевое значение, зависящее от исходных концентраций реагентов и константы скорости прямой реакции. Скорость же обратной реакции равна нулю, поскольку продукты прямой реакции, являющиеся для нее исходными веществами, в системе пока отсутствуют.
По ходу процесса скорость прямой реакции постепенно убывает из-за расходования исходных веществ, в то время как скорость обратной возрастает, благодаря накоплению продуктов. Когда эти скорости становятся одинаковыми, концентрации участников перестают меняться, т.е. в системе устанавливается равновесие. Т.О. кинетическим условием химического равновесия является равенство скоростей прямого и обратного процесса.
CO2,p + OH- <=> HCO3-
Известно, что как в прямом, так и в обратном направлении эта реакция идет в одну стадию, т.е. является элементарной, поэтому порядок реакции по каждому компоненту совпадает с его стехиометрическим коэффициентом в уравнении.
rпр = Кпр*С(СО2)*C(OH-)
rобр = Кобр*С(НСО3-)
Условием равновесия является равенство скоростей прямой и обратной реакций. Это равенство достигается при определенных (равновесных) концентрациях участников реакции.
rпр = rобр
Кпр*[CO2]*[OH-] = Kобр[НСО3-]
[HCO3-]/[CO2][OH-] = kпр/kобр = К
Поскольку константы имеют постоянные значения при заданной температуре, их отношение постоянно. Это отношение – константа равновесия данной реакции.
Произведение равновесных концентраций продуктов реакции, возведенных в степени, равные их стехиометрическим коэффициентам, к произведению концентраций исходных веществ, так же в степенях их стехиометрических коэффициентов, является постоянной для данной температуры величиной (константой равновесия реакции).
Химическое равновесие количественно характеризуется константой равновесия.
К = e^(-?rGo/RT)
K = kпр/kобр
kпр/kобр = e^(-?rGo/RT)
Численное значение константы равновесия указывает, что именно преобладает в реакционной смеси – исходные вещества или продукты реакции.
Если константа равновесия реакции существенно больше единицы, в равновесной смеси находится больше продуктов реакции, чем реагентов – равновесие смещено вправо. При константе намного меньше единицы, в состав реакционной смеси входят преимущественно исходные вещества – равновесие смещено влево.
Когда константа очень велика, количество остающихся в равновесной смеси исходных веществ может оказаться настолько незначительным, что их невозможно будет обнаружить – реакция практически необратима. (осаждение бромида серебра).
Реакции, константы которых очень малы, практически не идут.(2Fe2+ + I2 <=>2Fe3+ + 2I-)
Одним из признаков наличия в системе химического равновесия является то, что при изменении внешних условий равновесное состояние изменяется. Такое изменение называется смещением химического равновесия.
Говоря более точно, смещением химического равновесия называется изменение относительных количеств (концентраций) исходных веществ и продуктов реакции, происходящее в результате изменения внешних условий (температуры, давления) или количеств веществ, присутствующих в равновесной системе.
Рекомендуемые страницы:
lektsia.com
1. Скорость химической реакции.
96
Знание кинетики химических реакций необходимо при разработке технологии различных производственных процессов, их аппаратного оформления и изыскания возможности их интенсификации и автоматизации.
Кинетика также занимается изучением механизма химических реакций и разработкой теории химического взаимодействия (неформальная кинетика). Ввиду того, что химические процессы часто сопровождаются процессами растворения, адсорбции и другими физическими процессами, вопросы кинетики химических реакций тесно связаны с вопросами кинетики ряда физических процессов, например диффузии.
Количественно скорость химической реакции измеряется изменением концентрации продуктов реакции в единицу времени:
, (10.1)
где — средняя скорость химической реакции;
— изменение концентрации;
— промежуток времени.
В ходе химической реакции ее скорость непрерывно изменяется, поэтому истинная скорость химической реакции (v) в любой момент времени есть отношение бесконечно малого изменения концентрации dC к бесконечно малому изменению времени , в течении которого это изменение произошло:
, (10.2)
где знак “минус” относится к случаю уменьшения концентрации продукта в ходе химической реакции.
Следует помнить, что величины скоростей химических реакций, вычисленные по изменению концентраций различных продуктов химической реакции связаны между собой стехиометрическими коэффициентами.
Зависимость скорости химической реакции от концентрации ее продуктов выражается основным законом химической кинетики, сохранившем неточное название закона действующих масс. Он формулируется: “… скорость химической реакции в любой момент времени при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций берется в степени равной коэффициенту перед формулой этого вещества в уравнении химической реакции” (закон Гульдберга — Вааге, 1867 г.).
В аналитической форме записи закон Гульдберга — Вааге имеет вид:
, (10.3)
где k — константа скорости химической реакции.
Для химической реакции в произвольной форме записи
закон Гульдберга — Вааге дает:
— для прямой реакции;
— для обратной реакции;
k1 и k2 — константы скоростей прямой и обратной химических реакций соответственно.
Очевидно, что наблюдаемая или регистрируемая скорость химической реакции (v) вычислится:
v = v1 — v2. (10.4)
В ходе химической реакции концентрации исходных продуктов химической реакции уменьшаются и вместе с ними уменьшается и скорость прямой реакции. Одновременно растут концентрации конечных продуктов и, соответственно, скорость обратной реакции. Если v1 = v2, то v = 0 и наступает состояние химического равновесия:
, (10.5)
где kC — константа равновесия химической реакции, определенная ранее термодинамическим
методом.
Таким образом, в состоянии химического (термодинамического) равновесия процессы в системе, связанные с химическими реакциями не прекращяются, а непрерывно продолжаются во встречных направлениях с равными скоростями. Такое состояние называется еще состоянием динамического равновесия. Полученный вывод подтверждает тезис о том, что движение — единственно возможная форма существования материи.
2. Молекулярность и порядок химической реакции.
Химические реакции разделяются по признаку их молекулярности или по признаку порядка химической реакции.
Молекулярность химической реакции равна числу молекул (или других частиц), одновременным воздействием между которыми осуществляется элементарный акт химического превращения.
В зависимости от числа таких частиц различают моно (одно-) молекулярные, би (двух-) молекулярные и три (трех-) молекулярные реакции.
Мономолекулярные реакции — реакции разложения молекул:
I2 = 2I.
Для нее закон Гульдберга — Вааге дает:
.
К бимолекулярным реакциям относятся взаимодействия двух одинаковых или различных молекул:
Н2 + I2 = 2НI,
.
К тримолекулярным относятся реакции вида:
2NO + Н2 = N2O+Н2O (a)
или
Н2 + 2О2 = 2Н2O, (b)
для которых справедливы соотношения:
,
.
Молекулярность реакции — понятие теоретическое. Для того, чтобы знать молекулярность, нужно представлять, как именно протекает данная реакция, через взаимодействия каких молекул, через какие стадии.
В противоположность молекулярности порядок реакции — экспериментальная величина. Он связан с опытной зависимостью скорости данной реакции от концентрации исходных продуктов.
Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации и устанавливаемом экспериментально.
Для простых реакций, протекающих в полном соответствии с их стехиометрическим уравнением, порядок и молекулярность численно совпадают.
Причины несовпадения порядка реакции и ее молекулярности таковы.
А. Один из реагентов находится в большом избытке. Тогда в ходе реакции его концентрация изменяется незначительно и в уравнении закона Гульдберга — Вааге может быть принята постоянной.
В. Если данная реакция гетерогенная, то в зависимости от условий ее протекания порядок химической реакции изменяется.
С. Порядок каталитических реакций также может отличаться от молекулярности. Причина — сложный механизм таких реакций, не отражаемый стехиометрическим уравнением.
D. Наконец, для сложной реакции, протекающей в несколько стадий, характерно то, что основное влияние на скорость реакции может оказать какая-либо промежуточная стадия, которая и определит, в конечном итоге, порядок всей реакции.
Например, порядок реакции разложения пентаоксида азота
2N2O5 = 2N2O4 + O2,
казалось бы, должен быть равен двум.
Исследования показали, что реакция протекает в несколько стадий (результаты анализа химического состава газовой фазы):
N2O5 = N2O3 + O2, (1)
N2O3 = NO2 + NO, (2)
NO + N2O5 = 3NO2, (3)
4NO2 = 2 N2O4, (4)
причем стадия (1) является наиболее медленной, а поэтому и определяющей скорость всего процесса. Поэтому и суммарная реакция — бимолекулярная реакция первого порядка.
По признаку “порядок химической реакции” различают реакции нулевого, первого, второго и третьего порядков.
Если реакция протекает по нулевому порядку, то
,
отсюда
-dC = kd
и после интегрирования в интервале от С0 до С за время от 0 до :
С — С0 = -kС = С0 — k. (10.6)
Следовательно, в реакциях нулевого порядка концентрация линейно уменьшается со временем. Уравнение (10.6) — кинетическое уравнение реакции нулевого порядка.
Период полураспада (полупревращения) , равный времени, за которое концентрация исходного продукта уменьшается в два раза (С =) составит:
окончательно
. (10.7)
Константа скорости может быть найдена из (10.6):
. (10.8)
Выражение для скорости реакции первого порядка:
.
После разделения переменных и интегрирования от 0 до при изменении концентрации от С0 до С:
, (10.9)
и окончательно:
, (10.10)
. (10.11)
Подставляя , уравнение для расчета периода полураспада:
. (10.12)
Таким образом, для реакции первого порядка выполняются следующие закономерности: зависимость концентрации от времени экспоненциальная; зависимость логарифма концентрации от времени линейная; период полураспада не зависит от начальной концентрации.
При равенстве концентраций исходных продуктов реакции кинетические уравнения реакций второго и третьего порядков соответственно запишутся:
и .
После разделения переменных:
и ,
и после интегрирования:
и
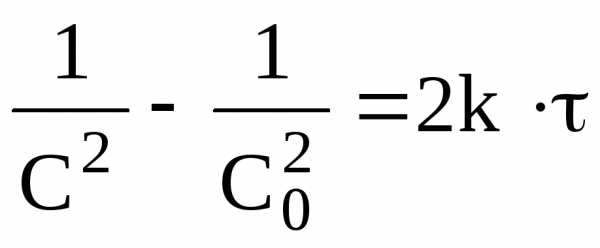 .
(10.13)
.
(10.13)
Из (10.13) для реакции второго порядка:
. (10.14)
Полагая, что для:
. (10.15)
Для реакции третьего порядка:
, (10.16)
. (10.17)
Таким образом для реакций второго порядка наблюдается линейная зависимость от времени (10.14), а период полураспада обратно пропорционален начальной концентрации.Для реакций третьего порядка наблюдается линейная зависимость от времени величины, обратной квадрату концентрации исходного продукта реакции. Период полураспада таких реакций обратно пропорционален квадрату начальной концентрации.
При интегрировании кинетических уравнений удобно обозначать концентрации реагентов с помощью изменения концентрации x одного из них в момент времени . Тогда x = C0 — C и уравнения (10.10 и (10.11) примут вид:
(10.18)
и
. (10.19)
Эти уравнения можно получить, составив кинетическое уравнение вида:
и проинтегрировав его в интервале от 0 до при изменении x от 0 до x.
Для реакции второго порядка кинетическое уравнение выглядит:
,
если .
Тогда с учетом :
.
Отсюда:
,
где а = С0’, a b = C0’’.
Далее после интегрирования:
и, наконец
. (10.20)
Для реакции третьего порядка, ограничиваясь случаем. когда две начальные концентрации одинаковы и равны а (С0’ = C0’’ = a), а третья начальная равна b (С0’’’ = b), уравнение для расчета константы скорости примет вид:
. (10.21)
studfiles.net

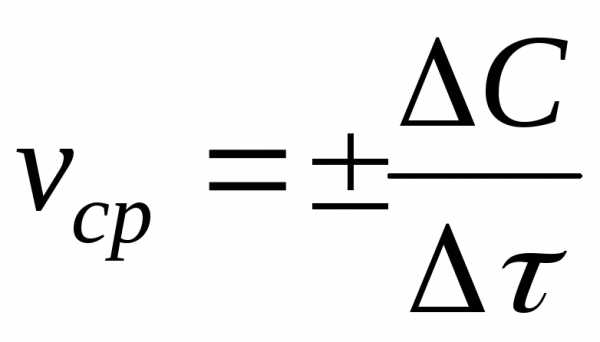 ,
,
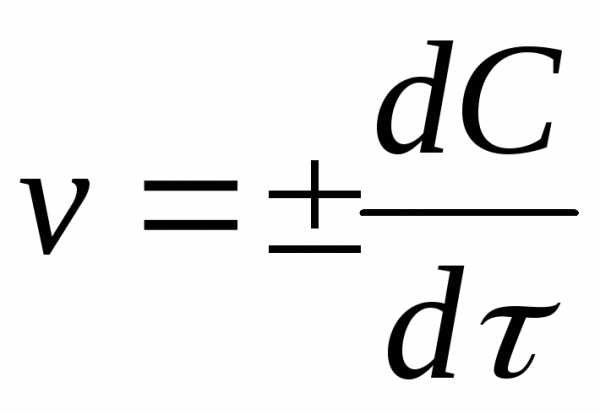 .
.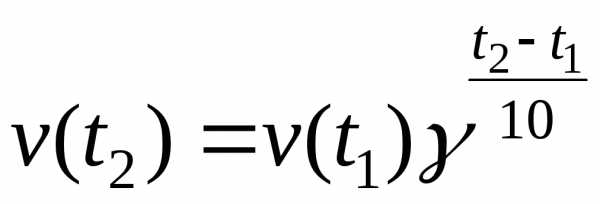 ,
,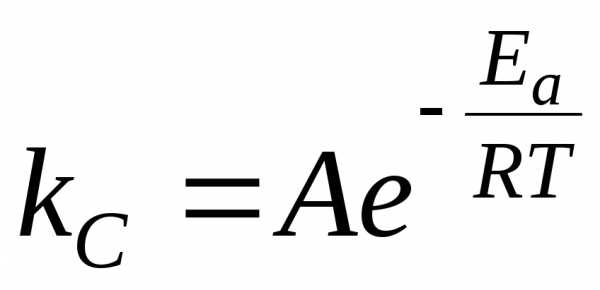 ,
,