Какая степень окисления у цинка?
Цинк – элемент IIВ группы Периодической системы Д.И. Менделеева. В своих соединениях он проявляет постоянную и положительную степень окисления равную (+2), например , , , , и др.
Цинк также может существовать в виде простого вещества – металла, а степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно (ответ на вопрос «какая степень окисления у цинка»).
В первой реакции происходит изменение степеней окисления у элементов цинк и сера, причем первый из них окисляется, а второй – восстанавливается. Схемы электронного баланса имеют следующий вид:
Во второй реакции происходит изменение степеней окисления у элементов цинк и азот, причем первый из них окисляется, а второй – восстанавливается. Схемы электронного баланса имеют следующий вид:
ZnSO4, степень окисления серы и др элементов
Общие сведения о сульфате цинка и степени окисления в ZnSO4
Брутто-формула – ZnSO4. Молярная масса сульфата цинка равна – 161,45 г/моль.

Рис. 1. Сульфат цинка. Внешний вид.
Хорошо растворяется в воде (гидролизуется по катиону). Реагирует с концентрированной серной кислотой, щелочами, гидратом аммиака. Вступает в реакции обмена и комплексообразования.
ZnSO4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав сульфата цинка, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Известно, что суммарная степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав кислоты и записывается со знаком минус. Сульфаты – это соли серной кислоты, брутто-формула, которой имеет вид H2SO4. В составе серной кислоты имеется два атома водорода, следовательно, степень окисления кислотного остатка (сульфат-иона) равна (-2): SO 42-.
Степень окисления кислорода в составе неорганических кислот, а, значит и их кислотных остатков, всегда равна (-2).Для нахождения степени окисления серы в сульфат ионе примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4×(-2) = -2;
x — 8 = -2;
x = +6.
Значит степень окисления серы в составе сульфат-иона равна (+6). Определим степень окисления цинка аналогичным способом:
y + (+6) + 4×(-2) = 0;
y + 6 – 8 = 0;
y -2 = 0;
y = +2.
Следовательно, степень окисления цинка равна (+2):
Zn+2S+6O-24.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Цинк — общая характеристика элемента, химические свойства цинка и его соединений
 Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d 104s2. В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO
3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2;
ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см
3, при температуре выше 125°С разлагается:
Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
himege.ru
Степени окисления цинка в технологиях производства и использование
Степень окисления цинка характеризует способность металла образовывать соединения в результате взаимодействия с реагентами. Это свойство используется при поиске, извлечении химического элемента из руды и промышленном производстве.

Цинк используется в промышленности и в медицине
Характеристика металла
Цинк принадлежит к группе цветных металлов и занимает по добыче третье место в мире, уступая только алюминию и меди. Хотя в мире наблюдается перепроизводство, добыча сырья непрерывно растет в связи с обширными потребностями применения в строительстве, химической промышленности и машиностроении.
Химический элемент № 30 — цветной металл, белого цвета с синим оттенком. Его плотность составляет 7,13 г/см3, а температура плавления — 419,5 °C. Ковким и эластичным он становится при разогреве до температуры 150— 200 °C.
С увеличением температурного градиента его можно преобразовать в порошок, а пары способны воспламеняться на воздухе с образованием густого дыма белого цвета, представляющего собой окись.
Добыча цинка
Химический элемент № 30 является достаточно распространенным на Земле. Он содержится в более чем 60 минералах, среди которых наиболее перспективными для добычи являются:
- вюрцит;
- сфалерит;
- цинкит;
- смитсонит;
- каламин.
Низкая концентрация в породе обусловливает переработку и обогащение руды непосредственно вблизи месторождения. Технология извлечения сырья из сульфидных руд предусматривает использование флотационного или гравитационного способа.

Добыча и переработка руды
Выплавка металла производится электролитическим или термическим способом.
Термическая обработка предполагает обжиг руды, предварительно измельченной и обогащенной.
В результате обжига образуется оксид. Концентрат подвергают спеканию с последующим восстановлением углем при температуре +1200 °C. Технология извлечения чистого материала постоянно совершенствуется, что минимизирует содержание второстепенных компонентов.
Основным способом добычи цинка, который применяется в промышленности, является электролитический.
Обогащенный концентрат руды обрабатывают серной кислотой с последующей очисткой раствора от примесей. Химически чистый компонент осаждается на алюминиевых катодах, а из отходов производства извлекают купорос.
В настоящее время добычу сырья осуществляет 50 стран. Крупнейший в мире цинковый рудник находится на Аляске в горах и эксплуатируется круглый год.
В связи с возрастающими потребностями промышленного производства в сырье, рассматриваются альтернативные источники его добычи, среди которых особое место занимают донные отложения океана.

Альтернативный источник добычи цинка
Технология извлечения химического элемента из руды постоянно усовершенствуется и позволяет повысить интенсивность разработки уже разведанных месторождений.
Окислительные реакции металла
Окисление цинка происходит на воздухе с образованием оксидной пленки, которая защищает поверхность от дальнейшего разрушения под влиянием реагентов и препятствует вытеснению водорода из воды.
Степенью окисления, которую проявляет химический элемент в соединениях, является +2.
- Цинк легко растворяется в разбавленных соляной и серной кислотах. В результате реакции происходит восстановление серной кислоты до серы или сероводорода.
- В результате реакции цинка с азотной кислотой образуются различные продукты восстановления кислоты.
- При взаимодействии цинка с раствором перманганата калия происходит обесцвечивание раствора.
- Реакция металла с ванадатом калия характеризуется восстановлением ванадия с последовательным изменением цвета раствора: желтый, синий, зеленый, фиолетовый.
- Металлический цинк растворяется в растворах щелочей с высокой концентрацией.
- Оксиды металла можно получить в результате термического разложения карбонатов и синтеза простых веществ.
- Соли цинка легко подвергаются гидролизу. В результате реакции металлического цинка с раствором хлорида металла, выделяется водород.
Применение цинка
Материал настолько прочно вошел в быт, что его часто можно не заметить в обыкновенных изделиях: водосточной трубе, ведре, инвентаре для сада и огорода, в патроне электрической лампочки и деталях машин.
- Использование цинка в качестве материала для покрытия изделий предотвращает коррозионные процессы и повышает устойчивость к механическим повреждениям и воздействию агрессивной среды.
- Цинк используют для формирования металлических сплавов, самым известным из которых является латунь. Для ее изготовления используется 20% добытого сырья.
- Цинк является сырьем для химической промышленности. Его используют для изготовления гальванических батарей, минеральных красок, очистки растворов.
- Половина добытого в мире металла используется для нанесения защитных покрытий, и только 15% используется для изготовления исключительно цинковых изделий.
- Химический элемент № 30 является важным минералом, обеспечивающим нормальное функционирование организма, поэтому его используют в фармакологии для изготовления витаминных комплексов.
Похожие статьи
ometallah.com
Цинк и Титан Степень окисления
 Цинк и Титан
Цинк и Титан
 • Степень окисления: +2; 0 • Степень окисления: +2; +4; 0 ; +3 (редко)
• Степень окисления: +2; 0 • Степень окисления: +2; +4; 0 ; +3 (редко)
 • Голубовато — серебристый металл. • Хрупкий • Хорошо прокатывается в листы (при 100 -150 °С) • Плавится при 419, 5 ° С • Серебристо-белый. • Легкий, немного тяжелее Al • Тугоплавкий (1665 °С) • Прочный и вязкий • Поддается различным видам обработки
• Голубовато — серебристый металл. • Хрупкий • Хорошо прокатывается в листы (при 100 -150 °С) • Плавится при 419, 5 ° С • Серебристо-белый. • Легкий, немного тяжелее Al • Тугоплавкий (1665 °С) • Прочный и вязкий • Поддается различным видам обработки
 • Цинк встречается только в виде соединений: • Zn. S – цинковая обманка • Zn. CO 3 – цинковый шпат • Титановые руды распространены широко, но содержание в них титана невелико: • Fe. Ti. O 3 • n. Fe 2 O 3– титаномагнетит • Fe. Ti. O 3 – ильменит • Ti. O 2 — рутил
• Цинк встречается только в виде соединений: • Zn. S – цинковая обманка • Zn. CO 3 – цинковый шпат • Титановые руды распространены широко, но содержание в них титана невелико: • Fe. Ti. O 3 • n. Fe 2 O 3– титаномагнетит • Fe. Ti. O 3 – ильменит • Ti. O 2 — рутил
 • Получение Цинка: 2 Zn. S + 3 O 2 → 2 Zn. O + 2 SO 2↑ Zn. CO 3 → Zn. O + CO 2↑ Zn. O + C → Zn + CO • Получение Титана: • Руды обогащают. Хлорируют рудные концентраты с последующим восстановлением магнием. Ti. O 2 + 4 HCl → Ti. Cl 4 + 2 H 2 O↑ Ti. Cl 4 + 2 Mg → Ti + 2 Mg. Cl 2 • Для выделения чистого титана образующуюся смесь нагревают в вакууме. При этом магний и хлорид магния испаряются.
• Получение Цинка: 2 Zn. S + 3 O 2 → 2 Zn. O + 2 SO 2↑ Zn. CO 3 → Zn. O + CO 2↑ Zn. O + C → Zn + CO • Получение Титана: • Руды обогащают. Хлорируют рудные концентраты с последующим восстановлением магнием. Ti. O 2 + 4 HCl → Ti. Cl 4 + 2 H 2 O↑ Ti. Cl 4 + 2 Mg → Ti + 2 Mg. Cl 2 • Для выделения чистого титана образующуюся смесь нагревают в вакууме. При этом магний и хлорид магния испаряются.
 Химические свойства (цинк) • Взаимодействие с простыми веществами. • Zn + Cl 2 → Zn. Cl 2 • 2 Zn + O 2 → 2 Zn. O • Zn + S → Zn. S • Взаимодействие со сложными веществами. • Zn + 2 Na. OH → Na 2 Zn. O 2 + H 2 • Zn + 2 Na. OH + 2 H 2 O → Na 2[Zn(OH)4] + H 2 • Zn + H 2 O → Zn. O + H 2 (при нагревании)
Химические свойства (цинк) • Взаимодействие с простыми веществами. • Zn + Cl 2 → Zn. Cl 2 • 2 Zn + O 2 → 2 Zn. O • Zn + S → Zn. S • Взаимодействие со сложными веществами. • Zn + 2 Na. OH → Na 2 Zn. O 2 + H 2 • Zn + 2 Na. OH + 2 H 2 O → Na 2[Zn(OH)4] + H 2 • Zn + H 2 O → Zn. O + H 2 (при нагревании)
 Химические свойства (титан) • Благодаря оксидной пленки, титан стоек против коррозии. При обычных условиях на Ti не действуют ни кислород воздуха, ни морская вода, ни «царская водка» . • При нагревании его химическая активность повышается. • Ti + 2 Cl 2 → Ti+4 Cl 4 • Ti + O 2 → Ti+4 O 2 (при нагревании) • Азотная кислота на титан не действует, а с разбавленной серной реагирует. • 2 Ti + 3 H 2 SO 4 → Ti 2+3(SO 4)3 + 3 H 2
Химические свойства (титан) • Благодаря оксидной пленки, титан стоек против коррозии. При обычных условиях на Ti не действуют ни кислород воздуха, ни морская вода, ни «царская водка» . • При нагревании его химическая активность повышается. • Ti + 2 Cl 2 → Ti+4 Cl 4 • Ti + O 2 → Ti+4 O 2 (при нагревании) • Азотная кислота на титан не действует, а с разбавленной серной реагирует. • 2 Ti + 3 H 2 SO 4 → Ti 2+3(SO 4)3 + 3 H 2
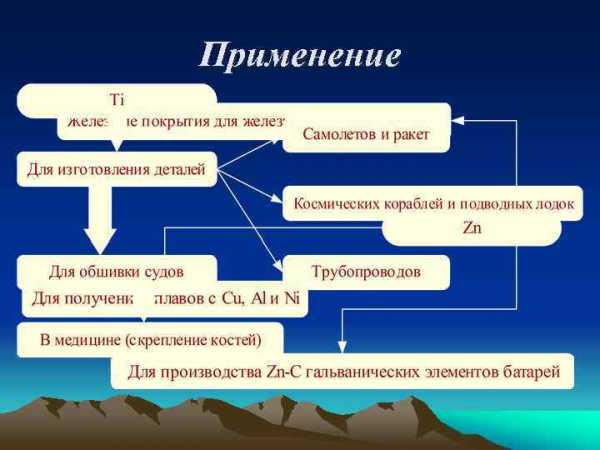 Применение
Применение
 Домашнее задание • § 24, 25, повторить § 23 • Стр. 118 упр. 6.
Домашнее задание • § 24, 25, повторить § 23 • Стр. 118 упр. 6.
present5.com
