Перечень типовых расчетных задач по химии
Поиск ЛекцийПРОГРАММА
ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ
ПО ХИМИИ
ДЛЯ ПОСТУПАЮЩИХ НА НАПРАВЛЕНИЕ «ХИМИЯ»
 |
Калининград
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ
1. Предмет и задачи химии. Явления физические и химические. Место химии среди естественных наук. Химия и экология.
2. Основы атомно-молекулярного учения. Понятия атома, молекулы, элемента, вещества. Относительная атомная и относительная молекулярная массы. Моль — единица количества вещества. Молярная масса. Стехиометрия: закон сохранения массы вещества и постоянства состава. Закон Авогадро, молярный объем, уравнение Менделеева — Клапейрона. Относительная плотность газа.
3. Химические элементы. Знаки химических элементов, формулы химических соединений. Простое вещество. Сложное вещество. Аллотропия. Валентность и степень окисления. Составление химических формул по валентности элементов и атомных групп.
4. Строение атома. Атомное ядро. Изотопы — разновидность атомов химических элементов. Ядерные превращения.
5. Строение электронных оболочек атомов. Электронные конфигурации атомов в основном и возбужденном состояниях.
6. Открытие Д. И. Менделеевым периодического закона и создание периодической системы химических элементов. Современная формулировка периодического закона. Строение периодической системы: большие и малые периоды, группы и подгруппы. Зависимость свойств элементов и образуемых ими соединений от положения элемента в периодической системе.
7. Виды химической связи: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Механизмы образования и примеры соединений. Понятие о гибридизации орбиталей.
8. Агрегатные состояния веществ. Типы кристаллических решеток. Зависимость свойств простых и сложных веществ от типа химической связи и кристаллической решетки.
9. Классификация химических реакций: реакции соединения, разложения, замещения, обмена. Примеры других классификаций.
10. Тепловые эффекты химических реакций. Термохимические уравнения.
11. Скорость химических реакций. Зависимость скорости реакции от природы и концентрации реагирующих веществ, температуры. Катализ и катализаторы.
12. Обратимость химических реакций. Химическое равновесие и условия его смещения, принцип Ле Шателье.
13. Растворы. Растворимость веществ. Зависимость растворимости веществ от их природы, температуры и давления. Способы выражения концентрации растворов (массовая доля, молярная концентрация).
14. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Условия протекания реакций в растворах электролитов. Ионные уравнения реакций. Свойства кислот, солей и оснований в свете теории электролитической диссоциации Аррениуса.
15. Окислительно-восстановительные процессы. Составление уравнений окислительно-восстановительных реакций. Электрохимический ряд напряжений металлов. Электролиз расплавов и растворов, законы электролиза.
Неорганическая химия
1. Основные классы неорганических веществ, их названия (номенклатура), генетическая связь между ними.
2. Оксиды. Способы получения, свойства оксидов.
3. Основания, способы получения, свойства. Щелочи, их получение, свойства, применение.
4. Кислоты, их классификация, общие свойства, способы получения.
5. Соли, их состав, химические свойства, способы получения. Гидролиз солей.
6. Металлы, их положение в периодической системе. Физические и химические свойства. Основные способы получения. Металлы и сплавы в технике.
7. Общая характеристика щелочных металлов. Оксиды и соли щелочных металлов. Калийные удобрения.
8. Общая характеристика элементов главной подгруппы II группы периодической системы химических элементов. Кальций и его соединения. Жесткость воды и ее устранение.
9. Общая характеристика элементов главной подгруппы III группы периодической системы химических элементов. Алюминий. Амфотерность оксида и гидроксида алюминия.
10. Железо, его оксиды и гидроксиды, зависимость свойств от степени окисления железа. Химические реакции, лежащие в основе получения чугуна и стали. Роль железа и его сплавов в технике.
11. Водород, его взаимодействие с металлами, неметаллами, оксидами, органическими соединениями.
12. Кислород, его аллотропные модификации. Свойства озона. Оксиды и пероксиды.
13. Вода, строение воды. Физические и химические свойства. Пероксид водорода. Кристаллогидраты.
14. Общая характеристика галогенов. Галогеноводороды. Галогениды. Кислородсодержащие соединения хлора.
15. Общая характеристика элементов главной подгруппы четвертой группы периодической системы химических элементов. Сера. Сероводород. Сульфиды. Оксиды серы (IV) и (VI), получение, производство серной кислоты.
16. Общая характеристика элементов главной подгруппы V группы периодической системы химических элементов. Азот. Аммиак, его промышленный синтез. Соли аммония. Нитриды. Оксиды азота. Азотная и азотистая кислоты и их соли. Азотные удобрения.
17. Фосфор, его аллотропные модификации. Оксид фосфора (V), орто-, мета- и дифосфорная кислоты и их соли. Фосфорные удобрения.
18. Общая характеристика элементов главной подгруппы IV группы периодической системы химических элементов. Углерод, его аллотропные модификации. Оксиды углерода. Угольная кислота и ее соли. Карбиды кальция и алюминия.
19. Кремний. Оксид кремния (IV). Кремниевая кислота и ее соли.
Органическая химия
1. Теория химического строения органических соединений А. М. Бутлерова. Зависимость свойств веществ от их строения. Виды изомерии. Природа химической связи в молекулах органических соединений, гомо-, гетеролитические способы разрыва связей. Понятие о свободных радикалах и ионах.
2. Предельные углеводороды (алканы и циклоалканы), их электронное и пространственное строение. Номенклатура. Изомерия.
3. Этиленовые углеводороды (алкены), их электронное и пространственное строение (s- и p-связи). Номенклатура, изомерия. Правило Марковникова. Сопряженные диеновые углеводороды, особенности их химических свойств.
4. Ацетиленовые углеводороды (алкины), их электронное и пространственное строение (s- и p-связи). Номенклатура.
5. Ароматические углеводороды (арены). Бензол, электронное и пространственное строение. Гомологи бензола. Понятие о взаимном влиянии атомов на примере толуола (реакции ароматической системы и углеводородного радикала).
6. Природные источники углеводородов: нефть, природный и попутный нефтяной газы, уголь. Перегонка нефти. Крекинг. Продукты, получаемые из нефти, их применение.
7. Спирты. Первичные, вторичные и третичные спирты. Номенклатура, строение, химические свойства одноатомных спиртов. Промышленный синтез этанола. Многоатомные спирты, номенклатура, особые свойства (этиленгликоль, глицерин).
8. Фенол, его строение, взаимное влияние атомов в молекуле. Химические свойства фенола, сравнение со свойствами алифатических спиртов.
9. Альдегиды. Номенклатура, строение, физические и химические свойства, Особенности карбонильной группы. Муравьиный и уксусный альдегиды, их получение, применение.
10. Карбоновые кислоты. Номенклатура, строение, физические и химические свойства. Взаимное влияние карбоксильной группы и углеводородного радикала. Предельные, непредельные и ароматические кислоты. Примеры кислот: муравьиная (ее особенности), уксусная, стеариновая, бензойная. Оксикислоты. Примеры оксикислот: молочная, винная, салициловая.
11. Сложные эфиры. Строение, химические свойства. Реакция этерификации. Жиры, их роль в природе, химическая переработка жиров (гидролиз, гидрирование).
12. Углеводороды. Моносахариды: глюкоза и фруктоза. Олигосахариды: мальтоза и сахароза. Полисахариды: крахмал и целлюлоза. Их строение, физические и химические свойства, роль в природе.
13. Амины. Алифатические и ароматические амины. Взаимное влияние атомов на примере анилина. Первичные, вторичные и третичные амины.
14. Аминокислоты. Строение, химические свойства, изомерия. Альфа-аминокислоты — структурные единицы белков. Пептиды. Строение, биологическая роль белков.
15. Пиррол. Пиридин. Пиримидиновые и пуриновые основания, входящие в состав нуклеиновых кислот. Представление о структуре нуклеиновых кислот.
16. Реакции полимеризации и поликонденсации. Общие понятия химии высокомолекулярных соединений (ВМС): мономер, полимер, элементарное звено, степень полимеризации (поликонденсации). Примеры различных типов ВМС.
Расчетные задачи
Экзаменационные билеты могут содержать как типовые, так и комбинированные задачи, состоящие из нескольких типов перечисленных выше расчетных задач. Кроме того, комбинированные задачи могут быть составлены по материалам различных разделов химии.
Для решения задач по химии необходимо знание не только химии, но и математики. После составления уравнений химических реакций нужно провести расчеты по этим химическим уравнениям. Для того чтобы решить математическую часть задачи, необходимо не только знать законы и основные формулы, но и уметь ими пользоваться.
В решении задачи указываются все используемые формулы и величины и поясняется ход решения. При оформлении задачи в произвольной форме дается краткая запись условия. Для окислительно-восстановительных реакций приводится электронный баланс, для реакций электролитов в растворах дается ионное уравнение. В химическом уравнении указываются все условия проведения химической реакции (нагрев, катализаторы) и явления, сопровождающие химическую реакцию (выделение газа, выпадение осадка, выделение тепла). Придерживайтесь разумной точности вычислений. Значения молярных масс округляются до целых величин (за исключением молярной массы хлора).
Перечень типовых расчетных задач по химии
1. Вычисление относительной молекулярной массы вещества по его формуле.
2. Вычисление массовых долей (процентного содержания) элементов в сложном веществе по его формуле.
3. Вычисление массовой доли растворенного вещества в растворе, если известна масса растворенного вещества и масса раствора.
4. Вычисление массы растворителя и массы растворенного вещества по известной массовой доле растворенного вещества и массе раствора.
5. Вычисление массы определенного количества вещества.
6. Вычисление количества вещества (в моль) по массе вещества.
7. Вычисление относительной плотности газообразных веществ.
8. Вычисление объема определенного количества газообразного вещества при любых заданных условиях.
9. Вычисление массы газообразного вещества, занимающего определенный объем, при любых заданных значениях температуры и давления.
10. Вычисление объема определенной массы газообразного вещества при любых заданных условиях.
11. Нахождение простейшей химической формулы вещества по массовым долям элементов.
12. Вычисление массы продукта реакции по известным массам исходных веществ.
13. Вычисление массы продукта реакции по известной массе одного из вступивших в реакцию веществ.
14. Вычисление выхода продукта реакции в процентах от теоретически возможного.
15. Вычисление массы (объема) продукта реакции по известной массе (объему) исходного вещества, содержащего определенную долю примесей.
16. Вычисление массовой доли компонентов смеси на основе данных задачи.
17. Установление молекулярной формулы газообразного вещества по продуктам сгорания.
Рекомендуемые страницы:
poisk-ru.ru
Образцы решения задач по химии.





ВНИМАНИЕ!!!
УЧАЩИЕСЯ 9 КЛАССОВ!!!
Для успешной сдачи экзамена по химии в некоторых билетах вам необходимо будет решить задачу. Предлагаем вам рассмотреть, разобрать и закрепить в памяти решение типовых задач по химии.
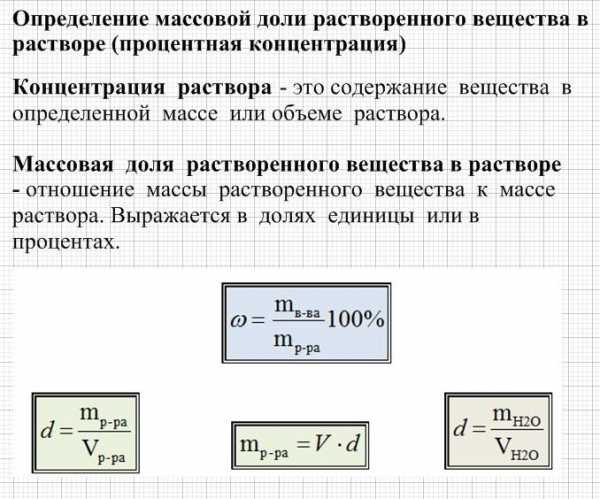
Задача на вычисление массовой доли вещества, находящегося в растворе.
В 150 г воды растворили 50г фосфорной кислоты. Найдите массовую долю кислоты в полученном растворе.
Записываем известные величины в условие задачи.
Дано: m(h3O) = 150г, m(h4PO4) = 50г
А так же записываем, что нам необходимо найти в результате решения задачи.
Найти : w (h4PO4) — ?
Приступаем к решению задачи.
Решение: 1). Находим массу получившегося раствора. Для этого просто сложим массу воды и массу прилитой к ней фосфорной кислоты.
m(раствора) = 150г + 50 г = 200 г
2). Для решения нам необходимо знать формулу массовой доли. Записываем формулу массовой доли вещества в растворе.
w (вещества) = * 100%
Подставляем в формулу массу фосфорной кислоты из условия задачи и рассчитанную массу раствора. и производим математические подсчеты.
w (h4PO4) = * 100%= 25%
Записываем ответ.
Ответ: w (h4PO4) =25%
Задача на вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Вычислите количество вещества железа, которое получится в результате взаимодействия водорода с 480г оксида железа(III).
Записываем известные величины в условие задачи.
Дано: m(Fe2O3) = 4
Так же записываем, что необходимо найти в результате решения задачи.
Найти : n (Fe) — ?
Приступаем к решению задачи.
Решение: 1). Для решения подобных задач сперва нужно записать уравнение реакции, описанной в условии задачи.
Fe2O3 + 3 h3 2Fe + 3h3О
2). Затем запишем формулу количества вещества.
n = , где n- количество вещества, m — масса этого вещества, а M — молярная масса вещества.
По условию задачи нам не известна масса получившегося железа, т. е. в формуле количества вещества нам неизвестны две величины. Поэтому мы будем искать количество вещества по количеству вещества оксида железа (III). Количества вещества железа и оксида железа(III) следующим отношением.
= ;где 2- стехиометрический коэффициент из уравнения реакции, стоящий перед железом, а 1 – коэффициент, стоящий перед оксидом железа(III).
отсюда n (Fe)= 2 n (Fe2O3)
3). Находим количество вещества оксида железа(III).
n (Fe2O3) = = 3 моль, где 480г – масса оксида железа (III), 160 – молярная масса оксида железа (III), которую мы вычисляем на основании относительных атомных масс железа и кислорода, а также учитывая количество этих атомов в оксиде железа (III): М(Fe2O3)= 2х 56 + 3х 16=112 + 48 = 160
4). Находим количество вещества железа, получившегося в ходе реакции.
n (Fe) = 2 : 3 моль = 6 моль
Запишем ответ.
Ответ: n (Fe) = 6 моль
Задача на вычисление объема полученного газа, если известна масса исходного вещества.
Какой объем водорода образуется при взаимодействии соляной кислоты с 54 г алюминия?
Записываем условие задачи.
Дано: m(Al) = 54г
А так же записываем, что нам необходимо найти в результате решения задачи.
Найти : V (h3) — ?
Приступаем к решению задачи.
Решение: 1) записываем уравнение реакции по условию задачи.
2 Al + 6 HCl 2 AlCl3 +3 h3
2). Запишем формулу объема вещества.
V = Vm *n, где V – объем вещества, Vm — молярный объем газа при нормальных условиях (н. у.) величина постоянная и равная 22, 4 *n — количество вещества данного газа.
V (Н2) = Vm * n (Н2)
3). Но в этой формуле нам неизвестно количество вещества водорода.
4). Найдем количество вещества водорода по количеству вещества алюминия по следующему соотношению.
= ; отсюда n (h3) = 3 n (Al): 2 , где 3 и 2 – стехиометрические коэффициенты, стоящие соответственно перед водородом и алюминием.
5). Найдем количество вещества алюминия по формуле количества вещества n =
n (Al) =
n (Al) = = 2 моль
6). А теперь высчитаем получившееся в ходе реакции количество вещества водорода по формуле n (h3) = 3 n (Al).
n (h3) = 3 х 2= 6 моль
7). Найдем полученный объем водорода по формуле V (Н2) = Vm * n (Н2)
V (Н2) =22, 4 * 6 моль= 134 ,4 л
Запишем ответ.
Ответ: V (Н2) =134 ,4 л
Задача на вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
Какое количество вещества кислорода потребуется для взаимодействия с 8 моль водорода при нормальных условиях?
Запишем условия задачи.
Дано: n (h3) = 8моль
А так же запишем, что необходимо найти в результате решения задачи.
Найти : n(O2) — ?
Приступаем к решению задачи.
Решение: 1). Запишем уравнение реакции, следуя условию задачи.
2 h3 + О2 2 h3О
2). Количество вещества водорода и количество вещества кислорода связывает следующее соотношение :
= ; где 2 и 1 – стехиометрические коэффициенты, стоящие перед водородом и кислородом соответственно в уравнении реакции.
3). Отсюда 2 n (O2)= n (h3)
А количество вещества кислорода равно : n (O2)= n (h3):2
4). Нам остается подставить в полученную формулу данные из условия задачи.
n (О2) = 8моль :2 = 4 моль
5). Запишем ответ.
Ответ: n (О2) = 4 моль
infourok.ru
Задачи по химии
Решение расчетных задач
Тема: Расчеты по химическим формулам
Задача №1. Определить массу бертолетовой соли, необходимой для получения 2,5 моль кислорода.
Дано: Решение:
n(O2) = 2,5 моль M(KClO3)= 39+35,5+16*3=122,5 г/моль.
m(KClO3)=? 1) Расчет по уравнению реакции
t
2KClO3 2KCl + 3O2
2моль 3 моль
По уравнению: 2 моль:2 моль
По условию: х моль:2,5 моль
2моль 3 моль 2 моль* 2,5 моль
х моль = 2,5 моль, х= 3 моль = 1,7 моль
m(KClO3)
n(KClO3) = M (KclO3) ; m(KClO3)=n(KClO3)*M (KclO3)=
= 1,7 моль*122,5 г/моль= 208,3 г.
Ответ: m(KClO3)=208,3 г.
Задача №2. Какое количество вещества меди образуется при восстановлении водородом 16 г оксида меди (Ⅱ)
Дано: Решение:
m(CuO)= 16г 1) определить количество данного вещества
n(Cu)=? m(CuO) 16 г
n(CuО) = М(CuO) = 80 г/моль = 0,2 моль
М(CuO)= 64+16=80 г/моль
2) расчет по уравнению реакции
t
CuO+H2 → Cu+ H2O
по уравнению: 1 моль (CuO) : 1 моль (Cu)
по условию: 0,2 моль (CuO) : х моль (Cu)
0,2 моль*1 моль
х= 1 моль = 0,2 моль
Ответ: n(Cu) = 0,2 моль.
Тема: Расчеты по уравнениям химической реакции.
Задача №1. В тигле сожгли порошок магния, в результате реакции масса тигля уыеличилась на 0,4 г. Сколько граммов оксида магния образовалось в результате реакции? Сколько граммов магния подверглось окислению?
Дано: Решение:
∆m =0,4 г 2 Mg+ O2 = 2 MgO
m(MgO)=? Из уравнения видно, что изменение массы магния происходит за счет его
m(Mg) — ? соединения с кислородом. Поэтому ∆m = m(O2) = 0,4 г.
1 способ: у г 0,4 г х г
2 Mg+ O2 = 2 MgO
2 моль 1 моль 2 моль
M(Mg) = 24 г/моль M(O2)=32 г/моль M(MgO)=24+16=40 г/моль
m(Mg)=n*M =48 г m(O2)=32 г m(MgO)=n*M=80 г
у г 0,4 г х г
48 г = 32 г = 80 г
у=0,6 г; х = 1 г или х=0,6+0,4=1 г.
2 способ: 2 Mg+ O2 = 2 MgO
2 моль 1 моль 2 моль
M(Mg) = 24 г/моль
n(O2)= m:M = 0,4г : 32 г/моль = 0,0125 моль
n(Mg)=n(MgO)=0,025 моль
M(MgO)=24+16=40 г/моль
m(MgO)=n*M=0,025 моль*40 г/моль= 1г
m(Mg)=0,025 моль*24 г/моль=0,6г
Ответ: m(MgO)=1г, m(Mg)= 0,6г
Тема: Закон Авогадро и следствия из него. Количество вещества, молярный объем.
Задача№1 Плотность по водороду пропан-бутановой смеси равна 23,5. Чему равен состав смеси (% объемн.) пропана и бутана?
Дано: Решение:
D(H2)(C3H8+C4H10)=23,5 1) M(смеси)=DH2 (смеси)*M(H2) = 23,5 * 2г/моль=47 г/моль
φ (C3H8) -? 2) Пусть n(C3H8) = x моль, тогда n(C4H10) = (1-х) моль
φ (C4H10) -? 3) Составляем уравнение:
М(C3H8) * n(C3H8) + М(C4H10) * n(C4H10) = M(смеси)
44*х+58*(1-х)=47 => х = 0,786 => n(C3H8) = 0,786 моль
n(C4H10) = 1-0,786=0,214 моль
4) Согласно следствию из закона Авогадро, отношение объемов
двух газов равно отношению их количеств веществ, поэтому:
V(газа) / V(смеси) = n(газа) / n(смеси) => φ (C3H8)= n(C3H8) /
n(C3H8)=0,786/1=0,786, или 78,6%
φ (C4H10)=1-φ (C3H8)=1-0,786=0,214, или 21,4%
Ответ: φ (C3H8)=78,6%, φ (C4H10)=21,4%
Задача№2. Вычислить объем водорода, необходимый для синтеза аммиака, если в реакцию вступает 89,6 л азота.
Дано: Решение:
V (N2)=89,6 л 1. определить количество данного вещества
V(H2) = ? Vm=22,4 л/моль 89,6x
n(N2)=V (N2): Vm= 22,4х/моль = 4 моль
2. расчет по уравнению реакции:
N2 + 3H2 →← 2 NH3
по уравнению: 1 моль:3 моль
по условию: 4 моль:х моль
1 моль:4 моль=3 моль:х моль
х(H2)=12 моль
V(H2) = n(N2)* Vm=12моль*22,4 л/моль=268,8 л
Ответ: V(H2)= 268,8 л.
Тема: Расчеты по уравнениям реакции, если реагенты содержат примеси, если известен выход одного из продуктов реакции. Расчеты по термохимическим уравнениям.
Задача№1 Определите количество вещества оксида углерода (IV), образовавшегося при разложении известняка массой 512,8 г. Массовая доля примесий в известняке составляет 22%.
Дано: Решение:
m(известн.)=512,8г m(известн.)=m(CaCO3,пр)=512 г
Ѡ(пр.)=22%=0,22 Ѡ(пр.)=m(прим) : m(CaCO3,пр), откуда
n(CO2) = ? m(прим)=Ѡ(пр.)*m(CaCO3,пр)=0,22*512,8 г=112,8 г
m(CaCO3) = m(CaCO3,прим) -m(прим)=512,8-112,8=400г
n(CaCO3) = m(CaCO3) : M(CaCO3) = 400г : 100 г/моль=4 моль
M(CaCO3) = 40+12+16*3=100г/моль
Расчет по уравнению реакции
t
CaCO3 → CaO+CO2
по уравнению: 1 моль(CaCO3):1 моль(CO2)
по условию: 4 моль:х моль
1 моль:4 моль=1 моль:х моль
х(CO2)=4 моль
Ответ: n(CO2)=4 моль
Задача№2. Определить массу нитробензола, вступившего в реакцию с водородом, если в результате получили 116,5 г анилина. Выход продукта составляет 80% от теоретически возможного.
Дано: Решение:
mпр(С6H5NH2)=116,5 г 1. определим теоретическую массу анилина.
W(С6H5NH2)=80%=0,8 W(С6H5NH2)=mпр(С6H5NH2) : mтеор(С6H5NH2)
m(C6H5NO2)-? mтеор(С6H5NH2)=mпр(С6H5NH2) : W(С6H5NH2)=116,5г:0,8=145,6г
n(С6H5NH2)= mтеор(С6H5NH2):М(С6H5NH2)=145,6г:93г/моль=1,6 моль
М(С6H5NH2)=12*6+5+14+2=93г/моль
kat
3 C6H5NO2 + 3H2 → С6H5NH2 +2H2O
по уравнению: 1 моль(C6H5NO2):1 моль(С6H5NH2)
по условию: х:1,6 моль
1 моль:х=1 моль:1,6 моль
х=1,6 моль. n(С6H5NO2)=1,6 моль
n(С6H5NO2)=m(C6H5NO2):М(С6H5NО2)
М(С6H5NО2)=12*6+5+14+16*2=123г/моль
m(C6H5NO2)=n(С6H5NO2)*М(С6H5NО2)=1,6 * 123 = 196,8г
Ответ: m(C6H5NO2)=196,8г.
Задача№3. Определить объем газа, выделившийся при обжиге 312,5г известняка, содержащего 20% примесей.
Дано: Решение:
m(известн.)= 1. определить m(прим.)
= m(CaCO3,пр) =312,5г Ѡ(прим.)=m(прим.):m(CaCO3,пр)=
Ѡ(прим.)=20% = 0,2 m(прим.)=m(CaCO3,пр)* Ѡ(прим.)
V(газа)=V(CO2) = ? m(прим.)=312,5г*0,2=62,5г
m(CaCO3) =m(CaCO3,пр)-m(прим.)=312,5г-62,5г=250г
n (CaCO3)= m(CaCO3):M(CaCO3)
M(CaCO3)= 40+12+16*3=100г/моль
n (CaCO3)= 250г:100г/моль=2,5 моль
V(CO2) по уравнению: t
CaCO3 → CaO+CO2
1 моль 1 моль
по условию: 2,5 моль х
n(CO2)=2,5 моль V(CO2)= n(CO2)* Vm, Vm=22,4л/моль
V(CO2)=2,5 моль*22,4 л/моль=56л
Ответ:V(CO2)=56л
Задача№4. Определить тепловой эффект реакции образования воды, если при взаимодействии 112 л водорода (н.у.) выделилось 1430 кДж теплоты.
Дано: Решение
V(H2) = 112 л n(H2) = V(H2):Vm, Vm=22,4 л/моль
Ԛ=1430 кДж n(H2)=112 л:22,4 л/моль=5 моль
Ԛ=? 2H2 +O2 →2H2O+Ԛ
по уравнению: 2 моль Ԛ кДж
по условию: 5 моль 1430 кДж
2 моль :5 моль =Ԛ:1430 кДж
Ԛ=572 кДж
Ответ Ԛ=572 кДж
Контроль знанй и умений.
Задача: Определите массовую долю примеси речного песка в порошке мела (CaCO3), если в результате обработки 2 г загрязненного мела избытком азотной кислоты образовалось 224 мл углекислого газа(н.у.)
Дано: Решение
m(CaCO3,пр)=2г 0,01моль 0,01моль
V(CO2)=224 мл=0,224л CaCO3 + 2HNO3=Ca(NO3)2 + H2O + CO2
Ѡ(прим.)(%) =? 1 моль 1 моль
n(CO2)=V:Vm=0,224л:22,4л/моль=0,01 моль=n(CaCO3)
M(CaCO3)=100г/моль
m(CaCO3)=n*M=0,01*100г=1г
m(прим.)=2-1=1г
Ѡ(прим.)= m(прим.):m(CaCO3,пр)=0,5
Ѡ(прим.) (%) =50%
Ответ Ѡ(прим.)(%) =50%
Тема: Способы выражения концентрации раствора. Задачи на приготовление растворов.
Задача№1. В 212,4мл 12%-ного раствора едкого натра (ρ =1,13 г/мл) опустили 23 г натрия. Найти массовую долю щелочи в полученном растворе после окончании реакции.
Дано: Решение
Vр-ра (NaOH)=212,4мл 2Na + 2H2O=2NaOH + H2
Ѡ1 (NaOH)=12% mр-ра = V*ρ = 212,4мл*1,13 г/мл=240г
m(Na)=23 г m1 (NaOH)= Ѡ1* mр-ра =0,12*240г=28,8г
ρ(NaOH) =1,13 г/мл n(Na)=m:M=23г:23г/моль=1 моль
Ѡ2 (NaOH)-? n(Na)=n(NaOH)=1 моль
m(NaOH)=n*M=40г
mобщ (NaOH)= m1+m2 =28,8г+49г=68,8г
n(H2) : n(Na) = 1:2 = n(H2)=0,5моль
m2р-ра =m1 р-ра+m(Na) — m(H2)=240г+23г-1г=262г
Ѡ2 (NaOH) = mобщ(NaOH): m2р-ра=68,8г:262г=0,2626, 26,26%
Ответ Ѡ2 (NaOH)=26,26%
Задача№2 Чтобы получить 8%-ный раствор, в 820 г 5%-ного раствора сернистой кислоты нужно растворить сернистый газ(н.у.). Найти объем сернистого газа
Дано: Решение
Ѡ1 (H2SO3)=5% SO2+H2O=H2SO3
Ѡ2 (H2SO3) =8% m(H2SO3)=Ѡ*m(р-ра)=0,05*820г=41г
m1р-ра= 820г Масса добавленного сернистого газа равна х г, тогда
V(SO2)=? n(SO2)=m:M=x:64(моль)
n(SO2)=n(H2SO3)= x:64
m(H2SO3)=n*M=(x:64)*82=1,28x
41+1,28х
820+х г
Ѡ =m(H2SO3):m(р-ра)
0,8=(41+1,28х):(820+х)=> x=20,5г
V(SO2)=m*Vm:M=20,5г*22,4л/моль:64 г моль=7,17л
Ответ V(SO2)=7,17л
Задача№3 Сколько (г) английской соли MgSO4*7H2O необходимо добавить к 225 г 12% ного раствора сульфата магния, чтобы получить в итоге 30% расвор MgSO4?
Дано: Решение
mp(MgSO4)=225г mp 2 = mp+ ∆m2 (MgSO4*7H2O)
Ѡ(MgSO4)=0,12 mв 2 = mв+ ∆m1(MgSO4)
Ѡ2 (MgSO4)=0,3 n(MgSO4)= n(MgSO4*7H2O)= х моль
∆m (MgSO4*7H2O)-? m(MgSO4)=mp* Ѡ=225г*0,12 =27г
Ѡ2 = mв 2: mp 2 ; 0,3=27г+120*х:225г+246*х
х=0,877 моль
∆ m= 246x=246*0,877=215,65г
Ответ ∆ m= 215,65г
Проверочная работа
Задача№1 Сколько мл воды нужно добавить к 60 мл 10% ного раствора гидроксида натрия, чтобы получить 4%ный раствор?
Дано: Решение
V(р-ра NaON) =60 мл 1.m(р-ра) =ρ(р-ра) * V(р-ра) =1,109г/мл*60мл==66,54г
ρ(р-ра NaON)=1,109 г/мл 2. m(NaOH)=Ѡ1*m(р-ра NaON)= 0,1*66,54г=6,654г
aplik.ru
Расчетные задачи по химии | Типовые задачи «В9» Химя ЕГЭ
В наиболее сложных задачах, в дополнение к вычислениям по теме «растворы», предполагается расчет по уравнению реакции. Приведен пример решения задачи на приготовление растворов ацетальдегида, а также дана задача на приготовление раствора формалина.
Задача 1.
В результате гидратации ацетилена объемом 67,2 л (н.у.) можно получить водный раствор ацетальдегида с массовой долей 15% . Масса полученного раствора равна … г. (запишите число с точностью до целых).
Дано:
объем ацетилена (н.у.): V(С2Н2) = 67,2 л;
массовая доля ацетальдегида в растворе: (Н3С-НС=О) = 15%.
Найти: массу раствора: mр-ра = ?
Решение:
М(Н–НС=О) = 30 г/моль.
1. Записываем уравнение реакции и рассчитываем по нему массу образовавшегося ацетальдегида:
Составляем пропорцию:
67,2 л HC=CH дает х г H3C–HC=O (по условию)
22,4 л НС=СН дает 44 г H3C–HC=O (по уравнению)
2. Находим массу 15%-ного раствора, содержащего 132 г ацетальдегида:
Ответ: mр-ра = 880 г.
Кроме реакции гидратации ацетилена, в задачах, аналогичных последней, использовались реакции взаимодействия оксидов щелочных и щелочноземельных металлов с водой.
Рассмотрим условие еще одной задачи, встречающейся в некоторых вариантах последних лет. Ее текст вызывает некоторое непонимание среди тестируемых и требует пояснений.
Задача 2.
Объем формальдегида, который потребуется для получения 1 л раствора (р = 1,11 г/мл) с массовой долей формалина 40% равен … л. В задаче имеется в виду, что путем растворения формальдегида получается 1 л раствора формалина (р = 1,11 г/мл) с массовой долей формальдегида 40%1.
Дано:
массовая доля формальдегида в растворе:(Н–НС=О) = 40%
плотность раствора формальдегида: рр-ра = 1,11 г/л.
Найти: Объем формальдегида: V(Н–НС=О) = ?
Решение:
1. Находим массу 1 л раствора формалина:
mр-ра = Vр-ра. рр-ра = 1000 мл . 1,11 г/л = 1110 г.
2. Находим массу формальдегида, которая требуется для получения 1 л раствора (р = 1,11 г/мл) с массовой долей формалина 40%, с применением соотношения для определения массовой доли:
3. Находим объем формальдегида, с учетом , что формальдегид в данных условиях является газом, получим:
Ответ: V(Н–НС=О) = 331,5 л.
Комментарии:
1Непонимание вызвала фраза: «1л раствора (р = 1,11 г/мл) с массовой долей формалина». Дело в том, что формалин — это уже 40% раствор формальдегида в воде. Некоторые учащиеся решили, что разбавлению подлежит формалин и требуется получить новый раствор, в котором массовая доля исходного раствора (формалина) будет 40%.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
buzani.ru
Методика решения типовых задач «В9» по химии на тему «Растворы»
Задача 1.
Массовая доля растворенных солей в некотором образце морской воды составляет 3,3%. Определите массу солей, содержащихся в 100,0 л такой воды (р = 1,12 г/мл). Ответ: … г (запишите число с точностью до целых).
Дано:
объем раствора морской воды: Vр-ра — 100,0 л;
массовая доля солей : (НNO3) = 3,3%
плотность раствора: pр-ра = 1,12 г/мл.
Найти: массу солей: mсолей = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение
объема в единицы измерения, соответствующие плотности.
Vр-ра = 100 л = 100000 мл
mр-ра = Vр-ра . рр-ра = 100000 . 1,12 = 112000г.
Далее используем соотношение для определения массовой доли.
Ответ: mсолей = 3696 г.
Задача 2.
Масса серной кислоты, содержащейся в 2 л ее водного 30%-ного раствора (р = 1,22 г/мл), равна … г (запишите число с точностью до целых).
Дано:
объем раствора: Vр-ра — 2 л;
массовая доля раствора серной кислоты:(H2SO4) = 30%
плотность раствора: pр-ра = 1,22 г/мл.
Найти: массу серной кислоты: m(H2SO4) = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение объема в единицы измерения, соответствующие плотности.
Vр-ра = 2 л = 2000 мл
mр-ра = Vр-ра . рр-ра = 2000 . 1,22 = 2440г.
Далее используем соотношение для определения массовой доли.
Ответ: m(H2SO4) = 732 г.
Задача 3.
Масса сахарозы, содержащейся в 1 л ее водного 50%-ного раствора (р = 1,23 г/мл) равна….. г (запишите число с точностью до целых).
Дано:
объем раствора: Vр-ра — 1 л;
массовая доля раствора сахарозы: (С12Н22О11) = 50%
плотность раствора: pр-ра = 1,23 г/мл.
Найти: массу сахарозы: m(С12Н22О11) = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует честь, что объем указан в литрах, а плотность в г/мл. Переведем значение объема в единицы измерения, соответствующие плотности.
Vр-ра = 1 л = 1000 мл
mр-ра = Vр-ра . рр-ра = 1000 . 1,23 = 1230 г.
Далее используем соотношение для определения массовой доли.
Ответ: m(12Н22О11) = 615 г.
Задача 4.
Масса этанола, содержащегося в 2 л его 56%-ного водного раствора (р = 0,900 г/мл) равна … г (запишите число с точностью до целых).
Дано:
объем раствора: Vр-ра — 2 л;
массовая доля раствора этанола:(С2Н6О) = 56%
плотность раствора: pр-ра = 0,900 г/мл.
Найти: массу сахарозы: m(С2Н6О)) = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение
объема в единицы измерения, соответствующие плотности.
Vр-ра = 2 л = 2000 мл
mр-ра = Vр-ра . рр-ра = 2000 . 0,900 = 1800 г.
Далее используем соотношение для определения массовой доли.
Ответ: m(С2Н6О) = 1008 г.
Задача 5.
Массовая доля соляной кислоты, полученной растворением 33,6 л (н.у.) хлороводорода в 1,5 л воды, равна … % (запишите число с точностью до сотых).
Дано:
объем раствора: Vр-ра = 1,5 л;
объем хлороводорода: V(HCl) = 33,6 л;
Найти: массовую долю раствора хлороводорода:(HCl) = ?
Решение:
М(HCl) = 36,5 г/моль.
m(H2O) = 1500 мл . 1г/мл = 1500 г
В первую очередь необходимо найти массу газообразного хлороводорода, растворенного в 1,5 л воды.
m(HCl) = n(HCl) . M(HCl) = V(HCl)/Vm. M(HCl) = 33,6 л/22,4л/моль . 36,5 г/моль = 54,75 г.
2. Находим массу раствора:
mр-ра = m(H2O) + m(HCl) = 1500 г + 54, 75 г = 1554,75 г.
3. Далее используем соотношение для определения массовой доли.
Ответ: (HCl) = 3,52%.
buzani.ru
Расчетные задачи по химии | Типовые задачи «В9» Химя ЕГЭ
В наиболее сложных задачах, в дополнение к вычислениям по теме «растворы», предполагается расчет по уравнению реакции. Приведен пример решения задачи на приготовление растворов ацетальдегида, а также дана задача на приготовление раствора формалина.
Задача 1.
В результате гидратации ацетилена объемом 67,2 л (н.у.) можно получить водный раствор ацетальдегида с массовой долей 15% . Масса полученного раствора равна … г. (запишите число с точностью до целых).
Дано:
объем ацетилена (н.у.): V(С2Н2) = 67,2 л;
массовая доля ацетальдегида в растворе: (Н3С-НС=О) = 15%.
Найти: массу раствора: mр-ра = ?
Решение:
М(Н–НС=О) = 30 г/моль.
1. Записываем уравнение реакции и рассчитываем по нему массу образовавшегося ацетальдегида:
Составляем пропорцию:
67,2 л HC=CH дает х г H3C–HC=O (по условию)
22,4 л НС=СН дает 44 г H3C–HC=O (по уравнению)
2. Находим массу 15%-ного раствора, содержащего 132 г ацетальдегида:
Ответ: mр-ра = 880 г.
Кроме реакции гидратации ацетилена, в задачах, аналогичных последней, использовались реакции взаимодействия оксидов щелочных и щелочноземельных металлов с водой.
Рассмотрим условие еще одной задачи, встречающейся в некоторых вариантах последних лет. Ее текст вызывает некоторое непонимание среди тестируемых и требует пояснений.
Задача 2.
Объем формальдегида, который потребуется для получения 1 л раствора (р = 1,11 г/мл) с массовой долей формалина 40% равен … л. В задаче имеется в виду, что путем растворения формальдегида получается 1 л раствора формалина (р = 1,11 г/мл) с массовой долей формальдегида 40%1.
Дано:
массовая доля формальдегида в растворе:(Н–НС=О) = 40%
плотность раствора формальдегида: рр-ра = 1,11 г/л.
Найти: Объем формальдегида: V(Н–НС=О) = ?
Решение:
1. Находим массу 1 л раствора формалина:
mр-ра = Vр-ра. рр-ра = 1000 мл . 1,11 г/л = 1110 г.
2. Находим массу формальдегида, которая требуется для получения 1 л раствора (р = 1,11 г/мл) с массовой долей формалина 40%, с применением соотношения для определения массовой доли:
3. Находим объем формальдегида, с учетом , что формальдегид в данных условиях является газом, получим:
Ответ: V(Н–НС=О) = 331,5 л.
Комментарии:
1Непонимание вызвала фраза: «1л раствора (р = 1,11 г/мл) с массовой долей формалина». Дело в том, что формалин — это уже 40% раствор формальдегида в воде. Некоторые учащиеся решили, что разбавлению подлежит формалин и требуется получить новый раствор, в котором массовая доля исходного раствора (формалина) будет 40%.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
buzani.ru
Решение задач по химии
Решебник
разноуровневых заданий
по химии
для дифференцированного контроля
знаний учеников
8 класс
г. Кривой Рог
2001 год
Вариант 1
Задачи
Первый уровень
1.
2.
3. О2 – молекула простого вещества – кислорода, состоящая из двух атомов оксигена.
2О2 – две молекулы простого вещества, каждая из которых состоит из двух атомов оксигена.
О – один атом оксигена.
10Н2 О – десять молекул сложного вещества, каждая из которых состоит из двух атомов гидрогена и одного атома оксигена.
4СО2 – четыре молекулы сложного вещества, каждая из которых состоит из одного атома карбона и двух атомов оксигена.
4. HNO3
Второй уровень
5.
6.
7.
Третий уровень
8. 2Ca+O2 =2CaO
CaO+H2 O=Ca(OH)2
Ca(OH)2 +2HCl=CaCl2 +2H2 O
9.
10. При увеличении давления химическое равновесие сместится в сторону образования водорода и кислорода.
Вариант 2
Задачи
Первый уровень
1.
2.
3.
4 2Br – два атома брома
Br – один атом брома
3HBr – три молекулы сложного вещества, каждая из которых
Второй уровень
5.
6.
7. С повышением температуры химическое равновесие сместится в сторону исходных веществ.
Третий уровень
8. 2Pb+O2 =2PbO
PbO+2HCl=PbCl2 +H2 O
PbCl2 +2AgNO3 =Pb(NO3 )2 +2AgCl↓
9. а) CuO+2HNO3 =Cu(NO3 )2 +H2 O
10.
Вариант 3
Задачи
Первый уровень
1.
2.
3. N2 – одна молекула простого вещества азота каждая из которых состоит из двух атомов нитрогена.
5N – пять атомов нитрогена.
N2 O – одна молекула сложного вещества, состоящая из двух атомов нитрогена и одного атома оксигена.
4HNO3 – четыре молекулы сложного вещества, каждая из которых состоит из одного атома гидрогена, одного атома нитрогена и трех атомов оксигена.
7H2 – семь молекул простого вещества водорода, каждая из которых состоит из двух атомов гидрогена.
4.
Второй уровень
5.
6.
7. С повышением температуры равновесие сместится в сторону исходных веществ.
mirznanii.com
