| Химические свойства | ПРАВИЛА | ИСКЛЮЧЕНИЯ | |
| МЕТАЛЛ + НЕМЕТАЛЛ СОЛЬ | Чем активнее, тем легче реагируют. | 1. При взаимодействии железа с галогенами образуется соль Fe 3+ ,а с остальными – соль Fe 2+ | |
| МЕТАЛЛ + О2 ОКСИД | Кроме благородных металлов | 1.У щелочных металлов пероксид, или надпероксид (кроме лития) 2. У железа – окалина Fe3O4 | |
| МЕТАЛЛ + ОКСИД МЕТАЛЛА 1 МЕТАЛЛ + ОКСИД МЕТАЛЛА2 | Металл в оксиде1 — переходный | ||
| МЕТАЛЛ + Н2О ЩЕЛОЧЬ + Н2 | Только для металлов, которым соответствует растворимое основание — щелочь | ||
| МЕТАЛЛ + КИСЛОТА СОЛЬ + Н2 | 1.Металлы должны стоять в ряду напряжения до водорода 2. Кроме азотной и концентрированной серной кислот. | ||
| МЕТАЛЛ + СОЛЬ СОЛЬ + МЕТАЛЛ | Соль должна содержать металл, который в ряду напряжения стоит правее. | ||
| (Ме до Mg) соль + Н2О + NH3 (соль) МЕТАЛЛ + HNO3 (РАЗБ) (отМg) соль + Н2О + NO (Ме до Mg) соль + Н2О + N2О МЕТАЛЛ + HNO3 (конц) (отМg) соль + Н2О + NO2 (Ме до Mg) соль + Н2О + H2S МЕТАЛЛ + H2SO4 (конц) (отМg по Н2) соль + Н2О + S (после Н2) соль + Н2О + SO2 | 1.На самом деле образуется соль аммония, так как аммиак быстро реагирует с избытком кислоты. 2. При определенной концентрации кислоты может образовываться и свободный азот. 3.При взаимодействии железа с раствором азотной кислоты образуется соль Fe 3+. 4. Железо реагирует с концентрированной серной кислотой только при нагревании, образуется соль Fe 3+. 5. Благородные металлы, железо, хром, алюминий пассивируются концентрированными серной, азотной кислотой. | ||
| МЕТАЛЛ + ЩЕЛОЧЬ + Н2О КОМПЛЕКСНАЯ СОЛЬ + Н2 | Так реагируют металлы, которые образуют амфотерные соединения. | ||
| НЕМЕТАЛЛ + ВОДОРОД летучее водородное соединение | Только активные неметаллы (кроме Si, P, As, Te, Se, B.) | ||
| НЕМЕТАЛЛ + О2 ОКСИД НЕМЕТАЛЛА | Кроме галогенов, а (S+ О2 S О2 , N2 + O2 2NO) | ||
| НЕМЕТАЛЛ + ЩЕЛОЧЬ Н2О + СОЛЬ + СОЛЬ | Только для галогенов и кремния.(Si + NaOH+H2O H2 + Na2SiO3 | ||
| НЕМЕТАЛЛ + HNO3 + Н2О КИЛОТА + NO(NO2) + Н2О | Кроме галогенов. | ||
multiurok.ru
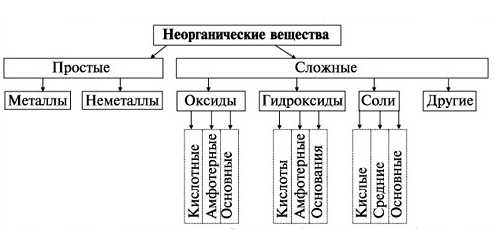
Классификация неорганических соединений (химические свойства классов веществ)
Неорганические вещества бывают простыми и сложными. Простые вещества делятся на металлы (K, Na, Li) и неметаллы (O, Cl, P). Сложные вещества делят на оксиды, гидроксиды (основания), соли и кислоты.
Оксиды
Оксиды — соединения химического элемента (металла или неметалла) с кислородом (степень окисления -2), при этом кислород связан с менее электроотрицательным элементом.
Выделяют:
1. Кислотные оксиды — оксиды, проявляющие кислотные свойства. Образованы неметаллами и кислородом. Примеры: SO3, SO2, CO2, P2O5, N2O5.
2. Амфотерные оксиды — оксиды, которые могут проявлять как основные, так и кислотные свойства (такое свойство называется амфотерность). Примеры: Al2O3, CrO3, ZnO, BeO, PbO.
3. Основные оксиды — оксиды металлов, при этом металлы проявляют степень окисления +1 или +2. Примеры: K2O, MgO, CaO, BaO, Li2O, Na2O.
4. Несолеобразующие оксиды — практически не вступают в реакции, не имеют соответствующих кислот и гидроксидов. Примеры: CO, NO.
Химические свойства основных оксидов
1. Взаимодействие с водой
В реакцию вступают только оксиды щелочных и щелочноземельных металлов, гидроксиды которых образуют растворимое основание
основной оксид + вода → щелочь
K2O + h3O → 2KOH
CaO + h3O → Ca(OH)2
2. Взаимодействие с кислотой
основной оксид + кислота → соль + вода
MgO + h3SO4 → MgSO4 + h3O
Na2O + h3S(изб) → 2NaHS + h3O
MgO(изб) + HCl → Mg(OH)Cl
3. Взаимодействие с кислотными или амфотерными оксидами
основной оксид + кислотный/амфотерный оксид → соль
При этом металл, находящийся в основном оксиде, становится катионом, а кислотный/амфотерный оксид становится анионом (кислотным остатком). Реакции между твердыми оксидами идут при нагревании. Нерастворимые в воде основные оксиды не взаимодействуют с газообразными кислотными оксидами.
BaO + SiO2 (t)→ BaSiO3
K2O + ZnO (t)→ K2ZnO2
FeO + CO2 ≠
4. Взаимодействие с амфотерными гидроксидами
основной оксид + амфотерный гидроксид → соль + вода
Na2O + 2Al(OH)3 (t)→ 2NaAlO2 + 3h3O↑
5. Разложение при температуре оксидов благородных металлов и ртути
2Ag2O (t)→ 4Ag + O2↑
2HgO (t)→ 2Hg + O2↑
6. Взаимодействие с углеродом (С) или водородом (Н2) при высокой температуре.
При восстановлении таким образом оксидов щелочных, щелочноземельных металлов и алюминия выделяется не сам металл, а его карбид.
FeO + C (t)→ Fe + CO↑
3Fe2O3 + C (t)→ 2Fe3O4 + CO↑
CaO + 3C (t)→ CaC2 + CO↑
CaO + 2h3 (t)→ Cah3 + h3O↑
7. Активные металлы восстанавливают менее активные из их оксидов при высокой температуре
CuO + Zn (t)→ ZnO + Cu
8. Кислород окисляет низшие оксиды в высшие.
Оксиды щелочных и щелочноземельных металлов переходят в пероксиды
4FeO + O2 (t)→ 2Fe2O3
2BaO + O2 (t)→ 2BaO2
2NaO + O2 (t)→ 2Na2O2
Химические свойства кислотных оксидов
1. Взаимодействие с водой
кислотный оксид + вода → кислота
SO3+ h3O → h3SO4
SiO2 + h3O ≠
У некоторых оксидов нет соответствующих кислот, в таком случае происходит реакция диспропорционирования
2NO2 + h3O → HNO3 + HNO2
3NO2 + h3O (t)→ 2HNO3 + NO↑
2ClO2 + h3O → HClO3 + HClO2
6ClO2 + 3h3O (t)→ 5HClO3 + HCl
В зависимости от количества присоединенных к P2O5 молекул воды образуются три разных кислоты — метафосфорная НРО3, пирофосфорная Н4Р2О7 или ортофосфорная Н3РО4.
P2O5 + h3O → 2HPO3
P2O5 + 2h3O → h5P2O7
P2O5 + 3h3O → 2h4PO4
Оксид хрома соответствует двум кислотам — хромовой h3CrO4 и дихромовой h3Cr2O7(III)
CrO3 + h3O → h3CrO4
2CrO3 + h3O → h3Cr2O7
2. Взаимодействие с основаниями
кислотный оксид + основание → соль + вода
Нерастворимые кислотные оксиды реагируют только при сплавлении, а растворимые — в обычных условиях.
SiO2 + 2NaOH (t)→ Na2SiO3 + h3O↑
При избытке оксида образуется кислая соль.
CO2(изб) + NaOH → NaHCO3
P2O5(изб) + 2Ca(OH)2 → 2CaHPO4 + h3O
P2O5(изб) + Ca(OH)2 + h3O → Ca(h3PO4)2
При избытке основания образуется основная соль
CO2 + 2Mg(OH)2(изб) → (MgOH)2CO3 + h3O
Оксиды, которые не имеют соответствующих кислот, вступают в реакцию диспропорционирования и образуют при этом две соли.
2NO2 + 2NaOH → NaNO3 + NaNO2 + h3O
2ClO2 + 2NaOH → NaClO3 + NaClO2 + h3O
CO2 реагирует с некоторыми амфотерными гидроксидами (Be(OH)2, Zn(OH)2, Pb(OH)2, Cu(OH)2), при этом образуется основная соль и вода.
CO2 + 2Be(OH)2 → (BeOH)2CO3↓ + h3O
CO2 + 2Cu(OH)2 → (CuOH)2CO3↓ + h3O
3. Взаимодействие с основным или амфотерным оксидом
кислотный оксид + основной/амфотерный оксид → соль
Реакции между твердыми оксидами идут при сплавлении. Амфотерные и нерастворимые в воде основные оксиды взаимодействуют только с твердыми и жидкими кислотными оксидами.
SiO2 + BaO (t)→ BaSiO3
3SO3 + Al2O3 (t)→ Al2(SO4)3
4. Взаимодействие с солью
кислотный нелетучий оксид + соль (t)→ соль + кислотный летучий оксид
Нелетучие кислотные оксиды вытесняют при сплавлении летучие кислотные оксиды из их солей.
SiO2 + CaCO3 (t)→ CaSiO3 + CO2↑
P2O5 + Na2CO3 → 2Na3PO4 + 2CO2↑
5. Кислотные оксиды не взаимодействуют с кислотами, но Р2О5 реагирует с безводными кислородсодержащими кислотами.
При этом образуется НРО3 и ангидрид соответствующей кислоты
P2O5 + 2HClO4(безводн) → Cl2O7 + 2HPO3
P2O5 + 2HNO3(безводн) → N2O5 + 2HPO3
6. Вступают в окислительно-восстановительные реакции.
1. Восстановление
При высокой температуре некоторые неметаллы могут восстанавливать оксиды.
CO2 + C (t)→ 2CO↑
SO3 + C → SO2 + CO↑
h3O + C (t)→ h3↑ + CO↑
Для восстановления неметаллов из их оксидов часто используют магнийтермию.
CO2 + 2Mg → C + 2MgO
SiO2 + 2Mg (t)→ Si + 2MgO
N2O + Mg (t)→ N2 + MgO
2. Низшие оксиды превращаются в высшие при взаимодействии с озоном (или кислородом) при высокой температуре в присутствии катализатора
NO + O3 → NO2 + O2
SO2 + O3 → SO3 + O2
2NO2 + O3 → N2O5 + O2
2CO + O2 (t)→ 2CO2
2SO2 + O2 (t, kat)→ 2SO3
P2O3 + O2 (t)→ P2O5
2NO + O2 (t)→ 2NO2
2N2O3 + O2 (t)→ 2N2O4
3. Оксиды вступают и в другие окислительно-восстановительные реакции
SO2 + NO2 → NO↑ + SO3 4NO2 + O2 + 2h3O → 4HNO3
2SO2 + 2NO → N2↑ + 2SO3 2N2O5 → 4NO2↑ + O2↑
SO2 + 2h3S → 3S↓ + 2h3O 2NO2 (t)→ 2NO↑ + O2↑
2SO2 + O2 + 2h3O → 2h3SO4 3N2O + 2Nh4 → 4N2 + 3h3O
2CO2 + 2Na2O2 → 2Na2CO3 + O2 10NO2 +8P → 5N2↑ + 4P2O5
N2O + 2Cu (t)→ N2↑ + Cu2O
2NO + 4Cu (t)→ N2↑ + 2Cu2O
N2O3 + 3Cu (t)→ N2↑ + 3CuO
2NO2 + 4Cu (t)→ N2↑ + 4CuO
N2O5 + 5Cu (t)→ N2↑ + 5CuO
Химические свойства амфотерных оксидов
1. Не взаимодействуют с водой
амфотерный оксид + вода ≠
2. Взаимодействие с кислотами
амфотерный оксид + кислота → соль + вода
Al2O3 + 3h3SO4 → Al2(SO4)3 + 3h3O
При избытке многоосновной кислоты образуется кислая соль
Al2O3 + 6h4PO4(изб) → 2Al(h3PO4)3 + 3h3O
При избытке оксида образуется основная соль
ZnO(изб) + HCl → Zn(OH)Cl
Двойные оксиды образуют две соли
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4h3O
3. Взаимодействие с кислотным оксидом
амфотерный оксид + кислотный оксид → соль
Al2O3 + 3SO3 → Al2(SO4)3
4. Взаимодействие с щелочью
амфотерный оксид + щелочь → соль + вода
При сплавлении образуется средняя соль и вода, а в растворе — комплексная соль
ZnO + 2NaOH(тв) (t)→ Na2ZnO2 + h3O↑
ZnO + 2NaOH + h3O → Na2[Zn(OH)4]
5. Взаимодействие с основным оксидом
амфотерный оксид + основной оксид (t)→ соль
ZnO + K2O (t)→ K2ZnO2
6. Взаимодействие с солями
Амфотерные оксиды вытесняют при сплавлении летучие кислотные оксиды из их солей
Al2O3 + K2CO3 (t)→ KAlO2 + CO2↑
Fe2O3 + Na2CO3 (t)→ 2NaFeO2 + CO2↑
Химические свойства оснований
Основания — вещества, в состав которых входит катион металла и гидроксид-анион. Основания бывают растворимыми (щелочи — NaOH, KOH, Ba(OH)2) и нерастворимыми (Al2O3, Mg(OH)2).
1. Растворимое основание + индикатор → изменение цвета
При добавлении индикатора в раствор основания его цвет
scienceforchildren.ru
Классификация и свойства сложных неорганических веществ. Взаимосвязь
В школьном курсе изучаются четыре основных класса сложных веществ: оксиды, основания, кислоты, соли.
— это сложные вещества, состоящие из двух элементов, один из которых кислород.
Оксиды делятся на:
несолеобразующие — не взаимодействуют ни с кислотами, ни с щелочами и не образуют солей. Это оксид азота (I) N2O, оксид азота (II) NO, оксид углерода (II) CO и некоторые другие.
солеобразующие — при взаимодействии с кислотами или основаниями образуют соль и воду.
В свою очередь они делятся на:
основные — им соответствуют основания. К ним относятся оксиды металлов с небольшими степенями окисления (+1, +2). Все они представляют собой твердые вещества)
кислотные — им
соответствуют кислоты. К ним относятся оксиды неметаллов и оксиды металлов с большими степенями окисления. Например оксид хрома (VI) CrO
амфотерные — в зависимости от условий проявляют основные или кислотные свойства, т.е. обладают двойственными свойствами. Это оксид цинка ZnO, оксид алюминия Al2O3, оксид железа (III) Fe2O3, оксид хрома (III) Cr2O3.
Типичные реакции основных оксидов
1. Основный оксид + вода = щелочь ( ! Реакция протекает, если образуется растворимое основание! )
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Основный оксид + кислотный оксид = соль
CaO + N2O5 = Ca(NO3)2
MgO + SiO2 = MgSiO3
3. Основный оксид + кислота = соль + вода
FeO + H2SO4 = FeSO4 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Типичные реакции кислотных оксидов
1. Кислотный оксид + вода = кислота (кроме оксида кремния SiO2)
SO2 + H2O = H2SO3
CrO3 + H2O = H2CrO4
2. Кислотный оксид + основный оксид = соль
SO3 + K2O = K2SO4
CO2 + CaO = CaCO3
3. Кислотный оксид + основание = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O
Типичные реакции амфотерных оксидов
1. Амфотерный оксид + кислота = соль + вода
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2. Амфотерный оксид + щелочь = соль + вода
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Cr2O3 + 2NaOH + 7H2O = 2Na[Cr(OH)4(H2O)2]
При сплавлении
ZnO + 2KOH = K2ZnO2 + H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
— это сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими гидроксогруппами.
Основания делятся на:
растворимые в воде (щелочи) — образованы элементами I группы главной подгруппы LiOH, NaOH, KOH, RbOH, CsOH и элементами II группы главной подгруппы (кроме магния и бериллия) Ca(OH)2, Sr(OH)2, Ba(OH)2.
нерастворимые в воде — все остальные.
Реакции, характерные для всех оснований
1. Основание + кислота = соль + вода
2KOH + H2SO4 = K2SO4 +2H2O
Cu(OH)2 + 2HCl = CuCl2 + H2O
Типичные реакции щелочей
1. Водные растворы изменяют окраску индикаторов (лакмус — синий, метилоранж — желтый, фенолфталеин — малиновый)
KOH = K+ + OH- (ионы OH- обуславливают щелочную реакцию среды)
Ca(OH)2 = Ca2+ + 2OH-
2. Щелочь + кислотный оксид = соль + вода
Ca(OH)2 + N2O5 = Ca(NO3)2 + H2O
2KOH + CO2 = K2CO3 + H2O
3. Щелочь + соль = соль + основание (если продукт реакции нерастворимое соединение или малодиссоциирующее вещество NH4OH)
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 (нераств.)
Ca(OH)2 + Na2SiO3 = CaSiO3 (нераств.) + 2NaOH
NaOH + NH4Cl = NaCl + NH4OH
4. Реагируют с жирами с образованием мыла
Типичные реакции нерастворимых оснований
1. Разлагаются при нагревании
Fe(OH)2 = FeO + H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Среди нерастворимых оснований есть амфотерные. Например, Be(OH)2, Zn(OH)2, Ge(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3, Sn(OH)4 и др.
Они взаимодействуют с щелочами в водном растворе
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Fe(OH)3 + NaOH = Na[Fe(OH)4]
или при сплавлении
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
— это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
Реакции, характерные для всех кислот
1. Кислота + основание = соль + вода
2HNO3 + Cu(OH)2 = Cu(NO3)2 +2H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
2. Кислота + основной оксид = соль + вода
CuO + H2SO4 = CuSO4 + 2H2O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
— это сложные вещества, в состав которых входят атомы металла и кислотного остатка.
Соли делятся на:
средние — в своем составе содержат в качестве катионов только атомы металла и в качестве анионов только кислотный остаток. Их можно рассматривать как продукты полного замещения атомов водорода в составе кислоты на атомы металла или продукты полного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками.
H2SO4 + 2NaOH = Na2SO4 + 2H2O
3H2SO4 + 2Fe(OH) 3 = Fe2(SO4)3 + 6H2O
кислые — в качестве катионов содержат не только атомы металла, но и водорода. Их можно рассматривать как продукты неполного замещения атомов водорода в составе кислоты. Образуются только многоосновными кислотами. Получаются при недостаточном количестве основания для образования средней соли.
H2SO4 + NaOH = NaHSO4 + H2O
основные — в качестве анионов содержат не только кислотный остаток, но и гидроксогруппу. Их можно рассматривать как продукты неполного замещения гидроксогрупп в составе многокислотного основания на кислотный остаток. Образуются только многокислотными основаниями. Получаются при недостаточном количестве кислоты для образования средней соли.
H2SO4 + Fe(OH) 3 = FeOHSO4 + 2H2O
Типичные реакции средних солей
1. Соль + кислота = другая соль + другая кислота ( Реакция протекает, если образуется нерастворимое соединение, выделяется газ – углекислый СО2, сернистый SO2, сероводород H2S – или образуется малодиссоциирующее вещество, например, уксусная кислота CH3COOH ! )
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
(CH3COO)2Ca + 2HNO3 = Ca(NO3)2 + 2CH3COOH
В результате этой реакции можно получить летучие кислоты: азотную и соляную, если взять твердую соль и сильную концентрированную кислоту (лучше серную)
2NaCl + H2SO4 = Na2SO4 + 2HCl
2KNO3 + H2SO4 = K2SO4 + 2HNO3
2. Соль + щелочь = другая соль + другое основание( Реакция протекает, если образуется нерастворимое соединение или образуется малодиссоциирующее вещество, например, гидроксид аммония NH4OH ! )
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2↓
NH4Cl + NaOH = NaCl + NH4OH
3. Соль(1) + соль(2) = соль(3) + соль(4) ( Реакция протекает, если образуется нерастворимое соединение ! )
NaCl + AgNO3 = NaNO3 + AgCl↓
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
4. Соль + металл = другая соль + другой металл ( Металл вытесняет из растворов солей все другие металлы, стоящие в ряду напряжений металлов правее него. Реакция протекает, если обе соли растворимы, а сам металл не взаимодействует с водой ! )
CuCl2 + Fe = FeCl2 + Cu
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Типичные реакции кислых солей
1. Кислая соль + щелочь = средняя соль + вода
NaHSO4 + NaOH = Na2SO4 + H2O
Типичные реакции основных солей
1. Основная соль + щелочь = средняя соль + вода
(CuOH) 2CO3 + H2CO3 = CuCO3↓ + 2H2O
school4eg.jimdo.com
Тема 2 Основные классы неорганических веществ
Простые вещества – их молекулы состоят из одного вида атомов. Подразделяют на металлы (например: K, Mg, Ni, Fe, Zn, Al, Cr, Ag, Cu) и неметаллы (S, P, N2, O2, O3, Br2).
Сложные вещества – их молекулы состоят из атомов нескольких видов.
Оксиды – сложные вещества, их молекулы состоят из двух видов элементов, одним из которых кислород.
Основные оксиды – оксиды типичных металлов со степенями окисления +1 и +2, иногда +3, которым в качестве гидроксидов соответствуют основания:
+1: K2O, Li2O, Na2O, Rb2O, Cs2O, Cu2O, Ag2O, Tl2O;
+2: CaO, BaO, SrO, MnO, FeO, MgO, NiO, TiO;
+3: Bi2O3, La2O3, Ti2O3.
Взаимодействуют с водой с образованием щелочей: СаО+Н2О=Са(ОН)2;
с кислотами MgO + H2SO4 = MgSO4 + H2O;
с кислотными оксидами ВаО + СО2 = ВаСО3.
Кислотные оксиды – это оксиды неметаллов (например, P2O5, B2O3, Cl2O7) и некоторых металлов в высшей степени окисления (например, Nb2O5, MoO3, Mn2O7), которым в качестве гидроксидов соответствуют кислоты.
Взаимодействуют с водой с образованием кислот P2O5 + 3H2O = 2H3PO4;
со щелочами СО2 + Ва(ОН)2 = ВаСО3 + Н2О;
с основными оксидами СаО + СО2 = СаСО3.
Амфотерными оксиды, которым в качестве гидроксидов соответствуют амфотерные гидроксиды – это оксиды металлов со степенями окисления:
+2: BeO, ZnO, SnO, PbO, CuO, GeO;
+3: Al2O3, Sb2O3, Cr2O3, Fe2O3, Ga2O3;
+4: SnO2, PbO2, GeO2.
Реагируют с кислотными оксидами и кислотами, проявляя основные свойства PbO+2HNO3=Pb(NO3)2+H2O
ZnO+SiO2=ZnSiO3;
с основными оксидами и щелочами, проявляя кислотные свойства ZnO+CaO=CaZnO2
Al2O3+2NaOH=2NaAlO2+H2O,
в растворе Al2O3+2NaOH+3H2O=2Na[Al(OH)4].
Гидроксиды – соединения оксидов химических элементов с водой,
СаО + H2O = Са(ОН)2
SO3 + H2O = H2SO4
Основные гидроксиды (основания) – состоят из катиона металла или аммония NH4+ и гидроксильной группы ОН–.
Например: NaOH, Ni(OH)2, Mg(OH)2, Bi(OH)3, NH4OH.
Щелочи – сильные основания, как правило, хорошо растворимые в воде, гидроксиды щелочных и щелочноземельных металлов (металлов I и II главных групп).
Например: NaOH, КОН, Ва(ОН)2 раствор Са(ОН)2.
Взаимодействуют: с кислотами Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
с амфотерными гидроксидами Al(OH)3 + NaOH = Na[Al(OH)4]
с кислотными оксидами СаO2+ СO= СаСO3
с амфотерными оксидами Al2O3+Ca(OН)2= Ca(AlO2)2 +H2O
Амфотерные гидроксиды (амфотерные основания) – гидроксиды, проявляющие в химических реакциях в зависимости от условий и основные и кислотные свойства, т.е. обладающие двойственной природой.
Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Ge(OH)2, Cu(OH)2;
Al(OH)3, Cr(OH)3, Sb(OH)3, Ga(OH)3, Au(OH)3, As(OH)3;
Sn(OH)4, Pb(OH)4, Ge(OH)4.
Амфотерные гидроксиды могут быть получены взаимодействием солей амфотерных металлов со щелочью. AlCl3+3NaOH=Al(OH)3+3NaCl
Следует помнить, что в избытке щелочи сразу образуются растворимые комлексные соли AlCl3 + 4NaOH= Na[Al(OH)4] + 3NaCl– тетрагидроксоалюминат натрия
AlCl3 + 6NaOH= Na3[Al(OH)6] + 3NaCl – гексагидроксоалюминат натрия
Амфотерные гидроксиды взаимодействуют с кислотами, проявляя основные свойства, формула гидроксида записана в виде основания:
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Амфотерные гидроксиды взаимодействуют со щелочами, проявляя кислотные свойства, формула гидроксида записана в виде кислоты H3AlO3, амфотерный металл в составе аниона:
в расплаве: H3AlO3 + NaOH = NaAlO2 + 2H2O
в растворе: Al(OH)3 + NaOH = Na[Al(OH)4] или
Al(OH)3 + 3NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Zn(OH)3 + 2NaOH = Na2[Zn(OH)4]
Кислотные гидроксиды (кислородсодержащие кислоты) – гидроксиды, которые проявляют кислотные свойства, являются кислотами.
Кислоты – соединения, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков (анионов кислот). Основность кислоты – это число атомов водорода, способных замещаться на металл: одно- (HCl, HNO3), двух- (H2SO3, H2S), трех- (H3PO4) основные.
Кислоты подразделяются на безкислородные (например, HCl) и кислородсодержащие (кислотные гидроксиды, например, H2SO4).
По химической активности (силе) кислоты делят на сильные (HCl, H2SO4) и слабые (H2SO3, СH3СООН).
Таблица 1
Названия кислот и их анионов
|
Кислоты |
Анионы кислот | ||
|
Бескислородные кислоты | |||
|
Хлороводородная |
HCl |
Cl |
Хлорид |
|
Фтороводородная |
HF |
F |
Фторид |
|
Бромоводородная |
HBr |
Br— |
Бромид |
|
Иодоводородная |
HI |
I |
Иодид |
|
Сероводородная |
H2S |
S2 |
Сульфид |
|
HS |
Гидросульфид | ||
|
Циановодородная |
HCN |
CN |
Цианид |
|
Родановодородная |
HCNS |
CNS |
Роданид |
|
Кислородсодержащие кислоты | |||
|
Азотная |
HNO3 |
NO3 |
Нитрат |
|
Азотистая |
HNO2 |
NO2 |
Нитрит |
|
Ортофосфорная |
H3PO4 |
H2PO4 |
Дигидрофосфат |
|
HPO42 |
Гидрофосфат | ||
|
PO43 |
Фосфат | ||
|
Серная |
H2SO4 |
HSO4 |
Гидросульфат |
|
SO42 |
Сульфат | ||
|
Сернистая |
H2SO3 |
HSO3 |
Гидросульфит |
|
SO32 |
Сульфит | ||
|
Тиосерная |
H2S2O3 |
S2O32 |
Тиосульфат |
|
Хлорная |
HClO4 |
ClO4 |
Перхлорат |
|
Хлорноватая |
HClO3 |
ClO3 |
Хлорат |
|
Хлористая |
HClO2 |
ClO2 |
Хлорит |
|
Хлорноватистая |
HСlO |
СlO |
Гипохлорит |
|
Угольная |
H2CO3 |
HCO3 |
Гидрокарбонат |
|
CO32 |
Карбонат | ||
|
Кремниевая |
H2SiO3 |
SiO32 |
Силикат |
|
Марганцовистая |
H2MnO4 |
MnO42 |
Манганат |
|
Марганцевая |
HMnO4 |
MnO4 |
Перманганат |
|
Хромовая |
H2CrO4 |
CrO42 |
Хромат |
|
Двухромовая |
H2Cr2O7 |
Cr2O72 |
Бихромат |
|
Муравьиная |
HCOOH* |
HCOO |
Формиат |
|
Уксусная |
CH3COOH* |
CH3COO |
Ацетат |
|
Щавелевая |
HOOCCOOH* |
C2O42 |
Оксалат |
*Муравьиная, уксусная и щавелевая кислоты являются органическими кислотами, поэтому вид их формул отличается от вида минеральных (неорганических) кислот. Водород, имеющий кислые свойства и способный замещаться на ион металла, занимает в минеральных кислотах первое место (H2SO4), в органических – последнее (HCOOH, CH3COOH, НООССООН).
Кислоты взаимодействуют
с основными гидроксидами Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
с амфотерными гидроксидами Al(OH)3 +3HNO3 = Al(NO3)3 + 3H2O;
с основными оксидами MgO+2HCl=MgCl2+H2O;
амфотерными оксидами Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O;
с металлами, стоящими в ряду напряжений до водорода Fe+H2SO4=FeSO4+H2↑.
Не взаимодействуют с металлами, стоящими за водородом: Cu, Hg, Ag, Au;
При взаимодействии с металлами HNO3и H2SO4 (конц.) окислителями являются S+6 и N+5. Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O;
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
Соли – продукты полного или неполного замещения водорода кислоты на металл, или замещения гидроксигрупп основания кислотным остатком.
Средние соли (NaCl, Na2SO4, K3PO4),
Кислые соли (NaHCO3, MgHPO4, КH2PO4),
Основные соли (FeOHCl, Al(OH)2Cl, (CaOH)2CO3,
Двойные соли (KAl(SO4)2),
Комплексные соли (Ag[(NH3)2]Cl, K4[Fe(CN)6]).
Характерные реакции и генетическая связь неорганических соединений разных классов представлены в Таблицах, для реакций, протекающих в растворе, кроме молекулярных уравнений приведены полные и краткие ионные уравнения. Понятия растворимость и сила оснований и кислот, двойственная природа амфотерных гидроксидов рассмотрены в главе Диссоциация.
Таблица 2
Генетическая связь между соединениями разных классов
Таблица 3
studfiles.net
| Металл Ме | Вода н2о | Оксид металла МеxОy | Оксид неметал-ла неМеxОy | Щелочь Ме(ОН)x | Нераство- римое основание | Кислота НxКО | Соль Меx(КО)y | Индика- торы | |
| Оксид металла | —— | Щелочь Ме(ОН)x | —— | Соль Меx(КО)y | —— | —— | Соль+ н2о | —— | ——- |
| Оксид неметалла | —— | Кислота НxКО | Соль Меx(КО)y | —— | Соль+ н2о | —— | —— | —— | —— |
| Щелочь | —— | —— | —— | Соль+ н2о | —— | —— | Соль+ н2о | Нераств. основание +соль | Меняет окраску |
| Нераство- римое основание | —— | —— | —— | —— | —— | —— | Соль+ н2о | —— | —— |
| Кислота | Соль+H2 Кроме НNO3 | —— | Соль+ н2о | —— | Соль+ н2о | Соль+ н2о | —— | Кислота или соль выпадают в осадок | Меняет окраску |
| Соль | Более активный металл вытесня-ет менее активный из раствора соли | —— | —— | —— | Нераств. основание +соль | —— | Кислота или соль выпадают в осадок | Одна из образующихся солей Выпадает в осадок | —— |
multiurok.ru
Тренировочные задания. Характерные химические свойства неорганических веществ

Материал для ответа на эти задания вы найдете в уроках 11–19 (Неорганическая химия). Чтобы правильно ответить на эти вопросы, вам необходимо знать химические свойства элементов и их соединений.
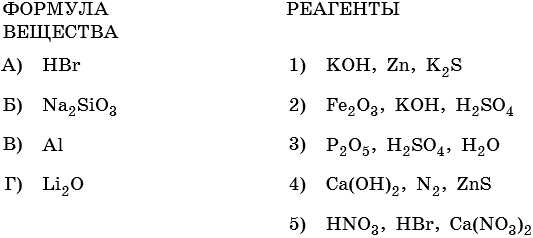
1. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

2. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

3. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

4. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

5. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

6. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

7. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

8. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

9. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

10. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

11. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

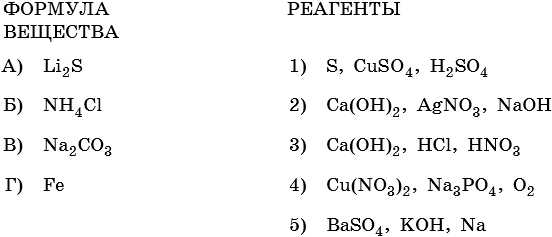
12. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

13. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

14. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

15. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
16. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

17. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

18. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

19. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

20. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

21. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

22. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

23. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

24. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

25. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

26. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
27. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

28. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

29. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

30. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

31. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

32. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

33. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

34. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

35. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

36. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

37. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

38. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

39. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

40. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

41. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

42. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

43. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

44. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

45. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

46. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

47. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

48. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

49. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.

50. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
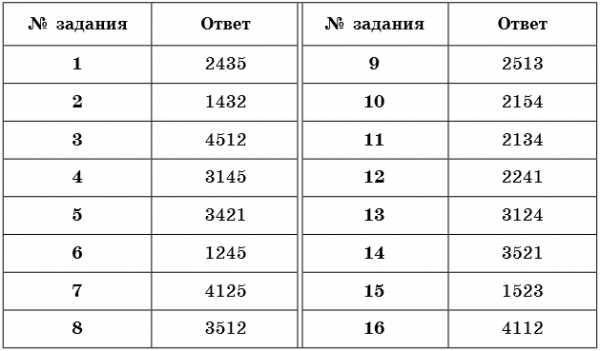
Ответы
himi4ka.ru
Классификация неорганических веществ
Простые вещества.
Молекулы состоят из атомов одного вида (атомов одного элемента). В
химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения).
Молекулы состоят из атомов разного вида (атомов различных химических
элементов). В химических реакциях разлагаются с образованием нескольких
других веществ.
| Неорганические вещества | |
| Простые | Металлы |
| Неметаллы | |
| Сложные | Оксиды |
| Основания | |
| Кислоты | |
| Соли | |
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия
Аллотропия — способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С — алмаз, графит, карбин.
O — кислород, озон.
S — ромбическая, моноклинная, пластическая.
P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле, например кислород O2 и озон O3
2) образованием различных кристаллических форм, например алмаз и графит.
ОСНОВАНИЯ
Основания
— сложные вещества, в которых атомы металлов соединены с одной или
несколькими гидроксильными группами (с точки зрения теории
электролитической диссоциации, основания — сложные вещества, при
диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид — анионы OH—).
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Получение
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O ® 2NaOH + H2
Ca + 2H2O ® Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Химические свойства
| Щёлочи | Нерастворимые основания |
| 1. Действие на индикаторы. | |
| лакмус — синий метилоранж — жёлтый фенолфталеин — малиновый |
— |
| 2. Взаимодействие с кислотными оксидами. | |
| 2KOH + CO2 ® K2CO3 + H2O KOH + CO2 ® KHCO3 |
— |
| 3. Взаимодействие с кислотами (реакция нейтрализации) | |
| NaOH + HNO3 ® NaNO3 + H2O | Cu(OH)2 + 2HCl ® CuCl2 + 2H2O |
| 4. Обменная реакция с солями | |
| Ba(OH)2 + K2SO4 ® 2KOH + BaSO4¯ 3KOH+Fe(NO3)3 ® Fe(OH)3¯ + 3KNO3 |
— |
| 5. Термический распад. | |
| — | Cu(OH)2 —t°® CuO + H2O |
ОКСИДЫ
Классификация
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
| ОКСИДЫ | |
| Несолеобразующие | CO, N2O, NO |
| Солеобразующие | Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na2O; MgO; CuO |
| |
Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды ZnO; Al2O3; Cr2O3; SnO2 |
| |
Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7 SO2; SO3; P2O5; Mn2O7; CrO3 |
| |
Основным оксидам соответствуют основания, кислотным — кислоты, амфотерным — и те и другие |
Получение
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ® 2MgO
4P + 5O2 ® 2P2O5
S + O2 ® SO2
2CO + O2 ® 2CO2
2CuS + 3O2 ® 2CuO + 2SO2
CH4 + 2O2 ® CO2 + 2H2O
4NH3 + 5O2 —кат.® 4NO + 6H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 —t°® CuO + H2O
(CuOH)2CO3 —t°® 2CuO + CO2 + H2O
2Pb(NO3)2 —t°® 2PbO + 4NO2 + O2
2HMnO4 —t°;H2SO4(конц.)® Mn2O7 + H2O
Химические свойства
| Основные оксиды | Кислотные оксиды |
| 1. Взаимодействие с водой | |
| Образуется основание: Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2 |
Образуется кислота: SO3 + H2O ® H2SO4 P2O5 + 3H2O ® 2H3PO4 |
| 2. Взаимодействие с кислотой или основанием: | |
| При реакции с кислотой образуется соль и вода MgO + H2SO4 —t°® MgSO4 + H2O CuO + 2HCl —t°® CuCl2 + H2O |
При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 ® BaCO3 + H2O SO2 + 2NaOH ® Na2SO3 + H2O |
| Амфотерные оксиды взаимодействуют | |
| с кислотами как основные: ZnO + H2SO4 ® ZnSO4 + H2O |
с основаниями как кислотные: ZnO + 2NaOH ® Na2ZnO2 + H2O (ZnO + 2NaOH + H2O ® Na2[Zn(OH)4]) |
| 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. | |
| Na2O + CO2 ® Na2CO3 | |
| 4. Восстановление до простых веществ: | |
| 3CuO + 2NH3 ® 3Cu + N2 + 3H2O P2O5 + 5C ® 2P + 5CO |
|
www.examen.ru
