| Предельные углеводороды . | Непредельные углеводороды . |
Ароматические или Арены |
||||
|
Алканы |
Циклоалканы |
Алкены |
Диеновые |
Алкины |
||
|
1.Общая формула |
Cnh3n CH4-МЕТАН С6Н12-ГКСАН С10Н22-ДЕКАН |
CnH2n С6Н12-ЦИКЛОГЕКСАН С3Н6-ЦИКЛОПРОПАН С4Н8-ЦИКЛОБУТАН |
CnH С2Н4-ЭТЕН С6Н12-ГЕКСЕН С4Н8-БУТЕН |
CnH2N-2 С3Н8-ПЕНТАДИЕН С3Н4-ПРОПАДИЕН С6Н10-ГЕКСАДИЕН |
CnH2N-2 С3Н4-ПРОПИН С4Н6-БУТИН С7Н12-ГЕПТИН |
CnH2n-6 С6Н6-БЕНЗОЛ С7Н8-ТУЛУОЛ С8Н10-КСИЛОЛ |
|
2.Строение |
||||||
| А) тип гибридизации |
sp3 -гибридизация |
sp3 -гибридизация |
sp2-гибридизация |
sp-гибридизация |
sp-гибридизация |
sp2-гибридизация |
| Б) угол связи |
∟ 109*28′ |
∟ 60*, 90*, 100*, 120* |
∟120* |
∟ 120* |
∟ 180* |
∟ 120* |
| В) длина связи (нм) |
0,154 |
0,154 |
0,134 |
0,134 |
0,12 |
0,142 |
| Г) форма молекулы |
тетраэдр |
стремится к тетраэдру |
плоская |
плоская |
линейная |
плоская |
| Д) структурная формула |
H H C H (МЕТАН) H |
CH2 CH2———CH2 (ЦИКЛОПРОПАН) |
Н H C=C H H (ЭТЕН) |
CH2=C=CH2 (ПРОПАДИЕН 1,2) |
HC≡CH (ЭТИН) |
CH
CH (БЕНЗОЛ) HC HC CH CH |
| 3.Изомерия | ||||||
|
1.Структурная |
По положению заместителя в ядре ! |
|||||
| А) строение углеродного скелета |
1) H3C-CH2-CH2-CH3 (Бутан) 2)H3C-CH-CH3 CH3 (2метил пропан) |
1) CH2-CH-CH3 CH2-CH2 (метил бутан) |
1) CH2=CH-CH2-CH3 (бутен 1) 2) CH2=C-CH3 CH3 (метилпрорен 1) |
1)CH2=C=CH-CH2-CH3 (пентадиен 1,2) 2)CH2=C=C-CH3 CH3 (2метилБутадиен1,2) |
1)CH≡C-CH2-CH2-CH3 (пентин 1) 2)CH≡C-CH-CH3 CH3 (2метилбутин1) |
1) CH3 CH3 -ортоксилол2) CH3 CH3 -Мметаксилол3 ) CH3-ПАРАКСИЛОЛ CH3 |
| Б) по положению двойной (тройной) связи |
CH2=CH-CH2-CH3 (бутен 1) CH3-CH=CH-CH3 (бутен2) |
1)CH2=C=CH-CH2-CH3 (пентадиен 1,2) 2)CH3=CH-CH=CH-CH3 (пентадиен 1,3) |
1)CH≡C-Ch3-CH3 (бутин 1) 2)CH3-C≡C-CH3 (бутин 2) |
|||
| В) с углеводородом Другого класса |
1)с алкенами 2) CH CH2=CH-CH3 CH———CH (пропен) (циклопропан) |
С циклоалканами (см циклоалканы) | С алкинами (см Алкины) |
С диеновыми : 1) CH2=C=CH2 (пропадиен) 2) CH≡C-CH3 (пропин) |
||
| Г) по положению радикала |
1) CH2-CH-CH3 2)CH2-CH-CH3 CH2-CH-CH3 CH3-CH-CH2 (1,2диметилбутан) (1,3диметилбутан) |
|||||
|
2.Пространственная |
||||||
| Д)Пространственная изомерия (цис-транс изомерия) |
CH3 CH3 CH3 H C=C C=C H (цис) H H (транс) CH3 |
CH3 CH=CH2 CH3 H C=C C=C H H H CH=Ch3 |
||||
|
3.Химические свойства . |
||||||
| А)Горение |
CH4+O2→CO2+H2O+Q МЕТАН |
CH2 CH2——CH2+O2→CO2+H2O+Q |
С2H4+O2→CO2+H2O+Q ЭТЕН |
Те же свойства что и у алкенов но реакции происходят в 2 этапа ! |
1.полное сгорание 2C2H2+5O2→4CO2+2H2O+Q 2 неполное сгорание С2H2+O2→C+H2O |
1.полное сгорание C6H6 +O2→CO2+H2O 2. Неполное сгорание C6H6+O2→C+H2O+Q |
| Б)Термическое разложение |
C4H10→4C+5H2+Q БУТАН |
С2H4→C+H2-Q ЭТЕН |
1. CH2=CH-CH=CH2+H2→ бутадиен CH2-CH=CH-CH2 Бутен2 H H 2. CH3-CH=CH=CH3+H2→ бутэн2 CH3-(CH2)2-CH3 бутан |
C2H2→C+H2 |
C6H6→C+H2 -Q |
|
| В)р замещения |
*Ch5+CL2→CH3CL+HCL хлорметан *CH3CL+CL2→CH2CL2+HCL дихлорметан *CH2CL2+CL=CHCL3+HCL Трихлорметан *CHCL3+CL2→CCL4+HCL тэтрахлорметан |
C7h24+Br2→C7h23Br+HBr (бромциклогептан) |
1. C6H6+CL2→C6H5-CL хлорбензол 2.C6H6+HNO3→C6H5-NO3 нитробензол |
|||
|
Г)Р присоединения (+H2, +H HAL ,+HAL2, +H2O) |
Р изомеризации CH3-Ch3-CH2-CH3 CH3-CH-CH3 CH3 (2 МЕТИЛПРОПАН) |
CH CH2—CH2+H2→CH3-CH2-CH3 (пропан) СH2 CH2—CH2+Br2→CH2+CH2+CH2 (1,3ДИБРОМПРОПАН) Br Br |
*CH2=CH2+H2→CH3+CH3ЭТАН *С2H4+HOH→CH3-CH2OH ЭТАНОЛ *C2H4+HCL→CH3-CH2CL ХЛОРЭТАН *C2H4+CL2→CH2CL-CH2CL ДИХЛОРЭТАН |
2 ЭТАПА : ≡→=→- 1. CH≡CH+2H2→CH3-CH3 ЭТИН 2. СH≡CH+2CL2→ ЭТИН CHCL2-CHCL2 (1122ТЕТРАХЛОЭТАН) 3. C2H2+2HCL→CH2CL=CH2CL 1,2 ДИХЛОРЭТАН 4. C2H2+H2O→CH3-C=O H (Альдегид) |
1. Гидрирование C6H6+3H2→C6H12 (циклогексан) 2.C6H6+3CL2→C6H5CL |
|
| Д) Полимеризация |
*2С2H4+O2→2CH2-CH2 O ПОЛИЭТИЛЕН |
n(CH2=CH-CH=CH2) → ДИВИНИЛ (-CH2-CH=CH-CH2-)n поливинил |
3C2H2→C6H6 (Бензол) |
|||
mirznanii.com
Тема №6 «Классификация органических и неорганических веществ»
Оглавление
- Классификация веществ
- Классификация неорганических веществ
- Классификация органических веществ
- Циклические углеводороды
- Ациклические углеводороды
- Замещенные углеводороды
- Номенклатура
- Виды формул в органической химии
- Задания для самопроверки
Классификация веществ
Самая простая классификация заключается в том. что все известные вещества делят на неорганические и органические. К органическим веществам относят углеводороды и их производные. Все остальные вещества — неорганические.
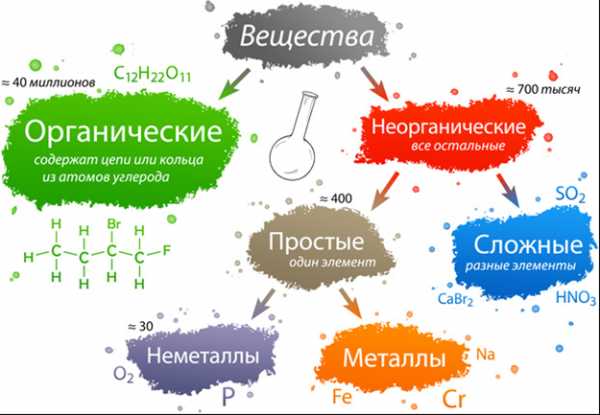
Классификация неорганических веществ
Неорганические вещества по составу делят на простые и сложные.
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
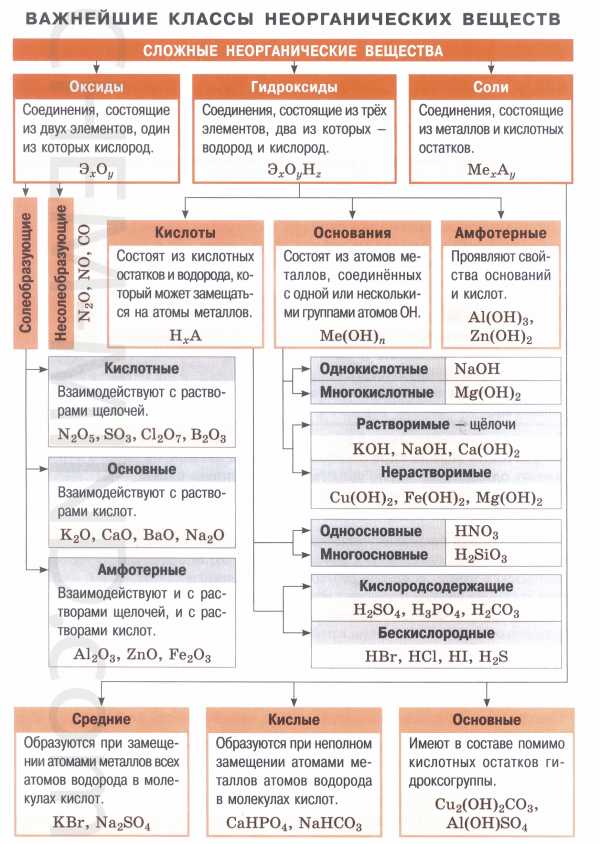
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли.
- Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
- Основные оксиды — это оксиды металлов в степенях окисления +1 и +2. К ним относятся:
- оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr
- оксиды металлов главной подгруппы второй группы (Mg и щелочноземельные металлы) Mg — Ra
- оксиды переходных металлов в низших степенях окисления
- Кислотные оксиды —образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2, SiO2, CrO3 и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными.
- Амфотерные оксиды — образованы амфотерными металлами со С.О. +2, +3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
- Несолеобразующие оксиды — оксиды неметаллов со С.О.+1, +2 (СО, NO, N2O, SiO).
- Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН). Общая формула оснований: М(ОН)у, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2). Основания делятся на растворимые (щелочи) и нерастворимые.
- Кислоты — (кислотные гидроксиды) — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка.
- Амфотерные гидроксиды — это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований.
- Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков. Такое определение относится к средним солям.
- Средние соли — это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
- Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия. Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
- Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН – групп, входящих в состав соли.Например, (CuOH)2CO3 – гидроксокарбонат меди (II).Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например, KAl(SO4)2, KNaSO4.
- Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
- Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
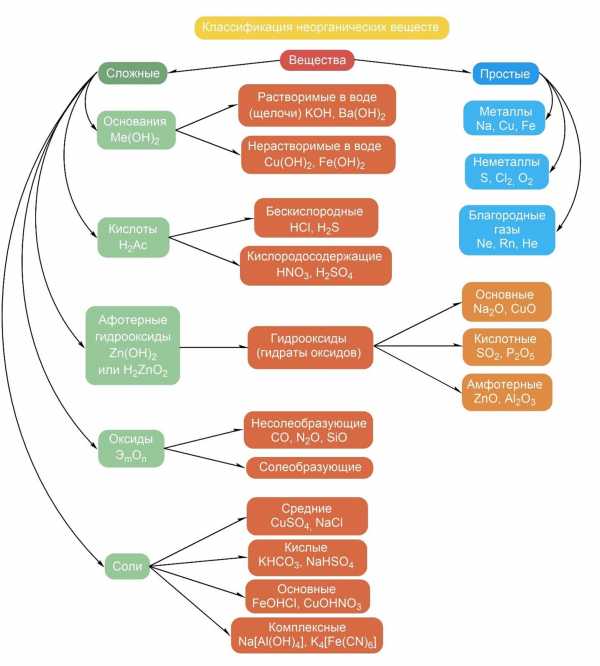 Классификация неорганических соединений
Классификация неорганических соединений
Классификация органических веществ
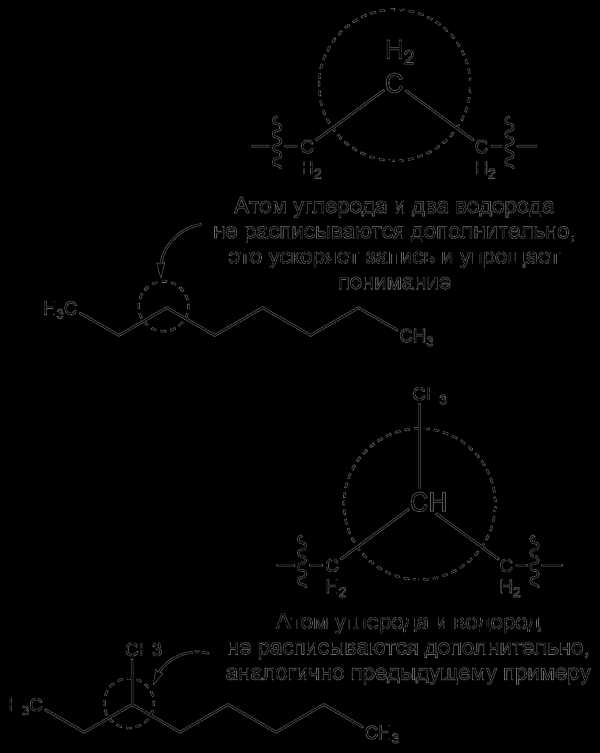
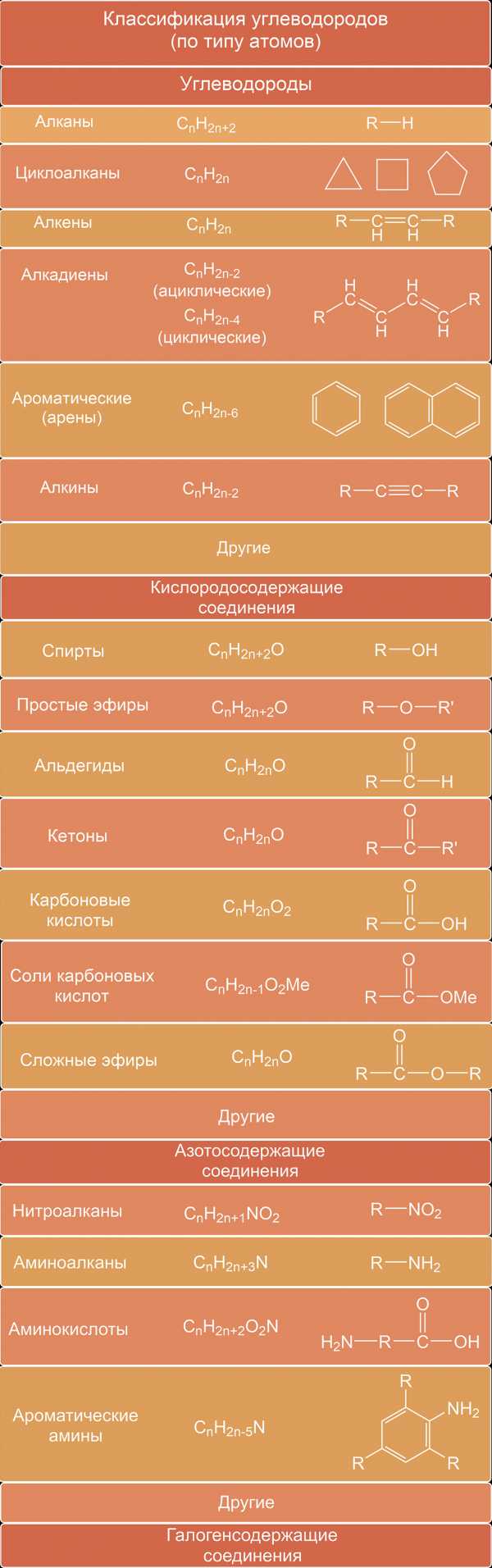
Соединения, состоящие только из атомов водорода и углерода, называют углеводородами. Прежде чем начать данный раздел, запомни, для упрощения записи, химики не расписывают в цепочках углероды и водороды, однако не забывай что углерод образует четыре связи, и если на рисунке углерод связан двумя связями, то еще двумя он связан с водородами, хоть последнее и не указано:
Циклические углеводороды
В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью — ациклические (алифатические) и циклические — с замкнутой цепью атомов.
Циклические делятся на две группы: карбоциклические соединения и гетероциклические.
Карбоциклическне соединения, в свою очередь, включают два ряда соединений: алициклические и ароматические.
Ароматические соединения в основе строения молекул имеют плоские углеродсодержащие циклы с особой замкнутой системой π-электронов. образующих общую π-систему (единое π-электронное облако).
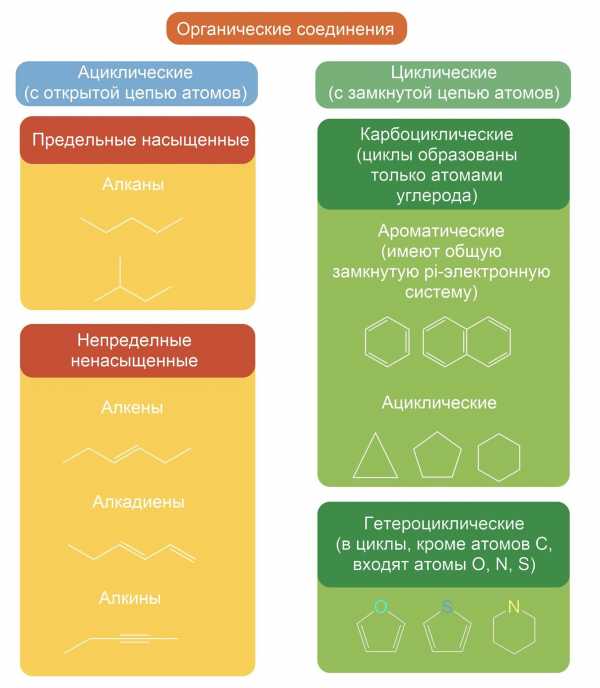
Как ациклические (алифатические), так и циклические углеводороды могут содержать кратные (двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными), в отличие от предельных (насыщенных), содержащих только одинарные связи.
Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием p-атомных орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-атомных орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-атомных орбиталей по обе стороны от линии соединения атомов.
В случае образования ароматической системы, например, бензола C6H6, каждый из шести атомов углерода находится в состоянии sp2 — гибридизации и образует три сигма-связи с валентными углами 120 °. Четвёртый p-электрон каждого атома углерода ориентируется перпендикулярно к плоскости бензольного кольца. В целом возникает единая связь, распространяющаяся на все атомы углерода бензольного кольца. Образуются две области пи-связей большой электронной плотности по обе стороны от плоскости сигма-связей. При такой связи все атомы углерода в молекуле бензола становятся равноценными и, следовательно, подобная система более устойчива, чем система с тремя локализованными двойными связями.
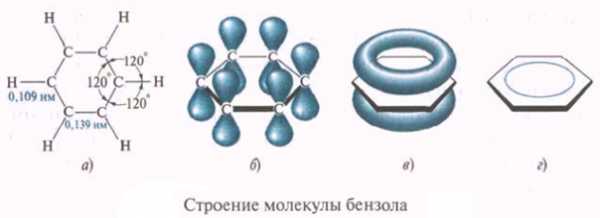
Ациклические углеводороды
Предельные алифатические углеводороды называют алканами, они имеют общую формулу СnН2n + 2, где n — число атомов углерода. Старое их название часто употребляется и в настоящее время — парафины:
Непредельные алифатические углеводороды с одной тройной связью называют алкинами. Их общая формула СnН2n — 2
Предельные алициклические углеводороды — циклоалканы, их общая формула СnН2n:
Мы рассмотрели классификацию углеводородов. Но если в этих молекулах один или большее число атомов водорода заменить на другие атомы или группы атомов (галогены, гидроксильные группы, аминогруппы и др.), образуются производные углеводородов: галогенопроизводные, кислородсодержащие, азотсодержащие и другие органические соединения.

Атомы или группы атомов, которые определяют самые характерные свойства данного класса веществ, называются функциональными группами.
Углеводороды в их производные с одной и той же функциональной группой образуют гомологические ряды.
Гомологическим рядом называют ряд соединений, принадлежащих к одному классу (гомологов), по отличающихся друг от друга по составу на целое число групп —СН2— (гомологическую разность), имеющих сходное строение и, следовательно, сходные химические свойства.
Сходство химических свойств гомологов значительно упрощает изучение органических соединений.
Замещенные углеводороды
- Галогенопроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. В соответствии с этим могут существовать предельные и непредельные моно-, ли-, три- (в общем случае поли-) галогенопроизводные.Общая формула галогенопроизводных предельных углеводородов R—Г.К кислородсодержащим органическим веществам относят спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры.
- Спирты — производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы.Спирты называют одноатомными, если они имеют одну гидроксильную группу, и предельными, если они — производные алканов.Общая формула предельных одноатомных спиртов: R—ОН.
- Фенолы — производные ароматических углеводородов (ряда бензола), в котором один или несколько атомов водорода в бензольном кольце замещены на гидроксильные группы.
- Альдегиды и кетоны — производные углеводородов, содержащие карбонильную группу атомов (карбонил).В молекулах альдегидов одна связь карбонила идет на соединение с атомом водорода, другая — с углеводородным радикалом.В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами.
- Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенные атомом кислорода: R=О—R или R—О—R2.Радикалы могут быть одинаковыми или разными. Состав простых эфиров выражается формулой СnН2n+2O.
- Сложные эфиры — соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал.
- Нитросоединения — производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу —NO2.
- Амины — соединения, которые рассматривают как производные аммиака, в котором атомы водорода замещены на углеводородные радикалы.В зависимости от природы радикала амины могут быть алифатическими. В зависимости от числа замещенных на радикалы атомов водорода различают первичные амины, вторичные, третичные. В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми. Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу. Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом, — аминогруппу —NH2 и карбоксил -СOОН.
Известны и другие важные органические соединения, которые имеют несколько разных или одинаковых функциональных групп, длинные линейные цепи, связанные с бензольными кольцами. В таких случаях строгое определение принадлежности вещества к какому-то определенному классу невозможно. Эти соединения часто выделяют в специфические группы веществ: углеводы, белки, нуклеиновые кислоты, антибиотики, алкалоиды и др. В настоящее время известно также много соединений, которые можно отнести и к органическим, и к неорганическим. Их называют элементоорганическими соединениями. Некоторые из них можно рассматривать как производные углеводородов.
Номенклатура
Рекомендуем посмотреть наш гайд по на
www.chem-mind.com
Обобщающая таблица по органической химии по теме «Углеводороды»
Обобщающая таблица по органической химии
Углеводороды
nH2n+2(n≥1)
CnH2n
(n≥2)
CnH2n-2
(n≥2)
CnH2n-2
(n≥3)
CnH2n
(n≥3)
CnH2n-6
(n≥6)
Особен-ности строения
Все связи одинарные
С-С
σ-связи
Есть двойная связь
С=С
(связи: σ,1-π)
Есть тройная связь
С≡С
(σ,2-π связи)
Есть две двойных связи между атомами углерода
(σ,2-π связи)
Есть цикл
σ-связи
/бензольное кольцо/
Тип гибриди-зации ключевых атомов углерода
sp3
тетраэдрическое строение
угол связи 109,28ₒ
sp2
плоское строение
угол связи 120ₒ
sp
линейное строение
угол связи 180ₒ
sp2 или sp
sp3
sp2
единая система сопряжённых связей, плоское строение
угол связи 120ₒ
Суффикс в названии
-ан
-ен
(-илен)
-ин
-диен
Цикло-…..ан
Тривиальные названия
……бензол или
фенил-
Пример
C3H8
CH3-CH2-CH3 пропан
C3H6
CH2=CH-CH3 пропен
(пропилен)
C3H4
CH≡C-CH3 пропин
C3H4 CH2=C=CH2 пропадиен
С6Н12 — циклогексан
С6Н6 — бензол
С6Н5 СН3 — толуол
/метилбензол/
Виды изомерии
-Углеродного скелета (с С4)
-Углеродного скелета (с С4)
-Положения = связи (с С4)
— Межклассовая с циклоалканами (с С3)
-Геометрическая изомерия (цис, транс)
-Углеродного скелета (с С4)
-Положения ≡ связи (с С4)
-Межклассовая с алкадиенами (с С3)
-Углеродного скелета (с С5)
-Взаимного положения = связей (с С4)
-Межклассовая с алкинами (с С3)
-Геометрическая изомерия (цис, транс)
-Углеродного скелета (размер цикла и положение заместителей)
-Межклассовая с алкенами (с С3)
Геометрическая-
У бензола и толуола – нет.
У гомологов (с С8) –изомерия углеродного скелета (заместителей и их взаимного положения в кольце)
Физичес-кие свойства
С1-С4-газы,
С5-С15 –жидкости с запахом,
с С16 –твёрдые вещества.
С2-С4-газы,
С5-С16 –жидкости,
с С17 –твёрдые вещества.
малорастворимы в воде
С2-С4-газы,
С5-С16 –жидкости,
с С17 –твёрдые вещества.
малорастворимы в воде
Бутадиен -1,3 – газ
Изопрен – легкокипящая жидкость
С3-С4-газы,
С5-С13 –жидкости,
с С14 –твёрдые вещества.
Первые члены ряда — бесцветные легкокипящие жидкости
Алканы
Алкены
Алкины
Алкадиены
Циклоалканы
Арены
Типичные химичес-кие реакции
1.Радикальное замещение
(с галогенами, азотной и серной кислотами)
2.Дегидрирование
3. Крекинг
4. Горение
5. Изомеризация
1. Присоединение по двойной связи
(водорода, галогенов, воды, галогеноводородов)
2. Полимеризация
3. Окисление (полное – горение, неполное окисление KMnO4)
1. Присоединение
(водорода, галогенов, воды, галогеноводородов)
2. Ди-, тримеризация
3. Окисление (полное – горение, неполное окисление KMnO4)
4. Замещение Н, стоящего у тройной связи на атомы металлов (слабые кислотные свойства)
1. Присоединение
(водорода, галогенов, воды, галогеноводородов)
2. Полимеризация (образуются синтетические каучуки)
3. Окисление (полное – горение, неполное)
1. Для малых циклов (С3-С4) характерны реакции присоединения (сходство с алкенами), для больших – реакции замещения (сходство с алканами).
2. Дегидрирование (образуются ароматические УВ)
3. Горение
1. Электрофильное замещение (с галогенами, азотной и серной кислотами, галогеналканами)
Возможно присоединение водорода
2. Возможно присоединение водорода
3. Окисление (полное – горение, неполное окисление KMnO4 (кроме бензола))
Отноше-ние к раствору KMnO4
Не реагируют
Обесцвечивание
Обесцвечивание
Обесцвечивание
Не реагируют
Окисление заместителей в цикле (бензол не реагирует)
Отноше-ние к бромной воде
Не реагируют
Обесцвечивание
Обесцвечивание
Обесцвечивание
Устойчивы
Не реагируют
Взаимодействие с галогенами
Радикальное замещение
Присоединение
Присоединение
Присоединение
У малых – присоединение, у больших – замещение.
Электрофильное (по кольцу) или радикальное (по боковой цепи) замещение
Каталити-ческое присоеди-нение водорода
Нет
Да
Да
Да
Да, для малых циклов
Да
Возможность получения полимеров
Нет
Да
Да
Да
Нет
Нет
infourok.ru
Таблица «Классификация органических соединений»
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Названия некоторых органических веществ. УГЛЕВОДОРОДЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Алканы
CnH2n+2
CH4 метан
Алкены
CnH2n
C2H4 этен CH2 ═ CH2
(CH2 ═ CH─) радикал винил
этилен
C3H6 пропен CH2═ CH─CH3
пропилен
Циклолканы
CnH2n
C4H8 циклобутан CH2─ CH2
│ │
CH2─ CH2
Алкины
CnH2n—2
C2H2 этин CH ≡ CH
ацетилен
Алкадиены
CnH2n—2
CH2═ CH─CH ═ CH2
бутадиен -1,3
дивинил
CH2═ C─CH ═ CH2
│
CH3
2-метилбутадиен -1,3
изопрен
Арены
Ароматические
углеводороды
CnH2n-6
C6H6 бензол
(C6H5─) радикал
фенил
C6H5CH3 CH3
метилбензол │
C7H8
толуол
C6H4(CH3)2 C8H10
1,2-диметилбензол
CH3
│
─ CH3
орто-ксилол
(о-ксилол)
C6H4(CH3)2 C8H10
1,3-диметилбензол
CH3
│
─ CH3
мета-ксилол
(м-ксилол)
C6H4(CH3)2 C8H10
1,4-диметилбензол CH3
│
│
CH3
пара-ксилол
(п-ксилол)
Арены
непредельные
CnH2n-8
C6H5─CH═ CH2
винилбензол ─CH ═ CH2
стирол
Названия некоторых органических веществ.
СПИРТЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предельные
одноатомные
спирты
CnH2n+1OH
CnH2n+2O
R─ OH
CH3OH метанол
метиловый спирт
древесный спирт
C2H5OH этанол
этиловый спирт
Непредельные
одноатомные
спирты
CnH2n-1OH
CH2═ CH─CH2─OH
пропен-2-ол-1
аллиловый спирт
Предельные
многоатомные
спирты
CH2 ─ CH2 этандиол-1,2
│ │
OH OH
этиленгликоль
CH2 ─ CH ─ CH2
│ │ │
OH OH OH
пропантриол-1,2,3
глицерин
Фенолы
C6H5OH Фенол OH
гидроксибензол │
карболовая кислота
C6H4(CH3)OH 2-метилфенол
1-гидрокси-2-метилбензол
OH
│
─ CH3
орто-крезол
(о- крезол)
C6H4(CH3)OH 3-метилфенол
1-гидрокси-3-метилбензол
OH
│
─ CH3
мета-крезол
(м- крезол)
C6H4(CH3)OH 4-метилфенол
1-гидрокси-4-метилбензол
OH
│
│
CH3
пара-крезол
(п- крезол)
Ароматические
спирты
C6H5─CH2 ─ OH
фенилиметанол ─CH2─OH
бензиловый спирт
Названия некоторых органических веществ.
ПРОСТЫЕ ЭФИРЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Простые эфиры
CnH2n+2O
R – O – R1
CH3 – O – CH3 метоксиметан
диметиловый эфир
C2H5 – O – C2H5 этоксиэтан
диэтиловый эфир
CH3 – O – C2H5 метоксиэтан
метилэтиловый эфир
Названия некоторых органических веществ.
АЛЬДЕГИДЫ. КЕТОНЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предельные
альдегиды
CnH2n+1СОН
CnH2nO
RCOH
О
//
R─С
\
H
HCOH метаналь О
//
H─С
\
H
муравьиный альдегид,
формальдегид
CH3COH этаналь О
//
CH3─С
\
H
уксусный альдегид,
ацетальдегид
Непредельные
альдегиды
CH2═ CH─COH О
пропеналь //
CH2═ CH─C
\
H
акриловый альдегид, акролеин
Ароматический
альдегид
C6H5COH O
//
бензальдегид С ─H
│
бензойный альдегид
Кетоны
CnH2nO
RCOR
R – C – R
||
O
CH3 – C – CH3 пропанон
||
O
ацетон, диметилкетон
Названия некоторых органических веществ.
КАРБОНОВЫЕ КИСЛОТЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предельные
карбоновые
кислоты
CnH2n+1СОOН
CnH2nO2
RCOOH
О
//
R─С
\
OH
HCOOH метановая О
кислота //
(соли метаноат) H─С
\
OH
муравьиная
кислота
(соли формиаты)
CH3COOH этановая О
кислота //
(соли этаноат) CH3─С
\
OH
уксусная
кислота, уксус
(соли ацетаты)
высшие предельные кислоты
C15H31COOH гексадекановая кислота
пальмитиновая к-та
(соли пальмитаты)
C17H35COOH октадекановая кислота
стеариновая к-та (соли стеараты)
Непредель-ные
кислоты
CH2═ CH─COOH О
пропеновая //
кислота CH2═ CH─C
\
OH
акриловая кислота
(соли акрилаты)
CH2═ C─COOH
| 2-метилпропеновая
CH3 кислота
метакриловая кислота
(соли метакрилаты)
высшие непредельные кислоты
C17H33COOH
олеиновая кислота
(имеет одну двойную связь)
C17H31COOH
линолевая кислота
(имеет две двойные связи)
C17H29COOH
линоленовая кислота
(имеет три двойные связи)
Аромати-ческая
кислота
C6H5COОH O
//
С ─ОH
│
бензойная кислота
(соли бензоаты)
Двух-основная кислота
предельная
HOOC – COOH
этандиовая кислота
щавелевая кислота
ароматическая
1,4-бензолдикарбоновоя кислота СOОH
│
|
СOОH
терефталевая кислота
Названия некоторых органических веществ.
СЛОЖНЫЕ ЭФИРЫ.
Формула соединений
Систематическое название и пояснение
Тривиальные названия
HCOOCH3
метилметаноат
метилформиат, метиловый эфир муравьинной кислоты
CH3COOCH3
метилэтаноат
метилацетат, метиловый эфир уксусной кислоты
CH3COOC2H5
этилэтаноат
этилацетат, этиловый эфир уксусной кислоты
CH2 ═ CH─COOCH3
метилпропеноат
Метилакрилат, метиловый эфир акриловой кислоты
CH2 ═ CH─COOCH3
|
CH3
Метил -2-метилпропеноат
Метилметакрилат, метиловый эфир метакриловой кислоты
ЖИРЫ
(сложные эфиры глицерина и высших карбоновых кислот)
CH2 – O – COC17H35
|
CH – O – COC17H35
|
CH2 – O – COC17H35
тристеарин (твердый жир)
CH2 – O – COC17H33
|
CH – O – COC17H33
|
CH2 – O – COC17H33
триолеин (жидкий жир)
CH2 – O – COC17H33
|
CH – O – COC17H35
|
CH2 – O – COC17H35
олеодистеарин (твердый жир)
Названия некоторых органических веществ.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предель-ные
амины
R – NH2 первичный
CH3 – NH2
метиламин
R –NH–R вторичный
CH3 – NH – CH3
диметиламин
R – N – R третичный
|
R
CH3 – N – CH3
|
CH3
триметиламин
Аромати-ческий
амин
C6H5NH2
аминобензол NH2─
фениланин
анилин
Аминокис-лоты
NH2 – CH – COOH
|
R
NH2 – CH2 – COOH
аминоэтановая кислота
аминоуксусная кислота, глицин
NH2 – CH – COOH
|
СH3
2-аминопропановая к-та
аланин
NH2 – CH – COOH
|
СH2─
фенилаланин
Названия некоторых органических веществ.
Систематическое название и пояснение
Тривиальные названия
тринитроглицерин C3H5(ONO2)3
CH2 ─ CH ─ CH2 сложный эфир глицерина
│ │ │ и азотной кислоты
ONO2ONO2ONO2
динамит (взрывчатое вещество)
триацетилцеллюлоза (полимер)
(сложный эфир целлюлозы и уксусного ангидрида)
[C6H7O2( O–COCH3)3]n
ацетатное волокно
полигексаметиленамид (полимер)
(–CO –(CH2)5–NH – )n
капрон (синтетическое волокно)
тринитроцеллюлоза сложный эфир целлюлозы
[C6H7O2( O–NO2)3]n и азотной кислоты
пироксилин (взрывчатое вещество)
1,2,3,4,5,6-гексахлорциклогексан C6H6Cl6
(продукт взаимодействия бензола с хлором)
гексахлоран
2,4,6-тринитрофенол C6H2(NO2)3OH
(продукт взаимодействия фенола с азотной кислотой)
Пикриновая кислота
(взрывчатое вещество)
2 – хлорбутадиен – 1,3
CH2═ C─CH ═ CH2
│
Cl
хлоропрен
Стереорегулярный каучук, полученный полимеризацией хлоропрена
[─CH2─ CCl ═ CH ─ CH2─]n
хлоропреновый каучук
Стереорегулярный каучук, полученный полимеризацией бутадиена – 1,3
[─CH2─ CH ═ CH ─ CH2─]n
бутадиеновый каучук
Стереорегулярный каучук, полученный полимеризацией изопрена
[─CH2─ C(CH3) ═ CH ─ CH2─]n
изопреновый каучук
Полимер, полученный из метилового эфира метакриловой кислоты
(─CH2 ─ C(CH3)(COOCH3)─)n
полиметилметакрилат, органическое стекло
Полиэтилентерефталат, полимер, полученный из сложного эфира терефталевой кислоты и этиленгликоля
лавсан, найлон, полиэстер
1- хлорэтен CH2 ═ CHCl
винилхлорид
Поливинилхлорид, полимер, полученный полимеризацией винилхлорида (─CH2 ─CH ─ )n
│
Cl
основа для производства искусственной кожи
Фенолформальдегидная смола, полимер, полученный поликонденсацией фенола и формальдегида OH
|
(─CH2 ─ ─ CH2 ─ )n
Основа для получения фенолформальдегидных пластмасс
Малкова С.В., учитель химии МБОУ Лужайской ООШ Нижегородской обл. Страница 6
infourok.ru
Номенклатура
Лекции для студентов лечебного факультета
Лекция 1
Тема: Классификация органических соединений. Номенклатура органических соединений.
Цель лекции:знакомство с классификацией и номенклатурой органических соединений
План:
Предмет и задачи органической химии. Значение её для фармации.
Классификация органических соединений.
Принципы тривиальной и рациональной номенклатуры.
Принципы номенклатуры ИЮПАК.
Предмет и задачи органической химии.
Органическая химия – это раздел химии, посвященный изучению строения, способов синтеза и химических превращений углеводородов и их функциональных производных.
Термин «органическая химия » впервые ввел шведский химик Йенс Якоб Берцеллиус в 1807 г.
Благодаря особенностям своего строения органические вещества очень многочисленны. Сегодня их число достигает 10 млн.
В настоящее время состояние органической химии таково, что позволяет научно спланировать и осуществить синтез любых сложных молекул (белков, витаминов, ферментов, лекарственных препаратов и т. д.).
Органическая химия тесно связана с фармацией. Она позволяет осуществлять выделение индивидуальных лекарственных веществ из растительного и животного сырья, синтезирует и проводит очистку лекарственного сырья, определяет структуру вещества и механизм химического действия, позволяет определять подлинность того или иного лекарственного препарата. Достаточно сказать, что 95 % лекарственных средств имеют органическую природу.
Классификация органических соединений
В классификации принимаются за основу два важнейших признака: строение углеродного скелетаи наличие в молекулефункциональных групп.
По строению углеродного скелета органические. соединения делятся на три большие группы.
I Ациклические(алифатические) соединения, имеющие открытую углеродную цепь как неразветвлённую, так и разветвлённую.
К ним относятся:
Алканы СН3– СН2– СН2– СН3
Алкены СН = СН – СН2– СН3
Алкины СН= С – СН2– СН3
Алкадиены СН2= СН – СН = СН2
II Циклические соединения, которые в свою очередь делятся на карбоциклические и гетероциклические.
Карбоциклическиесоединения-
это соединения в которых углеродная
цепь замкнута в цикл (кольцо). Они в свою
очередь подразделяются наалициклические
и ароматические. Примером алициклических
углеводородов является циклогексан, а
ароматических – бензол.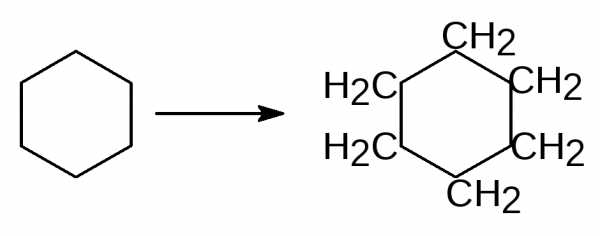
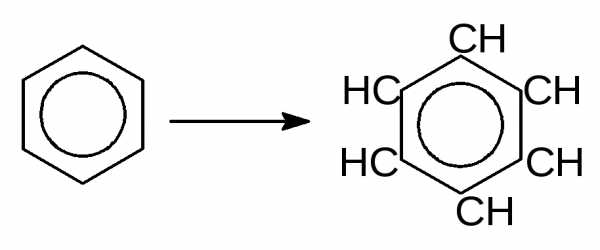
Циклогексан Бензол
Гетероциклическиесоединения (от греческогоheteros– другой), содержащие в цикле не только атомы углерода, но и атомы других элементов, чаще всего азота, кислорода, серы. Например:
Родоначальными соединениями в органической химии признаны углеводороды, состоящие только из атомов углерода и водорода. Разнообразные органические соединения можно рассматривать как производные углеводородов, полученные введением в них функциональных групп.
Функциональной группой называют структурный фрагмент молекулы, характерный для данного класса органических соединений и определяющий его химические свойства.
Например, свойства спиртов определяются наличием гидроксогруппы (— ОН), свойства аминов – аминогруппы (— NH2), карбоновых кислот наличием в молекуле карбоксильной группы (-СООН) и так далее.
Таблица 1. Основные классы органических соединений
|
Название класса органического соединения |
Общая формула |
Название функциональной группы |
|
Галогенопроизвоные |
СН3— Сl |
галоген |
|
Спирты |
СН3— ОН |
гидроксильная |
|
Фенолы |
С6Н5ОН |
гидроксильная |
|
Простые эфиры |
СН3– О – СН3 |
алкоксильная |
|
Амины |
СН3–NH2 |
аминогруппа |
|
Нитросоединения |
СН3–NО2 |
нитрогруппа |
|
Альдегиды |
СН3– С=О Н |
альдегидная |
|
Кетоны |
СН3– С — О |
карбонильная |
|
Карбоновые кислоты |
СН3— СООН |
карбоксильная |
Такая классификация важна потому, что функциональные группы во многом определяют химические свойства данного класса соединений.
Если соединения содержат несколько функциональных групп и они одинаковые, то такие соединения называют полифункциональными(СН2ОН– СНОН– СН2ОН — глицерин), если молекула содержит разные функциональные группы, то этогетерофункциональноесоединение (СН3– СН(ОН) —СООН — молочная кислота). Гетерофункциональные соединения можно сразу отнести к нескольким классам соединений.
3. Принципы тривиальной и рациональной номенклатуры.
Номенклатура органических соединений является первым этапом освоения научной терминологии. Номенклатура – это система правил, позволяющих назвать данное соединение.
Исторически первой была тривиальная номенклатура. В названии веществ по этой номенклатуре отражались способы получения вещества или его природные источники. Например, лактоза (молочный сахар) выделена из молока, пальмитиновая кислота выделена из пальмового масла и т. д. Многие соединения до сих пор называются по тривиальной номенклатуре, т.к. они более просты и удобны. Но они требуют запоминания и не отражают строения соединения. Например – муравьиная кислота, глюкоза, лимонная кислота.
С развитием химии появились попытки научного подхода к названию соединений. Появилась рациональная (радикальная) номенклатура. Ее называют радикало-функциональной, т.к. название по этой номенклатуре строится по названию радикала и функциональной группы. Атомы углерода нумеровались буквами греческого алфавита (α, β, γ и т.д.). Первым атомом углерода считался атом углерода, стоящий за атомом углерода функциональной группы.
Принципы номенклатуры ИЮПАК
Научные принципы номенклатуры были утверждены в 1965 г. международным союзом теоретической и прикладной химии (IUPAC). Отсюда и название (IUPAC- Международный союз теоретической и прикладной химии).
Для пользования этой номенклатурой необходимо знать ряд номенклатурных терминов –
Органический радикал– это остаток молекулы из которой удален один или несколько атомов водорода, при этом остаются свободными одна или несколько валентностей. Если из молекулы алкана удален один атом водорода, то суффикс –ан замещается на суффикс –ил. Например, СН4– метан, а СН3– метил.
Родоначальная структура– составляет основу называемого соединения. Ею, является самая длинная углеродная цепь, содержащая наибольшое количество заместителей и кратных связей или цикл в циклических соединениях. Если соединение содержит цепь и цикл, то за основу выбирают цепь.
Характеристическая группа – функциональная группа, связанная с родоначальной структурой или частично входящая в её состав
Заместитель – любой атом или группа атомов, замещающие атом водорода в исходном соединении. Таким образом, заместителем может быть любая функциональная группа или УВ радикал.
Составление названия органического соединения по международной номенклатуре проводят в следующей последовательности:
Определяют старшую функциональную группу, если она присутствует и родоначальную структуру соединения.
Старшую функциональную группу определяют с учетом старшинства всех функциональных групп. (См. таблицу 2)
Нумерация родоначальной структуры проводят так, чтобы старшая функциональная группа имела наименьший номер или так, чтобы заместители получили наименьшие номера. В гетероцикллах начало нумерации определяет гетероатом.
Название строят как сложное слово, состоящее из приставки, корня, суффикса и окончания.
В состав приставки входят младшие функциональные группы и УВ радикалы в алфавитном порядке с указанием места положения.
В состав корня входит название главной цепи или цикла.
Суффикс определяет степень насыщенности: если все связи одинарные –ан,двойная – ен, тройная– ин.
Окончание определяет старшая функциональная группа
Таблица 2 Порядок старшинства функциональных групп, обозначаемых префиксами и суффиксами
|
Функциональная группа |
Префикс |
Окончание |
|
-(С)ООН1 |
— |
овая кислота |
|
-СООН |
карбокси |
Карбоновая кислота |
|
-SO3H |
сульфо |
Сульфоновая кислота |
|
-(C)=N |
— |
нитрилы |
|
-C=O |
оксо |
аль |
|
-(С)=О |
оксо |
он |
|
-ОН |
гидрокси |
ол |
|
-SH |
меркапто |
тиол |
|
NH2 |
амино |
амин |
Рекомендуемая литература
Основная
1. Лузин А. П., Зурабян С. Э., Н. А. Тюкавкина, Органическая химия (учебник для учащихся средних фармацевтическх и медицинских заведений), 2002 г. С.23-34.
Дополнительная
Егоров А. С., Шацкая К. П.Химия. Пособие – репититор для поступающих в вузы
Кузьменко Н. Е., Еремин В. В., Попков В. А.Начала химии М., 1998. С. 57-61.
Райл С. А., Смит К., Уорд Р. Основы органической химии для студентов биологических и медицинских специальностей М.: Мир, 1983.
4. Лекции преподавателей.
4
studfiles.net
Качественные реакции органических соединений (Таблица)
Справочная таблица содержит качественные реакции органических соединений, такие как алканы, алкены, бензол, фенол, спирты, амины и другие вещества.
|
Органическое соединение |
Реактив |
Наблюдаемая качественная реакция |
|
Алканы |
Пламя |
Обьмно определяют путем исключения. Низшие алканы горят голубоватым пламенем |
|
Алкены С=С |
1) Бромная вода 2) Раствор КМnO4 3) Горение |
1) Обесцвечивание раствора 2) Обесцвечивание раствора, выпадение бурого осадка МnО2 3) Горят слегка желтоватым пламенем (частицы углерода) |
|
Бензол |
Горение |
Обычно определяют путем исключения. Горит коптящим пламенем |
|
Фенол |
1) Бромная вода 2) Раствор Na2СОз 3) FeCl3 |
1) Обесцвечивание, выпадение белого осадка трибромфенола 2) Выделение углекислого газа 3) Фиолетовое окрашивание |
|
Спирты |
1) Na 2) Горение 3) Мерная горячая прокаленная Сu-проволока |
1) Выделение водорода 2) Горят светлым голубоватым пламенем 3) Восстановление красной окраски у прокаленной горячей медной проволоки |
|
Многоатомные спирты |
Сu(ОН)2 + NaOH |
Синее окрашивание — образование глицератов и другое |
|
Амины |
1) Лакмус 2) HHal |
1) В водном растворе — синее окрашивание 2) Образуют соли с галогеноводородами — после выпаривания твердый осадок |
|
Анилин |
1) Бромная вода 2) HHal |
1) Обесцвечивание бромной воды, выпадение осадка триброманилина 2) После упаривания твердый осадок — соль гидрогалогенида анилина |
|
Альдегиды |
1) Аg2О 2) Сu(ОН)2 |
1) Реакция серебряного зеркала 2) Выпадение красного осадка Сu2O |
|
Карбоновые кислоты |
Лакмус |
Красное окрашивание Муравьиная — реакция серебряного зеркала Олеиновая — обесцвечивание бромной воды |
|
Крахмал |
Раствор I2 в KI или спиртовой раствор иода |
Синее окрашивание |
|
Белки |
Конц. HNO3 |
Желтое окрашивание, при добавлении щелочного раствора — оранжевое |
_______________
Источник информации:Насонова А.Е. Химия в таблицах. 8-11 класс. Справочное пособие, 2000
infotables.ru
