Молярная и нормальная концентрации
Молярная концентрация (молярность) показывает, сколько моль вещества содержится в 1 л (1000мл) раствора. Молярность обозначается СМ — моль/л, (M), например, 1 моль/л, 0,5 М.
Нормальная концентрация (нормальность) показывает, сколько эквивалентов растворенного вещества содержится в 1л (1000мл) раствора. Нормальность раствора обозначают буквами СН – моль/л, (Н), например, 1 моль/л, 0,5 Н.
0,2 М раствора Na2SO4 — это означает, что в 1л (1000мл) содержится 0,2 моля Na2SO4 или 0,2∙106=21,2 г Na2SO4.
В 1 л 0,2 н раствора Na2SO4 содержится 0,2 моль эквивалентов соли или 0,2∙53=10,6 г Na2SO4.
Решение. 1 моль H2SO4 составляет 98 г
0,1 моль H2SO4 составляет Х г
1000 мл раствора содержат 9,8 г H2SO4
500 мл раствора содержат Х г H2SO4
 =
4,9 г H2SO4
=
4,9 г H2SO4
Пример 7. Определить молярную и нормальную концентрацию раствора Na2CO3 , в 2 л которого содержится 21,2 Na2CO3.
Решение. 2000 мл раствора содержат 21,2 г Na2CO 3
1000 мл раствора содержат Х г Na2CO3
 =
10,6 г Na2CO3
=
10,6 г Na2CO3
Молярная масса Na2CO3 равна 106 г/моль следовательно, моль.
Эквивалентная
масса
г/моль,
следовательно, моль.
моль.
Ответ: 0,1 М, 0,2 н.
Пример 8. Определить молярность и нормальность 49 %-го раствора ортофосфорной кислоты (ρ =1,33) .
Решение. Известна процентная концентрация, т.е. содержание ортофосфорной кислоты 100 г раствора. Требуется определить, сколько грамм кислоты в 1000 мл раствора.
100
г раствора H
1000 мл ∙1,33 —- Х г,
 =
651,7 г.
=
651,7 г.
Масса одного моля H3PO4 составляет 98 г/моль.
Количество
моль ортофосфорной кислоты составляет
 =6,65
моль.
=6,65
моль.
Количество
моль эквивалентов составляет
 =19,95
моль, где 32,6 г/моль эквивалентная масса.
Таким образом, в 1 литре кислоты содержится
6,65 моль кислоты и 19,95 эквивалентов
кислоты. По определению это и есть
молярная и эквивалентная концентрации.
=19,95
моль, где 32,6 г/моль эквивалентная масса.
Таким образом, в 1 литре кислоты содержится
6,65 моль кислоты и 19,95 эквивалентов
кислоты. По определению это и есть
молярная и эквивалентная концентрации.
Ответ: 6,65 М, 19,95 н.
Пример 9. Для нейтрализации 30 мл 0,1 н раствора щелочи потребовалось 12 мл раствора кислоты. Определить нормальность кислоты.
Решение. Поскольку вещества взаимодействуют в эквивалентных количествах, то можно написать
Z кис. = Z осн.
Сн,к ∙Vк = Сн,щ ∙Vщ, где Сн,к , Сн,щ – нормальность кислоты и щелочи,
Vк, Vщ – соответствующие объемы.
моль/л.
Задание к разделу III
Провести необходимые вычисления
1. К 3л 10%-ного раствора HNO3 (ρ =1,054 г/мл) прибавили 5 л 2%-ного раствора той же кислоты (ρ =1,009 г/мл). Определить С % и См если считать, что объем полученного раствора равен 8 л.
3. Сколько воды необходимо прибавить к 200 мл 68 %-го раствора азотной кислоты (ρ =1,4 г/мл), чтобы получить 10 %-й раствор?
4. К 1л 10 %-го раствора KOH (ρ = 1,092 г/мл) прибавили 0,5 л 5% — го раствора (ρ =1,045 г/мл). Смесь разбавили до 5 л. Вычислить См, Сн.
5. Сколько мл 96 %-й серной кислоты (ρ=1,84 г/мл) необходимо взять для приготовления 2л 0,5Н раствора кислоты?
6. Какой объем 2Н раствора азотной кислоты можно приготовить из 50мл 100 %-й азотной кислоты (ρ = 1,51 г/мл)?
7. Сколько мл 38 %-й НСI (ρ =1,19 г/мл) необходимо для приготовления 1л 2Н раствора?
8. К 100мл 96 %-го раствора H2SO4 (ρ = 1,84 г/мл) прибавили 400 мл воды. Получился раствора плотностью 1.225 г/мл. Определить С %, С м.
9. Какой объем 96 %-й H2SO4 (ρ = 1,84 г/мл) необходимо взять для приготовления 250 мл 0,1М раствора?
10. Какие объемы 60 % H2SO4 (ρ = 1,5 г/мл) и 14 % — й H2SO4 (ρ = 1,1 г/мл) нужно смешать, чтобы получить 10 л 27 % -го раствора (ρ = 1,2 г/мл)?
11. Смешали 100мл 10 %-го гидроксида калия (ρ=1,08 г/мл) и 200мл 20%-ного раствора гидроксида натрия (ρ =1,22 г/мл). Вычислить молярную и нормальную концентрации гидроксида в полученном растворе.
12. Вычислить нормальность раствора KOH, полученного при сливании 100мл 10 %-го раствора (ρ = 1,08 г/мл) и 200 мл 20%-ного раствора (ρ = 1,2 г/мл), изменением объема при смешении можно пренебречь.
13. К 1л 60 %-го раствора ортофосфорной кислоты (ρ = 1.43) добавили 2л воды. Определить С % полученного раствора.
14. В 1л воды растворили 660 г KOH. Плотность полученного раствора 1,395. Определить С %, См, Сн.
15. К 100 мл 80 %-ного раствора HNO3 (ρ =1,46 г/мл) прибавили 400 мл воды. Получился раствор с плотностью 1,128 г/мл. Определить С % и Сн полученного раствора.
16. Сколько воды надо прибавить к 100 мл 48 %-ного раствора азотной кислоты (ρ = 1.3 г/мл ), чтобы получить 20 %-й раствор?
17. Сколько мл 56 %-й серной кислоты (ρ = 1, 46 г/мл) потребуется для приготовления 3л 1Н раствора?
18. 3,5 г технического едкого калия растворили в воде и получили 500 мл 0,1М раствора КОН. Каково процентное содержание КОН в образце?
19. Образец технической каустической соды содержит 92 % -й NaOH. Сколько граммов такой соды надо взять для приготовления 10 л 2М раствора NaOH?
20. Смешали два раствора: 500 мл 0,2М раствора NaOH и 2 л 0,1М раствора NaCl. Какова молярная концентрация NaOH и NaCl в полученном растворе?
21. Сколько мл 70 %-го раствора нитрата калия (ρ = 1,6 г/мл) нужно взять, чтобы получить 0,5 л 0,2Н раствора?
22. Смешали 100 мл 96 % -го раствора серной кислоты (ρ = 1,4 г/мл) и 100 мл 10 % — го раствора H2SO4 (ρ = 1,04 г/мл). Смесь разбавили водой до 3 л. Определить молярную и эквивалентную концентрации, полученного раствора.
23. Определить процентную концентрацию раствора, полученного при испарении 500 мл. воды из 1 л 5 % -го раствора хлорида натрия (ρ = 1,02 г/мл).
24. Сколько воды надо взять для приготовления 0,5 л 1,5 молярного раствора хлорида натрия из 10 г NaCl (ρ = 1,1 г/мл).
25. Вычислить нормальность раствора КОН, полученного при сливании 100 мл 10 % -го раствора (ρ = 1,08 г/мл) и 200 мл 20 % -го раствора (ρ = 1,2 г/мл). Объем полученного раствора принять равным 300 мл.
26. К 1 л 60 % -го раствора ортофосфорной кислоты (ρ = 1,43 г/мл) добавили 2 л воды. Определить процентную концентрацию.
27. В 600 мл раствора содержится 11, 76 г ортофосфорной кислоты. Определить молярную, нормальную и процентную концентрации.
28. Сколько мл 30 % го раствора азотной кислоты (ρ = 1,2 г/мл) нужно взять для приготовления 0,5 л 1 н раствора?
29. Вычислить процентную и молярную концентрации раствора, полученного при добавлении к 70 мл 4 % -го раствора бромида натрия (ρ = 1,2 г/мл) 10,5 г кристаллического NaBr.
30. К 100 мл 80 % -го раствора азотной кислоты (ρ=1,46 г/мл) прибавили 400 мл воды. Получился раствор с плотностью 1,128 г/мл. Определить процентную и нормальную концентрации раствора.
31. Сколько воды надо прибавить к 100 мл 48% раствора азотной кислоты (ρ=1,3 г/мл), чтобы получить 20 % раствор?
32. Сколько мл 56%-й серной кислоты (ρ=1,46 г/мл) потребуется для приготовления 3 л 1н раствора?33. Сколько нитрата меди (II) содержится в 50 мл 0,96 н раствора?
34. Какой объем воды при комнатной температуре надо добавить к 0,5 л 40%-го раствора едкого кали (ρ = 1,43 г/мл) для приготовления 10 % -го раствора?
35. Определить процентное содержание вещества в растворе, приготовленном смешиванием 100 мл 1 – молярного раствора уксусной кислоты (ρ = 1,007 г/мл) и 10 мл 60 % -го раствора той же кислоты (ρ = 1,064 г/мл).
36. 3,5 г технического едкого кали растворили в воде и получили 500 мл 0,1 М раствора KOH. Каково процентное содержание KOH в образце?
37. Образец технической каустической соды содержит 92 %-го NaOH. Сколько граммов такой соды надо взять для приготовления 10 л 2М раствора NaOH?
38. Смешали два раствора 500 мл 0,2 М раствора и 2 л 0,1 М раствора NaCl. Какова молярная концентрация NaOH и NaCl в полученном растворе?
39. Определить процентное содержание вещества в растворе, приготовленном смешиванием 200 мл 0,2 М BaCl2 (ρ=1,034 г/мл) и 50 мл 24 % раствора BaCl2 (ρ=1,06 г/мл).
40. Сколько мл 70 % -го раствора нитрата калия (ρ=1,6 г/мл) нужно взять, чтобы получить 0,5 л 0,2 Н раствора?
41. Имеется 40 %-й раствор гидроксида натрия (ρ = 1,43 г/мл). Какой объем этого раствора нужно взять для приготовления 10 л 15 % раствора (ρ = 1,16 г/мл)?
42. Найти массы воды и медного купороса CuSO4 ∙5H2O , необходимого для приготовления 3 л раствора, содержащего 10% безводной соли (ρ = 1,09 г/мл).
43. Сколько граммов глауберовой соли Na2SO4 ∙10H2O следует растворить в 500 г воды для получения 20 % -го раствора Na2SO4?
44. Сколько граммов Al2(SO4)3 ∙18H2O содержится в 1,5 кг 20 % — го раствора Al2(SO4)3?
45. Сколько граммов Na2НРO4 ∙12H2O требуется растворить в 1 л воды, чтобы получить 10 % -й раствор Na2НРO4?
46. Сколько граммов кристаллической соды Na2CO3 ∙ 10H2O необходимо взять для приготовления 100 г 0,5 % -го раствора Na2CO3?
47. Сколько молей MgSO4∙7H2O надо прибавить к 100 молям воды, чтобы получить 10 % -й раствор MgSO4?
48. Для борьбы с вредителями растений приготовлен раствор из 50 г BaCl2 ∙2H2O и 1 л воды, вычислить процентную концентрацию полученного раствора по безводной соли.
49. Сколько воды и буры Na2B4O7∙10H2O требуется для приготовления 1 кг 10% — го раствора Na2B4O7?
50. Сколько граммов кристаллогидрата СaCl2∙6H2O требуется для приготовления 7 л 0,25 н раствора СaCl2?
51. Сколько граммов NiCl2 ∙6H2O необходимо растворить в 1 л воды, чтобы получить 20 % раствор по безводной соли?
52. Сколько граммов FeSO4 ∙7H2O необходимо добавить к 400 мл 10 % раствора (ρ=1,1 г/мл) для получения 20 % -го раствора FeSO4?
53. Определить массу осадка BaCl2∙2H2O , который образуется из 5 л 1М раствора BaCl2.
54. Сколько граммов СuSO4 ∙5H2O и воды необходимо для приготовления 500 г 18 % -го раствора СuSO4 (ρ=1,2 г/мл)?
55. Сколько граммов щавелевой кислоты H2C2O4∙2H2O надо взять для приготовления 500 мл 0,02 н раствора H2C2O4 ?
56. Сколько мл 0,5 н раствора BaCl2 можно приготовить из 24,4 г BaCl2 ∙2H2O?
57. Сколько граммов медного купороса (CuSO4 ∙5H2O) образуется из 50 мл 0,2 н раствора CuSO4?
58. Определить молярную концентрацию FeSO4 полученного растворением в 0,5 л раствора 11,44 г FeSO4 ∙7H2O.
59. Определить процентную концентрацию раствора SrCl2 полученного растворением 84 г кристаллогидрата SrCl2∙6H2O в 100 г воды.
60. Сколько граммов глауберовой соли Na2SO4∙10H2O следует растворить в 500 г воды для получения 20 % -го раствора Na2SO4?
61. Определить молярную концентрацию CoCl2 полученного растворением в 1,2 л раствора 9,5 г CoCl2 ∙6H2O.
62. Определить молярную и эквивалентную концентрации растворенных веществ в следующих растворах
а) 16% раствора сульфата меди (ρ=1,18 г/мл).
б) 20% раствора хлорида цинка (ρ=1,17 г/мл).
в) 5% раствора ортофосфорной кислоты(ρ=1,2 г/мл).
г) 30,1% раствора азотной кислоты (ρ=1,185 г/мл).
д) 10% раствора сульфата натрия(ρ=1,1 г/мл).
е) 60% раствора уксусной кислоты (ρ=1,8 г/мл).
ж) 6% раствора ортоборной кислоты (ρ=1,2 г/мл).
з) 98% раствора серной кислоты (ρ=1,84 г/мл).
63. Определить молярную и процентную концентрации растворенных веществ в следующих растворах:
а)10 н раствора сульфата меди (ρ=1,18 г/мл).
б) 7,98 н раствора хлорида цинка (ρ=1,17 г/мл).
в) 5 н раствора ортофосфорной кислоты(ρ=1,27 г/мл).
г) 3,5 н раствора азотной кислоты (ρ=1.185 г/мл).
д) 1 н раствора сульфата натрия(ρ=1,1 г/мл).
е) 6 н раствора уксусной кислоты (ρ=1.068 г/мл).
ж) 4 н раствора ортоборной кислоты (ρ=1.2 г/мл).
з) 2 н раствора серной кислоты (ρ=1,84 г/мл).
64. Из 5 г карбоната натрия приготовлено 500 мл раствора. Какова нормальность и молярность этого раствора?
65. Какова процентная концентрация 5М раствора серной кислоты (ρ=1,29 г/мл), 2 н раствора сульфата никеля (II) (ρ=1,14 г/мл)?
66. К 100 мл 96 % раствора серной кислоты (ρ=1,84 г/мл) прибавили 400 мл воды. Определить ω и молярную концентрации полученного раствора (ρ=1,22 г/мл).
67. Сколько мл 5 %-го раствора серной кислоты (ρ=1,32 г/мл) пойдет на приготовление 2 л 0,5 н раствора серной кислоты?
68. 250 мл 96 %-го раствора серной кислоты (ρ=1,84 г/мл) разбавили водой до 1000 мл. Определить нормальную и молярную концентрации полученного раствора.
69. Сколько воды нужно прибавить к 200 мл 60 %-го раствора азотной кислоты (ρ=1,4 г/мл), чтобы получить 2 н раствор?
70. Сколько воды нужно выпарить из 2 л 1 М раствора гидроксида натрия, чтобы получить 10 %-го раствор (ρ=1,1 г/мл)?
71. До какого объема нужно разбавить 200 мл 20 %-го раствора хлорида меди (ρ=1,2 г/мл), чтобы получить 0,5 М раствор?
72. Сколько мл 2н раствора нитрата хрома (III) требуется для получения 0,2 молей гидроксида хрома (III)?
73. На нейтрализацию 250 мл 0,1 н раствора серной кислоты пошло 150 мл раствора гидроксида натрия. Какова нормальность раствора едкого натрия?
74. Сколько граммов серной кислоты содержится в 300 мл раствора, если на нейтрализацию его израсходовано 8 мл 1 н раствора гидроксида калия?
75. В 50 мл раствора содержится 0,5 г едкого натра. На нейтрализацию этого объема раствора потребовалось 25 мл раствора кислоты. Какова нормальность раствора?
76. Какова нормальная концентрация раствора нитрата серебра, если на реакцию с 0,924 г хлорида натрия израсходовано 16 мл раствора этой соли?
77. Сколько мл 20 %-го раствора серной кислоты (ρ=1,14 г/мл) вступило в реакцию с цинком, если при этом выделилось 56 л водорода? Сколько граммов цинка участвовало в реакции?
78. К раствору хлорида аммония добавили 100 мл 25 %-го раствора КОН (ρ=1,23г/мл). Вычислите объем выделившегося газа.
79. Какое количество моль сернистого газа необходимо пропустить через 200 мл 30% раствора NaOH (ρ=1,33 г/мл) для образования кислой соли?
80. Сколько требуется взять 2М раствора хлорноватистой кислоты, чтобы при взаимодействии его с карбонатом натрия получить 10 л СО2 у.н.?
81. Какой объем 20 %-го раствора гидроксида калия (ρ = 1,18 г/мл) необходимо взять для реакции с 200 мл 2 %-го раствора хлорида цинка (ρ = 1,02 г/мл), чтобы получить осадок гидроксида цинка?
82. Раствор, содержащий нитрат бария, смешан с 42 мл 26% раствора сульфата натрия (ρ = 1,3 г/мл). Сколько граммов сульфата бария образовалось?
83. Смешали 100 мл 4 %-го раствора хлороводородной кислоты (ρ=1,01 г/мл) и 50 мл 1М раствора гидроксида натрия. Сколько граммов соли образовалось? Какое вещество и в каком количестве взято в избытке?
84. Сколько мл 6,75 % -го раствора серной кислоты (ρ = 1,16 г/мл) требуется для реакции с раствором, содержащем 6,1 г BaCl2∙2H2O?
85. На 80 г цинка, содержащего 10% примесей, действуют 200 мл 20% -го раствора хлорноватистой кислоты (ρ=1,1 г/мл). Сколько хлорида цинка образовалось в результате реакции?
86. На 80 г цинка, содержащего 10 % примесей, действуют 200 мл 20 % -го раствора хлороводородной кислоты (ρ=1,1 г/мл). Сколько хлорида цинка образуется в результате реакции?
87. Сколько карбоната кальция получится при реакции 2,8 л СО2 и 200 г 5% — го раствора гидроксида кальция?
88. Какова нормальность раствора HCl, если на взаимодействие с 19,46 г карбоната натрия идет 2 л этого раствора?
89. При пропускании хлора через 500 мл раствора иодида калия вес выделившегося иода составил 75 г. Вычислить молярную концентрацию раствора иодида калия.
90. Для осаждения в виде BaSO4 всего бария, содержащегося в 500 мл раствора BaCl2 потребовалось 100 мл 0,3 н раствора H2SO4. Сколько граммов BaSO4 выпало в осадок? Чему равна нормальность раствора?
91.Какой объем 1 н раствора KOH потребуется для образования сульфида калия с сероводородом, полученным при взаимодействии сульфида железа (II) c 0,7 л 20 %-го раствора HCl (ρ=1,1 г/мл)?
92. Плотность раствора Na2CO3 равна 1,1 г/мл. Из 4 л этого раствора при действии соляной кислоты получено 60 л СО2 (н.у.). Вычислите процентную концентрацию Na2CO3 в этом растворе.
93. Какой объем 4 н раствора H2SO4 может взаимодействовать 0,65 л 20% раствора К2CO3 (ρ =1,19 г/мл)? Какой объем займет выделившийся газ при н.у.?
94. К 0,05 л 8 %-го раствора хлорида марганца (ρ=1,085 г/мл) прибавлено 0,2 л 10 %-го раствора гидроксида лития (ρ = 1,1 г/мл). Какое вещество взято в избытке и сколько его останется после реакции?
95. К 0,1 л 20% раствора хлорида бария (ρ=1,2 г/мл) прибавлен раствор сульфата хрома (III). Вычислить массу образовавшегося осадка BaSO4.
96. Какова масса Al(OH)3, если для его растворения потребовалось 0,2 л 30% раствора HNO3 (ρ=1,18)? Какой объем 2,5 н КОН необходимо затратить для растворения этого количества гидроксида алюминия?
97. Сколько миллилитров 8 % -го раствора NaOH (ρ=1,09 г/мл) требуется для нейтрализации 75 мл раствора H2SO4 , если известно, что из10 мл того же раствора можно получить 0,2334 г BaSO4.
98. Сколько молей хлорной кислоты необходимо для нейтрализации 1,5 л 0,25 М раствора гидроксида кальция?
99. Сколько миллилитров 8 %-го раствора едкого натра (ρ=1,1 г/мл) необходимо для растворения 8,1 г оксида цинка (II).
studfiles.net
массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, молярная доля, объёмная доля, титр.
Молярная концентрация равна количеству вещества (в молях), содержащегося в одном литре раствора. Она обозначается СМ и рассчитывается как отношение химического количества растворенного вещества (моль) Х к объему V раствора в литрах:
где m (Х) – масса растворенного вещества, г
М (Х) – молярная масса, г/моль
V – объем раствора, л.
Если объем V раствора измеряют в миллилитрах, то формула для расчета молярной концентрации имеет вид:
Молярная концентрация эквивалента (нормальность или нормальная концентрация) равна количеству вещества эквивалента (моль), содержащегося в одном литре раствора. Она обозначается Сн рассчитывается как отношение химического количества эквивалента растворенного вещества Х к объему раствора в литрах:
или, выразив в знаменателе молярную массу эквивалента через молярную массу вещества и фактор эквивалентности его в реакции по уравнению, получим:
В современных методах анализа широко используется разновидность массовой концентрации – титр.
Титр равен массе вещества (г), содержащейся в 1 мл раствора. Титр обозначается Т (Х) и рассчитывается, как отношение массы вещества Х к объему раствора V (мл):
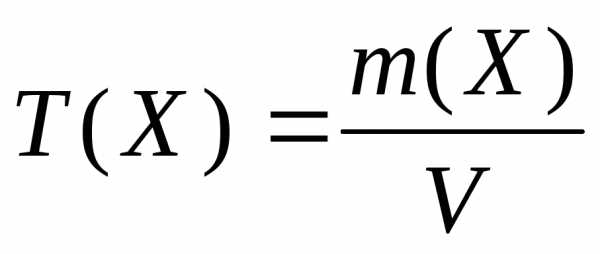
Можно установить связь между молярной концентрацией и титром:
Взаимосвязь молярной концентрацией раствора и его массовой долей описывается уравнением: ,
где ρ – плотность раствора, г/мл;
w (Х) – массовая доля растворенного вещества, %
Удобно использовать формулу, связывающую между собой молярную и нормальную концентрации:
В тех случаях, когда речь идет об отношении массы (или объема, или химического количества вещества) компонента к массе (или объему, или количеству вещества) всей системы, термин «концентрация» не употребляют. А говорят о «доле» – массовой, объемной или молярной. И выражают эту долю либо дробью, либо в процентах, принимая систему за 1 или за 100%.
Для обозначения доли компонента приняты следующие греческие буквы: массовая доля – ω (омега), объемная доля – φ (фи), молярная доля – χ (хи).
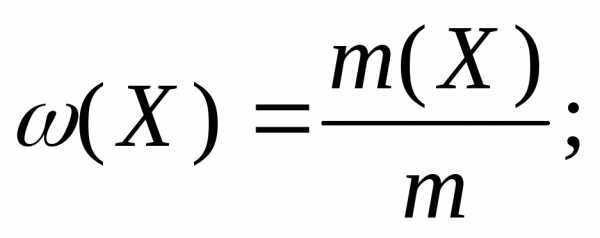


где m (Х) и m – массы компонента и масса всей системы
V (Х) и V – объемы компонента и объем всей системы
ν (Х) и Σ ν – количества вещества компонента и сумма всех количеств веществ всей системы.
Моляльность раствора – равна количеству вещества (моль) растворенного в 1 кг растворителя. Она обозначается Сm и рассчитывается по формуле:
42. Закон эквивалентов и его применение в количественном анализе. Способы определения точки эквивалентности. Способы приготовления рабочих растворов. Способы титрования: прямое, обратное, косвенное.
Химическим эквивалентом называется некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях.
Важнейшей характеристикой химического эквивалента является молярная масса эквивалента вещества, выраженная в г/моль.
Молярная масса эквивалента вещества (г/моль) – это масса 1 моль эквивалента вещества, рассчитываемая по формуле:
,
где fэ − фактор эквивалентности, определяемый из уравнения химической реакции.
Фактор эквивалентности fэ(Х) – число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Фактор эквивалентности рассчитывается по уравнению:
 ,
где Z
– суммарный заряд обменивающихся ионов
для кислотно-основных реакций или число
принятых или отданных электронов для
окислительно-восстановительных реакций.
,
где Z
– суммарный заряд обменивающихся ионов
для кислотно-основных реакций или число
принятых или отданных электронов для
окислительно-восстановительных реакций.
Закон эквивалентов: вещества взаимодействуют друг с другом и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам.
Для условной химической реакции аА + bВ → сС + dD:
νЭ (A) = νЭ (B) = νЭ (C) = νЭ (D),
где νЭ – химическое количество эквивалента вещества, моль
νЭ
=
 =>
=>
Титрование – это процесс постепенного добавления титранта к анализируемой пробе, продолжающийся до точки эквивалентности.
Точка эквивалентности (момент эквивалентности) – это момент, когда количество вещества эквивалента в добавленном растворе титранта становится равным количеству анализируемого вещества.
Титрант – это раствор точно известной концентрации, применяемый для титрования.
Существует два способа приготовления титрантов:
1. Взвешенную на аналитических весах точную навеску вещества растворяют в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (m) и объем полученного раствора (V), можно вычислить его титр: Т = m/V.
Титранты, приготовленные таким образом, называются стандартными растворами и для их получения применимы только те вещества, которые удовлетворяют следующим требованиям:
а) вещество должно быть химически чистым, т.е. должно содержать посторонних примесей не более 0,05-0,1%;
б) состав вещества должен строго соответствовать формуле;
в) вещество должно быть устойчивым при хранении и в твердом виде и в растворе;
2. Если вещества не удовлетворяют этим требованиям, то сначала готовят раствор приблизительно нужной концентрации, а затем устанавливают его точную концентрацию, титруя стандартным раствором. Такие титранты называются стандартизированными или рабочими растворами.
Разнообразные методы титриметрического анализа можно классифицировать по типу используемых реакций и по способу проведения анализа.
studfiles.net
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
,
где:
νi — количество i-го компонента, моль;
n — число компонентов;
Моляльность (молярная весовая концентрация)
Моляльность — количество растворённого вещества (число молей) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
,
где:
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
,
где:
m1 — масса растворённого вещества, г; V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используютмассовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций растворов к другим
От массовой доли к молярности:
,
где:
ρ — плотность раствора, г/л;
ω — массовая доля растворенного вещества в долях от 1;
M1 — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
,
где:
M — молярность, моль/л;
z — число эквивалентности.
От массовой доли к титру:
,
где:
ρ — плотность раствора, г/л;
ω — массовая доля растворенного вещества в долях от 1;
От молярности к титру:
,
где:
M — молярность, моль/л;
M1 — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
,
где:
M — молярность, моль/л;
ρ — плотность раствора, г/мл;
M1 — молярная масса растворенного вещества, г/моль.
От моляльности к мольной доле:
,
где:
mi — моляльность, моль/кг;
M2 — молярная масса растворителя, г/моль.
Эквивалентная масса окислителя(восстановителя) равна его мольной массе,деленной на число электронов,которое присоединяет(отдает) одна молекула окислителя(восстановителя)в данной реакции.
studfiles.net
Концентрация смеси — Википедия РУ
Концентра́ция или до́ля компонента смеси — величина, количественно характеризующая содержание компонента относительное всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного, или численного количества компонента, его массы, или объёма исключительно к объёму раствора[1] (типичные единицы измерения — соответственно моль/л, л−1, г/л, и безразмерная величина). Долей компонента ИЮПАК называет безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества.[2] Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам.
Массовая доля
Массовая доля — отношение массы компонента к массе смеси. Массовая доля измеряется в долях единицы или в процентах:
- ω=m1m{\displaystyle \omega ={\frac {m_{1}}{m}}}
- ω(%)=m1m⋅100%{\displaystyle \omega (\%)={\frac {m_{1}}{m}}\cdot 100\%}
где:
- ω — массовая доля компонента в долях
- ω(%) — массовая доля компонента в процентах
- m1 — масса компонента, г;
- m — общая масса смеси (для раствора — масса растворённого вещества плюс масса растворителя) г.
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля
Объёмная доля — отношение объёма компонента к объёму смеси. Объёмная доля измеряется в долях единицы или в процентах.
- υ=V1V{\displaystyle \upsilon ={\frac {V_{1}}{V}}} ,
где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)
Молярная концентрация (молярность, мольность[3]) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также используют выражение «в молярности». Возможно другое обозначение молярной концентрации CM{\displaystyle {C_{M}}} , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
- CM=νV{\displaystyle {C_{M}}={\frac {\nu }{V}}} ,
где:
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
- CH=CN=z⋅CM=z⋅νV=1feq⋅νV{\displaystyle {C_{H}}={C_{N}}=z\cdot {C_{M}}=z\cdot {\frac {\nu }{V}}={\frac {1}{f_{eq}}}\cdot {\frac {\nu }{V}}} ,
где:
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
- Xj=νj∑i=1nνi{\displaystyle X_{j}={\frac {\nu _{j}}{\sum _{i=1}^{n}\nu _{i}}}} ,
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация)
Моляльная концентрация (моляльность,[3] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
- Cm=νm2{\displaystyle {C_{m}}={\frac {\nu }{m_{2}}}} ,
где:
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
- T=m1V{\displaystyle T={\frac {m_{1}}{V}}} ,
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные (массо-объёмные) проценты
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[4] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[5]
Другие способы выражения концентрации
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm — от англ. parts per million). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций к другим
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От массовой доли к молярности:
- CM=1000⋅ρωM{\displaystyle C_{M}={\frac {1000\cdot \rho \omega }{M}}} ,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
- M — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
- Cn=CM⋅z{\displaystyle {C_{n}}={C_{M}}\cdot {z}} ,
где:
От массовой доли к титру:
- T=ρ⋅ω{\displaystyle {T}={\rho }\cdot {\omega }} ,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
От молярности к титру:
- T=0.001CM⋅M{\displaystyle {T}=0.001{C_{M}}\cdot {M}} ,
где:
- CM{\displaystyle {C_{M}}} — молярность, моль/л;
- M — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
- m=CMρ{\displaystyle m={\frac {C_{M}}{\rho }}} ,
где:
- CM{\displaystyle {C_{M}}} — молярность, моль/л;
- ρ — плотность раствора, г/мл;
От моляльности к мольной доле:
- Xi=mimi+1000/M{\displaystyle X_{i}={\frac {m_{i}}{m_{i}+1000/M}}} ,
где:
- mi — моляльность, моль/1000г;
- M — молярная масса растворителя, г/моль.
Наиболее распространённые единицы
| Эта статья или раздел содержит незавершённый перевод с английского языка. Вы можете помочь проекту, закончив перевод. |
Примечания
http-wikipediya.ru
