Атом — Википедия
Материал из Википедии — свободной энциклопедии
 Сравнительный размер атома гелия и его ядра
Сравнительный размер атома гелия и его ядра
А́том (от др.-греч. ἄτομος «неделимый[1], неразрезаемый[2]») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств[1][3].
Атомы состоят из ядра и электронов (точнее электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом[1]. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер[5].
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
ru.wikipedia.org
Строение атома — Викиверситет
Строение атома
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 0 | 0 | 1 | 1,7·10×10-24 |
| электрон | -1 | -1,6·10×10-19 | 0 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Свойства электрона
Перед изучением свойств электрона и правил формирования электронных уровней необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее «верных» представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества предположили еще древнегреческие философы (если какое-либо тело начать делить пополам, половинку ещё пополам и так далее, то этот процесс не сможет происходить до бесконечности; мы остановимся на частичке, которую уже не сможем поделить, — это и будет атом). После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома. Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов «упасть» на ядро, и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов
ru.wikiversity.org
Атом — Циклопедия
Строение атома и атомного ядра [1:15] Строение атома. Химия 11 класс. Часть 1 // UrokiXimii [28:23] Строение атома. Химия 11 класс. Часть 2 // UrokiXimii [19:58]Атом — наименьшая, электронейтральная, химически неделимая частица химического элемента. Атом состоит из плотного ядра из положительно заряженных протонов и электрически нейтральных нейтронов, которое окружено облаком отрицательно заряженных электронов. Когда количество протонов равно количеству электронов, атом электрически нейтрален; в противном случае он превращается в ион, имеющий определенный электрический заряд. Атомы классифицируются в соответствии с количеством протонов и нейтронов: количество протонов определяет химический элемент, а количество нейтронов — его нуклид.
Образуя между собой связи, атомы объединяются в молекулы и большие по размеру твердые тела.
[править] Общая характеристика строения атома
Современные представления о строении атома базируются на квантовой механике. На популярном уровне строение атома можно изложить в рамках волновой модели, которая опирается на модель Бора, но учитывает также дополнительные сведения из квантовой механики.
- Атомы состоят из элементарных частиц (протонов, электронов, и нейтронов). Масса атома в основном сосредоточена в ядре, поэтому большая часть объема относительно пуста. Ядро окружено электронами. Количество электронов равно количеству протонов в ядре, количество протонов определяет порядковый номер элемента в периодической системе. В нейтральном атоме суммарный отрицательный заряд электронов равен положительному заряду протонов. Атомы одного элемента с разным количеством нейтронов называются изотопами.
- В центре атома находится крошечное, положительно заряженное ядро, состоящее из протонов и нейтронов.
Ядро атома примерно в 100 000 раз меньше, чем сам атом. Таким образом, если увеличить атом до размеров аэропорта Борисполь, размер ядра будет меньше размера шарика для настольного тенниса.
- Ядро окружено электронным облаком, которое занимает большую часть его объема. В электронном облаке можно выделить оболочки, для каждой из которых существует несколько возможных орбиталей. Заполненные орбитали составляют электронную конфигурацию, характерную для каждого химического элемента.
- Каждая орбиталь может содержать до двух электронов, характеризующихся тремя квантовыми числами: основным, орбитальным и магнитным.
- Каждый электрон на орбитали имеет уникальное значение четвертого квантового числа: спина.
Орбитали определяются специфическим распределением вероятности того, где именно можно найти электрон. Примеры орбиталей и их обозначения приведены на рисунке справа. «Границей» орбитали считается расстояние, на котором вероятность того, что электрон может находиться вне ее, меньше 90 %.
- Каждая оболочка может содержать не больше строго определенного числа электронов. Например, ближайшая к ядру оболочка может иметь максимум два электрона, следующая — 8, третья от ядра — 18.
- Когда электроны присоединяются к атому, они занимают орбиталь с низкой энергией. Только электроны внешней оболочки могут участвовать в образовании межатомных связей. Атомы могут отдавать и присоединять электроны, становясь положительно или отрицательно заряженными ионами.
- Химические свойства элемента определяются тем, с какой легкостью ядро может отдавать или получать электроны. Это зависит как от числа электронов, так и от степени заполненности внешней оболочки.
[править] Электронные оболочки и орбитали
Сложные атомы имеют десятки, а для очень тяжелых элементов, даже сотни электронов. Электронные состояния атомов формируются всеми электронами, и невозможно определить, где находится каждый из них. Однако, в так называемом одноэлектронном приближении, можно говорить об определенных энергетических состояниях отдельных электронов.
Согласно этим представлениям существует определенный набор орбиталей, которые заполняются электронами атома. Эти орбитали образуют определенную электронную конфигурацию. На каждой орбитали может находиться не более чем два электрона (принцип исключения Паули). Орбитали группируются в оболочки, каждая из которых может иметь лишь определенное фиксированное количество орбиталей (1, 4, 10 и т. д.). Орбитали разделяют на внутренние и внешние. В основном состоянии атома внутренние оболочки полностью заполнены электронами.
На внутренних орбиталях электроны сильно связаны с ядром. Чтобы вырвать электрон из внутренней орбитали, нужно предоставить ему большую энергию, до нескольких тысяч электрон-вольт. Такую энергию электрон на внутренней оболочке может получить только поглотив квант рентгеновского излучения. Энергии внутренних оболочек атомов индивидуальные для каждого химического элемента, а потому по спектру рентгеновского поглощения можно идентифицировать атом. Эту индивидуальность используют в некоторых методах рентгеновской спектроскопии, в частности в рентгенофлуоресцентном анализе, рентгеновской спектроскопии поглощения, рентгеновской фотоэлектронной спектроскопии.
На внешней оболочке электроны находятся на большем расстоянии от ядра и слабее связаны с ним. Именно эти электроны участвуют в формировании химических связей, поэтому внешнюю оболочку называют валентной, а электроны внешней оболочки — валентными электронами.
[править] Ядерные свойства
Основная масса атома сосредоточена в ядре, которое состоит из нуклонов: протонов и нейтронов, связанных между собой силами ядерного взаимодействия.
Количество протонов в ядре атома определяет его атомный номер и то, которому элементу принадлежит атом. Например, атомы углерода содержат 6 протонов. Все атомы с определенным атомным номером имеют одинаковые физические характеристики и проявляют одинаковые химические свойства. В периодической таблице элементы перечислены в порядке возрастания атомного номера.
Общее количество протонов и нейтронов в атоме элемента называется массовым числом и определяет его атомную массу, поскольку протон и нейтрон имеют массу примерно равную 1 а.е.м. Нейтроны в ядре не влияют на то, которому элементу принадлежит атом, но химический элемент может иметь атомы с одинаковым количеством протонов и разным количеством нейтронов. Такие атомы имеют одинаковый атомный номер, но разную массу, и называются изотопами элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, который иногда называют протием — самая распространенная форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий)[1]. Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[2]
Когда пишут название изотопа, после него пишут массовое число. Например, изотоп углерод-14 содержит 6 протонов и 8 нейтронов, что в сумме составляет массовое число 14. Другой популярный метод нотации заключается в том, что атомная масса обозначается верхним индексом перед символом элемента. Например, углерод-14 обозначается, как 14C.
Атомная масса элемента, приведенная в периодической таблице, является усредненным значением массы изотопов, встречающихся в природе. Усреднения проводится в соответствии с распространенности изотопа в природе.
С увеличением атомного номера растет положительный заряд ядра, а, следовательно, кулоновское отталкивание между протонами. Чтобы удержать протоны вместе необходимо все больше нейтронов. Однако большое количество нейтронов нестабильно, и это обстоятельство накладывает ограничения на возможный заряд ядра и количество химических элементов, существующих в природе. Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[3][4] Химические элементы с большими атомными номерами имеют очень малый время жизни, могут быть созданы только при бомбардировке ядер легких элементов ионами, и наблюдаются лишь во время экспериментов с использованием ускорителей. По состоянию на февраль 2008 года самым тяжелым синтезированным химическим элементом является унуноктий.[5]
Многие изотопы химических элементов нестабильны и распадаются со временем. Это явление используется радиоэлементным анализом для определения возраста объектов, имеет большое значение для археологии и палеонтологии.
[править] Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц в нуклидов называют массовым числом. Значение массового числа близко к атомной массе нуклида. Массу покоя нуклида часто приводят в атомных единицах массы (а.е.м.) Эта единица определяется как 1/12 часть массы покоя нейтрального атома углерода-12, которая примерно равна 1,66×10−24 г.[6] Водород-1 или протий — легкий изотоп водорода, и атом с наименьшей массой, имеет массу около 1,007825 а.е.м.[7] Масса атома примерно равна произведению массового числа на атомную единицу массы.[8] Тяжелый стабильный изотоп — свинец-208[9] с массой 207,9766521 а.е.м.</ref> Так как массы даже самых тяжелых атомов в обычных единицах (например, в граммах) очень малы, в химии для измерения количества вещества используют моли. В одном моле любого вещества содержится одно и то же число атомов (примерно 6,022×1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а.е.м., то моль атомов этого элемента будет иметь массу 1 г. Например, атом углерода-12 имеет массу 12 а.е.м., значит, 1 моль углерода имеет массу 12 г.[10]
[править] Форма и размеры
Размер атома является величиной, трудно поддается измерению, ведь центральное ядро окружает размыта электронное облако. Для атомов, образующих твердые кристаллы, расстояние между смежными узлами кристаллической решетки может служить приближенным значением их размера. Для атомов, которые не образуют кристаллов, используют другие техники оценки, включая теоретические расчеты. Например, размер атома водорода оценивают 1,2×10−10 м. Это значение можно сравнить с размером протона (что является ядром атома водорода): 0,87×10−15 м и убедиться в том, что ядро атома водорода в 100 000 раз меньше, чем сам атом. Атомы других элементов сохраняют примерно то же соотношение. Причиной этого является то, что элементы с большим положительно-заряженным ядром притягивают электроны сильнее.
Еще одной характеристикой размеров атома является радиус Ван дер Ваальса — расстояние, на которое к данному атома может приблизиться другой атом. Межатомные расстояния в молекулах характеризуются длиной химических связей или ковалентным радиусом.
[править] Энергетические уровни
Значения энергии, которые может иметь атом, исчисляются и интерпретируются, исходя из положений квантовой механики. При этом учитываются такие факторы, как электростатическое взаимодействие электронов с ядром и электронов между собой, спины электронов, принцип неразличимости частиц. Существует определенный набор состояний, каждый из которых имеет определенное значение энергии. Состояние с наименьшей энергией называется основным состоянием. Другие состояния называются возбужденными. Атом находится в возбужденном состоянии конечное время, излучая рано или поздно квант электромагнитного поля (фотон) и переходя в основное состояние. В основном состоянии атом может находиться долго. Чтобы возбудиться, ему нужна внешняя энергия, которая может прийти к нему только из внешней среды. Атом излучает или поглощает свет только определенных частот, соответствующих разности энергий его состояний.
[править] Квантовые переходы в атоме
Между различными состояниями атомов возможны переходы, вызванные внешним возмущением, часто электромагнитным полем. Вследствие квантования состояний атома оптические спектры атомов состоят из отдельных линий, если энергия кванта света не превышает энергию ионизации. При более высоких частотах оптические спектры атомов становятся непрерывными. Вероятность возбуждения атома светом падает с дальнейшим ростом частоты, но резко возрастает при определенных характерных для каждого химического элемента частотах в рентгеновском диапазоне.
Возбужденные атомы излучают кванты света с теми же частотами, на которых происходит поглощение.
Переходы между различными состояниями атомов могут вызываться также взаимодействием с быстрыми заряженными частицами.
[править] Химические свойства
Химические свойства атома определяются в основном валентными электронами — электронами на внешней оболочке. Количество электронов на внешней оболочке определяет валентность атома.
Атомы последнего столбца периодической таблицы элементов имеют полностью заполненную внешнюю оболочку, а для перехода электрона на следующую оболочку нужно передать атому очень большую энергию. Поэтому эти атомы инертные, не склонные вступать в химические реакции, а соответствующие элементы называются инертными газами. Инертные газы сжижаются и кристаллизуются только при очень низких температурах.
Атомы первого столбца периодической таблицы элементов имеют на внешней оболочке один электрон, и являются химически активными. Их валентность равна 1. Характерным типом химической связи для этих атомов в кристаллизованном состоянии является металлическая связь.
Атомы элементов второго столбца периодической таблицы в основном состоянии имеют на внешней оболочке 2 s-электрона. Их внешняя оболочка заполнена, поэтому они должны быть инертными. Но для перехода из основного состояния с конфигурацией электронной оболочки s² в состояние с конфигурацией s¹p¹ нужно очень мало энергии, поэтому эти атомы имеют валентность 2, однако они проявляют меньшую активность.
Атомы элементов третьего столбца периодической таблицы элементов (в краткой форме) имеют в основном состоянии электронную конфигурацию s²p¹. Они могут проявлять различную валентность: 1, 3, 5. Последняя возможность возникает тогда, когда электронная оболочка атома дополняется до 8 электронов и становится замкнутой.
Атомы элементов четвертого столбца короткой формы периодической таблицы элементов основном имеют валентность 4 (например, углерод в составе углекислого газа), хотя возможна и валентность 2 (например, углерод в составе угарного газа). К этому столбцу принадлежит углерод — элемент, который образует самые разнообразные химические соединения. Соединениям углерода посвященный особый раздел химии — органическая химия. Другие элементы этого столбца — кремний, германий при обычных условиях является твердотельными полупроводниками.
Элементы пятого столбца имеют валентность 3 или 5.
Элементы шестого столбца короткой формы периодической таблицы в основном состоянии имеют конфигурацию s²p⁴ и общий спин 1. Поэтому они двухвалентные. Начиная с 3 периода, существует также возможность перехода атомов в возбужденные состояния s²p³d и sp³d², у которых валентность равна 4 и 6 соответственно.
Элементам седьмого столбца короткой формы периодической таблицы не хватает одного электрона на внешней оболочке для того, чтобы ее заполнить. Они в основном одновалентные. Однако они могут вступать в химические соединения в возбужденных состояниях, проявляя валентности 3, 5, 7.
Для переходных элементов характерно заполнение внешней s-оболочки, прежде чем полностью заполняется d-оболочка. Поэтому они в основном имеют валентность 1 или 2, но в некоторых случаях один из d-электронов участвует в образовании химических связей, и валентность становится равной трем. В образовании связей может принять участие и большее количество d-электронов. Именно элементам платиновой группы присущ широкий спектр валентностей[11] вплоть до максимального значения 8. А вот лантаноиды и актиноиды проявляют в основном валентность 3, реже 2, 4.
При образовании химических соединений атомные орбитали видоизменяются, деформируются и становятся молекулярными орбиталями. При этом происходит процесс гибридизации орбиталей — образование новых орбиталей, как специфической суммы базовых.
[править] Анализ и методы визуализации
Атомы слишком малы, чтобы их можно было наблюдать с помощью оптического микроскопа, разрешение которого не превышает десятых долей микрона. Разрешение электронного микроскопа целом сопоставимо с размерами атома, но все же получение изображений атомов в них — сложная техническая задача. Лучше отдельные атомы можно различить с помощью сканирующего туннельного микроскопа. При этом то изображение, которое видит исследователь, есть только результат компьютерной реконструкции на мониторе. Сканирующий туннельный микроскоп чувствует неровности на поверхности, в том числе неровности атомарных размеров, «на ощупь». В нем тонкий щуп сканирует поверхность в горизонтальном направлении, осуществляя такие движения в вертикальном направлении, чтобы поддерживать постоянным туннельный ток. Именно эти вертикальные смещения и записываются электроникой, которая в дальнейшем реконструирует изображение.
О существовании мельчайших частиц вещества человечество догадывалось еще с давних времен, однако подтверждение существования атомов было получено только в конце 19 века. Но почти сразу же стало понятно, что атомы, в свою очередь, имеют сложное строение, которым определяются их свойства.
Понятие атом, как и само слово, имеет древнегреческое происхождение, хотя истинность гипотезы о существовании атомов нашла свое подтверждение лишь в 20 веке.
Концепция атома как малейшей неделимой частицы материи впервые была предложена в начале I тысячелетия до н. э. и популяризована Демокритом — который, собственно, и ввел в научный оборот термин «атом». Основной идеей, которая стояла за данным понятием течение всех столетий, было представление о мире как о наборе огромного количества неделимых элементов, которые являются очень простыми по своей структуре и существуют от начала времен. В конце 19 — начале 20 веков, физики открыли первую из субатомных частиц — электрон, а несколько позже — атомное ядро, таким образом показав, что атом не является неделимым. Продвижение теории атома дал английский физик Дж. Томсон. Основным средством изучения Томсона были катодные лучи, используя их, он пришел к выводу, что атомы вещества содержат отрицательно заряженные частицы, которые получили название «электроны». В 1904 году Томсон представил первую модель строения атома — «пудинг с изюмом». В этой модели положительный заряд занимал весь объём атома и располагался там равномерно, электроны же находились внутри положительного заряда. Эрнест Резерфорд и Эрнест Марсден после опытов с бомбардировки золотой фольги альфа-частицами обнаружили, что небольшая часть альфа-частиц отражается, что идет вразрез с прогнозами модели Томсона. На основании этих результатов Резерфорд создал новую модель атома, получившую название планетарной. В этой модели положительный заряд и основная масса атома сосредоточены в небольшом ядре в центре, а отрицательно заряженные электроны вращаются вокруг ядра. Нильс Бор построил первую квантовую теорию атома водорода, которая получила название модели Бора. На смену теории Бора пришла квантовая теория, она учитывала волновые свойства электрона и других элементарных частиц.
[править] Натурфилософский атомизм
 Демокрит
Демокрит
Первым начал проповедовать атомистическое учение в 5 веке до нашей эры философ Левкипп. Затем эстафету подхватил его ученик Демокрит. Сохранились лишь отдельные фрагменты их работ, из которых становится ясно, что они исходили из небольшого количества достаточно абстрактных физических гипотез:
«Сладость и горечь, жара и холод смысл определения, на самом деле [только] атомы и пустота».
По Демокриту, вся природа состоит из атомов, мельчайших частиц вещества, которые покоятся или движутся в совершенно пустом пространстве. Все атомы имеют простую форму, а атомы одного сорта тождественны; многообразие природы отражает многообразие форм атомов и многообразие способов, в которые атомы могут сцепляться между собой. И Демокрит, и Левкипп считали, что атомы, начав двигаться, продолжают двигаться по законам природы.
Наиболее тяжелым для древних греков был вопрос о физической реальности основных понятий атомизма. В каком смысле можно было говорить о реальности пустоты, если она, не имея материи, не может иметь никаких физических свойств? Идеи Левкиппа и Демокрита не могли служить удовлетворительной основой теории вещества в физическом плане, так как не объясняли, из чего состоят атомы, на также почему атомы неделимы.
Через поколение после Демокрита, Платон предложил свое решение этой проблемы: «мельчайшие частицы принадлежат не царству материи, а царству геометрии; они представляют собой различные телесные геометрические фигуры, ограниченные плоскими треугольниками».
Через тысячу лет абстрактные рассуждения древних греков проникли в Индию и были восприняты некоторыми школами индийской философии. Но если западная философия считала, что атомистическая теория должна стать конкретной и объективной основой теории материального мира, индийская философия всегда воспринимала материальный мир как иллюзию. Когда атомизм появился в Индии, то он принял форму теории, согласно которой реальность в мире есть процесс, а не субстанция, и мы присутствуем в мире как звенья процесса, а не как сгустки вещества.
То есть и Платон, и индийские философы считали примерно так: если природа состоит из мелких, но конечных по размерам, долей, то почему их нельзя разделить, хотя бы в воображении, на еще более мелкие частицы, которые стали бы предметом дальнейшего рассмотрения
Римский поэт Лукреций (96 — 55 год до н. э.) был одним из немногих римлян, которые проявляли интерес к чистой науке. В своей поэме «О природе вещей» (De rerum natura) он подробно выстроил факты, свидетельствующие в пользу атомистической теории. Например, ветер, который дует с большой силой, хотя никто не может его видеть, наверное состоит из частиц, слишком малых, чтобы их разглядеть. Мы можем чувствовать вещи на расстоянии по запаху, звуку и теплу, которые распространяются, оставаясь невидимыми. Лукреций связывает свойства вещей со свойствами их составляющих, то есть атомов: атомы жидкости малы и имеют округлую форму, поэтому жидкость течет так легко и просачивается через пористое вещество, тогда как атомы твердых веществ имеют крючки, которыми они сцеплены между собой. Так же и разнообразные вкусовые ощущения и звуки различной громкости состоят из атомов соответствующих форм — от простых и гармоничных в извилистых и нерегулярных. Учение Лукреция были осуждены церковью, поскольку он дал достаточно материалистическую их интерпретацию: например, представление о том, что Бог, запустив один раз атомный механизм, более не вмешивается в его работу, или то, что душа умирает вместе с телом.
[править] Начала научной теории атома
Одна из первых теорий о строении атома, которая имеет уже современные очертания, была описана Галилеем (1564—1642). По его теории вещество состоит из частиц, которые не находятся в состоянии покоя, а под воздействием тепла движутся во все стороны; тепло — не что иное, как движением частиц. Структура частиц является сложной, и если лишить любую часть ее материальной оболочки, то изнутри брызнет свет. Галилей был первым, кто, хотя и в фантастической форме, представил строение атома.
В 17 и 18 веках химики установили, что химические вещества вступают в реакции в определенных пропорциях, которые выражаются с помощью малых чисел. Кроме того, они выделили определенные простые вещества, которые назвали химическими элементами. Эти открытия привели к возрождению идеи о неделимых частицах. Развитие термодинамики и статистической физики показало, что тепловые свойства тел можно объяснить движением таких частиц. В конце концов были экспериментально определены размеры атомов.
Основоположником атомной теории стал Джон Дальтон. Он доказал реальность атомов, первый ввел понятие «атомный вес», рассчитав при это атомный массы некоторых элементов. В 19 веке Джон Дальтон открыл закон кратных отношений и исходя из него развил теорию, названную им «новой системой химической философии», по которой химические вещества состоят из атомов, но он предполагал, что они неразделимы.[12] Новый толчок в становлении современного понимания атома дала молекулярно-кинетическая теория.
Первая модель атома Дж. Томсона «Пудинг с изюмом» Атомная модель РезерфордаВ 1897 году Джозеф Джон Томсон, изучая катодные лучи, открыл электрон и пришел к выводу, что они есть в каждом атоме. Таким образом, было опровергнуто предположение, что атомы являются неделимыми компонентами вещества.[13] Он создал первую модель строения атома, которая получила название модели пудинга с изюмом, где отрицательно заряженные электроны плавают в однородной положительно заряженной сфере. Эта модель была изменена в 1909 году. Ганс Гейгер,
Резерфорд пришел к выводу, что в весь положительный заряд сконцентрирован в малом объёме, а большинство атомного пространства пустое. α-частица — это ионизированные атомы гелия, и электроны, входящие в состав атома не способны отклонить α-частицу. Во время опыта большинство α-частиц проходили без отклонения, но небольшая часть частиц отклонялась на значительный угол, превышающий 30 градусов, такой результат нельзя получить при расположении положительного заряда по всему объёму атома, так как электрическое поле будет недостаточно сильным. Так на смену модели Томсона пришла планетарная модель Резерфорда:
- Положительно заряженное ядро, занимающее ничтожную часть объёма, находится в центре.
- Почти вся масса и весь положительный заряд сконцентрированы в ядре
- Электроны вращаются вокруг атома. Количество электронов равно положительному заряду ядра.
На основе данной модели нельзя было объяснить существование, так как электроны двигаются с ускорением, они должны излучать электромагнитные волны и терять энергию, что приведет к тому, что электроны «упадут» на ядро, и атом прекратит существование. Но в действительности атом в невозбужденном состоянии устойчив и может существовать неограниченно долго, также он не излучается электромагнитные волны. Следует вывод, что законы классической механики неприменимы.
Нильс Бор построил первую квантовую теорию атома водорода, которая получила название модели Бора. Модель Бора сумела объяснить оптические спектры атомов. Дальнейшее ее совершенствование привело к развитию квантовой механики. Значительный вклад в становление научной атомистики сделал Жан Батист Перрен, экспериментально подтвердив теорию броуновского движения Альберта Эйнштейна. Эксперименты Генри Мозли и установленный им закон Мозли позволили связать атомный номер химического элемента с электрическим зарядом ядра. В 1913 году, исследуя ионы неона в канальных лучах, Джозеф Джон Томсон впервые открыл изотопы.
Развитие квантовой механики дало возможность объяснить не только строение атомов, но также их свойства: оптические спектры, способность вступать в химические реакции, образовывать молекулы.
В изучении этого вопроса отличился датский физик Нильс Бор. Он считал, что для микромира не работают законы, предназначенные для макроскопических тел. Законы микромира — квантовые законы, были сформулированы в его постулатах и дополнили атом Резерфорда. Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение фотонов происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
[править] Квантовая теория строения атома
На смену теории Бора пришла квантовая теория, она учитывала волновые свойства электрона и других элементарных частиц. В основе квантовой теории строения атома лежат следующие положения:
- Электрон имеет корпускулярно-волновую природу. Он может вести себя как волна либо частица. Движущийся электрон проявляет волновые свойства, но как частица он обладает массой и зарядом.
- Неопределенность в измерении. Для электрона невозможно одновременно точно измерить скорость и координату, чем точнее один из показателей, тем больше неопределенность в другом.
- Электрон не движется по определённым траекториям вокруг ядра, он может находиться в любой точке пространства, но вероятность нахождения его в определённой точке не равна, наиболее вероятное пространство называют орбиталью.
- Ядро состоит из нуклонов: протонов и нейтронов, количество протонов численно равно порядковому номеру элемента, а количеств нуклонов равно массовому значению.
Данные положения формулируют квантовую теорию строения атома.
См. также: Атомная орбиталь.
- Белый М. В. (1973). Атомная физика. Киев: Высшая школа.
- Ландау Л. Д., Лившиц Е. М. (1974). Теоретическая физика. т. ИИИ. Квантовая механика. Нерелятивистская теория. Москва: Наука.
- Бронштейн М. П. (1980). Атомы и электроны (Серия «Библиотечка „Квант“»). Москва: Наука.
- Шехтер В. М., Ансельм А. А. (1984). Атом и квантовая механика (Серия: «Физика»). Москва: Знание.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer.
cyclowiki.org
Структура и принципы строения атома
Как известно, все материальное во Вселенной состоит из атомов. Атом – это мельчайшая единица материи, которая несет в себе ее свойства. В свою очередь, структура атома складывается из волшебного триединства микрочастиц: протонов, нейтронов и электронов.
При этом каждая из микрочастиц универсальна. То есть, не найти на свете двух разных протонов, нейтронов или электронов. Все они абсолютно друг на друга похожи. И свойства атома будут зависеть только от количественного состава этих микрочастиц в общем строении атома.
Например, структура атома водорода состоит из одного протона и одного электрона. Следующий по сложности, атом гелия состоит из двух протонов, двух нейтронов и двух электронов. Атом лития — из трех протонов, четырех нейтронов и трех электронов и т. д.
 Структура атомов (слева направо): водорода, гелия, лития
Структура атомов (слева направо): водорода, гелия, литияАтомы соединяются в молекулы, а молекулы — в вещества, минералы и организмы. Молекула ДНК, являющаяся основой всего живого – структура, собранная из тех же трех волшебных кирпичиков мироздания, что и камень, лежащий на дороге. Хотя эта структура и намного более сложная.
Еще более удивительные факты открываются тогда, когда мы пытаемся поближе рассмотреть пропорции и строение атомной системы. Известно, что атом состоит из ядра и электронов, двигающихся вокруг него по траектории, описывающей сферу. То есть это даже нельзя назвать движением в обычном понимании этого слова. Электрон скорее находится везде и сразу в пределах этой сферы, создавая вокруг ядра электронное облако и формируя электромагнитное поле.
Схематические изображения строения атомаЯдро атома состоит из протонов и нейтронов, и в нем сосредоточена почти вся масса системы. Но при этом, само ядро настолько мало, что если увеличить его радиус до масштаба в 1 см, то радиус всей структуры атома достигнет сотни метров. Таким образом, все, что мы воспринимаем как плотную материю, более чем на 99% состоит из одних только энергетических связей между физическими частицами и менее чем 1% — из самих физических форм.
Но что представляют собой эти физические формы? Из чего они состоят, и насколько они материальны? Чтобы ответить на эти вопросы, давайте подробнее рассмотрим структуры протонов, нейтронов и электронов. Итак, мы спускаемся еще на одну ступеньку в глубины микромира – на уровень субатомных частиц.
Из чего состоит электрон
Самая маленькая частица атома – электрон. Электрон обладает массой, но при этом не обладает объемом. В научном представлении электрон не из чего не состоит, а представляет собой бесструктурную точку.
Под микроскопом электрон невозможно увидеть. Он наблюдаем только в виде электронного облака, которое выглядит как размытая сфера вокруг атомного ядра. При этом с точностью, где находится электрон в момент времени, невозможно сказать. Приборы же способны запечатлеть не саму частицу, а только лишь ее энергетический след. Суть электрона не вкладывается в представления о материи. Он скорее подобен некой пустой форме, существующей только в движении и за счет движения.
 Атом водорода под микроскопом. В центре ядро, состоящее из одного протона и электронное облако вокруг.
Атом водорода под микроскопом. В центре ядро, состоящее из одного протона и электронное облако вокруг.Никакой структуры в электроне до сих пор не было обнаружено. Он является такой же точечной частицей, как и квант энергии. Фактически, электрон — и есть энергия, однако, это более устойчивая ее форма, нежели та, которая представлена фотонами света.
В настоящий момент электрон считают неделимым. Это понятно, ведь невозможно разделить то, что не имеет объема. Однако в теории уже есть наработки, согласно которым в составе электрона лежит триединство таких квазичастиц как:
- Орбитон – содержит информацию об орбитальном положении электрона;
- Спинон – ответственен за спин или вращательный момент;
- Холон – несет информацию о заряде электрона.
Впрочем, как видим, квазичастицы с материей уже не имеют абсолютно ничего общего, и несут в себе одну только информацию.
 Фотографии атомов разных веществ в электронный микроскоп
Фотографии атомов разных веществ в электронный микроскопИнтересно, что электрон может поглощать кванты энергии, например, света или тепла. В этом случае атом переходит на новый энергетический уровень, а границы электронного облака расширяются. Бывает и такое, что энергия, поглощаемая электроном настолько велика, что он может выскочить из системы атома, и далее продолжить свое движение как независимая частица. При этом он ведет себя подобно фотону света, то есть, он будто бы перестает быть частицей и начинает проявлять свойства волны. Это было доказано в эксперименте.
Эксперимент Юнга
В ходе эксперимента на экран с двумя прорезанными в нем щелями был направлен поток электронов. Проходя через эти прорези, электроны сталкивались с поверхностью еще одного – проекционного – экрана, оставляя на нем свой след. В результате такой «бомбардировки» электронами на проекционном экране появлялась интерференционная картина, подобная той, которая появилась бы, если бы через две прорези проходили бы волны, но не частицы.
Такой рисунок возникает из-за того, что волна, проходя между двух щелей, делится на две волны. В результате дальнейшего движения волны накладываются друг на друга, и на некоторых участках происходит их взаимное гашение. В результате мы получаем много полос на проекционном экране, вместо одной, как это было бы, если бы электрон вел себя как частица.
 Интерференционная картина
Интерференционная картина Структура ядра атома: протоны и нейтроны
Протоны и нейтроны составляют ядро атома. И притом, что в общем объеме ядро занимает менее 1%, именно в этой структуре сосредоточена почти вся масса системы. А вот на счет структуры протонов и нейтронов физики разделились во мнениях, и на данный момент существует сразу две теории.
- Теория №1 — Стандартная
Стандартная модель говорит о том, что протоны и нейтроны состоят из трех кварков, соединенных между собой облаком глюонов. Кварки являются точечными частицами, так же, как кванты и электроны. А глюоны – это виртуальные частицы, обеспечивающие взаимодействие кварков. Однако в природе так и не было найдено ни кварков, ни глюонов, потому эта модель поддается жестокой критике.
- Теория №2 — Альтернативная
А вот по альтернативной теории единого поля, разработанной Эйнштейном, протон, как и нейтрон, как и любой другая частица физического мира, представляет собой вращающееся со скоростью света электромагнитное поле.
 Электромагнитные поля человека и планеты
Электромагнитные поля человека и планеты Каковы же принципы строения атома?
Все в мире – тонкое и плотное, жидкое, твердое и газообразное – это лишь энергетические состояния бесчисленных полей, пронизывающих пространство Вселенной. Чем выше уровень энергии в поле, тем оно тоньше и неуловимей. Чем ниже энергетический уровень, тем оно более устойчивое и ощутимое. В структуре атома, как и в структуре любой другой единицы Вселенной, лежит взаимодействие таких полей – разных по энергетической плотности. Выходит, основа всего – энергия, а материя – только иллюзия ума.
Понравилась статья? Поддержите автора!
Структура и принципы строения атома
5 (100%) 3 votestaynoe.com
СТРОЕНИЕ АТОМА — это… Что такое СТРОЕНИЕ АТОМА?
- СТРОЕНИЕ АТОМА
СТРОЕНИЕ АТОМА — атом (см.) построен из элементарных частиц трёх видов — протонов (см.), нейтронов (см.) и электронов (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного ядра (см.), электроны образуют электронную оболочку. В ядре действуют силы ядерные (см.), благодаря которым положительно заряженные протоны и не имеющие зарядов нейтроны образуют в ядре прочную систему. Взаимодействие отрицательных электронов с положительно заряженным ядром и друг с другом подчиняется кулоновским силам притяжения и отталкивания. Число протонов в ядре равно числу электронов в оболочке, поэтому атом электрически нейтрален. Заряд ядра атома и общее число электронов равны порядковому номеру элемента в Периодической системе элементов. Современная модель С. а. известна как планетарная модель «атома Бора—Резерфорда». Согласно этой модели вокруг ядра, в котором сосредоточена практически вся масса атома, подобно планетам вокруг Солнца по орбитам вращаются электроны, но не по любым, а лишь по определённым, квантовым. Двигаясь по ним, электроны не теряют энергии и не падают на ядро атома. Они, вращаясь вокруг ядра, группируются в оболочки, каждая из которых имеет конечную ёмкость и может содержать строго определённое число электронов. Число электронных слоёв соответствует номеру периода в таблице Периодической системы элементов Д. И. Менделеева (см.). Однако электроны одного и того же энергетического уровня могут различаться значениями энергии и образовывать энергетические подуровни. Число электронов на внешнем слое соответствует номеру группы, если элемент находится в главной подгруппе. Число электронов на внутренних слоях равно 2n2, где n — номер оболочки (электронного слоя). Наружные электроны атома наиболее подвижны и слабо связаны с ядром, их число может составлять от 1 до 8, они определяют валентность (см.) элемента. Атом может находиться в стационарном состоянии, при этом он не излучает и не поглощает энергии. При переходе из одного стационарного состояния в др. атом излучает (или поглощает) квант энергии.
Большая политехническая энциклопедия. — М.: Мир и образование. Рязанцев В. Д.. 2011.
- СТРОГАНИЕ
- СТРОКА
Смотреть что такое «СТРОЕНИЕ АТОМА» в других словарях:
строение атома — atomo sandara statusas T sritis fizika atitikmenys: angl. atom structure; structure of atom vok. Atomaufbau, m; Atombau, m; Atomstruktur, f rus. строение атома, n; структура атома, f pranc. structure d’atome, f … Fizikos terminų žodynas
строение атома — atomo sandara statusas T sritis chemija apibrėžtis Atomą sudarančių dalelių ir jų ryšių visuma. atitikmenys: angl. atomic structure rus. строение атома … Chemijos terminų aiškinamasis žodynas
Строение атома — … Википедия
строение — сущ., с., употр. сравн. часто Морфология: (нет) чего? строения, чему? строению, (вижу) что? строение, чем? строением, о чём? о строении; мн. что? строения, (нет) чего? строений, чему? строениям, (вижу) что? строения, чем? строениями, о чём? о… … Толковый словарь Дмитриева
строение — СТРОЕНИЕ1, я, ср Системность, взаиморасположение частей, частиц в составе чего л.; внутреннее устройство чего л.; Син.: структура. Строение атома. Строение глаза. СТРОЕНИЕ2, я, ср То же, что здание; Син.: постройка. Быстрее стали выступать из… … Толковый словарь русских существительных
АТОМА СТРОЕНИЕ — раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся… … Энциклопедия Кольера
строение — я; ср. 1. Здание, постройка. Бревенчатое, каменное с. Ветхое с. Двухэтажное с. Полуразрушенное с. Жилые, хозяйственные строения. 2. Взаимное расположение частей, частиц в составе чего л.; внутреннее устройство чего л.; структура. С. вещества. С.… … Энциклопедический словарь
строение — я; ср. см. тж. строеньице 1) Здание, постройка. Бревенчатое, каменное строе/ние. Ветхое строе/ние. Двухэтажное строе/ние. Полуразрушенное строе/ние … Словарь многих выражений
Орбитальная модель атома — Атомная орбиталь одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами. Название «орбиталь» (а не орбита) отражает геометрическое… … Википедия
ЯДРО АТОМА — (атомное ядро) внутренняя центральная часть (см.), в которой сосредоточена почти вся его масса. Состоит из (см.) протонов и нейтронов (за исключением Я. а. водорода, состоящего всего лишь из единственного протона), связанных ядерными силами и… … Большая политехническая энциклопедия
polytechnic_dictionary.academic.ru
Строение атома Википедия
 Сравнительный размер атома гелия и его ядра
Сравнительный размер атома гелия и его ядра
А́том (от др.-греч. ἄτομος «неделимый[1], неразрезаемый[2]») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств[1][3].
Атомы состоят из ядра и электронов (точнее электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом[1]. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам[3][4].
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер[5].
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
ru-wiki.ru
Атом — это… Что такое Атом?
 Атом гелия
Атом гелия
А́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств.[1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.[2]
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
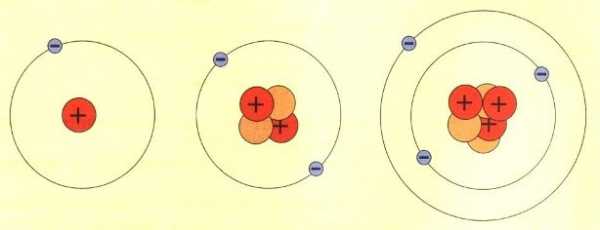
- Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27 кг).[5]
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10−15м, хотя размеры этих частиц определены плохо.[6]
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.[7][8]
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[10] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[11][12]
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[14] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[15] Самый тяжёлый стабильный изотоп — свинец-208[11] с массой 207,9766521 а. е. м.[16]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона (2·1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.[24]
Радиоактивный распад
 Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада[26][27]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Пример линейного спектра поглощенияКогда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.[42][43]
Дисперсионное притяжение
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами.[44]
См. также
Примечания
- ↑ Атом — статья из Большой советской энциклопедии
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5
- ↑ http://www.ido.rudn.ru/nfpk/fizika/mkt/1.html Планетарная модель атома]
- ↑ Demtröder, 2002
- ↑ Woan, 2000
- ↑ MacGregor, 1992
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2009.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2007.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Sills, 2003
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Mills и др. (1993).
- ↑ Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Проверено 4 января 2007.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Архивировано из первоисточника 21 августа 2011. Проверено 4 января 2007.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A729: 337–676. Проверено 2008-02-07.
- ↑ R. D. Shannon. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica, Section A 32: 751. DOI:10.1107/S0567739476001551. Проверено 2007-01-03.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2007.
- ↑ Zumdahl, 2002
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история) — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02·1023 атомов на моль.
- ↑ Feynman, 1995
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009).(недоступная ссылка — история) Проверено 16 сентября 2009.(недоступная ссылка — история)
- ↑ 1 2 Radioactivity. Splung.com. Архивировано из первоисточника 21 августа 2011. Проверено 19 декабря 2007.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006).(недоступная ссылка — история) Проверено 20 марта 2011.(недоступная ссылка — история)
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история)
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ Lynn Yarris. (весна 1997). «Talking Pictures». Berkeley Lab Research Review. Проверено 2008-01-09.(недоступная ссылка — история)
- ↑ Liang, Haacke, 1999
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Проверено 23 декабря 2007.
- ↑ Fowles, 1989
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Архивировано из первоисточника 21 августа 2011. Проверено 8 января 2007.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Архивировано из первоисточника 21 августа 2011. Проверено 10 августа 2006.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 14 февраля 2008.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Архивировано из первоисточника 21 августа 2011. Проверено 6 февраля 2008.
- ↑ Beyer, 2003
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Архивировано из первоисточника 21 августа 2011. Проверено 23 декабря 2007.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
Литература
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3
Ссылки
dic.academic.ru
