h3O, степень окисления кислорода и водорода в нем
Общие сведения о воде и степени окисления в h3O
Стандартная энергия Гиббса образования жидкой воды при температуре 298 Л рана – 237, 57кДж/моль, водяного пара – 228,94 кДж/моль. В этой связи константа диссоциации водяного пара на водород и кислород очень мала (8,88×10-41).
Агрегатное состояние воды определяется температурой и давлением (рис. 1). Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
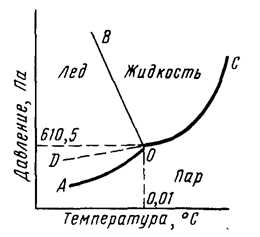
Рис. 1. Диаграмма состояния воды.
h3O, степени окисления элементов в ней
Вода – это по сути оксид водорода, а, как известно, степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления водорода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2×х + (-2) = 0;
2х — 2 = 0;
2х = 2;
x = + 1.
Значит степень окисления водорода в воде равна (+ 1):
H+12O-2.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Степень окисления химических элементов
Степенью окисления называют условный заряд атомов химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный характер
1. Степень окисления атомов в простом веществе равна нулю. (Cu0, H20)
2. Сумма степеней окисления всех атомов в молекуле вещества равна нулю.
3. Степень окисления водорода в соединениях с неметаллами равна +1.
4. Степень окисления водорода с металлами равна -1.
5. Степень окисления кислорода равна -2 (кроме OF2 и H2O2)
6. Окислители — атомы, ионы или молекулы, принимающие электроны, у окислителей степень окисленияпонижается.
7. Восстановители — атомы, ионы или молекулы, отдающие электроны, у восстановителей степень окисленияповышается.
Таблица элементов с постоянной степенью окисления
| Элементы | Степень окисления в сложных веществах |
| Li, Na, K, Rb, Cs | |
| Be, Mg, Ca, Sr, Ba, Zn | +2 |
| B, Al | +3 |
| F | -1 |
В соединениях из трех элементов степень окисления одного из элементов вычисляют, исходя из условия, что молекула электронейтральна.
Например, в молекуле фосфорной кислоты H3PO4 степень окисления водорода равна +1, кислорода -2, степень окисления фосфора обозначим за х.
Степень окисления фосфора рассчитываем по уравнению:
3 * (+1) + х + 4* (-2) = 0
х = + 5
Давайте порассуждаем вместе
1. Атом азота в азотной кислоте имеет степень окисления:
1) 0
2) +3
3) +5
4) -5
Ответ: Формула азотной кислоты HNO3, степень окисления водорода равна +1, кислорода -2, степень окисления азота обозначим за х и рассчитаем ее по уравнению: + 1 + х + 3* (-2) = 0
х = +5
2. Степень окисления -2 атом серы проявляет в каждом из соединений
1) CuSO4 и H2S
2) SO2 и Na2S
3) H2SO3 и SO3
4) CaS и FeS
Ответ: степень окисления -2 атом серы проявляет в бинарных соединениях с металлами (сульфидах) и водородом (H2S), поэтому правильный ответ CaS и FeS
3. Максимально возможную степень окисления атом хлора проявляет в соединении
1) HCl
2) HClO3
3) KClO4
4) Ba(ClO2)2
Ответ: атом хлора расположен в 7 группе, поэтому может иметь максимальную степень окисления +7. Такую степень окисления атом хлора проявляет в веществе KClO
4. Проверим это. У калия степень окисления +1, у кислорода -2, у хлора х. Из уравнения: +1 +х + 4* (-2) = 0 находим х = +7
4. В соединениях NO2 и NH3 степени окисления азота соответственно равны:
1) +4 и -3
2) +2 и +3
3) +2 и -2
4) +5 и +3
Ответ: В оксиде азота (IV) у кислорода степень окисления -2, значит у азота степень окисления +4. В аммиаке у водорода степень окисления +1, значит у азота степень окисления -3.
5. Установите соответствие между схемами превращения веществ и изменением степени окисления хлора
Схемы превращений Изменение степени окисления хлора A) Cl2 + F 2 = ClF3 1) -1 —> +5 Б) Cl2 + I2 = ICl3 2) +2 —> +4 В) ClO2 + H2 = HCl + H2O 3) 0 —> +3 4) 0 —> -1 5) +4 —> -1 6) +4 —> +1
Ответ:
В молекуле хлора Cl2 степень окисления хлора равна 0
В молекуле ClF3 у фтора степень окисления -1, значит у хлора +3
В молекуле ICl3 у хлора степень окисления -1
В молекуле ClO2 у кислорода степень окисления -2, значит у хлора +4
В молекуле HCl у водорода +1, а у хлора -1
6. Установите соответствие между схемами превращения веществ и изменением степени окисления
Схемы превращений Изменение степени окисления серы A) H2S + O2 = H2O + SO2 1) -2 —> +4 Б) Cl2 + S = S2Cl2 2) +2 —> +4 В) H2SO3 + NO2 = NO + H2SO4 3) 0 —> +4 4) 0 —> +1 5) +4 —> +6 6) -2 —> 0
Ответ:
В молекуле сероводорода у водорода степень окисления +1, а у серы -2
В молекуле SO2 у кислорода степень окисления -2, а у серы +4
В молекуле сернистой кислоты у водорода степень окисления +1, у кислорода -2, значит у серы +4
В молекуле серной кислоты у водорода степень окисления +1, у кислорода -2, значит у серы + 6
7. Установите соответствие между схемами превращения веществ и изменением степени окисления азота
Схемы превращений Изменение степени окисления азота A) PH3 + NO = H3PO4 + N2 1) -2 —> +5 Б) P + NO2 = P2O5 + NO 2) +3 —> +5 В) H3PO3 + N2H4 = H3PO2 + N2 + H2O 3) 0 —> +5 4) +2 —> 0 5) +4 —> +2 6) -2 —> 0
Ответ:
В молекуле NO степень окисления у кислорода равна -2, а у азота +2
В молекуле азота N2 степень окисления азота равна 0
В молекуле NO2 степень окисления азота равна +4
В молекуле N2H4 степень окисления азота равна -2
8. В каких реакциях железо выступает в роли восстановителя?
1) Fe + S = FeS
2) 2FeCl3 + H2 = 2FeCl2 + 2HCl
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) 3Fe + 2O2 = Fe3O4
5) 2FeCl2 + Cl2 = 2FeCl3
Ответ: 1, 4, 5 , т.к. в этих реакциях железо отдает электроны и повышает свою степень окисления.
9. В каких реакциях сера не изменяет степень окисления?
1) Cu + S = CuS
2) 2HCl + Na2SO3 = 2NaCl + SO2 + H2O
3) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
4) SO2 + H2O = H2SO3
5) SO2 + 2H2 = S + 2H2O
Ответ: 2, 4, т.к. в этих реакциях сера не изменяет свою степень окисления.
10. В каком соединении фосфор проявляет степень окисления -3
1) P2O3
2) Na3PO4
3)Ca3P2
4) PCl3
Ответ: степень окисления -3 фосфор проявляет в бинарных соединениях с металлами, значит в фосфиде кальция Ca3P2 у кальцая степень окисления +2, а у фосфора -3.
dx-dy.ru
32. Степень окисления
Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью — положительные.
Степень окисления — формальное понятие; в ряде случаев степень окисления не совпадает с валентностью
Например:
N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1)
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
Реакции без и с изменением степени окисления
Существует два типа химических реакций:
A Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения
SO2 + Na2O Na2SO3
Реакции разложения
Cu(OH)2 –t CuO + H2O
Реакции обмена
AgNO3 + KCl AgCl + KNO3
NaOH + HNO3 NaNO3 + H2O
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
2Mg0 + O20 2Mg+2O-2
2KCl+5O3-2 –t 2KCl-1 + 3O20
2KI-1 + Cl20 2KCl-1 + I20
Mn+4O2 + 4HCl-1 Mn+2Cl2 + Cl20 + 2H2O
Такие реакции называются окислительно — восстановительными.
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
H20 — 2ē 2H+
S-2 — 2ē S0
Al0 — 3ē Al+3
Fe+2 — ē Fe+3
2Br — — 2ē Br20
Процесс присоединения электронов — восстановление: При восстановлении степень окисления понижается.
Mn+4 + 2ē Mn+2
S0 + 2ē S-2
Cr+6 +3ē Cr+3
Cl20 +2ē 2Cl—
O20 + 4ē 2O-2
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов — (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
studfiles.net
Как рассчитать степень окисления — Химия! Помогите!!! как рассчитывать степени окисления атомов химических элементов? — 22 ответа
В разделе Естественные науки на вопрос Химия! Помогите!!! как рассчитывать степени окисления атомов химических элементов? заданный автором Valentina лучший ответ это Правила определения степеней окисления. 1. В простом веществе степень окисления атомов равна 0N20, Cl20, h30, Ne0,Fe0, Cu0, O30, P402. Степень окисления более электроотрицательного атома обозначают со знаком «−», а менее электроотрицательного – со знаком «+»Н+Сl−, K+F−, Ca+2S−2, Mg+2O−23. Cумма степеней окисления в нейтральном соединении равна 0, в многоатомном ионе равна заряду ионаН+Сl−, Ca+2S−2, Mg+2O−2, Al+3Cl3−(S+6O4−2)2−, (Mn+7O4−2)−, (H+1C+4O3−2)−4. Cтепени окисления атомов некоторых элементов в соединениях: a) Фтора F -1;b) Металлов IA – группы Li, Na, K, Rb, Cs +1; c) Металлов IIA – группы Be, Mg, Ca, Sr, Ba + 2; d) Алюминия Al +3; e) Цинка Zn + 2; f) Водород Н в соединениях с металлами −1, в остальных соединениях +1; g) Кислорода О в ОF2 +2, в O2F2 +1; в остальных пероксидах (содержат группу -О-О- ) −1, в остальных соединениях −2 Н+1F−1, K+1F−1, O+2F2−1, N+3F3−1, C+4F4−1, C+2H+1F3−1.Na2+1S−2, Li2+1S+6O4−2, K+1O−2H+1Ca+2S−2, Mg+2O−2, Ba+2(O−2H+1)2Al+3Cl3−, Al2+3(S+6O4−2)3Zn+2S+4O3−2, Zn+2O−2, Zn+2(O−2H+1)2Na+1H−1, Ca+2h3−1, C−4h5+1, Н+1F−1, K+1O−2H+1, Zn+2(O−2H+1)2Na2+1O2−1, h3+1O2−1, Mg+2O−2, (Mn+7O4−2)−5. Cтепень окисления гидроксильной группы ОН −1Ca+2(OH)2−16. Степень окисления группы Nh5 +1(Nh5)2+1S+6O4−27. Cтепень окисления кислотного остатка (продукта «отрыва» одного или нескольких Н – атомов от кислоты) отрицательна и равна числу «оторванных» Н — атомовSO4−2, PO4−3, HCO3−, h3PO4−, MnO4−2
Ответ от 22 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: Химия! Помогите!!! как рассчитывать степени окисления атомов химических элементов?
Ответ от Прослабить[новичек]
у хлора не всегда -1, может быть и +7 и+6 и+5 и+4 и+3 и +1)) КИСЛОРОД ОКИСЛЯЕТ ХЛОР, но у фтора такого не бывает.. . а. ещё у хлора бывает 0
Ответ от Натурфилософия[новичек]
У Cl не всегда -1. Ставишь степень окисления у K=+1, O=-2, но мы умножаем на 3 и получаем -6. А теперь составляем +1….-6, надо вместо пробелов вставить +5, чтобы получился 0, из этого следует, что у Cl степень окисления +5
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru
Окислительно – восстановительные реакции
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, в результате переноса электронов от одного атома к другому.
Степень окисления – формальный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только от ионов.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью − положительные.
Степень окисления − формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например: N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления
кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
Реакции с изменением и без изменения степени окисления
Существует два типа химических реакций:
A Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения: SO2 + Na2O Na2SO3
Реакции разложения: Cu(OH)2 CuO + H2O
Реакции обмена: AgNO3 + KCl AgCl +KNO3
NaOH + HNO3NaNO3 + H2O
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
2Mg0 + O202Mg+2O-2
2KCl+5O3-2 –t 2KCl-1 + 3O20
2KI-1 + Cl202KCl-1 + I20
Mn+4O2 + 4HCl-1Mn+2Cl2 + Cl20 + 2H2O
Такие реакции называются окислительно-восстановительными.
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
H20 − 2ē 2H+
S-2 − 2ē S0
Al0 − 3ē Al+3
Fe+2 − ē Fe+3
2Br — − 2ē Br20
Процесс присоединения электронов -− восстановление. При восстановлении степень окисления понижается.
Mn+4 + 2ē Mn+2
S0 + 2ē S-2
Сr+6 +3ē Cr+3
Cl20 +2ē 2Cl—
O20 + 4ē 2O-2
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а которые отдают электроны — восстановителями.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē Mn+2
2Cl-1 — 2ē Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
|
Mn+7 + 5ē Mn+2 |
2 |
|
2Cl-1 — 2ē Cl20 |
5 |
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-12KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
studfiles.net
Расчет степени окисления
Химия Расчет степени окисления просмотров — 113
Степень окисления
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Примеры
1. металл + неметалл ® соль
Hg + S ® HgS
2Al + 3I2 ® 2AlI3
2. основной оксид + кислотный оксид ® соль
Li2O + CO2® Li2CO3
CaO + SiO2 ® CaSiO3
3. основание + кислота ® соль
Cu(OH)2 + 2HCl ® CuCl2 + 2H2O
| FeCl3 | + | 3HNO3 | ® | Fe(NO3)3 | + | 3HCl |
| соль | кислота | соль | кислота |
4. металл ® основной оксид
2Ca + O2 ® 2CaO
4Li + O2 ® 2Li2O
5. неметалл ® кислотный оксид
S + O2 ® SO2
4As + 5O2 ® 2As2O5
6. основной оксид ® основание
BaO + H2O ® Ba(OH)2
Li2O + H2O ® 2LiOH
7. кислотный оксид ® кислота
P2O5 + 3H2O ® 2H3PO4
SO3 + H2O ® H2SO4
Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью — положительные.
Степень окисления — формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
К примеру:
N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3.
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
Читайте также
Степень окисления Тема: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в… [читать подробенее]
Степень окисления ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Примеры 1. металл + неметалл ® соль Hg + S ® HgS 2Al + 3I2 ® 2AlI3 2. основной оксид + кислотный оксид ® соль Li2O + CO2® Li2CO3 CaO + SiO2 ® CaSiO3 3. основание + кислота ® соль Cu(OH)2 + 2HCl ® CuCl2 + 2h3O FeCl3 + 3HNO3 ® Fe(NO3)3 … [читать подробенее]
Степень окисления ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Примеры 1. металл + неметалл ® соль Hg + S ® HgS 2Al + 3I2 ® 2AlI3 2. основной оксид + кислотный оксид ® соль Li2O + CO2® Li2CO3 CaO + SiO2 ® CaSiO3 3. основание + кислота ® соль Cu(OH)2 + 2HCl ® CuCl2 + 2h3O FeCl3 + 3HNO3 ® Fe(NO3)3 … [читать подробенее]
oplib.ru
Какую степень окисления может проявлять водород в своих соединениях? —
Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород окислитель, и в которых – восстановитель.
Решение:
Водород в своих соединениях может проявлять следующие степени окисления:
1) -1 (Na+H-1)
2) 0 (H20)
3) +1 (Н+Cl; H2+O-2)
2 H20 + O20 = 2 H2+O-2
|
2* |
H20 |
-2ê |
→ |
2 H+ |
H20 -восстановитель |
процесс окисления |
|||
|
|
O20 |
+4ê |
→ |
2O-2 |
O20– окислитель |
процесс восстановления |
|||
|
2 H20 + O20 = 2 H2+O-2 |
|
|
|
|
|
||||
H20 + 2 Na0 = 2 Na +Н–
|
|
H20 |
+2ê |
→ |
2 H-1 |
H20 – окислитель |
процесс восстановления |
|||
|
2* |
Na0 |
+1ê |
→ |
Na+ |
Na0 – восстановитель |
процесс окисления |
|||
|
2 H20 + O20 = 2 Na +Н-1 |
|
|
|
|
|
||||
einsteins.ru
