Сложные вещества — урок. Химия, 8–9 класс.
Химические элементы входят в состав сложных веществ (химических соединений).
Сложными называют вещества, состоящие из атомов разных химических элементов.
Большинство химических веществ являются сложными.
Многие сложные вещества имеют молекулярное строение. К молекулярным относятся метан Ch5, вода h3O, углекислый газ CO2, серная кислота h3SO4, глюкоза C6h22O6. Пластмассы, белки, жиры, крахмал тоже представляют собой сложные вещества, состоящие из молекул.
Модель молекулы воды
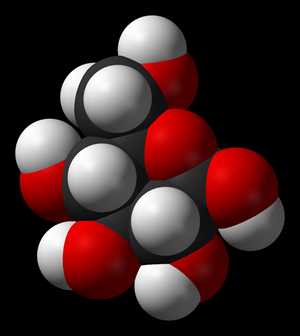
Модель молекулы глюкозы
Немолекулярное строение имеет песок SiO2, а также все сложные вещества, в состав которых входят металлы: поваренная соль NaCl, мел CaCO3, питьевая сода NaHCO3 и многие другие. Из сложных веществ немолекулярного строения состоят минералы и горные породы.
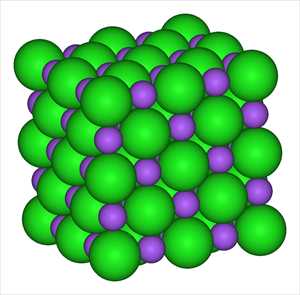
Модель кристалла поваренной соли
При определённых условиях сложные вещества можно разложить на несколько новых веществ. Так под действием электрического тока вода разлагается на водород и кислород, а сахар при нагревании превращается в уголь и воду.
Водород и кислород совсем не похожи на воду. При обычных условиях водород и кислород представляют собой газы, а вода — жидкость. Уголь и вода ничем не напоминают сахар.
Обрати внимание!
Свойства сложного вещества не являются суммой свойств веществ, образующихся при его разложении.
www.yaklass.ru
Сложные вещества — это… Что такое Сложные вещества?
- Сложные вещества
-
Сложные вещества
Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические. (см. также простые вещества)
Сложные вещества состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием нескольких других веществ и могут образоваться из нескольких менее сложных веществ. Например, вода состоит из атомов кислорода и водорода, сульфид железа состоит из атомов железа и серы.
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
- Простые вещества
- Горячеводский
Смотреть что такое «Сложные вещества» в других словарях:
СЛОЖНЫЕ РЕАКЦИИ
Сложные эфиры — Сложный эфир карбоновой кслоты. R и R обозначают любую алкильную или арильную группу Сложные эфиры производные оксокислот (как карбоновых так и минеральных) Rk … Википедия
Сложные тиоэфиры — Общая структура сложных тиоэфиров Сложные тиоэфиры органические соединения, содержащие функциональную группу C S CO C и являющиеся сложными эфирами тиолов и карб … Википедия
сложные реакции — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества. Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарь
Сложные реакции — такие Реакции химические, элементарные акты которых различны. В противоположность С. р. элементарные акты простых реакций не отличаются один от другого природой участвующих в них веществ, а лишь, возможно, направлением превращения, если… … Большая советская энциклопедия
Сложные белки — (протеиды, холопротеины) двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы простетическая группа. При гидролизе сложных белков, кроме свободных аминокислот, освобождается… … Википедия
Простые вещества — Аллотропная модификация углерода алмаз (в материнской породе) Простые вещества вещества, состоящие исключительно из атомов одного химического элемента (из гомоядер … Википедия
Неорганические вещества
высокочистые вещества — [highly purified materials] простые (химические элементы) и сложные вещества, содержат примесей от 10 6до 10 8 мас. %, но ≤10 3 мас. %. Такие вещества играют важную роль в полупроводниковой промышленности, атомной энергетике, волоконной оптике … Энциклопедический словарь по металлургии
ЭФИРЫ СЛОЖНЫЕ — ЭФИРЫ СЛОЖНЫЕ, вещества из класса органических соединений, которые образуются в результате реакции между СПИРТАМИ и КИСЛОТАМИ … Научно-технический энциклопедический словарь
dic.academic.ru
Сложные вещества | Химическая энциклопедия

Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений. Сложные вещества — это вещества, состоящие из атомов разных химических элементов.
Подавляющее большинство химических веществ – это сложные вещества. Вода, метан, сахар, поваренная соль – простейшие примеры сложных веществ. Сложные вещества делятся на две группы – неорганические и органические. Все органические вещества объединяет главный признак – в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение.
Простейшим органическим веществом является природный газ метан. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества являются соединениями атомов всех остальных элементов, кроме углерода. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и т.п.
Неорганических веществ около 500 тыс., но масса их многократно превышает массу органических веществ. Почти все они – твердые вещества немолекулярного строения, входят в состав минералов, почв, горных пород. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
1.3.1. Простые и сложные вещества
Исходя из основных положений атомно-молекулярного учения, можно дать определения простого и сложного вещества.Простыми веществами называются вещества, состоящие из атомов одного химического элемента.
Например:
O2, N2, S8.
Сложными веществами называются вещества, состоящие из атомов различных химических элементов.
Например:
Н2О, Н2SО4, CuCl2.
Следует заметить, что такое сложное вещество, как, например, вода Н2О, состоит не из водорода и кислорода (это названия простых веществ – водорода – Н2 и кислорода – O2), а из атомов элемента водорода – Н и атомов элемента кислорода – O.
Некоторые химические элементы способны образовывать несколько простых веществ, отличающихся друг от друга по строению и свойствам. В настоящее время известно более 400 простых веществ. Так, элемент углерод образует простые вещества:
Явление, при котором один и тот же элемент может образовать несколько простых веществ, называется аллотропией, а образуемые при этом простые вещества – аллотропными модификациями.
Примером аллотропных модификаций могут быть простые вещества – кислород О2 и озон О3, образованные атомами одного и того же элемента – кислорода.
Явление аллотропии вызывается двумя причинами:
различным числом атомов в молекуле, например, кислород О2 и озон О3,
различным строением кристаллической решетки и образованием различных кристаллических форм, например, алмаз, графит, карбин и фулерен.
Способность вещества участвовать в тех или иных химических реакциях характеризует химические свойства вещества.
Химические явления (процессы) – это процессы, в результате которых из одних веществ образуются другие вещества.
Если в результате протекания процесса химическая природа вещества не меняется, то такие процессы считаются физическими.
Примерами физических процессов традиционно считаются изменения агрегатного состояния вещества: плавление ионных кристаллов некоторых солей, плавление металлов, испарение воды и других жидкостей и т.д.
Следует заметить, что такой процесс, как растворение, считают физико-химическим, и, в данном случае, границы между химическими и физическими явлениями достаточно условны.
Принято различать чистые (химически чистые) вещества и смеси веществ.
Чистыми или индивидуальными веществами
Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ).
Чистые вещества характеризуются постоянством физических свойств, например, температурой плавления (Тпл) и температурой кипения (Ткип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей.
Если система образована смешиванием нескольких чистых веществ, причем их свойства при этом не изменились и ее можно разделить с помощью физических методов на исходные вещества, то такая система называется смесью. Почва, морская вода, воздух – все это примеры различных смесей. Вещества, входящие в состав смеси, называются компонентами. Содержание компонентов в смеси может меняться в широких пределах.
Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств. Среди большого числа методов, используемых для разделения и очистки веществ, можно назвать:
фильтрование,
отстаивание с последующей декантацией,
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Следует заметить, что на практике вещества, называемые «чистыми», являются таковыми лишь условно. Очистка веществ представляет сложную задачу и получение абсолютно чистых веществ, содержащих структурные единицы только одного вида, практически невозможно.
studfiles.net
Сложные вещества
Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом. По составу сложные неорганические вещества подразделяются на двухэлементные (бинарные) и многоэлементные.
Молекулы бинарных соединений состоят из атомов двух химических элементов, к ним относятся оксиды, некоторые кислоты и соли.
Молекулы многоэлементных соединений состоят из атомов трех и более химических элементов, к ним относятся гидроксиды, некоторые кислоты и соли.
1.2.1. Бинарные соединения
К важнейшим бинарным веществам относят соединения элементов с кислородом (оксиды), галогенами (галогениды или галиды), азотом (нитриды), углеродом (карбиды), а также соединения металлов с водородом (гидриды). Их названия образуют из латинского корня названия более отрицательного элемента с окончанием «…ид» и русского названия менее отрицательного элемента в родительном падеже, при этом в формуле бинарного соединения первым записывается символ менее отрицательного элемента в родительном падеже. Например, СаО – оксид кальция, ОF2 – фторид кислорода (фтор более отрицательный элемент, чем кислород), КBr – бромид калия, Мq3N2 – нитрид магния, СаС2 – карбид кальция (названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот.
Если менее отрицательный элемент может находиться в нескольких окислительных состояниях, то после его названия в скобках указывают римскими цифрами степень его окисления. Например, FeCl2 – хлорид железа (II), FeCl3 – хлорид железа (III), SF6 — фторид серы (VI). Можно также вместо степени окисления с помощью греческих числительных приставок (моно…, ди…, три…, тетра…, пента…, гекса… и т.д.) указывать число атомов более отрицательного элемента в формуле соединения. Например, NaCl – монохлорид натрия (приставку «моно…» почти всегда опускают), FeCl2 – дихлорид железа (II), SF6 – гексафторид серы.
Соединения элементов с кислородом
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.
Кислород в таких соединениях является более отрицательным элементом, за исключением ОF2. В зависимости от проявленной степени окисления кислорода в бинарном соединении оксиды подразделяются на нормальные оксиды, пероксиды, супероксиды, озониды.
В молекулах нормальных оксидов кислород проявляет степень окисления –2, и все его атомы непосредственно соединены с атомами других элементов. При составлении названия после слова «оксид» называется элемент, а затем в скобках римскими цифрами указывается его степень окисления, если он при взаимодействии с кислородом проявляет переменную валентность, т.е.
Э2О – оксид Э (I), Э2О5 – оксид Э(V),
ЭО – оксид Э (II), ЭО3 – оксид Э (VI),
Э2О3 – оксид Э(III), Э2О7 – оксид Э(VII),
ЭО2 – оксид Э (IV), ЭО4 – оксид Э (VIII).
Например, Na2O – оксид натрия; Cr2O3 – оксид хрома (III). Структурные формулы:
Na Cr ==== O
Na2O O Cr2O3 O
Na Cr ==== O
Пероксиды (перекиси) – соединения, в молекулах которых кислород проявляет степень окисления –1. В молекулы этих соединений входит пероксидная группировка -О-О-. Например, Na2O2 – пероксид натрия, его структурная формула Na- O-O-Na.
Супероксиды
– это оксиды, в молекулах которых
кислород проявляет степень окисления
–1/2 и атомы кислорода связаны в ион О .
Например,NaO2
– супероксид
(надперекись) натрия.
.
Например,NaO2
– супероксид
(надперекись) натрия.
В молекулах озонидов кислород имеет степень окисления –1/3. Например, КО3 – озонид калия.
По химическим свойствам нормальные оксиды подразделяются на солеобразующие и несолеобразующие, которые, в свою очередь, подразделяются на несколько подгрупп.
Солеобразующие оксиды (кислотные, амфотерные, основные) образуют соли при взаимодействии с кислотами и/или щелочами, им соответствуют гидроксиды (кислоты, основания или амфотерные), содержащие элемент в той же степени окисления.
Несолеобразующие оксиды (безразличные) не взаимодействуют ни с кислотами, ни с основаниями, т.е. не образуют солей. Наиболее важные из них СО – оксид углерода (II), NO – оксид азота (II), N2O – оксид азота (I), H2O2 – пероксид водорода и некоторые другие.
Подробнее остановимся на свойствах солеобразующих оксидов.
Основными называют оксиды, которые при взаимодействии с кислотами или кислотными оксидами образуют соли.
Химические свойства основных оксидов:
Основной оксид + вода
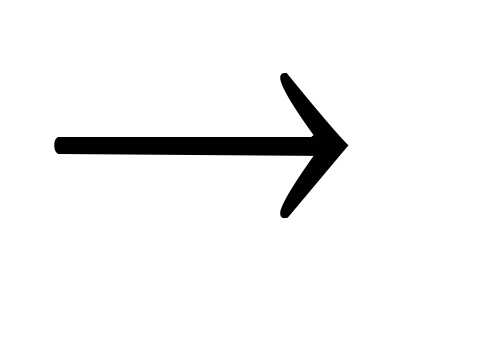 щелочь.
щелочь.
С водой взаимодействуют только оксиды щелочных и щелочноземельных металлов, образуя растворимые основания – щелочи.
MqO
+ H2O ; K2O
+ H2O
; K2O
+ H2O
 2KOH.
2KOH.
Основной оксид + кислота
 соль + вода
соль + вода
МqO
+2HCl
 MqCl2
+ H2O.
MqCl2
+ H2O.
Основной оксид + кислотный/амфотерный оксид
 соль
соль
BaO
+ SiO2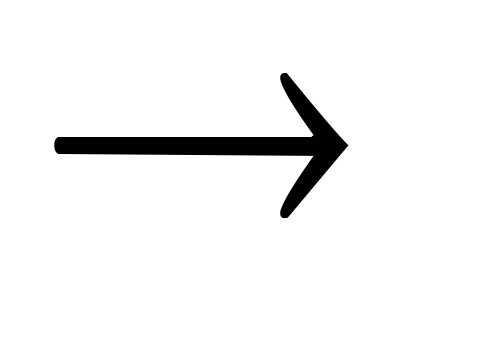 BaSiO3.
BaSiO3.
Основной оксид + амфотерный гидроксид
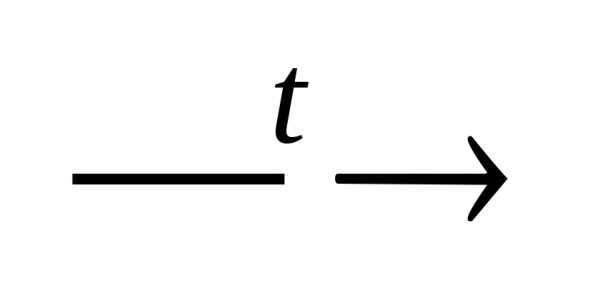 соль
+ вода
соль
+ вода
Na2O
+ 2Al(OH)3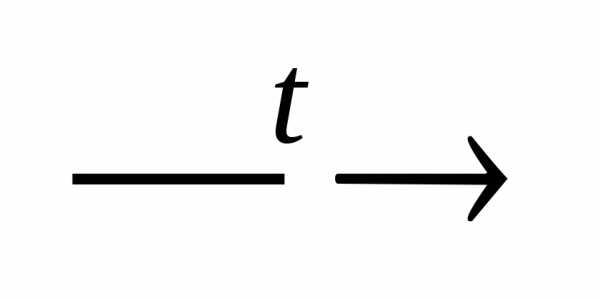 2NaAlO2
+ 3H2O.
2NaAlO2
+ 3H2O.
Кислотными называются оксиды, которые образуют соли в реакциях с основаниями или основными оксидами.
Химические свойства кислотных оксидов:
Кислотный оксид + вода
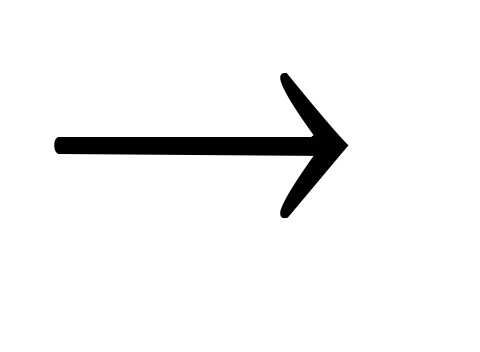 кислота.
кислота.
При растворении в воде кислотных оксидов образуются кислоты, в которых сохраняется степень окисления элемента (искл.: SiO2 нерастворим в воде)
SO3
+ H2O
 H2SO4.
H2SO4.
Кислотный оксид + основание
 соль + вода
соль + вода
СО2
+ 2NaOH
 Na2CO3
+ H2O.
Na2CO3
+ H2O.
Кислотный оксид + основной/амфотерный оксид
 соль
соль
3SO3
+ Al2O3 Al2(SO4)3.
Al2(SO4)3.
4.
Кислотный оксиднелетучий+соль соль+кислотный
оксидлетучий
соль+кислотный
оксидлетучий
SiO2
+ CaCO3 CaSiO3+
CO2
CaSiO3+
CO2 .
.
Амфотерныминазывают оксиды, образующие соли при взаимодействии как с кислотами, так и с основаниями. Эти оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами и со щелочами:
Al2O3
+ 6HCl
 2AlCl3
+
3H2O;
2AlCl3
+
3H2O;
Al2O3
+ 2NaOH + 3H2O
 2Na[Al(OH)4].
2Na[Al(OH)4].
К числу амфотерных оксидов относятся оксид алюминия Al2O3, оксид хрома (III) Cr2O3, оксид бериллия BeO, оксид цинка ZnO, оксид железа (III) Fe2O3 и ряд других. Амфотерным оксидам соответствуют как основания, так и кислоты. Так, амфотерному оксиду Al2O3 отвечают косвенно получаемые основание Al(OH)3 и кислоты: ортоалюминиевая H3AlO3 и метаалюминиевая HAlO2, т.е. Al2O3 является ангидридом этих кислот:
2HAlO2 Al2O3
+ H2O.
Al2O3
+ H2O.
Многоэлементные соединения
Среди многоэлементных соединений важную группу составляют гидроксиды – вещества, содержащие группу ОН—. Некоторые из них (основные гидроксиды) проявляют свойства оснований – NaOH, Ba(OH)2 и т.д., другие (кислотные гидроксиды) проявляют свойства кислот – HNO3, H3PO4 и т.д., существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как основные, так и кислотные свойства – Zn(OH)2, Al(OH)3, Cr(OH)3 и т.д.
Названия основных гидроксидов составляют из слова «гидроксид» и русского названия элемента в родительном падеже с указанием, если это необходимо, степени окисления элемента (римскими цифрами в скобках). Например, КОН – гидроксид калия, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III).
Кислотные гидроксиды называют по правилам, установленным для кислот.
К важнейшим классам неорганических соединений (бинарных и многоэлементных), выделяемым по химическим свойствам, относят основания, кислоты, соли.
ОСНОВАНИЯ
Основаниями с позиции теории электролитической диссоциации (ТЭД) являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов ОН— (других анионов они не образуют), т.е. основные гидроксиды.
Классификация оснований
1. По растворимости в воде основания делятся на растворимые и нерастворимые. К растворимым основаниям относятся гидроксиды щелочных и щелочноземельных металлов (щелочи), а также гидроксид аммония NH4OH. Нераствримые основания образуют все остальные металлы.
2. По количеству гидроксид-ионов ОН—, содержащихся в молекуле, основания подразделяются однокислотные (КОН, NH4OH и т.д.), двухкислотные (Ca(OH)2, Fe(OH)2 и т.д.), трехкислотные (Al(OH)3, Fe(OH)3, Cr(OH)3 и т.д.
3. По способности оснований диссоциировать, т.е. полностью или частично распадаться на ионы при растворении в воде, их делят на сильные и слабые. К сильным относят основания щелочных и щелочноземельных металлов. Они при растворении в воде диссоциируют нацело и необратимо. Например,
NaOH
 Na+
+
OH—
;
Ba(OH)2
Na+
+
OH—
;
Ba(OH)2
 Ba2+
+ 2OH—
и т.д.
Ba2+
+ 2OH—
и т.д.
Слабыми являются основания всех металлов за исключением щелочных и щелочноземельных, а также гидроксид аммония. Эти основания диссоциируют частично и обратимо, а многокислотные ступенчато:
NH4OH
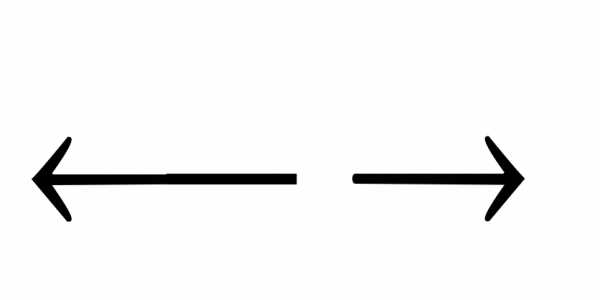 NH
NH +
OH—;
+
OH—;
1)
Fe(OH)3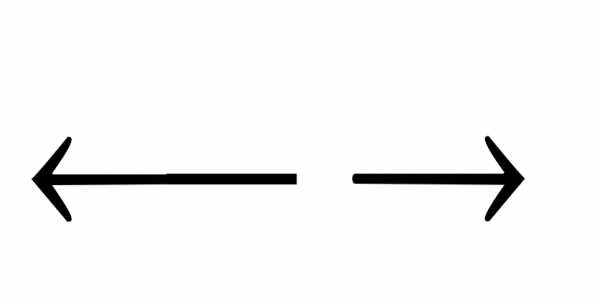 Fe(OH)
Fe(OH) + OH—;
+ OH—;
2)
Fe(OH)
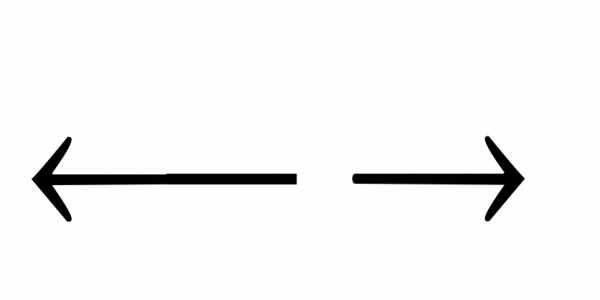 FeOH2++
OH—;
FeOH2++
OH—;
3)
FeOH2+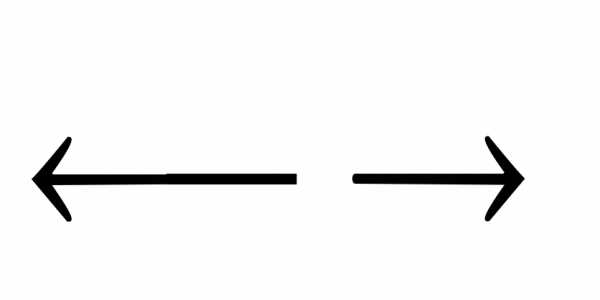 Fe3+
+ OH—.
Fe3+
+ OH—.
studfiles.net
предмет химии. вещества простые и сложные.
Простые и сложные вещества Для систематизации информации об известных науке веществах их объединяют в группы по сходности состава, строения и химических свойств. Все вещества можно разделить на две обширные группы — простых и сложных веществ. Простые вещества — это вещества, образованные из атомов одного элемента. Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот — атомами элемента азота. Сложные вещества, или химические соединения, —это вещества, образованные атомами разных элементов. Так, оксид меди (II) образован атомами элементов меди и кислорода, вода — атомами элементов водорода и кислорода. Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент» . Простое вещество характеризуется определенной плотностью, растворимостью, температурой кипения и плавления и т. п. Эти свойства относятся к совокупности атомов, и для разных простых веществ они различны. Химический элемент характеризуется определенным положительным зарядом ядра атома (порядковым номером) , степенью окисления, изотопным составом и т. д. Свойства элементов относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ кислорода и водорода, а из элементов кислорода и водорода. Названия элементов обычно совпадают с названиями соответствующих им простых веществ (исключения: углерод и одно из простых веществ кислорода — озон) . Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации — кислород и озон; элемент углерод — три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор. Явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле (например, кислород O2 и озон О3) или 2) образованием различных кристаллических форм (например, алмаз, графит и карбин, см. §7.2). Простые вещества делят на металлы и неметаллы. Неметаллов известно всего 22. Это водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат, радон. Сложные вещества можно разделить на две большие категории: неорганические и органические. К органическим веществам относятся практически все соединения углерода, за исключением его оксидов, солей угольной кислоты, карбидов и некоторых других. Органические вещества будут рассмотрены несколько позже. Сложные неорганические вещества принято подразделять на четыре класса: оксиды, основания (гидроксиды) , кислоты, соли. Кроме того, выделяют также класс комплексных соединений. Данная классификация является традиционной, но не отражает всего многообразия известных сложных неорганических веществ. Так, например, аммиак (Nh4), пентакарбонил железа (Fe(CO)5), гидрид лития (LiH), амид натрия (NaNh3) не учитываются в этой схеме.
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации — кислород и озон; элемент углерод — три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор. Явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле (например, кислород O2 и озон О3) или 2) образованием различных кристаллических форм (например, алмаз, графит и карбин, см. §7.2). Простые вещества делят на металлы и неметаллы. Неметаллов известно всего 22. Это водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат, радон. Сложные вещества можно разделить на две большие категории: неорганические и органические. К органическим веществам относятся практически все соединения углерода, за исключением его оксидов, солей угольной кислоты, карбидов и некоторых других. Органические вещества будут рассмотрены несколько позже. Сложные неорганические вещества принято подразделять на четыре класса: оксиды, основания (гидроксиды) , кислоты, соли. Кроме того, выделяют также класс комплексных соединений. Данная классификация является традиционной, но не отражает всего многообразия известных сложных неорганических веществ. Так, например, аммиак (Nh4), пентакарбонил железа (Fe(CO)5), гидрид лития (LiH), амид натрия (NaNh3) не учитываются в этой схеме.
без воздушна я пространство
touch.otvet.mail.ru
предмет химии. вещества простые и сложные.
Простые и сложные веществаДля систематизации информации об известных науке веществах их объединяют в группы по сходности состава, строения и химических свойств. Все вещества можно разделить на две обширные группы — простых и сложных веществ.
Простые вещества — это вещества, образованные из атомов одного элемента.
Например, простое вещество уголь образовано атомами элемента углерода, простое вещество железо — атомами элемента железа, простое вещество азот — атомами элемента азота.
Сложные вещества, или химические соединения, —это вещества, образованные атомами разных элементов.
Так, оксид меди (II) образован атомами элементов меди и кислорода, вода — атомами элементов водорода и кислорода.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент» . Простое вещество характеризуется определенной плотностью, растворимостью, температурой кипения и плавления и т. п. Эти свойства относятся к совокупности атомов, и для разных простых веществ они различны. Химический элемент характеризуется определенным положительным зарядом ядра атома (порядковым номером) , степенью окисления, изотопным составом и т. д. Свойства элементов относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ кислорода и водорода, а из элементов кислорода и водорода. Названия элементов обычно совпадают с названиями соответствующих им простых веществ (исключения: углерод и одно из простых веществ кислорода — озон) .
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации — кислород и озон; элемент углерод — три: алмаз, графит и карбин; несколько модификаций образует элемент фосфор.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле (например, кислород O2 и озон О3) или
2) образованием различных кристаллических форм (например, алмаз, графит и карбин, см. §7.2).
Простые вещества делят на металлы и неметаллы. Неметаллов известно всего 22. Это водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат, радон.
Сложные вещества можно разделить на две большие категории: неорганические и органические. К органическим веществам относятся практически все соединения углерода, за исключением его оксидов, солей угольной кислоты, карбидов и некоторых других. Органические вещества будут рассмотрены несколько позже.
Сложные неорганические вещества принято подразделять на четыре класса: оксиды, основания (гидроксиды) , кислоты, соли. Кроме того, выделяют также класс комплексных соединений. Данная классификация является традиционной, но не отражает всего многообразия известных сложных неорганических веществ. Так, например, аммиак (Nh4), пентакарбонил железа (Fe(CO)5), гидрид лития (LiH), амид натрия (NaNh3) не учитываются в этой схеме.
otvet.mail.ru
