Простые и сложные вещества — HimHelp.ru
Химия занимается изучением превращений химических веществ (число известных к настоящему времени веществ более десяти миллионов), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ.
Сложные вещества обычно делят на четыре важнейших класса: оксиды, основания (гидроксиды), кислоты, соли

Приведенная первичная классификация уже с самого начала оказывается несовершенной. Например, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Перед тем, как рассмотреть более детально каждый из классов неорганических соединений, целесообразно взглянуть на схему, отражающую генетическую связь типичных классов соединений

В верхней части схемы помещены две группы простых веществ — металлы и неметаллы, а также водород, строение атома которого отличается от строения атомов других элементов. На валентном слое атома водорода находится один электрон, как у щелочных металлов; в то же время, до заполнения электронного слоя оболочки ближайшего инертного газа — гелия — ему недостает также одного электрона, что роднит его с галогенами.
Волнистая черта отделяет простые вещества от сложных; он символизирует, что «пересечение» этой границы обязательно затрагивает валентные оболочки атомов в простых веществах, следовательно, любая реакция с участием простых веществ будет окислительно-восстановительной.
В левой части схемы под металлами помещены их типичные соединения — основные оксиды и основания, в правой части схемы помещены соединения, типичные для неметаллов, кислотные оксиды и кислоты. Водород, помещенный в верхней части схемы, дает очень специфический, идеально амфотерный оксид — воду Н2О, которая в комбинации с основным оксидом дает основание, а с кислотным — кислоту. Водород в сочетании с неметаллами образует бескислородные кислоты. В нижней части схемы помещены соли, которые, с одной стороны, отвечают соединению металла с неметаллом, а с другой — комбинации основного оксида с кислотным.
Приведенная схема до некоторой степени отражает и возможности протекания химических реакций — как правило, в химическое взаимодействие вступают соединения, принадлежащие разным половинам схемы.
Вещества простые и сложные. Химические элементы » HimEge.ru
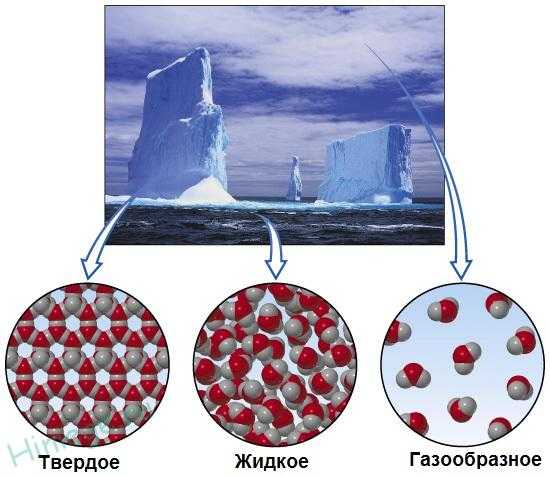
Три агрегатных состояния воды
Окружающий мир материален. Материя бывает двух видов: вещество и поле. Объект химии – вещество (в том числе и влияние на вещество различных полей – звуковых, магнитных, электромагнитных и др.)
Вещество — все, что имеет массу покоя (т.е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
Вещество бывает в трех агрегатных состояниях – газообразном, жидком и твердом. Есть еще одно состояние вещества – плазма (например, плазма есть в грозовой и шаровой молнии), но в школьном курсе химию плазмы почти не рассматривают.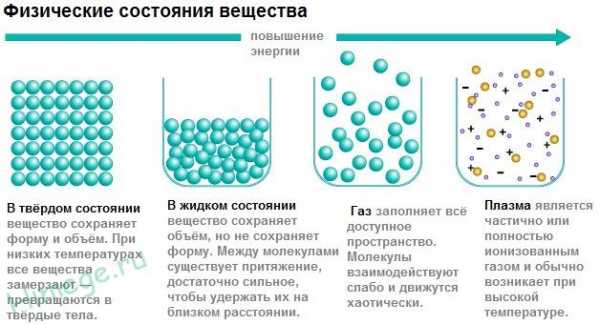
Вещества могут быть чистыми, очень чистыми (нужными, например, для создания волоконной оптики), могут содержать заметные количества примесей, могут быть смесями.
Все вещества состоят из мельчайших частиц – атомов. Вещества, состоящие из атомов одного вида (из атомов одного элемента), называют простыми (например, древесный уголь, кислород, азот, серебро и др.). Вещества, которые содержат связанные между собой атомы разных элементов, называют сложными.
Если в веществе (например, в воздухе) присутствуют два или большее число простых веществ, и их атомы не связаны между собой, то его называют не сложным, а смесью простых веществ. Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.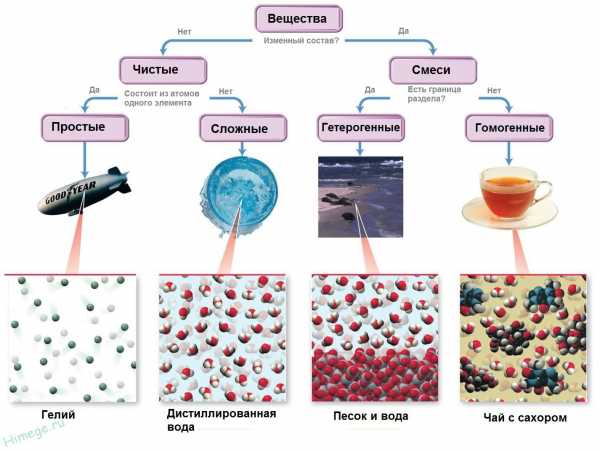
Вещества способны вступать между собой во взаимодействие, причем возникают новые вещества. Такие превращения называют
Химия изучает превращения одних веществ в другие. Задача химии – выяснить, с какими именно веществами может при данных условиях взаимодействовать (реагировать) то или иное вещество, что при этом образуется. Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Каждое вещество характеризуется совокупностью физических и химических свойств. Физические свойства – это свойства, которые можно охарактеризовать с помощью физических приборов
. Например, с помощью термометра можно определить температуру плавления и кипения воды. Физическими методами можно охарактеризовать способность вещества проводить электрический ток, определить плотность вещества, его твердость и т.д. При физических процессах вещества остаются неизменными по составу.Физические свойства веществ подразделяют на счислимые (те, которые можно охарактеризовать с помощью тех или иных физических приборов числом, например, указанием плотности, температур плавления и кипения, растворимости в воде и др.) и несчислимые (те, которые охарактеризовать числом нельзя или очень трудно – такие, как цвет, запах, вкус и др.).
Химические свойства вещества – это совокупность сведений о том, с какими другими веществами и при каких условиях вступает в химические взаимодействия данное вещество. Важнейшая задача химии – выявление химических свойств веществ.
В химических превращениях участвуют мельчайшие частицы веществ – атомы. При химических превращениях из одних веществ образуются другие вещества, и исходные вещества исчезают, а вместо них образуются новые вещества (продукты реакции). А
Число различных веществ огромно (и у каждого из них своя совокупность физических и химических свойств). Атомов, отличающихся друг от друга по важнейшим характеристикам, в окружающем нас материальном мире сравнительно невелико – около ста. Каждому виду атомов отвечает свой химический элемент. Химический элемент – это совокупность атомов с одинаковыми или близкими характеристиками. В природе встречается около 90 различных химических элементов. К настоящему времени физики научились создавать новые, отсутствующие на Земле виды атомов. Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Каждый элемент имеет латинское название и одно- или двух-буквенный символ. В русскоязычной химической литературе нет четких правил произношения символов химических элементов. Одни произносят так: называют элемент по-русски (символы натрия, магния и др.), другие – по латинским буквам (символы углерода, фосфора, серы), третьи – как звучит название элемента по-латыни (железо, серебро, золото, ртуть). Символ элемента водорода Н у нас принято произносить так, как эту букву произносят по-французски.
Сравнение важнейших характеристик химических элементов и простых веществ приведено в таблице ниже. Одному элементу может отвечать несколько простых веществ (явление аллотропии: углерод, кислород и др.), а может – и одно (аргон и др. инертные газы).
| Х и м и ч е с к и й э л е м е н т | П р о с т о е в е щ е с т в о |
| 1. Заряд ядра | 1. Совокупность физических свойств(цвет, запах, растворимость в воде, температуры плавления, кипения, разложения, тип кристаллической решетки и др.) 2. Совокупность химических свойств (с чем реагирует и при каких условиях) |
| 2. Значение электроотрицательности | |
| 3. Совокупность степеней окисления | |
| 4. Для элементов, встречающихся в природе: постоянство изотопного состава,и как следствие, постоянство атомной массы |

himege.ru
Простые вещества
В природе существуют простые и сложные вещества. Главное отличие между ними — в их составе. Так, простые вещества включают атомы одного элемента. Их (простых веществ) кристаллы можно синтезировать в лабораторных, а иногда и в домашних условиях. Однако часто для хранения полученных кристаллов необходимо создавать определенные условия.
Существует пять классов, на которые разделены простые вещества: металлы, полуметаллы, неметаллы, интерметаллиды и галогены (не встречающиеся в природе). Они могут быть представлены атомарными (Ar, Не) или молекулярными (О2, Н2, О3) газами.
В качестве примера можно взять простое вещество кислород. Оно включает молекулы, состоящие из двух атомов элемента Кислород. Или, например, вещество железо состоит из кристаллов, включающих только атомы элемента Железо. Исторически принято называть простое вещество по названию элемента, атомы которого входят в его состав. Строение этих соединений может быть молекулярным и немолекулярным.
Сложные вещества включают атомы различного вида и при разложении могут образовывать два (или больше) соединения. Например, вода при расщеплении формирует кислород и водород. При этом не каждое соединение можно разложить на простые вещества. Например, сульфид железа, сформированный атомами серы и железа, не поддается расщеплению. В этом случае, для того чтобы доказать, что соединение является сложным и включает разнородные атомы, применяют принцип обратной реакции. Другими словами, при помощи исходных компонентов получают сульфид железа.
Простые вещества являются формами химических элементов, существующих в свободном виде. Сегодня науке известно более четырехсот видов этих элементов.
В отличие от сложных веществ, простые нельзя получить из других простых веществ. Их также нельзя разложить на другие соединения.
Один химический элемент может сформировать разные типы простых веществ. (Например, элемент Кислород формирует трехатомный озон и двухатомный кислород, а Углерод способен образовать алмаз и графит). Это свойство называется аллотропией. Аллотропные модификации различаются по строению и способу размещения молекул в кристаллах или по составу самих молекул (атомов) элемента. Способность к формированию нескольких типов простых веществ обусловлена атомным строением, которое определяет вид химической связи, а также особенностями строения молекул и кристаллов.
Все аллотропные модификации обладают свойством переходить друг в друга. Разные типы простых веществ, сформированные одним химическим элементом, могут иметь разные физические свойства и разный уровень химической активности. Так, например, кислород проявляет меньшую, чем озон, активность, а температура плавления фуллерена, например, меньше, чем у алмаза.
В нормальных условиях для одиннадцати элементов простые вещества будут представлять собой газы (Ar, Xe, Rn, N, H, Ne, O, F, Kr, Cl, He,), для двух жидкости (Br, Hg), а для прочих элементов – твердые тела.
При температуре, приближенной к комнатной, пять металлов будут принимать жидкое или полужидкое состояние. Это связано с тем, что температура их плавления почти равна комнатной температуре. Так, ртуть и рубидий плавятся при 39 градусах, франций – при 27, цезий – при 28, а галлий при 30 градусах.
Следует отметить, что понятия «химический элемент», «атом», «простое вещество» смешивать не следует. Так, например, атом имеет определенное, конкретное значение и существует реально. Определение «химический элемент» является в целом абстрактным, собирательным. В природе элементы присутствуют в форме атомов свободных или химически связанных. При этом характеристики простых веществ (совокупности частиц) и химических элементов (изолированных атомов конкретного вида) имеют свои особенности.
fb.ru
Простые вещества — это… Что такое Простые вещества?
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул) [1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Схемы строения различных модификаций углеродаa: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C
g: аморфный углерод, h: углеродная нанотрубка
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже[4]:
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (дикислород O2) и озон; углерода — алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7
- ↑ 1 2 Глинка Н.Л. Общая химия. — 24 изд., испр. — Ленинград: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — С. 11-12. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6
Литература
- Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7.
- Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
dic.academic.ru
Простые вещества Википедия
Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации[ | ]
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11
ru-wiki.ru
Простые вещества — это… Что такое Простые вещества?
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации
Схемы строения различных модификаций углеродаa: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже[4]:
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (дикислород O2) и озон; углерода — алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7
- ↑ 1 2 Глинка Н.Л. Общая химия. — 24 изд., испр. — Ленинград: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — С. 11-12. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6
Литература
- Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7.
- Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки
biograf.academic.ru
Экзамен по химии — Простые и сложные вещества: различие в их составе. Основные классы неорганических соединений: примеры соединений, различие в их составе.
Простые и сложные вещества: различие в их составе. Основные классы неорганических соединений: примеры соединений, различие в их составе.
Простые вещества состоят из одного химического элемента. К ним относятся металлы и неметаллы.
Сложные вещества состоят из двух или более химических элементов. Сложные вещества, или соединения, подразделяют на классы:
оксиды
кислоты
основания
соли
Оксидами называют вещества, состоящие из двух элементов, один из которых кислород. Оксиды делят на оснóвные, кислотные, амфотерные, безразличные (несолеобразующие).
Оснóвным оксидам соответствуют основания. Это оксиды металлов, например натрия Na2O, кальция CaO. Основные оксиды реагируют с кислотами с образованием соли и воды.
Кислотным оксидам соответствуют кислоты. Это оксиды неметаллов, например, серы SO2, фосфора P2O5, или металлов в высшей степени окисления, например, оксид хрома (VI) CrO3. Кислотные оксиды реагируют со щелочами с образованием соли и воды
Амфотерные оксиды реагируют и с кислотами, и со щелочами. Примером могут служить оксиды цинка и алюминия.
Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относятся некоторые оксиды неметаллов, например, оксид азота (II) NO.
Кислоты – это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка.
Кислоты могут быть бескислородными, как соляная HCl, сероводородная h3S, или кислородсодержащими: азотная HNO3, серная h3SO4.
В зависимости от числа атомов водорода, кислоты делят на однооснóвные, например, азотная HNO3, двухоснóвные – серная h3SO4, трехснóвные – ортофосфорная (часто называют просто фосфорная) h4PO4.
С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода:
HCl → H+ + Cl-
Основания – это сложные вещества, состоящие из металла и одной или нескольких гидроксогрупп (OH). Основания могут быть растворимыми в воде – щелочи: гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, или нерастворимыми, как гидроксид меди (II) Cu(OH)2.
С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т.е. оснóвные гидроксиды:
NaOH → Na+ + OH-
С точки зрения протонной теории к основаниям относятся вещества, способные присоединять ионы водорода, например аммиак:
Nh4 + HOH = Nh5+ + OH-
Соли – это сложные вещества, в составе которых имеется металл (или сложный положительный ион) и кислотный остаток. Соли бывают:
средние – в составе нет ионов водорода и гидроксогрупп, например, хлорид натрия NaCl, карбонат натрия Na2CO3
кислые – содержат в своем составе ионы водорода, например, гидрокарбонат натрия NaHCO3, дигидрофосфат натрия Nah3PO4
оснóвные – содержат в своем составе гидроксогруппы, например, основный карбонат меди (II) (CuOH)2CO3
cribs.me
