Формула пластической серы в химии
Определение и формула пластической серы
Пластическая сера представляет собой замкнутые или открытые цепи соединяющейся между собой серы. Это вещество коричневого цвета (рис. 1), получаемое при резком охлаждении расплава серы. Через несколько часов после получения пластическая сера становится хрупкой и приобретает желтый цвет постепенно превращаясь в ромбическую модификацию.
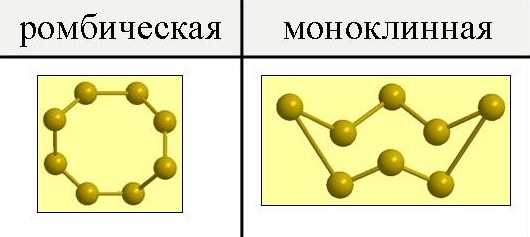
Рис. 1. Пластическая сера. Внешний вид.
Химическая формула пластической серы
Химическая формула пластической серы может иметь вид S4 или S6. Она показывает, что в составе молекулы этого вещества находится четыре или шесть атомов серы (Ar = 32 а.е.м.). По химической формуле можно вычислить молекулярную массу пластической серы:
Mr(S4) = 4×Ar(S) = 4×32 = 128;
Mr(S6) = 6×Ar(S) = 6×32 = 192.
Структурная (графическая) формула пластической серы
Более наглядной является структурная (графическая) формула пластической серы. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула белого фосфора имеет вид:
Электронная формула
Электронная формула пластической серы показывает распределение электронов в атоме по энергетическим подуровням:
16S 1s22s22p63s23p4.
Она также показывает, что сера относится к элементам р-семейства, а также число валентных электронов — на внешнем энергетическом уровне находится 6 электронов (3s23p4).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Формула серы в химии
Электронная формула серы
Атомная масса: 32,065 а.е.м.
Электронная формула: 1s2 2s2 2p6 3s23p4
Электронно-графическая формула атома серы
Электронно-графическая формула атома серы в основном и возбужденных состояниях с примерами соединений:

Атомы серы способны образовывать устойчивые цепочки. Такие гомоцепи имеют зигзагообразную форму, поскольку их образуют р-электроны соседних атомов, расположенные на взаимно перпендикулярных орбиталях. Цепи могут открытыми или замыкаться в циклы состава S20, S8, S6 и S 4.
Сера образует несколько десятков кристаллических и аморфных модификаций, которые отличаются составом молекул и полимерных цепей, а также спо собом их упаковки в твердом состоянии.
Основные аллотропные модификации серы:

В природе сера встречается в свободном состоянии (самородная сера) и в виде минералов (FeS2, ZnS, PbS и др.). Сера также присутст вует в нефти, природном угле, сланцах и природном газе. Присутствие сульфат-ионов в воде обуславливает ее постоянную жёсткость. Сера является жизненно важным элементом живых организмов, входит в состав белков.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Сера
Се́ра — элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. Sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
История открытия
Сера (англ. Sulfur, фр. Soufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, ещё в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точно происхождение серы не установлено, но, как сказано выше, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён.
Происхождение названия
Русское название серы восходит к праславянскому *sěra, которое связывают с лат. sērum «сыворотка». Латинское sulphur (эллинизированное написание более старого sulpur) восходит к индоевропейскому корню *swelp — «гореть».
Получение
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания. Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу. В 1890 г. Герман Фраш, предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху. Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Физические свойства
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S 8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде, скипидаре. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде. Важнейшие природные соединения серы: FeS 2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
|
Таблица ^ =>> v Пирит, FeS2 и самородная сера |
История открытия:Так как сера встречается в природе в самородном состоянии, она была известна человеку уже в глубокой древности. Большое внимание уделяли сере алхимики. Многим из них была уже известна серная кислота. Василий Валентин в XV в. подробно описал ее получение (нагреванием железного купороса). Фабричным способом серная кислота была получена впервые в Англии в середине XVIII в. Нахождение в природе, получение:В природе часто встречаются значительные залежи серы (большей частью вблизи вулканов). Наиболее часто встречающиеся сульфиды: железный колчедан (пирит) FeS2, медный колчедан CuFeS2, свинцовый блеск PbS и цинковая обманка ZnS. Еще чаще сера встречается в виде сульфатов, например сульфат кальция (гипс и ангидрит), сульфат магния (горькая соль и кизерит), сульфат бария (тяжелый шпат), сульфат стронция (целестин), сульфат натрия (глауберова соль). Физические свойства:Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций. ???… Химические свойства:Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления -2. При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6. Важнейшие соединения:
Диоксид серы, SO2 — бесцветный, тяжелый газ с острым запахом, очень легко растворяется в воде. В растворе SO2 легко окисляется. Применение:Сера широко применяется в промышленности и сельском хозяйстве. Около половины ее добычи расходуется для получения серной кислоты. Используют серу для вулканизации каучука. В виде серного цвета (тонкого порошка) сера применяется для борьбы с болезнями виноградника и хлопчатника. Она употребляется для получения пороха, спичек, светящихся составов. В медицине приготовляют серные мази для лечения кожных заболеваний. Мякишева Е.А. Источники: 1. Химия: Справ. Изд./В. Шретер. – М.: Химия, 1989. 2. Г.Реми «Курс неорганической химии» — М.: Химия,1972. |
www.kontren.narod.ru
Молярная масса серы (S), формула и примеры
Молярная масса серы
Порядковый номер – 16. Строение атома показано на рис. 1. Неметалл p-семейства.

Рис. 1. Схема строения атома серы.
В обычных условиях сера представляет собой хрупкие кристаллы желтого цвета, плавящиеся при температуре 112,8oC. Плотность 2,07 г/см3. Нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристалликов ромбической системы, имеющих форму октаэдров (ромбическая модификация).
Если расплавленную серу медленно охлаждать и в тот момент, когда она частично затвердевает слить еще не успевшую застыть жидкость можно получить длинные темно-желтые игольчатые кристаллы моноклинной системы (моноклинная модификация). Плотность 1,96 г/см3. Температура плавления 119,3oC.
Молярная масса серы равна 32,065 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
M = m / n.
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Поскольку вне зависимости от модификации сера находится в твердом или жидком состоянии, но не газообразном, для нахождения значения её молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Что такое Сера — фото, описание, свойства минерала, происхождение, месторождения
Сера (с лат. sērum «сыворотка») — минерал класса самородных элементов, неметалл. Латинское название связано с индоевропейским корнем swelp — «гореть». Химическая формула: S.
Физические свойства и фото серы
Сера в отличие от других самородных элементов имеет молекулярную решетку, что определяет ее низкую твердость (1,5-2,5), отсутствие спайности, хрупкость, неровный излом и обусловленный им жирный плеск; лишь на поверхности кристаллов наблюдается стеклянный блеск. Удельный вес 2,07 г/см3. Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах. Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Отличительные признаки: для самородной серы характерны: неметаллический блеск и то, что она загорается от спички и горит, выделяя сернистый газ, имеющий резкий удушливый запах. Наиболее характерным цветом для самородной серы является светло-желтый.
Разновидность:
Вулканит (селенистая сера). Оранжево-красного, красно-бурого цвета. Происхождение вулканическое.
- Моноклинная сера
- Кристаллическая сера
- Кристаллическая сера
- Селенистая сера — вулканит
Химические свойства серы
Загорается от спички и горит голубым пламенем, при этом образуется сернистый газ, имеющий резкий удушливый запах. Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Происхождение серы
Встречается самородная сера естественного и вулканического происхождений. Серобактерии живут в водных бассейнах, обогащенных сероводородом за счет разложения органических остатков, — на дне болот, лиманов, мелких морских заливов. Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H2S, SО2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.
Иногда при вулканических процессах сера изливается в жидком виде. Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Спутники. Среди осадочных пород: гипс, ангидрит, кальцит, доломит, сидерит, каменная соль, сильвин, карналлит, опал, халцедон, битумы (асфальт, нефть, озокерит). В месторождениях, образовавшихся в результате окисления сульфидов, — главным образом пирит. Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Применение
Широко используется в химической промышленности. Три четверти добычи серы идет на изготовление серной кислоты. Применяется она также для борьбы с сельскохозяйственными вредителями, кроме того, в бумажной, резиновой промышленности (вулканизация каучука), в производстве пороха, спичек, в фармацевтике, стекольной, пищевой промышленности.
Месторождения серы
На территории Евразии все промышленные месторождения самородной серы поверхностного происхождения. Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
www.geolib.net
25. Сера и ее свойства
Сера (S) в природе встречается в соединениях и свободном виде. Распространены и соединения серы, такие как свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S. Для получения серы основным источником служит железный колчедан (пирит) FeS2. Газовую серу получают из газов, образованных при коксовании и газификации угля.
Существует несколько известных аллотропных модификаций серы:
1) циклическая форма;
2) моноклинная форма;
3) кристаллическая ромбическая форма.
При температуре 20–25 °C (комнатная) наиболее устойчива желтая ромбическая сера (a-сера, r = 2,1 г/см3). При температурном интервале от 95,4 °C до 119,3 °C (температура плавления) наиболее стабильной является моноклинная сера (b-сера). При комнатной температуре кристаллы моноклинной серы постепенно переходят в монолит микроскопических кристаллов ромбической серы. При резком охлаждении сильно нагретой серы происходит образование пластической серы.
Реже встречается пурпурная сера, образующаяся при быстрой конденсации паров серы на поверхности, охлаждаемой жидким азотом.
Сера находится в VI группе третьего периода периодической системы. Имеет на внешнем электронном слое атома шесть электронов.
Проявляет степень окисления от -2 до +6.
Сера не растворима в воде, но растворима в органических растворителях. Является диэлектриком.
Сера – неметалл с типичными для него свойствами. Взаимодействует со многими металлами непосредственно (медью, железом, цинком), выделяя при этом теплоту. Среди металлов лишь золото, платина и рутений не вступают в реакцию с серой. Взаимодействует также с большинством неметаллов, за исключением азота и йода.
Химические свойства:
1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = h3S;
2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3;
3) при сжигании серы в струе кислорода образуется сернистый газ или сернистый ангидрид SO2: S + O2 = SO2;
4) чистая сера способна проявлять восстановительные свойства: S + 2HNO3 = h3SO4 + 2NO.
Сера используется в большом количестве в народном хозяйстве. Серу используют для получения резины – при помощи серы происходит ее затвердевание (вулканизация).
Каучук с высоким содержанием серы называется эбонит, являющийся качественным электрическим изолятором. Для уничтожения некоторых сельскохозяйственных вредителей серу применяют в виде серного цвета. Серу используют для приготовления спичек, синей краски (ультрамарина), сероуглерода, серной кислоты.
26. Сероводород и сульфиды
Сероводород (h3S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных.
Получение:
1) прямой синтез из элементов, при температуре 600 °C;
2) воздействием на сульфиды натрия и железа соляной кислотой.
Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота.
Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты:
1) горит голубоватым пламенем на воздухе:
2) при высокой температуре разлагается:
3) вступает в реакцию с галогенами:
4) взаимодействует с окислителями:
5) серебро при взаимодействии с сероводородом темнеет:
Применение: сероводород используют как химический реактив, а также как сырье для получения серы и серной кислоты.
Сероводородная кислота – слабая кислота. Водный раствор сероводорода.
Сульфиды – средние соли сероводородной кислоты.
Получение сульфидов:
1) взаимодействие металлов с серой при высокой температуре: Fe + S = FeS;
2) взаимодействие сводными растворами солей металлов: CuSO4 + h3S = CuS? + h3SO4;
3) сульфиды подвергаются гидролизу:
Взбалтывая раствор сульфида с серой можно обнаружить после выпаривания остаток, содержащий полисульфиды (многосернистые металлы).
Полисульфиды – соединения с большим содержанием серы, например Na2S2, Na2S5.
Для сульфидов характерны соединения переменного состава (FeS1,01—FeS1,14).
Природные сульфиды – основа руд цветных и редких металлов, поэтому их используют в металлургии. Некоторые сульфиды используют в производстве серной кислоты(FeS2 – железный колчедан). В химической и легкой промышленности применяют сульфиды щелочных и щелочноземельных металлов (в качестве основы люминофоров). В электронной технике используются как полупроводники.
studfiles.net
