Реакции в водных растворах | Chemistry-gid.ru
Уникальные особенности водных растворов
Водный раствор представляет собой раствор, который взаимодействует с водой. Что делает воду существенной, так как она может позволить веществам растворяться и / или диссоциировать на ионы внутри нее.
Электролиты
Вода обычно представляет собой растворитель, содержащийся в водном растворе, где растворителем является вещество, которое растворяет растворенное вещество. Растворённое вещество представляет собой вещество или соединение, растворенное в растворителе. Раствор имеет меньшее количество частиц, чем растворитель, где частицы находятся в случайном движении. Интересно, что водные растворы с ионами в некоторой степени проводят электричество. Чистая вода с очень низкой концентрацией ионов не может проводить электричество. Когда растворенное вещество диссоциирует в воде с образованием ионов, его называют электролитом из-за того, что раствор является хорошим электрическим проводником. Когда никакие ионы не образуются или содержание ионов невелико, растворенное вещество является неэлектролитом. Неэлектролиты не проводят электричество или проводят его в очень малой степени.
В водном растворе сильный электролит считается полностью ионизированным или диссоциированным в воде, то есть он растворим. Сильные кислоты и основания обычно являются сильными электролитами. Тогда слабый электролит считается не полностью диссоциированным, поэтому он все еще содержит целые соединения и ионы в растворе. Слабые кислоты и основания обычно являются слабыми электролитами. Другими словами, сильные электролиты имеют лучшую тенденцию подавать ионы в водный раствор, чем слабые электролиты, и поэтому сильные электролиты создают водный раствор, который является лучшим проводником электричества.
ПримерMgCl2 в воде: MgCl2→Mg2+(aq)+2Cl −(aq) Ионное соединение полностью диссоциирует с образованием ионов в воде, поэтому он является сильным электролитом. Теперь давайте посмотрим на слабый электролит: HC2H3O2(aq)⇌H+(aq)+C2H3O2− (aq) В этой ситуации ионное соединение, (HC2H3O2), лишь частично диссоциирует, что выражается двойными стрелками в реакции. Это означает, что реакция обратима и никогда не заканчивается. HC2H3O2 в этой ситуации лишь частично диссоциирует, что выражается двойными стрелками в реакции. Это означает, что реакция обратима и никогда не заканчивается. He \ (H ^ + \) катион является протоном, который взаимодействует с молекулами \ (H_2O \), в которые он погружен. Взаимодействие называется H + H +. Катион является протоном, который взаимодействует с молекулами H2OH2O, погруженным в . Это взаимодействие называется гидратацией. Фактический ион Н + не существует в водном растворе. Это ион гидроня, \ (H_3O ^ + \), который взаимодействует с водой, создает дополнительные виды, такие как \ (H_5O_2 ^ + \), \ (H_9O_4 ^ + \) и \ (H_7O_3 ^ + \). \ (H_3O ^ + \) можно просто описать как гидратацию одного H h4O + h4O +, который взаимодействует с водой для создания дополнительных видов, таких как H5O+ 2H5O2+, H9O + 4H9O4 + и H7O + 3H7O3+. H3O + H3O + можно просто описать как гидратацию одной H + и одной молекулы воды. Для неэлектролитов все, что нужно сделать, это написать молекулярную формулу, потому что не происходит никакой реакции или диссоциации. Одним из примеров неэлектролита является сахар: записывается как \ (C_6H_ {12} O_6 (aq) \). C6h22O6 (водн.) C6h22O6 (водн.). |
Концентрации ионов
В водном растворе количество ионов вида связано с количеством молей этого вида на концентрацию вещества в водном растворе. Молярность — это число молей растворенного вещества (n), деленного на общий объем (V) решения: (n), деленный на общий объем (V) решения:
Молярность или концентрация могут быть представлены путем размещения растворенного вещества в скобках ([Cl^-] ) для концентрации ионов хлорида. [Cl -] [Cl-] для концентрации Хлорид-ионы.
Реакции осаждения
Реакции осаждения происходят, когда катионы и анионы в водном растворе объединяются с образованием нерастворимого ионного твердого вещества, называемого осадком. Независимо от того, происходит ли такая реакция, можно определить, используя правила растворимости для обычных ионных твердых тел. Поскольку не все водные реакции образуют осадки, перед определением состояния продуктов и написанием чистого ионного уравнения необходимо проконсультироваться с правилами растворимости. Способность прогнозировать эти реакции позволяет ученым определять, какие из ионов присутствуют в растворе, и позволяет отраслям создавать химические вещества путем извлечения компонентов из этих реакций.
Свойства осадков
схема образования осадка в растворе.Осадки представляют собой нерастворимые ионные твердые продукты реакции, образующиеся, когда определенные катионы и анионы объединяются в водном растворе. Определяющие факторы образования осадка могут меняться. Некоторые реакции зависят от температуры, например, от растворов, используемых для буферов, тогда как другие зависят только от концентрации раствора. Твердые вещества, полученные в реакциях осаждения, представляют собой кристаллические твердые вещества и могут суспендироваться по всей жидкости или падать на дно раствора. Оставшаяся жидкость называется супернатантной жидкостью. Два компонента смеси (осадок и супернатант) могут быть разделены различными способами, такими как фильтрация, центрифугирование или декантирование.
Реакции осаждения и двойной замены
Использование правил растворимости требует понимания того, как реагируют ионы. Большинство реакций осаждения являются реакциями с одной заменой или реакциями с двойной заменой. Реакция двойной замены происходит, когда два ионных реагента диссоциируют и связывают с соответствующим анионом или катионом из другого реагента. Ионы заменяют друг друга на основе их зарядов как катион или анион. Это можно рассматривать как «коммутаторы». То есть два реагента, каждый из которых «теряет» своего партнера и формирует связь с другим партнером.
Реакция с двойной заменой конкретно классифицируется как реакция осаждения, когда рассматриваемое химическое уравнение происходит в водном растворе, и один из образованных продуктов является нерастворимым. Ниже приведен пример реакции осаждения:
Оба реагента являются водными и один продукт является твердым. Поскольку реагенты являются ионными и водными, они диссоциируют и поэтому растворимы. Тем не менее, существует шесть рекомендаций по растворимости, которые используются для прогнозирования того, какие молекулы нерастворимы в воде. Эти молекулы образуют твердый осадок в растворе.
Правила растворения
- Соли, образованные катионами группы 1 и катионами NH+4NH+4 , являются растворимыми. Существуют некоторые исключения для некоторых солей Li
- Растворимы ацетаты (C2H3O-2C2H3O2—), нитраты (NO—3NO3—) и перхлораты (ClO—4ClO4—).
- Бромиды, хлориды и иодиды растворимы.
- Сульфаты (SO2—4SO42-) растворимы, за исключением сульфатов, образованных с Ca2+ Ca2+, Sr2+ Sr2+ и Ba2+ Ba2+.
- Соли, содержащие серебро, свинец и ртуть (I), нерастворимы.
- Карбонаты (CO2-3CO2-3), фосфаты (PO3-4PO43-), сульфиды, оксиды и гидроксиды (OH—OH—) нерастворимы. Исключение составляют сульфиды, образованные катионами и гидроксидами группы 2, образованными кальцием, стронцием и барием.
Если в правилах указывается, что ион растворим, то он остается в форме водного иона. Если ион нерастворим в соответствии с правилами растворимости, он образует твердое вещество с ионом из другого реагента. Если показано, что все ионы в реакции растворимы, то реакция осаждения не происходит.
Ионные уравнения
Чтобы понять определение чистого ионного уравнения, напомним уравнение для реакции двойной замены. Поскольку эта конкретная реакция представляет собой реакцию осаждения, состояния материи могут быть назначены каждой переменной паре:
Первым шагом к написанию чистого ионного уравнения является отделение растворимых (водных) реагентов и продуктов в их соответствующие катионы и анионы. Осадки не диссоциируют в воде, поэтому твердое вещество не должно разделяться. Полученное уравнение выглядит так:
В приведенном выше уравнении на обеих сторонах уравнения присутствуют А+
Чистое ионное уравнение показывает только реакцию осаждения. Чистое ионное уравнение должно быть сбалансировано с обеих сторон не только с точки зрения атомов элементов, но и с точки зрения электрического заряда. Реакции осаждения обычно представлены исключительно чистыми ионными уравнениями. Если все продукты являются водными, чистое ионное уравнение не может быть записано, потому что все ионы нейтрализуются как зрительные ионы. Поэтому реакция осаждения не происходит.
Практические проблемы
Напишите чистое ионное уравнение для реакций потенциального двойного смещения. Не забудьте включить состояния материи и сбалансировать уравнения.
1. Независимо от физического состояния продуктами этой реакции являются Fe(OH)3 и NaNO3. Правила растворимости предсказывают, что NaNO3 растворима, поскольку все нитраты растворимы. Однако Fe(OH)3 нерастворим, поскольку гидроксиды нерастворимы, и Fe не является одним из катионов, что приводит к исключению. После диссоциации ионное уравнение выглядит следующим образом:
Отмена зрительных ионов оставляет чистое ионное уравнение:
2. Из реакции двойной замены продуктами являются AlCl3 и BaSO4. AlCl3 является растворимым, поскольку он содержит хлорид. Однако BaSO4 нерастворим: он содержит сульфат, но ион Ba2+ вызывает его нерастворимость, поскольку он является одним из катионов, который вызывает исключение из правила 4. Ионное уравнение (после балансировки):
Отмена зрительных ионов оставляет следующее чистое ионное уравнение:
3. Из реакции двойной замены образуются продукты HNO3 и ZnI2. Рассматривая правила растворимости, HNO3 растворима, поскольку содержит нитрат, а ZnI2 растворима, поскольку иодиды растворимы. Это означает, что оба продукта являются водными (то есть диссоциируют в воде) и, следовательно, реакция осаждения не происходит.
4. Продуктами этой двойной реакции замещения являются Ca3(PO4)2 и NaCl. Правило 1 гласит, что NaCl является растворимым, и согласно правилу 6 растворимости Ca3(PO4)2 является нерастворимым. Ионное уравнение:
После отбраковки ионов, ионное уравнение приведено ниже:
5. Первый продукт этой реакции, PbSO4, растворим в соответствии с правилом 4, поскольку он является сульфатом. Второй продукт, KNO 3, также растворим, поскольку он содержит нитрат. Поэтому реакция осаждения не происходит.
Rating: 3.0/5. From 2 votes.
Please wait…
Похожее
chemistry-gid.ru
Кинетическое исследование реакции растворения аспирина в воде
Библиографическое описание:
Хачатрян Э. А., Бадалян Э. М., Асланян С. Н., Киканян С. Л., Казарян Г. А. Кинетическое исследование реакции растворения аспирина в воде // Молодой ученый. 2018. №22. С. 31-34. URL https://moluch.ru/archive/208/50916/ (дата обращения: 20.11.2018).
Ключевые слова: аспирин, вода, кинетические параметры, модельные уравнения кинетики, область реагирования.
Аспирин (ацетилсалициловая кислота) является типичным представителем группы нестероидных противовоспалительных препаратов и в различных лекарственных формах широко применяется в медицинской практике, как эффективное противовоспалительное, анальгетическое, антиагрегатное средство [1]. Он также широко применяется при лечении сердечно-сосудистых заболеваний. Однако, недостатком аспирина является то, что он чаще всего вызывает раздражение желудка и двенадцатиперстной кишки, вызывает эрозивно-язвенные поражения ЖКТ (желудочно-кишечного тракта). Такое негативное действие аспирина определяется несколькими причинами, среди которых следует отметить плохую растворимость аспирина в воде [2]. Поэтому повышение гидрофильности и снижение токсичности аспирина является актуальной задачей современной формации.
Технология изготовления таблеток аспирина, а также вспомогательных веществ, входящих в ее состав, во многом способствуeт растворению и снижению риска повреждающего действия его на слизистую оболочку желудка.
Целью данной работы является изучение кинетических закономерностей растворения в воде аспирина разных производителей. Определение лимитирующей стадии процесса, нахождение адекватного формально кинетического описания и определение основных кинетических параметров реакции: констант скорости и энергии активации.
По существу, процесс растворения аспирина в воде является гетерогенным процессом и происходит на границе раздела фаз твердое тело-жидкость. Следовательно, общая скорость растворения складывается из скоростей двух последовательных стадий:
1. физико-химическое взаимодействие аспирина с водой; 2-диффузия продуктов с поверхности лекарственного вещества в раствор. Общая скорость процесса зависит от соотношения скоростей этих стадий и ограничивается скоростью наиболее медленно протекающей стадии, которая и определяет режим (кинетический и диффузионный) процесса растворения. В работе нами были использован аспирин Российского производства фирмы «Фармстандарт».
Исследование кинетики лекарственного вещества проводилось гравиметрически, при температурах 20, 25, 30 и 400С. В качестве растворителя использовалась дистиллированная вода (РH = 6,2–6,8). Степень растворения рассчитывали как отношение растворившегося аспирина к его взятой общей массе (0,6г). Кинетические данные дают возможность уточнить механизм реакции, выявить корреляционные зависимости между реакционной способностью молекул и их строением.
Результаты экспериментальных данных приведены в табл. 1.
Таблица 1
Зависимость степени растворения аспирина вводе от времени при различных температурах ирасчет константы скорости процесса.
|
t0C |
Время, с |
Степень растворения, |
1-(1-)1/310–3 |
Конст. скорости растворения, K 10–4 |
lnk |
|
20 |
300 600 2400 3600 |
0,012 0,017 0,070 0,110 |
3,10 6,15 2,50 3,60 |
–7,42 |
6,01 |
|
25 |
300 600 2400 3600 |
0,03 0,06 0,15 0,19 |
5,35 10,7 41,6 64,2 |
–6,84 |
1,07 |
|
30 |
300 600 2400 3600 |
0,030 0,058 0,220 0,310 |
9,9 19,8 79,2 118,8 |
–622 |
1,98 |
|
40 |
300 600 2400 3600 |
0,53 0,64 0,70 0,82 |
36,5 73,1 292,2 438,2 |
–4,92 |
7,30 |
Математическая обработка этих данных была проведена по трем уравнениям: Гистлинга, «Сокращающейся» сферы и Яндера [3].
Уравнение Гистлинга используется для описания скорости процесса во внешнедиффузионной области:
1 – (1 -) 2/3 =K (1)
Где: - степень растворения, К- константа скорости, — время.
Уравнение «Сокращающейся» сферы применимо для описания процесса, скорость которого зависит как от диффузии реагентов к поверхности реагирования, так и от скорости реакции на поверхности раздела фаз:
1 — (1 -) 1/3 =K (2)
А для описания скорости реакций, в ходе которых образуются достаточно плотные пленки продуктов, замедляющих поступление жидкого реагента к реакционной поверхности реагирования (диффузионная область), используют уравнение Яндера:
[1 — (1 -) 1/3]2 = K (3)
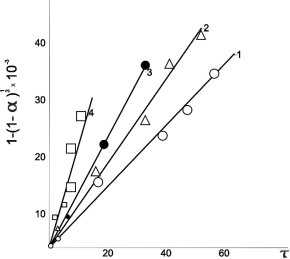
Рис. 1. Линеаризация кинетических данных процесса растворения аспирина в воде в координатах уравнения сокращающейся сферы
Для того, чтобы определить какое из вышеперечисленных уравнений болеет точно описывает экспериментальные данные, необходимо подставить степень растворения в несколько уравнений и построив графики, убедиться какой из них соответствует прямой линии.
Как видно из рис. 1 опытные данные удовлетворительно линеаризуются в координатах 1 — (1 -) 1/3— Следовательно именно уравнение «Сокращающейся» сферы наиболее точно описывает кинетику процесса растворения аспирина в воде.
По наклону этих прямых для каждой температуры рассчитывали константу скорости процесса (рис.2), и строили температурную зависимость константу скорости реакции растворения в аррениусовских координатах lnK-1/T. По тангенсу угла наклона этой прямой определяли значения основных кинетических параметров процесса: энергию активации (12,5 кДж/моль, что соответствует внешне — диффузионной области реагирования) и предэкспоненциальный множитель (К0 = 0,03 мин-1).
Подставляя полученные значения константы скорости и энергии активации в исходное уравнение, получаем выражение:
1 — (1 -) 1/3 = 0,03 exp(-12500/RT) (4)
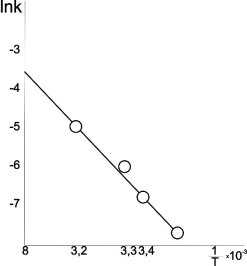
Рис. 2. Зависимость логарифма константы скорости реакции растворения аспирина в воде от обратной температуры С
А зависимость степени растворения от времени и температуры для данного процесса выглядит следующим образом:
= 1 — [1–0,03 exp(-12500/RT)]3 (5)
Таблица 2
Сравнение расчетных иэкспериментальных данных реакции растворения аспирина вводе
|
, мин |
Степень растворения аспирина () |
|||||
|
20оC |
30оC |
40оC |
||||
|
Эксп. |
Расч. |
Эксп. |
Расч. |
Эксп. |
Расч. |
|
|
5 20 40 60 |
0,012 0,050 0,070 0,110 |
0,016 0,053 0,081 0,090 |
0,03 0,11 0,22 0,31 |
0,028 0,092 0,280 |
0,53 0,64 0,73 0,82 |
0,46 0,58 0,66 0,70 |
Из таблицы 2 видно, что результаты расчета по уравнению (5) удовлетворительно согласуются с экспериментальными данными.
Литература:- Алехин Е. К. Аспирин: Новая жизнь старого лекарства // Соросовский Образовательный журнал, No 7, 1999. с. 85–90.
- Рафальский В. В., Лосенкова С. О., Крикова А. В., Максименкова К. И., Багликов А. Н. Сравнительная оценка кишечнорастворимых таблеток ацетилсалициловой кислоты разных производителей по тесту »Растворение». Российский кардиологический журнал, No 6 (86) 2010. с. 51–55.
- Барре П. Кинетика гетерогенных процессов М:Мир. 1976. 399.с.
Основные термины (генерируются автоматически): данные, уравнение, энергия активации, вод, константа скорости процесса, лекарственное вещество, процесс растворения аспирина, растворение, растворение аспирина.
moluch.ru
Урок «Растворение. Растворимость веществ в воде»
Урок химии в 8 классе. «____»_____________ 20___ г.
Растворение. Растворимость веществ в воде.
Цель. Расширить и углубить представление учащихся о растворах и процессах растворения.
Образовательные задачи: определить, что такое раствор, рассмотреть процесс растворения – как физико – химический процесс; расширить представление о строении веществ и химических процессах, происходящих в растворах; рассмотреть основные виды растворов.
Развивающие задачи:Продолжать развитие речевых навыков, наблюдательности и умение делать выводы на основе лабораторной работы.
Воспитательные задачи: воспитывать мировоззрение у обучающихся через изучение процессов растворимости, так как растворимость веществ важная характеристика для приготовления растворов в быту, медицине и других важных отраслях промышленности и жизни человека.
Ход урока.
Что такое раствор? Как приготовить раствор?
Опыт №1. В стакан с водой поместить кристалл перманганата калия. Что наблюдаем? К какому явлению относится процесс растворения?
Опыт №2.Налить в пробирку 5 мл воды. Затем добавить 15 капель концентрированной серной кислоты (h3SO4конц.). Что наблюдаем? (Ответ: пробирка нагрелась, протекает экзотермическая реакция, значит, растворение химический процесс).
Опыт №3. В пробирку с нитратом натрия добавляем 5 мл воды. Что наблюдаем? (Ответ: пробирка стала холоднее, протекает эндотермическая реакция, значит растворение химический процесс).
Процесс растворения рассматривают как физико-химический процесс.
Стр. 211 заполнить таблицу.
| Признаки сравнения | Физическая теория | Химическая теория. |
| Сторонники теории | Вант –Гофф, Аррениус, Оствальд | Менделеев. |
| Определение растворения | Процесс растворения является результатом диффузии, т.е. проникновения растворенного вещества в промежутки между молекулами воды | Химическое взаимодействие растворенного вещества с молекулами воды |
| Определение раствора | Однородные смеси, состоящие из двух или более однородных частей. | Однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия. |
Растворимость твердых веществ в воде зависит:
Задание: наблюдение влияния температуры на растворимость веществ.
Порядок выполнения:
В пробирки №1 и №2 с сульфатом никеля прилейте воды (1/3 объема).
Пробирку с №1 нагрейте, соблюдая технику безопасности.
В какой из предложенных пробирок №1 или №2 процесс растворения протекает быстрее?
Сделайте вывод о влиянии температуры на растворимость веществ.
Рис.126 стр. 213
А) растворимость хлорида калия при 30 0С составляет 40 г
при 65 0С составляет 50 г.
Б) растворимость сульфата калия при 40 0С составляет 10 г
при 800С составляет 20 г.
В) растворимость хлорида бария при 90 0С составляет 60 г
при 00С составляет 30 г.
Задание: наблюдение влияния природы растворенного вещества на процесс растворения.
Порядок выполнения:
В 3 пробирки с веществами: хлорид кальция, гидроксид кальция, карбонат кальция, прилейте по 5 мл воды, закройте пробкой и хорошо встряхните для лучшего растворения вещества.
Какое из предложенных веществ хорошо растворяется в воде? Какое не растворяется?
таким образом, процесс растворения зависит от природы растворенного вещества:
— хорошо растворимые: (по три примера)
— малорастворимые:
— практически нерастворимые:
3) Задание: наблюдение влияния природы растворителя на процесс растворения веществ.
Порядок выполнения:
В 2 пробирки с медным купоросом прилейте в 5 мл спирта (№1) и 5 мл воды (№2),
закройте пробкой и хорошо встряхните для лучшего растворения вещества.
Какой из предложенных растворителей хорошо растворяет медный купорос?
Сделайте вывод о влиянии природы растворителя на процесс растворения и
способности веществ растворяться в разных растворителях.
Виды растворов:
Насыщенный раствор – это раствор, в котором приданной температуре вещество больше не растворяется.
Ненасыщенный – это раствор, в котором при данной температуре вещество может еще растворяться.
Пересыщенный – это раствор, в котором вещество может еще растворяться только при повышении температуры.
Как-то утром я проспал.
В школу быстро собирался:
Чай холодный наливал,
Сахар всыпал, помешал,
Но не сладким он остался.
Я ещё досыпал ложку,
Стал послаще он немножко.
Чай допил я до остатка,
А в остатке стало сладко,
Сахар ждал меня на дне!
Стал прикидывать в уме –
Отчего судьбы немилость?
Виновата – растворимость.
Выделите виды растворов в стихотворении. Что необходимо сделать, чтобы сахар полностью растворился в чае.
Физико — химическая теория растворов.
Растворенное вещество при растворении с водой образует гидраты.
Гидраты-это непрочные соединения веществ с водой, существующие в растворе.
При растворении происходит поглощение или выделение теплоты.
При повышении температуры растворимость веществ увеличивается.
Состав гидратов непостоянен в растворах и постоянен в кристаллогидратах.
Кристаллогидраты – соли, в состав которых входит вода.
Медный купорос CuSO4∙5h3O
Сода Na2CO3∙ 10h3O
Гипс CaSO4∙2h3O
Задачи:
Растворимость хлорида калия в воде при 60 0С равна 50г. Определите массовую долю соли в растворе, насыщенном при указанной температуре.
Определите растворимость сульфата калия при 80 0С. Определите массовую долю соли в растворе, насыщенном при указанной температуре.
161 г глауберовой соли растворили в 180 л воды. Определите массовую долю соли в полученном растворе.
Домашнее задание. Параграф 35
Сообщения.
— удивительные свойства воды;
— вода – самое ценное соединение;
— использование воды в промышленности;
— искусственное получение пресной воды;
-борьба за чистоту воды.
Презентация «Кристаллогидраты», «Растворы — свойства, применение».
xn--j1ahfl.xn--p1ai
Реакция растворения медного купороса в воде. Безводный сульфат меди
Синие кристаллы сульфата меди при нагревании становятся белыми
Сложность:
Опасность:
Сделайте этот эксперимент дома
Реагенты
Безопасность
- Перед началом опыта наденьте защитные перчатки и очки.
- Проводите эксперимент на подносе.
- При проведении опыта держите поблизости ёмкость с водой.
- Поместите горелку на пробковую подставку. Не прикасайтесь к горелке сразу после завершения опыта − подождите, пока она остынет.
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 12 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 12 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Часто задаваемые вопросы
Синие кристаллы не белеют. Что делать?
Прошло 10 − 15 минут, но кристаллы сульфата меди CuSO 4 не белеют? Похоже, что-то не так с нагреванием формочки. Проверьте, горит ли свеча. Не забудьте, что формочка должна стоять по центру пламярассекателя, а свеча – по центру горелки.
Не перепачкайтесь!
Будьте внимательны: пламя свечи достаточно сильно коптит дно формочки. Оно быстро становится чёрным, и об него легко испачкаться.
Не заливайте водой!
Не заливайте алюминиевую формочку с сульфатом меди водой! Это может привести к протеканию бурных процессов: алюминий будет восстанавливаться, выделяя газ водород. Подробнее об этой реакции вы можете узнать в научном описании эксперимента (раздел «Что произошло»).
Другие эксперименты
Пошаговая инструкция
- Поместите три свечи в горелку для сухого горючего и зажгите их. Накройте горелку пламярассекателем, а сверху — фольгой.
- Поставьте на фольгу алюминиевую формочку. Высыпьте в нее одну большую ложку кристаллогидрата сульфата меди CuSO 4 ·5H 2 O.
- Следите за изменением цвета кристаллов: через 5 минут синие кристаллы станут голубыми, а еще через 10 — белыми.
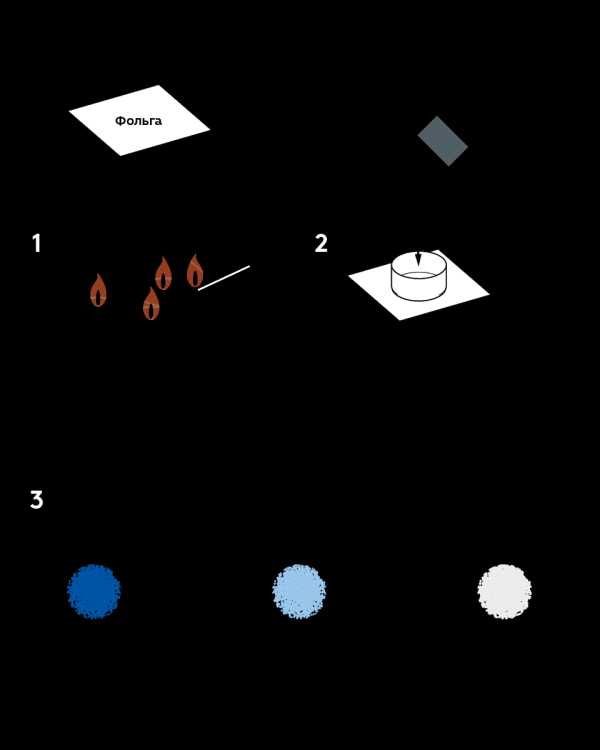
Ожидаемый результат
При нагревании вода, входящая в состав гидрата сульфата меди, покидает кристаллы и испаряется. В результате получается безводный сульфат меди белого цвета.
Утилизация
Утилизируйте твёрдые отходы эксперимента вместе с бытовым мусоро
cityshin.ru
8.3. Особенности растворения в воде различных веществ
В современную эпоху вся вода на Земле образует водную оболочку — гидросферу. Значение воды как мощного фактора, преобразующего планету, изучено достаточно хорошо. Действие воды на поверхности и в глубинах Земли связано с ее свойствами. Вода может находиться в трех агрегатных состояниях и способна растворять в себе многие вещества.
Природная вода содержит различные вещества разных концентраций. Так, самая чистая дождевая вода содержит растворенных веществ в количестве около 50 мг/л. Масса воды на Земле составляет всего около 0,025 % общей массы Земли. Она содержится в атмосфере в виде паров, составляет океаны, моря и континентальные воды, образует подземные воды в толщах осадочных пород. Большая часть воды сосредоточена в Мировом океане (до 86,5 %). Средняя глубина океана 3,8 км, общая масса воды в нем 1420 • 1018 кг. Океаническая вода содержит примерно 3,5 % растворенных веществ. Количество растворенного вещества в граммах, содержащегося в 1 кг морской воды, получило название солености океана.
Среди растворенных веществ (расположены по степени убывания количества вещества) есть катионы:, анионы:
, соляная и серная кислоты. Другие элементы, содержащиеся в небольшом количестве, играют важную роль в химических процессах океана и в жизни морских организмов, например азот, фосфор, кремний, которые усваиваются морскими растениями и животными. В морской воде растворены также кислород, азот, сероводород, углекислота, которые тесно связаны с атмосферой и живыми объектами моря. Среди них первое место по концентрации занимает углекислота, которая присутствует в разных формах, образуя карбонатную систему динамического равновесия. В Мировом океане ее в 60 раз больше, чем в атмосфере. С карбонатной системой связаны ионы кальция и весь комплекс растворенных веществ. Верхней границей гидросферы является поверхность открытых водоемов, а нижняя находится в глубинах Земли, в слоях с температурой порядка 374 °С.
Воду еще с древних времен рассматривали как основу жизни. У Аристотеля она входила в число четырех неуничтожимых элементов, или «начал», и ее соединение с другими «началами» —
291
землей, огнем и воздухом — порождало все многообразие мира. Г. Ка-вендиш и А. Лавуазье открыли свойства воды (1783). Кавендиш, исследуя свойства кислорода (недавно открытого), смешивал в лаборатории одну часть этого «воздуха» с двумя частями «горючего воздуха» (водорода) и пропускал через эту смесь электрический ток. Смесь вспыхивала, а на стенках колбы появлялись капельки жидкости — обычной воды. Лавуазье провел серию таких опытов, показавших, что вода не является элементом. Через пару лет ему удалось установить, что вода образуется из одной весовой части водорода и 6,5 частей кислорода (позже Гей-Люссак и Гумбольдт уточнили соотношение — 1:8). Так узнали, что вода — это Н20, и вслед за Лавуазье стали называть «горючий воздух» водородом. К XIX в. свойство воды быть элементом трансформировалось в свойство быть растворителем и важнейшим компонентом объектов живой и неживой природы. Изучение молекулярной структуры веществ привело к пониманию исключительной способности молекул воды образовывать связи с частицами почти всех веществ. Вода — это простейшее соединение водорода с кислородом, по массе вода состоит из 11,19 % водорода и 8,81 % кислорода. Вследствие существования трех изотопов водорода и шести изотопов кислорода существует 36 изотопных разновидностей воды.
Физические свойства воды совершенно аномальны. Самое удивительное из них — это способность ее при нормальных условиях быть жидкостью. Молекулы похожих на нее химических соединений (H2S или H2Se) намного тяжелее воды, но при этих условиях газообразны. Свойства гидридов (водородных соединений элементов), расположенных в тех же вертикальных столбцах таблицы Менделеева, должны меняться монотонно с ростом атомной массы. В шестой группе помимо кислорода находятся сера, селен, теллур, полоний, атомные массы кото растут: 32, 78, 127, 209 соответственно. При переходе от тяже элементов к легким свойства растут монотонно лишь для первых четырех. Так, температуры кипения и плавления снижаются линейно, т.е. область жидкой фазы гидридов становится все более холодной. И если бы для воды эта зависимость сохранилась, она была бы жидкой лишь в диапазоне от -80 до -95 °С, а при более высоких температурах была бы газом. Конечно, это свойство, как и другие, очень важно для всей биосферы. Кроме того, совершенно аномален сам диапазон существования воды в жидкой фазе — 100 °С.
Тройная точка воды, т.е. равновесие воды, льда и пара, наблюдается при температуре 0,01 °С и давлении 611 Па (рис. 8.1). Переохлажденная вода, т. е. остающаяся в жидком состоянии ниже 0°С, ведет себя странно: с одной стороны, плотность ее уменьшается при понижении температуры, с другой — приближается к
292
плотности льда. Переохлажденную воду получают в тонких капиллярах или в масляной эмульсии. Необычайно велики пределы допустимых значений переохлаждения и перегрева воды: можно продержать ее в жидком состоянии при температуре от -40 до +200 °С.
В отличие от большинства других жидкостей при повышении температуры ее удельный объем уменьшается, а плотность увеличивается, достигая минимума (соответственно максимума) при 4 °С. В обычных жидкостях плотность всегда уменьшается с уменьшением температуры. Получается, что с ростом температуры растет средняя тепловая скорость молекул воды, они сильнее расталкивают друг друга, но в воде при этом плотность растет, а не уменьшается. При замерзании объем воды увеличивается до 10 %. Плотность воды больше плотности льда. При плавлении кристаллов, когда регулярность упаковки ионов нарушается, плотность уменьшается на 2—4 %. Это свойство воды предохраняет водоемы от сплошного промерзания, спасая в них жизнь. Лед — плохой проводник теплоты.
Очень высока теплоемкость воды — при плавлении льда она увеличивается более чем вдвое. Поэтому моря и океаны являются гигантскими термостатами, сглаживая все колебания температуры воздуха. Кстати, эти же функции может выполнять и водяной пар в атмосфере. Отсутствие водяного пара в пустынях приводит к резким колебаниям ночной и дневной температур. В отличие от обычных жидкостей с ростом температуры в интервале от 0 до 150 °С теплопроводность воды растет, а вязкость уменьшается. При плавлении льда теплоемкость испытывает скачок от 37,8 до 75,6 Дж/(моль • К), т.е. в 2 раза. Значит, нужно больше затратить теплоты для поднятия температуры воды на 1 К. Этот скачок теплоемкости после плавления означает, что в воде появились очень энергоемкие процессы, на которые нужно истратить подводимую теплоту. И эти процессы сохраняются, пока вода находится в жидком состоянии. У переохлажденной воды эта аномалия теплоемкости еще больше.
Электропроводность воды зависит от примесей, но даже в очищенной воде она не нулевая. Это связано с частичной диссоциацией ее на ионы. Диэлектрическая постоянная водытакже аномальна — достигает 81 (у других жидкостей — менее 10). В переменных электрических полях она начинает зависеть не только от частоты приложенного поля, сильно уменьшаясь для высо-
293
кочастотных полей, но и от пространственных колебаний полей. Аномальна вода и в отношении распространения в ней звука. Под действием жесткого излучения вода распадается на свободные радикалы, при этом образуются водород и перекись
водорода. Обычно с ростом температуры растет сжимаемость жидкостей (степень уменьшения объема с ростом давления), но так вода себя ведет только при высоких температурах. При низких температурах вода ведет себя совсем иначе — при температуре 45 °С сжимаемость имеет минимум. Такие явления обычно свидетельствуют о наличии противоположных процессов — обычного и аномального.
Аномальность свойств воды связана со строением ее молекул и структуры в разных агрегатных состояниях. Сравнение с родственными воде жидкостями — гидридами шестой группы — показывает, что вода выпадает из плавной зависимости температур кипения и плавления этих жидкостей. Если бы она была обычной жидкостью, то кипела бы при -76 °С, а замерзала бы при -100 °С.
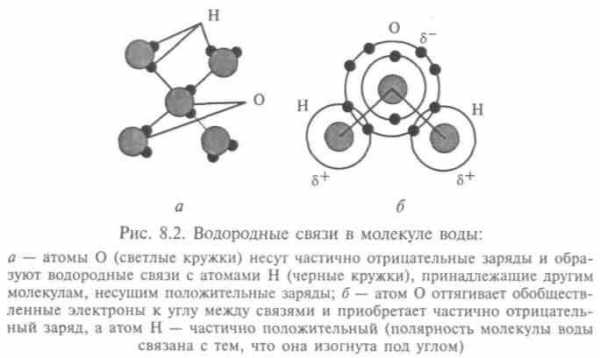
294
Главное отличие воды — в водородных связях (рис. 8.2), обусловленных квантово-механическими особенностями взаимодействия протона с атомами — способностью его к туннелированию. Хорошая модель молекулы воды — правильный тетраэдр. Ядра в молекуле Н2O образуют равнобедренный треугольник с двумя протонами в основании и кислородом в вершине. Угол НОН равен 105°, расстояние О—Н равно 0,957 • 10-8 м, а Н—Н только 1,54 • 10-8 м. Эту конструкцию окружает электронное облако, причем во льду каждая молекула связана четырьмя водородными связями с ближайшими молекулами. В этом состоянии расстояние между
295
алом для построения разветвленной сети водородных связей. Такая структура наиболее совершенна во льду.
Комплекс молекул воды (Н20)2(димера) существует в водяном пару (в свободном виде), в жидкой воде и во льду. Но, как установил Л. Полинг, лед не является кристаллом с полной упорядоченностью даже при О К. Структура льда достаточно рыхлая: каждая полость окружена шестью молекулами Н20, а каждая молекула — шестью полостями. Размер этих полостей таков, что в них может разместиться одна молекула, не нарушая каркаса водородных связей. Еще в начале XX в. У. Брэгг методом рентгено-структурного анализа показал, что во льду каждая молекула окружена четырьмя другими молекулами, но расположение атомов водорода этим методом не устанавливалось. Это удалось уловить лишь спектроскопическими исследованиями его ученику Берналу. Оказалось, что каждый атом кислорода связан с четырьмя атомами водорода, которые находятся на линии О—О, при этом со «своими» атомами — прочной ковалентной связью, а с «чужими» — водородной, но ни один из них не фиксирован на месте. Он «знает» только свою связь О—О, но может на этой линии занимать два положения (около «своего» и «чужого») и примерно одинаковое время. Расстояние между каждой парой О—О сохраняется неизменным и равным 2,76 • 10-10 м. Поэтому в присутствии внешнего электрического поля «перескоки» атомов водорода становятся более направленными и лед обладает высокой электропроводностью.
Структуру белков нельзя постичь, если не изучить структуру воды — среды, где они образуются. Поскольку в отсутствие молекулярной структуры плотность жидкой воды должна быть порядка 1,8 г/см3, а она равна 1 г/см3, то должна быть в ней структура, мешающая плотной упаковке. Впоследствии установили, что каждую молекулу воды в жидком состоянии окружают не 6, а 4,4 молекулы (так называемое координационное число, у льда оно равно 4). Значит, при таянии число соседей средней молекулы возрастает всего на 0,4. Концентрация дефектов структуры во льду относительно невелика (1/2,5 млн молекул), а в воде она возрастает в 25 тысяч раз (1/200 молекул). Попытка описывать воду как лед с большим числом дефектов оказалась несостоятельной.
Направленность водородных связей проявляется в необычности воды, образующейся при плавлении льда. Оказалось, они рвутся сразу, а не постепенно, как у других кристаллов, когда молекулы накапливают энергию, переходя из одной энергетической ямы в другую. Во льду лишь отдельные молекулы вырываются из структуры, сразу оказываясь без водородных связей на другом энергетическом уровне. Хотя между уровнями происходит обмен, по мере роста температуры все меньше молекул возвращается назад. По данным Л.Полинга, при 0°С лишь 15% водородных связей оказываются разорванными, т. е. в жидкой воде сохраняется гек-
296
сагональная структура. Даже в газообразном состоянии водородные связи сохраняются, исчезая лишь при температуре 600 °С. Заполнение пустот молекулярной конструкции льда при плавлении, как показал в 60-е гг. О. Самойлов, ведет к увеличению плотности. При нагревании пустоты заполняются больше и плотность растет. Но при нагревании идет еще и термическое расширение воды. В интервале температур от 0 до 4 °С преобладает процесс заполнения пустот, при более высоких температурах начинается расширение и плотность падает. Этим объясняются способность воды к переохлаждению и перегреву, высокая теплоемкость и др.
Водородные связи в биосистемах ведут к необычным электростатическим явлениям — в соседних точках флуктуации поляризации становятся коррелированными. Если период приложенного переменного электрического поля сравним с длиной водородных связей (около 3 • 10-10 м), то две соседние молекулы могут оказаться в противоположно направленных полях и диполи этих молекул будут стремиться развернуться в разные стороны. Но они связаны водородной связью, и это им может не удаться. И диэлектрическая проницаемость воды в таком поле зависит лишь от атомно-молекулярных механизмов перераспределения заряда. Эти механизмы определяют процессы возбуждения и передачи нервного импульса, слияния клеток и пр., ведь все эти процессы в живой природе происходят через водную прослойку электролитов.
Протон может находиться как около «своего» атома кислорода (на расстоянии порядка 10-10 м), так и вблизи «чужого» (на расстоянии от «своего» около 1,7-10-10 м), т.е. наряду с обычным димером НО — Н…ОН2 оказывается нестабильной ионная пара НО… Н — ОН2. В этом случае возрастает дипольный момент молекулы до 8 • 10—29 Кл • м. Последнее состояние имеет место для границы раздела фаз, возможно, в этом состоянии находится вода вокруг клеточных мембран живых организмов. Можно сказать, что вода «помнит» свое происхождение, тогда как другие жидкости не обладают этой способностью.
Химические свойства воды связаны с полярностью молекулы и строением ее электронной оболочки. Вода легко вступает в химические соединения, образуя гидроокиси. Щелочные и щелочноземельные металлы разлагают воду при обычной температуре — образуются водород и гидроокись. При повышенной температуре со всеми металлами происходит такая же реакция. Взаимодействие с водой ведет к коррозии металлов. В воде растворяется гораздо больше веществ, чем в любой другой жидкости. Молекулы растворяемого вещества отделяются друг от друга и смешиваются с молекулами растворителя. Из-за своей полярной природы вода растворяет ионные вещества и другие полярные соединения. А соединения, не имеющие заряда, в воде не растворяются,
297
между ними образуется поверхность раздела. Это обстоятельство очень важно для процессов внутри живых структур. Распадение вещества на ионы при растворении называется диссоциацией.
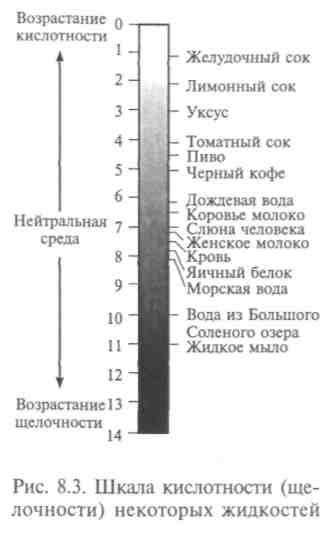
Вещество является кислотой, если оно диссоциирует в воде с образованием ионов водорода, и основанием, если способно в растворе присоединять ионы водорода или образовывать гидро-ксилионы ОН. Если в растворе не образуется ни то, ни другое, вещество называют солью. Кислотность или щелочность раствора характеризуется показателем рН, шкала которого охватывает значения от 0 до 14. Эта шкала логарифмическая, т.е. на ней отложены логарифмы концентрации водородных ионов. Кислотность раствора с рН5 в 10 раз больше, чем с рН6, и в 100 раз больше, чем с рН7. Раствор с рН6 содержит одну миллионную моля ионов водорода на 1 л, нейтральной среде соответствует рН7, ниже идут более кислые среды, а выше — щелочные.
Уникальные свойства воды в живой материи связаны и с малыми размерами ее молекул, их полярностью (неравномерным распределением зарядов в молекуле — дипольностью воды) и способностью соединяться друг с другом водородными связями. Водородные связи слабее, чем ионные, но оказываются важными при свойствах воды как превосходного растворителя, особенно для полярных молекул. К таким веществам относятся ионные соединения, например соли, у которых заряженные частицы (ионы) диссоциируют в воде при растворении, или неионные соединения — сахара и простые спирты, в молекулах которых есть заряженные группы (типа ОН-группы).
Когда вещество переходит в раствор, его молекулы или ионы могут более свободно двигаться, и реакционная способность возрастает. Большая часть реакций в клетке идет в водном растворе. Такие гидрофильные свойства полярных молекул важны в обеспечении стабильности мембран, белковых молекул, нуклеиновых кислот и других субклеточных структур. Неполярные вещества, такие как липиды, с водой не смешиваются и разделяют водные растворы на отдельные компоненты, как их разделяют мембраны. Поэтому неполярные части молекул водой отталкиваются и в присутствии воды притягиваются друг к другу, или обладают гидрофобным эффектом, например, сливание капелек масла в большую каплю и нерастворение ее в воде. Свойство воды — растворителя важно для транспортировки по организму разных веществ (это происходит в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений).
Долгое время воду считали пассивной средой, обеспечивающей протекание важных биохимических процессов и реакций. В начале 60-х гг. Л. Полинг опубликовал свои исследования влияния анестетиков на прохождение сигналов болевой чувствительности. Анестетики — вещества, нарушающие прохождение этих сиг-
298
налов у высших животных: четыреххлористый углерод, закись азота («веселящий» газ), сероуглерод и даже инертные газы. Оказалось, что парциальное давление паров анестетика, соответствующее этому порогу, пропорционально давлению кристаллизации гидрата этого анестетика при нуле градусов. Значит, образование гидратов связано с основами жизнедеятельности, в данном случае с включением сигнала боли. Рентгеноструктур-ный анализ гидратов анестетиков показал, что их молекулы находятся в пустотах каркаса, построенного из молекул воды. Следовательно, они представляют собой механические «включения», а не соединения при помощи химических связей. Их назвали клатратами, или клеточными соединениями.
В 70-е гг. появились работы, выполненные под руководством академика А. Николаева, в которых сообщалось об обнаружении клатратов в жидком состоянии и исследовании фазовых переходов в них вблизи критической точки. Академиком Э. Галимовым была обнаружена универсальная закономерность, выполняющаяся на любом уровне организации биосистем. Процессы вблизи критической точки могут идти обратимым образом, а микроскопический механизм этой обратимости связан с замедлением диффузии вблизи критического состояния. Оказалось, что в этой области процессы происходят по нелинейным законам и критические флуктуации концентраций веществ являются самоподдерживающимися, включающими способность к самокопированию. Дальнейший анализ происходящих в воде процессов может найти практическое применение во многих областях — от медицины и наркологии до самовоспроизводящихся химических машин и автоматов футурологии.
studfiles.net
Процесс растворения в воде твердых веществ
Познакомимся сначала с процессом растворения в воде твердых веществ, для чего обратимся опять к нашему стакану воды и посмотрим, что будет происходить, если мы всыплем в него ложку поваренной соли.
Находящиеся в непрерывном движении молекулы воды при столкновении с кристалликами соли будут как бы срывать с их поверхности отдельные молекулы соли, которые, попав в воду, начнут беспорядочное движение, подобно молекулам воды.
При этом, однако, они будут стремиться распределиться равномерно во всем объеме воды. Это свойство веществ называется диффузией, и, поскольку оно тесно связано с процессом растворения, необходимо остановиться на нем несколько подробнее.
Диффузией называют свойство вещества распространяться в какой-либо среде, т. е. стремление его проникнуть оттуда, где оно есть, туда, где его нет, причем этот процесс происходит исключительно за счет теплового беспорядочного движения молекул среды.
Представим себе, что непосредственно около дна стакана образовался некий слой воды, содержащий молекулы хлористого натрия.
Обозначим их условно точками, как это изображено на рис. 9, при этом этих молекул будет, естественно, особенно много непосредственно около поверхности кристаллов соли, далее, по мере удаления вверх, их число должно быть меньше.
Как же себя будут вести эти молекулы соли? Ведь, как мы уже знаем, их движение, обусловленное беспорядочным движением молекул воды, будет таким же беспорядочным и, следовательно, они будут продвигаться в воде в самых различных направлениях — иногда вниз, иногда вверх, а иногда в сторону или наискось.
Однако, как это ни может показаться на первый взгляд странным, несмотря на совершенно беспорядочное движение молекул соли, будет происходить постепенное закономерное движение их вверх из мест с более высокой их концентрацией в места с более низкой концентрацией, пока, наконец, молекулы соли не распространятся равномерно во всем объеме находящейся в стакане воды.
Для объяснения причины этого как будто неожиданного процесса, носящего название диффузии, рассмотрим, что будет происходить с молекулами соли на границе условно взятого в стакане сечения а-а (рис. 9).
Рис. 9. Диффузия молекул соли в воде.
Процесс диффузии не связан с какой-либо силой, которая якобы заставляет молекулы соли передвигаться вверх, т. е. в область с меньшей их концентрацией в воде.
Каждая молекула соли ведет себя независимо от других молекул соли, с которыми она встречается очень редко.
Каждая молекула соли, где бы она ни находилась -ниже сечения а-а или выше его, испытывает непрерывные толчки со стороны молекул воды, в результате которых она может продвигаться вниз от этого сечения или вверх от него.
Но тут вступает в силу теория вероятностей и ее основной закон больших чисел, широко применяемый в настоящее время естественными науками (и в первую очередь физикой и химией) при изучении свойств тел, состоящих из огромного числа отдельных частиц (молекул, атомов, ионов и др.).
Точность статистического закона больших чисел повышается по мере увеличения количества участвующих в данном явлении частиц и, наоборот, снижается с их уменьшением, вплоть до того, что при некотором их числе этот закон становится неприменимым и мы переходим в область чистой случайности.
Для пояснения этого положения можно прибегнуть к простому общедоступному опыту. Возьмем два одинаковых по размеру, но разных по окраске шарика: белый и черный.
Положим их в какую-нибудь урну или просто в шапку и будем последовательно вынимать один из этих шариков, каждый раз возвращая обратно вынутый шарик.
Поскольку шарики одинакового размера, по-видимому, имеется одинаковая возможность для каждого из них быть вынутым из урны. Но эта одинаковая возможность будет выявляться все в большей степени по мере увеличения числа опытов.
Если мы проведем два-три или даже пять опытов, то возможно, что 2-3 или даже 5 раз будет вынут только белый или только черный шарик.
Но для ста опытов такая вероятность становится невозможной, количество вынутых белых и черных шариков будет приближаться к пятидесяти.
При этом закон вероятности утверждает, что неточность, с какой мы можем определить среднее число случаев, в которых наступает данное явление, равно корню квадратному из количества этих случаев.
Вернемся теперь к нашему стакану с водой и растворенными в ней молекулами соли. Согласно теории вероятности возможности продвижения молекул соли вниз или вверх от сечения а-а будут одинаковы в силу того, что каждую молекулу соли окружает огромное количество молекул воды, от которых она испытывает колоссальное число толчков как вверх, так и вниз.
Но если все молекулы соли, находящиеся в стакане воды около сечения а-а, будут с одинаковой вероятностью перемещаться как вверх, так и вниз от этого сечения, то именно поэтому молекулы соли чаще будут пересекать сечение а-а снизу вверх, чем сверху вниз, поскольку ниже этого сечения концентрация молекул соли больше, чем над ним.
Такое преимущественное перемещение вверх молекул соли будет происходить до тех пор, пока не наступит равномерное распределение их во всем объеме воды.
Одновременно с процессом растворения соли происходит обратный процесс ее кристаллизации, так как в результате беспорядочного движения молекул соли некоторые из них, находящиеся вблизи поверхности кристаллов соли, при столкновении с нею могут задержаться на ней, восстанавливая, таким образом, частично разрушенный в результате процесса растворения кристалл.
Очевидно, что такая возможность обратного процесса будет возрастать по мере возрастания концентрации раствора.
Но по мере того как мы будем всыпать в наш стакан еще порции поваренной соли, наступит момент, когда растворение ее как бы прекратится, т. е. когда скорость обоих процессов (растворения и кристаллизации) выравняется, при этом в единицу времени будет столько же молекул переходить в раствор, сколько их выделится на кристаллах соли. Растворы, имеющие такую предельную концентрацию растворенного вещества, называют насыщенными растворами.
При достижении такого состояния в нашем стакане наступит так называемое динамическое равновесие между твердой солью и ее насыщенным раствором в воде, в результате которого нам будет казаться, что процесс растворения прекратился.
Чтобы убедиться в том, что в насыщенных водных растворах не прекращаются процессы растворения твердого вещества в воде и обратного его выделения из воды, достаточно провести следующий опыт.
После получения в нашем стакане насыщенного раствора хлористого натрия добавим в него некоторое количество кристаллов этой соли, содержащих радиоактивный натрий.
Тогда уже через несколько минут мы обнаружим с помощью специального счетчика (Гейгера-Мюллера), что в растворе появились радиоактивные атомы натрия, причем количество их будет постепенно нарастать, достигнув через несколько десятков минут наибольшего значения.
Этот опыт убедительно показывает, что в насыщенном растворе все время идет обновление кристаллов, т. е. переход молекул хлористого натрия с поверхности кристалла в насыщенный раствор и переход на их место молекул соли из раствора.
Процесс диффузии в растворах протекает относительно медленно, вследствие чего слой воды, непосредственно прилегающий к кристаллам соли, быстро становится насыщенным, после чего дальнейшее растворение происходит только по мере того, как из этого слоя диффундируют вверх растворенные молекулы соли.
Таким образом, процесс растворения соли быстро спадает и протекает так же медленно, как и диффузия растворенных молекул соли.
Поэтому для ускорения растворения прибегают к искусственному ускорению диффузии путем перемешивания раствора.
Растворение газов в воде происходит в основном аналогично растворению твердого тела, с тем лишь отличием, что проникновение в воду молекул твердого тела происходит путем отрыва их молекулами воды от кристаллов соли, находящихся в воде, а попадание в воду молекул газообразного вещества осуществляется в результате их беспорядочного движения над поверхностью воды, в результате чего некоторые из них попадают непосредственно на поверхность воды и, подвергаясь действию притягательных сил молекул воды, втягиваются внутрь.
Это втягивание молекул газа внутрь воды и является одним из существенных моментов процесса растворения газов в воде.
Дальнейшая судьба попавших в глубь воды молекул газа аналогична поведению растворенный молекул соли, которые, испытывая различные столкновения с окружающими их молекулами воды, совершают также беспорядочные движения.
Некоторые молекулы газа в результате этого движения между молекулами воды могут вновь очутиться на ее поверхности.
При благоприятном толчке этой молекулы по направлению к поверхности воды она может даже улететь из воды, или, очутившись на поверхности воды, эта молекула газа может освободиться в результате удачного толчка, который она получит от какой-либо подлетевшей другой молекулы газа, в противном случае эта молекула газа вновь будет втянута в глубь воды.
Таким образом, если мы имеем воду и находящийся над ней какой-либо газ, например кислород, то будут происходить одновременно два противоположных процесса: проникновение молекул кислорода в воду, т. е. его растворение в воде, и обратный процесс — вылетание молекул кислорода из воды.
По мере того как количество растворенных в воде молекул кислорода будет возрастать, будет соответственно увеличиваться возможность для некоторых из них вырваться из воды.
Наконец наступит момент, когда количество попадающих в воду молекул кислорода станет равным числу уходящих из воды молекул кислорода.
Следовательно, наступит аналогично системе кристаллы соли — насыщенный раствор так называемое динамическое равновесие, при котором процесс растворения кислорода в воде хотя и будет продолжаться, но количество молекул газа в воде будет неизменным.
Однако имеется и существенное отличие между системой кристаллы соли — насыщенный раствор ее в воде и системой газ — раствор газа в воде.
Дело в том, что максимальное количество молекул газа в нашем случае — кислорода, которое может быть растворено в воде, будет тем больше, чем больше этих молекул будет находиться над поверхностью воды и, следовательно, чем больше будет создаваться благоприятных столкновений молекул газа с водой и проникновение их в глубь ее.
В самом деле, вернемся к нашей системе кислород — раствор кислорода в воде, когда в ней наступило динамическое равновесие.
Что произойдет, если мы каким-либо путем увеличим количество находящегося над раствором кислорода, т. е. если мы увеличим количество молекул кислорода в единице объема пространства, находящегося над раствором?
Тогда количество молекул кислорода, попадающих в раствор, увеличится, в то время как количество молекул, вылетающих из него, остается пока еще тем же.
Следовательно, динамическое равновесие нарушится и начнется дальнейшее растворение молекул кислорода, пока в результате увеличения их в воде не наступит новое динамическое равновесие, которое будет отличаться от первого тем, что количество растворенных в воде молекул кислорода увеличится.
Итак, мы установили связь между количеством кислорода в единице объема над раствором и растворимостью кислорода в воде.
Но согласно молекулярно-кинетической теории давление газа, производимое им на стенки сосуда, в котором он находится, прямо пропорционально числу молекул в единице объема, т. е. чем больше молекул газа в единице объема, тем чаще эти молекулы будут ударяться о стенки сосуда, и, следовательно, тем большее давление они будут испытывать.
Отсюда можно сказать, что растворимость газа прямо пропорциональна его давлению. Эта связь между давлением газа и его растворимостью называется законом Генри-Дальтона.
Практически в большинстве случаев мы будем иметь дело не с одним каким-либо газом, а со смесью нескольких газов, и прежде всего с воздухом, представляющим собой смесь азота, кислорода, углекислого газа и др.
Как в этих условиях будет происходить растворение их в воде?
Совершенно очевидно, что вероятность проникновения молекул кислорода в воду будет, как и прежде, тем больше, чем больше этих молекул будет в единице объема пространства над водой, независимо от количества молекул других газов, т. е. опять будет действовать тот же закон Генри-Дальтона.
Но давление смеси газов слагается из давлений отдельных газов, определяемых соответственно числом молекул каждого газа.
При этом доля общего давления такой смеси газов, приходящаяся на отдельный газ, называется его парциальным давлением.
Следовательно, обобщая закон Генри — Дальтона и для смеси газов, можно сказать, что растворимость газов пропорциональна их парциальному давлению.
Познакомимся коротко с вопросом о влиянии на растворимость температуры. Для водных растворов твердых веществ в подавляющем большинстве случаев при повышении температуры растворимость более или менее увеличивается (вещества с положительным коэффициентом растворимости).
Однако некоторые вещества имеют отрицательный коэффициент растворимости, т. е. их растворимость в воде с повышением температуры понижается.
К таким веществам, в частности, относятся: гидрат окиси кальция Са(ОН)2 и сернокислый кальций CaSО4 *.
* Начиная с температуры 40° С и выше.
При повышении температуры в системе газ и его раствор в воде будет происходить, как мы уже знаем, увеличение интенсивности движения молекул, т. е. повышение числа быстрых молекул, что в свою очередь будет иметь два следствия.
С одной стороны это будет способствовать увеличению числа молекул газа, проникающих в воду, в то же время будет расти число молекул, могущих вырваться из воды.
В конечном итоге это приведет к понижению растворимости газа. Над водой всегда находится смесь газов, в том числе и некоторое количество паров воды.
При нагревании воды количество паров воды над ней начинает возрастать, за счет чего уменьшается количество остальных газов, а следовательно, уменьшается и их парциальное давление, вследствие чего растворимость остальных газов в воде заметно уменьшается, и тем больше, чем ближе температура воды к точке ее кипения.
При кипении над водой будет, по существу, находиться только один газ — пары воды, и, следовательно, парциальное давление других газов будет близким к нулю. Поэтому при кипении воды все растворенные в ней газы практически полностью удаляются.
Количество растворенного вещества, находящегося в единице объема или веса растворителя, называют концентрацией растворов.
Концентрацию водных растворов выражают обычно количеством граммов растворенного вещества в 1 л воды и обозначают сокращенно г/л, или в 1 м3 воды — г/м3, а для малорастворимых веществ — в миллиграммах растворенного вещества, т. е. мг/л.
Выражают также концентрацию растворов в процентах, чаще в весовых процентах, т. е, указывают, сколько весовых частей безводного вещества растворяется в 100 весовых частях растворителя или сколько весовых частей безводного вещества растворено в 100 весовых частях раствора.
В химии воды имеет распространение удобная мера концентрации веществ, выражаемая количеством граммов или миллиграммов вещества в 1 л раствора, численно равная его эквивалентному весу и сокращенно обозначаемая соответственно г-экв/л или мг-экв/л.
Эта мера концентрации удобна тем, что химические элементы соединяются между собой в эквивалентных количествах.
Растворимостью данного вещества в воде называют предельное количество этого вещества, которое может быть растворено в воде при данных условиях, т. е. когда этот раствор становится насыщенным.
Поэтому растворимость всякого вещества определяется величиной концентрации его насыщенного раствора.
www.comodity.ru
Процесс растворения, его физико-химический смысл. Понятие о кристаллогидраты
Рассмотрим процесс растворения веществ.
Например, если мы добавляем в чай сахар, то можем наблюдать, как количество твердого вещества постепенно уменьшается. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро. Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют связи с молекулами воды. При этом с одной молекулой сахара связывается несколько молекул воды.
Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя. Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря диффузии.
Если раствор нагреть или перемешивать, то диффузия происходит интенсивнее и растворение сахара проходит быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Вещества при растворении не меняются, после выпаривания растворов мы можем получить растворенное вещество в твердом состоянии. При растворении разрушается кристаллическая решетка растворенного вещества и ее частицы перемещаются в растворе, следовательно, растворение — это физический процесс. Для осуществления такого процесса необходимо затратить энергию.
Но когда молекулы растворенного вещества связываются с молекулами воды, то фактически образуются новые химические соединения. Эти молекулярные ассоциаты не имеют постоянного состава. Их общее название — гидраты. Процесс связывания веществ с водой называется гидратацией.
При выпаривании растворов происходит разрушение гидратов и образования кристаллического вещества. Однако некоторые вещества способны образовывать устойчивые гидраты, которые могут содержать воду даже в кристаллическом состоянии. Такие вещества называются кристаллогидратов. Их можно выделить из раствора, осторожно выпаривая воду. В формулах таких веществ кристаллизационная вода указывается после формулы соединения со знаком умножения.
Например: CuSO4 · 5h3O — медный купорос, FeSO4 · 7h3O — железный купорос. Образование гидратов, т.е. новых веществ, свидетельствует, что растворение — химический процесс.
Разобраться в сущности процесса растворения помогает изучение тепловых явлений, происходящих при этом. Известно, что одним из признаков химических реакций является выделение теплоты, а для физических явлений необходимо тратить энергию.
Растворения серной кислоты сопровождается сильным разогревом раствора. Это результат химического взаимодействия между молекулами воды и растворенного вещества — гидратация сопровождается выделением энергии.
А растворения нитрата аммония сопровождается охлаждением раствора. В этом случае на физический процесс разрушения кристаллической решетки тратится больше энергии, чем образуется при получении гидратов.
Приведенные факты говорят о том, что растворение следует считать физико-химическим процессом.
Растворение — это сложный физико-химический процесс, при котором происходит взаимодействие частиц растворителя и вещества, растворяется.
xn—-7sbfhivhrke5c.xn--p1ai
