Процесс — разложение — метан
Процесс — разложение — метан
Cтраница 1
Процесс разложения метана при высокой температуре должен быть подвергнут дополнительным тщательным исследованиям; однако и теперь уже очевидно, что химические реакции, протекающие при 1500 С и выше, совершенно не похожи на реакции, описываемые в руководствах по органической химии. [1]
Процесс разложения метана при высокой температуре должен быть подвергнут дополнительным тщательным исследованиям; однако и теперь уже очевидно, что химические реакции, протекающие при 1500 С и выше, совершенно не похож: и на реакции, описываемые в руководствах по органической химии. [2]
Установлено, что процесс разложения метана связан с постепенным обеднением промежуточных углеводородных соединений водородом. Протекание процесса разложения метана определяется температурой и продолжительностью пребывания газа в зоне высоких температур. [3]
Работы по осуществлению процесса разложения метана в аппаратах непрерывного типа проводят в СССР и за рубежом. Так, по предварительным данным, термическое разложение сухого газа может осуществляться на движущемся коксе — твердом теплоносителе. В процессе термического разложения параллельно с водородом получают на 1000 м3 водорода около 0 25 т углерода, который можно частично выводить из системы как товарный продукт. Чистота водорода будет порядка 90 — 95 объемн. [4]
Возможно здесь также проявляется активация процесса разложения метана аргоном и имеет место энергетический катализ. Поэтому возможно, что в данном случае наблюдается иного рода эффект — повышение общего давления переводит разряд в химически более эффективную форму, связанную с развитием более высоких температур. [5]
В химической промышленности медь служит катализатором процесса разложения метана и аналогичных углеводородов. Сплав Деварда разлагает воду и восстанавливает в кислой среде N0 и N02 до Nh4 — Благодаря своей коррозионной устойчивости медь применяется для защитных покрытий других металлов. [6]Все испытанные катализаторы при использовании в процессе разложения метана вначале быстро снижают активность в результате отложения на поверхности катализатора углерода, но затем их активность стабилизируется на определенном, довольно высоком уровне и сохраняется в течение долгого времени. [7]
Из рис. 12 видно, что скорость процесса разложения метана на поверхности тем выше, чем больше исходная удельная поверхность применяемого контакта, поэтому скорость процесса на муллите Земского значительно ниже, чем на муллите ТР-22, хотя природа и химический состав материала одинаковы, так же как в случае нефтяного кокса процесс идет значительно медленнее, чем на криптоле, а тем более на торфяном коксе. В то же время эти измерения показывают, что в условиях проведения опытов только величина удельной поверхности контакта не может определять величину скорости. Очевидно, в данном случае поверхность, доступная для процесса у активного глинозема, больше, чем у торфяного кокса. [9]
Наличие катализаторов ( железа, никеля) сильно ускоряет процесс разложения метана и других углеводородов. [10]
Автор нашел, что присутствие водорода весьма сильно задерживало процесс разложения метана. С механизмом реакции, предложенным Kassel eM, хорошо согласуются данные Storch40, изучавшего1 разложение метана в присутствии раскаленных угольных нитей. Storch нашел, что первичным продуктом разложения метана в этих условиях является этан. Действительно, если вести разложение метана в угольной лампочке накаливания, погруженной в жидкий азот, то получается 95 % теоретического выхода этана. [11]
Из вышеприведенных реакций видно, что для обеспечения максимальных выходов ацетилена необходимо подавить процесс разложения метана до углерода и водорода, что возможно при избыточном подводе количества энергии с последующей быстрой закалкой конечных продуктов. [12]
Изучение изменения структуры пор активного глинозема с различной степенью зауглероженности показало, что процесс разложения метана проходит главным образом в крупных порах. [13]
Относительно небольшая активность никелевого катализатора на окиси алюминия объясняется низким содержанием никеля в катализаторе ( 4 %) и быстрым его отравлением в процессе разложения метана. [14]
Установлено, что процесс разложения метана связан с постепенным обеднением промежуточных углеводородных соединений водородом. Протекание процесса разложения метана определяется температурой и продолжительностью пребывания газа в зоне высоких температур. [15]
Страницы: 1 2
www.ngpedia.ru
Термическое разложение — метан — Большая Энциклопедия Нефти и Газа, статья, страница 1
Термическое разложение — метан
Cтраница 1
Термическое разложение метана СН4 — С 2Н2, в результате чего ванна металла насыщается углеродом и водородом; при этом температура ванны падает. [1]
Термическое разложение метана про — Описание процесса и исходит при температуре 1400 — 1500 С. [2]
Термическое разложение метана не включает принципиально новых факторов по сравнению с термическим разложением других углеводородов. Однако оно имеет некоторые особенности. [3]Термическое разложение метана нередко сопровождается образованием из промежуточных продуктов его распада ( радикалов) более высокомолекулярных углеводородов, каковы этан, олефины, бутадиен, ацетилен, ароматика. [4]
Термическое разложение метана и углеводородов может быть проведено самыми различными технологическими методами. Например, углеводороды впрыскивают в расплавленное железо. Происходит распад углеводорода с образованием свободного водорода и растворением углерода в жидком металле. Выделившийся углерод выжигают из железа при продувке расплава воздухом или кислородом. При выжигании углерода тепла получается больше, чем требуется для разложения углеводорода. [5]
Термическое разложение метана может происходить в свободном объеме — гомогенно или на насадке — гетерогенно. [6]
Термическое разложение метана имеет сложный характер. [7]
Термическое разложение метана нередко сопровождается образованием из промежуточных продуктов его распада ( радикалов) более высокомолекулярных углеводородов, каковы этан, олефины, бутадиен, ацетилен, ароматика. [8]
На термическое разложение метана с образованием ацетилена некоторое влияние, помимо температуры, давления и времени нагрева, оказывает величина реакционной поверхности, а также материал стенок этой поверхности. [9]
Процесс термического разложения метана
на поверхности пористых контактов в интервале температуры 1000 — 1300 протекает в основном во внутренне-диффузионной области. [10]Реакции термического разложения метана, дающие возможность промышленной утилизации огромных количеств метана природного газа, издавна являются объектом многочисленных исследований и привлекают внимание ученых и поныне. [11]
Механизм термического разложения метана до сих пор тщательно зучается и обсуждается. Мы лкшекы возможности дать пере-ень всех работ посвященных этой сложной теме, и ограничимся оэтому изложением основных идей. [12]
Скорость термического разложения метана значительно меньше, чем скорость его окисления. [13]
Схема термического разложения метана, предложенная Уиле-ром и Вудом [9] несколько отличается от схемы Касселя и состоит в постепенной дегидрогенизации исходного продукта с промежуточным образованием радикалов СНз, СНа и СН, находящихся в равновесии соответственно с этаном, этиленом и ацетиленом. [14]
Реакция термического разложения метана занимает особое место в высокотемпературной химии углеводородов. Это связано не только с тем, что метан является простейшим углеводородом, а природный газ — основным сырьем для получения ацетилена из углеводородов. Высокотемпературный пиролиз любых алифатических углеводородов, начиная с С2, можно представить как процесс образования более мелких углеводородных фрагментов, в результате последовательных превращений которых возникает ацетилен. Специфика реакции термического разложения метана состоит в том, что она должна обязательно включать дополнительные бимолекулярные стадии, в которых ( — фрагменты, наоборот, образуют более высокомолекулярные С2 — фрагменты, являющиеся источником ацетилена. Промежуточными продуктами образования ацетилена оказываются те же соединения, что и при пиролизе высших углеводородов. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Разложение органических соединений метана — Справочник химика 21
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений — спиртов, альдегидов, кислот. Получаемый при термическом разложении метана (реакция 1) мелкодисперсный углерод (газовая сажа) используется как наполнитель при производстве резины, типографских красок. Водород используется в различных синтезах, в том числе в синтезе аммиака. При высокотемпературном крекинге метана (реакция 2) получается ацетилен, необходимая высокая температура (1400—1600 С) создается электрической дугой. Одной из важных областей применения метана является получение так называемого синтез-газа — смеси оксида углерода(П) и водорода (реакции 3 и 4), используемого в дальнейшем для получения многих органических соединений.Образование метана. Метан образуется в результате разложения органических соединений. Механизм образования метана в результате разложения органических соединений уже рассмотрен в гл. П, 2 и гл. 1П, 1. Кроме того, образование метана может [c.194]
Продуктами разложения органических соединений в диффузионных пламенах и пламенах гомогенных смесей являются водород и простейшие углеводороды. Общим простейшим углеводородом при разложении исследованных органических (соединений является метан. В пламенах кислородсодержащих соединений кроме этого образуются простейшие кислородсодержащие соединения типа СН2О, а в пламенах азотсодержащих соединений, вероятно, образуется азот, В процессе разложения некоторых соединений образуется этан, максимальное содержание которого составляет доли %. В качестве продукта разложения высокомолекулярных предельных углеводородов (парафина) обнаружен в незначительном количестве пропан. Наличие бутана в пламенах исследованных соединений не установлено. Продуктом разложения некоторых органических соединений является этилен. При горении высокомолекулярных предельных углеводородов (парафина) образуются кроме этилена другие непредельные соединения пропилен и в небольших количествах бутилен и бутадиен (дивинил). Характер распределения концентраций ацетилена в пламенах позволяет предположить, что он не является первичным продуктом разложения исходных соединений неароматического строения. [c.112]
Характеристическим летучим водородным соединением углерода является метан. В обычных условиях водород с углеродом не реагирует. Синтез метана идет только при достаточно высокой температуре и в присутствии катализатора (мелкораздробленный никель). Применяются также и другие способы получения метана из сложных органических веществ. В лаборатории метан можно получить разложением карбида алюминия водой. В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется р -гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000° С. Выше этой температуры разлагается с образованием ацетилена и водорода [c.362]
Метан всегда образуется в природе при гниении и разложении органических соединений с ограниченным доступом воздуха, например в канализационных осадках очистных городских установок (здесь он улавливается и используется для промышленных [c.224]
Метан СН4 представляет собой бесцветный, не имеющий запаха газ с т. кип. —161,4° С, т. замерз. —184° С. Он является главнейшей составной частью природных газов. Выделяется со дна болот как один из продуктов бескислородного (анаэробного) гнилостного разложения органических остатков растительного и животного происхождения, содержится в воздухе каменноугольных шахт (рудничный газ). Метан получа.ют непосредственным соединением углерода с водородом при нагревании в присутствии катализатора [c.262]
В надводной части коллекторов скапливаются вредные газы сероводород, аммиак, диоксид углерода, метан, пары бензина и др. Газы попадают в сеть через неплотности соединений труб, через колодцы, а также образуются в результате разложения органических составляющих осадков сточных вод. [c.47]
В природных условиях метан образуется высокоспециализированными анаэробными микроорганизмами-метаногенами. Субстратами для них служат уксусная кислота, метанол, метиламин, метилмеркаптан и смесь СО2 + Нз- Все эти соединения -продукты жизнедеятельности целого сообщества других анаэробных микроорганизмов-деструкторов, осуществляющих по-стадийное разложение мертвого органического вещества. В общем виде образование метана может быть представлено уравнениями [c.106]
Для очистки стоков по второму варианту (с высокой концентрацией органических веществ) применяют анаэробное разложение нх, состоящее из двух основных стадий 1) ферментативный гидролиз углеводов, белков и жиров, содержащихся в сточных водах 2) превращение образовавшихся продуктов гидролиза органических соединений в углекислый газ и метан. На второй стадии анаэробной очистки сточных вод могут образовываться минеральные соли и гумусоподобные вещества. [c.408]
По-видимому, любое органическое соединение, содержащее ацетильную группу, будет при пиролизе давать некоторое количество кетена. Хотя этот синтез применим и для высших членов ряда, но его использование ограничено в основном первым членом ряда, который лучше всего может быть получен по этому методу как в промышленности, так и в лаборатории. Из различных лабораторных способов [5] наилучший выход (90—95%) был получен при пропускании ацетона над проволокой из хромеля А при 700—750 °С. При проведении пиролиза в камере предпочтительными являются более низкие температуры (около 500 С) для предотвращения дальнейшего разложения на окись углерода и газообразные олефины. Кетен, получаемый из ацетона, смешан с метаном, что может осложнять его абсорбцию. С другой стороны, при пиролизе уксусного ангидрида [6] или дикетена (разд. А.4) подобные газообразные продукты не образуются. [c.376]
Для каждой из этих зон характерны определенные процессы превращения органического вещества, сопровождающиеся образованием различных углеводородов. Самая верхняя зона — биохимическая. В этой зоне под воздействием микроорганизмов, в основном бактерий, происходит разложение органических остатков с образованием соединений, уже более устойчивых к действию бактерий. В биохимической зоне генерируются в основном метан и углекислый газ. [c.95]
Метан требует особо детального рассмотрения и вот по каким причинам во-первых, он представляет начальный член всего ряда во-BfrapiHx, он встречается в газах всякого нирогенетического разложения органических соединений наконец потому, что из всех углеводо-родо В парафинового ряда он является веществом с наибольшим содержанием водорода С — 75%, Н — 25 %, и потому обладает большей термической устойчивостью и реакционной способностью особенного xJapaiKrrepa. [c.24]
Полисапробная зона характерна для свежезагрязненной воды, где протекают начальные этапы разложения органических соединений. Полисапробные воды содержат большое количество органических веществ, в первую очередь белков и углеводов. При разложении этих веществ в большом количестве выделяются углекислота, сероводород, метан. Вода бедна кислородом, поэтому химические процессы носят восстановительный характер. Резко выраженные неблагоприятные условия среды ведут к ограничению числа видов в растительном и животном населении водоема. Основными обитателями являются бактерии, количество которых достигает сотен миллионов в I мл воды. Очень много серобактерий и инфузорий. Все обитатели полисапробной зоны по способу питания относятся к консуйентам (потребителям), или иначе гетеротрофам. Они нуждаются в готовом органическом веществе. Продуценты (производители), т. е. автотрофы, к которым относятся зеленые растения, создающие органическое вещество из минеральных соединений, здесь совершенно отсутствуют. [c.156]
Осадок сточных вод и концентрированные производственные сточные воды с БПК выше 5 г/л подвергаются биохимическому разложению Б анаэробных условиях. Оно может происходить в сооружениях-септиках, представляющих собой отстойник, через который медленно проходит сточная жидкость. В двухъярусном отстойнике осадок отделен от проходящей сточной жидкости, его разложение осуществляется в иловой камере. На очистных сооружениях большой производительности осадок сточных вод выделяется в первичных отстойниках и вместе с избыточным активным илом подвергается сбраживанию в метантенках. Интенсивность и глубина разложения осадка прежде всего определяются его составом, который колеблется по соотношению содержания основных органических компонентов (углеводов, белков, жироподобных соединений) и неорганических веществ. Обычно в осадке городских сточных вод содержится 70—80% органических веществ. Так, примерный состав осадка ( % ) белки 24, углеводы 23, жироподобные вещества до 30. Чаще всего при кислом брожении осадка получаются уксусная, масляная, пропионовая кислоты. Образующиеся газы содержат диоксид углерода, метан, водород, сероводород. Водная фаза имеет кислую реакцию среды (рНбуферными свойствами, имеет резкий неприятный запах. [c.274]
Полисанробная зона (зона сильного загрязнения) соответствует свежему загрязнению водоема бытовыми сточными водами. Она характеризуется наличием большого количества сложных белковых соединений. Свободный кислород отсутствует, поэтому протекают биохимические процессы, имеющие восстановительный характер. В результате разложения органических соединений образуются сероводород, метан, диоксид углерода, аммиак. Основное население этой зоны представлено большим количеством бактерий. Численность их может достигать миллиона и более в 1 мл воды. Наряду с бактериями в этой зоне развиваются бесцветные жгутиковые, грибы, в иле находятся малощетинковые черви — тубифициды. Общее количество видов 30—36, возможны колебания видового состава в зависимости от времени года. [c.242]
Анаэробные биохимические процессы используются для разложения осадка сточных вод и иногда в качестве предварительной ступени очистки концентрированных производственных сточных вод. Разложение органических веществ идет с образованием метана, диоксида углерода, азота, сероводорода, водорода и продуктов неполного распада органических соединений. Этот способ обработки осадка сточных вод называется сбраживанием, которое осуществляется в септиках, двухъярз сных отстойниках и метан-тенках. [c.256]
Углеводороды в нефти своим происхождением обязаны, по-видимому, различным исто шикам и механизмам. Легкие углеводороды и газы, в которых ббычно содержится менее девяти атомов углерода, образуются в осадках в течение всего геологического времени в результате разложения органических соединений с большим числом углеродных атомов. Более тяжелые углеводороды синтезируются живыми организмами и образуются в осадках. По-видимому, образование углеводородов (УВ) продолжается до тех пор, пока из сильно измененных катагенезом пород не начнет выделяться только один метан. Вероятно, карбонатные осадки являются такими же эффективными материнскими породами, как и глинистые, хотя между ними существуют различия во времени и условиях образования, миграции и аккумуляции нефти. [c.278]
Самым простым но химическому составу углеводородным соединением является метан СИ4. Метан — газ, имеющий темпера- УРУ кипения —161,6°. Его часто называют болотным газом , так как он образуется при разложении органических веществ и выде- [c.174]
Первая стадия заключается в разложении крупных органических соединений и превращении их в органические кислоты с выделением газообразных побочных продуктов углекислого газа, метана и следов сероводорода. Эта стадия осуществляется разнообразными факультативными бактериями, функционирующими в лишенной кислорода среде. Если бы процесс на этом остановился, скопившиеся кислоты привели бы к понижению pH и к ингибированию последующего распада при закисании оставшихся сырых сточных вод. Для того чтобьг произошло сбраживание, на второй стадии необходима газификация для превращения органических кислот в метан и углекислый газ. Бактерии, расщепляющие кислоты с образованием метана, являются строгими анаэробами и очень чувствительны к условиям окружающей среды, т. е. к температуре, pH и анаэробиозу. [c.340]
А. П. Терентьев, Н. М. Туркельтауб, Е. А. Бондарев-ская, Л. А. Домочкина [39] разработали метод одновременного определения азота и кислорода. Анализируемую пробу органического соединения (5—10 мг) в платиновой или кварцевой лодочке разлагали в статических условиях в кварцевой трубке в атмосфере гелия, очищенного от кислорода, при разрежении 20 мм рт. ст. В присутствии никелированной сажи при 900° С конечными продуктами превращения кислорода и азота, содержащихся в анализируемом соединении, были окись углерода и азот. Авторы отмечают, что в некоторых случаях (по-видимому, в результате частичного гидрирования окиси и двуокиси углерода) в продуктах разложения в незначительных количествах появляется метан. [После разложения пробы простые продукты окисления [c.154]
Дёринг с сотр. [54] разработали реакционный метод определения муравьиной кислоты и ее производных. Метод основан на каталитическом разложении муравьиной кислоты на воду и оксид углерода и на количественном гидрировании оксида углерода в метан, который регистрируется пламенно-ионизационным детектором. Предел обнаружения 3-10 %. Относительное стандартное отклонение составляет 20% для области концентраций ниже 20-10 % и 5% для области концентраций 20- -100-10 %. Предложенный метод можно сочетать с газохроматографическим анализом компонентов смеси органических соединений. [c.238]
В контактных печах попутно с основной реакцией каталитического разложения спирта протекает много побочных реакций,, в результате чего, кроме бутадиена, образуются десятки других органических соединений. В состав высококипящей части контактного газа входят непрореагировавший этиловый спирт, образовавшаяся при реакции вода, пиперилен, этиловый эфир, альдегиды, высшие спирты и углеводороды. Низкокипящая часть содержит бутадиен, псевдОбутилен, этилен и другие непредельные углеводороды, метан, водород, а также углекислый газ, окисъ углерода и воздух. Экспериментально доказано, что коррозия углеродистой стали возрастает с увеличением содержания в контактном газе воздуха, который может попадать в систему из-за недостаточной герметичности. [c.167]
Между углеродистыми водородами известен лишь один, заключающий в частице 1 атом углерода и 4 атома водорода следовательно, это есть соединение с наивысшим процентным содержанием водорода (СН содержит 25°/о водорода). Этот предельный углеродистый водород СН называется болотным газом или метаном. Если приток воздуха к остаткам растений и животных ограничен, или даже не существует, то их разложение сопровождается образованием болотного газа, будет ли это разложение происходить при обыкновенной тем-температуре, или при температуре сравнительно весьма высокой. Оттого растения, разлагающиеся в болотах,под водою, выделяют этот газ. Всякий анает, что если тину болотного дна потрогать чем-нибудь, то из нее выделяется большое количество пузырей газа эти пузыри, хотя медленно, однако, выделяются и сами собою. Выделяющийся газ содержит преимущественно болотный газ, и его легко собрать, если стклянку опрокинуть в воде и в горло ее вставить (под водою же) воронку тогда пузыри газа легко уловить в отверстие воронки. Если дерево, каменный уголь и множество других растительных и животных веществ разлагаются действием жара без доступа воздуха, т.-е. подвергаются сухой перегонке, то они также выделяют вместе с другими газообразными продуктами разложения (углекислотою, водородом и различными другими веществами) много метана. Обыкновенно газ, употребляющийся для освещения — светильный газ, — получается именно этим способом, и потому он всегда содержит в себе болотный газ, смешанный с водородом и другими парами и газами, хотя он и очищается от некоторых из них [236]. А так как разложение органических остатков, образующих каменные угли, еще продолжается под землею, то в каменноугольных копях нередко продолжается еще выделение массы болотного газа, содержащего азот и СО . Смешиваясь с воздухом, он дает взрывчатую смесь, составляющую одно из бедствий копей этого рода, так как подземные работы приходится вести с лампами. Но эта опасность значительно уменьшается предохранительною лампою Гумфри Деви., который заметил, что если в пламя ввести плотную металлическую сетку, то поглощается столь много тепла, что за сеткой горение не продолжается (проходящие [c.259]
Попытки прямого фторирования органических соединений, предпринятые сразу после получения элементарного фтора, были многочисленны и неудачны. Первые из них были сделаны Муассаном и Шаваном, которые, пытаясь снизить энергию действия фтора, фторировали твердый метан жидким фтором при низкой температуре и в темноте. Несмотря на это и на высокое мастерство экспериментаторов, единственным итогом опыта был разрушительный взрыв. Муассан установил, что фтор реагирует со многими органическими соединениями настолько бурно, что в результате деструкции молекул образуются четырехфтористый углерод, фтористый водород, уголь и другие продукты разложения. Другие исследователи стремились получить фторуглероды путем взаимодействия углерода или углеродсодержащих соединений с элементарным фтором. Однако, как и Муассану, им удавалось получить только четырехфтористый метан, причем опыты часто заканчивались взрывами. Лебо и Дамену удалось более подробно изучить эту реакцию и определить свойства образующегося четырехфтористого углерода. [c.60]
Многие органические соединения разлагаются при относительно низкой температуре. Химическая природа и количество продуктов пиролкза зависят не только от строения исходного соединения, но также от конечной температуры разложения и от скорости нагревания. Характеристические фрагменты, главным образом, выделяются в интервале температур 300—700 °С. При более высокой температуре увеличивается степень образования простых веществ, таких как метан, монооксид и диоксид углерода, которые не могут достаточно полно характеризовать исходное соединение (рис. 3.1). [c.45]
При сожжении азотсодержащих органических соединений происходят два процесса термическое разложение вещества и окисление как самого вещества, так и продуктов его распада. В том случае, когда сожжение прошло количественно, в газах горения в конечном итоге не должно присутствовать соединений, не окислившихся полностью. Поэтому, хотя при термическом разложении азотсодержащих веществ и могут, в зависимости от их свойств, образоваться такие продукты пиролиза, как аммиак, дициан, цианистый водород, закись, окись и двуокись азота, свободный азот, закись углерода и метан или другие летучие углеводороды, в действительности в газах горения присутствуют лишь азот, окись или двуокись азота. Значительно реже и лишь при сожжении некоторых азотсодержащих веществ появляется реальная возможность недоокисления углеводородов или нитрильной группы. Многие исследователи указывают также на возможность недогорания угля, содержащего азот В последнем случае получатся, конечно, пониженные результаты, так же как и при образовании N-гpyппы, которая [c.73]
Синтезы соединений, меченных изотонами. Органические соединения, меченные изотопами, синтезируются при помощи известных методов, причем выбирают, разумеется, те реакции, в которых потери ценного изотопа наименьшие. Так, тяжелая серная кислота ОаЗО получается из 50з + ОаО, тяжелый хлористый водород из Ог Ч- Оз и т.д. При разложении карбида алюминия окисью дейтерия получается тетра-дейтерометан, или метан- СВ , при разложении карбида кальция окисью дейтерия образуется aцemuлeн-D2 СаОз. В результате присоединения дейтерия к различным соединениям с двойной связью получаются дейтеропроизводные [c.404]
Сведения о фотохимическом разложении гербицидов других классов весьма скудны, но какова цена классификации, если она не содержит пункта прочие Токсикологически интересный пример прочих соединений, несомненно, представляют органические соединения ртути, из которых в качестве гербицида применяется только фенилмеркурацетат. Соединения ртути легко распадаются на свету, и это их свойство используется уже давно. Соединения ртути применяют в качестве инициаторов, они претерпевают разрыв связи С—Н5. Например, диметилртуть дает ртуть, метан и этан с квантовым выходом, равным единице [95]. Облучение окси-этилмеркурхлорида приводит к образованию каломели и бутан-диола-1,4 [96]. [c.350]
В результате жизнедеятельности биоценоза метантенка происходит снижение концентрации органических загрязнений в отходах или сточных водах с одновременным образованием биогаза. В состав биогаза входят метан и диоксид углерода, общее количество и процентное соотношение компонентов биогаза во многом определяется исходным составом сбраживаемой среды. Так, при распаде 1 г жироподобных веществ в среднем образуется 1200 мл газа состава (в %) СН4 — 68, СО2 — 32. При распаде углеводоподобных соединений образуется около 800 мл газа из одного грамма, состав газа при этом (в %) СН4 — 50, СО2 — 50. Различным является и предел сбраживания различных органических соединений, например жироподобные вещества сбраживаются на 70, а углеводоподобные на 62,5 %. Предел сбраживания был найден экспериментально, по-видимо-му, если дальнейшее разложение органического вещества и имеет место, то оно не приводит к образованию газа. [c.136]
Глеевые воды. Термин глей пришел в науки о Земле из украинского языка. Так издавна называли сизый грунт со дна болот и озер. Этому народному термину академик Г. Н. Высоцкий (1865—1940) в 1905 г. придал значение научного понятия. Он выделил в иочвах особые глеевые горизонты сизого и зеленоватого цвета, для которых характерны соединения двухвалентного железа, восстановительная среда. С тех пор в почвоведении, а позднее и в грунтоведении укрепилось понятие об оглеенпи почв и грунтов — восстановительных процессах, для которых характерно двухвалентное железо. Оглеение возникает там, где разложение растительных остатков идет без доступа свободного кислорода, т. е. в анаэробной среде, При этом микроорганизмы отнимают кислород у минеральных соединений и с его помощью окисляют органические остатки, частично до СОз и Н2О, а частично до промежуточных продуктов — различных кислот и других органических соединений. Синтезируются и специфические органические вещества ночв — фульвокислоты и. гуминовые кислоты. Продуктами реакций служат также метан, водород и другпе газообразные восстановители, [c.90]
Таково влияние на характер нефтей динамометаморфизма . Теоретически говоря, более древние нефти подверглись и большему его влиянию. В общем, это подтверждается примером нефтей Соединенных Штатов, где палеозойские нефти, вообще говоря, легче мезозойских, мезозойские же — легче третичных. Но из этого правила много исключений, объясняемых особенностями исходного материала и геологической обстановкой того или иного месторождения. Из заводской практики нам хорошо известно, что если нефть будет перегрета, то начинается распадение ее тяжелых молекул на более легкие (на этом основан крекинг нефти). Если применить очень высокую температуру, то мы можем всю нефть превратить в газ, в составе которого главную роль будет играть метан. Вероятно, п в природе, если нефтяные залежи попадали в условия чрезвычайно высокого давления или очень больших температур, начиналось разложение нефти, которое заканчивалось разрушением углеводородов с выделением водорода и углерода. Это — крайняя степень метаморфизма органического вещества. Так, вероятно, образовался графпт — один пз крайних членов ряда битумов, а водород вследствие его малого атомного веса и крайней подвижности, вероятно, улетучился из литосферы в-атмосферу. [c.348]
Углеводороды (содержащие только углерод и водород) составляют большой класс природных и синтетических соединений. Простейший углеводород метан (СН4) представляет собой конечный продукт анаэробного разложения живых организмов и главную составную часть природного газа. На другом конце шкалы молекулярных масс расположен политен, который получается полимеризацией тысячи или большего числа молекул этена (этилена С2Н4). Углеводороды используются как топливо и в качестве сырья для промышленности органической химии. [c.77]
chem21.info
Алканы — номенклатура, получение, химические свойства » HimEge.ru
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле CnH2n+2.
В молекулах алканов все атомы углерода находятся в состоянии sр3-гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109° 28′.
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н-пентана.
Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси,
соединяющей ядра атомов, т. е. это σ-связи. Связи углерод — углерод являются неполярными и плохо поляризуемыми. Длина С—С связи в алканах равна 0,154 нм (1,54 • 10—10 м). Связи С—Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
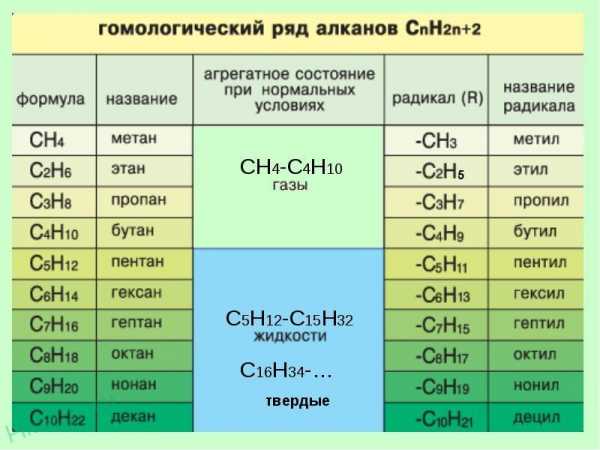
Гомологический ряд метана
Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, — это бутан.
Основы номенклатуры
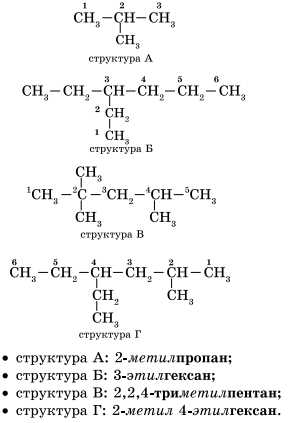
1. Выбор главной цепи. Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи. Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—СН3), затем этил (-СН2-СН3), пропил (-СН2-СН2-СН3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс —ил в названии соответствующего алкана.
3. Формирование названия. В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана ( метан СН4, этан С2Н6, пропан C3H8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан C7H16, октан C8H18,нонан С9Н20, декан С10Н22).
Физические свойства алканов
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С4Н12 до С15Н32 — жидкости; более тяжелые углеводороды — твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства алканов
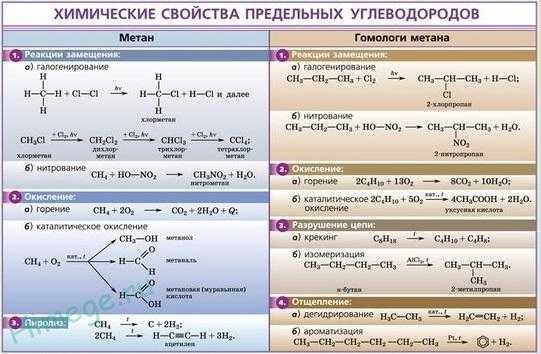
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
Реакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов.
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Способы получения

himege.ru
Метан разложение при высоких температурах
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений — спиртов, альдегидов, кислот. Получаемый при термическом разложении метана (реакция 1) мелкодисперсный углерод (газовая сажа) используется как наполнитель при производстве резины, типографских красок. Водород используется в различных синтезах, в том числе в синтезе аммиака. При высокотемпературном крекинге метана (реакция 2) получается ацетилен, необходимая высокая температура (1400—1600 С) создается электрической дугой. Одной из важных областей применения метана является получение так называемого синтез-газа — смеси оксида углерода(П) и водорода (реакции 3 и 4), используемого в дальнейшем для получения многих органических соединений. [c.69]
При высокой температуре метан подвержен термическому разложению. Система равновесий, устанавливающихся при термической диссоциации, может быть представлена следующим образом [c.465]
Сравнение реакционной способности углеводородов разных классов показывает, как сильно она зависит от температуры. Так, при нормальной температуре химически наиболее стойкими из всех классов углеводородов являются предельные углеводороды, а при температуре 500—800° С — ароматические углеводороды предельные же углеводороды становятся весьма нестойкими и легко подвергаются химическим превращениям. Толуол оказывается боле термически стойким, чем к-гептан [26]. В присутствии катализаторов реакционная способность предельных углеводородов проявляется при значительно более низких температурах. Реакционная способность парафиновых углеводородов при высоких температурах возрастает с увеличением молекулярного веса углеводородов. Низший член парафиновых углеводородов — метан — начинает в заметной степени подвергаться термическому разложению лишь при температурах выше 900° С [27 ], к-гексан разлагается уже при 520 С [28], а твердые парафины ( ao—С б) крекируются при 400 С. [c.55]
Характеристическим летучим водородным соединением углерода является метан. В обычных условиях водород с углеродом не реагирует. Синтез метана идет только при достаточно высокой температуре и в присутствии катализатора (мелкораздробленный никель). Применяются также и другие способы получения метана из сложных органических веществ. В лаборатории метан можно получить разложением карбида алюминия водой. В природе метан постоянно образуется при разложении органических веществ без доступа воздуха. Химическое строение метана определяется р -гибридизацией атома углерода. Молекула метана представляет собой правильный тетраэдр, в центре которого находится атом углерода, а по вершинам — атомы водорода. Метан — газ легче воздуха, почти нерастворим в воде, устойчив вплоть до 1000° С. Выше этой температуры разлагается с образованием ацетилена и водорода [c.362]
Существенно отличается от других парафиновых углеводородов характер термического распада метана. Он весьма термостабилен и подвергается пиролизу только при высоких температурах, при этом продукты его разложения распадаются с большей скоростью, чем сам метан. Первичная реакция описывается стехиометрическим уравнением [c.66]
Метан при высоких температурах находится в состоянии диссоциации, поэтому он является сильнейшим восстановителем. В то же время выделяющийся углерод очень активен и легко соединяется с различными металлами и неметаллами. Разложение метана ускоряется на поверхности раздела фаз, в частности на поверхности металлов, которые катализируют реакцию разложения. Реакцию проводят в фарфоровых, кварцевых или графитовых трубках (кварц при высоких температурах постепенно разрушается). Навеску металла или окисла металла помещают тонким слоем в фарфоровой или кварцевой лодочке в трубку и после вытеснения воздуха метаном (природный газ) прокаливают в слабом токе этого газа (рис. 36). Время прокаливания определяется степенью измельчения металла. Порошкообразные металлы насыщаются углеродом за 1—2 ч. Если же металл взят в реакцию в виде кусочков, то времени затрачивается больще, так как процесс носит диффузионный характер. [c.101]
В интервале температур от 800 до 1100° С при пиролизе бензола наблюдаются небольшие количества метана и следы ацетилена. Количество образующегося метана, примерно, такого же порядка, как и при нагревании углерода с водородом по-видимому, такая реакция, сопровождающая разложение бензола при высоких температурах, является основным источником образования метана. Интересно, что при нагревании так называемого аморфного углерода с водородом не получаются ароматические углеводороды, а вместо них благодаря реакции на ребрах кристаллов графита образуется метан. Можно считать, в свою очередь, что следы ацетилена, образующегося в процессе пиролиза бензола при высоких температурах, обусловлены скорее вторичным разложением метана, чем прямой диссоциацией бензола до ацетилена. Последняя реакция лишь предполагается некоторыми исследователями [4], однако она трудно доказуема. Ацетилен почти полностью разлагается при 750° С при этом получаются ароматические углеводороды, (в значительных количествах бензол) кокс и газы, среди которых обнаруживаются в убывающем порядке водород, метан и этилен [10]. Поскольку этилен является важным продуктом разложения ацетилена, а не самого бензола, то есть основания предполагать, что разложение бензола до ацетилена не относится к одной из основных реакций этого углеводорода. С другой стороны, [c.96]
Результаты хроматографического анализа продуктов крекинга (табл. 23 и 24) показывают, что при 20 мм (548°) вначале изобутан распадается быстрее (за первую минуту), чем бутан. С увеличением времени крекинга, влияние продуктов сглаживает это различие в скорости разложения. При более высокой температуре (573°) наблюдается обратное — изобутан при значительном времени крекинга распадается медленнее, чем бутан. Крекинг бутана на метан и пропилен в этих, условиях более чем в пять раз, а на этан и этилен более чем в два раза превосходит дегидрогенизацию. В тех же условиях дегидрогенизация изобутана в 7 раз, а деметанизация его в три раза превосходят деэтанизацию. [c.99]
Метан очень устойчив к термическому разложению. При очень высоких температурах (>800°С) и малом времени контакта метан дает этан, этилен, ацетилен, водород и некоторые ароматические углеводороды, главным образом, бензол. При температуре около 800°С все алканы образуют одинаковые продукты разложения наиболее важными из них являются этилен, пропен, бутены, бутадиен и водород. В промышленном процессе легкие нефтяные фракции, разбавленные паром, пропускают через пустую трубку при температуре около 800°С время контакта 1 с (или меньше). В случае этана основными продуктами являются этилен и водород в настоящее время эта реакция используется наиболее широко. [c.158]
Природный газ представляет собой смесь газов, состав которой зависит от месторождения. Иногда это почти чистый метан, но обычный состав природного газа таков около 75% метана, 15% этана и 5% пропана, а также небольшие количества других примесей, прежде всего высших алканов, азота, диоксида углерода, а иногда и гелия. Природный газ используется как промышленное топливо, а содержащиеся в нем алканы, прежде всего метан, являются важным химическим сырьем (разд. 8.4.1.1). Большое значение имеет каталитическое разложение содержащегося в природном газе метана водяным паром при высоких температурах. При этом образуется смесь водорода и оксида углерода, так называемый синтез-газ [c.242]
НОГО сырья, в частности метана. Сущность процесса окислительного пиролиза заключается в следующем. Подогретый метан и кислород подаются через горелку специальной конструкции в зону пиролиза реактора, где за счет сгорания части метана температура поднимается до 1400—1500° С. Благодаря большой объемной скорости газовой смеси (время пребывания газа в зоне реакции составляет 0,005 сек) при разложении метана образуются ацетилен, окись углерода и водород. Непосредственно после зоны пиролиза в реакторе расположена зона закалки, в которой реакционные газы резко охлаждаются внрыскиважием воды из форсунок. Быстрое охлаждение предотвращает разложение нестойкого при высоких температурах ацетилена. [c.15]
Метан, этилен, пропилен и другие углеводороды получаются термическим разложением (пиролизом) при высоких температурах и давлениях жидких углеводородов — рафинатов платформинга 5 и газообразных — этана 6, пропана 7. [c.114]
Общеизвестно, что температурные условия существенно влияют на состав нефтей. С увеличением глубины, а следовательно, и с повышением температуры происходит метанизация нефтей, как правило, уменьшается их вязкость, плотность, снижается содержание смол, асфальтенов и увеличивается выход светлых фракций. На больших глубинах при высоких температурах (200 °С и более) происходит деструкция (разложение) нефти и переход ее в газ (метан). Метан в свою очередь может также разлагаться при более высоких температурах на углерод и водород. Не исключена возможность, что графит, обнаруженный в некоторых глубоких и сверхглубоких скважинах в США, является продуктом разложения метана. [c.78]
Фотохимическое разложение ди-грег-бутилперекиси при 25—70° С/30 мм рт.ст. при малой интенсивности освещения дает метан, тогда как продукты разложения, протекающего в нормальных условиях, идентичны продуктам, которые получаются при термическом разложении (этан, ацетон и грет-бутанол) Дорфман и Зальцбург предполагают, что из метильного и трет-бутоксильного радикалов при высокой температуре образуются как метай, так и грег-бутанол с отрывом атома водорода от мо- [c.258]
При достаточно высокой температуре ( — 2000°) углерод может быть перенесен путем образования и разложения углеводородов, вероятно, преимущественно метана. Так как, с другой стороны, метан может реагировать с металлами с образованием карбидов, возникает возможность проводить реакции между твердыми веществами при пространственном их разделении. Если металл и углерод нагревать в присутствии водорода, то реакции протекают по уравнениям (19) и (20) [c.150]
Оказывается, таким образом, что при пиролизе метана с коротким периодом нагрева и в температурных пределах от 1050 до 1200°, могут быть получены лишь относительно невысокие выходы этилена. При этих условиях одновременно образуются как ацетилен, так и другие продукты, при более же высоких температурах превалирует ацетилен. Для оптимальных выходов непредельных углеводородов необходимы неактивные поверхности нагрева (состоящие из таких материалов как кварц, фарфор или медь, которые не ускоряют разложения метана на элементы). Полезным бывает также применение разбавляющих газов. Вследствие необходимости применять высокие температуры и вследствие относительно невысокой степени конверсии, метан не является подходящим сырьем для получения этилена. [c.139]
Петерс и Мейер [57] подвергали метан разложению до ацетилена, бензола, углерода и водорода над нагретыми вольфрамовыми спиралями в фарфоровых трубках. Реакция прекращалась до наступления равновесия, когда концентрация ацетилена становится достаточно высокой. Несмотря на то, что температурные данные этих авторов являются весьма приближенными, на основания их работ можно сделать некоторые выводы. Максимальная конверсия до ацетилена происходила при наивысшей температуре 3000° С и самом коротком времени контакта — 0,0001 сек. Уменыпение парциального давления метана приводило к увеличению конверсии до ацетилена и уменьшению выходов кокса и жидких продуктов. [c.64]
Основным компонентом углеводородных газов является метан. Поэтому сущность копверсионного метода получения азотоводородной смеси состоит в разложении при высокой температуре метана и его гомологов на водород и окись углерода с помощью окислителей — водяного пара или кислорода. Окислители могут применяться в различных сочетаниях. Конверсия метана с водяным паром и кислородом протекает по реакциям СН4 + НаО СО -Ь ЗНа — 206,4 кДж (—49,3 ккал) [c.33]
Имеется несколько патентов о крекинге жидкьх нефтяных продуктов, смешанных с углеводородными газами. В этих патентах указывается, что углеводородные газы, богатые водородом, могут реагировать в условиях крекинга с жидким нефтяным сырьем или продуктами разложения, обедненными водородом, и могут дать более высокие выходы бензинов и уменьшение образования кокса. Температурные условия процессов в данном случае не отличаются существенно от условий обыкновенного термического крекинга. Рекомендуемые давления те же самые или немного выше, чем при крекинге. На самом деле взаимодействие между такими газами, как метан, этан, пропан, и высокомолекулярными олефинами или циклическими углеводородами маловероятно при условиях обыкновенного крекинга с точки зрения термодинамики. Значительно более высокие температуры или более высокие давления следует применять, чтобы обеспечить их взаимодействие. Термическая конверсия низкомолекулярных парафинов также маловероятна в условиях обыкновенного крекинга. Таким образом, вряд ли эти патенты имеют практическое значение. [c.165]
Контактные газы после пиролиза быстро охлаждают ( закаливают ), Закалка преследует цель заморозить равновесную систему, полученную при высокой температуре, и предотвратить разложение ацетилена, неизбежное при медленном охлаждении контактных газов. Реактор термоокислительного пиролиза (рис. 209) состоит из камер смешения 1, сгорания 2 и закалки 3. Метан и кислород, нагретые предварительно до 700°С, поступают в смесительную камеру /, из которой газовая смесь попадает в камеру сгорания 2, газы движутся в каналах камер1э1 с большой скоростью, что предохраняет ее от обратного проскока пламени в смесительную камеру. Для-интенсификации процесса горения непосредственно в горелки подается добавочное количество кислорода (10%). Газы, выходящие из горелок, попадают в камеру закалки 5, где их охлаждают водой, которую впрыскивают через сопла 4 в кольцевом коллекторе. Процесс пиролиза протекает в камере горения и частично в камере закалки. [c.223]
Химическая инертность метана ставит его на особенное место среди углеводородов ряда метана. Его устойчивость при высоких температурах имеет весьма важное значение. В качестве непременного продукта, гидрогенизации углеводородов метан всегда присутствует в гавах, об(разова]ва шихся гари разложении, выдешйясь или не-посредсгвенно при разложении или в качестве продукта вторичной реакции гидрирования непредельных газообразных углеводородов при высокой температуре. [c.235]
Таково влияние на характер нефтей динамометаморфизма . Теоретически говоря, более древние нефти подверглись и большему его влиянию. В общем, это подтверждается примером нефтей Соединенных Штатов, где палеозойские нефти, вообще говоря, легче мезозойских, мезозойские же — легче третичных. Но из этого правила много исключений, объясняемых особенностями исходного материала и геологической обстановкой того или иного месторождения. Из заводской практики нам хорошо известно, что если нефть будет перегрета, то начинается распадение ее тяжелых молекул на более легкие (на этом основан крекинг нефти). Если применить очень высокую температуру, то мы можем всю нефть превратить в газ, в составе которого главную роль будет играть метан. Вероятно, п в природе, если нефтяные залежи попадали в условия чрезвычайно высокого давления или очень больших температур, начиналось разложение нефти, которое заканчивалось разрушением углеводородов с выделением водорода и углерода. Это — крайняя степень метаморфизма органического вещества. Так, вероятно, образовался графпт — один пз крайних членов ряда битумов, а водород вследствие его малого атомного веса и крайней подвижности, вероятно, улетучился из литосферы в-атмосферу. [c.348]
В ряду алканов метан является наиболее термически устойчивым, так как в нем отсутствуют связи С—С. Разложение метана на углерод и водород возможно при очень высоких температурах (примерно 1500°С). Распад этана, пропана и бутанов изучали многие исследователи. Для этана хэрактерна реакция дегидрирования [c.174]
Пиролиз углеводородов. Дэви, а затем Марченд и Бертло [1, с. 182] предположили, что образование углерода в пламени -происходит благодаря термическому разложению углеводородов. Они наблюдали, что при высокой температуре углеводороды распадались в основном на углерод и метан. Ацетилен, который очень эндотермичен, может распадаться при взрыве на углерод и водород. Таким образом было сделано предположение, что углерод образуется при пиролизе углеводорода при прохождении его через зону подогрева. [c.180]
Реакции разложения на элементы мог)гг быть практически возможны или при очень высоких температурах (выше 700° С), или в присутствии определенных металлических катализаторов при более умеренных температурных условиях. Никель является одним из наиболее энергичных катализаторов, ускоряющих разложение парафинов, как и других углеводородов, на элементы или метан и элементы. Сабатье и Сандерен [111] описали частичное разложение метана на углерод и водород при 390° С и этана при 325° С в присутствии никеля. Фрей и Смит [39] и Херд [56] наблюдали очень быстрое разложение пропана и бутана на углерод и газы при 350—400° С и 500° С в присутствии того же катализатора. Катализаторами подобного типа являются медь, железо, монель- леталл, многие другие тяжелые металлы и некоторые неметаллы, например селен. Особенно активны порошкообразные металлы. С Другой стороны, тот факт, что железные трубы не активируют разложение нефти на элементы в обычных условиях крекинга, должен указывать или на неактивность железа в виде сплошной массы или на деактивацию металлической поверхности вследствие отложения углерода. Однако каталитическое действие металлической поверхности труб может быть заметно при повышенных температурах, применяемых при крекинге в паровой фазе или в таких процессах, как дегидрогенизация. Предварительная обработка труб при высоких температурах паром или сероводородом может деактивировать металлическую поверхность. Небольшие количества пара или сероводорода (или других соединений серы), добавленные к сырью для крекинга, могут вызвать тот же эффект. В результате такой обработки активная металлическая поверхность покрывается неактивными окислами или сульфидами. Полученный эффект может быть приписан также отравлению активной поверхности образовавшимися окислами или сульфидами. [c.11]
Вопе и oward изучали разложение этилена и других углеводородов. Они в продолжение 2У2 часов заставляли этилен циркулировать через трубку, которая нагревалась до 570—580°, и в продуктах реакции нашли ацетилен, этан, метан, водород ароматические углеводороды углерода образовалось ничтожное количество. При более высоких температурах главными продуктами реакции являлись метап, водород и углерод. Авторы пришли к выводу, что основным продуктом разложения этилена является ацетилен. Было высказано предположение, что первичное влияние температуры на этилен и этан вызывает выделение водорода, с одновременным ослаблением или разрывом связи между углеродными атомами и образованием лабильных остатков =СН и СН. Эти остатки, имеющие весьма кратковременное существование, могут [c.80]
Как и в случае парафинов, все эти реакции, однако, не происходят при крекинге с температурой ниже 600—700° Сив отсутствии активных металлических катализаторов. В их присутствии скорость таких реакций невероятно повышается и реакции происходят при сравнительно умеренных температ) рах. Сабатье и Сандерен [111] и Кан-тело [16] разложили этилен и пропилен на водород, углерод и метан (этан) в присутствии никеля при 300—350°С, Хэрд и Мейнерт [59] показали, что разложение пропилена на свободные элементы или метан и элементы в трубках из монель-металла происходит при 350° С и заканчивается в 30 сек. Хэрд [56] разложил 25% изобутилена в трубках из монель-металла при 410°С в 17 сек. Известно также, что этилен при высоких температурах и под высоким давлением разлагается быстро и иногда со взрывом с образованием углерода, метана и водорода. [c.38]
Реакции дегидрогенизации олефинов, так же как деполимеризации, приводят к образованию олефинов, диолефинов и водорода. Парафины при этих реакциях не образуются. Однако парафиновые углеводороды, особенно низкомолекулярные парафины, включая метан и этан, легко получаются при других реакциях разложения олефинов. Исследования дальнейших стадий термического разложения олефинов при высоких температурах не могут быть включены в эту книгу из-за слишком большого количества их. Табл. 15 содержит результаты, полученные Уилером и Вудом [140] для термического разложения пропилена, и дает представление о продуктах дальнейшего разложения олефинов. Очень похожие данные были получены этими же авторами для этилена и бутилена. [c.49]
Хэрд и его сотрудники [56а] показали, что образование метана из изобутилена является одной из первичных реакций разложения изобутилена при 650—700° С и атмосферном давлении. Таким образом, термический крекинг олефинов осложняется многими побочными реакциями. Первой фазой крекинга является полимеризация, особенно при высоких давлениях, сопровождаемая деполимеризацией. В дальнейших стадиях при более высоких температурах или большей продолжительности процесса олефины дегидрогенизируются и разлагаются с образованием диолефинов, парафинов и водорода. В еще более поздних стадиях при высоких температурах олефины легко разлагаются на углерод, метан и водород. Эта схема не включает процессов циклизации и ароматизации, которые будут рассматриваться ниже. [c.50]
Углистые отложения, получающиеся при разных температурных условиях из разных исходных органических веществ (по разным механизмам), сильно отличаются по своим свойствам. Углистые вещества низкотемпературных механизмов содержат большое количество простых продуктов поликонденсации, которые иногда можно выделить из них при нагревании в вакууме до более высоких температур или экстрагировать различными растворителями [64]. Низкотемпературные углистые вещества на катализаторах часто представляют собой продукты полимеризации углеобразующего материала, т. е. карбоиды в данном случае не имеют ароматического характера и образуются без отщепления легких молекул. Например, как уже отмечалось выше, при разложении циклопентана углистое вещество по существу представляет собой полимер циклопентаднена [14]. Углистое вещество, полученное из пропилена на силикагеле и других катализаторах по низкотемпературному механизму (до 700°), представляет собой полимер пропилена [68, 70] углистое вещество, полученное из кумо-ла при температурах до 700°, — полимер кумола и т. д. Высокотемпературные углистые вещества, наоборот, не содержат экстрагируемых компонентов [64] и состоят из карбоидов ароматического характера и всегда представляют собой продукты поликонденсации, т. е. образуются при обязательном отщеплении каких-либо легких молекул (водород, вода, метан и др.). Например, углистое вещество, получаемое из бензола, состоит только из карбоидов, имеющих ароматический характер [50]. [c.275]
Метан — главная составная часть природного газа, — будучи подвергнут пиролизу при 1120° и продолжительности контакта в 0,1 сек., дает с хорошим выходом ацетилер и этилен. Разложение этана начинается в отсутствии катализаторов приблизительно при 485° и дает главным образом этилен и водород. При более высокой температуре получаются также метан, ацетилен и ароматические углеводороды. [c.686]
Нагревание спиртов до высокой температуры приводило к таким же результатам, как и любое другое пирогенетическое разложение органических веществ. При пропускании паров винного спирта через раскаленную глиняную трубку голландские химики еще в XVIII столетии впервые получили этилен [14]. Изучая эту же реакцию в 1886 г., Бертло мог уже более или менее точно измерять температуру он нашел, что спирт, пропущенный при 500°С через фарфоровую трубку с пемзой, образует наряду с этиленом еще и уксусный альдегид (см. [15]). Но Бертло получил ничтожные количества альдегида и определил его лишь качественно. Спирты большого молекулярного веса разлагаются еще сложнее и образуют метан, смолы, угольную массу. [c.33]
Из производных фтора наиболее эффективным окислителем является моноокись фтора (ОГг). Преимуществами ее по сравнению-с фтором являются более высокая температура кипения (—144,8°) и больший удельный вес (1,53), недостатком — исключительно высокая токсичность. Допустимая концентрация паров моноокиси фтора в воздухе составляет 0,00001 мг л [20]. При температуре жидкого-воздуха моноокись фтора представляет желтую с буроватым оттенком жидкость. По сравнению с фтором его мбноокись отличается меньшей химической активностью благодаря высокой энергии активации разложения. При смешении моноокиси фтора с водородом метаном и другими органическими веществами самовоспламенения не происходит [9]. Концентрированные растворы щелочи разрушают ее. [c.671]
To her исследовал термическое разложение октана, декана и различны) парафиновых дестиллатов с точки зрения оценки пригодности этих веществ дл5 производства светильного газа (из нефти). Автор пришел к выводу, что окта( и декан при низких т емпературах разлагаются на этилен и высшие олефииы метан и водород при более же высоких температурах не наблюдается образо-аания высших олефинов, и газообразные продукты реакции состоят лишь и этилена,. метана и водорода. [c.74]
Непредельные углеводороды — этилен, пропилен, бутилен или изоамилен — реагируют с сероводородом в присутствии силикагеля при температуре от 650 до 725° В результате этой реакции получаются самые разнообразные соединения, как например водород, метан, этиленовые, насыщенные и ароматические углеводороды, меркаптаны, тиоэфиры, тиофен и его гомологи, а также сероуглерод. Меркаптаны образуются при взаимодействии непредельных углеводородов с сероводородом. Разложение мерка птанов ведет к образованию тиоэфиров, которые затем переходят в тиофен и его гомологи. Бутилсульфид, или бутилмеркаптан, был превращен в тиофен в присутствии силикагеля при 700 При более высоких температурах повышалось содержание сероуглерода. [c.462]
chem21.info
Способы получения алканов | Химия онлайн
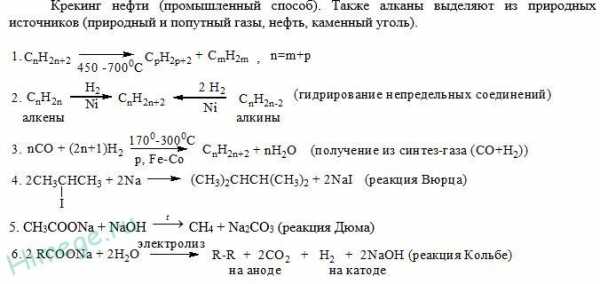
Алканы выделяют из природных источников (природный и попутный газ, нефть, каменный уголь).
Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум.
Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (80-97%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дня болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным или рудничным газом.
В промышленности
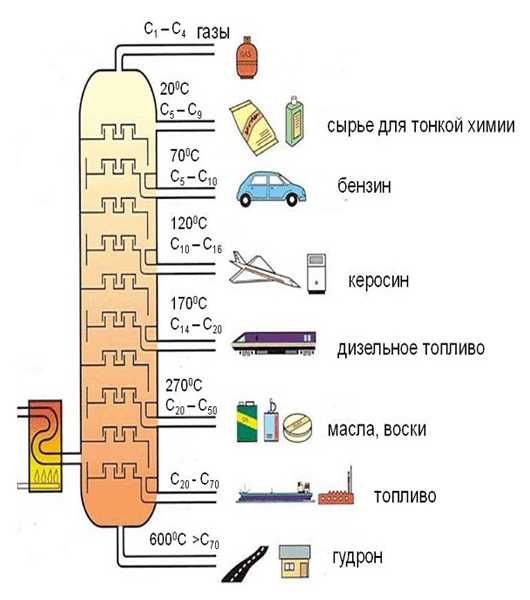
1. Получение алканов из природных источников (нефть, природный газ)
2. Синтезом на основе водяного газа из оксида углерода (II) и водорода можно получить метан:
3. Синтезом из водяного газа (СО+Н2) получают смесь алканов:
В лаборатории
1. Метан можно получить синтезом из простых веществ при нагревании, повышенном давлении в присутствии катализатора (Ni):
2. Гидролиз карбида алюминия (получение метана)
3. Взаимодействие карбида алюминия с сильными кислотами
4. Сплавление солей уксусной кислоты со щелочами (реакция Дюма)
Видеоопыт «Получение метана»
5. Каталитическое гидрирование (+Н2) непредельных углеводородов
6. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
7. Электролиз растворов солей карбоновых кислот (реакция Кольбе)
Алканы (предельные углеводороды)
himija-online.ru
