Факторы растворимости. Равновесия при растворении
Растворимость — это свойство вещества образовывать с различными растворителями гомогенные смеси. Как мы уже упоминали, количество растворяемого вещества, необходимое для получения насыщенного раствора и определяет растворимость этого вещества. В связи с этим растворимость имеет ту же меру, что и состав, например, массовая доля растворенного вещества в его насыщенном растворе или количество растворенного вещества в его насыщенном растворе.
Все вещества с точки зрения его растворимости можно классифицировать на:
- Хорошо растворимые – в 100 г воды способно раствориться более 10 г. вещества.
- Малорастворимые — в 100 г воды способно раствориться менее 1 г. вещества.
- Нерастворимые — в 100 г воды способно раствориться менее 0,01 г. вещества.
Известно, что если полярность растворяемого вещества схожа с полярностью растворителя, то оно скорее всего растворится. Если же полярности разные, то с большой долей вероятности раствора не получится. Почему же так происходит?
Полярный растворитель – полярное растворяемое вещество.
Для примера опишем раствор поваренной соли в воде. Как мы уже знаем, молекулы воды имеют полярную природу с частичным положительным зарядом на каждом атоме водорода и частичным отрицательным – на атоме кислорода. А твердые ионные вещества, вроде хлорида натрия, содержат катионы и анионы. Поэтому, когда поваренную соль помещают в воду, частичный положительный заряд на атомах водорода молекул воды притягивается отрицательно заряженным ионом хлора в NaCl. Аналогично, частичный отрицательный заряд на атомах кислорода молекул воды притягивается положительно заряженным ионом натрия в NaCl. И, поскольку притяжение молекул воды для ионов натрия и хлора сильнее взаимодействия, удерживающего их вместе, соль растворяется.
растворение хлорида натрияНеполярный растворитель – неполярное растворяемое вещество.
Попробуем растворить кусочек тетрабромида углерода в тетрахлориде углерода. В твердом состоянии молекулы тетрабромида углерода удерживаются вместе благодаря очень слабому дисперсионному взаимодействию. При помещению его в тетрахлорид углерода его молекулы будут располагаться более хаотично, т.е. увеличивается энтропия системы и соединение растворится.
Равновесия при растворении
Рассмотрим раствор малорастворимого соединения. Для того, чтобы между твердым веществом и его раствором установилось равновесие, раствор должен быть насыщенным и соприкасаться с нерастворившейся частью твердого вещества.
Например, пусть равновесие установилось в насыщенном растворе хлорида серебра:
AgCl(тв)=Ag+(водн.) + Cl—(водн.)
Рассматриваемое соединение является ионным и в растворенном виде присутствует в виде ионов. Нам уже известно, что в гетерогенных реакциях концентрация твердого вещества остается постоянной, что позволяет включить ее в константу равновесия. Поэтому выражение для константы равновесия будет выглядеть следующим образом:
K = [Ag+][ Cl—]
Такая константа называется произведением растворимости ПР, при условии, что концентрации выражаются в моль/л.
ПР = [Ag+][ Cl—]
Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении равновесия.
Следует отличать понятие растворимости и произведения растворимости. Растворимость вещества может меняться при добавлении в раствор еще какого-либо вещества, а произведение растворимости не зависит от присутствия в растворе дополнительных веществ. Хотя эти две величины взаимосвязаны, что позволяет зная одну величину, вычислить другую.
Зависимость растворимости от температуры и давления
Вода играет важную роль в нашей жизни, она способна растворять большое количество веществ, что имеет большое значение для нас. Поэтому основное внимание уделим именно водным растворам.
Растворимость газов повышается при росте давления газа над растворителем, а растворимость твердых и жидких веществ зависит от давления несущественно.
Уильям Генри впервые пришел к выводу, что количество газа, которое растворяется при постоянной температуре в заданном объеме жидкости, прямо пропорциональна его давлению. Данное утверждение известно как закон Генри и выражается оно следующим соотношением:
С = k·P,
где С – растворимость газа в жидкой фазе
Р – давление газа над раствором
k – постоянная Генри
На следующем рисунке приведены кривые зависимости растворимости некоторых газов в воде от температуры при постоянном давлении газа над раствором (1 атм)
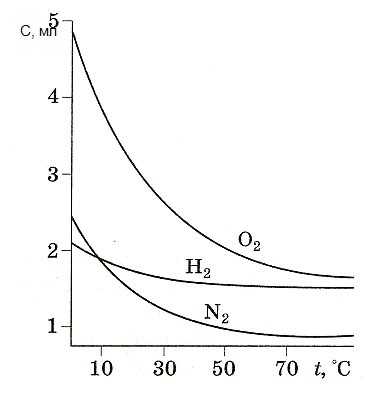 растворимость газов в воде
растворимость газов в водеКак видно, растворимость газов уменьшается с ростом температуры, в отличие от большинства ионных соединений, растворимость которых растет с увеличением температуры.
Влияние температуры на растворимость зависит от изменения энтальпии, которое происходит при процессе растворения. При протекании эндотермического процесса происходит увеличение растворимости с ростом температуры. Это следует из уже известного нам принципа Ле – Шателье: если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению.
Представим, что мы имеем дело с раствором, находящимся в равновесии с частично растворившимся веществом. И этот процесс является эндотермическим, т.е. идет с поглощением теплоты из вне, тогда:
Вещество + растворитель + теплота = раствор
Согласно принципу Ле – Шателье, при эндотермическом процессе, равновесие смещается в направлении, способствующее уменьшению поступления теплоты, т.е. вправо. Таким образом, растворимость увеличивается. Если же процесс экзотермический, то повышение температуры приводит к уменьшению растворимости.
Далее на рисунке показаны зависимости растворимости некоторых ионных соединений от температуры.
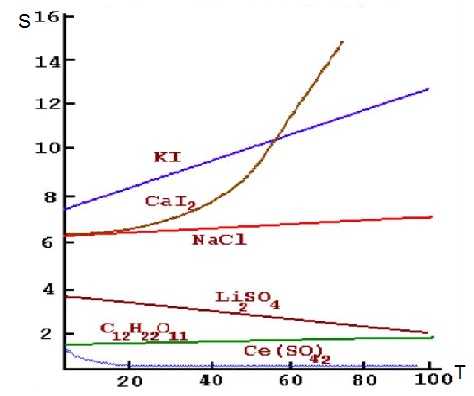 зависимость растворимости ионных соединеий от Температуры
зависимость растворимости ионных соединеий от ТемпературыИзвестно, что существуют растворы жидкостей в жидкостях. Некоторые из них могут растворяться друг в друге в неограниченных количествах, как вода и этиловый спирт, а другие — растворяются лишь частично. Так, если попробовать растворить четыреххлористый углерод в воде, то при этом образуются два слоя: верхний — насыщенный раствор воды в четыреххлористом углероде и нижний — насыщенный раствор четыреххлористого углерода в воде. При повышении температуры, в основном, взаимная растворимость таких жидкостей увеличивается. Это происходит до тех пор, пока не будет достигнута критическая температура, при которой обе жидкости смешиваются в любых пропорциях. От давления растворимость жидкостей практически не зависит.
При вводе в смесь, состоящую из двух несмешивающихся между собой жидкостей, вещества, которое может растворяться в любой из этих двух жидкостей, то его распределение между этими жидкостями будет пропорционально растворимости в каждой из них. Т.е. согласно закону распределения вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
С1/С2 = К,
где С1 и С2 – концентрации вещества в двух жидкостях
К – коэффициент распределения.
zadachi-po-khimii.ru
Растворимость веществ. Факторы, влияющие на растворимость
Одни вещества лучше растворяются в том или ином растворителе, другие хуже. Считается, что абсолютно нерастворимых веществ нет. Каждое вещество способно к растворению, пусть даже в некоторых случаях и в очень незначительных количествах (например, ртуть в воде, бензол в воде).
К сожалению, до настоящего времени, нет теории, с помощью которой можно было бы предсказать и вычислить растворимость любого вещества в соответствующем растворителе. Обусловлено это сложностью и многообразием взаимодействия компонентов раствора между собой и отсутствием общей теории растворов (особенно концентрированных). В связи с этим необходимые данные по растворимости веществ получают, как правило, опытным путем.
Количественно способность вещества к растворению характеризуется чаще всего растворимостьюили
Растворимость (S)показывает сколько граммов вещества может максимально раствориться при данных условиях (температуре, давлении) в 100 г растворителя с образованием насыщенного раствора.
При необходимости коэффициент растворимости определяется и для другого количества растворителя (например, для 1000 г, 100 см3, 1000 см3и т.д.).
По растворимости все вещества в зависимости от своей природы делятся на 3 группы: 1) хорошо растворимые; 2) мало растворимые; 3) плохо растворимые или нерастворимые.
Коэффициент растворимости для веществ первой группы больше 1 г (на 100 г растворителя), для веществ второй группы лежит в интервале 0,01 – 1,0 г и для веществ третьей группы S< 0,01 г.
На растворимость веществ оказывают влияние многие факторы, главными из которых являются природа растворителя и растворяемого вещества, температура, давление, наличие в растворе других веществ (особенно электролитов).
Влияние природы веществ на растворимость
Установлено опытным путем, что в растворителе, молекулы которого полярны, лучше всего растворяются вещества, образованные ионными или ковалентными полярными связями. А в растворителе, молекулы которого неполярны, лучше растворяются вещества, образованные слабополярными или неполярными ковалентными связями. По другому эту выявленную закономерность можно сформулировать так: «Подобное растворяется в подобном».
Растворимость веществ во многом обуславливается силой и характером их взаимодействия с молекулами растворителя. Чем сильнее выражено это взаимодействие, тем больше растворимость и наоборот.
Известно, что силы, действующие между неполярными и слабополярными молекулами, невелики и неспецифичны, т.е. в количественном выражении существенно не зависят от вида вещества.
Если в неполярную жидкость В ввести однотипные неполярные молекулы А, то энергия взаимодействия частиц А и В между собой не будет значительно отличаться от энергии взаимодействия между частицами А и А или частицами В и В. Поэтому подобно тому как смешиваются любые количества одного и того же вещества, с большой вероятностью будут неограниченно смешиваться друг с другом (т.е. растворяться друг в друге) и различные неполярные жидкости.
По этой же причине и молекулярные кристаллы обычно лучше растворяются в неполярных жидкостях.
Если же энергия взаимодействия молекул А и А или В и В больше чем А и В, то одинаковые молекулы каждого компонента будут предпочтительнее связываться между собой и растворимость их друг в друге понизится (табл. 6).
Полярность любого растворителя часто характеризуют значением его диэлектрической проницаемости (ε), которая легко определяется опытным путем. Чем она больше, тем более полярным является вещество.
Таблица 6. Растворимость KI(мас%) в растворителях различной полярности
|
Растворитель |
Н2О |
CH3OH |
н-С4Н9ОН |
C6H6 |
|
Диэлектрическая проницаемость растворителя, ε |
80,4 |
31,2 |
10,72 |
2,3 |
|
Растворимость, KI |
59,8 |
14,97 |
0,2 |
|
Растворимость веществ значительно повышается если они способны образовывать с растворителем водородные или донорно-акцепторные связи. Примером большой растворимости, обусловленной образованием водородных связей, является раствор этилового спирта в Н2О, а образованием донорно-акцепторных связей – растворNH3в воде. При этом растворимость спирта не ограничена, аNH3в Н2О растворяется в объемном соотношении ~ 700 : 1.
studfiles.net
Растворимость веществ, ее зависимость от различных факторов » mozok.click
Способность вещества растворяться в воде называют растворимостью. По растворимости вещества условно делят на хорошо растворимые, малорастворимые и практически нерастворимые (схема 3).
Схема 3. Классификация веществ по растворимости в воде
Если в растворе в результате химической реакции образуется вещество малорастворимое или практически нерастворимое в воде, то оно выпадает в виде осадка — раствор теряет прозрачность, становится мутным.
Растворимость некоторых неорганических веществ в воде приведена в таблице растворимости кислот, солей и гидроксидов (см. форзац 2).
Пределы растворимости веществ
Подавляющее большинство веществ ограничено растворимы в разных растворителях. Количественно их растворимость выражают
числом, которое показывает наибольшую массу вещества, способную раствориться в 100 г растворителя при определенных условиях. Эту величину называют коэффициентом растворимости, или просто растворимостью. Например, в 100 г воды при 20 °С можно растворить не более 32 г KNO3, 36 г NaCl, 0,25 г CaSO4 и только 0,007 г CaCO3. Эти данные можно найти в справочниках.
Обратите внимание: кальций карбонат, который считается практически нерастворимым, на самом деле в незначительном количестве переходит в раствор. Абсолютно нерастворимых веществ не существует.
Некоторые жидкости, например этиловый спирт, глицерин, ацетон, сульфатная, нитратная и уксусная кислоты, неограниченно растворимы в воде — их можно смешивать с водой в любых соотношениях (рис. 6.1). Бензин, керосин, масло, хлороформ и многие другие жидкости растворимы в воде незначительно, поэтому их считают практически нерастворимыми. Если такую жидкость, например растительное масло, вылить в воду и взболтать (рис. 6.2, а), то через некоторое время образуются два отдельных слоя — верхний (масло) и нижний (вода) (рис. 6.2, б). О таких жидкостях говорят, что они не смешиваются.
Газы также сильно отличаются по растворимости. Наиболее растворимы в воде гидроген хлорид HCl и аммиак NH3. При температуре 0 °С и атмосферном давлении в 1 л воды можно растворить 500 л гидроген хлорида и 1200 л аммиака! Растворимость других газов в воде значительно ниже. Так, при тех же условиях в 1 л воды растворяется лишь 1,7 л углекислого газа, 50 мл кислорода, 23 мл азота и 21,5 мл водорода. Наименее растворимым газом является гелий — 9,7 мл в 1 л воды.

Зависимость растворимости веществ от температуры
Растворимость веществ зависит от температуры. У большинства твердых веществ с повышением температуры она заметно увеличивается. Поваренная соль почти одинаково растворяется в холодной и горячей воде, а известь и гипс лучше растворимы в холодной воде.
При повышении температуры растворимость:
• твердых и жидких веществ увеличивается;
• газообразных веществ уменьшается.
Экспериментально установлено, что при температуре 0 °С в 100 г воды может раствориться не более 13 г калийной селитры KNO3, при 40 °С — 64 г, а при 100 °С — 244 г. Зависимость растворимости от температуры отображают на кривых растворимости (рис. 6.3).
Растворимость газообразных веществ, наоборот, с повышением температуры уменьшается (рис. 6.4). Если холодную водопроводную воду нагревать, не доводя до кипения, то на дне и стенках сосуда образуются пузырьки воздуха, который был растворен в воде и начал из нее выделяться.
Рис. 6.3. Зависимость растворимости некоторых твердых веществ от температуры: а — у большинства твердых веществ растворимость увеличивается; б — у некоторых — зависимость сложная
Рис. 6.4. Зависимость растворимости некоторых газов от температуры
Зависимость растворимости веществ от давления В отличие от жидкостей и твердых веществ, растворимость газов зависит от давления: газы значительно лучше растворяются при повышении давления. Скорее всего, вам приходилось открывать бутылку с газированной водой. В процессе приготовления газированных
напитков воду насыщают углекислым газом при повышенном давлении, а бутылку герметично закрывают. При открытии бутылки давление в ней понижается до атмосферного, растворимость углекислого газа резко уменьшается и избыточный углекислый газ начинает бурно выделяться.
При повышении давления растворимость:
• твердых и жидких веществ практически не меняется;
• газообразных веществ увеличивается.
Еще алхимики сформулировали один из главных принципов, определяющих растворимость веществ: подобное растворяется в подобном. Основываясь на этом принципе, можно объяснить, почему некоторые вещества растворяются в одном растворителе и не растворяются в другом. Веществ, которые растворялись бы абсолютно во всех растворителях, не существует. Так, полярные вещества хорошо растворяются в полярных растворителях (вода, этиловый спирт и др.), хуже растворяются в малополярных (ацетон и др.) и почти не растворяются в неполярных (бензол, петролейный эфир и др.). Например, сахар хорошо растворяется в воде и вообще не растворяется в бензоле. Наоборот, неполярные вещества хорошо растворяются в неполярных растворителях и плохо — в полярных. Например, сера нерастворима (и даже не смачивается) в воде, но хорошо растворяется в бензоле.
Во время азиатского похода весной 326 г. до н. э. войско Александра Македонского дошло до берегов реки Инд. Но, попав на территорию Индии, солдаты начали болеть кишечными инфекциями. Однако было замечено, что военачальники болели реже, чем солдаты, хотя в походах все жили в одинаковых условиях. Только через 2000 лет смогли объяснить этот факт: рядовые воины пили из оловянных чаш, а у начальников были серебряные. А серебро, хотя и в мизерном количестве, растворяется в воде, придавая ей бактерицидные свойства (в такой воде погибают бактерии). С XIX века до открытия антибиотиков такую воду использовали для промывания ран.
Ключевая идея
Некоторые вещества неограниченно растворяются в воде, но у большинства веществ растворимость ограничена. По этой характеристике выделяют растворимые, малорастворимые и практически нерастворимые вещества.
Контрольные вопросы
60. Приведите примеры растворимых и нерастворимых в воде кислот.
61. Назовите нерастворимые, малорастворимые и растворимые соли.
62. Какие вы знаете жидкости и газы, хорошо растворимые в воде?
63. Приведите примеры веществ, растворимость которых при нагревании: а) увеличивается; б) уменьшается; в) почти не меняется.
Задания для усвоения материала
64. Почему аквариумы нельзя наполнять кипяченой водой?
65. В воду случайно попал бензин. Как его можно отделить от воды? Будет ли вода иметь запах бензина, если разделение проводить путем:
а) отстаивания; б) дистилляции?
66. Какие из газов — кислород, гидроген хлорид, азот, аммиак, гелий — можно собирать: а) над водой; б) только вытеснением воздуха? Почему?
67. По кривой растворимости (рис. 6.3) определите, какую массу соли можно растворить в 1 кг воды: а) аргентум(1) нитрата при 0 °С; б) натрий нитрата при 20 °С; в) купрум(И) сульфата при 30 °С; г) плюмбум(И) хлорида при 100 °С; д) калий нитрата при 10 °С и 50 °С.
68. По рисунку 6.3 определите: а) соль с наименьшей растворимостью;
б) соль, растворимость которой наибольшая при 0 °С и 20 °С; в) соль, растворимость которой наиболее зависит от температуры; г) соль, растворимость которой наименее зависит от температуры.
69. По рисунку 6.3 сравните растворимость купрум(П) сульфата и натрий хлорида при температурах 20 °С и 80 °С.
70. В воде при 80 °С растворили максимальное количество натрий нитрата. Раствор охладили до комнатной температуры. Что можно наблюдать?
71. При изготовлении сильногазированной воды в одной бутылке объемом 1 л растворяют около 1600 мл углекислого газа. В такой открытой бутылке в растворенном состоянии остается около 880 мл углекислого газа. Какой объем углекислого газа выделится при открывании бутылки сильногазированной воды объемом 1 л? Больше или меньше газа выделится, если бутылку предварительно охладить? нагреть?
72. В лаборатории перед занятием по химическим свойствам углекислого газа приготовили известковую воду. Для этого в воде массой 150 г растворили максимально возможное количество кальций гидроксида. Вычислите, какую максимальную массу осадка можно получить при пропускании углекислого газа через приготовленный раствор. Для расчетов воспользуйтесь информацией из рисунка 6.3, учитывая, что температура в лаборатории была 20 °С.
73. При комнатной температуре в воде объемом 1 л максимально растворяется 6,3 • 10-3 моль барий флуорида. Вычислите массу такого количества вещества барий флуорида.
74. По материалам параграфа определите, какими веществами (растворимыми, малорастворимыми или практически нерастворимыми) являются: а) аммиак; б) углекислый газ; в) кислород. Ответ поясните.
75. По рисунку 6.3 определите, на сколько больше (по массе) калий нитрата можно максимально растворить в 100 г воды при температуре 60 °С, чем при 30 °С.
76. Предложите план эксперимента для определения растворимости вещества в воде. Какие измерения вы должны провести для достижения цели? Какие факторы будут влиять на точность эксперимента?
Это материал учебника Химия 9 класс Григорович
mozok.click
Растворимость — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Зависимость растворимости веществ от температуры выражается с помощью кривых растворимости. По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе-приводит к образованию некоторых минералов, участвует в процессах, протекающих в горных породах.
Способы выражения характеристик растворимости
Характеристики растворимости подразделяются на качественные и количественные.
Качественные характеристики определяют мнение исследователя в отношении растворимости данного вещества — хорошо растворимо, плохо растворимо, мало растворимо, нерастворимо и т.п., и являются субъективными. Попытка сделать их более объективными была сделана в Государственной фармакопее СССР для обозначения растворимости лекарственных средств, но она не получила распространения.
Количественные характеристики определяют количество вещества, растворённого в данном количестве растворителя при данных условиях и обычно имеют размерности концентрации (моль/л, г/100 г растворителя, г/100 г раствора, г/кг растворителя, мольная доля и т.д.).
Качественная и количественная растворимость приводится в справочной литературе.
Влияние условий на растворимость
Для определения качественной растворимости часто используется эмпирическое правило «подобное растворяется в подобном». Это правило разные источники объясняют немного по разному: полярные вещества растворяются в полярных растворителях, вещества имеющие гидроксильные группы хорошо растворяются в растворителях с гидроксильными группами и т.п.
Растворимость зависит от растворяемого вещества, растворителя, температуры, давления, наличия в растворителе других веществ.
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твердых и жидких веществ влияние давления на растворимость менее значимо, чем для газов.
Температура имеет различное влияние на различные системы «растворяемое вещество — растворитель», но в большинстве случаев при увеличении температуры растет растворимость (обратной зависимостью обладают, например, многие соли кальция). Так как растворяемое вещество часто увеличивает температуру кипения растворителя, растворимость при атмосферном давлении может быть измерена и выше температуры кипения растворителя. При повышенном давлении и температуре растворимость может сильно увеличиваться (например, в воде при высоком давлении и температуре относительно хорошо растворяются углеводороды и кварц, которые почти нерастворимы при обычных условиях).
Наличие в растворителе других веществ может сильно влиять на растворимость. Примеры: 1) добавление в водный раствор неполярных веществ солей может привести к выделению неполярного вещества в осадок, за счет эффекта высаливания, 2) наличие растворённого кислорода сильно влияет на растворимость ртути в воде за счет эффектов поверхностного окисления, 3) наличие небольшого количества влаги в абсолютном этаноле может сильно изменить растворимость неполярных веществ.
Энергетические эффекты при растворении
Растворение веществ часто происходит с разогреванием или охлаждением раствора.
Способы измерения растворимости
Самым старым способом измерения растворимости является растворение вещества до его выпадения в осадок, выдерживание такой смеси при определенной температуре, отделение осадка и вычисление растворившегося вещества.
В современных условиях для измерения очень малых значений растворимости часто пользуются хроматографическими системами.
При измерениях растворимости важно учесть все факторы, которые могут повлиять на растворимость.
Напишите отзыв о статье «Растворимость»
Литература
- Химическая энциклопедия. — Т. 4. — М.: Большая российская энциклопедия, 1995
См. также
- [http://www.chemport.ru/data/data6.shtml Таблица растворимости] (рус.)
- Произведение растворимости
- Константа равновесия
- Ионная жидкость
- [http://www.alfametal.ru/?id=prozrast Произведения растворимости (ПР)] (рус.) (водная среда, 25 °С)
- [http://www.catalogmineralov.ru/cont/rgwater.html Растворимость газов] (рус.)
- [http://www.chemport.ru/data/data15.shtml Растворимость некоторых газов в воде при нормальных условиях] (рус.)
Отрывок, характеризующий Растворимость
– Разве тебе что-то непонятно? – удивилась девочка.– Говоря честно – ещё как! – откровенно воскликнула я.
– Но ты же можешь намного больше? – ещё сильнее удивилась малышка.
– Больше?.. – ошарашено спросила я.
Она кивнула, смешно наклонив в сторону свою рыжую головку.
– Кто же тебе всё это показал? – осторожно, боясь чем-то её нечаянно обидеть, спросила я.
– Ну, конечно же бабушка. – Как будто что-то само собой разумеющееся сказала она. – Я была в начале очень грустной и одинокой, и бабушке было меня очень жалко. Вот она и показала мне, как это делается.
И тут я, наконец, поняла, что это и вправду был её мир, созданный лишь силой её мысли. Эта девочка даже не понимала, каким сокровищем она была! А вот бабушка, я думаю, как раз-то понимала это очень даже хорошо…
Как оказалось, Стелла несколько месяцев назад погибла в автокатастрофе, в которой погибла также и вся её семья. Осталась только бабушка, для которой в тот раз просто не оказалось в машине места… И которая чуть не сошла с ума, узнав о своей страшной, непоправимой беде. Но, что было самое странное, Стелла не попала, как обычно попадали все, на те же уровни, в которых находилась её семья. Её тело обладало высокой сущностью, которая после смерти пошла на самые высокие уровни Земли. И таким образом девочка осталась совершенно одна, так как её мама, папа и старший брат видимо были самыми обычными, ординарными людьми, не отличавшимися какими-то особыми талантами.
– А почему ты не найдёшь кого-то здесь, где ты теперь живёшь? – опять осторожно спросила я.
– Я нашла… Но они все какие-то старые и серьёзные… не такие как ты и я. – Задумчиво прошептала девчушка.
Вдруг она неожиданно весело улыбнулась и её милая мордашка тут же засияла ярким светлым солнышком.
– А хочешь, я покажу тебе, как это делать?
Я лишь кивнула, соглашаясь, очень боясь, что она передумает. Но девчушка явно не собиралась ничего «передумывать», наоборот – она была очень рада, найдя кого-то, кто был почти что её ровесником, и теперь, если я что-то понимала, не собиралась так легко меня отпускать… Эта «перспектива» меня полностью устраивала, и я приготовилась внимательно слушать о её невероятных чудесах…
– Здесь всё намного легче, чем на Земле, – щебетала, очень довольная оказанным вниманием, Стелла, – ты должна всего лишь забыть о том «уровне», на котором ты пока ещё живёшь (!) и сосредоточиться на том, что ты хочешь увидеть. Попробуй очень точно представить, и оно придёт.
Я попробовала отключиться от всех посторонних мыслей – не получилось. Это всегда давалось мне почему-то нелегко.
Потом, наконец, всё куда-то исчезло, и я осталась висеть в полной пустоте… Появилось ощущение Полного Покоя, такого богатого своей полнотой, какого невозможно было испытать на Земле… Потом пустота начала наполняться сверкающим всеми цветами радуги туманом, который всё больше и больше уплотнялся, становясь похожим на блестящий и очень плотный клубок звёзд… Плавно и медленно этот «клубок» стал расплетаться и расти, пока не стал похожим на потрясающую по своей красоте, гигантскую сверкающую спираль, конец которой «распылялся» тысячами звёзд и уходил куда-то в невидимую даль… Я остолбенело смотрела на эту сказочную неземную красоту, стараясь понять, каким образом и откуда она взялась?.. Мне даже в голову не могло прийти, что создала это в своём воображении по-настоящему я… И ещё, я никак не могла отвязаться от очень странного чувства, что именно ЭТО и есть мой настоящий дом…
– Что-о это?.. – обалдевшим шёпотом спросил тоненький голосок.
Стелла «заморожено» стояла в ступоре, не в состоянии сделать хотя бы малейшее движение и округлившимися, как большие блюдца глазами, наблюдала эту невероятную, откуда-то неожиданно свалившуюся красоту…
Вдруг воздух вокруг сильно колыхнулся, и прямо перед нами возникло светящееся существо. Оно было очень похожим на моего старого «коронованного» звёздного друга, но это явно был кто-то другой. Оправившись от шока и рассмотрев его повнимательнее, я поняла, что он вообще не был похож на моих старых друзей. Просто первое впечатление «зафиксировало» такой же обруч на лбу и похожую мощь, но в остальном ничего общего между ними не было. Все «гости», до этого приходившие ко мне, были высокими, но это существо было очень высоким, вероятно где-то около целых пяти метров. Его странные сверкающие одежды (если их можно было бы так назвать) всё время развевались, рассыпая за собой искрящиеся хрустальные хвосты, хотя ни малейшего ветерка вокруг не чувствовалось. Длинные, серебряные волосы сияли странным лунным ореолом, создавая впечатление «вечного холода» вокруг его головы… А глаза были такими, на которые лучше никогда бы не выпало смотреть!.. До того, как я их увидела, даже в самой смелой фантазии невозможно было представить подобных глаз!.. Они были невероятно яркого розового цвета и искрились тысячью бриллиантовых звёздочек, как бы зажигающихся каждый раз, когда он на кого-то смотрел. Это было совершенно необычно и до умопомрачения красиво…
o-ili-v.ru
Растворимость — это… Что такое Растворимость?
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
| Анионы | Катионы | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Pb2+ | Sn2+ | Cu2+ | |
| OH− | P | P | P | Р | P | M | H | M | H | H | H | H | H | H | H | H | Р | Р | H | H | H | |
| F− | P | P | P | P | P | M | H | H | M | P | H | H | H | P | P | M | P | P | M | H | P | P |
| Cl− | Р | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
См. также
|
Растворимость кислот, оснований и солей в воде |
|
|---|---|
|
{| border=»0″ cellpadding=»0″ cellspacing=»1″ |- | | | |H+ | |Li+ | |K+ | |Na+ | |NH4+ | |Ba2+ | |Ca2+ | |Mg2+ | |Sr2+ | |Al3+ | |Cr3+ | |Fe2+ | |Fe3+ | |Ni2+ | |Co2+ | |Mn2+ | |Zn2+ | |Ag+ | |Hg2+ | |Hg22+ | |Pb2+ | |Sn2+ | |Cu+ | |Cu2+ |- | OH− | | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н |- | |F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |- | |Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |- | |Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |- | |I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |- | |S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |- | |SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |- | |SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |- | |NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |- | |NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |- | |PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |- | |CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |- | |CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |- | |CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |- | |SiO32− | H | Н | P | P | Силикат аммония| ? | Н | Н | Н | Н | Силикат алюминия(III)|? | Силикат хрома(III)|? | Н | Силикат железа(III)|? | Силикат никеля|? | Силикат кобальта(II)|? | Н | Н | Силикат серебра(I)|? | Силикат ртути(II)|? | ? | Н | Силикат олова(II)|? | Силикат меди(I)|? | Силикат меди(II)|? |} |
dic.academic.ru
Растворимость — Википедия
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Зависимость растворимости веществ от температуры выражается с помощью кривых растворимости. По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе-приводит к образованию некоторых минералов, участвует в процессах, протекающих в горных породах.
Способы выражения характеристик растворимости[ | ]
Характеристики растворимости подразделяются на качественные и количественные.
Качественные характеристики определяют мнение исследователя в отношении растворимости данного вещества — хорошо растворимо, плохо растворимо, мало растворимо, нерастворимо и т. п., и являются субъективными. Попытка сделать их более объективными была сделана в Государственной фармакопее СССР для обозначения растворимости лекарственных средств, но она не получила распространения.
Количественные характеристики определяют количество вещества, растворённого в данном количестве растворителя при данных условиях и обычно имеют размерности концентрации (моль/л, г/100 г растворителя, г/100 г раствора, г/кг растворителя, мольная доля и т. д.).
Качественная и количественная растворимость приводится в справочной литературе.
Влияние условий на растворимость[ | ]
Для определения качественной растворимости часто используется эмпирическое правило «подобное растворяется в подобном». Это правило разные источники объясняют немного по разному: полярные вещества растворяются в полярных растворителях, вещества имеющие гидроксильные группы хорошо растворяются в растворителях с гидроксильными группами и т. п.
Растворимость зависит от растворяемого вещества, растворителя, температуры, давления, наличия в растворителе других веществ.
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твердых и жидких веществ влияние давления на растворимость менее значимо, чем для газов.
Температура имеет различное влияние на различные системы «растворяемое вещество — растворитель», но в большинстве случаев при увеличении температуры растет растворимость (обратной зависимостью обладают, например, многие соли кальция). Так как растворяемое вещество часто увеличивает температуру кипения растворителя, растворимость при атмосферном давлении может быть измерена и выше температуры кипения растворителя. При повышенном давлении и температуре растворимость может сильно увеличиваться (например, в воде при высоком давлении и температуре относительно хорошо растворяются углеводороды и кварц, которые почти нерастворимы при обычных условиях).
Наличие в растворителе других веществ может сильно влиять на растворимость. Примеры: 1) добавление в водный раствор неполярных веществ солей может привести к выделению неполярного вещества в осадок, за счет эффекта высаливания, 2) наличие растворённого кислорода сильно влияет на растворимость ртути в воде за счет эффектов поверхностного окисления, 3) наличие небольшого количества влаги в абсолютном этаноле может сильно изменить растворимость неполярных веществ.
Энергетические эффекты при растворении[ | ]
Растворение веществ часто происходит с разогреванием или охлаждением раствора.
Способы измерения растворимости[ | ]
Самым старым способом измерения растворимости является растворение вещества до его выпадения в осадок, выдерживание такой смеси при определенной температуре, отделение осадка и вычисление растворившегося вещества.
В современных условиях для измерения очень малых значений растворимости часто пользуются хроматографическими системами.
При измерениях растворимости важно учесть все факторы, которые могут повлиять на растворимость.
Литература[ | ]
- Химическая энциклопедия. — Т. 4. — М.: Большая российская энциклопедия, 1995
См. также[ | ]
encyclopaedia.bid
Растворимость зависимость от давления — Справочник химика 21
Зависимость растворимости от давления и температуры [c.98]
В соответствии с законом Томсона (Гиббса — Фрейндлиха — Оствальда для растворов, см. гл. I, 3) увеличение химического потенциала вещества малых частиц по сравнению с объемной фазой Ац = 2(тГ, г приводит к зависимостям давления пара/ и растворимости с от размера частиц, описываемым соотношениями [c.324]
Неограниченно растворимые жидкости, не подчиняющиеся закону Рауля, с положительными или отрицательными отклонениями и с максимумом или минимумом на кривой зависимости давления насыщенного пара от состава раствора. Диаграммы состояния, второй закон Коновалова. Для некоторых систем отклонения от закона Рауля могут быть так велики, что на кривой зависнмости общего давления от состава системы появляются точки, в которых давление пара больше, чем давление паров чистого более летучего компонента (при положительных отклонениях), или меньше, чем давление пара чистого менее летучего компонента (при отрицательных отклонениях). В результате на кривой общего давления появляются максимум или минимум (рис. 6.10 и 6.11). Поля, линии, точки на диаграммах имеют тот же смысл, что и на диаграммах для идеальных систем. Отличие заключается в том, что на диаграммах кипения для систем данного типа имеются азеотропные точки (точка С на рис. 6.11). К системам с азеотропами применим второй закон Коновалова [c.98]Какое заключение о зависимости растворимости от давления и состава газа можно сделать по данным, полученным при изучении растворимости в воде чистой двуокиси углерода и двуокиси углерода из смесей ее с водородом (i = 0 объем СО2 выражен в нм на 1 воды) (табл. 10). [c.179]
Растворимость газов в жидкостях. Зависимость растворимости от давления. Растворимость измеряется концентрацией растворенного вещества в насыщенном растворе, т. е. при условии равновесия между раствором и растворяющимся веществом при данной температуре и данном давлении. [c.194]
Лекция 19. Ограниченная взаимная растворимость жидкостей, ия ние температуры на взаимную растворимость. Зависимость давления насыщенного пара от состава в жидких системах с ограниченной растворимостью. [c.210]
Так как Хпл>0, то идеальная растворимость твердого вещества увеличивается с ростом температуры. В уравнение Шредера входят только величины, зависящие от растворенного вещества, поэтому растворимость не зависит от вида растворителя. При постоянной температуре зависимость идеальной растворимости от давления дается формулой (IV.38) [c.104]
Плотность надкритического газа, связанная с его растворяющей способностью, зависит от давления значительно сильнее, чем плотность жидких растворителей. И этим объясняется сложный вид кривой, показывающей зависимость растворимости веществ давления при постоянной температуре ветвь кривой соответствует конденсации [c.6]
В общем случае термодинамический расчет зависимости растворимости от давления возможен при знании зависимости активности растворенного вещества от концентрации раствора при данной температуре и различных давлениях. [c.240]
При ограниченной взаимной растворимости двух жидкостей кривые парциальных давлений паров принимают характерную форму. Схема зависимости давлений пара от состава при постоянной температуре показана на рис. Х ,4. Точкам а и Р отвечают соответственно давления насыщенных паров А и В. [c.400]
Газы в жидкостях растворяются ограниченно. Растворимость зависит как от их природы, так и от природы жидкости. Неполярные газы растворяются, как правило, лучше в неполярных растворителях, чем в полярных. При этом те из них растворяются больше, которые имеют высокую критическую температуру сжижения. На растворимость газов сильно влияют давление и температура. Зависимость растворимости от давления выражается законом Генри. Согласно уравнению (ХП.7) [c.194]
Выше было показано, что зависимость коэффициента растворимости от давления определяется коэффициентом активности компонента в газовой фазе и парциальным мольным объемом растворенного газа в полимере [c.96]
В гомогенной области характер зависимости давления или температуры от состава такой же, как для систем, компоненты которых полностью растворимы друг в друге. [c.75]
Решение. Так как == 25 соответствует температуре выше ( кр)сн, ( м. табл. 10, с. 202), для вычисления экстраполируем экспериментальные данные по температурной зависимости давления насыщенного пара до 1/Т = 1 (273,2 -f 25) = 0,00335 тогда получим фиктивное значение Р 370. Отсюда растворимость СН4 в любом растворителе, когда парциальное давление метана над рас- [c.273]
При снижении температуры происходит резкое увеличение растворимости в метаноле и возрастает селективность абсорбции. Десорбция осуществляется путем снижения давления без подогрева. Теплота растворения СО в метаноле составляет 16,55 кДя/моль (4,5 ккал/моль). Зависимость растворимости от давления выражается уравнением [c.231]
Зависимость растворимости от давления при данной температуре выражается уравнением [c.174]
Уравнение Рауля позволяет установить зависимость давления пара над чистым твердым растворенным веществом от его растворимости в идеальном растворе. [c.214]
По характеру зависимости давления насыщенных паров от состава раствора при постоянной температуре неограниченно растворимые жидкости разделяют на три типа 1) идеальные, подчиняющиеся закону Рауля 2) с положительными или отрицательными отклонениями от закона Рауля, но без максимума или минимума на кривой зависимости давления насыщенного пара от состава раствора 3) с максимумом или минимумом на кривой зависимости давления насыщенного пара от состава раствора. [c.93]Определить растворимость этана в идеальном растворе при Р = 1 и = 35, если для температурной зависимости давления насыщенного пара этана можно воспользоваться уравнением [c.177]
В идеальных растворах зависимость растворимости от давления выражается уравнением [c.82] Аналогично можно выразить, зависимость давления газа над раствором от температуры при заданной концентрации растворенного вещества или растворимости газа при заданном постоянном давлении. В большинстве случаев растворимость хорошо растворимых газов уменьшается при увеличении температуры (в достаточно широком интервале температур может проходить через минимум). Растворимость мало растворимых газов (например, водорода) во многих случаях возрастает при увеличении температуры. [c.28]Решение. Зависимость растворимости от давления не может быть выражена уравнением (VII, 7), так как растворимость растет медленее, чем давление. Кроме того, при одинаковом давлении растворимость чистой СО2 и СО2 из смесей различного состава неодинакова, т. е. закон Дальтона неприменим. [c.179]
Если пренебречь влиянием водорода на равновесие в системе азот — окись углерода, расчет такого процесса можно проводить но данным для двойной смеси [30]. На рис. УП-10 приведена рассчитанная по этим данным зависимость давления окиси углерода над раствором от ее концентрации в жидком азоте при различных температурах. Как видно из рисунка, растворимость окиси углерода [c.359]
Изменения давления газа или пара при определении проницаемости в пределах нескольких атмосфер не влияет на коэффициент проницаемости. При более высоких давлениях следует учитывать отклонение линейной зависимости растворимости от давления по закону Генри, а также уменьшение значений коэффициентов диффузии с увеличением плотности упаковки полимера 77-179, 181, 182, 184, 199 [c.241]
Анализируя растворимость веществ различного агрегатного состояния, следует отметить, что при растворении твердых и жидких веществ объем раствора обычно изменяется незначительно. Поэтому растворимость твердых и жидких веществ, как правило, не зависит от давления. При растворении газообразных веществ объем системы существенно уменьшается, и это предопределяет зависимость их растворимости от давления, причем повышение давления в соответствии с принципом Ле Шателье приводит к увеличению растворимости газа. [c.142]
Вначале рассмотрим зависимость растворимости от давления. При давлениях, близких к атмосферному, растворимость газов в воде растет обычно пропорционально давлению (закон Г енри в первоначальной формулировке). При повышенных давлениях такая зависимость соблюдается для легких газов (водород, гелий) с удовлетворительной точностью до 10 МПа. При более высоких давлениях растворимость ниже, чем она должна была бы быть по закону Г енри в первоначальной формулиров- [c.58]
Растворимость водорода возрастает с увеличением давления. В интервале давлений, при котором работают ТЭ, зависимость растворимости от давления водорода подчиняется ура,вне-нию Генри. [c.65]
При постоянной температуре зависимость растворимости от давления для растворов, падчвняпцихся закону Рвуля, выражается урав- [c.30]
Одним 113 основных параметров оценки межмолекулярного взаимодействия компонентов нефти, удобных для практических целей, является плотность энергии когезии, численно равная от-нощению энтальпии испарения жидкого компонента к его мольному объему [36]. Необходимые данные об энтальпиях испарения для расчета плотности энергии когезии и соответственно параметра растворимости жидких компонентов можно определить либо из непосредственных калориметрических данных, либо по температурной зависимости давления насыщенного пара, описываемой известным уравнением Клаузиуса — Клапейрона, либо по эмпирическим формулам через температуру кипения компонента. Однако энтальпию испарения экспериментально можно определить липль для углеводородов, испаряющихся без разложения. Для тех соединений, температура деструкции которых ниже температуры кипения, приемлемы методы расчета параметра растворимости на основе инкрементов плотности когезии отдельных групп атомов (ЛЯ ) [37] [c.20]
Неограниченно растворимые жидкости, не подчиняющиеся закону Рауля, с положительными или отрицательными отклонениями, но без максимума или минимума на кривой зависимости давления насыщенного пара от состава раствора. Диаграммы состояния. Большинство растворов проявляют отклонения от закона Рауля, которые могут быть положительными и отрицательными (см. 5.10). Образование растворов с положительными отклонениями сопровождается поглощением теплоты, что облегчает испарение. Поэтому давление пара над системой оказывается большим, чем вычисленное по закону Рауля. Положительные отклонения характерны для большинства гомоген- [c.96]
Растворимость СОг в воде составляет (по объему) 1,71 при 0°С 0,88 при 20 °С 0,36 при 60 °С. Зависимость растворимости от давления показана на рис. У-З. Следует отметить медленность установления приведенного в основном тексте равновесия реакции углекислого газа с водой. В равновесии с воздухом вода содержит около 0,0005 г/л двуокиси углерода и за счет ее растворения приобретает pH = 5,7, а насыщенный при обычных условиях водный раствор является приблизительно 0,04 М относительно СОг и имеет pH = 3,7. Из насыщенного на холоду раствора может быть выделен кристаллогидрат СОг-бНгО, являющийся аддуктом (V 2 доп. 3). Вместе с тем для угольной кислоты известен устойчивый лишь ниже 5°С эфират (СгН5)20-Н2С0з (т. пл. —47°С). [c.508]
Для определения давления образования кристаллогидратов можно использовать зависимости давления от температуры (рис. 2). Фазы, возникающие при расслоении газовых смесей. В гомогенных газовых смесях, находящихся при высоких давлениях, возможно возникновение двух ограниченно растворимых фаз при повышении давления (рис. 3). Как видно из рисунка при температуре 350 °С кривая АВКСА есть обычная кривая равновесия жидкость—пар, АВК — ветвь жидкости, АСК — ветвь пара. Если давление начинает превышать давление точки К. то [c.7]
Основы методов исследования отдельных свойств нефтей при пластовых условиях на аппаратуре всех типов одинаковы и подробно изложены в литературеАппаратура, предназначенная для определения физических характеристик пластовых нефтей, допускает проведение комплекса исследований, включающего пять этапов 1) однократное выделение газа (разгазирование) 2) ступенчатое разгазирование 3) определение зависимости давление — объем 4) определение вязкости 5) определение температуры насыщения нефти парафином. На основании полученных данных могут быть рассчитаны следующие характеристики пластовой нефти давление насыщения, коэффициент сжимаемости, газосодержание, плотность, объемный коэффициент и усадка, растворимость газа в нефти. По данным ступенчатого разгазирования могут быть получены зависимости между давлением и газосодержанием, давлением (или газосодержанием) и объемным коэффициентом, давлением (или газосодержанием) и плотностью нефти, давлением и плотностью выделяющегося газа. Кроме того, можно получить зависимость между давлением (или газосодержанием) и температурой насыщения нефти парафином, а также давлением (или газосодержанием) и вязкостью нефти. Эта аппаратура не рассчитана на проведение исследований изменения свойств нефтей при термических методах разработки залежей. [c.9]
Растворимость газа при хемосорбции зависит от зической растворимости газа, константы равновесия химическои реакции, стехиометрических соотношений при реакции и других факторов. Кроме того, растворы хемосорбентов во многих.случаях являются сильными или слабыми электролитами, к которым неприменимы уравнения теории разбавленных растворов И. Р. Кричевского. Характерная особенность растворимости газов в хемосорбентах заключается в неравномерном росте растворимости при увеличении давления чем выше давление, тем медленнее (по мере расхода хемосорбента) повышается растворимость. Зависимость растворимости газа от его парциального давления в данном случае более сложная, чем при физической абсорбции, и не может быть описана приведенными выше уравнениями. [c.32]
На рис. 1У-78 показана зависимость растворимости СО в аминопоташных растворах от содержания ДЭА. Зависимость давления паров воды над растворами поташа и ДЭА от степени карбонизации раствора показана на рис. 1У-79 данные по растворимости СО в 30%-ных растворах К2СО3 приведены на рис. 1У-80. [c.253]
Зависимость растворимости от давления подчиняется тем же закономерностя М, которые были сформулированы выше для смещения физико-химического равш>весия. Когда процесс растворения сопровождается уменьшением объема, повышение дав- [c.85]
chem21.info
