Углерод
Карбон (С) или углерод — химический элемент с атомным номером 6. Сказывается С, относится к числу распространенных элементов земной коры, составляя около 0,1% ее массы. Соединения углерода является основой всех растительных и животных организмов.
1. История
Углерод в виде древесного угля применялся в древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
На рубеже XVII-XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером, и Георгом Шталь. Эта теория признавала наличие в каждом горючей теле особого элементарного вещества — невесомого флюида — флогистона, которая испаряется в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистикы считали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистувальну» действие угля — его способность восстанавливать металлы из «вапен» и руд. Позднейшие флогистикы, Реомюра, Бергман и другие, уже начали понимать, что уголь является элементарной веществом. Однако впервые таким «чистый уголь» было признано Антуаном Лавуазье, исследовавший процесс сжигания в воздухе ат кислороде угля и других веществ. В книге Гитоном где Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» и в «Элементарный учебник химии» Лавуазье.
1791 английский химик Теннант первым получил свободный углерод, он пропускал пары фосфора над прокаленной мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Еще 1751 французский король Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает только алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательного линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большого зажигательного машины и пришел к выводу, что алмаз представляет собой кристаллический углерод. Второй алотроп углерода, графит, в алхимическом периоде считался видоизмененным свинцовым блеском и назывался plumbago, только 1740 Потт обнаружил отсутствие в граффити юудь всякой примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, признал его сернистым телом особого рода, особым минеральным углем, содержащий связанную «воздушную кислоту» (СО 2) и большое количество флогистона.
Двадцать лет спустя Гитоном где Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
2. Общая характеристика
При обычных условиях углерод химически инертен, при высоких температурах соединяется со многими элементами, проявляя сильные восстановительные свойства. Важнейшее свойство углерода — способность его атомов образовывать прочные химические связи как между собой, так и с другими элементами. Способность углерода образовывать 4 равнозначные валентные связи с другими атомами позволяет строить углеродные скелеты различных типов (линейные, разветвленные, циклические), именно этими свойствами и объясняется исключительная роль углерода в строении органических соединений и, в частности, всех живых организмов.
3. Физические свойства
3.1. Изотопы
Природный углерод состоит из двух стабильных изотопов — 12 С (98,93%) и 13 С (1,07%) и одного радиоактивного изотопа 14 С (β-излучатель, Т = 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции 14 N (n, p) 14 C, а также с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На создании и распаде 14 С основан метод радиоуглеродного датирования, широко применяется в четвертичной геологии и археологии.
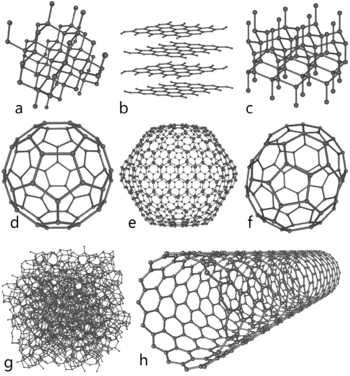
3.2. Аллотропных видоизменения
Углерод образует несколько аллотропных видоизменений:
- природные:
- искусственные:
3.2.1. Алмаз
Прозрачная и бесцветная или слегка окрашенная примесями в разнообразные оттенки кристаллическое вещество. Он ярко блестит из-за сильного преломления лучей.
Алмаз — самое твердое вещество среди всех известных. Благодаря своей чрезвычайной твердости он широко применяется при бурении твердых горных пород, обработке твердых металлов и их сплавов и т.д.. Отшлифованные бесцветные кристаллы алмаза — бриллианты — драгоценные украшения.
Крупнейшие месторождения алмазов расположены в Южной Африке и в Якутии. Ежегодная мировая добыча алмаза составляет около 300 кг. В последние годы алмаз начали получать искусственно при очень высоких давлениях и высокой температуре.
3.2.2. Графит
Темно-серая непрозрачная мелкокристаллическая вещество, жирная на ощупь. В отличие от алмаза графит хорошо проводит электрический ток и тепло и очень мягкий. Графит в больших количествах получают искусственно — нагреванием кокса или антрацита в специальных электрических печах при температуре около 3000 C и повышенном давлении без доступа воздуха. Искусственный графит отличается высокой чистотой и мягкостью. По своим качествам он лучше естественный. Графит широко применяется для изготовления электродов, в смеси с глиной для производства огнеупорных тиглей. С графита делают обычные карандаши. В смеси с минеральным маслом его используют для смазки машин, работающих при повышенных температурах.
Резкое различие в физических свойствах алмаза и графита объясняется их разной кристаллическим строением. В кристаллах алмаза каждый атом углерода окружен четырьмя другими атомами, расположенными на одинаковом расстоянии друг от друга. В кристаллах графита атомы углерода расположены в углах правильных шестиугольников в одной плоскости и образуют отдельные слои. Расстояние между отдельными слоями больше, чем между атомами в том же слое. Вследствие этого связь между отдельными слоями значительно слабее, чем между атомами того же слоя. Поэтому кристаллы графита легко расщепляются на отдельные чешуйки, которые сами по себе достаточно крепкие.
3.2.3. Графен
Графен по своему строению — отдельный атомный слой в структуре графита — атомы углерода образуют сотовую структуру с межатомного расстоянием 142 пм. Без опоры графен имеет тенденцию сворачиваться, но может быть устойчивым на пидкладинци.
3.2.4. Карбин
Искусственно полученный разновидность углерода, который представляет собой мелкокристаллический порошок черного цвета, кристаллическая структура характеризуется наличием длинных цепочек атомов углерода, расположенных параллельно. Плотность 3,23-3,30.
3.2.5. Фуллерен
Специфическая углеродная структура, молекула которой имеет вид мяча. Внутренняя часть молекулы пуста, что обуславливает широкие возможности для получения на основе фуллерена соединений включения.
Фуллерены C60 Кристаллы
3.2.6. Углеродные нанотрубки
Специфическая углеродная структура, в которой атомы углерода образуют поверхность «скручена» в трубку наноразмеров. Имеет уникальные физические свойства, в частности прочность на разрыв, адсорбционную способность. Активно исследуется и имеет большие перспективы для использования. Углеродные нанотрубки обнаружены в природе ( шунгит) и получены искусственно.
3.2.7. Аморфный углерод
Состояние углерода с неупорядоченной структурой — (сажа, кокс, древесный уголь). В природе не встречается. Его получают искусственно из различных соединений, содержащих углерод. Аморфный углерод, или просто аморфное угля, на самом деле является кристаллическим, но его кристаллики такие маленькие, что их не видно даже в микроскоп. Физические свойства «аморфного» углерода в значительной степени зависят от дисперсности частиц и от наличия примесей.
Важнейшими техническими сортами аморфного углерода является сажа и древесный уголь. Сажа представляет собой чистый аморфный углерод. В промышленности сажу получают в основном термическим разложением метана, а также при сжигании различных органических веществ при недостаточном доступе воздуха. Сажу широко применяют как наполнитель в производстве резины с каучука, а также для изготовления печатных красок, туши и т.д..
Древесный уголь добывают нагреванием дерева без доступа воздуха в специальных печах. Его применяют в металлургии для получения высоких сортов чугуна и стали, в кузнечном деле, для изготовления черного пороха и как адсорбент.
3.2.8. Лонсдейлит
Лонсдейлит обнаружен в метеоритах и получен искусственно; его структура и физические свойства окончательно не установлены.
4. Химические свойства
Химическая активность различных аллотропных видоизменений углерода различна. Алмаз и графит почти не вступают в химические реакции. Они могут реагировать только с чистым кислородом и только при очень высокой температуре.
Аморфный углерод, а также угля при обычной температуре достаточно инертны, но при сильном нагревании их активность резко возрастает и углерод непосредственно соединяется со многими элементами. Так, при нагревании на воздухе угля горит, образуя диоксид углерода :
При недостаточном доступе кислорода воздуха он частично сгорает до монооксида углерода CO, в котором углерод двухвалентный:
Когда через раскаленные угли пропускать пары серы, то образуется сероуглерод :
При высокой температуре угля достаточно сильный восстановитель. Оно отнимает кислород от окислов многих металлов. Например:
- 2CuO + C = 2Cu + CO 2 ↑
Через эту способность, уголь широко применяют в металлургии для получения металлов из руд.
Степени окисления +4, -4, редко +2 (С, карбиды металлов), +3 (C 2 N 2, галогенцианы) сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 до С 4 + соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
4.1. Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических. Крупнейшие группы: углеводороды, белки, жиры и др..
5. Распространение
Углерод в природе встречается как в свободном состоянии ( алмаз, графит, карбина и лонсдейлит, фуллерен, углеродные нанотрубки), так и в виде различных соединений. Среднее содержание углерода в земной коре 2,3 10 -2% (масс) основная масса углерода концентрируется в осадочных горных породах. Углерод накапливается в верхней части земной коры, где его присутствие связано в основном с живым веществом, каменным углем, нефтью, антрацитом, а также доломитами и известняками. Известно более 100 минералов углерода, среди которых наиболее распространены карбонаты кальция, магния и железа. Он входит в состав каменного угля, нефти и природного газа, а также различных минералов: мрамора, мела и известняка — CaCO 3, доломита — CaCO 3 MgCO 3, магнезита — MgCO 3, малахита — CuCO 3 Cu (OH) 2 и т.д..
Важную роль углерод играет в космосе, на Солнце углерод занимает 4-е место по распространенности после водорода, гелия и кислорода, ядра углерода участвуют в процессах нуклеосинтеза ( углеродно-азотный цикл, тройная α-реакция).
Большинство соединений углерода, и прежде углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существование огромного числа углеродсодержащих соединений, изучаемых органической химией.
В природе встречается минерал шунгит, в котором содержится как твердый углерод (≈ 25%), так и значительные количества оксида кремния (≈ 35%).
6. Биологическая роль
Соединения углерода является основой всех растительных и животных организмов.
7. Применение
Древесный уголь обладает способностью адсорбировать (поглощать) на своей поверхности различные газы и некоторые вещества из растворов. Адсорбция происходит поверхностью угля, поэтому оно способно поглощать (адсорбировать) тем большее количество веществ, чем больше его суммарная поверхность, т.е. чем больше оно дробленые или пористое. Пористость, а вместе с тем и адсорбционная способность древесного угля резко увеличивается при предварительном нагреве в струе водяного пара. При этом поры угля очищаются от смолистых веществ и его внутренняя поверхность очень увеличивается. Такой уголь называется активированным.
Активированный древесный уголь широко используется в сахарном производстве для очистки сахарного сиропа от примесей, оказывающих ему желтой окраски, в спиртовом производстве для очистки винного спирта от сивушных масел, в некоторых производствах для улавливания паров ценных летучих веществ — бензина, эфира, сероуглерода, бензола и др. с последующим удалением при нагревании.
В первую мировую войну активированный уголь по предложению академика Н.Д.Зелинского был применен в противогазах для защиты органов дыхания от отравляющих газов, в частности от хлора, который немцы применили в 1915 г. против французских войск. Активированный уголь как адсорбент применяется и в современных противогазах.
Графит используется в карандашной промышленности. Также его используют как смазка при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются как драгоценные каменно в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт / м К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов / грамм) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведение из организма различных токсинов графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Источником углерода для живых организмов обычно СО 2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым приобретают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, или захоронением в виде угля или нефти.
8. Токсическое действие
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит.
Токсическое действие 14 С, который вошел в состав молекул белков (особенно в ДНК и РНК), определяется его радиационным взаимодействием β-частицами (14 С (β) → 14 N), что приводит к изменению химического состава молекулы.
9. Поглощение углерода
Конечно касается поглощения углерода (в виде углекислого газа) из атмосферы такими поглотителями, как океаны, леса или почвы, содержащие углерод вне атмосферой.
См.. также
Источники
- Глоссарий терминов по химии / / Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им .. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — М.: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Ф. А. Деркач «Химия» Л. 1968.
- Малая горная энциклопедия. В 3-х т. / Под ред. С. Белецкого. — М.: «Донбасс», 2004. — ISBN 966-7804-14-3.
- Саранчук В.И. и др. Углерод: неизвестное об известна. — Донецк: УК Центр, 2006.
- Бухаркина Т.В. Химия природных энергоносителей и углеродных материалов / Т.В. Бухаркина, Н.Г. Дигуров. — М.: РХТУ им. Д.И. Менделеева, 1999. — 195 с. — ISBN 5-7237-0139-8
- Ола Д.А. Химия гиперкоординированного углерода = Hupercarbon chemistry / Ола Дж., Пракаш г.к.с., Уильямс Р.Е. и др. Перевод с англ. В.И. Минкина. — М.: Мир, 1990. — 336 с. — ISBN 5-03-001451-9
| |||||
nado.znate.ru
Углерод — Химические свойства
Химия — Углерод — Химические свойства
01 марта 2011Оглавление:
1. Углерод
2. История
3. Физические свойства
4. Нахождение в природе
5. Химические свойства
6. Применение
7. Токсическое действие
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2, +3; сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С к С соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами. Соединения с неметаллами имеют свои собственные названия метан, тетрафторметан.
Продукты горения углерода в кислороде являются CO и CO2. Известен также неустойчивый оксид С
Углекислый газ реагирует с водой, образуя слабую угольную кислоту H2CO3, которая образует соли карбонаты. На Земле наиболее широко распространены карбонаты кальция и магния.
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту:
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует карбиды, например:
- ;
- .
Важна в промышленности реакция углерода с водяным паром:
- .
При нагревании углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металургической промышленности.
Органические соединения
Способность углерода образовывать полимерные цепочки, порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25%, по массовой доле — около 18%.
Просмотров: 26823
4108.ru
Задания ЕГЭ по химии тест онлайн. Характерные химические свойства простых веществ
Лимит времени: 0
0 из 15 заданий окончено
Вопросы:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
Информация
Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди, цинка, хрома, железа.Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Тест загружается…
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
Ваше время:
Время вышло
Вы набрали 0 из 0 баллов (0)
| Место | Имя | Записано | Баллы | Результат |
|---|---|---|---|---|
| Таблица загружается | ||||
| Нет данных | ||||
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- С ответом
- С отметкой о просмотре
himege.ru
Углерод
УглеродВыполнил: Серенков Андрей
Ученик 11 «Б» класса
Проверил: Комарчева Е.А.
Канск
2005
План
1. Роль углеродов в живой природе
2.Распространение в природе.
3. Физические и химические свойства.
4. Роль углеводов в живой природе.
Углерод (лат. Carboneum), С — химический элемент IV группы периодической системы Менделеева. Известны два стабильных изотопа 12С (98,892 %) и 13С (1,108 %).
Углерод известен с глубокой древности. Древесный уголь служил для восстановления металлов из руд, алмаз — как драгоценный камень. Значительно позднее стали применяться графит для изготовления тиглей и карандашей.
В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучения горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 А.Лавуазье. Латинское название сarboneum углерод получил от сarbo — уголь.
Среднее содержание углерода в земной коре 2,3*10-2 % по массе (1*10 –2в ультраосновных, 1*10 –2 в основных, 2*10 –2 в средних, 3*10 –2 в кислых горных породах). Углерода накапливается в верхней части земной коры (биосфере): в живом веществе 18 % углерода, в древесине 50 %, в каменном угле 80 %, в нефти 85 %, антраците 96 %. Значит часть углерода литосферы сосредоточена в известняках и доломитах.
Число собственных минералов углерода — 112; исключительно велико число органических соединений углерода — углеводородов и их производных.
С накоплением углерода в земной коре связано накопление и многих других элементов, сорбируемых органическим веществом и осаждающихся в виде нерастворимых карбонатов и т.д.
По сравнению со средним содержанием в земной коре человечество в исключительно больших количествах извлекает углерод из недр (уголь, нефть, природный газ), т.к. эти ископаемые — основные источники энергии.
Углерод широко распространён также в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит — серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При комнатной температуре и нормальном давлении (0,1 Мн/м2, или 1кгс/см2) графит термодинамически стабилен. Алмаз — очень твердое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решетку: а=3,560Б. При комнатной температуре и нормальном давлении алмаз метастабилен. Заметное превращение алмаза в графит наблюдается при температурах выше 1400°С в вакууме или в инертной атмосфере. При атмосферном давлении и температуре около 3700°С графит возгоняется. Жидкий углерод может быть получен при давлении выше 10,5 Мн/м2 (1051 кгс/см2) и температурах выше 3700°С. Для твердого углерода (кокс, сажа, древесный уголь) характерно также состояние с неупорядоченной структурой “аморфный” углерод, который не представляет собой самостоятельной модификации; в основе его строения лежит структура мелкокристаллического графита. Нагревание некоторых разновидностей “аморфного” углерода выше 1500-1600°С без доступа воздуха вызывает их превращение в графит. Физические свойства “аморфный” углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоемкость, теплопроводность и электропроводность “аморфный” углерода всегда выше, чем графита. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок черного цвета (плотность 1,9 — 2 г/см3). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.
Конфигурация внешней оболочки атома углерода 2s22p2. Для углерода характерно образование четырех ковалентных связей, обусловленное возбуждение внешней электронной оболочки до состояния 2sp3. Поэтому углерод способен в равной степени как притягивать, так и отдавать электроны. Химическая связь может осуществляться за счет sp3-, sp2— и sp- гибридных орбиталей, которым соответствуют координационные числа 4,3 и 2. Число валентных электронов углерода и число валентных орбиталей одинаково; это одна из причин устойчивости связи между атомами углерода.
Уникальная способность атомов углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений углерода, изучаемых органической химией.
В соединениях углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Б,ковалентные радиусы 0,77Б, 0,67Б, 0,60Б соответственно в одинарной, двойной и тройной связях; ионной радиус С4- 2,60Б, С4+ 0,20Б. При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства.
Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.). “Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз — при нагревании. Непосредственно соединение углерода с хлором происходит в электрической дуге; с бромом и йодом углерод не реагирует, поэтому многочисленные углерода галогениды синтезируют косвенным путем. Из оксигалогенидов общей формулы COX2 (где Х — галоген) наиболее известная хлорокись COCI2 (фосген).
При температурах выше 1000°С углерод взаимодействует со многими металлами, давая карбиды. Все формы углерода при нагревании восстанавливают окислы металлов с образованием свободных металлов (Zn, Cd, Cu, Pb и др.) или карбидов (CaC2, Mo2C, WC, TaC и др.). Углерод реагирует при температурах выше 600 — 800°С с водяным паром и углекислым газом.
Все формы углерода нерастворимы в обычных неорганических и органических растворителях, но растворяются в некоторых расплавленных металлах (например, Fe, Ni, Co).
Углерод — важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества — витамины, гормоны, медиаторы и др.). Значительную часть необходимой организмам энергии образуется в клетках за счет окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы. Между атомами углерода, а также между углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность углерода образовывать 4 равнозначные валентные связи с другими атомами. Углерод создает возможность для построения углеродных скелетов различных типов — линейных, разветвленных, циклических. Показательно, что всего три элемента — С, О, Н — составляют 98 % общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет на много сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома углерода лежит в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно гипотезе А. И. Опарина, первые органические соединения на Земле имели абиогенное происхождение. Источниками углерода служили (СН4)и цианистый водород (HCN),содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического углерода, за счет которого образуется всё органическое вещество биосферы, является углерода двуокись (СО2),находящийся в атмосфере, а также растворенная в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляция) углерода (в форме СО2) — фотосинтез — осуществляется повсеместно зелеными растениями. На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы — хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника углерода, углеводороды нефти, — одна из важных современных научно — технических проблем.
Помимо стабильных изотопов углерода, в природе распространен радиоактивный 14С (в организме человека его содержится около 0,1мккюри). С использованием изотопов углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота углерода в природе. Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3 растениями и тканями животных, установлена последовательность реакции фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т. д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии.
coolreferat.com
Обычная температура — Большая Энциклопедия Нефти и Газа, статья, страница 3
Обычная температура
Cтраница 3
При обычной температуре цинк довольно хрупок, но при 100 — 110 С он хорошо прокатывается в листы. [31]
При обычной температуре электроны в органической молекуле находятся преимущественно в низших энергетических состояниях. Эти состояния называют основными. Для перехода на энергетически более высокий, незанятый уровень электрону необходим некоторый вполне определенный запас энергии, которую он забирает у поглощаемого электромагнитного излучения. Этот процесс электронных переходов может происходить до тех пор, пока электрон не приобретет в итоге потенциала ионизации и вообще не покинет области притяжения к ядру атома. В спектре каждому уровню возбуждения электрона соответствует определенная линия поглощения, которая наблюдается также и в атомных спектрах. В молекулярных спектрах отдельные линии, соответствующие одновременным изменениям в колебательном и вращательном движении в молекуле, объединяются в полосы поглощения. [32]
При обычной температуре совершаются 1лавным образом переходы из состояний Vi в Vi — Q. Наблюдаемые при этом частоты v — называют основными. Так как переходы совершаются одновременно в огромном числе молекул, в спектре должны наблюдаться все частоты ч — от Vi до vs, если соответствующие переходы оптически активны. [33]
При обычной температуре последний снова поглощает воду с заметным разогреванием. Если его замесить с водой в виде жидкого теста, то он довольно скоро застывает, образуя твердую массу, состоящую иа тонковолокнистых, переплетенных между собой кристаллов гипса. [35]
При обычной температуре четыреххлористый углерод химически инертен. Он не реагирует ни с основаниями, ни с кислотами, в том числе и с концентрированной серной кислотой. Между тем он заметно взаимодействует с некоторыми металлами, например с железом и алюминием. [36]
При обычной температуре водный раствор хлорида аммсщия имеет нейтральную реакцию. При кипячении такой раствор становится кислым вследствие улетучивания следов аммиака, образующегося в результате гидролиза. [37]
При обычной температуре в сухом воздухе сульфиды фосфора устойчивы. [38]
При обычной температуре кристаллизуется в виде гидрата LijSCvHjO в тонких моноклинных табличках. [39]
При обычной температуре последний снова поглощает воду с заметным разогреванием. Если его замесить с водой в виде жидкого теста, то он довольно скоро застывает, образуя твердую массу, состоящую иа тонковолокнистых, переплетенных между собой кристаллов гипса. [40]
При обычной температуре гидролиз солей многозарядных катионов практически ограничивается этой стадией. [41]
При обычной температуре углерод, особенно алмаз и графит, химически крайне инертен. Некоторые сорта черного углерода воспламеняются в атмосфере кислорода уже при сравнительно незначительном нагревании. Со фтором черный углерод реагирует уже при обычной температуре. При высоких температурах углерод соединяется с многочисленными элементами: водородом, серой, кремнием, бором и многими металлами. Соединения углерода с металлами и с другими электроположительными относительно углерода элементами называют карбидами. С азотом углерод непосредственно не соединяется, однако взаимодействие происходит в присутствии водорода с образованием цианистого водорода. [42]
При обычной температуре Четыреххлористый углерод химически инертен. Он не реагирует ни с основаниями, ни с кислотами, в том числе и с концентрированной серной кислотой. Между тем он заметно взаимодействует с некоторыми металлами, например с железом и алюминием. [43]
При обычной температуре заселенность основного уровня с / v2 несколько выше, чем уровня с I — — / г. Однако эта разность невелика — всего 10 — Б от общего числа магнитных ядер в образце. Связано это с тем, что энергия теплового движения значительно выше, чем разность уровней АЕ, При поглощении энергии переменного магнитного поля радиочастотного диапазона с частотой v происходит выравнивание заселенностей обоих уровней за счет перехода избыточной части ядер с низшего уровня на высший. В методе ЯМР регистрируется энергия излучения при возвращении ядер в исходное состояние. [44]
При обычной температуре водный раствор хлорида аммония имеет нейтральную реакцию. При кипячении такой раствор становится кислым вследствие улетучивания следов аммиака, образующегося в результате гидролиза. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
