Оксид фосфора (V) | справочник Пестициды.ru
Информация
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Подробнее >>>
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах.[1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты.
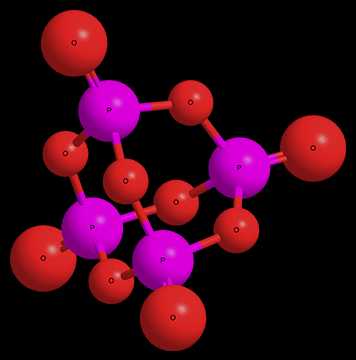
Трехмерная модель молекулы
Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот.[4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора.[2]
P2O5 + 3H2O
→ 2H3PO4Все встречающиеся в почве соли ортофосфорной кислоты и одновалентных катионов (NH4+, Na+, K+) и однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде.
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений.[4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Na4P
Гидролиз триполифосфата натрия:
Na5P3O10 + 2H2O + 2H+ → 3NaH2PO4 +2Na+
Гидролиз метафосфат иона (в кислой среде):
(PO3)66- + 3H2O → H2P3O103- + H2P2O72- + H2PO4—
Ортофосфорная кислота, будучи трехосновной отдиссоциирует три аниона H2PO—4, HPO42-, PO4 3- . В условиях слабокислой реакции среды, именно в них возделываются растения, наиболее распространен и доступен первый ион, в меньшей степени второй и практически недоступен третий. Однако люпин, гречиха, горчица, горох, донник, конопля и другие растения способны усваивать фосфор из трехзамещенных фосфатов. [4]
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Многие растения могут питаться фосфором из очень разбавленных растворов, вплоть до 0,01 мг /л P2O5 . Естественно, что удовлетворить потребность в фосфоре растения могут только при условии постоянного возобновления в нем концентрации хотя бы такого же низкого уровня.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
где:
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
Или:
y = x, % × 0,43643
Например:
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Статья составлена с использованием следующих материалов:
Литературные источники:
1. Ван Везер «Фосфор и его соединения». Монография. т. 1.: Изд-во иностранной литературы, М., 1962. 2.Калинский А.А., Вильдфлуш И.Р., Ионас В.А. и др. – Агрохимия в вопросах и ответах – Мн.: Урожай,1991. – 240 с.: ил.
3.Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
4.Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Свернуть Список всех источниковwww.pesticidy.ru
P2O5 какой это оксид
Оксид фосфора (V) (фосфорный ангидрид) представляет собой очень гигроскопичное вещество белого цвета. Является сильнейшим дегидратирующим агентом. Существует в аморфном (в виде хлопьев), стеклообразном и кристаллическом состояниях. При нагревании кристаллический оксид фосфора (V) возгоняется. Плавится только под избыточным давлением, переходя при этом в легкоподвижную жидкость. При дальнейшем нагревании полимеризуется, при охлаждении жидкости образуется стеклообразный продукт состава .
Оксид фосфора (V) в промышленных масштабах получают сжиганием фосфора в избытке кислорода или воздуха:
ru.solverbook.com
Оксид фосфора(V) — это… Что такое Оксид фосфора(V)?
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид фосфора(V)) — P2O5, кислотный оксид.
Строение
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P
2O5 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360оС) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580оС) и менее химически активны. H-форма переходит в О-форму при 300—360
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3
и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9
dic.academic.ru
Оксиды фосфора — АЗОТ. ФОСФОР — ХИМИЯ ЭЛЕМЕНТОВ — ОБЩАЯ ХИМИЯ — Химия подготовка к ЗНО и ДПА
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЯ ЭЛЕМЕНТОВ
НИТРОГЕН. ФОСФОР
Оксиды фосфора
Фосфор образует два оксиды — Р2O3 , P2O5. Это упрощенные формулы веществ. На самом деле молекулы оксидов Фосфора имеют такой состав: Р4O6 и Г4O10.
Физические свойства оксидов Фосфора
Фосфор(III) оксид Р2O3 (фосфітний ангидрид) представляет собой легкоплавкую вещество (Тпл = +24 °С, Ткип = +175 °С). Он растворяется в некоторых органических растворителях и в сірковуглецеві, а также в фосфатной и фосфітній кислоте, и имеет резкий запах.
Фосфор(V) оксид Р2O5 (фосфатный ангидрид) в обычных условиях является белой, очень гигроскопичным веществом. Плотность твердого фосфатного ангидрида равна 2,3 г/см3. При его нагревании до +359 °С происходит фазовый переход из твердого состояния в газообразное, минуя жидкое. Такой фазовый переход называют сублимацией.
Химические свойства оксидов Фосфора
Оба оксиды Фосфора являются кислотными оксидами.
Химические свойства фосфітного ангидрида
Р2O3 активно реагирует с водой. При этом образуется двохосновна фосфітна кислота Н3РO3 средней силы:
В твердом состоянии это бесцветное гигроскопичное кристаллическое соединение с температурой плавления +74 °С. В водных растворах происходит диссоциация по схеме (Ка1 = 2 ∙ 10 3, Ка2 = =6 ∙ 10-7):
При реакции Р2O3 со щелочами образуются соли фосфітної кислоты — фосфіти:
Фосфор триоксид, фосфітна кислота и ее соли проявляют четко выраженные восстановительные свойства. Например, фосфітна кислота восстанавливает малоактивные металлы из их водных растворов:
Кислород воздух — триоксид окисляет фосфор в пентаоксид:
Химические свойства фосфатного ангидрида
Фосфор(V) оксид очень активно взаимодействует с водой. При этом может образовываться три кислоты: метафосфатна (НРO3), пірофосфатна (Н4Р2O7) или ортофосфатная (Н3РO4). Продукты реакции зависят от количества воды:
Для того чтобы увидеть сходство этих кислот, их можно рассматривать как гидраты фосфор оксида:
|
НРO3 |
0,5 (Р2O5 ∙ Н2O) |
|
H4P2O7 |
1 (Р2O5 ∙ 2Н20) |
|
Н3РO4 |
0,5 (Р2O5 ∙ 3Н2O) |
Для упрощение вместо формул фосфатных кислот в большинстве уравнений реакции записывают формулу ортофосфатной кислоты Н3РO4.
Р2O5 проявляет свойства кислотного оксида. Он реагирует с щелочами и основными оксидами, при этом образуются соли фосфорной кислоты — фосфаты:
Фосфор пентаоксид очень активно поглощает влагу из воздуха. Давление паров воды над поверхностью Р2O5 составляет всего 0,00002 мм рт. ст. (для сравнения: давление паров над поверхностью концентрированной серной кислоты равна 0,003 мм рт. ст., т.е. примерно в 100 раз больше).
Фосфатный ангидрид отщепляет молекулы воды от многих соединений. Например, при действии Р2O5 на кислоты образуются соответствующие ангидриды кислот, а много органических соединений при действии фосфор оксида обугливаются:
na-uroke.in.ua
Фосфорный ангидрид — это… Что такое Фосфорный ангидрид?
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид (V) фосфора — P2O5, кислотный оксид.
Строение
Пары оксида фосфора (V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфоном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360оС) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру, также построенную из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580оС) и менее химически активны. H-форма переходит в О-форму при 300-360оC.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
- P4O10 + 6H2O (ж) → 4H3PO4 (-177 кДж)
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
- 2HNO3 + P2O5 → 2HPO3 + N2O5;
- 4HClO4 + P4O10 → (НРО3)4 + 2Cl2O7.
Оксид фосфора (V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
- P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
Карбоновые кислоты переводит в соотвествующие ангидриды:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
Также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с Nh4 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
- P4O10 + 8PCl3 + O2 → 12Cl3PO
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
- P4 + 5O2 → P4O10 + 2984 кДж.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной киcлоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид фосфора
Фосфор был открыт и выделен в 1669 году немецким химиком Х. Брандом. В природе этот элемент встречается только в виде соединений. Основные минералы — фосфорит Ca3(PO4)2 и апатит 3Ca3(PO4)2 • CaF2 или Ca5F(PO4)3. Кроме того, элемент входит в состав белков, а также содержится в зубах и костях. Фосфор легче всего взаимодействует с кислородом и хлором. При избытке этих веществ образуются соединения со степенью окисления (для P) +5, а при недостатке — со степенью окисления +3. Оксид фосфора может быть представлен несколькими формулами, отображающими разные химические вещества. Среди них самые распространенные — это P2O5 и P2O3. К другим редким и малоизученным оксидам относятся: P4O7, P4O8, P4O9, PO и P2O6.
Реакция окисления элементарного фосфора кислородом протекает медленно. Интересны ее различные стороны. Во-первых, в темноте хорошо видно свечение, которым она сопровождается. Во-вторых, процесс окисления этого химического вещества происходит всегда с образованием озона. Это обусловлено получением промежуточного соединения — фосфорила PO — по схеме: P + O2 → PO + O, а затем: O + O2 → O3. В-третьих, окисление связано с резким изменением электропроводности окружающего воздуха из-за его ионизации. Выделение света без заметного разогревания, при протекании химических реакций, называется хемилюминесценцией. Во влажных средах зеленая хемилюминесценция обусловлена образованием промежуточного вещества PO.
Окисление фосфора протекает только при определенной концентрации кислорода. Она не должна быть ниже минимального и выше максимального порогов парциального давления O2. Сам интервал зависит от температур и ряда других факторов. Например, при стандартных условиях скорость реакции окисления чистым кислородом фосфора возрастает до достижения 300 мм рт. ст. Затем она уменьшается и падает почти до нуля, когда парциальное давление кислорода достигнет 700 мм рт. ст. и выше. Таким образом, оксид при обычных условиях не образуется, так как фосфор практически не окисляется.
Пятиокись фосфора
Наиболее характерным окислом является фосфорный ангидрид, или высший оксид фосфора, P2O5. Это белый порошок с едким запахом. При определении в парах его молекулярного веса, установлено, что более правильной записью его формулы является P4O10. Это негорючее вещество, оно плавится при температуре 565,6 С. Ангидрид P2O5 —кислотный оксид со всеми характерными свойствами, но он жадно поглощает влагу, поэтому применяется в качестве осушителя жидкостей или газов. Оксид фосфора может отнимать воду, которая входит в состав химических веществ. Ангидрид образуется в результате сгорания фосфора в атмосфере кислорода или воздуха, при достаточном количестве O2 по схеме: 4P + 5O2 → 2P2O5. Его применяют в производстве кислоты h4PO4. При взаимодействии с водой может образовывать три кислоты:
- метафосфорную: P2O5 + h3O → 2HPO3;
- пирофосфорную: P2O5 + 2h3O → h5P2O7;
- ортофосфорную: P2O5 + 3h3O → 2h4PO4.
Пятиокись фосфора бурно реагирует с водой и веществами, содержащими воду, такими, как дерево или хлопок. При этом образуется большое количество тепла, что может даже привести к пожару. Он вызывает коррозию металла и очень раздражает (возникают серьезные ожоги глаз, кожи) дыхательные пути и слизистые оболочки, даже при таких низких концентрациях, как 1 мг/м³.
Трехокись фосфора
Фосфористый ангидрид, или триоксид фосфора, P2O3 (P4O6) — это белое кристаллическое вещество (внешне похоже на воск), которое плавится при температуре 23,8 С и кипит при температуре 173,7 С. Как и белый фосфор, P2O3 является очень ядовитым веществом. Это кислотный оксид, со всеми присущими свойствами. Оксид фосфора 3 образуется благодаря медленному окислению или горению свободного вещества (P) в среде, где имеет место недостаток кислорода. Трехокись фосфора медленно взаимодействует с холодной водой, образуя кислоту: P2O3 + 3h3O → 2h4PO3. Этот оксид фосфора энергично реагирует с горячей водой, при этом реакции протекают по-разному, в результате может образоваться красный фосфор (аллотропически видоизмененный подукт), гидрид фосфора, а также кислоты: h4PO3 и h4PO4. Термическое разложение ангидрида P4O6 сопровождается отщеплением атомов фосфора, при этом образуются смеси окислов P4O7, P4O8, P4O9. По строению они напоминают P4O10. Наиболее изученный из них P4O8.
fb.ru
P -> P2O5 уравнение реакции
В результате горения фосфора в кислороде происходит образование оксида фосфора (V) (P -> P2O5). Молекулярное уравнение реакции имеет вид:
Данная реакция относится к окислительно-восстановительным, поскольку химические элементы кислород и фосфор изменяют свои степени окисления. Схемы электронного баланса выглядят следующим образом:
Оксид фосфора (V) (фосфорный ангидрид) представляет собой очень гигроскопичное вещество белого цвета. Является сильнейшим дегидратирующим агентом. Существует в аморфном (в виде хлопьев), стеклообразном и кристаллическом состояниях. При нагревании кристаллический оксид фосфора (V) возгоняется. Плавится только под избыточным давлением, переходя при этом в легкоподвижную жидкость. При дальнейшем нагревании полимеризуется, при охлаждении жидкости образуется стеклообразный продукт состава .
Оксид фосфора (V) проявляет кислотные свойства, энергично реагирует с водой, щелочами. Легко галогенируется. Восстанавливается фосфором. Образует пероксосоединения.
ru.solverbook.com
