Окислительно-восстановительные реакции в органической химииСикорская О.Э._Электив
Муниципальное образовательное учреждение
с редняя
общеобразовательная школа № 36
редняя
общеобразовательная школа № 36
ПРОГРАММА элективного курса
«Окислительно-восстановительные реакции
в органической химии»
(углубленный курс)
Возраст обучающихся: 14-16 лет (10-11 класс)
Срок реализации – 0,5 года
Занятия проводятся по 1,5 ч в неделю (спаренные уроки)
Составитель: Сикорская Ольга Эдуардовна
Владикавказ, 2011г
Пояснительная записка.
Предлагаемый элективный курс может быть проведен во втором полугодии 10 класса или в 11 классе для углубленного изучения темы в классах естественно-математического профиля. Курс рассчитан на учащихся с хорошим уровнем базовой подготовки.
Знание химии совершенно необходимо специалистам большинства отраслей народного хозяйства. Глубокое изучение основ химии очень важно будущим врачам для более полного освоения биологии, биохимии, физиологии, фармакологии; химикам-технологам, инженерам-биотехнологам, военным специалистам, агрономам, ветеринарам и т. д. Знания – сила. Но знание может быть разным. Можно вызубрить таблицу умножения, но при этом не суметь решить простейшую задачу. Только знать мало, вряд ли кто-либо станет отрицать тот факт, что теория и практика не могут существовать друг без друга. Потребность в теории непосредственно вытекает из практики; в свою очередь теория служит необходимым руководством практической деятельности. Предлагаемый курс позволяет на практике отработать теоретические вопросы.
На процессы, связанные с окислительно-восстановительными реакциями, мы обращаем внимание учащихся при изучении практически каждого класса органических веществ. Однако, существующие рамки программы, а также недостаток часов, не позволяют учителю всесторонне и глубоко рассмотреть сущность и закономерности протекания данных процессов. Вместе с тем эта тема является одной из сложных тем школьного курса химии. В ряде заданий единого государственного экзамена по химии части C требуется не только привести схему реакции, а составить именно уравнение реакции окисления органического соединения с правильно подобранными коэффициентами.
Целями данного курса являются:
-
повышение компетентностей учащихся в области знаний об окислительно-восстановительных процессах;
-
подробное изучение ОВР с участием органических веществ, прогнозирование продуктов реакции;
-
создание условий для формирования и развития у учащихся умения самостоятельно работать с научной литературой, собственными конспектами и другими источниками информации;
-
воспитание убежденности в познаваемости химической составляющей окружающей действительности.
Задачи данной программы таковы:
-
углубить представления учащихся об ОВР с участием органических веществ;
-
научить прогнозировать состав продуктов ОВР;
-
совершенствовать навыки составления ОВР используя метод электронного баланса и метод макроподстановки.
После изучения предлагаемого курса учащиеся должны:
Знать:
-
основные понятия и законы теории ОВР
-
классификацию ОВР в органической химии;
-
отношение к восстановителям и окислителям различных классов органических веществ;
Уметь:
-
в свете представлений об индуктивном и мезомерном эффектах, рассматривать взаимное влияние атомов в молекулах органических веществ;
-
определять степени окисления атомов в органических веществах алгебраическим и графическим методами;
-
прогнозировать продукты реакций;
-
составлять и уравнивать ОВР с участием органических веществ;
-
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для критической оценки достоверности химической информации, поступающей из различных источников.
-
оформлять результаты своей работы;
-
осуществлять самоконтроль за результатами своей работы.
Основным положительным результатом работы по данному курсу является возможность выработать у учащихся более позитивный подход к решению ОВР с участием органических веществ.
Хочу дать некоторые разъяснения относительно последовательности тем предлагаемого курса.
Изучение первого раздела предполагает последовательное обобщение, систематизацию и углубление знаний основных понятий ОВР и структуры органических веществ.
В ОВР органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических веществ зависит от доступности электронов при взаимодействии с окислителем. Все факторы, вызывающие увеличение электронной плотности в молекуле, будут повышать их способность к окислению. Поэтому мне кажется целесообразным одно из занятий данного элективного курса посвятить изучению электронных эффектов в молекулах органических веществ.
Для расстановки коэффициентов обычно используют метод электронного баланса, что требует у учащихся умения расставлять степени окисления в органических веществах. В связи с этим на одном занятии мы разбираем способы определения степени окисления в органических веществах, причем как алгебраическим способом, так и графическим. А одно из занятий мы посвящаем уравниванию этих реакций, разбирая особенности метода электронного баланса, и знакомимся с методом макроподстановки (хотя он конечно оказывается более востребован учащимися уже при обучении в ВУЗе).
Все ОВР в органике можно условно разделить на 3 группы: полное окисление или горение, мягкое окисление и жесткое окисление (деструктивное окисление). Для того чтобы учащиеся более осознанно в дальнейшем оперировали этими понятиями, мне кажется целесообразным на одном из занятий показать все эти реакции и на готовых (но не уравненных) уравнениях: потренироваться в их различении.
На дальнейших занятиях более детально изучаются процессы окисления и восстановления различных классов органических веществ.
Итогом работы учащихся станет выполнение зачетной работы, содержащей задания из части С ЕГЭ по химии.
В приложении я привожу примерный теоретический и практический материал, отрабатываемый на занятиях. Объем предложенного материала варьируется в зависимости от уровня подготовки учащихся и их дальнейшей профессиональной ориентации.
Занятия рекомендуется проводить продолжительностью не менее 1,5 часа (спаренные уроки), что способствует более полному рассмотрению тем и вместе с тем позволяет отработать на практике теоретические вопросы.
Занятия желательно проводить в различных формах:
-
уроки проблемного обучения;
-
лекции-беседы;
-
практикумы;
-
уроки-исследования;
- семинарские занятия.
Учебно-тематический план.
|
№ темы |
Тема занятия |
Количество занятий |
|
1. |
Введение. |
4 |
|
2 |
Окислительные процессы с участием углеводородов. |
5 |
|
3. |
Окислительные процессы с участием кислородсодержащих органических веществ. |
4 |
|
4. |
Окисление аминов. |
1 |
|
5. |
Восстановительные процессы с участием органических веществ. |
1 |
|
6. |
Окислительно- восстановительные реакции в заданиях ЕГЭ. |
1 |
|
7 |
Итоговое занятие. |
1 |
Итого 17 занятий.
Содержание тем программы.
| № |
Тема занятия |
Основное содержание. |
|
Введение (4 часа) |
||
|
1 |
Вводное занятие. |
Знакомство с целями и задачами курса, его структурой. Основные положения теории ОВР(повторение и обобщение изученного в обязательном курсе). Электроотрицательность, валентность, степень окисления, их сходство и различия. Правила определения степени окисления. Способы определения степени окисления в органических веществах: алгебраический и графический методы. |
|
2 |
Взаимное влияние атомов в молекулах органических веществ. |
Электронные эффекты в органических веществах:. мезомерный и индуктивный эффекты. Их влияние на реакционную способность молекул. |
|
3 |
Составление уравнение окислительно-восстановительных реакций. |
Важнейшие окислители и восстановители. Таблицы поведение типичных окислителей и восстановителей. Метод электронного баланса и метод макроподстановки. Особые случаи составления электронного баланса. |
|
4 |
Классификация ОВР в неорганической и органической химии. |
Межмолекуляроное окисление-восстановление, внутримолекулярное окисление- восстановление, реакции диспропорционирования. Классификация ОВР в органической химии: полное окисление или горение, мягкое окисление и жесткое окисление (деструктивное окисление). |
|
Окислительные процессы с участием углеводородов. (5 часов) |
||
|
5 |
Окисление алканов |
Полное окисление, неполное сгорание, неполное каталитическое окисление. Решение задач на вывод формул по продуктам сгорания алканов. |
|
6 |
Окисление алкенов |
Мягкое окисление алкенов: эпоксидирование или неполное каталитическое окисление, реакция Вагнера. Жесткое окисление. Озонолиз. Полное сгорание. |
|
7 |
Окисление алкинов |
Реакция Кучерова, окисление KMnO4, K2Cr2O7 в кислой, нейтральной или щелочной средах. Полное окисление. |
|
8 |
Окисление аренов. |
Бензол: полное окисление озонолиз. Гомологи бензола: окисление перманганатом калия (зависимость продуктов реакции от характера среды). Окисление кумола и стирола. |
|
9 |
Окисление углеводородов. |
Тренировочные упражнения, содержащие задания по окислению углеводородов. |
|
Окислительные процессы с участием кислородсодержащих органических веществ. (4 часа) |
||
|
10 |
Окисление спиртов. |
Полное окисление. Частичное окисление первичных, вторичных и третичных спиртов. Окисление гликолей. Окисление фенола. |
|
11 |
Окисление альдегидов. |
Получение реактива Толленса и гидроксида меди (II). Окисление аммиачным раствором оксида серебра, окисление свежеосаждённым гидроксидом меди (II). Окисление перманганатом калия в кислой, нейтральной и щелочной средах. Особенности окисления муравьиного альдегида. Окисление кетонов. |
|
12 |
Окисление карбоновых кислот |
Окисление муравьиной и щавелевой кислот. |
|
13 |
Окисление углеводов. |
Реакция серебряного зеркала. Реакция моносахаридов с гидроксидом меди(II) при нагревании. Окисление моносахаридов азотной кислотой и бромной водой. Брожение и его виды. |
|
Окисление аминов. (1 час) |
||
|
14 |
Окисление аминов. |
Полное окисление аминов. Получение красителей. |
|
Восстановление органических веществ (1 час) |
||
|
15 |
Восстановительные процессы. |
Восстановление алкенов, алкинов, аренов, спиртов и альдегидов. Восстановление альдегидов и кетонов алюмогидридом лития или боргидридом натрия. Восстановление моносахаридов. Реакция Зинина. |
|
Окислительно- восстановительные реакции в заданиях ЕГЭ. |
||
|
16 |
Подведем итоги. |
Обобщение по всему курсу. Выполнение упражнений по материалам ЕГЭ. |
|
17 |
Итоговое занятие |
Выполнение итоговой работы. |
Литература для учащихся:
-
Архангельская О.В., Тюльков И.А. Задачи по теме «Уравнения окислительно-восстановительных реакций».
-
Дерябина Г.И. , Кантария Г.В. Интерактивный мультимедиа учебник Органическая химия 1998-2011. (http://www.chemistry.ssu.samara.ru).
-
Каверина А.А., Медведев Ю.Н., Добротин Д.Ю. ЕГЭ 2009 Химия.- М.:Эксмо, 2009.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии: в 2 т.- М: Федеративная книготорговая компания, 1998.
-
Кузьменко Н.Е., Еремин В.В., 2500 задач по химии с решениями для поступающих в ВУЗы.- М: «Экзамен», 2005.
-
Кузнецова Н.Е., Лёвкин А.Н., Задачник по химии для учащихся 10 класса (профильный уровень). –М.: Вентана-Граф,2007.
-
Литвинова Т.Н., Мельникова Е.Д., Соловьёва М.В., Ажипа Л.Т., Выскубова Н.К. Химия в задачах для поступающих в ВУЗы. М:ООО «Издательство Оникс», ООО «Издательство Мир и образование», 2009.
-
Потапов В.М., Татаринчик С.Н. Органическая химия.-М.: Химия,1989.
-
Хомченко Г.П., Севастьянова К.Е. Окислительно-восстановительные реакции, М: Просвещение, 1989.
-
Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в ВУЗы.- М.: Высшая школа,1987.
Литература для учителя:
-
Гостев М.М. Химический кружок в школе. М.: Изд-во АПН РСФСР. М., 1958.
-
Денисова В.Г. Материалы мастер-класса «Химические свойства веществ в заданиях ЕГЭ». (http://www.it-n.ru/communities.aspx?cat_no=131642&lib_no=229027&tmpl=lib)
-
Дерябина Н.Е. Прием макроподстановки как способ определения коэффициентов в уравнениях ОВР // Химия в школе.-2007.-№9.-С. 40-44
-
Дерябина Н.Е. Методика формирования умения определять степень окисления атома // Химия в школе.-2007.-№7.-С. 24-27
-
Ермаков, Д.С. Элективные курсы для профильного обучения / Д.С. Ермаков // Педагогика. – 2005. – № 2.
-
Нейланд О.Я. Органическая химия. М.: Высшая школа,1990.
-
Солдатова Т.М.. Тренинги и тесты с ответами по теме: «Окислительно-восстановительные реакции».-Волгоград: Учитель, 2007.
-
Шарп Дж., Госни И., Роули А. Практикум по органической химии / Пер. с англ. М.: Мир, 1993.
-
Шарпенак А.Э., Косенко С.А. Практикум по органической химии. М.: Высшая школа, 1965.
-
Шабаров Ю.С. “Органическая химия”, М., Химия, 2000.
-
Элективные курсы в профильном обучении / Министерство образования РФ. – Национальный фонд подготовки кадров. – М.: Вита-Пресс, 2004.
Приложение.
Примерный теоретический и практический материал, отрабатываемый на занятиях.
Определение степени окисления в органических веществах.
Окислительно-восстановительные реакции органических веществ – важнейшее свойство, объединяющее эти вещества. Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Несмотря на то, что в ходе любых окислительно-восстановительных реакций происходит как окисление, так и восстановление, их классифицируют в зависимости оттого, что происходит непосредственно с органическим соединением (если оно окисляется, говорят о процессе окисления, если восстанавливается – о процессе восстановления).
Степень окисления. Основные способы определения степени окисления в неорганических и органических веществах.
Степень окисления (СО) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице.
Правила расчета степени окисления (СО)
(при их использовании предпочтение отдаётся правилу с меньшим номером).
1. Сумма СО всех атомов в частице равна заряду этой частицы (в простых веществах СО всех атомов равна 0).
2. В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая СО. В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные СО,
3. Атомы, приведённые в таблице 1, в большинстве своих соединений проявляют постоянную СО. При определении СО предпочтение отдают элементу, который расположен выше:
Характерные СО для некоторых элементов
|
Щелочные металлы |
+1 |
|
Be, Mg, Ca, Sr, Ba, Zn, Cd |
+2 |
|
F |
-1 |
|
H |
+1,-1 (в гидридах) |
|
O |
-2 (-1 в пероксидах,+2 в ОF2) |
|
Cl, Br |
-1 |
|
B, Al, Ga, In, Sc, Y, La и большинство лантанидов |
+3 |
Например,
Ca+2(S-2C+4N-3)2
Кальций имеет постоянную степень окисления в веществе +2. Значит, ион SCN— имеет заряд -1.В этом ионе наиболее электроотрицательным является азот, значит, он будет иметь степень окисления -3. Наименее элекроотрицательным будет углерод, он приобретет степень окисления +4. Пусть степень окисления серы х, так как алгебраическая сумма степеней окисления в молекуле равна нулю, то: (+2) +2∙(х+(+4) +(-3))= 0, откуда х = -2.
K+14[Fe+2(C+2N-3)6]
Калий имеет постоянную степень окисления +1. 4 атома калия дают заряд 4+. Следовательно, комплексный ион имеет заряд 4-. Цианид ион имеет заряд 1-. таких ионов 6. Значит, они дают -6. Тогда степень окисления железа равна х+6∙ (-1) = -4. Откуда х =+2. Определим степень окисления атомов в цианид ионе. В нем азот более электроотрицательный элемент, чем углерод. Значит, азот имеет степень окисления -3. Тогда степень окисления углерода (у) равна у+(-3) =-1, у=+2
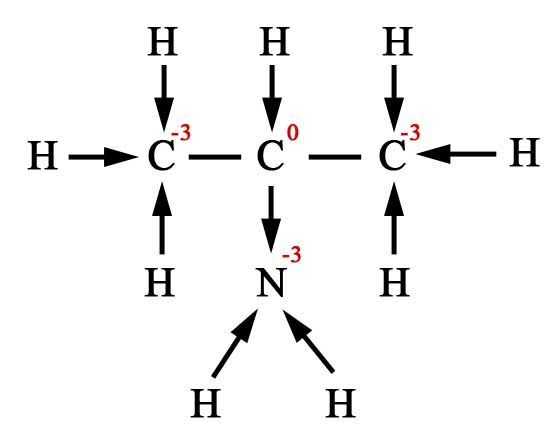
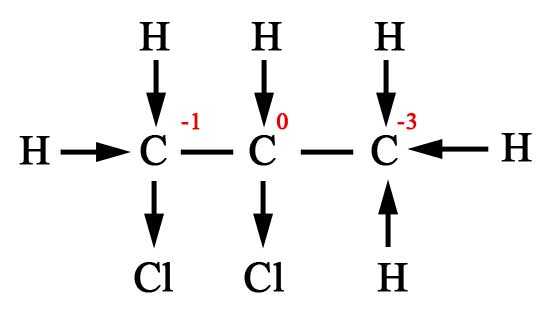
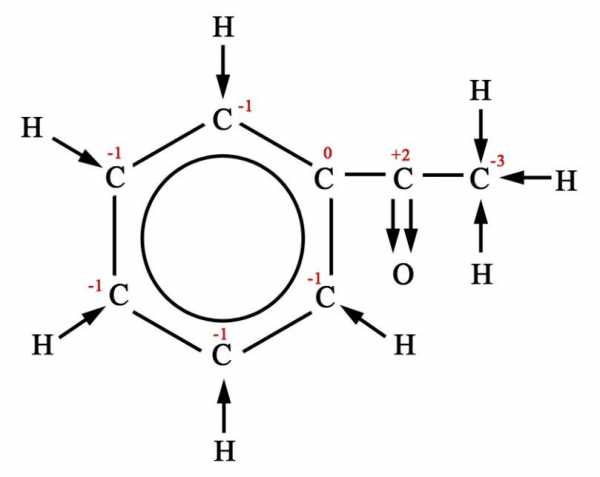
Определение степени окисления атомов в органических веществах.
Применение понятия «степени окисления» (СО) в органической химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных реакций. Однако, учитывая, что более или менее постоянной состав продуктов реакции возможен только при полном окислении (горении) органических веществ, целесообразность расстановки коэффициентов в реакциях неполного окисления отпадает. По этой причине обычно ограничиваются составлением схемы превращений органических соединений.
Степень окисления любого атома углерода в органическом веществе равна алгебраической сумме всех его связей с более электроотрицательных элементов (Cl, O, S,N, и др.), учитываемых со знаком «+», и связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с соседними атомами углерода не учитываются.
Существуют два подхода к определению степеней окисления элементов в органических веществах.
1. Вычисляют среднюю степень окисления атома углерода в молекуле органического соединения.
В органических веществах можно определять степени окисления элементов алгебраическим методом, при этом получается усредненное значение степени окисления. Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
2. Графический способ.
Однако, определение степени окисления атомов органических веществ по молекулярной формуле носит формальный характер, так как в органической химии большое значение имеют структурные формулы. В связи с этим для определения степени окисления атомов в органике используют графический способ. Для этого воспользуемся следующим порядком действий:
1) напишем полную структурную формулу вещества;
2) по каждой связи стрелкой покажем смещение электронной плотности к наиболее электроотрицательному элементу;
3) все связи С – С будем считать неполярными
4) далее ведем подсчет: сколько стрелок направлено к атому углерода , столько «–» , сколько от атома углерода – столько «+». Сумма «–» и «+» определяет степень окисления атома.
Например,
|
Название вещества |
Усредненное значение степени окисления |
Степень окисления каждого атома углерода |
|
2- аминопропан |
|
|
|
1,2 –дихлорпропан |
|
|
|
Метилфенилкетон |
|
Оставшуюся часть занятия учащиеся выполняют упражнения.
Составление уравнений окислительно-восстановительных
реакций
При составлении уравнений окислительно-восстановительных реакций
применяют:
1. Метод электронного баланса.
2. Метод ионно-электронный.( в данном курсе не рассматривается)
3. Метод макроподстановки (подробно рассмотрен в материалах мастер–класса у Денисовой В.Г.
www.uchmet.ru
ОВР в органической химии.
 ОВР в органической химии.
ОВР в органической химии.
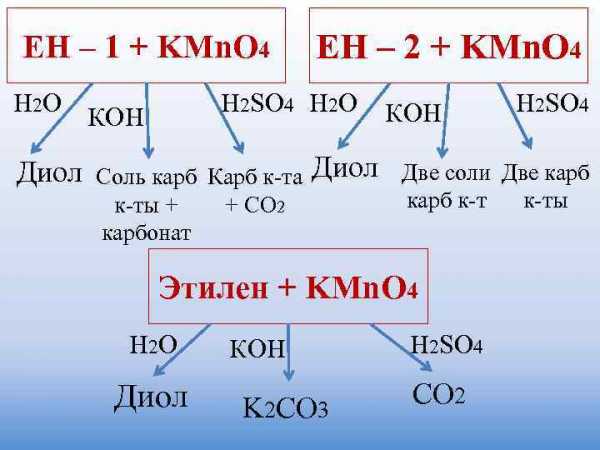 ЕН – 1 + KMn. O 4 ЕН – 2 + KMn. O 4 Н 2 О Н 2 SO 4 Н 2 О КОН Н 2 SO 4 КОН Диол Соль карб Карб к-та Диол Две соли Две карб к-ты + + СО 2 карб к-ты карбонат Этилен + KMn. O 4 Н 2 О КОН Н 2 SO 4 Диол K 2 CO 3 CO 2
ЕН – 1 + KMn. O 4 ЕН – 2 + KMn. O 4 Н 2 О Н 2 SO 4 Н 2 О КОН Н 2 SO 4 КОН Диол Соль карб Карб к-та Диол Две соли Две карб к-ты + + СО 2 карб к-ты карбонат Этилен + KMn. O 4 Н 2 О КОН Н 2 SO 4 Диол K 2 CO 3 CO 2
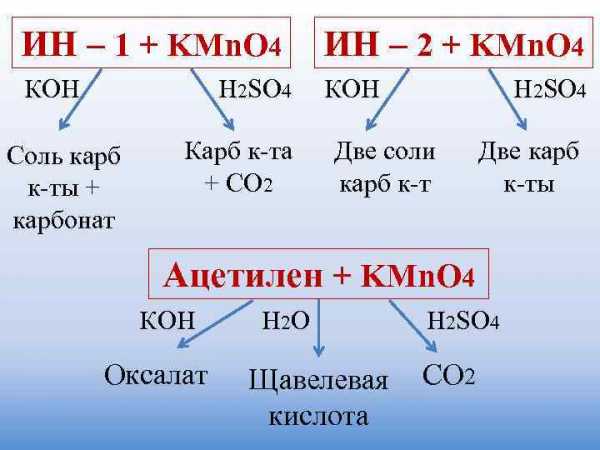 ИН – 1 + KMn. O 4 ИН – 2 + KMn. O 4 КОН H 2 SO 4 КОН H 2 SO 4 Соль карб Карб к-та Две соли Две карб к-ты + + СО 2 карб к-ты карбонат Ацетилен + KMn. O 4 КОН H 2 O H 2 SO 4 Оксалат Щавелевая CO 2 кислота
ИН – 1 + KMn. O 4 ИН – 2 + KMn. O 4 КОН H 2 SO 4 КОН H 2 SO 4 Соль карб Карб к-та Две соли Две карб к-ты + + СО 2 карб к-ты карбонат Ацетилен + KMn. O 4 КОН H 2 O H 2 SO 4 Оксалат Щавелевая CO 2 кислота
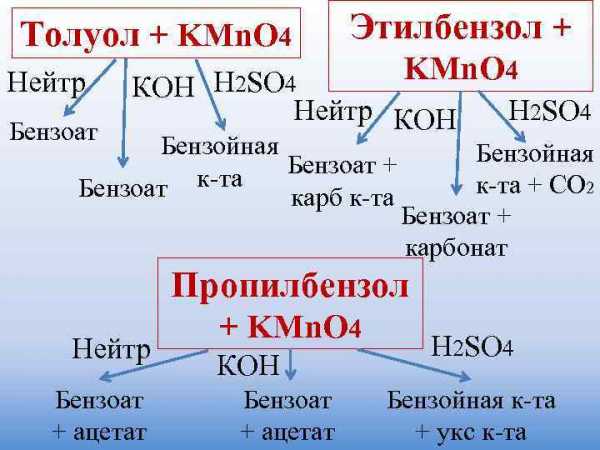 Толуол + KMn. O 4 Этилбензол + Нейтр KMn. O 4 КОН H 2 SO 4 Нейтр КОН H 2 SO 4 Бензоат Бензойная к-та Бензоат + Бензоат карб к-та + СО 2 Бензоат + карбонат Пропилбензол + KMn. O 4 Нейтр H 2 SO 4 КОН Бензоат Бензойная к-та + ацетат + укс к-та
Толуол + KMn. O 4 Этилбензол + Нейтр KMn. O 4 КОН H 2 SO 4 Нейтр КОН H 2 SO 4 Бензоат Бензойная к-та Бензоат + Бензоат карб к-та + СО 2 Бензоат + карбонат Пропилбензол + KMn. O 4 Нейтр H 2 SO 4 КОН Бензоат Бензойная к-та + ацетат + укс к-та
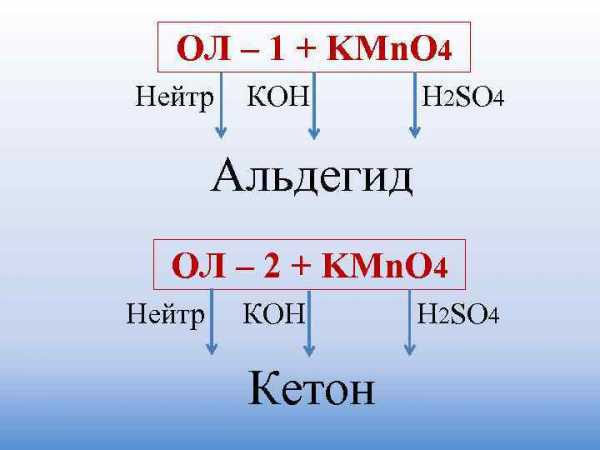 ОЛ – 1 + KMn. O 4 Нейтр КОН H 2 SO 4 Альдегид ОЛ – 2 + KMn. O 4 Нейтр КОН H 2 SO 4 Кетон
ОЛ – 1 + KMn. O 4 Нейтр КОН H 2 SO 4 Альдегид ОЛ – 2 + KMn. O 4 Нейтр КОН H 2 SO 4 Кетон
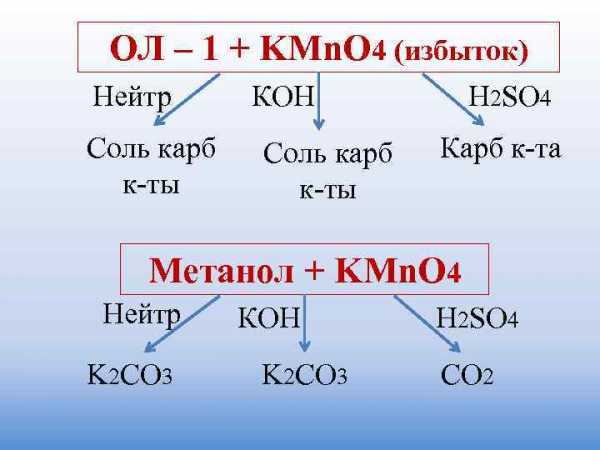 ОЛ – 1 + KMn. O 4 (избыток) Нейтр КОН H 2 SO 4 Соль карб Карб к-та к-ты Метанол + KMn. O 4 Нейтр КОН H 2 SO 4 K 2 CO 3 CO 2
ОЛ – 1 + KMn. O 4 (избыток) Нейтр КОН H 2 SO 4 Соль карб Карб к-та к-ты Метанол + KMn. O 4 Нейтр КОН H 2 SO 4 K 2 CO 3 CO 2
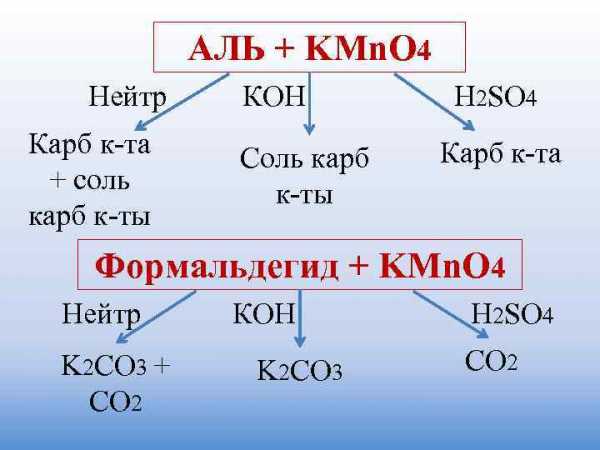 АЛЬ + KMn. O 4 Нейтр КОН H 2 SO 4 Карб к-та Соль карб Карб к-та + соль к-ты карб к-ты Формальдегид + KMn. O 4 Нейтр КОН H 2 SO 4 K 2 CO 3 + K 2 CO 3 CO 2 СО 2
АЛЬ + KMn. O 4 Нейтр КОН H 2 SO 4 Карб к-та Соль карб Карб к-та + соль к-ты карб к-ты Формальдегид + KMn. O 4 Нейтр КОН H 2 SO 4 K 2 CO 3 + K 2 CO 3 CO 2 СО 2
present5.com
Окислительно-восстановительные реакции в органической химии
Текст этой презентации
Слайд 1
Окислительно-восстановительные реакции (ОВР) с участием органических веществ
Слайд 2
Горение органических веществ(полное окисление)
Реакция горения приводит к полному окислению органических веществ, в результате чего образуются СО2 и Н2О: 2С4Н10 + 13О2 = 8СО2 + 10Н2О бутан
С2Н4 + 3О2 = 2СО2 + 2Н2О этен
2С2Н2 + 5О2 = 4СО2 + 2Н2О этин
С2Н5ОН + 3О2 = 2СО2 + 3Н2О этанол
При сгорании азотсодержащих веществ выделяется также N2:
4СН3Nh3 + 9O2 = 4CO2 + 10h3O + 2N2 метиламин
Горение хлорпроизводных углеводородов сопровождается выделением HСl:
2C2H5Cl + 6O2 = 4CO2 + 4h3O + 2HCl хлорэтан
Слайд 3
Алканы
При обычных условиях устойчивы к действию окислителей (растворы KMnO4, K2Cr2O7). В результате контролируемого каталитического окисления кислородом можно получить спирты, альдегиды, кетоны, карбоновые кислоты:
Слайд 4
Алкены
В зависимости от природы окислителя и условий реакции образуются различные продукты: двухатомные спирты, альдегиды, кетоны, карбоновые кислоты При окислении водным растворoм KMnO4 при комнатной температуре происходит разрыв π-связи и образуются двухатомные спирты (реакция Вагнера): Обесцвечивание раствора перманганата калия — качественная реакция на кратную связь
Слайд 5
Алкены
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но и σ-связи
Продукты реакции – карбоновые кислоты и кетоны (в зависимости от строения алкена)
С помощью этой реакции по продуктам окисления алкена можно определить положение двойной связи в его молекуле:
Слайд 6
Алкены
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона:
Слайд 7
Алкены
Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
Слайд 8
Алкены
В результате каталитического окисления алкенов кислородом воздуха получают эпоксиды:
В жестких условиях при сжигании на воздухе алкены, как и другие углеводороды, сгорают с образованием углекислого газа и воды:
С2Н4 + 3О2 → 2СО2 + 2Н2О
Слайд 9
Алкины
Алкины легко окисляются перманганатом калия и бихроматом калия по месту кратной связи
При действии на алкины водным раствором KMnO4 происходит его обесцвечивание (качественная реакция на кратную связь)
При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
Слайд 10
Алкины
Окисление перманганатам калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образованию кислот: Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих условиях образованием карбоновой кислоты и СО2:
Слайд 11
Циклоалканы
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) циклоалканы образуют двухосновные карбоновые кислоты с тем же числом атомов углерода: Адипиновая кислота используется для производства полиамидных волокон – капрона и найлона
Слайд 12
Арены
Бензол Устойчив к окислителям при комнатной температуре
Не реагирует с водными растворами перманганата калия, бихромата калия и других окислителей
Можно окислить озоном с образованием диальдегида:
Слайд 13
Арены
Гомологи бензола
Окисляются относительно легко. Окислению подвергается боковая цепь, у толуола – метильная группа. Мягкие окислители (MnO2) окисляют метильную группу до альдегидной группы:
О //
С6Н5СН3 + MnO2 → C6H5− C Н бензальдегид
Слайд 14
Арены
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной: В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль — бензоат калия:
Слайд 15
Арены
Под действием сильных окислителей (KMnO4 в кислой среде или хромовая смесь) боковые цепи окисляются независимо от строения: атом углерода, непосредственно связанный с бензольным ядром, до карбоксильной группы, остальные атомы углерода в боковой цепи — до СО2 Окисление любого гомолога бензола с одной боковой цепью под действием KMnO4 в кислой среде или хромовой смеси приводит к образованию бензойной кислоты:
Слайд 16
Арены
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты:
Слайд 17
Арены
В нейтральной или слабощелочной среде при окислении перманганатом калия образуются соль карбоновой кислоты и карбонат калия:
Слайд 18
Спирты
Наиболее подходящие окислители для первичных и вторичных спиртов: KMnO4, хромовая смесь, О2 в присутствии катализатора, Cl2, Br2 Первичные спирты, кроме метанола, окисляются до альдегидов или карбоновых кислот:
Слайд 19
Спирты
Метанол окисляется до СО2: Этанол под действием Cl2 окисляется до уксусного альдегида: Вторичные спирты окисляются до кетонов:
Слайд 20
Фенолы
Окисляются легко благодаря наличию гидроксогруппы, соединенной с бензольным кольцом Фенол окисляется пероксидом водорода в присутствии катализатора до двухатомного фенола пирокатехина, при окислении хромовой смесью – до пара-бензохинона:
Слайд 21
Альдегиды и кетоны
Альдегиды окисляются легко, при этом альдегидная группа окисляется до карбоксильной: Метаналь окисляется до CО2:
Слайд 22
Альдегиды и кетоны
Ароматические альдегиды легко окисляются даже кислородом воздуха:
Слайд 23
Альдегиды и кетоны
Качественные реакции на альдегиды: окисление гидроксидом меди(II) реакция «серебряного зеркала»
Соль, а не кислота!
Слайд 24
Альдегиды и кетоны
Кетоны окисляются с трудом, слабые окислители на них не действуют Под действием сильных окислителей происходит разрыв С — С связей по обе стороны карбонильной группы с образованием смеси кислот (или кетонов) с меньшим числом атомов углерода, чем в исходном соединении:
Слайд 25
Альдегиды и кетоны
В случае несимметричного строения кетона окисление преимущественно осуществляется со стороны менее гидрированного атома углерода при карбонильной группе (правило Попова – Вагнера) По продуктам окисления кетона можно установить его строение:
Слайд 26
Непредельные карбоновые кислоты
Легко окисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей: В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Слайд 27
Щавелевая кислота
Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии): При нагревании подвергается декарбоксилированию (реакция диспропорционирования): В присутствии концентрированной h3SO4 при нагревании щавелевая кислота и ее соли (оксалаты) диспропорционируют:
topslide.ru
ОВР в органической химии — Естественно-научные дисциплины — Кафедры — Каталог статей
План урока по химии в специализированном классе10 КЛАСС
ПРИМЕНЕНИЕ МЕТОДА ИОННО — ЭЛЕКТРОННОГО БАЛАНСА В КУРСЕ ОРГАНИЧЕСКОЙ ХИМИИ.
учитель химии лицея № 104 — Ивойлова Е.А.
Задачи урока:
Тип урока: Создать условия, для самостоятельного переноса имеющиеся у учащихся знаний об ОВР на курс органической химии 10 класса, дать возможность самостоятельно применить метод полуреакций при составлении окислительно – восстановительных реакций с участием органических веществ; составить алгоритм действий для таких уравнений. Показать учащимся возможности применения метода полуреакций в нестандартных ситуациях (при проведении практических исследований, при решении задач по органической химии). Провести диагностику и продолжить формирование таких умений как, сравнение и анализ полученных результатов, умения делать выводы.
Изучение нового материала
Оборудование: § Схема – KMnO4 , K2Cr2O7, h3O2 в различных средах
§ Задания для практического исследования по группам.
§ Карта опроса – решение задач по органической химии с использованием метода полуреакций (на два варианта, по трем уровням сложности).
Реактивы: C2H5OH, Ch4OH, HCOH, HCOOK, K2Cr2O7, KMnO4, h3O2, h3SO4, KOH (все вещества выдаются в растворах),
ХОД УРОКА
ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ ДЕЯТЕЛЬНОСТЬ УЧАЩИХСЯ
I. МОТИВАЦИОННО – ОРИЕНТАЦИОННЫЙ ЭТАП
1.Организационный момент. Подготовка к уроку, приветствие
2. Сообщение темы и цели занятия.
В экзаменационных билетах по химии для поступающих в ВУЗы часто встречаются задания, при выполнении которых необходимо подобрать коэффициенты в уравнениях окислительно – восстановительных реакций методами электронного и ионно-электронного баланса. Первый метод достаточно подробно рассмотрен в школьных учебниках, поэтому мы не будем подробно на нем останавливаться. Метод ионно-электронного баланса или полуреакций, вызывает множество вопросов, поэтому цель занятия как можно с большей самостоятельностью рассмотреть использование метода полуреакций в курсе органической химии.
Но сначала давайте вспомним основные термины, которые нам будут необходимы для последующей работы. Дайте определения следующим понятиям:
§ ОВР
§ Реакция окисления и восстановитель
§ Реакция восстановления и окислитель
§ Степень окисления
§ Ионы и условия их образования
§ Методы решения ОВР Запись темы урока в тетради.
Учащиеся дают определения понятиям, приводят примеры
II. ОПЕРАЦИОННО-ИСПОЛНИТЕЛЬСКИЙ ЭТАП.
3. Сопоставление методов электронного и ионно-электронного баланса при написании ОВР.
Для того, что бы определится каким из методов эффективнее пользоваться при решении ОВР в органической химии, давайте решим одно и то же уравнение этими двумя способами.
Исходя из ваших решений, сравните эти оба метода и сделайте вывод, в чем вы видите преимущества метода ИЭБ?
Двое учащихся решают уравнение у доски, остальные работают в тетрадях:
ЭБ:
§ Ch4OH + KMnO4 + h3SO4 HCOOH + MnSO4 + K2SO4 + h3O
C-2 – 4e C+2 5 реакция окисления, восстановитель
Mn +7 + 5e Mn+2 4 реакция восстановления, окислитель
5Ch4OH + 4KMnO4 +6 h3SO4 5HCOOH + 4MnSO4 + 2K2SO4 + 11h3O
ИЭБ:
§ 5Ch4OH + 4KMnO4 +6 h3SO4 5HCOOH + 4MnSO4 + 2K2SO4 + 11h3O
Ch4OH + h3O – 4e HCOOH + 4H+ 5
MnO4- + 8H+ + 5e Mn2+ + 4h3O 4
12 11
5Ch4OH +5 h3O + 4MnO4- + 32H+ 5 HCOOH + 20H++ 4Mn2+ + 16h3O
Учащиеся делают выводы и записывают их себе в тетрадь:
1. Не нужно определять степени окисления у атомов.
2. Применяются не гипотетически существующие частицы, а реально существующие ионы и вещества.
3. Возможно, определить не только число принятых или отданных электронов в полуреакции, но и видна роль среды как активного участника всего процесса.
4. Нет трудностей с расстановкой коэффициентов в молекулярных уравнениях.
5,6*. Не нужно знать все полученные вещества, или все вещества взятые для реакции , так как они появляются в уравнении реакции при его выводе.
7*. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов, происходящих в гальваническом элементе и при электролизе.
PS*. Пункты 5* – 7* появляются только при работе над следующим заданием.
4. Фронтальная работа по решению уравнений методом полуреакций с использованием различных сред.
Возможно, что у метода полуреакций есть еще положительные стороны. Давайте с вами вместе решим еще несколько уравнений, которые будут происходить в различных средах.
Двое учащихся решают уравнения на закрытых досках, остальные работают в тетрадях, а затем проводится проверка:
§ CH = CH + KMnO4 + h3O ?
CH = CH + 4h3O – 8e (COOH)2 + 8H+ 3
MnO4- + 2h3O + 3e MnO2 + 4OH- 8
28 4 24 h3O 8
3CH = CH + 12h3O + 8MnO4- + 16h3O 3(COOH)2 + 24H+ + 8 MnO2 + 32OH-
3CH = CH + 8KMnO4 + 4h3O 3(COOH)2 + 8MnO2 + 8KOH
щавелевая кислота
§ ? Ch3OH(CHOH)4COOH + Cu2O + h3O +Na2SO4
глюконовая кислота
Ch3OH(CHOH)4COH + 2OH- -2e Ch3OH(CHOH)4COOH + h3O 1
2Cu2+ + 2OH- + 2e Cu2O + h3O 1
4 2
Ch3OH(CHOH)4COH + 2OH- + 2Cu2+ + 2OH- Ch3OH(CHOH)4COOH + h3O + Cu2O + h3O
Ch3OH(CHOH)4COH + 4KOH + 2CuSO4 Ch3OH(CHOH)4COOH + 2h3O + Cu2O + + 2K2SO4
Записываются выводы 4* — 7*.
5. Составление алгоритма действий.
Ребята! Мы с вами рассмотрели как применяется метод полуреакций при решении уравнений с участием органических веществ. Давайте же обобщим полученные результаты, и составим алгоритм действий. В какой последовательности вы производили запись уравнений?
Запись алгоритма на доске со слов учащихся
Учащиеся самостоятельно формируют алгоритм действий и записывают его в тетрадь.
Алгоритм действий при составлении уравнений методом полуреакций:
1. Определить какие вещества, содержат химические элементы, меняющие степени окисления. Если не указаны исходные вещества или продукты реакции, предположит их строение согласно схеме:
УгВ [O] спирт [O] альдегид (кетон) [O] КК [O] CO2 + h3O.
NB! Чем сильнее окислитель, тем более окисленными будут продукты реакции.
2. Составить схемы ионно — электронных уравнений для процессов окисления и восстановления, используя реально существующие частицы и вещества.
3. Уравнять количества материальных частиц в полуреакциях, используя знания о среде в которой идет данная реакция
4. Уравнять сумму зарядов “до и после реакции”, согласно закону электронейтральности.
5. Определить коэффициенты увеличения для процессов окисления, восстановления (по закону сохранения и превращения энергии).
6.Суммировать “левые и правые” части ионно – электронных уравнений, с учетом подобранных коэффициентов.
7. Произвести сокращение подобных членов (при необходимости).
8. Расставить коэффициенты в молекулярном уравнении.
III. КОРРЕКЦИОННО – ПРАКТИЧЕСКИЙ ЭТАП.
6. Практическое исследование.
Для того, что бы посмотреть, как вы поняли новый материал и закрепить полученные на уроке знания и умения, предлагается выполнить вам небольшое практическое исследование. В течение 15 минут вы работаете в группах, а затем защищаете полученные результаты.
7. Объяснение задания на дом.
По карте “Готовимся к экзаменам “ прорешать ОВР методом полуреакций с использованием органических и неорганических веществ.
Учащиеся работают в группах, а затем защищают полученные результаты, остальные учащиеся фиксируют их у себя в тетрадях (См. приложение 1).
§ 3C2H5OH +2K2Cr2O7 + 8h3SO4 3Ch4COH + 2Cr2(SO4)3 +2K2SO4 + 11h3O
C2H5OH + h3O – 4 Ch4COH + 4H+ 3
Cr2O72- + 14H+ + 6e 2Cr3+ + 7h3O 2
16 11
3C2H5OH + 3h3O + 2Cr2O72- + 28H+ 3Ch4COH + 12H+ + 4Cr3+ + 14h3O
§ 3HCOH + KMnO4 + h3O 3CO2 + 4MnO2 + 4KOH + h3O
HCOH + h3O – 4e CO2 + 4H+ 3
MnO4- + 2h3O + 3e MnO2 +4OH- 4
11 12h3O 4
3HCOH + 3h3O + 4MnO4- + 8h3O 3CO2 + 12H+ + 4MnO2 +16OH-
§ Ch4OH + KMnO4 + h3SO4 CO2 + MnSO4 +
Ch4OH + h3O + 6e CO2 + 6H+ 5
MnO4- + 8H++ 5e Mn2+ + 4h3O 6
18 19
5Ch4OH + 5h3O + 6MnO4- + 48H+ 5CO2 + 30H+ + 6Mn2+ + 24h3O
§ HCCONa + NaOH + h3O2 Na2CO3 + 2h3O
HCCO- +3OH- -2e CO32- + 2h3O 1
h3O2 + 2e 2OH- 1
1
HCCO- +3OH- + h3O2 CO32- + 2h3O + 2OH-
Учащиеся записывают домашнее задание.
IV. КОТРОЛИРУЮЩЕ – ДИАГНОСТИЧЕСКИЙ ЭТАП.
8. Применение знаний в нестандартной ситуации (решение задач с использованием метода полуреакций).
Пришло время защитить те знания и умения, которые вы получили, для этого проведем контроль в нестандартной для вас ситуации – решим задачи с использование метода ионно — электронного баланса. Задачи даны в 2х вариантах , по трем программам А, В, С. (программа А – базисная, программа В – повышенный уровень, программа С – продвинутый уровень).
Учащиеся решают задачи с самостоятельным выбором уровня сложности и сдают тетради учителю (См. приложение 2).
V. ОЦЕНОЧНО – РЕФЛЕКСИВНЫЙ ЭТАП.
9. Подведение итогов урока.
Учитель выставляет оценки за урок и комментирует их.
Учащиеся оценивают свою деятельность на уроке, возвращаясь к плану урока, подводят итоги, еще раз перечисляя всё, что они делали на уроке и зачем проводилась та или иная форма работы.
ПРИЛОЖЕНИЕ 1
ЗАДАНИЯ ДЛЯ ПРАКТИЧЕСКОГО ИССЛЕДОВАНИЯ.
1. Проделайте опыты согласно номеру группы, в которой вы находитесь.
№ группы Задание
I, IV В пробирку с 1 мл этилового спирта прилейте примерно 0,5 мл дихромата калия, а затем добавьте 8 – 10 капель серной кислоты. Сравните полученный результат с эталоном. Написав соответствующую ОВР, сделайте вывод о возможных продуктах реакции.
II, IV В пробирку к 1 мл формалина прилейте примерно 1 мл перманганата калия, а затем добавьте немного дистиллированной воды. Сравните полученный результат с эталоном. Написав соответствующую ОВР, сделайте вывод о возможных продуктах реакции.
II, III В пробирку с 0,5 мл метанола прилейте примерно 3 мл перманганата калия, а затем добавьте 6 – 8 капель серной кислоты. Сравните полученный результат с эталоном. Написав соответствующую ОВР, сделайте вывод о возможных продуктах реакции.
I, III В пробирку к 1 мл формиата калия прилейте 1 мл гидроксида калия подкрашенного фенолфталеином, а затем добавьте немного перекиси водорода. Сравните полученный результат с эталоном. Написав соответствующее ОВР, сделайте вывод о возможных продуктах реакции.
2. Защитите полученные результаты, сравнив их с итогами работы других групп.
§ Выясните вопросы, возникшие во время работы над заданием.
ПРИЛОЖЕНИЕ 2
РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ МЕТОДА ПОЛУРЕАКЦИЙ.
УРОВЕНЬ ВАРИАНТ 1 ВАРИАНТ 2
УРОВЕНЬ
А Восстановление нитробензола в анилин в концентрированном растворе соляной кислоты идет согласно уравнению: C6H5NO2 + Fe + HCl — C6H5Nh3 + +FeCl2 + h3O. Определите объем образовавшейся воды, если для реакции взяли 1 кг технического нитробензола, содержащего 10 % примесей. Восстановление нитробензола в анилин в водном растворе идет согласно уравнению: C6H5NO2 + Fe + h3O — C6H5Nh3 + +Fe(OH)3. Определите объем образовавшегося анилина, если выход его от теоретически возможного составил 90 %, а для реакции был взят 1кг нитробензола.
А
В Для реакции окисления 44,8 г ацетилена до щавелевой кислоты (COOH–COOH) в нейтральной среде, было взято 142 г перманганата калия. Какой объём кислоты был получен в результате этой реакции, если её выход составил 98,3 %. Для реакции окисления 73,6 г толуола до бензойной кислоты (C6H5–COOH) в кислой среде, было взято 284 г 20%-ного раствора перманганата калия. Определите массу воды, образовавшейся в результате этой реакции.
В
С 11,4 г смеси формалина с этиловым спиртом массой подвергли окислению перманганатом калия в кислой среде. При пропускании образовавшегося газа через раствор известковой воды выпал осадок массой 45 г. Рассчитайте массовые доли веществ в исходной смеси. При реакции окисления 4,032 л смеси ацетилена с этиленом перманганатом калия до щавелевой кислоты (COOH–COOH) в нейтральной среде, был получен гидроксид калия. На нейтрализацию полученной щелочи было затрачено 18,25 г соляной кислоты. Рассчитайте объёмные доли веществ в исходной смеси.
С
§ Выполнение уровня А – обязательно.
ПРИЛОЖЕНИЕ 3
ВЛИЯНИЕ СРЕДЫ НА ХАРАКТЕР ПРОТЕКАНИЯ РЕАКЦИИ.
кислая ( H+ ) Mn2+
KMnO4 нейтральная ( h3O ) MnO2 (бурый осадок)
щелочная ( ОH- ) MnO42- (зеленный раствор)
K2CrO4 кислая ( H+ ) соли Cr3+
K2Cr2O7 щелочная ( ОH- ) CrO33-
CrO2-
окислитель кислая ( H+ ) h3O2 + 2H+ + 2e – 2h3O
h3O2 нейтр. и щелоч.(h3O, ОH-) h3O2 + 2e – 2 OH-
восстановитель 2h3O2 — 2e – 2h3O + O2
ПРИЛОЖЕНИЕ 4
БАЛАНС КИСЛОРОДА В ПОЛУРЕАКЦИЯХ
Избыток атомов кислорода Недостаток атомов кислорода
Кислая
… + x H+ y h3O + … … + x h3O y H+ + …
СРЕДА
Нейтральная … + x h3O y OH- + … … + x h3O y H+ + …
Щелочная … + x h3O y OH- + … … + x OH- y h3O + …
metodichka104.ucoz.ru
Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химииКандидат химических наук В. А. Кузьмин
Органическая химия располагает громадным числом реакций, большинство из которых имеет окислительно-восстановительную природу, т.е. они протекают с переносом электронов, при этом одни атомы повышают свою степень окисления (окисляются), другие понижают (восстанавливаются). Следует также отметить, что процессы окисления и восстановления обычно рассматриваются в курсе органики по отдельности друг от друга. С чем это связано? Термины “окисление” и “восстановление” применяются по отношению к тому веществу, превращения которого хочет достигнуть химик. Подобное вещество именуется субстратом, а вещество, играющее роль окислителя или восстановителя – реагентом (или агентом). Как в данной реакции отличить субстрат от агента? Молекула субстрата, как правило, имеет более сложное строение, чем молекула агента. В качестве окисляющих или восстанавливающих агентов часто применяются неорганические вещества. В большинстве случаев окислительные процессы в органической химии сводятся к присоединению к молекулам субстрата атомов кислорода или отщеплению атомов водорода (реакции дегидрирования), восстановительные же реакции сводятся к присоединению атомов водорода (гидрирование) или к отщеплению атомов кислорода. В данном разделе мы затронем лишь, те из ОВР внимание на которые обращает программа для поступающих в ВУЗы.
Окислительные процессы
Окисление спиртов
В качестве окислителей чаще всего используются:
KMnO4 +H2SO4
K2Cr2O7 + H2SO4
O2 (Cu)
CuO
Лёгкость окисления спиртов уменьшается в ряду:
Первичные ≥ Вторичные >> Третичные
а) Полное окисление спиртов (горение в кислороде):
б) Частичное окисление:
Окисление третичных спиртов протекает в жёстких условиях (сильный окислитель, нагревание) и приводит к сложной смеси карбоновых кислот и кетонов.
Отметим, что первая стадия данного процесса (дегидратация спирта протекает по правилу Зайцева: водород отщепляется от наименее гидрогенизированного углеродного атома).
Составление уравнений реакций окисления спиртов:
CH3OH + O2 (полное окисление) =
CH3OH + KMnO4 + H2SO4 =
СH3OH + K2Cr2O7 + H2SO4 =
CH3OH + O2 (на Cu) =
CH3OH + CuO =
Окисление альдегидов
Альдегиды окисляются гораздо легче, чем спирты.
Окисление альдегидов протекает до соответствующих карбоновых кислот.
Чаще всего для окисления альдегидов используют:
[Ag(NH3)2]OH (Ag2O, аммиачный раствор оксида серебра, реактив Толленса)
Cu(OH)2 (свежеосаждённый гидроксид меди (II))
Получение данных реагентов:
AgNO3 + NH4OH = NH4NO3 + Ag2O↓ + H2O
Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + 3H2O
AgNO3 + 5NH4OH = 2[Ag(NH3)2]OH + NH4NO3 + 4H2O (суммарное уравнение)
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 (можно использовать и другие растворимые соли меди (II) а также любую щёлочь)
а) Окисление аммиачным раствором оксида серебра (реакция “серебряного зеркала”), является качественной реакцией на альдегидную группу:
(в недостатке окислителя)
(в избытке окислителя)
В некоторых случаях подобную реакцию записывают в упрощённом виде:
б) Окисление свежеосаждённым гидроксидом меди (II):
в) Окисление перманганатом калия в кислой, нейтральной и щелочной средах:
Особенности окисления муравьиного альдегида:
Суммарное уравнение реакции:
Окисление кетонов
Кетоны окисляются достаточно в жёстких условиях (KMnO4 или K2Cr2O7 в кислой или щелочной среде при нагревании), продуктами реакции является смесь карбоновых кислот.
Пример:
Важное практическое значение имеют реакции окисления циклических кетонов, так как в их результате образуются дикарбоновые кислоты, которые применяют при производстве полимеров.
(синтез адипиновой кислоты из циклогексанона)
Окисление алкенов
а) Полное окисление:
CnH2n + 1,5nO2 = nCO2 + nH2O
б) Неполное каталитическое окисление (протекает до соответствующих эпоксидов):
в) Окисление перманганатом калия в нейтральной среде (Реакция Вагнера, продуктами являются двухатомные спирты- гликоли):
г) Окисление перманганатом калия в кислой среде (протекает с образованием соответствующих карбоновых кислот и (или) кетонов):
Кетоны, образовавшиеся в результате окисления, могут подвергаться дальнейшей деструкции.
С помощью данной реакции можно определить положение двойной связи в молекуле алкена.
д) Окисление озоном (протекает с образованием неустойчивых озонидов, реакция так же используется для определения положения двойных связей в молекуле алкена):
е) Окисление алкенов в присутствии солей палладия (Вакер-процесс, протекает с образованием альдегидов и кетонов, имеет промышленное значение):
Окисление гомологов этилена в этом случае протекает по менее гидрогенизированному углеродному атому:
Данным способом можно получить циклогексанон из циклогексена:
Окисление алкинов
а) Алкины окисляются до альдегидов или кетонов под воздействием воды в присутствии Hg2+ в кислой среде (реакция гидратации; реакция Кучерова):
На первой стадии реакции образуется непредельный спирт, в котором ОН-группа находится у атома углерода при двойной связи (виниловый спирт, енол). Это соединение является неустойчивым и подвергается на второй стадии изомеризации (Правило Эльтекова-Эрленмеера) с образованием альдегида.
Гомологи ацетилена при гидратации дают кетоны (при этом соблюдается Правило Марковникова):
б) Окисление KMnO4, K2Cr2O7 в кислой, нейтральной или щелочной средах (протекает с образованием карбоновых кислот (в кислой среде) или их солей (в нейтральной и щелочной)):
Данные реакции являются качественными на тройную углерод-углеродную связь.
Окисление бензола и его гомологов.
а) Полное окисление (горение в кислороде):
CnH2n-6 + O2 = CO2 + H2O
б) Окисление бензола озоном (озонолиз):
в) Окисление гомологов бензола перманганатом калия или бихроматом калия при нагревании:
д) Окисление кумола кислородом в присутствии катализатора (кумольный способ получения фенола):
Окисление алканов.
1). Полное окисление (горение в кислороде):
CnH2n+2 + O2 = CO2 + H2O
2). Неполное сгорание:
CnH2n+2 + O2 = CO + H2O
CnH2n+2 + O2 = C + H2O
3) Неполное каталитическое окисление:
C2H6 + O2 = CH3CHO + H2O
2C4H10 + 5O2 = 4CH3COOH + 2H2O
Восстановительные процессы
Восстановление алкенов (реакция гидрирования алкенов):
Алкен + Н2 = Алкан
CnH2n + H2 = CnH2n+2
Восстановление алкинов (реакция гидрирования алкинов):
Алкин + Н2 = Алкен + Н2 = Алкан
CnH2n-2 + H2 = CnH2n + H2 = CnH2n+2
Восстановление бензола (реакция гидрирования бензола):
Восстановление альдегидов:
А) водородом на катализаторе:
Б) литийалюмогидридом:
be.convdocs.org
ОВР с участием органических веществ
ОВР с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C2H4 + 2KMnO4 + 2H2O CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 17H2O (нагревание)
2) 5CH3CH=CH2 + 10KMnO4 + 15H2SO4 5CH3COOH + 5CO2 + 10MnSO4 + 5K2SO4 + 20H2O (нагревание)
3) CH3CH=CHCH2CH3 + 6KMnO4 + 10KOH CH3COOK + C2H5COOK + 6H2O + 6K2MnO4 (нагревание)
4) CH3CH=CH2 + 10KMnO4 + 13KOH CH3COOK + K2CO3 + 8H2O + 10K2MnO4 (нагревание)
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH3C CH + 8KMnO4 + 12H2SO4 5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R1–CO–CO–R2), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C2H2 + 8KMnO4 = 3K2C2O4 +2H2O + 8MnO2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C2H2 + 2KMnO4 +3H2SO4 =2CO2 + 2MnSO4 + 4H2O + K2SO4
Гомологи бензола. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O (при кипячении)
C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O (нагревание)
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислотной среде с раствором KMnO4 или K2Cr2O7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2–COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH. Все реакции идут при нагревании:
3CH3CHO + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4 = 3CH3COOH + Cr2(SO4)3 + 7H2O
CH3CHO + 2[Ag(NH3)2]OH = CH3COONH4 + 2Ag + H2O + 3NH3
Формальдегид с избытком окислителя окисляется до углекислого газа.
coolreferat.com