Растворимость — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июня 2018; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июня 2018; проверки требует 1 правка.Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Зависимость растворимости веществ от температуры выражается с помощью кривых растворимости. По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе — приводит к образованию некоторых минералов, участвует в процессах, протекающих в горных породах.
Способы выражения характеристик растворимости[править | править код]
Характеристики растворимости подразделяются на качественные и количественные.
Качеств
ru.wikipedia.org
Растворы
73
Леккия №17
РАСТВОРЫ
План
Общая характеристика растворов.
Способы выражения концентрации растворов.
Термодинамика и механизм процесса растворения.
Растворимость.
Вода как растворитель. Значение растворов в жизнедеятельности организмов
1. Общая характеристика растворов.
Растворы– это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы.
По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам.
2. Способы выражения концентрации растворов.
Относительное содержание компонентов в растворе определяется его концентрацией.
Молярная концентрация– это количество вещества, содержащееся в одном литре раствора (моль/л):
Э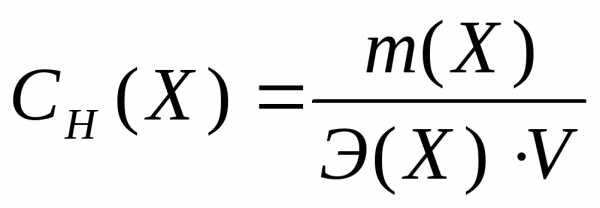 квивалентная
концентрация– это число молей
эквивалентов вещества, содержащихся в
одном литре раствора (моль/л):
квивалентная
концентрация– это число молей
эквивалентов вещества, содержащихся в
одном литре раствора (моль/л):
Эквивалент– это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону.
Масса одного моля эквивалентов называется молярной массой эквивалента вещества (Э). В разных реакциях одно и то же вещество может иметь разные эквиваленты.
Моляльная концентрация– это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
М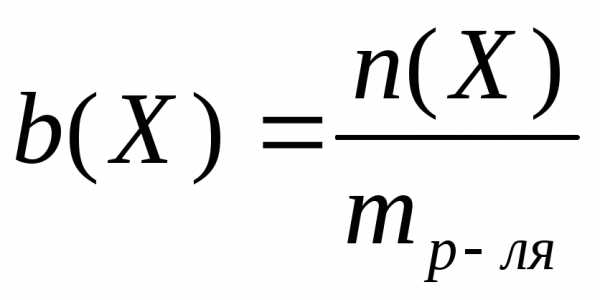 ассовая
доляравна отношению массы растворенного
вещества к массе раствора:
ассовая
доляравна отношению массы растворенного
вещества к массе раствора:
М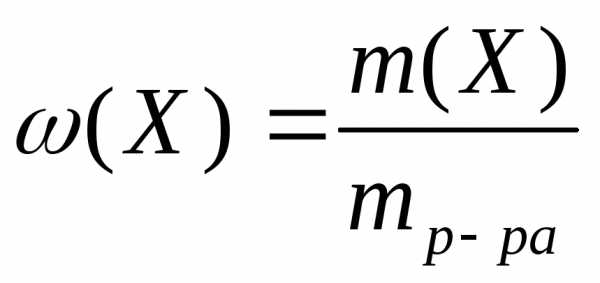 олярная
доляравна отношению количества
растворенного вещества в общему
количеству веществ в растворе:
олярная
доляравна отношению количества
растворенного вещества в общему
количеству веществ в растворе:
К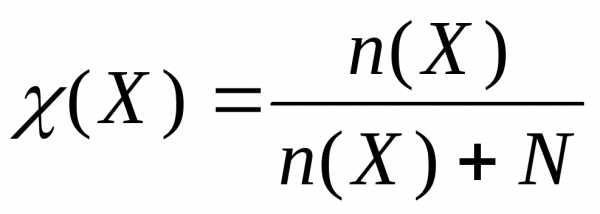 ак
правило, вещество обладает определенной
растворимостью в данном растворителе.
Подрастворимостьюпонимают
концентрацию вещества в насыщенном
растворе.
ак
правило, вещество обладает определенной
растворимостью в данном растворителе.
Подрастворимостьюпонимают
концентрацию вещества в насыщенном
растворе.
3. Термодинамика и механизм процесса растворения
Растворение – сложный физико-химический процесс, включающий три основные стадии, каждая из которых характеризуется изменениями термодинамических функций Н иS:
разрушение химических и межмолекулярных связей в растворяемом веществе (например, разрушение кристаллической решетки): Н1>0,S1>0
химическое взаимодействие частиц растворенного вещества с растворителем (сольватация): Н2<0,S2<0
равномерное распределение частиц растворенного вещества в среде растворителя путем диффузии: Н3>0,S3>0
Согласно 2-му закону термодинамики условием самопроизвольности процесса растворения является убыль энергии Гиббса:
G=H-TS< 0,
которая складывается из энтальпийного Н и энтропийногоTSфакторов.
Растворение газов в жидкостях приводит к упорядочению системы и, следовательно, сопровождается уменьшением энтропии: Sр-ния<0. Движущей силой процесса растворения в этом случае является энтальпийный фактор и растворение большинства газов является процессом экзотермическим:Н р-ния<0. Таким образом, самопроизвольное растворение газов возможно при низких температурах (|Н| > |TS|)
Растворение жидких и твердых веществ в жидкостях приводит к увеличению беспорядка в системе и увеличению энтропии: Sр-ния>0. Суммарный тепловой эффект процесса растворения определяется в основном слагаемымиН1иН2и в зависимости от их соотношения может и быть и положительным (NaCl), и отрицательным (NaOH). Растворение большинства кристаллических веществ – процесс эндотермическийНр-ния>0, так как энергия, затрачиваемая на разрушение кристаллической решетки не компенсируется энергией, выделяемой за счет сольватации. Таким образом, самопроизвольному растворению большинства твердых веществ способствуют высокие тепмературы (|Н| < |TS|).
4. Растворимость
Под растворимостьюпонимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Насыщеннымназывают раствор, который находится в равновесии с избытком растворяемого вещества (Gр-ния=0). Насыщенный раствор имеет максимально возможную в данных условиях концентрацию.
Растворимость зависит:
от природы растворенного вещества и растворителя;
от температуры;
от давления;
от присутствия третьих компонентов.
Влияние природыкомпонентов на растворимость определяется принципом:подобное растворяется в подобном. Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
Влияние температурына растворимость зависит от теплового эффекта растворения и определяется принципом Ле Шателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей — процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:
Количество газа, растворенного в определенном объеме жидкости при постоянной температуре прямо пропорционально давлению газа.
c(X) = Kгp(X)
где c(X) – молярная концентрация газа,моль/л
Kг — константа Генри, моль/лПа
p(X) – давление газа над раствором, Па
Влияние присутствия третьих компонентов.
Растворимость газов в жидкостях значительно снижается в присутствии электролитов (солей) Этот процесс называют высаливанием.
Закон Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается.
С(X) = С0(X)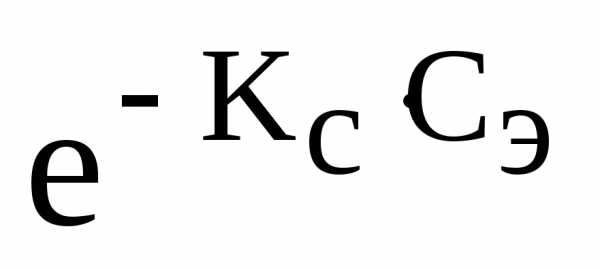
где С(X) – растворимость газа в присутствии электролита
С0(X) – растворимость газа в чистом растворителе
КС— константа Сеченова
Сэ— концентрация электролита
Биологическое значение законов Генри и Сеченова.
Изменение растворимости газов в крови при изменении давления может привести к тяжелым заболеванием. Кесонная болезнь у водолазов – проявление закона Генри. В соответствии с законом Сеченова растворимость кислорода и углекислого газа в крови зависит от концентрации электролитов, а также белков, липидов и других веществ.
5. Вода как растворитель. Значение растворов в жизнедеятельности организмов
Самым распространенным растворителем на нашей планете является вода. У животных и растительных организмов содержание воды составляет обычно более 50%, а в ряде случаев достигает 90-95%.
Вода хорошо растворяет многие ионные и полярные соединения. Такое свойство воды связано с ее высокой диэлектрической проницаемостью (= 78,5). В результате многие ионные соединения диссоциируют и отличаются высокой растворимостью в воде. Другой класс веществ, хорошо растворимых в воде, составляют полярные органические соединения (спирты, альдегиды, кетоны). Их растворимость обусловлена образованием водородных связей с молекулами воды.
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения, более высокая плотность в жидком состоянии, чем в твердом.
Вследствие высокой полярности вода вызывает гидролиз веществ (эфиров, амидов и др.). Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Биохимические процессы в живых организмах протекает в водных растворах.
В жидких средах организма поддерживается постоянство рН, концентрации солей и органических веществ, постоянство осмотического давления. Такое постоянство называется гомеостазом. Приведенные примеры показывают, что учение о растворах представляет особый интерес для медиков.
73
studfiles.net
таблица. Растворимость веществ в воде
В повседневной жизни люди редко сталкиваются с чистыми веществами. Большинство предметов представляют собой смеси веществ.
Раствор — это однородная смесь, в которой компоненты равномерно смешались. Есть несколько их видов по размеру частиц: грубодисперсные системы, молекулярные растворы и коллоидные системы, которые часто называют золи. В этой статье речь идет о молекулярных (или истинных) растворах. Растворимость веществ в воде — одно из главных условий, влияющих на образование соединений.
Растворимость веществ: что это и зачем нужно
Чтобы разобраться в этой теме, нужно знать, что такое растворы и растворимость веществ. Простым языком, это способность вещества соединяться с другим и образовывать однородную смесь. Если подходить с научной точки зрения, можно рассмотреть более сложное определение. Растворимость веществ — это их способность образовывать с одним или более веществами гомогенные (или гетерогенные) составы с дисперсным распределением компонентов. Существует несколько классов веществ и соединений:
- растворимые;
- малорастворимые;
- нерастворимые.

О чем говорит мера растворимости вещества
Содержание вещества в насыщенной смеси — это мера его растворимости. Как сказано выше, у всех веществ она разная. Растворимые — это те, которые могут развести более 10 г себя на 100 г воды. Вторая категория — менее 1 г при тех же условиях. Практически нерастворимые — это те, в смесь которых переходит менее 0,01 г компонента. В этом случае вещество не может передавать воде свои молекулы.
Что такое коэффициент растворимости
Коэффициент растворимости (k) — это показатель, максимальной массы вещества (г), которая может развестись в 100 г воды или другого вещества.
Растворители
В данном процессе участвуют растворитель и растворенное вещество. Первый отличается тем, что изначально он пребывает в таком же агрегатном состоянии, что и конечная смесь. Как правило, он взят в большем количестве.
Однако многие знают, что в химии вода занимает особое место. Для нее существуют отдельные правила. Раствор, в котором присутствует H2O называется водным. Когда говорится о них, жидкость является экстрагентом и тогда, когда она в меньшем количестве. В пример можно привести 80%-ный раствор азотной кислоты в воде. Пропорции здесь не равны Хоть доля воды меньше, чем кислоты, вещество называть 20%-ным раствором воды в азотной кислоте некорректно.
Существуют смеси, в которых отсутствует H2O. Они будут носить имя неводная. Подобные растворы электролита представляют собой ионные проводники. Они содержащие один или смеси экстрагентов. В их состав входят ионы и молекулы. Они используются в таких отраслях, как медицина, производство бытовой химии, косметики и в другие направления. Они могут сочетать в себе несколько нужных веществ с различной растворимостью. Компоненты многих средств, которые применяются наружно, являются гидрофобными. Иными словами, они плохо взаимодействуют с водой. В таких смесях растворители могут быть летучими, нелетучими и комбинированными. Органические вещества в первом случае хорошо растворяют жиры. К летучим относятся спирты, углеводороды, альдегиды и другие. Они часто входят в состав бытовой химии. Нелетучие чаще всего применяются для изготовления мазей. Это жирные масла, жидкий парафин, глицерин и прочие. Комбинированные — это смесь летучих и нелетучих, например, этанол с глицерином, глицерин с димексидом. Также они могут содержать воду.
Виды растворов по степени насыщенности
Насыщенный раствор — это смесь химических веществ, содержащая максимальную концентрацию одного вещества в растворителе при определенной температуре. Дальше оно разводиться не будет. В препарате твёрдого вещества заметно выпадение осадка, который находится в динамическом равновесии с ним. Под этим понятием подразумевается состояние, сохраняющееся во времени вследствие его протекания одновременно в двух противоположных направлениях (прямая и обратная реакции) с одинаковой скоростью.
Если вещество при постоянной температуре все еще может разлагаться, то этот раствор — ненасыщенный. Они устойчивы. Но если в них продолжать добавлять вещество, то оно будет разводиться в воде (или другой жидкости), пока не достигнет максимальной концентрации.
Еще один вид — перенасыщенный. В нем содержится больше растворенного вещества, чем может быть при постоянной температуре. Из-за того, что они находятся в неустойчивом равновесии, при физическом воздействии на них происходит кристаллизация.
Как отличить насыщенный раствор от ненасыщенного?
Это сделать достаточно просто. Если вещество — твердое, то в насыщенном растворе можно увидеть осадок. При этом экстрагент может загустевать, как, например, в насыщенном составе вода, в которую добавили сахар.
Но если изменить условия, повысить температуру, то он перестанет считаться насыщенным, так как при более высокой температуре максимальная концентрация этого вещества будет другой.
Теории взаимодействия компонентов растворов
Существует три теории относительно взаимодействия элементов в смеси: физическая, химическая и современная. Авторы первой — Сванте Август Аррениус и Вильгельм Фридрих Оствальд. Они предположили, что вследствие диффузии частицы растворителя и растворённого вещества равномерно распределились по всему объему смеси, но взаимодействия между ними нет. Химическая теория, которую выдвинул Дмитрий Иванович Менделеев, ей противоположна. Согласно ей, в результате химического взаимодействия между ними формируются неустойчивые соединения постоянного или переменного состава, которые называются сольваты.
В настоящее время используется объединенная теория Владимира Александровича Кистяковского и Ивана Алексеевича Каблукова. Она совмещает физическую и химическую. Современная теория гласит, что в растворе существуют как не взаимодействующие частицы веществ, так и продукты их взаимодействия — сольваты, существование которых доказывал Менделеев. В случае, когда экстрагент — вода, их называют гидратами. Явление, при котором образуются сольваты (гидраты) носит имя сольватация (гидратация). Она воздействует на все физико-химические процессы и меняет свойства молекул в смеси. Сольватация происходит благодаря тому, что сольватная оболочка, состоящая из тесно связанных с ней молекул экстрагента, окружает молекулу растворенного вещества.
Факторы, влияющие на растворимость веществ
Химический состав веществ. Правило «подобное притягивает подобное» распространяется и на реагенты. Схожие по физическим и химическим свойствам вещества могут взаимно растворяться быстрее. Например, неполярные соединения хорошо взаимодействуют с неполярными. Вещества с полярными молекулами или ионным строением разводятся в полярных, например, в воде. В ней разлагаются соли, щёлочи и другие компоненты, а неполярные — наоборот. Можно привести простой пример. Для приготовления насыщенного раствора сахара в воде потребуется большее количество вещества, чем в случае с солью. Как это понимать? Проще говоря, вы можете развести гораздо больше сахара в воде, чем соли.
Температура. Чтобы увеличить растворимость твердых веществ в жидкостях, нужно увеличить температуру экстрагента (работает в большинстве случаев). Можно продемонстрировать такой пример. Если положить щепотку хлорида натрия (соль) в холодную воду, то данный процесс займет много времени. Если проделать то же самое с горячей средой, то растворение будет проходить гораздо быстрее. Это объясняется тем, что вследствие повышения температуры возрастает кинетическая энергия, значительное количество которой часто тратится на разрушение связей между молекулами и ионами твёрдого вещества. Однако, когда повышается температура в случае с солями лития, магния, алюминия и щелочами, их растворимость понижается.
Давление. Этот фактор влияет только на газы. Их растворимость увеличивается при повышении давления. Ведь объём газов сокращается.
Изменение скорости растворения
Не стоит путать этот показатель с растворимостью. Ведь на изменение этих двух показателей влияют разные факторы.
Степень раздробленности растворяемого вещества. Этот фактор влияет на растворимость твердых веществ в жидкостях. В цельном (кусковом) состоянии состав разводится дольше, чем тот, который разбит на мелкие куски. Приведем пример. Цельный кусок соли будет растворяться в воде намного дольше, чем соль в виде песка.
Скорость помешивания. Как известно, этот процесс можно катализировать с помощью помешивания. Его скорость также важна, потому что чем она больше, тем быстрее растворится вещество в жидкости.
Для чего нужно знать растворимость твердых веществ в воде?
Прежде всего, подобные схемы нужны, чтобы правильно решать химические уравнения. В таблице растворимости есть заряды всех веществ. Их необходимо знать для правильной записи реагентов и составления уравнения химической реакции. Растворимость в воде показывает, может ли соль или основание диссоциировать. Водные соединения, которые проводят ток, имеют в своем составе сильные электролиты. Есть и другой тип. Те, которые плохо проводят ток, считаются слабыми электролитами. В первом случае компоненты представляют собой вещества, полностью ионизованные в воде. Тогда как слабые электролиты проявляют этот показатель лишь в небольшой степени.
Уравнения химической реакции
Есть несколько видов уравнений: молекулярный, полный ионный и краткий ионный. По сути последний вариант — сокращённая форма молекулярного. Это окончательный ответ. В полном уравнении записаны реагенты и продукты реакции. Теперь наступает очередь таблицы растворимости веществ. Для начала надо проверить, является ли реакция осуществимой, то есть выполняется ли одно из условий проведения реакции. Их всего 3: образование воды, выделение газа, выпадение осадка. Если два первых условия не соблюдаются, нужно проверить последнее. Для этого нужно посмотреть в таблицу растворимости и выяснить, есть ли в продуктах реакции нерастворимая соль или основание. Если оно есть, то это и будет осадок. Далее таблица потребуется для записи ионного уравнения. Так как все растворимые соли и основания — сильные электролиты, то они будут распадаться на катионы и анионы. Далее сокращаются несвязанные ионы, и уравнение записывается в кратком виде. Пример:
- K2SO4+BaCl2=BaSO4↓+2HCl,
- 2K+2SO4+Ba+2Cl=BaSO4↓+2K+2Cl,
- Ba+SO4=BaSO4↓.
Таким образом, таблица растворимости веществ — одно из ключевых условий решения ионных уравнений.
Подробная таблица помогает узнать, сколько компонента нужно взять для приготовления насыщенной смеси.
Таблица растворимости
Так выглядит привычная неполная таблица. Важно, что здесь указывается температура воды, так как она является одним из факторов, о которых мы уже говорили выше.
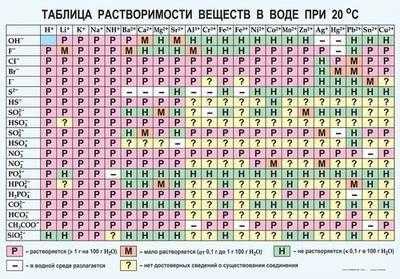
Как пользоваться таблицей растворимости веществ?
Таблица растворимости веществ в воде — один из главных помощников химика. Она показывает, как различные вещества и соединения взаимодействуют с водой. Растворимость твердых веществ в жидкости — это показатель, без которого многие химические манипуляции невозможны.
Таблица очень проста в использовании. В первой строке написаны катионы (положительно заряженные частицы), во второй — анионы (отрицательно заряженные частицы). Большую часть таблицы занимает сетка с определенными символами в каждой ячейке. Это буквы «Р», «М», «Н» и знаки «-» и «?».
- «Р» — соединение растворяется;
- «М» — мало растворяется;
- «Н» — не растворяется;
- «-» — соединения не существует;
- «?» — сведения о существовании соединения отсутствуют.
В этой таблице есть одна пустая ячейка — это вода.
Простой пример
Теперь о том, как работать с таким материалом. Допустим, нужно узнать растворима ли в воде соль — MgSo4 (сульфат магния). Для этого необходимо найти столбик Mg2+ и спускаться по нему до строки SO42-. На их пересечении стоит буква Р, значит соединение растворимо.
Заключение
Итак, мы изучили вопрос растворимости веществ в воде и не только. Без сомнений, эти знания пригодятся при дальнейшем изучении химии. Ведь растворимость веществ играет там важную роль. Она пригодится при решении и химических уравнений, и разнообразных задач.
fb.ru
Растворимость — это что такое?
Химия — интересная и достаточно сложная наука. Её термины и понятия попадаются нам в повседневной жизни, и не всегда интуитивно понятно, что они означают и каков их смысл. Одним из таких понятий является растворимость. Этот термин широко используется в теории растворов, и в повседневной жизни мы сталкиваемся с его применением потому, что окружены этими самыми растворами. Но важно не столько само употребление этого понятия, сколько те физические явления, что оно обозначает. Но прежде чем перейти к основной части нашего повествования, перенесёмся в девятнадцатый век, когда Сванте Аррениус и Вильгельм Оствальд сформулировали теорию электролитической диссоциации.

История
Начинается исследование растворов и растворимости с физической теории диссоциации. Она самая простая для понимания, однако слишком примитивная и только в части моментов совпадает с реальностью. Суть этой теории в том, что растворённое вещество, попадая в раствор, распадается на заряженные частицы, называемые ионами. Именно эти частицы и обуславливают химические свойства раствора и некоторые его физические характеристики, в том числе проводимость и температуру кипения, плавления и кристаллизации.
Однако есть более сложные теории, которые рассматривают раствор как систему, частицы в которой взаимодействуют между собой и образуют так называемые сольваты — ионы, окружённые диполями. Диполь — это, в целом, нейтральная молекула, полюса которой разноимённо заряжены. Диполем является чаще всего молекула растворителя. Попадая в раствор, растворённое вещество распадается на ионы, а диполи притягиваются к одним ионам разноимённо заряженным по отношению к ним концом, а к другим ионам — соответственно другим разноимённо заряженным по отношению к ним концом. Таким образом и получаются сольваты — молекулы с оболочкой из других нейтральных молекул.
Теперь поговорим немного о сути самих теорий и посмотрим на них внимательнее.

Теории растворов
Образованием таких частиц можно объяснить множество явлений, которые не поддаются описанию с помощью классической теории растворов. Например, тепловой эффект реакции растворения. С позиций теории Аррениуса, сложно сказать, почему при растворении одного вещества в другом теплота может поглощаться и выделяться. Да, происходит разрушение кристаллической решётки, и поэтому энергия либо затрачивается и раствор охлаждается, либо выделяется при распаде из-за избыточности энергии химических связей. Но объяснить это с позиций классической теории оказывается невозможным, так как остаётся непонятным сам механизм разрушения. А если применить химическую теорию растворов, становится понятно, что молекулы растворителя, вклиниваясь в пустоты решётки, разрушают её изнутри, как бы «ограждая» ионы друг от друга сольватной оболочкой.
В следующем разделе мы рассмотрим, что такое растворимость и всё, что связано с этой, казалось бы, простой и интуитивно понятной величиной.
Понятие растворимости
Чисто интуитивно понятно, что растворимость показывает, как хорошо то или иное вещество растворяется в данном конкретном растворителе. Однако о природе растворения веществ нам известно обычно очень мало. Почему, например, мел не растворяется в воде, а поваренная соль — наоборот? Всё дело тут в прочности связей внутри молекулы. Если связи прочные, то из-за этого эти частицы не могут диссоциировать на ионы, тем самым разрушив кристалл. Поэтому он и остаётся нерастворимым.
Растворимость — это количественная характеристика, показывающая, какая доля растворённого вещества находится в виде сольватированных частиц. Её величина зависит от природы растворённого вещества и растворителя. Растворимость в воде для разных веществ разная, в зависимости от связей между атомами в молекуле. Вещества с ковалентными связями имеют самую низкую растворимость, тогда как с ионными — самую высокую.
Но не всегда удаётся понять, какая величина растворимости большая, а какая маленькая. Поэтому в следующем разделе обсудим, чему равна растворимость различных веществ в воде.

Сравнение
В природе существует очень много жидких растворителей. Ещё больше существует альтернативных веществ, которые могут служить последними при достижении определённых условий, например определённого агрегатного состояния. Становится ясно, что если собирать данные о растворимости друг в друге каждой пары «растворённое вещество — растворитель», не хватит и целой вечности, потому что комбинаций получается огромное число. Поэтому так повелось, что на нашей планете универсальным растворителем и эталоном является вода. Сделали это потому, что она наиболее распространена на Земле.
Таким образом, была составлена таблица растворимости в воде для многих сотен и тысяч веществ. Все мы видели её, но в более коротком и понятном варианте. В клетках таблицы вписаны буквы, обозначающие растворимо вещество, нерастворимое или малорастворимое. Но есть более узкоспециализированные таблицы для тех, кто серьёзно разбирается в химии. Там указано точное численное значение растворимости в граммах на литр раствора.
Теперь обратимся к теории такого понятия, как растворимость.
Химия растворимости
Как происходит сам процесс растворения, мы уже разобрали в предыдущих разделах. Но вот как, например, записать это всё в виде реакции? Тут всё не так просто. Скажем, при растворении кислоты происходит реакция взаимодействия иона водорода с водой с образованием иона гидроксония H3O+. Таким образом, для HCl уравнение реакции будет выглядеть так:
HCl + H2O= H3O+ + Cl—
Растворимость солей, зависящая от их структуры, также определяется своей химической реакцией. Вид последней зависит от структуры соли и связей внутри её молекул.
Мы разобрались с тем, как записать графически растворимость солей в воде. Теперь пришла пора практического применения.

Применение
Если перечислять те случаи, когда эта величина необходима, не хватит и века. Косвенно с помощью неё можно вычислять другие величины, которые оказываются очень важными для исследования любого раствора. Без неё мы не смогли бы узнать точную концентрацию вещества, его активность, не смогли бы оценить, вылечит ли лекарство человека или убьёт (ведь в больших количествах даже вода опасна для жизни).
Кроме химической промышленности и научных целей, понимание сути растворимости необходимо ещё и в быту. Ведь иногда требуется приготовить, скажем, пересыщенный раствор какого-либо вещества. Например, это нужно для получения кристаллов соли для домашнего задания ребёнка. Зная растворимость соли в воде, мы с лёгкостью можем определить, сколько требуется её засыпать в сосуд, чтобы она начала выпадать в осадок и образовывать кристаллы от переизбытка.
Прежде чем завершить наш краткий экскурс в химию, поговорим о нескольких смежных с растворимостью понятиях.

Что ещё интересного?
На наш взгляд, если вы дошли до этого раздела, то наверняка уже поняли, что растворимость — это не просто странная химическая величина. Она является основой для других величин. И среди них: концентрация, активность, константа диссоциации, pH. И это далеко не полный список. Вы наверняка слышали хоть одно из этих слов. Без этих знаний о природе растворов, изучение которых началось с растворимости, мы уже не можем представить современную химию и физику. При чём тут физика? Иногда физики тоже имеют дело с растворами, измеряют их проводимость, используют и другие их свойства для своих нужд.

Заключение
В этой статье мы познакомились с таким химическим понятием, как растворимость. Это, наверное, была довольно полезная информация, так как большинство из нас вряд ли представляют себе глубинную суть теории растворов, не имея желания погрузиться подробно в её изучение. В любом случае очень полезно тренировать свой мозг, познавая что-то новое. Ведь всю жизнь человек должен «учиться, учиться и ещё раз учиться».
fb.ru
Основные понятия о растворах
В лаборатории чаще всего приходится готовить растворы твердых веществ, поэтому остановимся более подробно именно на них.
Если взять одинаковые объемы воды и попробовать растворять в них разные соли, например сернокислый барий, квасцы и хлористый кальций, то сразу бросится в глаза, что сернокислый барий совсем не переходит в раствор *, квасцы растворяются лучше, а хлористый кальций— очень хорошо. Кроме того, можно заметить, что после прибавления к воде некоторого определенного количества соли она уже больше не растворяется, сколько бы ее ни перемешивали.
Таким образом, количество твердого вещества, которое можно растворить в данном количестве воды, имеет предел, зависящий от свойств взятых веществ и от тех условий, в которых происходит растворение. Когда этот предел достигнут, получается насыщенный раствор. Концентрация насыщенного раствора называется растворимостью.
Следовательно, насыщение раствора каким-либо веществом зависит от его растворимости в данном растворителе при данных условиях. Таким образом, совершенно не обязательно, чтобы концентрация насыщенного раствора была бы высокой. Например, растворимость сернокислого кальция (CaSO4) составляет при комнатной температуре 0,77 г/л. При таком содержании соли раствор будет уже насыщенным.
* Точное исследование показывает, что сернокислый барий растворяется в воде, но в малой степени,
Во многих случаях растворимость твердого вещества можно повысить, если раствор нагревать. Однако некоторые соли не подчиняются этому правилу. Растворимость их или понижается с повышением температуры или повышается только до определенной температуры, выше которой растворимость уменьшается. Если растворять углекислый натрий, то количество его (пересчитанное на безводную соль, т. е. на Na2CO3), приходящееся на 100 г воды в насыщенных растворах при разных температурах, будет следующее:
Следовательно, самое большое количество безводного углекислого натрия можно растворить только при 35,2° С.
Если же взять углекислый литий, то у него растворимость с повышением температуры понижается. Например, при 100° С он почти в два раза меньше растворим, нежели при 20° С. Зависимость растворимости от температуры следует принципу Ле-Шателье. Если растворимое вещество при растворении поглощает тепло, что бывает в большинстве случаев, то растворимость увеличивается с повышением температуры. Если же растворение сопровождается выделением тепла, то растворимость при подведении тепла уменьшается.
Каждой температуре соответствует определенная растворимость данного вещества. Если охладить насыщенный раствор вещества, растворимость которого с температурой повышается, то растворенное вещество выпадает в осадок в таком количестве, что раствор остается насыщенным при той температуре, до которой ои охлажден. Однако в некоторых случаях при медленном охлаждении растворенное вещество не выделяется. Тогда говорят, что раствор пересыщен. Но это очень неустойчивое состояние раствора; достаточно какому-нибудь кристаллику или пылинке попасть в раствор, чтобы избыток соли выпал в осадок.
Плотность раствора отличается от плотности растворителя.Раствор кипит при более высокой температуре *, чем растворитель. Последним свойством пользуются, применяя солевые бани. Температура замерзания раствора, наоборот, ниже, чем у растворителя.
* Если насыщенный пар над раствором не содержит другого вещества, кроме растворителя.
Скорость растворения твердого вещества зависит от размера его частиц. Чем крупнее куски, тем медленнее идет растворение; наоборот, чем мельче отдельные частицы твердого вещества, тем скорее переходит оно в раствор. Поэтому перед растворением твердого вещества его всегда следует измельчить в ступке и отвешивать для растворения только измельченное вещество. Сказанное ие относится к гигроскопичным веществам, так как последние в измельченном виде очень легко поглощают влагу из воздуха вследствие большого увеличения поверхности. Поэтому гигроскопичные вещества растворяют, не измельчая, разве только быстро разбив большие куски.
Растворение тонко измельченного вещества значительно легче, но при этом возникают свои трудности. Дело в том, что некоторые порошки при высыпании их в воду или при приливании к ним воды вначале не смачиваются и плавают на поверхности воды, образуя тонкую пленку. В подобных случаях порошок вначале обливают небольшим количеством чистого спирта (метилового или этилового), а уже затем приливают воду или высыпают в нее порошок. Явление всплывания порошка при этом не наблюдается. Само собой разумеется, что применять спирт можно лишь в том случае, если ои не оказывает химического действия на вещество или на его раствор. Спирта следует брать очень немного, лишь бы он только смочил порошок.
Иногда при растворении твердых веществ, например кристаллических, их помещают в колбу. При неправильном введении таких веществ (особенно крупных кусков или кристаллов) случается, что колба разбивается. Чтобы не разбить колбу, поступают так: наклоняют ее под углом не больше 45° (лучше меньше) и опускают твердое вещество, чтобы оно скатывалось по горлу и стенке шара колбы. Удобнее сначала налить в колбу часть рассчитанного количества растворителя, например воды, а затем вводить твердое вещество, как описано выше, иногда встряхивая колбу. Оставшуюся часть растворителя вводят после того, как будет пересыпано все количество твердого вещества, предназначенного для растворения.
Большие трудности встречаются при растворении смолистых веществ, так как их размельчить в порошок нельзя. Такие вещества полезно разрезать (если это возможно) на небольшие куски и постепенно вводить в растворитель.
Следует остановиться на растворимости газов. Почти все газообразные вещества способны в той или иной мере растворяться в воде или органических растворителях. Некоторые из них, например Nh4, HCl, жадно поглощаются водой. Другие же газы (кислород, водород и др.) обладают меньшей или незначительной растворимостью в воде, причем она зависит от температуры воды и внешнего давления. Чем выше парциальное давление газа, тем больше он растворяется в воде, и чем выше температура воды, тем меньше растворимость газов. Поэтому воду для удаления растворенных в ней газов кипятят.
Рассмотрим теперь кратко вопрос о взаимном растворении жидкостей. При этом различаются три случая:
1. Жидкости практически не растворяются одна в другой, например вода и масло; при смешивании их они всегда отделяются друг от друга.
2. Жидкости растворяются одна в другой только в определенных количествах. Например, если смешать воду и эфир, То после взбалтывания и отстаивания раствор разделится на два слоя. Верхний слой представляет раствор воды в эфире, нижний — раствор эфира в воде, причем при определенной температуре концентрации обоих насыщенных растворов всегда имеют определенные значения. Так, при 2O0C в 100 объемах воды растворяется 8,11 объема эфира, а в 100 объемах эфира растворяется 2,93 объема воды.
3. Жидкости растворяются одна в другой в неограниченном количестве. Например, вода и спирт растворяются друг в друге в любом количестве. Так же ведут себя многие кислоты и вода.
При растворении жидкостей, как и при растворении твердых тел, наблюдается или выделение тепла, или его поглощение. Это явление используют при изготовлении охлаждающих смесей или для химического нагревания.
Нужно также отметить, что иногда при смешении жидкостей происходит уменьшение объема; если, например, взять 50 объемов воды и 50 объемов спирта, то получится не 100 объемов смеси, а только 96,3 (так называемое явление контракции).
По свойствам вещества можно разделить на два клас- . са: не набухающие при растворении и набухающие.
К первому классу относятся преимущественно вещества, имеющие кристаллическое строение, а ко второму — высокомолекулярные вещества, главным образом органические. При растворении последних в органических растворителях первой стадией процесса всегда будет набухание.
К оглавлению
см. также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксапалы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
www.himikatus.ru
Растворимость веществ и ее зависимость от различных факторов
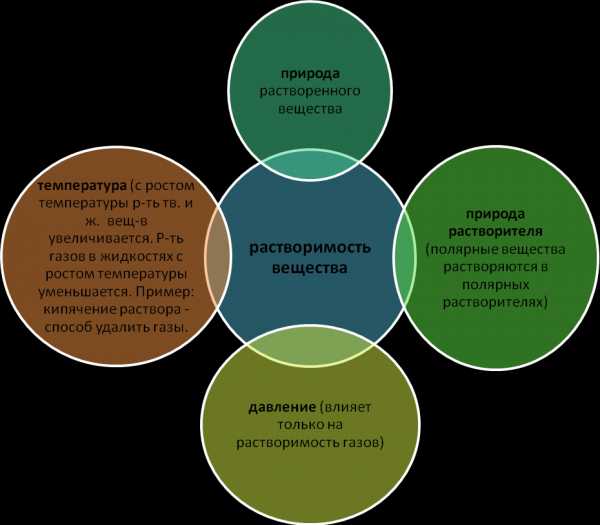
⇐ ПредыдущаяСтр 2 из 3Следующая ⇒Растворимость веществ зависит от природы растворителя и вещества, которое растворяется, а также от условий растворения: температуры, давления (для газов), концентрации, наличия других растворенных веществ.
Одни вещества растворяются в определенном растворителе хорошо, другие — плохо. Но можно и количественно оценить способность того или иного вещества к растворению или, другими словами, растворимость вещества.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе.
По растворимости в воде все вещества делятся на три группы:
― хорошо растворимые (р),
― малорастворимые (м),
― практически нерастворимые (н).
Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же будут растворяться в воде.
Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества).
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества). Следует отметить, что растворимость твердых веществ зависит от степени их измельчения. Мелкие кристаллики, размеры которых меньше примерно 0,1 мм, более растворимы, чем крупные.
Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости.
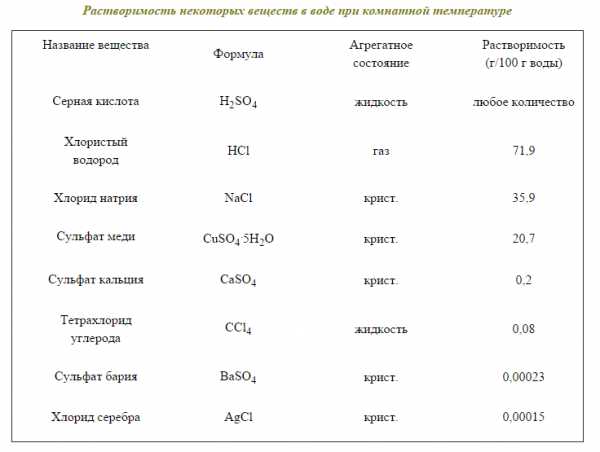
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в граммах на 100 г растворителя при определённых условиях. Растворимость некоторых веществ в воде при комнатной температуре приведена в табл.1.
Растворимость жидкостей в жидкостях может быть полной или ограниченной. Более распространена ограниченная растворимость. При полной взаимной растворимости жидкости смешиваются в любых соотношениях. Например (спирт-вода). Жидкости с ограниченной взаимной растворимостью всегда образуют два слоя. Примером системы с ограниченной растворимостью является система бензол-вода. При смешивании этих жидкостей всегда существует два слоя: верхний слой состоит в основном из воды и содержит бензол в небольших количествах (примерно 11 %), нижний слой, наоборот, состоит в основном из бензола и содержит около 5 % воды. С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает и часто при достижении определенной для каждой пары жидкостей температуры, называемой критической, жидкости полностью смешиваются одна с другой. Например, фенол и вода при t° 68,8° (критическая температура) и выше растворяются друг в друге в любых пропорциях; ниже критической температуры они лишь ограниченно растворимы друг в друге.
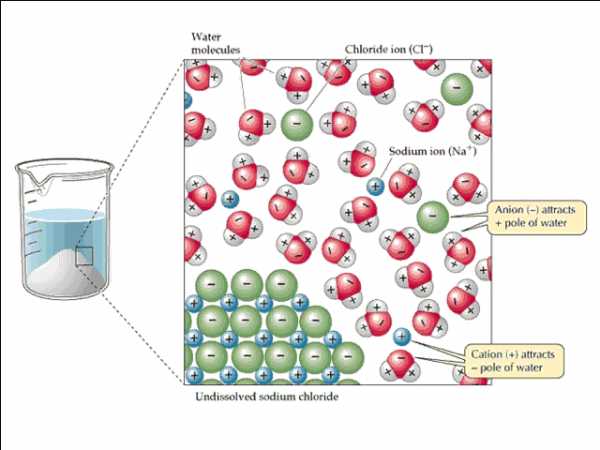
Вещества, для которых характерны ионный и полярный типы связи, лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак, уксусная кислота и др.). Напротив, вещества с неполярной или малополярным типом связи хорошо растворяются в неполярных растворителях (ацетон, сероуглерод, бензол и др.). Можно сформулировать общее правило взаимной растворимости веществ: «Подобное растворяется в подобном».
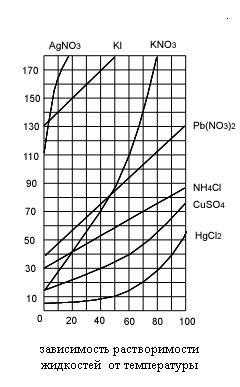
Зависимость растворимости твердых и газообразных веществ от температуры показывают кривые растворимости (рис. 1).
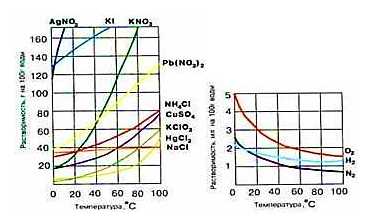
Рис. 1. Кривые растворимости твердых и газообразных веществ.
Ход кривых растворимости нитратов серебра, калия и свинца показывает, что с повышением температуры растворимость этих веществ существенно возрастает. Почти горизонтальный ход кривой растворимости хлорида натрия свидетельствует о незначительном изменении его растворимости с повышением температуры.
Для большинства солей характерно увеличение растворимости при нагревании.
По кривым растворимости можно определить:
― коэффициент растворимости веществ при различных температурах;
― массу растворимого вещества, которая выпадает в осадок при охлаждении раствора от t1oC до t2oC.
Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается. Практически все газы растворяются с выделением тепла, поэтому с повышением температуры растворимость газов уменьшается (рис.3). Так, кипячением воды можно удалить из нее газы, которые были растворены.
В табл. 2 указаны растворимости в воде некоторых газов при различных температурах.
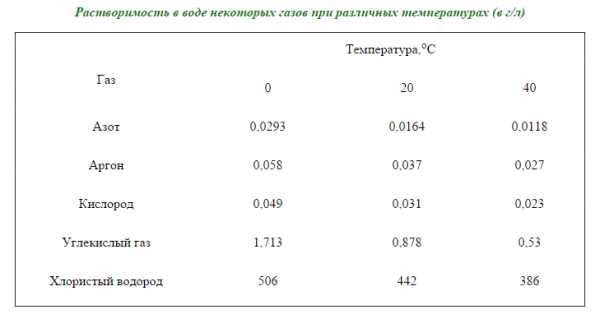
Растворимость газа зависит от природы жидкости и газа. Например, кислород растворяется в воде в количестве примерно вдвое большем, чем азот. Это обстоятельство имеет большое значение для жизни живых организмов в воде.
Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением — увеличивается.
Растворимость газов в воде уменьшается также при добавлении к раствору солей, ионы которых более прочно связываются с молекулами воды, чем молекулы газа, понижая тем самым его растворимость.
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.
arhivinfo.ru
Растворимость
Растворимостью вещества называют способность ее растворяться в той или иной среде. Мерой растворимости или коэффициентом растворимости служит количество граммов вещества, которое при данной температуре растворяется в 100 г воды с образованием насыщенного раствора.
1. Общая характеристика
Степень растворимости вещества в данном растворителе — концентрация его насыщенного раствора при определенных температуре и давлении. Растворимость газов зависит от температуры и давления, растворимость жидких и твердых тел от давления практически не зависит. Растворимость определяется физическим и химическим сродством молекул растворителя и розчинюванои вещества (выполняется принцип: «подобное растворяется в подобном»). Некоторые жидкости могут неограниченно растворяться в других, т.е. смешиваются в любых пропорциях (например, спирт и вода). Другие взаеморозчиняються только до определенного предела (например, при перемешивании пары «вода-эфир» образуется два слоя: верхний насыщенный раствор воды в эфире, нижний — насыщенный раствор эфира в воде).
2. Растворимость твердых веществ
По растворимости в воде твердые вещества делятся на хорошо растворимые, малорастворимые и практически нерастворимые. Примером хорошо растворимых веществ могут быть хлорид магния MgCl, карбонат натрия Na 2 CO 3 и нитрат серебра AgNO 3, растворимость которых (в граммах на 100 г воды с образованием насыщенного раствора) при обычной температуре составляет соответственно 20 г, 54 г и 215 г.
Вообще хорошо растворимыми называют такие вещества, растворимость которых при обычной температуре больше 10 г. малорастворимыми называют такие вещества, растворимость которых при обычной температуре менее 1 г, а практически нерастворимыми такие, растворимость которых меньше 0,01 г. Примером малорастворимых веществ могут служить сульфат кальция CaSO 4, растворимость которого составляет 0,21 г, и гидроксид кальция Ca (OH) 2, растворимость которого — 0,16 г. К практически нерастворимых веществ относятся сульфат бария BaSO 4, хлорид серебра AgCl, карбонат кальция CaCO 3, кварцевый песок SiO 2. Абсолютно нерастворимых веществ нет.
С повышением температуры растворимость большинства твердых веществ увеличивается, причем для некоторых веществ очень резко, а для некоторых — совсем мало. Так, например, для хлорида натрия NaCl растворимость мало меняется с изменением температуры и составляет при обычной температуре 36 г (на 100 г воды), а при 100 С — 39 г. Для калийной селитры KNO 3, напротив, растворимость очень резко меняется с изменением температуры и составляет при обычной температуре 31,5 г, а при 100 С — 245 г. Поэтому когда речь идет о растворимости (коэффициент растворимости) вещества, то всегда следует указывать и температуру, потому растворимость одного и того же вещества при различных температурах различна.
Зависимость растворимости твердых веществ от температуры для наглядности часто изображают графически кривыми растворимости. На оси абсцисс откладывают в определенном масштабе температуру, а на оси ординат — растворимость. Кривые растворимости дают возможность быстро находить растворимость вещества при любой температуре.
3. Растворимость жидкостей
Жидкости с их растворимостью в воде тоже делят на хорошо растворимые, малорастворимые и практически нерастворимые Некоторые жидкости, как спирт и глицерин, смешиваются с водой в любых отношениях, не образуя насыщенных растворов. Хорошо растворимыми в воде также сульфатная H 2 SO 4 и нитратная HNO 3 кислоты.
Примером малорастворимых жидкостей может служить эфир, уже при небольших количествах образует с водой насыщенный раствор. Вода в эфире растворяется тоже очень мало. Поэтому при смешивании эфира с водой образуются два слоя насыщенных растворов: нижний слой — эфира в воде и верхний — воды в эфире повышением температуры взаимная растворимость жидкостей обычно увеличивается. К нерастворимых в воде жидкостей относятся бензин, керосин, масло и др.. Вода в этих веществах тоже не растворяется.
4. Растворимость газов
Различные газы в воде растворяются также по-разному, причем растворимость газообразных веществ выражают обычно не в граммах, а в кубических сантиметрах (перечисленных на нормальные условия) и тоже относится к 100 г воды (иногда до 1 дм 3). Хорошо растворимыми в воде являются только некоторые газы, например аммиак NH 3 и хлороводород HCl. Растворимость аммиака при обычных условиях составляет 71 000 см 3 в 100 г воды, а хлороводорода — 45 000 см 3. Хорошо растворимыми также сероводород H 2 S и диоксид углерода CO 2, растворимость которых при обычных условиях составляет соответственно 204 см 3 и 66 см 3. Большинство газов плохо растворяются в воде. Так, растворимость кислорода при обычных условиях в 100 г составляет лишь 3,1 см 3, водорода — 1,8 см 3, а азота — 1,5 см 3.
При нагревании растворимость газов в воде резко уменьшается, а при увеличении давления, наоборот, увеличивается.
5. Тепловые явления при растворении
Процесс растворения каждого вещества в воде сопровождается или выделением, или поглощением тепла, вследствие чего получаемый раствор или нагревается, или охлаждается. Растворение газообразных веществ всегда сопровождается выделением тепла и нагреванием раствора. При растворении многих жидкостей в воде, например спирта и серной кислоты, тоже выделяется значительное количество тепла и раствор сильно нагревается.
При растворении твердых веществ в воде иногда выделяется, а иногда поглощается тепло. Так, при растворении едких щелочей (кристаллических) NaOH и KOH, безводного хлорида кальция CaCl 2 и многих других веществ наблюдается сильное нагревание раствора, а при растворении нитрата аммония NH 4 NO 3 и некоторых других веществ, наоборот, наблюдается сильное охлаждение раствора. Впервые на тепловые явления при процессах растворения обратил внимание и дал им теоретическое обоснование Д. И. Менделеев. По взглядам Менделеева, растворение является не только физическим процессом, при котором молекулы розчинюванои вещества равномерно распределяются между молекулами воды, но и химическим, в результате которого молекулы или ионы розчинюванои вещества с молекулами воды образуют определенные химические соединения. Эти соединения Менделеев назвал гидратами, а сам процесс их образования — процесс гидратации. Поэтому его теория была названа химической или гидратной, теории растворения.
Гидраты условились обозначать следующей общей формуле: А nH 2 O, где А — молекула или ион растворенного вещества, а n — определенное число молекул воды, приходящейся на одну молекулу или один ион растворенного вещества. Гидраты большинства веществ в отличие от обычных химических соединений очень неустойчивыми и существуют только в растворах, а при испарении раствора разлагаются. Но известны и сравнительно устойчивые гидраты, которые можно выделить из раствора в твердом состоянии (так называемые кристаллогидраты).
Образование гидратов сопровождается обычно выделением тепла, вследствие чего раствор нагревается. Но наряду с этим при растворении имеют место и другие процессы — отрыв частиц (молекул или ионов) от кристаллической поверхности розчинюванои вещества (в случае растворения твердых веществ) и их размещение по всему объему раствора, на что тратится определенное количество внутренней энергии, вследствие чего раствор должен охлаждаться. В связи с этим суммарный тепловой эффект растворения твердого вещества может быть различным. Если потраченная энергия на дробление кристаллического вещества равна энергии гидратации, то процесс растворения происходить без видимых тепловых изменений. Если же энергия гидратации меньше энергии дробления кристаллического вещества, то растворение будет сопровождаться охлаждением, а когда, наоборот, энергия гидратации больше, то растворение сопровождается нагреванием раствора.
См.. также
Источники
nado.znate.ru