Химия 11 класс, муниципальный этап (2 этап), г. Москва, 2017-2018 учебный год
Задания, ответы, критерии оценивания
Общие указания: если в задаче требуются расчёты, они обязательно должны быть приведены в решении. Ответ, приведённый без расчётов или иного обоснования, не засчитывается.
Решения и система оценивания
В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
Содержание
- Задание 1. «Правые части»
- Задание 2. «Анализ неорганического вещества»
- Задание 3. «Необычный эфир»
- Задание 4. «Полезный полимер»
- Задание 5. «Соединение-платформа»
- Задание 6. «Органический эксперимент»
Задание 1. Правые части
Содержание ↑
По правой части уравнения с коэффициентами восстановите формулы веществ и коэффициенты в левой части уравнений реакций:
- … + … = Fe(CO)5
- … + … = Fe(OH)3 + NaOH
- … + … = Fe(OH)3 + Na2SO4
- … + … + … = 2Fe(OH)3 + 6NH4Cl
- … + … = 3Fe(NO3)2
- … + … + … = K2FeO4 + 3KNO2 + H2O
- … + … = 2NaFeO2 + CO2
- … + … = 2Na2FeO4 +2Na2O
- … + … = K4[Fe(CN)6] + 2KCl
- … + … = 2FeS + S +6NH4Cl
Решение для задания «Правые части»
- Fe + 5CO = Fe(CO)5
- NaFeO2 + 2H2O = Fe(OH)3 + NaOH
- Fe(OH)SO4 + 2NaOH = Fe(OH)3 + Na2SO4
- 2FeCl3 + 6NH3 + 6H2O = 2Fe(OH)3 + 6NH4Cl
- Fe + 2Fe(NO 3)3 = 3Fe(NO3)2
- Fe + 2KOH + 3KNO3 = K2FeO4 + 3KNO2 + H2O
- Fe2O3 + Na2CO3 = 2NaFeO2 + CO2
- 2NaFeO2 + 3Na2O2 = 2Na2FeO4 +2Na2O
- FeCl2 + 6KCN = K4[Fe(CN)6] + 2KCl
- 2FeCl3 + 3(NH4)2S = 2FeS + S + 6NH4Cl
Критерии оценивания
За каждое уравнение – 1 балл (если верные вещества, но не уравнено – 0,5 балла)
Итого 10 баллов.
Задание 2. Анализ неорганического вещества
Содержание ↑
При прокаливании 5,00 г фиолетового вещества A образовалось голубое вещество В массой 3,92 г. Если через водный раствор, содержащий 2,00 г вещества А, пропустить постоянный ток, то на катоде выделится серебристый металл
- Определите вещества А – D. Ответ подтвердите расчётом.
- Какую окраску имеет водный раствор вещества А и чем она обусловлена?
- Запишите уравнения катодного и анодного процессов при его электролизе.
- Приведите ещё два примера металлов, которые так же, как и С, притягиваются магнитом.
Решение для задания «Анализ неорганического вещества»
1. Белый творожистый осадок D – это хлорид серебра AgCl. В 3,92 г вещества B содержится 0,711⋅5/2 = 1,778 г металла С. Массовая доля металла в веществе В составляет 1,778 / 3,92 = 0,4534. Если предположить, что вещество В состоит только из металла С и хлора, то массовая доля хлора равна 1 – 0,4534 = 0,5466, следовательно, молярная масса вещества В: M(B) = 35,5x / 0,5466 = 65x, где x – валентность металла в хлориде. Перебирая различные значения x, находим при x = 2, что неизвестный металл С – кобальт. Тогда вещество B – хлорид кобальта (II) CoCl2.
Убыль массы при прокаливании вещества А составляет 5 – 3,92 = 1,08 г. Количество вещества хлорида кобальта: n(CoCl2) = 3,92 / 130 = 0,030 моль, тогда молярная масса остатка 1,08 / 0,03 = 36 г/моль, что соответствует двум молекулам воды. Вещество А – дигидрат хлорида кобальта, CoCl2∙2H2O.
2. В водном растворе ионы [Co(H2O)6]2+ придают раствору красную (розовую) окраску.
3. Уравнения электродных процессов:
Катод: Co2+ + 2e– = Co↓
Анод: 2Cl– – 2e–= Cl2↑
4. Примерами металлов, притягивающихся магнитом, являются Fe, Ni (3d-металлы) и редкоземельные металлы Gd, Tb, Dy, Ho, Er (оценивать и другие верные варианты).
Ответ A–CoCl2∙2H2O, B – CoCl2, C – Co, D – AgCl.
Критерии оценивания
- Формулы веществ А–D – по 1 баллу, всего 4 балла
- Окраска раствора A – 1 балл
- формула комплексного иона – 1 балл
- Уравнения электродных реакций – по 1 баллу, всего 2 балла
- Примеры металлов, притягивающихся магнитом, – по 1 баллу, всего 2 балла
Итого 10 баллов.
Задание 3. Необычный эфир
Содержание ↑
При горении органического соединения X массой 12,00 г образуются 11,20 л (н.у.) оксида углерода (IV) и 10,80 г воды. Это соединение устойчиво в щелочной среде и легко гидролизуется в кислой с образованием смеси уксусной кислоты и метанола в молярном соотношении 1꞉3.
- Определите молекулярную формулу соединения X.
- Приведите структурную формулу соединения X и предложите его название.
- Составьте уравнение реакции гидролиза X в кислой среде.
- Предложите способ получения X.
- Соединения, к которым принадлежит X, обладают высокой реакционной способностью и широко используются в органическом синтезе. Обсудите возможность взаимодействия вещества X с 2,4,6-триметилбензойной кислотой и этанолом и укажите, какие соединения при этом образуются.
Решение и критерии оценивания для задания «Необычный эфир»
1. Судя по продуктам сгорания, вещество X может содержать углерод, водород и кислород и его можно описать формулой СxHyOz.
Определение молекулярной формулы вещества X.
ν(СО2) = 11,2 : 22,4 = 0,5 моль;
ν(С) = 0,5 моль;
ν(Н2О) = 10,8 : 18 = 0,6 моль;
ν(Н) = 1,2 моль.
Наличие кислорода можно определить по разности масс исходного вещества и масс углерода и водорода в продуктах сгорания:
m(O) = 12 – (12∙0,5 + 1∙1,2) = 4,8 г;
ν(О) = 4,8 : 16 = 0,3 моль
ν(С) ꞉ ν(Н) ꞉ ν(О) = 0,5 ꞉ 1,2 ꞉ 0,3 = 5 ꞉ 12 ꞉ 3.
Молекулярная формула X – С5Н12О3 2 балла
2. Анализ молекулярной формулы свидетельствует об отсутствии кратных связей в соединении. Эта формула может принадлежать трёхатомным спиртам, но такое заключение не соответствует условию задачи, так как трёхатомные спирты не подвергаются гидролизу. Анализ продуктов гидролиза даёт право предположить, что соединение состава С 5Н12О3 содержит три спиртовые группы и одну кислотную, и тогда ему может соответствовать структурная формула CН3–С(ОСН3)3.
Известно, что гидратные формы карбоновых кислот – ортокарбоновые кислоты RC(OH)3 – неустойчивы, однако их эфиры RC(OR)3 – вполне устой чивые соединения, имеющие высокие температуры кипения. Они, в отличие от сложных эфиров, не подвергаются гидролизу в щелочной среде, но легко гидролизуются в кислой, что соответствует условию задачи. Назвать этого соединение можно либо триметилортоацетатом, либо 1,1,1-триметоксиэтаном.
3 балла
3. При гидролизе триметилортоацетата вначале образуется сложный эфир, а затем карбоновая кислота:
CН3–С(ОСН3)3 + Н2О(Н+) → CН3СООСН3 + 2СН3ОН
CН3СООСН3 + Н2О(Н+) → СH3СООН + СН3ОН
Уравнение кислотного гидролиза метилового эфира ортоуксусной кислоты можно записать и суммируя эти две реакции:
CН3 – С(ОСН3)3 + 2Н2О(Н+) → CН3СООН + 3СН3ОН 1 балл
4. Эфиры ортокислот можно получить из 1,1,1-тригалогенидов углеводородов:
CН3СCl3 +3CH3ONa → CН3–С(ОСН3)3 + 3NaCl.
Можно использовать также алкоголиз нитрилов соответствующих кислот:
CH3C≡N + 3CH3OH + HCl → CН3–С(ОСН3)3 + NH4Cl 2 балла
5. При взаимодействии ортоэфиров с карбоновыми кислотами образуются сложные эфиры. Такой способ получения сложных эфиров можно использовать в тех случаях, когда этерификация пространственно затруднена. Такие затруднения возникают, например, при получении сложного эфира 2,4,6-триметилбензойной кислоты. Особенностью этой реакции является то, что для её проведения не требуются кислотные катализаторы.
1 балл
Ортоэфиры реагируют со спиртами с образованием простых эфиров:
C2H5OH + СН3–С(ОСН3)3 → C2H5OСН3 + СН3COOСН3+ CH3OH 1 балл
Итого 10 баллов.
Задание 4. Полезный полимер
Содержание ↑
2,58 г органического вещества А, применяемого в синтезе чрезвычайно важного полимера Б, сожгли в атмосфере кислорода и при этом получили 1,20 г твёрдого вещества
Решение для задания «Полезный полимер»
Поскольку соединение А органическое, при его горении в кислороде должен образовываться углекислый газ, следовательно один из газов – Д или Е – это СО2. Средняя молярная масса газовой смеси:
Mср = 29×Dвозд. = 29 × 1,388 = 40,25 г/моль.
Поскольку смесь газов Д и Е эквимолярная, средняя молярная масса равна среднему арифметическому молярных масс Д и Е. Так как одно из веществ это углекислый газ (М = 44 г/моль), второе вещество имеет молярную массу меньше 40,25. Таким образом, вещество Е – это углекислый газ. Найдём молярную массу вещества Д:
(44 + M(Д))/2 = 40,25
M(Д) = 36,5 г/моль
Газ Д – хлороводород.
Объём газовой смеси при н. у. равен 1792 мл, что соответствует 0,08 моль газов. Так как смесь эквимолярная, количества углекислого газа и хлороводорода соответственно равны по 0,04 моль. Бесцветная жидкость Г, образующаяся при сгорании органического вещества, вероятнее всего, – вода.
Её количество равно 0,72 : 18 = 0,04 моль. В состав исходного вещества А должен входить ещё один элемент, образующий нелетучий оксид В. Рассчитаем его молярную массу. Пусть вещество А содержит x атомов хлора. Исходя из полученных выше данных формулу вещества А можно описать как Э(CH3Cl)x.
Если х = 1, то молярная масса М(А) = 2,58 : 0,04 = 64,5 г/моль, М(Э) = 14, что соответствует азоту, однако он не образует нелетучего оксида.
Если х = 2, то молярная масса М(А) = 2,58 : 0,02 = 129 г/моль, М(Э) = 28, что соответствует кремнию, т.е. молекулярная формула соединения А – C2H6SiCl2. Тогда соединение В – это оксид кремния (IV). Действительно, m(SiO2) = 2,58/129 × 60 = 1,20 г, что соответствует условию задачи.
Таким образом, вещество А – это дихлордиметилсилан (CH3)2SiCl2, являющийся предшественником в синтезе полидиметилсилоксана (силикона) Б [–OSi(CH3)2–]n. При горении А образуются SiO2В, вода Г, хлороводород Д и углекислый газ Е.
Ответ:
А – (CH3)2SiCl2, Б – [–OSi(CH3)2–]n, В – SiO2, Г – H2O, Д – HCl, Е – CO2.
Уравнение реакции горения:
(CH3)2SiCl2 + 4O2 = SiO2 +2H2O + 2HCl + 2CO2
Силикон применяется для изготовления шлангов, силиконовой кухонной посуды, уплотнений, герметизации швов, смазки, теплоносителя и др.
Критерии оценивания для задания «Полезный полимер»
Определение веществ А–Е – по 1 баллу (всего 6 баллов).
Уравнение реакции горения – 2 балла (с неверными коэффициентами – 1 балл).
Любые две верно указанные области применения силикона – 2 балла.
(Ответ без расчётов – 0 баллов за всю задачу)
Итого 10 баллов.
Задание 5. Соединение-платформа
Содержание ↑
В последнее десятилетие большую популярность получил синтез на основе возобновляемого природного сырья. Некоторые соединения, получаемые из растительной биомассы, были включены в список так называемых «соединений-платформ», на основе которых будет создаваться химическая промышленность будущего. Одно из возможных соединений-платформ K, получаемое из углеводной биомассы, содержит 49,83 % углерода, 22,15 % кислорода и 24,57 % хлора (по массе). Соединение K вступает в следующие превращения:
Определите неизвестные вещества K–O и напишите уравнения протекающих реакций.
В качестве «зелёной» альтернативы какому веществу может рассматриваться соединение О?
Решение для задания «Соединение-платформа»
Сумма массовых долей элементов в соединении K составляет 96,55 %, следовательно, логично предположить, что в состав К также входит 3,45 % водорода. Выведем простейшую формулу соединения Х:
n(C) : n(H) : n(Cl) : n(O) = 49.83/12 : 3,45/1 : 24,57/35,5 : 22,15/16 = 6 : 5 : 1 : 2
Таким образом, формула соединения K – С6H5ClO2.
Под действием водного раствора гидроксида натрия происходит замена хлора на гидроксильную группу, следовательно, соединение M вероятнее всего имеет спиртовую группу. Оксид меди при нагревании окисляет первичную спиртовую группу до альдегидной, что сопровождается потерей двух атомов водорода. Окисление подкисленным раствором перманганата калия должно приводить к карбоновой кислоте. Поскольку количество атомов кислорода увеличилось на два, можно предположить, что соединение N содержало две альдегидные группы, а соединение O содержит две карбоксильные группы.
Таким образом, соединение О можно представить в виде С4H2O(COOH)2, где остаток С4H2O соответствует фурановому кольцу. Поскольку углеродный скелет в веществах К–О согласно условию получается из молекул углеводов, единственный возможный вариант соединения О – фуран-2,5-дикарбоновая кислота, являющаяся «зелёным» аналогом терефталевой кислоты. Синтез вещества L – это реакция алкилирования по Фриделю–Крафтсу.
Уравнения реакций:

Вещество О может выступать в качестве аналога терефталевой кислоты.
Критерии оценивания:
Вывод простейшей формулы вещества К – 1 балл
Структуры веществ К–О – по 1 баллу (всего 5 баллов)
(если указаны изомерные производные фурана вместо 2,5-дизамещенных, оценивать каждую структуру в 0,5 балла)
Уравнения реакций – по 1 баллу (всего 4 балла)
Итого 10 баллов.
Задание 6. Органический эксперимент
Содержание ↑
Органическое вещество А можно получить в лаборатории несколькими способами, два из которых рассмотрены ниже.
Способ 1. В пробирку 1 (см. рис. 1) наливают небольшое количество этанола, над которым закрепляют раскалённую медную спираль 2. По тонкой трубочке в пробирку вдувают воздух. По газоотводной трубке в пробирку 3 с холодной водой проходят пары, содержащие вещество А.
Рисунок 1
Способ 2. В колбу Вюрца 1 (см. рис. 2) помещают кусочки карбида кальция. Из капельной воронки добавляют воду. Как только вода попадает на поверхность карбида, тотчас начинает выделяться бесцветный газ Y, который пропускают через раствор сульфата меди в банке 2 для очистки от примесей. В банку 3 предварительно наливают раствор серной кислоты и добавляют оксид ртути(II).
При взаимодействии этих веществ образуется катализатор для реакции синтеза вещества A. В присутствии данного катализатора газ Y превращается в вещество А.
Рисунок 2
- О получении какого вещества А идёт речь в условии задачи?
- Приведите уравнение реакции превращения этанола в А.
- Определите вещество Y, о котором идёт речь при описании второго способа получения вещества А. Составьте соответствующие уравнения реакций. Кто открыл реакцию получения вещества А из вещества Y?
- С помощью каких качественных реакций можно доказать образование вещества А в ходе описанных опытов? Приведите два примера.
- По мере пропускания газа в банке 2 образуется осадок чёрного цвета.
- Предположите, какая реакция протекает в этом промывном сосуде, если известно, что сырьё, используемое в промышленности для получения вещества Y1, может содержать примесь сульфатов.
Решение и критерии оценивания для задания «Органический эксперимент»
1. Вещество А – уксусный альдегид (ацетальдегид, этаналь) CH3CHO. 1 балл
2. Способ 1 – получение ацетальдегида из этанола. Допускается несколько вариантов уравнений:
CH3–CH2–OH CH3–CHO + H2 (дегидрирование этанола)
2CH3–CH2–OH + O2 2CH3–CHO + 2H2O (каталитическое окисление этанола)
CH3–CH2–OH + CuO → CH3–CHO + H2O + Cu
2 балла за одно верное уравнение (любое)
3. Y – ацетилен 1 балл
CaC2 + 2H2O → C2H2↑ + Ca(OH)2
CH ≡CH + H2O → CH3–CHO
По 1 баллу за каждое уравнение
Реакцию гидратации ацетилена (и его гомологов) в присутствии солей ртути открыл русский учёный М.Г. Кучеров (1881). 1 балл
4. Образование ацетальдегида можно доказать с помощью качественных реакций на альдегиды, например, с фуксинсернистой кислотой или с аммиачным раствором оксида серебра (реактивом Толленса).
По одному баллу за каждый правильный вариант, всего 2 балла.
5. Технический карбид кальция – продукт прокаливания смеси оксида кальция с коксом. Оксид кальция получают из природных известняков, содержащих примеси фосфата и сульфата кальция. В результате их восстановления коксом в конечном продукте оказываются фосфид и сульфид. При действии воды на карбид кальция, загрязнённый данными соединениями, протекает реакция их гидролиза и в образующийся ацетилен попадают примеси фосфина и сероводорода. В банке 2 выделяющийся ацетилен очищается от этих примесей.
Сероводород с растворимой солью меди образует осадок чёрного цвета:
H2S + CuSO4 = CuS↓ + H2SO4 1 балл
Фосфин в этих же условиях тоже даёт осадок чёрного цвета:
3PH3 + 6CuSO4 + 3H2O = 2Cu3P↓ + 6H2SO4 + H3PO3.
Итого 10 баллов.
Содержание ↑
olimpiadnye-zadanija.ru
Химия 11 класс, школьный (первый) этап, г. Москва, 2017-2018 год
Содержание
- Задача 1. Элемент-хамелеон
- Задача 2. Свойства гомологов
- Задача 3. Синтез ванадата
- Задача 4. Гидратация углеводородов
- Задача 5. Идентификация кислородсодержащего соединения
- Задача 6. Получение и свойства неизвестной жидкости
Задача 1. Элемент-хамелеон
Содержание ↑
На приведённой ниже схеме представлены превращения соединений одного химического элемента:
Вещества Б, Д и Е нерастворимы в воде, а раствор вещества Г под действием серной кислоты меняет окраску. Определите вещества А–Е и напишите уравнения реакций, представленных на схеме.
Решение
Содержание ↑
А – K3[Cr(OH)6] (или K[Cr(OH)4])
Б – Cr(OH)3 (или Cr2O3·xH2O)
В – Cr2(SO4)3
Г – K2CrO4
Д – Cr2O3
Е – Cr
Уравнения реакций:
2K3[Cr(OH)6] + 3H2SO4 = 2Cr(OH)3↓ + 3K2SO4 + 6H2O
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2K3[Cr(OH)6] + 3KClO = 2K2CrO4 + 3KCl + 2KOH + 5H2O
2Cr(OH)3 = Cr2O3 + 3H2O
Cr2O3 + 4KOH + 3KNO3 = 2K2CrO4 + 3KNO2 + 2H2O
Cr2O3 + 2Al = 2Cr + Al2O3
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O
Критерии оценивания:
Формулы веществ А–Е – по 0,5 балла (всего 3 балла)
Уравнения реакций – по 1 баллу (всего 7 баллов)
(за неуравненные реакции ставить по 0,5 балла)
Итого 10 баллов
Задача 2. Свойства гомологов
Содержание ↑
Ниже приведены схемы термического разложения трёх органических веществ A, Г и Е, являющихся ближайшими гомологами:
А → Б + В
Г → Д + В
Е → Ж + H2O
Определите неизвестные вещества, если известно, что водные растворы соединений А, Б, Г, Д и Е окрашивают лакмус в красный цвет. Приведите тривиальные и систематические названия веществ А-Е. Напишите уравнение реакции соединения Ж с бензолом в присутствии хлорида алюминия.
Решение
Содержание ↑
А – щавелевая (этандиовая) кислота HOOC–COOH
Б – муравьиная (метановая) кислота HCOOH
В – углекислый газ (оксид углерода (IV)) CO2
Г – малоновая (пропандиовая) кислота HOOC–CH2–COOH
Д – уксусная (этановая) кислота CH3COOH
Е – янтарная (бутандиовая) кислота HOOC–CH2–CH2-COOH
Ж – янтарный ангідрид
Уравнение реакции:
Критерии оценивания:
Формулы веществ А–Ж – по 0,5 балла (всего 3,5 балла)
Тривиальные названия веществ А–Е – по 0,25 балла (всего 1,5 балла)
Систематические названия веществ А–Е – по 0,25 балла (всего 1,5 балла)
Уравнение реакции вещества Ж с бензолом – 3,5 балла
Итого 10 баллов
Задача 3. Синтез ванадата
Содержание ↑
В муфельной печи при температуре 820° С и давлении 101,3 кПа прокалили 8,260 г стехиометрической смеси оксида ванадия(V) и карбоната натрия. Образовалась соль, и выделился газ объёмом 3,14 л (при условиях эксперимента).
- Рассчитайте состав смеси в массовых долях.
- Определите формулу полученной соли. Напишите уравнение реакции.
- Полученная соль принадлежит гомологическому ряду солей, в котором гомологическая разность – NaVO3. Установите формулу родоначальника этого ряда.
- Приведите примеры формул двух солей этого гомологического ряда.
Решение
Содержание ↑
1) Количество вещества и массу карбоната натрия можно найти через объём выделившегося углекислого газа:
ν(Na2CO3) = ν(CO2) = PV / RT = 101,3 × 3,14 / (8,314 × 1093) = 0,035 моль.
m(Na2CO3)= νM = 0,035 × 106 = 3,71 г.
Состав смеси:
ω(Na2CO3) = 3,71 / 8,26 = 0,449 = 44,9 %; ω(V2O5) = 0,551 = 55,1%
2) Формулу ванадата определим из молярного соотношения реагентов:
ν(V2O5) = m / M = (8,260 – 3,71) / 182 = 0,025 моль.
ν(Na2CO3) : ν(V2O5)= 0,035 : 0,025 = 3,5 : 2,5 = 7 : 5.
Уравнение реакции:
7Na2CO3 + 5V2O5 = 7CO2↑ + 2Na7V5O16
Формула ванадата – Na7V5O16.
(Принимается любая формула вида (Na7V5O16)n)
3) В первом члене гомологического ряда должен быть один атом ванадия. Чтобы найти соответствующую формулу, надо из формулы Na7V5O16 вычесть 4 гомологические разности:
Na7V5O16 – 4NaVO3 = Na3VO4.
4) Ближайшие гомологи первого члена ряда – Na4V2O7 и Na5V3O10.
Критерии оценивания:
Количество вещества CO2 – 1 балл
Масса карбоната натрия – 1 балл
Cостав смеси – 1 балл
Формула соли – 3 балла
Уравнение реакции – 1 балл
Формула первого члена ряда – 2 балла
Формулы двух гомологов – 1 балл (по 0,5 балла за каждую формулу)
Итого 10 баллов
Задача 4. Гидратация углеводородов
Содержание ↑
При гидратации двух нециклических углеводородов с неразветвлённой углеродной цепью, содержащих одинаковое число атомов углерода, образуются предельный одноатомный вторичный спирт и кетон в молярном соотношении 1 ꞉ 2. При сгорании исходной смеси углеводородов массой 15,45 г образуются продукты реакции общей массой 67,05 г. Известно, что при пропускании исходной смеси углеводородов через аммиачный раствор оксида серебра осадок не образуется.
- Определите молекулярные формулы углеводородов. Приведите необходимые расчёты и рассуждения.
- Установите возможное строение углеводородов.
- Приведите уравнения реакций гидратации искомых углеводородов с указанием условий их проведения.
Решение
Содержание ↑
- Если при гидратации углеводорода образуется одноатомный насыщенный спирт, то исходным соединением в этой реакции является алкен CnН2n. Кетон образуется при гидратации алкина CnН2n–2.
0,5 балла
0,5 балла
Уравнения реакций горения алкена и алкина:
CnН2n + 1,5nO2 → nCO2 + nH2O 0,5 балла
CnН2n–2 + (1,5n–0,5)O2 → nCO2 + (n–1)H2 O 0,5 балла
Согласно условию молярное соотношение спирта и кетона равно 1 ꞉ 2, следовательно, в таком же соотношении взяты алкен и алкин. Пусть количество вещества алкена равно x моль, тогда количество вещества алкина равно 2x моль. Используя эти обозначения, можно выразить количества вещества продуктов реакции горения:
ν(CO2)III = nx + 2nx = 3nx моль,
ν(H2O) = nx + 2x(n–1) = (3n–2)x моль.
Молярные массы: М(CnН2n) = 14n г/моль, М(CnН2n–2) = (14n–2) г/моль.
Запишем выражения для массы исходной смеси и массы продуктов сгорания:
14n·x + (14n–2) ·2x = 15,45
44·3nx + 18×(3n–2)x = 67,05
Решение этой системы уравнений:
x = 0,075, n = 5.
Следовательно, исходные углеводороды имеют молекулярные формулы: алкен – C5Н10, алкин – C5Н8. 4 балла
2) Гидратация двух алкенов состава C5Н10 с неразветвлённой углеродной цепью приводит к образованию вторичных спиртов. Этими алкенами являются пентен-1 и пентен-2. 1 балл
Существует только один алкин состава C5Н8, который не имеет терминального расположения тройной связи и не реагирует по этой причине с аммиачным раствором оксида серебра, это пентин-2. 1 балл
3) Уравнения реакций гидратации пентена-1 и пентена-2:
CH2=CHCH2CH2CH3 + H2O → CH3CH(OH)CH2CH2CH3
CH3CH=CHCH2CH3 + H2O → CH3CH2CH(OH)CH2CH3
и
CH3CH=CHCH2CH3 + H2O → CH3CH(OH)CH2CH2CH3
Реакции присоединения воды к алкенам происходят в присутствии кислотных катализаторов, например серной или фосфорной кислот. 1 балл
Уравнение реакции гидратации алкина:
CH3C≡CCH2CH3 + H2O → CH3CH2C(О)CH2CH3
и
CH3C≡CCH2CH3 + H2O → CH3C(O)CH2CH2CH3
Присоединение воды к алкинам происходит в присутствии солей ртути(II) и сильных кислот. 1 балл
Итого 10 баллов
Задача 5. Идентификация кислородсодержащего соединения
Содержание ↑
В молекуле органического вещества имеются бензольное кольцо, карбонильная и гидроксильная группы. Все остальные связи углерод–углерод одинарные, других циклов и функциональных групп нет. В 0,25 моль этого вещества содержится 1,204·1024 атомов водорода.
- Определите молекулярную формулу органического вещества. Приведите соответствующие расчёты.
- Установите строение и дайте название органического соединения, если известно, что оно не даёт осадка с бромной водой, вступает в реакцию серебряного зеркала, а при окислении перманганатом калия в кислой среде образует терефталевую (1,4-бензолдикарбоновую) кислоту.
- Приведите уравнения реакций взаимодействия искомого соединения с аммиачным раствором оксида серебра и перманганатом калия в кислой среде.
Решение
Содержание ↑
1) Общая формула соединений, имеющих бензольное кольцо, карбонильную и гидроксильную группы – CnH2n–8O2.
Количество вещества водорода в 0,25 моль данного органического вещества равно:
ν(Н) = 1,204·1024 / 6,02·1023 = 2 моль.
1 моль данного соединения содержит 8 моль водорода: ν(Н) = 2 / 0,25 = 8 моль.
Используя эти данные можно определить число атомов углерода в искомом соединении и, соответственно, его молекулярную формулу:
2n – 8 = 8; n = 8; молекулярная формула соединения – C8H8O2.
4 балла
2) Соединение реагирует с аммиачным раствором оксида серебра с выделением металлического серебра (реакция серебряного зеркала), следовательно, карбонильная группа в нём – альдегидная. С водным раствором брома данное соединение не даёт осадка, следовательно, гидроксильная группа – не фенольная, т. е. не связана непосредственно с бензольным кольцом. В результате окисления образуется 1,4-бензолдикарбоновая кислота, следовательно, альдегидная и гидроксиметильная группы расположены в пара-положении по отношению друг к другу:
4-гидроксиметилбензальдегид
4 балла
3) Уравнение реакции с аммиачным раствором оксида серебра:
п-HOCH2–C6H4–CHO + 2[Ag(NH3)2]OH → п-HOCH2–C6H4–COONH4 + 2Ag + 3NH3 + H2O 1 балл
Уравнение реакции окисления перманганатом калия в кислой среде:
5п-HOCH2–C6H4–CHO + 6KMnO4 + 9H2SO4 → 5п-HOOC–C6H4–COOH + 3К2SO4 + 6MnSO4 + 14H2O 1 балл
Итого 10 баллов
Задача 6. Получение и свойства неизвестной жидкости
Содержание ↑
Вещество Х – бесцветная прозрачная жидкость с характерным резким запахом, смешивается с водой в любых отношениях. В водном растворе Х лакмус принимает красную окраску. Во второй половине XVII века это вещество было выделено из рыжих лесных муравьёв. С веществом Х провели несколько опытов.
Опыт 1.
В пробирку налили немного вещества Х и добавили концентрированную серную кислоту. Пробирку закрыли пробкой с газоотводной трубкой (см. рисунок). При небольшом нагревании наблюдали выделение газа Y без цвета и запаха. Газ Y подожгли, наблюдали пламя красивого голубого цвета. При горении Y образуется газ Z.
Опыт 2. В пробирку с раствором дихромата калия, подкисленным серной кислотой, налили небольшое количество вещества X и нагрели. Окраска раствора изменилась, из реакционной смеси выделялся газ Z.
Опыт 3. К веществу Х добавили каталитическое количество порошкообразного иридия и нагрели. В результате реакции Х разложилось на два газообразных вещества, одним из которых является Z.
Опыт 4. Измерили относительную плотность паров вещества Х по воздуху. Полученное значение оказалось заметно больше отношения молярной массы X к средней молярной массе воздуха.
- О каких веществах X, Y и Z идёт речь в условии задачи? Напишите уравнения реакций превращения Х в Y и Y в Z.
- Какие правила безопасности и почему следует соблюдать при проведении опыта 1?
- Как и почему изменяется окраска раствора в опыте 2? Ответ проиллюстрируйте уравнением химической реакции.
- Напишите уравнение реакции каталитического разложения X в рисутствии иридия (опыт 3).
- Объясните результаты опыта 4.
Решение
Содержание ↑
1) X — муравьиная кислота, Y — угарный газ, Z — углекислый газ.
3 балла
(по 1 баллу за каждое верное вещество)
1 балл
(по 0,5 балла за каждое верное уравнение)
2) Угарный газ — ядовитое вещество. При работе с ним следует соблюдать осторожность, работать под тягой, не допуская попадания газа в рабочую зону. Также следует соблюдать осторожность при работе с концентрированными серной и муравьиной кислотами. Это едкие вещества, которые могут вызвать сильные ожоги. Нельзя допускать попадание этих веществ на кожу, особенно следует беречь глаза.
1 балл
3) Дихромат-ионы Cr2O72—, имеющие яркую оранжевую окраску, восстанавливаются муравьиной кислотой до катионов хрома Cr3+, окраска которых зелёная:
3HCOOH + K2Cr2O7 + 4H2SO4 = 3CO2↑ + Cr2(SO4)3 + K2SO4 + 7H2O
2 балла
4)
1 балл
5) Между молекулами муравьиной кислоты образуются водородные связи, благодаря которым даже в газообразном состоянии существуют довольно устойчивые димеры:
По этой причине плотность паров муравьиной кислоты оказывается больше того значения, которое можно рассчитать из условия, что все молекулы в газовой фазе одиночные.
2 балла
Итого 10 баллов
olimpiadnye-zadanija.ru
Химия 11 класс, муниципальный (второй) этап, г. Москва, 2016 год
Задание 1. (10 баллов) Правые части
По правой части с коэффициентами восстановите формулы веществ и коэффициенты в левой части уравнений реакций:
- … + … + … = 2Na2CrO4 + 3NaNO2 + 2CO2
- … + … = Na2Cr2O7+ 2NaCl + H2O
- … + … + … = 2Na3[Cr(OH)6] + 3S + 4NaOH
- … + … = 2CrBr3 + 3Br2 + 7H2O + 2NaBr
- … + … = K3[Cr(OH)6] + 2K2SO4
- … + … = 2Cr(OH)3 + H2CrO4+ 12HF
- … + … = Cr2(SO4)3 + SO2 + 2H2O + 4HCl
- … + … = 2Na3[Cr(OH)6] + 3Na2S
- … + …= 2CrCl3 + 12CO
- … + … = 2Na2CrO4+ H2O
Решение.
- Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
- 2Na2CrO4+ 2HCl = Na2Cr2O7+ 2NaCl + H2O
- 2Na2CrO4+ 8H2O + 3Na2S = 2Na3[Cr(OH)6] + 3S + 4NaOH
- Na2Cr2O7+ 14HBr = 2CrBr3 + 3Br2 + 7H2O + 2NaBr
- KCr(SO4)2 + 6KOH = K3[Cr(OH)6] + 2K2SO4
- 3CrF4 + 10H2O = 2Cr(OH)3 + H2CrO4+ 12HF
- 2CrCl2 + 4H2SO4(конц.) = Cr2(SO4)3 + SO2 + 2H2O + 4HCl
- Cr2S3 + 12NaOH(конц.) = 2Na3[Cr(OH)6] + 3Na2S
- 2Cr(CO)6 + 3Cl2= 2CrCl3 + 12CO
- Na2Cr2O7+ 2NaOH = 2Na2CrO4+ H2O
Критерии оценивания:
Каждое уравнение – 1 балл (если верные вещества, но не уравнено – 0,5 балла).
Всего за задачу – 10 баллов.
Задание 2. (10 баллов) «Активное ароматическое соединение»
Ароматическое соединение А состава С7H8O взаимодействует со щелочами, растворяясь в них, даёт окрашивание с хлоридом железа(III), реагирует с ацетилхлоридом и, при осторожном окислении, даёт продукт состава С7H6O3.
Продукт окисления соединения А при нитровании образует, преимуществен но, один изомер.
- Приведите структурные формулы всех ароматических соединений состава С7H8
- Определите, какая из приведённых структур соответствует соединению А? Обоснуйте свой выбор.
- Напишите уравнения реакций взаимодействия соединения А с гидроксидом натрия, ацетилхлоридом, с подкисленным раствором перманганата калия, а также уравнение реакции нитрования продукта окисления соединения А.
Решение
- Молекулярной формуле С7H8O соответствуют пять ароматических соединений: о-, м— и п-крезолы (метилфенолы), бензиловый спирт и метилфениловый эфир.

о-, м-, п-крезолы
бензиловый
спирт
метилфениловый
эфир
2. Из этих пяти изомеров со щёлочами взаимодействуют только крезолы. Они же дают качественную реакцию с хлоридом железа(III). Все три крезола взаимодействуют с ацетилхлоридом и окисляются до гидроксибензойных кислот состава С7H6O3. В гидроксибензойных кислотах имеются активирующая (–OH) и дезактивирующая (–COOH) группы. В этом случае ориентация замещения определяется, главным образом, активирующей группой. При нитровании о— и м-крезолов образуются два и три изомерных мононитро-соединения, соответственно, и только п-гидроксибензойная кислота даёт преимущественно одно нитропроизводное. Следовательно, соединению А соответствует п-крезол (п-метилфенол).
3. Уравнения реакций:
Критерии оценивания.
- Структурные формулы ароматических соединений, соответствующихмолекулярной формуле С7H8O, – 3 балла (по 0,5 балла за каждый из крезолов и бензиловый спирт, 1 балл – за простой эфир).
- Выбор соединения А из межклассовых изомеров С7H8O и его обоснование – 3 балла (из них – 1 балл за выбор крезола, 2 балла – за обоснование пара-изомера).
- Уравнения реакций – по 1 баллу, всего – 4 балла.
Всего за задачу – 10 баллов.
Задание 3. (10 баллов) «Расчёт состава газовой смеси»
Смесь ацетилена, этилена и водорода, имеющая относительную плотность по водороду 4,4, содержит 25 % водорода как элемента (по массе).
- Определите объёмные доли газов в исходной смеси.
- Напишите уравнения реакций гидрирования углеводородов, составляющих исходную газовую смесь.
- Определите объёмные доли газов в смеси, полученной после пропускания исходной газовой смеси над никелевым катализатором. (Считайте выход реакций гидрирования равным 100 %.)
Решение
1. Пусть количество вещества исходной смеси газов равно 1 моль, n(С2Н2) = x моль; n(С2Н4) = y моль, тогда n(Н2) = (1 – x –y) моль. Средняя молярная масса исходной газовой смеси равна:
Мср(исх.) = 4,4·2 = 8,8 г/моль.
8,8 = 26x + 28y +2(1 – x –y) = 24x + 26y +2
24x + 26y = 6,8 (1-е уравнение)
Массовая доля атомов водорода в смеси:
Упрощая, получаем 2-е уравнение:
6x + 4,5y = 1,5
Решая систему уравнений, находим x = 0,175; y = 0,10.
- φ(С2Н2) = 0,175 = 17,5%;
- φ(С2Н4) = 0,10 = 10%;
- φ(Н2) = 1 – 0,175 – 0,10 = 0,725 = 72,5%.
2. Уравнения реакций гидрирования ацетилена и этилена:
- C2H2 + 2 H2 C2H6
- C2h5 + h3 C2H6
3. Газовая смесь после пропускания исходной смеси над никелевым катализатором состоит из этана и остаточного водорода.
- n(Н2)прореаг = n(С2Н2)·2 + n(С2Н4) = 0,45 моль;
- n(Н2)ост = 0,725 – 0,45 = 0,275 моль;
- n(С2Н6) = n(С2Н2) + n(С2Н4) = 0,275 моль.
Количества вещества этана и остаточного водорода равны, следовательно, равны и их объёмные доли:
φ(С2Н6) = φ(Н2) = 50%.
Критерии оценивания
- Расчёт мольной доли ацетилена, этилена и водорода в исходной газовой смеси – 4 баллов (из них – по 1 баллу за составление уравнений для средней молярной массы и массовой доли водорода).
- Уравнения реакций гидрирования ацетилена и этилена – 2 балла.
- Определение состава конечной газовой смеси и объёмных долей газов – 4 балла (по 1,5 балла – за количества веществ и 1 балл за объёмные доли).
Всего за задачу – 10 баллов.
Задание 4. (10 баллов) «Органическое основание»
Органическое соединение X, содержащее 11,57% азота (по массе), часто применяется в органическом синтезе в качестве основания. О реакционной способности соединения Х известно следующее: при взаимодействии соединения Х с хлором на свету образуется смесь двух монохлорпроизводных, при реакции с бромом в присутствии бромида железа(III) образуется единственное монобромпроизводное, а окисление Х горячим подкисленным раствором перманганата калия происходит без выделения газа.
- Установите структуру соединения Х и приведите его систематическое название.
- Напишите уравнения всех описанных реакций.
- Приведите уравнение реакции соединения Х с соляной кислотой.
Решение
1. Из описанных свойств вещества Х можно предположить, что оно имеет ароматический характер. Рассчитаем молярную массу вещества Х в предпо- ложении, что в молекуле – один атом азота:
M(X) = 14 / 0,1157 = 121 г/моль.
Вычитая молярную массу азота, получаем 107 г/моль, что соответствует остатку С8Н11. Таким образом, брутто-формула вещества Х – С8H11N. Тот факт, что соединение Х реагирует с хлором на свету, говорит о наличии боковых алкильных групп, присоединенных к ароматической системе (причём, как минимум, двух, так как происходит образование двух монохлорпроизводных). Поскольку при окислении подкисленным раствором перманганата калия не происходит выделения газа, можно сделать вывод о том, что алкильные группы представляют собой либо метильные группы, либо радикалы нормального строения длиной от трёх атомов углерода (окисляются в карбоновые кислоты). Наличие в молекуле этильных или изопропильных групп, соединённых с арома- тическим ядром, будет приводить к выделению углекислого газа. Так как бромирование на бромиде железа приводит к единственному монобромпроизводному, можно сделать вывод, что все свободные положения в ароматической системе Х, доступные для реакций замещения, эквивалентны. Анализ брутто-формулы говорит о том, что соединение Х – либо замещенный анилин, либо замещенный пиридин. Однако ни одно производное анилина не удовлетворяет условиям задачи. Из производных пиридина условиям удовлетворяют 2,4,6-триметилпиридин (известный как симм- коллидин) и 3,4,5-триметилпиридин. Последний плохо бромируется в орто- положение, но формально подходит.
2,4,6-триметилпиридин
3,4,5-триметилпиридин
2. Уравнения реакций (на примере 2,4,6-триметилпиридина):
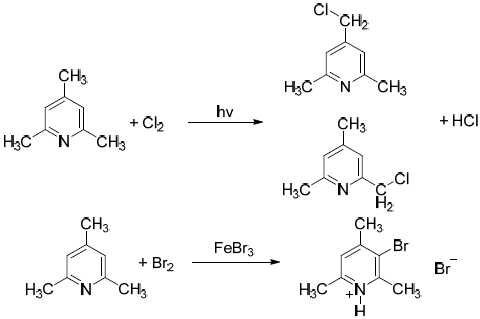
Уравнения реакций (на примере 2,4,6-триметилпиридина)
(допускается вариант с HBr и свободным пиридином)
Критерии оценивания
- Расчёт брутто-формулы вещества Х – 2 балла.
- Структурная формула вещества Х – 3 балла.
- Название вещества Х – 1 балл.
- Уравнения реакций – по 1 баллу (всего 4 балла) (0,5 балла за неуравненную реакцию).
Верно написанные уравнения реакций с изомерными анилинами или пиридинами оценивать полным баллом в случае, если количества образующихся продуктов удовлетворяют условию задачи.
Всего за задачу – 10 баллов.
Задание 5. (10 баллов) «Превращения азотсодержащих соединений»
Взаимодействие вещества K, содержащего 15,38% азота (по массе), с водо родом на палладиевом катализаторе приводит к образованию вещества L, активно применяемого в производстве красителей. Кипячение вещества L в безводной уксусной кислоте приводит к образованию белого кристаллического вещества M. Взаимодействие вещества M со смесью концентрированных азотной и серной кислот при нагревании даёт вещество N, при кипячении которого в водном растворе гидроксида натрия образуется продукт O, содержащий 20,29% азота (по массе).
- Укажите структуры веществ K–O и приведите уравнения всех упомянутых реакций.
- Приведите промышленный способ получения вещества L.
- Почему вещество O нельзя получить напрямую из вещества L?
Решение
- Описанные в задаче превращения говорят о наличии в веществах K–O ароматического кольца. Найдём молярную массу вещества K, предположив, что в молекуле K один атом азота: 14/0,1538 = 91 г/моль. Вычитая молярные массы азота и шести атомов углерода (бензольное кольцо), получаем 91 – 14 – 72 = 5 г/моль, что соответствует пяти атомам водорода. Однако для брутто-формулы C6H5N не удаётся подобрать адекватную структуру. Предположим, что в молекуле K два атома азота. Тогда М(K) = 28/0,1538 = 182 г/моль.
Удвоение брутто-формулы даёт C12H10N2, которое можно рассматривать как два бензольных кольца (С6H5) присоединённых к фрагменту N2, что соответствует структуре:
Гидрирование азобензола приводит к образованию анилина (L).
Уравнения реакций:
Финальным соединением в цепочке является пара-нитроанилин, содержащий 20,29% азота.
2. В промышленности анилин получают восстановлением нитробензола водородом:
3. Прямое нитрование анилина невозможно, так как аминогруппа неустойчива к действию кислот и окислителей.
Критерии оценивания
- Структура вещества K – 2 балла
- Структуры веществ L–O – по 1 баллу (всего 4 балла)
- Уравнения реакций – по 0,5 балла (всего 2 балла)
- Верно указан промышленный способ получения анилина (засчитывать любые разумные восстановители) – 1 балл
- Верно указаны причины невозможности прямого нитрования анилина – 1 балл
Всего за задачу – 10 баллов.
Задание 6. (10 баллов) «Органический эксперимент»
Органическое вещество А можно получить в лаборатории несколькими способами, два из которых рассмотрены ниже.
Способ 1
В пробирку 1 (см. рис. 6.1) наливают небольшое количество жидкости X, над которой закрепляют раскалённую медную спираль 2. По тонкой трубочке в пробирку вдувают воздух. По газоотводной трубке в пробирку 3 с холодной водой проходят пары, содержащие вещество А.
Рисунок 6.1
Способ 2
В колбу Вюрца 1 (см. рис. 6.2) помещают кусочки твёрдого вещества Y1. Из капельной воронки добавляют воду. Как только вода приходит в соприкосновение с поверхностью Y1, тотчас начинает выделяться бесцветный газ Y2, который пропускают через раствор сульфата меди в банке 2 для очистки от примесей. В банку 3 предварительно наливают раствор серной кислоты и добавляют оксид ртути(II). При взаимодействии этих веществ образуется катализатор для реакции синтеза A. В присутствии данного катализатора газ Y2 в банке 3 превращается в вещество А.

Рисунок 6.2
- О получении какого вещества А идёт речь в условии задачи?
- Из какого вещества X получают А в приборе, показанном на рис. 6.1? Приведите соответствующее уравнение реакции.
- Определите вещества Y1и Y2, о которых идёт речь при описании второго способа получения вещества А. Составьте соответствующие уравнения реакций. Кто открыл реакцию получения А из Y2?
- С помощью каких качественных реакций можно доказать образование вещества А в ходе описанных опытов? Приведите два примера.
- По мере пропускания газа в банке 2 образуется осадок чёрного цвета. Предположите, какая реакция протекает в этом промывном сосуде, если известно, что сырьё, используемое в промышленности для получения Y1, может содержать примесь сульфатов.
- Часто для получения газа Y2на вещество Y1действуют не водой, а крепким раствором поваренной соли. Почему?
Решение и критерии оценивания
1. Вещество А – уксусный альдегид (ацетальдегид, этаналь) Ch4CHO.
1 балл
2. Способ 1 – получение ацетальдегида из этанола, т.е. вещества X.
1 балл
Допускается несколько вариантов уравнений:
- CH3 – CH2 – OH CH3 – CHO + H2 (дегидрирование этанола)
- 2CH3 – CH2 – OH + O2 2CH3–CHO + 2H2O (каталитическое окисление этанола)
- CH3 – CH2 – OH + CuO → CH3 – CHO + H2O + Cu
1 балл за одно верное уравнение (любое)
3. Y1 – карбид кальция; Y2 – ацетилен
1 балл
- CaC2 + 2H2O → C2H2↑ + Ca(OH)2
- CH ≡ CH + H2O CH3 – CHO
По 1 баллу за каждое уравнение.
Реакцию гидратации ацетилена (и его гомологов) в присутствии солей ртути открыл российский учёный М.Г. Кучеров (1881 г.).
1 балл
4. Образование ацетальдегида можно доказать с помощью качественных реакций на альдегиды, например, с фуксинсернистой кислотой или с аммиачным раствором оксида серебра (реактивом Толленса).
1 балл (по 0,5 балла за каждый пример)
5. Технический карбид кальция (Y1) — продукт прокаливания смеси оксида кальция с коксом. Оксид кальция получают из природных известняков, содержащих примеси фосфата и сульфата кальция. В результате их восстановления коксом в конечном продукте оказываются фосфид и сульфид.
При действии воды на карбид кальция, загрязнённый данными соединениями, протекает реакция их гидролиза и в образующийся ацетилен попадают примеси фосфина и сероводорода. В банке 2 выделяющийся ацетилен очищается от этих примесей. Сероводород с растворимой солью меди образует осадок чёрного цвета:
H2S + CuSO4 = CuS↓ + H2SO4
1 балл
Фосфин в этих же условиях тоже даёт осадок чёрного цвета: 3PH3 + 6CuSO4 + 3H2O = 2Cu3P↓ + 6H2SO4 + H3PO3
6. При приливании воды к карбиду кальция реакция идёт всегда очень бурно.
Для получения более спокойного и равномерного тока ацетилена часто к карбиду кальция добавляют крепкий раствор поваренной соли.
1 балл
Всего за задачу – 10 баллов.
Максимальное количество баллов за работу – 50.
Общие указания: если в задаче требуются расчёты, они обязательно должны быть приведены в решении. Ответ, приведённый без расчётов или иного обоснования, не засчитывается.
В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
olimpiadnye-zadanija.ru
Муниципальный этап олимпиады по химии (11 класс) – УчМет
г. Нягань ХМАО-Югра Тюменская область
Решение заданий 11 класса
Тест.
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
№ ответа |
4 |
4 |
4 |
2 |
3 |
3 |
2 |
2 |
1 |
4 |
Задание 1
-
2Na + Cl2 = 2NaCl; 2. Na2O + 2HCl = 2NaCl + H2O; 3. NaOH + HCl = NaCl + H2O; 4. Na2CO3 + 2HCl = 2NaCl + H2O + CO2;
5. Na2SiO3 + 2HCl = 2NaCl + H2SiO3 (возможны другие варианты) Итого: 5 баллов
Задание 2
Вещества реагируют между собой с выпадением осадка хлорида серебра.
BaCl2 + 2AgNO3 = 2AgCl + Ba(NO3)2 (1 балл)
Масса хлорида бария m(BaCl2) = m(р-ра) * ω = 208 г * 0,2 = 41,6 г (0,5 балла)
Количество хлорида бария n(BaCl2) = m/M = 41,6 г : 208 г/моль = 0,2 моль
(0,5 балла)
Масса нитрата серебра бария m(AgNO3) = m(р-ра) * ω = 340 г * 0,1 = 34 г
(0,5 балла)
Количество нитрата серебра n(AgNO3) = m/M = 34 г : 170 г/моль = 0,2 моль
(0,5 балла)
1 моль хлорида бария реагирует с 2 моль нитрата серебра.
0,1 моль хлорида бария реагирует с 0,2 моль нитрата серебра, (1 балл)
следовательно, 0,1 моль хлорида бария осталась в избытке и находится в растворе. (1 балл)
Согласно уравнению реакции получилось 0,2 моль осадка хлорида серебра
(0,5 балла) и 0,1 моль нитрата бария (0,5 балла)
Масса осадка m(AgCl) = M * n = 143,5 г/моль * 0,2 моль = 28,7 г (0,5 балла). В растворе после отделения осадка находится 0,1 моль BaCl2 и 0,2 моль Ba(NO3)2 (0,5 балла) Итого: 7 баллов
Задание 3
|
|
Ga: +31 2)8)18)3) (0,25 балла)
P + 3e— → P3-(0,25 балла)
Ga — 3e— → Ga3+(0,25 балла) |
-
Распределение электронов по квантовым ячейкам (1 балл). Электронные формулы атомов: Р 1s22s22p63s23p3Ga 1s22s22p63s23p63d104s24p1 (1 балл)
-
Ga + P = GaP (0,5 балла)
-
связь ионная (0,5 балла) Итого: 8 баллов
Задание 4
1) С2Н2 + Н2 = С2Н4; 2) С2Н4 + HBr = C2H5Br;
3) C2H5Br + NaOH(водн. р-р) = C2H5OH + NaBr;
4) C2H5OH + CuO = CH3CHO + Cu + H2O; 5) CH3CHO + Ag2O = CH3COOH + 2Ag
А – ацетилен; С2Н4 – этилен; Б – бромэтан; В этанол; Г – этаналь; Д – уксусная кислота.
1 балл за каждое уравнение реакции, 0,15 балла за каждое название.
Итого: 6 баллов
Задание 5
Cl20+2ē 2Cl-1 │10 │ 5 │- окислитель (2 балла)
Cl20-10 ē 2Cl+5 │2 │ 1 │ — восстановитель (2 балла)
6Cl2 + 12KОН → 2KClО3 + 10KCl + 6H2O или
3Cl2 + 6KОН → KClО3 + 5KCl + 3H2O (3 балла)
Итого: 7 баллов
Задание 6
М(в-ва) = 22,4 *1,35 = 30 г/моль (1 балл)
n(CO2) = 13,2/44 = 0,3 моль. (0,5 балла)
n(C) = 0,3 моль. (0,5 балла)
n(H2O) = 8,1/18 = 0,45 моль. (0, 5 балла)
n(H) = 0,9 моль. (0,5 балла)
m(C) = 0,3 * 12 = 3,6 г (1 балл)
m(H) = 0,9 г m(O) = 0 г (1 балл)
x : y = 0,3 : 0,9 = 1 : 3 (1 балл)
простейшая формула СН3 (0, 5 балла)
истинная формула С2Н6 (0,5 балла)
Итого: 7 баллов
Всего: 50 баллов
www.uchmet.ru
Олимпиада по химии 11 класс с ответами 2017 2018 муниципальный этап
1. Число энергетических уровней в электронной оболочке атома равно
1) порядковому номеру 3) заряду ядра
2) номеру группы 4) номеру периода
2. В электронной оболочке атома магния число энергетических уровней равно:
1) 4 2) 1 3) 2 4) 3
3. Атому фосфора соответствует электронная схема:
1) 3)
+15 +8
2 8 5 2 6
2) 4)
+9 +19
2 7 2 8 8 1
4. Соотнесите:
Число энергетических уровней
А) 5 Б) 2 В) 3 Г) 4
Атом химического элемента
1) хлор 4) олово
2) водород 5) бром
3) фтор 6) цезий
5. Соотнесите:
Число электронов на внешнем уровне
А) 7 Б) 1 В) 3 Г) 5
Атом химического элемента
1) I 3) B 5) K
2) Ca 4) Ar 6) As
6. Ряд чисел 2, 8, 7 соответствует распределению электронов по энергети-
ческим уровням атома
1) фтора 3) азота
2) брома 4) хлора
7. Какой ряд чисел соответствует распределению электронов по энергети-
ческим уровням в атоме алюминия?
1) 2, 8, 3 3) 2, 3
2) 2, 8, 1 4) 2, 8, 8, 3
8. Символ химического элемента, электронная формула атома которого
1s22s22p63s23p2:
1) Se 2) C 3) Si 4) Al
9. Электронная формула атома азота:
1) 1s22s22p1 3) 1s22s22p63s2
2) 1s22s22p4 4) 1s22s22p3
10. Одинаковое число электронов на внешнем уровне имеют атомы:
1) K и Ca 3) S и Cl
2) Se и P 4) F и Br
kontrolnaya-s-otvetami.ru
Задания и решения школьного этапа олимпиады по химии для 11 класса.
Школьный этап олимпиады по химии 2018 -2019 учебный год.
11 класс
Максимальный балл – 50
Задание 11.1. «Ты это можешь» (максимум 10 баллов)
Вам предложены задания с выбором ответа (в каждом задании только один ответ правильный). Выберите верный ответ.
1. Изомерами являются:
| 1) метан и этан | 2) хлорметан и дихлорметан | 3) этан и этен | 4) бутен и циклобутан |
2. Установите справедливость утверждений
А. Для получения бромной воды нужно бромоводород растворить в воде
Б. Нашатырный спирт – это раствор аммиака в воде
| 1) Верно только А | 2) Верно только Б | 3) верны оба суждения | 4) оба суждения неверны |
3. Массовая доля серы в одном из ее оксидов составляет 40%. Чему равна массовая доля серы в кислоте, образующейся в результате растворения этого оксида в воде, %
| 1) 39,02 | 2) 33,33 | 3) 32,65 | 4) 28,07 |
4. Для нейтрализации раствора, полученного при растворении 7,5 г карбоновой кислоты в воде, потребовалось 125 мл раствора гидроксида натрия (С=1 моль/л). Какую кислоту растворили?
| 1) муравьиную | 2) уксусную | 3) масляную | 4) щавелевую |
5. Может реагировать при обычных условиях, как с соляной кислотой, так и с гидроксидом натрия
| 1) | муравьиная кислота |
| 2) | лимонная кислота |
| 3) | щавелевая кислота |
| 4) | аминоуксусная кислота |
6. Смешали равные объемы газов: аммиака, азота и метиламина. Полученную смесь, объемом 1,2 л пропустили через избыток раствора соляной кислоты. Чему будет равен, объем газа в литрах, измеренный при тех же условиях на выходе из склянки?
| 1) 0 | 2) 0,4 | 3) 0,8 | 4) 1,2 |
7. В метане, объемом 3 л (н.у.) содержится столько атомов водорода, сколько
| 1) | молекул водорода в порции массой 2 г |
| 2) | атомов водорода в 2 л этана (н.у.) |
| 3) | атомов кислорода в 7 л углекислого газа (н.у.) |
| 4) | атомов углерода в 5 л этана (н.у.) |
8. При добавлении к меди концентрированной серной кислоты наблюдается выделение:
| 1) водорода | 2) диоксида серы | 3) сероводорода | 4) отсутствие взаимодействия |
9. Для полного восстановления 1,16 г высшего оксида некоторого металла потребовалось 336 мл (н.у.) водорода. Этот металл
| 1) хром | 2) вольфрам | 3) марганец | 4) кобальт |
10. Электронную конфигурацию катиона кальция имеет ион
1) F— 2) Mg2+ 3) Cl— 4) Al3+
Задание 11.2. Решите задачу (максимум 10 баллов)
28,4 г оксида фосфора (V) растворили в 400 мл 3,9 %-ного по массе раствора NaOH, имеющего плотность ρ = 1,02 г/см3 . Рассчитайте долю (в масс. %) соли в полученном растворе.
Задание 11.3. (максимум 10 баллов)
Допишите недостающие вещества в уравнения химических реакций, составьте электронный баланс, расставьте коэффициенты:
NH3 + KMnO4 + KOH = N2 + … +H2O
Na2SO3 + KMnO4+H2O = MnO2 + Na2SO4 + …
KMnO4 + HCl = MnCl2 + Cl2 + … + …
CrCl3 + NaOH + H2O2 = … + NaCl + H2O
K2CrO4 + KNO2 + KOH +… = KNO3 + K3[Cr(OH)6]
Задание 11.4. Решите задачу (максимум 10 баллов)
Свежеприготовленная смесь пропанола и пропионовой кислоты может прореагировать с 100 мл 4,04% -ного раствора гидрокарбоната натрия (плотность раствора 1,04 г/мл). Выделившийся при этом газ занимает в 12 раз меньший объём, чем тот же газ, образующийся при полном сгорании такого же количества исходной смеси (объёмы газов измерены при одинаковых условиях).
Рассчитайте массовые доли (в %) компонентов исходной смеси.
Задание 11.5. Качественная задача (максимум 10 баллов)
Идентифицируйте следующие вещества. Напишите все уравнения реакций, указанные в тексте.
Вещество А – бесцветный ядовитый газ, хорошо горит на воздухе синим пламенем, восстанавливает оксид меди (II) до металла; реагирует с хлором, образуя другой ядовитый газ; при нагревании с расплавом щелочи под давлением образует соль, при обработке которой концентрированной серной кислотой выделяется газ А.
Вещество В – соль желтого цвета, хорошо растворимая в воде, окрашивает пламя в фиолетовый цвет. При добавлении в раствор соли разбавленной соляной кислоты окраска меняется на оранжево – красную. После нейтрализации раствора концентрированной щелочью окраска раствора вновь становится желтой. При взаимодействии кристаллической соли В с концентрированной соляной кислотой при нагревании выделяется газ желтого цвета, реагирующий с горячим раствором щелочи с образованием двух солей.
С – металл, который до конца XIX века оставался очень дорогим металлом и использовался в основном для изготовления ювелирных изделий (как «серебро из глины»). При взаимодействии этого металла с нитратом калия в концентрированном растворе гидроксида калия образуется газ D и соль Е. Газ D обладает слабовыраженными основными свойствами.
При пропускании через раствор соли Е углекислого газа выпадает осадок и образуется другая соль F, разлагающаяся при нагревании с образованием газа G, при пропускании которого через раствор известковой воды выпадает осадок.
Вещество Н представляет собой тригидрат некоторой соли. При нагревании вещества Н удаляется кристализационная вода, а затем соль разлагается с образованием веществ: I— твердое, черный цвет, К – газ бесцветный и L – газ бурого цвета. При восстановлении вещества I водородом образуется вещество М красного цвета.
Примерные варианты решений и оценка задач
Школьного этапа Всероссийской олимпиады школьников по химии
2018–2019 учебный год
11 класс
11.1 «Ты это можешь» (максимум 10 баллов)
Распределение баллов: всего 10 баллов, за каждый верный ответ по одному баллу.
| Вопрос | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 4) | 2) | 3) | 2) | 4) | 2) | 2) | 2) | 2) | 3) |
11.2. А.В. Артемов, С.С. Дерябина
28,4 г оксида фосфора (V) растворили в 400 мл 3,9 %-ного по массе раствора NaOH, имеющего плотность ρ = 1,02 г/см3 . Рассчитайте долю (в масс. %) соли в полученном растворе.
Решение:
P2 O5 + 2 NaOH + H2O = 2 NaH2PO4, (1) P2 O5 + 4 NaOH = 2 Na2HPO4 + H2O, (2) P2 O5 + 6 NaOH = 2 Na3PO4 +3H2O (3) | 3 балла |
n (P2 O5) = m (P2 O5) /M(P2 O5) = = 0,2 моль n (NaOH) = m (NaOH) /M(NaOH) = : 40 = = 0,4 моль | 2 балла |
n (P2 O5) : n (NaOH) = 0,2: 0,4 = 1:2 | 1 балл |
n (NaH2PO4) = n (NaOH) = 0,4 моль | 1 балл |
m (NaH2PO4) = n (NaH2PO4) × M (NaH2PO4) =0,4 ×120 =48 г. | 1 балл |
𝛚 = m (NaH2PO4) / Vρ + m (P2 O5 ) = 48 × 100 / 400 ×1,02 +28,4 = 11 мас. % | 2 балла |
| Итого: | 10 баллов |
11.3. МЭ всероссийской олимпиады школьников по химии 2017 – 2018 учебный год
Допишите недостающие вещества в уравнения химических реакций, составьте электронный баланс, расставьте коэффициенты:
NH3 + KMnO4 + KOH = N2 + … +H2O
Na2SO3 + KMnO4+H2O = MnO2 + Na2SO4 + …
KMnO4 + HCl = MnCl2 + Cl2 + … + …
CrCl3 + NaOH + H2O2 = … + NaCl + H2O
K2CrO4 + KNO2 + KOH +… = KNO3 + K3[Cr(OH)6]
Решение:
2NH3 + 6KMnO4 + 6KOH = N2 + 6K2MnO4 +6H2O
3Na2SO3 + 2KMnO4+H2O = 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2CrCl3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 6NaCl + 8H2O
2K2CrO4 + 3KNO2 + 2KOH +5H2O = 3KNO3 + 2K3[Cr(OH)6]
| Верно указаны пропущенные вещества | 0,5 балла за каждое уравнение реакции |
| Составлен электронный баланс | 0,5 балла за каждое уравнение реакции |
| Верно расставлены коэффициенты | 1 балл за каждое уравнение реакции |
| ИТОГО | 10 баллов |
11.4. МЭ всероссийской олимпиады школьников по химии 2017 – 2018 учебный год
Свежеприготовленная смесь пропанола и пропионовой кислоты может прореагировать с 100 мл 4,04% -ного раствора гидрокарбоната натрия (плотность раствора 1,04 г/мл). Выделившийся при этом газ занимает в 12 раз меньший объём, чем тот же газ, образующийся при полном сгорании такого же количества исходной смеси (объёмы газов измерены при одинаковых условиях).
Рассчитайте массовые доли (в %) компонентов исходной смеси.
Решение:
| 1 | Написаны уравнения реакций: C3H7OH + NaHCO3 ≠ C2H5COOH + NaHCO3 → C2H5COONa + H2O + CO2↑ (1) М = 74 г/моль М = 84 г/моль 2C2H5COOH + 7O2 → 6CO2↑ + 6H2O (2) 2C3H7OH + 9O2 → 6CO2↑ + 8H2O (3) М = 60 г/моль | 3 балла |
| 2 | Рассчитано количества вещества NaHCO3: n(NaHCO3) = 100 ∙ 1,04 ∙ 0,404/84 = 0,5 моль | 1 балл |
| 3 | Рассчитана масса пропионовой кислоты: n(C2H5COOH) = n(NaHCO3) = 0,05 моль m(C2H5COOH) = M ∙ n = 74 ∙ 0,05 = 3,7 г | 1 балл |
| 4 | Найдено количество вещества CO2 по уравнению (1): n(CO2) = n(C2H5COOH) = 0,05 моль | 1 балл |
| 5 | Найдено количество вещества CO2, образовавшееся при сгорании исходной смеси: n(CO2, образ. при сгорании исходной смеси) = 0,05 ∙ 12 = 0,6 моль | 1 балл |
| 6 | Найдено количество вещества CO2 по уравнению (2): n(CO2) = 3n(C2H5COOH) = 0,15 моль | 1 балл |
| 7 | Рассчитано количество вещества и масса пропанола: n(C3H7OH) = 1/3 n(CO2) = 0,45/3 = 0,15 моль m(C3H7OH) = 0,15 ∙ 60 =9 г | 1 балл |
| 8 | Рассчитана масса смеси и массовые доли её компонентов: m( исх. смеси) = m(C2H5COOH) + m(C3H7OH) = 3,7 + 9 = 12,7 г ώ (C3H7OH) = 9/12,7 = 0,7087, или70,87% ώ(C2H5COOH) = 3,7/12,7 = 0,2913,или70,87% | 1 балл |
| ИТОГО | 10 баллов |
11.5. Идентифицируйте следующие вещества. Напишите все уравнения реакций, указанные в тексте.
Вещество А – бесцветный ядовитый газ, хорошо горит на воздухе синим пламенем, восстанавливает оксид меди (II) до металла; реагирует с хлором, образуя другой ядовитый газ; при нагревании с расплавом щелочи под давлением образует соль, при обработке которой концентрированной серной кислотой выделяется газ А.
Вещество В – соль желтого цвета, хорошо растворимая в воде, окрашивает пламя в фиолетовый цвет. При добавлении в раствор соли разбавленной соляной кислоты окраска меняется на оранжево – красную. После нейтрализации раствора концентрированной щелочью окраска раствора вновь становится желтой. При взаимодействии кристаллической соли В с концентрированной соляной кислотой при нагревании выделяется газ желтого цвета, реагирующий с горячим раствором щелочи с образованием двух солей.
С – металл, который до конца XIX века оставался очень дорогим металлом и использовался в основном для изготовления ювелирных изделий (как «серебро из глины»). При взаимодействии этого металла с нитратом калия в концентрированном растворе гидроксида калия образуется газ D и соль Е. Газ D обладает слабовыраженными основными свойствами.
При пропускании через раствор соли Е углекислого газа выпадает осадок и образуется другая соль F, разлагающаяся при нагревании с образованием газа G, при пропускании которого через раствор известковой воды выпадает осадок.
Вещество Н представляет собой тригидрат некоторой соли. При нагревании вещества Н удаляется кристализационная вода, а затем соль разлагается с образованием веществ: I— твердое, черный цвет, К – газ бесцветный и L – газ бурого цвета. При восстановлении вещества I водородом образуется вещество М красного цвета.
Решение:

multiurok.ru
Олимпиада по Химии 11 класс
ШКОЛЬНЫЙ ЭТАП ВСЕРОССИЙСКОЙ ОЛИМПИАДЫ ШКОЛЬНИКОВ
2018-2019 УЧЕБНЫЙ ГОД
Химия, 11 класс
Время выполнения работы –
Тестовые задания (за каждый правильный ответ 1 балл)
1. Наибольшую молекулярную массу имеет
А) СН3С1
Б) СН2С12
В) СНС13
Г) СС14
2. Трехэлементное вещество — это …
А) С2Н5ОН
Б) С2Н6
В) СН3NО2
Г) СН2(NН2)-СООН
3. Сумма коэффициентов в молекулярном уравнении реакции C3H8+O2 → CO2 + H2O
А)10
Б)11
В)12
Г)13
4. Количество вещества (моль), содержащееся в 2,97 г С2Н4С12
А) 0,5
Б) 0,3
В) 0,03
Г)0,15
5. Реакция, в результате которой растворяется осадок
А) Са + Вг2
Б) К2СО3 + Н2SО4
В) Сu(ОН)2 + НNО3
Г) С2Н4 + КМnО4 + Н2О
6. В соединении С2Н5Э массовая доля элемента 55,04%. Неизвестный элемент — это …
А) фосфор
Б) хлор
В) азот
Г) бром
7. Молярная масса газа массой 1,26 г, занимающего объем 0,672 л (н.у.), равна
А) 44
Б) 28
В) 32
Г) 42
8. Какой объем газа выделится при растворении в избытке соляной кислоты 14 г железа:
А) 11,2 л
Б) 8,4 л
В) 5,6 л
Г) 2,24 л
9. Определите валентный угол у второго атома углерода в молекуле Н2С=С=СН-СН3
А) 1800
Б) 1090
В) 900
Г) 1200
10. Массовая доля водорода наименьшая:
А) в этане
Б) в пропане
В) в бутане
Г) в метане
Открытые вопросы
Задание № 1.
Почему в середине периодической системы появляется группа лантаноидов, у которых увеличение порядкового номера не вызывает существенного изменения их химических свойств, в то время, как для большинства элементов, изменения порядкового номера приводит к изменению химических свойств. Ответ подтвердите электронными формулами. (2 балла)
Задание № 2.
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объем собранного газа. (5 баллов)
Задание № 3.
Составьте все возможные изомеры гексана и запишите их структурные формулы.
(3 балла)
Ответы на тесты
Тестовое задание
№ 1 Г
№ 2 А
№ 3 Г
№ 4 В
№ 5 В
№ 6 Б
№ 7 Г
№ 8 В
№ 9 А
№ 10 Г
Задание № 1.
Химические свойства элементов определяются электронным строением атомов. Лантаноиды относятся к f- элементам, в атомах которых заполняются 4f-оболочки. Лантаноиды очень схожи по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия.
Задание № 2.
Уравнения реакций:
1)2Na2O2 + 2h3O = 4NaOH + O2↑
2NaOH + h3SO4 = Na2SO4 + 2h3O
2)Рассчитаны количества вещества серной кислоты и щелочи:
n(h3SO4) = (300•1,08•0,1)/98 = 0,33(моль)
n(NaOH) = 2n(h3SO4) = 2n(h3SO4) = 2•0,33 = 0,66(моль)
3)Рассчитаны количества вещества и масса пероксида натрия:
n(Na2O2) = 0,5n(NaOH) = 0,5•0,66 = 0,33 (моль)
m(Na2O2) = 0,33•78 = 25,74 (г)
4)Рассчитано количество вещества и объем кислорода:
n(O2) = 0,25n(NaOН) = 0,25•0,66 = 0,165 (моль)
V(O2) = n•Vm = 0,165•22,4 = 3,696л ≈3,7 л.
Задание № 3
Итого 29 баллов.
infourok.ru
